Система доставки ліків, здатна до самоемульгування, та спосіб лікування болю та запалення
Формула / Реферат
1. Фармацевтична композиція, придатна для перорального уведення, у формі первинного концентрату емульсії, яка містить
(і) сполуку формули (І)
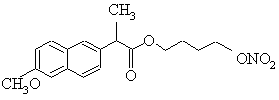 , (I)
, (I)
(іі) один або більше сурфактантів;
причому зазначена композиція утворює in-situ емульсію типу "масло у воді" після контакту з водними середовищами, як-то шлунково-кишкові рідини.
2. Фармацевтична композиція за п. 1, яка додатково містить масло або напівтвердий жир.
3. Фармацевтична композиція за п. 1, яка крім того містить один або більше коротколанцюгових спиртів.
4. Фармацевтична композиція за будь-яким з пп. 1- 2, яка відрізняється тим, що кількість сполуки формули (І) складає від 50-1500 мг на одиничну дозу.
5. Фармацевтична композиція за п. 4, яка відрізняється тим, що кількість сполуки формули (І) складає 125-500 мг на одиничну дозу.
6. Фармацевтична композиція згідно з будь-яким з попередніх пунктів, яка відрізняється тим, що сурфактантом є блок-співполімер.
7. Фармацевтична композиція згідно з будь-яким з попередніх пунктів, яка відрізняється тим, що сурфактантом є неіоногенний сурфактант.
8. Фармацевтична композиція за п. 7, яка відрізняється тим, що неіоногенним сурфактантом є полоксамер.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що сурфактант вибирають з групи, до складу якої входять Полоксамер 407, Полоксамер 401, Полоксамер 237, Полоксамер 338, Полоксамер 331, Полоксамер 231, Полоксамін 908, Полоксамін 1307, Полоксамін 1107 та поліоксіетилен-поліоксибутиленовий блок-співполімер.
10. Фармацевтична композиція згідно з будь-яким з попередніх пунктів, яка відрізняється тим, що загальна кількість сурфактанту (ів) складає від 12,5-6000 мг.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що загальна кількість сурфактанту (ів) складає від 100-500 мг.
12. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що співвідношення сполука формули (І):сурфактант знаходиться у межах 1:0,1-1:10.
13. Фармацевтична композиція за п. 12, яка відрізняється тим, що співвідношення сполука формули (І):сурфактант знаходиться у межах 1:0,3-1:3.
14. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що в ній присутнє масло.
15. Фармацевтична композиція за п. 14, яка відрізняється тим, що маслом є рослинна олія.
16. Фармацевтична композиція за п. 15, яка відрізняється тим, що рослинну олію вибирають з групи, до складу якої входять кокосове масло, кукурудзяна олія, соєва олія, рапсова олія, сафлорова олія та рицинова олія.
17. Фармацевтична композиція за п. 14, яка відрізняється тим, що маслом є тваринний жир.
18. Фармацевтична композиція за п. 17, яка відрізняється тим, що тваринним жиром є риб'ячий жир або один чи більше моно-, ди- або тригліцеридів.
19. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що напівтвердий жир використовують як наповнювач.
20. Фармацевтична композиція за п. 19, яка відрізняється тим, що напівтвердий жир вибирають з моно-, ди- та тригліцеридів.
21. Фармацевтична композиція за п. 20, яка відрізняється тим, що моно-, ди- та тригліцериди вибирають з групи, до складу якої входять гліцерилпалмітостеарат або суміш моно-, ди- та три-естерів гліцерину, моно- та ди-естерів поліетиленгліколів або вільний поліетиленгліколь.
22. Фармацевтична композиція за будь-яким з пп. 3-21, яка відрізняється тим, що коротколанцюговий спирт вибирають з етанолу, пропіленгліколю та гліцерину.
23. Фармацевтична композиція за будь-яким з попередніх пунктів, яка крім того містить співсурфактант.
24. Лікарська форма, заповнена фармацевтичною композицією за будь-яким з попередніх пунктів.
25. Лікарська форма за п. 24, вибрана з групи, до складу якої входять капсули, питні ампули, дозована подушечка, м'які пілюлі для жування та коржі на жувальній основі.
26. Лікарська форма за п. 25 у формі капсули.
27. Лікарська форма за п. 26, яка відрізняється тим, що зазначеною капсулою є тверда желатинова капсула.
28. Лікарська форма за п. 26, яка відрізняється тим, що зазначеною капсулою є м'яка желатинова капсула.
29. Розчин для перорального уведення, який містить фармацевтичну композицію за будь-яким з пп. 1-23, розчинену у воді.
30. Спосіб лікування болю, згідно з яким фармацевтичну композицію за будь-яким з попередніх пунктів уводять пацієнту, що потребує такого лікування.
31. Спосіб лікування запалення, згідно з яким фармацевтичну композицію за будь-яким з попередніх пунктів уводять пацієнту, що потребує такого лікування.
Текст
1. Фармацевтична композиція, придатна для перорального уведення, у формі первинного концентрату емульсії, яка містить (і) сполуку формули (І) 2 (19) 1 3 76098 4 21. Фармацевтична композиція за п. 20, яка відрі26. Лікарська форма за п. 25 у формі капсули. зняється тим, що моно-, ди- та тригліцериди ви27. Лікарська форма за п. 26, яка відрізняється бирають з групи, до складу якої входять гліцерилтим, що зазначеною капсулою є тверда желатинопалмітостеарат або суміш моно-, ди- та трива капсула. 28. Лікарська форма за п. 26, яка відрізняється естерів гліцерину, моно- та ди-естерів поліетиленгліколів або вільний поліетиленгліколь. тим, що зазначеною капсулою є м'яка желатинова 22. Фармацевтична композиція за будь-яким з капсула. пп. 3-21, яка відрізняється тим, що коротколан29. Розчин для перорального уведення, який місцюговий спирт вибирають з етанолу, пропіленглітить фармацевтичну композицію за будь-яким з колю та гліцерину. пп. 1-23, розчинену у воді. 23. Фармацевтична композиція за будь-яким з по30. Спосіб лікування болю, згідно з яким фармацепередніх пунктів, яка крім того містить співсурфаквтичну композицію за будь-яким з попередніх пунтант. ктів уводять пацієнту, що потребує такого ліку24. Лікарська форма, заповнена фармацевтичною вання. композицією за будь-яким з попередніх пунктів. 31. Спосіб лікування запалення, згідно з яким фа25. Лікарська форма за п. 24, вибрана з групи, до рмацевтичну композицію за будь-яким з попередскладу якої входять капсули, питні ампули, дозоніх пунктів уводять пацієнту, що потребує такого вана подушечка, м'які пілюлі для жування та коржі лікування. на жувальній основі. Даний винахід стосується нової фармацевтичної композиції у формі первинного концентрату емульсії, лікарської форми, що містить зазначену композицію, її використання у терапії, а також способу її виготовлення. Нестероїдні антизапальні ліки, що звичайно позначають як НСАЗЛ, є добре відомими ліками для лікування болю та запалення. Однією з головних вад НСАЗЛ є те, що вони мають серйозні шлунково-кишкові побічні ефекти. Пацієнти, яких довгий період часу лікували НСАЗЛ, як-то напроксеном, часто зтикаються з проблемами шлунково-кишкових побічних ефектів. Нещодавно було виявлено, що вивільняючі оксид нітрогену сполуки НСАЗЛ (у подальшому NO-вивільняючі НСАЗЛ) мають удосконалений профіль побічного ефекту, [див., наприклад, WO 94/04484, WO 94/12463, WO 95/09831 та WO 95/30641]. NO-вивільняючі НСАЗЛ є ліпофільними сполуками з поганою водорозчинністю. їх можна віднести до класу 2 згідно з Системою Біофармацевтичної Класифікації, запропонованої Amidon et al. (Pharm. Res. 12 (1995) pp.413-420). Ліки цього класу характеризуються поганою водорозчинністю, але значно гарною проникністю. Біофармацевтична проблема з цими сполуками полягає у тому, що їх поглинання з шлунково-кишкового тракту (ШКТ) може бути обмежене швидкістю розчинення, призводячи до поганої біопридатності після перорального уведення. [У заявці WO 95/08983] описується композиція, здатна до самоемульгування, для перорального уведення, яка утворює in situ мікроемульсію коли у контакті з біологічними рідинами. Таку композицію можна охарактеризувати як здатну до самомікроемульгування систему доставки ліків (СМЕСДЛ), і яка містить щонайменше - активну сполуку, - ліпофільну фазу, що складаються з суміші гліцеридів та естерів жирних кислот, - поверхнево-активний засіб, - косурфактант, та - гідрофільну фазу, яку досягають поглинання фізіологічним розчином дигестивного середовища. Даний винахід різниться за декількома аспектами від [WO 95/08983] та інших СМЕСДЛ. Незважаючи на те, що композиції, розкриті [у WO 95/08983], утворюють мікроемульсію in situ, композиції даного винаходу утворюють емульсію. СМЕСДЛ [згідно з WO 95/08983] потребує присутності ліпофільної фази для солюбілізації активної сполуки. Такої ліпофільної солюбілізаційної фази не потребує даний винахід, оскільки активна сполука, NO-вивільняючі НСАЗЛ, може сама створювати масляну фазу емульсії in situ. Композиції [згідно з WO 95/08983] містять, серед іншого, косурфактант на додаток до поверхнево-активного засобу. Присутність косурфактанту не є необхідним для композиції даного винаходу, зменшуючи токсикологічну суть до мінімуму. [ЕР 274 870] описує фармацевтичну композицію, що містить нестероідні анти-запальні ліки (НСАЗЛ) та сурфактант, причому композиція здатна утворювати міцели, що містять НСАЗЛ, після перорального уведення. Було виявлено, що ці міцели представляють особливо прийнятну форму для уведення НСАЗЛ пероральним шляхом, послаблюючи їх несприятливі ефекти на шлунковокишковий тракт (ШКГ).Міцели є агрегатами, в яких молекули сурфактанту звичайно знаходяться в межах сфероїдальної структури з гідрофобним регіоном, екранованим у серцевині, у водному розчині, від води оболонкою зовнішніх гідрофільних регіонів. Ліки є звичайно солюбілізованими у сурфактанті. Міцели мають бути порівняні у рамках своєї структури з емульсіями, сформованими композиціями даного винаходу. Хоча міцели є термодинамічно стабільними одно-фазовими системами (згідно з правилом фаз Гіббса), в яких агрегати звичайно мають діаметр приблизно у дві довжини молекули сурфактанту, що її утворює, тобто у порядку від десяти до ста ангстрем (Λ), 5 76098 6 емульсії є набагато більшими агрегатами, у порядКомпозиції згідно з винаходом можуть, як варіку від нанометрів до мікрометрів у діаметрі, що ант, крім того, містити один або більше короткоскладаються з маслянистої серцевини, яка оточеланцюгових спиртів. на одним або кількома шарами сурфактантів. Композиція утворюватиме in situ емульсію тиЕмульсії є звичайно дво-фазовими системами та пу "масло у воді" з невеликих крапель розміром від термодинамічно нестабільними (але можуть бути нанометру до мікрону після контакту зі шлунковокінетично стабільними). Інша головна відмінність кишковими рідинами, причому краплі складаються між композиціями [згідно ЕР 274 870] та даним зі сполуки формули (і), що утворює серцевину винаходом полягає у природі активної сполуки. краплі, яка покрита одним або кількома шарами Хоча НСАЗЛ є кристалічними порошками за своєю сурфактанту. In situ утворена емульсія типу "масло природою, NO-вивільняючі НСАЗЛ або їх суміші, у воді" забезпечуватиме гарну біопридатність сповикористовувані у даному винаході, є у масляній луки формули (і) після перорального уведення. формі або у формі терморозм'якшуваних напівтСтабільність збереження емульсії не є важливою, вердих продуктів Більш того, міцели звичайно потоскільки емульсія не утворюється, доки первинний ребують набагато вищого співвідношення ліки : концентрат не увели пацієнту, тобто раніше момесурфактант, порівняно з співвідношенням масло : нту уведення. Можливий неприємний смак персурфактант, потрібним для утворення емульсії. винного концентрату не є проблемою у заповненні Однією з унікальних особливостей NOу капсули. вивільняючих НСАЗЛ є те, що багато з цих сполук Фармацевтична композиція згідно з даним виє маслами або терморозм'якшеними твердими находом є первинним концентратом емульсії на продуктами, які практично не розчиняються у воді. час уведення пацієнту. Первинним концентратом З високими дозами NO-вивільняючих НСАЗЛ, наемульсії можна заповнювати одиничні лікарські приклад, коли доза вище приблизно 350мг, важко форми, як-то капсули, питні ампули та дозовані створювати таблетку прийнятного розміру з велипружні подушечки, або альтернативно він може кої кількості масла або напівтвердого продукту. бути сформованим як інші придатні форми дозуЛіпофільні NO-вивільняючі НСАЗЛ можна, однак, вання, як-то м'які пілюлі для жування та коржі на сформувати як емульсії типу "масло у воді," де жувальній основі. сполука складає або є частиною масляної фази, Після контакту з водними середовищами, як-то емульгованої у воді одним чи більше сурфакганшлунково-кишкові рідини, первинний концентрат тами. емульсії перетворюється у емульсію типу "масло у У фармакокінетичних дослідженнях тварин воді". Отже, композиція утворюватиме in-situ емунесподівано було виявлено, що такі емульсії типу льсію типу "масло у воді" у шлунково-кишкову тра"масло у воді" NO-вивільняючих НСАЗЛ виявлякті. Швидкість вивільнення ліків у композиції виють кращу біопридатність, порівняно з неемульгозначають розміром крапель емульсії in-situ та ванимим речовинами. Проблема з емульсіями полярністю крапель емульсії, остання регулюється полягає у тому, однак, що вони є термодинамічно гідрофільно-ліпофільним балансом (ГЛБ) суміші нестабільними та мають погану стабільність довліки/сурфактант та концентрацією сурфактанту. готривалого збереження, оскільки вони часто тяЗвичайно, невеликий розмір крапель та висока жіють до коалесценції, відстоювання/седиментації полярність підвищують швидкість вивільнення або розділення фаз. Більш того, вони не предсталіків (N.H. Shah et al. Int. J. Pharm. 106 (1994), pp. вляють зручної форми дозування для перорально15-23) го уведення, оскільки часто для уведення одної Сполука формули (І) складається з напрокседози потрібні великі об'єми та головною проблену, бутилового спейсеру та NO-вивільняючої часмою може бути неприємний різкий чи мильний тини, зазначені три частини є зв'язаними разом у смак. Крім того, неможливо заповнити желатинові одну одиничну молекулу. Напроксен за природою капсули емульсіями типу "масло у воді", оскільки має форму порошку, тоді як NO-вивільняючий нависокий вміст води в емульсії несумісний з оболопроксен формули (І) представляють сполуку у манкою капсули та розчиняв би її. слоподібній формі як такій при кімнатній темпераЗгадані вище проблеми зараз вирішені запротурі, внаслідок наявності спейсера. Ця унікальна понуванням нової здатної до самоемульгування особливість забезпечує перевагу тим, що до персистеми доставки ліків, звичайно відомої як винного концентрату емульсії не потрібно додаваСЕСДЛ, придатної для перорального уведення. ти додаткову матрицю з ліпофільних масел або Зокрема, винахід стосується фармацевтичної комнапівтвердих продуктів, оскільки це є невід'ємною позиції, придатної для перорального уведення, у особливістю ліків. Крім того, фармакологічно інерформі первинного концентрату емульсії, що містне масло або напівтвердий жирний продукт можтить на додавати до фармацевтичної композиції в яко(і) сполуку формули (І) сті наповнювачу або регулятору в'язкості. Наповнюваний засіб може бути потрібним для збільшення точності дозування при низьких дозах. (I) Регулятор в'язкості може бути потрібним для досягнення оптимальної в'язкості для заповнення ком(її) один або більше сурфактантів; позицією, наприклад, капсул. Зокрема висока (ііі), як варіант, масло або напівтвердий жир; швидкість заповнення рідиною капсул потребує зазначена композиція утворює in-situ емульсію обережного регулювання в'язкості у межах, що типу "масло у воді" після контакту з водними серепопереджують розбризкування в кінці при низький довищами, як-то шлунково-кишкові рідини. в'язкості та утворення в кінці при високій в'язкості 7 76098 8 нитки. Більш того, межі в'язкості треба вибирати Якщо у фармацевтичній композиції згідно з так, щоб мати придатну для перекачки композивинаходом використовують додаткові масло або цію. Межі в'язкості, звичайно потрібні для заповнапівтвердий жир, він може слугувати як наповнюнення рідиною капсул знаходяться в межах від 0,1 вач або як регулятор в'язкості. до 25Па. Вираз "коротко-ланцюгові спирти", використоЗагальна кількість сполуки формул (І), викоривувані згідно з даним винаходом, визначений тут стовуваної у композиції винаходу, знаходиться як лінійні чи розгалужені моно-, ди- або триатомні переважно у межах 50-1500мг на одиницю дози. У спирти, що мають 1-6 атомів карбону. Прикладами все ж кращому втіленні винаходу, кількість сполуки таких спиртів з коротким ланцюгом, корисних згідформул (І), використовуваної у композиції, є 125но з винаходом, є етанол, пропіленгліколь та глі500мг на одиницю дози. церин. Вираз "одинична доза" визначають як кількість Якщо до фармацевтичної композиції згідно з активної сполуки, уведеної у одній одиничній капвинаходом додають спирт з коротким ланцюгом, сулі, або розчиненої у одному стакані води. розчинність поліпшується і потрібна менша кільВираз "сурфактант" визначають як поверхнекість сурфактанту. во-активні амфіфільні сполук, як-то блокФармацевтичною композицією винаходу запокополімери. Кращими сурфактантами згідно з давнюють лікарські форми, придатні для пероральним винаходом є неіоногенні сурфактанти, наприного уведення, як-то капсули, питні ампули та доклад ті, що містять поліетиленгліколеві (ПЕГ) ланзовані подушечки, або їх можна сформувати як цюги, особливо блок-кополімери, як-то інші придатні форми перорального дозування, якполоксамери. то м'які пілюлі для жування та коржу на жувальній Прикладами придатних полоксамерів є Полокоснові. самер 407 (Pluronic F127®); Полоксамер 401 Згідно з кращим втіленням винаходу фарма(Pluronic L121®): Полоксамер 237 (Pluronic F87®); цевтичною композицією заповнюють тверді желаПолоксамер 338 (Pluronic FI38®): Полоксамер 331 тинові капсули, але капсули з альтернативних ма(Pluronic L101®): Полоксамер 231 (Pluronic LSI®); теріалів, як-то з оболонками на основі тетрафункціональний поліоксіетиленметилцелюлози, а також можна використовувати поліоксипропіленовий блок-кополімер етилендіам'які желатинові капсули. міну, відомий як Полоксамін 908 (Тетронік 908®); Згідно з альтернативним втіленням винаходу, Полоксамін 1307 (Тетронік 1307®); Полоксамін фармацевтичну композицію можна розчиняти, 1107 поліоксіетилен-поліоксибутиленовий блокнаприклад, у стакані води, надаючи тим самим кополімер, відомий як Полігліколь ВМ45®. Цей пезмоги первинному концентрату утворити емульсію, релік призначений тільки для ознайомлення зсуяку можна уводити як пероральний розчин. Компорфактантами, які можна використовувати згідно з зиціями, призначеними для розчинення перед даним винаходом, але ніяк не обмежує рамок виуведенням, можна заповнювати, наприклад, м'які находу. желатинові капсули, пластикові або алюмінієві Усі описані вище сурфактанти є комерційно подушечки, чи пластикові або скляні ампули. Ця доступними від, наприклад, таких фірм, як BASF, особливість є особливо переважною для високоDow Chemicals та Gattefosse. дозових композицій, як потребують великої капсуЗагальна кількість сурфактанту(ів) згідно з вили, для пацієнтів, які мають труднощі при ковтанні находом може бути у межах 12,5-6000мг, перевакапсул, та для дітей. жно 100-500мг. Співвідношення NO-вивільняючі Згідно з кращим втіленням винаходу фармаНСАЗЛ : сурфактант може змінюватися від 1:0,1 цевтичними композиціями даного винаходу заповдо 1:10, переважно від 1:0,3 до 1:3. нюють капсули. Кращими капсулами є желатинові Якщо до фармацевтичної композиції додають капсули, які можуть бути м'якими або твердими. додаткове масло, ним може бути будь-яке масло, Тверді желатинові капсули складаються з двох що є інертним та сумісним з матеріалом капсул, а частин, кришки та корпусу, першу вставлено у інтакож бути прийнятним для використання у фаршу. Тверді желатинові капсули отримують пустими мацевтичній практиці. Фахівцям зрозуміло, яке та заповнюють окремою операцією. М'які желатимасло треба вибирати для призначеної мети. Принові капсули є капсулами, які виробляють та запокладами придатних масел, які можна використовувнюють одною операцією. вати згідно з даним винаходом, є рослинні олії, якЯк згадано вище, первинний концентрат емуто кокосове масло, кукурудзяна олія, олія сої, олія льсії перетворюється у емульсію типу "масло у рапсу, сафлорова олія та рицинова олія. Також воді" після контакту з шлунково-кишковими рідидля досягнення мети даного винаходу є придатнами, при цьому вивільняються активні ліки. Отже, ними тваринні жири, як-то риб'ячий жир та триглікомпозиція утворюватиме in situ емульсію типу цериди. "масло у воді" у шлунково-кишковому тракті (ШК Якщо як наповнювач для фармацевтичної тракт). композиції використовують напівтвердий жир, його Фармацевтична композиція даного винаходу є можна переважно вибрати з моно-, ди- та тригліособливо корисною у лікуванні болю та запалення. церидів та жирно-кислотного спирту, як-то стеариВираз "біль" включає, але без обмеження, ноциловий спирт, GeluCires 33/01, 39/01, 43/01, палміцептивний та невропатичний біль або їх комбінації; тостеарат гліцерину, як-то PreCirol ATO5. GeluCire гострий, переривчастий та хронічний біль; біль при є cумішшю, отриманою змішуванням моно-, ди- та раку; мігрень та головні болі подібного походжентри-естерів гліцерину, моно- та ди-естерів ПЕГ або ня. Вираз "запалення" включає, але без обмеженвільного ПЕГ. ня, ревматоїдний артрит: остеоартрит; та юнаць 9 76098 10 кий артрит. вувати кілька добавок, наприклад, Cremophor EL®. Способи отримання ІІ. Заповнення Фармацевтичну композицію даного винаходу Для заповнення потрібно, щоб композиція буможна отримувати переважно наступними альтерла рідиною при температурі заповнення. Напівтнативними способами: вердими терморозм'якшуваними композиціями І. Змішування тому заповнюють при температурі вище темпераa) Маслоподібну сполуку формули (І) поміщатури зрідження. М'які желатинові капсули виробють у посудину, додають твердий або напівтверляють та заповнюють одною операцією, їх можна дий сурфактант та твердий/маслоподібний жир (як заповнювати при температурах до 40°С, тоді як варіант). Суміш гріють до температури, відповідній тверді желатинові капсули можна заповнювати точці плавлення ексципієнтів, створюючи композипри температурах до 70°С. Тверді желатинові капційну рідину, ретельно перемішують до гомогенної сули заповнюють композиціями, що залишаються маси (візуальний контроль) та первинним конценрідкими при збереженні температури, потрібній тратом заповнюють капсули, придатні для перодля закриття, наприклад, у бандажуванні желатирального уведення. ну для попередження витоку. Процес заповнення b) Альтернативно, маслоподібну сполуку форрідиною твердих желатинових капсул та потрібні мули (І) поміщають у посудину та додають рідкий для цього продукти, [наприклад, описані у W.J. сурфактант. Їх суміш ретельно перемішують до Bowtle, Pharmaceutical Technology Europe. October гомогенної маси (візуальний контроль) та первин1998: V.M. Young, Pharmaceutical Manufacturing ним концентратом заповнюють капсули, придатні and Packaging Sourcer, March 1999: та Є Т. Coole. для перорального уведення. Pharmaceutical Technology International. c) За наступним альтернативним способом September/October 1989]. Використовуючи двомаслоподібну сполуку формули (І) поміщають у частинні капсули, дозволяє заповнення більше, посудину, дрібно розмелюють (розмір частинок ніж одної фази у одиничну капсулу, що може бути менше 177мкм) додають твердий сурфактант. Рідпотрібним для дво- або багатофазного вивільненку суміш перемішують ретельно до гомогенної ня ліків [W.J. Bowtle etal. Jnt. J. Pharm. 141 (1996). маси (візуальний контроль) та первинним конценpp.9-16]. Кілька фаз застигаючого матеріалу можтратом заповнюють капсули, придатні для перона заповнювати на одиничних етапах. Кінцева фарального уведення. за може бути рідкою, якщо потрібно. Число фаз d) За ще одним альтернативним способом наобмежене тільки розміром капсул та об'ємом півтвердий/твердий сурфактант поміщають у поокремих фаз. Ці особливості можуть також дозвосудину та додають один чи більше спиртів. Суміш лити контрольоване вивільнення або розділення гріють до температури, відповідній точці плавленрізних ліків, сформованих в одній капсулі. Крім ня ексципієнтів, створюючи композиційну рідину, того, капсули можуть бути оброблені далі, наприретельно перемішують до гомогенної маси (візуаклад, ентеросолюбильним покриттям. льний контроль), додають маслоподібну сполуку III. Визначення параметрів композицій формули (І) та суміш ретельно перемішують до Для визначення параметрів композиції визнагомогенної маси (візуальний контроль). Первинним чають час, потрібний для утворення композицією концентратом заповнюють капсули, придатні для емульсії типу "масло у воді" після контакту з еквіперорального уведення. валентом шлункової рідини, ЕШР, (без фермене) За ще одним альтернативним способом рідтів), та утворену емульсію характеризують. ЕШР кий сурфактант поміщають у посудину та додають включає 7 мл концентрованої гідрохлоридної кисодин чи більше спиртів. Суміш ретельно перемілоти, 2г хлориду натрію та дистильовану воду до шують до гомогенної маси (візуальний контроль), загального об'єму 1л. "Тест на утворення емульсії" додають маслоподібну сполуку формули (І) та супроводять у тест-тубах (для струшування) з переміш ретельно перемішують до гомогенної маси мішуванням магнітною мішалкою. Тест-тубу, що (візуальний контроль). Первинним концентратом містить невеликий магніт, заповнюють 12,5мл заповнюють капсули, придатні для перорального ЕШР без ферментів, що відповідає одній десятій уведення. середнього об'єму шлункової рідини у людини та Для заповнення дво-частинних капсул або м'ядодають композицію, що відповідає одній десятій ких желатинових капсул рідиною композиція подози активної сполуки формули (І). винна мати в'язкість у деяких межах, які визначено Час утворення емульсії варіюватиме від 30с виробником, при придатній для заповнення темдо 15 хвилин, залежно від складу композиції. Якщо пературі процесу. Для дво-частинних капсул макдодають один чи більше коротко-ланцюгових симальна температура заповнення складає прибспиртів, час утворення емульсії варіюватиме між лизно 70°С. В'язкість композиції нормально 2-3с та 3-4 хвилинами. Також досліджують середповинна бути у межах 50-1000 сПуаз (=0,05-1 Пуній розмір частинок утвореної емульсії за допомоаз) при температурі процесу, вибраній для заповгою лазерної дифракції, ЛД, або протоннення. Для заповнення композицією м'яких желакореляційної спектроскопії, ПКС. Залежно від розтинових капсул, температура процесу не міру частинок можна використовувати будь-який з перевищує 30-40°С (точна температура залежить двох способів. від виробника). Композиція повинна бути рідкою та Винахід далі детальніше описаний наступними мати в'язкість, що дозволяє її перекачку при темприкладами, які не обмежують його рамок. пературі заповнення Для створення композиційної Отримували такі первинні концентрати емульрідини з прийнятною в'язкістю, можна використосій. 11 Приклад 1 кількість (г) (і) Сполука формули (І) 1000 (іі) Pluronic F127® 1000 Напівтверду композицію отримували розтопленням 1кг Pluronic F127® (Полоксамер 407) нагріванням до 62°С. Розплав ретельно перемішували для гарантування відсутності твердих частинок. 1кг сполуки формули (І) додавали до розтопленого Pluronic F127® та суміші давали досягти температури 62°С. Рідку композицію перемішували до гомогенної маси (візуальний контроль). Утвореною рідкою композицією далі заповнюють тверді желатинові капсули. Композиція стає напівтвердою після охолодження (у капсулі). Визначення параметрів 150мг композиції поміщали у 12,5мл ЕШР (без ферментів) і перемішували магнітною мішалкою. Отримано такі результати: Час до утворення емульсії: 13хв. Середній розмір частинок: 2-3мкм В'язкість вимірювали у конічному та тарілчатому віскозиметрі Stress Tech, вимірювальна система С 40 4 PC, зі швидкістю зсуву 20с-1. Потік був більше або менше ньютонівського. Приклад 2 кількість (г) (і) Сполука формули (Іа) 1000 (іі) Pluronic L 121® 1000 Рідку композицію отримували змішуванням 1кг рідкого сурфактанту Полоксамер 401 з 1кг сполуки формули (І) при кімнатній температурі. Рідку композицію перемішували до гомогенної маси (візуальний контроль). Утвореною рідкою композицією далі заповнюють тверді желатинові капсули. Визначення параметрів 150мг композиції поміщали у 12,5мл ЕШР (без ферментів) і перемішували магнітною мішалкою. Отримано такі результати: Час до утворення емульсії: 20с. Середній розмір частинок: 11мкм Приклад 3 кількість (г) (і) Сполука формули (І) 1000 (іі) Полігліколь ВМ 45® 1000 (ііі) Додецилсульфат натрію 40 Композицію отримували змішуванням 1кг Полігліколю ВМ 45® (Полоксамін 1107), 40г додецилсульфату натрію, що діє як ко-сурфактант, та 1кг сполуки формули (І). Рідку композицію перемішували до гомогенної маси (візуальний контроль). Утвореною рідкою композицією далі заповнюють тверді желатинові капсули. Визначення параметрів 150мг композиції поміщали у 12,5мл ЕШР (без ферментів) і перемішували магнітною мішалкою. Отримано такі результати: Час до утворення емульсії: 15 хвилин Середній розмір частинок: 0,7мкм Приклад 4 кількість (г) (і) Сполука формули (І) 1000 (іі) Pluronic F127® 500 (ііі) Cremophor EL® 500 76098 12 Для можливості заповнення напівтвердою композицією м'яких желатинових капсул, температура процесу повинна бути нижче 30-40°С (певна температура залежить від виробника). Це означає, що композиція повинна бути рідиною та здатною до перекачки нижче 30-40сС. Для отримання рідкої композиції при цій температурі деяку частину сурфактанту замінювали на Cremophor EL®. Розплав отримували як описано у прикладі 1, за винятком заміщення 0,5кг сурфактанту такою ж кількістю Cremophor EL®. Визначення параметрів 150мг композиції поміщали у 12,5мл ЕШР (без ферментів) і перемішували магнітною мішалкою. Отримано такі результати: Час до утворення емульсії: 9 хвилин Середній розмір частинок: 4-5мкм Приклад 5 кількість (г) (і) Сполука формули (І) 1250 (іі) Pluronic F127® 1500 (ііі) Фракціоноване кокосове масло 1880 Для гарантування, що композиції з низькою дозою матимуть гарну точність заповнення, та для заповнення капсул певного об'єму для зменшення кількості присутнього повітря, активною сполукою можна заповнювати до об'єму з аліквотом кокосового масла. Напівтверду композицію отримували розтопленням 1,500 кг Pluronic F127® (Полоксамер 407) нагріванням до 62°С. Розплав ретельно перемішували для гарантування відсутності твердих частинок. 1,250кг сполуки формули (І) та 1,880кг фракціонованого кокосового масла додавали до розтопленого Pluronic F127® та суміші давали досягти температури 62°С. Рідку композицію перемішували до гомогенної маси (візуальний контроль). Утвореною рідкою композицією далі заповнюють тверді желатинові капсули. Визначення параметрів Одну десяту композиції поміщали у 12,5мл ЕШР (без ферментів) і перемішували магнітною мішалкою. Отримано такі результати: Час для утворення емульсії: 10хв. Середній розмір частинок: 5мкм Приклад 6 кількість (г) (і) Сполука формули (І) 62,5 (іі) Полоксамер 407 375 (ііі) Фракціоноване кокосове масло 312,5 Композицію отримували як описано для прикладу 5 вище. Визначення параметрів Визначення параметрів здійснювали як для прикладу 5 вище. Отримано наступні результати: Час для утворення емульсії: 10хв. Середній розмір частинок: 36мкм Приклад 7 кількість (г) (і) Сполука формули (І) 62,5 (іі) Полоксамер 407® 375 (ііі) Фракціонована рицинова олія 312,5 Композицію отримували як описано для прикладів 5 вище. Визначення параметрів Визначення параметрів здійснювали як для 13 76098 14 прикладу 5 вище. Отримано такі результати: Час до утворення емульсії: в межах 20с. Час для утворення емульсії: 10хв. Приклад 10 Середній розмір частинок: 81мкм кількість (г) Приклад 8 (і) Сполука формули (І) 3 кількість (г) (ii)PluronicL101® 0,506 (і) Сполука формули (І) 3 (ііі) Монолаурат сорбіту 0,169 (іі) Pluronic L127® 0,843 (iv) Етанол 0,225 (ііі) Монолаурат сорбіту 0,282 Отримували рідку композицію. Розчин 0,506г (iv) Гліцерин 0,375 Pluronic L101® (Полоксамер 331), 0,169г монолауНапівтверду композицію отримували розтопрату сорбіту та 0,225г етанолу перемішували до ленням 0,843г Pluronic F127® (Полоксамер 407), гомогенної маси (візуальний контроль). 3г сполуки 0,282г монолаурату сорбіту та 0,375г гліцерину формули (І) додавали до суміші при кімнатній темнагріванням до 62°С. Розплав ретельно перемішупературі. Утвореною рідкою композицією далі завали для гарантування відсутності твердих частиповнюють м'які желатинові капсули. нок. 3г сполуки формули (І) додавали до суміші. Визначення параметрів Суміші давали досягти температури 62°С. Рідку 97мг композиції поміщали у 12,5мл ЕШР (без композицію перемішували до гомогенної маси (віферментів) і перемішували магнітною мішалкою. зуальний контроль). Утвореній рідкій композиції Отримано наступний результат: давали охолонути до температури 30°С, а далі Час до утворення емульсії: в межах 20с. заповнювали нею м'які желатинові капсули. КомДослідження композицій in vivo на міні свинях позиція стає напівтвердою після охолодження (у Дослідження на біопридатність композицій згікапсулі). дно з даним винаходом проводили після перораВизначення параметрів льного уведення голодним міні свинями. 112мг композиції поміщали у 12,5мл ЕШР (без У дослідженні використовували 6 самців міні ферментів) і перемішували магнітною мішалкою. свиней Gottingen SPF. На початку періоду аклімаСтримано наступний результат: тизації тварини мали вік 4 місяці та масу від 7,7 до Час до утворення емульсії: 2,5-3,5хв. 10,1кг. Тварини голодували протягом 12 годин Приклад 9 перед обробкою та доки не були узяті зразки крові кількість (г) на 4 годину після обробки. Автоклавоване сіно (і) Сполука формули (І) 3 давали кожної доби, а також, двічі на добу твари(іі) Pluronic LI 27® 0,843 нам пропонували воду для пиття домашньої якос(ііі) Монолаурат сорбіту 0,282 ті. (іν) Пропіленгліколь 0,375 Фармацевтичну композицію винаходу у придаНапівтверду композицію отримували розтоптній лікарській формі згідно з винаходом уводили ленням 0,843г Pluronic F127® (Полоксамер 407), кожній тварині. Рівні доз були приблизно 0,282г монолаурату сорбіту та 0,375г пропіленглі15мкмоль/кг маси тіла. 10мл водопровідної води колю нагріванням до 62°С. Розплав ретельно педавали для полегшення ковтання капсули або відремішували для гарантування вщсутності твердих повідної одиничної дози. частинок. 3г сполуки формули (І) додавали до суУсі видимі ознаки проблем зі здоров'ям та міші. Суміші давали досягти температури 62°С. будь-які зміни у поведінці реєстрували щодоби. Рідку композицію перемішували до гомогенної Будь-які відхилення від норми реєстрували з оглямаси (візуальний контроль). Утвореній рідкій комду на час початку, тривалість та суворість. Вклюпозиції давали охолонути до температури 30°С, а ченими у добовий контроль стану здоров'я були далі заповнювали нею м'які желатинові капсули. спостереження консистентності фекалій. Усіх тваКомпозиція стає напівтвердою після охолодження рин зважували після отримання та у першу добу (у капсулі). кожної обробки. Визначення параметрів Зразки крові (5мл) брали з шийної вени у туби 112 міліграм композиції поміщали у 12,5мл Вакутайнера, що містили гепарин. Зразки крові ЕШР (без ферментів) і перемішували магнітною брали перед обробкою (0) та на 15, 30 та 45 хвимішалкою. Отримано наступний результат: лині: 1, 1,5, 2, 4, 7 та 24 годині після обробки. Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSystem for drug delivery with capability for self-emulsification and method for treating pain and inflammation
Автори англійськоюHolmberg Christina, Siekmann Britta
Назва патенту російськоюСистема доставки лекарственных препаратов, проявляющая способность к самоэмульгированию и способ лечения боли и воспаления
Автори російськоюГолмберг Кристина, Зикманн Бритта
МПК / Мітки
МПК: A61K 9/113, A61P 29/00
Мітки: лікування, болю, доставки, запалення, самоемульгування, система, ліків, здатна, спосіб
Код посилання
<a href="https://ua.patents.su/7-76098-sistema-dostavki-likiv-zdatna-do-samoemulguvannya-ta-sposib-likuvannya-bolyu-ta-zapalennya.html" target="_blank" rel="follow" title="База патентів України">Система доставки ліків, здатна до самоемульгування, та спосіб лікування болю та запалення</a>
Попередній патент: Фармацевтична композиція для внутрішньом’язової ін’єкції, що містить локсопрофен
Наступний патент: Спосіб очистки газів
Випадковий патент: Картонний матеріал











