N-оксиди похідних піридилметилпіперазину та піридилметилпіперидину
Номер патенту: 96756
Опубліковано: 12.12.2011
Автори: ван Амстердам Петер Х., Баккер Йоган Антуан, Барф Герріт А., Ван Аар Марсель П.М., Герреманс Арнольдус Г.Й., Зоргдрагер Ян, ден Бестен Каталін
Формула / Реферат
1. N-оксид похідних піридилметилпіперазину або -піперидину, вибраний з групи, що включає 1-(2,3-дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо-3-піридиніл]метил]піперазин, 1-(2,3-дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-3-піридиніл]метил]-4-оксидопіперазин або 4-(2,3-дигідробензо[1,4]діоксин-5-іл-1-[5-4-фторфеніл]-1-оксипіридин-3-ілметил)піперазин-1-оксид, або його таутомер, стереоізомер, фармацевтично прийнятна сіль, гідрат або сольват.
2. N-оксид, як заявлено в п. 1, який містить менше ніж близько 1 або 0,5 % або в межах визначення вільний від 3-[[4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-1-піперазиніл]метил]-5-(4-фторфеніл)піридину як домішки.
3. Сполука за п. 1 або 2, яка являє собою 1-(2,3-дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо-3-піридиніл]метил]піперазин, представлений формулою:
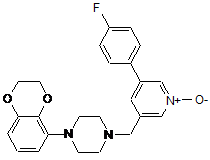 .
.
4. Сполука за п. 1 або 2, яка являє собою 1-(2,3-дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-3-піридиніл]метил]-4-оксидопіперазин, представлений формулою:
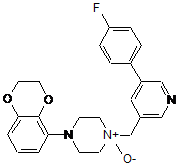 .
.
5. Сполука за п. 1, яка являє собою 4-(2,3-дигідробензо[1,4]діоксин-5-іл-1-[5-(4-фторфеніл)]-1-оксипіридин-3-ілметил)піперазин-1-оксид, представлений формулою:
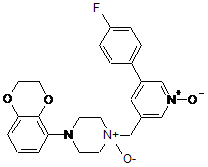 .
.
6. Лікарський засіб, який містить сполуку за будь-яким з пп. 1-5 або її фармацевтично прийнятну сіль, гідрат або сольват.
7. Фармацевтична композиція, яка містить поряд з фармацевтично прийнятним носієм та/або принаймні однією фармацевтично прийнятною допоміжною речовиною фармацевтично ефективну кількість принаймні однієї сполуки за будь-яким з пп. 1-5 або її фармацевтично прийнятної солі, гідрату або сольвату як діючої речовини.
8. Комбінований фармацевтичний препарат, який містить (і) N-оксид за будь-яким з пп. 1-5 або його фармацевтично прийнятну сіль, гідрат або сольват, та (іі) інший лікарський засіб, для одночасного, роздільного або послідовного застосування при лікуванні хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема шизофренії, та інших психічних розладів.
9. Комбінований фармацевтичний препарат, як заявлено у п. 8, у якому зазначеним іншим лікарським засобом є SLV313.
10. Сполука, заявлена у будь-якому з пп. 1-5, для лікуванні хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема шизофренії, та інших психічних розладів.
11. Застосування сполуки, заявленої у будь-якому з пп. 1-5, для виробництва фармацевтичної композиції для лікування хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема шизофренії, та інших психічних розладів.
12. Застосування комбінованого препарату, заявленого в п. 8, для виробництва фармацевтичної композиції для лікуванні хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема шизофренії, та інших психічних розладів.
13. Спосіб одержання сполуки, заявленої в п. 3, який відрізняється тим, що 3-(хлорметил)-5-(4-фторфеніл)піридин (пірифенхлорид) окиснюють, одержуючи 3-(хлорметил)-5-(4-фторфеніл)піридин-N-оксид (пірифенхлорид-N-оксид), який піддають взаємодії з 1-(2,3-дигідро-1,4-бензодіоксин-5-іл)піперазином, також відомим як елтопразин, з одержанням 1-(2,3-дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо-3-піридиніл]метил]піперазину:
 .
.
14. Спосіб одержання сполуки, заявленої в п. 5, який відрізняється тим, що 1-(2,3-дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо-3-піридиніл]метил]піперазин окиснюють мета-хлорпербензойною кислотою, одержуючи 4-(2,3-дигідробензо[1,4]діоксин-5-іл-1-[5-(4-фторфеніл)]-1-оксипіридин-3-ілметил)піперазин-1-оксид, представлений формулою:
 .
.
Текст
1. N-оксид похідних піридилметилпіперазину або -піперидину, вибраний з групи, що включає 1(2,3-дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4фторфеніл)-1-оксидо-3-піридиніл]метил]піперазин, 1-(2,3-дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4фторфеніл)-3-піридиніл]метил]-4-оксидопіперазин або 4-(2,3-дигідробензо[1,4]діоксин-5-іл-1-[5-4фторфеніл]-1-оксипіридин-3-ілметил)піперазин-1оксид, або його таутомер, стереоізомер, фармацевтично прийнятна сіль, гідрат або сольват. 2. N-оксид, як заявлено в п. 1, який містить менше ніж близько 1 або 0,5 % або в межах визначення вільний від 3-[[4-(2,3-дигідро-1,4-бензодіоксин-5іл)-1-піперазиніл]метил]-5-(4-фторфеніл)піридину як домішки. 3. Сполука за п. 1 або 2, яка являє собою 1-(2,3дигідро-1,4-бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)1-оксидо-3-піридиніл]метил]піперазин, представлений формулою: 2 3 96756 міжною речовиною фармацевтично ефективну кількість принаймні однієї сполуки за будь-яким з пп. 1-5 або її фармацевтично прийнятної солі, гідрату або сольвату як діючої речовини. 8. Комбінований фармацевтичний препарат, який містить (і) N-оксид за будь-яким з пп. 1-5 або його фармацевтично прийнятну сіль, гідрат або сольват, та (іі) інший лікарський засіб, для одночасного, роздільного або послідовного застосування при лікуванні хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема шизофренії, та інших психічних розладів. 9. Комбінований фармацевтичний препарат, як заявлено у п. 8, у якому зазначеним іншим лікарським засобом є SLV313. 10. Сполука, заявлена у будь-якому з пп. 1-5, для лікуванні хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема шизофренії, та інших психічних розладів. 11. Застосування сполуки, заявленої у будь-якому з пп. 1-5, для виробництва фармацевтичної компо 4 зиції для лікування хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема шизофренії, та інших психічних розладів. 12. Застосування комбінованого препарату, заявленого в п. 8, для виробництва фармацевтичної композиції для лікуванні хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема шизофренії, та інших психічних розладів. 13. Спосіб одержання сполуки, заявленої в п. 3, який відрізняється тим, що 3-(хлорметил)-5-(4фторфеніл)піридин (пірифенхлорид) окиснюють, одержуючи 3-(хлорметил)-5-(4фторфеніл)піридин-N-оксид (пірифенхлорид-Nоксид), який піддають взаємодії з 1-(2,3-дигідро1,4-бензодіоксин-5-іл)піперазином, також відомим як елтопразин, з одержанням 1-(2,3-дигідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо-3піридиніл]метил]піперазину: окиснення пірифенхлорид пірифенхлорид-N-оксид елтопразин сполучення . 14. Спосіб одержання сполуки, заявленої в п. 5, який відрізняється тим, що 1-(2,3-дигідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо-3піридиніл]метил]піперазин окиснюють метахлорпербензойною кислотою, одержуючи 4-(2,3дигідробензо[1,4]діоксин-5-іл-1-[5-(4-фторфеніл)]1-оксипіридин-3-ілметил)піперазин-1-оксид, представлений формулою: F O + O N O N N+ O Передумови створення винаходу Психотропні похідні піриділметилпіперазину та піриділметилпіперидину описані у ЕР 0 908 458. Серед інших сполук у цьому патенті згадується 3[[4-(2,3-дігідро-1,4-бензодіоксин-5-іл)-1піперазиніл]метил]-5-(4-фторфеніл)піридин, відомий також як also SLV313, антагоніст рецептора допаміну-D2 та агоніст рецептора серотоніну 5НТ1А, який у клінічних дослідженнях виявився ати . повим антипсихотичним засобом. Дослідження метаболізму в людини довели, що одним з головних метаболітів f SLV313 є його піридин-N-оксид. Це було несподіване, бо цей N-оксид не виявлявся у плазмі крові щурів та собак, яким вводили цю сполуку при токсикологічних випробуваннях. Піперазин-N-оксид SLV313 не був знайдений як метаболіт цієї сполуки у людини або у тварин під час токсикологічних випробувань. 5 3-[[4-(2,3-дігідро-1,4-бензодіоксин-5-іл)-1піперазиніл]метил]-5-(4-фторфеніл)-піридин, 1(2,3-дігідро-1,4-бензодіоксин-5-іл)-4-[[5-(4фторфеніл)-1-оксидо-3піридиніл]метил]піперазин 1-(2,3-дігідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-3піридиніл]метил]-4-оксидо-піперазин (відповідно SLV313, його піридин-N-оксид та його піперазин-N-оксид) N-оксиди відомі з 1894 р. Зараз добре відомо, що N-оксиди є метаболітами багатьох третинних амінів, а часто-густо також проміжними сполуками між третинними амінами та їх Nдеалкенільованими аналогами. Більшість, але не всі лікарські препарати на основі третинних амінів породжують N-оксиди, наприклад, морфін, іміпрамін, промазин, циннарізин та нікотин. Ступінь N-окислення коливається від слідів до майже повної конверсії. Деякі N-оксиди діють сильніше, ніж відповідні третинні аміни. Найвідомішим прикладом є хлордіазепоксид (Librium®), який належить до найпоширеніших ліків у психіатрії та загальній медицині. Втім, у багатьох випадках Nоксиди діють слабкіше, ніж відповідні третинні аміни, а тому N-окислення здебільшого розглядається як метаболічна деактивація. Хоча N-оксиди легко відновлюються до відповідних третинних амінів хімічним шляхом, у людському організмі це відбувається у різному ступені. Деякі N-оксиди майже повністю відновлюються до відповідних третинних амінів, в інших випадках реакція майже не помітна або й зовсім не відбувається (Bickel, 1969). Отже, утворення N-оксидів та їх відповідних третинних амінів є непередбачуваним. Якщо N-оксиди утворюються, вони можуть бути більш активні, ніж відповідні третинні аміни, менш активні ба й зовсім не активні. N-оксиди можуть відновлюватися до відповідних третинних амінів, а можуть і не відновлюватися. Якщо така реакція відбувається, вона проходить у діапазоні від ледь помітної до практично повної. З часів Парацельса ('Sola dosis facit venenum' - "Однієї дози вистачить") вважається, що як лікувальна, так і токсична дія препаратів залежить від їх концентрації у цільовій точці організму. Оскільки останньої досягти важко, приблизним показником концентрації препарату слугує його рівень у плазмі крові. Під час розробки лікарського засобу визначають вікно концентрацій у плазмі між нижнім рівнем ефективної дії та верхнім рівнем, де стають помітними бічні явища. В ідеаль 96756 6 ному випадку ці крайні рівні рознесені настільки далеко один від одного, що засіб легко вводиться у різних концентраціях, не даючи бічних явищ. У реальності ситуація є надто далека від ідеалу, й ліки здебільшого чинять небажану дію. У більшості випадків наявність бічних явищ можна пов'язати з піковими концентраціями у плазмі, які перевищують нижню межу, при якій з'являються небажані ефекти. При введенні у стандартних оральних композиціях SLV313 дає пікові концентрації у плазмі, пов'язані з негативними бічними ефектами. Це явище, яке спостерігається у плазмі крові після орального прийому, виявилося вкрай неочікуваним, оскільки його не було ні з якими тваринами при токсикологічних випробуваннях. Цю проблему можна розв'язати додержанням спеціального режиму дозування або створенням складних композицій SLV313 з уповільненою дією. Альтернативою є пошук іншої сполуки з таким само фармакологічним профілем, але з більш сприятливим фармакокінетичним профілем. In vitro, піридин-N-оксиди SLV313 або їх аналоги діють приблизно так само, як і сполуки, від яких вони походять, і у залежності від шляху введення вони in vivo мають такі само терапевтичні можливості, як ці сполуки (ЕР 0 908 458). Nоксиди, утворенні окисленням третинних Nатомів піперазинового або піперидинового кільця, майже не активні in vitro. Але при оральному введенні у якості прекурсорів вони швидко перетворюються на свої вихідні сполуки. Цей винахід стосується N-оксидів сполук загальної формули (а): де: - А представляє гетероциклічну групу з 5-7 кільцевих атомів, яка містить 1-3 гетероатоми з групи О, N та S, - R1 - водень або фтор, - R2 - С1-4-алкіл, C1-4-алкоксі або оксогрупа, а р - 0, 1 або 2, 7 96756 8 - Ζ представляє вуглець або азот, а пунктирна лінія позначає простий зв'язок, коли Ζ - азот, та простий або подвійний зв'язок, коли Ζ - вуглець, - R3 та R4 незалежно один від одного - водень або С1-4-алкіл, - n має значення 1 або 2, - R5 - 2-піриділ, 3-піриділ або 4-піриділ, заміщений у мета-положенні відносно метиленового містка групою Y, а за бажанням заміщений (Re)q, - Υ - феніл, фураніл або тієніл, які можуть бути заміщені 1-3 замісниками з групи гідроксі, галоген, CF3, С1-4-алкоксі, С1-4-алкіл, ціан, амінокарбоніл, моно- або ді-С1-4-алкіламінкарбоніл, - R6 - галоген, гідроксі, С1-4-алкоксі або С1-4алкіл, a q - 0, 1, 2 або 3, де окислений атом азоту може бути атомом азоту в піридільному кільці, або атомом азоту в піперидиновому кільці (коли Ζ - вуглець) або одним з атомів азоту в піперазиновому кільці (коли Ζ - азот), або разом атомом азоту, приєднаним до R5 через метиленову групу та атомом азоту у піридільному кільці R5, а також їх таутомери, стереоізомери, фармакологічно прийнятні солі, гідрати та сольвати. N-оксиди за винаходом можуть по суті не містити 3-[[4-(2,3-дігідро-1,4бензодіоксин-5-іл)-1-піперазиніл]метил]-5-(4фторфеніл)піридину. Винахід стосується рацематів, сумішей діастереомерів та окремих стереоізомерів сполук формули (а), а також їх гідратів та сольватів. Фармацевтично прийнятні солі можна одержувати відомими способами, наприклад, змішуючи сполуку за винаходом з відповідною кислотою, наприклад, органічною або неорганічною. Переважно сполуки за винаходом являють собою N-оксиди сполук формули (а), де окислений атом азоту є атомом азоту у піридільному кільці R5, піридинові N-оксиди N-оксидів сполук формули (а) та їх таутомери, стереоізомери, фармакологічно прийнятні солі, гідрати та сольвати. Також переважними є N-оксиди сполук формули (а), де окислений атом азоту зв'язаний з R5 через метиленову групу, та їх таутомери, стереоізомери, фармакологічно прийнятні солі, гідрати та сольвати. Особливо переважними є 1-(2,3-дігідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо3-піридиніл]метил]-піперазин, 1-(2,3-дігідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-3піридиніл]метил]-4-оксидо-піперазин та 4-(2,3дігідро-бензо[1,4]діоксин-5-іл-1-[5-4-фторфеніл]1-оксі-піридин-3-ілметил)піперазин-1-оксид, відповідно піридиновий N-оксид, піперазиновий Nоксид та 'біс-N-оксид' 3-[[4-(2,3-дігідро-1,4бензодіоксин-5-іл)-1-піперазиніл]метил]-5-(4фторфеніл)піридину (SLV313), представлені формулами: N-оксиди сполук за винаходом загальної формули (а), а також їх фармакологічно прийнятні солі виявляють антагоністичну активність щодо рецепторів допаміну-D2 та агоністичну активність щодо 5-НТ1А. Вони можуть використовуватися для лікування хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема, шизофренії та інших психічних розладів. Винахід також охоплює: фармацевтичні композиції для лікування, наприклад, розладів або станів шляхом придушення рецепторів допаміну-D2 та/або активації рецепторів 5-НТ1А, які містять N-оксид сполуки формули (а) або його фармацевтично прийнятну сіль та фармацевтиично прийнятний носій; способи лікування розладів або станів шляхом придушення рецепторів допаміну-О2 та/або активації рецепторів 5-НТ1А, згідно з якими ссавцеві, який потребує такого лікування, вводять Nоксид сполуки формули (а) або його фармацевтично прийнятну сіль; фармацевтичні композиції для лікування розладів або станів, обраних з-поміж хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема, шизофренії та інших психічних розладів; способи лікування розладів або станів, обраних з наведеної групи, згідно з якими ссавцеві, який потребує такого лікування, вводять N-оксид сполуки формули (а) або його фармацевтично прийнятну сіль; фармацевтичні композиції для лікування хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема, шизофренії та інших психічних розладів, які містять N-оксид сполуки формули (а) або його фармацевтично прийнятну сіль та фармацевтиично прийнятний носій; способи лікування хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема, шизофренії та інших психічних розладів, 9 згідно з якими ссавцеві, який потребує такого лікування, вводять N-оксид сполуки формули (а) або його фармацевтично прийнятну сіль. Винахід також передбачає застосування Nоксид сполуки формули (а) або його солі для виготовлення лікарського засобу. Далі, винахід стосується комбінованої терапії, у якій сполуку за винаходом або її фармацевтично прийнятну сіль вводять одночасно, або після, або у вигляді комбінованого лікарського засобу з іншим лікарським засобом або засобами для лікування одного або кількох із зазначених станів. Інші лікарські засоби можна вводити до, після або одночасно з прийомом сполук за винаходом. Винахід пропонує сполуки, фармацевтичні композиції, набори та способи лікування хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема, шизофренії та інших психічних розладів, згідно з якими ссавцеві, який потребує такого лікування, вводять N-оксид сполуки формули (а) або його фармацевтично прийнятну сіль. Сполуки за винаходом виявляють антагоністичну активність щодо рецепторів допаміну-D2 та агоністичну активність щодо 5-НТ1А. (Ант)агоністична активність сполук за винаходом демонструється, наприклад, кількома випробуваннями, які описані тут або є відомі фахівцям. Також винахід пропонує способи одержання сполук за винаходом та проміжних сполук, що застосовуються у цих способах. Сполуки за винаходом можуть містити один або кілька асиметричних центрів, а відтак мати форму рацематів та рацемічних сумішей, цілих енантіомерів, діастереомерних сумішей та окремих діастереомерів. У залежності від характеру різних замісників молекула може мати додаткові асиметричні центри. Кожний такий асиметричний центр окремо продукує два оптичні ізомери. Усі можливі оптичні ізомери та діастереомери, чисті та у сумішах, та частково очищені сполуки охоплюються обсягом винаходу. До винаходу належать усі такі ізомерні форми сполук, про які йдеться. Формула (а) показує структуру класу сполук, не вдаючись до переважної стереохімії. Незалежно синтезувати такі діастеореомери або хроматографічно розділити їх можна відомими прийомами шляхом модифікації наведеної тут методики. їх абсолютна стереохімія визначається рентгенівською кристалографією кристалічних продуктів або проміжних сполук, за потреби дериватизованих реагентом, який містить асиметричний центр з точно відомою абсолютною конфігурацією. Рацемічні суміші сполук можна розділяти на окремі енантіомери відомими способами, наприклад, приєднанням рацемічної суміші сполук до енантіомерно чистої сполуки з утворенням суміші діастереомерів, з якої надалі виділяють окремі діастереомери відомими прийомами, наприклад, фракційною кристалізацією або хроматографією. Таке приєдання часто приводить до утворення енантіомерно чистої кислоти або основи, наприклад, (-)-ді-р-толуоїл-D-винної кислоти та/або (+) 96756 10 ді-р-толуоїл-L-винної кислоти. Діастереомерні похідні можна потім перетворити на чисті енантіомери відщепленням доданого хірального залишку. Рацемічну суміш сполук можна також прямо розділити відомими хроматографічними методами з застосуванням хіральних стаціонарних фаз. Або ж будь-який енантіомер сполуки можна одержати відомими прийомами стереоселективного синтезу з використанням оптично чистих вихідних матеріалів або реагентів з відомою конфігурацією. Цис- і трансізомери N-оксидів сполук формули (а) або їх фармацевтично прийнятних солей так само належать до обсягу винаходу, як і таутомери N-оксидів сполук формули (а) або їх фармацевтично прийнятних солей. Деякі кристалічні форми сполук можуть існувати як поліморфи, які також охоплюються винаходом. Крім того, деякі сполуки можуть утворювати сольвати з водою (тобто гідрати) або з органічними розчинниками. І ці сольвати входять до обсягу винаходу. Мічені ізотопами N-оксиди сполук формули (а) або їх фармацевтично прийнятних солей, у тому числі N-оксиди N-оксидів сполук формули (а), мічені з метою розпізнавання при позитронній емісійній томографії або твердофазній томографії, також охоплюються винаходом. Це також стосується N-оксиди N-оксидів сполук формули 13 14 3 18 125 (а), мічених [ С]-, [ С]-, [ Н]-, [ F]-, [ I|- або іншими збагаченими ізотопами атомами, придатних для зв'язування рецепторів або досліджень метаболізму. Випадково визначена обставина, що Nоксидні метаболіти певних похідних піриділметилпіперазину та -піперидину є придатні як альтернативи або як "прекурсори" відповідних сполук, від котрих вони походять, дозволяє застосовувати ці сполуки як альтернативні ліки, клінічними перевагами яких є більш тривала дія та згладжений пік концентрацій у плазмі, що обмежує небажані бічні ефекти. Отже, у деяких варіантах здійснення винаходу сполуки за винаходом можуть по суті не містити вихідної сполуки 3-[[4-(2,3дігідро-1,4-бензодіоксин-5-іл)-1піперазиніл]метил]-5-(4-фторфеніл)піридину (SLV-313). "По суті не містять" означає, що сполука за винаходом містить біля 50%, 40%, 30%, 20%, 10%, 1%, 0.5%, або у межах визначення не містить 3-[[4-(2,3-дігідро-1,4-бензодіоксин-5-уІ)-1піперазиніл]метил]-5-(4-фторфеніл)піридину (SLV-313) як домішки. Фармацевтичні композиції з вмістом N-оксидів SLV-313, які по суті не містять SLV-313, виготовлені згідно з цим винаходом. Визначення хімічних та інших термінів Термін „алкіл‟ стосується прямих чи розгалужених насичених вуглеводневих радикалів. „Алкіл(С1-3), наприклад, означає метил, етил, nпропил або ізопропил, а „алкіл(С1-4)‟ означає „метил, етил, n-пропил, ізопропил, n-бутил, 2-бутил, ізобутил або 2-метил-n-пропил‟. „Гало‟ або „галоген‟ означає хлор, фтор, бром або йод; „гетеро‟ у термінах типу „гетероалкіл, гетероароматичний‟ тощо означає такий, що містить один або кілька 11 атомів N, О або S. „Гетероалкіл‟ включає алкільні групи з гетероатомами у будь-яких положеннях, у тому числі N-зв'язані, О-зв'язані або S-зв'язані алкільні групи. Терміни "оксі", "тіо" та "карбо" у складі іншої групи стосуються відповідно атома кисню, атома сірки та карбонільної групи (С=О), що слугують містками між двома групами, наприклад, гідроксил, оксіалкіл, тіоалкіл, карбоксіалкіл та інші. Термін "аміно" сам по собі або у складі групи стосується атома азоту, який може бути або закінченням, або містком між двома іншими групами, причому група може являти собою первинний, вторинний або третинний (відповідно два атоми водню приєднані до атома азоту, один атом водню приєднаний до атома азоту та жодний атом водню не приєднаний до атома азоту) амін. Щодо замісників термін "незалежно" означає, що при наявності кількох замісників вони можуть бути однакові або різні. З метою точнішого опису деякі кількісні показники наводяться з виразом "біля". Незалежно від наявності або відсутності цього "біля" усі наведені кількісні значення є фактичні, а ступінь наближення цієї величини цілком зрозумілий для фахівця з урахуванням експериментальних та/або вимірювальних умов для такої величини. В описі та формулі термін "містити" та його варіанти на зразок "такий, що містить" або "містять" не включає інших добавок, компонентів, цілих чисел або операцій. Термін "композиція" у цьому винаході охоплює продукти, що містять зазначені компоненти у завданих кількостях або пропорціях, а також продукти, що утворюються прямо чи непрямо з комбінації зазначених компонентів у зазначених кількостях. Відносно фармацевтичних композицій йдеться про продукт, який містить один або кілька діючих компонентів та носій з інертних компонентів, а також продукт, що є прямим або непрямим результатом комбінації, комплексоутворення або агрегатування двох чи більше компонентів, або розкладу одного чи кількох компонентів, або інших видів реакцій чи взаємодій між компонентами. Як правило, фармацевтичні композиції одержують рівномірним та ретельним змішуванням діючого компонента з рідким або подрібненим твердим носієм чи обома, після чого за потреби продукту надають завдану форму. У фармацевтичній композиції діючу сполуку вводять у достатній кількості для досягнення потрібної дії на хід стану або хвороби. Відповідно фармацевтичною композицією за винаходом є будь-яка композиція, одержана змішуванням сполуки за винаходом з фармацевтично прийнятним носієм. У цій заявці термін „комбінований препарат‟ стосується як справжніх комбінацій, тобто Nоксидів сполук формули (а) або їх фармацевтично прийнятних солей, фізично комбінованих з іншими лікарськими засобами в одній таблетці або рідині для ін'єкцій, так і „наборів‟, у яких Nоксиди сполук формули (а) або їх фармацевтично прийнятні солі існують разом з SLV313 або іншими лікарськими засобами в окремих випускних формах з єдиною інструкцією із застосуван 96756 12 ня, а за бажанням з іншими засобами, що докладніше пояснюють, як користуватися ліками, наприклад, етикеткою або малюнком. У справжніх комбінаціях лікувальна дія відбувається за визначенням одночасно. Вміст "наборів" можна вживати одночасно або через певні проміжки часу. Одночасна або послідовна терапія залежить від характеристик інших застосованих ліків, таких, як початок та тривалість дії, рівні у плазмі, чистота тощо, а також від роду хвороби, її стадії та особливостей конкретного хворого. "Фармацевтично прийнятним" є носій, розбавник або наповнювач, сумісний з іншими інгредієнтами композиції та не шкідливий для хворого. Доза: Спорідненість сполук за винаходом до рецепторів допаміну-D2 та 5-НТ1А визначається, як описано далі. За спорідненістю зв'язування, виміряної для даної сполуки формули (а), можна розрахувати теоретичну мінімальну ефективну дозу. При концентрації сполуки, яка вдвічі перевищує виміряну величину Ki, близько 100% рецепторів можуть бути зайняті сполукою. Переводячи цю величину концентрації у мг на кг ваги хворого, визначають теоретичну мінімальну ефективну дозу, виходячи з ідеальної біозасвоюваності. З фармакокінетичних, фармакодинамічних та інших міркувань фактичну дозу змінюють у менший або більший бік. Доза сполуки, що вводиться, залежить від медичних показань, віку, ваги та статі хворого й визначається лікарем. Переважно доза знаходиться у межах від 0,01 до 10 мг/кг. Типова добова доза діючих речовин коливається у широких межах і залежить від багатьох факторів, як от медичні показання, шлях введення, вік, вага та стать хворого й визначається лікарем. Як правило, оральні та парентеральні дози становлять від 0,1 до 1000 мг на добу суми діючих речовин. Термін "терапевтично ефективна кількість" означає кількість лікарського засобу, яка здатна вилікувати або попередити той чи інший стан шляхом прийому сполуки за винаходом. Це достатня кількість для того, щоб спричинити відчутну реакцію загоєння, попередження або поліпшення стану у тканинній системі, у людини чи у тварини, наприклад, вилікувати або попередити один з тих станів, що перелічені тут. Точна ефективна кількість для даного суб'єкта залежить від його ваги, стану здоров'я, характеру та ступеню захворювання, від якого його лікують, рекомендацій лікаря (дослідника, ветеринара, терапевта або іншого клініциста), а також обраних ліків або сполучення ліків. Через те визначати ефективну терапевтичну кількість наперед недоцільно. Термін "фармацевтично прийнятна сіль" охоплює солі, які, на здоровий медичний розсуд, є придатні для застосування у контакті з тканинами людей та тварин, не спричинюючи небажаної токсичності, подразнення, алергічної реакції тощо, й відповідають позитивному критерію ефект/ризик. Фармацевтично прийнятні солі добре відомі фахівцям. їх можна готувати на місці з виділених та очищених сполук за винаходом або уособицю реакцією з фармацевтично прийнятними нетоксичними основами чи кислотами, включаючи органічні та неорганічні кислоти, не 13 органічні та органічні основи. Термін "лікування" стосується будь-якого лікування станів або хвороб ссавців, переважно людей, і включає: (1) профілактику настання хвороби або стану у суб'єкта, який має схильність до подібного захворювання, але воно ще не діагностовано, (2) інгібування хвороби або стану, тобто припинення її поширення, (3) вилікування хвороби або стану, коли її примушують відступити, (4) усунення симптомів хвороби. Термін "медична терапія" охоплює профілактичні, діагностичні або лікувальні процедури, що проводяться in vivo або ex vivo на людях та інших ссавцях. "Суб'єктом" у цьому опиетап 0 1 2 3 4 повний час 0 1.8 2.5 2.7 3.0 96756 14 сі є тварина, зокрема, ссавець, переважно людина, котра є об'єктом лікування, нагляду або експерименту. Приклади Приклад 1: Методики аналізу Рідинна хроматографія - мас-спектрометрія (LC-MS) Система LC-MS складається з двох мікронасосів Perkin Elmer серії 200. насоси з'єднані між собою трійниковим змішувачем на 50 мкл, приєднаним до автоматичного пробовідбирача Gilson 215. Методика є наступна: витрата (мкл/хв) 2000 2000 2000 2000 2000 А(%) 95 0 0 95 95 В(% 5 100 100 5 5 А= 100% води з 0.025% НСООН та 10 ммолів NH4HCOO рН= +/- 3 В= 100% ACN з 0.025% НСООН Автоматичний пробовідбирач має впорскувач на 2 мкл. Він з'єднаний з колонкою Waters Atlantis C18 30*4.6 мм з розміром часток 3 мкм. Колонка термостатована у печі Perkin Elmer серії 200 при 40° С Колонка з'єднана з вимірювачем ультрафіолетового випромінювання Perkin Elmer серії 200 з коміркою на 2.7 мкл. Довжина хвилі встановлюється 254 нм. Вимірювач з'єднаний з масспектрометром Sciex API 150EX. Параметри масспектрометра наступні: діапазон розгортки: 150900 одиниць маси; полярність: позитивна; режим розгортки: профільний; розрізнення Q1: ОДИНИЦЯ; крок розгортки: 0.10 одиниць маси; повна розгортка: 0.500 с; NEB: 10; CUR: 10; IS: 5200; ТЕМ: 325; DF: 30; FP: 225 та ЕР: 10. Детектор розсіяння світла підключений до Sciex АРІ 150. Це Sedere Sedex 55, який працює при 50° С та 3 бар N2. Системою в цілому управляє блок G3. Приклад 2: Синтез окремих сполук Окремі сполуки, синтез яких описаний далі, призначені лише докладніше ілюструвати винахід і ніяким чином не обмежують його обсяг. Інші варіанти здійснення винаходу стануть очевидні фахівцям при ознайомленні з теорією та практикою винаходу, описаними далі. Отже, опис та приклади носять суто ілюстративний характер. 1-(2,3-дігідро-1,4-бензодіоксин-5-іл-4-[[5-(4фторфеніл)-1-оксидо-3-піридиніл]метил]піперазин, сполука 1, піридиновий N-оксид SLV313 Синтез 1-(2,3-дігідро-1,4-бензодіоксин-5-іл)-4[[5-(4-фторфеніл)-1-оксидо-3піридиніл]метил]піперазину (1) зображений на схемі 1. N-окислення пірифенхлориду (2) дає пірифенхлорид-N-оксид (3), який зв'язується з елтопразином (4) з одержанням цільового N-оксиду: Етап 1: окислення пірифенхлориду (2) Н2О2: Суміш 4.66 г (21.0 ммоль) 3-(хлорметил)-5-(4фторфеніл)піридину (пірифенхлориду, (2), одержаного згідно з ЕР 0 908 458), 70 мл оцтової кислоти та 6 мл 35% Н2О2 нагрівають до 70°С. Після 95 годин реакції додають ще 2 мл Н2О2. Перемішують ще 23 години при 70°С і додають ще 2 мл 35% Н2О2. Реакційну суміш додатково перемішують усю ніч 70°С та концентрують в обертовому випарнику, одержуючи коричневу олію. Осад роз 15 чиняють у 100 мл діхлорметану. Після додання 50 мл 10% водного розчину карбонату натрію розділяють фази. Органічну фазу екстрагують 100 мл діхлорметану та 50 мл діхлорметану відповідно. Органічні фази з'єднують та концентрують під зниженим тиском в обертовому випарнику. Сирий продукт очищують препаративною рідинною хроматографією (колонка Inertsil ODS3, градієнт елюенту від 10/90% ацетонітрил/вода до 90/10% ацетонітрил/вода з вмістом 0.1% НСООН),одержуючи 1.48 г (29 ммолів, вихід 30%) відповідного N-оксиду (3). а Етап 1 : окислення пірифенхлориду (2) метахлорпербензойною кислотою (mСРВА) 1.11 г mСРВА перемішують у 20 мл діхлорметану. 1.0 г пірифенхлориду (2) розчиняють у 20 мл діхлорметану, жовтий розчин додають до розчину m-СРВА з перемішуванням при кімнатній температурі. Прозорий жовтий розчин перемішують 90 хвилин, після чого додають ще 0.55 г mCPBA. Продовжують перемішування ще годину, далі додають 25 мл води та 1 г NaHCO3 й реакційну суміш перемішують 10 хвилин. Розділяють фази й додають 10 мл води та 2 мл 2N NaOH. Після перемішування розділяють фази й водну фазу екстрагують ЕtOАс. Органічні фази з'єднують, промивають водою та концентрують до суха, одержуючи 0.98 г (вихід 91%) відповідного Nоксиду у вигляді помаранчевої олії. У збільшеному масштабі процес синтезу проводять наступним чином. 192 г (0.745 моля) 3-(хлорметил)-5-(4фторфеніл)піридину (2) у вигляді моногідрохлориду суспендують у 1 л діхлорметану. Додають 140 г NaHCO3, після чого поступово приливають 2 л води протягом 15 хвилин. 239 г глСРВА (1.25 еквіваленту) перемішують у 1350 мл діхлорметану і цей розчин додають по краплинах до суспензії пірифенхлориду у розчиннику діхлорметан/вода протягом 20 хвилин. Прозорий жовтий розчин перемішують 90 хвилин і розділяють фази . Водну фазу екстрагують 335 мл діхлорметану. Органічні фази з'єднують та екстрагують сумішшю 1675 мл води та 670 мл 2N NaOH. Після розділення фаз водну фазу екстрагують 670 мл діхлорметану. Біля 2.4 л діхлорметану видаляють дистиляцією. Додають 2.7 л MtBE (метил-третбутилетеру) та кристалізують продукт. 2.5 л суміші діхлорметан/MtBE видаляють дистиляцією. Суміш охолоджують до 5°С протягом 30 хвилин та перемішують при цій температурі 30 хвилин. Тверду фазу виділяють фільтруванням, одержуючи 161 г (91 %) відповідного білого кристалічного N-оксиду. Етап 2: зв'язування пірифенхлориду N-оксиду (3) з елтопразином (4): 96756 16 До суспензії 1.48 г (6.23 ммолів) пірифенхлориду N-оксиду (3) додають 1.63 г (1.0 еквівалент) елтопразину.НСІ (4), одержаного згідно з ЕР 0 189 612, 1.04 г (1.2 еквіваленту) карбонату калію та 27.5 мл 2-бутанону з 1.5 мл води. Суміш нагрівають до температури флегми (74°С) 20 годин. Після охолодження до кімнатної температури додають 27.5 мл води, щоб усі реагенти розчинилися, й розділяють фази. Водну фазу екстрагують двічі 45 мл 2-бутанону. Органічні фази з'єднують та промивають 30 мл води, після чого конконцентрують в обертовому випарнику. Сирий продукт очищують препаративною рідинною матографією (колонка Inertsil ODS-3, градієнт елюенту від 10/90% ацетонітрил/вода до 90/10% ацетонітрил/вода з вмістом 0.1% НСООН), одержуючи 1.83 г (4.34 ммоля, вихід 70%) відповідного N-оксиду SLV313: 1-(2,3-дігідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо3-піридиніл]метил]-піперазин. Точка топлення (за диференційною скануючою спектрометрією): 171 °С. У збільшеному масштабі процес синтезу проводять наступним чином.: 155 мл води додають до перемішуваної суспензії 155 г (652 ммолів) N-оксиду 3, 167.5 г (1 еквівалент) елтопразину.НСІ (4), 108.2 г (781 ммолів) порошку карбонату калію та 2.5 л 2бутанону. Суміш нагрівають при температурі флегми (76°С) 3 години, охолоджують до біля 50°С та тричі екстрагують 500 мл води при цій температурі. Водні фази з'єднують й екстрагують 200 мл метилетилкетону. Органічні фази з'єднують й видаляють дистиляцією 1.6 л 2-бутанону. Суміш охолоджують до 0°С. До розчину вносять затравку при 35°С. Одержану суспензію перемішують 30 хвилин при 0°С. Тверду фазу виділяють фільтруванням, одержуючи 257.3 г (94%) сирого N-оксиду SLV313. Перекристалізація 480 г сирого N-оксиду з 3.5 л ЕtOАс дає 404 г (84 %) 1(2,3-дігідро-1,4-бензодіоксин-5-іл)-4-[[5-(4фторфеніл)-1-оксидо-3-піридиніл]метил]піперазину (сполука 1). Точка топлення (за диференційною скануючою спектрометрією): 171°С. 1-(2,3-дігідро-1,4-бензодіоксин-5-іл)-4-[[5-(4фторфеніл)-3-піридиніл]метил]-4-оксидопіперазин, сполука 2, піперазиновий N-оксид SLV313. 4.4 г (10 ммолів) 1-(2,3-дігідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-3піридиніл]метил]піперазин моногідрохлориду (SLV313.HCI, 1) суспендують у 25 мл діхлорметану. Додають 42 мл 5% розчину бікарбонату натрію. 3.08 г (1.25еквіваленту) 17 96756 18 mСРВА розчиняють у 20 мл діхлорметану. Цей розчин додають до перемішуваної суспензії SLV313 у суміші діхлорметан/вода протягом 1 хвилини. Суміш перемішують 2.5 години при кімнатній температурі, після чого розділяють фази . Водну фазу екстрагують 10 мл EtOAc. Органічні фази з'єднують й екстрагують 25 мл води та 10 мл 2N NaOH. Органічну фазу концентрують до суха. Сирий продукт (2.83 г) кристалізують з 40 мл ацетонітрилу. Тверду фазу виділяють фільт руванням. Після сушки (50°С у вакуумі) одержують 1.63 г (39%) білого 1-(2,3-дігідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-3піридиніл]метил]-4-оксидо-піперазину, сполуки 2. Точка топлення (за диференційною скануючою спектрометрією): 181 ° -182°С. 4-(2,3-дігідробензо[1,4]діоксин-5-іл-1-[5-4фторфеніл]-1-оксіпіридин-3-ілметил)піперазин-1оксид, сполука 3, біс-N-оксид‟ SLV313. 0.5 г (1.19 ммоля) 1-(2,3-дігідро-1,4бензодіоксин-5-іл)-4-[[5-(4-фторфеніл)-1-оксидо3-піридиніл]метил]-піперазину, піридинового Nоксиду SLV313, суспендують у 40 мл ацетону. Додають 0.32 г (1.85 ммоля) mСРВА. Прозорий розчин перемішують 30 хвилин при кімнатній температурі. Суміш концентрують у вакуумі, осад очищують хроматографією (DMA 1), одержуючи 0.26 г (50%) 4-(2,3-дігідробензо[1,4]діоксин-5-іл-1[5-4-фторфеніл]-1-оксіпіридин-3ілметил)піперазин-1-оксиду, сполуки 3. Точка топлення: 170-173°С. Подібним чином можна синтезувати N-оксиди інших сполук формули (а). Вибір того чи іншого шляху синтезу залежить від факторів, добре відомих фахівцям, наприклад, від сумісності функціональних груп із застосованими реагентами, можливості використання захисних груп, каталізаторів, активуючих та зв'язувальних реагентів та структурних властивостей цільової сполуки. Приклад 3: композиції, що застосовуються у дослідах на тваринах Для орального (р.о.) введення: до потрібної кількості (0.5-5 мг) твердої сполуки А1 у скляній трубці додають кульки та подрібнюють у вихровому млині 2 хвилини . Після додання 1 мл розчину 1% метилцелюлози у воді та 2% (об.) Poloxamer 188 (Lutrol F68) сполуку суспендують у вихрі 10 хвилин. рН доводять до 7 кількома краплинами водного розчину NaOH (0.1 Ν). Решту часток додатково суспендують за допомогою ультразвукової бані. Для внутрішньочеревного (і.р.) в ведення: до потрібної кількості (0.5-15 мг) твердої сполуки А1 у скляній трубці додають кульки та подрібнюють у вихровому млині 2 хвилини . Після додання 1 мл розчину 1% метилцелюлози та 5% манітолу у воді сполуку суспендують у вихрі 10 хвилин. рН доводять до 7. Приклад 4: Фармакологічні методи Спорідненість до рецепторів нейтротрансмітерів in vitro. Дані про зв'язування, наведені нижче, одержані дослідним центром CEREP (8, рю Дантон, 92500 Рюель-Мальмезон, Франція) або фірмою Solvay Pharmaceuticals B.V. (ван Хоутенлаан 36, 1381 СР Веесп, Нідерланди) згідно з правильно документованими стандартними методиками. Спорідненість до рецепторів допамінуD2 та 5-НТ1А, наприклад, визначають за Creese (1997) та Gozlan (1983) відповідно. (Ант)агоністичну активність in vitro щодо людських рецепторів D2 та 5-НТ1А визначають за методиками Solomon (1974) та Weiss (1985) відповідно, при утворенні аденилатциклази у клітинних 19 96756 лініях, де проявляється експресія цих клонованих рецепторів. Ретракцію нижньої губи, тваринну модель in vivo для агоністичної активності рецепторів серотоніну 5-НТ1А, вимірюють за методикою Berendsen (1989); Спричинену апоморфіном лазальну поведінку в мишей, тваринну модель in vivo для антагоністичної активності рецепторів допаміну-D2, визначають за методикою Costall (1978). N-оксиди сполук за винаходом загальної формули (а), а також їх фармацевтично прийнятні солі є альтернативою вихідним сполукам або їх 20 прекурсорам, у яких антагоністична активність щодо рецепторів допаміну-D2 сполучається з агоністичною активністю щодо рецепторів 5-НТ1А. Вони придатні для лікування уражень та хвороб центральної нервової системи, спричинених розладами допамінергійної або серотенергійної систем, як, наприклад, хвороби Паркінсона, агресивності, розладів бентежності, аутизму, запаморочення, депресії, розладів мислення або пам'яті, зокрема, шизофренії та інших психічних розладів. Приклад 5: Результати фармакологічних досліджень Таблиця 1 Фармакологічні дослідження in vitro та in vivo SLV313 та його піридинового N-оксиду Спорідненість до рецепторів in vitro SLV313 Піридиновий N-оксид Піперазиновий N-оксид Ki(nМ) Рецептор Вид радіоліганд Kі(nМ) Kі(nМ) Допамін-D1 Допамін-D2 Допамін-Оз Допамін-О4 Людина Людина Людина Людина [ H]-SCH 23390 3 [ Н]-спіперон 3 | Н]-спіперон 3 [ Н]-спіперон > 10,000 4 4 10 > 10,000 5 8 20 Серотонін-5-НТ1А Серотонін-5-НТ1D Серотонін-5-НТ2А Серотонін-5-НТ2C Серотонін-5-НТ3 Серотонін-5-НТ4 Серотонін-5-НТ6 Серотонін-5-НТ7 Повт.засв. 5-НТ Людина Корова Людина Людина ЩУР Людина Людина Людина Людина [ H]-8-OH-DPAT 3 [ Н]-серотонін 3 [ Н]-кетансерин 125 [ l]-DOI 3 [ H]-GR 38032F 3 [ H]-GR 113808 3 [ H]-LSD 3 [ H]-LSD 3 [ Н]-пароксетин 0.8 13,000 250 > 1,000 > 1,000 > 1,000 > 1,000 63 > 1,000 0.4 4,000 500 > 10,000 > 10,000 > 10,000 > 10,000 100 320 1- адренергін 2- адренергін Щур Щур [ Н]-празосин [ H]-RX 821002 500 > 1,000 1,000 630 Гістамін-Н1 Людина [ Н]-піриламін > 1,000 > 10,000 Мускарин-M1 Мускарин-М4 Мускарин-М5 Людина Людина Людина [ Н]-пірензепин 3 [ H]-4-DAMP 3 [ H]-4-DAMP > 10,000 > 1,000 > 1,000 > 10,000 > 10,000 > 10,000 μ-опіат Щур [ H]-DAMGO 8,000 3,200 SLV313 Піридиновий N-оксид 8.9 9.3 8.8 9.2 SLV313 Піридиновий N-оксид Піперазиновий N-оксид 0.5 мг/кг орал 2.3 мг/кг орал 0.9 мг/кг орал 3.0 мг/кг орал 0.3 мг/кг орал 10 мг/кг орал 3 3 3 3 3 3 3 Функціональна активність рецепторів in vitro Агонізм до люд.рецепторів 5-НТ1А, рЕС50 = Антагонізм до люд.рецепторів D2, pA2 = Фармакологічні показники in vivo Лазіння від антагон. апоморфіну: ED50 = Ретракція нижньої губи: ED50 = Очевидно, що фармакологічні профілі як in vitro, так і in vivo, SLV313 та його піридинового N > 1,000 25 Піперазиновий N-оксид оксиду є ідентичні. У порівнянні з цими сполуками піперазиновий N-оксид майже не виявляє актив 21 96756 ності in vitro, але in vivo демонструє аналогічну дію. Він може бути прототипом прекурсору. SLV313 та його піридиновий N-оксид уводять індивідуально (внутрішньовенна (і.ν.) або орально (р.о.)) мишам (по 3 тварини одночасно), після 22 чого роблять аналізи крові методом рідинної хроматографії-мас-спектрометрії (методику див. вище) на SLV313 та його піридиновий N-оксид. Усереднені дані (n=3) наведені у табл, 2. Таблиця 2 Концентрації у плазмі крові SLV313 та його піридинового N-оксиду уведено Вміст у крові Час (год) SLV313 [нг/мл] Піридиновий N-оксид [нг/мл] SLV313 0.5 мг/кг i.v. 0.17 0.5 1 3 7 24 113 92 49 11 2 0 0.58 0.91 0.44 0 0 0 Піридиновий N-оксид 0.5 мг/кг i.v. 0.17 0.5 1 3 7 24 1.9 1.1 0.6 0 0 0 264 114 31 0.8 0 0 SLV313 5 мг/кг р.о. 0.17 0.5 1 3 7 24 182 117 157 45 14 0 3.1 3.8 3.3 1.1 0.6 0 Піридиновий N-оксид 5 мг/кг р.о. 0.17 0.5 1 3 7 24 1.0 1.5 1.3 2.8 2.3 0 222 316 80 45 11 0 SLV313, введений мишам (i.v. або р.о.), у невеличкому ступні метаболізується до свого піридинового N-оксиду: концентрація останнього не перевищує 1 - 2% вмісту вихідної сполуки. Коли вводять сам N-оксид, він лише незначно (менше 1%) відновлюється до вихідної сполуки. Для мишей піридиновий N-оксид є скоріше альтернативою, а не прекурсором SLV313. SLV313 та його піперазиновий N-оксид уводять індивідуально (внутрішньовенна (і.ν.) або орально (р.о.)) мишам (по 3 тварини одночасно), після чого роблять аналізи крові методом рідинної хроматографії-мас-спектрометрії (методику див. вище) на SLV313 та його піперазиновий Nоксид. Усереднені дані (n=3) наведені у табл. 3. 23 96756 24 Таблиця 3 Концентрації у плазмі крові SLV313 та його піперазинового N-оксиду уведено Вміст у крові Час (год) SLV313 0.5 мг/кг i.v. Піперазиновий N-оксид 0.5 мг/кг i.v. SLV313 5 мг/кг р.о. Піперазиновий N-оксид 5 мг/кг р.о. SLV313 [нг/мл] Піперазиновий N-оксид [нг/мл] 0.17 0.5 1 3 7 24 113 92 49 11 2 0 0 0 0 0 0 0 0.17 0.5 1 3 7 24 52 29 16 4 1 0 91 10 2 0 0 0 0.17 0.5 1 3 7 24 182 117 157 45 14 0 0 0 0 0 0 0 0.17 0.5 1 3 7 24 10 51 79 72 23 0 28 14 6 0 0 0 SLV313, введений мишам (i.v. або р.о.), не метаболізується до свого піперазинового Nоксиду. При введенні мишам піперазинового Nоксиду за півгодини його концентрація у плазмі стає більшою за вміст вихідної молекули. Піперазиновий N-оксид, безсумнівно, є прекурсором SLV313. SLV313 та його піперазиновий N-оксид уводять індивідуально (внутрішньовенна (і.ν.) або орально (р.о.)) мишам (по 3 тварини одночасно), після чого роблять аналізи мозку методом рідинної хроматографії-мас-спектрометрії (методику див. вище) на SLV313 та його піперазиновий Nоксид. Усереднені дані (n=3) наведені у табл. 3. 25 96756 26 Таблиця 4 Концентрації у мозку SLV313 та його піперазинового N-оксиду уведено Вміст у мозку Час (год) SLV313 [нг/мл] Піперазиновий N-оксид [нг/мл] Піперазиновий N-оксид 0.5 мг/кг і.ν. 0.17 0.5 1 3 7 24 77 65 49 12 4 0 3.1 4.4 0 0 0 0 Піперазиновий N-оксид 5 мг/кг р.о. 0.17 0.5 1 3 7 24 13 138 145 145 48 0 2.9 2.6 0 0 0 0 Введений мишам (і.ν. або р.о.) піперазиновий N-оксид майже не виявляється у мозку, тоді як присутність вихідної сполуки SLV313 є очевидною. Обсяг розподілу Обсяг розподілу (VD), або "здаваний обсяг розподілу" - це фармакологічний термін, який стосується кількісного розподілу лікарського за собу в організмі після орального або парентерального введення. Він визначається як обсяг, у якому потрібно розподілити певну кількість засобу, щоб досягти концентрації, яка спостерігається (Widmark, 1919). Обсяг розподілу SLV313 та його піридинового N-оксиду вимірюють у мишей за відомою стандартною методикою. сполука VD, л/кг VD для середньої людини вагою 70 кг SLV313 Піридиновий N-оксид SLV313 5 1 350 L 70 L З наведених даних очевидно, що обсяг розподілу SLV313 у п'ять разів вище, ніж у його піридинового N-оксиду. Обсяг розподілу - це не фізіологічний обсяг, а співвідношення між загальною кількістю лікарського засобу в організмі та його концентрацією у плазмі. Вважається, що обсяг розподілу більшменш однаковий для всіх видів, а тому результати вимірювань на лабораторних тваринах дозволяє з високою вірогідністю робити прогноз щодо людини. сполука SLV313 Піридиновий N-оксид SLV313 Піперазиновий N-оксид SLV313 Бic-N-оксид SLV313 Величина 350 л, розрахована для середньої людини вагою 70 кг, у багато разів перевищує реальний обсяг тіла, отже, сполука має екстенсивно розподілятися у тканинах, а її концентрація у плазмі є низька. Піридиновий N-оксид SLV313 має розрахунковий обсяг розподілу 70 л для людини вагою 70 кг, а відтак розподіляється в усій рідині тіла. Коефіцієнт розподілу Коефіцієнти розподілу (log Ρ) SLV313 та його N-оксидів розраховують і визначають (при рН 7.0) відомими способами. Молекулярна маса ALog P (розрахунковий) Log Ρ (виміряний) 405.5 421.5 421.5 437.5 3.9 3.1 3.1 2.2 3.6 2.6 1.7 Очевидно, N-оксиди SLV313 є менш ліпофільні, ніж вихідна сполука. При оральному прийомі 27 96756 28 однакових доз N-оксиди потрапляють до кровообігу повільніше, ніж SLV313, і її пікові концентрації нижчі, ніж у SLV313. Нижченаведена схема ілюструє винахід: різні N-оксиди SLV313, однієї з сполук формули (а). "Піперазиновий N-оксид', який не виявляється як метаболіт, є практично неактивний in vitro, але після орального введення швидко відновлюється до своєї вихідної молекули SLV313. У піридинового N-оксиду, метаболіту в людському організмі, фармакологічний профіль дуже близький до профілю вихідної сполуки. Це активний метаболіт. Подібним чином біс-N-оксид SLV313 („піперазиновий N-оксид піридинового N-оксиду‟) є неактивним in vitro, але чинить таку само дію, що й вихідна молекула - піридиновий N-оксид. Bic-Nоксид є прекурсором активного метаболіту. Приклад 6: Фармацевтичні препарати Для клінічного застосування N-оксиди сполук формули (а) вводять до складу фармацевтичних композицій, які становлять важливий новий аспект винаходу. Фармацевтичні композиції можуть мати, зокрема, форму таблеток, жуйних таблеток, розчинів, парентеральних розчинів, капсул (у тому числі мікрокапсул), мазей (кремів або гелів), супозиторіїв, суспензій та інші форми, розкриті у цьому описі, або очевидні для фахівця, або відомі з рівня техніки. Фармацевтичні композиції за винаходом можна вводити орально, внутрішньовенно, підшкірно, трахеально, бронхіально, інтраназально, пульмонарно, трансдермально, букально, ректально, парентерально (внутрішньом'язово або внутрішньовенно), ректально або іншими шляхами. Фармацевтична композиція містить принаймні одну сполуку формули (а) в суміші з фармацевтично прийнятним ад'ювантом, розбавником та/або носієм. Сумарна кількість діючих речовин становить від біля 0,1 до біля 95% від маси композиції, зокрема, від 0.5% до 50%, переважно від 1% до 25%. Сполукам за винаходом можна надавати форм, придатних для введення, відомими способами із застосуванням допоміжних речовин - рідких, твердих, порошкоподібних, як от звичайні фармацевтичні наповнювачі та розширювачі, розчинники, емульгатори, мастила, смакові добавки, фарбники та/або буферні речовини. До найчастіше вживаних допоміжних речовин належать Карбонат магнію, двооксид титану, лактоза, сахароза, сорбітол, манітол та інші сахари або цукрові спирти, тальк, молочний білок, желатин, крохмаль, амілопектин, целюлоза та її похідні, тваринні та рослинні олії, наприклад, риб'ячий жир, соняшникова, арахісова або кунжутна олія, поліетиленгліколь, та розчинники, наприклад, стерильна вода, одно- та багатоатомні спирти, як гліцерин, а також дезінтегранти й мастила, наприклад, стеарат магнію, стеарат кальцію, стеарилфумарат натрію та поліетиленглікольні воски. Таку суміш можна гранулювати або пресувати з неї таблетки. Діючі речовини можна попередньо змішувати з іншими інгредієнтами перед змішуванням повної композиції. Також діючі речовини можна попередньо змішувати між собою, а вже потім з 29 неактивними інгредієнтами, одержуючи композицію. 4 М'які желатинові капсули можна одержувати з суміші діючих речовин за винаходом, рослинної олії, жирів або інших придатних носіїв для м'яких желатинових капсул. Тверді желатинові капсули можуть містити гранули діючих компонентів у суміші з твердими порошками, наприклад, лактози, сахарози, сорбітолу, манітолу, картопляного крохмалю, кукурудзяного крохмалю, амілопектину, похідних целюлози або желатину. Форми для ректального введення можна одержувати (і) у вигляді супозиторіїв, які містять суміш діючої речовини з нейтральною жировою основою; (іі) у вигляді желатинових ректальних капсул, які містять суміш діючої речовини з рослинною олією, парафіновою олією або іншим придатним носієм; (ііі) у вигляді готових мікроклізм; (iv) у вигляді сухих мікроклізм, які розчиняють у придатному розчиннику перед застосуванням. Рідкі препарати можна готувати у вигляді сиропів, еліксирів, концентрованих краплин або суспензій, наприклад, розчинів або суспензій, що містять діючу речовину, а решта складається з сахарів або цукрових спиртів і сумішей етанолу, води, гліцерину, пропиленгліколю та поліетиленгліколю. За бажанням такі рідкі препарати можуть містити фарбники, смакові добавки, консерванти, сахарин, карбоксіметилцелюлозу або інші загусники. Також можна готувати рідкі препарати у вигляді сухого порошку, який розчиняють у придатному розчиннику перед застосуванням. Розчини для парентерального введення можна одержувати розчиненням композиції за винаходом у фармацевтично прийнятному розчиннику. Такі розчини можуть містити також стабілізатори, консерванти та/або буферні інгредієнти. Рідкі препарати можна готувати у вигляді сиропів, еліксирів, концентрованих крапель або суспензій, наприклад, розчини або суспензії, що містять діючі речовини, а решту становлять, наприклад, сахари або цукрові спирти й суміш етанолу, води, гліцерину, пропилепнгліколю та поліетиленгліколю. За бажанням такі рідкі препарати можуть містити фарбники, смакові добавки, консерванти, сахарин та карбоксіметилцелюлозу або інший загусник. Також рідкі препарати можна готувати у вигляді сухого порошку, який перед застосуванням розчиняють у придатному розчиннику. Розчини для парентерального введення можна також одержувати у вигляді сухого порошку, який роз Комп‟ютерна верстка Л. Купенко 96756 30 чиняють у придатному розчиннику перед застосуванням. У варіантах здійснення винаходу передбачено фармацевтичний набір, утворений однією або кількома вмістинами, заповненими одним або кількома компонентами фармацевтичної композиції згідно з винаходом. До такої вмістини (вмістин) можуть додаватися друковані матеріали, наприклад, інструкція із вживання або нотатка за формою, Передбаченою державним органом, який контролює виробництво, застосування або продаж фармацевтичних продуктів, причому ця нотатка означає затвердження таким органом виробництва, застосування або продажу композиції для людей або тварин. Застосування композицій за винаходом у виробництві лікарських засобів для лікування станів, де потрібен антагонізм щодо рецепторів допаміну-D2 та/або активація рецепторів 5-НТ1А, а також способи лікування шляхом введення терапевтично ефективної кількості принаймні однієї сполуки формули (а) як ліків або, у разі прекурсорів, після прийому суб'єктом, який страждає від станів, де потрібен антагонізм щодо рецепторів допаміну-D2 та/або активація рецепторів 5-НТ1А. Література Berendsen et al., Pharmacol. Biochem. Behav. 33, 821-827, 1989. Bickel, M.H.,: "The pharmacology and Biochemistry of N-okcuos", Pharmacol. Reviews, 21(4), 325-355, 1969. Costall, В., Naylor, R.J. and Nohria, V., 'Differential actions of typical and atypical agents on two behavioural effects of apomorphine in the mouse', Brit J Pharmacol, 63: 381-382, 1978. 3 Creese I, Schneider R and Snyder S.H., „[ H]Spiroperidol labels допамін receptors in rat pituitary and brain‟, Eur. J. Pharmacol, 46, 377-381, 1997 Gozlan H, El Mestikawy S., Pichat L, Glowinsky J. and Hamon, M., "Identification of presynaptic се3 ротонін autoreceptors using a new ligand H-PAT", Nature, 305, 140-142, 1983. Solomon, Y., Landos, C, Rodbell, M., "A highly selective adenylyl cyclase assay", Anal Biochem, 58, 541-548, 1974 Weiss, S., Sebben, M. and Bockaert, J.J., „Corticotropin-peptide regulation of intracellular cyclic AMP production in cortical neurons in primary culture‟, J Neurochem, 45, 869-874, 1985. Widmark, E.P.M., „Studies in the concentration of indifferent narcotics in blood and tissues‟‟, Acta Med. Scand., 52, 87-164, 1919. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюN-oxides of pyridylmethylpiperazine and -piperidine derivatives
Автори англійськоюVan Aar Marcel P M, Van Amsterdam Peter H., Barf Gerrit A, Bakker Johan Antoine, Den Besten Cathaline, Herremans Arnoldus H J, Zorgdrager, Jan
Назва патенту російськоюN-оксиды производных пиридилметилпиперазина и пиридилметилпиперидина
Автори російськоюВан Аар Марсель П.М., ван Амстердам Петер Х., Барф Геррит А., Баккер Йоган Антуан, ден Бестен Каталин, Герреманс Арнольдус Г.Й., Зоргдрагер Ян
МПК / Мітки
МПК: A61P 25/22, A61P 25/16, A61P 25/24, C07D 405/12, A61P 25/18, A61K 31/444
Мітки: похідних, n-оксиди, піридилметилпіперидину, піридилметилпіперазину
Код посилання
<a href="https://ua.patents.su/15-96756-n-oksidi-pokhidnikh-piridilmetilpiperazinu-ta-piridilmetilpiperidinu.html" target="_blank" rel="follow" title="База патентів України">N-оксиди похідних піридилметилпіперазину та піридилметилпіперидину</a>
Попередній патент: Підігрівальна камера місткості прямого плавлення та місткість прямого плавлення
Наступний патент: Заміщені пролінаміди, їх одержання та їх застосування як лікарських засобів
Випадковий патент: Пристрій для приймання інформації