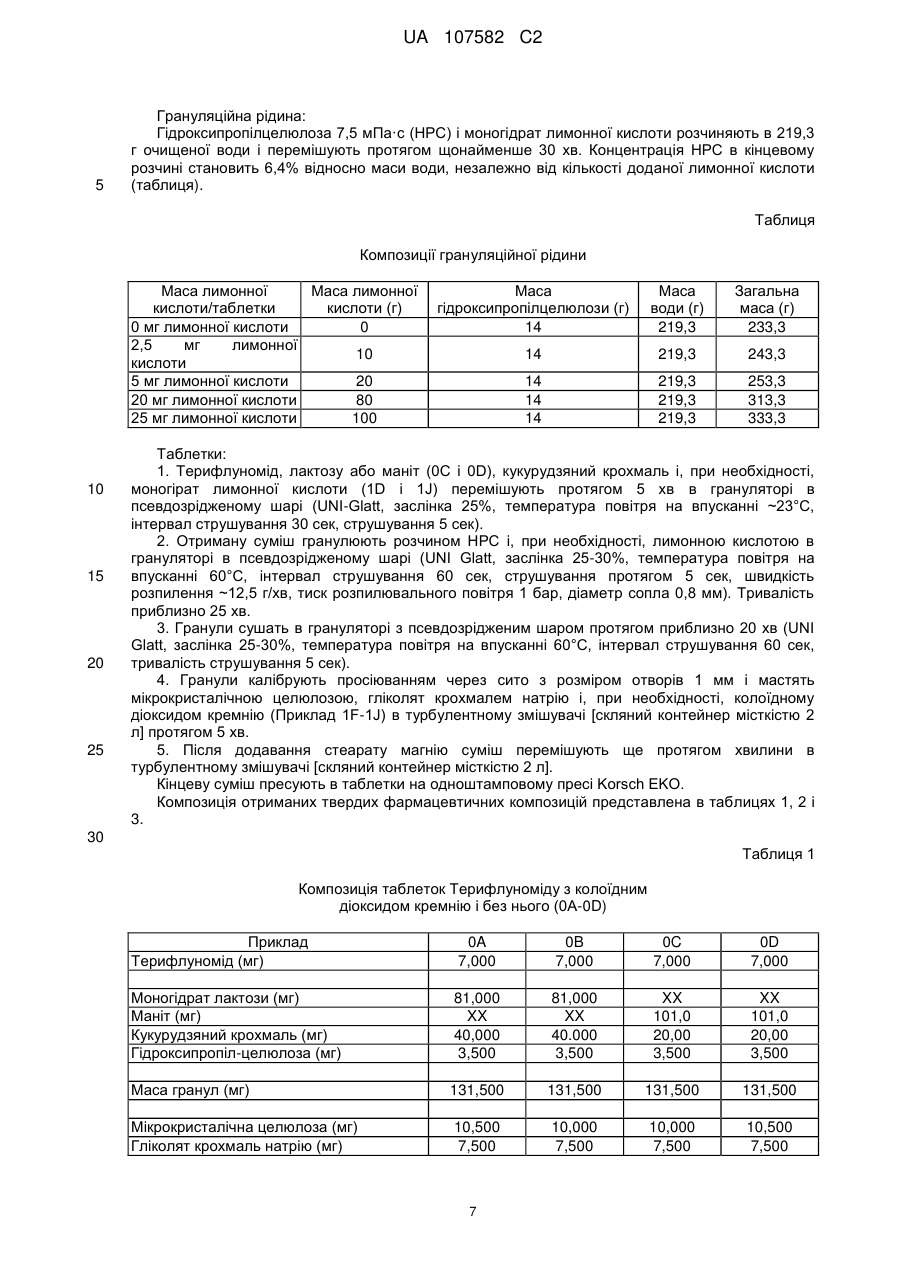
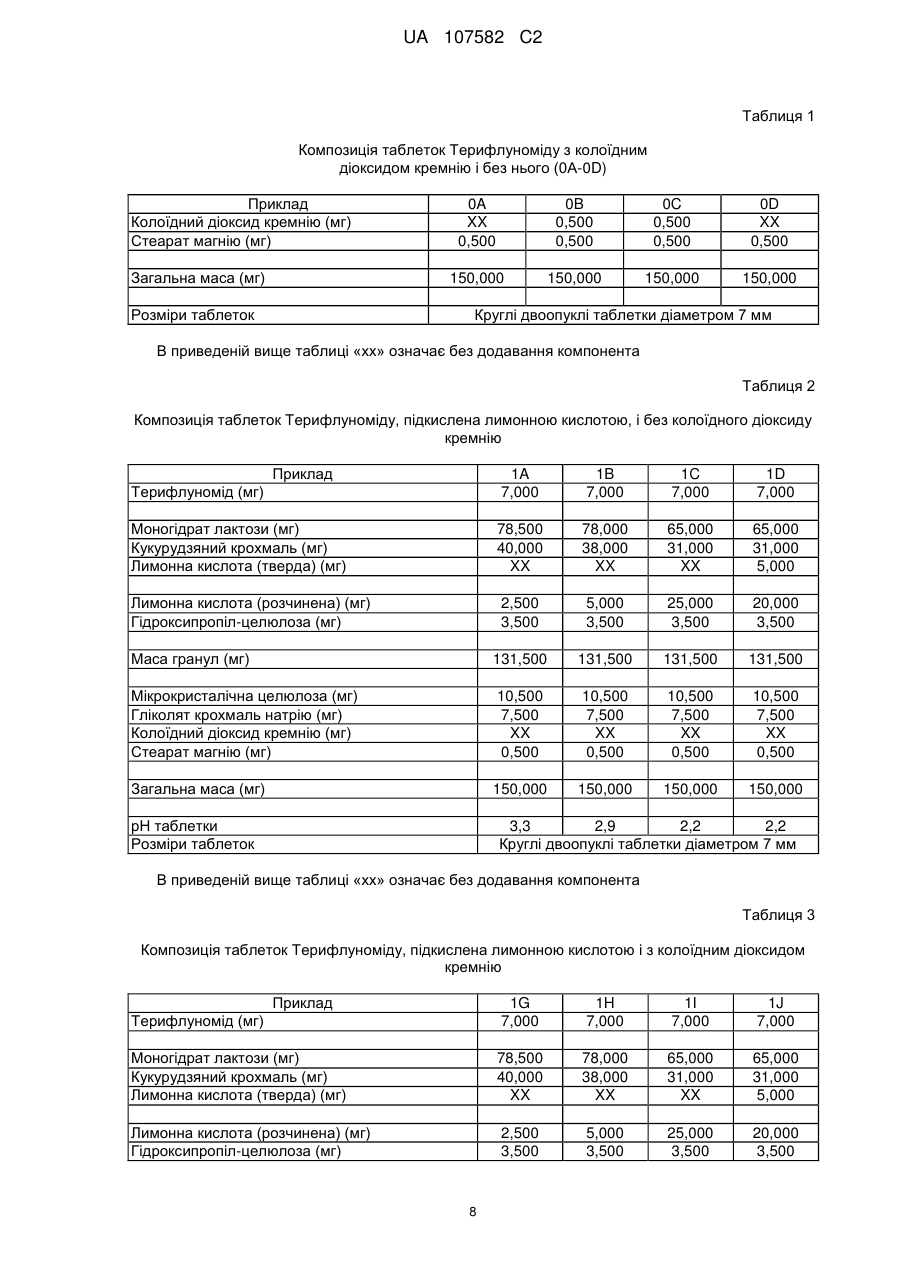
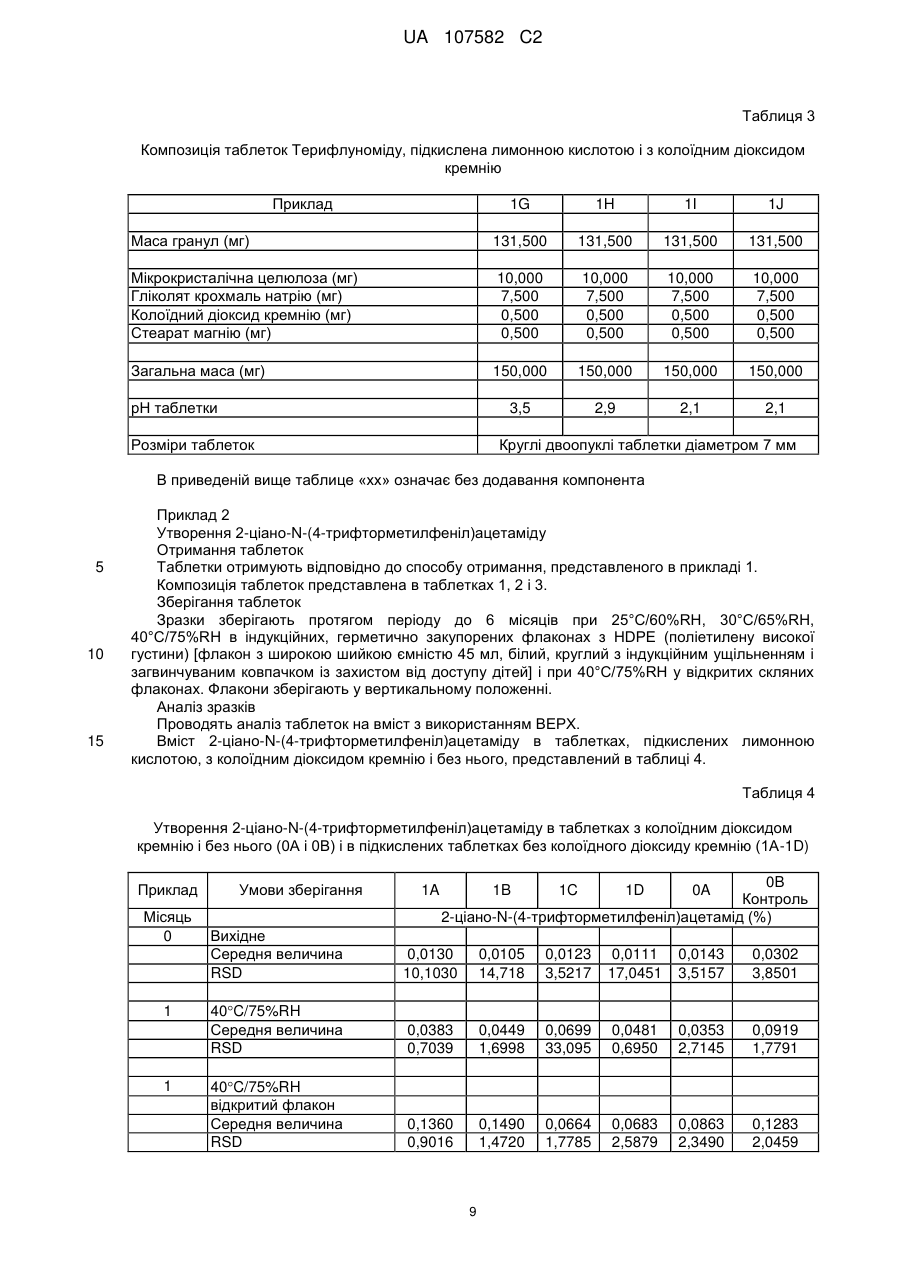
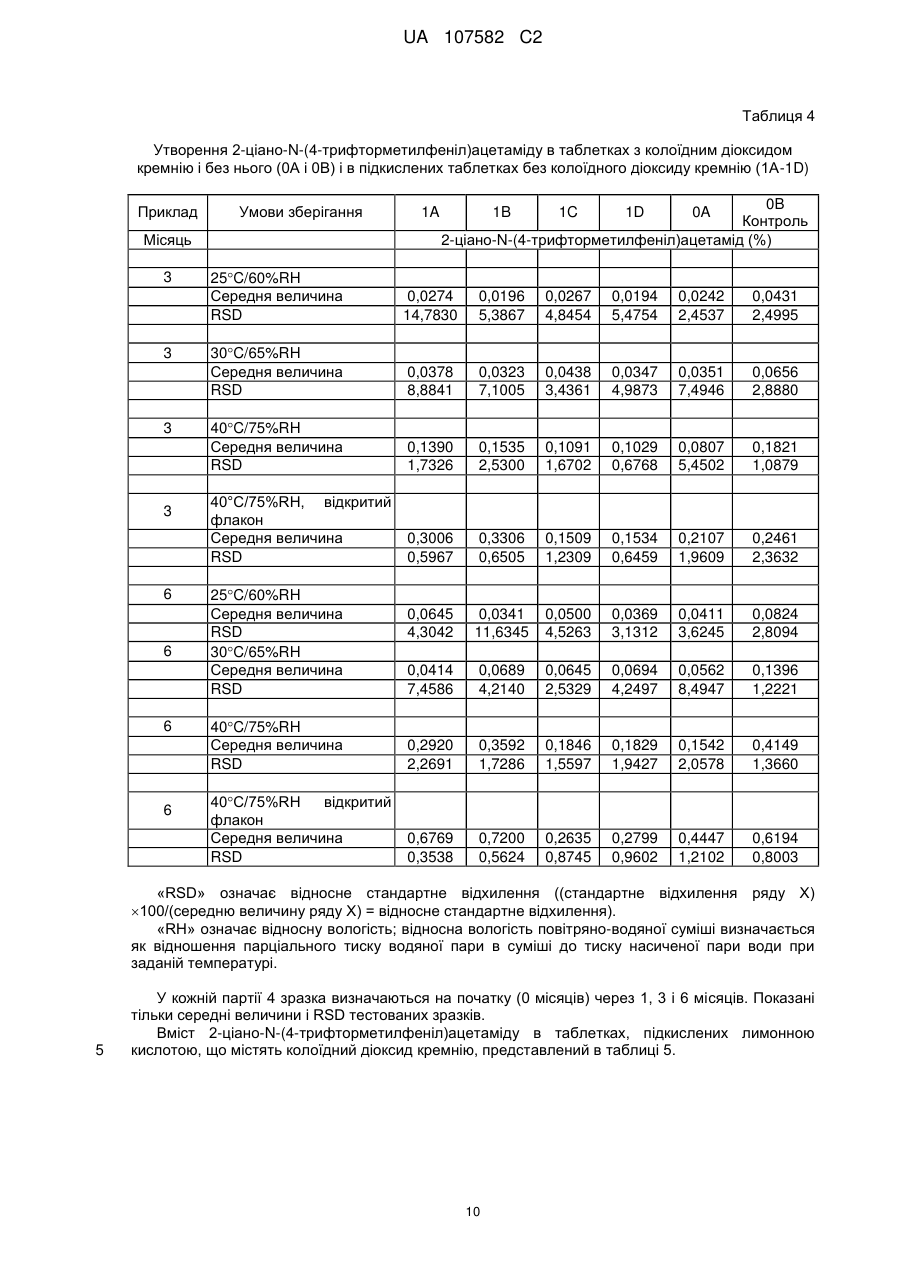
Таблетований препарат (4′-трифторметилфеніл)аміду (z)-2-ціано-гідроксибут-2-еноєвої кислоти з поліпшеною стійкістю
Формула / Реферат
1. Тверда фармацевтична композиція, що містить:
a) від 1 % до 30 % мас./мас. терифлуноміду або його фармацевтично прийнятної основно-адитивної солі,
b) від 5 % до 20 % мас./мас. розпушувача,
c) від 0 % до 40 % мас./мас. зв'язувального агента,
d) від 0,1 % до 2 % мас./мас. мастильної речовини і
e) процентну частку, що залишається, яка містить розріджувачі,
за умови, що тверда фармацевтична композиція не містить колоїдний діоксид кремнію.
2. Тверда фармацевтична композиція за п. 1, де зазначений розпушувач вибраний з групи, що складається з карбоксиметилцелюлози, низькозаміщеної гідроксипропілцелюлози, мікрокристалічної целюлози, порошкоподібної целюлози, кроскармелози натрію, метилцелюлози, полакриліну калію, альгінату натрію, гліколяту крохмалю натрію або суміші одного або більше зі вказаних розпушувачів.
3. Тверда фармацевтична композиція за п. 2, де розпушувач вибраний з групи, що складається з низькозаміщеної гідроксипропілцелюлози, мікрокристалічної целюлози, порошкоподібної целюлози, кроскармелози натрію, гліколяту крохмалю натрію або суміші одного або більше зі вказаних розпушувачів.
4. Тверда фармацевтична композиція за п. 1, де вказаний зв'язувальний агент вибраний з групи, що складається з акації, карбоксиметилцелюлози, гідроксіетилцелюлози, гідроксипропілцелюлози, декстрину, желатину, кизельгуру, гідроксипропілметилцелюлози, мальтодекстрину, метилцелюлози, альгінату натрію, прежелатинізованого крохмалю, картопляного крохмалю, кукурудзяного крохмалю або злакового крохмалю і зеїну або суміші одного або більше зі вказаних зв'язувальних агентів.
5. Тверда фармацевтична композиція за п. 4, де вказаний зв'язувальний агент вибраний з групи, що складається з гідроксипропілцелюлози, гідроксипропілметилцелюлози, прежелатинізованого крохмалю, крохмалів, таких як: картопляний крохмаль, кукурудзяний крохмаль або злаковий крохмаль, і суміші одного або більше зі вказаних зв'язувальних агентів.
6. Тверда фармацевтична композиція за п. 1, де вказану мастильну речовину вибирають з групи, що складається зі стеарату кальцію, гліцерилпальмітостеарату, бензоату натрію, лаурилсульфату натрію, стеарилфумарату натрію, стеаринової кислоти, тальку, стеарату цинку і стеарату магнію або суміші однієї або більше зі вказаних мастильних речовин.
7. Тверда фармацевтична композиція за п. 6, де вказану мастильну речовину вибирають з групи, що складається з стеарилфумарату натрію і стеарату магнію або суміші однієї або більше зі вказаних мастильних речовин.
8. Тверда фармацевтична композиція за п. 1, де вказаний розріджувач вибирають з групи, що складається з целюлози, ацетату целюлози, декстратів, декстрину, декстрози, фруктози, 1-О-α-О-глюкопіранозил-D-маніту, гліцерилпальмітостеарату, гідрованої рослинної олії, каоліну, лактиту, лактози, моногідрату лактози, мальтиту, маніту, мальтодекстрину, мальтози, прежелатинізованого крохмалю, хлориду натрію, сорбіту, крохмалів, сахарози, тальку і ксиліту або суміші одного або більше зі вказаних розріджувачів.
9. Тверда фармацевтична композиція за п. 8, де вказаний розріджувач вибирають з групи, що складається з лактози, моногідрату лактози, маніту і крохмалів або суміші одного або більше зі вказаних розріджувачів.
Текст
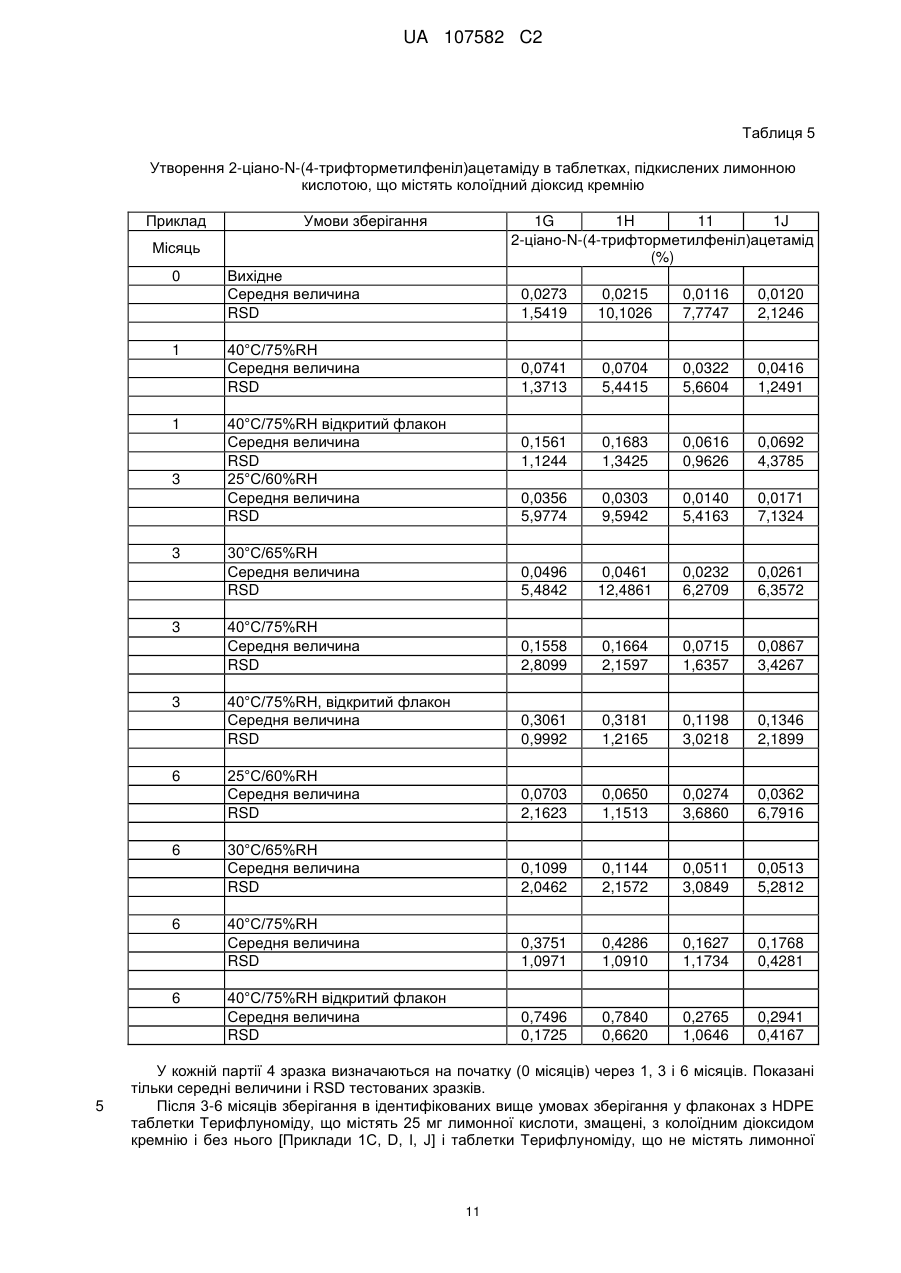
Реферат: Винахід належить до галузі фармацевтики і стосується твердих фармацевтичних композицій, що містять (4-трифторметилфеніл)амід (Z)-2-ціано-3-гідроксибут-2-еноєвої кислоти (терифлуномід), за умови, що композиція не містить колоїдний діоксид кремнію. UA 107582 C2 (12) UA 107582 C2 UA 107582 C2 5 10 15 20 25 30 35 40 45 Галузь, до якої належить винахід Даний винахід стосується фармацевтичних композицій, що містять (4'трифторметилфеніл)амід (Z)-2-ціано-3-гідрокси-бут-2-еноєвої кислоти, загальновідомих як Терифлуномід, а також способу їх отримання, способів застосування таких композицій для лікування індивідів, які страждають на аутоімунні захворювання, зокрема, системний червоний вовчак або хронічне захворювання трансплантат проти хазяїна, або розсіяний склероз або ревматоїдний артрит. Передумови винаходу (4'-Трифторметілфеніл)амід (Z)-2-ціано-3-гідрокси-бут-2-еноєвої кислоти (Терифлуномід) має структуру, що ілюструється формулою I: Формула I Застосування (4'-трифторметилфеніл)аміду (Z)-2-ціано-3-гідрокси-бут-2-еноєвої кислоти (Терифлуноміду, Формули I) при лікуванні хронічного захворювання трансплантат проти хазяїна було описано в патенті США № 4965276, виданому 23 жовтня 1990 р. У патенті США № 5459163, виданому 21 жовтня 1997 р. і в патенті США № 5679709, виданому 21 жовтня 1997 р., розкриті композиції, які можуть застосовуватися для лікування аутоімунних захворювань, зокрема, червоного вовчака. Було показано, що Терифлуномід викликає антипроліферативні ефекти на широку різноманітність імунних клітин і клітинних ліній (Cherwinski H. M., et al., J Pharmacol. Exp. Ther. 1995;272:460-8; Prkash А., et al., Drugs 1999;58(6):1 137-66; Bartlett R. R. et al., Agent Action 1991;32(1-2):10-21). Крім того, він інгібує фермент дигідрооротат-дегідрогеназу, фермент, суттєвий для синтезу піримідинів (Bruneau J-M, et al., Biochem. J. 1998; 36:299-303). В Європейському патенті № 1381356 B1 описане застосування Терифлуноміду для отримання лікарського засобу для лікування розсіяного склерозу, де вказаний лікарський засіб вводиться перорально. У Міжнародній Заявці WO 2007/118684 розкритий Лефлуномід, що містить тверді фармацевтичні композиції, що включають органічну або неорганічну кислоту, які характеризуються поліпшеною стійкістю. Вказані композиції виявляють менше руйнування Лефлуноміду в Терифлуномід, ніж таблетках Arava®, що є в продажу. Описані кількості Терифлуноміду, які знаходяться в діапазоні від 0,02 мг до 0,511 мг на таблетку, що містить 10 мг Лефлуноміду. Вказані кількості складають менше ніж 0,35% Терифлуноміду відносно загальної маси таблетки, яка становить 150 мг. Тверда фармацевтична препаративна форма Терифлуноміду була розроблена для застосування в клінічних дослідженнях. Одне зі спостережень, зроблених під час дослідження стійкості, полягало в значному збільшенні вмісту одного продукту розпаду Терифлуноміду, який являє собою 2-ціано-N-(4-трифторметилфеніл)ацетамід і має структуру, що ілюструється формулою II: Формула II При зберіганні в умовах кімнатної температури, рівні 2-ціано-N-(4трифторметилфеніл)ацетаміду до 0,2% досягаються в твердій фармацевтичній препаративній формі після 12 місяців зберігання [таблетки Терифлуноміду по 7 мг, блістери з алюмінію/поліхлорфінілу, зберігання при 25±2°С і відносній вологості {RH} 60%]. Інший продукт розпаду Терифлуноміду може являти собою 4-трифторметиланілін. Задачею даного винаходу є пошук твердої фармацевтичної препаративної форми Терифлуноміду, яка не має недоліків, пов'язаних з утворенням високих концентрацій 2-ціано-N(4-трифторметилфеніл)ацетаміду або 4-трифторметиланіліну (4-TFMA). Було виявлено, що деякі тверді фармацевтичні препаративні форми Терифлуноміду без колоїдного діоксиду кремнію не мають вказаних недоліків, тобто спричиняють обмежене збільшення концентрації 2-ціано-N-(4-трифторметилфеніл)ацетаміду і обмежене утворення 4 1 UA 107582 C2 5 10 15 20 25 30 35 40 45 50 55 60 TFMA. Крім того, була виявлена перевага додавання кислотної сполуки, що вступає в реакцію, до вказаної твердої фармацевтичної препаративної форми Терифлуноміду без колоїдного діоксиду кремнію. Крім того, була також виявлена перевага додавання кислотної сполуки, що вступає в реакцію, до твердої фармацевтичної препаративної форми Терифлуноміду, що містить колоїдний діоксид кремнію. Короткий виклад суті даного винаходу Даний винахід стосується твердої фармацевтичної композиції, що містить приблизно від 1% до 30% мас.:мас. Терифлуноміду або його фармацевтично прийнятної основно-адитивної солі, приблизно від 5% до 20% мас.:мас. розпушувача, приблизно від 0% до 40% мас.:мас. зв’язувального агента, приблизно від 0,1% до 2% мас.:мас. мастильної речовини і процентну частку, що залишається, яка містить розріджувачі за умови, що вказана тверда фармацевтична композиція не містить колоїдного діоксиду кремнію. Другий аспект винаходу стосується твердої фармацевтичної композиції, що містить приблизно від 1% до 30% мас.:мас. Терифлуноміду або його фармацевтично прийнятної основно-адитивної солі, приблизно від 5% до 20% мас.:мас. розпушувача, приблизно від 0% до 30% мас.:мас. зв’язувального агента, приблизно від 0,1% до 2% мас.:мас. мастильної речовини, приблизно від 1% до 20% мас.:мас. кислотної сполуки, що вступає в реакцію, і процентну частку, що залишається, яка містить розріджувачі. Третій аспект винаходу стосується твердої фармацевтичної композиції, що містить приблизно від 1% до 30% мас.:мас. Терифлуноміду або його фармацевтично прийнятної основно-адитивної солі, приблизно від 5% до 20% мас.:мас. розпушувача, приблизно від 0% до 30% мас.:мас. зв’язувального агента, приблизно від 0,1% до 2% мас.:мас. мастильної речовини, приблизно від 1% до 20% мас.:мас. кислотної сполуки, що вступає в реакцію, приблизно від 0,1% до 0,5% мас.:мас. колоїдного діоксиду кремнію і процентну частку, що залишається, яка містить розріджувачі. Докладний опис винаходу Тому препарат відповідно до винаходу надає тверду фармацевтичну композицію, що містить: a) приблизно від 1% до 30% мас.:мас. Терифлуноміду або його фармацевтично прийнятної основно-адитивної солі, b) приблизно від 5% до 20% мас.:мас. розпушувача, c) приблизно від 0% до 40% мас.:мас. зв’язувального агента, d) приблизно від 0,1% до 2% мас.:мас. мастильної речовини і e) процентну частку, що залишається, яка містить розріджувачі, за умови, що вказана тверда фармацевтична композиція не містить колоїдного діоксиду кремнію. Терміни, що використовуються в даний заявці, мають значення, визначені в даному описі. «Колоїдний діоксид кремнію» являє собою субмікроскопічну білу сажу, також відому як пірогенний діоксид кремнію. Це не кристалічний, дрібнозернистий, що має низьку щільність і високу площу поверхні діоксид кремнію. Первинний розмір частинок складає від 5 нм до 50 нм. 2 2 Частинки є не пористими і мають поверхню від 50 м /г до 600 м /м. Його можна отримати, наприклад, під торговою назвою Aeorsil 200 Pharma від компанії Evonik Industries [Evonik Degussa GmbH, Inorganic Materials, 9, 60287 Frankfurt, Germany] або під торговою назвою CABO-SIL M-5P/5DP від компанії Cabot Corporation з головним офісом в Бостоні, Массачусеттс, США. «Продукт розпаду» стосується будь-яких матеріалів, що містяться в лікарському засобі, що утворюється після руйнування в організмі отриманої стандартної лікарської форми. Аналіз домішок і продуктів розпаду проводиться з використанням методик ВЕРХ в оберненій фазі на екстрагованих зразках, як відомо в даній галузі. «Фармацевтично прийнятна основно-адитивна сіль» являє собою будь-яку органічну або неорганічну основно-адитивна сіль сполуки Терфлуноміду. Ілюстративні неорганічні основи, які утворюють прийнятні солі, включають гідроксид калію, гідроксид натрію, L-лізин або гідроксид кальцію. «Пацієнт» означає теплокровна тварину, таку як, наприклад, щури, миші, собаки, кішки, морські свинки і примати, такі як люди. «Лікувати» або «лікування» означає будь-яке лікування, включаючи без обмеження полегшення симптомів, усунення причини симптомів на тимчасовій або постійній основі або запобігання або сповільнення появи симптомів і прогресування названого розладу або стану. 2 UA 107582 C2 5 10 15 20 25 30 35 40 45 50 55 60 «Терапевтично ефективна кількість» означає кількість сполуки, яка ефективна при лікуванні названого розладу або стану. «Стереоізомери» являє собою загальний термін для всіх ізомерів окремих молекул, які відрізняються тільки орієнтацією їх атомів в просторі. Він включає ізомери дзеркального зображення (енантіомери), геометричні (цис/транс) ізомери і ізомери сполук з більше ніж одним хіральним центром, які не являють собою дзеркальні зображення один одного (діастереоізомери). «Терифлуномід» являє собою генеричну назву сполуки (4'-трифторметилфеніл)амід (Z)-2ціано-3-гідрокси-бут-2-еноєвої кислоти. Терифлуномід може використовуватися в формі, в якій він отриманий хімічно або може бути підданий процесу, який змінює фізичну природу частинок. Наприклад, матеріал може бути підданий розмелюванню будь-яким способом, відомим в даній галузі. Не вичерпні приклади таких способів включають механічний помел і струминний помел. Частинки, отримані або безпосередньо в результаті способу хімічного отримання Терифлуноміду, або після операції помелу, переважно забезпечують отримання частинок зі середніми величинами діаметра в діапазоні від 1 мкм до 100 мкм. Переважне використання вказаних частинок Терифлуноміду від 1 мкм до 100 мкм при отриманні твердої фармацевтичної композиції, зокрема, в кількості приблизно від 1% до 10% мас.: мас. Терифлуноміду. Синтез Терифлуноміду був описаний, і він здійснюється способами, які добре відомі фахівцям в даній галузі. Наприклад, в патенті США № 5990141, виданому 23 листопада 1999 р. описані способи його синтезу. У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 2% до 15% мас.:мас. Терифлуноміду і інші компоненти: розпушувач, зв’язувальний агент, мастильну речовину і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах b)-e). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 7% до 15% мас.:мас. розпушувача і інші компоненти: Терифлуномід, зв’язувальний агент, мастильна речовина і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах a) і с)-e). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 15% до 35% мас.:мас. зв’язувального агента і інші компоненти: Терифлуномід, розпушувач, мастильна речовина і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах a), b), d) і е). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 0,1% до 1,0% мас.:мас. мастильної речовини і інші компоненти: Терифлуномід, розпушувач, зв’язувальний агент і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах a)-c) і е). Прикладами розпушувачів є карбоксиметилцелюлоза, низькозаміщена гідроксипропілцелюлоза, мікрокристалічна целюлоза, порошкоподібна целюлоза, кроскармелоза натрію, метилцелюлоза, полакрилін калію, альгінат натрію, гліколят крохмаль натрію або суміш одного або більше зі вказаних розпушувачів. Прикладами зв’язувальних агентів є акація, карбоксиметилцелюлоза, гідроксіетилцелюлоза, гідроксипропілцелюлоза, декстрин, желатин, кізельгур, гідроксипропілметилцелюлоза, мальтодекстрин, метилцелюлоза, альгінат натрію, прежелатинізований крохмаль, крохмаль, такий як картопляний крохмаль, кукурудзяний крохмаль або злаковий крохмаль і зеїн або суміш одного або більше із вказаних зв’язувальних агентів. Прикладами мастильних речовин є стеарат кальцію, гліцерилпальмітостеарат, бензоат натрію, лаурилсульфат натрію, стеарилфумарат натрію, стеаринова кислота, тальк, стеарат цинку і стеарат магнію або суміш одного або більше зі вказаних мастильних речовин. Прикладами розріджувачів є целюлоза, ацетат целюлози, декстрати, декстрин, декстроза, фруктоза, 1-O--D-Глюкопіранозил-D-маніт, гліцерилпальмітостеарат, гідрована рослинна олія, каолін, лактит, лактоза, моногідрат лактози, мальтит, маніт, мальтодекстрин, мальтоза, прежелатинізований крохмаль, хлорид натрію, сорбіт, крохмаль, сахароза, тальк і ксиліт або суміші одного або більше зі вказаних розріджувачів. У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить від 2% до 15% мас.:мас. Терфлуноміду, від 7% до 15% мас.:мас. розпушувача, вибраного з одного або більше з мікрокристалічної целюлози або гліколят крохмалю натрію, від 15% до 35% мас.:мас. зв’язувального агента, вибраного з одного або більше з гідроксипропілцелюлози або кукурудзяного крохмалю, від 0,1% до 1,0 % мас.:мас. мастильної речовини, вибраної з стеарату магнію, і процентну частку, що залишилася, яка містить розріджувачі, вибрані з моногідрату лактози. 3 UA 107582 C2 5 10 15 20 25 30 35 40 45 50 55 60 У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить: A) приблизно від 1% до 30% мас.:мас. Терифлуноміду або його фармацевтично прийнятної основно-адитивної солі, B) приблизно від 5% до 20% мас.:мас. розпушувача, C) приблизно від 0% до 30% мас.:мас. зв’язувального агента, D) приблизно від 0,1% до 2% мас.:мас. мастильної речовини і E) приблизно від 1% до 20% мас.:мас. кислотної сполуки, що вступає в реакцію і F) процентну частку, що залишається, яка містить розріджувачі. У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 2% до 15% мас.:мас. Терифлуноміду і інші компоненти: розпушувач, зв’язувальний агент, мастильну речовину, кислотну сполуку, що вступає в реакцію, і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах В)-F). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 7% до 15% мас.:мас. розпушувача і інші компоненти: Терифлуномід, зв’язувальний агент, кислотну сполуку, що вступає в реакцію, і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А) і С)-F). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 15% до 30% мас.:мас. зв’язувального агента і інші компоненти: Терифлуномід, розпушувач, мастильну речовину, кислотну сполуку, що вступає в реакцію, і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А), В) і D)-F). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 0,1% до 1,0% мас.:мас. мастильної речовини і інші компоненти: Терифлуномід, розпушувач, зв’язувальний агент, кислотну сполуку, що вступає в реакцію, і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А)-C), Е) і F). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 3% до 20% мас.:мас. кислотної сполуки, що вступає в реакцію і інші компоненти: Терифлуномід, розпушувач, зв’язувальний агент, мастильну речовину і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А)-D) і F). Прикладами кислотних сполук, що вступають в реакцію, є лимонна кислота, оцтова кислота, гліколева кислота, молочна кислота, піровиноградна кислота, малонова кислота, бурштинова кислота, глутарова кислота, фумарова кислота, яблучна кислота, винна кислота, аскорбінова кислота, малеїнова кислота, гідроксималеїнова кислота, бензойна кислота, гідроксибензойна кислота, фенілоцтова кислота, цинамова кислота, саліцилова кислота, 2-феноксибензойна кислота, п-толуолсульфонова кислота і сульфонові кислоти, такі як метансульфонова кислота і 2-гідроксіетансульфонова кислота або суміш однієї або більше зі вказаних кислотних сполук, які вступають в реакцію. Терифлуномід змішується зі вказаними компонентами у вигляді розпушувачів, зв’язувальних агентів, мастильних речовин і розріджувачів для отримання концентрації Терифлуноміду і вказаних інших компонентів відповідно до даного винаходу в кінцевій суміші і, нарешті, змішується з кислотною сполукою, що вступає в реакцію. У ще одному варіанті здійснення винаходу, тверда фармацевтична композиція, що містить компоненти А)-F), як визначено вище, виявляє pH від 4,5 до 2,0, коли вода адсорбується в фармацевтичну композицію, або коли вода додається в невеликих кількостях до фармацевтичної композиції. У ще одному варіанті здійснення винаходу, тверда фармацевтична композиція, що містить компоненти А)-F), як визначено вище, виявляє pH від приблизно pH 3 до приблизно pH 2. Визначення pH виконується суспендуванням однієї таблетки приблизно в 1 мл очищеної води. pH супернатанту визначається датчиком, чутливим до pH. У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить: A) приблизно від 1% до 30% мас.:мас. Терифлуноміду або його фармацевтично прийнятної основно-адитивної солі, B) приблизно від 5% до 20% мас.:мас. розпушувача, C) приблизно від 0% до 30% мас.:мас. зв’язувального агента, D) приблизно від 0,1% до 2% мас.:мас. мастильної речовини, E) приблизно від 1% до 20% мас.:мас. кислотної сполуки, що вступає в реакцію, F) приблизно від 0,1% до 0,5% мас.:мас. колоїдного діоксиду кремнію і 4 UA 107582 C2 5 10 15 20 25 30 35 40 45 50 55 60 G) процентну частку, що залишається, яка містить розріджувачі. У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 2% до 15% мас.:мас. Терифлуноміду і інші компоненти: розпушувач, зв’язувальний агент, мастильну речовину, кислотну сполуку, що вступає в реакцію, колоїдний діоксид кремнію і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах В)-G). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 7% до 15% мас.:мас. розпушувача і інші компоненти: Терифлуномід, зв’язувальний агент, мастильну речовину, кислотну сполуку, що вступає в реакцію, колоїдний діоксид кремнію і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А) і С)-G). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 15% до 30% мас.:мас. зв’язувального агента і інші компоненти: Терифлуномід, розпушувач, мастильну речовину, кислотну сполуку, що вступає в реакцію, колоїдний діоксид кремнію і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А), В) і D)-G). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 0,1% до 1,0% мас.:мас. мастильної речовини і інші компоненти: Терифлуномід, розпушувач, зв’язувальний агент, кислотна сполука, що вступає в реакцію, колоїдний діоксид кремнію і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А)-C), Е) і G). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 3% до 20% мас.:мас. кислотної сполуки, що вступає в реакцію, і інші компоненти: Терифлуномід, розпушувач, зв’язувальний агент, мастильну речовину, колоїдний діоксид кремнію і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А)-D), і F), і G). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно від 0,2% до 0,4% мас.:мас. колоїдного діоксиду кремнію і інші компоненти: Терифлуномід, розпушувач, зв’язувальний агент, мастильну речовину, кислотну сполуку, що вступає в реакцію, і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А)-E) і G). У ще одному варіанті здійснення, винахід стосується твердої фармацевтичної композиції, що містить приблизно 0,3% колоїдного діоксиду кремнію і інші компоненти: Терифлуномід, розпушувач, зв’язувальний агент, мастильну речовину, кислотну сполуку, що вступає в реакцію, і розріджувачі, які присутні в композиції в такій же кількості, як визначено вище в підпунктах А)E) і G). Терифлуномід змішується зі вказаними компонентами у вигляді розпушувача, зв’язувального агента, мастильної речовини, колоїдного діоксиду кремнію і розріджувачів для отримання концентрації Терифлуноміду і вказаних інших компонентів відповідно до даного винаходу в кінцевій суміші і, нарешті, змішується з кислотним компонентом, що вступає в реакцію. У ще одному варіанті здійснення винаходу, тверда фармацевтична композиція, що містить компоненти А)-G), як визначено вище, виявляє pH від 4,5 до 2,0, коли вода адсорбується в фармацевтичну композицію, або коли вода додається в невеликих кількостях до фармацевтичної композиції. У ще одному варіанті здійснення винаходу, тверда фармацевтична композиція, що містить компоненти А)-G), як визначено вище, виявляє pH від приблизно pH 3 до приблизно pH 2. При отриманні препаративних форм Терифлуноміду, прийнятних для утворення стандартної лікарської форми, Терифлуномід і інші компоненти твердої фармацевтичної композиції відповідно до винаходу можуть змішуватися у вигляді порошків. Дане змішування може проводитися з використанням будь-якої з методик змішування, відомих в даній галузі. Змішування переважно проводиться з використанням мішалки з високим зсувом, V-подібного змішувача (або іншого двокорпусного змішувача), бункерного змішувача або турбулентного змішувача-вібратора. Змішування звичайно проводиться спочатку без додавання мастильної речовини протягом часу, достатнього для забезпечення повного змішування. У цей момент, звичайно додається мастильна речовина з подальшим короткочасним (приблизно 1-10 хвилин) періодом додаткового змішування. Після отримання суміші, стандартні лікарські форми отримують процедурами, відомими в даній галузі. Переважно, стандартні лікарські форми отримують на роторних таблеткових пресах або станках для заповнення капсул. Потім можливе покривання отриманих таким чином лікарських форм плівкою, призначеною для забезпечення легкого проковтування, патентованого або сприяючого ідентифікації зовнішнього вигляду і/або 5 UA 107582 C2 5 10 15 20 25 30 35 40 45 50 55 60 захисту лікарської форми. Альтернативно, переважні способи отримання вологим гранулюванням Терифлуноміду і інших компонентів твердої фармацевтичної композиції включають наступні стадії: (a) змішування Терифлуноміду з розріджувачем і, можливо, з деякими або усіма з ексципієнтів, що залишаються, необхідних в кінцевій композиції. Дані інші ексципієнти можуть включати зв’язувальні агенти, розпушувач, мастильну речовину, кислотну сполуку, що вступає в реакцію, і колоїдний діоксид кремнію; (b) додавання грануляційного розчинника при впливі зсувом на матеріал зі стадії (a). Переважні грануляційні розчинники включають воду, етанол, ізопропанол і їх комбінації. У даній галузі відомо, що в грануляційний розчинник можуть додаватися інші інгредієнти. Прикладами таких добавок є зв’язувальні агенти, кислотні сполуки, які вступають в реакцію, змочувальні агенти, стабілізатори і буфери. Розчинник може вноситися будь-якою технологією, відомою в даній галузі. Переважні способи внесення розчинника при впливі зсувом включають грануляцію з великим зусиллям зсуву, грануляцію з низьким зусиллям зсуву і грануляцію екструзією; (с) можливий помел, подрібнення або просіювання через сито матеріалу зі стадії (b). Потім цей вологий матеріал сушиться, переважно, з використанням повітряного сушіння, сушіння у псевдозрідженому шарі, сушіння в печі або сушіння в мікрохвильовій печі. Сушіння переважно проводиться так, щоб температура сушіння не перевищувала приблизно 60°С; (d) потім можливий помел або просіювання даного матеріалу; (е) потім матеріал змішується з додатковими ексципієнтами; і (f) можливе формування композиції в стандартну лікарську форму, переважно, таблетку або капсулу. Потім можливе покривання отриманим таким чином лікарських форм плівкою, призначеною для забезпечення легкості проковтування, патентованого або сприяючого ідентифікації зовнішнього вигляду і/або захисту лікарської форми. Потім готова лікарська форма упаковується з використанням процедур, відомих в даній галузі. Для даного винаходу, упаковка переважно представлена в формі блістерів з двох шарів фольги, отриманих холодним формуванням, пластиковими блістерів або герметично запаяних флакончиків з осушувачем або без нього. Для блістерів переважні пакувальні матеріали з 2 проникністю для водяної пари нижчою ніж 0,25 г/м /день. Тверда фармацевтична композиція відповідно до винаходу може вводитися в будь-якій формі або режимі, який робить сполуку біологічно доступною в терапевтично ефективних кількостях, включаючи пероральне, сублінгвальне, букальне, внутрішньодермальне, інтраназальне, ректальне, місцеве і тому подібні форми введення. Фахівець в галузі отримання препаративних форм може визначити потрібну форму і шлях введення, залежно від конкретного характерного захворювання, що підлягає лікуванню, стадії захворювання, стану пацієнта і інших релевантних обставин. Наприклад, див. посібник Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990). Тверда фармацевтична форма відповідно до винаходу може вводитися перорально, наприклад, в формі таблеток, пастилок, капсул, облаток, жувальних гумок і тому подібних. Інші лікарські форми можуть містити інші різні матеріали, які модифікують фізичну форму стандартної лікарської форми, наприклад, у вигляді покриттів. Таким чином, таблетки або пілюлі можуть бути покриті нефункціональними покриттями, подібними покриттям на основі гіпромелози, цукри, шелаку або інших ентеросолюбільних агентів. Діапазон дозування, в якій Терифлуномід виявляє свою здатність надавати терапевтичну дію, може варіюватися, залежно від тяжкості захворювання пацієнта, інших патологічних станів, що лежать в основі, на які страждає пацієнт, і інших медикаментозних засобів, які можуть одночасно вводитися пацієнту. Загалом, Терифлуномід виявить свою терапевтичну активність в дозуванні від приблизно 0,001 мг/кг маси тіла пацієнта до 100 мг/кг маси тіла пацієнта/день. Тверда фармацевтична композиція відповідно до винаходу підходить, наприклад, для лікування гострих імунологічний явищ, таких як сепсис, алергія, реакція трансплантат проти хазяїна і реакція хазяїн проти трансплантата, аутоімунних захворювань, таких як ревматоїдний артрит, системний червоний вовчак або розсіяний склероз, псоріазу, астми, висипу, риніту і увеїту, злоякісних захворювань, таких як рак легенів, лейкоз, рак яєчників, саркома, саркома Капоші, менінгіома, рак кишечника, рак лімфовузлів, пухлини мозку, рак молочних залоз, рак підшлункової залоза, рак передміхурових залози або рак шкіри. Наступні не обмежуючі приклади ілюструють заявником способи, яким віддається перевага отримання і застосування фармацевтичних композицій за даним винаходом. ПРИКЛАДИ Приклад 1 Спосіб отримання 6 UA 107582 C2 5 Грануляційна рідина: Гідроксипропілцелюлоза 7,5 мПа·с (HPC) і моногідрат лимонної кислоти розчиняють в 219,3 г очищеної води і перемішують протягом щонайменше 30 хв. Концентрація HPC в кінцевому розчині становить 6,4% відносно маси води, незалежно від кількості доданої лимонної кислоти (таблиця). Таблиця Композиції грануляційної рідини Маса лимонної Маса лимонної кислоти/таблетки кислоти (г) 0 мг лимонної кислоти 0 2,5 мг лимонної 10 кислоти 5 мг лимонної кислоти 20 20 мг лимонної кислоти 80 25 мг лимонної кислоти 100 10 15 20 25 Маса гідроксипропілцелюлози (г) 14 Маса води (г) 219,3 Загальна маса (г) 233,3 14 219,3 243,3 14 14 14 219,3 219,3 219,3 253,3 313,3 333,3 Таблетки: 1. Терифлуномід, лактозу або маніт (0C і 0D), кукурудзяний крохмаль і, при необхідності, моногірат лимонної кислоти (1D і 1J) перемішують протягом 5 хв в грануляторі в псевдозрідженому шарі (UNI-Glatt, заслінка 25%, температура повітря на впусканні ~23°С, інтервал струшування 30 сек, струшування 5 сек). 2. Отриману суміш гранулюють розчином HPC і, при необхідності, лимонною кислотою в грануляторі в псевдозрідженому шарі (UNI Glatt, заслінка 25-30%, температура повітря на впусканні 60°С, інтервал струшування 60 сек, струшування протягом 5 сек, швидкість розпилення ~12,5 г/хв, тиск розпилювального повітря 1 бар, діаметр сопла 0,8 мм). Тривалість приблизно 25 хв. 3. Гранули сушать в грануляторі з псевдозрідженим шаром протягом приблизно 20 хв (UNI Glatt, заслінка 25-30%, температура повітря на впусканні 60°С, інтервал струшування 60 сек, тривалість струшування 5 сек). 4. Гранули калібрують просіюванням через сито з розміром отворів 1 мм і мастять мікрокристалічною целюлозою, гліколят крохмалем натрію і, при необхідності, колоїдному діоксидом кремнію (Приклад 1F-1J) в турбулентному змішувачі [скляний контейнер місткістю 2 л] протягом 5 хв. 5. Після додавання стеарату магнію суміш перемішують ще протягом хвилини в турбулентному змішувачі [скляний контейнер місткістю 2 л]. Кінцеву суміш пресують в таблетки на одноштамповому пресі Korsch EKO. Композиція отриманих твердих фармацевтичних композицій представлена в таблицях 1, 2 і 3. 30 Таблиця 1 Композиція таблеток Терифлуноміду з колоїдним діоксидом кремнію і без нього (0A-0D) Приклад Терифлуномід (мг) 0A 7,000 0B 7,000 0C 7,000 0D 7,000 Моногідрат лактози (мг) Маніт (мг) Кукурудзяний крохмаль (мг) Гідроксипропіл-целюлоза (мг) 81,000 XX 40,000 3,500 81,000 XX 40.000 3,500 XX 101,0 20,00 3,500 XX 101,0 20,00 3,500 Маса гранул (мг) 131,500 131,500 131,500 131,500 Мікрокристалічна целюлоза (мг) Гліколят крохмаль натрію (мг) 10,500 7,500 10,000 7,500 10,000 7,500 10,500 7,500 7 UA 107582 C2 Таблиця 1 Композиція таблеток Терифлуноміду з колоїдним діоксидом кремнію і без нього (0A-0D) Приклад Колоїдний діоксид кремнію (мг) Стеарат магнію (мг) Розміри таблеток 0B 0,500 0,500 0C 0,500 0,500 0D XX 0,500 150,000 Загальна маса (мг) 0A XX 0,500 150,000 150,000 150,000 Круглі двоопуклі таблетки діаметром 7 мм В приведеній вище таблиці «хх» означає без додавання компонента Таблиця 2 Композиція таблеток Терифлуноміду, підкислена лимонною кислотою, і без колоїдного діоксиду кремнію Приклад Терифлуномід (мг) 1A 7,000 1B 7,000 1C 7,000 1D 7,000 Моногідрат лактози (мг) Кукурудзяний крохмаль (мг) Лимонна кислота (тверда) (мг) 78,500 40,000 XX 78,000 38,000 XX 65,000 31,000 XX 65,000 31,000 5,000 Лимонна кислота (розчинена) (мг) Гідроксипропіл-целюлоза (мг) 2,500 3,500 5,000 3,500 25,000 3,500 20,000 3,500 Маса гранул (мг) 131,500 131,500 131,500 131,500 Мікрокристалічна целюлоза (мг) Гліколят крохмаль натрію (мг) Колоїдний діоксид кремнію (мг) Стеарат магнію (мг) 10,500 7,500 XX 0,500 10,500 7,500 XX 0,500 10,500 7,500 XX 0,500 10,500 7,500 XX 0,500 Загальна маса (мг) 150,000 150,000 150,000 150,000 pH таблетки Розміри таблеток 3,3 2,9 2,2 2,2 Круглі двоопуклі таблетки діаметром 7 мм В приведеній вище таблиці «хх» означає без додавання компонента Таблиця 3 Композиція таблеток Терифлуноміду, підкислена лимонною кислотою і з колоїдним діоксидом кремнію Приклад Терифлуномід (мг) 1G 7,000 1H 7,000 1I 7,000 1J 7,000 Моногідрат лактози (мг) Кукурудзяний крохмаль (мг) Лимонна кислота (тверда) (мг) 78,500 40,000 XX 78,000 38,000 XX 65,000 31,000 XX 65,000 31,000 5,000 Лимонна кислота (розчинена) (мг) Гідроксипропіл-целюлоза (мг) 2,500 3,500 5,000 3,500 25,000 3,500 20,000 3,500 8 UA 107582 C2 Таблиця 3 Композиція таблеток Терифлуноміду, підкислена лимонною кислотою і з колоїдним діоксидом кремнію Приклад 1G 1H 1I 1J Маса гранул (мг) 131,500 131,500 131,500 131,500 Мікрокристалічна целюлоза (мг) Гліколят крохмаль натрію (мг) Колоїдний діоксид кремнію (мг) Стеарат магнію (мг) 10,000 7,500 0,500 0,500 10,000 7,500 0,500 0,500 10,000 7,500 0,500 0,500 10,000 7,500 0,500 0,500 Загальна маса (мг) 150,000 150,000 150,000 150,000 3,5 2,9 2,1 2,1 pH таблетки Розміри таблеток Круглі двоопуклі таблетки діаметром 7 мм В приведеній вище таблице «хх» означає без додавання компонента 5 10 15 Приклад 2 Утворення 2-ціано-N-(4-трифторметилфеніл)ацетаміду Отримання таблеток Таблетки отримують відповідно до способу отримання, представленого в прикладі 1. Композиція таблеток представлена в таблетках 1, 2 і 3. Зберігання таблеток Зразки зберігають протягом періоду до 6 місяців при 25°С/60%RH, 30°С/65%RH, 40°С/75%RH в індукційних, герметично закупорених флаконах з HDPE (поліетилену високої густини) [флакон з широкою шийкою ємністю 45 мл, білий, круглий з індукційним ущільненням і загвинчуваним ковпачком із захистом від доступу дітей] і при 40°С/75%RH у відкритих скляних флаконах. Флакони зберігають у вертикальному положенні. Аналіз зразків Проводять аналіз таблеток на вміст з використанням ВЕРХ. Вміст 2-ціано-N-(4-трифторметилфеніл)ацетаміду в таблетках, підкислених лимонною кислотою, з колоїдним діоксидом кремнію і без нього, представлений в таблиці 4. Таблиця 4 Утворення 2-ціано-N-(4-трифторметилфеніл)ацетаміду в таблетках з колоїдним діоксидом кремнію і без нього (0A і 0B) і в підкислених таблетках без колоїдного діоксиду кремнію (1A-1D) Приклад Місяць 0 1 1 Умови зберігання 1A 0B Контроль 2-ціано-N-(4-трифторметилфеніл)ацетамід (%) 1B 1C 1D 0A Вихідне Середня величина RSD 0,0130 10,1030 0,0105 14,718 0,0123 3,5217 0,0111 17,0451 0,0143 3,5157 0,0302 3,8501 40C/75%RH Середня величина RSD 0,0383 0,7039 0,0449 1,6998 0,0699 33,095 0,0481 0,6950 0,0353 2,7145 0,0919 1,7791 40C/75%RH відкритий флакон Середня величина RSD 0,1360 0,9016 0,1490 1,4720 0,0664 1,7785 0,0683 2,5879 0,0863 2,3490 0,1283 2,0459 9 UA 107582 C2 Таблиця 4 Утворення 2-ціано-N-(4-трифторметилфеніл)ацетаміду в таблетках з колоїдним діоксидом кремнію і без нього (0A і 0B) і в підкислених таблетках без колоїдного діоксиду кремнію (1A-1D) Приклад Умови зберігання Місяць 3 3 3 3 6 6 6 6 1A 0B Контроль 2-ціано-N-(4-трифторметилфеніл)ацетамід (%) 1B 1C 1D 0A 25C/60%RH Середня величина RSD 0,0274 14,7830 0,0196 5,3867 0,0267 4,8454 0,0194 5,4754 0,0242 2,4537 0,0431 2,4995 30C/65%RH Середня величина RSD 0,0378 8,8841 0,0323 7,1005 0,0438 3,4361 0,0347 4,9873 0,0351 7,4946 0,0656 2,8880 40C/75%RH Середня величина RSD 0,1390 1,7326 0,1535 2,5300 0,1091 1,6702 0,1029 0,6768 0,0807 5,4502 0,1821 1,0879 40°C/75%RH, відкритий флакон Середня величина RSD 0,3006 0,5967 0,3306 0,6505 0,1509 1,2309 0,1534 0,6459 0,2107 1,9609 0,2461 2,3632 0,0645 4,3042 0,0341 11,6345 0,0500 4,5263 0,0369 3,1312 0,0411 3,6245 0,0824 2,8094 0,0414 7,4586 0,0689 4,2140 0,0645 2,5329 0,0694 4,2497 0,0562 8,4947 0,1396 1,2221 40C/75%RH Середня величина RSD 0,2920 2,2691 0,3592 1,7286 0,1846 1,5597 0,1829 1,9427 0,1542 2,0578 0,4149 1,3660 40C/75%RH відкритий флакон Середня величина RSD 0,6769 0,3538 0,7200 0,5624 0,2635 0,8745 0,2799 0,9602 0,4447 1,2102 0,6194 0,8003 25C/60%RH Середня величина RSD 30C/65%RH Середня величина RSD «RSD» означає відносне стандартне відхилення ((стандартне відхилення ряду X) 100/(середню величину ряду X) = відносне стандартне відхилення). «RH» означає відносну вологість; відносна вологість повітряно-водяної суміші визначається як відношення парціального тиску водяної пари в суміші до тиску насиченої пари води при заданій температурі. 5 У кожній партії 4 зразка визначаються на початку (0 місяців) через 1, 3 і 6 місяців. Показані тільки середні величини і RSD тестованих зразків. Вміст 2-ціано-N-(4-трифторметилфеніл)ацетаміду в таблетках, підкислених лимонною кислотою, що містять колоїдний діоксид кремнію, представлений в таблиці 5. 10 UA 107582 C2 Таблиця 5 Утворення 2-ціано-N-(4-трифторметилфеніл)ацетаміду в таблетках, підкислених лимонною кислотою, що містять колоїдний діоксид кремнію Приклад Умови зберігання 1G 1H 11 1J 2-ціано-N-(4-трифторметилфеніл)ацетамід (%) Місяць 0 1 1 3 3 3 3 6 6 6 6 5 Вихідне Середня величина RSD 0,0273 1,5419 0,0215 10,1026 0,0116 7,7747 0,0120 2,1246 40°C/75%RH Середня величина RSD 0,0741 1,3713 0,0704 5,4415 0,0322 5,6604 0,0416 1,2491 0,1561 1,1244 0,1683 1,3425 0,0616 0,9626 0,0692 4,3785 0,0356 5,9774 0,0303 9,5942 0,0140 5,4163 0,0171 7,1324 30°C/65%RH Середня величина RSD 0,0496 5,4842 0,0461 12,4861 0,0232 6,2709 0,0261 6,3572 40°C/75%RH Середня величина RSD 0,1558 2,8099 0,1664 2,1597 0,0715 1,6357 0,0867 3,4267 40°C/75%RH, відкритий флакон Середня величина RSD 0,3061 0,9992 0,3181 1,2165 0,1198 3,0218 0,1346 2,1899 25°C/60%RH Середня величина RSD 0,0703 2,1623 0,0650 1,1513 0,0274 3,6860 0,0362 6,7916 30°C/65%RH Середня величина RSD 0,1099 2,0462 0,1144 2,1572 0,0511 3,0849 0,0513 5,2812 40°C/75%RH Середня величина RSD 0,3751 1,0971 0,4286 1,0910 0,1627 1,1734 0,1768 0,4281 40°C/75%RH відкритий флакон Середня величина RSD 0,7496 0,1725 0,7840 0,6620 0,2765 1,0646 0,2941 0,4167 40°C/75%RH відкритий флакон Середня величина RSD 25°C/60%RH Середня величина RSD У кожній партії 4 зразка визначаються на початку (0 місяців) через 1, 3 і 6 місяців. Показані тільки середні величини і RSD тестованих зразків. Після 3-6 місяців зберігання в ідентифікованих вище умовах зберігання у флаконах з HDPE таблетки Терифлуноміду, що містять 25 мг лимонної кислоти, змащені, з колоїдним діоксидом кремнію і без нього [Приклади 1C, D, I, J] і таблетки Терифлуноміду, що не містять лимонної 11 UA 107582 C2 5 10 15 20 25 30 35 кислоти, але змащені, без колоїдного діоксиду кремнію (Example OA) виявляють значно знижене утворення 2-ціано-N-(4-трифторметилфеніл)ацетаміду, в порівнянні з таблетками Терифлуноміду, що містять колоїдний діоксид кремнію (Приклад 0B). У індукційно герметизованих флаконах з HDPE, стабілізуючий ефект лимонної кислоти більш виражений в присутності колоїдного діоксиду кремнію. Визначення вмісту Терифлуноміду, 2-ціано-N-(4-трифторметилфеніл)ацетаміду і 4-TFMA (4трифторметилфенілацетаміду) виконують за допомогою градієнтної системи для високоефективної рідинної хроматографії (ВЕРХ) таким чином: Стаціонарна фаза: Purospher STAR RP18e (3 мкм) Матеріал колонки: неіржавіюча сталь Довжина колонки: 125 мм Внутрішній діаметр колонки: 4,0 мм Урівноваження колонки: Колонка повинна промиватися рухомою фазою В протягом щонайменше 15 хв при швидкості потоку 1,0 мл/хв Рухома фаза Буфер отримують перенесенням 50 ммоль (4,2 г) ацетату натрію, 50 ммоль (2,9 г) хлориду натрію в скляний флакон для рухомих фаз і додаванням 1000 мл води. pH доводять до 6,5 крижаною оцтовою кислотою з використанням рН-метра. Рухома фаза А Рухома фаза В Буфер pH 6,5 900 мл Буфер pH 6,5 100 мл Ацетонітрил 100 мл Ацетонітрил 900 мл Час (хвилини) 0 Від 0 до 20 Від 20 до 25 Від 25 до 26 Від 26 до 30 Процедура Швидкість потоку: Очікуване падіння тиску: Об'єм інжекції: Температура автосамплера: Градієнт: Рухома фаза А (%) 100 52 0 100 100 Рухома фаза В (%) 0 48 100 0 0 1,0 мл/хвилину 220 бар 10 мкл Встановити температуру автосамплера на +15°С Встановити температуру колонки на +20°С 249 нм (УФ) 25 хвилин 30 хвилин Температура колонки: Виявлення: Типовий час представлення даних: Типовий час всього циклу: Величини часу утримування: Терифлуномід приблизно 15,0 хвилин 2-ціано-N-(4приблизно 19,3 хвилини трифторметилфеніл)ацетамід 4-TFMA приблизно 19,8 хвилини Приклад 3. Визначення pH таблеток Визначення pH виконується суспендуванням однієї таблетки приблизно в 1 мл очищеної води. Після руйнування таблетки і осадження твердого вмісту, pH супернатанту визначається датчиком, чутливим до pH. Середній результат по двох окремих таблетках представляється у вигляді pH таблетки (див. таблиці 2 і 3). Приклад 4 Утворення 2-ціано-N-(4-трифторметилфеніл)ацетаміду і 4-TFMA в таблетках Терифлуноміду з колоїдним діоксидом кремнію і без нього Отримання таблеток Таблетки отримують відповідно до способу отримання, представленого в таблиці 1. Композиція таблеток представлена в таблиці 1. Зберігання таблеток У додатковому дослідженні стійкості зразки зберігають протягом 6 місяців при 40°С/75%RH в індукційно ущільнених флаконах з HDPE [флаконах з широкою шийкою місткістю 60 мл, білих, круглих з індукційним ущільненням із загвинчуваним ковпачком із захистом від доступу дітей]. Флакони зберігають у вертикальному положенні. 12 UA 107582 C2 5 Аналіз зразків Проводять аналіз таблеток на зв'язані домішки із застосуванням ВЕРХ (використовуючи спосіб, описаний вище). Вміст 2-ціано-N-(4-трифторметилфеніл)ацетаміду і 4-TFMA після 6 місяців зберігання при 40°С/75%RH в таблетках з колоїдним діоксидом кремнію і без нього представлено в таблиці 6. Таблиця 6 Утворення 2-ціано-N-(4-трифторметилфеніл)ацетаміду і 4-TFMA в таблетках з колоїдним діоксидом кремнію і без нього (0A і 0B) Приклад Умови зберігання 0A 0B 0C 0D 2-ціано-N-(4-трифторметилфеніл)ацетамід [%] Місяць 0 6 Місяць 0 6 10 15 Вихідний Середня величина RSD 0,004 0,191 0,013 0,026 0,008 0,010 0,002 0,320 40°С/75%RH Середня величина RSD 0,213 0,006 0,543 0,001 0,600 0,001 0,241 0,001 4-TFMA [м. ч.] Вихідний Середня величина RSD 0,00 0,00 0,00 0,00 40°С/75%RH Середня величина RSD 28 0,049 57 0,035 48 0,244 22 0,050 Після 6 місяців зберігання в ідентифікованих вище умовах у флаконах з HDPE змащені таблетки Терифлуноміду без колоїдного діоксиду кремнію (Приклад 0A і 0D) виявляють значно знижене утворення 2-ціано-N-(4-трифторметилфеніл)ацетаміду, в порівнянні з таблетками Терифлуноміду, що містять колоїдний діоксид кремнію (Приклад 0B і 0С). Крім того, утворення 4-TFMA сильно знижується в таблетках, що не містять колоїдного діоксиду кремнію (Приклад 0A і 0D), в порівнянні зі змащеними таблетками з колоїдним діоксидом кремнію (Приклад 0B і 0C). Визначення вмісту Терифлуноміду, 2-ціано-N-(4-трифторметилфеніл)ацетаміду і 4-TFMA виконуються за допомогою градієнтної системи для високоефективної рідинної хроматографії (ВЕРХ), як описано в Прикладі 2. ФОРМУЛА ВИНАХОДУ 20 25 30 1. Тверда фармацевтична композиція, що містить: a) від 1 % до 30 % мас./мас. терифлуноміду або його фармацевтично прийнятної основноадитивної солі, b) від 5 % до 20 % мас./мас. розпушувача, c) від 0 % до 40 % мас./мас. зв'язувального агента, d) від 0,1 % до 2 % мас./мас. мастильної речовини і e) процентну частку, що залишається, яка містить розріджувачі, за умови, що тверда фармацевтична композиція не містить колоїдний діоксид кремнію. 2. Тверда фармацевтична композиція за п. 1, де зазначений розпушувач вибраний з групи, що складається з карбоксиметилцелюлози, низькозаміщеної гідроксипропілцелюлози, мікрокристалічної целюлози, порошкоподібної целюлози, кроскармелози натрію, метилцелюлози, полакриліну калію, альгінату натрію, гліколяту крохмалю натрію або суміші одного або більше зі вказаних розпушувачів. 3. Тверда фармацевтична композиція за п. 2, де розпушувач вибраний з групи, що складається з низькозаміщеної гідроксипропілцелюлози, мікрокристалічної целюлози, порошкоподібної 13 UA 107582 C2 5 10 15 20 25 целюлози, кроскармелози натрію, гліколяту крохмалю натрію або суміші одного або більше зі вказаних розпушувачів. 4. Тверда фармацевтична композиція за п. 1, де вказаний зв'язувальний агент вибраний з групи, що складається з акації, карбоксиметилцелюлози, гідроксіетилцелюлози, гідроксипропілцелюлози, декстрину, желатину, кизельгуру, гідроксипропілметилцелюлози, мальтодекстрину, метилцелюлози, альгінату натрію, прежелатинізованого крохмалю, картопляного крохмалю, кукурудзяного крохмалю або злакового крохмалю і зеїну або суміші одного або більше зі вказаних зв'язувальних агентів. 5. Тверда фармацевтична композиція за п. 4, де вказаний зв'язувальний агент вибраний з групи, що складається з гідроксипропілцелюлози, гідроксипропілметилцелюлози, прежелатинізованого крохмалю, крохмалів, таких як: картопляний крохмаль, кукурудзяний крохмаль або злаковий крохмаль, і суміші одного або більше зі вказаних зв'язувальних агентів. 6. Тверда фармацевтична композиція за п. 1, де вказану мастильну речовину вибирають з групи, що складається зі стеарату кальцію, гліцерилпальмітостеарату, бензоату натрію, лаурилсульфату натрію, стеарилфумарату натрію, стеаринової кислоти, тальку, стеарату цинку і стеарату магнію або суміші однієї або більше зі вказаних мастильних речовин. 7. Тверда фармацевтична композиція за п. 6, де вказану мастильну речовину вибирають з групи, що складається з стеарилфумарату натрію і стеарату магнію або суміші однієї або більше зі вказаних мастильних речовин. 8. Тверда фармацевтична композиція за п. 1, де вказаний розріджувач вибирають з групи, що складається з целюлози, ацетату целюлози, декстратів, декстрину, декстрози, фруктози, 1-О-αО-глюкопіранозил-D-маніту, гліцерилпальмітостеарату, гідрованої рослинної олії, каоліну, лактиту, лактози, моногідрату лактози, мальтиту, маніту, мальтодекстрину, мальтози, прежелатинізованого крохмалю, хлориду натрію, сорбіту, крохмалів, сахарози, тальку і ксиліту або суміші одного або більше зі вказаних розріджувачів. 9. Тверда фармацевтична композиція за п. 8, де вказаний розріджувач вибирають з групи, що складається з лактози, моногідрату лактози, маніту і крохмалів або суміші одного або більше зі вказаних розріджувачів. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Автори англійськоюHauck, Gerrit
Автори російськоюХаук Геррит
МПК / Мітки
МПК: A61K 31/196, A61K 47/08, A61K 9/20
Мітки: препарат, стійкістю, кислоти, z)-2-ціано-гідроксибут-2-еноєвої, 4'-трифторметилфеніл)аміду, поліпшеною, таблетований
Код посилання
<a href="https://ua.patents.su/16-107582-tabletovanijj-preparat-4-triftormetilfenilamidu-z-2-ciano-gidroksibut-2-enoehvo-kisloti-z-polipshenoyu-stijjkistyu.html" target="_blank" rel="follow" title="База патентів України">Таблетований препарат (4′-трифторметилфеніл)аміду (z)-2-ціано-гідроксибут-2-еноєвої кислоти з поліпшеною стійкістю</a>
Попередній патент: Способи зниження віруліцидної активності композицій, що містять pcv-2, і композиції, що містять рсv-2 з підвищеною імуногенністю
Наступний патент: Спіроциклічні нітрили як інгібітори протеази
Випадковий патент: Привід живильника машини для розсівання мінеральних добрив