Фармацевтична композиція, що містить 4-{4-[3-(4-хлор-3-трифторметилфеніл)-уреїдо]-3-фторфенокси}-піридин-2-карбонової кислоти метиламід (варіанти), спосіб одержання твердої дисперсії зазначеної сполуки та спос
Формула / Реферат
1. Фармацевтична композиція, що містить як активнодіючу сполуку 4{4-[3-(4-хлор-3-трифторметилфеніл)-уреїдо]-3-фторфенокси}-піридин-2-карбонової кислоти метиламід та/або його солі, гідрати, сольвати у формі твердої дисперсії.
2. Фармацевтична композиція, яка містить тверду дисперсію сполуки формули І
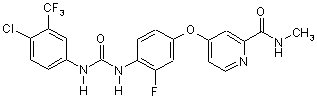 (І)
(І)
та фармацевтично прийнятної матриці.
3. Фармацевтична композиція за п. 2, у якій матриця містить полімерні наповнювачі або неполімерні наповнювачі, здатні розчиняти або диспергувати сполуку Формули І.
4. Фармацевтична композиція за п. 2, у якій матриця містить комбінацію полімерних наповнювачів та неполімерних наповнювачів, здатних розчиняти або диспергувати сполуку Формули І.
5. Фармацевтична композиція за п. 2, у якій матриця містить водорозчинний полімер.
6. Фармацевтична композиція за п. 5, у якій матриця містить принаймні один полімер з групи, що включає полівінілпіролідон, коповідон, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, поліетиленгліколь або поліетиленоксид.
7. Фармацевтична композиція за п. 6, яка містить полівінілпіролідон як матричний агент.
8. Фармацевтична композиція за п. 7, у якій масове співвідношення сполуки Формули І, розраховане як вільна від розчинника основа до полівінілпіролідону, становить від 1:0,5 до 1:20.
9. Фармацевтична композиція за п. 6, яка містить гідроксипропілцелюлозу як матричний агент.
10. Фармацевтична композиція за п. 9, у якій масове співвідношення сполуки Формули І, розраховане як вільна від розчинника основа до гідроксипропілцелюлози, становить від 1:0,5 до 1:20.
11. Фармацевтична композиція за будь-яким з пп. 1-10, у якій тверда дисперсія містить кроскармелозу натрію, натрію гліколят крохмалю, кросповідон, низькозаміщену гідроксипропілцелюлозу, крохмаль, мікрокристалічну целюлозу або їх комбінацію.
12. Фармацевтична композиція за п. 8, у якій тверда дисперсія містить полівінілпіролідон та кроскармелозу натрію.
13. Фармацевтична композиція за п. 8, у якій тверда дисперсія містить полівінілпіролідон та натрію гліколят крохмалю.
14. Фармацевтична композиція за п. 8, у якій тверда дисперсія містить полівінілпіролідон, кроскармелозу натрію та мікрокристалічну целюлозу.
15. Фармацевтична композиція за п. 10, у якій тверда дисперсія містить гідроксипропілцелюлозу та кроскармелозу натрію.
16. Фармацевтична композиція за п. 10, у якій тверда дисперсія містить гідроксипропілцелюлозу та принаймні один наповнювач, який являє собою цукор, цукровий спирт, циклодекстрин.
17. Фармацевтична композиція за будь-яким з пп. 1-16, у якій тверда дисперсія переважно гомогенна.
18. Фармацевтична композиція за будь-яким з пп. 1-17, яка містить сполуку Формули І переважно у аморфній формі.
19. Фармацевтична композиція за будь-яким з пп. 1-18, яка являє собою фармацевтичну композицію для перорального застосування.
20. Фармацевтична композиція за будь-яким з пп. 1-19, яка являє собою фармацевтичну композицію у формі таблетки.
21. Фармацевтична композиція за будь-яким з пп. 1-19, яка являє собою фармацевтичну композицію у формі капсули.
22. Фармацевтична композиція за будь-яким з пп. 1-19, яка являє собою фармацевтичну композицію у формі порошку, грануляту або саше.
23. Спосіб одержання твердої дисперсії сполуки Формули І
 (І)
(І)
або її солі, гідрату або сольвату, у якому:
екструдують сполуку Формули І або її сіль, гідрат або сольват та принаймні один матричний агент на екструдері, при температурі у діапазоні від 160 до 200°С; або
розчиняють сполуку Формули І або її сіль, гідрат або сольват та принаймні один матричний агент у розчиннику, доки всі порошкоподібні речовини не перейдуть у розчин, з наступним випаровуванням розчинника до сухого залишку.
24. Спосіб одержання за п. 23, у якому тверду дисперсію одержують шляхом піддавання сполуки Формули І та принаймні одного матричного агента екструзії з розплаву.
25. Спосіб одержання за п. 23, у якому тверду дисперсію одержують шляхом піддавання сполуки Формули І та принаймні одного матричного агента технології випарювання розчинника.
26. Спосіб одержання за п. 25, у якому розчинник вибирають з групи, що включає метанол, етанол, н-пропанол, ізопропанол та ацетон або їх комбінації.
27. Спосіб одержання за п. 26, у якому суміш етанолу та ацетону використовують як розчинник.
28. Спосіб одержання за будь-яким з пп. 23-27, у якому тверду дисперсію додатково обробляють за допомогою принаймні однієї додаткової стадії обробки, яка являє собою подрібнення, просіювання, ущільнення прокатуванням, розтирання, сортування, змішування або їх комбінації.
29. Спосіб одержання за будь-яким з пп. 23-28, який містить додаткову стадію змішування твердої дисперсії з одним або більше фармацевтично прийнятними наповнювачами для утворення суміші та формування цієї суміші у таблетки, наповнені капсули або саше.
30. Спосіб лікування гіперпроліферативних розладів, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять ссавцю, включаючи людину, або як окремий агент, або у комбінації з іншими терапіями.
31. Спосіб лікування раку, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять ссавцю, включаючи людину, або як окремий агент, або у комбінації з іншими терапіями.
32. Спосіб лікування раку, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять ссавцю, включаючи людину, або як окремий агент, або у комбінації з радіотерапією.
33. Спосіб лікування раку, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять людині, у комбінації з цитотоксичною терапією.
34. Спосіб лікування раку, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять людині, у комбінації з іншою протираковою терапією, спрямованою або на VEGFR, PDGFR, src, abl flt-3, EGFR, HER-2, aurora, raf, MEK, ERK, PI-3 кіназу, АKТ, mTOR або на HDAC.
Текст
1. Фармацевтична композиція, що містить як активнодіючу сполуку 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламід та/або його солі, гідрати, сольвати у формі твердої дисперсії. 2 3 92472 кросповідон, низькозаміщену гідроксипропілцелюлозу, крохмаль, мікрокристалічну целюлозу або їх комбінацію. 12. Фармацевтична композиція за п. 8, у якій тверда дисперсія містить полівінілпіролідон та кроскармелозу натрію. 13. Фармацевтична композиція за п. 8, у якій тверда дисперсія містить полівінілпіролідон та натрію гліколят крохмалю. 14. Фармацевтична композиція за п. 8, у якій тверда дисперсія містить полівінілпіролідон, кроскармелозу натрію та мікрокристалічну целюлозу. 15. Фармацевтична композиція за п. 10, у якій тверда дисперсія містить гідроксипропілцелюлозу та кроскармелозу натрію. 16. Фармацевтична композиція за п. 10, у якій тверда дисперсія містить гідроксипропілцелюлозу та принаймні один наповнювач, який являє собою цукор, цукровий спирт, циклодекстрин. 17. Фармацевтична композиція за будьяким з пп. 1-16, у якій тверда дисперсія переважно гомогенна. 18. Фармацевтична композиція за будьяким з пп. 1-17, яка містить сполуку Формули І переважно у аморфній формі. 19. Фармацевтична композиція за будьяким з пп. 1-18, яка являє собою фармацевтичну композицію для перорального застосування. 20. Фармацевтична композиція за будьяким з пп. 1-19, яка являє собою фармацевтичну композицію у формі таблетки. 21. Фармацевтична композиція за будьяким з пп. 1-19, яка являє собою фармацевтичну композицію у формі капсули. 22. Фармацевтична композиція за будьяким з пп. 1-19, яка являє собою фармацевтичну композицію у формі порошку, грануляту або саше. 23. Спосіб одержання твердої дисперсії сполуки Формули І CF3 O Cl O O N H H N N N H CH3 F (І) або її солі, гідрату або сольвату, у якому: екструдують сполуку Формули І або її сіль, гідрат або сольват та принаймні один матричний агент на екструдері, при температурі у діапазоні від 160 до 200°С; або розчиняють сполуку Формули І або її сіль, гідрат або сольват та принаймні один матричний агент у Даний винахід відноситься до нових фармацевтичних композицій, до способів одержання зазначених нових фармацевтичних композицій та до їх застосування для лікування гіперпроліферативних розладів, таких як рак, або як 4 розчиннику, доки всі порошкоподібні речовини не перейдуть у розчин, з наступним випаровуванням розчинника до сухого залишку. 24. Спосіб одержання за п. 23, у якому тверду дисперсію одержують шляхом піддавання сполуки Формули І та принаймні одного матричного агента екструзії з розплаву. 25. Спосіб одержання за п. 23, у якому тверду дисперсію одержують шляхом піддавання сполуки Формули І та принаймні одного матричного агента технології випарювання розчинника. 26. Спосіб одержання за п. 25, у якому розчинник вибирають з групи, що включає метанол, етанол, н-пропанол, ізопропанол та ацетон або їх комбінації. 27. Спосіб одержання за п. 26, у якому суміш етанолу та ацетону використовують як розчинник. 28. Спосіб одержання за будь-яким з пп. 23-27, у якому тверду дисперсію додатково обробляють за допомогою принаймні однієї додаткової стадії обробки, яка являє собою подрібнення, просіювання, ущільнення прокатуванням, розтирання, сортування, змішування або їх комбінації. 29. Спосіб одержання за будь-яким з пп. 23-28, який містить додаткову стадію змішування твердої дисперсії з одним або більше фармацевтично прийнятними наповнювачами для утворення суміші та формування цієї суміші у таблетки, наповнені капсули або саше. 30. Спосіб лікування гіперпроліферативних розладів, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять ссавцю, включаючи людину, або як окремий агент, або у комбінації з іншими терапіями. 31. Спосіб лікування раку, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять ссавцю, включаючи людину, або як окремий агент, або у комбінації з іншими терапіями. 32. Спосіб лікування раку, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять ссавцю, включаючи людину, або як окремий агент, або у комбінації з радіотерапією. 33. Спосіб лікування раку, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять людині, у комбінації з цитотоксичною терапією. 34. Спосіб лікування раку, при якому фармацевтичну композицію за будь-яким з пп. 1-22 вводять людині, у комбінації з іншою протираковою терапією, спрямованою або на VEGFR, PDGFR, src, abl flt-3, EGFR, HER-2, aurora, raf, MEK, ERK, PI-3 кіназу, АKТ, mTOR або на HDAC. окремий агент або у комбінації з іншими терапіями. Діарилсечовини являють собою клас інгібіторів серін-треонін кінази, також як і інгібіторів тирозинкінази, відомий у даній галузі техніки. Наступні публікації ілюструють їх застосування як активного 5 інгредієнту у фармацевтичних композиціях для лікування гіпер-проліферативних хвороб, таких як рак: Smith та ін., Bioorg. Med. Chern. Lett. 2001, 11, 2775-2778. LowingerTa ін., Clin. Cancer Res. 2000, 6(suppl), 335. Lyons та ін., Endocr.-Relat. Cancer 2001, 5, 219225. Riedl та ін., Book of Abstracts, 92ndAACR Meeting, New Orleans, LA, USA, реферат 4956. Khire та ін., Book of Abstracts, 93rd AACR Meeting, San Francisco, CA, USA, реферат 4211. Lowinger та ін., Curr. Pharm. Design 2002, 8, 99110. Carter та ін., Book of Abstracts, 92nd AACR Meeting, New Orleans, LA, USA, реферат 4954. Vincent та ін., Book of Abstracts, 38th ASCO Meeting, Orlando, FL, USA, реферат 1900. Hilger та ін., Book of Abstracts, 38th ASCO Meeting, Orlando, FL, USA, реферат 1916. Moore та ін., Book of Abstracts. 38th ASCO Meeting, Orlando, FL, USA, реферат 1816. Strumberg та ін., Book of Abstracts, 38th ASCO Meeting, Orlando, FL, USA, реферат 121. Омега-карбоксиарил-дифеніл-сечовини розкриті у WO00/42012 (опублікованій 20 липня 2000), WO00/41698 (опублікованій 20 липня 2000), та у наступних опублікованих заявках США: US2002-0165394-A1, опублікована 7 листопада 2002, US2001-003447-A1, опублікована 25 жовтня 2001, US2001 -0016659-А1, опублікована 23 серпня 2001, US2002-013774-A1, опублікована 26 вересня 2002, та заявках США, що одночасно розглядаються: 09/758,547, поданій 12 січня 2001, 09/889,227, поданій 12 липня 2001, 09/993,647, поданій 27 листопада 2001, 10/042,203, поданій 11 січня 2002 та 10/071,248, поданій 11 лютого 2002. Зокрема, розкрито, що дифеніл-сечовина Формули І, що також називається як 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метил-амід, являє собою сильний інгібітор raf, VEGFR-2, р38, та PDGFR кіназ. Зазначені ферменти являють собою всі молекули-цілі, що розглядаються, для лікування гіпер-проліферативних хвороб, включаючи рак. Тому, сполука Формули І буде використовуватися як лікарський засіб для лікування зазначених вище хвороб. Кращий шлях застосування лікарського засобу - через ротову порожнину. Зазначений шлях забезпечує найбільшу комфортність та зручність дозування. Біодоступність, що досягається після перорального застосування, являє собою міру потенційної корисності пероральної дозувальної форми лікарського засобу. Біодоступність після перорального застосування залежить від декількох факторів, таких як розчинність активної речовини у водному середовищі, величина дози, розчинність 92472 6 лікарської форми, абсорбція через шлунковокишковий тракт та предсистемний ефект. Тому, бажаними є тверді фармацевтичні композиції для перорального застосування, що містять сполуку Формули I, які приводять до покращеної розчинності, абсорбції та контакту у ссавців, покращеної між-пацієнтної мінливості, та загальної покращеної ефективності у клінічному застосуванні. Наразі було винайдено, що зазначена ціль покращена розчинність, більша абсорбція та підвищена біодоступність та інші потреби, які будуть зрозумілими спеціалісту, кваліфікованому у даній галузі техніки, досягається за допомогою представленого винаходу, який детально описаний нижче. Використання нової фармацевтичної композиції, що містить тверду дисперсію сполуки Формули І, буде надавати значних переваг при клінічному застосуванні. Формула І представлена нижче: Термін "сполука Формули І" або "сполука даного винаходу" відноситься не тільки до 4{4-[3-(4хлор-3-трифторметилфеніл)-уреїдо]-3фторфенокси}-піридин-2-карбонової кислоти метил-аміду, як показано у Формулі І, а також відноситься до його сольватів, гідратів, фармацевтично прийнятних солей або їх комбінації. Даний винахід відноситься до (i) нових фармацевтичних композицій, що містять сполуку Формули І у формі твердої дисперсії, яка включає тверді розчини, скляні розчини, скляні суспензії, аморфні осади у кристалічному носії, евтектики або монотектики, сполуку або комплексне утворення та їх комбінації, (ii) способів одержання зазначених нових фармацевтичних композицій, (iii) застосування зазначених композицій для лікування гіпер-проліферативних хвороб, таких як рак, або як окремий агент або у комбінації з іншими терапіями. Описані нижче різні типи твердих дисперсій (тверді розчини, скляні розчини, скляні суспензії, аморфні осади у кристалічному носії, евтектики або монотектики, сполука або комплексне утворення та їх комбінації) сукупно називаються твердою дисперсією. Фармацевтична композиція у відповідності з даним винаходом включає тверду дисперсію, що містить принаймні сполуку Формули І та фармацевтично прийнятну матрицю. Термін "матриця" або "матричні агенти" як використано у цьому описі відноситься до полімерних наповнювачів, неполімерних наповнювачів та їх комбінацій, які здатні розчиняти або диспергувати сполуку Формули І. Аспект даного винаходу, що особливо розглядається, являє собою фармацевтичну композицію, 7 що містить тверду дисперсію, у якій матриця включає фармацевтично прийнятний полімер, такий як, наприклад, полівінілпіролідон, вінілпіролідон/вінілацетат співполімер, кросповідон, поліалкілен-гліколь (наприклад, поліетилен-гліколь), поліетиленоксид, полоксамер, гідроксиалкілцелюлоза (наприклад, гідроксипропіл целюлоза), гідроксиалкіл-метил-целюлоза (наприклад, гідроксипропіл-метил-целюлоза), карбоксиметилцелюлоза, карбоксиметил-целюлоза натрію, етилцелюлоза, сукцинати целюлози (наприклад, ацетат-сукцинат целюлози та ацетат-сукцинат гідроксипропіл-метил-целюлози), фталати целюлози (наприклад, ацетат-фталат целюлози та фталат гідроксипропіл-метил-целюлози), поліметакрилати (наприклад, типи Eudragit ), полігідроксиалкілакрилати, полігідроксиалкілметакрилати, поліакрилати, полівініловий спирт, полівініл-ацетат, вініловий спирт/вінілацетат співполімер, ксантанова камедь, галактоманани, карагенан, хітозан, хітін, альгінова кислота та її солі, полілактиди, декстрини, крохмаль та похідні крохмалю, білки та їх комбінації. Інший аспект даного винаходу являє собою фармацевтичну композицію, що містить тверду дисперсію, у якій матриця містить цукор та/або цукровий спирт та/або циклодекстрин, такий як, наприклад, сахароза, лактоза, фруктоза, мальтоза, рафіноза, сорбіт, лактитол, манітол, мальтитол, еритритол, треїтол, адонітол, арабітол, ксилітол, дульцит, інозитол, трегалоза, ізомальт, інулін, Мальто декстрин, -цикл о декстрин, гідроксипропіл- -циклодекстрин, сульфобутилового ефіру циклодекстрин або їх комбінації. Додаткові прийнятні наповнювачі, які є корисними для утворення матриці твердої дисперсії, включають, не обмежуючись наведеними, спирти, органічні кислоти, органічні основи, солі, амінокислоти, пептиди, фосфоліпіди, ліпіди (наприклад, моно-, ди- та тригліцериди), жирні кислоти, жирні спирти, воски, складні ефіри жирних кислот, складні ефіри поліоксиетилен-сорбіту і жирної кислоти, полігліколізовані гліцериди, ефіри сахарози, сечовину та їх комбінації. Тверда дисперсія сполуки Формули І у матриці може містити певні додаткові фармацевтичні прийнятні інгредієнти, такі як носії, поверхнево-активні речовини, наповнювачі, дезінтегруючі агенти, адсорбуючі речовини, інгібітори перекристалізації, пластифікатори, розріджуючі агенти, протипінні добавки, антиоксиданти, речовини для зменшення клейкості, рН-модифікатори, гліданти та любриканти. Носій у відповідності з даним винаходом являє собою наповнювач, який змішують з сумішшю, що містить принаймні матричний агент та сполуку даного винаходу, у процесі виробництва твердої дисперсії, наприклад, шляхом екструзії з розплаву, покривання з розплаву, гранулювання, заморожування, процесів випарювання розчиннику (наприклад, нашарування, покриття, гранулювання), і, таким чином, являє собою невід'ємну частину твердої дисперсії. У кращому втіленні даного винаходу, матриця містить водорозчинний полімер. 92472 8 У іншому кращому втіленні принаймні одну з груп, таких як полівінілпіролідон, коповідон. гідроксипропіл-целюлоза, гідроксипропіл-метилцелюлоза, поліетилен-гліколь та поліетилен-оксид, використовують як матричний агент у твердій дисперсії. У іншому кращому втіленні полівінілпіролідон використовують як матричний агент. Втілення, що особливо розглядається, включає сполуку Формули І (розраховану як вільна від розчиннику основа) та полівінілпіролідон у масовому співвідношенні від 1:0,5 до 1:20. Інше краще втілення включає гідроксипропілцелюлозу як матричний агент. Втілення, що особливо розглядається, включає сполуку Формули І (розраховану як вільна від розчиннику основа) та гідроксипропіл-целюлозу у масовому співвідношенні від 1:0,5 до 1:20. Інший аспект даного винаходу, що особливо розглядається, являє собою тверді дисперсії, що містять кроскармелозу натрію, натрію гліколят крохмалю, кросповідон, низько-заміщену гідроксипропіл-целюлозу (L-HPC), крохмаль, мікрокристалічну целюлозу або їх комбінацію як носій або диспергуючий агент. У кращому втіленні, тверда дисперсія містить полівінілпіролідон та кроскармелозу натрію. У іншому кращому втіленні, тверда дисперсія містить полівінілпіролідон та натрію гліколят крохмалю. У іншому кращому втіленні, тверда дисперсія містить полівінілпіролідон, кроскармелозу натрію та мікрокристалічну целюлозу. У іншому кращому втіленні, тверда дисперсія містить гідроксипропіл-целюлозу та кроскармелозу натрію. У ще одному кращому втіленні, тверда дисперсія містить гідроксипропіл-целюлозу та принаймні один наповнювач, який являє собою цукор, цукровий спирт, циклодекстрин. Тверду дисперсію даного винаходу одержують відповідно до способів, відомих у галузі виробництва твердих дисперсій, таких як технологія сплавлення/плавлення, екструзія з розплаву, покривання з розплаву, гранулювання, заморожування, випарювання розчиннику (наприклад, сушка виморожуванням, розпилювальна сушка, вакуумна сушка, шарування пудри, гранули або пігулки та гранулювання з псевдозрідженого шару), співосадження, технологія надкритичних рідин та електростатичний спосіб ротаційного витиснення. Технології екструзії з розплаву або випарювання розчиннику є кращими процесами для одержання складів твердої дисперсії даного винаходу. Розчинник, прийнятний для виробництва твердих дисперсій шляхом процесів випарювання розчиннику, таких як розпилювальна сушка, шарування та гранулювання з псевдозрідженого шару, може являти собою будь-яку речовину, у якій може розчинятися сполука Формули І. Кращі розчинники включають спирти (наприклад, метанол, етанол, гіпропанол, ізопропанол та бутанол), кетони (наприклад, ацетон, метил-етил-кетон та метил-ізобутилкетон), складні ефіри (наприклад, етилацетат та пропіл-ацетат) та різні інші розчинники, такі як 9 ацетонітрил, метиленхлорид, хлороформ, гексан, толуол, тетрагідрофуран, циклічні ефіри та 1,1,1трихлоретан. Також можуть бути використані розчинники з нижчою леткістю, такі як диметилацетамід або диметил-сульфоксид. Суміші розчинників, такі як 20% етанолу та 80% ацетону, також можуть бути використані, також як і суміші з водою, поки лікарський засіб та, якщо необхідно, матричний агент є достатньо розчинними для проведення процесу. У кращому втіленні розчинник, що використовують для виробництва твердої дисперсії, включає метанол, етанол, н-пропанол, ізопропанол або ацетон. У кращому втіленні, суміш етанолу та ацетону використовують як розчинник для одержання твердої дисперсії. Аспект даного винаходу, що особливо розглядається, являє собою композицію, у якій тверда дисперсія є значною мірою гомогенною. Аспект даного винаходу, що особливо розглядається, являє собою фармацевтичну композицію, у якій сполука Формули І є значною мірою аморфною. Зазначена фармацевтична композиція буде використовуватися для досягнення бажаного фармакологічного ефекту шляхом перорального застосування до пацієнта, якому це необхідно, та матиме переваги над звичайними композиціями з погляду вивільнення лікарського засобу, біодоступності, між-пацієнтній мінливості та/або ефективності у ссавців. Пацієнт, для цілей даного винаходу, являє собою ссавця, включаючи людину, який потребує лікування певного стану або хвороби, включаючи профілактичне лікування. Для перорального застосування, тверда дисперсія, представлена у цьому описі, може бути сформульована у твердий або рідкий препарати, такі як порошок, гранули, пігулки, таблетки, капсули, драже, жувальні таблетки, шипучі таблетки, таблетки, що здатні диспергуватися, пастилки, лікарський льодяник, розплави, розчини, суспензії, або емульсії, та може бути одержана у відповідності зі способами, відомими у даній галузі техніки для виробництва фармацевтичних композицій. Для цього тверда дисперсія може бути змішана зі звичайними носіями, наприклад, такими як зв'язуючі речовини, наповнювачі, любриканти, дезінтегруючи агенти, розчинники, поверхнево-активні речовини, емульгатори, згущувачі та стабілізатори, гліданти та любриканти, матеріали для покриття, також як і підсолоджувачі, ароматизатори та барвники. Вважається, що спеціаліст, кваліфікований у даній галузі техніки, використовуючи попередню інформацію, зможе використовувати даний винахід у найширших межах. Пероральна композиція сполуки Формули І має відношення до широкого ряду доз, таких як 1 мг, 10 мг, 100 мг, або навіть 1 г добової дози та більше. Це може бути здійснено, наприклад, шляхом модифікування композиції та розміру таблетки або капсули, та/або шляхом застосування декількох таблеток або капсул на день пацієнтом, якому це необхідно. Альтернативно, склад твердої дисперсії також може бути дозова 92472 10 ний у формах, таких як порошки, гранули, жувальні, шипучі таблетки або таблетки, що здатні диспергуватися, або шляхом диспергування будь-якої прийнятної твердої композиції у прийнятній рідині перед застосуванням, наприклад, якщо оптимальний режим дозування більше не узгоджується з наявним розміром таблетки або капсули. Спосіб лікування гіпер-проліферативних розладів Даний винахід також відноситься до способу застосування нової пероральної фармацевтичної композиції сполуки Формули І для лікування гіперпроліферативних розладів ссавців, включаючи рак. Зазначений спосіб включає застосування фармацевтичної композиції у формі твердої дисперсії до ссавця, якому необхідне таке лікування, включаючи людину, кількості, яка є ефективною для лікування розладу. Термін "гіпер-проліферативні розлади" та/або "рак" відноситься не тільки до солідних пухлин, таких як рак молочної залози, дихальних шляхів, мозку, репродуктивних органів, шлунково-кишкового тракту, сечовивідних шляхів, ока, печінки, шкіри, голови та шиї, щитовидної залози, навколощитовидної залози та їх віддалені метастази, але також включає лімфоми, саркоми та лейкемії. Приклади раку молочної залози включають, не обмежуючись наведеними, інвазивну протокову карциному, інвазивну лобулярну карциному, протокову карциному in situ, та лобулярну карциному in situ. Приклади раку дихальних шляхів включають, не обмежуючись наведеними, дрібноклітинну та недрібноклітинну карциному легені, а також аденому бронхів та плевро-легеневу бластому. Приклади раку мозку включають, не обмежуючись наведеними, гліому стовбуру мозку та піддіафрагмальну гліому, мозочкову та церебральну астроцитому, медулобластому, епендімому, а також нейроектодермальну та пінеальну пухлину. Пухлини чоловічих репродуктивних органів включають, не обмежуючись наведеними, рак простати та яєчок. Пухлини жіночих репродуктивних органів включають, не обмежуючись наведеними, рак ендометрію, шийки матки, яєчників, піхви та вульви, а також саркому матки. Пухлини шлунково-кишкового тракту включають, не обмежуючись наведеними, рак анусу, товстої кишки, кишечнику, стравоходу, жовчного міхура, шлунку, підшлункової залози, прямої кишки, тонкої кишки та слинної залози. Пухлини сечовивідних шляхів включають, не обмежуючись наведеними, рак сечового міхура, статевого члену, нирки, ниркового цебрику, сечоводу та уретри. Рак ока включає, не обмежуючись наведеними, внутрішньоочну меланому та ретинобластому. Приклади раку печінки включають, не обмежуючись наведеними, гепатоцелюлярний рак (гепатома з або без фібро ламелярного варіанту), холангіокарциному (карцинома внутрішньопечінкових жовчних шляхів), та змішану гепатоцелюлярну холангіокарциному. Рак шкіри включає, не обмежуючись наведеними, плоскоклітинну карциному, саркому Капоші, 11 злоякісну меланому, рак шкіри з клітин Меркеля та немеланомний рак шкіри. Рак голови та шиї включає, не обмежуючись наведеними, гортанний / гіпофарингеальний / носоглотковий І ротоглотковий рак, та рак губ та ротової порожнини. Лімфоми включають, не обмежуючись наведеними, СНІД-пов'язану лімфому, неходжкінову лімфому, шкірну Т-клітинну лімфому, ходжкінову хворобу та лімфому центральної нервової системи. Саркоми включають, не обмежуючись наведеними, саркому м'якої тканини, фібросаркому, остеосаркому, злоякісну фіброзну гістиоцитоксантому, лімфосаркому та рабдоміосаркому. Лейкемії включають, не обмежуючись наведеними, гостру мієлоїдну лейкемію, гостру лімфобластичну лейкемію, хронічну лімфоцитарну лейкемію, хронічну мієлогенну лейкемію та лейкемію ворсистих клітин. Зазначені розлади добре описані для людей, але вони також існують з подібною етіологією у інших ссавців, таких як родина псових та котячих, та можуть лікуватися шляхом застосування фармацевтичних композицій даного винаходу. Загальна кількість активного інгредієнту (сполука Формули І), що застосовується пероральним шляхом, використовуючи фармацевтичну композицію даного винаходу, в основному буде знаходитися у інтервалі від приблизно 0,01 мг/кг до приблизно 50 мг/кг маси тіла на добу. Базуючись на стандартних лабораторних технологіях, відомих для оцінки сполук, корисних для лікування гіперпроліферативних розладів, шляхом стандартних випробувань на токсичність та шляхом стандартних фармакологічних досліджень для визначення лікування станів, описаних вище, у ссавців, та шляхом порівняння цих результатів з результатами відомих лікарських засобів, які використовують для лікування зазначених станів, ефективна доза фармацевтичних композицій даного винаходу може бути легко визначена спеціалістом, кваліфікованим у даній галузі техніки. Кількість застосовуваного активного інгредієнту може змінюватися у широких межах відповідно до таких факторів як певна сполука та лікарська одиниця, що використовується, спосіб та час застосування, період лікування, вік, стать та загальний стан пацієнта, якого лікують, природи та ступеню стану, що лікують, швидкості метаболізму та екскреції лікарського засобу, можливих комбінацій лікарських засобів та взаємодії лікарських засобів, та подібних. Фармацевтичні композиції даного винаходу можуть застосовуватися як окремий агент або у комбінації з однією або більше терапіями, де комбінація не спричиняє неприйнятних несприятливих ефектів. Наприклад, вони можуть бути об'єднані з цитотоксичними агентами, інгібіторами сигнальної трансдукції, або з іншими протираковими агентами або терапіями, а також з їх сумішами та комбінаціями. У одному втіленні, фармацевтичні композиції даного винаходу можуть бути об'єднані з цитотоксичними протираковими агентами. Приклади таких агентів можуть бути знайдені у 11-ому виданні 92472 12 Merck Index (1996). Зазначені агенти включають, не обмежуючись наведеними, такі як аспарагіназа, блеоміцин, карбоплатін, кармустин, хлорамбуцил, цисплатин, коласпаза, циклофосфамід, цитарабін, дакарбазин, дактиноміцин, даунорубіцин, доксорубіцин (адріаміцин), епірубіцин, етопозид, 5фторурацил, гексаметилмеламін, гідроксисечовина, іфосфамід, іринотекан, лейковорин, ломустин, мехлоретамін, 6-меркаптопурин, месна, метотрексат, мітоміцин С, мітоксантрон, преднізолон, преднізон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тіогуанін, топотекан, вінбластин, вінкристин та віндезин. Інші цитотоксичні лікарські засоби, прийнятні для застосування з фармацевтичними композиціями даного винаходу, включають, не обмежуючись наведеними, ті сполуки, які визнані для використання у лікування неопластичних хвороб у Goodman and Gilman's The Pharmacological Basis of Therapeutics (дев'яте видання, 1996, McGrawHill). Зазначені агенти включають, не обмежуючись наведеними, такі як аміноглутетимід, Lаспарагіназа, азатіоприн, 5-азацитидин кладрибін, бусульфан, діетилстилбестрол, 2',2'дифтордеоксицитидин, доцетаксел, еритрогідроксиноніладенін, етиніл естрадіол, 5фтордеоксиуридин, 5-фтордеоксиуридин монофосфат, флударабін фосфат, флуоксиместерон, флутамід, гідроксипрогестерон капроат, ідарубіцин, інтерферон, медроксипрогестерон ацетат, мегестрол ацетат, мелфалан, мітотан, паклітаксел, пентостатин, N-фосфоноацетил-Ь-аспартат (PALA), плікаміцин, семустин, теніпозид, тестостерон пропіонат, тіотепа, триметилмеламін, уридин та вінорелбін. Інші цитотоксичні протиракові агенти, прийнятні для застосування з композиціями даного винаходу, також включають нещодавно відкриті цитотоксичні активні компоненти лікарського засобу, такі як оксаліплатин, гемцитабін, капецитабін, епотилон та їх природні або синтетичні похідні, темозоломід (Quinn та ін., J. Clin. Oncology 2003, 27(4), 646-651), тозитумомаб (Bexxar), трабедектин (Vidal та ін., Proceedings of the American Society for Clinical Oncology 2004, 23, реферат 3181), та інгібітори кінезин веретеноподібного білку Eg5 (Wood та ін., Curr. Оріn. Pharmacol. 2001, 7, 370-377). У іншому втіленні, фармацевтичні композиції даного винаходу можуть бути скомбіновані з іншими інгібіторами сигнальної трансдукції. Особливо розглядаються інгібітори сигнальної трансдукції, які направлені на EGFR родину, такі як EGFR, HER-2, та HER-4 (Raymond та ін., Drugs 2000, 60 (Suppl. І), 15-23; Нагап та ін., Oncogene 19 (53), 6102-6114), га їх відповідні ліганди. Приклади таких агентів включають, не обмежуючись наведеними, терапії антитілами, такі як Herceptin (трастузумаб), Erbitux (цетуксимаб), та пертузумаб. Приклади таких терапій також включають, не обмежуючись наведеними, дрібно молекулярні кіназні інгібітори, такі як ZD-1839/ Iressa (Baselga та ін., Drugs 2000, 60 (Suppl. 1), 33-40), OSI-774 / Tarceva (Pollack та ін. J. Pharm. Exp Ther. 1999, 291(2), 739748). СІ-1033 (Bridges, Curr. Med. Chem. 1999, 6, 825-843), GW-2016 (Lackey та ін., 92nd AACR 13 Meeting, New Orleans. March 24-28, реферат 4582), CP-724,714 (Jani та ін., Proceedings of the American Society for Clinical Oncology 2004, 23, реферат 3122), AEE-788 (Baselga та ін., Proceedings of the American Society for Clinical Oncology 2005, 24, реферат 3028), HKI-272 (Rabindran та ін., Cancer Res. 2004, 64, 3958-3965), та EKB-569 (Greenberger та ін., 11th NCI-EORTC-AACR Symposium on New Drugs in Cancer Therapy, Amsterdam, November 7-10, 2000, реферат 388). У іншому втіленні, фармацевтичні композиції даного винаходу можуть бути скомбіновані з іншими інгібіторами сигнальної трансдукції, що направлені на рецепторні кінази родин доменів спліткінази (VEGFR, FGFR, PDGFR, flt-3, c-kit, c-fms, та подібні), та їх відповідними лігандами. Зазначені агенти включають, не обмежуючись наведеними, антитіла, такі як Avastin (бевацизумаб). Зазначені агенти також включають, не обмежуючись наведеними, дрібномолекулярні інгібітори, такі як STI-571 / Gleevec (Zvelebil, Curr. Оріп. Oncol., Endocr. Metab. Invest. Drugs 2000, 2(1), 74-82), PTK-787 (Wood та ін.. Cancer Res. 2000, 60(8), 2178-2189), SU-11248 (Demetn та ін., Proceedings of the American Society for Clinical Oncology 2004, 23, реферат 3001), ZD-6474 (Hennequin та ін., 92nd AACR Meeting, New Orleans, March 24-28, 2001 реферат 3152), AG-13736 (Herbst та ін., Clin. Cancer Res. 2003, 9, 16 (suppl. 1), реферат C253), KRN-951 (Taguchi та ін., 95th AACR Meeting, Orlando, FI1 2004, реферат 2575), CP-547,632 (Beebe та ін., Cancer Res. 2003, 63, 7301-7309), CP-673,451 (Roberts та ін., Proceedings of the American Association of Cancer Research 2004, 45, реферат 3989), CHIR-258 (Lee та ін., Proceedings of the American Association of Cancer Research 2004, 45, реферат 2130), MLN-518 (Shen та ін., Blood 2003, 102, 11, реферат 476), AMG-706 (Herbst та ін., Eur. J. Cancer 2004, 2(8), реферат 151), BlBF-1120 (Mross та ін., Proceedings of the American Society for Clinical Oncology 2005, 24, реферат 3031), ABT-869 (Albert та ін., Proceedings of the American Association of Cancer ksearch 2005, 46, реферат 676), та AZD-2171 (Hennequin та ін., Proceedings of the American Association of Cancer Research 2004, 45, реферат 4539). У іншому втіленні, фармацевтичні композиції даного винаходу можуть бути скомбіновані з інгібіторами aurora кіназ (Mortlock та ін., Curr. Topics Med. Chern. 2005, 5, 199). Вони включають, без обмеження наведеними, VX-680 (Harrington та ін., Nature Med. 2004, 10, 262), та РНА-680632 (Fancelli та ін., Proceedings of the American Association of Cancer Research 2005, 46, реферат LB-113). У іншому втіленні, фармацевтичні композиції даного винаходу можуть бути скомбіновані з інгібіторами bcr-abl та/або src. Вони включають, без обмеження наведеними, AZD-0530 (Gallagher та ін., Proceedings of the American Association of Cancer Research 2005, 46, реферат 3972), AMN107 та BMS-354825 (O'Hare та ін., Cancer Res. 2005, 65(11), 4500). У іншому втіленні, фармацевтичні композиції даного винаходу можуть бути скомбіновані з інгібіторами шляху трансдукції Raf/MEK/ERK (Avruch та 92472 14 ін., Recent Prog. Horm. Res. 2901, 56, 127-155), або PKB (akt) шляху (Lawlor та ін., J. Cell Sci. 2001, 114, 2903-2910). Вони включають, без обмеження наведеними, PD-325901 (Sebolt-Leopold та ін., Proceedings of the American Association of Cancer Research 2004, 45, реферат 4003), та ARRY142886 (Wallace та ін., Proceedings of the American Association of Cancer Research 2904, 45, реферат 3891). У іншому втіленні, фармацевтичні композиції даного винаходу можуть бути скомбіновані з інгібіторами гістон-деацетилази. Приклади таких агентів включають, без обмеження наведеними, субероїланілід-гідроксамову кислоту (SAHA), LAQ-824 (Ottmann та ін., Proceedings of the American Society for Clinical Oncology 2004, 23, реферат 3024), LBH589 (Beck та ін., Proceedings of the American Society for Clinical Oncology 2004, 23, реферат 3025), MS-275 (Ryan та ін., Proceedings of the American Association of Cancer Research 2004, 45, реферат 2452), та FR-901228 (Piekarz та ін., Proceedings of the American Society for Clinical Oncology 2004, 23, реферат 3028). У іншому втіленні, фармацевтичні композиції даного винаходу можуть бути скомбіновані з іншими протираковими агентами, такими як інгібітори протеасоми, та m-TOR інгібітори. Вони включають, без обмеження наведеними, бортезоміб (Mackay та ін., Proceedings of the American Society for Clinical Oncology 2004, 23, Реферат 3109), та CCI779 (Wu та ін., Proceedings of the American Association of Cancer Research 2004, 45, реферат 3849). В основному, застосування цитотоксичних та/або цитостатичних протиракових агентів у комбінації з фармацевтичними композиціями даного винаходу будуть слугувати для: (1) одержання кращої ефективності у зменшенні росту пухлини або навіть знищенні пухлини у порівнянні з застосуванням будь-якого агенту окремо, (2) забезпечення застосування менших кількостей застосовуваних агентів, (3) забезпечення протоколу хіміотерапевтичного лікування, який краще переноситься пацієнтом з меншими шкідливими фармакологічними ускладненнями, ніж це спостерігається при хіміотерапіях за допомогою одного агенту та певних інших комбінованих терапіях, (4) забезпечення лікування ширшого спектру різних типів раку у ссавців, особливо людей, (5) забезпечення більшої швидкості відповіді серед пацієнтів, яких лікували, (6) забезпечення довшого часу виживання серед пацієнтів, яких лікували, у порівнянні зі стандартними хіміотерапевтичними лікуваннями, (7) забезпечення довшого часу прогресування пухлини, та/або (8) одержання результатів ефективності та переносимості принаймні такими ж гарними як і агентів, використовуваних окремо, у порівнянні з відомими випадками, коли інші комбінації ракових агентів приводять до антагоністичних ефектів. Вважається, що спеціаліст, кваліфікований у даній галузі техніки, використовуючи описану вище 15 інформацію та інформацію, доступну у даній галузі техніки, може використовувати даний винахід у найширших межах. Спеціалісту, кваліфікованому у даній галузі техніки, має бути очевидним, що зміни та модифікації можуть бути зроблені у даному винаході не відступаючи від суті або обсягу даного винаходу, як це представлено у даному винаході. Всі публікації, заявки та патенти, процитовані вище та нижче, включені у даний опис шляхом посилання. Синтетичне одержання сполук, використаних у даному винаході, описане у Прикладі 1. Типові солі сполук Прикладу 1 описані у Прикладах 2, 3 та 4. Нові композиції твердих дисперсій сполуки Формули І описані у Прикладах 5-20. Приклади слугують для додаткової ілюстрації винаходу, не обмежуючи його. Приклади Абревіатури, використані у даному описі, приймають значення, наведені нижче: HPLC Високо ефективна рідинна хроматографія LC-MS Рідинна хроматографія з масспектрометричним детектуванням LC RT Час утримання у рідинній хроматографії Тпл. Температура плавлення ЯМР Ядерний магнітний резонанс ТШХ Тонко шарова хроматографія RT Час утримання ES Електроспрей HRMS Mac-спектроскопія високого розділення Одержання 4-аміно-3-фторфенолу У суху колбу, яку продули аргоном, додають 10% Pd/C (80 мг), а потім 3-фтор-4-нітрофенол (1,2 г, 7,64 ммоль) у вигляді розчину у етилацетаті (40 мл). Суміш перемішують у Н2 атмосфері впродовж 4 годин. Суміш фільтрують через фільтр Celite та розчинник випарюють при зниженому тиску з одержанням бажаного продукту у вигляді ковто-коричневої твердої речовини (940 мг, 7,39 ммоль; 97 % вихід); 1Н-ЯМР (DMSO-d6) 4,38 (s, 2Н), 6,29-6,35 (m, 1Н), 6,41 (dd, J=2,5, 12,7, 1Н), 6,52-6,62 (m, 1Н), 8,76 (s, 1Н). Одержання 4-(4-аміно-3фторфенокси)піридин-2-карбонової кислоти метил-аміду 92472 16 Розчин 4-аміно-3-фторфенолу (500 мг, 3,9 ммоль) у N,N-диметилацетаміді (6 мл), охолоджений до 0 C, обробляють за допомогою третбутокиду калію (441 мг, 3,9 ммоль), та коричневий розчин залишають перемішуватися при 0 C впродовж 25 хвилин. До суміші додають 4-хлор-Nметил-2-піридинкарбоксамід (516 мг, 3,0 ммоль) у вигляді розчину у диметилацетаміді (4 мл). Реакційну суміш нагрівають при 100 0C впродовж 16 годин. Суміш охолоджують до кімнатної температури, реакцію гасять за допомогою Н2О (20 мл), та екстрагують етилацетатом (4х40 мл). Об'єднані органічні фракції промивають за допомогою Н2О (2х30 мл), сушать (MgSO4), та випарюють з одержанням червоно-коричневого масла. 1Н-ЯМР показав присутність залишкового диметилацетаміду, таким чином, зазначене масло переносять у діетиловий ефір (50 мл) та додатково промивають сольовим розчином (5 х 30 мл). Органічний шар сушать (MgSO4) та концентрують з одержанням 950 мг бажаного продукту у вигляді червонокоричневої твердої речовини, яку використовують у наступній стадії без очищення. Приклад 1: Одержання 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метил-аміду До розчину 4-(4-аміно-3-фторфенокси)піридин2-карбонової кислоти метил-аміду (177 мг, 0,68 ммоль) у толуолі (3 мл) додають 4-хлор-3(трифторметил)фенілізоціанат (150 мг, 0,68 ммоль). Суміш перемішують при кімнатній температурі впродовж 72 годин. Реакційну суміш концентрують при зниженому тиску та залишок розтирають з діетиловим ефіром. Отриману тверду речовину збирають фільтруванням та сушать у вакуумі впродовж 4 годин з одержанням заголовної сполуки (155 мг, 0,32 ммоль; 47% вихід); 1HЯMP (DMSO-d6) 2,78 (d, J=4,9, 3Н), 7,03-7,08 (m, 1Н), 7,16 (dd, J=2,6, 5,6, 1Н), 7,32 (dd, J=2,7, 11,6, 1Н), 7,39 (d, J=2,5, 1Н), 7,60 (s, 2Н), 8,07-8,18 (m, 2Н), 8,50 (d, J=5,7, 1Н), 8,72 (s, 1Н), 8,74-8,80 (m, 1Н), 9,50 (s, 1Н); MS (HPLC/ES) 483,06 m/z = (M+1). Спосіб одержання 4-хлор-N-метил-2тридинкарбоксамщу описаний у Bankston та ін. "А Scaleable Synthesis of BAY 43-9006: A Potent Raf Kinase Inhibitor for the Treatment of Cancer" Org. 17 92472 18 Proc. Res. Dew 2002, 6(6), 777-781. Приклад 2: Одержання 4-{4-(3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду гідрохлориду Сполуку Прикладу 1 у вигляді вільної основи (2,0 г) розчиняють у безводному тетрагідрофурані (15 мл) та додають 4М НСІ/діоксан (надлишок). Потім розчин концентрують у вакуумі з одержанням 2,32 грам брудно-білої твердої речовини. Сиру сіль розчиняють у гарячому етанолі (125 мл), додають активоване вугілля та суміш нагрівають при зрошенні впродовж 15 хвилин. Гарячу суспензію фільтрують через фільтр Celite 521 та залишають охолонути до кімнатної температури. Колбу поміщають у морозильну камеру на ніч. Кристалічну тверду речовину збирають фільтруванням за допомогою водяного насосу, промивають етанолом, потім гексаном та сушать на повітрі. Маточні рідини концентрують та залишають для кристалізації (у морозильній камері) на ніч. Другу партію твердої речовини збирають та об'єднують з першою партією. Безбарвну сіль сушать у вакуумній печі при 60 0C впродовж двох днів. Одержують вихід гідрохлоридної солі 1,72 г (79%). Температура плавлення: 215 C Елементний аналіз: Розраховано Знайдено C 48,57 48,68 H 3,11 2,76 5,54 5,59 Приклад 4: Одержання 4{4-(3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду фенілсульфонату Сполуку Прикладу 1 у вигляді вільної основи (2,25 г) суспендують у етанолі (50 мл) та додають бензолсульфонову кислоту (0,737 г) у етанолі (50 мл). Суміш нагрівають з енергійним перемішуванням. Весь твердий матеріал розчиняється з одержанням червонуватого розчину. Зазначений розчин залишають охолонути до кімнатної температури та колбу затирають. Утворення кристалів повільне, було знайдено декілька зародків, та їх додають до розчину і помішають у морозильну камеру на ніч. Сірувато-жовто-коричнева тверда речовина утворюється у колбі; зазначений матеріал подрібнюють та збирають фільтруванням з відсмоктуванням. Тверду речовину промивають етанолом, потім гексаном та сушать на повітрі. Зважений продукт: 2,05 г, 69 % вихід. Температура плавлення: 213 C Елементний аналіз: Розраховано Знайдено C 50,59 50,24 H 3,30 3,50 N Cl 10,79 13,65 10,60 13,63 S F 14,63 14,88 Приклад 3: Одержання 4{4-(3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фтор-фенокси}піридин-2-карбонової кислоти метиламіду мезилату Сполуку Прикладу 1 у вигляді вільної основи (2,25 г) розчиняють у етанолі (100 мл) та додають вихідний розчин метансульфонової кислоти (надлишок). Далі розчин концентрують у вакуумі з одержанням жовтого масла. Додають етанол та концентрування повторюють, що приводить до одержання 2,41 г брудно-білої твердої речовини. Сиру сіль розчиняють у гарячому етанолі ( 125 мл) та потім повільно охолоджують для кристалізації. Після досягнення кімнатної температури, колбу поміщають у морозильну камеру на ніч. Безбарвний кристалічний матеріал збирають фільтруванням з відсмоктуванням; осад на фільтрі промивають етанолом, потім гексаном та сушать на повітрі, з одержанням 2,05 г матеріалу, який сушать у вакуумній печі при 60 C впродовж ночі. Температура плавлення: 231 C Елементний аналіз: Розраховано Знайдено C 45,64 45,34 H 3,31 3,08 N 9,68 9,44 Cl 6,12 6,08 F 13,13 13,42 S N 8,74 8,54 F 11,86 11,79 Cl 5,53 5,63 5.00 5,16 Приклад 5: Одержання 1+4 твердої дисперсії 4{4-[3-(4-хлор-3-трифторметилфеніл)-уреїдо]-3фторфенокси}-піридин-2-карбонової кислоти метиламіду з полівінілпіролідоном. У незакритій пробірці, одну частину сполуки Прикладу 1 у вигляді вільної основи змішують з чотирма частинами полівінілпіролідону (PVP-25 / Kollidon® 25), та розчиняють у достатній кількості 1:1 суміші ацетону та етанолу, поки весь порошок не перейде у розчин. Незакриту пробірку поміщають у вакуумну піч при 400C, та залишають сохнути на принаймні 24-48 годин. Приклад 6: Одержання 1+3 твердої дисперсії 4{4-[3-(4-хлор-3-трифторметилфеніл)-уреїдо]-3фторфенокси}-піридин-2-карбонової кислоти метиламіду з полівінілпіролідоном. Одну частину сполуки Формули І у вигляді основи та три частини полівінілпіролідону (PVP 25 / Kollidoir 25) розчиняють у 30 частинах 80:20 суміші ацетон/етанол (мас/мас). Використовуючи роторний вакуумний випаровувач, розчинник видаляють при 700C Сухий залишок видаляють з колби випарювання та просіюють (630 мкм). Приклад 7: Одержання 1+7 твердої дисперсії 4{4-13-(4-хлор-3-трифторметилфеніл)-уреїдо]-3фторфенокси}-піридин-2-карбонової кислоти метиламіду з полівінілпіролідоном. Одну частину сполуки Формули І у вигляді основи та сім частин PVP 25 розчиняють у 30 частинах 80:20 суміші ацетон/етанол (мас/мас). Використовуючи роторний вакуумний випаровувач, розчинник видаляють при 700C Сухий залишок видаляють з колби випарювання та просіюють 19 (630 мкм). Приклад 8: Тверда дисперсія 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду з гідроксипропіл-целюлозою (НРС), одержана шляхом екструзії з розплаву. Дві частини сполуки Формули І у вигляді основи змішують з однією частиною мальтитолу (Maltitol) та сімома частинами НРС-М. Суміш екструдують, використовуючи лабораторний двошнековий екструдер при температурі 160-2000C Екструдований матеріал відрізають та далі подрібнюють, використовуючи ударний лабораторний млин. Отриманий порошок може використовуватися у такому вигляді або він може бути додатково сформульований, наприклад, у саше, капсульну або таблеткову композицію. Приклад 9: Тверда дисперсія 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду з PVP та кроскармелозою натрію. Одержують розчин 0,4 кг сполуки Формули І у вигляді основи та 1,2 кг PVP 25 у суміші 6,4 кг ацетону та 1,6 кг етанолу. Використовуючи вакуумний гранулятор з псевдозрідженою фазою, зазначений розчин розбризкують на порошкову основу 1,6 кг кроскармелози натрію при температурі 60-700C Після висушування, продукт просіюють (1 мм). Гранулят може використовуватися у такому вигляді або він може бути додатково сформульований, наприклад, у саше, капсульну або таблеткову композицію. Приклад 10: Тверда дисперсія 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду з PVP та натрію гліколят крохмалю. Зазначений матеріал одержують шляхом, подібним описаному у Прикладі 9, за винятком того, що розчин розбризкують на порошкову основу 1,6 кг натрію гліколяту крохмалю типу А - (Explotab®) Приклад 11: Тверда дисперсія 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду з PVP та кроскармелозою натрію. Одержують розчин 0,4 кг сполуки Формули І у вигляді основи та 1,6 кг PVP 25 у суміші 6.4 кг ацетону та 1,6 кг етанолу. Використовуючи вакуумний гранулятор з псевдозрідженою фазою, зазначений розчин розбризкують на порошкову основу 2 кг кроскармелози натрію при температурі 60-700C Після висушування, продукт просіюють (1 мм). Гранулят може використовуватися у такому вигляді або він може бути додатково сформульований, наприклад, у саше, капсульну або таблеткову композицію. Приклад 12: Тверда дисперсія 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду з PVP, кроскармелозою натрію та мікрокристалічною целюлозою. Зазначений матеріал одержують шляхом, подібним описаному у Прикладі 11, за винятком того, що розчин розбризкують на порошкову основу 1 кг кроскармелози натрію та 1 кг мікрокристалічної целюлози. 92472 20 Приклад 13: Тверда дисперсія 4{4-[3-(4-хлор-3трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду з HPCSL та кроскармелозою натрію. Одержують розчин 0,4 кг сполуки Формули І у вигляді основи та 1,6 кг HPC-SL у 20 кг ацетону. Використовуючи вакуумний гранулятор з псевдозрідженою фазою, зазначений розчин розбризкують на порошкову основу 2 кг кроскармелози натрію при температурі 40-600C Після висушування, продукт просіюють (1 мм). Гранулят може використовуватися у такому вигляді або він може бути додатково сформульований, наприклад, у саше, капсульну або таблеткову композицію. Приклад 14: Тверда дисперсія 4{4-(3-(4-хлор3-трифторметилфеніл)-уреїдо]-3-фторфенокси}піридин-2-карбонової кислоти метиламіду з HPC-L та кроскармелозою натрію. Одержують розчин 0,4 кг сполуки Формули І у вигляді основи та 1,6 кг HPC-L у 28 кг ацетону. Використовуючи вакуумний гранулятор з псевдозрідженою фазою, зазначений розчин розбризкують на порошкову основу 2 кг кроскармелози натрію при температурі 40-600C Після висушування, продукт просіюють (1 мм). Гранулят може використовуватися у такому вигляді або він може бути додатково сформульований, наприклад, у саше, капсульну або таблеткову композицію. Приклад 15: Таблетки, що містять тверду дисперсію 4{4-[3-(4-хлор-3трифторметилфеніл)уреїдо]-3-фторфенокси}-піридин-2-карбонової кислоти метиламіду Гранулят Прикладу 11 ущільнюють прокатуванням та просіюють 3 та 1 мм. Далі стиснений гранулят змішують з 0,54 кг кроскармелози натрію, 24 г колоїдного безводного кремнезему та 36 г стеарату магнію. Цю готову до пресування суміш пресують на ротаційному таблетковому пресі з одержанням таблеток, що містять 20, 50 та 100 мг сполуки Формули І. Таблетки можуть бути покриті плівкою для захисту від світла. Приклад 16: Таблетки, що містять тверду дисперсію 4{4-[3-(4-хлор-3-трифторметилфеніл)уреїдо]-3-фторфенокси}-піридин-2-карбонової кислоти метиламіду Гранулят Прикладу 12 ущільнюють прокатуванням та просіюють 3 та 1 мм. Далі стиснений гранулят змішують з 0,54 кг кроскармелози натрію, 24 г колоїдного безводного кремнезему та 36 г стеарату магнію. Цю готову до пресування суміш пресують на ротаційному таблетковому пресі з одержанням таблеток, що містять 20, 50 та 100 мг сполуки Формули І. Таблетки можуть бути покриті плівкою для захисту від світла. Приклад 17: Таблетки, що містять тверду дисперсію 4{4-[3-(4-хлор-3-трифторметилфеніл)уреїдо]-3-фторфенокси}-піридин-2-карбонової кислоти метиламіду Одержують розчин 0,4 кг сполуки Формули І у вигляді основи та 1,2 кг PVP 25 у суміші 6.4 кг ацетону та 1,6 кг етанолу. Використовуючи вакуумний гранулятор з псевдозрідженою фазою, зазначений розчин розбризкують на порошкову основу 0,8 кг кроскармелози натрію та 0,8 кг мікрокристалічної целюлози при температурі 60-700C Після висушу 21 вання, продукт просіюють (1 мм). Гранулят ущільнюють прокатуванням та просіюють 3 та 1 мм. Далі стиснений гранулят змішують з 1,34 кг кроскармелози натрію, 24 г колоїдного безводного кремнезему та 36 г стеарату магнію. Цю готову до пресування суміш пресують на ротаційному таблетковому пресі з одержанням таблеток, що містять 20, 50 та 100 мг сполуки Формули І. Таблетки можуть бути покриті плівкою для захисту від світла. Приклад 18: Порівняння розчинення лікарських засобів нових фармацевтичних композицій та звичайно використовуваного складу сполуки Формули І. Розчинення лікарських засобів нових фармацевтичних композицій Прикладу 6 та 7 досліджують, використовуючи лопатевий апарат "Apparatus 2" USP 28-NF 23 (The United States Pharmacopoeia USP 28 2005) при температурі 37 ± 0,50C та швидкість обертання лопатей 75 об./хв. 900 мл ацетатного буферу рН 4,5 USP з додаванням 0,1 % (маса/об'єм) лаурил-сульфату натрію як поверхневоактивної речовини використовують як середовище розчинення. Кількість твердої дисперсії, еквівалентної 50 мг сполуки Формули І у вигляді основи, поміщають у кожну посудину. В процесі випробування на розчинність зразки пропускають через фільтр та розчинену кількість речовин лікарського засобу визначають за допомогою УФ спектрометрії. Визначену кількість активної сполуки розраховують як % (мас/мас.) загальної дози (50 мг). На Фігурі 1 розчинення лікарського засобу твердої дисперсії Прикладу 6 та 7 порівнюють з 1+7 фізичною сумішшю сполуки Формули І у вигляді основи з PVP 25, одержаною змішуванням активної речовини та наповнювача у Turbula міксері (звичайно використовуваний склад). Результати показують, що розчинення лікар 92472 22 ського засобу фізичної суміші є повільним та неповним. Через низьку розчинність активної речовини розчинилося тільки приблизно 20 % 50 мг дози. В той час як, тверді дисперсії показують швидке та майже повне рзчинення активної речовини. Приблизно 90% дози, еквівалентної приблизно 45 мг сполуки даного винаходу, розчиняється протягом 1 години, незважаючи на низьку розчинність активної речовини у цьому середовищі (2,3 мг/900 мл при 37°С). Тверді нові с|армацевтичні композиції Прикладу 6 та 7, які містять активну речовину головним чином З аморфній формі, показують явне перенасичення у порівнянні з фізичною сумішшю активної речовини та PVP, та ніякої значної перекристалізації не спостерігається впродовж принаймні 1 години. Через швидке розчинення, сильну здатність утворювати перенасичені розчини та непогану стабільність перенасиченого розчину композиції нової твердої дисперсії даного винаходу вважаються прийнятними для досягнення покращеної абсорбції, біодоступності та ефективності при лікуванні гіперпроліферативних розладів, включаючи рак. Приклад 19: Порівняння пероральної біодоступності декількох звичайно використовуваних складів сполуки Прикладу 1, та нової фармацевтичної композиції Прикладу 5. Одиничну дозу сполук Прикладів 1, 2, 3, 4 та 5 перорально застосовують до кожного з трьох голодних щурів Уістара чоловічої статі (220-250г; 6-8 тижневого віку). Сполуки Прикладів 1-4 застосовують пероральним зондовим введенням у композиції, описаній у ці 1. Тверду дисперсію Прикладу 5 (1,25 мг лікарської речовини у 5 мг PVP-25) застосовують у кількості 9 капсул. Застосовують одну капсулу на щура. Приблизно 0,4 мл цільної крові збирають через постійний яремний катетер у: 0,25, 0,5, 1, 2, 4, 7, 24 та 48 годин після введення дози. Зразки крові центрифугують (приблизно 5 хв.) для того, щоб отримати плазму, яку потім переносять у маркіровані відповідним чином пробірки та зберігають замороженою (-200C) до аналізу на вихідну лікарську речовину. Зразки плазми аналізують за допомогою LC/MS/MS для визначення концентрацій вихідної лікарської речовини та фармакокінетичні параметри розраховують, використовуючи Watson LIMS. 23 92472 24 Таблиця 1 Порівняння пероральних біодоступностей у щурів для різних складів сполуки Формули І Приклад номер 1 2 3 4 5 Доза (мг/кг) 5 5 5 5 5 5 Наповнювач 0,5% тилози у воді 0,5% NaCMC та 0,5% Tween 80 у воді 0,5% NaCMC та 0,5% Tween 80 у воді 0,5% NaCMC та 0,5% Tween 80 у воді 0,5% NaCMC та 0,5% Tween 80 у воді Інкапсульований Доза 5 мг/кг фармацевтичної композиції Прикладу 5 означає 5 мг лікарської речовини (сполука Прикладу 1) на кг маси тіла. Відносні біодоступності у щура розраховують з даних внутрішньовенної болюсної дози 2 мг/кг у тієї ж самої породи щурів, використовуючи розчин активної речовини у наповнювачі Cremophor RH40: етанол: вода (12,5:12,5:75). Експонування плазми у маніпуляторі експонуваеея суспензії у 0,5% тилозному розчині (9,9% F) відображає кристалічну, мікронізовану речовину лікарського засобу з наступними характеристиками: 208 0C (початок), 211 0C (пік), AH = 91,4 Дж/г. Фармацевтична композиція, основана на 1+4 твердій дисперсії сполуки даного винаходу з полівінілпіролідоном (PVP-25, Приклад 5), забезпечує покращену абсорбцію та пероральний вплив у щура, у порівнянні з двома звичайно використовуваними композиціями вільної основи, та трьома звичайно використовуваними композиціями фармацевтично прийнятних солей сполуки Формули І. Приклад 20: Порівняння впливу нової фармацевтичної композиції та звичайно використовуваної композиції сполуки Формули І Одиничні дози сполуки даного винаходу у формі звичайно використовуваної та нової композиції застосовують перорально шляхом зондового введення голодним щурам чоловічої статі (приблизно AUC (0-int) (мг год./л) 17 21,8 12,1 16,8 15,8 42,2 %F 10 13 7 10 10 25 250 г; 3 щури на точку часу). Звичайно використовувана композиція являє собою суспензію мікронізованої сполуки формули І у вигляді основи у водному 0,5% тилозному розчині. Нова композиція являє собою гранулят твердої дисперсії Прикладу 11, який суспендували у воді перед застосуванням. Для звичайно використовуваної композиції дози 2, 10 та 50 мг лікарської речовини /кг маси тіла застосовують у об'ємі 5 мл/кг маси тіла. Для нової композиції Прикладу 11. що містить 10% сполуки даного винаходу, кількість 20, 100 та 500 мг грануляту/кг маси тіла (еквівалентні дозам 2, 10 та 50 мг/кг відповідно) застосовують у 5 мл води/кг маси тіла. Приблизно 0,5 мл цільної крові збирають через постійний яремний катетер у 0,5, 1, 2, 4, 7, 9 та 24 години після введення дози. Зразки крові центрифугують для того, щоб отримати плазму, яку потім переносять у маркіровані відповідним чином пробірки та зберігають замороженою (
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions containing 4-{4-[3-(4-chloro-3-trifluoromethylphenyl)-ureido]-3-fluorophenoxy}-pyridine-2-carboxylic acid methyl amide, process for the preparation of solid dispersion thereof and methods for the treatment with use of said compositions
Автори англійськоюDumas Jacques, Ehrlich Paul, Zuleger Susanne
Назва патенту російськоюФармацевтическая композиция, которая содержит 4-{4-[3-(4-хлор-3-трифторметилфенил)-уреидо]- 3-фторфенокси}-пиридин-2-карбоновой кислоты метиламид (варианты), способ получения твердой дисперсии указанного соединения и способ лечения с применением указанного соединения (варианты)
Автори російськоюДюма Жак, Вехрлих Пауль, Цулегер Сузанна
МПК / Мітки
МПК: A61K 31/44, A61K 9/16, A61P 35/00
Мітки: композиція, спос, містить, одержання, спосіб, кислоти, сполуки, варіанти, фармацевтична, 4-{4-[3-(4-хлор-3-трифторметилфеніл)-уреїдо]-3-фторфенокси}-піридин-2-карбонової, твердої, зазначеної, дисперсії, метиламід
Код посилання
<a href="https://ua.patents.su/13-92472-farmacevtichna-kompoziciya-shho-mistit-4-4-3-4-khlor-3-triftormetilfenil-uredo-3-ftorfenoksi-piridin-2-karbonovo-kisloti-metilamid-varianti-sposib-oderzhannya-tverdo-dispersi-zazna.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить 4-{4-[3-(4-хлор-3-трифторметилфеніл)-уреїдо]-3-фторфенокси}-піридин-2-карбонової кислоти метиламід (варіанти), спосіб одержання твердої дисперсії зазначеної сполуки та спос</a>
Попередній патент: Спосіб плазмоелектричної генерації енергії та плазмоелектрична система для його здійснення (варіанти)
Наступний патент: Канатна дорога та шків тертя для неї
Випадковий патент: Пристрій для вимірювання сил тертя в трибоспряженні вал-втулка паливного насоса












