Новий спосіб синтезу івабрадину і його адитивних солей з фармацевтично прийнятною кислотою
Формула / Реферат
1. Спосіб синтезу івабрадину формули (І):
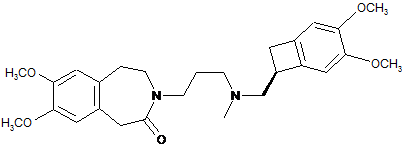 , (I)
, (I)
який відрізняється тим, що сполуку формули (VI):
 , (VI)
, (VI)
піддають реакції лактамізації за присутності зв'язуючої речовини і основи в органічному розчиннику,
щоб одержати івабрадин формули (І), який може бути перетворений на його адитивні солі з фармацевтично прийнятною кислотою, вибраною із соляної кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, янтарної кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензенсульфонової кислоти і камфорної кислоти, і на його гідрати.
2. Спосіб синтезу за п. 1, який відрізняється тим, що зв'язуючу речовину, яку використовують для проведення реакції лактамізації сполуки формули (VI), вибирають із оксалілхлориду, тіонілхлориду, N,N-дициклогексилкарбодііміду (ДЦК), 1-етил-3-(3-диметиламінопропіл)карбодііміду (ЕДКІ), N,N-карбонілдіімідазолу (КДІ), 1-пропанфосфонової кислоти циклічного ангідриду (Т3П) і 1-(метилсульфоніл)-1H-бензотриазолу.
3. Спосіб синтезу за п. 2, який відрізняється тим, що зв'язуюча речовина, яку використовують для проведення реакції лактамізації сполуки формули (VI), являє собою тіонілхлорид.
4. Спосіб синтезу за п. 3, який відрізняється тим, що кількість тіонілхлориду, яку використовують для проведення реакції лактамізації сполуки формули (VI), знаходиться в діапазоні від 1 до 5 еквівалентів, включно.
5. Спосіб синтезу за будь-яким з пп. 1-4, який відрізняється тим, що основа, яку використовують для проведення реакції лактамізації сполуки формули (VI), вибирають з триетиламіну, діізопропілетиламіну і піридину.
6. Спосіб синтезу за п. 5, який відрізняється тим, що основа, яку використовують для проведення реакції лактамізації сполуки формули (VI), являє собою триетиламін.
7. Спосіб синтезу за будь-яким з пп. 1-6, який відрізняється тим, що органічний розчинник, який використовують для проведення реакції лактамізації сполуки формули (VI), вибирають з дихлорметану, тетрагідрофурану, ацетонітрилу, ацетону і толуолу.
8. Спосіб синтезу за п. 7, який відрізняється тим, що органічний розчинник, який використовують для проведення реакції лактамізації сполуки формули (VI), являє собою дихлорметан.
9. Спосіб синтезу за будь-яким з пп. 1-8, який відрізняється тим, що реакцію лактамізації сполуки формули (VI) проводять за температури від 0 °C до 40 °C, включно.
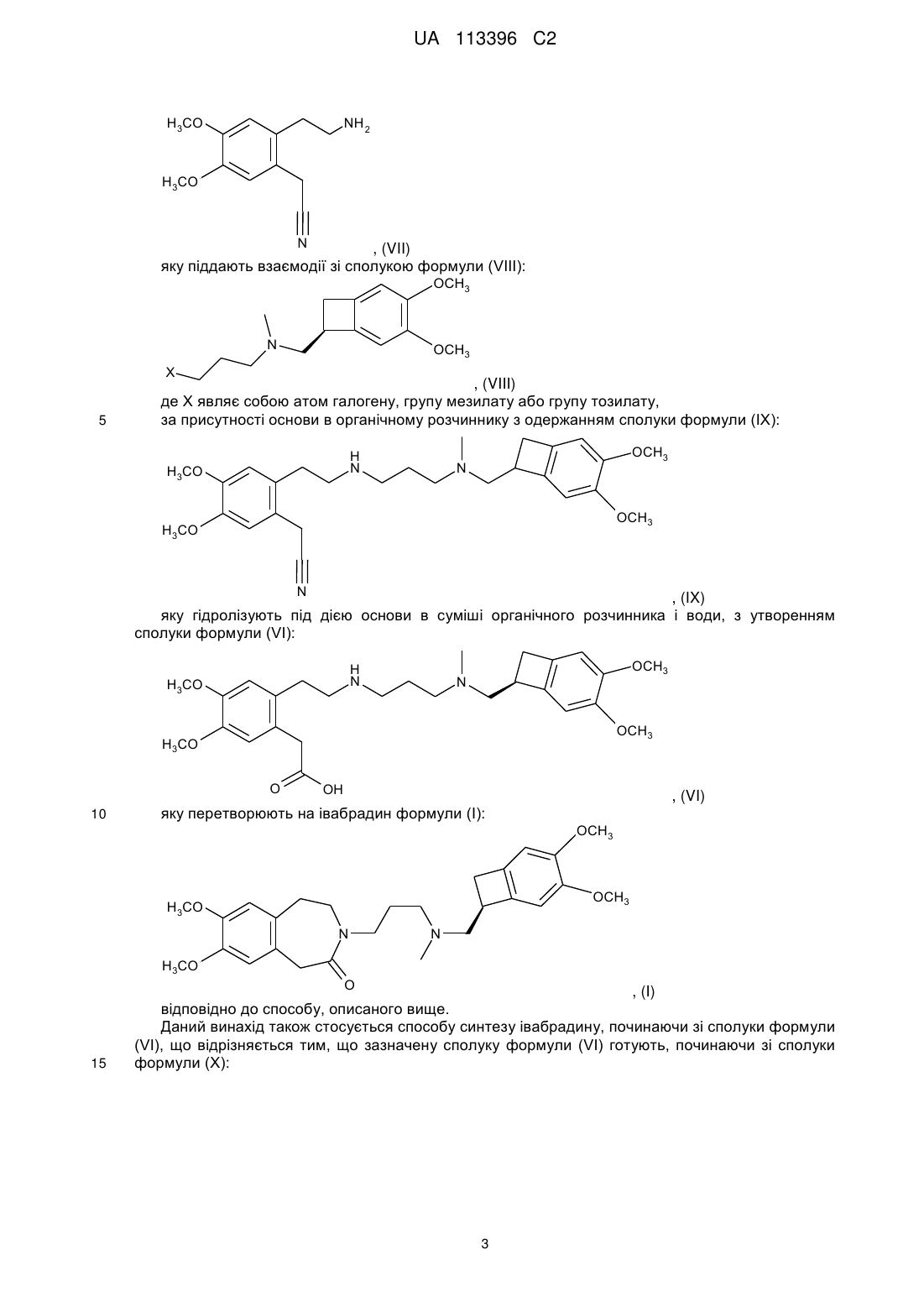
10. Спосіб синтезу за п. 1, який відрізняється тим, що сполуку формули (VI) одержують, починаючи зі сполуки формули (VII):
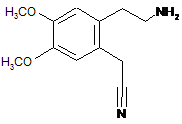 , (VII)
, (VII)
яку піддають взаємодії зі сполукою формули (VIII):
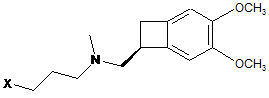 , (VIII)
, (VIII)
де X являє собою атом галогену, групу мезилату або групу тозилату,
за присутності основи в органічному розчиннику з одержанням сполуки формули (IX):
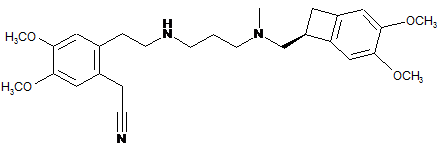 , (IX)
, (IX)
яку гідролізують під дією основи в суміші органічного розчинника і води з утворенням сполуки формули (VI):
 . (VI)
. (VI)
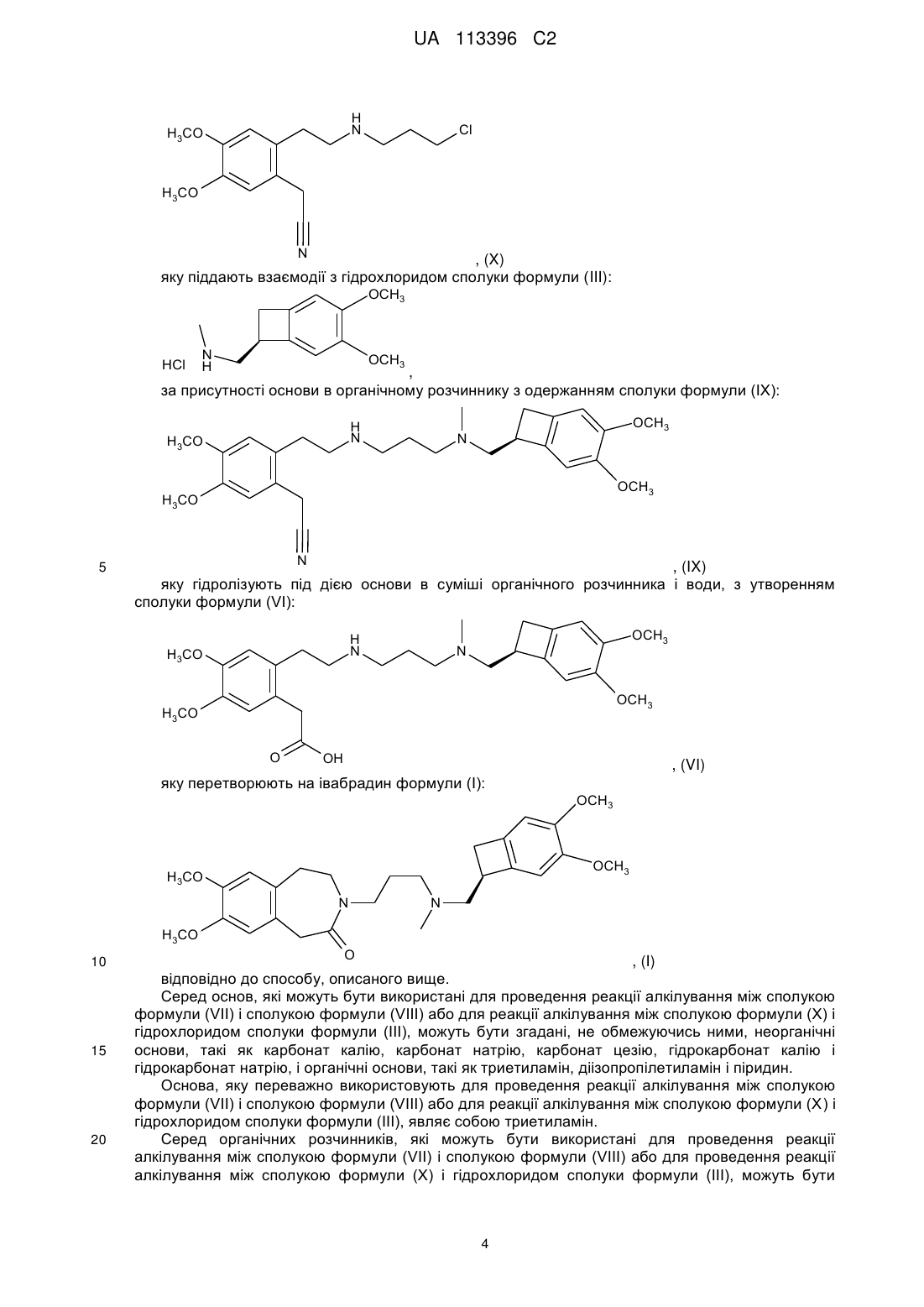
11. Спосіб синтезу за п. 1, який відрізняється тим, що сполуку формули (VI) одержують, починаючи зі сполуки формули (X):
 , (X)
, (X)
яку піддають взаємодії з гідрохлоридом сполуки формули (III):
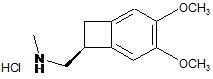 , (III)
, (III)
за присутності основи в органічному розчиннику з одержанням сполуки формули (IX):
 , (IX)
, (IX)
яку гідролізують під дією основи в суміші органічного розчинника і води, з утворенням сполуки формули (VI):
 . (VI)
. (VI)
12. Спосіб синтезу за п. 10 або п. 11, який відрізняється тим, що основу, яку використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), вибирають із карбонату калію, карбонату натрію, карбонату цезію, гідрокарбонату калію, гідрокарбонату натрію, триетиламіну, діізопропілетиламіну і піридину.
13. Спосіб синтезу за п. 12, який відрізняється тим, що основа, яку використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), являє собою триетиламін.
14. Спосіб синтезу за будь-яким з пп. 10-13, який відрізняється тим, що органічний розчинник, який використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), вибирають із ацетонітрилу, ацетону, метилетилкетону (МЕК), диметилформаміду (ДМФ), N-метилпіролідону (N-МП) і диметилсульфоксиду (ДМСО).
15. Спосіб синтезу за п. 14, який відрізняється тим, що органічний розчинник, який використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), являє собою ацетонітрил.
16. Спосіб синтезу за будь-яким з пп. 10-15, який відрізняється тим, що реакцію алкілування між сполукою формули (VII) і сполукою формули (VIII) або реакцію алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III) проводять за температури від 20 °C до 100 °C, включно.
17. Спосіб синтезу за будь-яким з пп. 10-16, який відрізняється тим, що основу, яку використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), вибирають із гідроксиду калію, гідроксиду натрію, гідроксиду літію і гідроксиду барію.
18. Спосіб синтезу за п. 17, який відрізняється тим, що основа, яку використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою гідроксид натрію.
19. Спосіб синтезу за будь-яким з пп. 10-18, який відрізняється тим, що органічний розчинник, який використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою спиртовий розчинник.
20. Спосіб синтезу за п. 19, який відрізняється тим, що спиртовий розчинник, який використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), вибирають з метанолу, етанолу, ізопропанолу і бутанолу.
21. Спосіб синтезу за п. 20, який відрізняється тим, що спиртовий розчинник, який використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою етанол.
22. Спосіб синтезу за будь-яким з пп. 10-21, який відрізняється тим, що гідроліз сполуки формули (IX) для утворення сполуки формули (VI) проводять за температури від 0 °C до 110 °C, включно.
23. Сполука формули (VI):
 . (VI)
. (VI)
24. Сполука формули (IX):
 . (IX)
. (IX)
25. Сполука формули (X):
 . (X)
. (X)
26. Етил N-{2-[2-(ціанометил)-4,5-диметоксифеніл]етил}-b-аланінат оксалат.
27. (2-{2-[(3-гідроксипропіл)аміно]етил}-4,5-диметоксифеніл)ацетонітрил.
Текст
Реферат: Спосіб синтезу івабрадину формули (І): OCH3 OCH3 H3CO N N H3CO O і його адитивних солей з фармацевтично прийнятною кислотою. , (I) UA 113396 C2 (12) UA 113396 C2 UA 113396 C2 Даний винахід стосується способу синтезу івабрадину формули (І): OCH3 OCH3 H3CO N N H3CO O 5 10 15 , (I), або 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]пропіл}7,8-диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-ону, його адитивних солей з фармацевтично прийнятною кислотою і їх гідратів. Івабрадин і його адитивні солі з фармацевтично прийнятною кислотою і, зокрема, його гідрохлорид, мають дуже цінні фармакологічні і терапевтичні властивості, зокрема брадикардичні властивості, які роблять ці сполуки корисними для лікування або профілактики різних клінічних станів ішемії міокарда, таких як стенокардія, інфаркт міокарда і пов'язані порушення серцевого ритму, а також різних патологій, що включають порушення ритму, зокрема суправентрикулярні порушення ритму, і при серцевій недостатності. Приготування і терапевтичне застосування івабрадину і його адитивних солей з фармацевтично прийнятною кислотою, і, зокрема, його гідрохлориду, були описані в описі Європейського патенту ЕР 0 534 859. В описі зазначеного патенту охарактеризовано синтез івабрадину гідрохлориду, починаючи зі сполуки формули (II): OCH3 H N OCH3 , (II) яку розділяють для одержання сполуки формули (III): OCH3 HN 20 OCH3 , (III) яка взаємодіє зі сполукою формули (IV): H3CO N I H3CO O , (IV) з одержанням сполуки формули (V): OCH3 OCH3 H3CO N N H3CO O 25 , (V) каталітична гідрогенація якої дає вихід івабрадину, який потім перетворюється на його гідрохлорид. Недоліком даного шляху синтезу є те, що в результаті відбувається одержання івабрадину з виходом тільки 1 %. 1 UA 113396 C2 З точки зору фармацевтичної цінності даної сполуки, важливою була можливість одержання її за допомогою ефективного способу синтезу, який в результаті дає хороший вихід івабрадину. Даний винахід стосується способу синтезу івабрадину формули (І): OCH3 OCH3 H3CO N N H3CO O 5 , (I) де спосіб відрізняється тим, що сполуку формули (VI): H N H3CO OCH3 N OCH3 H3CO O 10 15 20 25 30 35 OH , (VI) піддають реакції лактамізації за присутності зв'язуючої речовини і основи в органічному розчиннику, щоб одержати івабрадин формули (І), який може бути перетворений на його адитивні солі з фармацевтично прийнятною кислотою, вибраною із соляної кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, янтарної кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензенсульфонової кислоти і камфорної кислоти, і на його гідрати. Серед зв'язуючих речовин, які можуть бути використані для реакції лактамізації сполуки формули (VI), можуть бути згадані, не обмежуючись ними, наступні реагенти: оксалілхлорид, тіонілхлорид, N,N-дициклогексилкарбодіімід (ДЦК)>1-етил-3-(3-диметиламінопропіл)карбодіімід (ЕДКІ), N,N-карбонілдіімідазол (КДІ), 1-пропанфосфонової кислоти циклічний ангідрид (Т3П) і 1(метилсульфоніл)-1Н-бензотриазол. Речовина, що зв'язує, яка переважно використовується для реакції лактамізації сполуки формули (VI), являє собою тіонілхлорид. Кількість тіонілхлориду, яка переважно використовується для проведення реакції лактамізації сполуки формули (VI), знаходиться в діапазоні від 1 до 5 еквівалентів, включно. Серед основ, які можуть використовуватись для проведення реакції лактамізації сполуки формули (VI), можуть бути згадані, не обмежуючись ними, триетиламін, діізопропілетиламін і піридин. Основа, яка переважно використовується для проведення реакції лактамізації сполуки формули (VI), являє собою триетиламін. Серед органічних розчинників, які можуть використовуватись для проведення реакції лактамізації сполуки формули (VI), можуть бути згадані, не обмежуючись ними, дихлорметан, тетрагідрофуран, ацетонітрил, ацетон і толуол. Органічним розчинником, який переважно використовується для проведення реакції лактамізації сполуки формули (VI), є дихлорметан. Реакцію лактамізації сполуки формули (VI) переважно проводять при температурі від 0 °C до 40 °C, включно. Даний винахід також стосується способу синтезу івабрадину, починаючи зі сполуки формули (VI), де спосіб відрізняється тим, що зазначену сполуку формули (VI) одержують, починаючи зі сполуки формули (VII): 2 UA 113396 C2 H3CO NH 2 H3CO N , (VII) яку піддають взаємодії зі сполукою формули (VIII): OCH3 N OCH3 X 5 , (VIII) де X являє собою атом галогену, групу мезилату або групу тозилату, за присутності основи в органічному розчиннику з одержанням сполуки формули (IX): H N H3CO OCH3 N OCH3 H3CO N , (IX) яку гідролізують під дією основи в суміші органічного розчинника і води, з утворенням сполуки формули (VI): H N H3CO OCH3 N OCH3 H3CO O 10 OH , (VI) яку перетворюють на івабрадин формули (І): OCH3 OCH3 H3CO N N H3CO O 15 , (I) відповідно до способу, описаного вище. Даний винахід також стосується способу синтезу івабрадину, починаючи зі сполуки формули (VI), що відрізняється тим, що зазначену сполуку формули (VI) готують, починаючи зі сполуки формули (X): 3 UA 113396 C2 H N H3CO Cl H3CO N , (X) яку піддають взаємодії з гідрохлоридом сполуки формули (III): OCH3 HCl N H OCH3 , за присутності основи в органічному розчиннику з одержанням сполуки формули (IX): H N H3CO OCH3 N OCH3 H3CO 5 N , (IX) яку гідролізують під дією основи в суміші органічного розчинника і води, з утворенням сполуки формули (VI): H N H3CO OCH3 N OCH3 H3CO O OH , (VI) яку перетворюють на івабрадин формули (І): OCH3 OCH3 H3CO N N H3CO 10 15 20 O , (I) відповідно до способу, описаного вище. Серед основ, які можуть бути використані для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), можуть бути згадані, не обмежуючись ними, неорганічні основи, такі як карбонат калію, карбонат натрію, карбонат цезію, гідрокарбонат калію і гідрокарбонат натрію, і органічні основи, такі як триетиламін, діізопропілетиламін і піридин. Основа, яку переважно використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), являє собою триетиламін. Серед органічних розчинників, які можуть бути використані для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для проведення реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), можуть бути 4 UA 113396 C2 5 10 15 20 25 30 35 40 45 50 55 згадані, не обмежуючись ними, ацетонітрил, ацетон, метилетилкетон (МЕК), диметилформамід (ДМФ), N-метилпіролідон (N-МП) і диметилсульфоксид (ДМСО). Органічним розчинником, який переважно використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), є ацетонітрил. Реакцію алкілування між сполукою формули (VII) і сполукою формули (VIII) або реакцію алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III) переважно проводять при температурі від 20 °C до 100 °C, включно. Серед основ, які можуть бути використані для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), можуть бути згадані, не обмежуючись ними, гідроксид калію, гідроксид натрію, гідроксид літію і гідроксид барію. Основа, яку переважно використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою гідроксид натрію. Органічний розчинник, який переважно використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою спиртовий розчинник. Серед спиртових розчинників, які можуть бути використані для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), можуть бути згадані, не обмежуючись ними, метанол, етанол, ізопропанол і бутанол. Спиртовий розчинник, який переважно використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою етанол. Гідроліз сполуки формули (IX) для утворення сполуки формули (VI) переважно проводять при температурі від 0 °C до 110 °C, включно. Сполуки з формулами (VI), (IX) і (X), а також 3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5триєн-7-іл]метил}(метил)аміно]-1-пропанол, етил N-{2-[2-(ціанометил)-4,5диметоксифеніл]етил}--аланінат оксалат і (2-{2-[(3-гідроксипропіл)аміно]етил}-4,5диметоксифеніл)ацетонітрил є новими сполуками для використання як проміжних продуктів синтезу в хімічній або фармацевтичній галузі, зокрема в синтезі івабрадину, його адитивних солей з фармацевтично прийнятною кислотою і його гідратів, і як такі є невід'ємною частиною даного винаходу. Список скорочень, які використовуються: ДМФ: диметилформамід ДМСО: диметилсульфоксид ЯМР: Ядерний магнітний резонанс т. пл.: температура плавлення ТГФ: тетрагідрофуран Спектр ЯМР реєструють на апараті Bruker за частоти 400 МГц для протонних спектрів і за частоти 100 МГц для вуглецевих спектрів. Хімічні зсуви виражають в термінах частин на мільйон (внутрішній стандарт: ТМС). Наступні скорочення використовуються для опису піків: синглет (с), дублет (д), дублет дублетів (дд), триплет (т), квадруплет (к), мультиплет (м). Приклади, наведені нижче в цьому документі, ілюструють винахід. Приготування А: N-[2-(3,4-диметоксифеніл)етил]-2,2,2-трифторацетамід До розчину 2-(3,4-диметоксифеніл)етанаміну (50 г, 276 ммоль) в 350 мл етилацетату, який перемішують за температури навколишнього середовища, додають краплями розчин трифтороцтового ангідриду (46,1 мл, 330 ммоль) в 40 мл етилацетату. Після контактування протягом 1 години за температури навколишнього середовища суміш гідролізують, використовуючи 100 мл води. Органічну фазу промивають сумішшю води/триетиламіну (100 мл/38,5 мл) і 100 мл насиченого водного розчину NaCl, а потім висушують над MgSO 4 і піддають висушуванню для одержання 65,8 г твердої речовини бежевого кольору, яка відповідає зазначеній в заголовку сполуці. Вихід: 86 % т. пл.: 93 °C 1 Н ЯМР (CDCl3, 400 МГц): 2,86 частин на мільйон (2Н, т) - 3,62 частин на мільйон (2Н, к) 3,89 частин на мільйон (6Н, с) - 6,52 частин на мільйон (NH) - 6,71 частин на мільйон і 6,84 частин на мільйон (3Н, м). 13 С ЯМР (CDCl3, 100 МГц): 34,4 частин на мільйон (СН2) - 41,3 частин на мільйон (СН2) - 55,8 частин на мільйон (2СН3) - 111,6 частин на мільйон і 111,8 частин на мільйон (2СН) - 115,8 1 19 13 частин на мільйон (CF3, к, J( F- С)=288 Гц) - 120,7 частин на мільйон (1СН) - 130,0 частин на 5 UA 113396 C2 5 10 15 20 25 30 35 40 45 50 55 мільйон, 147,9 частин на мільйон і 149,1 частин на мільйон (3 Cq) - 157,5 частин на мільйон 2 19 13 (С=О, J( F- C)=37 Гц. Приготування Б: N-{2-[2-(хлорметил)-4,5-диметоксифеніл]етил}-2,2,2-трифторацетамід У тригирлій колбі змішують N-[2-(3,4-диметоксифеніл)етил]-2,2,2-трифторацетамід (35 г, 126 ммоль) і 37 % водний формальдегід (776 мл, 1,014 моль) в 120 мл дихлорметану за температури 0 °C. До одержаної двофазної суміші повільно додають, за температури 0 °C, 345 мл водного 37 % розчину соляної кислоти і нагрівають до температури 40 °C. Після контактування протягом 3 годин суміш гідролізують, використовуючи 250 мл води, і промивають водну фазу дихлорметаном (2×100 мл). Об'єднують органічні фази, висушують їх над MgSO 4 і проводять висушування in vacuo для одержання меренги бежевого кольору (38,2 г). Одержаний продукт перекристалізовують із толуолу для одержання 31,5 г білого порошку, який відповідає зазначеній в заголовку сполуці. Вихід: 77 % т. пл.: 140 °C 1 Н ЯМР (CDCl3, 400 МГц): 2,89 частин на мільйон (2Н, т) - 3,58 частин на мільйон (2Н, к) 3,79 частин на мільйон (3Н, с) - 3,81 частин на мільйон (3Н, с) - 4,54 частин на мільйон (2Н, с) 6,45 частин на мільйон (NH) - 6,60 частин на мільйон (1Н, с) - 6,77 частин на мільйон (1Н, с). 13 С ЯМР (CDCl3, 100 МГц): 31,0 частин на мільйон (СН2) - 40,8 частин на мільйон (СН2) - 44,4 частин на мільйон (СН2) - 55,9 частин на мільйон (СН3) - 56,0 частин на мільйон (СН3) - 112,7 1 19 частин на мільйон (СН) - 113,6 частин на мільйон (СН) - 115,8 частин на мільйон (CF3, к, J( F13 C)=288 Гц) - 127,7 частин на мільйон, 129,1 частин на мільйон, 148,0 частин на мільйон і 150,0 2 19 13 частин на мільйон (4 Cq) - 157,6 частин на мільйон (С=О, J( F- С)=37 Гц). Приготування В: N-{2-[2-(ціанометил)-4,5-диметоксифеніл]етил}-2,2,2-трифторацетамід У тригирлій колбі перемішують за температури навколишнього середовища суспензію ціаніду натрію (9,8 г, 200 ммоль) в 160 мл ДМСО. Додають до суспензії краплями розчин N-{2-[2(хлорметил)-4,5-диметоксифеніл]етил}-2,2,2-трифторацетаміду (26 г, 798 ммоль) в 80 мл ДМСО. Після контактування протягом 1 години 30 хвилин за температури навколишнього середовища суміш гідролізують, використовуючи 300 мл води, і екстрагують суміш дихлорметаном (3×150 мл). Об'єднують органічні фази і промивають їх 10 % водним розчином NaOAc (150 мл) і насиченим водним розчином NaCl (4×150 мл), потім висушують їх над MgSO 4 і проводять висушування in vacuo. Одержаний продукт перекристалізовують із толуолу (66 мл) для одержання 12,8 г білого порошку, який відповідає зазначеній в заголовку сполуці. Вихід: 51 % т. пл.: 131 °С 1 Н ЯМР (ДМСО, 400 МГц): 2,78 частин на мільйон (2Н, т) - 3,38 частин на мільйон (2Н, к) 3,73 частин на мільйон (6Н, с) - 3,91 частин на мільйон (2Н, с) - 6,80 частин на мільйон (1Н, с) 6,95 частин на мільйон (1Н, с) - 9,52 частин на мільйон (NH, т). 13 С ЯМР (ДМСО, 100 МГц): 19,8 частин на мільйон (СН2) - 31,0 частин на мільйон (СН2) 39,6 частин на мільйон (СН2) - 55,4 частин на мільйон (СН3) - 55,5 частин на мільйон (СН3) 113,1 частин на мільйон (СН) - 113,7 частин на мільйон (СН) - 115,9 частин на мільйон (CF3, к, 1 19 13 J( F- C)=288 Гц) - 119,3 частин на мільйон, 121,2 частин на мільйон, 129,0 частин на мільйон, 2 19 147,5 частин на мільйон і 148,2 частин на мільйон (5 Cq) - 156,2 частин на мільйон (С=О, J( F13 C)=36 Гц. Приготування Г: [2-(2-аміноетил)-4,5-диметоксифеніл]ацетонітрил Нагрівають за температури 50 °C суміш N-{2-[2-(ціанометил)-4,5-диметоксифеніл]етил}2,2,2-трифторацетаміду (20,5 г, 64,8 ммоль), етанолу (160 мл), карбонату калію (13,2 г, 97,2 ммоль) і води (40 мл). Після контактування протягом 1 години 30 хвилин суміш екстрагують шляхом додавання 200 мл дихлорметану і 100 мл насиченого водного розчину NaCl. Водну фазу екстрагують з 100 мл дихлорметану. Об'єднують органічні фази, промивають їх насиченим водним розчином NaCl (100 мл), висушують їх над MgSO 4 і проводять висушування in vacuo для одержання 10 г жовтого масла, яке відповідає зазначеній в заголовку сполуці. Вихід: 70 % т. пл.: 78 °C 1 Н ЯМР (ДМСО, 400 МГц): 2,61 частин на мільйон (2Н, м) - 2,72 частин на мільйон (2Н, м) 3,40 до 3,00 (NH2+HDO) - 3,72 частин на мільйон (3Н, с) - 3,73 частин на мільйон (3Н, с) - 3,90 частин на мільйон (2Н, с) - 6,81 частин на мільйон (1Н, с) - 6,92 частин на мільйон (1Н, с) 6 UA 113396 C2 13 5 10 15 20 25 30 35 40 45 50 55 60 С ЯМР (ДМСО, 100 МГц): 20,0 частин на мільйон (СН2) - 35,9 частин на мільйон (СН2) 42,9 частин на мільйон (СН2) - 55,5 частин на мільйон (СН3) - 55,6 частин на мільйон (СН3) 113,0 частин на мільйон (СН) - 113,7 частин на мільйон (СН) - 119,6 частин на мільйон, 121,0 частин на мільйон, 131,0 частин на мільйон, 147,1 частин на мільйон і 148,3 частин на мільйон (5 Cq). Приготування Д: 3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]-1-пропанол Нагрівають, за температури 50 °C, суміш [(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн7-іл]-N-метилметанамін гідрохлориду (20 г, 82 ммоль), триетиламіну (34,2 мл, 246 ммоль) і 3бромо-1-пропанолу (14,8 г, 107 ммоль) в 100 мл ТГФ з 5 % ДМФ. Після контактування протягом 24 годин суміш гідролізують, використовуючи 80 мл води, і екстрагують з 80 мл дихлорметану. Промивають органічну фазу насиченим водним розчином NaCl (5×60 мл), висушують її над MgSO4 і проводять висушування для одержання 23,7 г жовтого масла, яке відповідає зазначеній в заголовку сполуці. Вихід: 96 % 1 Н ЯМР (CDCl3, 400 МГц): 1,66 частин на мільйон (2Н, м) - 2,31 частин на мільйон (3Н, с) 2,50 до 2,70 частин на мільйон (5Н, м) - 3,21 частин на мільйон (1Н, дд) - 3,54 частин на мільйон (1Н, м) - 3,77 частин на мільйон (6Н, с і 2Н, м) - 6,62 частин на мільйон (1Н, с) - 6,69 частин на мільйон (1Н, с). 13 С ЯМР (CDCl3, 100 МГц): 27,7 частин на мільйон (СН2) - 34,8 частин на мільйон (СН2) - 40,4 частин на мільйон (СН) - 42,3 частин на мільйон (СН3) - 56,2 частин на мільйон (СН3) - 56,3 частин на мільйон (СН3) - 59,1 частин на мільйон (СН2) - 62,8 частин на мільйон (СН2) - 64,9 частин на мільйон (СН2) - 106,7 частин на мільйон (СН) - 107,4 частин на мільйон (СН) - 134,8 частин на мільйон, 138,5 частин на мільйон, 140,4 частин на мільйон і 149,9 частин на мільйон (4Cq). Приготування Є: 3-хлор-N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-1пропанамін До суміші 3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]-1пропанолу (20,8 г, 78,4 ммоль) і триетиламіну (11 мл, 78,9 ммоль) в 200 мл дихлорметану додають, за температури навколишнього середовища, 8,65 мл тіонілхлориду (157 ммоль). Після контактування протягом 3 годин за температури 40 °C суміш гідролізують, використовуючи 150 мл води і 30 мл 1 н. водного розчину NaOH. Коректують рівень рН водної фази до 10, використовуючи 10 н. водний розчин NaOH, і екстрагують з 50 мл дихлорметану. Об'єднують органічні фази і промивають їх насиченим водним розчином Na 2CO3 (100 мл), висушують їх над MgSO4 і проводять висушування in vacuo для одержання 19,8 г масла коричневого кольору, яке відповідає зазначеній в заголовку сполуці. Вихід: 89 % 1 Н ЯМР (CDCl3) 400 МГц): 1,90 частин на мільйон (2Н, м) - 2,28 частин на мільйон (3Н, с) 2,65 частин на мільйон (3Н, м) - 2,68 частин на мільйон (2Н, м) - 3,19 частин на мільйон (1Н, дд) - 3,54 частин на мільйон (1Н, м) - 3,56 частин на мільйон (2Н, т) - 3,78 частин на мільйон (6Н, с) 6,62 частин на мільйон (1Н, с) - 6,66 частин на мільйон (1Н, с). 13 С ЯМР (CDCl3, 100 МГц): 30,2 частин на мільйон (СН2) - 35,0 частин на мільйон (СН2) - 40,6 частин на мільйон (СН) - 42,6 частин на мільйон (СН3) - 43,1 частин на мільйон (СН2) - 54,8 частин на мільйон (СН2) - 56,2 частин на мільйон (СН3) - 56,3 (СН3) - 62,0 частин на мільйон (СН2) - 106,8 частин на мільйон (СН) - 107,4 частин на мільйон (СН) - 135,0 частин на мільйон, 135,0 частин на мільйон, 149,3 частин на мільйон і 149,9 частин на мільйон (4Cq). Приготування Е: 3-хлор-N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-1пропанамін оксалат До розчину 3-хлор-N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил1-пропанаміну (19,8 г, 69,8 ммоль) в 60 мл нагрітого до кипіння етилацетату додають розчин щавлевої кислоти (6,91 г, 76,7 ммоль) в 60 мл етанолу. Осадження із суміші відбувається протягом контакту під час кипіння. Після повернення до температури навколишнього середовища суміш фільтрують і промивають 20 мл етанолу для одержання 17,35 г коричневого порошку, який відповідає зазначеній в заголовку сполуці. Вихід: 67 % т. пл.: 154 °C 1 Н ЯМР (ДМСО, 400 МГц): 2,14 частин на мільйон (2Н, м) - 2,75 частин на мільйон (3Н, с) 2,88 частин на мільйон (1Н, дд) - 3,12 частин на мільйон (2Н, м) - 3,16 частин на мільйон (1Н, 7 UA 113396 C2 5 10 15 20 25 30 35 40 45 50 55 дд) - 3,28 частин на мільйон (1Н, дд) - 3,41 частин на мільйон (1Н, дд) - 3,69 до 3,75 частин на мільйон (9Н, м) - 6,79 частин на мільйон (1Н, с) - 6,86 частин на мільйон (1Н, с) - 9,21 частин на мільйон (2ОН). 13 С ЯМР (ДМСО, 100 МГц): 26,8 частин на мільйон (СН2) - 35,0 частин на мільйон (СН2) 37,5 частин на мільйон (СН) - 40,1 частин на мільйон (СН2) - 42,6 частин на мільйон (СН2) - 53,1 частин на мільйон (СН2) - 55,8 частин на мільйон (СН3) - 55,9 частин на мільйон (СН3) - 58,6 частин на мільйон (СН2) - 107,6 частин на мільйон (СН) - 108,0 частин на мільйон (СН) - 134,2 частин на мільйон, 135,7 частин на мільйон, 149,3 частин на мільйон і 150,2 частин на мільйон (4 Cq) - 164,4 частин на мільйон (С=О). Приготування Ж: Етил N-{2-[2-(ціанометил)-4,5-диметоксифеніл]етил}--аланінат оксалат Суміш [2-(2-аміноетил)-4,5-диметоксифеніл]ацетонітрилу (6,5 г, 29,5 ммоль) та етил акрилату (3,9 мл, 36 ммоль, 1,2 екв.) в 120 мл етанолу перемішують протягом 20 годин за температури навколишнього середовища. Реакційну суміш піддають висушуванню in vacuo, потім неочищену реакційну суміш переносять в суміш етилацетату (133 мл) і етанолу (13 мл) і нагрівають до кипіння за присутності щавлевої кислоти (2,52 г, 28 ммоль, 0,95 екв.). Осадження із суміші відбувається протягом контакту під час кипіння. Після повернення до температури навколишнього середовища суміш фільтрують і промивають 19 мл етилацетату для одержання білого порошку (9 г), який відповідає зазначеній в заголовку сполуці. Вихід: 74 % т. пл.: 218 °C 1 Н ЯМР (CDCl3, 400 МГц): 1,19 частин на мільйон (3Н, т) - 2,74 частин на мільйон (2Н, т) 2,88 частин на мільйон (2Н, м) - 3,06 частин на мільйон (2Н, м) - 3,17 частин на мільйон (2Н, т) 3,74 частин на мільйон (3Н, с) - 3,75 частин на мільйон (3Н, с) - 3,93 частин на мільйон (2Н, с) 4,09 частин на мільйон (2Н, квадруплет) - 6,88 частин на мільйон (1Н, с) - 6,97 частин на мільйон (1Н, с). 13 С ЯМР (CDCl3, 100 МГц): 14,00 частин на мільйон (СН3) - 19,86 частин на мільйон (СН2) 28,28 частин на мільйон (СН2) - 30,39 частин на мільйон (СН2) - 42,25 частин на мільйон (СН2) 47,19 частин на мільйон (СН2) - 55,60 частин на мільйон (СН3) - 55,62 частин на мільйон (СН3) 60,53 частин на мільйон (СН2) - 113,13 частин на мільйон (СН) - 113,74 частин на мільйон (СН) 119,36 частин на мільйон (Cq) - 121,40 частин на мільйон (Cq) - 127,70 частин на мільйон (Cq) 147,73 частин на мільйон (Cq) - 148,42 частин на мільйон (Cq) - 164,65 частин на мільйон (Cq) 170,29 частин на мільйон (Cq). Приготування З: (2-{2-[(3-гідроксипропіл)аміно]етил}-4,5-диметоксифеніл)ацетонітрил До суспензії 10,8 г NaBH4 (284 ммоль, 11 екв.) в 110 мл ТГФ додають декілька разів за певний період часу етил N-{2-[2-(ціанометил)-4,5-диметоксифеніл]етил}--аланінат оксалат (10,6 г, 25,9 ммоль). Перемішування проводять протягом 30 хвилин за температури навколишнього середовища, а потім 23,1 мл метанолу (570 ммоль, 22 екв.) виливають у суміш краплями. Суміш нагрівають протягом 16 годин за температури 60 °C, а потім гідролізують, використовуючи 100 мл 5 н. соляної кислоти. Потім додають 100 мл дихлорметану і 200 мл демінералізованої води. Після розділення фаз до водної фази додають 50 мл 10 н. розчину гідроксиду натрію (рН>10) і екстрагування проводять, використовуючи 3×70 мл дихлорметану. Органічні фази об'єднують і промивають розчином 2×75 мл насиченого водного NaCl, а потім висушують над MgSO4. Після проведення висушування in vacuo одержують 6,15 г безбарвного масла, яке відповідає зазначеній в заголовку сполуці. Вихід: 85 % 1 Н ЯМР (CDCl3, 400 МГц): 1,54 частин на мільйон (2Н, квінтуплет) - 2,59 частин на мільйон (2Н, т) - 2,66 частин на мільйон (4Н, м) - 3,44 частин на мільйон (2Н, т) - 3,72 частин на мільйон (3Н, с) - 3,73 частин на мільйон (3Н, с) - 3,88 частин на мільйон (2Н, с) - 6,82 частин на мільйон (1Н, с) - 6,91 частин на мільйон (1Н, с). 13 С ЯМР (CDCl3, 100 МГц): 19,96 частин на мільйон (СН2) - 32,44 частин на мільйон (СН2) 32,69 частин на мільйон (СН2) - 46,73 частин на мільйон (СН2) - 50,58 частин на мільйон (СН2) 55,51 частин на мільйон (СН3) - 55,59 частин на мільйон (СН3) - 59,62 частин на мільйон (СН2) 112,98 частин на мільйон (СН) - 113,65 частин на мільйон (СН) - 119,54 частин на мільйон (Cq) 120,92 частин на мільйон (Cq) - 131,27 частин на мільйон (Cq) - 147,03 частин на мільйон (Cq) 148,23 частин на мільйон (Cq). Приготування І: (2-{2-[(3-хлорпропіл)аміно]етил}-4,5-диметоксифеніл)ацетонітрил 8 UA 113396 C2 5 10 15 20 25 30 35 40 45 50 55 60 До суміші 2-{2-[(3-гідроксипропіл)аміно]етил}-4,5-диметоксифеніл)ацетонітрилу (1,7 г, 6,1 ммоль) і триетиламіну (2,5 мл, 18,3 ммоль, 3 екв.) в 16 мл дихлорметану додають, шляхом вливання краплями, розчин, що складається з 885 мкл тіонілхлориду (12,2 ммоль, 2 екв.) і 1 мл дихлорметану. Суміш нагрівають протягом 2 годин за температури 40 °C, а потім, відразу після повернення до температури навколишнього середовища, гідролізують, використовуючи 15 мл демінералізованої води. Після перемішування протягом ночі за температури навколишнього середовища додають 3 мл 10 н. водного розчину гідроксиду натрію (рН>10). Після розділення фаз органічну фазу видаляють і зберігають. Водну фазу екстрагують з 20 мл дихлорметану. Органічні фази об'єднують і промивають 25 мл насиченого водного розчину NaCl, а потім висушують над MgSO4. Після проведення висушування in vacuo одержують 1,5 г масла коричневого кольору, яке відповідає зазначеній в заголовку сполуці. Вихід: 83 % 1 Н ЯМР (CDCl3, 400 МГц): 1,91 частин на мільйон (2Н, квінтуплет) - 2,75 частин на мільйон (2Н, м) - 2,77 частин на мільйон (2Н, м) - 2,83 частин на мільйон (2Н, м) - 3,59 частин на мільйон (2Н, т) - 3,71 частин на мільйон (2Н, с) - 3,86 частин на мільйон (3Н, с) - 3,87 частин на мільйон (3Н, с) - 6,71 частин на мільйон (1Н, с) - 6,84 частин на мільйон (1Н, с). 13 С ЯМР (CDCl3, 100 МГц): 21,11 частин на мільйон (СН2) - 32,73 частин на мільйон (СН2) 33,16 частин на мільйон (СН2) - 43,04 частин на мільйон (СН2) - 46,88 частин на мільйон (СН2) 50,45 частин на мільйон (СН2) - 56,03 частин на мільйон (СН3) - 56,08 частин на мільйон (СН3) 112,17 частин на мільйон (СН) - 113,08 частин на мільйон (СН) - 118,20 частин на мільйон (СН) 120,02 частин на мільйон (Cq) - 130,19 частин на мільйон (Cq) - 147,72 частин на мільйон (Cq) 148,74 частин на мільйон (Cq). Приклад 1: {2-[2-({3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл}аміно)етил]-4,5-диметоксифеніл}ацетонітрил Перший варіант Суміш 3-хлор-N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-1пропанамін оксалату (15 г, 40,1 ммоль) і 85 мл 1 н. водного розчину NaOH в 150 мл дихлорметану перемішують протягом 1 години за температури навколишнього середовища. Суміш розділяють і органічну фазу висушують над MgSO 4, і піддають висушуванню in vacuo для одержання 11,3 г масла жовтогарячого кольору, яке відповідає 3-хлор-N-{[(7S)-3,4диметоксибіцикло-[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-1-пропанаміну. Одержаний вище продукт перемішують за температури навколишнього середовища за присутності йодистого калію (1,46 г, 8,78 ммоль) в 200 мл ацетонітрилу. До одержаної суміші додають, послідовно, триетиламін (5,6 мл, 40,2 ммоль), а потім [2-(2-аміноетил)-4,5диметоксифеніл]ацетонітрил (8,82 г, 40,1 ммоль) розчиняють в 50 мл ацетонітрилу. Після контактування протягом 24 годин за температури 60 °C додають 150 мл води і суміш екстрагують шляхом додавання дихлорметану (150 мл). Органічну фазу промивають 185 мл води і 15 мл водного 37 % розчину соляної кислоти. Водну фазу збирають, додають 185 мл насиченого водного розчину NaHCO3 і одержану в результаті фазу екстрагують з 150 мл дихлорметану. Органічну фазу висушують над MgSO 4 і піддають висушуванню для одержання 14,1 г масла жовтогарячого кольору, яке відповідає зазначеній в заголовку сполуці. Вихід: 75 % Другий варіант Суміш (2-{2-[(3-хлорпропіл)аміно]етил}-4,5-диметоксифеніл)ацетонітрилу (870 мг, 2,93 ммоль), 1-[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-N-метил-метанамін гідрохлориду (714 мг, 2,93 ммоль) і триетиламіну (1,25 мл, 8,97 ммоль, 3 екв.) в 10 мл ацетонітрилу нагрівають до кипіння протягом 6 годин. Після повернення до температури навколишнього середовища суміш фільтрують in vacuo. Фільтрат висушують над MgSO4 і піддають висушуванню in vacuo для одержання меренги коричневого кольору (0,9 г, 66 %), яка відповідає зазначеній в заголовку сполуці. Вихід: 66 % 1 Н ЯМР (CDCl3, 400 МГц): 2,10 частин на мільйон (12Н, с) - 2,45 частин на мільйон (2Н, м) 2,84 до 2,94 частин на мільйон (2Н, м) - 3,10 до 3,60 частин на мільйон (10Н, м) 3,80 частин на мільйон (6Н, м) - 4,36 частин на мільйон (NH, с) - 6,56 частин на мільйон (1Н, с) - 6,69 частин на мільйон (1Н, с) - 6,78 частин на мільйон (1Н, с) - 6,83 частин на мільйон (1Н, с). 13 С ЯМР (CDCl3, 100 МГц): 21,3 частин на мільйон (СН2) - 21,8 частин на мільйон (СН2) - 29,0 частин на мільйон (СН2) - 36,2 частин на мільйон (СН2) - 37,5 частин на мільйон (СН) - 40,7 частин на мільйон (СН3) - 45,6 частин на мільйон (СН2) - 48,6 частин на мільйон (СН2) - 55,1 частин на мільйон (СН2) - 56,1 частин на мільйон (СН3) - 56,2 частин на мільйон (СН3) - 56,4 9 UA 113396 C2 5 10 15 20 25 30 35 40 45 50 55 частин на мільйон (СН3) - 56,6 частин на мільйон (СН3) - 60,1 частин на мільйон (СН2) - 107,1 частин на мільйон (СН) - 107,3 частин на мільйон (СН) - 112,7 частин на мільйон (СН) - 113,6 частин на мільйон (СН) - 119,0 частин на мільйон, 120,8 частин на мільйон, 126,7 частин на мільйон, 134,1 частин на мільйон, 134,2 частин на мільйон, 148,5 частин на мільйон, 149,2 частин на мільйон, 149,9 частин на мільйон і 150,9 частин на мільйон (9Cq). Приклад 2: {2-[2-({3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]пропіл}аміно)етил]-4,5-диметоксифеніл}оцтова кислота 1,3 г одержаного в Прикладі 1 продукту (2,77 ммоль) і 1,11 г гранул NaOH (27,7 ммоль) нагрівають до кипіння в 6,2 мл етанолу і 14,6 мл води. Після кипіння протягом 6 годин реакційну суміш гідролізують, використовуючи 10 мл води, і додають 20 мл дихлорметану. Органічну фазу екстрагують з 20 мл води. Водні фази об'єднують і промивають 15 мл дихлорметану. Рівень рН промитої водної фази коректують до 7, використовуючи водний 37 % розчин соляної кислоти, і потім проводять висушування in vacuo. Тверду речовину жовтого кольору, одержану таким чином, поміщають в 40 мл ацетону за температури навколишнього середовища. Одержану суспензію фільтрують in vacuo. Фільтрувальні рідини піддають висушуванню in vacuo для одержання 0,7 г меренги жовтого кольору, яка відповідає зазначеній в заголовку сполуці. Вихід: 52 % 1 Н ЯМР (CDCl3, 400 МГц): 2,10 частин на мільйон (2Н, м) - 2,54 частин на мільйон (3Н, с) 2,70 до 3,30 частин на мільйон (12Н, м) - 3,47 частин на мільйон (2Н, с) - 3,55 частин на мільйон (1Н, м) - 3,71 частин на мільйон (3Н, с) - 3,73 частин на мільйон (3Н, с) - 3,74 частин на мільйон (3Н, с) - 3,75 частин на мільйон (3Н, с) - 6,55 частин на мільйон (Н, с) - 6,62 частин на мільйон (Н, с) - 6,63 частин на мільйон (Н, с) - 6,64 частин на мільйон (Н, с). 13 С ЯМР (CDCl3, 100 МГц): 20,7 частин на мільйон (СН2) - 28,1 частин на мільйон (СН2) - 34,9 частин на мільйон (СН2) - 37,0 частин на мільйон (СН) - 39,1 частин на мільйон (СН3) - 40,1 частин на мільйон (СН2) - 44,7 частин на мільйон (СН2) - 48,1 частин на мільйон (СН2) - 52,9 частин на мільйон (СН2) - 54,8 частин на мільйон (СН3) - 54,9 частин на мільйон (СН3) - 55,2 частин на мільйон (СН3) - 55,3 частин на мільйон (СН3) - 59,1 частин на мільйон (СН2) - 105,8 частин на мільйон (СН) - 106,2 частин на мільйон (СН) - 111,6 частин на мільйон (СН) - 112,6 частин на мільйон (СН) - 126,3 частин на мільйон, 127,0 частин на мільйон, 133,2 частин на мільйон, 134,2 частин на мільйон, 146,9 частин на мільйон, 147,2 частин на мільйон, 148,7 частин на мільйон і 149,6 частин на мільйон (8Cq - 176,9 частин на мільйон (С=О). Приклад 3: 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]-пропіл}-7,8диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он У тригорлій колбі змішують 0,7 г одержаного у Прикладі 2 продукту (1,44 ммоль) і 0,4 мл триетиламіну (2,88 ммоль) в 14 мл дихлорметану. Охолоджують суміш за температури 5 °C і додають, краплями, 0,16 мл тіонілхлориду (2,16 ммоль). Перемішують протягом 1 години за температури 30 °C і потім суміш гідролізують, використовуючи 12 мл 1 н. водного розчину NaOH. Органічну фазу послідовно промивають 10 мл води, а потім 10 мл розчину насиченого водного NaCl. Висушують органічну фазу над MgSO 4 і проводять висушування in vacuo для одержання 0,5 г масла жовтогарячого кольору, яке відповідає зазначеній в заголовку сполуці. Вихід: 74 % 1 Н ЯМР (CDCl3, 400 МГц): 1,78 частин на мільйон (2Н, м) - 2,32 частин на мільйон (3Н, с) 2,40 до 2,80 частин на мільйон (5Н, м) - 3,16 частин на мільйон (2Н, т) - 3,19 частин на мільйон (1Н, м) - 3,42 частин на мільйон (3Н, м) - 3,55 до 3,80 частин на мільйон (16Н, м) - 6,50 частин на мільйон (1Н, с) - 6,52 частин на мільйон (1Н, с) - 6,61 частин на мільйон (1Н, с) - 6,65 частин на мільйон (1Н, с). 13 С ЯМР (CDCl3, 100 МГц): 25,0 частин на мільйон (СН2) - 31,3 частин на мільйон (СН2) - 34,3 частин на мільйон (СН2) - 39,2 частин на мільйон (СН) - 41,2 частин на мільйон (СН3) - 41,6 частин на мільйон (СН2) - 43,9 частин на мільйон (СН2) - 45,6 частин на мільйон (СН2) - 54,1 частин на мільйон (СН2) - 54,9 частин на мільйон (СН3) - 54,9 частин на мільйон (СН3) - 55,2 частин на мільйон (СН3) - 55,3 частин на мільйон (СН3) - 60,7 частин на мільйон (СН2) - 105,8 частин на мільйон (СН) - 106,4 частин на мільйон (СН) - 112,1 частин на мільйон (СН) - 112,9 частин на мільйон (СН) - 122,4 частин на мільйон, 126,4 частин на мільйон, 126,4 частин на мільйон, 133,8 частин на мільйон, 146,1 частин на мільйон, 146,8 частин на мільйон, 148,4 частин на мільйон і 148,9 частин на мільйон (8Cq) - 171,2 частин на мільйон (С=О). 10 UA 113396 C2 ФОРМУЛА ВИНАХОДУ 1. Спосіб синтезу івабрадину формули (І): OCH3 OCH3 H3CO N N H3CO O 5 , (I) який відрізняється тим, що сполуку формули (VI): H N H3CO OCH3 N OCH3 H3CO O 10 15 20 25 30 35 40 OH , (VI) піддають реакції лактамізації за присутності зв'язуючої речовини і основи в органічному розчиннику, щоб одержати івабрадин формули (І), який може бути перетворений на його адитивні солі з фармацевтично прийнятною кислотою, вибраною із соляної кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, янтарної кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензенсульфонової кислоти і камфорної кислоти, і на його гідрати. 2. Спосіб синтезу за п. 1, який відрізняється тим, що зв'язуючу речовину, яку використовують для проведення реакції лактамізації сполуки формули (VI), вибирають із оксалілхлориду, тіонілхлориду, N,N-дициклогексилкарбодііміду (ДЦК), 1-етил-3-(3диметиламінопропіл)карбодііміду (ЕДКІ), N,N-карбонілдіімідазолу (КДІ), 1-пропанфосфонової кислоти циклічного ангідриду (Т3П) і 1-(метилсульфоніл)-1H-бензотриазолу. 3. Спосіб синтезу за п. 2, який відрізняється тим, що зв'язуюча речовина, яку використовують для проведення реакції лактамізації сполуки формули (VI), являє собою тіонілхлорид. 4. Спосіб синтезу за п. 3, який відрізняється тим, що кількість тіонілхлориду, яку використовують для проведення реакції лактамізації сполуки формули (VI), знаходиться в діапазоні від 1 до 5 еквівалентів, включно. 5. Спосіб синтезу за будь-яким з пп. 1-4, який відрізняється тим, що основа, яку використовують для проведення реакції лактамізації сполуки формули (VI), вибирають з триетиламіну, діізопропілетиламіну і піридину. 6. Спосіб синтезу за п. 5, який відрізняється тим, що основа, яку використовують для проведення реакції лактамізації сполуки формули (VI), являє собою триетиламін. 7. Спосіб синтезу за будь-яким з пп. 1-6, який відрізняється тим, що органічний розчинник, який використовують для проведення реакції лактамізації сполуки формули (VI), вибирають з дихлорметану, тетрагідрофурану, ацетонітрилу, ацетону і толуолу. 8. Спосіб синтезу за п. 7, який відрізняється тим, що органічний розчинник, який використовують для проведення реакції лактамізації сполуки формули (VI), являє собою дихлорметан. 9. Спосіб синтезу за будь-яким з пп. 1-8, який відрізняється тим, що реакцію лактамізації сполуки формули (VI) проводять за температури від 0 °C до 40 °C, включно. 10. Спосіб синтезу за п. 1, який відрізняється тим, що сполуку формули (VI) одержують, починаючи зі сполуки формули (VII): 11 UA 113396 C2 H3CO NH 2 H3CO N , (VII) яку піддають взаємодії зі сполукою формули (VIII): OCH3 N OCH3 X 5 , (VIII) де X являє собою атом галогену, групу мезилату або групу тозилату, за присутності основи в органічному розчиннику з одержанням сполуки формули (IX): H N H3CO OCH3 N OCH3 H3CO N , (IX) яку гідролізують під дією основи в суміші органічного розчинника і води з утворенням сполуки формули (VI): H N H3CO OCH3 N OCH3 H3CO O 10 OH . (VI) 11. Спосіб синтезу за п. 1, який відрізняється тим, що сполуку формули (VI) одержують, починаючи зі сполуки формули (X): H3CO H N Cl H3CO N , (X) яку піддають взаємодії з гідрохлоридом сполуки формули (III): OCH3 HCl 15 N H OCH3 , (III) за присутності основи в органічному розчиннику з одержанням сполуки формули (IX): 12 UA 113396 C2 H N H3CO OCH3 N OCH3 H3CO N , (IX) яку гідролізують під дією основи в суміші органічного розчинника і води, з утворенням сполуки формули (VI): H N H3CO OCH3 N OCH3 H3CO O 5 10 15 20 25 30 35 40 OH . (VI) 12. Спосіб синтезу за п. 10 або п. 11, який відрізняється тим, що основу, яку використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), вибирають із карбонату калію, карбонату натрію, карбонату цезію, гідрокарбонату калію, гідрокарбонату натрію, триетиламіну, діізопропілетиламіну і піридину. 13. Спосіб синтезу за п. 12, який відрізняється тим, що основа, яку використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), являє собою триетиламін. 14. Спосіб синтезу за будь-яким з пп. 10-13, який відрізняється тим, що органічний розчинник, який використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), вибирають із ацетонітрилу, ацетону, метилетилкетону (МЕК), диметилформаміду (ДМФ), N-метилпіролідону (N-МП) і диметилсульфоксиду (ДМСО). 15. Спосіб синтезу за п. 14, який відрізняється тим, що органічний розчинник, який використовують для проведення реакції алкілування між сполукою формули (VII) і сполукою формули (VIII) або для реакції алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III), являє собою ацетонітрил. 16. Спосіб синтезу за будь-яким з пп. 10-15, який відрізняється тим, що реакцію алкілування між сполукою формули (VII) і сполукою формули (VIII) або реакцію алкілування між сполукою формули (X) і гідрохлоридом сполуки формули (III) проводять за температури від 20 °C до 100 °C, включно. 17. Спосіб синтезу за будь-яким з пп. 10-16, який відрізняється тим, що основу, яку використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), вибирають із гідроксиду калію, гідроксиду натрію, гідроксиду літію і гідроксиду барію. 18. Спосіб синтезу за п. 17, який відрізняється тим, що основа, яку використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою гідроксид натрію. 19. Спосіб синтезу за будь-яким з пп. 10-18, який відрізняється тим, що органічний розчинник, який використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою спиртовий розчинник. 20. Спосіб синтезу за п. 19, який відрізняється тим, що спиртовий розчинник, який використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), вибирають з метанолу, етанолу, ізопропанолу і бутанолу. 21. Спосіб синтезу за п. 20, який відрізняється тим, що спиртовий розчинник, який використовують для проведення гідролізу сполуки формули (IX) для утворення сполуки формули (VI), являє собою етанол. 13 UA 113396 C2 22. Спосіб синтезу за будь-яким з пп. 10-21, який відрізняється тим, що гідроліз сполуки формули (IX) для утворення сполуки формули (VI) проводять за температури від 0 °C до 110 °C, включно. 23. Сполука формули (VI): H N H3CO OCH3 N OCH3 H3CO O 5 OH . (VI) 24. Сполука формули (IX): H N H3CO OCH3 N OCH3 H3CO N . (IX) 25. Сполука формули (X): H N H3CO Cl H3CO N 10 . (X) 26. Етил N-{2-[2-(ціанометил)-4,5-диметоксифеніл]етил}--аланінат оксалат. 27. (2-{2-[(3-Гідроксипропіл)аміно]етил}-4,5-диметоксифеніл)ацетонітрил. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Автори російськоюAlexandre le Flohic, Mathieu Grandjean
МПК / Мітки
МПК: C07C 229/34, C07D 223/16, A61K 31/55, C07C 255/42, C07C 215/08
Мітки: спосіб, кислотою, адитивних, івабрадину, новий, солей, фармацевтично, синтезу, прийнятною
Код посилання
<a href="https://ua.patents.su/16-113396-novijj-sposib-sintezu-ivabradinu-i-jjogo-aditivnikh-solejj-z-farmacevtichno-prijjnyatnoyu-kislotoyu.html" target="_blank" rel="follow" title="База патентів України">Новий спосіб синтезу івабрадину і його адитивних солей з фармацевтично прийнятною кислотою</a>
Попередній патент: Поліпшення швидкості фільтрування при очищенні терефталевої кислоти регулюванням % води в суспензії, що подають в фільтр
Наступний патент: Попередження несприятливих ефектів, спричинених специфічними доменами зв’язування cd3
Випадковий патент: Спосіб ідентифікації автентичності виноградних виноматеріалів і вин