Похідні 1-[2-(заміщений вініл)]-5н-2,3-бензодіазепіну, спосіб їх отримання (варіанти),проміжна сполука, фармацевтична композиція, спосіб її отримання та спосіб лікування захворювань центральної нервової системи
Номер патенту: 61873
Опубліковано: 15.12.2003
Автори: ШІМІГ Дьюла, Білкєі-Горзо Андраш, Реітер Йожеф, Дьєртьян Іштван, Дароці Казоне Клара, Ваго Паль, Сенкуті Естер, Бєрженьі Паль, Кьорьоші Єньо, Едьєд Андраш, Андраші Ференц, Ботка Петер, Мате Дьордьнє, Хаморі Тамаш, Баконьі Анна, Моравчік Імре, Хорват Едіт, Тіханьі Карой, Гацшальі Іштван, Байногель Юдіт, Зольомі Габор, Блашко Габор, Шаламон Хашкане Цецилія, Хорват Каталін
Формула / Реферат
1. Производные 1-[2-(замещенный винил)]-5Н-2,3-бензодиазепина общей формулы (I):
, (I)
где
А и В вместе образуют группу формулы -C=N- или -CH-NH-,
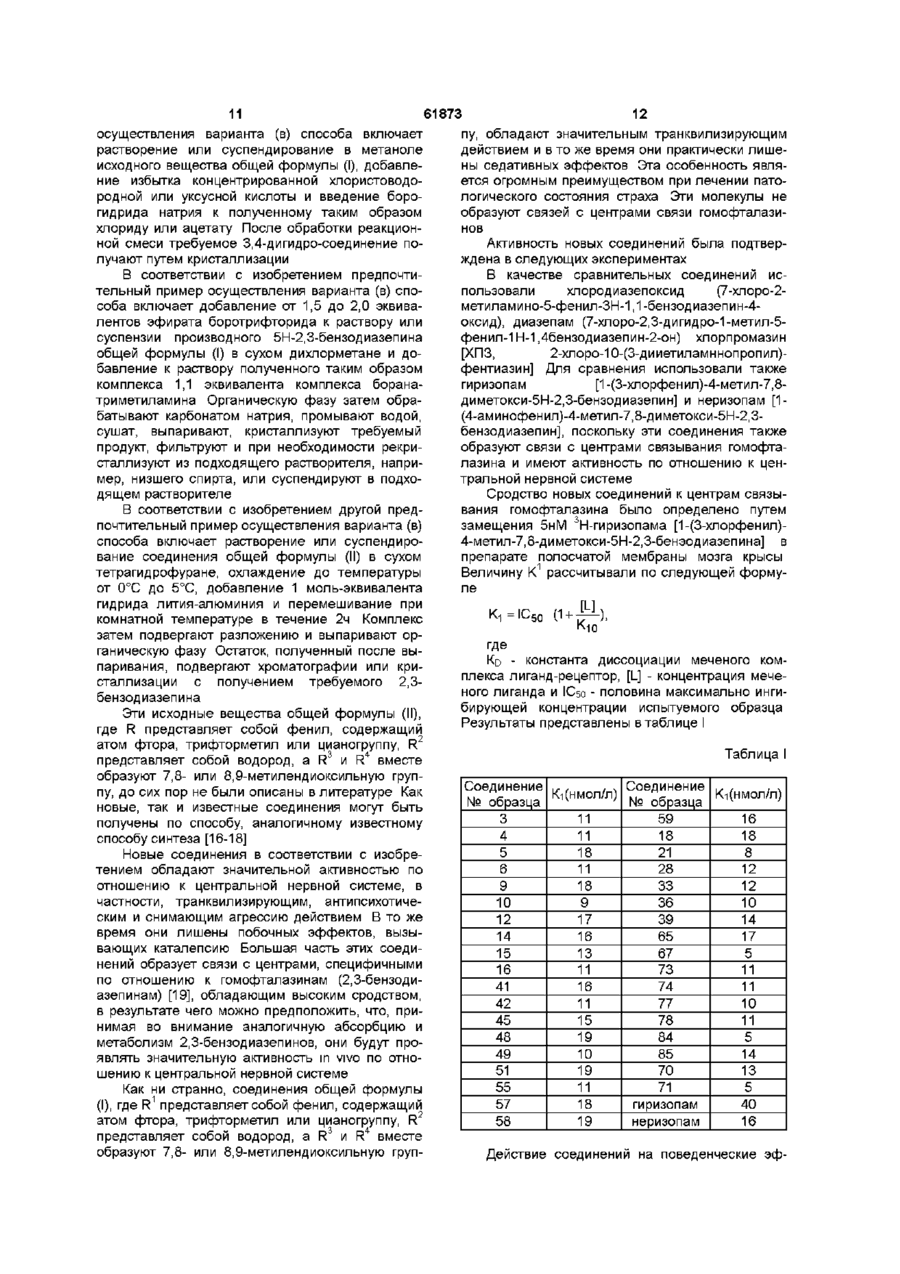
R1 представляет собой фенил, который содержит от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей галоген, трифторметил или циано,
R2 представляет собой водород,
R3 и R4 вместе образуют 7,8- или 8,9-метилендиоксильную группу,
и их фармацевтически приемлемые соли присоединения кислот.
2. Производные 1-[2-(замещенный винил)]-5Н-2,3-бензодиазепина общей формулы (I) по п. 1, отличающиеся тем, что
А и В вместе образуют группу формулы -C=N-,
R1, R2, R3 и R4 такие, как указано в п. 1,
и их фармацевтически приемлемые соли присоединения кислот.
3. Производные 1-[2-(замещенный винил)]-5Н-2,3-бензодиазепина общей формулы (I) по п. 1, отличающиеся тем, что
А и В вместе образуют группу формулы -С=N- или -CH-NH-,
R1 представляет собой фенил, несущий атом фтора, трифторметил и/или циано;
R2, R3 и R4 такие, как указано в п. 1,
и их фармацевтически приемлемые соли присоединения кислот.
4. Соединение общей формулы (I) по п. 1:
1-(4-фторостирил)-4-метил-7,8-метилендиокси-5Н-2,3-бензодиазепин и его фармацевтически приемлемые соли присоединения кислот.
5. Способ получения производных 1-[2-(замещенный винил)]-5Н-2,3-бензодиазепина общей формулы (I):
, (I)
где
А и В вместе образуют группу формулы -C=N-,
R1, R2, R3 и R4 такие, как указано в п. 1,
включающий взаимодействие хлората 2-бензопирила общей формулы (II):
, (II)
где R1, R2, R3 и R4 такие же, как указано выше, с гидразингидратом, и, если необходимо, превращение полученного таким образом основания общей формулы (І) в его соль присоединения кислоты.
6. Способ получения производных 1-[2-(замещенный винил)]-5Н-2,3-бензодиазепина общей формулы (I):
, (I)
где
А и В вместе образуют группу формулы -CH-NH-,
R1, R2, R3 и R4 такие же, как указано в п. 1,
включающий восстановление соединения общей формулы (I),
где
А и В вместе образуют группу формулы -С=N-,
R1, R2, R3 и R4 такие же, как указано в п. 1,
комплексом гидрида металла и/или комплексом бора, и, если необходимо, превращение полученного таким образом основания общей формулы (І) в его соль присоединения кислоты.
7. Фармацевтическая композиция для лечения заболеваний центральной нервной системы, содержащая эффективное количество активного компонента и подходящие инертные твердые или жидкие фармацевтические носители, отличающаяся тем, что в качестве активного компонента она содержит, по меньшей мере, одно соединение общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п. 1, или его фармацевтически приемлемую соль.
8. Фармацевтическая композиция по п. 7, отличающаяся тем, что она содержит в качестве активного компонента, по меньшей мере, одно соединение общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п. 2.
9. Фармацевтическая композиция по п. 7, отличающаяся тем, что она содержит в качестве активного компонента, по меньшей мере, одно соединение общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п. 3.
10. Фармацевтическая композиция по п. 7, отличающаяся тем, что она содержит в качестве активного компонента 1-(4-фторостирил)-4-метил-7,8-метилендиокси-5Н-2,3-бензодиазепин или его фармацевтически приемлемые соли присоединения кислот.
11. Способ получения фармацевтической композиции пригодной, в частности, для лечения заболеваний центральной нервной системы, отличающийся тем, что используют соединение общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п. 1, или его фармацевтически приемлемую соль.
12. Способ получения фармацевтической композиции пригодной, в частности, для лечения заболеваний центральной нервной системы по п. 11, отличающийся тем, что используют соединение общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п. 2, или его фармацевтически приемлемую соль.
13. Способ получения фармацевтической композиции пригодной, в частности, для лечения заболеваний центральной нервной системы по п. 11, отличающийся тем, что используют соединение общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п. 3, или его фармацевтически приемлемую соль.
14. Способ лечения заболеваний центральной нервной системы, отличающийся тем, что пациенту назначают эффективное количество соединения общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п. 1, или его фармацевтически приемлемой соли.
15. Производные хлората 2-бензопирила общей формулы (II):
, (II)
где
R1 представляет собой фенил, несущий атом фтора, трифторметил и/или циано,
R2 представляет собой водород,
R3 и R4 вместе образуют 7,8- или 8,9-метилендиоксильную группу,
в качестве промежуточного соединения для получения соединений формулы (I) по п. 1.
Текст
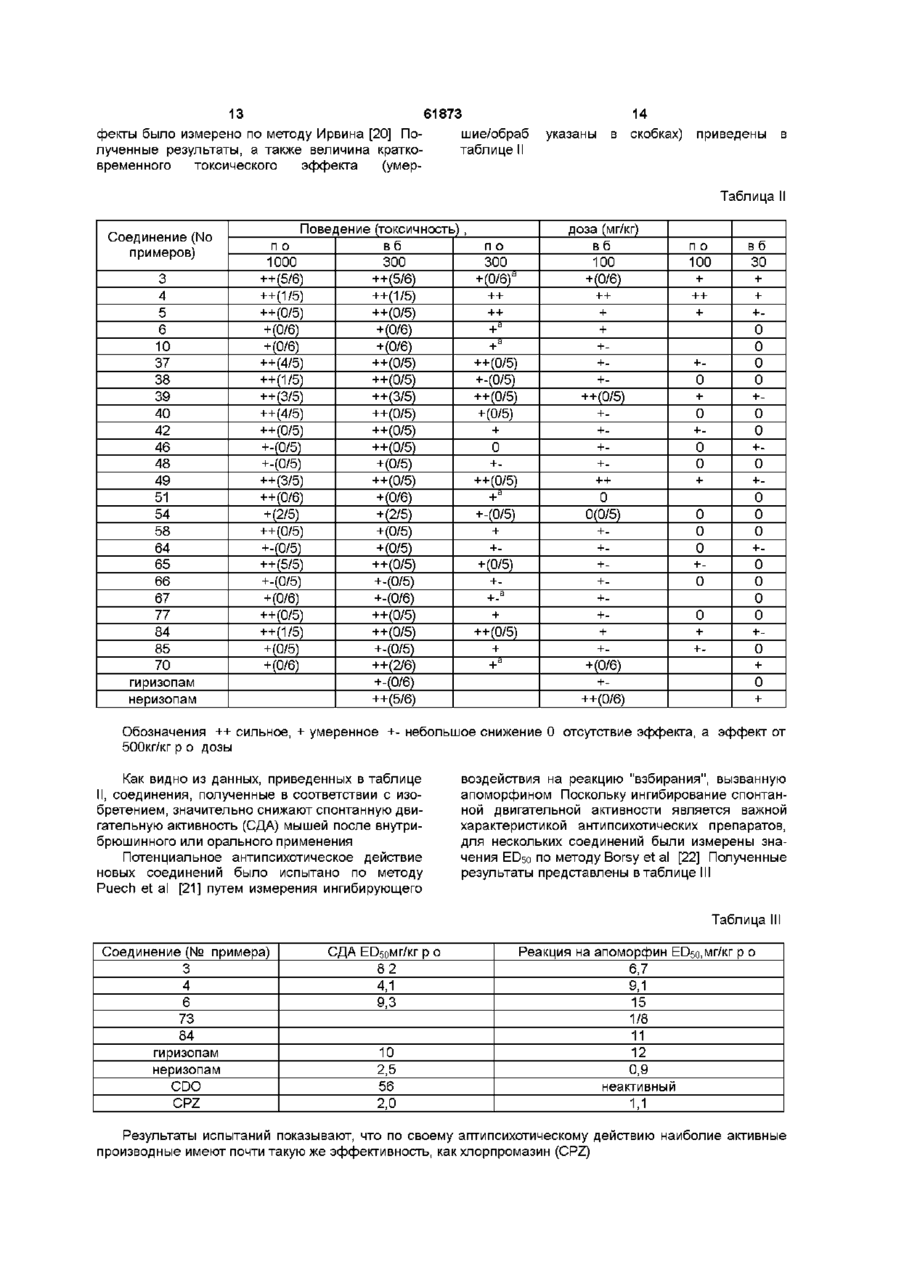
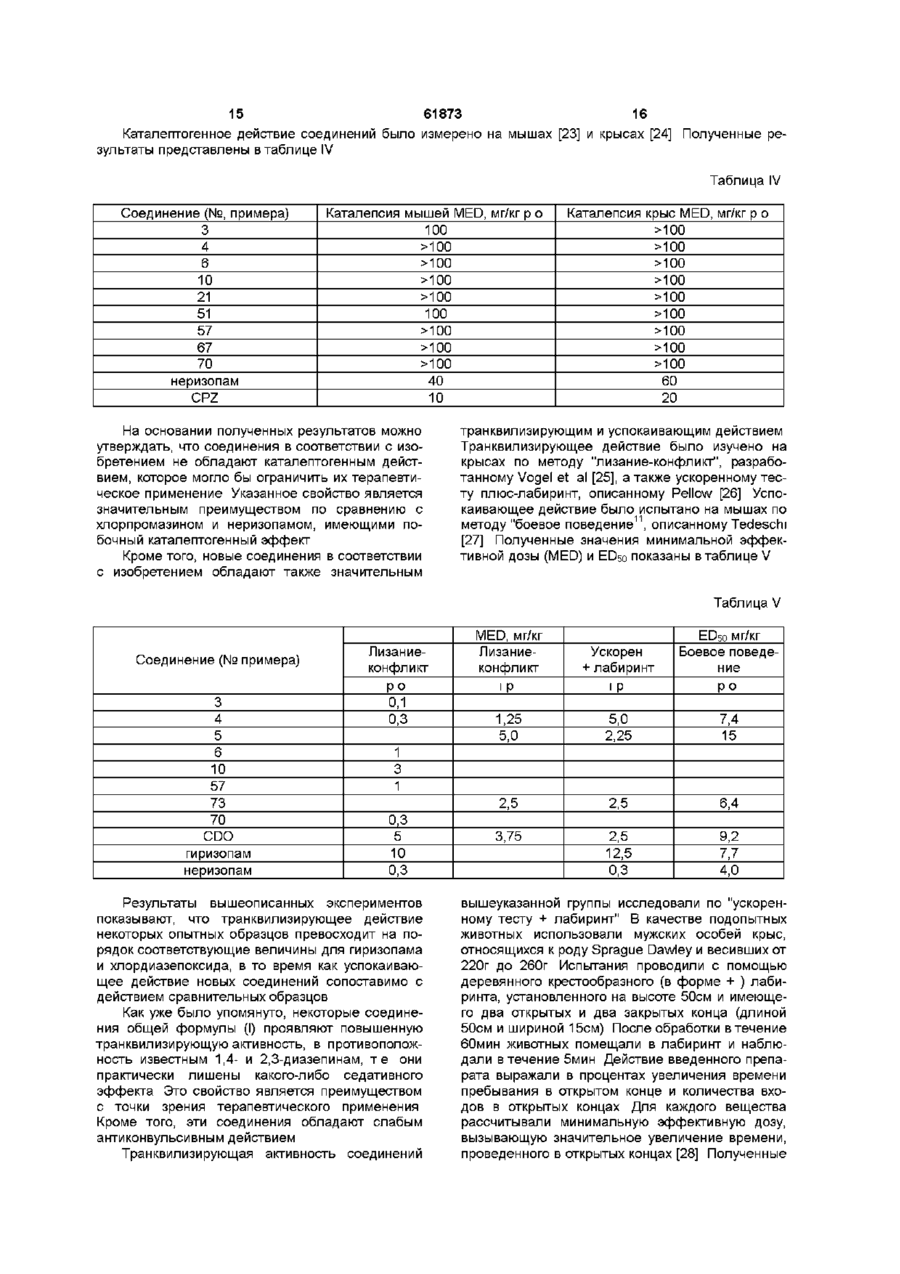
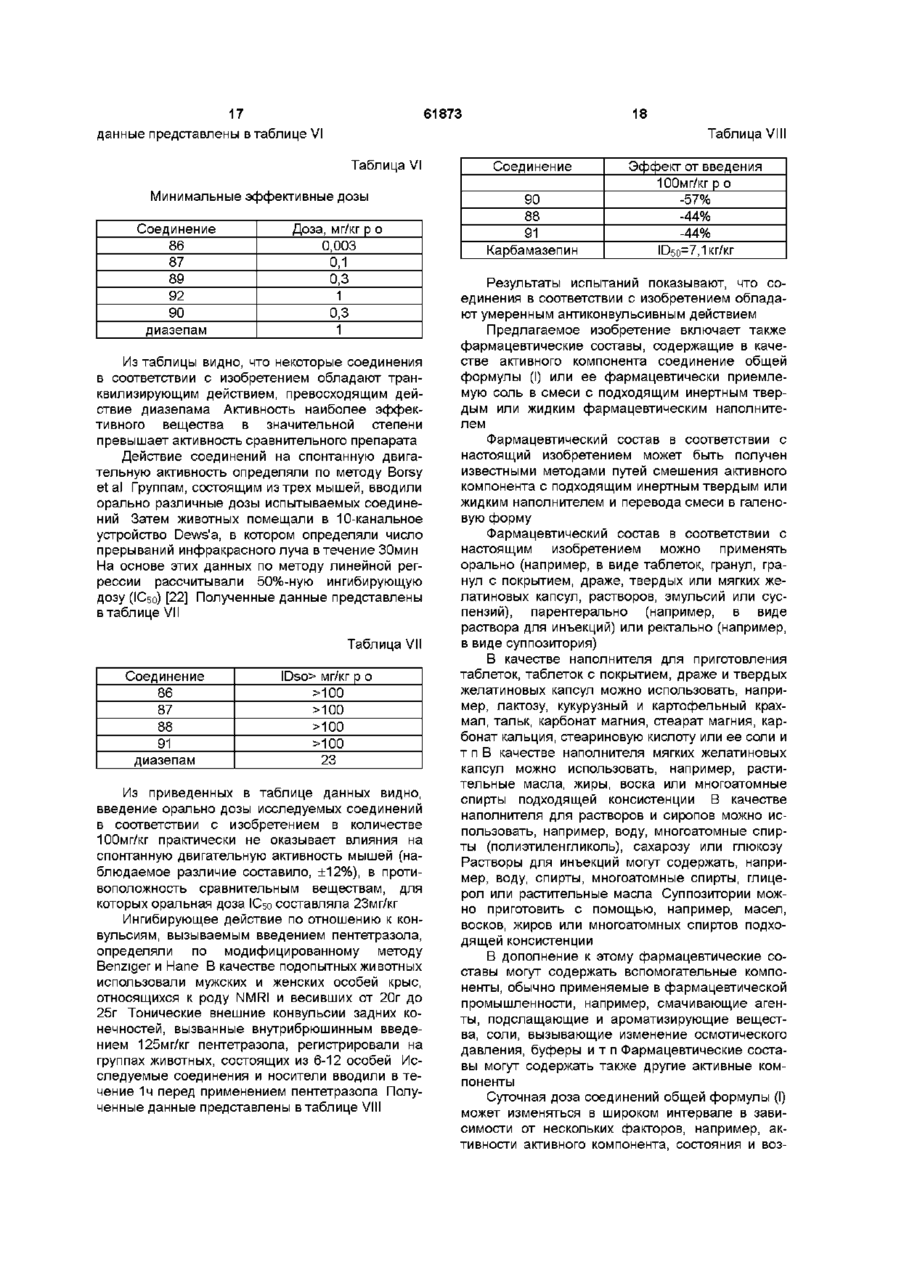
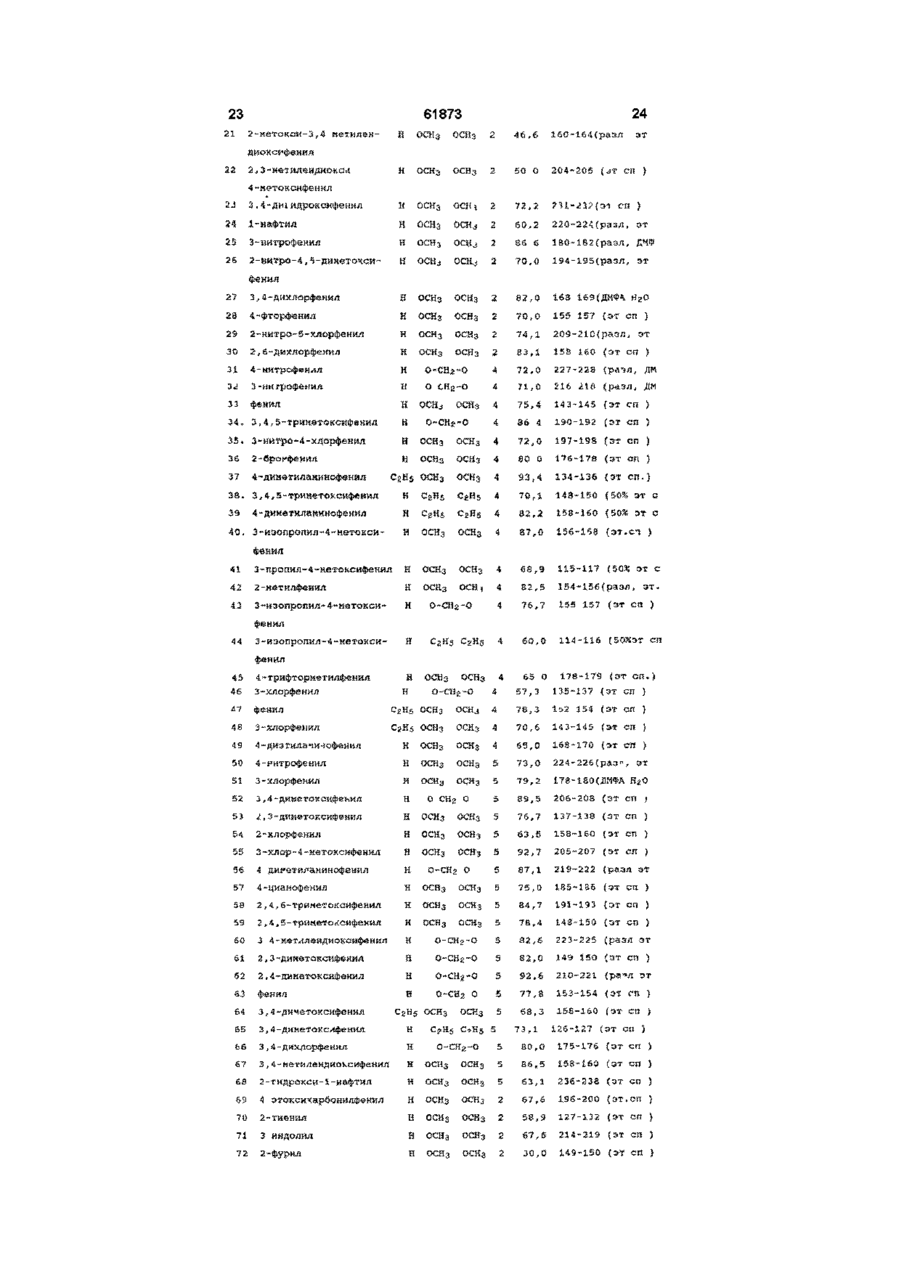
1 Производные 1-[2-(замещенный винил)]-5Н2,3-бензодиазепина общей формулы (І) R2 R и R вместе образуют 7,8- или 8,9метилендиоксильную группу, и их фармацевтически приемлемые соли присоединения кислот 2 Производные 1-[2-(замещенный винил)]-5Н-2,3бензодиазепина общей формулы (І) по п 1, отличающиеся тем, что А и В вместе образуют группу формулы -C=N-, R1, R2, R3 и R4 такие, как указано в п 1, и их фармацевтически приемлемые соли присоединения кислот 3 Производные 1-[2-(замещенный винил)]-5Н-2,3бензодиазепина общей формулы (І) по п 1, отличающиеся тем, что А и В вместе образуют группу формулы -C=N- или -CH-NH-, R1 представляет собой фенил, несущий атом фтора, трифторметил и/или циано, R2, R3 и R4 такие, как указано в п 1, и их фармацевтически приемлемые соли присоединения кислот 4 Соединение общей формулы (I) по п 1 1-(4-фторостирил)-4-метил-7,8-метилендиокси-5Н2,3-бензодиазепин и его фармацевтически приемлемые соли присоединения кислот 5 Способ получения производных 1 -[2(замещенный винил)]-5Н-2,3-бензодиазепина общей формулы (I) где А и В вместе образуют группу формулы -C=N- или -CH-NH-, R1 представляет собой фенил, который содержит от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей галоген, трифторметил или циано, R2 представляет собой водород, где А и В вместе образуют группу формулы -C=N-, R1, R2, R3 и R4 такие, как указано в п 1, включающий взаимодействие хлората бензопирила общей формулы (II) О ГО 00 (О 2 61873 ного компонента, по меньшей мере, одно соеди1 2 3 4 нение общей формулы (I), где А, В, R , R , R и R такие же, как указано в п 3 10 Фармацевтическая композиция по п 7, отличающаяся тем, что она содержит в качестве актисю; вного компонента 1-(4-фторостирил)-4-метил-7,8метилендиокси-5Н-2,3-бензодиазепин или его фармацевтически приемлемые соли присоединения кислот 1 2 3 где R , R , R и R такие же, как указано выше, с 11 Способ получения фармацевтической компогидразингидратом, и, если необходимо, превразиции пригодной, в частности, для лечения забощение полученного таким образом основания облеваний центральной нервной системы, отличащей формулы (І) в его соль присоединения кислоющийся тем, что используют соединение общей 1 2 3 4 ты формулы (I), где А, В, R , R , R и R такие же, как 6 Способ получения производных 1 -[2указано в п 1, или его фармацевтически приемле(замещенный винил)]-5Н-2,3-бензодиазепина обмую соль щей формулы (I) 12 Способ получения фармацевтической компо.2 зиции пригодной, в частности, для лечения заболеваний центральной нервной системы по п 1 1 , отличающийся тем, что используют соединение общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п 2, или его фармацевтически приемлемую соль 13 Способ получения фармацевтической композиции пригодной, в частности, для лечения заболеваний центральной нервной системы по п 1 1 , отличающийся тем, что используют соединение общей формулы (I), где А, В, R1, R2, R3 и R4 такие же, как указано в п 3, или его фармацевтически где приемлемую соль А и В вместе образуют группу формулы -CH-NH-, 14 Способ лечения заболеваний центральной 1 2 3 4 R , R , R и R такие же, как указано в п 1, нервной системы, отличающийся тем, что пациевключающий восстановление соединения общей нту назначают эффективное количество соединеформулы (I), ния общей формулы (I), где А, В, R1, R2, R3 и R4 где такие же, как указано в п 1, или его фармацевтиА и В вместе образуют группу формулы -C=N-, чески приемлемой соли 1 2 3 4 R , R , R и R такие же, как указано в п 1, 15 Производные хлората 2-бензопирила общей комплексом гидрида металла и/или комплексом формулы бора, и, если необходимо, превращение полученного таким образом основания общей формулы (I) в его соль присоединения кислоты 7 Фармацевтическая композиция для лечения заболеваний центральной нервной системы, сосю; держащая эффективное количество активного компонента и подходящие инертные твердые или жидкие фармацевтические носители, отличающаяся тем, что в качестве активного компонента она содержит, по меньшей мере, одно соединение где общей формулы (I), где А, В, R1, R , R3 и R4 такие R представляет собой фенил, несущий атом же, как указано в п 1 , или его фармацевтически фтора, трифторметил и/или циано, приемлемую соль R2 представляет собой водород, 8 Фармацевтическая композиция по п 7, отличаR3 и R4 вместе образуют 7,8- или 8,9ющаяся тем, что она содержит в качестве активметилендиоксильную группу, ного компонента, по меньшей мере, одно соедив качестве промежуточного соединения для полу1 2 3 4 нение общей формулы (I), где А, В, R , R , R и R чения соединений формулы (I) по п 1 такие же, как указано в п 2 9 Фармацевтическая композиция по п 7, отличающаяся тем, что она содержит в качестве актив Настоящее изобретение относится к новый производным 1-[2-(замещенный винил)]-5Н-2,3бензодиазепина, способу его получения, фарма цевтическому составу, применению указанных производных бензодиазепина для лечения заболеваний и приготовления фармацевтических со ставов, пригодных при лечении заболеваний Как известно, в литературе описаны производные 5Н-2,3-бензо-диазепина, содержащие в качестве заместителей фенил, нафтил, замещенный фенил, фурил, тиенил или гидроксистирил в 1 положении основной цепи молекулы [1-10] Соединения известной группы оказывают воздействие на центральную нервную систему, в то время как производные 5Н-2,3-бензодиазепина, относящиеся к другой группе, обладают положительным миотропным эффектом и не проявляют активности по отношению к центральной нервной системе Известные 2,3-бензодиазепины, активные по отношению к центральной нервной системе, обладают транквилизирующим и успокаивающим действием, однако, в противоположность обычным 1,4-бензодиазе-пинам, не дают эффекта расслабления мышц, кроме того, транквилизирующее действие сопровождается нейролептической активностью Известное соединение неризопам, принадлежащее к этой же группе, также обладает транквилизирующим и успокаивающим действием, однако он имеет также побочный каталептический эффект Задачей изобретения является получение новых производных 2,3-бензодиазепина, сравнимых с известными 1,4и 2,3бензодиазепинами, у которых, однако, отсутствует какой-либо побочный каталептогенный эффект, препятствующий терапевтическому применению Помимо этого, около 20% населения земли страдает от чувства беспричинного страха, в связи с чем лечение этого заболевания приобретает особо важное значение Преобладающее большинство медикаментов, применяемых при лечении чувства страха, представляет собой производные 1,4-бензодиазепина Указанные лекарства, однако, оказывают нежелательный побочный эффект, например, седативный, вызывающий расслабление мышц и сонливость Другой задачей настоящего изобретения является получение новых производных 2,3бензодиазепина, оказывающих значительное транквилизирующее действие даже в малых дозах, однако, в противоположность известным седативным средствам, практически не влияющих на двигательную активность животных даже в больших дозах Было обнаружено, что соединения в соответствии с изобретением характеризуются следующим признаком В соответствии с настоящим изобретением получены производные 1-[2-(замещенный винил)3-5Н-2,3-бензодиазепина общей формулы (I), где А и В вместе образуют группу формулы =C=N 61873 или =CH-NH-, 1 R представляет собой фенил, который может содержать от 2 до 3 гидроксильных групп или от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей галоген, трифторметид, нитро-, циано-, амино-, Сі з алкиламино-, ди-(Сі з алкил) -амино-, Сі 4 алканоиламино-, Сі 4 алкил Сі 4 алкокси-, карбокси, (Сі 4 алкокси)карбонил, Сі 4 алкоксикарбонилокси и метилендиоксил, нафтил, который может содержать заместитель, выбранный из группы, включающей гидроксил, С-і 4 алкокси- и Сі 4 ацилоксигруппу, фурил, тиенил или индол, R представляет собой водород или алкил, R и R каждый представляет собой Сі 4 алкоксигруппу, присоединенную в положениях 7 или 8 бензодиазепинового кольца, или R3 и R4 вместе образуют 7,8- или 8,9-метилендиоксильную группу, и фармацевтически приемлемые соли кислотного присоединения Предпочтительными соединениями общей формулы (I) являются такие соединения, в которых А и В вместе образуют группу формулы -C=N, R1 представляет собой фенил, который может содержать 1 или 2 заместителя из группы, включающей фтор, циано, трифторметил, аминогруппу, ди(Сі з алкил)-аминогруппу или Сі 4 алкокси группу, R2 представляет собой водород, a R3 и R4 вместе образуют 7,8-метилен-диоксил, а также фармацевтически приемлемые соли кислотного присоединения В частности, предпочтительными соединениями в соответствии с изобретением являются следующие производные 1-(4-диметиламиностирил)-4-метил-7,8диметокси-5Н-2,3-бензодиазепин, 1-(4-аминостирил)-4-метил-7,8-диметокси-5Н2,3-бензодиазепин, 1-(3,4-диметоксистирил)-4-метил-7,8диметокси-5Н-2,3-бензодиазепин, 1 -(4-фторостирил)-4-метил-7,8метилендиокси-5Н-2,3-бензодиазепин, и фармацевтически приемлемые соли, полученные присоединением кислот Употребляемый в описании и формуле изобретения термин "низшие" относится к группам или соединениям с числом атомов углерода от 1 до 4 Термин "алкил" относится к линейным или разветвленным группам, имеющим данное число атомов углерода, например, таким как метил, этил, нпропил, и тп Термин "алкенил" относится к таким линейным или разветвленным группам, как винил, 1-метилвинил, 2-метилвинил, 1-пропенил, 2пропенил и т п Термин "алканоиламино-" относится к линейным или разветвленным алифатическим карбоксильным кислым амидным группам (например, ацетиламино-, пропаноиламиног-руппа и т п ) Термин "алоксикарбонильная группа" относится к карбоксильным группам, этерифицированным линейными или разветвленными алифатическими спиртами, имеющими от 1 до 4 атомов углерода, например, таким как метоксикарбонильная, этоксикарбонильная группа и др Термин "ацилоксигруппа" относится к гидроксильным группам, ацилированным алифатическими карбокси 61873 8 пы могут иметь две гидроксильные группы или один или два одинаковых или различных заместителя, выбранных из группы, включающей галоген, трифторметил, нитро-, циано-, амино-, метилендиокси-, Сі 4 алкил-, Сі 4 алкоксигруппу, карбоксил или (Сі 4 алкокси)-карбонил, a R - такой же, как указано выше, в) восстановление соединения общей формулы (I), где А и В вместе образуют группу формулы 1 2 3 4 =C=N-, a R , R , R и R такие же, как указано выше, комплексным гидридом металла и/или комплексом борана, с получением соединения общей формулы (I), где А и В вместе -образуют группу 1 формулы =CH-NH-, R представляет фенил, содержащий атом фтора, трифторметил или циано2 4 группу, R представляет собой водород, a R и R вместе образуют 7,8- или 8,9-метилендиоксильную группу, и, при желании, превращение полученного таким образом основания общей формулы (І) в его соль кислотного присоединения В соответствии с изобретением вариант (а) способа включает осуществление взаимодействия перхлората 2-бензопирила общей формулы (II) с гидразингидратом Реакцию предпочтительно проводят в растворителе, но она может также В изобретении предложен также способ полупротекать и без растворителя, в избытке гидрата чения производных 1-[2-(замещенный винил)]-5Нгидразина В качестве растворителей можно ис2,3-бензодиазепина общей формулы (І), в которой пользовать полярные или неполярные раствориА, В, R1, R2, R3 и R4 как указано выше, включаютели, предпочтительно воду, низшие спирты, дищий оксан, тетрагидрофуран, дихлорметан, а) взаимодействие перхлората 2хлороформ, диметилформамид, диметилсульфокбензопирила общей формулы (II) сид, пиридин или их смеси Реакцию проводят при температуре от 0°С до точки кипения реакционной смеси, предпочтительно от +10°С до +120°С Предпочтительно также проводить реакцию в концентрированном (90-100%) гидразингидрате, при его избытке от 1 до 3 молей кислотами, имеющими от 1 до 4 атомов углерода, например, таким как ацетокси-, трет-бутоксикарбонилоксигруппа и др Термин "атом галогена" включает все четыре атома галогена, т е фтор, хлор, йод и бром Фармацевтически приемлемые соли кислотного присоединения соединений общей формулы (I) могут быть образованы с неорганическими кислотами (например, галогенводородами, такими как хлористый или бромистый водород, серной, фосфорной или пергалоидными кислотами, такими как хлорная кислота), органическими карбоновими кислотами (например, фумаровой, уксусной, пропионовой, гликолевой, малеиновой, гидроксималеиновой, аскорбиновой, лимонной, яблочной, салициловой, молочной, коричной, бензойной, фенилуксусной, пара-амино-бензойной, парагид роксибензойной, пара-аминосалициловой кислотой и др), алкилсульфоновыми кислотами (например, метансульфокислотой, этансульфокислотой) или арилсульфоновыми кислотами (например, пара-толуолсульфоновой, парабромфенилсульфоновой, нафтилсульфоновой, сульфанильной кислотами) где R1, R , R3 и R4 как указано выше, с гидразингидратом, с получением соединения общей формулы (I), где А и В вместе образуют группу формулы =C=N-, a R1, R2, R3 и R4 такие же, как указано выше, б) восстановление соединения общей формулы (I), где R1 представляет собой нитрофенил, который может содержать 2 гидроксильные группы или 1 или 2 одинаковых или различных заместителя, выбранных из группы, включающей галоген, трифторметил, нитро-, циано-, амино-, метилендиокси, Сі 4 алкил-, Сі 4 алкоксигруппу, карбоксил или (Сі 4 алкокси)-карбонил, гидразингидратом в присутствии катализатора и, при необходимости, ацилирование или алкилирование полученного таким образом аминосоединения с получением 1-[2-(замещенный винил)]-5Н-2,3бензодиазепина общей формулы (I), где А и В вместе образуют группу формулы =C-N-, R3 и R4 независимо друг от друга представляют собой Сі 4 алкоксигруппу, присоединенную в положениях 7 или 8 бензодиазепинового кольца, или R3 и R4 вместе образуют 7,8-метилендиоксильную группу, R представляет собой аминофенил, (Сі 3 алкил) аминофенил, ди(Сі з алкил)-аминофенил или (Сі &, алканоил)-аминофенил, при этом указанные груп В соответствии с изобретением предпочтительный пример выполнения варианта (а) способа включает осуществление взаимодействия перхлората 2-бензопирила общей формулы (II) с 3 моль-эквивалентами гидразингидрата в низшем спирте, предпочтительно этаноле, при комнатной температуре, отделение полученного сырого продукта от реакционной смеси, вымывание солеподобных побочных продуктов из желаемого продукта в горячей воде, фильтрование полученного продукта и, при необходимости, суспендирование в подходящем растворителе, предпочтительно низшем спирте, или перекристаллизация из него В соответствии с изобретением другой предпочтительный пример выполнения варианта (а) способа включает суспендирование в растворителе, предпочтительно, низшем спирте, соединения общей формулы (II) и осуществление его взаимодействия с эквивалентами 90-100%-ного гидразингидрата сначала при комнатной температуре в течение 1-Зч, затем либо при температуре от 45 до 50°С в течение от 10 до 50мин, либо при температуре от 70 до 100°С в точение получаса Если соединение общей формулы (II) труднорастворимо при комнатной температуре или если соединение общей формулы (I) начинает отделяться от реакционной смеси во время реакции, предпочтительно в конце реакции использовать повышенную температуру 61873 10 почтительный пример выполнения варианта (б) способа включает осуществление взаимодействия производного 1 -нитростирил-5Н-2,3бензодиазепина общей формулы (І) в течение 12ч с 3 эквивалентами 100%-ного гидразингидрата спирте при комнатной температуре, после чего к реакционной смеси добавляют катализатор и еще 2 эквивалента 100%-ного гидразингидрата и перемешивают в течение нескольких часов при комнатной температуре Затем смесь обрабатывают как указано выше Полученное таким образом производное аминостирилбензодиазепина общей формулы (I) при необходимости ацилируют или алкилируют Если желательно провести алкилирование, его осуществляют известными методами, предпочтительно с алкилгалогенидами в индифферентном растворителе в присутствии агента, связывающего кислоту, при температуре от комнатной до точки кипения растворителя Предпочтительно можно использовать следующие растворители алифатические спирты, кетоны, нитрилы, тетрагидрофуран, диоксан, динетилформамид или диметилсульфоксид В качестве агента, связывающего кислоту, предпочтительно используют карбонат или гидрокарбонат щелочного металла или 1-2 эквивалента низшего третичного ямина Полученные, как указано выше, производные аминостирилбензодиазепина при необходимости ацилируют Ацилирование проводят с помощью 12 эквивалентов галогенида кислоты или ангидрида кислоты Реакцию предпочтительно проводят в присутствии агента, связывающего кислоту, предпочтительно низшего алифатического третичного амина или в пиридине Предпочтительно проводить реакцию в растворителе (например, в алиВосстановление предпочтительно осуществфатическом кетоне, нитриле, тетрагидрофуране, ляют в органическом растворителе Предпочтидиоксане, пиридине), однако реакцию можно протельно можно использовать следующие растворивести также без растворителя, в избытке реагентели низшие спирты, диоксан, тетрагидрофуран, та бензол, хлороформ, дихлорметан, диметилформамид, диметилсульфоксид и пиридин ПредпочВ соответствии с изобретением вариант (в) тительно проводить реакцию в избытке 90-100%способа включает восстановление комплексным ного пиридина В качестве катализатора предпочгидридом металла и/или комплексом борана 5-Нтительно использовать палладий на костяной уг2,3-бензодиазепина общей формулы (I), где А и В ле, платину или никель Рэнея Реакцию проводят вместе образуют группу формулы =C=N-, R1 предпри температуре от 0°С до точки кипения раствоставляет собой фенил, содержащий атом фтора, рителя, предпочтительно от + 10°С до +100°С трифторметил или цианогруппу, R2 представляет 3 4 собой водород, a R и R вместе образуют 7,8- или В соответствии с изобретением предпочти8,9-метилендиок-сильную группу Можно испольтельный пример выполнения варианта (б) способа зовать следующие восстановительные агенты включает суспендирование в метаноле производборогидрид натрия, гидрид лития-алюминия, боного 1-нитростирил-5Н-2,3-бензодиазвпина общей ран и комплексы борана Восстановление предформулы (I) и осуществление его взаимодействия почтительно проводят в растворителе В качестве с 2-4, предпочтительно 3 эквивалентами 98-100%растворителей можно использовать воду, низшие ного гидразингидрата в присутствии в качестве спирты, низшие карбоксильные кислоты, раствокатализатора никеля Рэнея при комнатной темперители эфирного типа, ароматические углеводоратуре в течение 1-2ч Сырой продукт отделяют от роды, хлорированные алифатические углеводореакционной смеси известными методами Если роды, пиридин или их смеси Растворитель или полученное соединение труднорастворимо в месмесь растворителей, которую используют в дантаноле, так что происходит частичное его отделеном случае, зависит от выбранного восстановиние, предпочтительно промыть катализатор нетельного агента сколько раз растворителем, в результате чего продукт легко будет растворен (например, хлороВосстановление проводят при температуре от формом)» Сырой продукт при необходимости 0°С до 100°С с использованием предпочтительно очищают путем рекристаллизации или растирания от 1,1 до 25 молярных эквивалентов восстановив порошок в растворителе тельного агента В соответствии с изобретением еще один предпочтительный пример выполнения варианта (а) способа включает добавление соединения общей формулы (II) к смеси, содержащей 3 эквивалента 90-100%-ного гидразингидрата и диметилформамид, при температуре от 10 до 15°С и затем при комнатной температуре Конечный продукт отделяют от раствора путем добавления к смеси воды Побочный продукт затем отмывают от него водой и конечный продукт при необходимости очищают путем рекристаллизации или кипячения в спирте В соответствии с изобретением пример выполнения варианта (б) способа получают производное бензодиазепина общей формулы (I), содержащее аминофенил, который может быть замещен, моно- или ди-(Сі &, низший алкил)аминофенил или Сі 4 алканоиламинофенил в качестве радикала Ri, путем восстановления соответствующего производного нитрофенила и при необходимости ацилирования или алкилирования полученного продукта Для восстановления нитрогруппы используют метод селективного восстановления, который не приводит к насыщению C=N- связей семичленного кольца, или винильной группы Описание способа восстановления таких соединений в литературе неизвестно Было обнаружено, что использование гидразингидрата в присутствии катализатора может быть применено для селективного восстановления соединений подобного типа Известно, что гидразингидрат в присутствии катализатора использовали для превращения в аминосоединения только таких нитросоединеиий, которые не содержали других групп, способных к восстановлению [13-15] В соответствии с изобретением другой пред В соответствии с изобретением другой пример 12 11 61873 осуществления варианта (в) способа включает пу, обладают значительным транквилизирующим растворение или суспендирование в метаноле действием и в то же время они практически лишеисходного вещества общей формулы (I), добавлены седативных эффектов Эта особенность являние избытка концентрированной хлористоводоется огромным преимуществом при лечении патородной или уксусной кислоты и введение борологического состояния страха Эти молекулы не гидрида натрия к полученному таким образом образуют связей с центрами связи гомофталазихлориду или ацетату После обработки реакционнов ной смеси требуемое 3,4-дигидро-соединение поАктивность новых соединений была подтверлучают путем кристаллизации ждена в следующих экспериментах В соответствии с изобретением предпочтиВ качестве сравнительных соединений истельный пример осуществления варианта (в) спопользовали хлородиазепоксид (7-хлоро-2соба включает добавление от 1,5 до 2,0 эквиваметиламино-5-фенил-ЗН-1,1-бензодиазепин-4лентов эфирата боротрифторида к раствору или оксид), диазепам (7-хлоро-2,3-дигидро-1-метил-5суспензии производного 5Н-2,3-бензодиазепина фенил-1 Н-1,4бензодиазепин-2-он) хлорпромазин общей формулы (І) в сухом дихлорметане и до[ХПЗ, 2-хлоро-10-(3-дииетиламннопропил)бавление к раствору полученного таким образом фентиазин] Для сравнения использовали также комплекса 1,1 эквивалента комплекса боранагиризопам [1-(3-хлорфенил)-4-метил-7,8триметиламина Органическую фазу затем обрадиметокси-5Н-2,3-бензодиазепин] и неризопам [1батывают карбонатом натрия, промывают водой, (4-аминофенил)-4-метил-7,8-диметокси-5Н-2,3сушат, выпаривают, кристаллизуют требуемый бензодиазепин], поскольку эти соединения также продукт, фильтруют и при необходимости рекриобразуют связи с центрами связывания гомофтасталлизуют из подходящего растворителя, наприлазина и имеют активность по отношению к ценмер, низшего спирта, или суспендируют в подхотральной нервной системе дящем растворителе Сродство новых соединений к центрам связывания гомофталазина было определено путем В соответствии с изобретением другой предзамещения 5нМ 3Н-гиризопама [1-(3-хлорфенил)почтительный пример осуществления варианта (в) 4-метил-7,8-диметокси-5Н-2,3-бенэодиазепина] в способа включает растворение или суспендиропрепарате полосчатой мембраны мозга крысы вание соединения общей формулы (II) в сухом Величину К1 рассчитывали по следующей формутетрагидрофуране, охлаждение до температуры ле от 0°С до 5°С, добавление 1 моль-эквивалента гидрида лития-алюминия и перемешивание при К 1 = 1С комнатной температуре в течение 2ч Комплекс 50 К 10 затем подвергают разложению и выпаривают органическую фазу Остаток, полученный после выгде паривания, подвергают хроматографии или криКо - константа диссоциации меченого комсталлизации с получением требуемого 2,3плекса лиганд-рецептор, [L] - концентрация мечебензодиазепина ного лиганда и ICso - половина максимально ингибирующей концентрации испытуемого образца Эти исходные вещества общей формулы (II), Результаты представлены в таблице I где R представляет собой фенил, содержащий атом фтора, трифторметил или цианогруппу, R2 Таблица I представляет собой водород, a R3 и R4 вместе образуют 7,8- или 8,9-метилендиоксильную групСоединение Соединение пу, до сих пор не были описаны в литературе Как Кі(нмол/л) Кі(нмол/л) № образца № образца новые, так и известные соединения могут быть 3 11 59 16 получены по способу, аналогичному известному способу синтеза [16-18] 4 11 18 18 5 18 21 8 Новые соединения в соответствии с изобре6 11 28 12 тением обладают значительной активностью по отношению к центральной нервной системе, в 9 18 33 12 частности, транквилизирующим, антипсихотиче10 9 36 10 ским и снимающим агрессию действием В то же 12 17 39 14 время они лишены побочных эффектов, вызы14 16 65 17 вающих каталепсию Большая часть этих соеди15 13 67 5 нений образует связи с центрами, специфичными 16 11 73 11 по отношению к гомофталазинам (2,3-бензоди41 16 74 11 азепинам) [19], обладающим высоким сродством, 42 11 77 10 в результате чего можно предположить, что, при45 15 78 11 нимая во внимание аналогичную абсорбцию и метаболизм 2,3-бензодиазепинов, они будут про48 19 84 5 являть значительную активность in vivo по отно49 10 85 14 шению к центральной нервной системе 51 19 70 13 55 11 71 5 Как ни странно, соединения общей формулы (I), где R1 представляет собой фенил, содержащий 57 18 гиризопам 40 атом фтора, трифторметил или цианогруппу, R2 58 19 неризопам 16 представляет собой водород, a R3 и R4 вместе образуют 7,8- или 8,9-метилендиоксильную групДействие соединений на поведенческие эф 13 61873 фекты было измерено по методу Ирвина [20] Пошие/обраб лученные результаты, а также величина краткотаблице II временного токсического эффекта (умер указаны 14 в скобках) приведены в Таблица Соединение(No примеров) 3 4 5 6 10 37 38 39 40 42 46 48 49 51 54 58 64 65 66 67 77 84 85 70 гиризопам неризопам Поведение (токсичность) , по вб 1000 300 ++(5/6) ++(5/6) ++(1/5) ++(1/5) ++(0/5) ++(0/5) +(0/6) +(0/6) +(0/6) +(0/6) ++(4/5) ++(0/5) ++(1/5) ++(0/5) ++(3/5) ++(3/5) ++(4/5) ++(0/5) ++(0/5) ++(0/5) +-(0/5) ++(0/5) +-(0/5) +(0/5) ++(3/5) ++(0/5) ++(0/6) +(0/6) +(2/5) +(2/5) ++(0/5) +(0/5) +-(0/5) +(0/5) ++(5/5) ++(0/5) +-(0/5) +-(0/5) +(0/6) +-(0/6) ++(0/5) ++(0/5) ++(1/5) ++(0/5) +(0/5) +-(0/5) +(0/6) ++(2/6) +-(0/6) ++(5/6) по 300 а +(0/6) ++ ++ а + а + ++(0/5) +-(0/5) ++(0/5) +(0/5) + 0 +++(0/5) +а +-(0/5) + ++(0/5) ++.а + ++(0/5) + +а доза (мг/кг) вб 100 +(0/6) ++ + + +++++(0/5) ++++++ 0 0(0/5) +++++++ ++(0/6) +++(0/6) по 100 + ++ + +0 + 0 +0 0 + 0 0 0 +0 0 + + вб 30 + + +0 0 0 0 +0 0 +0 +0 0 0 +0 0 0 0 +0 + 0 + Обозначения ++ сильное, + умеренное +- небольшое снижение 0 отсутствие эффекта, а эффект от 500кг/кг р о дозы Как видно из данных, приведенных в таблице II, соединения, полученные в соответствии с изобретением, значительно снижают спонтанную двигательную активность (СДА) мышей после внутрибрюшинного или орального применения Потенциальное антипсихотическое действие новых соединений было испытано по методу Puech et al [21] путем измерения ингибирующего воздействия на реакцию "взбирания", вызванную апоморфином Поскольку ингибирование спонтанной двигательной активности является важной характеристикой антипсихотических препаратов, для нескольких соединений были измерены значения ED50 по методу Borsy et al [22] Полученные результаты представлены в таблице III Таблица Соединение (№ примера) 3 4 6 73 84 гиризопам неризопам CDO CPZ СДА ЕОбоМг/кг р о 82 4,1 9,3 10 2,5 56 2,0 Реакция на апоморфин EDso,мг/кг р о 6,7 9,1 15 1/8 11 12 0,9 неактивный 1,1 Результаты испытаний показывают, что по своему аптипсихотическому действию наиболие активные производные имеют почти такую же эффективность, как хлорпромазин (CPZ) 15 61873 16 Каталептогенное действие соединений было измерено на мышах [23] и крысах [24] Полученные результаты представлены в таблице IV Таблица IV Соединение (№, примера) 3 4 6 10 21 51 57 67 70 неризопам CPZ Каталепсия мышей MED, мг/кг р о 100 >100 >100 >100 >100 100 >100 >100 >100 40 10 На основании полученных результатов можно утверждать, что соединения в соответствии с изобретением не обладают каталептогенным действием, которое могло бы ограничить их терапевтическое применение Указанное свойство является значительным преимуществом по сравнению с хлорпромазином и неризопамом, имеющими побочный каталептогенный эффект Кроме того, новые соединения в соответствии с изобретением обладают также значительным Каталепсия крыс MED, мг/кг р о >100 >100 >100 >100 >100 >100 >100 >100 >100 60 20 транквилизирующим и успокаивающим действием Транквилизирующее действие было изучено на крысах по методу "лизание-конфликт", разработанному Vogel et al [25], а также ускоренному тесту плюс-лабиринт, описанному Pellow [26] Успокаивающее действие было испытано на мышах по методу "боевое поведение11, описанному Tedeschi [27] Полученные значения минимальной эффективной дозы (MED) и ED50 показаны в таблице V Таблица V Соединение (№ примера) 3 4 5 6 10 57 73 70 CDO гиризопам неризопам MED, мг/кг Лизаниеконфликт Ускорен + лабиринт іР іР Боевое поведение ро 1,25 5,0 5,0 2,25 7,4 15 2,5 Лизаниеконфликт ро 0,1 0,3 2,5 6,4 3,75 2,5 12,5 0,3 9,2 7,7 4,0 ED50 МГ/КГ 1 3 1 0,3 5 10 0,3 Результаты вышеописанных экспериментов показывают, что транквилизирующее действие некоторых опытных образцов превосходит на порядок соответствующие величины для гиризопама и хлордиазепоксида, в то время как успокаивающее действие новых соединений сопоставимо с действием сравнительных образцов Как уже было упомянуто, некоторые соединения общей формулы (I) проявляют повышенную транквилизирующую активность, в противоположность известным 1,4- и 2,3-диазепинам, т е они практически лишены какого-либо седативного эффекта Это свойство является преимуществом с точки зрения терапевтического применения Кроме того, эти соединения обладают слабым антиконвульсивным действием Транквилизирующая активность соединений вышеуказанной группы исследовали по ускоренному тесту + лабиринт" В качестве подопытных животных использовали мужских особей крыс, относящихся к роду Sprague Dawley и весивших от 220г до 260г Испытания проводили с помощью деревянного крестообразного (в форме + ) лабиринта, установленного на высоте 50см и имеющего два открытых и два закрытых конца (длиной 50см и шириной 15см) После обработки в течение бОмин животных помещали в лабиринт и наблюдали в течение 5мин Действие введенного препарата выражали в процентах увеличения времени пребывания в открытом конце и количества входов в открытых концах Для каждого вещества рассчитывали минимальную эффективную дозу, вызывающую значительное увеличение времени, проведенного в открытых концах [28] Полученные 17 18 61873 Таблица VIII данные представлены в таблице VI Таблица VI Минимальные эффективные дозы Соединение 86 87 89 92 90 диазепам Доза, мг/кг р о 0,003 0,1 0,3 1 0,3 1 Из таблицы видно, что некоторые соединения в соответствии с изобретением обладают транквилизирующим действием, превосходящим действие диазепама Активность наиболее эффективного вещества в значительной степени превышает активность сравнительного препарата Действие соединений на спонтанную двигательную активность определяли по методу Borsy et al Группам, состоящим из трех мышей, вводили орально различные дозы испытываемых соединений Затем животных помещали в 10-канальное устройство Dews'a, в котором определяли число прерываний инфракрасного луча в течение ЗОмин На основе этих данных по методу линейной регрессии рассчитывали 50%-ную ингибирующую дозу (IC50) [22] Полученные данные представлены в таблице VII Таблица VII Соединение 86 87 88 91 диазепам IDso> мг/кг р о >100 >100 >100 >100 23 Из приведенных в таблице данных видно, введение орально дозы исследуемых соединений в соответствии с изобретением в количестве 100мг/кг практически не оказывает влияния на спонтанную двигательную активность мышей (наблюдаемое различие составило, ±12%), в противоположность сравнительным веществам, для которых оральная доза ICso составляла 23мг/кг Ингибирующее действие по отношению к конвульсиям, вызываемым введением пентетразола, определяли по модифицированному методу Benziger и Нэпе В качестве подопытных животных использовали мужских и женских особей крыс, относящихся к роду NMRI и весивших от 20г до 25г Тонические внешние конвульсии задних конечностей, вызванные внутрибрюшинным введением 125мг/кг пентетразола, регистрировали на группах животных, состоящих из 6-12 особей Исследуемые соединения и носители вводили в течение 1ч перед применением пентетразола Полученные данные представлены в таблице VIII Соединение 90 88 91 Карбамазепин Эффект от введения 100мг/кг р о -57% -44% -44% Ю5о=7,1 кг/кг Результаты испытаний показывают, что соединения в соответствии с изобретением обладают умеренным антиконвульсивным действием Предлагаемое изобретение включает также фармацевтические составы, содержащие в качестве активного компонента соединение общей формулы (I) или ее фармацевтически приемлемую соль в смеси с подходящим инертным твердым или жидким фармацевтическим наполнителем Фармацевтический состав в соответствии с настоящий изобретением может быть получен известными методами путей смешения активного компонента с подходящим инертным твердым или жидким наполнителем и перевода смеси в галеновую форму Фармацевтический состав в соответствии с настоящим изобретением можно применять орально (например, в виде таблеток, гранул, гранул с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий), парентерально (например, в виде раствора для инъекций) или ректально (например, в виде суппозитория) В качестве наполнителя для приготовления таблеток, таблеток с покрытием, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный и картофельный крахмал, тальк, карбонат магния, стеарат магния, карбонат кальция, стеариновую кислоту или ее соли и т п В качестве наполнителя мягких желатиновых капсул можно использовать, например, растительные масла, жиры, воска или многоатомные спирты подходящей консистенции В качестве наполнителя для растворов и сиропов можно использовать, например, воду, многоатомные спирты (полиэтиленгликоль), сахарозу или глюкозу Растворы для инъекций могут содержать, например, воду, спирты, многоатомные спирты, глицерол или растительные масла Суппозитории можно приготовить с помощью, например, масел, восков, жиров или многоатомных спиртов подходящей консистенции В дополнение к этому фармацевтические составы могут содержать вспомогательные компоненты, обычно применяемые в фармацевтической промышленности, например, смачивающие агенты, подслащающие и ароматизирующие вещества, соли, вызывающие изменение осмотического давления, буферы и т п Фармацевтические составы могут содержать также другие активные компоненты Суточная доза соединений общей формулы (I) может изменяться в широком интервале в зависимости от нескольких факторов, например, активности активного компонента, состояния и воз 20 19 61873 раста пациента, тяжести заболевания и Способ А т п Предпочтительно оральная доза составляет от 4,0г (8,56ммоля) перхлората 1-(3,40,1 до 500мг/сутки Следует подчеркнуть, что выдиметоксистирил)-3-метил-6,7-диметокси-2шеуказанная доза носит справочный характер и бензопирила суспендировали в 80мл этанола, к применять состав можно только в дозах, назнасуспензии добавили 1,3мл (25,7моля) 100%-ного ченных врачом-терапевтом гидрата гидразина и реакционную смесь кипятили с обратным холодильником в течение 5мин РасНастоящее изобретение включает также иствор выпаривали под вакуумом Затем повторили пользование соединений общей формулы (I) или операции Примера 1 В результате было получено его фармацевтически приемлемых солей кислот1,5г (46,6%) конечного продукта Тпл 156-158°С ного присоединения для получения фармацевтических составов, воздействующих, в частности, на Способ В центральную нервную систему К смеси 0,32мл (6,42ммоля) 100%-ного гидрата гидразина и 5мл диметилформамида в течение Настоящее изобретение включает также сподобавили 1,0г (2,14молей) перхлората 2соб лечения расстройств центральной нервной бензопирила, приготовленного как указано выше, системы, включающий назначение пациенту эфпри охлаждении проточной водой Полученный фективного количества соединения общей форраствор перемешивали в течение 0,5ч, затем влимулы (I) или его фармацевтически приемлемой вали в 100мл 15%-ного водного раствора хлорида соли, полученной присоединением кислоты натрия и отделившийся сырой продукт экстрагиБолее подробно изобретение описано в поровали хлороформом Хлороформную фазу суследующих примерах его реализации, которые, шили и выпаривали под вакуумом Выло получено однако, не ограничивают область изобретения 0,86г сырого продукта Для очистки сырой продукт Пример 1 подвергали перекристаллизации из 4мл этанола, 1-(4-бромостирил)-4-метил-7,8-диметокси-5Нсуспендировали в 20мл горячей воды, фильтро2,3-бензодиазепин вали, промывали горячей водой и сушили В реК суспензии из 4,6г (9,47ммолей) порошкообзультате было получено 0,59г (71,9%) конечного разного перхлората 1-(4-бромостирил)-3-метилпродукта, полученного в чистом виде Тпл 1566,7-диметокси-2-бензопкрила (Т пл (разл) 274158°С 275°С) в 46мл 99,5%-ного этанола добавили 1,4мл (28,4моля) 100%-ного гидрата гидразина и смесь Способ С перемешивали до полного растворения Затем ее 1,0г (2,14ммоля) перхлората 2-бензопирила, выдерживали при температуре 25°С в течение приготовленного как указано выше, кипятили в получаса и выпаривали под вакуумом Остаток в смеси 20мл хлороформа и 0,32мл (6,42моля) 100мл воды, фильтровали, промывали три раза 100%-ного гидрата гидразина в течение ЗОмин порциями воды по 15мл, сырой продукт суспендиБыл получен раствор Растворитель затем выпаровали в горячем виде в 400мл воды в течение ривали, а остаток растирали в 40мл горячей воды ЗОмин, фильтровали, промывали три раза порСырой продукт сушили и подвергали перекрициями воды по 15мл и сушили при 80-100°С Было сталлизации из Змл этанола Затем его суспендиполучено 2,8г сырого продукта Для очистки сырой ровали в 25мл горячей воды, фильтровали, пропродукт кипятили в 15мл этанола, охлаждали, мывали три раза порциями горячей воды по 1мл и фильтровали, промывали тремя порциями по 1мл сушили В результате было получено 0,21 г (25,6%) этанола и сушили В результате было получено конечного продукта, полученного в чистом виде 2,26г (60%) конечного продукта Тпл ,156-158°С Тпл 15б-158°С Пример 2 Способ D 1-(4-нитростирил)-4-метил-5-этил-7,8Смочь, содержащую 2,0г (4,20ммоля) перхлодиметокси-5Н-2,3-бензодиазепин рата 2-бензопырила, приготовленного как указано выше, 4г пиридина и 0,65мл (12,8ммоля) 100%К суспензии из 1,58г (З.Зммоля) порошкообного гидрата гидразина перемешивали при комразного перхлората 1-(4-нитростирил)-3-метил-4натной температуре в течение 1ч Реакционную этил-6,7-диметокси-2-бензопирила (Т пл (разл) смесь затем вливали в 100мл воды, а отделенный 277-278°С) в 16мл 99,5 %-ного этанола добавили осадок фильтровали, промывали три раза пор0,5мл (Ю.Омолей) 100%-ного гидрата гидразина и циями по 10мл горячей воды» сырой продукт сусмесь перемешивали до полного растворения, шили и подвергали перекристаллизации из 10мл после перемешивания в течение 10-15мин треэтанола В результате было получено 1,06г буемый продукт начинал отделяться в кристалли(64,6%) конечного продукта Тпл 156-158°С ческом виде от раствора Смесь перемешивали еще в течение часа, продукт отфильтровывали, Способ Е промывали три раза порциями этанола по 1мл и Смесь, содержащую 2,0г (4,28ммоля) перхлотри раза порциями воды по 5мл и сушили при 80рата 2-бензопирила, приготовленного как указано 100°С Было получено 1,1г конечного продукта выше, 4мл тетрагидрофурана и 0,64мл Тпл 218-220°С(разл ) Для очистки сырой продукт (12,84ммоля) 100-ного гидрата, гидразина кипятили с обратным холодильником в течение ЗОмин кипятили в 5мл этанола, охлаждали, фильтСуспензию охлаждали до комнатной температуры, ровали, промывали тремя порциями по 1мл этафильтровали и фильтрат вливали в 100мл воды, а нола и сушили В результате было получено 1,03г отделенный осадок экстрагировали 15мл хлоро(80%) конечного продукта Тпл 220-221 °С форма, после чего повторили операцию очистки, Пример 3 приведенную в Примере 2 В результате было 1-(3,4-диметоксистирил)-4-метил-7,8получено 0,37г (22,6%) конечного продукта диметокси-5Н-2,3-бензодиазепин 22 21 61873 Тпл 15б-158°С сушили при температуре от 80 до 100°С Было получено 12,9г сырого продукта, Для очистки сыСпособ F рой продукт подвергали кипячению со 100мл 50%Смесь, содержащую 2,0г (4,28ммоля) перхлоного этанола в точение 15мин, суспензию охлажрата 2-бензопирила, приготовленного как указано дали до комнатной температуры, фильтровали, выше, 20мл бензола и 0,64мл (12,84ммоля) 100%промывали три раза порциями по 15мл 50%-ного ного гидрата гидразина кипятили с обратным хоэтанола и сушили В результате было получено лодильником в течение 7ч Затем фильтровали 10,5г (76,3%) конечного продукта, полученного в при 25°С, фильтрат выпаривали и остаток кипятичистом виде Тпл 170-172°С ли в течение ЗОмин в горячей воде, декантировали в горячем виде и сырой продукт подвергали Пример 5 перекристаллизации из 5мл этанола В результате 1-(2,4-димотоксистирил)-4-метил-7,8было получено 0,83г (50,6%) конечного продукта диметокси-5Н-2,3-бензодиазспин Тпл 156-158°С К смеси 21,5мл диметилформамида и 2,3мл (46,0ммоль) 100%-ного гидрата гидразина, котоСпособ G рую охлаждали проточной водой, добавили 7,15г Смесь, содержащую 2,0г (4,28ммоля) перхло(15,3ммоль) перхлората 1-(2,4-диметоксисти-рил)рата 2-бензопирила, приготовленного как указано 3-метил-6,7-диметокси-2-бензопирила (Тпл 270выше, 4мл диметилсульфоксида и 0,64мл 271 °С, разл) в течение 15мин Полученный жел(12,84ммоля) 100%-ного гидрата гидразина подтоватый раствор перемешивали в течение ЗОмин, вергали тем же операциям, что и в Способе В В а затем к нему по каплям добавили 43мл воды при результате было получено 1,2г (73,6%) конечного охлаждении Полученную таким образом кристалпродукта Тпл 156-158°С лическую взвесь выдерживали при температуре Пример 4 5°С в течение 12ч, фильтровали, промывали три 1-(4-диметиламиностирил)-4-мєтил-7,8раза порциями по 20мл воды и сушили при темпедиметокси-5Н-2,3-бензодиазепин ратуре от 80 до 100°С Было получено 5,18г сыроК смеси 80,0мл диметилформамида и 5,7мл го продукта После перекристаллизации из 26мл (114,0ммоль) 100%-ного гидрата гидразина, котоэтанола было получено 5,01 г (86,1%) конечного рую охлаждали проточной водой, добавили 17,07г продукта Тпл 151-153°С (37,9ммоль) перхлората 1-(4-диметиламиностирил )-3-метил-6,7-диметокси-2-бензопирила (Тпл 245Далее в соответствии со способами, приве246°С) Полученный раствор перемешивали в теденными в Примерах 1-5, были получены соедичение 40мин, затем выпускали по каплям в 800мл нения общей формулы (I), представленные в табводы Отделенный сырой продукт фильтровали, лице IX промывали три раза порциями по 60мл воды и Т а б л и ц а IX Е3 Пр. R4 Срав. Выход Т ПЛ.°С (перйкрист-} пр. ОСНз осн 3 1 65, 6 185-18? (эт.сч.) ОСНэ ОСЯз 1 70, 5 178-180 {эт.сп.) ОСНз ОСНз 1 60, 0 135-136 (иэопр.) ОСНз 1 6S, 0 140-142 (ЭТ.СП.) ОСНз 1 56, 0 146-148 (эт.СП.) ОСНз 1 вз, ,6 172-174 (эт.сп.) 12. 4-нитрофенил н ОСНз н ОСНз н сгн5 н ОСНз ОСНз 1 65;,3 166-168 (эт-сгг.) 13. 2,4-ди.члорфенил н ОСНз 1 64,,0 1 8 0 - 1 8 2 {ЭТ.СП.) ОСНз 1 6В,.1 160-161 (зт.сп.) ОСНз 1 40 ,2 125-123 (зт.сп.) ОСНз 1 42 ,2 140-142 {эт.сп.) н н 6. 3,4,5-триметоксифенил 7. 2-нитрофенил ffl 9 3,4,5~триметаксифенил 4-метоксифенил 10. 2-фторфенил 11. 4-нитрофенил С ОСНз 16. З-изопрапоксифенил н осн 3 н осн 3 н ОСНз 17. 4-изопропоксифенил н 18. 2-из опропоксифенил н 14, З-кетил-4-нетокаифенил 15. 4-изопропоксифенил 19. 4-иэопропсксифенил 20. 4-этоксифенил о-снг-о 1 55 ,1 2 0 0 - 2 0 2 { э т с-п. ) ОСНз ОСНз 1 45 ,2 125-127 С 2 Н=, ОСНз ОСНэ 1 50 ,6 1 2 0 - 1 2 2 £50%ЭТ-СП ОСНз 1 61 ,9 158-160(разл, н ОСНз {эт.сп.) №9 61873 23 21 2-кетокси-3,4 метияен И 0СН3 Н ОСН 3 24 ОСНз 2 4 6,6 160-161(разл зт 2 50 О 204-205 (JT СП ) ?гх-гг^(эл си ) диоксі-фенил 22 2,3~метилен/даоксм ОСН 3 4-«ртоксифєнил гJ 3,4-дщ идроксифвішл Н ОСН 3 ОСІ! І 2 72,2 24 1-нафтия Н ОСН 3 OCHj 2 60,2 220-224(разЛ, ЗТ 25 3-нИтрофенйЛ И GCH 3 OCHj 2 Вб 6 1В0~182{разл, ДМФ 2-НИТРО-4 ,
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 1-[2-(substituted vinyl)]-5н-2,3-benzodiazepine, a method for producing thereof (variants), intermediate compound, a pharmaceutical composition, a method for producing thereof and a method for treatment of central nervous system diseases
Автори англійськоюGyertyan Istvan, Gyertyan, Istvan, Egyed Andras, Andrashi Ferents, Botka Peter, Khamori Tamash, Moravchik Imre
Назва патенту російськоюПроизводные 1-[2-(замещенный винил)]-5н-2,3-бензодиазепина, способ их получения (варианты), промежуточное соединение, фармацевтическая композиция, способ ее получения и способ лечения заболеваний центральной нервной системы
Автори російськоюДьертьян Иштван, Эдьед Андраш, Андраши Ференц, Ботка Петер, Хамори Тамаш, Моравчик Имре
МПК / Мітки
МПК: A61P 25/22, C07D 493/04, C07D 491/056, C07D 243/02, C07D 403/06, C07D 409/06, C07D 405/06, A61P 25/00, A61P 25/20, A61K 31/551, C07D 491/04, A61K 31/55
Мітки: композиція, фармацевтична, 1-[2-(заміщений, похідні, сполука, центральної, захворювань, спосіб, отримання, лікування, варіанти),проміжна, нервової, вініл)]-5н-2,3-бензодіазепіну, системі
Код посилання
<a href="https://ua.patents.su/16-61873-pokhidni-1-2-zamishhenijj-vinil-5n-23-benzodiazepinu-sposib-kh-otrimannya-variantipromizhna-spoluka-farmacevtichna-kompoziciya-sposib-otrimannya-ta-sposib-likuvannya-zakhvoryuvan-c.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-[2-(заміщений вініл)]-5н-2,3-бензодіазепіну, спосіб їх отримання (варіанти),проміжна сполука, фармацевтична композиція, спосіб її отримання та спосіб лікування захворювань центральної нервової системи</a>
Попередній патент: Фунгіцидна композиція, похідні триазолопіримідину, спосіб їх одержання та спосіб боротьби з грибками
Наступний патент: Полімер етилена, спосіб його одержання, плівка та інші вироби, що містять полімер етилену
Випадковий патент: Спосіб прогнозування зрощення перелому