Композиція суспензії фексофенадину
Номер патенту: 89584
Опубліковано: 10.02.2010
Автори: Харібхакті Раджив, Мермі Меттью, Агравала Прафулла, Сільві Гері Лі, Хшан Казімеж, Тран Вінх, Порселло Кертіс Дж.
Формула / Реферат
1. Водна фармацевтична суспензія, в якій рН знаходиться в межах від приблизно 4,25 до приблизно 9,43, з коректуванням за допомогою буферної системи, що містить за вагою/об'ємом (г/100 мл)
приблизно від 0,03 % до приблизно 4,80 % форми І цвітер-іонного дигідрату фексофенадину формули (І) з розміром частинок менше приблизно 280 мкм, що складають принаймні приблизно 90 % форми І цвітер-іонного дигідрату фексофенадину;
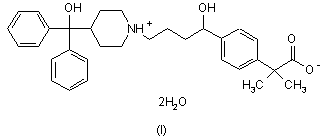
від приблизно 0,01 % до приблизно 0,20 % змочувальної речовини;
суспендувальну речовину, яка вибирається з від приблизно 0,10 % до приблизно 0,50 % гідроколоїдної камеді або від приблизно 0,1 % до приблизно 1,0 % гідроксіетилцелюлози;
система підсолоджувача, яка включає
від приблизно 5 % до приблизно 40 % сахарози або інвертованої сахарози; і
від 0 % до приблизно 40 % ксиліту, сорбіту або розчину сорбіту, або розчину мальтиту;
за умови що відношення кількостей (сахарози або інвертованої сахарози) : (ксиліту, сорбіту або розчину сорбіту, або розчину мальтиту) дорівнює або більше приблизно 1:1; і
систему консерванту, що включає
від приблизно 0,010 % до приблизно 0,058 % пропілпарабену, пропілпарабену натрію або пропілпарабену калію; і
від приблизно 0,0005 % до приблизно 0,0350 % бутилпарабену або бутилпарабену натрію.
2. Водна фармацевтична суспензія за п. 1, в якій система консервантів додатково включає від приблизно 0,06 % до приблизно 0,26 % динатрійетилендіамінтетраацетату, від приблизно 0,01 % до приблизно 0,27 % бензойної кислоти або бензоату натрію, від приблизно 0,01 % до приблизно 0,30 % сорбінової кислоти або сорбату калію або від приблизно 0,10 % до приблизно 1,50 % бензилового спирту.
3. Водна фармацевтична суспензія за п. 1, в якій рН знаходиться в межах від приблизно 5,00 до приблизно 8,00.
4. Водна фармацевтична суспензія за п. 1, в якій рН знаходиться в межах від приблизно 5,80 до приблизно 7,00.
5. Водна фармацевтична суспензія за п. 1, в якій розмір частинок складає менше приблизно 50 мкм принаймні для приблизно 90 % форми І цвітер-іонного дигідрату фексофенадину.
6. Водна фармацевтична суспензія за п. 1, в якій розмір частинок складає менше приблизно 40 мкм принаймні для приблизно 90 % форми І цвітер-іонного дигідрату фексофенадину.
7. Водна фармацевтична суспензія за п. 2, в якій рН знаходиться в межах від приблизно 5,80 до приблизно 7,00 і розмір частинок складає менше приблизно 40 мкм принаймні для приблизно 90 % форми І цвітер-іонного дигідрату фексофенадину.
8. Водна фармацевтична суспензія за п. 7, в якій форма І цвітер-іонного дигідрату фексофенадину складає за вагою/об'ємом (г/100 мл) від приблизно 0,60 % до приблизно 1,20 %.
9. Водна фармацевтична суспензія за п. 7, в якій форма І цвітер-іонного дигідрату фексофенадину складає за вагою/об'ємом (г/100 мл) приблизно 0,60 %.
10. Водна фармацевтична суспензія за п. 7, в якій змочувальна речовина складає за вагою/об'ємом (г/100 мл) від приблизно 0,01 % до приблизно 0,05 %.
11. Водна фармацевтична суспензія за п. 7, в якій змочувальна речовина складає за вагою/об'ємом (г/100 мл) від приблизно 0,02 % до приблизно 0,05 %.
12. Водна фармацевтична суспензія за п. 7, в якій гідроколоїдна камедь складає за вагою/об'ємом (г/100 мл) від приблизно 0,23 % до приблизно 0,45 %.
13. Водна фармацевтична суспензія за п. 7, в якій гідроколоїдна камедь складає за вагою/об'ємом (г/100 мл) від приблизно 0,35 % до приблизно 0,45 %.
14. Водна фармацевтична суспензія за п. 7, в якій як гідроколоїдна камедь використовується ксантанова камедь.
15. Водна фармацевтична суспензія за п. 7, в якій гідроксіетилцелюлоза складає за вагою/об'ємом (г/100 мл) від приблизно 0,2 % до приблизно 0,4 %.
16. Водна фармацевтична суспензія за п. 7, в якій гідроксіетилцелюлоза складає за вагою/об'ємом (г/100 мл) від приблизно 0,2 % до приблизно 0,3 %.
17. Водна фармацевтична суспензія за п. 7, в якій ксиліт, сорбіт або розчин сорбіту, або розчин мальтиту складає за вагою/об'ємом (г/100 мл) від 0 % до приблизно 20 %.
18. Водна фармацевтична суспензія за п. 7, в якій ксиліт, сорбіт або розчин сорбіту, або розчин мальтиту складає за вагою/об'ємом (г/100 мл) від приблизно 10 % до приблизно 20 %.
19. Водна фармацевтична суспензія за п. 7, в якій ксиліт, сорбіт або розчин сорбіту, або розчин мальтиту складає за вагою/об'ємом (г/100 мл) приблизно 10 %.
20. Водна фармацевтична суспензія за п. 7, в якій сахароза або інвертована сахароза складає за вагою/об'ємом (г/100 мл) від приблизно 10 % до приблизно 40 %.
21. Водна фармацевтична суспензія за п. 7, в якій сахароза або інвертована сахароза складає за вагою/об'ємом (г/100 мл) від приблизно 10 % до приблизно 20 %.
22. Водна фармацевтична суспензія за п. 7, в якій сахароза або інвертована сахароза складає за вагою/об'ємом (г/100 мл) приблизно 20 %.
23. Водна фармацевтична суспензія за п. 7, в якій у систему підсолоджувача входять ксиліт і сахароза.
24. Водна фармацевтичнасуспензія за п. 7, в якій у систему підсолоджувача входять ксиліт і сахароза, і відношення кількостей сахароза : ксиліт складає приблизно 2:1.
25. Водна фармацевтична суспензія за п. 7, в якій у систему підсолоджувача входять за вагою/об'ємом (г/100 мл) від 0 % до приблизно 20 % ксиліту і від приблизно 10 % до приблизно 40 % сахарози.
26. Водна фармацевтична суспензія за п. 7, в якій у систему підсолоджувача входять за вагою/об'ємом (г/100 мл) від приблизно 10 % до приблизно 20 % ксиліту і від приблизно 10 % до приблизно 20 % сахарози.
27. Водна фармацевтична суспензія за п. 7, в якій у систему підсолоджувача входять за вагою/об'ємом (г/100 мл) приблизно 20 % сахарози і приблизно 10 % ксиліту.
28. Водна фармацевтична суспензія за п. 7, в якій відношення кількостей (сахарози або інвертованої сахарози) : (ксиліту, сорбіту або розчину сорбіту, або розчину мальтиту) складає приблизно від 1:1 до 2:1.
29. Водна фармацевтична суспензія за п. 7, в якій відношення кількостей (сахарози або інвертованої сахарози) : (ксиліту, сорбіту або розчину сорбіту, або розчину мальтиту) складає приблизно 1:1.
30. Водна фармацевтична суспензія за п. 7, в якій відношення кількостей (сахарози або інвертованої сахарози) : (ксиліту, сорбіту або розчину сорбіту, або розчину мальтиту) складає приблизно 2:1.
31. Водна фармацевтична суспензія за п. 7, в якій пропілпарабен, пропілпарабен натрію або пропілпарабен калію складає за вагою/об'ємом (г/100 мл) від приблизно 0,014 % до приблизно 0,048 %.
32. Водна фармацевтична суспензія за п. 7, в якій пропілпарабен, пропілпарабен натрію або пропілпарабен калію складає за вагою/об'ємом (г/100 мл) від 0,027 % до приблизно 0,040 %.
33. Водна фармацевтична суспензія за п. 7, в якій бутилпарабен або бутилпарабен натрію складає за вагою/об'ємом (г/100 мл) від приблизно 0,0008 % до приблизно 0,0240 %.
34. Водна фармацевтична суспензія за п. 7, в якій бутилпарабен або бутилпарабен натрію складає за вагою/об'ємом (г/100 мл) від приблизно 0,014 % до приблизно 0,020 %.
35. Водна фармацевтична суспензія за п. 7, в якій динатрійетилендіамінтетраацетат складає за вагою/об'ємом (г/100 мл) від приблизно 0,10 % до приблизно 0,18 %.
36. Водна фармацевтична суспензія за п. 7, в якій динатрійетилендіамінтетраацетат складає за вагою/об'ємом (г/100 мл) від приблизно 0,12 % до приблизно 0,18 %.
37. Водна фармацевтична суспензія за п. 7, в якій система консерванту включає пропілпарабен, бутилпарабен і динатрійетилендіамінтетраацетат.
38. Водна фармацевтична суспензія за п. 7, в якій бензойна кислота або бензоат натрію складає за вагою/об'ємом (г/100 мл) від приблизно 0,10 % до приблизно 0,20 %.
39. Водна фармацевтична суспензія за п. 7, в якій бензойна кислота або бензоат натрію складає за вагою/об'ємом (г/100 мл) від приблизно 0,12 % до приблизно 0,18 %.
40. Водна фармацевтична суспензія за п. 7, в якій сорбінова кислота або сорбат калію складає за вагою/об'ємом (г/100 мл) від приблизно 0,10 % до приблизно 0,22 %.
41. Водна фармацевтична суспензія за п. 7, в якій сорбінова кислота або сорбат калію складає за вагою/об'ємом (г/100 мл) від приблизно 0,12 % до приблизно 0,20 %.
42. Водна фармацевтична суспензія за п. 7, в якій бензиловий спирт складає за вагою/об'ємом (г/100 мл) від приблизно 0,25 % до приблизно 1,00 %.
43. Водна фармацевтична суспензія за п. 7, в якій бензиловий спирт складає за вагою/об'ємом (г/100 мл) від приблизно 0,24 % до приблизно 0,50 %.
44. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл)
від приблизно 0,06 % до приблизно 1,05 % одноосновного фосфату натрію або відповідну еквівалентну кількість гідрату одноосновного фосфату натрію, або від приблизно 0,069 % до приблизно 1,190 % одноосновного фосфату калію; і
від приблизно 0,32 % до приблизно 2,69 % двоосновного фосфату натрію або відповідну еквівалентну кількість гідрату двоосновного фосфату натрію, або від приблизно 0,39 % до приблизно 3,30 % двоосновного фосфату калію або відповідну еквівалентну кількість гідрату двоосновного фосфату калію.
45. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл)
від приблизно 0,22 % до приблизно 0,87 % одноосновного фосфату натрію або відповідну еквівалентну кількість гідрату одноосновного фосфату натрію, або від приблизно 0,25 % до приблизно 0,99 % одноосновного фосфату калію; і
від приблизно 0,32 % до приблизно 1,15 % двоосновного фосфату натрію або відповідну еквівалентну кількість гідрату двоосновного фосфату натрію, або від приблизно 0,39 % до приблизно 1,41 % двоосновного фосфату калію або відповідну еквівалентну кількість гідрату двоосновного фосфату калію.
46. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл)
від приблизно 0,65 % до приблизно 0,87 % одноосновного фосфату натрію або відповідну еквівалентну кількість гідрату одноосновного фосфату натрію, або від приблизно 0,74 % до приблизно 0,99 % одноосновного фосфату калію; і
від приблизно 0,32 % до приблизно 0,67 % двоосновного фосфату натрію або відповідну еквівалентну кількість гідрату двоосновного фосфату натрію, або від приблизно 0,39 % до приблизно 0,82 % двоосновного фосфату калію або відповідну еквівалентну кількість гідрату двоосновного фосфату калію.
47. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл)
від приблизно 0,06 % до приблизно 1,05 % одноосновного фосфату натрію або відповідну еквівалентну кількість гідрату одноосновного фосфату натрію; і
від приблизно 0,32 % до приблизно 2,69 % двоосновного фосфату натрію або відповідну еквівалентну кількість гідрату двоосновного фосфату натрію.
48. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл)
від приблизно 0,22 % до приблизно 0,87 % одноосновного фосфату натрію або відповідну еквівалентну кількість гідрату одноосновного фосфату натрію; і
від приблизно 0,32 % до приблизно 1,15 % двоосновного фосфату натрію або відповідну еквівалентну кількість гідрату двоосновного фосфату натрію.
49. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл)
від приблизно 0,65 % до приблизно 0,87 % одноосновного фосфату натрію або відповідну еквівалентну кількість гідрату одноосновного фосфату натрію; і
від приблизно 0,32 % до приблизно 0,67 % двоосновного фосфату натрію або відповідну еквівалентну кількість гідрату двоосновного фосфату натрію.
50. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл) від приблизно 0,07 % до приблизно 1,20 % моногідрату одноосновного фосфату натрію і від приблизно 0,60 % до приблизно 5,08 % гептагідрату двоосновного фосфату натрію.
51. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл) від приблизно 0,26 % до приблизно 1,00 % моногідрату одноосновного фосфату натрію і від приблизно 0,60 % до приблизно 2,17 % гептагідрату двоосновного фосфату натрію.
52. Водна фармацевтична суспензія за п. 7, в якій як буфер використовується буферна система, що містить за вагою/об'ємом (г/100 мл) від приблизно 0,75 % до приблизно 1,00 % моногідрату одноосновного фосфату натрію і від приблизно 0,60 % до приблизно 1,25 % гептагідрату двоосновного фосфату натрію.
53. Водна фармацевтична суспензія за п. 7, в якій як змочувальна речовина використовується неіоногенна сполука.
54. Водна фармацевтична суспензія за п. 7, в якій як змочувальна речовина використовується полоксамер 407 або полоксамер 188.
55. Водна фармацевтична суспензія за п. 7, в якій як змочувальна речовина використовується полоксамер 407.
56. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,1 % до приблизно 3,0 % мікрокристалічної целюлози.
57. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 1,0 % до приблизно 2,0 % мікрокристалічної целюлози.
58. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 1,5 % до приблизно 2,0 % мікрокристалічної целюлози.
59. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,01 % до приблизно 0,20 % сахарину.
60. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,012 % до приблизно 0,130 % сахарину.
61. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,05 % до приблизно 0,10 % сахарину.
62. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,01 % до приблизно 1,00 % ацесульфаму калію або сукралози.
63. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,01 % до приблизно 0,50 % ацесульфаму калію або сукралози.
64. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,01 % до приблизно 0,10 % ацесульфаму калію або сукралози.
65. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,1 % до приблизно 15,0 % пропіленгліколю.
66. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 1,0 % до приблизно 10,0 % пропіленгліколю.
67. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 2,5 % до приблизно 5,0 % пропіленгліколю.
68. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від 0 % до приблизно 4 % поліетиленгліколю 200, поліетиленгліколю 300 або поліетиленгліколю 400.
69. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від 0 % до приблизно 2 % поліетиленгліколю 200, поліетиленгліколю 300 або поліетиленгліколю 400.
70. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від 0 % до приблизно 1% поліетиленгліколю 200, поліетиленгліколю 300 або поліетиленгліколю 400.
71. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від 0 % до приблизно 0,50 % замутнювального компонента.
72. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від 0 % до приблизно 0,10 % замутнювального компонента.
73. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,05 % до приблизно 0,10 % замутнювального компонента.
74. Водна фармацевтична суспензія за п. 71, в якій як замутнювальний компонент використовується двоокис титану.
75. Водна фармацевтична суспензія за п. 72, в якій як замутнювальний компонент використовується двоокис титану.
76. Водна фармацевтична суспензія за п. 73, в якій як замутнювальний компонент використовується двоокис титану.
77. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,20 % до приблизно 0,70 % ароматизуючої речовини.
78. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,30 % до приблизно 0,45 % ароматизуючої речовини.
79. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) від приблизно 0,40 % до приблизно 0,45 % ароматизуючої речовини.
80. Водна фармацевтична суспензія за п. 79, в якій ароматизуючою речовиною є ароматизатор «малина з вершками» або ароматизатор «апельсини з вершками».
81. Водна фармацевтична суспензія за п. 80, в якій ароматизуючою речовиною є ароматизатор «малина з вершками» або ароматизатор «апельсини з вершками».
82. Водна фармацевтична суспензія за п. 80, в якій ароматизуючою речовиною є ароматизатор «малина з вершками» або ароматизатор «апельсини з вершками».
83. Водна фармацевтична суспензія за п. 7, що містить за вагою/об'ємом (г/100 мл) приблизно 0,60 % форми І цвітер-іонного дигідрату фексофенадину, приблизно 2,5 % пропіленгліколю, приблизно 0,15 % динатрійетилендіамінтетраацетату, приблизно 0,034 % пропілпарабену, приблизно 0,017 % бутилпарабену, приблизно 0,35 % ксантанової камеді, приблизно 0,05 % полоксамеру 407, приблизно 1,25 % гептагідрату двоосновного фосфату натрію, приблизно 0,75 % моногідрату одноосновного фосфату натрію, приблизно 20 % сахарози і приблизно 10 % ксиліту.
84. Водна фармацевтична суспензія за п. 83, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) приблизно 0,1 % двоокису титану.
85. Водна фармацевтична суспензія за п. 84, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) приблизно 0,4 % ароматизатора «малина з вершками».
86. Водна фармацевтична суспензія за п. 7, що містить за вагою/об'ємом (г/100 мл) приблизно 0,60 % форми І цвітер-іонного дигідрату фексофенадину, приблизно 2,5 % пропіленгліколю, приблизно 0,15 % динатрійетилендіамінтетраацетату, приблизно 0,034 % пропілпарабену, приблизно 0,017 % бутилпарабену, приблизно 0,35 % ксантанової камеді, приблизно 0,05 % полоксамеру 407, приблизно 1,25 % гептагідрату двоосновного фосфату натрію, приблизно 0,75 % моногідрату одноосновного фосфату натрію, приблизно 10 % сахарози і приблизно 10 % ксиліту.
87. Водна фармацевтична суспензія за п. 86, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) приблизно 0,1 % двоокису титану.
88. Водна фармацевтична суспензія за п. 87, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) приблизно 0,4 % ароматизатора «малина з вершками».
89. Водна фармацевтична суспензія за п. 7, що містить за вагою/об'ємом (г/100 мл) приблизно 0,60 % форми І цвітер-іонного дигідрату фексофенадину, приблизно 2,5 % пропіленгліколю, приблизно 0,15 % динатрійетилендіамінтетраацетату, приблизно 0,034 % пропілпарабену, приблизно 0,017 % бутилпарабену, приблизно 0,35 % ксантанової камеді, приблизно 0,05 % полоксамеру 407, приблизно 1,25 % гептагідрату двоосновного фосфату натрію, приблизно 0,75 % моногідрату одноосновного фосфату натрію, приблизно 20% сахарози і приблизно 10 % розчину сорбіту.
90. Водна фармацевтична суспензія за п. 89, що додатково містить за вагою/об'ємом (г/100 мл) приблизно 0,1 % двоокису титану.
91. Водна фармацевтична суспензія за п. 90, що необов'язково додатково містить за вагою/об'ємом (г/100 мл) приблизно 0,4 % ароматизатора «малина з вершками».
92. Водна фармацевтична суспензія за п. 1, що містить за вагою/об'ємом (г/100 мл) приблизно 0,60 % форми І цвітер-іонного дигідрату фексофенадину, приблизно 2,5 % пропіленгліколю, приблизно 0,042 % пропілпарабену, приблизно 0,021 % бутилпарабену, приблизно 0,35 % ксантанової камеді, приблизно 0,05 % полоксамеру 407, приблизно 1,25 % гептагідрату двоосновного фосфату натрію, приблизно 0,75 % моногідрату одноосновного фосфату натрію, приблизно 10 % сахарози і приблизно 10 % ксиліту.
93. Водна фармацевтична суспензія за п. 1, що містить за вагою/об'ємом (г/100 мл) приблизно 0,60 % форми І цвітер-іонного дигідрату фексофенадину, приблизно 2,5 % пропіленгліколю, приблизно 0,042 % пропілпарабену, приблизно 0,021 % бутилпарабену, приблизно 0,35 % ксантанової камеді, приблизно 0,05 % полоксамеру 407, приблизно 1,25 % гептагідрату двоосновного фосфату натрію, приблизно 0,75 % моногідрату одноосновного фосфату натрію, приблизно 20 % сахарози і приблизно 10 % ксиліту.
Текст
1. Водна фармацевтична суспензія, в якій рН знаходиться в межах від приблизно 4,25 до приблизно 9,43, з коректуванням за допомогою буферної системи, що містить за вагою/об'ємом (г/100 мл) приблизно від 0,03 % до приблизно 4,80 % форми І цвітер-іонного дигідрату фексофенадину формули (І) з розміром частинок менше приблизно 280 мкм, що складають принаймні приблизно 90 % форми І цвітер-іонного дигідрату фексофенадину; C2 2 (19) 1 3 89584 4 10. Водна фармацевтична суспензія за п. 7, в якій близно 20 % ксиліту і від приблизно 10 % до призмочувальна речовина складає за вагою/об'ємом близно 20 % сахарози. (г/100 мл) від приблизно 0,01 % до приблизно 0,05 27. Водна фармацевтична суспензія за п. 7, в якій %. у систему підсолоджувача входять за ва11. Водна фармацевтична суспензія за п. 7, в якій гою/об'ємом (г/100 мл) приблизно 20 % сахарози і змочувальна речовина складає за вагою/об'ємом приблизно 10 % ксиліту. (г/100 мл) від приблизно 0,02 % до приблизно 0,05 28. Водна фармацевтична суспензія за п. 7, в якій %. відношення кількостей (сахарози або інвертованої 12. Водна фармацевтична суспензія за п. 7, в якій сахарози) : (ксиліту, сорбіту або розчину сорбіту, гідроколоїдна камедь складає за вагою/об'ємом або розчину мальтиту) складає приблизно від 1:1 (г/100 мл) від приблизно 0,23 % до приблизно 0,45 до 2:1. %. 29. Водна фармацевтична суспензія за п. 7, в якій 13. Водна фармацевтична суспензія за п. 7, в якій відношення кількостей (сахарози або інвертованої гідроколоїдна камедь складає за вагою/об'ємом сахарози) : (ксиліту, сорбіту або розчину сорбіту, (г/100 мл) від приблизно 0,35 % до приблизно 0,45 або розчину мальтиту) складає приблизно 1:1. %. 30. Водна фармацевтична суспензія за п. 7, в якій 14. Водна фармацевтична суспензія за п. 7, в якій відношення кількостей (сахарози або інвертованої як гідроколоїдна камедь використовується ксантасахарози) : (ксиліту, сорбіту або розчину сорбіту, нова камедь. або розчину мальтиту) складає приблизно 2:1. 15. Водна фармацевтична суспензія за п. 7, в якій 31. Водна фармацевтична суспензія за п. 7, в якій гідроксіетилцелюлоза складає за вагою/об'ємом пропілпарабен, пропілпарабен натрію або пропіл(г/100 мл) від приблизно 0,2 % до приблизно 0,4 парабен калію складає за вагою/об'ємом (г/100 мл) %. від приблизно 0,014 % до приблизно 0,048 %. 16. Водна фармацевтична суспензія за п. 7, в якій 32. Водна фармацевтична суспензія за п. 7, в якій гідроксіетилцелюлоза складає за вагою/об'ємом пропілпарабен, пропілпарабен натрію або пропіл(г/100 мл) від приблизно 0,2 % до приблизно 0,3 парабен калію складає за вагою/об'ємом (г/100 мл) %. від 0,027 % до приблизно 0,040 %. 17. Водна фармацевтична суспензія за п. 7, в якій 33. Водна фармацевтична суспензія за п. 7, в якій ксиліт, сорбіт або розчин сорбіту, або розчин бутилпарабен або бутилпарабен натрію складає мальтиту складає за вагою/об'ємом (г/100 мл) від за вагою/об'ємом (г/100 мл) від приблизно 0,0008 0 % до приблизно 20 %. % до приблизно 0,0240 %. 18. Водна фармацевтична суспензія за п. 7, в якій 34. Водна фармацевтична суспензія за п. 7, в якій ксиліт, сорбіт або розчин сорбіту, або розчин бутилпарабен або бутилпарабен натрію складає мальтиту складає за вагою/об'ємом (г/100 мл) від за вагою/об'ємом (г/100 мл) від приблизно 0,014 % приблизно 10 % до приблизно 20 %. до приблизно 0,020 %. 19. Водна фармацевтична суспензія за п. 7, в якій 35. Водна фармацевтична суспензія за п. 7, в якій ксиліт, сорбіт або розчин сорбіту, або розчин динатрійетилендіамінтетраацетат складає за вамальтиту складає за вагою/об'ємом (г/100 мл) гою/об'ємом (г/100 мл) від приблизно 0,10 % до приблизно 10 %. приблизно 0,18 %. 20. Водна фармацевтична суспензія за п. 7, в якій 36. Водна фармацевтична суспензія за п. 7, в якій сахароза або інвертована сахароза складає за динатрійетилендіамінтетраацетат складає за вавагою/об'ємом (г/100 мл) від приблизно 10 % до гою/об'ємом (г/100 мл) від приблизно 0,12 % до приблизно 40 %. приблизно 0,18 %. 21. Водна фармацевтична суспензія за п. 7, в якій 37. Водна фармацевтична суспензія за п. 7, в якій сахароза або інвертована сахароза складає за система консерванту включає пропілпарабен, бувагою/об'ємом (г/100 мл) від приблизно 10 % до тилпарабен і динатрійетилендіамінтетраацетат. приблизно 20 %. 38. Водна фармацевтична суспензія за п. 7, в якій 22. Водна фармацевтична суспензія за п. 7, в якій бензойна кислота або бензоат натрію складає за сахароза або інвертована сахароза складає за вагою/об'ємом (г/100 мл) від приблизно 0,10 % до вагою/об'ємом (г/100 мл) приблизно 20 %. приблизно 0,20 %. 23. Водна фармацевтична суспензія за п. 7, в якій 39. Водна фармацевтична суспензія за п. 7, в якій у систему підсолоджувача входять ксиліт і сахаробензойна кислота або бензоат натрію складає за за. вагою/об'ємом (г/100 мл) від приблизно 0,12 % до 24. Водна фармацевтична суспензія за п. 7, в якій приблизно 0,18 %. у систему підсолоджувача входять ксиліт і сахаро40. Водна фармацевтична суспензія за п. 7, в якій за, і відношення кількостей сахароза : ксиліт скласорбінова кислота або сорбат калію складає за дає приблизно 2:1. вагою/об'ємом (г/100 мл) від приблизно 0,10 % до 25. Водна фармацевтична суспензія за п. 7, в якій приблизно 0,22 %. у систему підсолоджувача входять за ва41. Водна фармацевтична суспензія за п. 7, в якій гою/об'ємом (г/100 мл) від 0 % до приблизно 20 % сорбінова кислота або сорбат калію складає за ксиліту і від приблизно 10 % до приблизно 40 % вагою/об'ємом (г/100 мл) від приблизно 0,12 % до сахарози. приблизно 0,20 %. 26. Водна фармацевтична суспензія за п. 7, в якій 42. Водна фармацевтична суспензія за п. 7, в якій у систему підсолоджувача входять за вабензиловий спирт складає за вагою/об'ємом (г/100 гою/об'ємом (г/100 мл) від приблизно 10 % до примл) від приблизно 0,25 % до приблизно 1,00 %. 5 89584 6 43. Водна фармацевтична суспензія за п. 7, в якій від приблизно 0,32 % до приблизно 1,15 % двоосбензиловий спирт складає за вагою/об'ємом (г/100 новного фосфату натрію або відповідну еквіваленмл) від приблизно 0,24 % до приблизно 0,50 %. тну кількість гідрату двоосновного фосфату на44. Водна фармацевтична суспензія за п. 7, в якій трію. як буфер використовується буферна система, що 49. Водна фармацевтична суспензія за п. 7, в якій містить за вагою/об'ємом (г/100 мл) як буфер використовується буферна система, що від приблизно 0,06 % до приблизно 1,05 % одномістить за вагою/об'ємом (г/100 мл) основного фосфату натрію або відповідну еквівавід приблизно 0,65 % до приблизно 0,87 % однолентну кількість гідрату одноосновного фосфату основного фосфату натрію або відповідну еквіванатрію, або від приблизно 0,069 % до приблизно лентну кількість гідрату одноосновного фосфату 1,190 % одноосновного фосфату калію; і натрію; і від приблизно 0,32 % до приблизно 2,69 % двоосвід приблизно 0,32 % до приблизно 0,67 % двоосновного фосфату натрію або відповідну еквіваленновного фосфату натрію або відповідну еквівалентну кількість гідрату двоосновного фосфату натну кількість гідрату двоосновного фосфату натрію, або від приблизно 0,39 % до приблизно 3,30 трію. % двоосновного фосфату калію або відповідну 50. Водна фармацевтична суспензія за п. 7, в якій еквівалентну кількість гідрату двоосновного фосяк буфер використовується буферна система, що фату калію. містить за вагою/об'ємом (г/100 мл) від приблизно 45. Водна фармацевтична суспензія за п. 7, в якій 0,07 % до приблизно 1,20 % моногідрату одноосяк буфер використовується буферна система, що новного фосфату натрію і від приблизно 0,60 % до містить за вагою/об'ємом (г/100 мл) приблизно 5,08 % гептагідрату двоосновного фовід приблизно 0,22 % до приблизно 0,87 % односфату натрію. основного фосфату натрію або відповідну еквіва51. Водна фармацевтична суспензія за п. 7, в якій лентну кількість гідрату одноосновного фосфату як буфер використовується буферна система, що натрію, або від приблизно 0,25 % до приблизно містить за вагою/об'ємом (г/100 мл) від приблизно 0,99 % одноосновного фосфату калію; і 0,26 % до приблизно 1,00 % моногідрату одноосвід приблизно 0,32 % до приблизно 1,15 % двоосновного фосфату натрію і від приблизно 0,60 % до новного фосфату натрію або відповідну еквіваленприблизно 2,17 % гептагідрату двоосновного фотну кількість гідрату двоосновного фосфату насфату натрію. трію, або від приблизно 0,39 % до приблизно 1,41 52. Водна фармацевтична суспензія за п. 7, в якій % двоосновного фосфату калію або відповідну як буфер використовується буферна система, що еквівалентну кількість гідрату двоосновного фосмістить за вагою/об'ємом (г/100 мл) від приблизно фату калію. 0,75 % до приблизно 1,00 % моногідрату одноос46. Водна фармацевтична суспензія за п. 7, в якій новного фосфату натрію і від приблизно 0,60 % до як буфер використовується буферна система, що приблизно 1,25 % гептагідрату двоосновного фомістить за вагою/об'ємом (г/100 мл) сфату натрію. від приблизно 0,65 % до приблизно 0,87 % одно53. Водна фармацевтична суспензія за п. 7, в якій основного фосфату натрію або відповідну еквіваяк змочувальна речовина використовується неіолентну кількість гідрату одноосновного фосфату ногенна сполука. натрію, або від приблизно 0,74 % до приблизно 54. Водна фармацевтична суспензія за п. 7, в якій 0,99 % одноосновного фосфату калію; і як змочувальна речовина використовується половід приблизно 0,32 % до приблизно 0,67 % двоосксамер 407 або полоксамер 188. новного фосфату натрію або відповідну еквівален55. Водна фармацевтична суспензія за п. 7, в якій тну кількість гідрату двоосновного фосфату наяк змочувальна речовина використовується полотрію, або від приблизно 0,39 % до приблизно 0,82 ксамер 407. % двоосновного фосфату калію або відповідну 56. Водна фармацевтична суспензія за п. 7, що еквівалентну кількість гідрату двоосновного фоснеобов'язково додатково містить за вагою/об'ємом фату калію. (г/100 мл) від приблизно 0,1 % до приблизно 3,0 % 47. Водна фармацевтична суспензія за п. 7, в якій мікрокристалічної целюлози. як буфер використовується буферна система, що 57. Водна фармацевтична суспензія за п. 7, що містить за вагою/об'ємом (г/100 мл) необов'язково додатково містить за вагою/об'ємом від приблизно 0,06 % до приблизно 1,05 % одно(г/100 мл) від приблизно 1,0 % до приблизно 2,0 % основного фосфату натрію або відповідну еквівамікрокристалічної целюлози. лентну кількість гідрату одноосновного фосфату 58. Водна фармацевтична суспензія за п. 7, що натрію; і необов'язково додатково містить за вагою/об'ємом від приблизно 0,32 % до приблизно 2,69 % двоос(г/100 мл) від приблизно 1,5 % до приблизно 2,0 % новного фосфату натрію або відповідну еквіваленмікрокристалічної целюлози. тну кількість гідрату двоосновного фосфату на59. Водна фармацевтична суспензія за п. 7, що трію. необов'язково додатково містить за вагою/об'ємом 48. Водна фармацевтична суспензія за п. 7, в якій (г/100 мл) від приблизно 0,01 % до приблизно 0,20 як буфер використовується буферна система, що % сахарину. містить за вагою/об'ємом (г/100 мл) 60. Водна фармацевтична суспензія за п. 7, що від приблизно 0,22 % до приблизно 0,87 % однонеобов'язково додатково містить за вагою/об'ємом основного фосфату натрію або відповідну еквіва(г/100 мл) від приблизно 0,012 % до приблизно лентну кількість гідрату одноосновного фосфату 0,130 % сахарину. натрію; і 7 89584 8 61. Водна фармацевтична суспензія за п. 7, що (г/100 мл) від приблизно 0,20 % до приблизно 0,70 необов'язково додатково містить за вагою/об'ємом % ароматизуючої речовини. (г/100 мл) від приблизно 0,05 % до приблизно 0,10 78. Водна фармацевтична суспензія за п. 7, що % сахарину. необов'язково додатково містить за вагою/об'ємом 62. Водна фармацевтична суспензія за п. 7, що (г/100 мл) від приблизно 0,30 % до приблизно 0,45 необов'язково додатково містить за вагою/об'ємом % ароматизуючої речовини. (г/100 мл) від приблизно 0,01 % до приблизно 1,00 79. Водна фармацевтична суспензія за п. 7, що % ацесульфаму калію або сукралози. необов'язково додатково містить за вагою/об'ємом 63. Водна фармацевтична суспензія за п. 7, що (г/100 мл) від приблизно 0,40 % до приблизно 0,45 необов'язково додатково містить за вагою/об'ємом % ароматизуючої речовини. (г/100 мл) від приблизно 0,01 % до приблизно 0,50 80. Водна фармацевтична суспензія за п. 79, в якій % ацесульфаму калію або сукралози. ароматизуючою речовиною є ароматизатор ”ма64. Водна фармацевтична суспензія за п. 7, що лина з вершками” або ароматизатор “апельсини з необов'язково додатково містить за вагою/об'ємом вершками”. (г/100 мл) від приблизно 0,01 % до приблизно 0,10 81. Водна фармацевтична суспензія за п. 80, в якій % ацесульфаму калію або сукралози. ароматизуючою речовиною є ароматизатор “ма65. Водна фармацевтична суспензія за п. 7, що лина з вершками” або ароматизатор “апельсини з необов'язково додатково містить за вагою/об'ємом вершками”. (г/100 мл) від приблизно 0,1 % до приблизно 15,0 82. Водна фармацевтична суспензія за п. 80, в якій % пропіленгліколю. ароматизуючою речовиною є ароматизатор “ма66. Водна фармацевтична суспензія за п. 7, що лина з вершками” або ароматизатор “апельсини з необов'язково додатково містить за вагою/об'ємом вершками”. (г/100 мл) від приблизно 1,0 % до приблизно 10,0 83. Водна фармацевтична суспензія за п. 7, що % пропіленгліколю. містить за вагою/об'ємом (г/100 мл) приблизно 67. Водна фармацевтична суспензія за п. 7, що 0,60 % форми І цвітер-іонного дигідрату фексофенеобов'язково додатково містить за вагою/об'ємом надину, приблизно 2,5 % пропіленгліколю, прибли(г/100 мл) від приблизно 2,5 % до приблизно 5,0 % зно 0,15 % динатрійетилендіамінтетраацетату, пропіленгліколю. приблизно 0,034 % пропілпарабену, приблизно 68. Водна фармацевтична суспензія за п. 7, що 0,017 % бутилпарабену, приблизно 0,35 % ксантанеобов'язково додатково містить за вагою/об'ємом нової камеді, приблизно 0,05 % полоксамеру 407, (г/100 мл) від 0 % до приблизно 4 % поліетиленгліприблизно 1,25 % гептагідрату двоосновного фоколю 200, поліетиленгліколю 300 або поліетиленгсфату натрію, приблизно 0,75 % моногідрату одліколю 400. ноосновного фосфату натрію, приблизно 20 % 69. Водна фармацевтична суспензія за п. 7, що сахарози і приблизно 10 % ксиліту. необов'язково додатково містить за вагою/об'ємом 84. Водна фармацевтична суспензія за п. 83, що (г/100 мл) від 0 % до приблизно 2 % поліетиленглінеобов'язково додатково містить за вагою/об'ємом колю 200, поліетиленгліколю 300 або поліетиленг(г/100 мл) приблизно 0,1 % двоокису титану. ліколю 400. 85. Водна фармацевтична суспензія за п. 84, що 70. Водна фармацевтична суспензія за п. 7, що необов'язково додатково містить за вагою/об'ємом необов'язково додатково містить за вагою/об'ємом (г/100 мл) приблизно 0,4 % ароматизатора “мали(г/100 мл) від 0 % до приблизно 1% поліетиленгліна з вершками”. колю 200, поліетиленгліколю 300 або поліетиленг86. Водна фармацевтична суспензія за п. 7, що ліколю 400. містить за вагою/об'ємом (г/100 мл) приблизно 71. Водна фармацевтична суспензія за п. 7, що 0,60 % форми І цвітер-іонного дигідрату фексофенеобов'язково додатково містить за вагою/об'ємом надину, приблизно 2,5 % пропіленгліколю, прибли(г/100 мл) від 0 % до приблизно 0,50 % замутнюзно 0,15 % динатрійетилендіамінтетраацетату, вального компонента. приблизно 0,034 % пропілпарабену, приблизно 72. Водна фармацевтична суспензія за п. 7, що 0,017 % бутилпарабену, приблизно 0,35 % ксантанеобов'язково додатково містить за вагою/об'ємом нової камеді, приблизно 0,05 % полоксамеру 407, (г/100 мл) від 0 % до приблизно 0,10 % замутнюприблизно 1,25 % гептагідрату двоосновного фовального компонента. сфату натрію, приблизно 0,75 % моногідрату од73. Водна фармацевтична суспензія за п. 7, що ноосновного фосфату натрію, приблизно 10 % необов'язково додатково містить за вагою/об'ємом сахарози і приблизно 10 % ксиліту. (г/100 мл) від приблизно 0,05 % до приблизно 0,10 87. Водна фармацевтична суспензія за п. 86, що % замутнювального компонента. необов'язково додатково містить за вагою/об'ємом 74. Водна фармацевтична суспензія за п. 71, в якій (г/100 мл) приблизно 0,1 % двоокису титану. як замутнювальний компонент використовується 88. Водна фармацевтична суспензія за п. 87, що двоокис титану. необов'язково додатково містить за вагою/об'ємом 75. Водна фармацевтична суспензія за п. 72, в якій (г/100 мл) приблизно 0,4 % ароматизатора “малияк замутнювальний компонент використовується на з вершками”. двоокис титану. 89. Водна фармацевтична суспензія за п. 7, що 76. Водна фармацевтична суспензія за п. 73, в якій містить за вагою/об'ємом (г/100 мл) приблизно як замутнювальний компонент використовується 0,60 % форми І цвітер-іонного дигідрату фексофедвоокис титану. надину, приблизно 2,5 % пропіленгліколю, прибли77. Водна фармацевтична суспензія за п. 7, що зно 0,15 % динатрійетилендіамінтетраацетату, необов'язково додатково містить за вагою/об'ємом приблизно 0,034 % пропілпарабену, приблизно 9 89584 10 0,017 % бутилпарабену, приблизно 0,35 % ксантабутилпарабену, приблизно 0,35 % ксантанової нової камеді, приблизно 0,05 % полоксамеру 407, камеді, приблизно 0,05 % полоксамеру 407, приприблизно 1,25 % гептагідрату двоосновного фоблизно 1,25 % гептагідрату двоосновного фосфату сфату натрію, приблизно 0,75 % моногідрату однатрію, приблизно 0,75 % моногідрату одноосновноосновного фосфату натрію, приблизно 20% саного фосфату натрію, приблизно 10 % сахарози і харози і приблизно 10 % розчину сорбіту. приблизно 10 % ксиліту. 90. Водна фармацевтична суспензія за п. 89, що 93. Водна фармацевтична суспензія за п. 1, що додатково містить за вагою/об'ємом (г/100 мл) містить за вагою/об'ємом (г/100 мл) приблизно приблизно 0,1 % двоокису титану. 0,60 % форми І цвітер-іонного дигідрату фексофе91. Водна фармацевтична суспензія за п. 90, що надину, приблизно 2,5 % пропіленгліколю, приблинеобов'язково додатково містить за вагою/об'ємом зно 0,042 % пропілпарабену, приблизно 0,021 % (г/100 мл) приблизно 0,4 % ароматизатора “малибутилпарабену, приблизно 0,35 % ксантанової на з вершками”. камеді, приблизно 0,05 % полоксамеру 407, при92. Водна фармацевтична суспензія за п. 1, що близно 1,25 % гептагідрату двоосновного фосфату містить за вагою/об'ємом (г/100 мл) приблизно натрію, приблизно 0,75 % моногідрату однооснов0,60 % форми І цвітер-іонного дигідрату фексофеного фосфату натрію, приблизно 20 % сахарози і надину, приблизно 2,5 % пропіленгліколю, приблиприблизно 10 % ксиліту. зно 0,042 % пропілпарабену, приблизно 0,021 % Даний винахід присвячений композиції водної суспензії форми І цвітеріонного дигідрату фексофенадину. Фексофенадин (fexofenadine) і його фармацевтично прийнятні солі використовуються як антигістамінні препарати відповідно до інформації, що розкривається в патенті U.S. №4254129 і публікації U.S. №2002-0193603 Α1. Фексофенадину гідрохлорид є в продажу у всіляких твердих лікарських формах, включаючи капсули з миттєвим вивільненням, таблетки з миттєвим вивільненням і таблетки з тривалим вивільненням. При цьому відсутня інформація у відношенні водних суспензій фексофенадину або кристалічної форми цвітеріонного дигідрату фексофенадину. Також відсутні дані про будь-яку суспензію, що особливо зручна для спрощення прийому для дітей або для прийому дорослими з проблемами ковтання капсул і таблеток, якою є суспензія, представлена в даному винаході. Даний винахід присвячений водній фармацевтичній суспензії, забуференій до рН від приблизно 4,25 до приблизно 9,43, що містить за вагою/обсягом (г/100мл) приблизно від 0,03% до приблизно 4,80% форми І цвітеріонного дигідрату фексофенадину з формулою (І) з розміром частинок менше приблизно 280мкм, що складають принаймні приблизно 90% форми І цвітеріонного дигідрату фексофенадину; від приблизно 0,01% до приблизно 0,20% змочувальної речовини; суспендувальну речовину, вибирану з від приблизно 0,10% до приблизно 0,50% гідроколоїдної камеді або від приблизно 0,1% до приблизно 1,0% гідроксіетилцелюлози; підсолоджувач, що включає від приблизно 5% до приблизно 40% сахарози або інвертованої сахарози; і від 0% до приблизно 40% ксиліту, сорбіту або розчину сорбіту, або розчину мальтиту; за умови що відношення кількостей (сахарози або інвертованої сахарози): (ксиліту, сорбіту або розчину сорбіту, або розчину мальтиту) дорівнює або більше приблизно 1:1; і систему консерванту, що включає від приблизно 0,010% до приблизно 0,058% пропілпарабену, пропілпарабену натрію або пропілпарабену калію; і від приблизно 0,0005% до приблизно 0,0350% бутилпарабену або бутилпарабену натрію. Даний винахід більш докладно обговорюється нижче за допомогою наведених фігур і на основі докладного опису. Фіг.1 містить спектри твердофазного ЯМР суспензії фексофенадину, зняті після додавання безводної форми І фексофенадину гідрохлориду до буферного розчину в процесі приготування, спектри безводної форми І фексофенадину гідрохлориду, а також форми І цвітеріонного дигідрату фексофенадину. Фіг.2 містить спектри рентгенівської порошкової дифракції суспензії фексофенадину, зняті після додавання безводної форми І фексофенадину гідрохлориду до буферного розчину в процесі приготування, а також форми І цвітеріонного дигідрату фексофенадину. Фіг.3 містить Фур'є-ІЧ спектр безводної форми І фексофенадину гідрохлориду. Фіг.4 містить Фур'є-ІЧ спектр форми І цвітеріонного дигідрату фексофенадину. Визначення термінів Використовувані вище і у всьому тексті опису винаходу наступні терміни, якщо не вказано інакше, мають наступні прийняті значення. «Відповідна еквівалентна кількість гідрату двоосновного фосфату калію» означає кількість гідратованої форми двоосновного фосфату калію, що еквівалентна відповідній кількості двоосновно 11 89584 12 го фосфату калію, необхідного для коректування «Розмір частинок» визначається за допомогою рН суспензії. малокутового лазерного світлорозсіювання «90% ДІ» означає 90-процентний довірчий ін(МКЛСР) і розраховується для сфер еквівалентнотервал. го діаметра для тестового зразка. Розподіл части«Відповідна еквівалентна кількість гідрату однок за розмірами описується як % від обсягу розноосновного фосфату натрію» означає кількість поділу вище або нижче заданого діаметра. гідратованої форми одноосновного фосфату наНаприклад, Dv10, Dv50 і Dv90 відносяться, відповідтрію, що еквівалентна відповідній кількості одноно, до діаметра частинок, з яких 10, 50 і 90% всьоосновного фосфату натрію, необхідного для корего обсягу розподілу частинок за розмірами виявктування рН суспензії. ляється нижче вказаного діаметра. ' «Відповідна еквівалентна кількість гідрату «Полоксамер» - блок-співполімер a -гідро-wдвоосновного фосфату натрію» означає кількість гідроксиполі(оксіетилен) полі(оксипропілен) погідратованої форми двоосновного фосфату налі(оксіетилену). До прикладів полоксамеру віднотрію, що еквівалентна відповідній кількості двооссяться полоксамер 407 і полоксамер 188. новного фосфату натрію, необхідного для корек«Одноосновний фосфат калію» означає тування рН суспензії. КН2РО4. «ППК(О-¥)» означає площа під кривою часової «Двоосновний фосфат калію» означає залежності концентрації в плазмі, екстрапольоваК2НРО4. ної до нескінченності. «Гідрат двоосновного фосфату калію» вклю«Смакс» означає максимальну концентрацію в чає, наприклад тригідрат двоосновного фосфату плазмі. калію і гексагідрат двоосновного фосфату калію. «Буферна система» використовується для ко«Одноосновний фосфат натрію» означає ректування рН суспензії, щоб звести до мінімуму Na2PO4. розчинність компонента фексофенадину і підтри«Гідрат одноосновного фосфату натрію» мувати фексофенадин у формі І цвітеріонного дивключає, наприклад, моногідрат одноосновного гідрату фексофенадину як мінімум протягом 18 фосфату натрію і дигідрат одноосновного фосфамісяців; а більш точно, принаймні приблизно 24 ту натрію. місяця. Прикладами буферної системи є система «Двоосновний фосфат натрію» означає (лимонна кислота/двоосновний фосфат натрію Na2HPO4. або гідрат двоосновного фосфату натрію), систе«Гідрат двоосновного фосфату натрію» вклюма (бурштинова кислота/гідроксид натрію), систечає, наприклад, дигідрат двоосновного фосфату ма (лимонна кислота/цитрат натрію, гідрат цитрату натрію, гептагідрат двоосновного фосфату натрію і натрію або цитрат калію), система (малеїнова кисдодекагідрат двоосновного фосфату натрію. лота/гідроксид натрію), система (фумарова кисло«Розчин сорбіту» включає розчин сорбіту за та/гідроксид натрію), система (одноосновний фоФармакопеєю США і розчин сорбіту, що не кристасфат натрію, гідрат одноосновного фосфату лізується, за національним формуляром відповіднатрію або одноосновний фосфат кано до визначення Фармакопеї США. Розчин сорбілію/двоосновний фосфат натрію, гідрат двоосновту за Фармакопеєю США являє собою водний ного фосфату натрію, двоосновний фосфат калію розчин, що містить не менше 64% D-сорбіту (заабо гідрат двоосновного фосфату калію), зокрема, звичай маркується як 70%). Розчин сорбіту, що не система (одноосновний фосфат натрію, гідрат кристалізується, у натуральній формі являє собою одноосновного фосфату натрію або одноосновний водний розчин, що містить не менше 45% Dфосфат калію/двоосновний фосфат натрію, гідрат сорбіту. двоосновного фосфату натрію, двоосновний фосНижче наводяться конкретні варіанти здійсфат калію або гідрат двоосновного фосфату канення, що відносяться до даного винаходу, з полію), більш точно (одноосновний фосфат натрію, силанням на його опис у даному документі. гідрат одноосновного фосфату наОдним з конкретних варіантів здійснення витрію/двоосновний фосфат натрію, гідрат двооснонаходу є водна фармацевтична суспензія, в якій вного фосфату натрію), і ще більш точно, система система консервантів додатково включає від при(моногідрат одноосновного фосфату наблизно 0,06% до приблизно 0,26% динатрійтрію/гептагідрат двоосновного фосфату натрію). етилендіамінтетраацетату, від приблизно 0,01% «КВ%» означає коефіцієнт варіації. до приблизно 0,27% бензойної кислоти або бензо«Геометричне середнє за МНК» означає геоату натрію, від приблизно 0,01% до приблизно метричне середнє за методом найменших квадра0,30% сорбінової кислоти або сорбату калію або тів. від приблизно 0,10% до приблизно 1,50% бензи«Розчин мальтиту» являє собою водний розлового спирту. чин гідрогенізованого, частково гідролізованого Іншим конкретним варіантом здійснення винакрохмалю, що містить більше приблизно 50ваг. % ходу є водна фармацевтична суспензія, в якій рН D-мальтиту (С12Н24О11), а зазвичай більше 90ваг. знаходиться в межах від приблизно 5,00 до при% D-мальтиту і менше приблизно 16ваг. % Dблизно 8,00; або більш точно, від 5,80 до приблизсорбіту (С6Н14O6). Він також відомий за назвою но 7,00. гідрогенізованої крохмальної патоки (загальний Іншим конкретним варіантом здійснення винатермін). Він зазвичай містить D-мальтит поряд з Dходу є водна фармацевтична суспензія, в якій сорбітом і гідрогенізованими оліго- і полісахарирозмір частинок менше приблизно 50мкм; або, дами. 13 89584 14 більш точно, 40мкм; принаймні для приблизно 90% Іншим конкретним варіантом здійснення винаформи І цвітеріонного дигідрату фексофенадину. ходу є водна фармацевтична суспензія, в якій відІншим конкретним варіантом здійснення винаношення кількостей (сахарози або інвертованої ходу є водна фармацевтична суспензія, в якій фосахарози): (ксиліту, сорбіту або розчину сорбіту, рма І цвітеріонного дигідрату фексофенадину або розчину мальтиту) дорівнює приблизно від 1:1 складає за вагою/об'ємом (г/100мл) від приблизно до 2:2. 0,60% до приблизно 1,20%; більш точно, приблизІншим конкретним варіантом здійснення винано 0,6%. ходу є водна фармацевтична суспензія, в якій відІншим конкретним варіантом здійснення винаношення кількостей (сахарози або інвертованої ходу є водна фармацевтична суспензія, в якій сахарози): (ксиліту, сорбіту або розчину сорбіту, змочувальна речовина складає за вагою/об'ємом або розчину мальтиту) дорівнює приблизно 2:1. (г/100мл) від приблизно 0,01% до приблизно Іншим конкретним варіантом здійснення вина0,05%; більш точно, від приблизно 0,02% до приходу є водна фармацевтична суспензія, в якій відблизно 0,05%. ношення кількостей (сахарози або інвертованої Іншим конкретним варіантом здійснення винасахарози): (ксиліту, сорбіту або розчину сорбіту, ходу є водна фармацевтична суспензія, в якій гідабо розчину мальтиту) дорівнює приблизно 1:1. роколоїдна камедь складає за вагою/об'ємом Іншим конкретним варіантом здійснення вина(г/100мл) від приблизно 0,23% до приблизно ходу є водна фармацевтична суспензія, в якій 0,45%; більш точно, від приблизно 0,35% до припропілпарабен, пропілпарабен натрію або пропілблизно 0,45%. парабен калію складає за вагою/об'ємом (г/100мл) Іншим конкретним варіантом здійснення винавід приблизно 0,014% до приблизно 0,048%; або ходу є водна фармацевтична суспензія, в якій як зокрема, від приблизно 0,027% до приблизно гідроколоїдна камедь використовується ксантано0,04%. ва камедь. Іншим конкретним варіантом здійснення винаІншим конкретним варіантом здійснення винаходу є водна фармацевтична суспензія, в якій буходу є водна фармацевтична суспензія, в якій гідтилпарабен або бутилпарабену натрію складає за роксіетилцелюлоза складає за вагою/об'ємом вагою/об'ємом (г/100мл) від приблизно 0,0008% до (г/100мл) від приблизно 0,2% до приблизно 0,4%; приблизно 0,0240%; зокрема, від приблизно або більш точно, від приблизно 0,2% до приблизно 0,014% до приблизно 0,020%. 0,3%. Іншим конкретним варіантом здійснення винаІншим конкретним варіантом здійснення винаходу є водна фармацевтична суспензія, в якій диходу є водна фармацевтична суспензія, в якій ксинатрій-етилендіамінтетраацетат складає за валіт, сорбіт або розчин сорбіту, або розчин мальтигою/об'ємом (г/100мл) від приблизно 0,10% до ту складає за вагою/об'ємом (г/100мл) від 0% до приблизно 0,18%; зокрема, від приблизно 0,12% приблизно 20%; більш точно, від приблизно 10% до приблизно 0,18%. до приблизно 20%, і ще точніше, приблизно 10%. Іншим конкретним варіантом здійснення винаІншим конкретним варіантом здійснення винаходу є водна фармацевтична суспензія, в якій сисходу є водна фармацевтична суспензія, в якій сатема консерванту включає пропілпарабен, бутилхароза або інвертована сахароза складає за вапарабен і динатрій-етилендіамінтетраацетат. гою/об'ємом (г/100мл) від приблизно 10% до Іншим конкретним варіантом здійснення винаприблизно 40%; більш точно, від приблизно 10% ходу є водна фармацевтична суспензія, в якій до приблизно 20%, а ще точніше, приблизно 20%. бензойна кислота або бензоат натрію складає за Іншим конкретним варіантом здійснення винавагою/об'ємом (г/100мл) від приблизно 0,10% до ходу є водна фармацевтична суспензія, в якій у приблизно 0,20%; зокрема, від приблизно 0,12% систему підсолоджувача входять ксиліт і сахароза. до приблизно 0,18%. Іншим конкретним варіантом здійснення винаІншим конкретним варіантом здійснення винаходу є водна фармацевтична суспензія, в якій у ходу є водна фармацевтична суспензія, в якій сосистему підсолоджувача входять ксиліт і сахароза, рбінова кислота або сорбат калію складає за ваі відношення кількостей сахароза: ксиліт складає гою/об'ємом (г/100мл) від приблизно 0,10% до приблизно 2:1. приблизно 0,22%; зокрема, від приблизно 0,12% Іншим конкретним варіантом здійснення винадо приблизно 0,20%. ходу є водна фармацевтична суспензія, в якій у Іншим конкретним варіантом здійснення винасистему підсолоджувача входять за вагою/об'ємом ходу є водна фармацевтична суспензія, в якій бе(г/100мл) від 0% до приблизно 20% ксиліту і від нзиловий спирт складає за вагою/об'ємом приблизно 10% до приблизно 40% сахарози. (г/100мл) від приблизно 0,25% до приблизно Іншим конкретним варіантом здійснення вина1,00%; зокрема, від приблизно 0,25% до приблизходу є водна фармацевтична суспензія, в якій у но 0,50%. систему підсолоджувача входять за вагою/об'ємом Іншим конкретним варіантом здійснення вина(г/100мл) від приблизно 10% до приблизно 20% ходу є водна фармацевтична суспензія, в якій як ксиліту і від 10% до приблизно 20% сахарози. буфер використовується буферна система, що Іншим конкретним варіантом здійснення винамістить за вагою/об'ємом (г/100мл) ходу є водна фармацевтична суспензія, в якій у від приблизно 0,06% до приблизно 1,05% одсистему підсолоджувача входять за вагою/об'ємом ноосновного фосфату натрію або відповідну екві(г/100мл) приблизно 20% сахарози і приблизно валентну кількість гідрату одноосновного фосфату 10% ксиліту. натрію, або від приблизно 0,069% до приблизно 1,190% одноосновного фосфату калію; і 15 89584 16 від приблизно 0,30% до приблизно 2,69% двобуфер використовується буферна система, що основного фосфату натрію або відповідну еквівамістить за вагою/об'ємом (г/100мл) лентну кількість гідрату двоосновного фосфату від приблизно 0,65% до приблизно 0,87% однатрію, або від приблизно 0,39% до приблизно ноосновного фосфату натрію або відповідну екві3,30% двоосновного фосфату калію або відповідну валентну кількість гідрату одноосновного фосфату еквівалентну кількість гідрату двоосновного фоснатрію; і фату калію. від приблизно 0,32% до приблизно 0,67% двоІншим конкретним варіантом здійснення винаосновного фосфату натрію або відповідну еквіваходу є водна фармацевтична суспензія, в якій як лентну кількість гідрату двоосновного фосфату буфер використовується буферна система, що натрію. містить за вагою/об'ємом (г/100мл) Іншим конкретним варіантом здійснення винавід приблизно 0,22% до приблизно 0,87% одходу є водна фармацевтична суспензія, в якій як ноосновного фосфату натрію або відповідну еквібуфер використовується буферна система, що валентну кількість гідрату одноосновного фосфату містить за вагою/об'ємом (г/100мл) від приблизно натрію, або від приблизно 0,25% до приблизно 0,07% до приблизно 1,20% моногідрату одноосно0,99% одноосновного фосфату калію; і вного фосфату натрію і від приблизно 0,60% до від приблизно 0,32% до приблизно 1,15% двоприблизно 5,08% гептагідрату двоосновного фососновного фосфату натрію або відповідну еквівафату натрію. лентну кількість гідрату двоосновного фосфату Іншим конкретним варіантом здійснення винанатрію, або від приблизно 0,39% до приблизно ходу є водна фармацевтична суспензія, в якій як 1,41% двоосновного фосфату калію або відповідну буфер використовується буферна система, що еквівалентну кількість гідрату двоосновного фосмістить за вагою/об'ємом (г/100мл) від приблизно фату калію. 0,26% до приблизно 1,00% моногідрату одноосноІншим конкретним варіантом здійснення винавного фосфату натрію і від приблизно 0,60% до ходу є водна фармацевтична суспензія, в якій як приблизно 2,17% гептагідрату двоосновного фосбуфер використовується буферна система, що фату натрію. містить за вагою/об'ємом (г/100мл) Іншим конкретним варіантом здійснення винавід приблизно 0,65% до приблизно 0,87% одходу є водна фармацевтична суспензія, в якій як ноосновного фосфату натрію або відповідну еквібуфер використовується буферна система, що валентну кількість гідрату одноосновного фосфату містить за вагою/об'ємом (г/100мл) від приблизно натрію, або від приблизно 0,74% до приблизно 0,75% до приблизно 1,00% моногідрату одноосно0,99% одноосновного фосфату калію; і вного фосфату натрію і від приблизно 0,60% до від приблизно 0,32% до приблизно 0,67% двоприблизно 1,25% гептагідрату двоосновного фососновного фосфату натрію або відповідну еквівафату натрію. лентну кількість гідрату двоосновного фосфату Іншим конкретним варіантом здійснення винанатрію, або від ходу є водна фармацевтична суспензія, в якій як приблизно 0,39% до приблизно 0,82% двоосзмочувальна речовина використовується неіононовного фосфату калію або відповідну еквівалентгенна сполука, наприклад, полоксамер 407 і полону кількість гідрату двоосновного фосфату калію. ксамер 188. Іншим конкретним варіантом здійснення винаІншим конкретним варіантом здійснення винаходу є водна фармацевтична суспензія, в якій як ходу є водна фармацевтична суспензія, що додатбуфер використовується буферна система, що ково також містить за вагою/об'ємом (г/100мл) від містить за вагою/об'ємом (г/100мл) приблизно 0,1% до приблизно 3,0%; більш точно, від приблизно 0,06% до приблизно 1,05% одвід приблизно 1,0% до приблизно 2,0%, а ще точноосновного фосфату натрію або відповідну еквініше, від приблизно 1,5% до приблизно 2,0% міквалентну кількість гідрату одноосновного фосфату рокристалічної целюлози. натрію; і Іншим конкретним варіантом здійснення винавід приблизно 0,32% до приблизно 2,69% двоходу є водна фармацевтична суспензія, що додатосновного фосфату натрію або відповідну еквіваково також містить за вагою/об'ємом (г/100мл) від лентну кількість гідрату двоосновного фосфату приблизно 0,01% до приблизно 0,20%; більш точнатрію. но, від приблизно 0,012% до приблизно 0,13%, а Іншим конкретним варіантом здійснення винаще точніше, від приблизно 0,05% до приблизно ходу є водна фармацевтична суспензія, в якій як 0,10% сахарину. буфер використовується буферна система, що Іншим конкретним варіантом здійснення винамістить за вагою/об'ємом (г/100мл) ходу є водна фармацевтична суспензія, що додатвід приблизно 0,22% до приблизно 0,87% одково також містить за вагою/об'ємом (г/100мл) від ноосновного фосфату натрію або відповідну еквіприблизно 0,01% до приблизно 1,00%; більш точвалентну кількість гідрату одноосновного фосфату но, від приблизно 0,01% до приблизно 0,50%, а ще натрію; і точніше, від приблизно 0,01% до приблизно 0,10% від приблизно 0,32% до приблизно 1,15% двоацесульфаму або калію сукралози. основного фосфату натрію або відповідну еквіваІншим конкретним варіантом здійснення виналентну кількість гідрату двоосновного фосфату ходу є водна фармацевтична суспензія, що додатнатрію. ково також містить за вагою/об'ємом (г/100мл) від Іншим конкретним варіантом здійснення винаприблизно 0,1% до приблизно 15,0%; більш точно, ходу є водна фармацевтична суспензія, в якій як від приблизно 1,0% до приблизно 10,0%, а ще то 17 89584 18 чніше, від приблизно 2,5% до приблизно 5,0% теріонного дигідрату фексофенадину, приблизно співрозчинника, наприклад, пропіленгліколю. 2,5% пропіленгліколю, приблизно 0,15% динатрійІншим конкретним варіантом здійснення винаетилендіамінтетраацетату, приблизно 0,034% ходу є водна фармацевтична суспензія, що додатпропілпарабену, приблизно 0,017% бутилпарабеково також містить за вагою/об'ємом (г/100мл) від ну, приблизно 0,35% ксантанової камеді, приблиз0% до приблизно 4%; більш точно, від 0% до прино 0,05% полоксамеру 407, приблизно 1,25% гепблизно 2%, а ще точніше, від 0% до приблизно 1% тагідрату двоосновного фосфату натрію, співрозчинника, наприклад поліетиленгліколю 200, приблизно 0,75% моногідрату одноосновного фополіетиленгліколю 300 або поліетиленгліколю 400. сфату натрію, приблизно 20% сахарози, приблизІншим конкретним варіантом здійснення винано 10% ксиліту, приблизно 0,1% двоокису титану і ходу є водна фармацевтична суспензія, що додатприблизно 0,4% ароматизатора «малина з вершково також містить за вагою/об'ємом (г/100 мл) від ками». 0% до приблизно 0,50%; більш точно, від 0% до Іншим конкретним варіантом здійснення винаприблизно 0,10%, а ще точніше, від приблизно ходу є водна фармацевтична суспензія, у буфері 0,05% до приблизно 0,10% замутнювального комдо рН від приблизно 5,80 до приблизно 7,00, що понента, наприклад, двоокису титану. містить за вагою/об'ємом (г/100мл) приблизно Іншим конкретним варіантом здійснення вина0,60% форми І цвітеріонного дигідрату фексофеходу є водна фармацевтична суспензія, що додатнадину з розмірами частинок менше приблизно ково також містить за вагою/об'ємом (г/100мл) від 40мкм для принаймні приблизно 90% форми І цвіприблизно 0,20% до приблизно 0,70%; більш точтеріонного дигідрату фексофенадину, приблизно но, від приблизно 0,30% до приблизно 0,45%, а ще 2,5% пропіленгліколю, приблизно 0,15% динатрійточніше, від приблизно 0,40% до приблизно 0,45% етилендіамінтетраацетату, приблизно 0,034% ароматизуючої речовини, наприклад, ароматизапропілпарабену, приблизно 0,017% бутилпарабетора «малина з вершками» або ароматизатора ну, приблизно 0,35% ксантанової камеді, приблиз«апельсини з вершками». но 0,05% полоксамеру 407, приблизно 1,25% гепІншим конкретним варіантом здійснення винатагідрату двоосновного фосфату натрію, ходу є водна фармацевтична суспензія, у буфері приблизно 0,75% моногідрату одноосновного фодо рН від приблизно 5,80 до приблизно 7,00, що сфату натрію, приблизно 10% сахарози і приблизмістить за вагою/об'ємом (г/100мл) приблизно но 10% ксиліту. 0,60% форми І цвітеріонного дигідрату фексофеІншим конкретним варіантом здійснення винанадину з розмірами частинок менше приблизно ходу є водна фармацевтична суспензія, у буфері 40мкм для принаймні приблизно 90% форми І цвідо рН від приблизно 5,80 до приблизно 7,00, що теріонного дигідрату фексофенадину, приблизно містить за вагою/об'ємом (г/100мл) приблизно 2,5% пропіленгліколю, приблизно 0,15% динатрій0,60% форми І цвітеріонного дигідрату фексофеетилендіамінтетраацетату, приблизно 0,034% надину з розмірами частинок менше приблизно пропілпарабену, приблизно 0,017% бутилпарабе40мкм для принаймні приблизно 90% форми І цвіну, приблизно 0,35% ксантанової камеді, приблизтеріонного дигідрату фексофенадину, приблизно но 0,05% полоксамеру 407, приблизно 1,25% геп2,5% пропіленгліколю, приблизно 0,15% динатрійтагідрату двоосновного фосфату натрію, етилендіамінтетраацетату, приблизно 0,034% приблизно 0,75% моногідрату одноосновного фопропілпарабену, приблизно 0,017% бутилпарабесфату натрію, приблизно 20% сахарози і приблизну, приблизно 0,35% ксантанової камеді, приблизно 10% ксиліту. но 0,05% полоксамеру 407, приблизно 1,25% гепІншим конкретним варіантом здійснення винатагідрату двоосновного фосфату натрію, ходу є водна фармацевтична суспензія, у буфері приблизно 0,75% моногідрату одноосновного фодо рН від приблизно 5,80 до приблизно 7,00, що сфату натрію, приблизно 10% сахарози, приблизмістить за вагою/об'ємом (г/100мл) приблизно но 10% ксиліту і приблизно 0,1% двоокису титану. 0,60% форми І цвітеріонного дигідрату фексофеІншим конкретним варіантом здійснення винанадину з розмірами частинок менше приблизно ходу є водна фармацевтична суспензія, у буфері 40мкм для принаймні приблизно 90% форми І цвідо рН від приблизно 5,80 до приблизно 7,00, що теріонного дигідрату фексофенадину, приблизно містить за вагою/об'ємом (г/100мл) приблизно 2,5% пропіленгліколю, приблизно 0,15% динатрій0,60% форми І цвітеріонного дигідрату фексофеетилендіамінтетраацетату, приблизно 0,034% надину з розмірами частинок менше приблизно пропілпарабену, приблизно 0,017% бутилпарабе40мкм для принаймні приблизно 90% форми І цвіну, приблизно 0,35% ксантанової камеді, приблизтеріонного дигідрату фексофенадину, приблизно но 0,05% полоксамеру 407, приблизно 1,25% геп2,5% пропіленгліколю, приблизно 0,15% динатрійтагідрату двоосновного фосфату натрію, етилендіамінтетраацетату, приблизно 0,034% приблизно 0,75% моногідрату одноосновного фопропілпарабену, приблизно 0,017% бутилпарабесфату натрію, приблизно 20% сахарози, приблизну, приблизно 0,35% ксантанової камеді, приблизно 10% ксиліту і приблизно 0,1% двоокису титану. но 0,05% полоксамеру 407, приблизно 1,25% гепІншим конкретним варіантом здійснення винатагідрату двоосновного фосфату натрію, ходу є водна фармацевтична суспензія, у буфері приблизно 0,75% моногідрату одноосновного фодо рН від приблизно 5,80 до приблизно 7,00, що сфату натрію, приблизно 10% сахарози, приблизмістить за вагою/об'ємом (г/100мл) приблизно но 10% ксиліту, приблизно 0,1% двоокису титану і 0,60% форми І цвітеріонного дигідрату фексофеприблизно 0,4% ароматизатора «малина з вершнадину з розмірами частинок менше приблизно ками». 40мкм для принаймні приблизно 90% форми І цві 19 89584 20 Іншим конкретним варіантом здійснення винаІншим конкретним варіантом здійснення винаходу є водна фармацевтична суспензія, у буфері ходу є водна фармацевтична суспензія, що місдо рН від приблизно 5,80 до приблизно 7,00, що тить за вагою/об'ємом (г/100мл) приблизно 0,60% містить за вагою/об'ємом (г/100мл) приблизно форми І цвітеріонного дигідрату фексофенадину, 0,60% форми І цвітеріонного дигідрату фексофеприблизно 2,5% пропіленгліколю, приблизно надину з розмірами частинок менше приблизно 0,042% пропілпарабену, приблизно 0,021% бутил40мкм для принаймні приблизно 90% форми І цвіпарабену, приблизно 0,35% ксантанової камеді, теріонного дигідрату фексофенадину, приблизно приблизно 0,05% полоксамеру 407, приблизно 2,5% пропіленгліколю, приблизно 0,15% динатрій1,25% гептагідрату двоосновного фосфату натрію, етилендіамінтетраацетату, приблизно 0,034% приблизно 0,75% моногідрату одноосновного фопропілпарабену, приблизно 0,017% бутилпарабесфату натрію, приблизно 20% сахарози і приблизну, приблизно 0,35% ксантанової камеді, приблизно 10% ксиліту. но 0,05% полоксамеру 407, приблизно 1,25% гепПовинно бути зрозуміло, що винахід віднотагідрату двоосновного фосфату натрію, ситься до усіх придатних комбінацій конкретних приблизно 0,75% моногідрату одноосновного фозгаданих при цьому варіантів здійснення. сфату натрію, приблизно 20% сахарози і приблизСуспензія, представлена в даному винаході, но 10% розчину сорбіту. особливо зручна для спрощення прийому для діІншим конкретним варіантом здійснення винатей і для дорослих із проблемами ковтання капсул ходу є водна фармацевтична суспензія, у буфері і таблеток. до рН від приблизно 5,80 до приблизно 7,00, що Використовуваний у даному винаході суспенмістить за вагою/об'ємом (г/100мл) приблизно дувальний агент збільшує фізичну стабільність 0,60% форми І цвітеріонного дигідрату фексофепродукту, значно підвищуючи в'язкість, для того надину з розмірами частинок менше приблизно 40 щоб скоротити швидкість осідання, одночасно замкм для принаймні приблизно 90% форми І цвітебезпечуючи достатню плинність. Крім того, систеріонного дигідрату фексофенадину, приблизно ма суспендувального агента дає можливість з лег2,5% пропіленгліколю, приблизно 0,15% динатрійкістю суспендувати продукт, при цьому відповідну етилендіамінтетраацетату, приблизно 0,034% дозу можна прийняти після мінімального струшупропілпарабену, приблизно 0,017% бутилпарабевання. В'язкість продукту дозволяє активній речону, приблизно 0,35% ксантанової камеді, приблизвині залишатися однорідно суспендованою після но 0,05% полоксамеру 407, приблизно 1,25% гепвживання дози. тагідрату двоосновного фосфату натрію, Водні фармацевтичні суспензії даного винахоприблизно 0,75% моногідрату одноосновного фоду можуть бути приготовлені додаванням дисперсфату натрію, приблизно 20% сахарози, приблизсії суспендувального агента і попередньо розчино 10% розчину сорбіту і приблизно 0,1% двоокису нених компонентів системи консервантів у титану. придатному співрозчиннику в аліквоту води, попеІншим конкретним варіантом здійснення винаредньо нагріту приблизно до 25-80°С, точніше, до ходу є водна фармацевтична суспензія, у буфері 35-80°С, і ще точніше, до 35-45°С. Додавання дисдо рН від приблизно 5,80 до приблизно 7,00, що персії за допомогою такого методу сприяє гідратамістить за вагою/об'ємом (г/100мл) приблизно ції і розчиненню суспендувального агента. Темпе0,60% форми І цвітеріонного дигідрату фексофературу підтримують постійною протягом надину з розмірами частинок менше приблизно послідовного додаванні порції буферної системи 40мкм для принаймні приблизно 90% форми І цві(для збереження контролю рН), інших компонентів теріонного дигідрату фексофенадину, приблизно системи консервантів і компонентів системи підсо2,5% пропіленгліколю, приблизно 0,15% динатрійлоджувачів, що призводить до утворення основної етилендіамінтетраацетату, приблизно 0,034% маси розчину. пропілпарабену, приблизно 0,017% бутилпарабеАктивну речовину розподіляють у водному ну, приблизно 0,35% ксантанової камеді, приблизрозчині інших компонентів буферної системи і но 0,05% полоксамеру 407, приблизно 1,25% гепзмочувального агента. рН розчину контролюють тагідрату двоосновного фосфату натрію, до додавання активної речовини, щоб підтримуваприблизно 0,75% моногідрату одноосновного фоти належний фізичний стан. Якщо додають замутсфату натрію, приблизно 10% сахарози, приблизнювальний компонент, його додають після цього, і но 20% розчину сорбіту, приблизно 0,1% двоокису дисперсію активної речовини додають до згаданотитану і приблизно 0,4% ароматизатора «малина з го вище основного розчину, попередньо охоловершками». дженого до 20-35°С, точніше, до 20-30°С, призвоІншим конкретним варіантом здійснення винадячи до утворення суспензії. При необхідності до ходу є водна фармацевтична суспензія, що міспотрібної ваги додають ароматизуючу речовину й тить за вагою/об'ємом (г/100мл) приблизно 0,60% іншу воду. Загальну масу суспензії потім розмеформи І цвітеріонного дигідрату фексофенадину, люють і деаерують. Суспензія може бути приготоприблизно 2,5% пропіленгліколю, приблизно влена на стандартному технологічному устатку0,042% пропілпарабену, приблизно 0,021% бутилванні. Як альтернативу використовують мішалку з парабену, приблизно 0,35% ксантанової камеді, високим зсувовим зусиллям, наприклад Admix®, приблизно 0,05% полоксамеру 407, приблизно для приготування дисперсії фексофенадин гідро1,25% гептагідрату двоосновного фосфату натрію, хлориду і суміші консервантів/суспендувального приблизно 0,75% моногідрату одноосновного фоагента, для розмелювання використовують сфату натрію, приблизно 10% сахарози і приблизUrschel® і для деаерування застосовують но 10% ксиліту. Versator®. 21 89584 22 Водну фармацевтичну суспензію даного виначити баланс ротора в процесі центрифугування. ходу досліджують наступними аналітичними метоЗразки обертають зі швидкістю 35000 обертів на дами. При цьому варто розуміти, що фахівцю в хвилину (об/хв) протягом 45 хвилин при темпераданій галузі не потрібно всієї наведеної інформатурі 20°С і з встановленням вакууму 1 мікрон. Пісції, щоб визначити присутність форми І цвітеріонля завершення центрифугування пробірки виданого дигідрату фексофенадину в даній сполуці, ляють, розчин зливають, і перевертають пробірки але що для визначення присутності форми І цвітена лист фільтрувального паперу, витримуючи їх ріонного дигідрату фексофенадину можна викориперевернутими приблизно 1 годину, час від часу стовувати будь-яку частину даних аналізу, яку фазмінюючи положення фільтрувального папера, хівець в галузі вважатиме достатньою для тому що розчин, що залишився в пробірці, не абвстановлення її присутності. сорбований фільтрувальним папером. Пробірки Спектрометрія 13С твердофазного ядерного закривають кришкою і поміщають або в холодильмагнітного резонансу (твердофазного ЯМР) ник при 5°С, або в морозильну камеру при -20°С Робоча частота ЯМР спектрометра складала до моменту проведення аналізу. При необхідності для 1Н 399,870 МГц (13С=100,557 МГц) (мікромагдо перенесення в холодильник зразки приблизно ніт, виробництва Oxford, поле 9,4 Тесла). Головна на 20 годин поміщають у піч при 50°С. Кожна консоль, що керує формуванням імпульсної посліцентрифугувальна пробірка має окрему мітку, а довності, генерацією частот, детектуванням і контотриманий твердий зразок одержує унікальний ролем температури, являє собою консоль керуномер серії. Зразки зберігають при низькій темпевання Varian Unity plus, зв'язану за допомогою ратурі, і витягають приблизно за 5 хвилин до анаінтерфейсу з робочою станцією Sun Microsystems лізу. Ultra 10, що використовує програмне забезпечення Рентгенівська порошкова дифракція (РПД) Varian VNMR 6,1С. Контроль швидкості обертання Криві РПД отримані на дифрактометрі Scintag здійснюють за допомогою комп'ютера х86 комп'юX2 або XDS 2000 q/q, що працює на випромінютерної системи HIMS, що управляє програмним ванні міді при 45кВ і 40мА, з використанням тверзабезпеченням версії 1,0 (9/93) контролера Varian дофазного детектора Thermo ARL з термоелектMAS через інтерфейс із блоком пневматичного ричним охолодженням на ефекті Пельт'є або контролю з точністю ± 1Гц. Використовують датчик детектора Moxtek з повітряним охолодженням за подвійного резонансу Varian 7мм (НХ) з обертандопомогою ефекту Пельт'є, відповідно. Для збору ням під магічним кутом (MAS). Зразки помішують у даних використовували вихідні щілини коліматору 7мм Sі3N4 ротори і закривають приводним наконе2 і 4мм і щілини детектора 0,5 і 0,3мм. Перекрисчником Torlon®. Використовувані силові підсилюталізовані і суспендовані зразки обережно подрібвачі включають модель 3448 силового (1 кВт) нювали за допомогою ступки і товкачика. Зразки твердофазного підсилювача, що випускається поміщали в тримач з нержавіючої сталі, розрівнюAmerican Microwave Technologies (АМТ), для смуги вали за допомогою предметного скла мікроскопа і X і систему підсилювачів Chemagnetics, що вклюсканували по одному або в шестипозиційному авчає силовий (500 Вт) ламповий підсилювач томатичному пристрої установки зразка. Криві Chemagnetics і джерело харчування Chemagnetics РПД зразків реєстрували в діапазоні від 2° до 42° для каналу 1Н. Через високі потужності, викорис2q зі швидкістю 17хв. Калібрування обох дифрактовувані у твердофазній ЯМР спектроскопії, також тометрів проводили щорічно з використанням стазастосовують силовий пасивний підсилювач ндартного зразка порошкового кремнію. Файли Varian. Для пригнічення потрапляння в приймач вихідних даних конвертували в стандарт ASCII, небажаних частот до з'єднувального 50 Ом коаксіпереносили на IBM-сумісний комп'ютер і відобраального кабелю, що зв'язує датчик, підключають 4жали в програмі Origin® 6,1 для Windows. компонентний силовий 200 МГц фільтр нижніх чаІнфрачервона спектрометрія з Фур'єстот Trilithic на смузі X і 4-компонентний силовий перетворенням (Фур'є-ІЧ) 400 МГц смуговий фільтр К & L Microwave протонФур'є-ІЧ спектри реєстрували на приладі ного каналу. Настроювання контуру зразка здійсBioRad FTIR Model FTS6000 з використанням принюють за допомогою блоку настроювання Varian, строю дифузійного відображення BioRad, Model: підключеного до опори магніту. Вибирають задаDR. Спектр зразка для всіх результатів аналізу ний канал, і до відповідного роз'єму датчика підвизначали за 16 сканами з розрішенням 2см-1, а ключають коаксіальний кабель 50 Ом. Регулюють для фона - за 64 сканами Зразки для аналізу готуручки настроювання і збігання на датчику для вибвали розмелюванням невеликої кількості досліраного каналу, так щоб зменшити відбиту потужджуваної речовини з бромідом калію (КВr) за доність на РК-дисплеї. Прийнятним вважається знапомогою ступки і товкачика в співвідношенні чення < 10 при установці атенюатора на 8. приблизно 1:10. Отриману суміш потім помішували Підготовка зразка для твердофазного ЯМР у тримач зразка дифузійного відображення, що Для відділення твердої фази від суспензії вивстановлювали в спектрометрі і протягом 5 хвилин користовують ультрацентрифугу Beckman L8-80 продували газоподібним N2. Μ. Зразок суспензії виливають у 40мл центрифужФексофенадин є амфотерним і існує в множині ні пробірки і закривають кришкою та ущільнювальполіморфних і псевдополіморфних форм, у тому ним кільцем. Усі пробірки заповнюють однаковою числі у формі гідрохлориду, гідрату і сольвату. кількістю і поміщають у ротор для ультрацентриФорму І безводного фексофенадину гідрохлориду фугування, або цілком заповнюючи ротор на 12 переводять у форму І цвітеріонного дигідрату фекпробірок, або рівномірно розміщаючи зразки на софенадину в ході його готування регулюванням однаковій відстані один від одного, щоб забезперН. У діапазоні рН від приблизно 4,25 до приблиз 23 89584 24 но 9,43, точніше, від приблизно 5,00 до приблизно 30°С. Вимірюють рН розчину. В окремій посудині 8,00, а ще точніше, від приблизно 5,80 до приблипорції гептагідрату двоосновного фосфату натрію зно 7,00, фізичним станом фексофенадину голо(45,03кг) і моногідрату одноосновного фосфату вним чином є форма І цвітеріонного дигідрату. натрію (26,15кг), що залишилися, додають до приОскільки рН контролюють протягом усього процесу близно 950кг очищеної води і розчиняють за довиготовлення, після додавання форми І безводнопомогою мішалки з високим зусиллям зсуву. Дого фексофенадину гідрохлориду до буферного дають і розчиняють полоксамер 407 (4,5кг). розчину у вказаному інтервалі рН спостерігається Вимірюють рН розчину. До розчину повільно дойого конверсія у форму І цвітеріонного дигідрату дають форму І безводного фексофенадину гідрофексофенадину, що підтверджує аналіз спектрів хлориду (54,1кг) і одержують однорідну дисперсну РПД і твердофазного ЯМР. На фіг. 1 і 2 привосистему. До дисперсної суміші повільно додають дяться спектри твердофазного ЯМР і РПД суспендвоокис титану (9,01кг) і одержують однорідну сизії фексофенадину, відповідно, зареєстровані в стему. Дисперсну суміш переносять у розчин в процесі готування. Розроблено метод Фур'є-ІЧ, що основному реакторі змішування із сорочкою. Реакдозволяє розрізняти відповідні фізичні стани фортор, що містить дисперсну суміш, промивають ми І безводного фексофенадину гідрохлориду і порцією очищеної води (приблизно 250кг), і переформи І цвітеріонного дигідрату фексофенадину носять змив в основний реактор змішування. Під для використання для можливих промислових тиском додають ароматизатор «малина з вершкаіспитів. Характерні спектри форми І безводного ми» в основний реактор змішування і розчиняють. фексофенадину гідрохлориду і форми І цвітеріонДодається достатня кількість води, необхідна для ного дигідрату фексофенадину наводяться на досягнення кінцевої ваги нетто (10000кг). ПереміФіг.3 і 4, відповідно. Необхідний фізичний стан шування продовжують і одержують однорідну суфексофенадину (форма І цвітеріонного дигідрату) спензію. Вимірюють рН. Суспензію подрібнюють зберігається мінімум протягом 18 місяців; точніше, (наприклад за допомогою млина Urschel) і деаеприблизно близько 24 місяців. рують. Отримана суспензія містить 30мг форми І Нижче наводяться наступні приклади для ілюцвітеріонного дигідрату фексофенадину (трансфострації винаходу, що не покликані будь-яким чирмованого з форми І безводного гідрохлориду феном його обмежувати. ксофенадину) на 5 мл суспензії. Сполука навоПриклади диться в таблиці 1. Приклад 1: Приклад 2: Пропілпарабен (3,06кг) і бутилпарабен (1,53кг) З використанням загального методу з прикладодають у посудину з нержавіючої сталі придатнода 1 одержують суспензію, що містить приблизно го розміру, що містить приблизно 198,2кг пропілен30мг форми І цвітеріонного дигідрату фексофенагліколю, розчиняють при перемішуванні на мішалці дину (трансформованого з форми І безводного з високим зсувовим зусиллям (наприклад, Admix® фексофенадину гідрохлориду) на 5мл суспензії і Rotosolver™). До суміші повільно додають ксантатакої, що має склад, описаний в таблиці 1. У данову камедь і рівномірно розмішують. При включеному препараті рівень сахарози знижений із приному контурі рециркуляції суміш переносять в осблизно 20% до приблизно 10% за вагою/об'ємом новний реактор змішування із сорочкою, що (г/100мл). містить приблизно 5488кг очищеної води, що поПриклад 3: передньо нагріта до 35-45°С, і перемішують. ПарЗ використанням загального методу з приклатію постійно перемішують до самого кінця обробда 1 одержують суспензію, що містить приблизно ки. Температуру підтримують до стадії додавання 30мг форми І цвітеріонного дигідрату фексофенаксиліту. Посудину промивають залишками пропідину (трансформованого з форми І безводного ленгліколю (27кг) і порцією очищеної води (прифексофенадину гідрохлориду) на 5мл суспензії і близно 50,3кг), і змивши переносять в основний таку, що має склад, описаний в таблиці 1. У данореактор змішування. У реактор із сорочкою додаму препараті розчин сорбіту NF, що некристалізують динатрій-етилендіамінтетраацетат (1,351кг) і ється, використовується замість ксиліту на рівні розчиняють його. Порції гептагідрату двоосновного приблизно 10% за вагою/об'ємом (//100мл). фосфату натрію (67,57кг) і моногідрату одноосноПриклади 4-9: вного фосфату натрію (41,45кг) додають у реактор З використанням загального методу з приклаіз сорочкою і розчиняють. У реактор додають сада 1 одержують суспензії фексофенадину, що махарозу (1802кг) і ксиліт (901кг) і розчиняють. Розють склад, описаний в таблиці 1. чин у реакторі із сорочкою охолоджують до 20 25 89584 26 Таблиця 1 Інгредієнт (в ваг./об. %) 1 Форма І цвітеріонного ди0,6 гідрату фексофенадину Пропіленгліколь 2,5 Динатрій-етилендіамін 0,15 тетраацетат Пропілпарабен 0,034 Бутилпарабен 0,017 Ксантанова камедь 0,35 Полоксамер 407 0,05 Двоокис титану 0,1 Гептагідрат двоосновного 1,25 фосфату натрію Моногідрат одноосновного 0,75 фосфату натрію Сахароза 20 Ксиліт 10 Некристалізований розчин сорбіту NF Сахарин-натрій ПЕГ 400 Ароматизатор «малина з 0,4 вершками» рН 6,2 2 3 4 Приклади 5 6 7 8 9 0,6 0,6 0,6 0,6 1,2 1,2 0,6 0,6 2,5 2,5 2,5 2,5 2,5 2,5 2,5 2,5 0,15 0,15 0,034 0,017 0,35 0,05 0,1 0,034 0,017 0,35 0,05 0,1 0,030 0,015 0,35 0,05 0,1 0,030 0,015 0,35 0,05 0,1 0,030 0,015 0,35 0,05 0,1 0,030 0,015 0,35 0,05 0,1 0,042 0,021 0,35 0,05 0,1 0,042 0,021 0,35 0,05 0,1 1,25 1,25 1,25 1,25 1,25 1,25 1,25 1,25 0,75 0,75 0,75 0,75 0,75 0,75 0,75 0,75 10 10 20 40 40 40 40 20 10 10 10 10 10 1,00 1,00 0,05 1,00 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 6,2 6,2 6,2 6,2 6,2 6,2 6,2 6,2 Дослідження біодоступності Дослідження 1: Проводили двостороннє перехресне рандомізоване відкрите дослідження біоеквівалентності за співставленням суспензії фексофенадину з приклада 1 з наявним у продажу препаратом фексофенадину гідрохлориду (Allegra®) у таблетках по 30мг на п'ятдесяти трьох здорових дорослих, ви пробуваних натщесерце. Оцінку біоеквівалентності 5мл суспензії фексофенадину з приклада 1 у порівнянні з наявними у продажу 30мг таблетками Allegra® проводять після виключення чотирьох випробуваних, для яких концентрації відрізнялися від стандартної процедури перевірки. Результати дослідження наводяться нижче в таблиці 2. Таблиця 2 Параметр Лікування [1] ППК(0-¥ (нг.ч/мл) Смакс (нг/мл) Таблетка Суспензія Таблетка Суспензія Порівняння лікування № випробовува- Середнє ариф- Геометричне сеВідношення ного метичне (КВ%) реднє за МНК 90% ДІ [2] 49 732 (44,5) 665 97,5 87,7-109 49 714 (47,5) 649 49 109 (55,0) 95,5 109 96,1-122 49 118 (56,2) 104 [1]: Таблетка: разова пероральна доза 30мг фексофенадину гідрохлориду у формі наявної у продажу таблетки (стандарт). Суспензія: разова пероральна доза 5мл суспензії фексофенадину з приклада 1 (тест). [2]: Відношення = геометричне середнє за МНК для тесту / геометричне середнє за МНК для стандарту (суспензія/таблетка). Дослідження 2: Проводять перехресне рандомізоване відкрите дослідження біоеквівалентності за співставленням суспензій фексофенадину з прикладів 4, 5, 6 і 7 з наявним у продажі препаратом фексофенадину гідрохлориду (Allegra®) у таблетках по 60мг на тридцятьох шести здорових дорослих випробуваних натщесерце. Результати дослідження наводяться нижче в таблиці 3. Дані для ППК(0-¥) і Смакс представлені у вигляді середніх значень ± стандартне відхилення (ст. відх.). 27 89584 28 Таблиця 3 А Параметр ППК(0-¥) (нг.ч/мл) Смакс (нг/мл) 90% ДІ [4] ППК(0-¥) 90% ДІ [4] Смакс В Лікування [3] С D Ε 1595±779 1250±531 1518±563 1150±699 1153±396 340,2±198,7 140,29% (114,13-172,44) 213,92% (172,88-264,69) 220,1±112,2 112,83% (91,79-138,68) 143,53% (116,00-177,60) 287,3±124,6 122,68% (99,81-150,79) 151,19% (122,19-187,07) 150,5±62,5 88,68% (72,15-109,00) 79,73 (64,44-98,66) 168,1±74,9 [3]: Лікування А: разова пероральна доза 10мл суспензії фексофенадину з приклада 4 (тест). Лікування В: разова пероральна доза 10мл суспензії фексофенадину з приклада 5 (тест). Лікування С: разова пероральна доза 5мл суспензії фексофенадину з приклада 6 (тест). Лікування D: разова пероральна доза 5мл суспензії фексофенадину з приклада 7 (тест). Лікування Е: разова пероральна доза 60мг фексофенадину гідрохлориду у формі наявної у продажу таблетки (стандарт). [4]: Стосовно лікування Ε. Дослідження 3: Проводять двостороннє перехресне рандомізоване відкрите дослідження біоеквівалентності за співставленням суспензій фексофенадину з прикладів 8 і 9 з наявним у продажу препаратом фексофенадину гідрохлориду (Allegra®) у таблетках по 60мг на двадцятьох двох здорових дорослих випробуваних натщесерце. Результати дослідження наводяться нижче в таблиці 4. Таблиця 4 Параметр ППК(0-¥) (нг.ч/мл) Смакс (нг/мл) Лікування № випробовува- Середнє арифмети- Геометричне се- Порівняння лікування [5] ного чне (КВ%) реднє за МНК Відношення[6] 90% ДИ F 22 1393,4 (30,2) 1321,9 85,47G 22 1413,1 (45,7) 1304,7 98,69 113,96 89,55Η 22 1461,3 (38,3) 1368,3 103,51 119,64 F 22 210,12(39,9) 193,67 89,39G 22 244,90 (58,6) 212,39 109,67 134,54 98,18Η 22 261,17(48,9) 233,63 120,64 148,23 [5]: Лікування F: разова пероральна доза 60мг фексофенадину гідрохлориду у формі наявної у продажу таблетки, прийнятий разом з 240мл води кімнатної температури (стандарт). Лікування G: разова пероральна доза 10мл суспензії фексофенадину з приклада 8, прийнята з 230мл води кімнатної температури (тест). Лікування Н: разова пероральна доза 10мл суспензії фексофенадину з приклада 9, прийнята з 230 мл води кімнатної температури (тест). [6]: Відношення = геометричне середнє за МНК для тесту / геометричне середнє за МНК для стандарту. Здійснення даного винаходу можуть приймати інші конкретні форми, що не будуть стосуватися суті винаходу або його основних положень. 29 89584 30 31 Комп’ютерна верстка Л. Купенко 89584 Підписне 32 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFexofenadine suspension formulation
Автори англійськоюAgrawala Prafulla, Chrzan Kazimierz, Haribhakti Rajiv, Mermey Matthew, Porcello Curtis J., Silvey Gary Lee, Tran Vinh
Назва патенту російськоюКомпозиция суспензии фексофенадина
Автори російськоюАгравала Прафулла, Хшан Казимеж, Харибхакти Раджив, Мерми Меттью, Порселло Кертис Дж., Сильви Гери Ли, Тран Винх
МПК / Мітки
МПК: A61K 9/16, A61P 37/08, A61K 31/445
Мітки: суспензії, фексофенадину, композиція
Код посилання
<a href="https://ua.patents.su/16-89584-kompoziciya-suspenzi-feksofenadinu.html" target="_blank" rel="follow" title="База патентів України">Композиція суспензії фексофенадину</a>
Попередній патент: Літальний апарат
Наступний патент: Глушник звуку пострілу стрілецької зброї
Випадковий патент: Пристрій для контролю ресурсу комутаційних апаратів












