Фармацевтичний продукт з ноотропними властивостями
Формула / Реферат
1. Фармацевтичний продукт як засіб з ноотропними та психостимулюючими властивостями, який містить одну або більше дозовані одиниці фармацевтичної композиції на основі амінофенілмасляної кислоти, вміст якої складає від 45 до 52 мас. % композиції, як допоміжні речовини містить розріджувач, розпушувач, змащувальну речовину, який відрізняється тим, що розріджувачем є целюлоза мікрокристалічна, фармацевтична композиція додатково містить ковзну речовину, причому допоміжні речовини композиція містить при наступному співвідношенні компонентів між собою мас. %:
розріджувач
75,0-95,0
ковзна речовина
8,5-9,5
розпушувач
8,5-9,5
змащувальна речовина
1,0-2,5.
2. Фармацевтичний продукт за пунктом 1, який відрізняється тим, що допоміжні речовини фармацевтична композиція дозованої одиниці продукту містить при наступному співвідношенні компонентів між собою мас. %:
розріджувач
80,0
ковзна речовина
9,1
розпушувач
9,1
змащувальна речовина
1,8.
3. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту містить активну речовину кількістю 47-50 мас. % композиції.
4. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці містить активну речовину кількістю 47-48 мас. % композиції.
5. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозована одиниця продукту містить від 237 до 262 мг активної речовини.
6. Фармацевтичний продукт згідно за будь-яким з попередніх пунктів, який відрізняється тим, що дозована одиниця продукту містить 250 мг активної речовини.
7. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як розпушувач містить карбоксиметилкрохмаль натрію.
8. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як змащувальну речовину містить кальцію стеарат або магнію стеарат.
9. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як ковзну речовину містить кремнію діоксид колоїдний.
10. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як змащувальну речовину містить кальцію стеарат.
11. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту містить наступне співвідношення компонентів мас. %:
амінофенілмасляна кислота
45-52
мікрокристалічна целюлоза
41-43
кремнію діоксид колоїдний
4-6
карбоксиметилкрохмаль натрію
4-6
кальцію стеарат
0,8-1,0.
12. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту містить наступне співвідношення компонентів мас. %:
амінофенілмасляна кислота
47-48
мікрокристалічна целюлоза
41-43
кремнію діоксид колоїдний
4-6
карбоксиметилкрохмаль натрію
4-6
кальцію стеарат
0,8-1,0.
13. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту містить наступне співвідношення компонентів мас. %:
амінофенілмасляна кислота
47,62
мікрокристалічна целюлоза
42
кремнію діоксид колоїдний
4,38
карбоксиметилкрохмаль натрію
5
кальцію стеарат
1.
14. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозовані одиниці продукту є твердими дозованими одиницями.
15. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозовані одиниці продукту призначені для перорального введення пацієнту.
16. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозовані одиниці продукту є таблетками.
17. Фармацевтичний продукт за пунктом 16, який відрізняється тим, що дозовані одиниці продукту одержують методом прямого пресування.
18. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозовані одиниці продукту є таблетками з механічною міцністю не менше 30Н.
19. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що має такий профіль розчинення, що амінофенілмасляна кислота вивільняється кількістю щонайменше 70 % за 45 хв.
20. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що має такий профіль розчинення, що амінофенілмасляна кислота вивільняється кількістю щонайменше 74 % за 45 хв.
21. Фармацевтичний продукт за будь-яким з пунктів 1-8, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як ковзну речовину містить натрію кроскармелозу.
22. Фармацевтичний продукт за будь-яким з попередніх пунктів 1-8, 21, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту додатково містить тальк.
23. Фармацевтичний продукт за пунктом 22 який відрізняється тим, що композиція містить тальк кількістю до 1 мас. %.
24. Фармацевтичний продукт за будь-яким з пунктів 1-8, 21-23 який відрізняється тим, що дозовані одиниці продукту є твердими дозованими одиницями для перорального введення пацієнту.
25. Фармацевтичний продукт за будь-яким з попередніх пунктів 1-8, 21-24, який відрізняється тим, що дозовані одиниці продукту є твердими желатиновими капсулами.
26. Фармацевтичний продукт за пунктом 25, який відрізняється тим, що до складу капсул входить желатин та титану діоксид.
27. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозовані одиниці продукту знаходяться у контурній чарунковій упаковці або у банці полімерній.
28. Фармацевтичний продукт за пунктом 27, який відрізняється тим, що дозовані одиниці продукту знаходяться у контурній чарунковій упаковці або у банці полімерній по 10 одиниць або більше.
29. Фармацевтичний продукт за будь-яким з попередніх пунктів 27 або 28, який відрізняється тим, що продукт додатково поміщено у пачку.
Текст
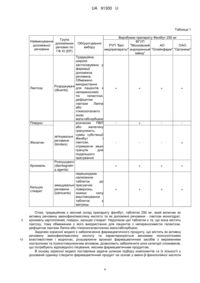
Реферат: UA 91300 U UA 91300 U 5 10 Корисна модель належить до медицини, зокрема до хіміко-фармацевтичної промисловості, а саме до створення, виробництва та впровадження в клінічну практику лікувальнопрофілактичного засобу з ноотропними властивостями, до фармацевтичного продукту на основі амінофенілмасляної кислоти. Корисна модель може знайти своє застосування в медицині та ветеринарії для лікування станів, що потребують призначення пацієнту ноотропних та/або психостимулюючих засобів. У клінічній практиці часто виникає необхідність у призначенні пацієнтам препаратів як з ноотропними, так і з заспокійливими властивостями. Прикладом такого препарату може бути фенібут, який поряд з високими ноотропними властивостями проявляє певну заспокійливу дію, але при цьому позбавлений небажаних явищ, характерних для транквілізаторів, антидепресантів, психостимуляторів. Фенібут являє собою γ-аміно-β-фенілолійної кислоти гідрохлорид (амінофенілмасляна кислота) і має наступну структурну формулу: OH H2 N O HCl 15 20 25 30 35 40 45 50 . Фенібут покращує функціональний стан мозку за рахунок нормалізації метаболізму тканин та впливу на мозковий кровообіг (збільшує об'ємну і лінійну швидкість мозкового кровотоку, зменшує тонус судин мозку, покращує мікроциркуляцію, має антиагрегантні властивості). Сприяє зниженню або зникненню почуття тривоги, напруженості, занепокоєння і страху, нормалізує сон, має певну протисудомну дію. Фенібут (як показали чисельні експериментальні і клінічні дослідження) має седативну дію, стимулює процеси навчання і пам'яті, підвищує фізичну працездатність. Його транквілізуюча дія проявляється ослабленням симптомів тривоги, страху, підвищеної емоційної збудливості і спостерігається у хворих з синдромом астенії. Крім цього у препарата виражена здатність збільшувати вміст глюкози в мозку і антигіпоксична дія. При проведенні порівняльного аналізу встановлено, що за ступенем вираженості ноотропного та вазовегетативного (зникнення головного болю, вегетативної лабільності) впливів фенібут перевершує пірацетам, однак має патогенетичний транквілізуючий ефект, який проявляється спільно з ноотропною дією. Також слід зазначити, що, на відміну від пірацетаму та аміналону, фенібут не проявляє психостимулюючої дії, яка проявляється в підвищенні дратівливості, тривозі, порушенні сну та інших небажаних ефектів. Клінічний ефект від прийому препарату з'являється вже в перші години і дні його прийому (Палий И. Г. Актуальные вопросы медицинской науки - врачам семейной медицины //Провизор- 2002.- № 7). В останні роки значно зросло практичне застосування фенібуту. Дослідження психофармакологічного профілю дії препарату показують, що анксіолітичний ефект, тобто здатність пригнічувати тривогу, страх, емоційну напругу, виражений слабко, є повторним, опосередкованим, виявляється разом і паралельно з ноотропною дією лише в частини хворих (Мехилане Л.С., Ряго Л.Г., Алликметс Л.Х. Эффективность фенибута при лечении больных неврозами и неврозоподобными состояниями: Серия "В помощь практическому врачу". - Вып. 5. - Киев, 2002. - С. 24-30). Транквілізуюча дія препарату, найбільш виражена при неврозоподібних станах із внутрішньою напругою, емоційною лабільністю, слізливістю, тобто при явищі психічної і фізичної астенії (Адаменко Р.Я. Лечение неврозоподобных состояний // Журн. Практ. лікаря.2000. - № 2.- С. 26-28.). В умовах подібної клінічної симптоматики в препараті особливо чітко виявляється активуючий компонент дії: відзначається поліпшення концентрації уваги, підвищення інтелектуально-мнестичних можливостей, зникають в'ялість, сонливість, більш глибоким стає нічний сон. γ-аміно-β-фенілолійної кислоти гідрохлорид (фенібут) має перевагу перед транквілізаторами бензодіазепінового ряду в тих випадках, коли тривога, внутрішня напруженість, емоційна лабільність, дратівливість сполучаються з астенічними явищами, оскільки наслідки в цих випадках можуть збільшувати фізичну і психічну астенію (Хаунина Р.А., Лапин И.П. Применение фенибута в психиатрии и неврологии и его место среди других психотропных средств. // Журн. невропатол. и психиатрии. - 1989. - № 4. - С. 1146-1152). Транквілізуючі ефекти γ-аміно-βфенілолійної кислоти гідрохлорид пов'язані з її здатністю підсилювати тормозну (стримуючу) функцію неокортексу над субкортикальними, у тому числі лімбічними, утвореннями мозку внаслідок впливу на ГАМК - бензодіазепіновий комплекс. Активуючий компонент у спектрі дії γ 1 UA 91300 U 5 10 15 20 25 30 35 40 45 50 55 60 аміно-β-фенілолійної кислоти гідрохлорид особливо чітко виявляється у дітей та людей похилого віку, що проявляється пожвавленням інтересів, підвищенням активності, спонуканням до ігрової діяльності, зменшенням явищ астенії. У дітей транквілізуючий і компонуючий компоненти дії γ-аміно-β-фенілолійної кислоти гідрохлорид спостерігались у 82 % випадках застосування препарату, причому ці ефекти проявлялися одночасно, що відрізняє γ-аміно-βфенілолійної кислоти гідрохлорид від інших транквілізаторів (Мехилане Л.С., Ряго Л.Г., Алликметс Л.Х. Изучение эффективности фенибута при лечении психических расстройств у детей: Серия "В помощь практическому врачу". - Вып. 6. - К., 2002. - 10с). Застосування препарату у людей похилого віку знижує психомоторне збудження (занепокоєння, метушливість), особливо вночі; найбільш ефективним є при станах ажитації, тривоги і страху при судинних захворюваннях головного мозку. Препарат добре переноситься людьми похилого віку, чим вигідно відрізняється від нейролептиків і транквілізаторів бензодіазепінового ряду (Хаунина Р.А., Лапин И.П. Применение фенибута в психиатрии и неврологии и его место среди других психотропных средств. // Журн. невропатол. и психиатрии. - 1989. - № 4. - С. 1146-1152). Особливості як транквілізуючого, так і активуючого компонента в дії γ-аміно-β-фенілолійної кислоти гідрохлорид пов'язані з тим, що препарат є не тільки похідним ГАМК, як його традиційно розглядають, але в однаковій мірі - похідним b-феніл-етиламіну (ФЕА) - нейроактивного моноаміну, який має як прямий, так і опосередкований через дофаміненергічну систему вплив на мозок. В гетерогенній нейрохімічній природі тривожних станів ФЕА, як анксиоген, бере участь в ґенезі астенічних форм, при яких ефективна g-аміно-b-фенілолійна кислота гідрохлорид (Хаунина Р.А., Лапин И.П. Применение фенибута в психиатрии и неврологии и его место среди других психотропных средств. //Журн. невропатол. и психиатрии. - 1989. - № 4. - С. 1146-1152). Снодійної дії γ-аміно-β-фенілолійної кислоти гідрохлорид не має, але прискорює процес засинання та подовжує сон, не порушуючи його структури (Хаунина Р.А., Лапин И.П. Применение фенибута в психиатрии и неврологии и его место среди других психотропных средств. //Журн. невропатол. и психиатрии. - 1989. - № 4. - С. 1146-1152). γ-аміно-βфенілолійної кислоти гідрохлорид має центральну міорелаксуючу властивість, знижує тонус спастичних м'язів, не поступаючись у цьому відношенні за ефективністю баклофену (Мехилане Л.С., Ряго Л.Г., Алликметс Л.Х. Изучение эффективности фенибута при лечении психических расстройств у детей: Серия "В помощь практическому врачу". - Вып. 6. - К., 2002. - 10 с). Така спільність дії препаратів пояснюється схожістю хімічної структури: γ-аміно-β-фенілолійної кислоти гідрохлорид відрізняється від баклофену відсутністю атома хлору в фенільному кільці. Особливістю міорелаксуючої дії γ-аміно-β-фенілолійної кислоти гідрохлорид є її ефективність тільки при еластичності пірамідного ґенезу. На нормальний тонус м'язів препарат практично не впливає, чим вигідно відрізняється від похідних бензодіазепіну. Ця перевага робить саме γ-аміно-β-фенілолійної кислоти гідрохлорид кращим для вживання у спортсменів, водіїв, операторів тощо. Немалу зацікавленість представляє застосування препарату при судомних станах. Призначення γ-аміно-β-фенілолійної кислоти гідрохлориду разом із протисудомними засобами підсилює терапевтичний ефект останніх при резистентних станах епілепсії, що призводить до зниження кількості та покращення психічного стану пацієнтів (Хаунина Р.А., Лапин И.П. Применение фенибута в психиатрии и неврологии и его место среди других психотропных средств. // Журн. невропатол. и психиатрии. - 1989. - № 4. - С. 1146-1152; Юровская В.П., Борщева А.А. Психоэмоциональное регулирование и обезбаливание родов при применении фенибута // Вопросы охраны материнства и детства. - 1990. - Т. 35, № 5. - С. 135137). Лікувальні засоби, що призначаються для лікування екстрапірамідних розладів, зокрема синдрому паркінсонізму на сьогодні є недостатньо ефективними та використовуються в дозах, що нерідко викликають побічні явища (Вейн А.М, Голубев В.А., Берзиньш Ю.Э. Паркинсонизм. Рига, 1981. - 127 с). Одним із можливих шляхів підвищення ефективності антипаркінсонічних засобів є одночасне призначення препаратів, що посилюють їх дію. γ-аміно-β-фенілолійної кислоти гідрохлорид посилює дію різних нейропсихотропних засобів. У сполученні препарату з нейролептиками посилюються не тільки седативні, але й антипсихотичні ефекти. Болезаспокійливої дії γ-аміно-β-фенілолійної кислоти гідрохлорид не має, однак підвищує пороги як моторних, так і емоційних компонентів больової реакції. Препарат потенціює ефекти наркотичних речовин, тому рекомендується як засіб для премедикації (Машковский М.Д. Лекарственные средства: в 2-х т. - Т. 1. - 14-е изд., перераб., испр. и доп. - М: ООО "Издательство Новая Волна", 2001. - С.110-111, 116., Хаунина Р.А., Лапин И.П. Применение фенибута в психиатрии и неврологии и его место среди других психотропных средств. //Журн. невропатол. и психиатрии. - 1989. - № 4. - С. 1146-1152). 2 UA 91300 U 5 10 15 20 25 30 35 40 45 Особливий інтерес викликає питання про ноотропні властивості γ-аміно-β-фенілолійної кислоти гідрохлориду. Основними властивостями лікувальних засобів цієї групи є здатність прискорювати процеси навчання, покращувати пам'ять, підвищувати мнестичні функції та стійкість мозку до різних шкідливих впливів (травма, інтоксикація), а також позитивно впливати на енергетичний потенціал клітин, стимуляцію синтезу РНК (Машковский М.Д. Лекарственные средства: в 2-х т. - Т. 1. - 14-е изд., перераб., испр. и доп. - М: ООО "Издательство Новая Волна", 2001. - С. 110-111, 116.). У здорових людей γ-аміно-β-фенілолійної кислоти гідрохлорид має легкий стимулюючий вплив на пам'ять. Препарат перешкоджає розвитку порушень як розумової, так і фізичної діяльності, покращує індекс оперативної пам'яті (Мехилане Л.С., Ряго Л.Г., Алликметс Л.Х. Эффективность фенибута при лечении больных неврозами и неврозоподобными состояниями: Серия "В помощь практическому врачу". - Вып.5. - К., 2002. С. 24-30; Хаунина Р.А., Лапин И.П. Применение фенибута в психиатрии и неврологии и его место среди других психотропных средств. //Журн. невропатол. и психиатрии. - 1989. - № 4. - С. 1146-1152). γ-аміно-β-фенілолійної кислоти гідрохлорид має антигіпоксичною властивістю, зменшує шкідливий вплив радіального прискорення, перегрівання, зменшує інтоксикацію стрихніном, адреналіном, знижує летальну дію електричного струму. Препарат викликає неспецифічне підвищення опору організму, має адаптогенну дію (Богачев Н.А., Спасов А.А., К антистрессорной активности фенибута. - В кн.: Фенибут и замещенные гамма-аминомасляной кислоты и альфа-пирролидоны (химия, фармакология, клиника, производство). - Черкассы, 1981. - С. 86-92). На відміну від класичного представника групи ноотропних засобів - пірацетаму, γ-аміно-βфенілолійної кислоти гідрохлорид в експерименті має протинабрякову дію при травматичному і токсичному набряку мозку у щурів: він нормалізує утримання води і щільність мозкової тканини, а також утримання макроергічних фосфатів та лактату в тканинах мозку (Хаунина Р.А., Лапин И.П. Применение фенибута в психиатрии и неврологии и его место среди другихпсихотропных средств. // Журн. невропатол. и психиатрии. - 1989. - № 4. - С. 1146-1152). Фармакологічний аналіз експериментальних досліджень на тваринах та клінічних спостережень на волонтерах і пацієнтах дозволяє вважати γ-аміно-β-фенілолійної кислоти гідрохлорид нейрометаболічним церебропротектором (ноотропним засобом) із властивістю слабкого денного транквілізатора з активуючим антиастенічним типом дії (Мехилане Л.С., Ряго Л.Г., Алликметс Л.Х. Эффективность фенибута при лечении больных неврозами и неврозоподобными состояниями: Серия "В помощь практическому врачу". - Вып. 5. - К., 2002. С. 24-30). Є дані про використання складів, які містять фенібут у ветеринарній практиці для підвищення адаптивних можливостей організму та профілактики стресу під час проведення різноманітних заходів та маніпуляцій з тваринами, таких як транспортування, виставки, грумінг, діагностичні дослідження, зміна місця проживання та раціону годування тощо (RU2367428, Опубл 20.09.2009; препарати "СТОП-СТРЕСС" виробництва Апи-Сан НПО ООО, Росія). Фармацевтичні препарати, у яких активною речовиною є γ-аміно-β-фенілолійної кислоти гідрохлорид (фенібут або амінофенілмасляна кислота), є комерційно доступними. В попередньому рівні техніки розкриті дозування та склади цих препаратів фенібуту. Так, наприклад, склад лікарських засобів препаратів фенібуту у формі таблеток подібний у різних виробників. Зокрема зазначені таблетки містять як активну речовину фенібут кількістю 250 мг (або 100 мг), при цьому як розріджувач (наповнювач) використовують лактозу. При гранулюванні використовують розчини повідону, крохмалю або желатину. Як розпушуючу речовину традиційно використовують крохмаль. Дані, що описують склад препаратів з діючою речовиною амінофенілмасляною кислотою різних виробників наведено нижче у таблиці 1. 3 UA 91300 U Таблиця 1 Виробники препарату Фенібут 250 мг ФГУП Обґрунтування РУП "Бел "Московский АО ОАО вибору медпрепараты" эндокринный "Олайнфарм" "Органика" завод" Традиційна, широко застосовувана у фармації допоміжна речовина. Обмежено використання Розріджувачі для пацієнтів з + + + + (diluents) непереносиміс тю галактози, дефіцитом лактази Лаппа або глюкозогалакто зною мальтабсорбцією розчином ПВП + або желатину гранулюють суміш субстанції зв'язувальні Фенібут і речовини лактози, + (binders) отримуючи міцні гранули для подальшого пресування Розпушувачі (disintegratin + + + + д agents) перешкоджає налипанню таблеток до змащувальні пресуючих речовини поверхонь, + + + + {lubricants) знижує силу виштовхування таблеток з матриць Група Найменування допоміжних допоміжної речовин по речовини ГФ XI (ЕР) Лактоза Повідон Желатин Крохмаль Кальцію стеарат 5 10 Отже, традиційним є якісний склад препарату фенібут, таблетки 250 мг, який включає як активну речовину амінофенілмасляну кислоту та як допоміжні речовини - лактози моногідрат, крохмаль картопляний, повідон, кальцію стеарат. Недоліком цієї таблетки є те, що вона містить лактозу, тому обмеженим є його використання для пацієнтів з непереносимістю галактози, дефіцитом лактази Лаппа або глюкозогалактозною мальтабсорбцією. Задачею корисної моделі є забезпечення фармацевтичного продукту, що містить як активну речовину амінофенілмасляну кислоту та характеризуються високими технологічними властивостями і водночас, розширюючи арсенал фармацевтичних засобів з вираженими ноотропним та психостимулюючим впливом, дозволяють забезпечити різні категорії споживачів, що потребують відповідного лікування, якісним фармацевтичним продуктом. В основу корисної моделі поставлена задача шляхом підбору компонентів та їх кількості у дозованій одиниці створити фармацевтичний продукт на основі γ-аміно-β-фенілолійної кислоти 4 UA 91300 U 5 10 гідрохлориду (амінофенілмасляної кислоти, фенібуту), який є придатними для використання також пацієнтами з непереносимістю галактози, дефіцитом лактази Лаппа або глюкозогалактозною мальтабсорбцією, і при цьому у продукті мінімізовано можливу взаємодію діючої та допоміжних речовин, а також негативний вплив на діючу речовину процесів технологічної обробки. Поставлену задачу вирішують шляхом створення фармацевтичного продукту, який містить 1 або більше дозовані одиниці фармацевтичної композиції, які містять як активну речовину амінофенілмасляну кислоту, та як допоміжні речовини містить розріджувач - целюлозу мікрокристалічну, ковзну речовину, розпушувач та змащувальну речовину при наступному співвідношенні компонентів між собою мас. %: розріджувач ковзна речовина розпушувач змащувальна речовина 75,0-95,0 8,5-9,5 8,5-9,5 1,0-2,5. Переважним є наступне співвідношення допоміжних компонентів мас. %: розріджувач ковзна речовина розпушувач змащувальна речовина 80,18 8,95 8,95 1,92. 15 20 25 30 35 40 45 50 Також, згідно з корисною моделлю, дозовані одиниці фармацевтичного продукту можуть містити активну речовину кількістю 45-52 мас. % композиції. Переважно 47-50 мас. % композиції. Більш бажано 47-48 мас. % композиції. Також, згідно з корисною моделлю, дозована одиниця фармацевтичного продукту може містити 100 мг активної речовини. У кращому варіанті дозована одиниця фармацевтичного продукту містить від 237 до 262 мг активної речовини, більш бажано 250мг. Також, згідно з корисною моделлю, дозовані одиниці фармацевтичного продукту можуть містити як переважні допоміжні речовини мікрокристалічну целюлозу, кремнію діоксид колоїдний або натрію кроскармелозу, карбоксиметилкрохмаль натрію, кальцію або магнію стеарат. Переважно лікарський засіб містить як змащувальну речовину кальцію стеарат. Також, згідно з корисною моделлю, дозовані одиниці фармацевтичного продукту можуть бути твердими дозованими одиницями, переважно для перорального застосування. Переважно таблетками. Більш бажано таблетками, одержаними способом прямого пресування. Також фармацевтична композиція дозованої одиниці продукту може додатково містити тальк, наприклад кількістю до 1 мас. %. Дозовані одиниці продукту можуть також бути твердими желатиновими капсулами для перорального введення пацієнту, наприклад капсулами, до складу яких входить желатин та титану діоксид. Також фармацевтична композиція та дозовані одиниці фармацевтичного продукту, що її містять, можуть містити допоміжні речовини при наступному співвідношенні компонентів мас. %: мікрокристалічна целюлоза 75,0-95,0; кремнію діоксид колоїдний 8,5-9,5; карбоксиметилкрохмаль натрію - 8,5-9,5; кальцію стеарат -1,0-2,5. Переважно допоміжні речовини містяться при наступному співвідношенні компонентів, мас. %: мікрокристалічна целюлоза - 80,18; кремнію діоксид колоїдний -8,95; карбоксиметилкрохмаль натрію - 8,95; кальцію стеарат -1,92. Також, згідно з корисною моделлю, переважна фармацевтична композиція дозованої одиниці продукту може містити наступне співвідношення компонентів мас. %: амінофенілмасляна кислота - 45-52, мікрокристалічна целюлоза - 41-43, кремнію діоксид колоїдний - 4-6, карбоксиметилкрохмаль натрію - 4-6, кальцію стеарат - 0,8-1,0. Переважно може містити, мас. %: амінофенілмасляну кислоту - 47-48, мікрокристалічну целюлозу - 41-43, кремнію діоксид колоїдний - 4-6, карбоксиметилкрохмаль натрію - 4-6, кальцію стеарат - 0,8-1,0. Більш бажано, щоб фармацевтична композиція та лікарський засіб на її основі містили мас. %: амінофенілмасляну кислоту - 47,62, мікрокристалічну целюлозу - 42, кремнію діоксид колоїдний - 4,69, карбоксиметилкрохмаль натрію - 4,69, кальцію стеарат -1. Також, згідно з корисною моделлю, дозовані одиниці фармацевтичного продукту можуть бути одержані методом прямого пресування. Переважно дозовані одиниці продукту є таблетками з механічною міцністю не менше 30Н. 5 UA 91300 U 5 10 15 20 25 30 35 40 45 50 55 60 Також, згідно з корисною моделлю, дозовані одиниці продукту можуть знаходитися у контурній чарунковій упаковці або банці полімерній, як варіант по 10 одиниць на упаковку або більше. Як варіант 1, 2, 3 або 5 або більше контурних чарункових упаковок або банки полімерні можуть бути поміщені у пачку. Також фармацевтичний продукт, згідно з корисною моделлю, може містити інструкцію із застосування. Фармацевтичний продукт, згідно з корисною моделлю, може призначатися для профілактики та лікування станів, що потребують призначення пацієнту ноотропних та/або психостимулюючих засобів і може призначатися у вигляді монотерапії, комбінованої або комплексної терапії. Також зазначений стан може включати: зниження інтелектуальної та емоційної активності, порушення пам'яті, зниження концентрації уваги; астенічний та тривожно-неврологічний стан, неспокій, тривогу, страх, стресовий стан, зокрема стан, що виникає перед хірургічним втручанням і болючими діагностичними дослідженнями, захитування при кінетозах, хворобу Меньєра, запаморочення, пов'язані з дисфункцією вестибулярного апарату судинного, травматичного та інфекційного ґенезу (отогенний лабіринт), остеохондроз шийно-грудного відділу хребта та клімактеричні розлади, алкогольний пределіріозний та деліріозний стани, алкоголізм, психопатологічні та соматовегетативні розлади при абстинентному синдромі, безсоння, нічний неспокій, заїкання, енурез, тик тощо. Технічний результат, отримуваний при застосуванні корисної моделі, полягає в мінімізації можливої взаємодії діючого та допоміжних речовин фармацевтичної композиції та фармацевтичного продукту на її основі, а також негативного впливу на діючу речовину процесів технологічної обробки. Так використання у запропонованій фармацевтичній композиції сучасних допоміжних речовин, таких як розріджувач кількістю 75,0-95,0 мас. %, ковзна речовина кількістю 8,5-9,5 мас. %, розпушувач кількістю 8,5-9,5 мас. % та змащувальна речовина кількістю 1,0-2,5 мас. %, дозволяють отримувати якісний препарат без стадії вологого гранулювання. Запропонований спосіб дозволяє уникнути впливу дестабілізуючих факторів (температура, волога) на діючу речовину. З цією метою як наповнювач (розріджувач) може бути використано мікрокристалічну целюлозу. Для поліпшення сипучості таблетмаси може бути використано кремнію діоксид колоїдний безводний. Для отримання більш стабільних і постійних при зберіганні результатів по дезінтеграції дозованих одиниць до складу введений розпушувач, зокрема супер-дезінтегрант - карбоксиметилкрохмаль натрію. Як варіант використовують також натрію кроскармелозу. Як змащувальна речовина у всіх складах використовується кальцію або магнію стеарат. Також новий ефективний склад продукту забезпечує можливість використання сучасних технологічних підходів та одержання лікарського засобу, у якому підвищені не тільки основні якості дозованих одиниць продукту (зокрема механічна міцність, розпадність, розчинність), а й вивільнення діючої речовини. Крім цього засіб є придатним для використання хворими на цукровий діабет 2 типу завдяки відсутності в ньому лактози. Лікарський засіб є придатним для пацієнтів з непереносимістю галактози, дефіцитом лактази Лаппа або глюкозогалактозною мальтабсорбцією. Показаннями для застосування запропонованого фармацевтичного продукту можуть, зокрема, бути зниження інтелектуальної та емоційної активності, порушення пам'яті, зниження концентрації уваги; астенічний та тривожно-неврологічний стан, неспокій, тривога, страх; профілактика стресових станів, що виникають перед хірургічними втручаннями і болючими діагностичними дослідженнями; комплексне лікування жінок з остеохондрозом шийно-грудного відділу хребта та клімактеричними розладами; профілактика захитування при кінетозах; хвороба Меньєра, запаморочення, пов'язані з дисфункцією вестибулярного апарату судинного, травматичного та інфекційного ґенезу (отогенний лабіринт). У комбінації з дезінтоксикаційними засобами для лікування алкогольних пределіріозних і деліріозних станів; в комплексній терапії при лікуванні алкоголізму для купірування психопатологічних і соматовегетативних розладів при абстинентному синдромі. Людям літнього віку препарат призначається при безсонні, нічному неспокої; дітям препарат показаний при заїканні, енурезі, тику. Досягнення технічного результату при здійсненні корисної моделі підтверджується наступними прикладами, які наведені для ілюстрування у і ніяким чином не обмежують її. Термін "дозована одиниця" зазвичай стосується фізично дискретних одиниць, придатних як одиничні дози для пацієнтів, причому кожна містить попередньо визначену певну кількість активної речовини, розраховану для отримання необхідної дії, наприклад, таблетки (з оболонкою або без неї), пілюлі, порошки, супозиторії, капсули тощо. Способи та композиції для отримання таких дозованих одиниць відомі фахівцям в даній галузі. Наприклад технології одержання таблеток і пігулок, що містять активні інгредієнти, 6 UA 91300 U 5 10 15 20 25 30 35 40 45 50 55 60 описані в довідковій літературі, Gennaro et al., Remington's Pharmaceutical Sciences, (18th ed., Mack Publishing Company, 1990, дивись зокрема Part 8: Pharmaceutical Preparations and Their Manufacture). Для отримання дозованих одиниць, наприклад таблеток, передбачається використання допоміжних речовин, наприклад наповнювачів, дезінтегрантів, антифрикційних речовин, барвників, полімерних зв'язуючих речовин тощо. Розріджувач лактоза (молочний цукор) не використовуються у запропонованій корисній моделі. Натомість використано мікрокристалічну целюлозу. Ковзна речовина (glidant) адсорбуючись на поверхні часток (гранул), усуває або зменшує їх шорсткість і тим самим підвищує плинність. Найвищу ефективність ковзання мають частинки сферичної форми. Як ковзні речовини використовуються крохмаль, тальк, поліетиленоксид, кремнію діоксид колоїдний безводний або аеросил та інші. Розпушувач (disintegrating agent) використовують для поліпшення розпадання або розчинення. Розпушувачі забезпечують механічне руйнування дозованих одиниць, зокрема таблеток, у рідкому середовищі, що необхідно для швидкого вивільнення діючої речовини. Як набухаючі розпушувачі використовують крохмаль картопляний, пшеничний, кукурудзяний, рисовий, пектини, желатин, карбоксиметилкрохмаль натрію, метилцелюлозу, натрійкарбоксиметилцелюлозу, амілопектин, ультраамілопектин, агар-агар, кислоту альгінову тощо. Змащувальна речовина (lubricant) полегшує виштовхування дозованих одиниць лікарського засобу із матриці. Змащувальні речовини не лише зменшують тертя на контактних ділянках, але й значно полегшують деформацію частинок внаслідок адсорбційного зменшення їх міцності за рахунок проникнення в мікропори. Функція змащувальних речовин полягає і в тому, щоб перебороти сили тертя між гранулами і стінкою матриці, боковою поверхнею спресованої таблетки і стінкою матриці в мить виштовхування нижнім пуансоном із матриці. Як змащувальні речовини використовуються кислота стеаринова, кальцію і магнію стеарати тощо. Склад дозованої одиниці може містити додаткові фармацевтично прийнятні допоміжні речовини. Такі речовини мають будь-яку з речовин, уже згаданих, так само як будь-яку з використовуваних традиційно, таких як описані в Remington: Наука й Практика Фармації (Gennaro й Gennaro, 20 видання, Lippincott Williams & Wilkins, 2000); Теорія й Практика Промислової Фармації (Lachman й ін., З видання, Lippincott Williams & Wilkins, 1986); Енциклопедія Фармацевтичної Технології (Swarbrick й Воуlаn, 2 вивільнення, Marcel Dekker, 2002). Вони можуть бути згадані тут як "фармацевтично прийнятні допоміжні речовини", щоб вказати, що вони комбінуються з активною речовиною і можуть призначатися безпечно суб'єкту в терапевтичних цілях. Так коригувальні речовини наприклад можуть додаватись до складу з метою поліпшення смаку, кольору і запаху, барвники - з метою надання товарного вигляду, позначення терапевтичної групи лікарських речовин тощо. Для приготування фармацевтичної композиції, що входить до складу дозованої одиниці згідно з корисною моделлю, є придатними комерційно доступні субстанції амінофенілмасляної кислоти. Як варіант, використовували субстанції амінофенілмасляної кислоти виробництва ФГУП "СКТБ "Технолог", Росія. Субстанція амінофенілмасляної кислоти являє собою білий кристалічний порошок. Легкорозчинний у воді, розчинний у спирті 95 %, практично нерозчинний в ацетоні. рН 2,5 % водного розчину складає 2,3-2,7. Субстанція амінофенілмасляної кислоти містить не менше 99,0 % C10H13NO2 HCI в перерахунку на суху речовину. Контроль якості субстанції здійснювався, згідно з затвердженою специфікацією, за наступними показниками: опис, розчинність, справжність, температура розкладання, прозорість розчину, кольоровість розчину, рН, сторонні домішки, залізо, сульфатна зола, важкі метали, втрата в масі при висушуванні, мікробіологічна чистота, кількісне визначення. Фізико-хімічними характеристиками діючої речовини, які можуть впливати на біодоступність, є розчинність, форма і розмір кристалів тощо. Амінофенілмасляна кислота легкорозчинна у воді, що в свою чергу підвищує біодоступність і терапевтичну ефективність препарату. Проведені на етапі фармацевтичної розробки дослідження фізико-хімічних, технологічних і функціональних властивостей діючої і допоміжних речовин та їх потенційної несумісності дозволили вибрати оптимальну технологію, здатну забезпечити випуск ефективного, якісного та безпечного продукту. Використання сучасних допоміжних речовин дозволило отримати якісний препарат без стадії гранулювання (методом прямого пресування). Склад для прямого пресування дозволяє уникнути впливу дестабілізуючих факторів (температура, волога) на діючу речовину. З цією метою як розріджувач (наповнювач) у прикладі здійснення корисної моделі використовували мікрокристалічну целюлозу. Для поліпшення сипучості таблетмаси використовували кремнію 7 UA 91300 U 5 10 15 20 25 30 35 40 45 діоксид колоїдний безводний. Для отримання більш стабільних і постійних при зберіганні результатів по дезінтеграції таблеток до складу вводили супер-дезінтегрант карбоксиметилкрохмаль натрію. Як змащувальну речовину у всіх складах використовували кальцію стеарат (або магнію стеарат). У випадку виготовлення дозованих одиниць у вигляді твердих желатинових капсул для приготування наповнювача у фармацевтичній композиції використовували розпушувач (дезінтегрант) - натрію кроскармелозу та додатково тальк, що покращує сипучі властивості наповнювача. Тверді капсули заповнюють після того, як цілком пройде весь технологічний процес їх формування, і вони набудуть відповідної пружності і стануть твердими. Тверді капсули мають двосекційну будову і можуть бути виготовлені заздалегідь, а наповнити їх лікарськими речовинами можна пізніше, коли виникне необхідність. Технологія виготовлення таких капсул добре відома. Для наповнення твердих желатинових капсул використовують автомати різних фірм, що відрізняються продуктивністю (від 20 до 150 тис. / ч), точністю дозування (2-5 %) і будовою дозатора. Наповнення твердих желатинових капсул проводиться в п'ять операцій: орієнтування порожніх капсул, поділ (розтин) порожніх капсул, наповнення корпусу капсули, з'єднання і закриття тіла і кришечки капсули, викид наповнених капсул. Технологія прямого пресування добре описана у рівні техніки і у загальному вигляді включає наступні стадії: змішування компонентів (барабанний змішувач, змішувач з лопатями); пресування і знепилення (таблетна машина); пакування, маркування і відвантажування. Для одержання дозованої одиниці фармацевтичного продукту згідно з прикладом використовували наступні допоміжні речовини: целюлоза мікрокристалічна, кремнію діоксид колоїдний безводний, карбоксиметилкрохмаль натрію, кальцію стеарат. Зазначені допоміжні речовини описані в провідних фармакопеях світу (ЕР або USP / NF). Використані допоміжні речовини не відносяться до речовин тваринного походження. Вони добре вивчені і не проявляють несумісності одна до одної, що підтверджується результатами вивчення стабільності готового продукту. Функції кожної допоміжної речовини наведені нижче: целюлоза мікрокристалічна - розріджувач (diluent); кремнію діоксид колоїдний безводний - ковзна речовина (glidant); карбоксиметилкрохмаль натрію - розпушувач (disintegrating agent); кальцію стеарат (або магнію стеарат) - змащувальна речовина (lubricant). Згідно з прикладом здійснення корисної моделі, одержували лікарський засіб, дозовані одиниці якого містять як активну речовину фенібут і представляють собою таблетки, 250 мг, одержані методом прямого пресування. Процес виробництва препарату включав наступні стадії: 1. Стадія підготовки сировини - сировину, що має допуск відділу контролю якості, просіювали і зважували. 2. Отримання таблетмаси. Амінофенілмасляну кислоту змішували у змішувачі з мікрокристалічною целюлозою, колоїдним оксидом кремнію, натрію гліколят крохмалем, стеаратом кальцію. Таблеткову масу контролювали на кількісний вміст амінофенілмасляної кислоти. Як приклад, інгредієнти змішували у наступному співвідношенні (див. таблицю 2). Таблиця 2 Амінофенілмасляна кислота Аеросил МКЦ Кальцію стеарат маса, кг/ мас. % мас. % мас. % мас. % 40,0 /47-48 4-6 41-43 0,8-1,0 50 8 UA 91300 U Продовження таблиці 2 Примогель Змішування Таблетмаса Таблетмаса 5 мас. % Час, хв маса, кг Вміст АФМК, г в 0,525 г опудреного грануляту 4-6 5 Отримана 0,238-0,263 3. Таблетування. Отриману масу таблетували. У процесі таблетування контролювали масу таблеток. Серію таблеток контролювали в аналітичній лабораторії. Згідно з прикладом, одержували таблетки білого або білого зі злегка жовтуватим відтінком кольору, плоскоциліндричної форми з фаскою і рискою з наступними характеристиками (див. таблицю 3). Таблиця 3. Діаметр, мм Висота, мм Середня маса, г Механічна міцність, Н Міцність на випробування, % 10 15 12,0±0,3 4,2±0,5 0,5±5,0 % не менше 30 Н не менше 97 % 4. Фасування та пакування. Таблетки, що мають допуск на фасування, фасували і запаковували. Препарат запаковували у контурні чарункові упаковки. Контурні чарункові упаковки разом з інструкцією по медичному застосуванню поміщували в пачку. Пачки поміщували в групову упаковку. Дозовані одиниці як варіант можуть бути запаковані по 10 у контурні чарункові упаковки з плівки полівінілхлоридної і фольги алюмінієвої друкованої лакованої. У пачку з картону як варіант може бути поміщено по 1, 2, 3 або 5 контурних чарункових упаковки. Готову продукцію аналізували у відділі контролю якості. Кінцевий якісний склад дозованої одиниці, одержуваної згідно з прикладом здійснення, наведено нижче у таблиці 4. 20 Таблиця 4. Активна речовина: Амінофенілмасляна кислота Допоміжні речовини: Мікрокристалічна целюлоза (ЕР або USP / NF) Кремнію діоксид колоїдний (ЕР або USP / NF) Карбоксиметилкрохмаль натрію (ЕР або USP / NF) Кальцію стеарат (ЕР або USP / NF) маса таблетки 25 30 47,62 мас. % 42 мас. % 4,69 мас. % 4,69 мас. % 1 мас. % 0,525 г Діюча речовина одержуваного препарату легкорозчинна у воді. Було проаналізовано кількість діючої речовини (в інтервалах часу), що дифундувала з таблеток у середовище для розчинення. Визначення розчинення проводять, відповідно до вимог ОФС 42 0003 04 (Загальна фармакопейна стаття). Нижче наведені експериментальні дані, які ілюструють профіль розчинення препарату фенібут, 250 мг, старого складу та профіль розчинення нового складу. 1. Буферний розчин рН 1,2. Середовище розчинення - 0,1 М розчин хлористоводневої кислоти. Час відбору проб: 5 хв, 10 хв, 20 хв, 30 хв, 45 хв. Кількість діючої речовини, що перейшла у середовище для розчинення наведено у таблиці 5. 9 UA 91300 U Таблиця 5 Час, хв 0 5 10 20 30 45 5 Старий склад 0 49,8 % 75,2 % 97,7 % 98,6 % 99,1 % Новий склад 0 58,9 % 77,3 % 99,6 % 100,5 % 101,2 % 2. Ацетатний буферний розчин рН 4,5. Середовище розчинення - ацетатний буферний розчин рН 4,5. Час відбору проб: 5 хв, 10 хв, 20 хв, 30 хв, 45 хв. Кількість діючої речовини, що перейшла у середовище для розчинення наведено у таблиці 6. Таблиця 6 Час, хв 0 5 10 20 30 45 10 Старий склад 0 41,2 % 60,7 % 78,4 % 81,5 % 83,1 % Новий склад 0 46,5 % 63,1 % 80,2 % 83,6 % 84,5 % 3. Фосфатний буферний розчин рН 7.4. Середовище розчинення - фосфатний буферний розчин рН 7,4. Час відбору проб: 5 хв, 10 хв, 20 хв, 30 хв, 45 хв. Кількість діючої речовини, що перейшла у середовище для розчинення наведено у таблиці 7. 15 Таблиця 7 Час, хв 0 5 10 20 30 45 20 25 30 Старий склад 0 33,10 % 48,60 % 59,90 % 65,70 % 73,10 % Новий склад 0 35,50 % 49,10 % 61,30 % 66,50 % 73,90 % На фігурі 1 представлено графічне зображення профілів розчинення препаратів фенібут, 250 мл, старого та нового складу (середовище розчинення - 0,1М розчин хлористоводневої кислоти). На фігурі 2 представлено графічне зображення профілів розчинення препаратів фенібут, 250 мл, старого та нового складу (середовище розчинення - ацетатний буферний розчин рН 4,5). На фігурі 3 представлено графічне зображення профілів розчинення препаратів фенібут, 250 мл, старого та нового складу (середовище розчинення - фосфатний буферний розчин рН 7,4). Як видно з отриманих результатів профілі розчинення подібні. Розчинність - не менше 70 % (Q) за 45 хв. З метою виявлення можливих продуктів розкладання були проаналізовані таблетки 250 мг нового складу через 12 місяців з дати випуску і препарат Фенібут, таблетки 250 мг старого складу на момент випуску і після закінчення терміну придатності. Було встановлено, що обидва склади препарату демонструють достатню стабільність діючої речовини, а вміст супутніх домішок в досліджуваних складах подібний. Одинична домішка не більше 0,5 %. 10 UA 91300 U 5 10 15 20 25 30 Було проведено дослідження стабільності в нормальних умовах на зразках лікарського засобу, що зберігалися при температурі 25 °C ± 2 °C і відносній вологості 65 % ± 5 % протягом 12 місяців. Отримані дані дозволяють екстраполювати результати вивчення стабільності протягом 36 місяців. Дослідження стабільності в умовах прискореного зберігання проводилися на зразках лікарського засобу, що зберігалися при температурі 40 °C ± 2 °C і відносній вологості 75 % ± 5 % протягом 6 місяців. Дослідження стабільності свідчать про те, що одержуваний препарат хімічно стабільний при температурі 25 °C ± 2 °C і відносній вологості 65 % ± 5 % протягом 36 місяців змін зовнішнього вигляду не спостерігалося після 6 місяців при температурі 40 °C ± 2 °C і відносній вологості 75 % ± 5 %. Кількісне визначення показало вміст амінофенілмасляної кислоти в одній дозованій одиниці (таблетці) від 0,237 до 0,262 г, з розрахунку на середню масу однієї таблетки. Результати тестування на кількісний вміст та розчинення вказують на відсутність взаємодії між діючою та допоміжними речовинами запропонованого складу в умовах проведення технологічного процесу. Фармацевтичний продукт, одержуваний, згідно з корисною моделлю, та виготовлений як для клінічних досліджень, так і в умовах серійного промислового виробництва, має високу якість і відповідає передбаченому застосуванню, зберігається при температурі не вище 30 °C протягом 3-х років. Таким чином, згідно з корисною моделлю, отримують ефективний, якісний та безпечний фармацевтичний продукт фенібуту (амінофенілмасляної кислоти), який завдяки своєму новому складу можна отримувати без стадії гранулювання (методом прямого пресування), що в свою чергу дозволяє уникнути впливу дестабілізуючих факторів (температура, волога) на діючу речовину. У фармацевтичного продукту, який отримують, згідно з корисною моделлю, підвищено не тільки основні якості його дозованих одиниць (механічна міцність, розпадність, розчинність), а й вивільнення діючої речовини. Крім цього, завдяки своєму якісному складу він придатний для призначення пацієнтам з непереносимістю галактози, дефіцитом лактази Лаппа або глюкозогалактозною мальтабсорбцією та може застосовуватися для профілактики та лікування станів, при яких показане вживання препаратів з ноотропною та психостимулюючою активностями. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 35 40 1. Фармацевтичний продукт як засіб з ноотропними та психостимулюючими властивостями, який містить одну або більше дозовані одиниці фармацевтичної композиції на основі амінофенілмасляної кислоти, вміст якої складає від 45 до 52 мас. % композиції, як допоміжні речовини містить розріджувач, розпушувач, змащувальну речовину, який відрізняється тим, що розріджувачем є целюлоза мікрокристалічна, фармацевтична композиція додатково містить ковзну речовину, причому допоміжні речовини композиція містить при наступному співвідношенні компонентів між собою мас. %: розріджувач ковзна речовина розпушувач змащувальна речовина 45 2. Фармацевтичний продукт за пунктом 1, який відрізняється тим, що допоміжні речовини фармацевтична композиція дозованої одиниці продукту містить при наступному співвідношенні компонентів між собою мас. %: розріджувач ковзна речовина розпушувач змащувальна речовина 50 75,0-95,0 8,5-9,5 8,5-9,5 1,0-2,5. 80,0 9,1 9,1 1,8. 3. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту містить активну речовину кількістю 4750 мас. % композиції. 11 UA 91300 U 5 10 15 20 4. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці містить активну речовину кількістю 47-48 мас. % композиції. 5. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозована одиниця продукту містить від 237 до 262 мг активної речовини. 6. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозована одиниця продукту містить 250 мг активної речовини. 7. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як розпушувач містить карбоксиметилкрохмаль натрію. 8. Фармацевтичний продукт забудь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як змащувальну речовину містить кальцію стеарат або магнію стеарат. 9. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як ковзну речовину містить кремнію діоксид колоїдний. 10. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як змащувальну речовину містить кальцію стеарат. 11. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту містить наступне співвідношення компонентів мас. %: амінофенілмасляна кислота мікрокристалічна целюлоза кремнію діоксид колоїдний карбоксиметилкрохмаль натрію кальцію стеарат 25 12. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту містить наступне співвідношення компонентів мас. %: амінофенілмасляна кислота мікрокристалічна целюлоза кремнію діоксид колоїдний карбоксиметилкрохмаль натрію кальцію стеарат 30 40 47-48 41-43 4-6 4-6 0,8-1,0. 13. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту містить наступне співвідношення компонентів мас. %: амінофенілмасляна кислота мікрокристалічна целюлоза кремнію діоксид колоїдний карбоксиметилкрохмаль натрію кальцію стеарат 35 45-52 41-43 4-6 4-6 0,8-1,0. 47,62 42 4,38 5 1. 14. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється дозовані одиниці продукту є твердими дозованими одиницями. 15. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється дозовані одиниці продукту призначені для перорального введення пацієнту. 16. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється дозовані одиниці продукту є таблетками. 17. Фармацевтичний продукт за пунктом 16, який відрізняється тим, що дозовані продукту одержують методом прямого пресування. 18. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється дозовані одиниці продукту є таблетками з механічною міцністю не менше 30Н. 12 тим, що тим, що тим, що одиниці тим, що UA 91300 U 5 10 15 20 25 19. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що має такий профіль розчинення, що амінофенілмасляна кислота вивільняється кількістю щонайменше 70 % за 45 хв. 20. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що має такий профіль розчинення, що амінофенілмасляна кислота вивільняється кількістю щонайменше 74 % за 45 хв. 21. Фармацевтичний продукт за будь-яким з пунктів 1-8, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту як ковзну речовину містить натрію кроскармелозу. 22. Фармацевтичний продукт за будь-яким з попередніх пунктів 1-8, 21, який відрізняється тим, що фармацевтична композиція дозованої одиниці продукту додатково містить тальк. 23. Фармацевтичний продукт за пунктом 22, який відрізняється тим, що композиція містить тальк кількістю до 1 мас. %. 24. Фармацевтичний продукт за будь-яким з пунктів 1-8, 21-23, який відрізняється тим, що дозовані одиниці продукту є твердими дозованими одиницями для перорального введення пацієнту. 25. Фармацевтичний продукт за будь-яким з попередніх пунктів 1-8, 21-24, який відрізняється тим, що дозовані одиниці продукту є твердими желатиновими капсулами. 26. Фармацевтичний продукт за пунктом 25, який відрізняється тим, що до складу капсул входить желатин та титану діоксид. 27. Фармацевтичний продукт за будь-яким з попередніх пунктів, який відрізняється тим, що дозовані одиниці продукту знаходяться у контурній чарунковій упаковці або у банці полімерній. 28. Фармацевтичний продукт за пунктом 27, який відрізняється тим, що дозовані одиниці продукту знаходяться у контурній чарунковій упаковці або у банці полімерній по 10 одиниць або більше. 29. Фармацевтичний продукт за будь-яким з попередніх пунктів 27 або 28, який відрізняється тим, що продукт додатково поміщено у пачку. 13 UA 91300 U Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Автори російськоюИсмагилов Искандар Халиуллович
МПК / Мітки
МПК: A61K 31/00
Мітки: продукт, ноотропними, властивостями, фармацевтичний
Код посилання
<a href="https://ua.patents.su/16-91300-farmacevtichnijj-produkt-z-nootropnimi-vlastivostyami.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичний продукт з ноотропними властивостями</a>
Попередній патент: Спосіб одержання дозованих одиниць ноотропного лікарського засобу
Наступний патент: Ківш навантажувальної машини
Випадковий патент: Спосіб одержання провітаміну а спонукача якісного горіння палива