Похідні піколінаміду як інгібітори кінази
Номер патенту: 103034
Опубліковано: 10.09.2013
Автори: Бюргер Метью Т., Хан Вусіок, Нішігучі Жизель, Лан Джіонг
Формула / Реферат
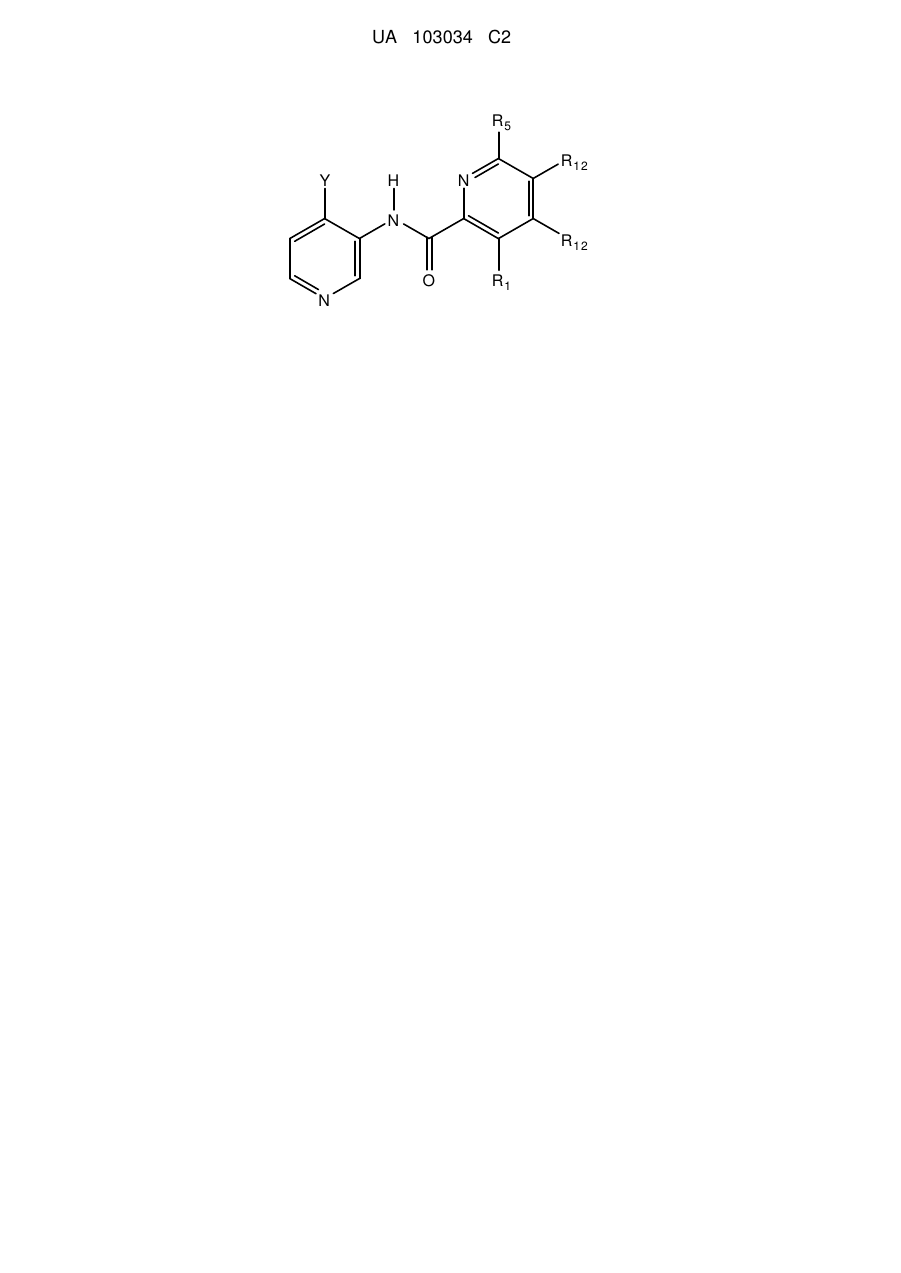
1. Сполука формули II
 II
II
або її стереоізомер, таутомер або фармацевтично прийнятна сіль,
у якій
Y являє собою циклогексил, що містить 1-3 замісники, вибрані з групи, що включає гідроксигрупу, аміногрупу, С1-С4-алкіл і С1-С4-галогеналкіл;
R1 являє собою водень, -NH2 або галоген;
R12 у кожному випадку незалежно вибраний з групи, що включає водень і галоген; і
R5 вибраний з групи, що включає циклогексил, феніл і піридил, причому зазначений циклогексил, зазначений феніл і зазначений піридил усі незалежно містять до 3 замісників, вибраних з групи, що включає галоген, гідроксигрупу, С1-С4-алкіл і ОС1-С4-алкіл.
2. Сполука за п. 1, у якій Y містить 1-3 замісники, вибрані з групи, що включає метил, гідроксигрупу, аміногрупу та CF3.
3. Сполука за п. 1, у якій R1 являє собою водень, аміногрупу або фтор.
4. Сполука за п. 1, у якій R5 являє собою феніл, що містить до 3 замісників, вибраних з групи, що включає галоген, гідроксигрупу, С1-С4-алкіл та ОС1-С4-алкіл.
5. Сполука за п. 4, у якій Y містить 1-3 замісники, вибрані з групи, що включає метил, гідроксигрупу, аміногрупу та CF3; R1 являє собою водень; і R5 являє собою феніл, що містить до 3 замісників, вибраних з групи, що включає фтор, гідроксигрупу, метил, етил, метоксигрупу та пропоксигрупу.
6. Сполука за п. 5, у якій R1 являє собою 2,6-дифторфеніл.
7. Сполука за п. 1, вибрана з групи, що включає
N-(4-((3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід;
3-aміно-N-(4-((1R,3R,4S,5S)-3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід;
N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід;
3-аміно-N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід і
N-(4-((3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід;
або її стереоізомер, таутомер або фармацевтично прийнятна сіль.
8. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-7 та фармацевтично прийнятний носій або наповнювач.
9. Фармацевтична композиція за п. 8, яка додатково містить щонайменше один додатковий засіб для лікування раку.
10. Фармацевтична композиція за п. 9, у якій додатковий засіб вибраний з групи, що включає іринотекан, топотекан, гемцитабін, 5-фторурацил, лейковорин, карбоплатин, цисплатин, таксани, тезацитабін, циклофосфамід, алкалоїди барвінку, іматиніб (глівек), антрацикліни, ритуксимаб і трастузумаб.
11. Сполука за будь-яким з пп. 1-7, призначена для застосування для лікування патологічного стану шляхом модуляції активності провірусної інтеграції кінази Мелоні (кінази РІМ).
12. Сполука за п. 11, де патологічним станом є рак, вибраний з групи, що включає карциному легенів, підшлункової залози, щитовидної залози, яєчників, сечового міхура, молочної залози, передміхурової залози або товстої кишки, меланому, мієлолейкоз, множинну мієлому і еритролейкоз, ворсинчасту аденому товстої кишки та остеосаркому.
13. Сполука за п. 1, вибрана з групи, що включає:
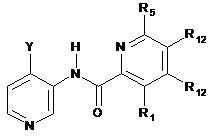
1
6-(2,6-дифторфеніл)-5-фтор-N-(4-((1R,3S,5S)-3-гідрокси-5-метилциклогексил)піридин-3-іл)піколінамід
4

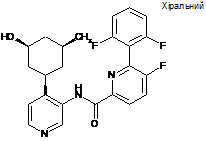
N-(4-((1R,3R,4R,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-4-гідроксифеніл)-5-фторпіколінамід
5
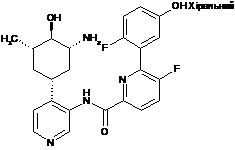
N-(4-((1R,3R,4R,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-5-гідроксифеніл)піколінамід
6

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2-фтор-4-гідроксифеніл)піколінамід
7

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2-фтор-5-гідроксифеніл)піколінамід
8

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифтор-4-гідроксифеніл)піколінамід
9

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-4-гідроксифеніл)піколінамід
10

N-(4-((1R,5R)-5-aміно-3,3-диметилциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-4-гідроксифеніл)піколінамід
11

N-(4-((1R,5R)-5-aмiнo-3,3-димeтилциклoгексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)-5-фторпіколінамід
12

N-(4-((1R,5R)-5-аміно-3,3-диметилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)піколінамід
14

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-5-фтор-6-(2,3,5-трифторфеніл)піколінамід
15
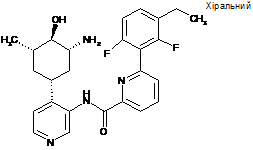
N-(4-((1R,3R,4R,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(3-етил-2,6-дифторфеніл)піколінамід
17
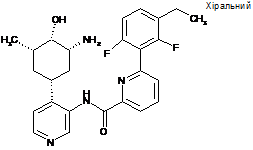
N-(4-((1R,3R,4S,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(3-етил-2,6-дифторфеніл)піколінамід
18

N-(4-((1R,3R,4S)-3-aмiнo-4-гiдpoкcициклoгексил)піридин-3-іл)-6-(3-етил-2,6-дифторфеніл)піколінамід
19
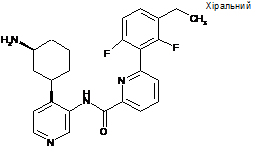
N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(3-етил-2,6-дифторфеніл)піколінамід
20

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)-5-фторпіколінамід
21
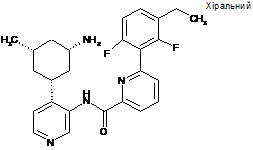
N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(3-етил-2,6-дифторфеніл)піколінамід
27
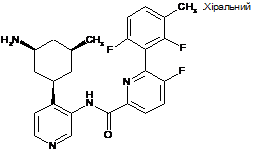
N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)-5-фторпіколінамід
28

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)піколінамід
29
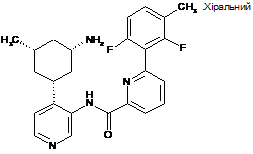
N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)піколінамід
30
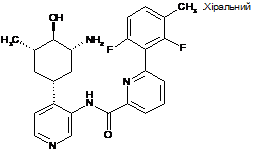
N-(4-((1R,3R,4R,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)піколінамід
31
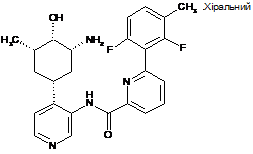
N-(4-((1R,3R,4S,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)піколінамід
32

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифтор-4-гідроксифеніл)-5-фторпіколінамід
33

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-5-гідроксифеніл)піколінамід
34

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-3-фтор-6-(2-фтор-5-гідроксифеніл)піколінамід
35

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2-фтор-5-гідроксифеніл)піколінамід
36

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-4-гідроксифеніл)піколінамід
37

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2-фтор-4-гідроксифеніл)піколінамід
38

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-4-гідроксифеніл)піколінамід
39

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-3-фтор-6-(2-фтор-4-гідроксифеніл)піколінамід
40

N-(4-((1R,3R,4S,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)-5-фторпіколінамід
41

N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)піколінамід
42

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-4-гідроксифеніл)-3-фторпіколінамід
43

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-3-фтор-6-(2-фтор-5-гідроксифеніл)піколінамід
44

N-(4-((1R,3R,4R,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)-5-фторпіколінамід
45

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-5-метоксифеніл)піколінамід
46

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-5-гідроксифеніл)піколінамід
47
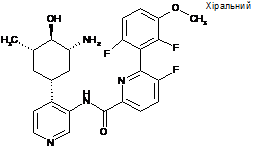
N-(4-((1R,3R,4R,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-метоксифеніл)-5-фторпіколінамід
48

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,3,5-трифторфеніл)піколінамід
49

N-(4-((1R,5R)-5-аміно-3,3-диметилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
50

N-(4-((1R,3R,4R,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
51

3-aміно-N-(4-((1R,3S,5S)-3-aміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
52

N-(4-((1S,3S,4S,5R)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
53

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-5-фтор-6-((1s,4s)-4-гідроксициклогексил)піколінамід
54

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-5-фтор-6-((1s,4s)-4-гідроксициклогексил)піколінамід
55

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-5-фтор-6-((1r,4r)-4-гідроксициклогексил)піколінамід
56

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-5-фтор-6-((1r,4r)-4-гідроксициклогексил)піколінамід
57

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2-фторфеніл)піколінамід
58

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2-фтор-5-метилфеніл)піколінамід
59

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-5-метилфеніл)піколінамід
60

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,3-дифторфеніл)-5-фторпіколінамід
61

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,5-дифторфеніл)-5-фторпіколінамід
62

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2-фторфеніл)піколінамід
63

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
64
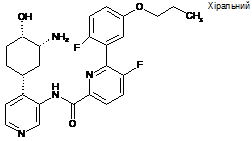
N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-5-пропоксифеніл)піколінамід
65
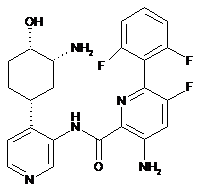
3-aміно-N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
66
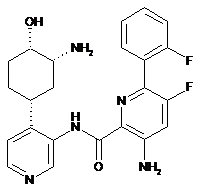
3-aміно-N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-5-фтор-6-(2-фторфеніл)піколінамід
67

3-aміно-N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-5-пропоксифеніл)піколінамід
68

3-aміно-N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-6-(2-фтор-5-пропоксифеніл)піколінамід
69

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-3-фторпіколінамід
70

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
71

N-(4-((1S,3R,5R)-3-aміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-3-фторпіколінамід
72

N-(4-((1S,3R,5R)-3-aмiнo-5-мeтилциклoгeкcил)пipидин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
73

N-(4-((1R,3R,4S,5S)-3-aмiнo-4-гiдpoкcи-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2-фтор-5-метилфеніл)піколінамід
74

N-(4-((1R,3R,4S,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2-фтор-5-метилфеніл)піколінамід
75

N-(4-((1R,3R,4S,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2-фторфеніл)піколінамід
76

N-(4-((1R,3R,4S,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
77
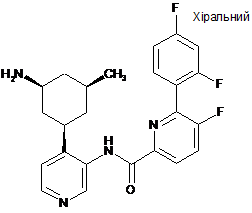
N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,4-дифторфеніл)-5-фторпіколінамід
78

N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
79

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,3-дифторфеніл)-5-фторпіколінамід
80

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-3-фторпіколінамід
81

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,5-дифторфеніл)-5-фторпіколінамід
82

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,4-дифторфеніл)-5-фторпіколінамід
83

N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-6-(2-фторфеніл)піколінамід
84
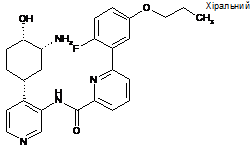
N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-6-(2-фтор-5-пропоксифеніл)піколінамід
85

N-(4-((1R,3R,4S,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
86

N-(4-((1R,3R,4S,5S)-3-aміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
87

N-(4-((1R,3R,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-5-фтор-6-(2-фторфеніл)піколінамід
88

N-(4-((1S,3S,4R)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
89
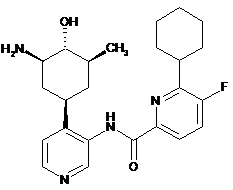
N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-циклогексил-5-фторпіколінамід
90
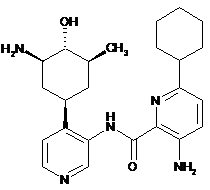
3-аміно-N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-циклогексилпіколінамід
91
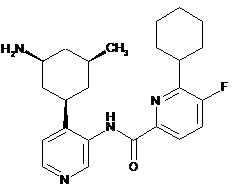
N-(4-(3-аміно-5-метилциклогексил)піридин-3-іл)-6-циклогексил-5-фторпіколінамід
94
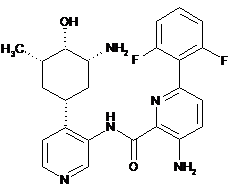
3-аміно-N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
95
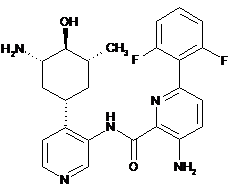
3-аміно-N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
97

3-аміно-N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
98

3-аміно-N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
99

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
100

3-аміно-N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
101
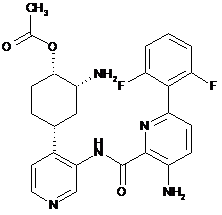
2-аміно-4-(3-(3-аміно-6-(2,6-дифторфеніл)піколінамідо)піридин-4-іл)циклогексилацетат
102
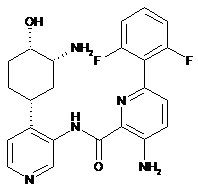
3-аміно-N-(4-(3-аміно-4-гідроксициклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
104
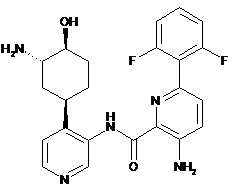
3-aміно-N-(4-((1R,3S,4S)-3-aміно-4-гідроксициклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
106
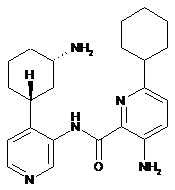
3-аміно-N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-циклогексилпіколінамід
108

N-(4-((1R,3R,5S)-3-aміно-5-(трифторметил)циклогексил)піридин-3-іл)-6-(2-фтор-5-метилфеніл)піколінамід
109

N-(4-((1R,3R,5S)-3-аміно-5-(трифторметил)циклогексил)піридин-3-іл)-6-(2,6-дифтор-4-метоксифеніл)піколінамід
110

3-aміно-N-(4-((1R,3R,5S)-3-aміно-5-(трифторметил)циклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
111

N-(4-((1R,3R,5S)-3-aміно-5-(трифторметил)циклогексил)піридин-3-іл)-6-циклогексил-5-фторпіколінамід
112

3-aміно-N-(4-((1R,3R,5S)-3-aміно-5-(трифторметил)циклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід
117

6-(2,6-дифторфеніл)-N-(4-((1R,3R,4R,5S)-3,4-дигідрокси-5-метилциклогексил)піридин-3-іл)-5-фторпіколінамід
121

3-аміно-6-(2,6-дифторфеніл)-N-(4-((1R,3R,4R,5S)-3,4-дигідрокси-5-метилциклогексил)піридин-3-іл)-5-фторпіколінамід
122

N-(4-((1R,5R)-5-аміно-3,3-диметилциклогексил)піридин-3-іл)-6-(2,6-дифтор-4-гідроксифеніл)-5-фторпіколінамід
123

N-(4-((1R,5R)-5-аміно-3,3-диметилциклогексил)піридин-3-іл)-6-(2,6-дифтор-4-метоксифеніл)-5-фторпіколінамід
124

N-(4-((1R,3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-гідроксифеніл)-5-фторпіколінамід
125

N-(4-((1R,3S,5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-3-гідроксифеніл)-5-фторпіколінамід
128
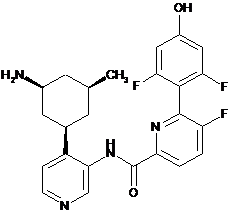
N-(4-((1R,3S,5S)-3-aміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифтор-4-гідроксифеніл)-5-фторпіколінамід
129

N-(4-((1R,3S,5S)-3-aміно-5-метилциклогексил)піридин-3-іл)-5-фтор-6-(2,3,6-трифторфеніл)піколінамід
130
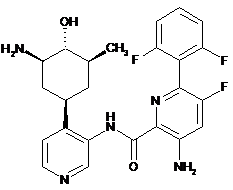
3-аміно-N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
131
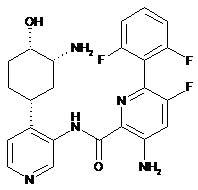
3-аміно-N-(4-(3-аміно-4-гідроксициклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
132
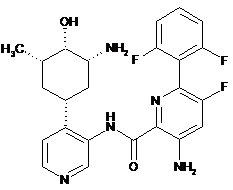
3-аміно-N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
133
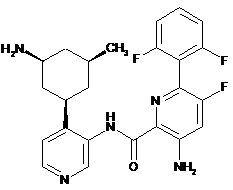
3-аміно-N-(4-(3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
134
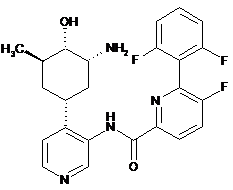
N-(4-(-3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
135
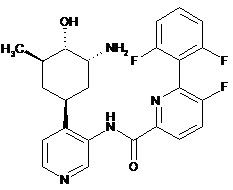
N-(4-(3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід
або її фармацевтично прийнятна сіль.
14. Сполука формули II
 II
II
або її стереоізомер, таутомер або фармацевтично прийнятна сіль,
у якій
Y являє собою піперидиніл, заміщений метилом, гідроксигрупою і аміногрупою;
R1 вибраний з групи, що включає водень, NH2 і фтор;
R12 у кожному випадку незалежно вибраний з групи, що включає водень і галоген; та
R5 вибраний з групи, що включає піридил, фторпіридил, циклогексил і феніл, де зазначений феніл містить до 3 замісників, вибраних з групи, що включає фтор, гідроксигрупу та метил.
15. Сполука за п. 14, у якій Y являє собою 3-аміно-4-гідрокси-5-метилпіперидин-1-іл.
16. Сполука за п. 14 або 15, у якій R1 являє собою водень.
17. Сполука за п. 16, у якій R5 являє собою дифторфеніл.
18. Сполука за п. 14 або п. 15, у якій R5 являє собою 2,6-дифторфеніл.
19. Сполука за п. 14, вибрана з групи, що включає
N-(4-((3R,4R,5S)-3-aмiнo-4-гiдpoкcи-5-мeтилпіпepидин-1-iл)пipидин-3-iл)-6-(2,6-дифторфеніл)-5-фторпіколінамід,
3-aмiнo-N-(4-((3R,4R,5S)-3-aмiнo-4-гiдpoкcи-5-мeтилпiпepидин-1-iл)пipидин-3-iл)-6-(2,6-дифторфеніл)-5-фторпіколінамід і
N-(4-((3R,4R,5S)-3-aмінo-4-гiдpoкcи-5-мeтилпiпepидин-1-iл)пipидин-3-iл)-6-(2,6-дифтop-3-метилфеніл)-5-фторпіколінамід.
20. Сполука за будь-яким з пп. 14-19, призначена для застосування для лікування патологічного стану шляхом модуляції активності провірусної інтеграції кінази Мелоні (кінази РІМ).
21. Сполука за п. 20, де патологічним станом є рак, вибраний з групи, що включає карциному легенів, підшлункової залози, щитовидної залози, яєчників, сечового міхура, молочної залози, передміхурової залози або товстої кишки, меланому, мієлолейкоз, множинну мієлому та еритролейкоз, ворсинчасту аденому товстої кишки і остеосаркому.
22. Сполука за п. 14, вибрана з групи, що включає:
 ,
,
 ,
,
 ,
,
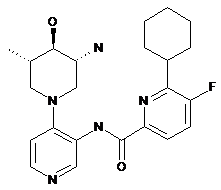 ,
,
 ,
,
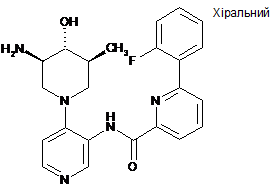 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
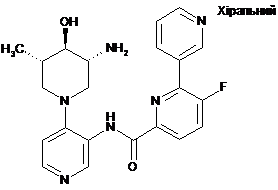 ,
,
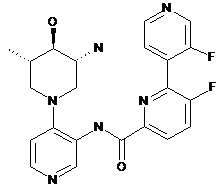
та 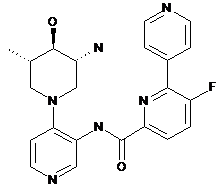 ,
,
або її фармацевтично прийнятна сіль.
23. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 14-22 та фармацевтично прийнятний носій або наповнювач.
Текст
Реферат: У заявці описані нові сполуки, композиції та способи інгібування активності провірусної інтеграції кінази Мелоні (кінази РІМ), пов'язані з онкогенезом у людини або тварини. У деяких варіантах здійснення сполуки і композиції ефективні для інгібування активності щонайменше однієї кінази РІМ. Нові сполуки і композиції можна використовувати окремо або у комбінації щонайменше з одним додатковим засобом, призначеним для лікування порушення, опосередковуваного серин/треонінкіназою або рецепторною тирозинкіназою, такого як рак. UA 103034 C2 (12) UA 103034 C2 R5 R 12 Y H N N R 12 O N R1 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки За цією заявкою відповідно до 35 U.S.C. §119(e) заявляється пріоритет за попередньою заявкою U.S. № 61/093666, поданою 02 вересня 2008 р., і за попередньою заявкою U.S. № 61/225660, поданою 15 липня 2009, які у всій своїй повноті включені в даний винахід як посилання. Галузь техніки, до якої відноситься винахід Даний винахід відноситься до нових сполук, їх таутомерів і стереоізомерів і їх фармацевтично прийнятних солей, складним ефірам, метаболітам або пролікам, композиціям нових сполук разом з фармацевтично прийнятними носіями й до застосування нових сполук окремо або у комбінації щонайменше з одним додатковим терапевтичним засобом для профілактики або лікування раку. Рівень техніки Інфікування ретровірусом Мелоні та інтеграція генома в геном клітини-хазяїна приводить до розвитку лімфом у мишей. Провірусна інтеграція кінази Мелоні (кінази PIM) ідентифікована, як один із частих протоонкогенів, здатний транскрипційно активуватися цим явищем ретровірусної інтеграції (Cuypers HT et al., "Murine leukemia virus-induced T-cell lymphomagenesis: integration of proviruses in distinct chromosomal region, " Cell 37(1):141-50 (1984); Selten G, et al., "Proviral activation of the putative oncogene Pim-1 in Mulv induced T-cell lymphomas" EMBO J 4(7):1793-8 (1985)), і тим самим встановлена кореляція між надекспресуванням цієї кінази та її онкогенним потенціалом. Аналіз гомології послідовностей показав, що існують 3 сильно гомологічні кінази Pim (Pim1, 2 і 3), Pim1 є протоонкогеном, вперше ідентифікованим за допомогою ретровірусної інтеграції. Крім того, у трансгенних мишей, що надекспресують Pim1 або Pim2, виявляється підвищена частота T-клітинних лімфом (Breuer M et al., "Very high frequency of lymphoma induction by chemical carcinogen in pim-1 transgenic mice" Nature 340(6228):61-3 (1989)), а надекспресування у комбінації з c-myc зв'язують з частотою B-клітинних лімфом (Verbeek S et al., "Mice bearing the E mu-myc і E mu-pim-1 transgenes develop pre-b-cell leukemia prenatally" Mol Cell Biol 11(2):1176-9 (1991)). Таким чином, ці моделі на тваринах приводять до сильної кореляції між надекспресуванням Pim і онкогенезом при гематопоетичних злоякісних новотворах. На додаток до даних для цих моделей на тваринах надекспресування Pim виявлено для багатьох інших новотворів людини. Надекспресування Pim1, 2 і 3 часто спостерігається для багатьох гематопоетичних злоякісних новотворів (Amson R et al., "The human protooncogene product p33pim is expressed during fetal hematopoiesis і in diverse leukemias, " PNAS USA 86(22):8857-61 (1989); Cohen AM et al., "Increased expression of the hpim-2 gene in human chronic lymphocytic leukemia і non-hodgkin lymphoma, " Leuk Lymph 45(5):951-5 (2004), Huttmann A et al., "Gene expression signatures separate B-cell chronic lymphocytic leukaemia prognostic subgroups defined by ZAP-70 і CD38 expression status, " Leukemia 20:1774-1782 (2006)) і при раку передміхурової залози (Dhanasekaran SM, et al., "Delineation of prognostic biomarkers in prostate cancer, " Nature 412(6849):822-6 (2001); Cibull TL, et al., "Overexpression of Pim-1 during progression of prostatic adenocarcinoma, " J Clin Pathol 59(3):285-8 (2006)), а надекспресування Pim3 часто спостерігається при гепатоцелюлярній карциномі (Fujii C, et al., "Aberrant expression of serine/threonine kinase Pim-3 in hepatocellular carcinoma development і its role in the proliferation of human hepatoma cell lines, " Int J Cancer 114:209-218 (2005)) і раці підшлункової залози (Li YY et al., "Pim-3, proto-oncogene with serine/threonine kinase activity, is aberrantly expressed in human pancreatic cancer і phosphorylates bad to block bad-mediated apoptosis in human pancreatic cancer cell lines, " Cancer Res 66(13):6741-7 (2006)). Pim1, 2 і 3 є серин/треонінкіназами, що нормально функціонують при життєдіяльності і проліферації гематопоетичних клітин у відповідь на фактори росту і цитокіни. Сигнали цитокінів по шляху Jak/Stat приводять до активації транскрипції генів Pim і синтезу білків. Для забезпечення активності кінази Pim не потрібні додаткові посттрансляційні модифікації. Таким чином, передача сигналів у прямому напрямку в першу чергу контролюється на рівні транскрипції/трансляції і метаболізму білків. Субстрати кіназ Pim включають регулятори апоптозу, такі як Bcl-2, представник сімейства BAD (Aho T et al., "Pim-1 kinase promotes inactivation of the pro-apoptotic Bad protein by phosphorylating it on the Ser112 gatekeeper site, : WFA1/CIP1 FEBS Letters 571: 43-49 (2004)), регулятори клітинного циклу, такі як p21 (Wang Z, et al., "Phosphorylation of the cell cycle inhibitor p21Cip1/WAF1 by Pim-1 kinase, " Biochim Biophys Acta 1593:45-55 (2002)), CDC25A (1999), C-TAK (Bachmann M et al., "The Oncogenic Serine/Threonine Kinase Pim-1 Phosphorylates and Inhibits the Activity of Cdc25C-associated Kinase 1 (C-TAK1). A novel role for Pim-1 at the G2/M cell cycle checkpoint, " J Biol Chem 179:48319-48328 (2004)) і Numa (Bhattacharya N, et al., "Pim-1 associates with protein complexes necessary for mitosis, " Chromosoma 111(2):80-95 (2002)) і регулятор синтезу білка 4EBP1 (Hammerman PS et al., "Pim 1 UA 103034 C2 5 10 15 20 25 30 35 and Akt oncogenes are independent regulators of hematopoietic cell growth and survival, " Blood 105(11):4477-83 (2005)). Вплив кіназ Pim на ці регулятори узгоджується з роллю в захисті від апоптозу і стимулюванні проліферації та росту клітин. Тому передбачається, що надекспресування кіназ Pim при раці відіграє роль при стимулюванні виживаності та проліферації ракових клітин і тому їх інгібування повинно являти собою ефективний шлях лікування ракових захворювань, при яких вони надекспресуються. У дійсності, у декількох публікаціях відзначають, що порушення експресування кіназ Pim за допомогою siРНК приводить до інгібування проліферації і загибелі клітин (Dai JM, et al., "Antisense oligodeoxynucleotides targeting the serine/threonine kinase Pim-2 inhibited proliferation of DU-145 cells, " Acta Pharmacol Sin 26(3):364-8 (2005); Fujii et al. 2005; Li et al. 2006). Крім того, вважають, що мутаційна активація деяких добре відомих онкогенів при гематопоетичних злоякісних новотворах щонайменше частково виявляє свої впливи за допомогою кіназ Pim. Наприклад, спрямована понижувальна регуляція експресування Pim порушує життєдіяльність гематопоетичних клітин, трансформованих за допомогою Flt3 і BCR/ABL (Adam et al. 2006). Таким чином, інгібітори Pim1, 2 і 3 повинні бути застосовані для лікування цих злоякісних новотворів. На додаток до потенційної застосованості для лікування раку і мієлопроліферативних захворювань, такий інгібітор повинен бути корисний для регулювання поширення імунних клітин при інших патологічних станах, таких як аутоімунні захворювання, алергійні реакції та синдроми при відторгненні трансплантатів органів. На користь такого висновку свідчать дані про те, що диференціація Th1 хелперних T-клітин за допомогою IL-12 і IFN-α приводить до індукції експресування обох Pim1 і 2 (Aho T et al., "Expression of human Pim family genes is selectively upregulated by cytokines promoting T helper type 1, but not T helper type 2, cell differentiation, " Immunology 116: 82-88 (2005)). Крім того, експресування кіназ Pim придушується в обох типах клітин імуносупресорними TGF- ((Aho et al. 2005). Ці результати показують, що кінази Pim беруть участь у ранньому процесі диференціації хелперних T-клітин, що координує імунні відповіді при аутоімунних захворюваннях, алергійних реакціях і відторгненні трансплантатів тканин. Зберігається необхідність у сполукух, які придушують проліферацію капілярів, придушують ріст пухлин, лікують рак, модулюють зупинку клітинного циклу і/або інгібують такі молекули, як Pim1, Pim2, Pim3, і у фармацевтичних препаратах і лікарських засобах, які містять такі сполуку. Також необхідні способи введення таких сполук, фармацевтичних препаратів і лікарських засобів пацієнтам або суб'єктам, які їх потребують. Короткий виклад сутності винаходу Даний винахід відноситься до нових сполук формули I і до їх стереоізомерів, таутомерів і фармацевтично прийнятних солей R5 Y H N Z2 N I Z3 X4 X3 X1 O R1 X2 40 45 50 у якій, X1, X2, X3 і X4 незалежно вибрані із групи, що включає CR2 і N; за умови, що щонайменше один, але не більше двох з X1, X2, X3 і X4 позначають N; Y вибраний із групи, що включає циклоалкіл, частково ненасичений циклоалкіл і гетероциклоалкіл, де кожний представник зазначеної групи може містити до 4 замісників; Z2 і Z3 незалежно вибрані із групи, що включає CR12 і N; за умови, що не більше, ніж один з Z2 і Z3 може позначати N; R1 вибраний із групи, що включає водень, NHR3, галоген, гідроксигрупу, алкіл, ціаногрупу та нітрогрупу; R2 і R12 у кожному випадку незалежно вибрані із групи, що включає водень, галоген, гідроксигрупу, нітрогрупу, ціаногрупу, SO 3H і заміщений або незаміщений алкіл, алкеніл, алкініл, алкоксигрупу, аміногрупу, циклоалкіл, гетероциклоалкіл і частково насичений циклоалкіл; R3 вибраний із групи, що включає водень, COR 4 і заміщений або незаміщений алкіл, 2 UA 103034 C2 5 10 15 20 циклоалкіл, гетероцикліл, арил і гетероарил; R4 вибраний із групи, що включає алкіл, заміщений алкіл, алкоксигрупу, заміщену алкоксигрупу, аміногрупу, заміщену аміногрупу і алкіламіногрупу; і R5 позначає групу, обрану із групи, що включає заміщений або незаміщений арил, C 3-C7циклоалкіл, гетероарил, частково ненасичений циклоалкіл і алкіл, у якій кожна зазначена заміщена група R5 може містити до 4 замісників, обраних із групи, що включає галоген, ціаногрупу, аміногрупу, C1-C4-алкіл, C3-C6-циклоалкіл, алкоксигрупу, нітрогрупу, карбоксигрупу, карбоніл, карбалкоксигрупу, амінокарбоксигрупу, заміщений амінокарбоніл, аміносульфоніл, заміщений аміносульфоніл і алкоксиалкіл. Деякі варіанти здійснення відносяться до нових сполук формули I або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій X 2 позначає N і X1, X3 і X4 позначають CR2. Деякі варіанти здійснення відносяться до нових сполук формули I або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R 2 вибраний із групи, що включає водень, метил, етил, галоген, ціаногрупу. Деякі варіанти здійснення відносяться до сполук формули I або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Z2 і Z3 позначають CR12. Деякі варіанти здійснення відносяться до сполук формули I або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R12 вибраний із групи, що включає водень, галоген, метил, етил і ціаногрупу. Інші варіанти здійснення відносяться до нових сполук і їх стереоізомерів, таутомерів і фармацевтично прийнятних солей формули II R5 R 12 Y H N II N R 12 O R1 N 25 30 35 40 45 50 у якій, Y вибраний із групи, що включає циклогексил, частково ненасичений циклогексил і гетероцикло-C5-алкіл, де кожний представник зазначеної групи може містити до 4 замісників; R1 вибраний із групи, що включає водень, NHR3, галоген, гідроксигрупу, алкіл, C 3-C4циклоалкіл, ціаногрупу і нітрогрупу; R12 у кожному випадку незалежно вибраний із групи, що включає водень, галоген, гідроксигрупу, аміногрупу, нітрогрупу, ціаногрупу, SO 3H і заміщений або незаміщений алкіл, алкеніл, алкініл, алкоксигрупу, аміногрупу, циклоалкіл, гетероциклоалкіл і частково насичений циклоалкіл; R3 вибраний із групи, що включає водень, COR 4 і заміщений або незаміщений алкіл, циклоалкіл, гетероцикліл, арил і гетероарил; R4 вибраний із групи, що включає алкіл, заміщений алкіл, алкоксигрупу, заміщену алкоксигрупу, аміногрупу, заміщену аміногрупу і алкіламіногрупу; і R5 позначає групу, обрану із групи, що включає водень і заміщений або незаміщений алкіл, C6-циклоалкіл, арил і гетероарил, у якій кожна зазначена заміщена група R 5 може містити до 4 замісників, обраних із групи, що включає галоген, ціаногрупу, аміногрупу, C 1-C4-алкіл, C3-C6циклоалкіл, алкоксигрупу, нітрогрупу, карбоксигрупу, карбоніл, карбалкоксигрупу, амінокарбоксигрупу, заміщений амінокарбоніл, аміносульфоніл, заміщений аміносульфоніл і алкоксиалкіл. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y вибраний із групи, що включає заміщений або незаміщений циклоалкіл, циклоалкеніл, піперидиніл і піперазиніл, де кожний представник зазначеної групи містить до 4 замісників. У деяких варіантах здійснення Y містить до 4 замісників, обраних із групи, що включає, ціаногрупу, нітрогрупу, галоген, гідроксигрупу, аміногрупу, алкоксигрупу, заміщену аміногрупу, C1-C4-алкіл, C1-C4-галогеналкіл і C3-C4циклоалкіл. В інших варіантах здійснення Y містить до 4 замісників, обраних із групи, що 3 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 включає метил, пропіл, ізопропіл, етил, гідроксигрупу, аміногрупу, галоген, моногалоген-C1-C3алкіл, тригалоген-C1-C3-алкіл і дигалоген-C1-C3-алкіл. Деякі варіанти здійснення відносяться до нових сполук формули II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y вибраний із групи, що включає заміщений або незаміщений циклогексил, циклогексиніл, і піперидиніл, де кожний представник зазначеної групи містить до 4 замісників. Деякі варіанти здійснення відносяться до нових сполук формули II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y містить до 4 замісників, незалежно обраних із групи, що включає водень, ціаногрупу, нітрогрупу, галоген, гідроксигрупу, аміногрупу, алкоксигрупу, заміщену аміногрупу, C1-C4-алкіл, C1-C4-галогеналкіл і C3-C4-циклоалкіл. У деяких варіантах здійснення замісники незалежно вибрані із групи, що включає метил, пропіл, ізопропіл, етил, гідроксигрупу, аміногрупу, галоген, моногалоген-C1-C3-алкіл, тригалоген-C1-C3алкіл і дигалоген-C1-C3-алкіл. Деякі варіанти здійснення відносяться до сполук формули II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R12 вибраний із групи, що включає водень, галоген, метил, етил і ціаногрупу. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y вибраний із групи, що включає заміщений або незаміщений циклогексил, циклогексеніл, піперидиніл, піперазиніл, у якій зазначена група Y може містити до 3 замісників, обраних із групи, що включає метил, етил, гідроксигрупу, аміногрупу і метоксигрупу; R1 вибраний із групи, що включає водень, і аміногрупу; і R12 незалежно в кожному випадку позначає водень, галоген, або метил. Деякі варіанти здійснення відносяться до сполук формули II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y вибраний із групи, що включає заміщений циклогексил, циклогексеніл, піперидиніл, і піперазиніл; R1 вибраний із групи, що включає водень, –NH2, галоген, C1-C4-алкіл, C3-C4-циклоалкіл і CN; R12 у кожному випадку незалежно вибраний із групи, що включає водень, галоген, C 1-C4-алкіл і аміногрупу; і R5 вибраний із групи, що включає заміщений або незаміщений феніл, циклогексил, циклопентил, тіазол, піридил, піримідил і піразиніл, у якій група R 5 може містити до 3 замісників, обраних із групи, що включає галоген, водень, метил, заміщений амінокарбоніл і алкоксигрупу. У типовому варіанті здійснення сполуку формул I або II або їх стереоізомер, таутомер або фармацевтично прийнятна сіль вибрані із групи, що включає N-(4-((1R, 3R, 4R, 5S)-3-аміно-4гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід, N-(4-((1R, 3S, 5S)-3-аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід. N-(4((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифторфеніл)-5фторпіколінамід, 3-аміно-N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід, і N-(4-((1R, 3S)-3-аміноциклогексил)піридин-3-іл)-6(2,6-дифторфеніл)-5-фторпіколінамід, і 3-аміно-N-(4-((1R, 3S)-3-аміноциклогексил)піридин-3-іл)6-(2,6-дифторфеніл)-5-фторпіколінамід. В інших об'єктах даний винахід відноситься до способів лікування порушень, пов'язаних із провірусною інтеграцією кінази Мелоні (кінази PIM), у людини або тварини, що потребує такого лікування, що включають введення зазначеному суб'єкту сполуки формули I або II у кількості, ефективній для інгібування активності PIM у суб'єкта. В інших об'єктах даний винахід відноситься до способів лікування порушень, пов'язаних з PIM, у людини або тварини, що потребує такого лікування, що включають введення зазначеному суб'єкту сполуки формули I або II у кількості, ефективній для зменшення або попередження росту пухлини в суб'єкта. В інших об'єктах даний винахід відноситься до способів лікування порушень, пов'язаних з PIM, у людини або тварини, що потребує такого лікування, що включають введення зазначеному суб'єкту сполуки формули I або II у кількості, ефективній для зменшення або попередження росту пухлини в суб'єкта, у комбінації щонайменше з одним додатковим засобом, призначеним для лікування раку. В інших об'єктах даний винахід відноситься до терапевтичної композиції, що містить щонайменше одне сполуку формули I або II у комбінації з одним або більшою кількістю додаткових засобів, призначених для лікування раку, які звичайно використовуються для лікування раку. Сполуки, запропоновані в цьому винаході, можна застосовувати для лікування раку, включаючи гематопоетичні злоякісні новотвори, карциноми (наприклад, легенів, печінки, підшлункової залози, яєчників, щитовидної залози, сечового міхура або товстої кишки), меланоми, мієлоїдні порушення (наприклад, мієлолейкозу, множинної мієломи та 4 UA 103034 C2 5 10 15 еритролейкозу), аденоми (наприклад, ворсинчастої аденоми товстої кишки), саркоми (наприклад, остеосаркоми), аутоімунних захворювань, алергійних реакцій і синдромів відторгнення трансплантатів органів. Даний винахід також відноситься до композицій, способів застосування і способів одержання, описаних у докладному описі винаходу. Опис креслень Зазначені вище об'єкти і багато інших переваг цього винаходу буде легше оцінити, коли вони будуть краще зрозумілі з наведеного нижче докладного опису разом з прикладеними кресленнями, на яких представлено наступне: На фіг. 1 представлена залежність для ефективності сполуки прикладу 99 за даними моделі ксеротрансплантата KMS11-luc, описаної в прикладі 144. На фіг. 2 представлена залежність для ефективності сполуки прикладу 70 за даними моделі ксеротрансплантата KMS11-luc, описаної в прикладі 144. На фіг. 3 представлена залежність для ефективності сполуки прикладу 96 за даними моделі ксеротрансплантата KMS11-luc, описаної в прикладі 144. Докладний опис винаходу Іншим об'єктом цього винаходу є нові сполуку та їх стереоізомери, таутомери і фармацевтично прийнятні солі формули I: R5 Z2 Y H N I N X4 Z3 X3 X1 O R1 X2 20 25 30 35 40 45 50 у якій, X1, X2, X3 і X4 незалежно вибрані із групи, що включає CR2 і N; за умови, що щонайменше один, але не більше двох з X1, X2, X3 і X4 позначають N; Y вибраний із групи, що включає циклоалкіл, частково ненасичений циклоалкіл і гетероциклоалкіл, де кожний представник зазначеної групи може містити до 4 замісників; Z2 і Z3 незалежно вибрані із групи, що включає CR12 і N; за умови, що не більше, ніж один з Z2 і Z3 може позначати N; R1 вибраний із групи, що включає водень, NHR3, галоген, гідроксигрупу, алкіл, ціаногрупу та нітрогрупу; R2 і R12 у кожному випадку незалежно вибрані із групи, що включає водень, галоген, гідроксигрупу, нітрогрупу, ціаногрупу, SO3H і заміщений або незаміщений алкіл, алкеніл, алкініл, алкоксигрупу, аміногрупу, циклоалкіл, гетероциклоалкіл і частково насичений циклоалкіл; R3 вибраний із групи, що включає водень, COR 4 і заміщений або незаміщений алкіл, циклоалкіл, гетероцикліл, арил і гетероарил; R4 вибраний із групи, що включає алкіл, заміщений алкіл, алкоксигрупу, заміщену алкоксигрупу, аміногрупу, заміщену аміногрупу та алкіламіногрупу; і R5 позначає групу, обрану із групи, що включає заміщений або незаміщений арил, C 3-C7циклоалкіл, гетероарил, частково ненасичений циклоалкіл і алкіл, у якій кожна зазначена заміщена група R5 може містити до 4 замісників, обраних із групи, що включає галоген, ціаногрупу, аміногрупу, C1-C4-алкіл, C3-C6-циклоалкіл, алкоксигрупу, нітрогрупу, карбоксигрупу, карбоніл, карбалкоксигрупу, амінокарбоксигрупу, заміщений амінокарбоніл, аміносульфоніл, заміщений аміносульфоніл і алкоксиалкіл. Деякі варіанти здійснення відносяться до нових сполук формули I або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій X2 позначає N і X1, X3 і X4 позначають CR2. Деякі варіанти здійснення відносяться до нових сполук формули I або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R 2 вибраний із групи, що включає водень, метил, етил, галоген, ціаногрупу. Деякі варіанти здійснення відносяться до сполук формули I або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Z2 і Z3 позначають CR12. 5 UA 103034 C2 5 Деякі варіанти здійснення відносяться до сполук формули I або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R12 вибраний із групи, що включає водень, галоген, метил, етил і ціаногрупу. Інші варіанти здійснення відносяться до нових сполук та їх стереоізомерів, таутомерів і фармацевтично прийнятних солей формули II R5 R12 Y N H II N R12 O R1 N 10 15 20 25 30 35 40 45 50 у якій, Y вибраний із групи, що включає циклогексил, частково ненасичений циклогексил і гетероцикло-C5-алкіл, де кожний представник зазначеної групи може містити до 4 замісників; R1 вибраний із групи, що включає водень, NHR3, галоген, гідроксигрупу, алкіл, C3-C4циклоалкіл, ціаногрупу та нітрогрупу; R12 у кожному випадку незалежно вибраний із групи, що включає водень, галоген, гідроксигрупу, аміногрупу, нітрогрупу, ціаногрупу, SO 3H і заміщений або незаміщений алкіл, алкеніл, алкініл, алкоксигрупу, аміногрупу, циклоалкіл, гетероциклоалкіл і частково насичений циклоалкіл; R3 вибраний із групи, що включає водень, COR 4 і заміщений або незаміщений алкіл, циклоалкіл, гетероцикліл, арил і гетероарил; R4 вибраний із групи, що включає алкіл, заміщений алкіл, алкоксигрупу, заміщену алкоксигрупу, аміногрупу, заміщену аміногрупу і алкіламіногрупу; і R5 позначає групу, обрану із групи, що включає водень і заміщений або незаміщений алкіл, C6-циклоалкіл, арил і гетероарил. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y вибраний із групи, що включає заміщений або незаміщений циклоалкіл, циклоалкеніл, піперидиніл і піперазиніл, де кожний представник зазначеної групи містить до 4 замісників. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y вибраний із групи, що включає заміщений або незаміщений циклогексил, циклогексиніл, і піперидиніл, де кожний представник зазначеної групи містить до 4 замісників. У деяких варіантах здійснення Y містить до 4 замісників, обраних із групи, що включає водень, ціаногрупу, нітрогрупу, галоген, гідроксигрупу, аміногрупу, алкоксигрупу, заміщену аміногрупу, C1-C4-алкіл, C1-C4-галогеналкіл і C3-C4-циклоалкіл. В інших варіантах здійснення Y містить до 4 замісників, обраних із групи, що включає метил, пропіл, ізопропіл, етил, гідроксигрупу, аміногрупу, галоген, моногалоген-C1-C3-алкіл, тригалоген-C1-C3-алкіл і дигалоген-C1-C3-алкіл. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R1 позначає водень, аміногрупу або фтор. Один варіант здійснення відноситься до сполук формули II, обраних з таблиці I або таблиці II. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R 5 вибраний із групи, що включає заміщений або незаміщений арил, C5-C6-циклоалкіл, гетероарил, частково ненасичений C5-C6циклоалкіл і C1-C4 алкіл, де кожна зазначена група може містити до 4 замісників, обраних із групи, що включає галоген, ціаногрупу, аміногрупу, C 1-C4-алкіл, C3-C5-циклоалкіл, алкоксигрупу, нітрогрупу, карбоксигрупу, карбоніл, карбалкоксигрупу, амінокарбоксигрупу, заміщений амінокарбоніл, аміносульфоніл, заміщений аміносульфоніл і алкоксиалкіл. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R5 позначає заміщений або незаміщений феніл, де фенільна група може містити до 4 замісників, обраних із групи, що включає водень, ціаногрупу, нітрогрупу, галоген, гідроксигрупу, аміногрупу, алкоксигрупу, заміщену аміногрупу, C 1-C4-алкіл, C1-C4-галогеналкіл і C3-C4-циклоалкіл. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R 5 позначає 6 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 2,6-дифторфеніл. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій R12 вибраний із групи, що включає водень, галоген, метил, етил і ціаногрупу. Деякі варіанти здійснення відносяться до сполук формул I або II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y вибраний із групи, що включає заміщений або незаміщений циклогексил, циклогексеніл, піперидиніл, піперазиніл, у якій зазначена група Y може містити до 3 замісників, обраних із групи, що включає метил, етил, гідроксигрупу, аміногрупу і метоксигрупу; R1 вибраний із групи, що включає водень, і аміногрупу; і R12 незалежно в кожному випадку позначає водень, галоген, або метил. Деякі варіанти здійснення відносяться до сполук формули II або їх стереоізомеру, таутомеру або фармацевтично прийнятної солі, у якій Y вибраний із групи, що включає заміщений циклогексил, циклогексеніл, піперидиніл, і піперазиніл; R1 вибраний із групи, що включає водень, –NH2, галоген, C1 C1-C4-алкіл, C3-C4-циклоалкіл і CN; R12 у кожному випадку незалежно вибраний із групи, що включає водень, галоген, C 1-C4-алкіл і аміногрупу; і R5 вибраний із групи, що включає заміщений або незаміщений феніл, циклогексил, циклопентил, тіазол, піридил, піримідил і піразиніл, у якій група R 5 може містити до 3 замісників, обраних із групи, що включає галоген, водень, метил, заміщений амінокарбоніл і алкоксигрупу. Кращим варіантом здійснення цього винаходу є сполука формули (II), у якій Y позначає циклогексил, що містить до 3 замісників, зазначені замісники краще вибрані із групи, що включає гідроксигрупу, аміногрупу, C1-C4-алкіл або C1-C4-галогеналкіл і ще краще вибрані із групи, що включає метил, гідроксигрупу, аміногрупу і CF 3, і найкраще із групи, що включає метил, аміногрупу і гідроксигрупу; R 1 позначає водень, NH2 або галоген (краще, R1 позначає водень, аміногрупу або фтор, ще краще R1 позначає водень); R12 усі незалежно позначають водень або галоген (краще, якщо кожний R12 позначає водень, хлор або фтор); R5 позначає циклогексил, феніл, або піридил, де зазначений циклогексил, зазначений феніл і зазначений піридил усі незалежно містять до 3 замісників, обраних із групи, що включає галоген, гідроксигрупу, C1-C4-алкіл і C1-C4-алкоксигрупу (краще, якщо R5 позначає піридил або феніл, кожний з яких незалежно містить до 3 замісників, обраних із групи, що включає галоген, гідроксигрупу, C1-C4-алкіл або C1-C4-алкоксигрупу, ще краще, якщо R5 позначає феніл, що містить до 3 замісників, обраних із групи, що включає галоген, гідроксигрупу, C 1-C4-алкоксигрупу і C1-C4-алкіл, найкраще феніл, що містить до 3 замісників, обраних із групи, що включає фтор, гідроксигрупу, метил, етил, метоксигрупу, або пропоксигрупу, найкраще, якщо R 5 позначає 2,6дифторфеніл. В іншому кращому варіанті здійснення даний винахід відноситься до сполуки формули II, у якій Y позначає піперидиніл, заміщений метилом, гідроксигрупою і аміногрупою; R1 позначає водень, NH2, або фтор; R12 у кожному випадку незалежно вибраний із групи, що включає водень і галоген; і R5 позначає піридил, фтор піридил, циклогексил, або феніл, де зазначений феніл містить до 3 замісників, обраних із групи, що включає фтор, гідроксигрупу і метил, краще, якщо R5 позначає дифторфеніл. В іншому кращому варіанті здійснення Y краще позначає 3-аміно-4гідрокси-5-метилпіперидин-1-іл; R1 позначає водень і R5 позначає 2,6-дифторфеніл. У типовому варіанті здійснення кращі сполуки формул I або II або їх стереоізомер, таутомер або фармацевтично прийнятна сіль вибрані з групи, що включає N-(4-((3S, 5S)-3-аміно-5метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; 3-аміно-N-(4-((1R, 3R, 4S, 5S)-3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)піколінамід; N(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифторфеніл)-5фторпіколінамід; N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3-іл)-6(2,6-дифторфеніл)-5-фторпіколінамід; 3-аміно-N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; N-(4-((3R, 4R, 5S)-3аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифтор-3-метилфеніл)-5фторпіколінамід; 3-аміно-N-(4-((1R, 3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5фторпіколінамід; N-(4-((3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5фторпіколінамід; N-(4-((1R, 3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6(2,6-дифторфеніл)-5-фторпіколінамід; N-(4-((1R, 3S, 5S)-3-аміно-5-метилциклогексил)піридин-3іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід); N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; N-(4-((1R, 3S)-3аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; 3-аміно-N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифторфеніл)-5фторпіколінамід; і 3-аміно-N-(4-((1R, 3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)5-фторпіколінамід. 7 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 В інших об'єктах даний винахід відноситься до способів лікування порушень, пов'язаних з провірусною інтеграцією кінази Мелоні (кінази PIM), у людини або тварини, що потребує такого лікування, що включають введення зазначеному суб'єкту сполуки формули I або II у кількості, ефективній для інгібування активності PIM у суб'єкта. У кращому варіанті здійснення даний винахід відноситься до способу лікування патологічного стану шляхом модуляції активності провірусної інтеграції кінази Мелоні (кінази PIM), що включає введення пацієнтові, що потребує такого лікування, сполуки формули I в ефективній кількості. В інших об'єктах даний винахід відноситься до способів лікування порушень, пов'язаних з PIM, у людини або тварини, що потребує такого лікування, що включають введення зазначеному суб'єкту сполуки формули I або II у кількості, ефективній для зменшення або попередження росту пухлини в суб'єкта. В інших об'єктах даний винахід відноситься до способів лікування порушень, пов'язаних з PIM, у людини або тварини, що потребує такого лікування, що включають введення зазначеному суб'єкту сполуки формули I або II у кількості, ефективній для зменшення або попередження росту пухлини у суб'єкта, у комбінації щонайменше з одним додатковим засобом, призначеним для лікування раку. В іншому об'єкті даний винахід відноситься до терапевтичної композиції, що містить щонайменше одну сполуку формули I або II у комбінації з одним або більшою кількістю додаткових засобів, призначених для лікування раку, які звичайно використовуються для лікування раку. Таким чином, даний винахід відноситься до фармацевтичної композиції, що містить сполуку формули I або формули II. Кращий варіант здійснення цього об'єкта є фармацевтична композиція, що містить сполуку, обрану із групи, що включає N-(4-((3S, 5S)-3аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; 3-аміно-N-(4((1R, 3R, 4S, 5S)-3-аміно-4-гідрокси-5-метилциклогексил)піридин-3-іл)-6-(2,6дифторфеніл)піколінамід; N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; 3-аміно-N-(4-((1R, 3S)-3-аміноциклогексил)піридин-3іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; N-(4-((3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6дифторфеніл)-5-фторпіколінамід; N-(4-((1R, 3R, 4R, 5S)-3-аміно-4-гідрокси-5метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; N-(4-((1R, 3S, 5S)-3аміно-5-метилциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід); N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифторфеніл)-5фторпіколінамід; N-(4-((1R, 3S)-3-аміноциклогексил)піридин-3-іл)-6-(2,6-дифторфеніл)-5фторпіколінамід; 3-аміно-N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; 3-аміно-N-(4-((1R, 3S)-3-аміноциклогексил)піридин-3іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифторфеніл)-5-фторпіколінамід; 3-аміно-N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3-іл)-6-(2,6-дифторфеніл)-5фторпіколінамід; і N-(4-((3R, 4R, 5S)-3-аміно-4-гідрокси-5-метилпіперидин-1-іл)піридин-3-іл)-6(2,6-дифтор-3-метилфеніл)-5-фторпіколінамід. Інший кращий варіант здійснення відноситься до фармацевтичної композиції, що додатково містить додатковий засіб, призначений для лікування раку, причому кращий додатковий засіб вибраний із групи, що включає іринотекан, топотекан, гемцитабін, 5-фторурацил, лейковорин карбоплатин, цисплатин, таксани, тезацитабін, циклофосфамід, алкалоїди барвінку, іматиніб (глівек), антрацикліни, ритуксимаб і трастузумаб. Сполуки, запропоновані в цьому винаході, можна застосовувати для лікування раку, включаючи гематопоетичні злоякісні новотвори, карциноми (наприклад, легенів, печінки, підшлункової залози, яєчників, щитовидної залози, сечового міхура або товстої кишки), меланоми, мієлоїдні порушення (наприклад, мієлолейкозу, множинної мієломи та еритролейкозу), аденоми (наприклад, ворсинчастої аденоми товстої кишки), саркоми (наприклад, остеосаркоми), аутоімунних захворювань, алергійних реакцій і синдромів відторгнення трансплантатів органів. В іншому об'єкті даний винахід відноситься до застосування сполуки формули I або формули II для приготування лікарського засобу, призначеного для лікування патологічного стану шляхом модуляції активності провірусної інтеграції кінази Мелоні (кінази PIM). У кращому варіанті здійснення цього об'єкта цього винаходу патологічним станом є рак, вибраний із групи, що включає карциному легенів, підшлункової залози, щитовидної залози, яєчників, сечового міхура, молочної залози, передміхурової залози або товстої кишки, меланому, мієлолейкоз, множинну мієлому і еритролейкоз, ворсинчату аденому товстої кишки і остеосаркому. В іншому об'єкті даний винахід відноситься до способів інгібування активності щонайменше однієї кінази, обраної із групи, що включає Pim1, Pim2 і Pim3, у суб'єкта або лікування біологічного патологічного стану, опосередковуваного щонайменше однією з Pim1, Pim2 і Pim3, у людини або тварини, що потребує такого лікування, що включають введення суб'єкту 8 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше одної сполуки формули I або II у кількості, ефективній для інгібування кінази у суб'єкта. Терапевтичні сполуки можна застосовувати для лікування пацієнтів, що потребують таких інгібіторів (наприклад, що страждають від раку, опосередковуваного аномальною передачею сигналів рецептора серин/треонінкінази). Визначення "Інгібітор PIM" використовується в цьому винаході для позначення сполуки, яка має значення IC50 для активності кінази PIM, рівне не більше приблизно 100 мкМ, і частіше - не більше приблизно 50 мкМ, отриманим при дослідженнях витрачання при впливі PIM, описаних нижче в цьому винаході. Термін "алкіл" означає алкільні групи, які не містять гетероатоми. Цей термін включає алкільні групи з лінійним ланцюгом, такі як метил, етил, пропіл, бутил, пентил, гексил, гептил, октил, ноніл, децил, ундецил, додецил і т.п. Термін також включає ізомери, що мають розгалужений ланцюг, алкільні групи з лінійним ланцюгом, включаючи, але не обмежуючись тільки ними, наступні, які наведені як приклад: –CH(CH3)2, CH(CH3)(CH2CH3), CH(CH2CH3)2, C(CH3)3, C(CH2CH3)3, CH2CH(CH3)2, CH2CH(CH3)(CH2CH3), CH2CH(CH2CH3)2, CH2C(CH3)3, CH2C(CH2CH3)3, CH(CH3)CH(CH3)(CH2CH3), CH2CH2CH(CH3)2, CH2CH2CH(CH3)(CH2CH3), CH2CH2CH(CH2CH3)2, CH2CH2C(CH3)3, CH2CH2C(CH2CH3)3, CH(CH3)CH2CH(CH3)2, CH(CH3)CH(CH3)CH(CH3)2, CH(CH2CH3)CH(CH3)CH(CH3)(CH2CH3) і ін. Таким чином, вираз алкільні групи включає первинні алкільні групи, вторинні алкільні групи і третинні алкільні групи. Кращі алкільні групи включають алкільні групи, які мають лінійний і розгалужений ланцюг, що містять від 1 до 12 атомів вуглецю. Краще визначення "алкілу" відноситься до C1-C4-алкільних груп, що мають лінійний ланцюг, таких як метил, етил, н-пропіл і н-бутил. Краще визначення "алкілу" також включає розгалужені C3-C5-алкільні групи, включаючи CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, C(CH3)3, CH(CH3)CH2CH2CH3, CH(CH3)CH(CH3)2, CH2CH(CH3)CH2CH3, CH2CH2CH(CH3)2, і CH(CH2CH3)2 і т.п. Термін "алкеніл" означає алкільні групи, визначені вище, у яких міститься щонайменше один ненасичений фрагмент, тобто в якому два сусідні атоми вуглецю зв'язані подвійним зв'язком. Термін "алкініл" означає алкільні групи, у яких два сусідні атоми вуглецю зв'язані потрійним зв'язком. Термін "алкоксигрупа" означає OR, де R позначає алкіл. При використанні в цьому винаході термін "галоген" означає хлоридну, бромідну, фторидну і йодидну групи. "Галогеналкіл" означає алкільний радикал, заміщений одним або більшою кількістю атомів галогенів. Таким чином, термін "галогеналкіл" включає моногалогеналкіл, дигалогеналкіл, тригалогеналкіл і т.п. Типові моногалогеналкільні групи включають -CH2F, CH2Cl, -CH2CH2F, -CH2CH2Cl, -CH(F)CH3, -CH(Cl)CH3; типові дигалогеналкільні групи включають CHCl2, -CHF2, -CCl2CH3, -CH(Cl)CH2Cl, -CH2CHCl2, -CH2CHF2; типові тригалогеналкільні групи включають -CCl3, -CF3, -CCl2CH2Cl, -CF2CH2F, CH(Cl)CHCl2, -CH(F)CHF2 і типові пергалогеналкільні групи включають -CCl3, -CF3, -CCl2CCl3, -CF2CF3. "Аміногрупа" у цьому винаході означає групу –NH2, яка може бути заміщена з утворенням – NRR'. Термін "алкіламіногрупа" у цьому винаході означає групу –NRR', у якій R і R' усі незалежно вибрані із групи, що включає водень і нижч. алкіл. Термін "ариламіногрупа" у цьому винаході означає групу –NRR', у якій R позначає арил і R' позначає водень, нижч. алкіл або арил. Термін "арилалкіламіногрупа" у цьому винаході означає групу –NRR', у якій R позначає нижч. арилалкіл і R' позначає водень, нижч. алкіл, арил або нижч. арилалкіл. Термін ціаногрупа означає групу –CN. Термін нітрогрупа означає групу –NO2. Термін "алкоксиалкіл" означає групу –alk1-O-alk2, у якій alk1 позначає алкіл або алкеніл і alk 2 позначає алкіл або алкеніл. Термін "нижч. алкоксиалкіл" означає алкоксиалкіл, де alk 1 позначає нижч. алкіл або нижч. алкеніл і alk 2 позначає нижч. алкіл або нижч. алкеніл. Термін "арилоксиалкіл" означає групу – алкіл-o-арил. Термін "арилалкоксиалкіл" означає групу алкіленіл-o-арилалкіл, у якій арилалкіл означає нижч. арилалкіл. Термін "амінокарбоніл" у цьому винаході означає групу –C(O)-NH2. "Заміщений амінокарбоніл" у цьому винаході означає групу C(O)-NRR', у якій R позначає нижч. алкіл і R' позначає водень або нижч. алкіл. У деяких варіантах здійснення R і R' разом із приєднаним до них атомом N можуть утворювати "гетероциклоалкілкарбонільну" групу. Термін "ариламінокарбоніл" у цьому винаході означає групу C(O)-NRR', у якій R позначає арил і R' позначає водень, нижч. алкіл або арил. "арилалкіламінокарбоніл" у цьому винаході означає групу –C(O)-NRR', у якій R позначає нижч. арилалкіл і R' позначає водень, нижч. алкіл, арил, або нижч. арилалкіл. "Аміносульфоніл" у цьому винаході означає групу –S(O)2-NH2. "Заміщений аміносульфоніл" у цьому винаході означає групу S(O)2-NRR, у якій R позначає нижч. алкіл і R' позначає водень або нижч. алкіл. Термін "арилалкіламіносульфоніларил" у цьому винаході означає групу –арил 9 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 S(O)2–NH-арилалкіл, у якій арилалкіл являє собою нижч. арилалкіл. "Карбоніл" означає двовалентну групу –C(O). "Карбоксигрупа" означає-C(=O)-OH. "Алкоксикарбоніл" означає складний ефір –C(=O)-OR, у якому R позначає алкіл. "Нижч. алкоксикарбоніл" означає складний ефір –C(=O)-OR, у якому R позначає нижч. алкіл. "Циклоалкоксикарбоніл" означає –C(=O)-OR, у якому R позначає циклоалкіл. "Циклоалкіл" означає моно- або поліциклічний, гетероциклічний або карбоциклічний алкільний замісник. Карбоциклоалкільні групи є циклоалкільними групами, у яких усі кільцеві атоми є атомами вуглецю. Типові циклоалкільні замісники містять від 3 до 8 атомів, що входять у головний ланцюг (тобто в кільце), у яких кожний атом головного ланцюга є атомом вуглецю або гетероатомом. Термін "гетероциклоалкіл" у цьому винаході означає циклоалкільні замісники, які містять у кільцевій структурі від 1 до 5 і частіше - від 1 до 4 гетероатомов. Придатними гетероатомами, що використовуються в сполуках, запропонованих у цьому винаході, є азот, кисень і сірка. Типові гетероциклоалкільні фрагменти включають, наприклад, морфолінову групу, піперазиніл, піперидиніл і т.п. Карбоциклоалкільні групи являють собою циклоалкільні групи, у яких усі кільцеві атоми є атомами вуглецю. При використанні у зв'язку з циклоалкільними замісниками термін "поліциклічний" у цьому винаході означає конденсовані та неконденсовані циклоалкільні структури. Терміни "частково ненасичений циклоалкіл", "частково насичений циклоалкіл" і "циклоалкеніл" всі означають циклоалкільну групу, у якій міститься щонайменше один ненасичений фрагмент, тобто в якій два сусідні атоми вуглецю зв'язані подвійним зв'язком або потрійним зв'язком. Ілюстративні приклади включають циклогексеніл, циклогексиніл, циклопропеніл, циклобутиніл, і т.п. Терміни "заміщений гетероцикл" або "гетероциклічна група", або "гетероцикл" при використанні в цьому винаході означає кожне 3- або 4-членне кільце, що містить гетероатом, вибраний із групи, що включає азот, кисень і сірку, або 5- або 6-членне кільце, що містить від 1 до 3 гетероатомів, обраних із групи, що включає азот, кисень і сірку; де 5-членне кільце містить 0-2 подвійних зв'язків і 6-членне кільце містить 0-3 подвійних зв'язків; де атоми азоту і сірки необов'язково можуть бути окиснені; де атоми азоту і сірки необов'язково можуть кватернізовані; і включає будь-яку біциклічну групу, у якій кожне із зазначених вище гетероциклічних кілець сконденсоване з бензольним кільцем або іншим 5- або 6-членним гетероциклічним кільцем, незалежно визначеним вище. Термін "гетероциклоалкіл" при використанні в цьому винаході означає 5- або 6-членне кільце, що містить від 1 до 3 гетероатомів, обраних із групи, що включає азот, кисень і сірку, причому кільце не містить подвійних зв'язків. Наприклад, термін гетероцикло-C5-алкіл означає 6-членне кільце, що містить 5 атомів вуглецю і гетероатом, такий як N. Таким чином, термін "гетероцикл" включає кільця, у яких азот є гетероатомом, а також частково і повністю насичені кільця. Кращі гетероцикли включають, наприклад: диазепініл, пірил, піролініл, піролідиніл, піразоліл, піразолініл, піразолідиніл, імідазоліл, імідазолініл, імідазолідиніл, піридил, піперидиніл, піразиніл, піперазиніл, N-метилпіперазиніл, азетидиніл, N-метилазетидиніл, піримідиніл, піридазиніл, оксазоліл, оксазолідиніл, ізоксазоліл, ізоазолідиніл, морфолініл, тіазоліл, тіазолідиніл, ізотіазоліл, ізотіазолідиніл, індоліл, хінолініл, ізохінолініл, бензімідазоліл, бензотіазоліл, бензоксазоліл, фурил, тієніл, триазоліл і бензотієніл. Гетероциклічні фрагменти можуть бути незаміщеними або монозаміщеними або дизаміщеними різними замісниками, незалежно обраними із групи, що включає гідроксигрупу, галоген, оксогрупу (C=O), алкіліміногрупу (RN=, у якій R позначає нижч. алкіл або нижч. алкоксигрупу), аміногрупу, алкіламіногрупу, диалкіламіногрупу, ациламіноалкіл, алкоксигрупу, тіоалкоксигрупу, поліалкоксигрупу, нижч. алкіл, циклоалкіл або галогеналкіл. Гетероциклічні групи можуть бути приєднані в різних положеннях, як це повинно бути очевидно фахівцям в галузі органічної та медичної хімії у зв'язку з розкриттям у цьому винаході. Типові гетероцикліли включають, наприклад, імідазоліл, піридил, піперазиніл, піперидиніл, азетидиніл, тіазоліл, фураніл, триазоліл бензімідазоліл, бензотіазоліл, бензоксазоліл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, фталазиніл, індоліл, нафтпіридиніл, індазоліл, і хінолізиніл. "Арил" означає необов'язково заміщені моноциклічні і поліциклічні ароматичні групи, що містять у головному ланцюзі від 3 до 14 атомів вуглецю або гетероатомів і включають кабоциклічні арильні групи та гетероциклічні арильні групи. Карбоциклічні арильні групи являють собою арильні групи, у яких усі кільцеві атоми ароматичного кільця є атомами вуглецю. Термін "гетероарил" у цьому винаході означає арильні групи, що містять від 1 до 4 гетероатомів як кільцевих атомів ароматичного кільця, а інші кільцеві атоми є атомами вуглецю. При використанні у зв'язку з арильними замісниками термін "поліциклічний арил" у цьому винаході означає конденсовані та неконденсовані циклічні структури, у яких щонайменше одна циклічна структура є ароматичною, такою як, наприклад, бензодіоксозолова група (яка містить 10 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 гетероциклічну структуру, сконденсовану з фенільною групою, тобто нафтил і т.п. Типові арильні фрагменти, що використовуються як замісники у сполуках, запропонованих у цьому винаході, включають феніл, піридил, піримідиніл, тіазоліл, індоліл, імідазоліл, оксадиазоліл, тетразоліл, піразиніл, триазоліл, тіофеніл, фураніл, хінолініл, пуриніл, нафтил, бензотіазоліл, бензопіридил і бензімідазоліл і т.п. "Необов'язково заміщений" або "заміщений" означає заміщення одного або більшої кількості атомів водню одновалентним або двовалентним радикалом. Придатні групи, що заміщають, включають, наприклад, гідроксигрупу, нітрогрупу, аміногрупу, іміногрупу, ціаногрупу, галоген, тіогрупу, сульфоніл, тіоамідну групу, амідинову групу, імідино, оксогрупу, оксамідинову групу, метоксамідинову групу, імідино, гуанідинову групу, сульфонамідну групу, карбоксигрупу, форміл, нижч. алкіл, галоген-нижч. алкіл, нижч. алкіламіногрупу, галоген-нижч. алкіламіногрупу, нижч. алкоксигрупу, галоген-нижч. алкоксигрупу, нижч. алкоксиалкіл, алкілкарбоніл, амінокарбоніл, арилкарбоніл, арилалкілкарбоніл, гетероарилкарбоніл, гетероарилалкілкарбоніл, алкілтіогрупу, аміноалкіл, ціаноалкіл, арил і т.п. Група, що заміщає, сама може бути заміщена. Замісником групи, що заміщає, може бути карбоксигрупа, галоген, нітрогрупа, аміногрупа, ціаногрупа, гідроксигрупа, нижч. алкіл, нижч. алкоксигрупа, амінокарбоніл, -SR, тіоамідна група, -SO3H, -SO2R або циклоалкіл, у яких R звичайно позначає водень, гідроксигрупу або нижч. алкіл. Якщо заміщений замісник включає групу, що має лінійний ланцюг, то заміщення може відбуватися всередині ланцюга (наприклад, 2-гідроксипропіл, 2-амінобутил і т.п.) або наприкінці ланцюга (наприклад, 2-гідроксиетил, 3-ціанопропіл і т.п.). Заміщені замісники можуть являти собою розгалужене або циклічне угруповання ковалентно зв'язаних атомів вуглецю або гетероатомів, що має лінійний ланцюг. Слід розуміти, що наведені вище визначення не включають неприпустимі схеми заміщення (наприклад, метил, заміщений 5 фторидними групами, або атом галогену, заміщений іншим атомом галогену). Такі неприпустимі схеми заміщення добре відомі фахівцеві в цій галузі техніки. Фахівцям у цій галузі техніки повинно бути зрозуміло, що сполуки, запропоновані в цьому винаході, або їх стереоізомери, а також фармацевтично прийнятні солі, складні ефіри, метаболіти і проліки кожної з них можуть зазнавати таутомерних перетворень і тому можуть існувати в різних таутомерних формах, у яких протон одного атома молекули переміщається до іншого атома і хімічні зв'язки між атомами молекули відповідним чином перебудовуються. Див., наприклад, March, Advanced Organic Chemistry: Reactions, Mechanisms and Structures, Fourth Edition, John Wiley & Sons, pages 69-74 (1992). При використанні в цьому винаході термін "таутомер" означає сполуки, утворені шляхом переміщення протона, і слід розуміти, що всі таутомерні форми, якщо вони можуть існувати, входять в обсяг цього винаходу. Сполуки, запропоновані в цьому винаході, а також фармацевтично прийнятні солі, складні ефіри, метаболіти і проліки кожної з них, можуть містити асиметрично заміщені атоми вуглецю. Такі асиметрично заміщені атоми вуглецю можуть привести до сполук, запропонованих у цьому винаході, що існують в енантіомерних, диастереоізомерних та інших стереоізомерних формах, які за допомогою позначень абсолютних стереохімічних конфігурацій можна позначити, як (R)або (S)-форми. Тому всі такі можливі ізомери, окремі стереоізомери в їх оптично чистих формах, їх суміші, рацемічні суміші (або "рацемати"), суміші диастереоізомерів, а також окремі диастереоізомери сполук, запропонованих у цьому винаході, входять в обсяг цього винаходу. Терміни "S" і "R" конфігурація при використанні в цьому винаході мають значення, визначені в публікації IUPAC 1974 Recommendations for Section E, Fundamental Stereochemistry, Pure Appl. Chem. 45:13-30 (1976). Позначення α і β використовуються для визначення положень циклів у циклічних сполуках. α-Положення в розглянутій площині є положенням, у якому кращий замісник розташований у положенні з меншим номером. Замісники, розташовані з протилежної сторони розглянутої площини, позначають символом β. Слід зазначити, що ці позначення відрізняються від позначень циклічних стереоізомерів, для яких "α" означає "нижче площини" і позначає абсолютну конфігурацію. Терміни α- і β-конфігурація при використанні в цьому винаході мають значення, визначені в публікації Chemical Abstracts Index Guide-Appendix IV (1987) paragraph 203. При використанні в цьому винаході термін "фармацевтично прийнятні солі" означає солі нетоксичної кислоти або солі нетоксичного лужноземельного металу сполук формул I або II. Ці солі можна одержати in situ при остаточному виділенні і очищенні сполук формул I або II або шляхом роздільних реакцій основних або кислотних груп з придатною органічною або неорганічною кислотою або основою відповідно. Типові солі включають, але не обмежуються тільки ними, наступні: ацетат, адипат, альгінат, цитрат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропіонат, 11 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 додецилсульфат, етансульфонат, глюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, фумарат, гідрохлорид, гідробромід, гідройодид, 2-гідроксиетансульфонат, лактат, малеат, метансульфонат, нікотінат, 2-нафталінсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенілпропіонат, пікрат, півалат, пропіонат, сукцинат, сульфат, тартрат, тіоцианат, п-толуолсульфонат і ундеканоат. Крім того, основні групи, що містять азот, можна кватернізувати такими реагентами, як нижч. алкілгалогеніди, такі як метил-, етил-, пропіл- і бутилхлориди, -броміди і -йодиди; диалкілсульфати, такі як диметил-, диетил-, дибутил- і диамілсульфати, галогеніди з довгими ланцюгами, такі як децил-, лаурил-, міристил- і стеарилхлориди, -броміди та -йодиди, арилалкілгалогеніди, такі як бензил- і фенетилброміди та ін. У такий спосіб одержують продукти, що розчиняються або диспергуються у воді або олії. Приклади кислот, які можна використовувати для одержання фармацевтично прийнятних солей приєднання з кислотами, включають такі неорганічні кислоти, як хлористоводнева кислота, азотна кислота, сірчана кислота і фосфорна кислота, і такі органічні кислоти, як щавлева кислота, малеїнова кислота, метансульфонова кислота, бурштинова кислота і лимонна кислота. Солі приєднання з основами можна одержати in situ при остаточному виділенні та очищенні сполук формули (I) або шляхом роздільних реакцій кислотних груп карбонових кислот з придатною основою, такою як гідроксид, карбонат або бікарбонат фармацевтично прийнятного катіона металу, або з аміаком або з первинним, вторинним або третинним органічним аміном. Фармацевтично прийнятні солі включають, але не обмежуються тільки ними, солі, що містять катіони лужних і лужноземельних металів, такі як солі натрію, літію, калію, кальцію, магнію, алюмінію і т.п., а також нетоксичні солі амонію, четвертинного амонію та амінів, включаючи, але не обмежуючись тільки ними солі амонію, тетраметиламонію, тетраетиламонію, метиламіну, диметиламіну, триметиламіну, триетиламіну, етиламіну і т.п. Інші типові органічні аміни, що застосовуються для одержання солей приєднання з основами, включають диетиламін, етилендиамін, етаноламін, диетаноламін, піперазин і т.п. При використанні в цьому винаході термін "фармацевтично прийнятний складний ефір" означає складні ефіри, які гідролізуються in vivo, і включають такі, які легко руйнуються в організмі людини з вивільненням вихідної сполуки або її солі. Придатні складноефірні групи включають, наприклад, утворені з фармацевтично прийнятних аліфатичних карбонових кислот, краще алканкарбонових, алкенкарбонових, циклоалканкарбонових і алкандикарбонових, у яких кожний алкільний або алкенільний фрагмент краще містить не більше 6 атомів вуглецю. Типові приклади кращих складних ефірів включають, але не обмежуються тільки ними, форміати, ацетати, пропіонати, бутирати, акрилати та етилсукцинати. Термін "фармацевтично прийнятні проліки" при використанні в цьому винаході означає такі проліки сполук, запропонованих у цьому винаході, які з медичної точки зору можна застосовувати для взаємодії з тканинами людини і нижчих тварин без прояву небажаної токсичності, подразнення, алергійної реакції і т.п., характеризуються розумним співвідношенням користь/ризик і ефективні для застосування за призначенням, а також, коли це можливо, цвітеріонні форми сполук, запропонованих у цьому винаході. Термін "проліки" означає сполуки, які швидко зазнають перетворення in vivo і утворюють вихідні сполуки зазначеної вище формули, наприклад, шляхом гідролізу в крові. Докладне обговорення наведено в публікаціях T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 °F the A.C.S. Symposium Series, і Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, які включені в даний винахід як посилання. Будь-яка формула, наведена в цьому винаході, також характеризує немічені форми, а також ізотопно-мічені форми сполук. Ізотопно-мічені сполуки мають структури, що описуються формулами, наведеними в цьому винаході, за винятком того, що один або більша кількість атомів замінена на атоми атомними масами, що мають зазначені, або масові числа. Приклади ізотопів, які можна вводити в сполуки, запропоновані в цьому винаході, включають ізотопи 2 3 11 13 14 15 18 водню, вуглецю, азоту, кисню, фосфору, сірки, фтору і хлору, такі як H, H, C, C, C, N, F 31 32 35 36 125 P, P, S, Cl, I відповідно. В обсяг цього винаходу входять різні ізотопно-мічені сполуки, 3 13 запропоновані в цьому винаході, наприклад, у які включені радіоактивні ізотопи, такі як H, C, і 14 C. Такі ізотопно-мічені сполуки можна застосовувати для вивчення метаболізму (що краще 14 2 3 містять C), кінетики реакцій (що містять, наприклад, H або H), у методологіях детектування і візуалізації, таких як позитронна емісійна томографія (ПЕТ) або однофотонна емісійна комп'ютерна томографія (ОФЕКТ), включаючи дослідження розподілу лікарського засобу або 18 субстрату в тканинах або променеву терапію пацієнтів. Зокрема, сполука, що містить F або мічена ним, може бути особливо кращою для досліджень за допомогою ПЕТ або ОФЕКТ. Ізотопно-мічені сполуки, запропоновані в цьому винаході, і їх проліки звичайно можна одержати за методиками, розкритими на схемах або в прикладах і синтезах, описаних нижче, шляхом 12 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 заміни реагенту, що не містить ізотоп, на легко доступний ізотопно-мічений реагент. 2 Крім того, заміщення більш важкими ізотопами, такими як дейтерій (тобто H або D), може забезпечити деякі терапевтичні переваги, обумовлені їх більш високою метаболічною стабільністю, наприклад, збільшеною тривалістю напіввиведення in vivo або можливістю використання менших доз, або поліпшенням терапевтичного індексу. Слід розуміти, що в цьому контексті дейтерій розглядається як замісник у з'єднанні формули (I). Концентрацію такого більш важкого ізотопу, зокрема, дейтерію, можна визначити за допомогою коефіцієнта ізотопного збагачення. Термін "коефіцієнт ізотопного збагачення" при використанні в цьому винаході означає відношення вмісту ізотопу до вмісту конкретного ізотопу в природі. Якщо замісник у з'єднанні, запропонованому в цьому винаході, означає дейтерій, то така сполука характеризується коефіцієнтом ізотопного збагачення для кожного позначеного атома дейтерію, рівним не менше 3500 (вміст дейтерію для кожного позначеного атома дейтерію рівний 52,5 %), не менше 4000 (вміст дейтерію рівний 60 %), не менше 4500 (вміст дейтерію рівний 67,5 %), не менше 5000 (вміст дейтерію рівний 75 %), не менше 5500 (вміст дейтерію рівний 82,5 %), не менше 6000 (вміст дейтерію рівний 90 %), не менше 6333,3 (вміст дейтерію рівний 95 %), не менше 6466,7 (вміст дейтерію рівний 97 %), не менше 6600 (вміст дейтерію рівний 99 %) або не менше 6633,3 (вміст дейтерію рівний 99,5 %). Ізотопно-мічені сполуки формули (I) звичайно можна одержати за звичайними методиками, відомими фахівцям у цій галузі техніки, або за методиками, аналогічними описаним у прикладах, що додаються, і синтезах з використанням ізотопно-міченого реагенту замість неміченого реагенту, що використовувався раніше. Фахівцям у цій галузі техніки повинно бути очевидно, що сполуки, запропоновані в цьому винаході, або їх таутомери, проліки і стереоізомери, а також фармацевтично прийнятні солі, складні ефіри та проліки кожної з них, можуть піддатися перетворенням in vivo шляхом метаболізму в організмі людини або тварини або в клітині з утворенням метаболітів. Термін "метаболіт" при використанні в цьому винаході означає будь-яке похідне, що утворилося в суб'єкті після введення вихідної сполуки. Похідні можуть утворюватися з вихідної сполуки за допомогою різних біохімічних перетворень, що відбуваються в суб'єкті, таких як, наприклад, окиснення, відновлення, гідроліз або кон'югація, і включають, наприклад, оксиди та деметильовані похідні. Метаболіти сполуки, запропонованої в цьому винаході, можна ідентифікувати за стандартними методиками, відомими у цій галузі техніки. Див., наприклад, Bertolini, G. et al., J. Med. Chem. 40:2011-2016 (1997); Shan, D. et al., J. Pharm. Sci. 86(7):765-767; Bagshawe K., Drug Dev. Res. 34:220-230 (1995); Bodor, N., Advances in Drug Res. 13:224-331 (1984); Bundgaard, H., Design of Prodrugs (Elsevier Press 1985); і Larsen, I. K., Design and Application of Prodrugs, Drug Design and Development (Krogsgaard-Larsen et al., eds., Harwood Academic Publishers, 1991). Слід розуміти, що індивідуальні хімічні сполуки, які являють собою метаболіти сполук формул I або II, або їх таутомери, проліки та стереоізомери, а також фармацевтично прийнятні солі, складні ефіри і проліки кожної з них входять в обсяг цього винаходу. Термін "рак" означає ракові захворювання, які можна ефективно лікувати шляхом інгібування кінази Pim, включаючи, наприклад, сóлідні ракові захворювання, такі як карциноми (наприклад, легенів, підшлункової залози, щитовидної залози, яєчників, сечового міхура, молочної залози, передміхурової залози або товстої кишки), меланоми, мієлоїдні порушення (наприклад, мієлолейкоз, множинну мієлому і еритролейкоз), аденоми (наприклад, ворсинчасту аденому товстої кишки) і саркоми (наприклад, остеосаркому). Методики синтезу Сполуки, запропоновані в цьому винаході, можна одержати за методиками, відомими фахівцям у цій галузі техніки. Наприклад, як показано на схемі, циклогександіони через монотрифлати можна перетворити у відповідні ефіри циклогексенонборонової кислоти, які при каталізі паладієм утворюють зв'язок з атомом вуглецю 4-хлор, 3-нітропіридину з одержанням заміщених нітропіридином циклогексенонів I. Відновлення енонової групи може дати циклогексенол II, який після захисту гідроксигрупи, відновлення нітрогрупи та алкену, реакції комбінації з утворенням аміду і видалення захисної групи може дати циклогексаноламіди III. Циклогексенол II також можна ввести в реакцію Міцунобу з фталімідом і одержати захищений аміноциклогексен IV. Після відновлення нітрогрупи та алкену аміноциклогексилпіридиланілін Va, що містить фталімідну захисну групу, можна ввести в реакцію комбінації з утворенням аміду і вилучити захисну групу та одержати аміноциклогексанаміди VI. Відповідний аміноциклогексанпіридиланілін Vb, що містить захисну групу Boc, також можна одержати із циклогексенолу II у такий спосіб: захистити гідроксигрупу, відновити алкен і нітрогрупу, ввести в піридиламін захисну групу Cbz, видалити силільну захисну групу, провести окиснення за 13 UA 103034 C2 5 10 15 20 25 Дессом-Мартіном в циклогексанон, провести відновлювальне амінування бензиламіном, видалити захисні групи Cbz і Bn і видалити захисну групу Boc з первинного аліфатичного аміну. У випадку амідів III і VI, якщо R2 позначає галоген або трифлат, то аміди III і VI можна додатково модифікувати за стандартними методиками модифікації шляхом введення заміщених арилів, алкілів і гетероарилів по R2. Наприклад, якщо R2 позначає Br, то за реакцією з бороновими кислотами або металоорганічними реагентами або шляхом перетворення у відповідний ефір боронової кислоти і реакції з арил/гетероарилгалогенідами або трифлатами можна виконати різні модифікації R2. Схема 1. Альтернативно, як показано на схемі 2, циклогексенол II можна дегідратувати і одержати циклогексадіен, який після епоксидування (шляхом утворення бромгідрину і відщеплення HBr або безпосередньо із МХПБК (м-хлорпероксибензойна кислота)) і розкриття епоксидного кільця азидом дає циклогексенілазидоспирт VI. Циклогексенілазидоспирт VI можна перетворити в транс-захищений аміногідроксианілін VIIa шляхом відновлення азидної групи, захисту гідроксигрупи і відновлення алкену та нітрогрупи. Альтернативно, циклогексенілазидоспирт VI можна перетворити в цис-захищений аміногідроксианілін VIIb шляхом відновлення азидної групи і введення захисної групи Boc, мезилювання спирту і внутрішньомолекулярної циклізації в цис-циклічний карбамат, наступного введення захисної групи Boc і відновлення алкену та нітрогрупи. Отримані циклогексилпіридиланіліни VIIa і VIIb можна перетворити у відповідні піридинаміди VIIIa і VIIIb за допомогою реакції комбінації з утворенням аміду, розщеплення ацетату або циклічного карбамату і видалення захисної групи Boc. Якщо R2 позначає галоген або трифлат, то аміди VIIIa і VIIIb можна додатково модифікувати за стандартними методиками модифікації шляхом введення заміщених арилів, алкілів і гетероарилів по R2 після утворення амідного зв'язку і до повного видалення захисних груп. Наприклад, якщо R2 позначає Br, то за реакцією з бороновими кислотами або металоорганічними реагентами або шляхом перетворення у відповідний ефір боронової кислоти і реакції з арил/гетероарилгалогенідами або трифлатами можна виконати різні модифікації R2. 14 UA 103034 C2 Схема 2. 5 10 15 20 Альтернативно, як показано на схемі 3, можна одержати тризаміщені 5-алкіл-4-гідрокси-3амінопіперидини і їх модифікувати та у такий спосіб одержати тризаміщені 5-алкіл-4-гідрокси-3амінопіперидинілпіридинаміди IX. Реакція Гарнера альдегіду з (R)-4-бензил-3пропіонілоксазолідин-2-оном, наступне введення захисної групи TBS в отриманий спирт дає сполуку X. Відновлення оксазолідинону, наступне ведення азидної групи дає проміжний продукт XI. Видалення захисної групи в кислому середовищі дає відповідний аміноспирт, який після введення захисної групи Boc і наступного мезилювання первинного спирту дає проміжний продукт XII. Відновлення азиду дозволяє одержати піперидин, який потім вводять у реакцію з 4хлор-3-нітропіридином, відновлюють в амін, вводять у реакцію комбінації з відповідною карбоновою кислотою і видаляють захисну групу та одержують тризаміщені 5-метил-4-гідрокси3-амінопіперидинілпіридинаміди IX. Якщо R1 позначає галоген або трифлат, то амід IX можна додатково модифікувати за стандартними методиками модифікації шляхом введення заміщених арилів, алкілів і гетероарилів по R1 після утворення амідного зв'язку і до повного видалення захисних груп. Наприклад, якщо R1 позначає Br, то за реакцією з бороновими кислотами або металоорганічними реагентами або шляхом перетворення у відповідний ефір боронової кислоти і реакції з арил/гетероарилгалогенідами або трифлатами можна виконати різні модифікації R1. Схема 3. 15 UA 103034 C2 5 10 15 20 25 30 Альтернативно, як показано на схемі 4, можна одержати тризаміщені 5-метил-4-гідрокси-3амінопіперидини і їх модифікувати і у такий спосіб одержати тризаміщені 5-метил-4-гідрокси-3амінопіперидиніламіди XIII. Реакція кротилових ефірів боронової кислоти з альдегідом SerOBn, наступне утворення циклічного карбамату, окисне відщеплення алкену і відновлення дає сполуку XIV, що містить гідроксигрупу. Видалення бензильної захисної групи, наступне бістозилювання і реакція з п-метоксибензиламіном, і видалення захисної групи аміну дає піперидин XV. Реакція заміщеного піперидину XV з галогеннітрозаміщеними аренами або гетероаренами, наступне введення карбаматної захисної групи, відновлення нітрогрупи, реакція комбінації з утворенням аміду, розкриття циклічного карбамату і видалення захисної групи дає тризаміщені 5-метил-4-гідрокси-3-амінопіперидиніламіди XIII. Якщо R3 позначає галоген або трифлат, то амід XV можна додатково модифікувати за стандартними методиками модифікації шляхом введення заміщених арилів, алкілів і гетероарилів по R3. Наприклад, якщо R3 позначає Br, то за реакцією з бороновими кислотами або металоорганічними реагентами або шляхом перетворення у відповідний ефір боронової кислоти і реакції з арил/гетероарилгалогенідами або трифлатами можна виконати різні модифікації R3. Схема 4. Сполуки, запропоновані в цьому винаході, можна застосовувати in vitro або in vivo для придушення росту ракових клітин. Сполуку можна застосовувати окремо або в композиціях разом з фармацевтично прийнятним носієм або інертним наповнювачем. Придатні фармацевтично прийнятні носії або інертні наповнювачі включають, наприклад, технологічні добавки і речовини, що модифікують і поліпшують доставку лікарського засобу, такі як, наприклад, фосфат кальцію, стеарат магнію, тальк, моносахариди, дисахариди, крохмаль, желатин, целюлоза, метилцелюлоза, натрієва сіль карбоксиметилцелюлози, декстроза, гідроксипропіл-β-циклодекстрин, полівінілпіролідинон, воски з низькою температурою плавлення, іонообмінні смоли і т.п., а також комбінації будь-яких двох або більшої кількості з них. Інші придатні фармацевтично прийнятні інертні наповнювачі описані в публікації "Remington's Pharmaceutical Sciences, " Mack Pub. Co., New Jersey (1991), яка включена в даний винахід як посилання. Ефективні кількості сполук запропонованих у цьому винаході, звичайно являють собою будь-які кількості достатні для інгібування активності Pim, що реєструється, яке виявляється за 16 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою кожної з методик дослідження, описаних у цьому винаході, за допомогою інших методик дослідження активності кінази Pim, відомих фахівцям із загальною підготовкою в цій галузі техніки, або такого, що виявляється по придушенню або ослабленню симптомів раку. Кількість активного інгредієнта, яку можна об'єднати з носіями з одержанням разової дозованої форми, буде мінятися залежно від реципієнта, що зазнає лікування, і конкретного шляху введення. Однак слід розуміти, що точна доза для будь-якого конкретного пацієнта буде залежати від безлічі факторів, включаючи активність конкретної сполуки, що використовується, вік, масу тіла, загальний стан здоров'я, стать, дієту, час введення, шлях введення, швидкість виведення, комбінацію лікарських засобів і вагу конкретного захворювання, що зазнає лікування. У кожному випадку терапевтично ефективну кількість можна легке визначити за допомогою стандартних досліджень і на підставі своєї професійної підготовки рішення ухвалює лікар. Для завдань цього винаходу терапевтично ефективна доза звичайно являє собою повну добову дозу, що вводиться реципієнтові у вигляді однієї або розділених доз у кількостях, які можуть становити, наприклад, від 0,001 до 1000 мг/(кг маси тіла) на добу і ще краще від 1,0 до 30 мг/(кг маси тіла) на добу. Разова доза композиції може становити частку таких кількостей, так щоб у сумі вони утворювали добову дозу. Сполуки, запропоновані в цьому винаході, можна вводити перорально, парентерально, сублінгвально, за допомогою аерозолю або інгаляції спрея, ректально або місцево у вигляді разових доз композицій, що при необхідності містять звичайні нетоксичні фармацевтично прийнятні носії, допоміжні речовини і розчинники. Місцеве введення також може включати застосування засобів крізьшкірного введення, таких як крізьшкірні пластири або обладнання для іонофорезу. Термін "парентерально" при використанні в цьому винаході включає підшкірні ін'єкції, внутрішньовенні, внутрішньом'язові, надчеревні ін'єкції та вливання. Препарати для ін'єкції, наприклад, стерильні водні або олійні суспензії для ін'єкції можна приготувати з використанням відомих у цій галузі техніки придатних диспергуючих або змочувальних агентів і суспендуючих агентів. Стерильний препарат для ін'єкції також може являти собою стерильний розчин, суспензію або емульсію для ін'єкції в нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, розчин в 1,3-пропандіолі. У число прийнятних носіїв і розріджувачів, які можна використовувати, входять вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовище звичайно використовують стерильні нелетучі олії. Для цієї мети можна використовувати будь-яку рідку нелетучу олію, включаючи синтетичні моно- або дигліцериди. Крім того, для приготування засобів для ін'єкції використовують жирні кислоти, такі як олеїнову кислоту. Супозиторії для ректального введення лікарського засобу можна приготувати шляхом змішування лікарського засобу з придатним інертним наповнювачем, що не чинить подразнюючий вплив, таким як олія какао або поліетиленгліколі, які є твердими при температурі навколишнього середовища, але рідкими при температурі прямої кишки і тому плавляться в прямій кишці та вивільняють лікарський засіб. Тверді дозовані форми для перорального введення можуть включати капсули, таблетки, пігулки, порошки і гранули. У таких твердих дозованих формах, активну сполуку можна змішати щонайменше з одним інертним розріджувачем, таким як сахароза, лактоза або крохмаль. Такі тверді дозовані форми можуть включати, що є звичайною практикою, додаткові речовини, що не є інертними розріджувачами, наприклад агенти, що змазують, такі як стеарат магнію. У випадку капсул, таблеток і пігулок дозовані форми також можуть включати буферні агенти. Таблетки і пігулки також можна виготовити з ентеросолюбільними покриттями. Рідкі дозовані форми для перорального введення можуть включати фармацевтично прийнятні емульсії, розчини, суспензії, сиропи та еліксири, що містять інертні розріджувачі, що звичайно використовуються в цій галузі техніки, такі як воду. Такі композиції також можуть містити допоміжні речовини, такі як змочувальні агенти, емульгуючі та суспендуючі агенти, циклодекстрини і підсолоджувачі, смакові добавки і ароматизатори. Сполуки, запропоновані в цьому винаході, також можна вводити у вигляді ліпосом. Як відомо в цій галузі техніки, ліпосоми звичайно одержують із фосфоліпідів або інших ліпідів. Ліпосоми формуються моно- або багатошаровими гідратованими рідкими кристалами, які дисперговані у водному середовищі. Можна використовувати будь-який нетоксичний фізіологічно прийнятний ліпід, що зазнає метаболізм, здатний утворювати ліпосоми. Композиції, запропоновані в цьому винаході, у ліпосомній формі на додаток до сполуки, запропонованої в цьому винаході, можуть містити стабілізатори, консерванти, інертні наповнювачі і т.п. Кращими ліпідами є фосфоліпіди і фосфатидилхоліни (лецитини), натуральні та синтетичні. Методики 17 UA 103034 C2 5 10 15 20 25 30 35 40 45 50 55 60 приготування ліпосом відомі в цій галузі техніки. Див., наприклад, публікацію Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.W., p. 33 et seq. (1976). Хоча сполуки, запропоновані в цьому винаході, можна вводити як єдиний лікарський засіб, їх також можна застосовувати в комбінації з одним або більшою кількістю інших засобів, що застосовуються для лікування раку. Сполуки, запропоновані в цьому винаході, також можна застосовувати в комбінації з відомими лікарськими засобами і протираковими засобами і комбінації сполук, запропонованих у цьому винаході, з іншими протираковими засобами або хіміотерапевтичними засобами входять в обсяг цього винаходу. Приклади таких засобів наведені в публікації Cancer Principles and Practice of Oncology, V. T. Devita and S. Hellman (editors), 6th edition (Feb. 15, 2001), Lippincott Williams & Wilkins Publishers. Фахівець із загальною підготовкою в цій галузі техніки повинен бути здатний визначити, які комбінації засобів будуть застосовувати відповідно до характеристик конкретних лікарських засобів і таких, що зазнають лікування раком. Такі протиракові засоби включають, але не обмежуються тільки ними, наступні: модулятори естрогенного рецептора, модулятори андрогенного рецептора, модулятори ретиноїдного рецептора, цитотоксичні/цитостатичні засоби, антипроліферативні засоби, інгібітори пренілпротеїнтрансферази, інгібітори HMG-CoA редуктази та інші інгібітори ангіогенезу, інгібітори проліферації клітин і передачі сигналів життєздатності, засоби, що індукують апоптоз, і засоби, які впливають на ключових стадіях клітинного циклу. Сполуки, запропоновані в цьому винаході, також можна застосовувати разом з променевою терапією. Тому, в одному варіанті здійснення цього винаходу сполуки, запропоновані в цьому винаході, також застосовуються у комбінації з відомими протираковими засобами, включаючи, наприклад, модулятори естрогенного рецептора, модулятори андрогенного рецептора, модулятори ретиноїдного рецептора, цитотоксичні засоби, антипроліферативні засоби, інгібітори пренілпротеїнтрансферази, інгібітори HMG-CoA редуктази, інгібітори протеази ВІЛ (вірус імунодефіциту людину), інгібітори зворотної транскриптази та інші інгібітори ангіогенезу. У деяких у цей час кращих варіантах здійснення цього винаходу типові засоби, можна застосовувати у комбінації зі сполуками, запропонованими в цьому винаході, для лікування раку включають, наприклад, іринотекан, топотекан, гемцитабін, 5-фторурацил, лейковорин карбоплатин, цисплатин, таксани, тезацитабін, циклофосфамід, алкалоїди барвінку, іматиніб (глівек), антрацикліни, ритуксимаб, трастузумаб, а також протиракові хіміотерапевтичні засоби. Зазначені вище сполуки, що застосовуються у комбінації зі сполуками, запропонованими в цьому винаході, можна використовувати в терапевтичних кількостях, як це зазначено в публікації Physicians' Desk Reference (PDR) 47th Edition (1993), яка включена в даний винахід як посилання, або в таких терапевтично застосовних кількостях, які повинні бути відомі фахівцеві із загальною підготовкою в цій галузі техніки. Сполуки, запропоновані в цьому винаході, та інші протиракові засоби можна вводити в рекомендованому максимальному клінічному дозуванні або в менших дозах. Величини доз активних сполук у композиціях, запропонованих у цьому винаході, можуть мінятися так, щоб забезпечити необхідний терапевтичний вплив відповідно до шляху введення, тяжкості захворювання та реакцією пацієнта. Комбінацію можна вводити у вигляді окремих композицій або у вигляді разової дозованої форми, що містить обидва засоби. При введенні у вигляді комбінації лікарські засоби можна приготувати у вигляді окремих композицій, які вводять одночасно або в різні моменти часу, або лікарські засоби можна вводити у вигляді однієї композиції. В одному варіанті здійснення даний винахід відноситься до способу інгібування Pim1, Pim2 або Pim3 у людини або тварини. Спосіб включає введення суб'єкту, що її потребує, сполуки або її фармацевтично прийнятної солі, що відповідає кожному з варіантів здійснення сполук формули I або II, в ефективній кількості. Даний винахід буде легше зрозуміти з використанням наведених нижче прикладів, які представлені тільки для ілюстрації і не призначені для обмеження цього винаходу. Приклади У наведених нижче прикладах сполуки, що відповідають кращим варіантам здійснення, синтезували за методиками, описаними у цьому винаході, або за іншими методиками, які відомі в цій галузі техніки. Сполуки і/або проміжні продукти характеризували за допомогою високоефективної рідинної хроматографії (ВЕРХ) з використанням хроматографічної системи Waters Millenium з модулем поділу 2695 (Milford, MA). Використовували аналітичні колонки зі зверненою фазою Phenomenex Luna C18-5 мкм, 4,650 мм, що випускаються фірмою Alltech (Deerfield, IL). Використовували елюювання в градієнтному режимі (швидкість потоку 2,5 мл/хв), звичайно починаючи від суміші 5 % ацетонітрил/95 % вода і закінчуючи 100 % ацетонітрилом, протягом 10 хв. Усі розчинники 18 UA 103034 C2 5 10 15 20 25 30 35 40 45 містили 0,1 % трифтороцтової кислоти (ТФК). Сполуку детектували по поглинанню в ультрафіолетовій (УФ) області спектра при довжині хвилі 220 або 254 нм. Використовували розчинники для ВЕРХ, що випускаються фірмами Burdick and Jackson (Muskegan, MI) або Fisher Scientific (Pittsburgh, PA). У деяких випадках чистоту визначали за допомогою тонкошарової хроматографії (ТШХ) з використанням скляних або пластмасових пластин, покритих силікагелем, таких як, наприклад, гнучкі пластини Baker-Flex Silica Gel 1B2-F. Дані ТШХ легко одержували шляхом візуального детектування при ультрафіолетовому висвітленні або шляхом використання добре відомої методики фарбування парами йоду або різних інших методик фарбування. Мас-спектрометричні дослідження проводили на одному з трьох приладів для РХМС (рідинна хроматографія-мас-спектроскопія): Waters System (Alliance HT HPLC і Micromass ZQ мас-спектрометр; колонка: Eclipse XDB-C18, 2,150 мм; градієнтний режим: 5-95 % (або 3595 %, або 65-95 % або 95-95 %) ацетонітрил у воді з додаванням 0,05 % ТФК протягом 4 хв; швидкість потоку 0,8 мл/хв; діапазон молекулярних мас 200-1500; різниця потенціалів на конусі 20 В; температура колонки 40 °C), іншого Waters System (ACQUITY UPLC system і ZQ 2000 system; колонка: ACQUITY UPLC HSS-C18, 1,8 мкм, 2,150 мм; градієнтний режим: 5-95 % (або 35-95 %, або 65-95 % або 95-95 %) ацетонітрил у воді з додаванням 0,05 % ТФК протягом 1,3 хв; швидкість потоку 1,2 мл/хв; діапазон молекулярних мас 150-850; потенціалів на конусі 20 В; температура колонки 50 °C) або Hewlett Packard System (Series 1100 HPLC; колонка: Eclipse XDB-C18, 2,150 мм; градієнтний режим: 5-95 % ацетонітрил у воді з додаванням 0,05 % ТФК протягом 4 хв; швидкість потоку 0,8 мл/хв; діапазон молекулярних мас 150-850; різниця потенціалів на конусі 50 В; температура колонки 30 °C). Усі наведені маси відносяться до протонованих вихідних іонів. Дослідження за допомогою ядерного магнітного резонансу (ЯМР) проводили для деяких сполук на приладі Varian 400 Мгц ЯМР (Palo Alto, CA). Як стандарт використовували ТМС (триметилсилан) або відоме хімічне зрушення розчинника. Препаративні розділення проводили за допомогою хроматографічної системи Flash 40 і Kpsil, 60A (Biotage, Charlottesville, VA) або за допомогою колонкової флеш-хроматографії з використанням силікагелю (230-400 меш) як насадки, або за допомогою ВЕРХ з використанням Waters 2767 Sample Manager, C-18 колонки зі зверненою фазою, 3050 мм, швидкість потоку 75 мл/хв. Типовими розчинниками, використаними для системи Flash 40 Biotage і колонкової флеш-хроматографії, були дихлорметан, метанол, етилацетат, гексан, ацетон, водний розчин аміаку (або гідроксид амонію) і триетиламін. Типовими розчинниками, використаними для ВЕРХ зі зверненою фазою, були ацетонітрил у різних концентраціях і вода з додаванням 0,1 % трифтороцтової кислоти. Слід розуміти, що органічні сполуки, які відповідають кращим варіантам здійснення, можуть мати таутомерію. Оскільки хімічні структури в цій заявці можуть представляти тільки одну з можливих таутомерних форм, слід розуміти, що кращі варіанти здійснення включають будь-яку таутомерну форму зображеної структури. Слід розуміти, що даний винахід не обмежується варіантами здійснення, представленими в цьому винаході для ілюстрації, а включає всі його форми, відповідні до обсягу наведеного вище опису. У прикладах, наведених нижче, а також у всій цій заявці представлені нижче абревіатури мають зазначені значення. Терміни, для яких не наведені визначення, мають загальноприйняті значення. Абревіатури ДАТС (диетиламіно)трифторид сірки ДХМ дихлорметан ДІЕА диізопропілетиламін ДМА диметилацетамід ДМАП 4-диметиламінопіридин ДМЕ 1,2-диметоксиетан ДМФ N, N-диметилформамід ДФФФ 1,1'-біс(дифенілфосфіно)фероцен 1-(3-диметиламінопропіл)-3ЕДХ етилкарбодиімідгідрохлорид EtOAc етилацетат EtOH етанол HOAT гідроксиазабензотриазол K2CO3 карбонат калію 19 UA 103034 C2 ацетонітрил сульфат магнію метанол карбонат натрію хлорид натрію бікарбонат натрію N-бромсукцинімід N-метил-2-піролідон трис(дибензиліденацетон)дипаладій(0) тетракіс(трифенілфосфін)паладій(0) адукт дихлор-(1,2Pd(dppf)Cl2біс(дифенілфосфіно)етан)-паладію(II) ДХМ з дихлорметаном КТ кімнатна температура TBDMSCl трет-бутилдиметилсилілхлорид ТЕА триетиламін sat. насичений розчин ТГФ тетрагідрофуран MeCN MgSO4 MeOH Na2CO3 NaCl NaHCO3 NBS NMP Pd2(dba)3 Pd(Pph3)4 Синтез 3-оксоциклогекс-1-енілтрифторметансульфонату O OTf 5 10 До розчину циклогексан-1,3-діону (1 екв.) у ДХМ (0,4 M) додавали Na2CO3 (1,0 екв.) і охолоджували до 0 °C. По краплях протягом 1 год. при кімнатній температурі в атмосфері азоту додавали Tf2O (1,0 екв.) у ДХМ (5 M). Після додавання реакційну суміш перемішували протягом 2 год. (темно-червоний розчин). Розчин фільтрували і до фільтрату додавали насичений розчин NaHCO3 (обережно), потім екстрагували органічні речовини, промивали розсолом, потім сушили над Na2SO4 і концентрували. Неочищену речовину використовували на наступній стадії без додаткового очищення. 3-оксоциклогекс-1-енілтрифторметансульфонат одержували з виходом 67 %. Трифлат розкладає при зберіганні і його необхідно відразу використовувати в наступній реакції. РХ/МС=244,9/286,0 (M+H і M+CH3CN); Rt=0,88 хв. Синтез 3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)циклогекс-2-енону O O 15 20 B O До розчину 3-оксоциклогекс-1-енілтрифторметансульфонату (1,0 екв.) у дегазованому діоксані (0,3 M) додавали біс(пінаколято)дибор (2,0 екв.), KOAc (3,0 екв.) і Pd(dppf)Cl2-ДХМ (0,05 екв.). Реакційну суміш нагрівали при 80 °C протягом 2 год., потім фільтрували. Розчин у діоксані використовували на наступній стадії без додаткового очищення. РХ/МС = 140,9 (M+H боронової кислоти). Синтез 3-(3-нітропіридин-4-іл)циклогекс-2-енону O NO 2 N До розчину 3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)циклогекс-2-енону (1,0 екв.) у дегазованому діоксані і 2M Na2CO3 додавали 4-хлор-3-нітропіридин (1,2 екв.) і Pd(dppf)Cl2-ДХМ (0,05 екв.). Реакційну суміш нагрівали на олійній бані при 110 °C протягом 2 год. Охолоджували 20 UA 103034 C2 5 до кімнатної температури, потім розбавляли за допомогою EtOAc, додавали H 2O – утворювався темний розчин, багато емульгованої речовини. Фільтрували для видалення твердих речовин, потім органічну фазу екстрагували, сушили над Na 2SO4 і концентрували. Неочищену речовину очищали за допомогою хроматографії на силікагелі при елююванні етилацетатом і гексанами (1:1) і одержували 3-(3-нітропіридин-4-іл)циклогекс-2-енон (55 %, 2 стадії). РХ/МС = 219 (M+H), РХ = 2,294 хв. Синтез 3-(3-нітропіридин-4-іл)циклогекс-2-енолу OH NO 2 10 15 N До розчину 3-(3-нітропіридин-4-іл)циклогекс-2-енону (1,0 екв.) додавали EtOH (0,2 M) і CeCl37H2O (1,3 екв.). Реакційну суміш охолоджували до 0 °C, потім порціями додавали NaBH4 (1,3 екв.). Перемішували протягом 2 год. при 0 °C, потім реакцію зупиняли шляхом додавання води, концентрували для видалення EtOH, додавали EtOAc, екстрагували органічні речовини, промивали розсолом, потім сушили над Na2SO4 і концентрували та одержували 3-(3нітропіридин-4-іл)циклогекс-2-енол (99 %). РХ/МС = 221,1 (M+H), РХ = 2,235 хв. Синтез 2-(3-(3-нітропіридин-4-іл)циклогекс-2-еніл)ізоіндолін-1,3-діону O N O NO2 N 20 До розчину 3-(3-нітропіридин-4-іл)циклогекс-2-енолу (1,0 екв.), трифенілфосфін (1,5 екв.) і фталімід (1,5 екв.) у ТГФ (0,3 M) при 0 °C по краплях додавали (E)-ди-трет-бутилдиазен-1,2дикарбоксилат (1,5 екв.). Реакційну суміш перемішували при 0 °C протягом 2 год. Концентрували досуха у вакуумі, потім неочищену речовину очищали за допомогою колонкової хроматографії на силікагелі при елююванні за допомогою EtOAc і гексанів (1:1 з додаванням 5 % метанолу) і одержували 2-(3-(3-нітропіридин-4-іл)циклогекс-2-еніл)ізоіндолін-1,3-дион (вихід 63 %). РХ/МС = 350,3 (M+H), РХ = 3,936 хв. Синтез 2-(3-(3-амінопіридин-4-іл)циклогекс-2-еніл)ізоіндолін-1,3-дион O N O NH 2 N 25 30 До розчину 2-(3-(3-нітропіридин-4-іл)циклогекс-2-еніл)ізоіндолін-1,3-діону (1,0 екв.) в AcOH (0,38 M) додавали Fe (6,0 екв.) і реакційну суміш перемішували при кімнатній температурі протягом 2 год. Фільтрували, потім промивали метанолом і фільтрат концентрували. До неочищеної речовини додавали етилацетат і насичений розчин NaHCO 3, органічні речовини сушили над Na2SO4 і концентрували та одержували 2-(3-(3-амінопіридин-4-іл)циклогекс-2еніл)ізоіндолін-1,3-дион у вигляді грузлої жовтої смоли з виходом 96 %. РХ/МС = 320,0 (M+H), РХ = 2,410 хв. Синтез 2-(3-(3-амінопіридин-4-іл)циклогексил)ізоіндолін-1,3-діону 21 UA 103034 C2 O N O NH 2 N 5 10 До розчину 2-(3-(3-нітропіридин-4-іл)циклогекс-2-еніл)ізоіндолін-1,3-діону (1,0 екв.) в оцтовій кислоті (0,1 M) додавали 10 % Pd/C (0,2 екв.) і реакційну суміш перемішували в атмосфері H2, що подається з балона. Через 3 дні реакційну суміш фільтрували крізь целіт, промивали етилацетатом і метанолом, фільтрат розбавляли етилацетатом і двічі промивали 2M розчином Na2CO3. Органічну фазу сушили над сульфатом магнію, фільтрували та концентрували. Неочищену речовину розтирали з гексанами і етилацетатом та одержували 2-(3-(3амінопіридин-4-іл)циклогексил)ізоіндолін-1,3-дион з виходом 73 %. РХ/МС = 322,2 (M+H), Rt=0,64 хв. Синтез 5,5-диметил-3-оксоциклогекс-1-енілтрифторметансульфонату O 15 20 25 OTf В 3-горлечковій круглодонній колбі 5,5-диметилциклогексан-1,3-діон (1,0 екв.) розчиняли в ДХМ (0,2 M). Додавали карбонат натрію (1,1 екв.) і суміш в атмосфері N 2 при перемішуванні магнітною мішалкою в бані лід/розчин солі охолоджували до ~ -5 ºC. Ангідрид трифторметансульфонової кислоти (1,05 екв.), розведений за допомогою ДХМ, по краплях додавали крізь краплинну лійку протягом 90 хв. Після завершення додавання реакційну суміш перемішували при ~ 0 ºC протягом 1 год. За даними РХМС і 1H ЯМР ще залишалася вихідна речовина. Додатково додавали карбонат натрію (0,51 екв.) і ангідрид трифторметансульфонової кислоти (0,50 екв.). Через 2 год. суміш фільтрували крізь лійку з грубим фільтром з пористого скла (осад на фільтрі промивали за допомогою ДХМ), переносили в колбу Ерленмейера, реакційну суміш нейтралізовували до pH=7 шляхом обережного додавання насиченого водного розчину бікарбонату натрію при енергійному перемішуванні, переносили в ділильну лійку і шари розділяли. Органічний шар промивали розсолом, сушили над MgSO4, фільтрували і концентрували та одержували 5,5-диметил-3-оксоциклогекс-1енілтрифторметансульфонат, який використовували на наступній стадії без додаткового + очищення. РХ/МС (m/z): MH =273,1, Rt=1,03. Синтез 5,5-диметил-3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)циклогекс-2-енону O O 30 35 B O Усі реагенти: 5,5-диметил-3-оксоциклогекс-1-енілтрифторметансульфонат (1,0 екв.), ацетат калію (3,0 екв.), і біс(пінаколято)дибор (2,0 екв.) додавали до 1,4-діоксану (0,2 M) у круглодонній колбі і дегазували шляхом пропущення N2 крізь суміш протягом 10 хв. Додавали адукт PdCl2(dppf) - ДХМ (0,03 екв.) і реакційну суміш нагрівали в атмосфері N 2 протягом ночі при 80 ºC на олійній бані в колбі, обладнаній зворотним холодильником. Суміш охолоджували до кімнатної температури, фільтрували крізь лійку з грубим фільтром з пористого скла, осад на фільтрі промивали 1,4-діоксаном і одержували 5,5-диметил-3-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)циклогекс-2-енон в 1,4-діоксані, який використовували на наступній стадії + без додаткового очищення. РХ/МС (m/z): MH (боронова кислота) =169,1, Rt=0,50. Синтез 5,5-диметил-3-(3-нітропіридин-4-іл)циклогекс-2-енону 22 UA 103034 C2 O NO2 5 10 N Ефір боронової кислоти 5,5-диметил-3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)циклогекс-2-енону (1,0 екв.) розчиняли в 1,4-діоксані в круглодонній колбі і дегазували шляхом пропущення N2 крізь розчин протягом 30 хв. Додавали 4-хлор-3-нітропіридин (1,3 екв.) і 2M водний розчин карбонату натрію (2,0 екв.) і протягом 10 хв N 2 пропускали і потім додавали PdCl2(dppf) - ДХМ (0,05 екв.). Реакційну суміш перемішували при 110 °C протягом 2 год. Суміш додавали до EtOAc і воді. Отриману суміш фільтрували крізь целіт, осад на фільтрі промивали за допомогою EtOAc. Органічний шар відокремлювали і водний шар екстрагували за допомогою EtOAc. Об'єднані органічні шари промивали розсолом, сушили над MgSO 4, фільтрували та концентрували. Залишок очищали за допомогою хроматографії на силікагелі (елюювали сумішшю EtOAc:гексани = від 1:10 до 2:1) і одержували 5,5-диметил-3-(3-нітропіридин-4+ іл)циклогекс-2-енон (46,7 % за три стадії). РХ/МС (m/z): MH =247,2, Rt=0,79. Синтез 5,5-диметил-3-(3-нітропіридин-4-іл)циклогекс-2-енолу OH NO2 15 20 N До розчину 5,5-диметил-3-(3-нітропіридин-4-іл)циклогекс-2-енону (1,0 екв.) і CeCl3-7H2O (1,2 екв.) в MeOH (0,2 M) при 0 °C додавали NaBH4 (1,0 екв.). Розчин перемішували протягом 1 год. і потім реакцію зупиняли шляхом додавання 5 мл води. Летучі речовини видаляли у вакуумі і залишок піддавали розподілу між EtOAc і H2O. Органічний шар відокремлювали та промивали розсолом. Об'єднаний водний шар піддавали зворотній екстракції за допомогою EtOAc і органічну речовину промивали розсолом. Об'єднані органічні речовини сушили над MgSO 4, фільтрували і концентрували. Залишок очищали на колонці (5 % метанолу в суміші 1:1 етилацетату і гексанів) і одержували 5,5-диметил-3-(3-нітропіридин-4-іл)циклогекс-2-енол + (74 %). РХ/МС (m/z): MH =249,2, Rt=0,76. Синтез 2-(5,5-диметил-3-(3-нітропіридин-4-іл)- циклогекс-2-еніл)ізоіндолін-1,3-діону O N O NO2 25 30 N До гомогенного розчину 5,5-диметил-3-(3-нітропіридин-4-іл)циклогекс-2-енолу (1,0 екв.) додавали трифенілфосфін (1,5 екв.) і фталімід (1,5 екв.) у ТГФ (0,2 M), охолоджені до 0 °C, до розчину додавали ди-трет-бутилазодикарбоксилат (1,5 екв.) у ТГФ. Суміш перемішували при 0 °C протягом 2 год. Реакційну суміш концентрували у вакуумі. Залишок очищали на колонці (5 % метанолу в суміші 1:1 етилацетату і гексанів) і одержували 2-(5,5-диметил-3-(3+ нітропіридин-4-іл)циклогекс-2-еніл)ізоіндолін-1,3-діон (99 %). РХ/МС (m/z): MH =378,2, Rt=1,10. Синтез 2-(3-(3-амінопіридин-4-іл)-5,5-диметилциклогекс-2-еніл)ізоіндолін-1,3-діону 23 UA 103034 C2 O N O NH 2 5 10 N Розчин 2-(5,5-диметил-3-(3-нітропіридин-4-іл)циклогекс-2-еніл)ізоіндолін-1,3-діону (1 екв.) в оцтовій кислоті (0,1 M) продували азотом протягом 10 хв. Потім додавали 10 % Pd/C (0,10 екв.). Реакційну суміш перемішували при кімнатній температурі протягом ночі в атмосфері водню. Тверді речовини видаляли фільтруванням крізь целіт, потім промивали за допомогою EtOAc і MeOH. Фільтрат концентрували, розбавляли за допомогою EtOAc і 2 промивали 2M водним розчином Na2CO3. Органічний шар сушили над MgSO4, фільтрували і концентрували. Залишок очищали на колонці (5 % метанолу в суміші 1:1 етилацетату і гексанів) і одержували 2-(3-(3амінопіридин-4-іл)-5,5-диметилциклогекс-2-еніл)ізоіндолін-1,3-діон (89 %). РХ/МС (m/z): + MH =348,3, Rt=0,79. Синтез 2-(5-(3-амінопіридин-4-іл)-3,3-диметилциклогексил)ізоіндолін-1,3-діону O N O NH 2 15 20 25 N Розчин 2-(3-(3-амінопіридин-4-іл)-5,5-диметилциклогекс-2-еніл)ізоіндолін-1,3-діону (1,0 екв.) в оцтовій кислоті (0,1 M) продували азотом протягом 10 хв. Потім 10 % Pd/C (0,1 екв.) додавали. 2 Реакційну суміш перемішували при 45 °C при тиску водню, рівному 300 фунт-сила/дюйм , у 2 сталевому автоклаві протягом ночі і при 65 °C при 300 фунт-сила/дюйм протягом 5 год. Тверді речовини видаляли фільтруванням крізь целіт, потім промивали за допомогою EtOAc і MeOH. Фільтрат концентрували, розбавляли за допомогою EtOAc і 2 промивали 2M водним розчином Na2CO3. Органічний шар сушили над MgSO4, фільтрували і концентрували. Залишок очищали на колонці (5 % метанолу в суміші 1:1 етилацетату і гексанів) і одержували 2-(5-(3-амінопіридин+ 4-іл)-3,3-диметилциклогексил)ізоіндолін-1,3-діон (53 %). РХ/МС (m/z): MH =350,3, Rt=0,78. Енантіомерно чисті 2-((1R, 5R)-5-(3-амінопіридин-4-іл)-3,3-диметилциклогексил)ізоіндолін-1,3діон і 2-((1S, 5S)-5-(3-амінопіридин-4-іл)-3,3-диметилциклогексил)ізоіндолін-1,3-діон виділяли за допомогою хіральної ВЕРХ (для аналізу Rt=7,526 хв і 13,105 хв відповідно; гексани:етанол= 80:20 (об.:об.), Chiralcel OJ-H 1004,6 мм при 1 мл/хв. Для препаративного поділу, 1 гексани:етанол = 80:20 (об.:об.), Chiralcel OJ-H (25020 мм при 20 мл/хв). H ЯМР (CDCl3): 8,04 (s, 1H), 8,00 (d, 1H), 7,82 (m, 2H), 7,71 (m, 2H), 7,06 (d, 1H), 4,54 (m, 1H), 3,71 (m, 2H), 2,89 (m, 1H), 2,23-2,44 (m, 2H), 1,90 (m, 1H), 1,20-1,60 (m, 3H), 1,18 (s, 3H), 1,07 (s, 3H). Синтез 4-(циклогекса-1,3-диеніл)-3-нітропіридину NO 2 30 35 N До розчину 3-(3-нітропіридин-4-іл)циклогекс-2-енолу (1,0 екв.) додавали діоксан (0,18 M) і пТСК (п-толуолсульфонова кислота) (1,1 екв.). Розчин нагрівали при 100 °C протягом 4 год. Охолоджували до кімнатної температури, обробляли насиченим розчином NaHCO 3 і етилацетатом, органічну фазу сушили над Na2SO4 і концентрували. Неочищену речовину очищали за допомогою колонкової хроматографії на силікагелі при елююванні за допомогою 100 % ДХМ і одержували 4-(циклогекса-1,3-диеніл)-3-нітропіридин у вигляді жовтої олії (вихід + 1 27 %). РХМС (m/z): 203,1 (MH ), РХ Rt=3,53 хв, H-ЯМР (CDCl3): 9,02 (s, 1H), 8,70 (d, J=5,3, 1H), 24 UA 103034 C2 7,30 (d, J=5,3, 1H), 6,15-6,17 (m, 1H), 6,02-6,11 (m, 2H), 2,35-2,38 (m, 4H). Синтез (+/-)-2-азидо-4-(3-нітропіридин-4-іл)циклогекс-3-енолу OH N3 NO 2 5 10 15 N До розчину 4-(циклогекса-1,3-диеніл)-3-нітропіридину (1,0 екв.) у ДХМ (0,1 M) додавали NaHCO3 (1,2 екв.) і одержували жовтий розчин. Охолоджували до 0 ºC, потім до розчину однією порцією додавали МХПБК (1,0 екв.) у вигляді твердої речовини. Реакційну суміш перемішували при 0 ºC протягом 3,5 год. За протіканням реакції стежили за допомогою ТШХ і РХ/МС. Продукт іонізується у вигляді M+H=237 (діол); Rt=0,41 хв в UPLC. Реакцію зупиняли насиченим розчином NaHCO3, потім екстрагували за допомогою ДХМ (3 рази). Органічну фазу додатково промивали розсолом, потім сушили над Na2SO4, фільтрували і концентрували та одержували неочищений епоксид у вигляді жовтої олії, яку використовували без додаткового очищення. До розчину отриманої вище неочищеної речовини в EtOH і воді (3:1) (мутний жовтий розчин) додавали NaN3 (2,0 екв.) і NH4Cl (2,0 екв.) і одержували прозорий жовтогарячий розчин. Реакційну суміш перемішували протягом 16 год., потім концентрували. EtOAc і додавали воду, органічну фазу додатково сушили над MgSO4 і концентрували та одержували коричневу олію. Олію завантажували в силікагель і очищали за допомогою колонкової хроматографії (ISCO, 050 % EtOAc) і одержували (+/-)-2-азидо-4-(3-нітропіридин-4-іл)циклогекс-3-енол у вигляді жовтої + олії (44 % за 2 стадії). РХМС (m/z) = 262 (MH ), РХ Rt=2,35 хв. Синтез (+/-)-4-(3-азидо-4-(трет-бутилдиметилсилілокси)циклогекс-1-еніл)-3-нітропіридину OTBS N3 NO 2 20 25 N До розчину (+/-)-2-азидо-4-(3-нітропіридин-4-іл)циклогекс-3-енолу (1,0 екв.) у ДХМ (0,15 M) при кімнатній температурі додавали TBSCl (2,0 екв.), імідазол (2,0 екв.) і ДМАП (0,1 екв.). Через 18 год. додавали воду, органічні речовини промивали розсолом, потім сушили над Na 2SO4 і концентрували. Неочищену речовину завантажували в силікагель і очищали за допомогою колонкової хроматографії (ISCO) при елююванні етилацетатом і гексанами (20 %). (+/-)-4-(3Азидо-4-(трет-бутилдиметилсилілокси)циклогекс-1-еніл)-3-нітропіридин одержували у вигляді + жовтої олії з виходом 60 %. РХМС (m/z): 376,3 (MH ), РХ Rt=5,848 хв. Синтез (+/-)-трет-бутил-6-(трет-бутилдиметилсилілокси)-3-(3-нітропіридин-4-іл)циклогекс-2енілкарбамату OTBS NHBoc NO2 N 30 35 У круглодонну колбу додавали (+/-)-4-(3-азидо-4-(трет-бутилдиметилсилілокси)циклогекс-1еніл)-3-нітропіридин (1,0 екв.) і піридин (0,1 M) і одержували жовтий розчин. Додавали гідроксид амонію (10:1 піридин: гідроксид амонію), потім PMe3 (3,0 екв.). Через 10 хв реакційна суміш ставала темно-коричневою. Перемішували при кімнатній температурі протягом 1,5 год. Реакцію зупиняли шляхом додавання EtOH і концентрували. Повторювали ще 2 рази. До неочищеної речовини додавали насичений розчин NaHCO3 і діоксан (1:1, 0,1M). Додавали Boc2O (1,0 екв.). 25 UA 103034 C2 5 Перемішували протягом 1 год. при кімнатній температурі. Промивали за допомогою H2O і EtOAc, органічну фазу сушили над MgSO4, фільтрували і концентрували. Залишок очищали за допомогою колонкової хроматографії на силікагелі (ISCO, 5:1 Hex/EtOAc). Чисті фракції збирали і концентрували та одержували (+/-)-трет-бутил-6-(трет-бутилдиметилсилілокси)-3-(3нітропіридин-4-іл)циклогекс-2-енілкарбамат у вигляді спіненої речовини. РХМС (m/z): 450,3 + (MH ), РХ Rt=5,83 хв. Синтез (+/-)-трет-бутил-3-(3-амінопіридин-4-іл)-6-(трет-бутилдиметилсилілокси)циклогекс-2енілкарбамату OTBS NHBoc NH 2 10 15 N До розчину (+/-)-трет-бутил-6-(трет-бутилдиметилсилілокси)-3-(3-нітропіридин-4іл)циклогекс-2-енілкарбамату (1,0 екв.) в AcOH (0,18 M) додавали Fe (6,0 екв.) і реакційну суміш перемішували протягом 20 год. Обробляли шляхом розведення реакційної суміші метанолом, фільтрували і фільтрат концентрували. До неочищеної речовини додавали етилацетат і насичений розчин NaHCO3, органічні речовини сушили над сульфатом натрію і концентрували та одержували (+/-)-трет-бутил-3-(3-амінопіридин-4-іл)-6-(третбутилдиметилсилілокси)циклогекс-2-енілкарбамат у вигляді жовтої олії з виходом 94 %. РХМС + (m/z): 420,3 (MH ), РХ Rt=3,88 хв. Синтез (+/-)-трет-бутил-5-(3-амінопіридин-4-іл)-2-(третбутилдиметилсилілокси)циклогексилкарбамату OTBS NHBoc NH 2 20 25 30 N До розчину (+/-)-трет-бутил-3-(3-амінопіридин-4-іл)-6-(третбутилдиметилсилілокси)циклогекс-2-енілкарбамату (1,0 екв.) в MeOH (0,1 M) додавали Pd/C (20 мас. %) і реакційну суміш перемішували в атмосфері водню, що подається з балону, протягом 18 год. РХ/МС реакційної суміші вказувала на наявність диастереоізомерів, реакційну суміш фільтрували, промивали за допомогою EtOAc і фільтрат концентрували. Неочищену речовину очищали за допомогою препаративної ВЕРХ (у ДМСО - диметилсульфоксид) і чисті фракції поєднували, нейтралізовували твердим NaHCO 3, екстрагували етилацетатом, промивали розсолом, сушили над Na2SO4 і концентрували та одержували продукт A (вихід 8 %) і продукт B (вихід 51 %). + Продукт A: РХМС (m/z): 422,4 (MH ), РХ Rt=3,75 хв. + Продукт B: РХМС (m/z): 422,4 (MH ), РХ Rt=3,94 хв. Синтез 1,4-діоксаспіро[4,5]дец-7-ен-8-ілтрифторметансульфонату O 35 O OTf 1,4-Діоксаспіро[4,5]декан-8-он (1,0 екв.) розчиняли в ефірі (0,1 M) і перемішували при -15 °C потім додавали 1M NaHMDS (1,05 екв.) і перемішували протягом 70 хв, потім додавали Tf 2O (1,05 екв.) і реакційній суміші давали повільно нагрітися до КТ. Суміш перемішували протягом 28 год., промивали насиченим водним розчином NaHCO 3 і потім водою. Водні шари поєднували і екстрагували ефіром. Органічні шари поєднували, сушили над MgSO 4, фільтрували та концентрували. Залишок очищали на колонці (етиловий ефір: гексани = 1:4) і одержували 1,4 26 UA 103034 C2 + діоксаспіро[4,5]дец-7-ен-8-ілтрифторметансульфонат (65 %). РХ/МС (m/z): MH =289,0, Rt=0,97. ВЕРХ Rt=3,77. Синтез 4,4,5,5-тетраметил-2-(1,4-діоксаспіро[4,5]дец-7-ен-8-іл)-1,3,2-діоксаборолану O O 5 10 O B O Розчин 1,4-діоксаспіро[4,5]дец-7-ен-8-ілтрифторметансульфонату (1,0 екв.) у діоксані (0,5 M) продували азотом протягом 30 хв. Потім додавали 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2діоксаборолан) (1,0 екв.), KOAc (3,0 екв.), Pd(dppf)Cl2-ДХМ (0,2 екв.) і розчин перемішували в закритому автоклаві при 80 °C. Реакційну суміш фільтрували крізь шар целіту, потім до фільтрату додавали етилацетат і промивали розсолом, сушили над MgSO 4, фільтрували та концентрували. Залишок очищали на колонці (етилацетат: гексани = 1:1) і одержували 4,4,5,5тетраметил-2-(1,4-діоксаспіро[4,5]дец-7-ен-8-іл)-1,3,2-діоксаборолан (95 %). РХ/МС (m/z): + MH =267,1, Rt=0,95. Синтез 3-нітро-4-(1,4-діоксаспіро[4,5]дец-7-ен-8-іл)піридину O O NO2 15 20 N Розчин ДМЕ (0,2 M) і 2M водний розчин карбонату натрію (1,7 екв.) продували азотом протягом 20 хв. Потім додавали 4-хлор-3-нітропіридин (1,6 екв.), 4,4,5,5-тетраметил-2-(1,4діоксаспіро[4,5]дец-7-ен-8-іл)-1,3,2-діоксаборолан (1,0 екв.), Pd(dppf)Cl2-ДХМ (0,05 екв.) і перемішували в закритому автоклаві при 110 °C. Реакційну суміш перемішували при цій температурі протягом 3,5 год. Реакційну суміш розбавляли етилацетатом, промивали водою, сушили над MgSO4, фільтрували та концентрували. Залишок очищали на колонці (етилацетат: гексани = 1:1 з додаванням 10 % метанолу) і одержували 3-нітро-4-(1,4-діоксаспіро[4,5]дец-7-ен+ 8-іл)піридин (83 %). РХ/МС (m/z): MH =263,2, Rt=0,71. Синтез 4-(3-нітропіридин-4-іл)циклогекс-3-енону O NO2 25 30 N Суміш 3-нітро-4-(1,4-діоксаспіро[4,5]дец-7-ен-8-іл)піридину (1,0 екв.) в 20 % ТФК в CH2Cl2 (0,2 M) перемішували при кімнатній температурі протягом ночі. Розчинники видаляли при зниженому тиску. Залишок розчиняли в етилацетаті (200 мл) і промивали насиченим розчином NaHCO3 (30 мл) і насиченим розчином NaCl (30 мл). Органічні речовини сушили над MgSO4, фільтрували і концентрували та одержували 4-(3-нітропіридин-4-іл)циклогекс-3-енон (85 %). Неочищений продукт використовували на наступній стадії без додаткового очищення. РХ/МС + (m/z): MH =218,9, Rt=0,60 Синтез 4-(3-нітропіридин-4-іл)циклогекс-3-енолу 27 UA 103034 C2 OH NO2 5 N До розчину 4-(3-нітропіридин-4-іл)циклогекс-3-енону (1,0 екв.) у метанолі (0,2 M) при 0 °C додавали борогідрид натрію (1,8 екв.). Реакційну суміш перемішували при 0 °C протягом 2 год. Метанол видаляли при зниженому тиску. Залишок розчиняли в етилацетаті (200 мл) і промивали насиченим розчином NaCl (30 мл). Органічні речовини сушили над MgSO 4, фільтрували і концентрували та одержували 4-(3-нітропіридин-4-іл)циклогекс-3-енол (85 %). Неочищений продукт використовували на наступній стадії без додаткового очищення. РХ/МС + (m/z): MH =221,0, Rt=0,55 Синтез 4-(3-нітропіридин-4-іл)циклогекс-3-енілметансульфонату OMs NO2 10 15 N До розчину 4-(3-нітропіридин-4-іл)циклогекс-3-енолу (1,0 екв.) і ДІПЕА (диізопропілетиламін) (2,5 екв.) в CH2Cl2 (0,15 M) при 0 °C додавали метансульфонілхлорид (1,8 екв.). Реакційну суміш перемішували при 0 °C протягом 1 год. Реакційну суміш розбавляли етилацетатом (200 мл) і промивали насиченим розчином NaCl (30 мл). Органічні речовини сушили над MgSO 4, фільтрували і концентрували та одержували 4-(3-нітропіридин-4-іл)циклогекс-3енілметансульфонат (93 %). Залишок використовували на наступній стадії без додаткового + очищення. РХ/МС (m/z): MH =299,0, Rt=0,70 Синтез 4-(циклогекса-1,3-диеніл)-3-нітропіридину NO2 20 25 N До розчину 4-(3-нітропіридин-4-іл)циклогекс-3-енілметансульфонату (1,0 екв.) у тетрагідрофурані (0,1 M) при кімнатній температурі додавали ДБУ (1,8диазабіцикло[5.4.0]ундец-7-ен) (1,8 екв.). Реакційну суміш перемішували при КТ протягом ночі. Реакційну суміш розбавляли етилацетатом (200 мл) і промивали насиченим розчином NaCl (30 мл). Органічні речовини сушили над MgSO 4, фільтрували та концентрували. Залишок очищали на колонці (5 % метанолу в суміші 1:1 етилацетату і гексанів) і одержували 4-(циклогекса-1,3+ диеніл)-3-нітропіридин. РХ/МС (m/z): MH =203,2, Rt=0,85. Синтез (+/-)-трет-бутил-6-гідрокси-3-(3-нітропіридин-4-іл)циклогекс-2-енілкарбамату OH NHBoc NO 2 30 N До розчину (+/-)-2-азидо-4-(3-нітропіридин-4-іл)циклогекс-3-енолу (1,0 екв.) у піридині і NH4OH (8:1, 0,23 M) при кімнатній температурі додавалитриметилфосфін (3,0 екв.). Суміш перемішували при кімнатній температурі протягом 3 год. Розчинники видаляли. До залишку додавали етанол. Потім етанол видаляли у вакуумі для забезпечення повного видалення 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPicolinamide derivatives as kinase inhibitors
Автори російськоюBurger, Matthew, T., Han, Wooseok, Lan, Jiong, Nishiguchi, Gisele
МПК / Мітки
МПК: A61K 31/444, A61P 35/00, C07D 401/14, C07D 401/12
Мітки: похідні, кінази, інгібітори, піколінаміду
Код посилання
<a href="https://ua.patents.su/160-103034-pokhidni-pikolinamidu-yak-ingibitori-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні піколінаміду як інгібітори кінази</a>
Попередній патент: Спосіб одержання дикарбонових кислот за низьких рн
Наступний патент: Крило літального апарата
Випадковий патент: Відновлююча суміш для виплавки феросплавів