Похідні феніламінопіримідину як інгібітори bcr-abl кінази
Номер патенту: 94570
Опубліковано: 25.05.2011
Автори: Компелла Амала кішан, Адібхатла Калі Сатія Бхуджанга рао, Рачаконда Среенівас, Венкаіах Чоударі Наннапанені, Поділі Кхадгапатхі
Формула / Реферат
1. Феніламінопіридопіримідин формули (І)
 ,(I)
,(I)
де X є СН або N, n=1 або 2, і R є Н або СН3; або
його фармацевтично прийнятна сіль.
2. Сполука за п. 1, де X є N, n=1, і R є Н або СН3; або її фармацевтично прийнятна сіль.
3. Сполука за п. 1, де X є СН, n=1 або 2, і R є Н або СН3; або її фармацевтично прийнятна сіль.
4. Сполука за будь-яким з пп. 1-3, в якій:
якщо n=1, трифторметильна група приєднана до ароматичного кільця в положенні 3; і
якщо n=2 і Х-СН, перша трифторметильна група приєднана до ароматичного кільця в положенні 3 та друга трифторметильна група приєднана до ароматичного кільця в положенні 5.
5. Сполука за будь-яким з пп. 1-4, де R є СН3.
6. Сполука за будь-яким з пп. 1-5:
де R є метил, X є СН, і n=1;
де R є метил, X є СН, і n=2;
де R є метил, X є N, і n=1;
де R є метил, X є N, Y є відсутнім, і n=2; або
її фармацевтично прийнятна сіль.
7. Сполука за будь-яким з пп. 1-6, якою є:
(3-трифторметил)-N-[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)-феніл]-бензамід;
(3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)-феніл]-бензамід;
(2-трифторметил)-N-[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)-феніл]-бензамід;
(6-трифторметил)-N-[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)-феніл]-нікотинамід;
(5-трифторметил)-N-[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)-феніл]-нікотинамід; або її фармацевтично прийнятна сіль.
8. Сполука за будь-яким з пп. 1-7, якою є (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)-феніл]-бензамід; або її фармацевтично прийнятна сіль.
9. Сполука, вибрана з групи:
(3,5-біс-трифторметил)-N-(4-метил-3-нітрофеніл)-бензамід;
(2-трифторметил)-N-(4-метил-3-нітрофеніл)-бензамід;
(6-трифторметил)-N-(4-метил-3-нітрофеніл)-нікотинамід;
(5-трифторметил)-М-(4-метил-3-нітрофеніл)-нікотинамід; або
її фармацевтично прийнятна сіль.
10. Сполука за п. 9, якою є (3,5-біс-трифторметил)-N-(4-метил-3-нітрофеніл)-бензамід; або її фармацевтично прийнятна сіль.
11. Сполука Формули XV
 , (XV)
, (XV)
де X є СН або N, n=1 або 2, і R є Н або СН3; або
її фармацевтично прийнятна сіль.
12. Сполука за п. 11:
де R є метил, X є СН і n=2;
де R є метил, X є СН, і n=1;
де R є метил, X є N і n=1; або
де R є метил, X є N і n=2.
13. Сполука за п. 11 або 12, вибрана з:
(3,5-біс-трифторметил)-N-(3-гуанідино-4-метилфеніл)-бензамід;
(3-трифторметил)-N-(3-гуанідино-4-метилфеніл)-4-бензамід;
(2-трифторметил)-N-(3-гуанідино-4-метилфеніл)-бензамід;
(6-трифторметил)-N-(3-гуанідино-4-метилфеніл)-нікотинамід;
(5-трифторметил)-N-(3-гуанідино-4-метилфеніл)-нікотинамід;
або її фармацевтично прийнятна сіль.
14. Сполука за будь-яким з пп. 11-13, якою є (3,5-біс-трифторметил)-N-(3-гуанідино-4-метилфеніл]-бензамід; або її фармацевтично прийнятна сіль.
15. Спосіб одержання феніламінопіридопіримідину за будь-яким з пп. 1-9 формули І
 , (I)
, (I)
де X є СН або N, n=1 або 2, і R є Н або СН3; або його фармацевтично прийнятної солі;
спосіб, який відрізняється тим, що здійснюють: конденсацію 4-метил-3-нітроаніліну формули XI
 , (XI)
, (XI)
де R має значення, наведене вище;
з трифторметилароїлхлоридами формули XII;
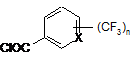 , (XII)
, (XII)
де X і n мають значення, наведені вище;
в присутності хлорвуглеводневого розчинника та основи з одержанням проміжної сполуки нітротрифторметилароїламіду формули XIII
 , (XIII)
, (XIII)
де X, n і R мають значення, наведені вище;
відновлення сполуки формули XIII з використанням відновлювального агента метал/кислота при температурі в інтервалі 0-5 °С з одержанням проміжної сполуки амінотрифторметилароїламіду формули XIV
 , (XIV)
, (XIV)
де X, n і R мають значення, наведені вище;
конденсацію сполуки формули XIV з ціанамідом (CNNH2) при температурі в інтервалі від 60 до 95 °С в присутності полярного розчинника та неорганічної кислоти з одержанням проміжної сполуки солі гуанідинотрифторметилароїламіду формули XV
 , (XV)
, (XV)
де X, n і R мають значення, наведені вище;
конденсацію сполуку формули XV з сполукою формули XVI
 , (XVI)
, (XVI)
в присутності основи з одержанням сполуки формули І; та
за бажанням перетворення сполуки формули І на фармацевтично прийнятну сіль.
16. Спосіб за п. 15, який відрізняється тим, що основа, яку використовують на стадії конденсації сполуки формули XV з сполукою формули XVI, містить гідроксид калію або гідроксид натрію.
17. Спосіб за п. 15 або 16, який відрізняється тим, що хлорвуглеводневим розчинником є хлороформ, метиленхлорид або етиленхлорид, і краще хлороформ; та/або основою, яку використовують в перетворенні сполуки формули (XII) на сполуку формули (XIII), є триетиламін, дипропіламін або діізопропіламін, і краще триетиламін.
18. Спосіб за будь-яким з пп. 15-17, який відрізняється тим, що відновлювальним агентом метал/кислота є:
дихлорид олова і концентрована НСl,
залізо і концентрована НСl, або
цинк і концентрована НСl,
і краще дихлорид олова і концентрована НСl.
19. Спосіб одержання солі гуанідинотрифторметилароїламіду за будь-яким з пп. 11-14 формули XV
 , (XV)
, (XV)
де X є СН або N, n=1 або 2, і R є Н або СН3;
в якому здійснюють:
конденсацію сполуки за формулою XIV
 , (XIV)
, (XIV)
де X, n і R мають значення, наведені вище;
з ціанамідом (CNNH2) при температурі в інтервалі від 60 до 95 °С в присутності полярного розчинника та неорганічної кислоти з одержанням проміжних солей гуанідинотрифторметилароїламіду формули XV.
20. Спосіб за будь-яким з пп. 15-19, який відрізняється тим, що:
полярним розчинником є н-пропанол, ізопропанол, етанол, н-бутанол або їх суміші, і краще є н-бутанол; та/або температура для конденсації сполуки за формулою XIV з ціанамідом може знаходитись в інтервалі 90-95 °С.
21. Спосіб одержання феніламінопіридопіримідину за будь-яким з пп. 1-9 формули І
 , (I)
, (I)
де X є CH або N, n=1 або 2, і R є СН3; або його фармацевтично прийнятної солі;
в якому здійснюють:
конденсацію N-(5-аміно-2-метилфеніл)-4-(3-піридил)-2-піримідинаміну формули XVII
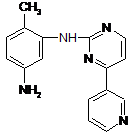 , (XVII)
, (XVII)
з трифторметилароїлхлоридом формули XII
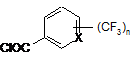 (XII)
(XII)
з одержанням сполуки формули І.
22. Фармацевтична композиція для лікування лейкемії, яка містить:
феніламінопіридопіримідин за будь-яким з пп. 1-9; і
фармацевтично прийнятний носій.
23. Фармацевтична композиція за п. 22, яка відрізняється тим, що фармацевтично прийнятний носій придатний для місцевого, парентерального або ентерального (наприклад орального або ректального) введення; і/або
фармацевтично прийнятний носій являє собою неорганічні, органічні, тверді, рідкі агенти або їх комбінації.
24. Фармацевтична композиція за пп. 22 або 23, яка, крім того, містить наповнювачі, допоміжні речовини, розбавлювачі, зв'язувальні агенти, ароматизатори, підсилювачі смаку, фармацевтично прийнятні барвники або їх суміші.
25. Фармацевтична композиція за п. 24, яка відрізняється тим, що розбавлювачем є мікрокристалічна целюлоза, мікроволокниста целюлоза, лактоза, крохмаль, прежелатинізований крохмаль, кальцію карбонат, кальцію сульфат, цукор, декстрати, декстрин, декстроза, дигідрат двозаміщеного кальцію фосфату, тризаміщений кальцію фосфат, каолін, магнію карбонат, магнію оксид, мальтодекстрин, манітол, поліметакрилати, калію хлорид, целюлоза у формі порошку, натрію хлорид, сорбітол і тальк або їх суміші.
26. Фармацевтична композиція за п. 24, яка відрізняється тим, що зв'язувальним агентом є акацієва камедь, альгінова кислота, карбомер, натрій карбоксиметилцелюлоза, декстрин, етилцелюлоза, желатин, гуарова камедь, гідрогенізована рослинна олія, гідроксіетилцелюлоза, гідроксипропілцелюлоза, гідроксипропілметилцелюлоза, розчин глюкози, магнію алюмінію силікат, мальтодекстрин, метилцелюлоза, поліметакрилати, повідон (наприклад, Kollidon(R), Plasdone(R)), прежелатинізований крохмаль, натрію альгінат, крохмаль або їх суміші.
27. Фармацевтична композиція за п. 24, яка відрізняється тим, що ароматизатором або підсилювачем смаку є мальтол, ванілін, етилванілін, ментол, лимонна кислота, фумарова кислота, етилмальтол, винна кислота або їх суміші.
28. Фармацевтична композиція за п. 24, яка відрізняється тим, що містить сполуку формули (І), полівінілпіролідон, лактозу, тальк, кросповідон, стеарат магнію і лаурилсульфат натрію.
29. Фармацевтична композиція за п. 22, яка відрізняється тим, що лейкемією є хронічна мієлоїдна лейкемія або гостра лімфобластна лейкемія.
30. Фармацевтична композиція для лікування BCR-abl позитивних ракових та пухлинних захворювань, яка містить феніламінопіридопіримідин за будь-яким з пп. 1-9.
Текст
1. Феніламінопіридопіримідин формули (І) 2 3 94570 (5-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-нікотинамід; або її фармацевтично прийнятна сіль. 8. Сполука за будь-яким з пп. 1-7, якою є (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-бензамід; або її фармацевтично прийнятна сіль. 9. Сполука, вибрана з групи: (3,5-біс-трифторметил)-N-(4-метил-3-нітрофеніл)бензамід; (2-трифторметил)-N-(4-метил-3-нітрофеніл)бензамід; (6-трифторметил)-N-(4-метил-3-нітрофеніл)нікотинамід; (5-трифторметил)-М-(4-метил-3-нітрофеніл)нікотинамід; або її фармацевтично прийнятна сіль. 10. Сполука за п. 9, якою є (3,5-біс-трифторметил)N-(4-метил-3-нітрофеніл)-бензамід; або її фармацевтично прийнятна сіль. 11. Сполука Формули XV 4 який відрізняється тим, що здійснюють: конденсацію 4-метил-3-нітроаніліну формули XI NO2 NH 2 R , (XI) де R має значення, наведене вище; з трифторметилароїлхлоридами формули XII; X (CF3)n ClOC , (XII) де X і n мають значення, наведені вище; в присутності хлорвуглеводневого розчинника та основи з одержанням проміжної сполуки нітротрифторметилароїламіду формули XIII O2 N NH NH HN H N X (CF3)n O R , (XV) де X є СН або N, n=1 або 2, і R є Н або СН3; або її фармацевтично прийнятна сіль. 12. Сполука за п. 11: де R є метил, X є СН і n=2; де R є метил, X є СН, і n=1; де R є метил, X є N і n=1; або де R є метил, X є N і n=2. 13. Сполука за п. 11 або 12, вибрана з: (3,5-біс-трифторметил)-N-(3-гуанідино-4метилфеніл)-бензамід; (3-трифторметил)-N-(3-гуанідино-4-метилфеніл)-4бензамід; (2-трифторметил)-N-(3-гуанідино-4-метилфеніл)бензамід; (6-трифторметил)-N-(3-гуанідино-4-метилфеніл)нікотинамід; (5-трифторметил)-N-(3-гуанідино-4-метилфеніл)нікотинамід; або її фармацевтично прийнятна сіль. 14. Сполука за будь-яким з пп. 11-13, якою є (3,5біс-трифторметил)-N-(3-гуанідино-4-метилфеніл]бензамід; або її фармацевтично прийнятна сіль. 15. Спосіб одержання феніламінопіридопіримідину за будь-яким з пп. 1-9 формули І H N N H N X (CF3)n (CF3)n O R H2N X , (XIII) де X, n і R мають значення, наведені вище; відновлення сполуки формули XIII з використанням відновлювального агента метал/кислота при температурі в інтервалі 0-5 °С з одержанням проміжної сполуки амінотрифторметилароїламіду формули XIV H2 N NH X (CF3)n O R , (XIV) де X, n і R мають значення, наведені вище; конденсацію сполуки формули XIV з ціанамідом (CNNH2) при температурі в інтервалі від 60 до 95°С в присутності полярного розчинника та неорганічної кислоти з одержанням проміжної сполуки солі гуанідинотрифторметилароїламіду формули XV NH H2N HN R H N X (CF3)n O , (XV) де X, n і R мають значення, наведені вище; конденсацію сполуку формули XV з сполукою формули XVI NMe2 O N O R N , (I) де X є СН або N, n=1 або 2, і R є Н або СН3; або його фармацевтично прийнятної солі; N , (XVI) в присутності основи з одержанням сполуки формули І; та 5 94570 за бажанням перетворення сполуки формули І на фармацевтично прийнятну сіль. 16. Спосіб за п. 15, який відрізняється тим, що основа, яку використовують на стадії конденсації сполуки формули XV з сполукою формули XVI, містить гідроксид калію або гідроксид натрію. 17. Спосіб за п. 15 або 16, який відрізняється тим, що хлорвуглеводневим розчинником є хлороформ, метиленхлорид або етиленхлорид, і краще хлороформ; та/або основою, яку використовують в перетворенні сполуки формули (XII) на сполуку формули (XIII), є триетиламін, дипропіламін або діізопропіламін, і краще триетиламін. 18. Спосіб за будь-яким з пп. 15-17, який відрізняється тим, що відновлювальним агентом метал/кислота є: дихлорид олова і концентрована НСl, залізо і концентрована НСl, або цинк і концентрована НСl, і краще дихлорид олова і концентрована НСl. 19. Спосіб одержання солі гуанідинотрифторметилароїламіду за будь-яким з пп. 11-14 формули XV NH H2N H N HN (CF3)n X O R , (XV) де X є СН або N, n=1 або 2, і R є Н або СН3; в якому здійснюють: конденсацію сполуки за формулою XIV H2 N NH X (CF3)n O R , (XIV) де X, n і R мають значення, наведені вище; з ціанамідом (CNNH2) при температурі в інтервалі від 60 до 95 °С в присутності полярного розчинника та неорганічної кислоти з одержанням проміжних солей гуанідинотрифторметилароїламіду формули XV. 20. Спосіб за будь-яким з пп. 15-19, який відрізняється тим, що: полярним розчинником є н-пропанол, ізопропанол, етанол, н-бутанол або їх суміші, і краще є нбутанол; та/або температура для конденсації сполуки за формулою XIV з ціанамідом може знаходитись в інтервалі 90-95 °С. 21. Спосіб одержання феніламінопіридопіримідину за будь-яким з пп. 1-9 формули І H N N N H N X (CF3)n O R N , (I) 6 де X є CH або N, n=1 або 2, і R є СН3; або його фармацевтично прийнятної солі; в якому здійснюють: конденсацію N-(5-аміно-2-метилфеніл)-4-(3піридил)-2-піримідинаміну формули XVII CH3 N NH N NH2 N , (XVII) з трифторметилароїлхлоридом формули XII ClOC X (CF3)n (XII) з одержанням сполуки формули І. 22. Фармацевтична композиція для лікування лейкемії, яка містить: феніламінопіридопіримідин за будь-яким з пп. 1-9; і фармацевтично прийнятний носій. 23. Фармацевтична композиція за п. 22, яка відрізняється тим, що фармацевтично прийнятний носій придатний для місцевого, парентерального або ентерального (наприклад орального або ректального) введення; і/або фармацевтично прийнятний носій являє собою неорганічні, органічні, тверді, рідкі агенти або їх комбінації. 24. Фармацевтична композиція за пп. 22 або 23, яка, крім того, містить наповнювачі, допоміжні речовини, розбавлювачі, зв'язувальні агенти, ароматизатори, підсилювачі смаку, фармацевтично прийнятні барвники або їх суміші. 25. Фармацевтична композиція за п. 24, яка відрізняється тим, що розбавлювачем є мікрокристалічна целюлоза, мікроволокниста целюлоза, лактоза, крохмаль, прежелатинізований крохмаль, кальцію карбонат, кальцію сульфат, цукор, декстрати, декстрин, декстроза, дигідрат двозаміщеного кальцію фосфату, тризаміщений кальцію фосфат, каолін, магнію карбонат, магнію оксид, мальтодекстрин, манітол, поліметакрилати, калію хлорид, целюлоза у формі порошку, натрію хлорид, сорбітол і тальк або їх суміші. 26. Фармацевтична композиція за п. 24, яка відрізняється тим, що зв'язувальним агентом є акацієва камедь, альгінова кислота, карбомер, натрій карбоксиметилцелюлоза, декстрин, етилцелюлоза, желатин, гуарова камедь, гідрогенізована рослинна олія, гідроксіетилцелюлоза, гідроксипропілцелюлоза, гідроксипропілметилцелюлоза, розчин глюкози, магнію алюмінію силікат, мальтодекстрин, метилцелюлоза, поліметакрилати, повідон (наприклад, Kollidon(R), Plasdone(R)), прежелатинізований крохмаль, натрію альгінат, крохмаль або їх суміші. 27. Фармацевтична композиція за п. 24, яка відрізняється тим, що ароматизатором або підсилювачем смаку є мальтол, ванілін, етилванілін, мен 7 94570 8 тол, лимонна кислота, фумарова кислота, етилмальтол, винна кислота або їх суміші. 28. Фармацевтична композиція за п. 24, яка відрізняється тим, що містить сполуку формули (І), полівінілпіролідон, лактозу, тальк, кросповідон, стеарат магнію і лаурилсульфат натрію. 29. Фармацевтична композиція за п. 22, яка відрізняється тим, що лейкемією є хронічна мієлоїдна лейкемія або гостра лімфобластна лейкемія. 30. Фармацевтична композиція для лікування BCR-abl позитивних ракових та пухлинних захворювань, яка містить феніламінопіридопіримідин за будь-яким з пп. 1-9. Даний винахід стосується нових проміжних сполук, придатних для одержання нових похідних феніламінопіримідину, фармацевтичної композиції, що містить нові похідні феніламінопіримідину, та способів їх одержання. Конкретно винахід стосується нових похідних фенілпіримідинаміну загальної формули І, наведеної нижче де R1 являє собою заміщений циклічний радикал, циклічний радикал, в кожному випадку зв'язаний з кільцевим атомом вуглецю та вибраний з фенілу, піридилу, піразинілу, тіазолілу, піримідинілу, піридазинілу та імідазолілу, причому замісники у вищеназваному циклічному радикалі вибрані з однієї або більше наступних груп: галоген, ціано, карбамоїл, -C(=O)-OR3, -C(=O)-R4, -SO2-N(R5)-, -N(R7)-, R8, -OR9 та заміщений фтором нижчий алкіл, де кожен з R3, R4, R5, R6, R7, R8 та R9 незалежно від інших являє собою водень або нижчий алкіл, незаміщений або заміщений моно- або динижчим алкіламіно; та R2 вибраний з галогену, ціано, карбамоїлу, C(=O)-OR10, -C(=O)-R11, -SO2-N(R12)-R13, N(R14)-R15, -OR16 та заміщеного фтором нижчого алкілу, де кожен з R10, R11, R12, R13, R14, R15 та R16 незалежно від інших являє собою водень або нижчий алкіл, незаміщений або заміщений моноабо ди- нижчим алкіламіно, або сіль такої сполуки, що містить щонайменше одну групу, здатну утворювати сіль. У WO 9509853 розкриті похідні N-феніл-2піримідинаміну сполуки загальної формули III Позначення у формулі мають наступні значення: Серія А Х = СН n = 1, 2 R = Н, Me Серія В X=N n=1 R = Н, Me Винахід також пропонує фармацевтично прийнятні солі формули І, як визначено вище. Додатково, даний винахід також пропонує спосіб одержання вищевказаних нових сполук та їх фармацевтично прийнятних солей. Винахід також пропонує фармацевтичну композицію, що містить нові сполуки загальної формули І разом із звичайними фармацевтично прийнятними допоміжними речовинами, а також спосіб її одержання. Нові сполуки формули І можуть бути застосовані для лікування хронічної мієлоїдної лейкемії (ХМЛ). Оскільки значення ІС50 вказаних молекул знаходяться в інтервалі від 0,1 до 10,0 нм, такі нові сполуки є потенційно придатними для лікування ХМЛ Передумови винаходу Похідні фенілпіримідинаміну відомі з патентів WO 9509851, WO 9509853, ЕР0588762, WO 9509847, WO 9903854 та ЕР-В-0-564 409 як ефективні сполуки для лікування пухлин. Наприклад, в WO 9509851 розкриті сполуки загальної формули II Похідне N-феніл-2-піримідинаміну формули III, де R0 являє собою водень, галоген, нижчий алкокси або нижчий алкіл, R1 являє собою a) N-(аміно-нижчий алкіл)-карбамоїл, b) N-(гідрокси-нижчий алкіл)-карбамоїл, c) гідразино, d) циклогексиламіно, незаміщений або заміщений аміногрупою, e) піперазиніл, незаміщений або заміщений аміно-нижчим алкілом, f) морфолініл, або д) нижчий алкіламіно, заміщений морфолінілом, гідрокси-нижчим алкіламіно, ціано, iмідазолілом, гуанідилом, аміно, нижчим алканоїламіно, нижчим алкіламіно-карбоніламіно, амідино, ди-нижчим алкіламіно-циклогексилом, карбокси, нижчим алкоксикарбонілом, карбамоїлом, Nгідрокси-карбамоїлом, гідрокси, нижчим алкокси, дигідроксифосфорилокси, піперазинілом, нижчим алканоїл-піперазинілом, формілпіперазинілом, проліламідо або радикалом формули Н2 N-CH(R) 9 C(=O)-NH-, де R являє собою водень, С1-С4 алкіл, бензил, гідроксиметил, 1-гідрокси-етил, меркаптометил, 2-метилтіо-етил, індол-3-іл-метил, фенілметил, 4-гідрокси-феніл-метил, карбамоїл-метил, 2-карбамоїл-етил, карбокси-метил, 2-карбоксиетил, 4-аміно-бутил, 3-гуанідил-пропіл, або R являє собою 1Н-імідазол-4-іл-метил, та R2 являє собою С1-С6 алкіл, С1-C3 алкокси, хлор, бром, йод, трифторметил, гідрокси, феніл, аміно, моно(С1-C3 алкіл)аміно, ди(С1-C3 алкіл)аміно, С2-С4 алканоїл, пропенілокси, карбокси, карбокси-метокси, етоксикарбоніл-метокси, сульфаніламідо, Ν,Ν-ди-(С1-C3 алкіл)сульфаніламідо, N-метил-піперазиніл, піперидиніл, 1Н-iмідазол-1іл, 1Н-триазол-1-іл, 1Н-бензiмідазол-2-іл, 1нафтил, циклопентил, 3,4-диметил-бензил або радикал однієї з наступних формул: -CO2R3, -NH-C(=O)-R3, -N(R3)-C(=O)-R4, -O(CH2)n-N(R3)-R4, -С(.dbd.O)-NH-(CH2)n-R4@a, C(=O)-NH-(CH2)n-N(R3)-R4, -CH(CH3)-NH-CHO, C(CH3).dbd.N-OH, -C(CH3)=N-O-CH3, -CH(CH3)NH2, -NH-CH2-C(=O)-N(R3)-R4, де кожен з R3 та R4 незалежно від інших являє собою С1-C3 алкіл, R4@a являє собою гідрокси, аміно або імідазоліл, X являє собою кисень або сірку, m дорівнює 1,2 або 3, n дорівнює 2 або 3, R5 являє собою водень, С1-C3 алкіл, С1-C3 алкокси, хлор, бром, йод або трифторметил, R6 являє собою 1Н-імідазол-1-іл або морфолініл та R7 являє собою С1-C3 алкіл або являє собою феніл, незаміщений або монозаміщений С1-C3 алкілом, галогеном або трифторметилом, або його сіль Похідне N-феніл-2піримщинаміну формули III, де R0 являє собою водень, галоген, нижчий алкокси або нижчий алкіл, R1 являє собою a) N-(аміно-нижчий алкіл)-карбамоїл, b) N-(гідрокси-нижчий алкіл)-карбамоїл, c) гідразино, d) циклогексил-аміно, незаміщений або заміщений аміногрупою, e) піперазиніл, незаміщений або заміщений аміно-нижчим алкілом, f) морфолініл, або g) нижчий алкіламіно, заміщений морфолінілом, гідрокси-нижчим алкіламіно, ціано, імідазолілом, гуанідилом, аміно, нижчим алканоїламіно, нижчим алкіламіно-карбоніламіно, амідино, динижчим алкіламіно-циклогексилом, карбокси, нижчим алкоксикарбонілом, карбамоїлом, N-гідроксикарбамоїлом, гідрокси, нижчим алкокси, дигідроксифосфорилокси, піперазинілом, нижчим алканоїл-піперазинілом, формілпіперазинілом, проліламідо або радикалом формули Н2 N-CH(R)-C(=O)NH-, де R являє собою водень, С1-С4 алкіл, бензил, гідроксиметил, 1-гідрокси-етил, меркаптометил, 2-метилтіо-етил, індол-3-іл-метил, фенілметил, 4-гідрокси-феніл-метил, карбамоїл-метил, 2-карбамоїл-етил, карбокси-метил, 2-карбоксиетил, 4-аміно-бутил, 3-гуанідил-пропіл або R являє собою 1Н-імідазол-4-іл-метил, та R2 являє собою С1-С6 алкіл, С1-C3 алкокси, хлор, бром, йод, трифторметил, гідрокси, феніл, аміно, моно(С1-C3 алкіл)аміно, ди(С1-C3 алкіл)аміно, С2-С4 алканоїл, пропенілокси, карбокси, карбокси-метокси, етоксикарбоніл-метокси, суль 94570 10 фаніламідо, Ν,Ν-ди-(С1-C3 алкіл)сульфаніламідо, N-метил-піперазиніл, піперидиніл, 1Н-імідазол-1іл, 1Н-триазол-1-іл, 1Н-бензімідазол-2-іл, 1нафтил, циклопентил, 3,4-диметил-бензил або радикал однієї з наступних формул: -CO2R3, -NH-C(=O)-R3, -N(R3)-C(=O)-R4, -O(CH2)n-N(R3)-R4, -C(=O)-NH-(CH2)n-R4@a, C(=O)-NH-(CH2)n-N(R3)-R4, -CH(CH3)-NH-CHO, C(CH3)=N-OH, -C(CH3)=N-O-CH3, -CH(CH3)-NH2, NH-CH2-C(=O))-N(R3)-R4, де кожен з R3 та R4 незалежно від інших являє собою С1-C3 алкіл, R4@a являє собою гідрокси, аміно або імідазоліл, X являє собою кисень або сірку, m дорівнює 1,2 або 3, n дорівнює 2 або 3, R5 являє собою водень, С1-C3 алкіл, С1-C3 алкокси, хлор, бром, йод або трифторметил, R6 являє собою 1Н-імідазол-1-іл або морфолініл та R7 являє собою С1-C3 алкіл або являє собою феніл, незаміщений або монозаміщений С1-C3 алкілом, галогеном або трифторметилом, або його сіль ЕР0588762 (той же автор), US 5,516,775 розкривають сполуки загальної формули IV: де R1 являє собою водень або С1-C3 алкіл, R2 являє собою водень або С1-C3 алкіл, R3 являє собою 2-піридил, 3-піридил, 4-піридил, 2-метил-3піридил, 4-метил-3-піридил, 2-фурил, 5-метил-2фурил, 2,5-диметил-3-фурил, 2-тієніл, 3-тієніл, 5метил-2-тієніл, 2-фенотіазиніл, 4-піразиніл, 2бензофурил, N-оксид-2-піридил, N-оксид-3піридил, N-оксид-4-піридил, 1Н-індол-2-іл, 1Ніндол-3-іл, 1-метил-1Н-пірол-2-іл, 4-хінолініл, Іметил-піридиній-4-ілйодид, диметиламінофеніл або N-ацетил-N-метиламінофеніл, R4 являє собою водень, С1-C3 алкіл, -СО-СО-О-С2Н5 або Ν,Νдиметиламіноетил, щонайменше один з R5, R6, R7 та R8 являє собою С1-С6 алкіл, С1-C3 алкокси, хлор, бром, йод, трифторметил, гідрокси, феніл, аміно, моно-(С1-C3 алкіл)аміно, ди(С1-C3 алкіл)аміно, С2-С4 алканоїл, пропенілокси, карбокси, карбоксиметокси, етоксикарбонілметокси, сульфаніламідо, N,N-ди(C1-C3 алкіл)сульфаніламідо, Nметилпіперазиніл, піперидиніл, 1Н-імідазол-1-іл, 1Н-триазол-1-іл, 1Н-бензімідазол-2-іл, 1-нафтил, циклопентил, 3,4-диметилбензил або радикал однієї з наступних формул: -CO2R, -NH-C(=O)-R, -N(R)-C(=O)-R, -O-(CH2)n -N(R)-R, -C(=O)-NH-(CH2)n-N(R)-R, CH(CH3)-NH-CHO, -C(CH3)=N-OH, -C(CH3)=N-O-CH3, -C(CH3)-NH2, -NH-CH2C(=O)-N(R)-R, -(CH2)m-R10, -X-(CH2)m-R10, або де R являє собою С1-C3 алкіл, X являє собою кисень або сірку, m дорівнює 1, 2 або 3, 11 94570 n дорівнює 2 або 3, R9 являє собою водень, С1-C3 алкіл, С1-C3 алкокси, хлор, бром, йод або трифторметил, R10 являє собою 1Н-імідазол-1-іл або морфолініл, та R11 являє собою С1-C3 алкіл або незаміщений феніл або феніл, монозаміщений С1-C3 алкілом, галогеном або трифторметилом, та інші замісники R5, R6, R7 та R8 являють собою водень, або їх фармацевтично прийнятні солі. В ЕР 0564 409 розкриті сполуки загальної формули V де R1 являє собою нафтил, флуореніл, антраценіл або заміщений циклічний радикал, причому в кожному випадку циклічний радикал зв'язаний з кільцевим атомом вуглецю та вибраний з фенілу, піридилу, 1Н-індолілу, піразинілу, тіазолілу, піримідинілу, піридазинілу та імідазолілу, де замісники у вищеназваному фенільному радикалі вибрані з гідрокси, галогену, нітро, ціано, незаміщеного або заміщеного галогеном нижчого алкокси, та з радикалу формули VIa C(=O)-(O)m-R3 де R1 являє собою піразиніл, 1-метил-1Н-піроліл; феніл, заміщений аміно- або аміно-нижчим алкілом, де в кожному випадку аміногрупа є вільною, алкільованою або ацильованою; 1Н-індоліл або 1Н-імідазоліл, приєднаний через атом вуглецю 5членного кільця; або піридил, незаміщений або заміщений нижчим алкілом, приєднаний через кільцевий атом вуглецю, та незаміщений або заміщений киснем за кільцевим атомом азоту, кожен з R2, R3 незалежно від інших являє собою водень або нижчий алкіл, кожен один або два з радикалів R4, R5, R6, R7 та R8 являють собою нітро, заміщений фтором нижчий алкокси або радикал формули (Va) -N(R9)-C(=X)-(Y)n-R10 (Va) де R9 являє собою водень або нижчий алкіл, X являє собою оксо, тіо, іміно, N-нижчий алкіліміно, гідроксіміно або О-нижчий алкіл-гідроксіміно, Υ являє собою кисень або групу ΝΗ, n дорівнює 0 або 1 та R10 являє собою аліфатичний радикал, що містить як мінімум 5 атомів вуглецю, або ароматичний, ароматично-аліфатичний, циклоаліфатичний, циклоаліфатично-аліфатичний, гетероциклічний або гетероциклічно-аліфатичний радикал, та кожен з решти радикалів R4, R5, R6, R7 та R8 незалежно від інших являє собою водень, нижчий алкіл, незаміщений або заміщений вільним або алкільованим аміно, піперазинілом, піперидинілом, піролідинілом або морфолінілом, або нижчий алканоїл, трифторметил, вільний, етерифікований або естерифікований гідроксил, вільний, алкільований або ацильований аміно або вільний або естерифікований карбокси, або сіль такої сполуки, що містить як мінімум одну групу, здатну утворювати сіль. У WO 9509847 розкрите похідне N-феніл-2піримідинаміну загальної формули VI 12 (VIa) де m дорівнює 0 або 1 та R3 являє собою водень, бензил, нижчий алкіл або аміно-нижчий алкіл, де аміногрупа є вільною, заміщеною нижчим алкілом або нижчим алканоїлом, з радикалу формули m -C(=O)-N(R4)R5 (Vlb) де кожен з R4 та R5 незалежно від інших являє собою водень або незаміщений або аміно- або гідрокси-заміщений нижчий алкіл, з радикалу формули VIc -SO2-N(R6)R7 (VIc) де кожен з R6 та R7 незалежно від інших являє собою водень, нижчий алкіл або аміно-нижчий алкіл, або де R6 та R7 разом утворюють двохвалентний радикал -(CH2)2-NH-(CH2)2-, та з радикалу формули Vld -N(R8)R9 (Vld) де кожен з R8 та R9 незалежно від інших являє собою нижчий алкіл, або де R8 являє собою водень та R9 являє собою аміно або аміно-циклогексил, або являє собою нижчий алкіл, заміщений імідазолілом, гуанідилом, нижчим алкіламіно-карбоніламіно, амідино, динижчим алкіламіно-циклогексилом, піперазинілом, карбокси, нижчим алкоксикарбонілом, карбамоїлом, N-гідрокси-карбамоїлом, гідрокси, нижчим алкокси, дигідроксифосфорилокси або формілпіперазинілом, та замісники інших вищезгаданих циклічних радикалів вибрані з гідрокси, галогену, ціано, аміно-нижчого алкілу, незаміщеного або заміщеного галогеном нижчого алкокси, заміщеного фталімідом нижчого алкілу, з радикалу наведених вище формул VIa, m або VIc та з радикалу формули VII -N(R10)R11 (VII) де кожен з R10 та R11 незалежно від іншого являє собою водень або нижчий алкіл, або 13 94570 де R10 являє собою водень та R11 являє собою аміно або аміно-циклогексил, або являє собою нижчий алкіл, заміщений аміно, нижчий алкіламіно, ди-нижчий алкіламіно, нижчий алканоїламіно, імідазоліл, гуанідил, нижчий алкіламіно-карбоніламіно, амідино, ди-нижчий алкіламіно-циклогексил, піперазиніл, формілпіперазиніл, карбокси, нижчий алкоксикарбоніл, карбамоїл, Nгідрокси-карбамоїл, гідрокси, нижчий алкокси, дигідроксифосфорилокси або заміщений гліциламідо; та R2 являє собою нітро, заміщений фтором нижчий алкокси або радикал формули VIII -N(R12)-C(=X)-(Y)n-R13 (VIII) де R12 являє собою водень або нижчий алкіл, X являє собою оксо, тіо, іміно, N-нижчий алкіліміно, гідроксіміно або О-нижчий алкіл-гідроксіміно, Υ являє собою кисень або групу ΝΗ, n дорівнює 0 або 1, та R13 являє собою аліфатичний радикал, що містить щонайменше 5 атомів вуглецю, або ароматичний, ароматично-аліфатичний, циклоаліфатичний, циклоаліфатично-аліфатичний, гетероциклічний або гетероциклічно-аліфатичний радикал, або сіль такої сполуки, яка містить щонайменше одну групу, здатну до утворення солі. Крім того, ЕР0564409 розкриває застосування вказаної сполуки для лікування атеросклерозу. Патент WO9903854 описує застосування похідних піридилпіримідинаміну, особливо Gleevec, сполуки Novartis GGP57148 формули IX, як інгібіторів тирозинкінази в лікуванні раку. Опубліковане значення ІС50 для Gleevec становить 38 нмоль (нМ). В нещодавно виданому Novartis патенті WO 0222597 від 11.09.2001 розкриті сполуки формули (X), де: R1 являє собою піразиніл; 1-метил-1Н-піроліл; феніл, заміщений аміно- або аміно-нижчим алкілом, де в кожному випадку аміногрупа є вільною, алкільованою або ацильованою; 1Н-індоліл або 1Н-імідазоліл, приєднаний через атом вуглецю 5членного кільця; або піридил, незаміщений або заміщений нижчим алкілом, приєднаний через 14 кільцевий атом вуглецю, та незаміщений або заміщений киснем за кільцевим атомом азоту, кожен з R2 та R3 незалежно від інших являє собою водень або нижчий алкіл, один з радикалів R4, R5, R6, R7 та R8 являє собою радикал формули 11 -N(R9)-C(=X)-(Y)n-R10, де R9 являє собою водень або нижчий алкіл, X являє собою оксо, тіо, іміно, N-нижчий алкіліміно, гідроксіміно або О-нижчий алкіл-гідроксіміно, Υ являє собою кисень або групу ΝΗ, n дорівнює 0 або 1 та R10 являє собою феніл, що а) заміщений радикалом, вибраним з групи, що складається з аміно; моно- або ди-нижчий алкіл-аміну; нижчий алканоїл-аміно; формілу; нижчий алкокси-карбонілу; та нижчого алкілу, заміщеного аміно, моно- або динижчий алкіл-аміно або нижчий алканоїл-аміно, або b) заміщений незаміщеним або заміщеним радикалом, вибраним з групи, що складається з бензиламіно; бензоіламіно; піролідинілу; піперидилу; піперазинілу; піперазиніл-карбонілу; морфолінілу; та нижчого алкілу, заміщеного бензиламіно, бензоіламіно, піролідинілом, піперидилом, піперазинілом або морфолінілом; де замісники у вказаному заміщеному радикалі вибрані з групи, що складається з ціано; нижчого алкілу; гідрокси- або аміно-заміщеного нижчого алкілу; трифторметилу; гідрокси; нижчого алкокси; нижчого алканоїлокси; аміно; моно- або ди-нижчий алкіл-аміно; нижчого алканоїламіно; бензоіламіно; карбокси; нижчого алкоксикарбонілу та галогену; та с) необов'язково додатково заміщений одним або більше радикалів, вибраних з групи, що складається з ціано; нижчого алкілу; гідрокси- або аміно-заміщеного нижчого алкілу; трифторметилу; гідрокси; нижчого алкокси; нижчого алканоїлокси; аміно; моно- або ди-нижчий алкіл-аміно; нижчого алканоїламіно; бензоіламіно; карбокси; нижчого алкоксикарбонілу та галогену, за умови, що R10 не є (4-метил-піперазиніл)метилфенілом, та кожен з решти радикалів R4, R5, R6, R7 та R8 незалежно від інших являє собою водень; нижчий алкіл, незаміщений або заміщений вільним або алкільованим аміно, піперазинілом, піперидилом, піролідинілом або морфолінілом; нижчий алканол; трифторметил; вільний, етерифікований або естерифікований гідрокси; вільний, алкільований або ацильований аміно; або вільний або естерифікований карбокси, або сіль такої сполуки, що містить щонайменше одну групу, здатну до утворення солі. Дуже добре відоме, що феніламінопіридопіримідини, які належать до згаданих вище категорій, є високою мірою придатними для лікування BCR-abl позитивних ракових та пухлинних захворювань, таких як лейкемії [особливо хронічної мієлоїдної лейкемії (ХМЛ) та гострої лімфобластної лейкемії, при яких виявлені апоптотичні механізми дії]. Таким чином, інтерес та увага приділяються розробці нових молекул, що належать до згаданих вище категорій сполук. З урахуванням викладених вище цілей ми продовжили наші науково-дослідницькі роботи у вказаних напрямках, за результатами яких нами подані заявки на видачу патентів як на нові моле 15 94570 кули, так і на вдосконалені способи одержання вказаних молекул. Таким чином, головне завдання даного винаходу полягає в одержанні нових феніламінопіридопіримідинів загальної формули (І), визначеної вище, та їх фармацевтично прийнятних солей. Інше завдання даного винаходу полягає в одержанні нових феніламінопіридопіримідинів загальної формули (І), визначеної вище, та їх фармацевтично прийнятних солей, які мають значення ІС50 в інтервалі від 0,1 до 10,0 нМ. Ще одне завдання даного винаходу полягає в одержанні нових феніламінопіридопіримідинів загальної формули (І) та їх фармацевтично прийнятних солей, придатних для лікування ХМЛ. Інше завдання даного винаходу полягає в створенні способу одержання нових феніламінопіридопіримідинів загальної формули (І), визначеної вище, та їх фармацевтично прийнятних солей. Додаткове завдання даного винаходу полягає в одержанні фармацевтичної композиції, що містить нові феніламінопіридопіримідини загальної формули (І) та їх фармацевтично прийнятні солі, придатної для лікування ХМЛ. Ще одне завдання даного винаходу полягає в створенні способу одержання фармацевтичної композиції, що містить нові феніламінопіридопіримідини загальної формули (І), визначеної вище, та їх фармацевтично прийнятні солі. Інше завданням даного винаходу полягає в одержанні нових проміжних сполук, придатних для одержання нових сполук формули (І), визначеної вище. Ще одне завдання даного винаходу полягає в створенні способів одержання нових проміжних сполук, придатних для одержання нових сполук формули (І), визначеної вище. Відповідно, даний винахід пропонує феніламінопіридопіримідини загальної формули (І) 16 положенні 3 фенільного/піридинільного кільця (n=1, Серія А, Серія В), та, якщо присутні дві таких групи, переважним є їх розташування в положеннях 3, 5 (n=2, Серія А). Ще більш особлива перевага надається сполуці(кам) загальної формули (І), де R, що представляє метильну групу та трифторметильну групу, знаходиться в положенні 3 та положеннях 3,5 фенільного кільця (n=1 та 2, Серія А). Наведені вище сполуки є новими і не описані в літературі. Сполуки формули (І) утворюють фармацевтично прийнятні солі. Наприклад, утворюються солі з неорганічними кислотами, такими як хлористоводнева кислота, сірчана кислота, фосфорна кислота, (або) з придатними органічними карбоновими (або) сульфоновими кислотами, наприклад, аліфатичними моно-(або) дикарбоновими кислотами, такими як трифтороцтова кислота, оцтова кислота, пропіонова кислота, гліколева кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, гідроксималеїнова кислота, яблучна кислота, винна кислота, лимонна кислота (або) щавлева кислота (або) амінокислоти, такі як аргінін (або) лізин, ароматичні карбонові кислоти, такі як бензойна кислота, 2-феноксибензойна кислота, 2ацетоксибензойна кислота, саліцилова кислота, ароматичні аліфатичні карбонові кислоти, такі як нікотинова кислота, аліфатичні сульфонові кислоти, такі як метансульфонова кислота, та ароматичні сульфонові кислоти, наприклад, такі як бензолта 4-толуолсульфонова кислоти. Однак, з лікувальною метою застосовують тільки фармацевтично прийнятні нетоксичні солі, і, таким чином, вказані солі є кращими. У відповідності до іншого варіанту винаходу пропонується спосіб одержання нових феніламінопіридопіримідинів формули І: де позначення мають наступні значення: Серія А Х = СН n = 1, 2 R = Н, Me Серія В X=N n=1 R = H, Me та їх фармацевтично прийнятні солі. Трифторметильна група у вищезгаданих сполуках переважно приєднана до фенілу/піридинілу в положенні 3 (якщо n=1) та, якщо присутні дві таких групи, вони переважно приєднані в положеннях 3,5 (якщо n=2). Особлива перевага надається сполукам загальної формули (І), де R, що представляє метильну групу та трифторметильну групу, знаходиться в де позначення мають наведені нижче значення, та їх фармацевтично прийнятних кислотноадитивних солей, який включає: (і) - конденсацію 4-метил-3-нітроаніліну формули (XI) де R являє собою водень або метил, з трифторметилароїлхлоридами формули (XII) 17 де n дорівнює 1 або 2, та X являє собою N або Н, в присутності хлорвуглеводневого розчинника та основи при температурі в інтервалі від 30 до 40°C з одержанням нових проміжних сполук нітротрифторметилароїламідів формули (XIII) де R та n мають значення, наведені вище. (іі) Відновлення одержаних нових сполук формули (XIII) з використанням відновлювального агента метал/кислота при температурі в інтервалі 0-5°C з одержанням нових проміжних сполук амінотрифторметилароїламідів формули (XIV) 94570 18 де R та n мають значення, наведені вище. (ііі) Конденсацію сполуки формули (XIV) з ціанамідом (CNNH2) при температурі в інтервалі від 60 до 95°C в присутності полярного розчинника та неорганічної кислоти з одержанням нових проміжних сполук солей гуанідинотрифторметилароїламідів формули (XV) де R та n мають значення, наведені вище, та (iv) Конденсацію нових сполук формули (XV) з сполуками формули (XVI) в присутності основи при температурі в інтервалі від 30 до 40°C з одержанням нових сполук загальної формули (І), де R, n та X мають значення, наведені вище, та, за бажанням, перетворення нових сполук формули І на фармацевтично прийнятні солі з використанням традиційних способів. Описаний вище спосіб показаний на Схемі І, наведеній нижче 19 94570 20 У відповідності до іншого варіанту винаходу пропонується спосіб одержання нових нітротрифторметилароїламідів формули (XIII) У відповідності до іншого варіанту винаходу пропонується спосіб одержання нових амінотрифторметилароїламідів формули (XIV) придатних як проміжні сполуки для одержання нової сполуки формули І, який включає конденсацію 4-метил-3-нітроаніліну формули (XI) де R являє собою водень або метил, з трифторметилароїлхлоридами формули (XII) де n дорівнює 1 або 2, та x являє собою N або Н, в присутності хлорвуглеводневого розчинника та основи при температурі в інтервалі від 30 до 40°C з одержанням нових проміжних сполук нітротрифторметилароїламідів формули (XIII) де R та n мають значення, наведені вище, придатних для одержання нових сполук формули І, який включає відновлення нових сполук формули (XIII) з використанням відновлювального агента метал/кислота при температурі в інтервалі 0-5°C, з одержанням нових сполук формули XIV. У відповідності до іншого варіанту винаходу пропонується спосіб одержання нових солей гуанідинотрифторметилароїламідів формули (XV) 21 де R та n мають значення, наведені вище, придатних в ролі проміжних сполук для одержання нових сполук формули І, який включає конденсацію нових сполук формули (XIV) з ціанамідом (CNNH2) при температурі в інтервалі від 60 до 95°C в присутності полярного розчинника та неорганічної кислоти з одержанням нових проміжних сполук формули (XV). В кращому варіанті винаходу хлорвуглеводневий розчинник, який використовують на стадії (і), може бути вибраний з хлороформу, метиленхлориду або етиленхлориду, і краще являє собою хлороформ. Основа, яку використовують, може бути вибрана з триетиламіну, дипропіламіну або діізопропіламіну, краще являє собою триетиламін. Температура переважно може знаходитись в інтервалі від 30 до 40°C В іншому варіанті відновлювальний агент метал/кислота, який використовують на стадії (іі) для відновлення нової сполуки формули (XII), може бути вибраний з олова хлориду/конц. НСІ, заліза/конц. НСІ, цинку/конц. НСІ, і переважно являє собою олова хлорид/конц. НСІ. Полярний розчинник, який використовують на стадії (ііі), може бути вибраний з n-пропанолу, ізопропанолу, етанолу, n-бутанолу або їх сумішей, і переважно являє собою n-бутанол. Основа, така як калію гідроксид або натрію гідроксид, переважно може бути використана на стадії (iv), і температура може знаходитись в інтервалі 90-95°C. У відповідності до ще одного варіанту даного винаходу пропонується альтернативний спосіб одержання сполук загальної формули І, визначеної вище. Відповідно даний винахід пропонує спосіб одержання сполук загальної формули І, визначеної вище, який включає (і) Одержання N-(5-аміно-2-метилфеніл)-4-(3піридил)-2-піримідинаміну формули (XVII) за традиційними способами. (іі) Конденсацію N-(5-аміно-2-метилфеніл)-4(3-піридил)-2-піримідинаміну формули (XVII) з трифторметилароїлхлоридами формули (XII) з одержанням нових сполуки загальної формули (І), де [R, n, Χ мають значення, наведені вище]. Сполуки формули (І), визначеної вище, інгібують BCR-abl кіназу і, таким чином, як пояснювалося вище, є придатними для лікування BCR-abl позитивних ракових та пухлинних захворювань, таких як лейкемія (особливо хронічна мієлоїдна лейкемія [ХМЛ] та гостра лімфобластна лейкемія, при яких виявлені апоптотичні механізми дії). Винахід також стосується фармацевтичних композицій,що містять ефективну кількість, особ 94570 22 ливо кількість активного інгредієнта, ефективну для профілактики або лікування одного з вказаних вище захворювань, разом з фармацевтично прийнятними носіями, придатними для місцевого, ентерального, наприклад перорального або ректального, або парентерального введення, що можуть бути неорганічними або органічними, твердими або рідкими агентами. На додаток до активного(их) інгредієнта(ів) фармацевтичні композиції за даним винаходом можуть містити одну або більше допоміжних речовин (наповнювачів або ад'ювантів). Вибір допоміжних речовин та їх кількостей для застосування може бути легко здійснений науковцем в галузі розробки лікарських форм на базі досвіду та з урахуванням стандартних методик і довідників в даній галузі. Розбавлювачі збільшують об'єм твердої фармацевтичної композиції та можуть зробити фармацевтичну лікарську форму, що містить композицію, більш зручною для пацієнта та особи, що здійснює догляд. Розбавлювачі для твердих композицій включають, наприклад, мікрокристалічну целюлозу (наприклад, Avicel(R)), мікроволокнисту целюлозу, лактозу, крохмаль, прежелатинізований крохмаль, кальцію карбонат, кальцію сульфат, цукор, декстрати, декстрин, декстрозу, двохосновний кальцію фосфат дигідрат, трьохосновний кальцію фосфат, каолін, магнію карбонат, магнію оксид, мальтодекстрин, манітол, поліметакрилати (наприклад, Eudragit(R)), калію хлорид, целюлозу у формі порошку, натрію хлорид, сорбітол і тальк. Тверді фармацевтичні композиції, які виготовляють у виді дозованої лікарської форми, такої як капсули, можуть включати допоміжні речовини, функції яких включають сприяння зв'язуванню активного інгредієнта та інших допоміжних речовин після пресування. Зв'язувальні агенти для твердих фармацевтичних композицій включають акацієву камедь, альгінову кислоту, карбомер (наприклад, карбопол), натрій карбоксиметилцелюлозу, декстрин, етилцелюлозу, желатин, гуарову камедь, гідрогенізовану рослинну олію, гідроксиетилцелюлозу, гідроксипропілцелюлозу (наприклад, Klucel(R)), гідроксипропілметилцелюлозу (наприклад, Methocel(R)), розчин глюкози, магнію алюмінію силікат, мальтодекстрин, метилцелюлозу, поліметакрилати, повідон (наприклад, Kollidon(R), Plasdone(R)), прежелатинізований крохмаль, натрію альгінат та крохмаль. Розчинність ущільненої твердої фармацевтичної композиції в шлунку пацієнта може бути підвищена шляхом додавання до композиції дезінтегранту. Дезінтегранти включають альгінову кислоту, кальцій карбоксиметилцелюлозу, натрій карбоксиметилцелюлозу (наприклад, Ac-Di-Sol(R), Primellose(R)), колоїдний кремнію діоксид, натрій кроскармелозу, кросповідон (наприклад, Kollidon(R), Polyplasdone(R)), гуарову камедь, магнію алюмінію силікат, метилцелюлозу, мікрокристалічну целюлозу, полакрилін калію, целюлозу у формі порошку, прежелатинізований крохмаль, натрію альгінат, натрію крохмаль гліколят (наприклад, Explotab(R)) та крохмаль. Засоби для збільшення ковзання можуть бути додані для покращення плинності неущільненої 23 твердої композиції та для покращення точності дозування. Допоміжні речовини, які можуть виконувати функцію засобів для збільшення ковзання, включають колоїдний кремнію діоксид, магнію трисилікат, целюлозу у формі порошку, крохмаль, тальк і трьохосновний кальцію фосфат. Якщо дозовану лікарську форму, таку як капсула, виготовляють шляхом ущільнення порошкової композиції, останню піддають тиску штампу та пуансона. Деякі допоміжні речовини та активні інгредієнти мають тенденцію до зчеплення з поверхнею штампу та пуансона, що може спричиняти ерозію поверхні продукту та інші нерівності поверхні. Змащувальний агент може бути доданий до композиції для зменшення зчеплення та полегшення витягання продукту із штампу. Змащувальні агенти включають магнію стеарат, кальцію стеарат, гліцерил моностеарат, гліцерил пальмітостеарат, гідрогенізовану рицинову олію, гідрогенізовану рослинну олію, мінеральне масло, поліетиленгліколь, натрію бензоат, натрію лаурилсульфат, натрію стеарилфумарат, стеаринову кислоту, тальк та цинку стеарат. Ароматизатори та підсилювачі смаку роблять дозовану лікарську форму прийнятною для пацієнта. Розповсюджені ароматизатори та підсилювачі смаку для фармацевтичних продуктів, які можуть бути додані в композицію за даним винаходом, включають мальтол, ванілін, етилванілін, ментол, лимонну кислоту, фумарову кислоту, етилмальтол та винну кислоту. Для покращення зовнішнього вигляду та/або полегшення ідентифікації пацієнтом твердим композиціям також може бути надане забарвлення з використанням будь-якого фармацевтично прийнятного барвника. Детальний опис винаходу викладений у Прикладах нижче, які наведені тільки з метою ілюстрації винаходу і не повинні інтерпретуватися як такі, що обмежують винахід. Приклад 1 Одержання (3-трифторметил)-N-[4-метил-3-(4піридин-3-іл-піримідин-2-іламіно)-феніл]-бензаміду формули (І), де R являє собою метил, X являє собою СН та n=1 Стадія І: Одержання нового (3-трифторметил)N-(4-метил-3-нітро-феніл)-бензаміду формули (XIII), де R являє собою метил, X являє собою СН та n=1 По-перше, 3-трифторметилбензоїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином. Тіонілхлорид (312,0 г, 2,63 моль) додають протягом 15 хв до розчину 3-трифторметилбензойної кислоти (100,0 г, 0,53 моль) в хлороформі (1000 мл) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний трифторметилбензоїлхлорид охолоджують до кімнатної температури та розчиняють в 100 мл хлороформу. 94570 24 Розчин 4-метил-3-нітроаніліну (49,0 г, 0,32 моль) в хлороформі (600 мл) охолоджують до -5°C та додають триетиламін (161,0 г, 1,59 моль). Трифторметилбензоїлхлорид, одержаний як описано вище, в хлороформі додають по краплях при -5°C протягом 60-75 хв. Одержану суспензію перемішують протягом 1 год при -5°C. Здійснюють упарювання суспензії до залишкового об'єму 800 мл, фільтрують, промивають охолодженим хлороформом (250 мл) та сушать під вакуумом з одержанням 85,0 г нового (3-трифторметил)-N-(4-метил-3нiтро-феніл)-бензаміду формули (IV), де R являє собою метил, X являє собою СН та n=1, з виходом 83% у вигляді кристалів блідо-жовтого кольору (за даними ВЕРХ чистота становить 98,0%) MR-162164°C. Стадія II: Одержання нового (3трифторметил)-N-(3-аміно-4-метил-феніл)бензаміду формули (XIV), де R являє собою метил, X являє собою СН та n=1 Суспензію (3-трифторметил)-N-(4-метил-3нітро-феніл)-бензаміду формули (XII) (85 г, 0,26 моль), одержаного за способом, описаним для стадії І, та олова хлориду (297,5 г, 1,3 моль) в абсолютному етанолі (490 мл) нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 30 хв. Далі одержану суспензію охолоджують до кімнатної температури та виливають у 4 л льодяної води. рН реакційної суміші доводять до 8,0 за допомогою 2,4 л 5% розчину натрію гідроксиду та екстрагують 2x2 л етилацетату. Етилацетатну фракцію послідовно промивають водою і сольовим розчином та сушать над натрію сульфатом. Етилацетат повністю відганяють та 500 мл гексану додають до залишку та фільтрують. Залишок на фільтрі сушать під вакуумом при 60°C з одержанням 60,0 г нового (3-трифторметил)-N-(3-аміно-4-метилфеніл)-бензаміду формули (XIV), де R являє собою метил, X являє собою СН та n=1, з виходом 80% у вигляді жовтих кристалів (за даними ВЕРХ чистота становить 98,2%) MR-145-149°C. Стадія III: Одержання (3-трифторметил)-N-(3гуанідино-4-метил-феніл)-бензаміду формули (XV), де R являє собою метил, X являє собою СН та n=1 Суспензію (3-трифторметил)-N-(3-аміно-4метил-феніл)-бензаміду формули (XIV), одержану за способом, описаним для стадії (II) (60 г, 0,20 моль), в н-бутанолі (400 мл) послідовно обробляють концентрованою сірчаною кислотою до досягнення рН 2,5 (13 г) та розчином ціанаміду (12,6 г, 0,3 моль) у воді (13 мл) протягом 30 хв. Одержану реакційну суміш перемішують при температурі кипіння із зворотним холодильником протягом 6 год. Далі реакційну суміш упарюють під вакуумом до повного видалення розчинника і залишку дозволяють охолонути до кімнатної температури. Суміш 240 мл метанолу та 240 мл ізопропілового ефіру (ІРЕ) додають до реакційної маси та перемішують при кімнатній температурі протягом 1 год. Продукт відфільтровують під тиском, промивають сумішшю метанолу та ізопропілового ефіру (ІРЕ) (3x50 мл) та сушать під вакуумом при 60°C з одержанням 43,2 г солі (3-трифторметил)-N-(3 25 гуанідино-4-метил-феніл))-бензаміду нітрату формули (XV), де R являє собою метил, X являє собою СН та n=1, з виходом 53% від теоретичного (площа піку за даними ВЕРХ становить 99%) MR243-245°C. Стадія (IV): Одержання (3-трифторметил)-N[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)феніл]-бензаміду формули (І), де R являє собою метил, X являє собою СН та n=1 В атмосфері азоту суспензію солі (3трифторметил)-N-(3-гуанідино-4-метил-феніл)бензаміду нітрату, одержаної за способом, описаним для стадії (XV) (43 г, 0,11 моль), в н-бутанолі (290 мл) послідовно обробляють пластівцями натрію гідроксиду (6,9 г, 0,17 моль) та 3диметиламіно-1-піридин-3-іл-пропеноном (18,6 г, 0,11 моль). Одержану суспензію нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 2 год. Реакційна суміш перетворюється на гомогенний розчин насиченого оранжевого кольору, після чого диметиламін видаляють шляхом дистиляції нбутанолу. Реакційну масу охолоджують до кімнатної температури, додають суміш води та хлороформу (250 мл + 250 мл) і хлороформну фракцію відокремлюють. Хлороформну фракцію промивають водою та упарюють до залишкового об'єму 40 мл. Етилацетат (200 мл) додають до реакційної маси та відфільтровують під тиском, відокремлену тверду речовину промивають етилацетатом (2x50 мл) та водою (2x50 мл) і сушать під вакуумом при 60° С. Вихід: 29,0 г (60% від теоретичного) нового (3-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-бензаміду формули (1), де R являє собою метил, X являє собою СН та n=1, у вигляді кристалів блідо-жовтого кольору (за даними ВЕРХ чистота становить 99,89%). MR-211213°C. ІС50 -8 нМ (Фіг. 1). 1 Н-ЯМР (400 МГц, ДМСО-d6, ): 2,23 (с, 3H); 7,20-9,28 (арил, 13Н); 10,42 (с, 1Н). Елементний аналіз: C24H18F3N5O Молекулярна маса: 449,0 ІЧ: диск KBr -1 -NH-C=О: 3445 см -1 -NH-C=О: 1648 см Приклад 2 Альтернативний спосіб одержання (3трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-бензаміду формули (І), де R являє собою метил, X являє собою С Η та n=1 По-перше, 3-трифторметилбензоїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином. Тіонілхлорид (2,65 кг, 3,72 моль) додають протягом 15 хв до розчину 3-трифторметилбензойної кислоти (0,848 кг, 4,46 моль) та ДМФА (8,5 мл) в хлороформі (9 л) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний 3 94570 26 трифторметилбензоїлхлорид охолоджують до кімнатної температури та розчиняють в 600 мл хлороформу. Розчин N-(5-аміно-2-метилфеніл)-4-(3піридил)-2-піримідинаміну формули (XVII) (1,03 кг, 3,72 моль) в хлороформі (9 л) охолоджують до 5°C та додають триетиламін (1,35 кг, 13,37 моль). По краплях додають трифторметилбензоїлхлорид, приготовлений, як описано вище, в хлороформі при -5°C протягом 60-75 хв. Одержану суспензію перемішують протягом 1 год при -5°C. Здійснюють упарювання суспензії до залишкового об'єму 6 л та фільтрують, промивають водою демінералізованою та метанолом (2,5 л) і сушать під вакуумом з одержанням 1 кг нового (3-трифторметил)-N-[4метил-3-(4-піридин-3-іл-піримідин-2-іламіно)феніл]-бензаміду формули (І), де R являє собою метил, X являє собою СН та n=1, з виходом 60% у вигляді кристалів блідо-жовтого кольору (площа піку за даними ВЕРХ становить 95,0%). Одержаний продукт додатково очищують кип'ятінням із зворотним холодильником з трьома об'ємами етилацетату та фільтрують при температурі 40°C [0,85 кг, 50,9%] (за даними ВЕРХ чистота становить 98,5%) MR-MR-210-213°C. Приклад 3 Одержання (3,5-біс-трифторметил)-N-[4метил-3-(4-піридин-3-іл-піримідин-2-іламіно)феніл]-бензаміду формули (І), де R являє собою метил, X являє собою СН та n=2 Стадія І: Одержання нового (3,5-бістрифторметил)-N-(4-метил-3-нітро-феніл)бензаміду (XIII), де R являє собою метил, X являє собою СН та n=2 По-перше, 3,5-біс-трифторметилбензоїлхлорид, який використовують як один із вихідних матеріалів, одержують наступним чином. Тіонілхлорид (576,0 г, 4,8 моль) додають протягом 15 хв до розчину 3,5-бістрифторметилбензойної кислоти (Lancaster) (250,0 г, 0,97 моль) в хлороформі (2,5 л) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний 3,5-біс-трифторметилбензоїлхлорид охолоджують до кімнатної температури та розчиняють в 400 мл хлороформу. Розчин 4-метил-3-нітроаніліну (92,0 г, 0,60 моль) в хлороформі (1,2 л ) охолоджують до -5°C і додають триетиламін (304,8 г, 3,0 моль). 3,5-Бістрифторметилбензоїлхлорид в хлороформі додають по краплях при -5°C протягом 60-75 хв. Одержану суспензію перемішують протягом 1 год при 5°C. Здійснюють упарювання суспензії до залишкового об'єму 800 мл та фільтрують, промивають охолодженим хлороформом (200 мл) та сушать під вакуумом з одержанням 160,0 г нового (3,5-бістрифторметил)-N-(4-метил-3-нітро-феніл)бензаміду (XIII), де R являє собою метил, X являє собою СН та n=2,з виходом 68% у вигляді кристалів кремового кольору (за даними ВЕРХ чистота становить 98,2%) MR-123-130°C. 27 Стадія (II): Одержання (3,5-біс-трифторметил)N-(3-аміно-4-метил-феніл)-бензаміду (XIV), де R являє собою метил, X являє собою СН та n=2 Суспензію нового (3,5-біс-трифторметил)-N-(4метил-3-нітро-феніл)-бензаміду (XIII) (160 г, 0,41 моль) та олова хлориду (460,8 г, 2,0 моль) в абсолютному етанолі (850 мл) нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 40 хв. Далі одержану суспензію охолоджують до кімнатної температури та виливають у 5 л льодяної води. рН реакційної суміші доводять до 8,0 за допомогою 4,3 л 5% розчину натрію гідроксиду та екстрагують 2x2 л етилацетату. Етилацетатну фракцію послідовно промивають водою і сольовим розчином та сушать над натрію сульфатом. Етилацетат повністю відганяють, 500 мл гексану додають до залишку та фільтрують. Залишок на фільтрі сушать під вакуумом при температурі 60°C з одержанням 96,0 г нового (3,5-біс-трифторметил)-N-(3-аміно-4метил-феніл)-бензаміду (XIV), де R являє собою метил, X являє собою СН та n=2 формули (V), з виходом 65% у вигляді жовтих кристалів, (за даними ВЕРХ чистота становить 98,5%) MR-153156°C. Стадія (III): Одержання (3,5-бicтрифторметил)-N-(3-гуанідино-4-метил-феніл)бензаміду (XV), де R являє собою метил, X являє собою СН та n=2 Суспензію (3,5-біс-трифторметил)-N-(3-аміно4-метил-феніл)-бензаміду (90 г, 0,20 моль) в нбутанолі (500 мл) послідовно обробляють концентрованою сірчаною кислотою до досягнення рН 2,5 (15,9 г) та розчином ціанаміду (15,7 г, 0,37 моль) у воді (15 мл) протягом 30 хв. Одержану реакційну суміш перемішують при температурі кипіння із зворотним холодильником протягом 6 год. Далі реакційну суміш упарюють під вакуумом до повного видалення розчинника і залишку дозволяють охолонути до кімнатної температури. Суміш 180 мл метанолу та 180 мл ізопропілового ефіру (ІРЕ) додають до реакційної маси та перемішують при кімнатній температурі протягом 1 год. Продукт відфільтровують під тиском, промивають сумішшю метанолу та ізопропілового ефіру (ІРЕ) (3x50 мл) та сушать під вакуумом при 60°C з одержанням 72,0 г нової солі (3,5-біс-трифторметил)-N-(3гуанідино-4-метил-феніл)-бензаміду нітрату формули (XV), де R являє собою метил, X являє собою СН та n=2, з виходом 62% від теоретичного (за даними ВЕРХ чистота становить 99,2%), MR285-287°C. Стадія (IV): Одержання (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-бензаміду (І), де R являє собою метил, X являє собою СН та n=2 Суспензію (3,5-біс-трифторметил)-N-(3гуанідино-4-метил-феніл)-бензаміду нітрату (70 г, 0,15 моль) в н-бутанолі (470 мл) в атмосфері азоту послідовно обробляють пластівцями натрію гідроксиду (7,0 г, 0,18 моль) та 3-диметиламіно-1піридин-3-іл-пропенону (28,0 г, 0,16 моль). Одержану суспензію нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 2 год. Реакційна суміш пе 94570 28 ретворюється на гомогенний розчин насиченого оранжевого кольору, після чого диметиламін видаляють шляхом дистиляції н-бутанолу. Реакційну масу охолоджують до кімнатної температури, додають суміш води та хлороформу (300 мл + 300 мл) і хлороформну фракцію відокремлюють. Хлороформну фракцію промивають водою та дистилюють до залишкового об'єму 70 мл. До реакційної маси додають етилацетат (350 мл) та відфільтровують під тиском, відокремлену тверду речовину промивають етилацетатом (2x50 мл) і водою (2x50 мл) та сушать під вакуумом при 60°C. Вихід: 48,0 г (62% від теоретичного) (3,5-біс-трифторметил)-N[4-метил-3-(4-піридин-3-іл-шримідин-2-іламіно)феніл]-бензаміду формули (І), де R являє собою метил, X являє собою СН та n=2, у вигляді кристалів блідо-жовтого кольору, (за даними ВЕРХ чистота становить 99,9%) MR-248-250°C, IC50=0,7 нМ (Фіг. 2). 1 Н-ЯМР (400 МГц, ДМСО-d6, ): 2,24 (с, 3H); 7,22-9,28 (арил, 12Н); 10,61 (с, 1Н). Елементний аналіз: C25H17F6N5O Молекулярна маса: 517,0 ІЧ: диск KBr -1 -NH-C=O: 3445,3 см -1 -NH-C=O: 1651,6 см Приклад 4 Альтернативний спосіб одержання (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-бензаміду (І), де R являє собою метил, X являє собою СН та n=2 По-перше, 3,5-бістрифторметилбензоїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином: Тіонілхлорид (2,4 кг, 17,2 моль) додають протягом 15 хв до розчину 3,5-бістрифторметилбензойної кислоти (855,0 г, 3,3 моль) та ДМФА (9 мл) у хлороформі (9 л) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний 3,5-біс-трифторметилбензоїлхлорид охолоджують до кімнатної температури та розчиняють в 700 мл хлороформу. Розчин N-(5-аміно-2-метилфеніл)-(3-піридил)2-піримідинаміну формули (XVII) (0,73 кг, 2,64 моль) в хлороформі (9 л) охолоджують до -5° С та додають триетиламін (1,03 кг, 10,2 моль). 3,5-Бістрифторметилбензоїлхлорид в хлороформі додають по краплях при -5° С протягом 60-75 хв. Одержану суспензію перемішують протягом 1 год при 5° С. Суспензію фільтрують, промивають водою демінералізованою та метанолом і сушать під вакуумом з одержанням 1,3 кг вологої сирої названої в заголовку сполуки, яка при перекристалізації з метанолу дає 0,82 кг (60%) (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)- феніл]-бензаміду (І), де R являє собою метил, X являє собою СН та n=2, у вигляді кристалів кремового кольору (за даними ВЕРХ чистота становить 99,9%) MR-248-250°C. 29 Приклад 5 Одержання (2-трифторметил)-N-[4-метил-3-(4піридин-3-іл-піримідин-2-іламіно)-феніл]-бензаміду (І), де R являє собою метил, X являє собою СН та n=1 Стадія І: Одержання нового (2-трифторметил)N-(4-метил-3-нітро-феніл)-бензаміду формули (XIII), де R являє собою метил, X являє собою СН та n=1 По-перше, трифторметилбензоїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином. Тіонілхлорид (62,4 г, 0,53 моль) додають протягом 15 хв до розчину 2-трифторметилбензойної кислоти (Aldrich) (20,0 г, 0,106 моль) в хлороформі (200 мл) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після завершення дистиляції одержаний трифторметилбензоїлхлорид охолоджують до кімнатної температури та розчиняють в 100 мл хлороформу. Розчин 4-метил-3-нітроаніліну (9,80 г, 0,06 моль) в хлороформі (120 мл) охолоджують до -5° С та додають триетиламін (32,2 г, 0,32 моль). По краплях додають трифторметилбензоїлхлорид, одержаний, як описано вище, в хлороформі при 5° С протягом 30-45 хв. Одержану суспензію перемішують протягом 1 год при -5° С Здійснюють упарювання суспензії до залишкового об'єму 150 мл, фільтрують, промивають охолодженим хлороформом та сушать під вакуумом з одержанням 19,0 г нового (2-трифторметил)-N-(4-метил-3нітро-феніл)-бензаміду формули (XIII), де R являє собою метил, X являє собою СН та n=1, з виходом 92% у вигляді кристалів блідо-жовтого кольору (за даними ВЕРХ чистота становить 97,50%) MR-120130°C. Стадія II: Одержання нового (2трифторметил)-N-(3-аміно-4-метил-феніл)бензаміду формули (XIV), де R являє собою метил, X являє собою СН та n=1 Суспензію (2-трифторметил)-N-(4-метил-3нітро-феніл)-бензаміду формули (XIII) (19 г, 0,058 моль), одержаного за способом, описаним для стадії І, та олова хлориду (59,5 г, 0,26 моль) в абсолютному етанолі (100 мл) нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 30 хв. Далі одержану суспензію охолоджують до кімнатної температури та виливають в 1 л льодяної води. рН реакційної суміші доводять до 8,0 за допомогою 0,5 л 5% розчину натрію гідроксиду та екстрагують 2x0,5 л етилацетату. Етилацетатну фракцію послідовно промивають водою і сольовим розчином та сушать над натрію сульфатом. Етилацетат повністю відганяють, до залишку додають 100 мл гексану та фільтрують. Залишок на фільтрі сушать під вакуумом при 60°C з одержанням 14,0 г нового (2трифторметил)-N-(3-аміно-4-метил-феніл)бензаміду формули (XIV), де R являє собою метил, X являє собою СН та n=1, з виходом 83% у 94570 30 вигляді жовтих кристалів (за даними ВЕРХ чистота становить 98,4%) MR-128-135°C. Стадія III: Одержання (2-трифторметил)-N-(3гуанідино-4-метил-феніл)-бензаміду формули (XV), де R являє собою метил, X являє собою СН та n=1 Суспензію (2-трифторметил)-N-(3-аміно-4метил-феніл)-бензаміду формули (XIV), одержаного за способом, описаним для стадії (II) (14 г, 0,047 моль), в н-бутанолі (100 мл) послідовно обробляють концентрованою сірчаною кислотою до досягнення рН 2,5 (2,6 г) та розчином ціанаміду (2,5 г, 0,06 моль) у воді (3 мл) протягом 10 хв. Одержану реакційну суміш перемішують при температурі кипіння із зворотним холодильником протягом 4-6 год. Далі реакційну суміш упарюють під вакуумом до повного видалення розчинника, і залишку дозволяють охолонути до кімнатної температури. Суміш 50 мл метанолу та 50 мл ізопропілового ефіру (ІРЕ) додають до реакційної маси та перемішують при кімнатній температурі протягом 1 год. Продукт відфільтровують під тиском, промивають сумішшю метанолу та ізопропілового ефіру (ІРЕ) (3x20 мл) та сушать під вакуумом при 60°C з одержанням 8,6 г солі (2-трифторметил)-N-(3гуанідино-4-метил-феніл)-бензаміду нітрату формули (XV), де R являє собою метил, X являє собою СН та n=1, з виходом 52% від теоретичного, (за даними ВЕРХ чистота становить 99,1%) MR160-165°C. Стадія (IV): Одержання (2-трифторметил)-N[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)феніл]-бензаміду формули (І), де R являє собою метил, X являє собою СН та n=1 Суспензію солі N-(3-гуанідино-4-метил-феніл)(2-трифторметил)-бензаміду нітрату, одержаного за способом, описаним для стадії (XV) (8,6 г, 0,02 моль) в н-бутанолі (60 мл) в атмосфері азоту послідовно обробляють пластівцями натрію гідроксиду (1,4 г, 0,03 моль) та 3-диметиламіно-1-піридин3-іл-пропеноном (3,72 г, 0,02 моль). Одержану суспензію нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 2 год. Реакційна суміш перетворюється на розчин насиченого оранжевого кольору, після чого диметиламін видаляють шляхом дистиляції н-бутанолу. Реакційну масу охолоджують до кімнатної температури, додають суміш води та хлороформу (50 мл + 50 мл) та хлороформну фракцію відокремлюють. Хлороформну фракцію промивають водою і випарюють до залишкового об'єму 10 мл. Етилацетат (40 мл) додають до реакційної маси та відфільтровують під тиском; відокремлену тверду речовину промивають етилацетатом (2x10 мл), водою (2x10 мл) та сушать під вакуумом при 60°C. Вихід: 6,2 г (64% від теоретичного) нового (2-трифторметил)-N-[4-метил-3-(4піридин-3-іл-піримідин-2 -іламіно)-феніл]бензаміду формули (І), де R являє собою метил, X являє собою СН та n=1, у вигляді практично білих кристалів. MR -206-207°C. 1 Н - ЯМР (400 МГц, ДМСО-d6, ): 2,2 (с, 3H); 7,20-9,28 (арил, 13Н);10,4 (с, 1Н). Елементний аналіз: C24H18F3N5O Молекулярна маса: 449,0 31 ІЧ: диск KBr -1 -NH-C=О: 3431,2 см -1 -NH-C=О: 1655,9 см Приклад 6 Альтернативний спосіб одержання (2трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-бензаміду (І), де R являє собою метил, X являє собою СН та n=1 По-перше, 2-трифторметилбензоїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином. Тіонілхлорид (156 г, 1,3 моль) додають протягом 15 хв до розчину 2-трифторметилбензойної кислоти (50,0 г, 0,26 моль) в хлороформі (250 мл) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний трифторметилбензоїлхлорид охолоджують до кімнатної температури та розчиняють в 100 мл хлороформу. Розчин N-(5-аміно-2-метилфеніл)-(3-піридил)2-піримідинаміну формули (XVII) (55 г, 0,20 моль) в хлороформі (440 мл) охолоджують до -5°C і додають триетиламін (79,6 г, 0,788 моль). Трифторметилбензоїлхлорид приготовлений, як описано вище, в хлороформі додають по краплях при -5°C протягом 30-45 хв. Одержану суспензію перемішують протягом 1 год при -5°C. Суспензію фільтрують, промивають водою демінералізованою, метанолом та сушать під вакуумом з одержанням 51,9 г (58%) нового 4-(2-трифторметил)-N-[4метил-3-(4-піридин-3-іл-піримідин-2-іламіно)феніл]-бензаміду (І), де R являє собою метил, X являє собою СН та n=1, у вигляді кристалів блідожовтого кольору (за даними ВЕРХ чистота становить 99,50%) Приклад 7 Одержання (6-трифторметил)-N-[4-метил-3-(4піридин-3-іл-піримідин-2-іламіно)-феніл]нікотинаміду (І), де R являє собою метил, X являє собою N та n=1 Стадія І: Одержання нового (6-трифторметил)N-(4-метил-3-нітро-феніл)-бензаміду формули (XIII), де R являє собою метил, X являє собою N та n=1 По-перше, 6-трифторметилнікотиноїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином. Тіонілхлорид (15,6 г, 0,13 моль) додають протягом 15 хв до розчину 6-трифторметилнікотинової кислоти (консорціум GEORGANICS, Словацька Республіка) (5,0 г, 0,026 моль) в хлороформі (100 мл) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний 6трифторметилнікотиноїлхлорид охолоджують до кімнатної температури та розчиняють в 10 мл хлороформу. 94570 32 Розчин 4-метил-3-нітроаніліну (2,4 г, 0,016 моль) в хлороформі (50 мл) охолоджують до -5°C та додають триетиламін (8,0 г, 0,08 моль). 6Трифторметилнікотиноїлхлорид, приготовлений, як описано вище, в хлороформі додають по краплях при -5°C протягом 30 хв. Одержану суспензію перемішують протягом 1 год при -5°C. Суспензію фільтрують, промивають охолодженим хлороформом та сушать під вакуумом з одержанням 3,6 г нового (6-трифторметил)-N-(4-метил-3-нітрофеніл)-нікотинаміду формули (XIII), де R являє собою метил, X являє собою N та n=1, з виходом 70% у вигляді кристалів блідо-жовтого кольору (за даними ВЕРХ чистота становить 98,0%) MR-167171°C. Стадія II: Одержання нового (6трифторметил)-N-(3-аміно-4-метилфеніл)нікотинаміду формули (XIV), де R являє собою метил, X являє собою N та n=1 Суспензію (6-трифторметил)-N-(4-метил-3нітро-феніл)-нікотинаміду формули (XIII) (3,6 г, 0,011 моль), одержаного за способом, описаним для стадії І та олова хлориду (12,4 г, 0,055 моль) в абсолютному етанолі (25 мл) нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 30 хв. Далі одержану суспензію охолоджують до кімнатної температури та виливають у 0,28 л льодяної води рН реакційної суміші доводять до 8,0 за допомогою 5% розчину натрію гідроксиду та екстрагують 2x50 мл етилацетату Етилацетатну фракцію послідовно промивають водою і сольовим розчином та сушать над натрію сульфатом Етилацетат повністю відганяють, до залишку додають 10 мл гексану та фільтрують Залишок на фільтрі сушать під вакуумом при температурі 60°C з одержанням 3,0 г нового (3-трифторметил)-N-(3-аміно-4-метилфеніл)-бензаміду формули (XIV), де R являє собою метил, X являє собою N та n=1, з виходом 92% у вигляді жовтих кристалів (за даними ВЕРХ чистота становить 98%) MR-174-180 5°C. Стадія III: Одержання (6-трифторметил)-N-(3гуанідино-4-метил-феніл)-нікотинаміду формули (XV), де R являє собою метил, X являє собою N та n=1 Суспензію (6-трифторметил)-N-(3-аміно-4метил-феніл)-нікотинаміду формули (XIV), одержаного за способом, описаним для стадії (II) (3,0 г, 0,01 моль), в н-бутанолі (20 мл) послідовно обробляють концентрованою сірчаною кислотою до досягнення рН 2,5 (0,65 г) та розчином ціанаміду (0,64 г, 0,015 моль) у воді (1 мл) протягом 5 хв. Одержану реакційну суміш перемішують при температурі кипіння із зворотним холодильником протягом 5 год. Далі реакційну суміш упарюють під вакуумом до повного видалення розчинника, і залишку дозволяють охолонути до кімнатної температури. Суміш 12 мл метанолу та 12 мл ізопропілового ефіру (ІРЕ) додають до реакційної маси і перемішують при кімнатній температурі протягом 1 год. Продукт відфільтровують під тиском, промивають сумішшю метанолу та ізопропілового ефіру (ІРЕ) (3x10 мл) та сушать під вакуумом при 60°C з одержанням 1,70 г солі (6-трифторметил)-N-(3гуанідино-4-метил-феніл)-нікотинаміду нітрату 33 формули (XV), де R являє собою метил, X являє собою N та n=1, з виходом 50% від теоретичного (за даними ВЕРХ чистота становить 99,1%) MR287,6-292,4°C. Стадія (IV): Одержання (6-трифторметил)-N[4-метил-3-(4-піридин-3-іл-піримідин-2-іл-аміно)феніл]-нікотинаміду формули (І), де R являє собою метил, X являє собою N та n=1 Суспензію солі (6-трифторметил)-N-(3гуанідино-4-метил-феніл)-нікотинаміду нітрату, одержаного за способом, описаним для стадії (XV) (1,7 г, 0,005 моль), в н-бутанолі (12 мл) в атмосфері азоту послідовно обробляють пластівцями натрію гідроксиду (0,22 г, 0,005 моль) та 3диметиламіно-1-піридин-3-іл-пропеноном (0,85 г, 0,005 моль). Одержану суспензію нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 2 год. Реакційна суміш перетворюється на гомогенний розчин насиченого оранжевого кольору, після чого диметиламін видаляють шляхом дистиляції нбутанолу. Реакційну масу охолоджують до кімнатної температури, додають суміш води та хлороформу (50 мл + 50 мл) і хлороформну фракцію відокремлюють. Хлороформну фракцію промивають водою та упарюють до залишкового об'єму 5 мл. Етилацетат (25 мл) додають до реакційної маси та фільтрують під тиском. Відокремлену тверду речовину промивають етилацетатом та водою і сушать під вакуумом при 60°C. Вихід 1,4 г (62% від теоретичного) нового (6-трифторметил)-N-[4метил-3-(4-піридин-3-іл-піримідин-2-іл-аміно)феніл]-нікотинаміду формули (І), де R являє собою метил, X являє собою N та n=1, у вигляді кристалів блідо-жовтого кольору (за даними ВЕРХ чистота становить 99,9%) MR-243-244°C. 1 Н-ЯМР (400 МГц, ДМСО-d6, ):2,2 (с, 3H), 7,20-9,28 (арил, 12), 10,7 (с, 1Н). Елементний аналіз: С23H17F3N6О Молекулярна маса: 450,0 ІЧ: диск KBr -1 -NH-C=О: 3444 см -1 -NH-C=О: 1648 см Приклад 8 Альтернативний спосіб одержання (6трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-нікотинамід (І), де R являє собою метил, X являє собою N та n=1 По-перше, 6-трифторметилнікотиноїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином. Тіонілхлорид (15,6 г, 0,13 моль) додають протягом 15 хв до розчину 6трифторметилнікотинової кислоти (консорціум GEORGANICS, Словацька Республіка) (5,0 г, 0,026 моль) в хлороформі (100 мл) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний 6трифторметилнікотиноїлхлорид охолоджують до кімнатної температури та розчиняють в 10 мл хлороформу. 94570 34 Розчин N-(5-аміно-2-метилфеніл)-4-(3піридил)-2-піримідинаміну формули (XVII) (4,8 г, 0,016 моль) в хлороформі (50 мл) охолоджують до -5°C та додають триетиламін (8,0 г, 0,08 моль). 6Трифторметилнікотиноїлхлорид, одержаний, як описано вище, в хлороформі додають по краплях при -5°C протягом 30 хв. Одержану суспензію перемішують протягом 1 год при -5°C. Суспензію фільтрують, промивають водою демінералізованою та метанолом та сушать під вакуумом з одержанням 4,3 г нового (6-трифторметил)-N-[4-метил3-(4-піридин-3-іл-піримідин-2-іламіно)-феніл]нікотинаміду (І), де R являє собою метил, X являє собою N та n=1, з виходом 60% у вигляді кристалів кремового кольору (за даними ВЕРХ чистота становить 98,0%) MR-242-244°C. Приклад 9 Одержання (5-трифторметил)-N-[4-метил-3-(4піридин-3-іл-піримідин-2-іламіно)-феніл]нікотинаміду (І), де R являє собою метил, X являє собою N та n=1 Стадія І: Одержання нового (5-трифторметил)N-(4-метил-3-нітро-феніл)-нікотинаміду формули (XIII), де R являє собою метил, X являє собою N та n=1 По-перше, 5-трифторметилнікотиноїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином. Тіонілхлорид (15,6 г, 0,13 моль) додають протягом 15 хв до розчину 5трифторметилнікотинової кислоти (консорціум GEORGANICS, Словацька Республіка) (5,0 г, 0,026 моль) в хлороформі (100 мл) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний 6трифторметилнікотиноїлхлорид охолоджують до кімнатної температури та розчиняють в 10 мл хлороформу. Розчин 4-метил-3-нітроаніліну (2,4 г; 0,016 моль) в хлороформі (50 мл) охолоджують до -5°C і додають триетиламін (8,0 г, 0,08 моль). 6Трифторметилнікотиноїлхлорид, одержаний, як описано вище, в хлороформі додають по краплях при -5°C протягом 30 хв. Одержану суспензію перемішують протягом 1 год при -5°C. Суспензію фільтрують, промивають охолодженим хлороформом та сушать під вакуумом з одержанням 3,6 г нового (5-трифторметил)-N-(4-метил-3-нітрофеніл)-нікотинаміду формули (XIII), де R являє собою метил, X являє собою N та n=1, з виходом 70% у вигляді кристалів блідо-жовтого кольору (за даними ВЕРХ чистота становить 98,0%)MR-167171°C. Стадія II: Одержання нового (5трифторметил)-N-(3-аміно-4-метил-феніл)нікотинаміду формули (XIV), де R являє собою метил, X являє собою N та n=1 Суспензію (5-трифторметил)-N-(4-метил-3нітро-феніл)-нікотинаміду формули (XIII) (3,6 г, 0,011 моль), одержаного за способом, описаним для стадії І, та олова хлориду (12,4 г, 0,055 моль) в 35 абсолютному етанолі (25 мл) нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 30 хв. Далі одержану суспензію охолоджують до кімнатної температури та виливають у 0,28 л льодяної води. рН реакційної суміші доводять до 8,0 за допомогою 5% розчину натрію гідроксиду та екстрагують 2x50 мл етилацетату. Етилацетатну фракцію послідовно промивають водою і сольовим розчином та сушать над натрію сульфатом. Етилацетат повністю випарюють, 10 мл гексану додають до залишку та фільтрують. Залишок на фільтрі сушать під вакуумом при 60°C з одержанням 3,0 г нового (5-трифторметил)-N-(3-аміно-4-метилфеніл)-нікотинаміду формули (XIV), де R являє собою метил, X являє собою N та n=1, з виходом 92% у вигляді жовтих кристалів (за даними ВЕРХ чистота становить 98%). MR-174-180,5°C. Стадія III: Одержання (5-трифторметил)-N-(3гуанідино-4-метил-феніл)-нікотинаміду формули (XV), де R являє собою метил, X являє собою N та n=1 Суспензію (5-трифторметил)-N-(3-аміно-4метил-феніл)-нікотинаміду формули (XIV), одержаного за способом, описаним для стадії (II) (3,0 г, 0,01 моль) в н-бутанолі (20 мл) послідовно обробляють концентрованою сірчаною кислотою до досягнення рН 2,5 (0,65 г) та розчином ціанаміду (0,64 г, 0,015 моль) у воді (1 мл) протягом 5 хв. Одержану реакційну суміш перемішують при температурі кипіння із зворотним холодильником протягом 5 год. Далі реакційну суміш упарюють під вакуумом до повного видалення розчинника і залишку дозволяють охолонути до кімнатної температури. Суміш 12 мл метанолу та 12 мл ізопропілового ефіру (ІРЕ) додають до реакційної маси і перемішують при кімнатній температурі протягом 1 год. Продукт відфільтровують під тиском, промивають сумішшю метанолу та ізопропілового ефіру (ІРЕ) (3x10 мл) і сушать під вакуумом при 60°C з одержанням 1,70 г солі (5-трифторметил)-N-(3гуанідино-4-метил-феніл)-нікотинаміду нітрату формули (XV), де R являє собою метил, X являє собою N та n=1, з виходом 50% від теоретичного (за даними ВЕРХ чистота становить 99,1%). MR287,6-292,4°C. Стадія (IV): Одержання (5-трифторметил)-N[4-метил-3-(4-піридин-3-іл-піримідин-2-іл-аміно)феніл]-нікотинаміду формули (І), де R являє собою метил, X являє собою N та n=1 Суспензію солі (5-трифторметил)-N-(3гуанідино-4-метил-феніл)-нікотинаміду нітрату, одержаного за способом, описаним для стадії (XV) (1,7 г, 0,005 моль), в н-бутанолі (12 мл) в атмосфері азоту послідовно обробляють пластівцями натрію гідроксиду (0,22 г, 0,005 моль) та 3диметиламіно-1-піридин-3-іл-пропеноном (0,85 г, 0,005 моль). Одержану суспензію нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 2 год. Реакційна суміш перетворюється на гомогенний розчин насиченого оранжевого кольору, після чого диметиламін видаляють шляхом дистиляції нбутанолу. Реакційну масу охолоджують до кімнатної температури, додають суміш води та хлоро 94570 36 форму (50 мл + 50 мл) та хлороформну фракцію відокремлюють. Хлороформну фракцію промивають водою та упарюють до залишкового об'єму 5 мл. Етилацетат (25 мл) додають до реакційної маси та відфільтровують під тиском, відокремлену тверду речовину послідовно промивають етилацетатом і водою та сушать під вакуумом при 60°C. Вихід: 1,4 г (62% від теоретичного) нового (5трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іл-аміно)-феніл]-нікотинаміду формули (І), де R являє собою метил, X являє собою N та n=1, у вигляді кристалів блідо-жовтого кольору, (за даними ВЕРХ чистота становить 99,9%). MR-243244°C. 1 Н-ЯМР (400 МГц, ДМСО-d6, ): 2,2 (с, 3H); 7,20-9,28 (арил, 12); 10,7 (с, 1Н). Елементний аналіз: C23H17F3N6O Молекулярна маса: 450,0 ІЧ: диск KBr -1 -NH-C=О: 3444 см -1 -NH-C=О: 1648 см Приклад 10 Альтернативний спосіб одержання (5трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-нікотинаміду (І), де R являє собою метил, X являє собою N та n=1 По-перше, 5-трифторметилнікотиноїлхлорид, який використовують як один з вихідних матеріалів, одержують наступним чином. Тіонілхлорид (15,6 г, 0,13 моль) додають протягом 15 хв до розчину 5-трифторметилнікотинової кислоти (5,0 г, 0,026 моль) в хлороформі (100 мл) при кімнатній температурі. Реакційну суміш нагрівають до температури кипіння із зворотним холодильником, витримуючи при цій температурі протягом 1 год. Надлишок тіонілхлориду видаляють сумісною дистиляцією з хлороформом при зниженому тиску і температурі 40°C. Після закінчення дистиляції одержаний 6трифторметилнікотиноїлхлорид охолоджують до кімнатної температури та розчиняють в 10 мл хлороформу. Розчин N-(5-аміно-2-метилфеніл)-4-(3піридил)-2-піримідинаміну формули (XVII) (4,8 г, 0,016 моль) в хлороформі (50 мл) охолоджують до -5°C і додають триетиламін (8,0 г, 0,08 моль). 6Трифторметилнікотиноїлхлорид приготовлений, як описано вище, в хлороформі додають по краплях при температурі -5°C протягом 30 хв. Одержану суспензію перемішують протягом 1 год при -5°C. Суспензію фільтрують, промивають водою демінералізованою і метанолом та сушать під вакуумом з одержанням 4,3 г нового (5-трифторметил)N-[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)феніл]-нікотинаміду (І), де R являє собою метил, X являє собою N та n=1, з виходом 60% у вигляді кристалів кремового кольору (за даними ВЕРХ чистота становить 98,0%) MR-242-244°C. Приклад 11 Капсули, що містять 25 мг та 50 мг сполук, одержаних за способом, описаним в Прикладі 1, (3-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)-феніл]-бензаміду, та Прикладі 3 - (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-іл-піримідин-2-іламіно)-феніл]-бензаміду, 37 94570 38 наступного складу (в таблиці нижче) виготовляли традиційним способом. Інгредієнт ПВП Лактоза Тальк Кросповідон Магнію стеарат Натрію лаурилсульфат (SLS) Сполука формули І (3,5-бістрифторметил)-N-[4-метил-3-(4піридин-3-іл-піримідин-2-іламіно)феніл]-бензамід мг/капсулу* 25,0 25,0 127,0 0,5 20,0 0,5 2,0 Дослідження in vitro Сполуки формули І, одержані за способом, описаним в Прикладі 1 та Прикладі З, для проведення досліджень in vitro розчиняли в середовищі для культивування клітин з концентрацією ДМСО 10 мМ. Запасний розчин додатково розбавляли вказаним середовищем для культивування клітин та використовували в концентраціях 0,1-10 мкм для експериментів. Для одержання результатів, розкритих в даному описі, використовували BCR-abl-позитивну лінію клітин K562 (безперервна лінія клітин, започаткована Lozzio та Lozzio [1975] з плеврального ексудату жінки віком 53 роки з хронічною мієлоїдною лейкемією в стадії термінальної бластної кризи) та лінію клітин D32p210 (BCR-ablтрансфікована лінія клітин). Клітини K562 та D32p210 вирощували в середовищі Меморіального Інституту Росвелла Парка (RPMI) з додаванням 10% сироватки телячого ембріону при 37°C, 5% СО2 та 95% повітря. Клітини перевивали кожні 24 год. Проліферацію клітин у відповідності до аналі3 зу МТТ забезпечували наступним чином: 5x10 клітин висівали в кожну ячейку 96-ячейкого планшету та додавали різні концентрації сполук формули (І) в інтервалі від 1 нМ до 100 мкМ в чотириразовому повторенні. Після інкубації клітин із сполуками протягом необхідного періоду часу (24 год) додавали 20 мл 5 мг/мл МТТ (кінцева концентрація 100 мкг/мл) та інкубували протягом додаткових 3 год при 37°C з 5% СО2. Після проходження 3 год кристали формазану розчиняли в буфері лізису (10% натрію лаурилсульфату [SDS], 5% ізобутанолу, 12 ммоль/л НСІ) при 37°C. Оптичну густину вимірювали на пристрої для зчитування ELISA на подвійній довжині хвилі 570-630 нм. З використанням МТТ аналізу обчислювали значення ІС50 сполук формули (І). Одержані значення становили 8 нМ та 0,7 нМ, відповідно, як показано на доданих до опису Фіг. 1 та Фіг. 2. Аналіз фрагментації ДНК здійснювали наступним чином. Клітини обробляли сполуками формули (І) протягом 24 год і фрагментовану ДНК добували з використанням методу екстракції натрію лаурилсульфатом/Протеїназою К/РНКазою, який дозволяє витягати тільки фрагментовану ДНК без забруднення геномною ДНК (Nucleic acids Res -22: 5506-5507, 1994). Клітини промивали в холодному Сполука формули І (3трифторметил)-N-[4-метил-3-(4піридин-3-іл-піримідин-2-іламіно)феніл]-бензамід мг/капсулу* 50,0 50,0 77,0 0,5 20,0 0,5 2,0 фосфатному буферному розчині (ФБР) та здійснювали лізис в буфері, що містив 50 мМ Трис НСІ (рН 8,0), 1 мМ ЕДТА, 0,2% тритону Х-100 протягом 20 хв при 4°C. Після центрифугування при 14 000 g протягом 15 хв супернатант обробляли протеїназою K (0,5 мг/мл) та 1% натрію додецилсульфатом (SDS) протягом 1 год при 50°C. ДНК екстрагували двічі буферизованим фенолом та осаджували за допомогою 140 мМ NaCI та 2 об'ємів етанолу при -20°C, протягом ночі. Осад ДНК двічі промивали в 70% етанолі, розчиняли в ТрисЕДТА (ТЕ) та обробляли РНКазою протягом 1 год при 37°C. Білкові мікролітри (мкл) ДНК змішували з 3 мкл буферу зразка ДНК (0,25% бромфенолового блакитного, 0,25% ксиленціанолу та 30% гліцерину) та розділяли в 1% агарозному гелі в ТВЕ (44,6 мМ Трис, 445 мМ борної кислоти та 1 мМ ЕДТА). Фрагментацію ДНК візуалізували шляхом забарвлення агарозного гелю етидію бромідом (0,5 мг/мл) та освітлення УФ-світлом. На наявність апоптоза вказувала поява східців фрагментів олігонуклеосомальної ДНК, що є були кратними приблизно 180-200 пар основ. Фрагменти ДНК в гелі чітко демонструють, що сполуки формули (І), визначеної вище, спричиняють апоптоз в лінії BCRАblпозитивних клітин K562, як показано на Фіг. 3. Аналіз FACS: Аналіз із сортуванням активованих клітин за флуоресценцією (FACS) здійснювали наступним чином. Для кількісного визначення апоптоза в клітинах D32p210, оброблених сполуками формули (І), одержаними за способом, описаним в Прикладі 1 та Прикладі 3, проводили флоуцитометричний аналіз з використанням пропідію йодиду (ПЙ). Клітини D32p210 обробляли сполуками формули (І) протягом 24 год. Після обробки клітини двічі промивали льодяним ФБР та поступово фіксували за допомогою 1 мл льодяного 70% етанолу, витримуючи при температурі при 4°C протягом ночі. Клітини збирали центрифугуванням при 500xg протягом 10 хв, двічі промивали ФБР та повторно суспендували в 1 мл розчину для забарвлення ДНК, що містив 0,1% тритону X -100, 0,1 мМ ЕДТА, РНКазу (50 мкг/мл) та 50 мкг/мл пропідію йодиду (ПЙ) та інкубували протягом 1 год в темряві при кімнатній температурі. Червону флуоресценцію окремих клітин вимірювали за допомогою флоуци 39 тометра (Becton Dickinson, san Jose, Каліфорнія, США), придатного для сортування за флуоресценцією активованих клітин (FACS). Було зареєстровано мінімум 10000 імпульсів для зразку. Відносний підрахунок ДНК на клітину здійснювали, вимірюючи флуоресценцію ПЙ, який стехіометрично зв'язується з ДНК, як показано на Фіг. 4. Значення константи інгібування kі (константа зв'язування інгібітора з ферментом) або ІС50 (інгібувальна концентрація, при який ріст або активність інгібуються на 50%), одержані в результаті здійснення описаних вище аналізів і досліджень in vitro, визначають міру здатності сполук формули (І) до інгібування, визначеної вище, та показані на Фіг. 5. Аналіз кінази in vitro здійснювали наступним чином: Інгібування активності кінази BCR-abl тирозинкінази сполуками формули І (Приклад 1) визначали за допомогою вестерн-блотингу та денситомет6 ричного аналізу. Якщо коротко, 5х10 клітин 32Dp210 обробляли різними концентраціями сполук формули І (Приклад 1, Стадія IV) протягом 30 хв. В кінці інкубації клітини гранулювали, промивали ФБР та лізували в 50 мкл буфера, який містить 10 мМ Трис-НСІ (рН 8,0), 150 мМ NaCl, 1% Тритону Х-100, 1% Na дезоксихолату, 0,1 мМ Na ортованадату, 50 мМ гліцерофосфату, 50 мМ NaF, 1 мМ фенілметилсульфонілфториду, 10 мкг/мл лейпептину та 10 мкг/мл пепстатину. Контролем були клітини без лікарського засобу. Рівні кількості білків розчиняли в 6% гелі натрію лаурилсульфату та переносили на нітроцелюлозну мембрану. Після блокування за допомогою 5% знежиреного сухого молока, додавали первинне антитіло (антифосфотирозинове антитіло). Блотинг здійснювали з використанням вторинного антитіла, кон'югованого з лужною фосфатазою. Інтенсивність стрічки BCR-abl кінази визначали шляхом денситометричного аналізу. Апоптоз, спричинений сполуками формули 1 (Приклад 1, стадія IV), спостерігали за допомогою фазово-контрастної мікроскопії. Відсоток апоптоза становив 53,3%. Сполуки формули І, одержані за описаним у Прикладі 1 способом, інгібували кіназ 94570 40 ну активність BCR-abl кінази в клітинах 32Dp210 дозозалежним чином, та значення ІС50, обчислене за допомогою денситометричного аналізу, становило 4 нМ. Дослідження ex vivo здійснювали наступним чином: Лімфоцити екстрагували з периферичної крові, відібраної у хворих на ХМЛ та здорових осіб, з використанням Ficoll Histopaque. Якщо коротко, кров розбавляли у співвідношенні 1:1 0,96% NaCl (сольовий розчин) та обережно наносили на градієнт Ficoll histopaque. Лейкоцитарну плівку лімфоцитів екстрагували шляхом центрифугування при 1000 об/хв протягом 20 хв при кімнатній температурі. Лімфоцити обережно збирали з поверхні з використанням піпетки Пастера та промивали один раз середовищем Меморіального Інституту Росвелла Парка (RPMI). Одержані, як описано вище, лімфоцити культивували в середовищі Меморіального Інституту Росвелла Парка (RPMI), яке містило 10% ФБР при 37°C з 5% СО2. Клітини перевивали кожні 48 год. Після 48 год культивування клітини (від хворих на ХМЛ та здорових осіб) висівали на 963 ячейковий планшет з щільністю 5x10 клітин/ячейку. Сполуки формули (І), одержані за описаним в Прикладі 1 та Прикладі 3 способом, додавали в різних концентраціях до клітин та інкубували протягом 24 год. Після закінчення періоду інкубації до клітин додавали МТТ та інкубували ще протягом 3 год. Утворені кристали формазану розчиняли в буфері лізису та оптичну густину вимірювали на подвійній довжина хвилі 570-630 нм. Відсоток інгібування проліферації клітин обчислювали по відношенню до клітин, що не реагували. Відсоток інгібування проліферації клітин, одержаний в результаті аналізу МТТ, наведені в таблиці (Фіг. 6). Переваги винаходу: 1. Розкриті нові сполуки формули (І) та нові проміжні сполуки. 2. Нові сполуки формули (І) потенційно являють собою лікувальні агенти, придатні для лікування ХМЛ, що продемонстровано дослідженнями in vitro та ex-vivo. 41 94570 42 43 94570 44 45 94570 46 47 94570 48 49 94570 50 51 Комп’ютерна верстка О.Гапоненко 94570 Підписне 52 Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenylaminopyrimidine derivatives as inhibitors of bcr-abl kinase
Автори англійськоюKompella Amala Kishan, Adibhatla Kali Satya Bhujanga Rao, Rachakonda Sreenivas, Podili Khadgapatkhi, Venkaiah Chowdary Nannapaneni
Назва патенту російськоюПроизводные фениламинопиримидина как ингибиторы bcr-abl киназы
Автори російськоюКомпелла Амала кишан, Адибхатла Кали Сатия Бхуджанга рао, Рачаконда Среенивас, Подили Кхадгапатхи, Венкаиах Чоудари Наннапанени
МПК / Мітки
МПК: C07D 401/04, C07D 213/82, C07C 233/66, C07D 401/14, C07C 233/80, A61K 31/506, A61P 35/02
Мітки: похідні, інгібітори, кінази, bcr-abl, феніламінопіримідину
Код посилання
<a href="https://ua.patents.su/26-94570-pokhidni-fenilaminopirimidinu-yak-ingibitori-bcr-abl-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні феніламінопіримідину як інгібітори bcr-abl кінази</a>
Попередній патент: Спосіб формування поїздів із окремих вагонів
Наступний патент: Похідні 3-ариламінопіридинів
Випадковий патент: Спосіб діагностики недостатності лютеїнової фази оваріального циклу при безплідді трубно-перитонеального ґенезу












