Фармацевтична композиція ребаміпіду
Формула / Реферат
1. Фармацевтична композиція, що містить (1) ребаміпід, (2) аміноцукор і (3) буферний агент, яка не містить неорганічний катіон.
2. Фармацевтична композиція за п. 1, в якій аміноцукор являє собою щонайменше один, вибраний з групи, яка складається з D-глюкозаміну і меглуміну.
3. Фармацевтична композиція за п. 1 або 2, в якій буферний агент являє собою щонайменше один, вибраний з групи, яка складається з борної кислоти, фосфорної кислоти і амінокислоти.
4. Фармацевтична композиція за будь-яким з пп. 1-3, що додатково містить регулятор рН.
5. Фармацевтична композиція за будь-яким з пп. 1-4, що додатково містить солюбілізуючий агент.
6. Фармацевтична композиція за п. 5, в якій солюбілізуючий агент являє собою щонайменше один, вибраний з групи, яка складається з полівінілпіролідону і макроголу.
7. Фармацевтична композиція за будь-яким з пп. 1-6, де фармацевтична композиція являє собою офтальмологічну фармацевтичну композицію.
8. Застосування фармацевтичної композиції за будь-яким з пп. 1-7 для лікування сухості очей шляхом місцевого введення в очі.
Текст
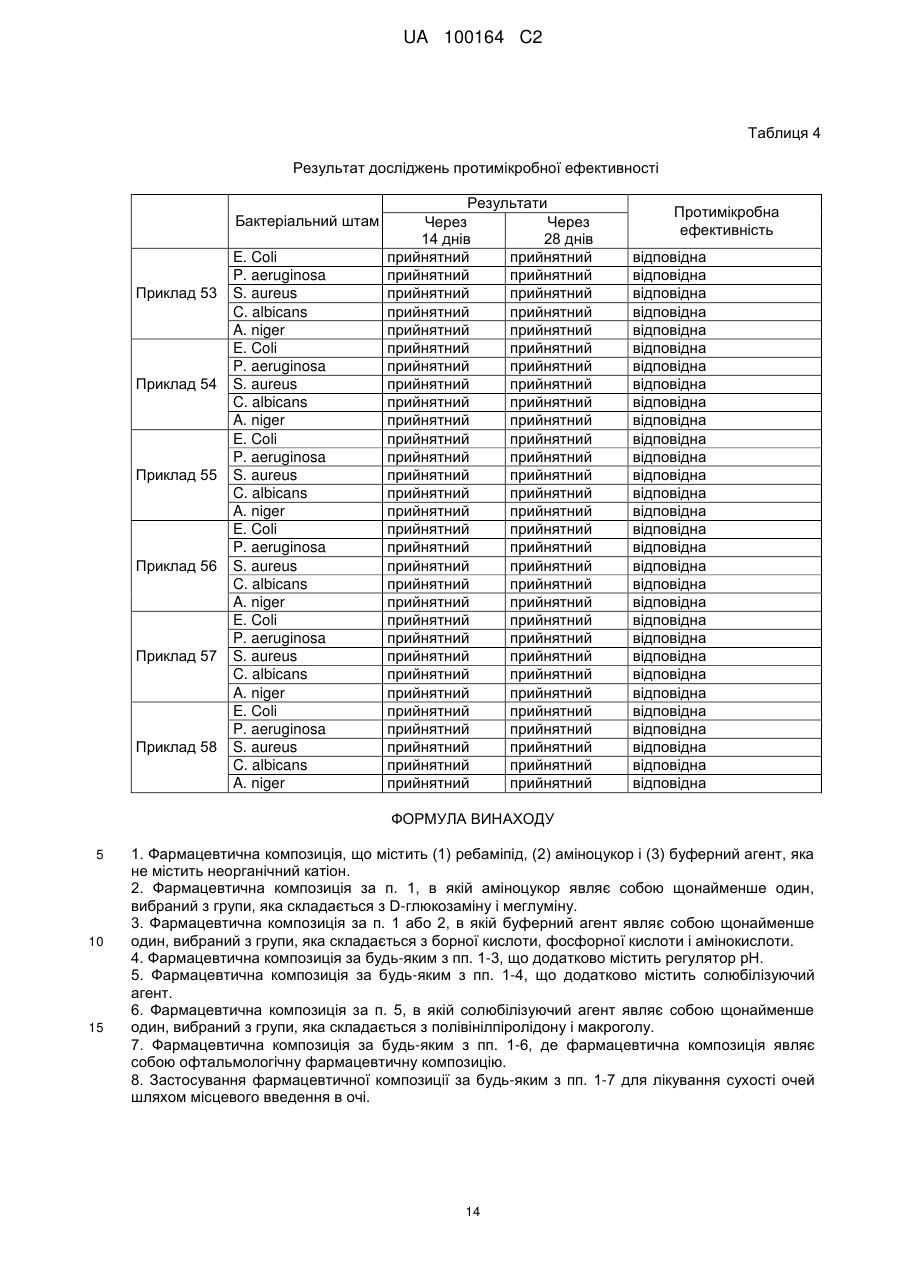
Реферат: Винахід стосується фармацевтичної композиції, яка містить ребаміпід, що не вимагає повторного диспергування, має достатню прозорість та рН від нейтрального до слабкокислого. Дана композиція містить (1) ребаміпід, (2) аміноцукор і (3) буферний агент та не містить неорганічного катіона. UA 100164 C2 (12) UA 100164 C2 UA 100164 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки винаходу Даний винахід стосується фармацевтичної композиції. Попередній рівень техніки Ребаміпід [хімічна назва: (±)-2-(4-хлорбензоїламіно)-3-(2-хінолон-4-іл)пропіонова кислота] відомий як корисний противиразковий лікарський засіб. Крім того, ребаміпід має посилюючу дію на щільність келихоподібних клітин в оці, посилюючу дію на продукцію слизу в оці і посилюючу дію на продукцію слізної рідини, і вже відомий як засіб для лікування сухості очей, тобто, синдрому сухого ока (WO 97/013515). Ребаміпід розчинний в лужних водних розчинах, але його розчинність в нейтральних розчинах надто низька. З іншого боку, очні краплі з високим pH непридатні для пацієнта, який страждає на порушення функції кератокон'юктиви, такої як сухість очей. Крім цього, навіть у випадку лужного розчину, що містить ребаміпід, іноді можуть утворюватися кристали ребаміпіду, і, таким чином, вважається, що розробки офтальмологічних виробів на водній основі, що містять ребаміпід, є складною задачею. WO 97/013515 розкриває нейтральну водну суспензію, що містить ребаміпід. Однак суспензія може утворити шар осаду при стоянні протягом довгого часу. Таким чином, суспензію потрібно добре збовтувати для того, щоб повторно диспергувати. Крім того, такий продукт у вигляді суспензії може, як вважають, мати деякі недоліки, наприклад, спричиняти страждання від розфокусування зору і залишати білі плями на одязі, оскільки продукт у вигляді суспензії є білою офтальмологічною суспензією. WO 2008/050896 розкриває аналогічну суспензію, що містить ребаміпід, в якій ребаміпід стійко диспергований в стані дрібних частинок, і, крім того, дрібні частинки не піддаються повторній аглютинації. Водна суспензія, що містить ребаміпід, в WO 2008/050896 поліпшена по суспендованості в порівнянні з продукцією вищезазначеного WO 97/013515. Однак водну суспензію, що містить ребаміпід, в WO 2008/050896 також необхідно добре збовтувати для повторного диспергування, оскільки суспензія в WO 2008/050896 являє собою білу офтальмологічну суспензію, в якій ребаміпід розчинений не повністю, і неможливо уникнути утворення шару осілого ребаміпіду при стоянні протягом довгого часу. Більш того, такі недоліки, як страждання від розфокусування зору і білі плями на одязі при розливанні суспензії, все ще не були усунені в WO 2008/050896. WO 2006/052018 розкриває водну суспензію, що містить кристалічний ребаміпід, яка включає суміш щонайменше однієї зі сполук, вибираних з водорозчинних полімерів і поверхнево-активних речовин, водного кислого розчину і водного розчину, що містить водорозчинну сіль ребаміпіду, яку не потрібно повторно диспергувати, що має достатню прозорість і представляє собою нейтральну суспензію, що не викликає пошкодження кератокон'юктиви у пацієнтів, які страждають на сухість очей. Однак водна суспензія, що містить кристалічний ребаміпід в WO 2006/052018, має проблему, пов'язану з високою собівартістю, оскільки для здійснення процесу потрібне обладнання, що дорого коштує, таке як гомогенізатор високого тиску, колоїдний млин і сонікатор, і виробничий процес є важким, складним і тривалим. Взагалі, для запобігання мікробному зараженню до звичайних офтальмологічних засобів додають консервант. Однак для пацієнта, страждаючого на порушення, пов'язане з рогівкою, такого як сухість очей, необхідний офтальмологічний засіб, що не містить консерванту, оскільки консервант шкідливий для пацієнта. Відомі ємності для офтальмологічного агента, що не містить консерванту, включають одноразову пластикову упаковку з однократною дозою і ємність для багаторазового застосування, забезпечену фільтром, який здатний затримувати бактерії поблизу отвору крапельниці. Однак водні суспензії у вищезазначених WO 2008/050896 і WO 2006/052018 важко пропускати через фільтр, таким чином, стає неможливим використовувати ємність для багаторазового застосування і необхідно використовувати порівняно дорогу упаковку з однократною дозою. Таким чином, потрібно розробити фармацевтичну композицію, що містить ребаміпід, яка не вимагає повторного диспергування, має достатню прозорість і має рівень рН від нейтрального до слабко кислого, що не заподіює шкоду кератокон'юктиві пацієнта, страждаючого на сухість очей, і недорогий спосіб отримання такої фармацевтичної композиції без використання обладнання, що дорого коштує. Суть винаходу (Проблема, яка вирішена винаходом) Задачею даного винаходу є надання фармацевтичної композиції, що містить ребаміпід, що не вимагає повторного диспергування, що має достатню прозорість і має рН від нейтрального 1 UA 100164 C2 5 10 15 20 25 30 35 40 45 50 55 60 до слабко кислого, що не заподіює шкоди кератокон'юктиві пацієнта, страждаючого на сухість очей. Зокрема, фармацевтична композиція є офтальмологічною композицією. Крім того, задачею даного винаходу є надання фармацевтичної композиції, яку можна виготувати з низькою вартістю без використання обладнання, що дорого коштує. (Спосіб розв'язання проблеми) Для рішення вищевказаної задачі автори даного винаходу провели ретельне дослідження і потім виявили, що фармацевтична композиція, яка містить (1) ребаміпід, (2) аміноцукор і (3) буферний агент, що не містить катіону, має хорошу здатність повторно диспергуватися і має підвищену прозорість. Крім того, автори даного винаходу виявили, що дана фармацевтична композиція має протимікробну ефективність. На основі отриманих нових даних був реалізований даний винахід. Даний винахід надає фармацевтичні композиції і їх застосування, як показано в наступних абзацах [1]-[8]. [1] Фармацевтична композиція, що містить (1) ребаміпід, (2) аміноцукор і (3) буферний агент, що не містить неорганічного катіона. [2] Фармацевтична композиція згідно з абзацом [1], в якій аміноцукор являє собою щонайменше один, вибраний з групи, яка складається з D-глюкозаміну і меглуміну. [3] Фармацевтична композиція згідно з абзацом [1] або [2], в якій буферний агент являє собою щонайменше один, вибраний з групи, яка складається з борної кислоти, фосфорної кислоти і амінокислоти. [4] Фармацевтична композиція за будь-яким з абзаців [1-3], що додатково містить регулятор рН. [5] Фармацевтична композиція за будь-яким з абзаців [1-4], що додатково містить солюбілізатор. [6] Фармацевтична композиція згідно з абзацом [5], в якій солюбілізатор являє собою щонайменше один, вибраний з групи, яка складається з полівінілпіролідону і макроголу. [7] Фармацевтична композиція за будь-яким з абзаців [1-6], де фармацевтична композиція являє собою офтальмологічну фармацевтичну композицію. [8] Застосування фармацевтичної композиції за будь-яким з абзаців [1-7] для лікування сухості очей шляхом місцевого введення в очі. Фармацевтична композиція за даним винаходом являє собою композицію, що містить (1) ребаміпід, (2) аміноцукор і (3) буферний агент, що не містить неорганічного катіона. Фармацевтична композиція, переважно, складена у вигляді рідкого розчину на водній основі і, більш переважно, застосовується як офтальмологічна фармацевтична композиція. Концентрація ребаміпіду в фармацевтичній композиції за винаходом складає від приблизно 0,1 % (мас./об.) до приблизно 5 % (мас./об.), переважно від приблизно 0,5 % (мас./об.) до приблизно 3 % (мас./об.), більш переважно від приблизно 1 % (мас./об.) до приблизно 2 % (мас./об.). Наприклад, "1 % (мас./об.)", що використовується в даному описі, означає концентрацію 1 г на 100 мл. Використовуваний тут катіон належить до неорганічного катіону і включає, наприклад, одновалентний катіон лужного металу, такий як іон літію, іон натрію, іон калію і іон цезію і двовалентний катіон лужноземельного металу, такий як іон магнію і іон кальцію. Використовуваний тут термін "фармацевтична композиція не містить неорганічного катіона" означає "фармацевтична композиція фактично не містить неорганічного катіона". Більш детально, це означає, що кількість неорганічного катіона в фармацевтичній композиції складає менше 15 мЕкв, переважно менше 1,5 мЕкв, більш переважно менше 0,3 мЕкв. Використовуваний тут аміноцукор включає, наприклад, меглумін (тобто N-метил-Dглюкамін), D-глюкозамін, D-галактозамін, D-манозамін, мікозамін, канозамін, неозамін С, Nметил-L-глюкозамін, мікамінозу, мурамову кислоту і стрептамін. Серед цих аміноцукрів переважними аміноцукрами є меглумін, D-глюкозамін, Dгалактозамін, D-манозамін, микозамін, канозамін, неозамін С, N-метил-L-глюкозамін, мікаміноза, мурамова кислота і стрептамін; особливо меглумін і D-глюкозамін є найбільш переважними. Вищезазначені аміноцукри можна використовувати у вигляді одиночного інгредієнта або в комбінації, що складається з двох або декількох інгредієнтів. Концентрація аміноцукру в фармацевтичній композиції за винаходом складає, наприклад, від приблизно 0,1 % (мас./об.) до приблизно 15 % (мас./об.), переважно від приблизно 0,5 % (мас./об.) до приблизно 10 % (мас./об.), більш переважно від приблизно 1 % (мас./об.) до приблизно 8 % (мас./об.). Використовуваний тут буферний агент включає, наприклад, кислоту в некатіонній формі, таку як борна кислота, фосфорна кислота, амінокислота і органічна кислота; переважно, 2 UA 100164 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовуються борна кислота і фосфорна кислота. Вищезазначені буферні агенти можна використовувати у вигляді одиночного інгредієнта або в комбінації, що складається з двох або декількох інгредієнтів. Концентрація буферного агента в фармацевтичній композиції за винаходом складає, наприклад, від приблизно 0,01 % (мас./об.) до приблизно 4 % (мас./об.), переважно від приблизно 0,03 % (мас./об.) до приблизно 3 % (мас./об.), більш переважно від приблизно 0,05 % (мас./об.) до приблизно 2 % (мас./об.). Фармацевтична композиція за винаходом може необов'язково містити регулятор pH. Регулятор pH включає, наприклад, звичайну кислоту в некатіонній формі, таку як соляна кислота, молочна кислота, оцтова кислота, сірчана кислота, азотна кислота, вугільна кислота, фосфорна кислота і лимонна кислота; переважно, використовують соляну кислоту і лимонну кислоту. Регулятори pH можна використовувати у вигляді одиночного інгредієнта або в комбінації, що складається з двох або декількох інгредієнтів. Фармацевтична композиція за винаходом може необов'язково містити ізотонічний агент для того, щоб зробити фармацевтичну композицію ізотонічною сльозі, яка містить воду. Ізотонічний агент переважно являє собою ізотонічний агент, вільний від катіонів, який включає звичайний агент для офтальмологічного розчину, такий як маніт, гліцерин, поліпропіленгліколь, поліетиленгліколь, мальтоза, цукроза, сорбіт і глюкоза, більш переважно, використовуються вільні від катіонів гліцерин і цукрозу. Ізотонічні агенти можна використовувати як єдиний інгредієнт або в комбінації, що складається з двох або декількох інгредієнтів. Фармацевтична композиція за винаходом може необов'язково містити солюбілізуючий агент. Солюбілізуючий агент включає, наприклад, солюбілізуючий агент, який не містить катіонів. Солюбілізуючий агент, який не містить катіонів, включає, наприклад, полімер, такий як полівінілпіролідон, макрогол (поліетиленгліколь), полівініловий спирт і гідроксиметилцелюлозу; поверхнево-активну речовину, таку як полісорбат, поліоксіетиленовий ефір гідрованої жирної кислоти і поліоксіетилен-поліоксипропілен; багатоатомний спирт, такий як поліпропіленгліколь; органічну кислоту, таку як бензойна кислота і сорбінова кислота; амінокислоту, таку як альгінова кислота, гістидин, гліцин і лізин; і похідне ксантину, таке як кофеїн. Переважний солюбілізуючий агент являє собою полівінілпіролідон, макрогол, полівініловий спирт, бензойну кислоту, сорбінову кислоту і альгінову кислоту; особливо, більш переважними солюбілізуючими агентами є полівінілпіролідон і макрогол. Солюбілізуючі агенти можна використовувати як єдиний інгредієнт або в комбінації, що складається з двох або декількох інгредієнтів. Молекулярна маса полівінілпіролідону, що використовується тут, переважно складає не більше 200000, більш переважно не більше 40000. Переважний полівінілпіролідон включає, але не обмежується, полівінілпіролідон (PVP, BASF, марка: Kollidon® 25): PVP (K-25) і полівінілпіролідон (PVP, BASF, марка: Kollidon® 17PF): PVP (K-17PF). Співвідношення концентрацій ребаміпіду і полівінілпіролідону переважно становить 20:1-1:20, більш переважно 4:1-1:6. Молекулярна маса макроголу, що використовується тут, переважно складає не більше 50000, більш переважно не більше 10000. Переважний макрогол включає, але не обмежується, макрогол 1500, макрогол 4000, макрогол 6000 і макрогол 20000. Співвідношення концентрацій ребаміпіду і макроголу переважно становить 20:1-1:20, більш переважно 4:1-1:6. У разі додання до даної композиції солюбілізуючого агента, концентрація солюбілізуючого агента звичайно лежить в межах від приблизно 0,01 % (мас./об.) до приблизно 15 % (мас./об.), переважно від приблизно 0,1 % (мас./об.) до приблизно 10 % (мас./об.), більш переважно від приблизно 0,5 % (мас./об.) до приблизно 6 % (мас./об.). Фармацевтична композиція за винаходом може необов'язково містити консервант, такий як сіль четвертинного амонію (наприклад, бензалконіум хлорид і бензетоніум хлорид, хлоргексидин глюконат, параоксибензоат (наприклад, метилпараоксибензоат і пропілпараоксибензоат), і спиртову сполуку (наприклад, хлорбутанол і бензиловий спирт); і/або стабілізатор, такий як аскорбінова кислота, що не містить неорганічного катіона, і токоферол. У випадку, коли дана фармацевтична композиція являє собою водний рідкий препарат, pH складає приблизно від 3 приблизно до 9, переважно приблизно від 7 приблизно до 9 і найбільш переважно 7,7-9. Співвідношення між (1) ребаміпідом і (2) аміноцукром, що міститься в даній композиції, залежить від типу інгредієнтів, що використовуються тут, і від типу рецептури композиції. Кількість (1) ребаміпіду складає, але не обмежується, наприклад, від приблизно 0,01 до приблизно 10 вагових частин, переважно від приблизно 0,05 до приблизно 2 вагових частин, більш переважно від приблизно 0,1 до приблизно 1,5 вагових частин і найбільш переважно 0,1-1 вагову частину, на одну вагову частину (2) аміноцукру. 3 UA 100164 C2 5 10 15 20 25 30 35 40 Переважна фармацевтична композиція за даним винаходом являє собою фармацевтичну композицію, що містить (1) ребаміпід, (2) меглумін і (3) борну кислоту, яка не містить неорганічного катіона. Більш переважна фармацевтична композиція являє собою фармацевтичну композицію, що містить від 0,5 % (мас./об.) до 3 % (мас./об.) ребаміпіду, від 0,5 % (мас./об.) до 10 % (мас./об.) меглуміну і від 0,03 % (мас./об.) до 3 % (мас./об.) борної кислоти, яка не містить неорганічного катіона. Навіть більш переважна фармацевтична композиція являє собою фармацевтичну композицію, що містить від 1 % (мас./об.) до 2 % (мас./об.) ребаміпіду, від 1 % (мас./об.) до 8 % (мас./об.) меглуміну, від 0,05 % (мас./об.) до 2 % (мас./об.) борної кислоти, і регулятор рН вибирають з групи, яка складається з лимонної кислоти і соляної кислоти, яка не містить неорганічного катіона. Найбільш переважною фармацевтичною композицією є вищезазначена фармацевтична композиція, що додатково містить полівінілпіролідон як солюбілізуючий агент. Концентрація солюбілізуючого агента складає переважно від 0,5 % (мас./об.) до 6 % (мас./об.). (Ефект від винаходу) Прозорість даної фармацевтичної композиції, що містить (1) ребаміпід, (2) аміноцукор і (3) буферний агент можна підвищити при відсутності якого-небудь неорганічного катіона. Дану фармацевтичну композицію не потрібно повторно диспергувати, крім того, її можна скласти по рецептурі у вигляді водного препарату, який має достатню прозорість і має рН від нейтрального до слабко кислого. Дана фармацевтична композиція має антисептичний ефект, таким чином, очікується, що вона виявляє консервуючий ефект. Таким чином, даному водному препарату не потрібно містити звичайний консервант (наприклад, сіль четвертинного амонію, таку як бензалконіум хлорид і бензетоніум хлорид; катіонну сполуку, таку як хлоргексидин глюконат; параоксибензоат, такий як метилпараоксибензоат і пропілпараоксибензоат; і спиртову сполуку, таку як хлорбутанол і бензиловий спирт). Крім того, дана фармацевтична композиція настільки стабільна, що, таким чином, до неї не потрібно додавати стабілізатор (наприклад, аскорбінову кислоту, що не містить неорганічного катіона, або токоферол). Спосіб виробництва даної фармацевтичної композиції можна здійснити при низьких витратах, без важко здійснимого процесу, без застосування спеціального диспергуючого/суспендуючого пристрою, що є великою перевагою промислового масштабу. Даний водний офтальмологічний продукт може запобігти небажаному розфокусуванню зору у застосовуючого його пацієнта, таким чином, очікується значне підвищення його прийнятності для пацієнта, який страждає на сухість очей, і він дає можливість використовувати ємність для багаторазового застосування, забезпечену асептичним фільтром поблизу отвору крапельниці, який призначений для офтальмологічного агента, що не містить консерванту, оскільки його можна пропустити через асептичний фільтр. Таким чином, даний винахід забезпечує великий внесок в медицину. Крім того, дана фармацевтична композиція має відмінну прозорість, таким чином, відсутня прикрість залишити білі плями на одязі при розливанні композиції. Найкращий спосіб здійснення винаходу Даний винахід проілюстрований більш детально наступними прикладами, які не повинні вважатися такими, що обмежують його. Приклад 1 Ребаміпід Полівінілпірролідон (К-25) Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 2г 3г 1,5 г 5,9 г 0,722 г q.s. (до рН=8,3) q.s. 100 мл Примітка: q.s. означає достатню кількість. 45 До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою 4 UA 100164 C2 5 мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою прозорий розчин з кольором від світло-жовтуватого до блідо-жовтуватого. Приклад 2 Ребаміпід Полівінілпірролідон (К-25) Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 10 15 2г 3г 1г 4,3 г 1,185 г q.s. (до рН=8,3) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою прозорий розчин з кольором від світло-жовтуватого до блідо-жовтуватого. Приклад 3 Ребаміпід Полівінілпірролідон (К-25) Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 20 25 2г 1г 1,5 г 6г 0,796 г q.s. (до рН=8,5) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою прозорий розчин з кольором від безбарвного до світло-жовтуватого. Приклад 4 Ребаміпід Полівінілпірролідон (К-25) Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 2г 6г 1,5 г 5,9 г 0,398 г q.s. (до рН=8,3) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, 5 UA 100164 C2 5 регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою прозорий розчин з кольором від світло-жовтуватого до блідо-жовтуватого. Приклад 5 Ребаміпід Полівінілпірролідон (К-25) Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 10 15 1г 3г 1,5 г 4,7 г 0,991 г q.s. (до рН=8,0) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою прозорий розчин з кольором від світло-жовтуватого до блідо-жовтуватого. Приклад 6 Ребаміпід Полівінілпірролідон (К-25) Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 20 25 1г 3г 1г 3,4 г 1,389 г q.s. (до рН=8,0) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою прозорий розчин з кольором від світло-жовтуватого до блідо-жовтуватого. Приклад 7 Ребаміпід Полівінілпірролідон (К-25) Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 1г 1г 1,5 г 5г 1,046 г q.s. (до рН=8,2) q.s. 100 мл 6 UA 100164 C2 5 До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою прозорий розчин з кольором від безбарвного до світло-жовтуватого. 10 Приклад 8 Ребаміпід Полівінілпірролідон (К-25) Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 15 20 25 30 35 40 45 1г 6г 1,5 г 4,7 г 0,676 г q.s. (до рН=8,0) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою прозорий розчин з кольором від світло-жовтуватого до блідо-жовтуватого. Приклад 9 Прозору фармацевтичну композицію з кольором від жовтуватого до блідо-жовтуватого отримували способом, аналогічним прикладу 1, використовуючи полівінілпіролідон (K-17) замість полівінілпіролідону (K-25). Приклад 10 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 2, використовуючи полівінілпіролідон (K-17) замість полівінілпіролідону (K-25). Приклад 11 Прозору фармацевтичну композицію з кольором від безбарвного до блідо-жовтуватого отримували способом, аналогічним прикладу 3, використовуючи полівінілпіролідон (K-17) замість полівінілпіролідону (K-25). Приклад 12 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 4, використовуючи полівінілпіролідон (K-17) замість полівінілпіролідону (K-25). Приклад 13 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 5, використовуючи полівінілпіролідон (K-17) замість полівінілпіролідону (K-25). Приклад 14 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 6, використовуючи полівінілпіролідон (K-17) замість полівінілпіролідону (K-25). Приклад 15 Прозору фармацевтичну композицію з кольором від безбарвного до світло-жовтуватого отримували способом, аналогічним прикладу 7, використовуючи полівінілпіролідон (K-17) замість полівінілпіролідону (K-25). 7 UA 100164 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 16 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 8, використовуючи полівінілпіролідон (K-17) замість полівінілпіролідону (K-25). Приклад 17 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 1, використовуючи лимонну кислоту замість соляної кислоти. Приклад 18 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 2, використовуючи лимонну кислоту замість соляної кислоти. Приклад 19 Прозору фармацевтичну композицію з кольором від безбарвного до світло-жовтуватого отримували способом, аналогічним прикладу 3, використовуючи лимонну кислоту замість соляної кислоти. Приклад 20 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 4, використовуючи лимонну кислоту замість соляної кислоти. Приклад 21 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 5, використовуючи лимонну кислоту замість соляної кислоти. Приклад 22 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 6, використовуючи лимонну кислоту замість соляної кислоти. Приклад 23 Прозору фармацевтичну композицію з кольором від безбарвного до світло-жовтуватого отримували способом, аналогічним прикладу 7, використовуючи лимонну кислоту замість соляної кислоти. Приклад 24 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 8, використовуючи лимонну кислоту замість соляної кислоти. Приклад 25 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 1, використовуючи цукрозу (2,889 г) замість гліцерину (0,722 г). Приклад 26 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 2, використовуючи цукрозу (4,741 г) замість гліцерину (1,185 г). Приклад 27 Прозору фармацевтичну композицію з кольором від безбарвного до світло-жовтуватого отримували способом, аналогічним прикладу 3, використовуючи цукрозу (3,185 г) замість гліцерину (0,796 г). Приклад 28 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 4, використовуючи цукрозу (1,593 г) замість гліцерину (0,398 г). Приклад 29 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 5, використовуючи цукрозу (3,963 г) замість гліцерину (0,991 г). Приклад 30 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 6, використовуючи цукрозу (5,556 г) замість гліцерину (1,389 г). 8 UA 100164 C2 5 10 15 20 Приклад 31 Прозору фармацевтичну композицію з кольором від безбарвного до світло-жовтуватого отримували способом, аналогічним прикладу 7, використовуючи цукрозу (4,185 г) замість гліцерину (1,046 г). Приклад 32 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 8, використовуючи цукрозу (2,704 г) замість гліцерину (0,676 г). Приклад 33 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 1, використовуючи цукрозу (2,889 г) замість гліцерину (0,722 г) і використовуючи лимонну кислоту замість соляної кислоти. Приклад 34 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 5, використовуючи цукрозу (3,963 г) замість гліцерину (0,991 г) і використовуючи лимонну кислоту замість соляної кислоти. Приклад 35 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 1, використовуючи цукрозу (2,889 г) замість гліцерину (0,722 г) і використовуючи фосфорну кислоту замість соляної кислоти. Приклад 36 Прозору фармацевтичну композицію з кольором від світло-жовтуватого до блідожовтуватого отримували способом, аналогічним прикладу 5, використовуючи цукрозу (3,963 г) замість гліцерину (0,991 г) і використовуючи фосфорну кислоту замість соляної кислоти. 25 Приклад 37 Ребаміпід Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 30 2г 1,5 г 6,2 г 0,861 г q.s. (до рН=8,7) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою безбарвний прозорий розчин. 35 Приклад 38 Ребаміпід Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 40 2г 1г 4,5 г 1,259 г q.s. (до рН=8,7) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 9 UA 100164 C2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою безбарвний прозорий розчин. Приклад 39 Ребаміпід Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 5 10 1г 1,5 г 5,2 г 1,287 г q.s. (до рН=8,4) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою безбарвний прозорий розчин. Приклад 40 Ребаміпід Борна кислота Меглумін Гліцерин Соляна кислота Очищена вода Усього 15 20 25 30 35 40 1г 1г 3,6 г 1,565 г q.s. (до рН=8,0) q.s. 100 мл До невеликої кількості очищеної води додавали ребаміпід, полівінілпіролідон (K-25), борну кислоту, меглумін і гліцерин при перемішуванні, і рН суміші, що вийшла в результаті, регулювали соляною кислотою. Перемішування здійснювали низькошвидкісною гвинтовою мішалкою без застосування високошвидкісного перемішувача, такого як змішувач-гомогенізатор або гомогенізатор. Кожний інгредієнт легко розчинявся за допомогою низькошвидкісної гвинтової мішалки. Потім розчин, що вийшов в результаті, в стерильних умовах фільтрували через 0,2 мкм фільтр для отримання фармацевтичної композиції. Фармацевтична композиція являла собою безбарвний прозорий розчин. Приклад 41 Безбарвну прозору фармацевтичну композицію отримували способом, аналогічним прикладу 37, використовуючи лимонну кислоту замість соляної кислоти. Приклад 42 Безбарвну прозору фармацевтичну композицію отримували способом, аналогічним прикладу 39, використовуючи лимонну кислоту замість соляної кислоти. Приклад 43 Безбарвну прозору фармацевтичну композицію отримували способом, аналогічним прикладу 37, використовуючи цукрозу (3,444 г) замість гліцерину (0,861 г). Приклад 44 Безбарвну прозору фармацевтичну композицію отримували способом, аналогічним прикладу 39, використовуючи цукрозу (5,148 г) замість гліцерину (1,287 г). Приклад 45 Безбарвну прозору фармацевтичну композицію отримували способом, аналогічним прикладу 37, використовуючи цукрозу (3,444 г) замість гліцерину (0,861 г) і використовуючи лимонну кислоту замість соляної кислоти. Приклад 46 Безбарвну прозору фармацевтичну композицію отримували способом, аналогічним прикладу 39, використовуючи цукрозу (5,148 г) замість гліцерину (1,287 г) і використовуючи лимонну кислоту замість соляної кислоти. 10 UA 100164 C2 5 10 15 Приклад 47 Безбарвну прозору фармацевтичну композицію отримували способом, аналогічним прикладу 37, використовуючи цукрозу (3,444 г) замість гліцерину (0,861 г) і використовуючи фосфорну кислоту замість соляної кислоти. Приклад 48 Безбарвну прозору фармацевтичну композицію отримували способом, аналогічним прикладу 39, використовуючи цукрозу (5,148 г) замість гліцерину (1,287 г) і використовуючи фосфорну кислоту замість соляної кислоти. Композиції по прикладах 49-52 і порівняльних прикладах 1-5 представлені в наступній таблиці 1, готували тим же самим способом, що і в прикладі 1, використовуючи кожний інгредієнт і кожну його кількість, як описано в таблиці 1, кожна з яких являла собою прозору фармацевтичну композицію, що має pH в межах 7-9. Композиції зберігали в холодильнику протягом 4 тижнів, потім спостерігали і реєстрували кожний аспект композицій. У результаті, в фармацевтичних композиціях порівняльних прикладів 1-5, які містили неорганічний катіон, утворився осад або гель. У той час як в фармацевтичних композиціях по прикладах 49-52, які не містили якого-небудь неорганічного катіону, осад або гель взагалі не утворювався. Таблиця 1 Порівн. Порівн. Порівн. Порівн. Порівн. Приклад Приклад Приклад Приклад приклад приклад приклад приклад приклад 49 50 51 52 1 2 3 4 5 Ребаміпід (г) Меглумін (г) PVP K25 (г) Макрогол (г) Борна кислота (г) 1) Боракс (г) Фосфат Na (г) Цитрат Na (г) Карбонат Na (г) Ангідрид лимонної кислоти 10 % HCl Гліцерин (г) NaCl (г) Очищена ) вода2 2,02 2,02 2,02 2,02 2,02 2,02 2,02 2,02 2,02 5 4 5 4 5 4 5 4 5 4 5 4 5 4 5 5 3 1 1 1 1 1 1,9 1 1 1 q.s. q.s. q.s. q.s. q.s. q.s. q.s. q.s. 0,706 0,706 0,706 0,706 0,706 q.s. 0,706 0,25 0,706 0,706 q.s. q.s. q.s. q.s. q.s. q.s. q.s. q.s. q.s. 1,9 г боракс: 1г тетраборату натрію. "q.s." очищеної води: загальний об'єм препарату доводили до 100 мл очищеною водою. 20 25 30 Для того щоб підтвердити хорошу прозорість і хорошу проникність даної фармацевтичної композиції, виготовили приклад 1, приклад 37, порівняльний приклад 6, згідно WO 2008/050896, і порівняльний приклад 7, згідно з WO 2006/052018. Коротко, після виготовлення кожної композиції спостерігали і реєстрували кожний аспект, оптичну прозорість при 640 нм і здатність до фільтрування через мембранний фільтр з розміром пор 0,2 мкм. Після того, як композиції витримували при кімнатній температурі протягом чотирьох тижнів, спостерігали і реєстрували кожний аспект. Результати представлені в таблиці 2. В даних фармацевтичних композиціях (приклади 1 і 37) їх оптична прозорість не порушувалася, здатність до фільтрування була хорошою і ці аспекти не змінювалися навіть через 4 тижні. У той час як фармацевтична композиція за порівняльним прикладом 6 була молочно-білою, тобто непрозорою, і її було важко фільтрувати. Фармацевтична композиція за порівняльним прикладом 7 була білою, і її не можна було 11 UA 100164 C2 5 10 15 20 фільтрувати, оскільки фільтр був забитий її кристалами. Крім того, фармацевтичну композицію за порівняльним прикладом 7, яка простояла протягом 4 тижнів, доводилося ретельно збовтувати для повторного диспергування, оскільки виділялися кристали. Порівняльний приклад 6 (Виготовлення суспензії, що містить 2 % (мас./об.) кристалічного ребаміпіду) До 700 мл водного розчину гідроксиду натрію, отриманого шляхом розчинення 4,4 г гідроксиду натрію в очищеній воді, додавали 20 г ребаміпіду. Суміш розчиняли при нагріванні, і потім розчин охолоджували до 30-40ºC. З іншого боку, змішували 12 мл 10н соляної кислоти, 68 мл очищеної води і 200 мл водної 10 % (мас./об.) гідроксипропілметилцелюлози (виробництва Shin-Etsu Chemical Co., Ltd, TC-5E), і розчин охолоджували на бані з льодом. Розчин перемішували при 1400 об./хв, вищеописаний розчин гідроксиду натрію, що містить ребаміпід, поступово виливали при озвученні для виділення кристалів ребаміпіду. Після виділення кристалів швидкість перемішування підіймали до 3000 об./хв, і суміш перемішували протягом додаткових 20 хвилин. По закінченні виділення pH суміші встановлювали на рівні 6-6,5 5н гідроксидом натрію, і загальний об'єм доводили до 1 літра очищеною водою до отримання необхідної водної суспензії, що містить кристалічний ребаміпід. Порівняльний приклад 7 (Виготовлення суспензії, що містить 2 % (мас./об.) кристалічного ребаміпіду) До 80 мл очищеної води додавали 0,5 г частково сапоніфікованого полівінілового спирту (виробництва KURARAY CI., LTD, Poval 224C), 0,11 г лимонної кислоти, 0,146 г цитрату натрію, 0,715 г хлориду натрію і 0,180 г хлориду калію, і суміш розчиняли при нагріванні. Після охолоджування розчин фільтрували. До фільтрату додавали ребаміпід, і суміш, що вийшла в результаті, перемішували. Потім її загальний об'єм доводили до 100 мл очищеною водою до отримання необхідної водної суспензії. 25 Таблиця 2 Композиція Приклад 37 Аспект Відразу після виготовлення Приклад 1 Прозора Прозора 100,0 дуже хороша Оптична прозорість при 640 нм (%) Здатність до фільтрування через 0,2 мкм мембранний фільтр Через 4 тижні Аспект без змін Порівняльний приклад 6 Молочно біла, прозора Порівняльний приклад 7 100,0 44,5 0,0 дуже хороша дещо важка блокується кристалами без змін Виділились кристали, повторне диспергування при ретельному збовтуванні без змін Біла Випробування на протимікробну ефективність (Бактерійні штами) Як посівна культура у випробуваннях використовували наступні штами. 30 бактерії: дріжджі і плісняви: Escherichia Coli NBRC 3972 Pseudomonas aeruginosa NBRC 13275 Staphylococcus aureus NBRC 13276 Candida albicans NBRC 1594 Aspergillus niger NBRC 9455 (Зразки для досліджень) Приклади 53-58 отримували способом, аналогічним прикладу 1, використовуючи інгредієнти, перераховані в таблиці 3. 35 12 UA 100164 C2 Таблиця 3 Композиції для дослідження протимікробної ефективності Ребаміпід PVP (K25) PVP (K17) Борна кислота Меглумін Гліцерин 10 % HCl Очищена вода Всього Приклад 53 Приклад 54 Приклад 55 Приклад 56 Приклад 57 Приклад 58 2г 2г 2г 2г 2г 2г 3г 3г 3г 3г 1,5 г 2г 1,5 г 2г 1,5 г 1,2 г 6,2 г 7,9 г 5,9 г 7,4 г 5,7 г 4,8 г 0,972 г 0,616 г 0,844 г 0,5 г 0,819 г 1,05 г q.s. q.s. q.s. q.s. q.s. q.s. (близько (близько (близько (близько (близько (близько 8,7) 8,7) 8,3) 8,3) 8,3) 8,3) q.s. q.s. q.s. q.s. q.s. q.s. 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл Примітка: PVP означає полівінілпіролідон. 5 10 15 20 25 30 (Спосіб) 56 Кожну посівну культуру асептично додавали до прикладів 53-58 при концентрації 10 10 колонієутворюючих одиниць/мл, і кожну композицію рівномірно перемішували для отримання кожного тестованого зразка. Ці зразки зберігали при 20-25ºC, оберігаючи від потрапляння світла. На 0, 14 і 28 дні з кожного тестованого зразка відбирали по 1 мл і визначали кількість життєздатних клітин. Визначення кількості життєздатних клітин бактерій проводили таким чином. Розчин кожного зразка розбавляли десятиразовими розведеннями SCDLP середовищем. По 1 мл з кожного розведення висівали на чашки Петрі і додавали туди по 15-20 мл SCDLP середовища з агаром. Після культивування середовища при 30-35ºC протягом 5 днів, проводили підрахунок життєздатних клітин. Відбирали чашки Петрі, в яких підрахунок життєздатних клітин був не більшим 300, і записували результат підрахунку. Визначення кількості життєздатних клітин дріжджів і плісняви визначали таким чином. Розчин кожного зразка розбавляли десятиразовими розведеннями GPLP середовищем. По 1 мл з кожного розведення висівали на чашки Петрі і додавали туди по 15-20 мл GPLP середовища з агаром. Після культивування середовища при 20-25ºC протягом 5 днів, проводили підрахунок життєздатних клітин. Відбирали чашки Петрі, в яких підрахунок життєздатних клітин був не більшим 100, і записували результат підрахунку. Підрахунок життєздатних клітин в розчині кожного зразка отримували множенням записаного числа на ступінь його розведення і додатково обчислювали процентне відношення підрахунку життєздатних клітин до початкового підрахунку життєздатних клітин. (Визначення) Для бактерій визначення "добре" давали у випадку, коли процентне відношення на 14 день складало не більше ніж 0,1 %; і процентне відношення на 28 день залишалося на тому ж рівні, як результат на 14 день, або було меншим. Про визначення протимікробної ефективності судили як про "відповідну" у випадку, коли обидва результати були "прийнятними". Для дріжджів і плісняв визначення "хороший" давали у випадку, коли процентне відношення залишалося на тому ж самому рівні, як первинне, або було меншим. Про визначення протимікробної ефективності судили як про "позитивну" у випадку, коли обидва результати на 14 і на 28 день були "хорошими". (Результат) Всі приклади 53-58 оцінювали відносно протимікробної ефективності. 35 13 UA 100164 C2 Таблиця 4 Результат досліджень протимікробної ефективності Бактеріальний штам Приклад 53 Приклад 54 Приклад 55 Приклад 56 Приклад 57 Приклад 58 E. Coli P. aeruginosa S. aureus C. albicans A. niger E. Coli P. aeruginosa S. aureus C. albicans A. niger E. Coli P. aeruginosa S. aureus C. albicans A. niger E. Coli P. aeruginosa S. aureus C. albicans A. niger E. Coli P. aeruginosa S. aureus C. albicans A. niger E. Coli P. aeruginosa S. aureus C. albicans A. niger Результати Через Через 14 днів 28 днів прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний прийнятний Протимікробна ефективність відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна відповідна ФОРМУЛА ВИНАХОДУ 5 10 15 1. Фармацевтична композиція, що містить (1) ребаміпід, (2) аміноцукор і (3) буферний агент, яка не містить неорганічний катіон. 2. Фармацевтична композиція за п. 1, в якій аміноцукор являє собою щонайменше один, вибраний з групи, яка складається з D-глюкозаміну і меглуміну. 3. Фармацевтична композиція за п. 1 або 2, в якій буферний агент являє собою щонайменше один, вибраний з групи, яка складається з борної кислоти, фосфорної кислоти і амінокислоти. 4. Фармацевтична композиція за будь-яким з пп. 1-3, що додатково містить регулятор рН. 5. Фармацевтична композиція за будь-яким з пп. 1-4, що додатково містить солюбілізуючий агент. 6. Фармацевтична композиція за п. 5, в якій солюбілізуючий агент являє собою щонайменше один, вибраний з групи, яка складається з полівінілпіролідону і макроголу. 7. Фармацевтична композиція за будь-яким з пп. 1-6, де фармацевтична композиція являє собою офтальмологічну фармацевтичну композицію. 8. Застосування фармацевтичної композиції за будь-яким з пп. 1-7 для лікування сухості очей шляхом місцевого введення в очі. 14 UA 100164 C2 Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition comprising rebamipide
Автори англійськоюSumida, Shun-ichiro, Ishikawa, Shinichi
Назва патенту російськоюФармацевтическая композиция ребамипида
Автори російськоюСумида Сун-итиро, Исикава Синити
МПК / Мітки
МПК: A61K 47/02, A61K 47/26, A61P 27/02, A61K 31/4704
Мітки: фармацевтична, композиція, ребаміпіду
Код посилання
<a href="https://ua.patents.su/17-100164-farmacevtichna-kompoziciya-rebamipidu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція ребаміпіду</a>
Наступний патент: Автоін’єктор та спосіб підготовки до роботи автоін’єктора
Випадковий патент: Пиловловлювач