Капсульована лікарська форма, яка містить монтелукаст і левоцетиризин
Номер патенту: 112083
Опубліковано: 25.07.2016
Автори: Парк Дзає Хіун, Кім Кієонг Соо, Кім Донг Хо, Квон Таек Кван, Кім Йонг Іл, Воо Дзонг-Соо
Формула / Реферат
1. Капсульована лікарська форма для профілактики або лікування алергійного риніту і астми, яка включає два окремі шари:
(1) шар монтелукасту, що містить монтелукаст або його фармацевтично прийнятну сіль; і
(2) шар левоцетиризину, що містить левоцетиризин або його фармацевтично прийнятну сіль, в якій вказаний шар монтелукасту і вказаний шар левоцетиризину отримані без використання води або органічного розчинника, в якій вказаний шар монтелукасту і вказаний шар левоцетиризину містить воду в кількості 5 % або менше.
2. Капсульована лікарська форма за п. 1, в якій вказаний шар монтелукасту або вказаний шар левоцетиризину представлені у вигляді гранул або таблетки.
3. Капсульована лікарська форма за п. 2, в якій щонайменше один з двох вказаних шарів монтелукасту і левоцетиризину знаходиться в формі таблетки.
4. Капсульована лікарська форма за п. 1, в якій вказаний шар монтелукасту і шар левоцетиризину додатково містять фармацевтично прийнятну добавку, вибрану з групи, що складається з розріджувача, розпушувача, зв'язувальної речовини, стабілізуючого агента, мастильної речовини, барвника і їх суміші.
5. Капсульована лікарська форма за п. 3, в якій таблетка додатково містить покривний шар.
6. Капсульована лікарська форма за п. 5, в якій вказаний покривний шар містить підкладку покриття, вибрану з групи, яка складається з метилцелюлози, етилцелюлози, полівінілового спирту, полівінілпіролідону, гідроксіетилцелюлози, гіпромелози і їх суміші.
7. Капсульована лікарська форма за п. 6, в якій вказана підкладка покриття знаходиться в кількості від 1 до 20 % по масі від загальної маси таблетки.
8. Капсульована лікарська форма за п. 1, в якій вказана капсула являє собою тверду капсулу.
9. Капсульована лікарська форма за п. 8, в якій вказана капсула виконана з матеріалу, вибраного з групи, яка складається з гіпромелози, пулулану, желатину і полівінілового спирту.
10. Капсульована лікарська форма за п. 8, в якій вказана капсула виконана з гіпромелози або пулулану.
11. Капсульована лікарська форма за п. 1, в якій вказаний монтелукаст або його вказана фармацевтично прийнятна сіль міститься в кількості від 2,5 мг до 20 мг на стандартну лікарську форму.
12. Капсульована лікарська форма за п. 1, в якій вказаний левоцетиризин або його вказана фармацевтично прийнятна сіль містяться в кількості від 2,5 мг до 20 мг на стандартну лікарську форму.
13. Капсульована лікарська форма за п. 1, в якій вказана фармацевтично прийнятна сіль монтелукасту є монтелукастом натрію.
14. Капсульована лікарська форма за п. 1, в якій вказана фармацевтично прийнятна сіль левоцетиризину є дигідрохлоридом левоцетиризину.
15. Капсульована лікарська форма за п. 1, де вказаний алергійний риніт включає ринорею, назальну обструкцію, назальний свербіж, чхання, свербіж в ділянці очей.
16. Спосіб отримання капсульованої лікарської форми за п. 1, який включає наступні стадії:
(і) змішування монтелукасту або його фармацевтично прийнятної солі і фармацевтично прийнятної добавки і гранулювання суміші з отриманням гранул або формування гранул в таблетки;
(іі) змішування левоцетиризину або його фармацевтично прийнятної солі і фармацевтично прийнятної добавки і гранулювання суміші з отриманням гранул або формування гранул в таблетки; і
(ііі) поміщення вказаної таблетки або гранул монтелукасту, отриманих на стадії (і), і вказаної таблетки або гранул левоцетиризину, отриманих на стадії (іі), в тверду капсулу з утворенням окремих шарів в капсулі, де вказаний шар монтелукасту і вказаний шар левоцетиризину отримані без використання води або органічного розчинника, де вказаний шар монтелукасту і вказаний шар левоцетиризину містить воду в кількості 5 % або менше.
17. Спосіб за п. 16, який додатково включає покриття вказаної таблетки, отриманої на стадії (і) або (іі).
18. Спосіб за п. 16, в якому щонайменше один з двох вказаних шарів монтелукасту і левоцетиризину знаходиться в формі таблетки.
Текст
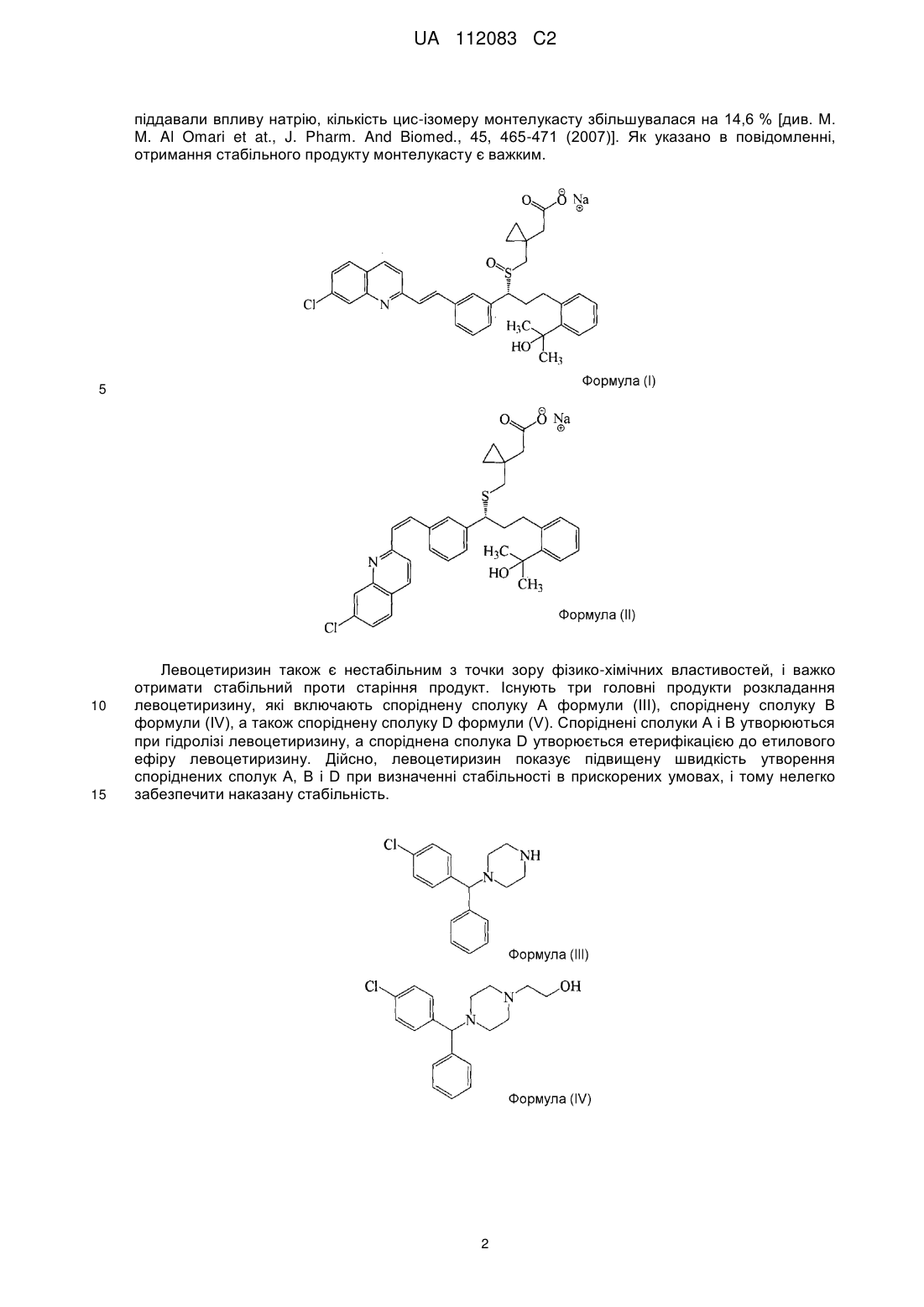
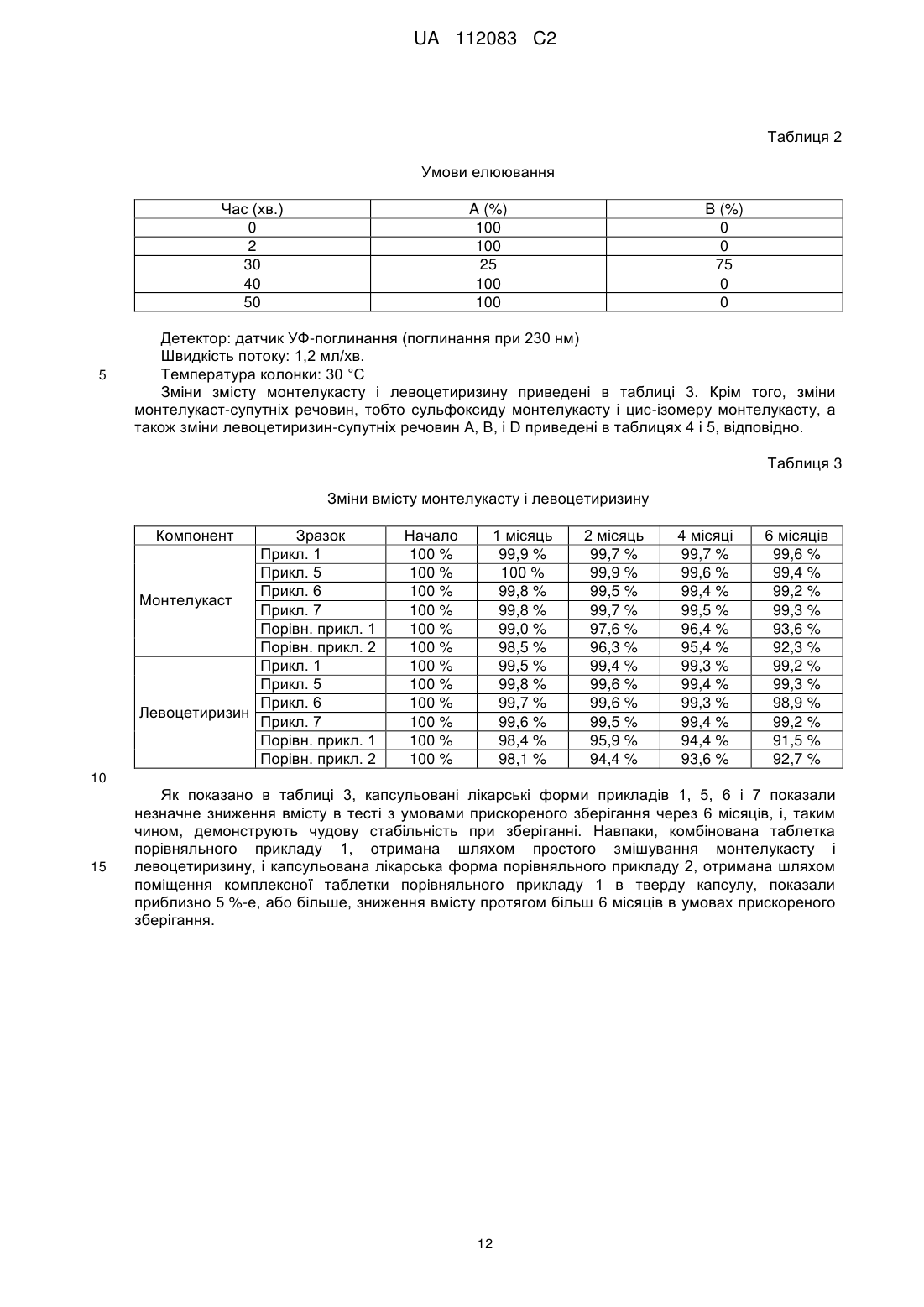
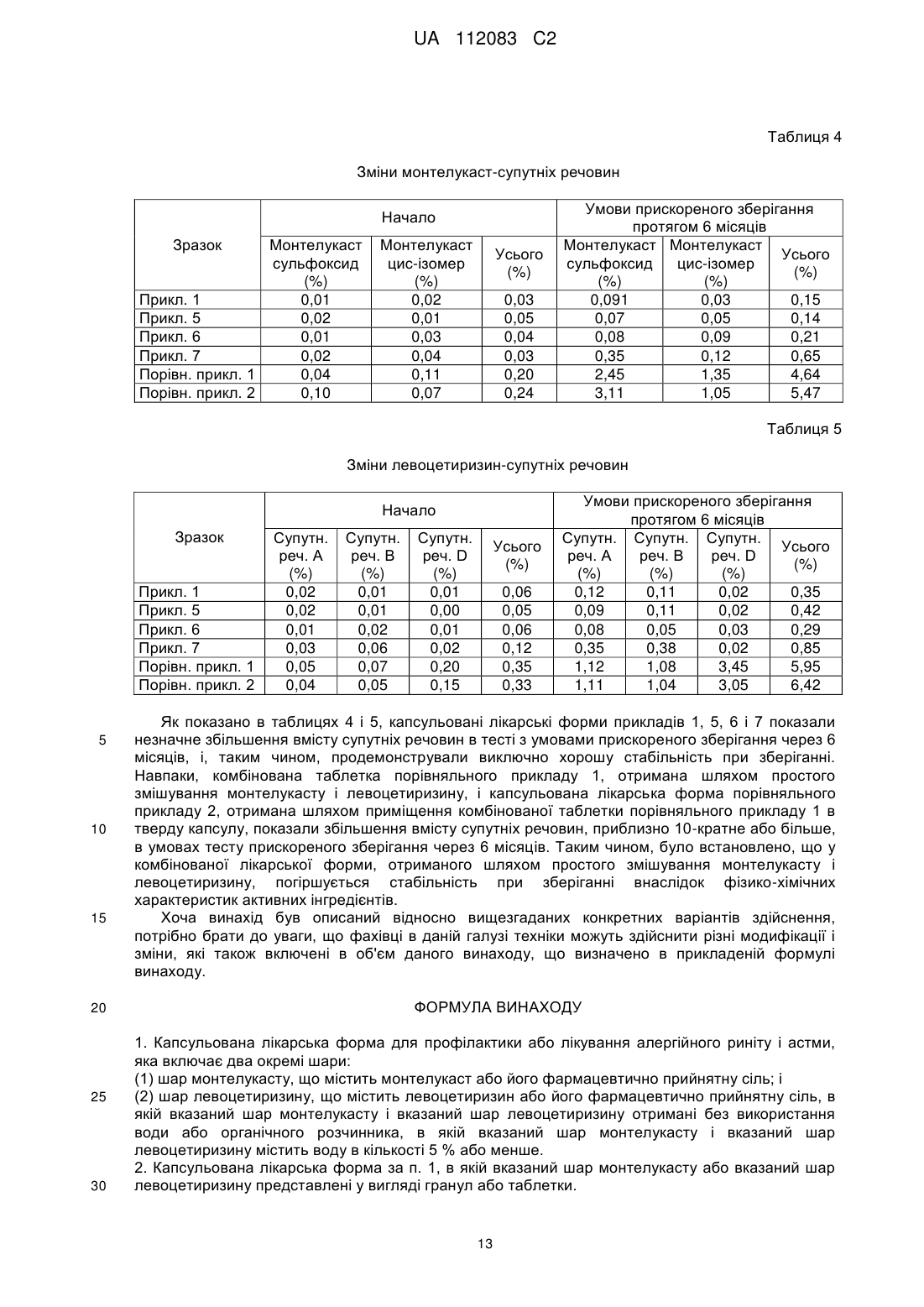
Реферат: Винахід стосується капсульованої лікарської форми для профілактики або лікування алергійного риніту і астми, яка складається з двох окремих шарів: (1) шару монтелукасту, що містить монтелукаст або його фармацевтично прийнятну сіль, і (2) шару левоцетиризину, що містить левоцетиризин або його фармацевтично прийнятну сіль, в якій вказаний шар монтелукасту і вказаний шар левоцетиризину отримані без використання води або органічного розчинника, в якій вказаний шар монтелукасту і вказаний шар левоцетиризину містить воду в кількості 5 % або менше; і способу її отримання. UA 112083 C2 (12) UA 112083 C2 UA 112083 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується капсульованої лікарської форми для профілактики або лікування алергійного риніту і астми, яка складається з двох окремих шарів: (1) шару монтелукасту, що містить монтелукаст або його фармацевтично прийнятну сіль, і (2) шару мевоцетиризину, що містить мевоцетиризин або його фармацевтично прийнятну сіль; і способу його отримання. ПЕРЕДУМОВИ ВИНАХОДУ "Алергійний риніт" стосується симптоматичного розладу в порожнині носа, що викликається IgE-опосередкованим запаленням назальних мембран після впливу алергену. Алергійний риніт включає в себе такі симптоми, як ринорея, назальна обструкція, назальний свербіж, чхання, свербіж в ділянці очей і так далі. "Астма" стосується розладу, при якому в результаті запалення дихальних шляхів відбувається набухання слизової оболонки бронхів і м'язовий спазм в бронхах, і що, відповідно, обмежує повітряний потік в легені і з легень. Астма може викликати такі симптоми, як задишка, сильний кашель, а у важких випадках астматичний стан, який може привести навіть до смерті. Алергійний риніт і астма можуть розвиватися самостійно, однак, існують дослідження, які показують, що приблизно 60 % пацієнтів з алергійним ринітом страждають також на астму, і що 85~95 % пацієнтів з астмою також страждають на алергійний риніт, що вказує на високу частоту ускладнень у вказаних двох груп пацієнтів. Таким чином, існує потреба в розробці комбінованої композиції, яка має поліпшену стабільність і ефективність для лікування двох вказаних станів. Тим часом, монтелукаст є антагоністом, який інгібує цистеїніл лейкотриєнові рецептори (CysLTl), які використовують для профілактики і лікування лейкотриєн-опосередкованих захворювань. Зокрема, повідомлялося, що монтелукаст є ефективним при лікуванні алергійного риніту, атопічного дерматиту, хронічної уртикарії, синуситу, назального поліпа, хронічного обструктивного захворювання легень, кон'юнктивіту, включаючи кон'юнктивіт з назальними симптомами, гемікранії, кістозного фіброзу, вірусного бронхіоліту і т. п. [див., наприклад, S.E. Dahlen, Eur. J. Pharmacol., 533(1-3), 40-56(2006)]. Крім того, Singulair (MSD), що містить монтелукаст натрію, схвалений для лікування астми у хворих дорослих і дітей від 2 років і старше, і в цей час доступний на ринку. Цетиризин являє собою (2-(4-((4-хлорфеніл)фенілметил)-L-піперазиніл)етоксіоцтову кислоту, і її лівообертальний і правообертальний дзеркальні енантіомери були описані як "левоцетиризин" і "декстроцетиризин", відповідно. Левоцетиризин може бути отриманий шляхом розкладання або асиметричного синтезу з рацемічної суміші цетиризину, наприклад, звичайними способами, описаними в патенті UK № 225321, або з допомогою ферментативного біокаталітичного гідролізу, описаного в патентах США №№ 4800162 і 5057427. Левоцетиризин має антигістамінні властивості і тому використовується як протиалергійний (антигістамінний) засіб, а також як протисудомний і бронхолітичний засіб. У міжнародній публікації WO 94/06429 описаний спосіб лікування сезонного і цілорічного алергійного риніту з допомогою левоцетиризину. Крім того, в корейському патенті № 926410 описана фармацевтична композиція для лікування алергійних захворювань, яка включає як активні інгредієнти сегмент, що містить цетиризин, і сегмент, що містить псевдоефедрин. Однак, ефективність вказаних активних інгредієнтів, цетиризину і псевдоефедрину, проти алергійного захворювання астми не була доведена. Крім того, постійне застосування засобу проти закладеності носа, псевдоефедрину, може посилити закладеність носа через реакцію "ребаунда", і може привести до риніту, який не піддається лікуванню, викликаного застосуванням лікарських засобів. Тому не рекомендується їх застосування протягом більше 2 тижнів. Крім того, було повідомлення, що стосується фармацевтичної композиції у вигляді двошарової таблетки, що містить монтелукаст натрію, який має стійкість в основному середовищі, і дигідрохлорид левоцетиризину, який має стійкість в кислому середовищі [R. T. Rathod, J. Indian Med. Assoc., 107(8), 562-564 (2009)]. При отриманні вказаної композиції у вигляді таблетки дуже важко повністю відділити монтелукаст і левоцетиризин один від одного. Навіть у випадку отримання двошарової таблетки неможливо механічно відділити кожний активний інгредієнт повністю. І до того ж, для того, щоб виготовити такі таблетки потрібна машина для виготовлення двошарових таблеток. Крім того, монтелукаст, як відомо, нестабільний при впливі світла, тепла і вологи, а також дає такі продукти розкладання, такі як сульфоксид монтелукасту формули (I) і цис-ізомер монтелукасту формули (II). Згідно з M. M. Al Omari et al., коли комерційно доступні жувальні таблетки Singulair піддавали впливу сонячного світла, кількість сульфоксиду монтелукасту збільшувалася на 2,4 % через 3 тижні, а коли монтелукаст в 0,1 М розчині соляної кислоти 1 UA 112083 C2 піддавали впливу натрію, кількість цис-ізомеру монтелукасту збільшувалася на 14,6 % [див. M. M. Al Omari et at., J. Pharm. And Biomed., 45, 465-471 (2007)]. Як указано в повідомленні, отримання стабільного продукту монтелукасту є важким. 5 10 15 Левоцетиризин також є нестабільним з точки зору фізико-хімічних властивостей, і важко отримати стабільний проти старіння продукт. Існують три головні продукти розкладання левоцетиризину, які включають споріднену сполуку А формули (III), споріднену сполуку В формули (IV), а також споріднену сполуку D формули (V). Споріднені сполуки А і В утворюються при гідролізі левоцетиризину, а споріднена сполука D утворюється етерифікацією до етилового ефіру левоцетиризину. Дійсно, левоцетиризин показує підвищену швидкість утворення споріднених сполук А, В і D при визначенні стабільності в прискорених умовах, і тому нелегко забезпечити наказану стабільність. 2 UA 112083 C2 5 10 15 20 25 30 35 40 45 50 Таким чином, автори даного винаходу розробили фармацевтичну композицію, яка містить як антилейкотриєновий засіб монтелукаст з хорошою стабільністю і який при цьому не надає негативного впливу; і як антигістамінний агент левоцетиризин, який є ефективним на ранній фазі алергійної реакції, для лікування алергійних захворювань, включаючи алергійний риніт і астму, що має стабільність протягом тривалого періоду застосування. СУТЬ ВИНАХОДУ Таким чином, метою даного винаходу є отримання фармацевтичної лікарської форми для профілактики або лікування алергійного риніту і астми, який включає монтелукаст або його фармацевтично прийнятну сіль і левоцетиризин або його фармацевтично прийнятну сіль. Ще однією метою даного винаходу є розробка способу отримання фармацевтичної лікарської форми. Відповідно до мети даного винаходу запропонована капсульована лікарська форма для профілактики або лікування алергійного риніту і астми, яка складається з двох окремих шарів: (1) шару монтелукасту, що містить монтелукаст або його фармацевтично прийнятну сіль; і (2) шару левоцетиризину, що містить левоцетиризин або його фармацевтично прийнятну сіль. Відповідно до іншої мети даного винаходу, запропонований спосіб отримання капсульованої лікарської форми, який включає наступні стадії: (I) змішування монтелукасту або його фармацевтично прийнятної солі і фармацевтично прийнятної добавки і гранулювання суміші з отриманням гранул або формування гранул в таблетки; (II) змішування левоцетиризину або його фармацевтично прийнятної солі і фармацевтично прийнятної добавки і гранулювання суміші з отриманням гранул або формування гранул в таблетки; і (III) поміщення вказаної таблетки або гранул монтелукасту, отриманих на стадії (I), і вказаної таблетки або гранул левоцетиризину, отриманих на стадії (II), в тверду капсулу з утворенням окремих шарів в капсулі. КОРОТКИЙ ОПИС ФІГУРИ Вищезгадані і інші об'єкти і ознаки даного винаходу стануть очевидними з наступного опису винаходу, приведеного разом з супровідною фігурою, на якій показаний схематичний вигляд капсульованої лікарської форми за даним винаходом. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Далі даний винахід пояснюється більш детально. Даний винахід стосується капсульованої лікарської форми для профілактики або лікування алергійного риніту і астми, яка складається з двох окремих шарів: (1) шару монтелукасту, що містить монтелукаст або його фармацевтично прийнятну сіль, і (2) шару левоцетиризину, що містить левоцетиризин або його фармацевтично прийнятну сіль. У даному винаході, шар монтелукасту і шар левоцетиризину, незалежно, можуть бути у вигляді гранул або таблетки. Зокрема, капсульована лікарська форма за даним винаходом являє собою капсульовану лікарську форму, отриману шляхом поміщення (1) таблетки або гранул монтелукасту, що містять монтелукаст або його фармацевтично прийнятну сіль, і (2) таблетки або гранул левоцетиризину, що містять левоцетиризин або його фармацевтично прийнятну сіль, в тверду капсулу з утворенням двох окремих шарів в капсулі. Де, принаймні, один з двох шарів монтелукасту і левоцетиризину може бути у вигляді таблетки. Для запобігання будь-яким небажаним побічним взаємодіям, що викликаються водою, вказані шар монтелукасту і шар левоцетиризину можуть бути утворені без використання води або органічного розчинника, або отримані в стані, який по суті не містить воду або органічний розчинник. Кількість вмісту води в шарі монтелукасту і шарі левоцетиризину становить 5 % або менше, відповідно. 3 UA 112083 C2 5 10 15 20 25 30 35 40 45 50 55 У капсульованій лікарській формі за даним винаходом як перший активний інгредієнт використовується антигістамінний агент левоцетиризин з метою зменшення алергійної реакції на ранній стадії, тоді як другий активний інгредієнт використовується антилейкотриєновий агент монтелукаст для лікування і профілактики одного з основних симптомів пізньої стадії алергійного риніту, тобто закладеності носа і астми. Монтелукаст або його фармацевтично прийнятна сіль, що використовуються як перший активний інгредієнт за даним винаходом, переважно, являє собою монтелукаст натрію. Добова доза монтелукасту або його фармацевтично прийнятної солі становить від 0,4 до 100 мг, переважно, від 1 до 50 мг, більш переважно, від 2,5 до 20 мг на стандартну лікарську форму. Левоцетиризин або його фармацевтично прийнятна сіль, що використовуються як другий активний інгредієнт відповідно до даного винаходу, описаний, наприклад, в Європейській патентній заявці №№ 0058146, 0601028 і 0801064, патентах UK №№ 2225320 і 2225321, патенті US № 5478941 і міжнародній патентній публікації № WO 97/37982. Фармацевтично прийнятна сіль левоцетиризину може включати, але ними не обмежуватися, кислотно-адитивну сіль фармацевтично прийнятної нетоксичної органічної або неорганічної кислоти, наприклад, сіль оцтової кислоти, лимонної кислоти, малеїнової кислоти, янтарної кислоти, аскорбінової кислоти, соляної кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти і тому подібне; сіль металу (наприклад, сіль натрію або кальцію), сіль амоній, сіль аміну і сіль амінокислоти, переважно, дигідрохлорид левоцетиризину. Добова доза левоцетиризину або його фармацевтично прийнятної солі становить від 0,4 до 100 мг, переважно від 1 до 50 мг, більш переважно від 2,5 до 20 мг на стандартну лікарську форму. Два активні інгредієнти відповідно до даного винаходу характеризуються швидким початком дії, відповідною кількістю дози і менш шкідливими побічними ефектами, і, таким чином, вони можуть використовуватися пацієнтами-дітьми і вони показують хорошу переносимість і безпеку навіть при тривалому застосуванні. У капсульованій лікарській формі за даним винаходом шар монтелукасту і шар левоцетиризину, зокрема, таблетки або гранули, які утворюють кожний з вказаних шарів, можуть містити фармацевтично прийнятний розріджувач. Відповідні приклади розріджувача можуть включати мікрокристалічну целюлозу, лактозу, лудипрес, маніт, одноосновний фосфат кальцію, крохмаль, гідроксипропілцелюлозу з низьким ступенем заміщення і їх суміші. Розріджувач може бути використаний в кількості в межах від приблизно 1 до приблизно 99 % по масі, переважно, від приблизно 5 до приблизно 95 % по масі від загальної маси таблетки або гранули. Крім того, таблетки або гранули, які утворюють кожний з вказаних шарів, додатково містять фармацевтично прийнятну добавку, наприклад, розпушувач, зв'язувальну речовину, стабілізуючий агент, мастильну речовину, барвник і тому подібне. Приклади розпушувача можуть включати будь-яку речовину, яка показує стабільне розпушення в рідкому середовищі і яка вибрана з групи, що складається з кросповідону, натрій гліколят крохмалю, кроскармелози натрію, гідроксипропілцелюлози з низьким ступенем заміщення, крохмалю, альгінату або його натрієвої солі і їх сумішей. Переважно, розпушувачем може бути кросповідон, натрію гліколат крохмаль, кроскармелоза натрію, гідроксипропілцелюлоза з низьким ступенем заміщення або їх суміш. Розпушувач може бути використаний в кількості від 1 до 30 % по масі, переважно, від 2 до 15 % по масі від загальної маси таблетки або гранул. Приклади зв'язувальної речовини можуть включати гідроксипропілцелюлозу, гіпромелозу (гідроксипропілметилцелюлозу), полівінілпіролідон, коповідон, макрогол, слабку безводну кремнієву кислоту, синтетичний алюмосилікат, похідні силікатів, такі як силікат кальцію або алюмінат метасилікату магнію, фосфатні солі, такі як двоосновний фосфат кальцію, карбонатні солі, такі як карбонат кальцію, і їх суміші. Зв'язувальна речовина може бути використана в кількості від 1 до 30 % по масі, переважно, від 2 до 20 % по масі від загальної маси таблетки або гранули. Стабілізуючим агентом, що використовується в даному винаході, переважно, може бути антиоксидант. Застосування антиоксиданту зменшує кількість небажаних побічних реакцій, викликаних температурою і вологістю, і, таким чином, підвищує стійкість до ефекту старіння. Конкретні приклади антиоксиданту можуть включати бутилований гідрокситолуол (ВНТ), бутилований гідроксіанізол (ВНА), аскорбінову кислоту, аскорбілпальмітат, етилендіамінтетраоцтову кислоту (EDTA), піросульфіт натрію і їх суміші, переважно, бутилований гідрокситолуол. Стабілізуючий агент може бути використаний в кількості від 0,01 до 10 % по масі, переважно, від 0,1 до 5 % по масі від загальної маси таблетки або гранул. 4 UA 112083 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади мастильної речовини можуть включати стеаринову кислоту, солі металів стеаринової кислоти, такі як стеарат кальцію або стеарат магнію, тальк, колоїдний діоксид кремнію, ефір цукру і жирної кислоти, гідрогенізовану рослинну олію, віск з високою температурою плавлення, складний ефір гліцерину і жирної кислоти, дибегенат гліцерину і їх суміші. Мастильна речовина може бути використана в кількості від 0,3 до 5 % по масі, переважно, від 0,5 до 3 % по масі від загальної маси таблетки або гранул. Крім того, кожна таблетка, що містить шар монтелукасту або левоцетиризину, може додатково містити шар покриття. Шар покриття може бути утворений на поверхні щонайменше однієї вибраної з вказаних таблеток, з тим, щоб повністю відділити монтелукаст від левоцетиризину. На цьому етапі для поліпшення стабільності монтелукасту і левоцетиризину шар покриття може бути утворений без використання води або органічного розчинника, або утворений у вигляді покриття на водній основі, яке по суті не містить воду або органічний розчинник. У даному винаході основа покриття, що використовується для утворюючого покриття шару, може являти собою звичайні високомолекулярні сполуки. Приклади основи покриття можуть включати, але ними не обмежуються, метилцелюлозу, етилцелюлозу, полівініловий спирт, полівінілпіролідон, гідроксіетилцелюлозу, гіпромелозу. Для підвищення ефективності виробництва і забезпечення оптимального для введення розміру препарату, кількість основи покриття, переважно, підтримують мінімальним. Таким чином, основа покриття може бути використана в кількості від 1 до 20 % по масі, переважно, від 2 до 10 % по масі від загальної маси таблетки або гранул. У капсульованій лікарській формі за даним винаходом, капсула може бути будь-якою звичайною твердою капсулою, яку звичайно використовують при отриманні лікарської форми. Основи твердих капсул, що використовуються в даному винаході, можуть включати, наприклад, желатин, гіпромелозу, пулулан (NP caps™ і т.д.; Capsugel) або полівініловий спирт. У даному винаході для мінімізації розпаду активних інгредієнтів, викликаного водою, переважними є гіпромелоза або пулулан, що мають низький вміст води. У даному винаході тверді капсули можуть мати будь-який звичайний розмір капсул, що використовується при отриманні лікарського засобу. Внутрішній об'єм залежить від розміру твердих капсул: №00 (0,95 мл), №0 (0,68 мл), №1 (0,47 мл), №2 (0,37 мл), №3 (0,27 мл) і №4 (0,20 мл). Для зручності пацієнта розмір капсули, переважно, є невеликим, однак, через обмеження маси вмісту для заповнення капсули, розмір капсули, що використовується в даному винаході, може включати №0, №1, №2, №3 і №4, переважно, №1, №2 і №3. У одному варіанті здійснення даного винаходу капсульована лікарська форма містить: (a) таблетку монтелукасту, що містить монтелукаст або його фармацевтично прийнятну сіль, і (b) таблетку левоцетиризину, що містить левоцетиризин або його фармацевтично прийнятну сіль, де таблетки вміщені в тверду капсулу. У іншому варіанті здійснення даного винаходу капсульована лікарська форма містить: (a) гранули монтелукасту, що містять монтелукаст або його фармацевтично прийнятну сіль, і (b) таблетку левоцетиризину, що містить левоцетиризин або його фармацевтично прийнятну сіль, де гранули і таблетка вміщені в тверду капсулу. У ще одному варіанті здійснення даного винаходу капсульована лікарська форма за винаходом містить: (a) таблетку монтелукасту, що містить монтелукаст або його фармацевтично прийнятну сіль, і (b) гранули левоцетиризину, що містять левоцетиризин або його фармацевтично прийнятну сіль, де таблетка і гранули вміщені в тверду капсулу. Капсульована лікарська форма за даним винаходом може використовуватися для профілактики або лікування алергійного риніту і астми, і алергійний риніт може включати такі симптоми, як ринорея, назальна обструкція, назальний свербіж, чхання, свербіж в ділянці очей і тому подібне. Крім того, даний винахід стосується способу отримання капсульованої лікарської форми, який включає наступні стадії: (i) змішування монтелукасту або його фармацевтично прийнятної солі і фармацевтично прийнятної добавки і гранулювання суміші з отриманням гранул або формування гранул в таблетки; (ii) змішування левоцетиризину або його фармацевтично прийнятної солі і фармацевтично прийнятної добавки і гранулювання суміші з отриманням гранул або формування гранул в таблетки; і (iii) поміщення вказаної таблетки або гранул монтелукасту, отриманих на стадії (i), і вказаної таблетки або гранул левоцетиризину, отриманих на стадії (ii), в тверду капсулу з утворенням окремих шарів в капсулі. На стадіях (i) і (ii) процес таблетування гранул може бути здійснений відповідно до звичайних способів таблетування з використанням таблеткової машини. Отримана таблетка може мати необхідну твердість, наприклад, в діапазоні від 1 до 30 кПа середньої твердості. 5 UA 112083 C2 5 10 15 20 25 Середня твердість може бути виміряна до утворення будь-якого шару плівкового покриття на таблетки. Крім того, у випадку, якщо таблетки отримують на стадії (i) або (ii), стадія додатково може включати процес нанесення покриття на таблетку. На стадії (iii) таблетка або гранули монтелукасту і таблетка або гранули левоцетиризину можуть бути вміщені в тверді капсули з утворенням окремих шарів, причому щонайменше один вибраний шар монтелукасту і шари левоцетиризину можуть бути в формі таблетки. Капсульована лікарська форма, отримана відповідно до даного винаходу, може бути введена пероральним, лінгвальним або сублінгвальним способом. Капсульована лікарська форма за даним винаходом містить монтелукаст і левоцетиризин в твердій капсулі окремо, і таким чином два вказані активні інгредієнти повністю відділені один від одного. Отже, здатність вступати у взаємодію між двома активними інгредієнтами може бути мінімізована і підвищена стабільність препарату, і, відповідно, оптимізована терапевтична ефективність. Це також вигідно, тому що замість розробки нового аналітичного методу для композиції за даним винаходом може бути також використаний аналітичний метод оцінки, який існував раніше, що залежить від часу стабільності єдиної композиції. Наступні приклади призначені для додаткової ілюстрації даного винаходу без обмеження його об'єму. Приклад 1: Отримання капсульованої лікарської форми I Шар монтелукасту Кількість 10,4 мг Монтелукаст натрій (монтелукаст, 10 мг) D-маніт 74,3 мг Мікрокристалічна целюлоза 74,3 мг Слабка безводна кремнієва 5,0 мг кислота Гідроксипропілцелюлоза 4,0 мг Натрій гліколят крохмаль 30,0 мг Стеарат магнію 2,0 мг Шар левоцетиризину Кількість Левоцетиризин 5,0 мг дигідрохлорид Лудипрес 60,5 мг Мікрокристалічна целюлоза 30,0 мг Кроскармелоза натрію 3,0 мг Слабка безводна кремнієва 0,5 мг кислота Стеарат магнію 1,0 мг ® Opadry White (Y-1-7000) 3,0 мг Дистильована вода (15,0 мг) Інгредієнти, вказані в шарі монтелукасту, змішували, і суміш пресували в таблетки з використанням круглого штампу з діаметром 5,5 мм з отриманням таблетки монтелукасту. При цьому вищеописану процедуру повторювали, за винятком використання інгредієнтів, вказаних в шарі левоцетиризину, з отриманням таблетки левоцетиризину. Потім на таблетку левоцетиризину наносили утворюючий покриття розчин, отриманий шляхом розчинення ® Opadry White (Y-1-7000, Colorcon) в дистильованій воді. Нарешті, отриманим таким чином вказані дві таблетки вміщували в тверду капсулу № 1, яка в основному складається з гіпромелози, з отриманням капсульованої лікарської форми, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Приклад 2: Отримання капсульованої лікарської форми II Шар монтелукасту Кількість 5,2 мг Монтелукаст натрій (монтелукаст, 5 мг) D-маніт 37,15 мг Мікрокристалічна целюлоза 37,15 мг Слабка безводна кремнієва 2,5 мг кислота Гідроксипропілцелюлоза 2,0 мг 6 UA 112083 C2 Натрій гліколят крохмаль Стеарат магнію 5 10 15,0 мг 1,0 мг Шар левоцетиризину Кількість Левоцетиризин 5,0 мг дигідрохлорид Лудипрес 60,5 мг Мікрокристалічна целюлоза 30,0 мг Кроскармелоза натрію 3,0 мг Слабка безводна кремнієва 0,5 мг кислота Стеарат магнію 1,0 мг ® Opadry White (Y-1-7000) 3,0 мг Дистильована вода (15,0 мг) Процедуру прикладу 1 повторювали, за винятком використання інгредієнтів і композицій, вказаних вище для шару монтелукасту, з отриманням капсульованої лікарської форми, що містить 5 мг монтелукасту і 5 мг левоцетиризину. Приклад 3: Отримання капсульованої лікарської форми III Шар монтелукасту Кількість 5,2 мг Монтелукаст натрію (монтелукаст 5 мг) D-маніт 37,15 мг Мікрокристалічна целюлоза 37,15 мг Слабка безводна кремнієва 2,5 мг кислота Гідроксипропілцелюлоза 2,0 мг Натрій гліколят крохмаль 15,0 мг Стеарат магнію 1,0 мг Шар левоцетиризину Кількість Левоцетиризин 2,5 мг дигідрохлорид Лудипрес 60,5 мг Мікрокристалічна целюлоза 30,0 мг Кроскармелоза натрію 3,0 мг Слабка безводна кремнієва 0,5 мг кислота Стеарат магнію 1,0 мг ® Opadry White (Y-1-7000) 3,0 мг Дистильована вода (15,0 мг) Процедуру прикладу 1 повторювали, за винятком використання інгредієнтів і композицій, вказаних вище для шару монтелукасту, і того, що фактичний вміст левоцетиризину становив 2,5 мг в шарі левоцетиризину, з отриманням капсульованої лікарської форми, що містить 5 мг монтелукасту і 2,5 мг левоцетиризину. Приклад 4: Отримання капсульованої лікарської форми IV Шар монтелукасту Кількість 4,16 мг Монтелукаст натрій (монтелукаст 4 мг) D-маніт 29,72 мг Мікрокристалічна целюлоза 29,72 мг Слабка безводна кремнієва 2,0 мг кислота Гідроксипропілцелюлоза 1,6 мг Натрій гліколят крохмаль 12,0 мг Стеарат магнію 0,8 мг Шар левоцетиризину Левоцетиризин Кількість 5,0 мг 7 UA 112083 C2 дигідрохлорид Лудипрес 60,5 мг Мікрокристалічна целюлоза 30,0 мг Кроскармелоза натрію 3,0 мг Слабка безводна кремнієва 0,5 мг кислота Стеарат магнію 1,0 мг ® Opadry White (Y-1-7000) 3,0 мг Дистильована вода (15,0 мг) Процедуру прикладу 1 повторювали, за винятком використання інгредієнтів і композицій, вказаних вище для шару монтелукасту, з отриманням капсульованої лікарської форми, що містить 4 мг монтелукасту і 5 мг левоцетиризину. Приклад 5: Отримання капсульованої лікарської форми V Шар монтелукасту Кількість 10,4 мг Монтелукаст натрій (монтелукаст 10 мг) D-маніт 74,3 мг Мікрокристалічна целюлоза 74,3 мг Слабка безводна кремнієва 5,0 мг кислота Гідроксипропілцелюлоза 4,0 мг Натрій гліколят крохмаль 30,0 мг Стеарат магнію 2,0 мг Гіпромелоза 1,73 мг Гідроксипропілцелюлоза 1,73 мг Діоксид титану 1,5 мг Червоний оксид заліза 0,04 мг Дистильована вода (15,0 мг) 5 10 15 20 Шар левоцетиризину Кількість Левоцетиризин 5,0 мг дигідрохлорид Лудипрес 60,5 мг Мікрокристалічна целюлоза 30,0 мг Кроскармелоза натрію 3,0 мг Слабка безводна кремнієва 0,5 мг кислота Стеарат магнію 1,0 мг ® Opadry White (Y-1-7000) 3,0 мг Дистильована вода (15,0 мг) Інгредієнти, описані для шару монтелукасту, змішували, і суміш пресували в таблетки з використанням круглого штампу діаметром 5,5 мм, з отриманням таблеток монтелукасту. Потім на таблетки монтелукасту наносили утворюючий покриття розчин, отриманий розчиненням гіпромелози, гідроксипропілцелюлози, діоксиду титану і червоного оксиду заліза в дистильованій воді. При цьому процедуру прикладу 1 повторювали з отриманням таблетки левоцетиризину. Нарешті, отриманим таким чином вказані дві таблетки вміщували в тверду капсулу № 1, яка в основному складається з гіпромелози, з отриманням капсульованої лікарської форми, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Приклад 6: Отримання капсульованої лікарської форми VI Процедуру прикладу 5 повторювали, за винятком використання твердої капсули, яка в основному складається з пулулану, з отриманням капсульованої лікарської форми, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Приклад 7: Отримання капсульованої лікарської форми VII Процедуру прикладу 5 повторювали, за винятком використання твердої капсули, яка в основному складається з желатину, з отриманням капсульованої лікарської форми, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Приклад 8: Отримання капсульованої лікарської форми VIII Шар монтелукасту (гранула) Кількість 8 UA 112083 C2 Монтелукаст натрію D-маніту Мікрокристалічна целюлоза Гідроксипропілцелюлоза Натрій гліколят крохмаль Дистильована вода 5 10 15 10,4 мг (монтелукаст 10 мг) 74,3 мг 74,3 мг 4,0 мг 30,0 мг (20,0 мг) Шар левоцетиризину Кількість Левоцетиризин 5,0 мг дигідрохлорид Лудипрес 60,5 мг Мікрокристалічна целюлоза 30,0 мг Кроскармелоза натрію 3,0 мг Слабка безводна кремнієва 0,5 мг кислота Стеарат магнію 1,0 мг ® Opadry White (Y-1-7000) 3,0 мг Дистильована вода (15,0 мг) Відповідно до інгредієнтів і композицій, описаних для шару монтелукасту вище, вказані інгредієнти змішували і перемішували зі зв'язувальним розчином, отриманим шляхом розчинення монтелукасту і гідроксипропілцелюлози в дистильованій воді, здійснювали вологе гранулювання, просіювання через сито 20 меш і сушіння з отриманням гранул монтелукасту. При цьому процедуру прикладу 1 повторювали з отриманням таблетки левоцетиризину. Нарешті, гранули монтелукасту і таблетку левоцетиризину вміщували в тверду капсулу №1, яка в основному складається з гіпромелози, з отриманням капсульованої лікарської форми, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Приклад 9: Отримання капсульованої лікарської форми IX Шар монтелукасту Кількість 10,4 мг Монтелукаст натрій (монтелукаст 10 мг) D-маніт 74,3 мг Мікрокристалічна целюлоза 74,3 мг Слабка безводна кремнієва 5,0 мг кислота Гідроксипропілцелюлоза 4,0 мг Натрій гліколят крохмаль 30,0 мг Стеарат магнію 2,0 мг Гіпромелоза 1,73 мг Гідроксипропілцелюлоза 1,73 мг Діоксид титану 1,5 мг Червоний оксид заліза 0,04 мг Дистильована вода (50,0 мг) Шар левоцетиризину Кількість Левоцетиризин 5,0 мг дигідрохлорид Лудипрес 60,5 мг Мікрокристалічна целюлоза 30,0 мг Кроскармелоза натрію 3,0 мг Гідроксипропілцелюлоза 4,0 мг Дистильована вода (15,0 мг) Інгредієнти, описані для шару монтелукасту, змішували і суміш пресували в таблетки з використанням круглого штампу, що має діаметр 5,5 мм, з отриманням монтелукасту. Потім на таблетки монтелукасту наносили утворюючий покриття розчин, отриманий розчиненням гіпромелози, гідроксипропілцелюлози, діоксиду титану і червоного оксиду заліза в дистильованій воді. 9 UA 112083 C2 5 10 15 20 При цьому, відповідно до інгредієнтів і композицій, описаних вище для шару левоцетиризину, вказані інгредієнти змішували і перемішували зі зв'язувальним розчином, отриманим шляхом розчинення левоцетиризину і гідроксипропілцелюлози в дистильованій воді, здійснювали вологе гранулювання, просівали через сито 20 меш і сушили з отриманням гранул левоцетиризину. Нарешті, таблетки монтелукасту і гранули левоцетиризину вміщували в тверду капсулу №1, яка в основному складається з гіпромелози, з отриманням капсульованої лікарської форми, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Порівняльний приклад 1: Отримання комбінованої таблетки Кількість 10,4 мг Монтелукаст натрій (монтелукаст, 10 мг) Левоцетиризин 5,0 мг дигідрохлорид D-маніт 74,3 мг Мікрокристалічна целюлоза 74,3 мг Слабка безводна кремнієва 5,0 мг кислота Гідроксипропілцелюлоза 4,0 мг Етанол (20,0 мг) Натрій гліколят крохмаль 30,0 мг Стеарат магнію 2,0 мг Гіпромелоза 1,73 мг Гідроксипропілцелюлоза 1,73 мг Діоксид титану 1,5 мг Дистильована вода (50,0 мг) Відповідно до інгредієнтів і композицій, описаних вище, монтелукаст натрій і левоцетиризин дигідрохлорид змішували, і суміш перемішували зі зв'язувальним розчином, отриманим шляхом розчинення гідроксипропілцелюлози в етанолі, здійснювали вологе гранулювання, просівали через сито 20 меш і сушили. Потім додавали слабку безводну кремнієву кислоту і стеарат магнію, змішували і пресували в таблетку за допомогою таблетуючої машини. Потім на отриману таблетку монтелукасту і левоцетиризину наносили утворюючий покриття розчин, отриманий розчиненням гіпромелози, гідроксипропілцелюлози, двоокису титану і червоного оксиду заліза в дистильованій воді, з отриманням комбінованої таблетки, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Порівняльний приклад 2: Отримання капсульованої лікарської форми Комплексну таблетку, отриману в порівняльному прикладі 1, вміщували в тверду капсулу, яка в основному складається з желатину, з отриманням капсульованої лікарської форми, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Порівняльний приклад 3: Отримання двошарової таблетки Кількість 10,4 мг Монтелукаст натрій (монтелукаст, 10 мг) D-маніт 74,3 мг Мікрокристалічна целюлоза 74,3 мг Слабка безводна кремнієва 5,0 мг кислота Гідроксипропілцелюлоза 4,0 мг Етанол (20,0 мг) Натрій гліколят крохмаль 30,0 мг Стеарат магнію 2,0 мг Левоцетиризин 5 мг дигідрохлорид Лудипрес 60,5 мг Мікрокристалічна целюлоза 30,0 мг Кроскармелоза натрію 3,0 мг Слабка безводна кремнієва 0,5 мг кислота 10 UA 112083 C2 5 10 15 20 25 Стеарат магнію 1,0 мг Гіпромелоза 1,73 мг Гідроксипропілцелюлоза 1,73 мг Діоксид титану 1,5 мг Дистильована вода (50,0 мг) Відповідно до інгредієнтів і композицій, описаних в попередньому прикладі, вказані інгредієнти змішували, і потім суміш перемішували зі зв'язувальним розчином, отриманим шляхом розчинення монтелукасту і гідроксипропілцелюлози в дистильованій воді, здійснювали вологе гранулювання, просівали через сито 20 меш і сушили. Потім додавали слабку безводну кремнієву кислоту і стеарат магнію, змішували і пресували в таблетки за допомогою таблетуючої машини. Роздільно, змішували левоцетиризин, лудипрес, мікрокристалічну целюлозу, кроскармелозу натрію, слабку безводну кремнієву кислоту і стеарат магнію, і суміш пресували в таблетки разом з отриманою таблеткою монтелукасту з отриманням двошарової таблетки. Потім на двошарову таблетку наносили утворюючий покриття розчин, отриманий шляхом розчинення гіпромелози, гідроксипропілцелюлози, діоксиду титану і червоного оксиду заліза в дистильованій воді, з отриманням внаслідок двошарової таблетки, що містить 10 мг монтелукасту і 5 мг левоцетиризину. Експериментальний приклад 1: Тест на стабільність в умовах прискореного зберігання Капсульовані лікарські форми, які містять монтелукаст і левоцетиризин, отримані в прикладах 1, 5, 6 і 7, і порівняльних прикладах 1 і 2, зберігали в умовах прискореного зберігання відповідно до наступних умов. Вимірювали зміни вмісту монтелукасту і левоцетиризину, і кількості супутніх речовин (домішок). Результати показані в таблицях 3-5. Умови зберігання: Утримували в пляшці ПЕНД при 40 °C, 75 % відносній вологості Тривалість дослідження: початковий момент, 1, 2, 4 і 6 місяць Об'єкт аналізу: монтелукаст і левоцетиризин Колонка: Колонка для ВЕРХ Zorbax SB-Phenyl (Agilent Zorbax), що має трубку з нержавіючої сталі (внутрішній діаметр від 4,6 мм × довжина 25 см), заповнену діізопропілфенетил силікагелем (розмір частинок: 5 мкм) Елюенти: А - Вода, що містить 0,1 % трифтороцтову кислоту (ТФО) В - Ацетонітрил, що містить 0,1 % ТФО Таблиця 1 Умови елюювання Час (хв.) 0 20 30 31 35 30 35 A (%) 60 10 10 60 60 B (%) 40 90 90 40 40 Детектор: датчик УФ-поглинання (поглинання при 238 нм) Швидкість потоку: 1,5 мл/хв. Температура колонки: 25 °C Колонка: колонка для ВЕРХ Symmetry Shield RP18 (Waters), що включає трубку з нержавіючої сталі (внутрішній діаметр від 4,6 мм × довжина 25 см), заповнена октадецилсиліл силікагелем (розмір частинок: 5 мкм) Елюенти: А - DW: ацетонітрил: 10 % ТФО = 69:30:1 (об'єм/об'єм) В - DW: ацетонітрил: 10 % ТФО = 29:70:1 (об'єм/об'єм) 11 UA 112083 C2 Таблиця 2 Умови елюювання Час (хв.) 0 2 30 40 50 5 A (%) 100 100 25 100 100 B (%) 0 0 75 0 0 Детектор: датчик УФ-поглинання (поглинання при 230 нм) Швидкість потоку: 1,2 мл/хв. Температура колонки: 30 °C Зміни змісту монтелукасту і левоцетиризину приведені в таблиці 3. Крім того, зміни монтелукаст-супутніх речовин, тобто сульфоксиду монтелукасту і цис-ізомеру монтелукасту, а також зміни левоцетиризин-супутніх речовин А, В, і D приведені в таблицях 4 і 5, відповідно. Таблиця 3 Зміни вмісту монтелукасту і левоцетиризину Компонент Зразок Прикл. 1 Прикл. 5 Прикл. 6 Монтелукаст Прикл. 7 Порівн. прикл. 1 Порівн. прикл. 2 Прикл. 1 Прикл. 5 Прикл. 6 Левоцетиризин Прикл. 7 Порівн. прикл. 1 Порівн. прикл. 2 Начало 100 % 100 % 100 % 100 % 100 % 100 % 100 % 100 % 100 % 100 % 100 % 100 % 1 місяць 99,9 % 100 % 99,8 % 99,8 % 99,0 % 98,5 % 99,5 % 99,8 % 99,7 % 99,6 % 98,4 % 98,1 % 2 місяць 99,7 % 99,9 % 99,5 % 99,7 % 97,6 % 96,3 % 99,4 % 99,6 % 99,6 % 99,5 % 95,9 % 94,4 % 4 місяці 99,7 % 99,6 % 99,4 % 99,5 % 96,4 % 95,4 % 99,3 % 99,4 % 99,3 % 99,4 % 94,4 % 93,6 % 6 місяців 99,6 % 99,4 % 99,2 % 99,3 % 93,6 % 92,3 % 99,2 % 99,3 % 98,9 % 99,2 % 91,5 % 92,7 % 10 15 Як показано в таблиці 3, капсульовані лікарські форми прикладів 1, 5, 6 і 7 показали незначне зниження вмісту в тесті з умовами прискореного зберігання через 6 місяців, і, таким чином, демонструють чудову стабільність при зберіганні. Навпаки, комбінована таблетка порівняльного прикладу 1, отримана шляхом простого змішування монтелукасту і левоцетиризину, і капсульована лікарська форма порівняльного прикладу 2, отримана шляхом поміщення комплексної таблетки порівняльного прикладу 1 в тверду капсулу, показали приблизно 5 %-е, або більше, зниження вмісту протягом більш 6 місяців в умовах прискореного зберігання. 12 UA 112083 C2 Таблиця 4 Зміни монтелукаст-супутніх речовин Начало Зразок Монтелукаст сульфоксид (%) Прикл. 1 0,01 Прикл. 5 0,02 Прикл. 6 0,01 Прикл. 7 0,02 Порівн. прикл. 1 0,04 Порівн. прикл. 2 0,10 Монтелукаст цис-ізомер (%) 0,02 0,01 0,03 0,04 0,11 0,07 Усього (%) 0,03 0,05 0,04 0,03 0,20 0,24 Умови прискореного зберігання протягом 6 місяців Монтелукаст Монтелукаст Усього сульфоксид цис-ізомер (%) (%) (%) 0,091 0,03 0,15 0,07 0,05 0,14 0,08 0,09 0,21 0,35 0,12 0,65 2,45 1,35 4,64 3,11 1,05 5,47 Таблиця 5 Зміни левоцетиризин-супутніх речовин Начало Зразок Прикл. 1 Прикл. 5 Прикл. 6 Прикл. 7 Порівн. прикл. 1 Порівн. прикл. 2 5 10 15 20 25 30 Супутн. реч. A (%) 0,02 0,02 0,01 0,03 0,05 0,04 Супутн. реч. B (%) 0,01 0,01 0,02 0,06 0,07 0,05 Супутн. реч. D (%) 0,01 0,00 0,01 0,02 0,20 0,15 Усього (%) 0,06 0,05 0,06 0,12 0,35 0,33 Умови прискореного зберігання протягом 6 місяців Супутн. Супутн. Супутн. Усього реч. A реч. B реч. D (%) (%) (%) (%) 0,12 0,11 0,02 0,35 0,09 0,11 0,02 0,42 0,08 0,05 0,03 0,29 0,35 0,38 0,02 0,85 1,12 1,08 3,45 5,95 1,11 1,04 3,05 6,42 Як показано в таблицях 4 і 5, капсульовані лікарські форми прикладів 1, 5, 6 і 7 показали незначне збільшення вмісту супутніх речовин в тесті з умовами прискореного зберігання через 6 місяців, і, таким чином, продемонстрували виключно хорошу стабільність при зберіганні. Навпаки, комбінована таблетка порівняльного прикладу 1, отримана шляхом простого змішування монтелукасту і левоцетиризину, і капсульована лікарська форма порівняльного прикладу 2, отримана шляхом приміщення комбінованої таблетки порівняльного прикладу 1 в тверду капсулу, показали збільшення вмісту супутніх речовин, приблизно 10-кратне або більше, в умовах тесту прискореного зберігання через 6 місяців. Таким чином, було встановлено, що у комбінованої лікарської форми, отриманого шляхом простого змішування монтелукасту і левоцетиризину, погіршується стабільність при зберіганні внаслідок фізико-хімічних характеристик активних інгредієнтів. Хоча винахід був описаний відносно вищезгаданих конкретних варіантів здійснення, потрібно брати до уваги, що фахівці в даній галузі техніки можуть здійснити різні модифікації і зміни, які також включені в об'єм даного винаходу, що визначено в прикладеній формулі винаходу. ФОРМУЛА ВИНАХОДУ 1. Капсульована лікарська форма для профілактики або лікування алергійного риніту і астми, яка включає два окремі шари: (1) шар монтелукасту, що містить монтелукаст або його фармацевтично прийнятну сіль; і (2) шар левоцетиризину, що містить левоцетиризин або його фармацевтично прийнятну сіль, в якій вказаний шар монтелукасту і вказаний шар левоцетиризину отримані без використання води або органічного розчинника, в якій вказаний шар монтелукасту і вказаний шар левоцетиризину містить воду в кількості 5 % або менше. 2. Капсульована лікарська форма за п. 1, в якій вказаний шар монтелукасту або вказаний шар левоцетиризину представлені у вигляді гранул або таблетки. 13 UA 112083 C2 5 10 15 20 25 30 35 40 45 3. Капсульована лікарська форма за п. 2, в якій щонайменше один з двох вказаних шарів монтелукасту і левоцетиризину знаходиться в формі таблетки. 4. Капсульована лікарська форма за п. 1, в якій вказаний шар монтелукасту і шар левоцетиризину додатково містять фармацевтично прийнятну добавку, вибрану з групи, що складається з розріджувача, розпушувача, зв'язувальної речовини, стабілізуючого агента, мастильної речовини, барвника і їх суміші. 5. Капсульована лікарська форма за п. 3, в якій таблетка додатково містить покривний шар. 6. Капсульована лікарська форма за п. 5, в якій вказаний покривний шар містить підкладку покриття, вибрану з групи, яка складається з метилцелюлози, етилцелюлози, полівінілового спирту, полівінілпіролідону, гідроксіетилцелюлози, гіпромелози і їх суміші. 7. Капсульована лікарська форма за п. 6, в якій вказана підкладка покриття знаходиться в кількості від 1 до 20 % по масі від загальної маси таблетки. 8. Капсульована лікарська форма за п. 1, в якій вказана капсула являє собою тверду капсулу. 9. Капсульована лікарська форма за п. 8, в якій вказана капсула виконана з матеріалу, вибраного з групи, яка складається з гіпромелози, пулулану, желатину і полівінілового спирту. 10. Капсульована лікарська форма за п. 8, в якій вказана капсула виконана з гіпромелози або пулулану. 11. Капсульована лікарська форма за п. 1, в якій вказаний монтелукаст або його вказана фармацевтично прийнятна сіль міститься в кількості від 2,5 мг до 20 мг на стандартну лікарську форму. 12. Капсульована лікарська форма за п. 1, в якій вказаний левоцетиризин або його вказана фармацевтично прийнятна сіль містяться в кількості від 2,5 мг до 20 мг на стандартну лікарську форму. 13. Капсульована лікарська форма за п. 1, в якій вказана фармацевтично прийнятна сіль монтелукасту є монтелукастом натрію. 14. Капсульована лікарська форма за п. 1, в якій вказана фармацевтично прийнятна сіль левоцетиризину є дигідрохлоридом левоцетиризину. 15. Капсульована лікарська форма за п. 1, де вказаний алергійний риніт включає ринорею, назальну обструкцію, назальний свербіж, чхання, свербіж в ділянці очей. 16. Спосіб отримання капсульованої лікарської форми за п. 1, який включає наступні стадії: (і) змішування монтелукасту або його фармацевтично прийнятної солі і фармацевтично прийнятної добавки і гранулювання суміші з отриманням гранул або формування гранул в таблетки; (іі) змішування левоцетиризину або його фармацевтично прийнятної солі і фармацевтично прийнятної добавки і гранулювання суміші з отриманням гранул або формування гранул в таблетки; і (ііі) поміщення вказаної таблетки або гранул монтелукасту, отриманих на стадії (і), і вказаної таблетки або гранул левоцетиризину, отриманих на стадії (іі), в тверду капсулу з утворенням окремих шарів в капсулі, де вказаний шар монтелукасту і вказаний шар левоцетиризину отримані без використання води або органічного розчинника, де вказаний шар монтелукасту і вказаний шар левоцетиризину містить воду в кількості 5 % або менше. 17. Спосіб за п. 16, який додатково включає покриття вказаної таблетки, отриманої на стадії (і) або (іі). 18. Спосіб за п. 16, в якому щонайменше один з двох вказаних шарів монтелукасту і левоцетиризину знаходиться в формі таблетки. 14 UA 112083 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Автори англійськоюKim, Yong Il, Kim, Dong Ho, Kwon, Taek Kwan, Kim, Kyeong Soo, Park, Jae Hyun, Woo, Jong Soo
Автори російськоюКим Йонг Ил, Ким Донг Хо, Квон Таек Кван, Ким Киеонг Соо, Парк Дзае Хиун, Воо Дзонг Соо
МПК / Мітки
МПК: A61K 9/48, A61K 31/495, A61K 31/47, A61P 37/08
Мітки: лікарська, містить, форма, монтелукаст, левоцетиризин, капсульована, яка
Код посилання
<a href="https://ua.patents.su/17-112083-kapsulovana-likarska-forma-yaka-mistit-montelukast-i-levocetirizin.html" target="_blank" rel="follow" title="База патентів України">Капсульована лікарська форма, яка містить монтелукаст і левоцетиризин</a>
Попередній патент: Кристалічна форма конденсованої гетероциклічної сполуки
Наступний патент: Спосіб консервування побічних продуктів м’ясної промисловості та інших галузей харчової промисловості
Випадковий патент: Генератор високочастотного переключення