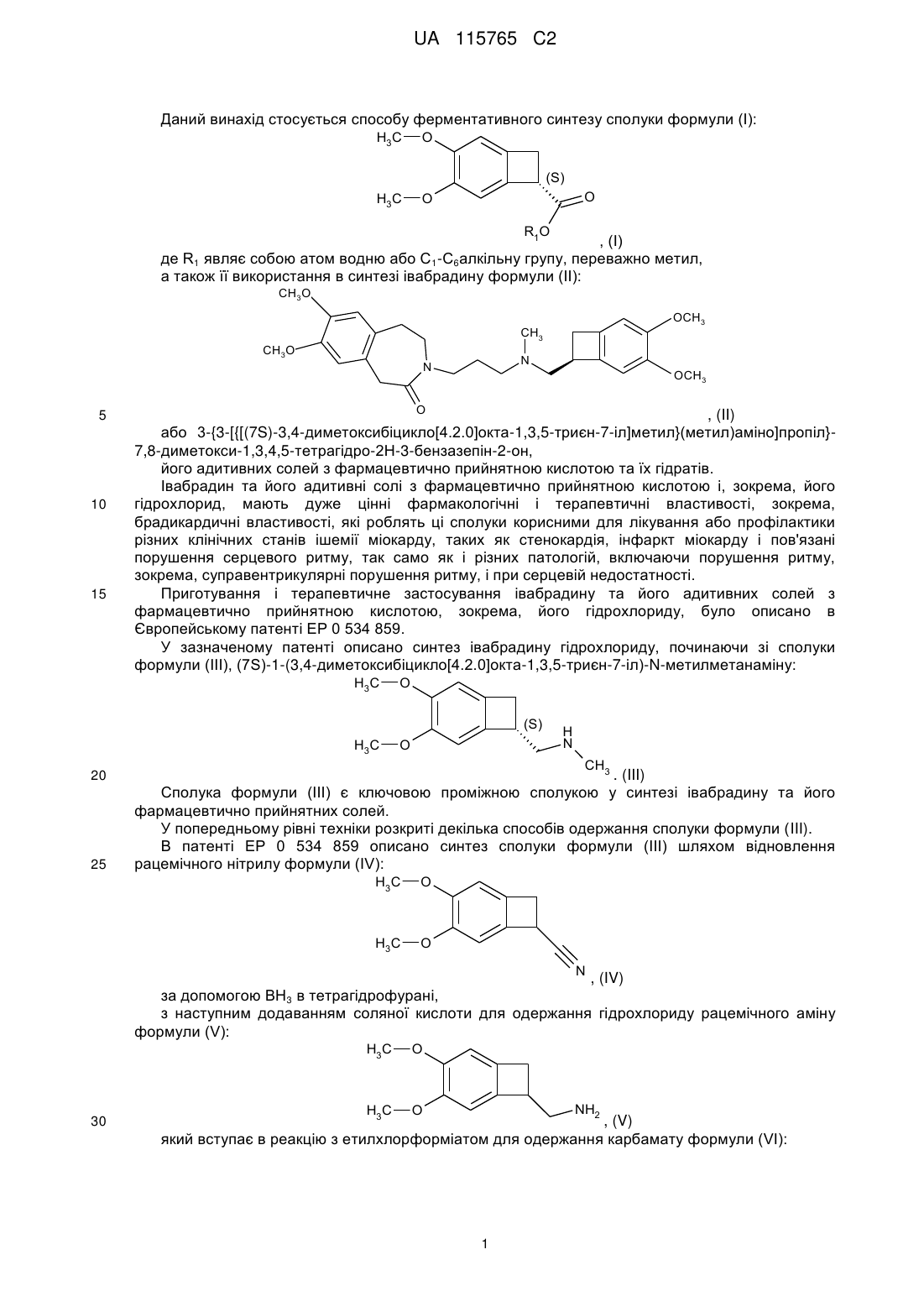
Спосіб ферментативного синтезу (7s)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонової кислоти або її естерів та застосування в синтезі івабрадину та його солей
Формула / Реферат
1. Спосіб синтезу оптично чистої сполуки формули (Іа)
 (Іа)
(Іа)
шляхом енантіоселективної ферментативної естерифікації рацемічної або іншої оптично нечистої кислоти формули (X):
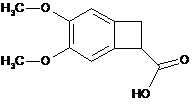 , (X)
, (X)
з використанням ліпази Candida аntarctica або Pseudomonas fluorescens,
в суміші спирту ROH, де R являє собою лінійну або розгалужену С1-С6алкільну групу, і органічного співрозчинника,
в концентрації від 5 до 500 г/л сполуки формули (X) на літр суміші розчинників,
за співвідношення Ф/С від 10/1 до 1/100,
за температури від 25 до 40 °C.
2. Спосіб синтезу за п. 1, який відрізняється тим, що співвідношення Ф/С становить від 1/5 до 1/10.
3. Спосіб синтезу за будь-яким з пп. 1 або 2, який відрізняється тим, що спирт ROH являє собою метанол, а співрозчинник являє собою ацетонітрил.
4. Спосіб синтезу за п. 3, який відрізняється тим, що співвідношення ацетонітрилу/метанолу становить від 8/2 до 9/1.
5. Спосіб синтезу за будь-яким з пп. 1-4, який відрізняється тим, що естер з конфігурацією (R), вторинний продукт реакції:
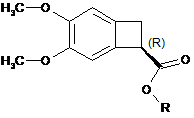 ,
,
гідролізується під дією основи з утворенням рацемічної кислоти формули (X) з метою повторного використання у способі ферментативної естерифікації.
6. Спосіб синтезу за п. 5, який відрізняється тим, що основа являє собою KOH.
7. Спосіб синтезу за будь-яким з пп. 5 або 6, який відрізняється тим, що етап гідролізу/рацемізації здійснюють in situ.
8. Спосіб синтезу за будь-яким з пп. 1-7, який відрізняється тим, що кислоту формули (Іа) виділяють після одного або більше циклів ферментативної естерифікації.
9. Спосіб синтезу оптично чистої сполуки формули (Іb):
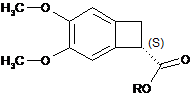 , (Ib)
, (Ib)
де R являє собою лінійну або розгалужену С1-С6алкільну групу,
шляхом енантіоселективного ферментативного гідролізу рацемічного або іншого оптично нечистого естеру формули (XI):
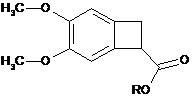 , (XI)
, (XI)
де R являє собою лінійну або розгалужену С1-С6алкільну групу,
з використанням ліпази Candida аntarctica або Pseudomonas fluorescens, у воді, у буферному розчині з рівнем рН від 5 до 8 або у суміші органічного розчинника і води або буфера з рівнем рН від 5 до 8, за концентрації, що становить від 1 до 200 г/л сполуки формули (XI) на літр розчинника або суміші розчинників,
за співвідношення Ф/С від 10/1 до 1/100,
за температури від 25 до 40 °C,
з подальшим виділенням естеру формули (Іb).
10. Спосіб синтезу за п. 9, який відрізняється тим, що співвідношення Ф/С становить від 1/5 до 1/10.
11. Спосіб синтезу за будь-яким з пп. 9 або 10, який відрізняється тим, що R являє собою метилову групу.
12. Спосіб синтезу за будь-яким з пп. 9-11, який відрізняється тим, що реакція здійснюється в суміші ацетонітрилу і буфера з рівнем рН=7.
13. Спосіб синтезу за п. 12, який відрізняється тим, що співвідношення ацетонітрилу/буфера з рівнем рН=7 становить від 8/2 до 9/1.
14. Спосіб синтезу за будь-яким з пп. 9-13, який відрізняється тим, що кислоту з конфігурацією (R), вторинний продукт реакції:
 ,
,
рацемізують під дією основи, а потім рацемічну кислоту, одержану у такий спосіб, алкілують з утворенням рацемічного естеру формули (XI) з метою повторного використання у способі ферментативного гідролізу.
15. Спосіб синтезу за п. 14, який відрізняється тим, що кислоту з конфігурацією (R) рацемізують під дією КОН у гарячому стані.
16. Спосіб синтезу за будь-яким з пп. 9-13, який відрізняється тим, що кислоту з конфігурацією (R), вторинний продукт реакції:
 ,
,
спочатку алкілують, а потім естер з конфігурацією (R), одержаний у такий спосіб, рацемізують під дією основи з метою повторного використання у способі ферментативного гідролізу.
17. Спосіб синтезу за п. 16, який відрізняється тим, що естер з конфігурацією (R) рацемізують під дією ДБУ у гарячому стані або під дією КОН за температури навколишнього середовища.
18. Спосіб синтезу сполуки формули (III):
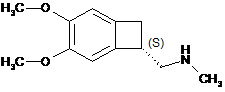 , (III)
, (III)
який починають із нітрилу формули (IV):
 , (IV)
, (IV)
який потім гідролізують з утворенням рацемічної кислоти формули (X):
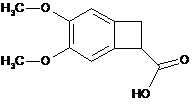 , (X)
, (X)
ферментативна естерифікація якої, за будь-яким з пп. 1-8, дає вихід оптично чистої кислоти формули (Іа):
 , (Ia)
, (Ia)
яку потім перетворюють на оптично чистий амід формули (XII):
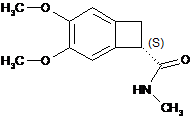 , (XII)
, (XII)
відновлення якого дає вихід сполуки формули (III).
19. Спосіб синтезу сполуки формули (III):
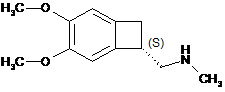 , (III)
, (III)
починаючи із нітрилу формули (IV):
 , (IV)
, (IV)
який гідролізують з утворенням рацемічної кислоти формули (X):
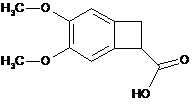 , (X)
, (X)
і потім алкілують з утворенням рацемічного естеру формули (XI):
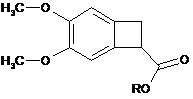 , (XI)
, (XI)
де R являє собою лінійну або розгалужену С1-С6алкільну групу,
ферментативний гідроліз якої, за будь-яким з пп. 9-17, дає вихід оптично чистого естеру формули (Іb):
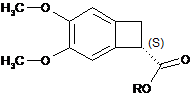 , (Іb)
, (Іb)
де R являє собою лінійну або розгалужену С1-С6алкільну групу,
що перетворюють на оптично чистий амід формули (XII):
 , (XII)
, (XII)
відновлення якого дає вихід сполуки формули (III).
20. Спосіб синтезу за будь-яким з пп. 18 або 19, який відрізняється тим, що відновлення сполуки формули (XII) для одержання сполуки формули (III) здійснюють за допомогою ВН3, NaBH4 або LiAlH4.
21. Спосіб синтезу івабрадину формули (ІІ):
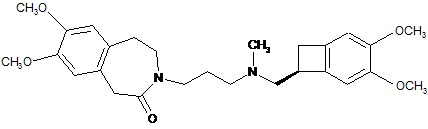 , (II)
, (II)
починаючи із сполуки формули (ІІІ), одержаної за способом синтезу за будь-яким з пп. 18-20, яку поєднують із сполукою формули (XIII):
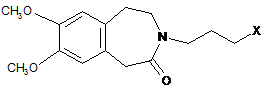 , (ХIII)
, (ХIII)
де X являє собою атом галогену,
або піддають реакції відновлювального амінування зі сполукою формули (XIV) за присутності відновлювача:
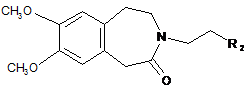 , (XIV)
, (XIV)
де R2 являє собою групу, вибрану із СНО і CHR3R4,
де R3 і R4, кожен, являють собою лінійну або розгалужену (С1-С6)алкоксигрупу або утворюють, разом з атомом вуглецю, що їх несе, 1,3-діоксанове, 1,3-діоксоланове або 1,3-діоксепанове кільце,
з одержанням івабрадину, який потім перетворюють на адитивну сіль з фармацевтично прийнятною кислотою, зазначена сіль знаходиться у безводній або у гідратованій формі.
22. Спосіб синтезу за п. 21, який відрізняється тим, що X являє собою атом йоду.
23. Спосіб синтезу за п. 21, який відрізняється тим, що сполуку формули (III) використовують в реакції відновлювального амінування у формі її гідрохлориду з одержанням івабрадину у формі гідрохлориду.
24. Спосіб синтезу за будь-яким з пп. 21 або 23, який відрізняється тим, що реакцію відновлювального амінування зі сполукою формули (XIV) здійснюють за присутності дигідрогену, що каталізується паладієм-на-вуглеці.
Текст
Реферат: UA 115765 C2 (12) UA 115765 C2 Спосіб ферментативного синтезу сполуки формули (І): H3C O H3C O (S) O R1O , (І), де R1 являє собою атом водню або алкільну групу. Використання в синтезі івабрадину і його адитивних солей з фармацевтично прийнятною кислотою. UA 115765 C2 Даний винахід стосується способу ферментативного синтезу сполуки формули (І): H3C O H3C O (S) O R1O , (І) де R1 являє собою атом водню або С1-С6алкільну групу, переважно метил, а також її використання в синтезі івабрадину формули (II): CH3O OCH3 CH3 CH3O N N 5 10 15 OCH3 O , (II) або 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]пропіл}7,8-диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он, його адитивних солей з фармацевтично прийнятною кислотою та їх гідратів. Івабрадин та його адитивні солі з фармацевтично прийнятною кислотою і, зокрема, його гідрохлорид, мають дуже цінні фармакологічні і терапевтичні властивості, зокрема, брадикардичні властивості, які роблять ці сполуки корисними для лікування або профілактики різних клінічних станів ішемії міокарду, таких як стенокардія, інфаркт міокарду і пов'язані порушення серцевого ритму, так само як і різних патологій, включаючи порушення ритму, зокрема, суправентрикулярні порушення ритму, і при серцевій недостатності. Приготування і терапевтичне застосування івабрадину та його адитивних солей з фармацевтично прийнятною кислотою, зокрема, його гідрохлориду, було описано в Європейському патенті ЕР 0 534 859. У зазначеному патенті описано синтез івабрадину гідрохлориду, починаючи зі сполуки формули (III), (7S)-1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-N-метилметанаміну: H3C O H3C O (S) 20 25 H N CH3 . (III) Сполука формули (III) є ключовою проміжною сполукою у синтезі івабрадину та його фармацевтично прийнятних солей. У попередньому рівні техніки розкриті декілька способів одержання сполуки формули (III). В патенті ЕР 0 534 859 описано синтез сполуки формули (III) шляхом відновлення рацемічного нітрилу формули (IV): H3 C O H3 C O N , (IV) за допомогою ВН3 в тетрагідрофурані, з наступним додаванням соляної кислоти для одержання гідрохлориду рацемічного аміну формули (V): H3C 30 O H3C O NH2 , (V) який вступає в реакцію з етилхлорформіатом для одержання карбамату формули (VI): 1 UA 115765 C2 H3C O H3C O H N OEt O , (VI) відновлення якого за допомогою LiAlH4 дає вихід рацемічного метильованого аміну формули (VII): H3C O H3C O H N CH3 5 10 , (VII) розщеплення якого з використанням камфорсульфонової кислоти дає сполуку формули (III). Цей спосіб має недолік одержання сполуки формули (III) тільки з дуже низьким виходом, який становить від 2 до 3 %, починаючи із рацемічного нітрилу формули (IV). Цей дуже низький вихід відбувається через низький вихід (від 4 до 5 %) етапу розщеплення вторинного аміну формули (VII). В Європейському патенті ЕР 1 598 333 описано одержання сполуки формули (III) шляхом розщеплення рацемічного первинного аміну формули (V) на оптично активний амін формули (VIII): H3C O (S) H3C 15 20 NH2 O , (VIII) з використанням N-ацетил-L-глутамінової кислоти з наступним метилуванням з використанням такої ж реакційної послідовності, яка зазначена вище (перетворення на карбамат з наступним відновленням). Вихід етапу розщеплення становить 39 %. В Європейському патенті ЕР 2 166 004 описано одержання сполуки формули (III) шляхом оптичного розщеплення рацемічного нітрилу формули (IV) за допомогою хіральної хроматографії для одержання оптично чистого нітрилу формули (IX): H3 C O H3 C O (S) N 25 30 35 , (IX) який відновлюється за допомогою NaBH4 для одержання первинного аміну формули (VIII), який потім метилюють, використовуючи таку ж реакційну послідовність, яка зазначена вище (перетворення на карбамат з наступним відновленням). Вихід етапу розщеплення становить 45 %. Проблемою даного винаходу було одержання сполуки формули (III) з використанням ефективного способу, зокрема, з високим виходом, особливо для етапу розщеплення. Використання біокаталізу для надання можливості одержання хіральних молекул здається все більш цінним як альтернатива традиційному органічному синтезу. Дійсно, використання ферментів, які мають власні природні властивості, такі як хіміо-, регіо- та стерео-селективність, дозволяє використовувати ферменти як реагенти в зеленій хімії, яка проявляє повагу до навколишнього середовища. У випадку, описаному в цьому документі, використання гідролітичних ферментів (гідролаз), які функціонують без кофакторів, таких як ліпази (EC 3.1.1.3 в міжнародній класифікації ферментів) або естерази (ЕС 3.1.1.1), робить можливим одержання хіральних сполук ключових проміжних сполук в синтезі фармацевтичних активних інгредієнтів - у високому енантіомерному надлишку і з високим виходом. Зокрема, даний винахід стосується способу синтезу оптично чистої сполуки формули (Іа): 2 UA 115765 C2 H3C O H3C O (S) O HO , (Ia) шляхом енантіоселективної ферментативної естерифікації рацемічної або іншої оптично нечистої кислоти формули (X): H3C O H3C O O HO 5 10 15 20 25 , (X) з використанням ліпази або естерази в суміші спирту ROH, де R являє собою лінійну або розгалужену С 1-С6алкільну групу, і органічного співрозчинника, в концентрації від 5 до 500 г/л, переважно - від 100 до 200 г сполуки формули (X) на літр суміші розчинників, за співвідношення Ф/С від 10/1 до 1/100, переважно - від 1/5 до 1/10, за температури від 25 °C до 40 °C. Серед ліпаз та естераз, які можуть бути використані у способі ферментативної естерифікації відповідно до даного винаходу, можна згадати, але не обмежуючись, ліпази Candida antarctica, Pseudomonas fluorescens, Pseudomonas cepacia, Rhizopus oryzae, Aspergillus niger, Mucor javanicus, Aspergillus oryzae і Penicillium camemberti, та естерази Rhizopus oryzae, Mucor miehei і Rhizopus niveus. Ліпази, які є переважними відповідно до винаходу, являють собою ліпази Candida antarctica і Pseudomonas fluorescens. Серед ліпаз Candida antarctica можуть бути згадані, як приклад, ліпази, іммобілізовані на полімерній матриці, зокрема, на акриловій смолі, такі як Novozym®435 від компанії Novozymes або SPRIN adsorbed CALB® від компанії Sprin Technologies, або на полістироловій смолі, такі як SPRIN actiplus CALB®, SPRIN acti CALB® або SPRIN lipo CALB® від компанії Sprin Technologies, або на акриловій епоксидній смолі, такі як SPRIN epobond CALB® від компанії Sprin Technologies. Спирт ROH переважно являє собою метанол або етанол. Співрозчинники переважно являють собою ацетонітрил, толуол, МТБЕ або n-гептан. Переважно співвідношення співрозчинник/спирт становить від 8/2 до 9/1. Схема ферментативної естерифікації відповідно до винаходу є наступною: H3C O H3C O H3C Ліпаза H3C O O (X) ROH (R) H3C H3C O + O O O (S) O O HO R (Ia) HO основа 30 35 Переважно естер з конфігурацією (R), вторинний продукт реакції, може бути гідролізований під дією основи, переважно КОН, ДБУ, триетиламіну, ДАБЦО, ТБД, етоксиду натрію, метоксиду натрію або K2СО3, для утворення рацемічної кислоти формули (X) з метою повторного використання у способі ферментативної естерифікації. Коли етап гідролізу/рацемізації здійснюється in situ, спосіб за винаходом являє собою спосіб динамічного кінетичного розщеплення (ДКР), що дозволяє одержати S кислоту формули (Іа) з єн 98 % і виходом 65 %. Кислоту формули (Іа) переважно виділяють з реакційної суміші після одного або більше циклів ферментативної естерифікації. Інший аспект винаходу стосується способу синтезу оптично чистої сполуки формули (Іb): 3 UA 115765 C2 H3 C O H3 C O (S) O RO , (Іb) де R являє собою лінійну або розгалужену С1-С6алкільну групу, переважно - метил або етил, шляхом енантіоселективного ферментативного гідролізу рацемічного або іншого оптично нечистого естеру формули (XI): H3 C H3 C 5 10 15 20 25 O O O RO , (XI) де R являє собою лінійну або розгалужену С1-С6алкільну групу, з використанням ліпази або естерази, у воді, у буферному розчині з рівнем рН від 5 до 8 або в суміші органічного розчинника і води або буфера з рівнем рН від 5 до 8, за концентрації, що становить від 1 до 200 г/л, переважно - приблизно 100 г сполуки формули (XI) на літр розчинника або суміші розчинників, за співвідношення Ф/С від 10/1 до 1/100, переважно - від 1/5 до 1/10, за температури від 25 °C до 40 °C, з подальшим виділенням естеру формули (Іb). Серед ліпаз і естераз, які можуть бути використані у способі ферментативного гідролізу відповідно до даного винаходу, можна згадати, але не обмежуючись, ліпази Candida antarctica, Pseudomonas fluorescens, Pseudomonas cepacia, Rhizopus oryzae, Aspergillus niger, Mucor javanicus, Aspergillus oryzae і Penicillium camemberti, та естерази Rhizopus oryzae, Mucor miehei і Rhizopus niveus. Ліпази, які є переважними відповідно до цього аспекту винаходу, являють собою ліпази Candida antarctica і Pseudomonas fluorescens. Серед ліпаз Candida antarctica можуть бути згадані, як приклад, ліпази, іммобілізовані на полімерній матриці, зокрема, на акриловій смолі, такі як Novozym® 435 від компанії Novozymes або SPRIN adsorbed CALB® від компанії Sprin Technologies, або на полістироловій смолі, такі як SPRIN actiplus CALB®, SPRIN acti CALB® або SPRIN lipo CALB® від компанії Sprin Technologies, або на акриловій епоксидній смолі, такі як SPRIN epobond CALB® від компанії Sprin Technologies. Коли реакція здійснюється за присутності органічного розчинника, останній переважно являє собою ацетонітрил, толуол, МТБЕ або n-гептан. Переважно співвідношення органічний розчинник/вода або буфер знаходиться в діапазоні від 8/2 до 9/1. Схема ферментативного гідролізу відповідно до винаходу є наступною: H3C O Ліпаза H3C H3C O H3C (R) H3C O O H3C O 35 40 O + (S) O RO HO RO 30 O O (Ib) (XI) . Переважно кислота з конфігурацією (R), вторинний продукт реакції, може бути рацемізованою під дією основи, переважно під дією КОН у гарячому стані, а потім рацемічна кислота, одержана у такий спосіб, може бути алкілована, щоб сформувати рацемічний естер формули (XI) з метою повторного використання у способі ферментативного гідролізу. Альтернативно кислота з конфігурацією (R), вторинний продукт реакції, може спочатку бути алкілована, а потім естер з конфігурацією (R), одержаний у такий спосіб, може бути рацемізований під дією основи, переважно під дією ДБУ, КОН, триетиламіну, ДАБЦО, ТБД, етоксиду натрію, метоксиду натрію або K2СО3, з метою повторного використання у способі ферментативного гідролізу. Коли рацемізація здійснюється у гарячому стані, температура переважно становить від 50 °C до 80 °C. Визначення 4 UA 115765 C2 5 10 Під оптично чистою сполукою розуміють сполуку, яка має енантіомерний надлишок більше ніж або такий, що дорівнює 90 %. Під кислотою або естером, які не є оптично чистими, розуміють кислоту або естер, що має енантіомерний надлишок менше ніж 90 %. Під рацемічною кислотою або естером розуміють кислоту або естер у формі суміші двох енантіомерів у співвідношенні від 55:45 до 45:55. Під енантіоселективною естерифікацією рацемічної або іншої оптично нечистої кислоти розуміють пріоритетну естерифікацію одного з енантіомерів суміші. Під енантіоселективним гідролізом рацемічного або іншого оптично нечистого естеру розуміють пріоритетний гідроліз одного з енантіомерів суміші. Інший аспект винаходу стосується способу синтезу сполуки формули (III), починаючи з нітрилу формули (IV), який гідролізується для утворення рацемічної кислоти формули (X), ферментативна естерифікація якої, згідно з винаходом, дає вихід оптично чистої кислоти формули (Іа), яка потім перетворюється на оптично чистий амід формули (XII): H3C O (S) H3C O O HN 15 20 CH3 , (XII) відновлення якого, переважно за допомогою ВН 3, NaBH4 або LiAlH4, дає вихід сполуки формули (III). Інший аспект винаходу стосується способу синтезу сполуки формули (III), починаючи із нітрилу формули (IV), який гідролізується з утворенням рацемічної кислоти формули (X), а потім алкілується з утворенням рацемічного естеру за формулою (XI), ферментативний гідроліз якого, згідно з винаходом, дає вихід оптично чистого естеру формули (Іb), який перетворюється на оптично чистий амід формули (XII): H3C O H3C O (S) O HN CH3 25 , (XII) відновлення якого, переважно за допомогою ВН 3, NaBH4 або LiAlH4, дає вихід сполуки формули (III). Сполуку формули (III) згодом або поєднують зі сполукою формули (XIII): CH3O X N CH3O 30 O , (ХIII) де X являє собою атом галогену, переважно атом йоду, або піддають реакції відновлювального амінування зі сполукою формули (XIV) за присутності відновлювача: CH3O N CH3O 35 O R2 , (XIV) де R2 являє собою групу, вибрану із СНО і CHR3R4, де R3 і R4, кожен, являють собою лінійну або розгалужену (С1-С6)алкоксигрупу або утворюють, разом з атомом вуглецю, що їх несе, 1,3-діоксанове, 1,3-діоксоланове або 1,3діоксепанове кільце, 5 UA 115765 C2 5 10 15 для одержання івабрадину, який потім перетворюється на адитивну сіль з фармацевтично прийнятною кислотою, зазначена сіль знаходиться у безводній або у гідратованій формі. Сполука формули (III) також може бути використана в реакції відновлювального амінування у формі її адитивної солі із фармацевтично прийнятною кислотою, переважно - її гідрохлориду. В такому випадку івабрадин одержують безпосередньо у формі гідрохлориду. Серед фармацевтично прийнятних кислот можуть бути згадані, але не обмежуючись, соляна кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кислота, бензолсульфонова кислота і камфорна кислота. Серед відновлювачів, які можуть бути використані в реакції відновлювального амінування між сполукою формули (III) і сполукою формули (XIV), можуть бути згадані, але не обмежуючись, сполуки гідридного донора, такі як триацетоксиборгідрид натрію або ціаноборгідрид натрію, і дигідроген за присутності каталізатора, такого як паладій, платина, нікель, рутеній, родій або їх сполуки, зокрема, на підкладці або у формі оксидів. Переважний відновлювач для реакції відновлювального амінування між сполукою формули (III) і сполукою формули (XIV) є дигідроген, що каталізується паладієм-на-вуглеці. Приклади наведені тут нижче ілюструють винахід. 20 Скорочення ТФК ТШХ ДАБЦО ДБУ ДКР Е ен екв. ВЕРХ МеОН МТБЕ оч Ф/С співвідношення ЯМР МС ТБД ТГФ ТМС 25 30 35 40 Трифтороцтова кислота Тонкошарова хроматографія 1,4-Діазабіцикло[2.2.2]Октан Діазабіциклоундецен Динамічне кінетичне розщеплення Коефіцієнт енантіоселективності енантіомерний надлишок молярний еквівалент Високоефективна рідинна хроматографія Метанол Метил-трет-бутиловий ефір оптична або енантіомерна чистота Фермент/Субстрат співвідношення (г/г) Ядерний магнітний резонанс (спектроскопія) Мас-спектрометрія 1,5,7-Триазабіцикло-[4.4.0]Дек-5-ен Тетрагідрофуран Тетраметилсилан ПРИКЛАД 1: 3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонова кислота Суспендують 3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил (11 г, 58,1 ммоль) в 1 н. розчині гідроксиду натрію (70 мл) і реакційну суміш кип'ятять (110 °C) протягом 2 годин. Дозволяють охолонути до температури навколишнього середовища, а потім підкислюють суміш за допомогою концентрованої соляної кислоти. Спостерігається осадження. Розчиняють продукт у 200 мл дихлорметану, а потім екстрагують водну фазу. Висушують над MgSO4 і випаровують з одержанням продукту, названого в заголовку (11,6 г), з виходом, що становить 95,9 %. ПРИКЛАД 2: (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонова кислота 0,5 г (с = 200 г/л) рацемічної кислоти, одержаної у Прикладі 1, розчиняють в 2,5 мл суміші 8/2 ацетонітрилу/метанолу. 0,1 г (с = 40 г/л) ліпази Candida antarctica NOVOZYM 435® (Novozymes Denmark) потім додають до суміші (Ф/С співвідношення 1/5). Реакційну суміш підтримують за температури 30 °C із поворотним перемішуванням зі швидкістю 220 обертів за хвилину протягом 48 годин. Реакцію контролюють шляхом хірально-фазової ВЕРХ за умов, що надають можливість визначати енантіомерні надлишки як естеру, так і кислоти: Chiralpak® IС 250*4.6 колонка 30 % абсолютного етанолу + 0,1 % ТФК + 70 % гептану + 0,1 % ТФК 1 мл/хв., 25 °C, 288 нм 6 UA 115765 C2 % кислоти 18 год. 24 год. 48 год. 5 10 15 20 25 30 35 40 45 50 55 % естеру 59 55 51 41 45 49 Ен (%) кислоти (S) 66 78 97 Ен (%) естеру (R) Е >99 >99 >98 77 100 890 Хроматограми хірально-фазової ВЕРХ рацемічних сполук і продукту через 48 годин продемонстровані на Фігурах 1 і 2. Через 48 годин спостерігають наявність оптично чистого естеру і кислоти в оптимальному співвідношенні кислота/естер близько до 50/50. Реакційну суміш фільтрують, фермент промивають 5 мл метанолу, а потім фільтрат випаровують in vacuo. Оптично чисту S кислоту та R естер розділяють шляхом хроматографії на колонці із силікагелем (елюент: дихлорметан/метанол 98/1). 20 (S) кислота: 0,22 г (44 %); оптична чистота > 96 %; [α] D за 589 нм: +57,1° (5 мг/мл в МеОН) 20 (R) естер: 0,24 г; оптична чистота > 96 %; [α] D за 589 нм: -62,7° (5 мг/мл в МеОН) Загальний вихід (S+R): 92 %. ПРИКЛАД 3: Метил-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат Суспендують метил-(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат (445 мг) (ен>96 %) в ізопропанолі (2,5 мл) і додають діазабіциклоундецен (58 мкл - 1,5 екв.). Нагрівають реакційну суміш за температури 65 °C протягом 2 годин. Повну рацемізацію спостерігають наприкінці 2-годинного періоду реакції естеру. Умови аналізу: Chiralpak® IС 250*4.6 колонка 30 % абсолютного етанолу + 0,1 % ТФК + 70 % гептану + 0,1 % ТФК 1 мл/хв., 25 °C, 288 нм ПРИКЛАД 4: 3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонова кислота Суспендують метил-(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат (50 мг) (ен>96 %) в метанолі (1 мл) і додають гідроксид калію (56,1) (25 мг-2 екв.). Нагрівають реакційну суміш за температури 65 °C протягом 6 годин. Спостерігають гідроліз естеру з утворенням рацемічної кислоти. Умови аналізу: Chiralpak® IС 250*4.6 колонка 30 % абсолютного етанолу + 0,1 % ТФК + 70 % гептану + 0,1 % ТФК 1 мл/хв., 25 °C, 288 нм. ПРИКЛАД 5: (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонова кислота 2 г (с = 200 г/л) рацемічної 3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонової кислоти розчиняють в 20 мл суміші ацетонітрилу/метанолу (9/1). 0,4 г (с = 20 г/л) ліпази Candida antarctica SPRIN actiplus CALB® (Sprin Technologies) потім додають до суміші. Реакційну суміш підтримують за температури 30 °C із поворотним перемішуванням зі швидкістю 220 обертів за хвилину протягом 24 годин. Фермент відфільтровують і потім промивають метанолом. 0,5 г КОН (2 екв.) потім додають до суміші (фільтрат) і перемішування підтримують протягом 6 годин за температури 30 °C. Потім суміш випаровують in vacuo. Це надає можливість повної рацемізації і гідролізу R естеру без рацемізації S кислоти. Залишок переносять в етилацетат, а потім промивають 10 % розчином лимонної кислоти. Екстракція етилацетатом не є достатньою, розчинні у воді кислоти повторно екстрагують розчином бутан-1-ол. Екстракти висушують над MgSO4 з одержанням, після випаровування, 1,9 г кислоти, яка має співвідношення 75:25 (S:R). Цю енантіомерно збагачену кислоту використовують у другій ферментативній реакції за присутності 0,2 г ліпази. Через 24 години за температури 30°C фермент відфільтровують, а потім промивають метанолом. Після випаровування залишок піддають хроматографії на колонці із силікагелем (елюент: СН2Сl2/МеOН від 99/1 до 99/2) з одержанням наступних продуктів: (S) кислота: 1,33 г; оч > 96 %; вихід кислоти (теоретично 75 %): 67 %; (R) естер: 0,42 г; оч > 96 %; вихід естеру (теоретично 25 %): 21 %; Загальний вихід реакції становить ~88 %. ЯМР і МС характеристика кислоти: 1 Н ЯМР (ДМСО-d6, ррm/ТМС): 3,17 (дд; 1Н; 13,6 Гц; 2,4 Гц); 3,27 (дд; 1Н; 13,6 Гц; 5,3 Гц); 4,13 (дд; 1Н); 3,71 (с; 3Н); 6,78 (с; 1Н); 6,80 (с; 1Н); 12,40 (с; 1Н). МС (ЕІ+) Молекулярний іон М+ за m/z 208. ЯМР і МС характеристика естеру: 7 UA 115765 C2 1 5 10 15 20 25 30 35 40 45 Н ЯМР(ДМСО-d6, м.ч./ТМС) = 3,19(дд; 1Н; 13,6 Гц; 2,4 Гц); 3,33 (дд; 1Н; 13,6 Гц; 5,5 Гц); 3,65 (с; 3Н); 3,71 (с; 6Н); 4,23 (дд; 1Н); 6,79 (с; 1Н); 6,82 (с; 1Н). МС (ЕІ+) Молекулярний іон М+ за m/z 222. Послідовність реакцій контролюють шляхом хірально-фазової ВЕРХ за умов, що надають можливість визначати енантіомерні надлишки як естеру, так і кислоти: Chiralpak® IС 250*4.6 колонка 30 % абсолютного етанолу + 0,1 % ТФК + 70 % гептану + 0,1 % ТФК 1 мл/хв., 25 °C, 288 нм ПРИКЛАД 6: Метил-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат Розчиняють 3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонову кислоту (3 г - 14,4 ммоль) в метанолі і додають ацетил хлориду (1,65 г - 21,1 ммоль). Кип'ятять реакційну суміш протягом 2 годин. Аналіз за допомогою ТШХ (елюент: дихлорметан) демонструє відсутність початкового матеріалу рацемічної кислоти. Випаровують реакційну суміш, переносять залишок в етилацетат і промивають органічну фазу NaHCO3. Випаровують до сухості і висушують з одержанням продукту, названого в заголовку, з виходом, що становить 97 %. ПРИКЛАД 7: Метил-(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат 2 г (с = 100 г/л) рацемічного метил-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7карбоксилату розчиняють у 20 мл суміші 80/20 ацетонітрилу/буфера з рівнем рН=7. 0,4 г (с = 20 г/л) ліпази Candida antarctica NOVOZYM 435® (Novozymes Denmark) потім додають до суміші (Ф/С співвідношення 1/5). Реакційну суміш підтримують за температури 30 °C із поворотним перемішуванням зі швидкістю 230 обертів за хвилину. Після реагування протягом 4 годин (рН=5,8) рівень рН коригують до 7,2. Через 24 години фермент відфільтровують і промивають шляхом перемішування в метанолі. Всі фільтрати збирають, випаровують і ліофілізують. Ліофілізат переносять в етилацетат, підтримують перемішування протягом ночі, потім реакційну суміш фільтрують і фільтрат випаровують. Залишок очищують на колонці із силікагелем (елюент дихлорметан/ метанол) з одержанням 0,81 г естеру названого в заголовку (7S), тобто з виходом, що становить 41 %. 20 [α] D за 589 нм: +64,7° (5 мг/мл в МеОН) Фракцію, яка містить кислоту, переносять в етилацетат з одержанням 0,72 г (7R) кислоти, тобто з виходом, що становить 36 %. 20 [α] D за 589 нм: -58,8° (5 мг/мл в МеОН). ПРИКЛАД 8: Метил-(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат Рацемічний метил-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат (1 мг; с=1 г/л) розчиняють в 1 мл суміші 90/10 фосфатного буфера з рівнем рН=7/толуолу. 5 мг (с = 5 г/л) ліпази Pseudomonas fluorescens потім додають до суміші (Ф/С співвідношення 5/1). Реакційну суміш підтримують за температури 28 °C із поворотним перемішуванням зі швидкістю 220 обертів за хвилину протягом 48 годин. Реакційну суміш аналізують за допомогою обернено-фазової ВЕРХ, а енантіоселективність (ен) залишкового естеру контролюють шляхом хірально-фазової ВЕРХ, відповідно до способів, описаних нижче: Умови аналізу реакційної суміші за допомогою обернено-фазової ВЕРХ: Kinetex® 2,6 мкм С18 50*2.1, 40 °C, 0,6мл/хв. 100 % А на 100 % В протягом 5 хвилин. А (1000 вода+25 АЦН+1 ТФК) В (1000 АЦН+25 вода+1 ТФК) Умови аналізу енантіоселективності за допомогою хірально-фазової ВЕРХ: Chiralpak® IС 250*4.6 колонка, 100 % абсолютного етанолу, 1 мл/хв., 25 °C, 288 нм Енантіомер (7R) (7S) Час затримки (хв.) 7,19 9,03 50 55 Аналіз реакційної суміші демонструє хорошу гідролітичну активність (відсотковий вміст залишкового естеру: 25 %). Аналіз енантіоселективності демонструє значення єн, що становить 90 %, для естеру (7S). ПРИКЛАД 9: 3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонова кислота Суспендують (7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонову кислоту (50 мг ен >95 %) в метанолі (1 мл) і додають гідроксид калію (20 мг). Нагрівають реакційну суміш за температури 65 °C протягом 24 годин. 8 UA 115765 C2 5 10 15 20 25 30 35 40 45 50 55 60 Спостерігають повну рацемізацію кислоти. Умови аналізу: Chiralpak® IС 250*4.6 колонка 30 % абсолютного етанолу + 0,1 % ТФК + 70 % гептану + 0,1 % ТФК 1 мл/хв., 25 °C, 288 нм ПРИКЛАД 10: (7S)-3,4-диметокси-N-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксамід Суспендують (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонову кислоту, одержану у Прикладі 5 (300 мг) в ТГФ (3 мл) за температури навколишнього середовища, а потім додають триетиламін (200 мкл). Етилхлорформіат (150 мкл) додають повільно до суміші. Реакційна суміш осаджується (суміш І). В іншій колбі метиламін як 2М розчин в ТГФ (2,25 мл) перемішують з водою (1 мл) і триетиламіном (300 мкл). Перемішування підтримують протягом 20 хвилин і потім одержану в результаті суміш додають до суміші І і перемішують за температури навколишнього середовища протягом ночі. Реакційну суміш потім випаровують і очищують шляхом препаративної ВЕРХ. (7S)-3,4-диметокси-N-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксамід одержують з виходом, що становить 60 %. 1 Н ЯМР (ДМСО-d6, ppm / ТМС) = 2,61 (м; 3Н); 3,16 (м; 2Н); 3,71 (с; 6Н); 4,05 (м; 1Н); 6,78 (с; 1Н); 6,81 (с; 1Н); 7,78 (с; 1Н). ПРИКЛАД 11: (7S)-3,4-диметокси-N-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксамід Суспендують метил-(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат (500 мг) у воді, а потім за температури навколишнього середовища повільно додають 20 мл 33 % розчину метиламіну в абсолютному етанолі. Після перемішування протягом 3 годин реакційну суміш випаровують. Одержаний залишок очищують шляхом препаративної ВЕРХ (елюент: вода/ацетонітрил/трифтороцтова кислота від 98/2/0,2 до 20/80/0,2) протягом 30 хвилин з одержанням продукту, названого в заголовку, з виходом, що становить 70 %. ПРИКЛАД 12: (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-N-метилметанамін Суспендують (7S)-3,4-диметокси-N-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксамід (450 мг) в тетрагідрофурані (20 мл), а потім до реакційної суміші повільно додають 1,6 мл розчину 2М LiАlН4 в тетрагідрофурані за температури навколишнього середовища. Спостерігають значне виділення газу, і реакційна суміш стає прозорою. Нагрівають реакційну суміш і кип'ятять протягом 30 хвилин. Після охолодження до температури навколишнього середовища гідролізують, а потім екстрагують етилацетатом. Висушують над MgSO 4, a потім випаровують. Одержаний залишок очищують шляхом препаративної ВЕРХ (елюент: вода/ацетонітрил/трифтороцтова кислота від 98/2/0,2 до 20/80/0,2) понад 30 хвилин з одержанням продукту, названого в заголовку, з виходом, що становить 46 %. 1 Н ЯМР (ДМСО-d6, м.ч. / ТМС) = 2,60 (м; 3Н); 2,85 (м; 1Н); 3,15 (м; 1Н); 3,25 (дд; 1Н); 3,30 (м; 1Н); 3,62 (м; 1Н); 3,70 (с; 6Н); 6,82 (с; 1Н); 6,89 (с; 1Н); 8,48 (с;1Н). ПРИКЛАД 13: (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-N-метилметанамін гідрохлорид 20 мл молярного розчину ВН3 в тетрагідрофурані додають, за температури навколишнього середовища, до суміші 2,2 г (10 ммоль) (7S)-3,4-диметокси-N-метилбіцикло[4.2.0]окта-1,3,5триєн-7-карбоксаміду в 45 мл тетрагідрофурану. Після перемішування протягом 1 години додають 10 мл розчину ВН3 в тетрагідрофурані. Після перемішування протягом ночі за температури навколишнього середовища додають по краплях 20 мл етанолу і суміш перемішують доти, доки більше не виділяється газ (приблизно 1 година). Потім додають по краплях 20 мл розчину соляної кислоти в етанолі. Після перемішування протягом 4 годин одержаний осад (1,2 г продукту, названого в заголовку) відфільтровують. Фільтрат концентрують і додаткові 0,65 г продукту, названого в заголовку, одержують за допомогою перенесення його твердої речовини в суміш 80/20 етилацетату/етанолу. Два осади поєднують з одержанням 1,85 г продукту, названого в заголовку (вихід: 77 %). ПРИКЛАД 14: Івабрадину гідрохлорид Завантажують 5,5 кг 3-[2-(1,3-диоксолан-2-іл)етил]-7,8-диметокси-1,3-дигідро-2Н-3бензазепін-2-он, 27,5 літрів етанолу і 550 г паладію-на-вуглеці, в автоклав. Очищують азотом, а потім воднем, нагрівають до температури 55 °C, а потім гідрогенізують за цієї температури під тиском 5 бар доти, доки не буде поглинута теоретична кількість водню. Потім охолоджують до температури навколишнього середовища і розгерметизовують автоклав. 9 UA 115765 C2 5 10 15 20 25 Потім додають 4 кг (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триен-7-іл]-Nметилметанамінгідрохлориду, 11 літрів етанолу, 5,5 літрів води і 1 кг паладію-на-вуглеці. Очищують азотом, а потім воднем, нагрівають до температури 85 °C, а потім гідрогенізують за цієї температури під тиском 30 бар доти, доки не буде абсорбована теоретична кількість водню. Потім повертають до температури навколишнього середовища, очищують автоклав, фільтрують реакційну суміш; відганяють розчинники, і виділяють івабрадину гідрохлорид шляхом кристалізації із суміші толуолу/1-метил-2-піролідинону. Івабрадин гідрохлорид одержують у такий спосіб з виходом, що становить 85 %, і з хімічною чистотою вище за 99 %. Порівняльний ПРИКЛАД: Попередній відбір ліпаз та естераз для ферментативного гідролізу метил-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилату Рацемічний метил-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксилат (1 мг; с=1 г/л) розчиняють в 1 мл суміші 90/10 фосфатного буфера з рівнем рН=7/толуолу. 5 мг (с = 5 г/л) досліджуваної ліпази або естерази потім додають до середовища (Ф/С співвідношення 5/1). Реакційну суміш підтримують за температури 28 °C із поворотним перемішуванням зі швидкістю 220 обертів за хвилину протягом 48 годин. Реакційну суміш аналізують за допомогою обернено-фазової ВЕРХ і енантіоселективність (ен) залишкового естеру контролюють шляхом хірально-фазової ВЕРХ, відповідно до способів, описаних нижче: Умови аналізу реакційної суміші за допомогою обернено-фазової ВЕРХ: Kinetex® 2,6 мкм C18 50*2.1, 40 °C, 0,6 мл/хв. 100 % А на 100 % В протягом 5 хвилин А (1000 вода+25 АЦН+1 ТФК) В (1000 АЦН+25 вода+1 ТФК) Умови аналізу енантіоселективності за допомогою хірально-фазової ВЕРХ: Chiralpak® IС 250*4.6 колонка 100 % абсолютного етанолу, 1 мл/хв., 25 °C, 288 нм Енантіомер (7R) (7S) Час затримки (хв.) 7,19 9,03 Результати представлені в наступній таблиці: 30 Ліпаза Ліпаза підшлункової залози свиней типу II Ліпаза PS (Pseudomonas cepacia) Ліпаза AY 30 (Candida rugosa) Ліпаза FAP-15 (Rhizopus oryzae) Ліпаза А6 (Aspergillus niger) Ліпаза AH (Pseudomonas cepacia) Ліпаза М "Amano"10 (Mucor javanicus) Ліпаза Aspergillus oryzae Ліпаза G "Amano" (Penicillium camemberti) Ліпаза AYS "Amano" (Candida rugosa) Ліпаза R "Amano" (Penicillium roqueforti) Естераза печінки свиней Естераза Rhizopus oryzae Естераза Mucor miehei Естераза печінки коней Newlase F (Rhizopus niveus) Ліпаза Pseudomonas fluorescens Ліпаза В Candida antarctica (Novozym® 435) % естеру 55 45 76 90 60 78 40 60 40 79 25 30 а % кислоти 100 45 100 55 24 10 40 22 60 40 100 100 60 21 100 100 75 70 a Ен (%) естеру 0 34 (S енантіо) 0 52 (S енантіо) 68 (R енантіо) 14 (S енантіо) 36 (S енантіо) 64 (S енантіо) 26 (R енантіо) 4 (R енантіо) 0 0 50 (S енантіо) 45 (S енантіо) 0 0 90 S енантіо) 94 (S енантіо) b Е 3 4 6 8 5 5 2 1 3 6 6 9 Енантіомерний надлишок ен (en %) = % енантіо Е2 - % енантіо Е1 / % енантіо Е2 + % енантіо Е1 (енантіо Е2 є переважним енантіомером) b коефіцієнт енантіоселективності Е = ln[(1-c)(1-eH(S)] / ln[(1-c)(1+eH(S)]; с = рівень конверсії = ен(естер) /ен(естер) + ен(кислота). 10 UA 115765 C2 ФОРМУЛА ВИНАХОДУ 1. Спосіб синтезу оптично чистої сполуки формули (Іа) H3C O H3C O (S) 5 O HO (Іа) шляхом енантіоселективної ферментативної естерифікації рацемічної або іншої оптично нечистої кислоти формули (X): H3C O H3C O O HO 10 15 20 , (X) з використанням ліпази Candida аntarctica або Pseudomonas fluorescens, в суміші спирту ROH, де R являє собою лінійну або розгалужену С 1-С6алкільну групу, і органічного співрозчинника, в концентрації від 5 до 500 г/л сполуки формули (X) на літр суміші розчинників, за співвідношення Ф/С від 10/1 до 1/100, за температури від 25 до 40 °C. 2. Спосіб синтезу за п. 1, який відрізняється тим, що співвідношення Ф/С становить від 1/5 до 1/10. 3. Спосіб синтезу за будь-яким з пп. 1 або 2, який відрізняється тим, що спирт ROH являє собою метанол, а співрозчинник являє собою ацетонітрил. 4. Спосіб синтезу за п. 3, який відрізняється тим, що співвідношення ацетонітрилу/метанолу становить від 8/2 до 9/1. 5. Спосіб синтезу за будь-яким з пп. 1-4, який відрізняється тим, що естер з конфігурацією (R), вторинний продукт реакції: H3C O H3C O (R) O O R 25 30 , гідролізується під дією основи з утворенням рацемічної кислоти формули (X) з метою повторного використання у способі ферментативної естерифікації. 6. Спосіб синтезу за п. 5, який відрізняється тим, що основа являє собою KOH. 7. Спосіб синтезу за будь-яким з пп. 5 або 6, який відрізняється тим, що етап гідролізу/рацемізації здійснюють in situ. 8. Спосіб синтезу за будь-яким з пп. 1-7, який відрізняється тим, що кислоту формули (Іа) виділяють після одного або більше циклів ферментативної естерифікації. 9. Спосіб синтезу оптично чистої сполуки формули (Іb): H3 C O H3 C O (S) O RO 35 , (Ib) де R являє собою лінійну або розгалужену С1-С6алкільну групу, шляхом енантіоселективного ферментативного гідролізу рацемічного або іншого оптично нечистого естеру формули (XI): 11 UA 115765 C2 H3 C O H3 C O O RO 5 10 15 , (XI) де R являє собою лінійну або розгалужену С1-С6алкільну групу, з використанням ліпази Candida аntarctica або Pseudomonas fluorescens, у воді, у буферному розчині з рівнем рН від 5 до 8 або у суміші органічного розчинника і води або буфера з рівнем рН від 5 до 8, за концентрації, що становить від 1 до 200 г/л сполуки формули (XI) на літр розчинника або суміші розчинників, за співвідношення Ф/С від 10/1 до 1/100, за температури від 25 до 40 °C, з подальшим виділенням естеру формули (Іb). 10. Спосіб синтезу за п. 9, який відрізняється тим, що співвідношення Ф/С становить від 1/5 до 1/10. 11. Спосіб синтезу за будь-яким з пп. 9 або 10, який відрізняється тим, що R являє собою метилову групу. 12. Спосіб синтезу за будь-яким з пп. 9-11, який відрізняється тим, що реакція здійснюється в суміші ацетонітрилу і буфера з рівнем рН=7. 13. Спосіб синтезу за п. 12, який відрізняється тим, що співвідношення ацетонітрилу/буфера з рівнем рН=7 становить від 8/2 до 9/1. 14. Спосіб синтезу за будь-яким з пп. 9-13, який відрізняється тим, що кислоту з конфігурацією (R), вторинний продукт реакції: 20 H3 C O H3 C O (R) O HO 25 , рацемізують під дією основи, а потім рацемічну кислоту, одержану у такий спосіб, алкілують з утворенням рацемічного естеру формули (XI) з метою повторного використання у способі ферментативного гідролізу. 15. Спосіб синтезу за п. 14, який відрізняється тим, що кислоту з конфігурацією (R) рацемізують під дією KОН у гарячому стані. 16. Спосіб синтезу за будь-яким з пп. 9-13, який відрізняється тим, що кислоту з конфігурацією (R), вторинний продукт реакції: H3 C O (R) H3 C O O HO 30 , спочатку алкілують, а потім естер з конфігурацією (R), одержаний у такий спосіб, рацемізують під дією основи з метою повторного використання у способі ферментативного гідролізу. 17. Спосіб синтезу за п. 16, який відрізняється тим, що естер з конфігурацією (R) рацемізують під дією ДБУ у гарячому стані або під дією KОН за температури навколишнього середовища. 18. Спосіб синтезу сполуки формули (III): H3C O H3C O (S) 35 H N CH3 , (III) який починають із нітрилу формули (IV): 12 UA 115765 C2 H3 C O H3 C O N , (IV) який потім гідролізують з утворенням рацемічної кислоти формули (X): H3C O H3C O O HO 5 , (X) ферментативна естерифікація якої, за будь-яким з пп. 1-8, дає вихід оптично чистої кислоти формули (Іа): H3C O H3C O (S) O HO , (Ia) яку потім перетворюють на оптично чистий амід формули (XII): H3C O (S) H3C O O HN CH3 10 , (XII) відновлення якого дає вихід сполуки формули (III). 19. Спосіб синтезу сполуки формули (III): H3C O (S) H3C O H N CH3 , (III) починаючи із нітрилу формули (IV): H3 C O H3 C O N , (IV) який гідролізують з утворенням рацемічної кислоти формули (X): H3C H3C 15 O O O HO , (X) і потім алкілують з утворенням рацемічного естеру формули (XI): 13 UA 115765 C2 H3 C O H3 C O O RO , (XI) де R являє собою лінійну або розгалужену С1-С6алкільну групу, ферментативний гідроліз якої, за будь-яким з пп. 9-17, дає вихід оптично чистого естеру формули (Іb): H3 C O H3 C O (S) 5 O RO , (Іb) де R являє собою лінійну або розгалужену С1-С6алкільну групу, що перетворюють на оптично чистий амід формули (XII): H3C O H3C O (S) O HN CH3 10 , (XII) відновлення якого дає вихід сполуки формули (III). 20. Спосіб синтезу за будь-яким з пп. 18 або 19, який відрізняється тим, що відновлення сполуки формули (XII) для одержання сполуки формули (III) здійснюють за допомогою ВН 3, NaBH4 або LiAlH4. 21. Спосіб синтезу івабрадину формули (ІІ): CH3O OCH3 CH3 CH3O N N 15 OCH3 O , (II) починаючи із сполуки формули (ІІІ), одержаної за способом синтезу за будь-яким з пп. 18-20, яку поєднують із сполукою формули (XIII): CH3O X N CH3O 20 O , (ХIII) де X являє собою атом галогену, або піддають реакції відновлювального амінування зі сполукою формули (XIV) за присутності відновлювача: CH3O N CH3O R2 O , (XIV) де R2 являє собою групу, вибрану із СНО і CHR3R4, 14 UA 115765 C2 5 10 де R3 і R4, кожен, являють собою лінійну або розгалужену (С 1-С6)алкоксигрупу або утворюють, разом з атомом вуглецю, що їх несе, 1,3-діоксанове, 1,3-діоксоланове або 1,3-діоксепанове кільце, з одержанням івабрадину, який потім перетворюють на адитивну сіль з фармацевтично прийнятною кислотою, зазначена сіль знаходиться у безводній або у гідратованій формі. 22. Спосіб синтезу за п. 21, який відрізняється тим, що X являє собою атом йоду. 23. Спосіб синтезу за п. 21, який відрізняється тим, що сполуку формули (III) використовують в реакції відновлювального амінування у формі її гідрохлориду з одержанням івабрадину у формі гідрохлориду. 24. Спосіб синтезу за будь-яким з пп. 21 або 23, який відрізняється тим, що реакцію відновлювального амінування зі сполукою формули (XIV) здійснюють за присутності дигідрогену, що каталізується паладієм-на-вуглеці. Комп’ютерна верстка Л. Бурлак Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Автори російськоюSandrine Pedragosa Moreau, Francois Lefoulon
МПК / Мітки
МПК: C07C 213/08, C12P 7/40, C12P 41/00, C07D 223/16, C12P 7/62, C07C 217/58, C07C 62/34, C07C 69/753
Мітки: кислоти, івабрадину, 7s)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонової, синтезу, солей, естерів, ферментативного, синтезі, застосування, спосіб
Код посилання
<a href="https://ua.patents.su/17-115765-sposib-fermentativnogo-sintezu-7s-34-dimetoksibiciklo420okta-135-triehn-7-karbonovo-kisloti-abo-esteriv-ta-zastosuvannya-v-sintezi-ivabradinu-ta-jjogo-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб ферментативного синтезу (7s)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонової кислоти або її естерів та застосування в синтезі івабрадину та його солей</a>