Спосіб ферментного синтезу (7s)-1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-n-метилметанаміну та використання в синтезі івабрадину та його солей
Номер патенту: 113052
Опубліковано: 12.12.2016
Автори: Сандрін Педрагоса Моро, Франсуа Лефулон, Франсіско Моріс Варас, Хавьєр Гонзалез Сабін
Формула / Реферат
1. Спосіб синтезу сполуки формули (IX):
 , (IX)
, (IX)
де R1 являє собою лінійну або розгалужену С1-С6алкільну, алільну або бензильну групу,
шляхом енантіоселективного ферментативного ацилювання рацемічного аміну формули (IV):
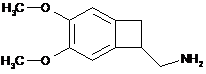 , (IV)
, (IV)
використовуючи ліпазу (EC 3.1.1.3 в міжнародній класифікації ферментів), з карбонатом формули R1O-(CO)-OR1, де R1 є таким, як визначено вище, в кількості в діапазоні від 1 до 15 молярних еквівалентів відносно аміну формули (IV), в органічному або водному розчиннику, суміші органічних розчинників або в суміші органічних і водних розчинників, в концентрації від 5 до 500 г/л сполуки формули (IV) на літр розчинника або суміші розчинників,
при співвідношенні E/S від 10/1 до 1/100, за температури від 25 °C до 40 °C.
2. Спосіб синтезу за п. 1, який відрізняється тим, що ліпазу вибирають із ліпаз Pseudomonas fluorescens, Pseudomonas cepacia, підшлункової залози свині, і ліпази PS 'Amano' SD (Burkholderia cepacia) і IМ (іммобілізовані на діатоміті).
3. Спосіб синтезу за п. 2, який відрізняється тим, що ліпаза є ліпазою Pseudomonas серасіа або ліпазою PS 'Amano' IМ.
4. Спосіб синтезу за будь-яким з пп. 1-3, який відрізняється тим, що співвідношення E/S становить від 1/1 до 1/10.
5. Спосіб синтезу за будь-яким з пп. 1-4, який відрізняється тим, що розчинник вибирають із ТБМЕ, ТГФ, 2-МеТГФ і 1,4-діоксану, самостійно або в суміші із буфером з рН=7.
6. Спосіб синтезу за будь-яким з пп. 1-5, який відрізняється тим, що R1 є групою етилу, алілу або бензилу.
7. Спосіб синтезу сполуки формули (І):
 , (І)
, (І)
шляхом ферментативного ацилювання рацемічного аміну формули (IV), вказаного у будь-якому з пп. від 1-6, з одержанням карбамату формули (IX):
 , (IX)
, (IX)
де R1 являє собою лінійну або розгалужену С1-С6алкільну, алільну або бензильну групу,
який потім відновлюють з використанням відновлювача, вибраного із LiAIH4 і Red-AI,
щоб одержати сполуку формули (І).
8. Спосіб синтезу за п. 7, який відрізняється тим, що сполуку формули (І) потім або поєднують зі сполукою формули (X):
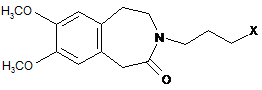 , (X)
, (X)
де X являє собою атом галогену,
або, за присутності відновлювача, піддають реакції відновлювального амінування зі сполукою формули (XI):
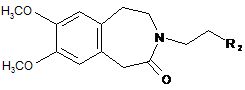 , (XI)
, (XI)
де R2 являє собою групу, вибрану із СНО і CHR3R4,
де R3 і R4, кожен, являє собою лінійну або розгалужену (С1-С6)алкоксигрупу або утворюють, разом з атомом вуглецю, який їх несе 1,3-діоксанове, 1,3-діоксоланове або 1,3-діоксепанове кільце,
з одержанням івабрадину, який потім перетворюють на адитивну сіль з фармацевтично прийнятною кислотою у безводній або в гідратованій формі.
9. Спосіб синтезу за п. 8, який відрізняється тим, що X є атомом йоду.
10. Спосіб синтезу за п. 8, який відрізняється тим, що сполука формули (І), яка використовується в реакції відновлювального амінування, перебуває у формі її гідрохлориду, з одержанням івабрадину у формі гідрохлориду.
11. Спосіб синтезу за п. 8 або п. 10, який відрізняється тим, що реакцію відновлювального амінування зі сполукою формули (XI) здійснюють за присутності дигідрогену, який каталізують паладієм-на-вуглеці.
Текст
Реферат: Спосіб ферментативного синтезу сполуки формули (І) (7S)-1-(3,4-диметоксибіцикло[4.2.0]окта1,3,5-триєн-7-іл)-N-метилметанаміну: H3C O H3C O (S) H N CH3 , (І) і використання в синтезі івабрадину і його адитивних солей з фармацевтично прийнятною кислотою. UA 113052 C2 (12) UA 113052 C2 UA 113052 C2 Даний винахід стосується способу ферментативного синтезу сполуки формули (І), (7S)-1(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-N-метилметанаміну: H3C O H3C O (S) H N CH3 , (І) а також її використання в синтезі івабрадину формули (II): CH3O OCH3 CH3 CH3O 5 10 15 20 O H3 C O N , (III) за допомогою ВН3 в тетрагідрофурані, з наступним додаванням соляної кислоти, з одержанням гідрохлориду рацемічного аміну формули (IV): H3 C O H3 C 30 OCH3 O , (IІ) або 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]пропіл}7,8-диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-ону, його адитивних солей з фармацевтично прийнятною кислотою і їх гідратів. Івабрадин і його адитивні солі з фармацевтично прийнятною кислотою і, зокрема, його гідрохлорид, мають дуже цінні фармакологічні і терапевтичні властивості, зокрема брадикардичні властивості, які роблять ці сполуки корисними для лікування або профілактики різних клінічних станів ішемії міокарда, таких як стенокардія, інфаркт міокарда і пов'язані порушення серцевого ритму, а також різних патологій, які включають порушення ритму, зокрема, суправентрикулярні порушення ритму, і при серцевій недостатності. Приготування і терапевтичне застосування івабрадину і його адитивних солей з фармацевтично прийнятною кислотою і, зокрема, його гідрохлориду, були описані в Європейському патенті ЕР 0534859. В зазначеному патенті описується синтез івабрадину гідрохлориду, починаючи зі сполуки формули (І). Сполука формули (І) є ключовою проміжною сполукою у синтезі івабрадину і його фармацевтично прийнятних солей. У попередньому рівні техніки розкриті декілька способів одержання сполуки формули (І). У Європейському патенті ЕР 0534859 описується синтез сполуки формули (І) шляхом відновлення рацемічного нітрилу формули (III): H3 C 25 N N O H3C O H3C O NH2 , (IV) який реагує з етилхлорформіатом з одержанням карбамату формули (V): H N OEt O , (V) 1 UA 113052 C2 відновлення якого, за допомогою LiAIH4, дає вихід рацемічного метилованого аміну формули (VI): H3C O H3C O H N CH3 5 10 , (VI) розщеплення якого, з використанням камфорсульфонової кислоти, дає сполуку формули (І). Цей спосіб має недолік одержання сполуки формули (І) тільки з дуже низьким виходом, який становить від 2 до 3 %, починаючи із рацемічного нітрилу формули (III). Цей дуже низький вихід відбувається через низький вихід (від 4 до 5 %) етапу розщеплення вторинного аміну формули (VI). У Європейському патенті ЕР 1598333 описується одержання сполуки формули (І) шляхом конверсії рацемічного первинного аміну формули (IV) на сіль з використанням N-ацетил-Lглутамінової кислоти, з наступною перекристалізацією, а потім поверненням до основи, з одержанням оптично активного первинного аміну формули (VII): H3 C O (S) H3 C H3 C 20 O H3 C 15 O NH2 O , (VII), з наступним метилуванням його з використанням такої ж реакційної послідовності, яка зазначена вище (конверсія на карбамат з наступним відновленням). Цей спосіб призводить до одержання метанаміну формули (І) за 4 етапи з виходом близько 30 %, починаючи з рацемічного первинного аміну формули (IV). Проблемою даного винаходу було одержання сполуки формули (І) шляхом зменшення кількості етапів, починаючи з рацемічного первинного аміну формули (IV), зберігаючи в той же час хороший загальний вихід. Зокрема, даний винахід стосується способу синтезу карбамату формули (IX): (S) N O R1O 25 30 35 40 , (IX) де R1 являє собою лінійну або розгалужену С1-С6алкільну, алільну або бензильну групу, шляхом енантіоселективного ферментативного ацилювання рацемічного аміну формули (IV), використовуючи ліпазу (EC 3.1.1.3 в міжнародній класифікації ферментів), з карбонатом формули R1O-(CO)-OR1, де R1 є таким, як визначено вище, в кількості в діапазоні від 1 до 15 молярних еквівалентів відносно аміну формули (IV), в органічному або водному розчиннику, суміші органічних розчинників або суміші органічних і водних розчинників, в концентрації від 5 до 500 г/л сполуки формули (IV) на літр розчинника або суміші розчинників, при співвідношенні E/S від 10/1 до 1/100, переважно - від 1/1 до 1/10, за температури від 25 °C до 40 °C. Карбамат формули (IX), одержаний за допомогою способу згідно з даним винаходом, переважно має енантіомерну чистоту більше ніж 85 %, тобто енантіомерний надлишок більше ніж 70 %. Серед ліпаз, які можуть бути використані у способі ферментативної етерифікації відповідно до даного винаходу, можна згадати, не обмежуючись тільки ними, ліпази Pseudomonas fluorescens, Pseudomonas серасіа, підшлункової залози свині, і ліпази PS 'Amano' SD (Burkholderia серасіа) і IМ (іммобілізовані на діатоміті). Ліпази, які є переважними згідно з винаходом, являють собою ліпази Pseudomonas серасіа та PS 'Amano' IМ. Переважними карбонатами R1O-(CO)-OR1 є ті, де R1 являє собою групу алілу, етилу або бензилу. 2 UA 113052 C2 5 Серед органічних розчинників, які можуть бути використані для реакції ферментативного ацилювання згідно з даним винаходом, можуть бути згадані, не обмежуючись ними, етилацетат, ТБМЕ, ТГФ, 2-МеТГФ, толуол, 1,4-діоксан, трет-аміловий спирт, ЦПМЕ та ацетонітрил. Переважними розчинниками є ТБМЕ, ТГФ, 2-МеТГФ та 1,4-діоксан, самостійно або в суміші з буфером з рН=7. Схема ферментативного ацилювання відповідно до винаходу є наступною: O OCH3 H2N O R1 O (S) OR1 R1 O OCH3 Фермент Розчинник + OCH3 (IV) 10 (R) OCH3 N H H2N OCH3 OCH3 (IX) . Карбамат формули (IX) потім виділяють з реакційної суміші, а потім відновлюють з використанням алюмогідриду, такого як літію алюмогідрид (LiАІН 4) або натрію біс(2метоксиетокси)алюмогідрид (Red-AI), з одержанням метилованого аміну формули (І). Останній потім або поєднують зі сполукою формули (X): H3CO X N H3CO 15 O , (X) де X являє собою атом галогену, переважно атом йоду, або, за присутності відновлювача, піддають реакції відновлювального амінування зі сполукою формули (XI): H3CO N H3CO 20 25 30 35 40 45 R2 O , (XI) де R2 являє собою групу, вибрану із СНО і CHR3R4, де R3 і R4, кожен, являє собою лінійну або розгалужену (С 1-С6)алкоксигрупу або утворюють, разом з атомом вуглецю, що їх несе, 1,3-діоксанове, 1,3-діоксоланове або 1,3-діоксепанове кільце, з одержанням івабрадину, який потім перетворюється на адитивну сіль з фармацевтично прийнятною кислотою. Сполука формули (І) також може бути використана в реакції відновлювального амінування у формі її адитивної солі з фармацевтично прийнятною кислотою, переважно - її гідрохлориду. В такому випадку івабрадин одержують безпосередньо у формі гідрохлориду. Визначення Під рацемічною сполукою розуміють сполуку у формі суміші двох енантіомерів у співвідношенні від 55:45 до 45:55. Під енантіоселективним ацилюванням аміну у формі суміші двох енантіомерів розуміють пріоритетне ацилювання одного з енантіомерів суміші. Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-яких обмежень, соляна кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кислота, бензолсульфонова кислота і камфорна кислота. Серед відновлювачів, які можуть бути використані в реакції відновлювального амінування між сполукою формули (І) і сполукою формули (XI), можуть бути згадані, без будь-яких обмежень, сполуки гідридного донора, такі як триацетоксиборгідрид натрію або ціаноборгідрид натрію, і дигідроген, за присутності каталізатора, такого як паладій, платина, нікель, рутеній, родій, або їх сполуки, зокрема на підкладці або у формі оксидів. Переважний відновлювач для реакції відновлювального амінування між сполукою формули (І) і сполукою формули (XI) є дигідроген, який каталізується паладієм-на-вуглеці. Приклади, наведені тут нижче, ілюструють винахід. 3 UA 113052 C2 Скорочення ЦПМЕ ЦиклоПентилМетилЕфір ДЕА ДиЕтилАмін Е Коефіцієнт енантіоселективності E/S співвідношення Фермент/Субстрат, виражене в г/г ее енантіомерний надлишок екв. молярний еквівалент ВЕРХ Високоефективна рідинна хроматографія Red-AI натрію біс(2-метоксиетокси)алюмогідрид ЯМР Ядерний магнітний резонанс (спектроскопія) ТБМЕ Трет-БутилМетилЕфір ТГФ ТетраГідроФуран 2-Ме ТГФ 2-МетилТетраГідроФуран об./хв. обертів за хвилину 5 10 ПРИКЛАД 1: Етил{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}карбамат 5 мг 1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл) метанаміну і 12,6 мг (10 екв.) діетилкарбонату розчиняють в 2-МеТГФ. 5 мг ліпази II Pseudomonas cepacia (PS-CII Аmаnо) потім додають до суміші (E/S співвідношення 1/1). Реакційну суміш підтримують за температури 30 °C із поворотним перемішуванням зі швидкістю 250 об./хв. протягом періоду часу від 24 годин до 96 годин. Реакцію контролюють шляхом хірально-фазової ВЕРХ за умов, які надають можливість визначати енантіомерні надлишки як карбамату, так і аміну: Хірально-фазові умови: Chiralpak® 1С 250*4.6 колонка 50 % абсолютного етанолу + 0,1 % ДЕА + 50 % гептану + 0,1 % ДЕА 1 мл/хв., 25 °C, 288 нм Концентрація 20 25 Конверсія с (%) 10 г/л 20 г/л 50 г/л 15 t 24 год.96 год. 96 год. 38 51 57 Ее (%) карбамат (S) Е 92,3 88,8 76,1 45 58 69 ПРИКЛАД 2: Етил{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}карбамат 0,5 г 1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метанаміну розчиняють в 50 мл 2МеТГФ, а потім додають діетилкарбонат (1,5 мл, 12 екв.). Додають 0,5 г (E/S співвідношення 1/1) ліпази II Pseudomonas cepacia (PS-СII Amano) до суміші, яку підтримують за температури 30 °C протягом 48 годин із перемішуванням зі швидкістю 220 об./хв. Через 48 годин реакційну суміш фільтрують, щоб видалити фермент, а потім випаровують. Карбамат конфігурації S одержують після розділення на колонці SiO 2, елююючи циклогексаном/етилацетатом 95/5, потім 80/20 і, нарешті, 50/50, щоб відновити більш полярний амін. Потім одержують етил карбамат конфігурації S (224 мг) з виходом 32,5 % відносно початкового аміну (65 % відносно очікуваної кількості карбамату) і з енантіомерною чистотою 90 %. Реакцію контролюють шляхом хірально-фазової ВЕРХ за умов, які надають можливість визначати енантіомерні надлишки як карбамату, так і аміну: Хірально-фазові умови: Chiralpak® IС 250*4.6 колонка 50 % абсолютного етанолу + 0,1 % ДЕА + 50 % гептану + 0,1 % ДЕА 1 мл/хв., 25 °C, 288 нм Час (год.) 24 48 30 Ее (%) амін (R) 57,7 93,2 99,9 Конверсія (%) 34 53 Ее (карбамат) (%) 88 81 Ее (амін) (%) 45 93 Е 23 35 ПРИКЛАД 3: Аліл{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}карбамат 0,87 г 1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл) метанаміну розчиняють в 100 мл 2-МеТГФ, а потім додають діалілкарбонат (1,5 мл, ~2 екв.). Потім додають 0,5 г (E/S 4 UA 113052 C2 5 співвідношення 1/1) ліпази II Pseudomonas cepacia (PS-CII Amano) до суміші, яку підтримують за температури 30 °C протягом 42 годин із перемішуванням зі швидкістю 220 об./хв. Потім реакційну суміш фільтрують, щоб видалити фермент, а потім випаровують. Алілкарбамат одержують після розділення на колонці SiO 2, елююючи циклогексаном/етилацетатом 95/5, потім 80/20 і, нарешті, 50/50, щоб відновити більш полярний амін. Потім одержують алілкарбамат конфігурації S (440 мг) з виходом 35 % відносно початкового аміну (70 % відносно очікуваної кількості карбамату) і з енантіомерною чистотою 88 %. Час (год.) 42 Конверсія (%) 50 Ее (карбамат)(%) 89 Ее (амін) (%) 82 Е 26 10 Реакційну суміш аналізують за допомогою обернено-фазової ВЕРХ, а енантіоселективність (ее) карбамату та аміну контролюють шляхом хірально-фазової ВЕРХ, відповідно до способів, описаних нижче: Обернено-фазові умови: Phenomenex® LUNA HST 50*3 колонка С18(2) 2.5 мкм від 0 % до 100 % В понад 8 хв. 0,8 мл/хв. 40 °C А (1000 води + 25 АЦН + 1 ТФК) В (1000 АЦН + 25 води + 1 ТФК) Хірально-фазові умови: Chiralpak® IС 250*4.6 колонка 50 % ізопропанолу + 0,1 % ЕА + 50 % гептану + 0,1 %ЕА 1 мл/хв., 30 °C, 288 нм 15 20 25 ПРИКЛАД 4: Бензил{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}карбамат 0,5 г 1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метанаміну розчиняють в 50 мл 2МеТГФ, а потім додають дибензил карбонат (4,5 г, 7 екв.). Додають 0,5 г (E/S співвідношення 1/1) ліпази II Pseudomonas cepacia (PS-C II Amano) до суміші, яку підтримують за температури 30 °C із перемішуванням зі швидкістю 220 об./хв. Через 24 години реакційну суміш фільтрують, щоб видалити фермент, а потім випаровують. Карбамат конфігурації S одержують після розділення на колонці SiO2, елююючи циклогексаном/етилацетатом 95/5, потім 80/20 і, нарешті, 50/50, щоб відновити більш полярний амін. Потім одержують бензилкарбамат конфігурації S (0,26 г) з виходом 30 % відносно початкового аміну (60 % відносно очікуваної кількості карбамату) і з енантіомерною чистотою 95 %. Реакційну суміш аналізують за допомогою обернено-фазової ВЕРХ, а енантіоселективність (ее) карбамату та аміну контролюють шляхом хірально-фазової ВЕРХ, відповідно до способів, описаних нижче: 30 Обернено-фазові умови: Хірально-фазові умови: Час (год.) 24 35 Конверсія (%) 58 Phenomenex® LUNA HST 50*3 колонка С18(2) 2,5 мкм від 0 % до 100 % В понад 8 хв. 0,8 мл/хв. 40 °C А (1000 води + 25 АЦН + 1 ТФК) В (1000 АЦН + 25 води + 1 ТФК) Chiralpak® IС 250*4.6 колонка 50 % ізопропанолу + 0,1 % ДЕА + 50 % гептану + 0,1 % ДЕА 1 мл/хв., 25 °C, 288 нм Ее (карбамат) (%) 90 Ее (амін) (%) 87 Е 12 ПРИКЛАД 5: (7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-N-метилметанамін В атмосфері азоту завантажують в реактор літію алюмогідрид (1,41 кг) і тетрагідрофуран (32,5 л), а потім за температури 20 °C вливають розчин етил {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}карбамату (5 кг) в тетрагідрофурані (50 л). Нагрівають за кипіння протягом 1 години, а потім охолоджують до температури нижче 15 °C і 5 UA 113052 C2 5 10 15 20 25 30 35 40 гідролізують реакційну суміш водою (1 л), 5N водним розчином гідроксиду натрію (1 л), а потім водою (1 л). Відфільтровують одержану тверду речовину. Висушують органічну фазу. Зазначений у заголовку продукт одержують у вигляді масла з виходом 93 %. 1 Н ЯМР (ДМСО-d6, частин на мільйон / TMS) = 2,60 (м; 3Н); 2,85 (м; 1Н); 3,15 (м; 1Н); 3,25 (дд; 1Н); 3,30 (м; 1Н); 3,62 (м; 1Н); 3,70 (с; 6Н); 6,82 (с; 1Н); 6,89 (с; 1Н);8,48 (сл; 1Н). ПРИКЛАД 6: (7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-N-метилметанаміну гідрохлорид Завантажують в реактор (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-Nметилметанамін (5 кг), етилацетат (40 л) і етанол (10 л). Перемішують за температури 20 °C протягом 30 хвилин, а потім через донний клапан реактора або через занурену трубку додають газоподібний хлористий водень (1,012 кг). Одержану суспензію перемішують за температури 1520 °C протягом 1 години, а потім фільтрують або висушують з відсмоктуванням. Осад промивають сумішшю етилацетату/етанолу 4/1 (2×5 л), а потім висушують з одержанням зазначеного у заголовку продукту з виходом 92 %. ПРИКЛАД 7: Івабрадину гідрохлорид Завантажують в автоклав 5,5 кг 3-[2-(1,3-діоксолан-2-іл)етил]-7,8-диметокси-1,3-дигідро-2H3-бензазепін-2-ону, 27,5 л етанолу і 550 г паладію-на-вуглеці. Очищують азотом, а потім воднем, нагрівають до температури 55 °C, а потім гідрогенізують за цієї температури під тиском 5 бар доти, доки не буде поглинута теоретична кількість водню. Потім охолоджують до температури навколишнього середовища і розгерметизовують автоклав. Потім додають 4 кг (75)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-Nметилметанаміну гідрохлориду, 11 літрів етанолу, 5,5 літрів води і 1 кг паладію-на-вуглеці. Очищують азотом, а потім воднем, нагрівають до температури 85 °C, а потім гідрогенізують за цієї температури під тиском 30 бар доти, доки не буде поглинута теоретична кількість водню. Потім повертають до температури навколишнього середовища, очищують автоклав, а потім фільтрують реакційну суміш; відганяють розчинники, а потім виділяють івабрадину гідрохлорид шляхом кристалізації із суміші толуолу/1-метил-2-піролідинону. Івабрадину гідрохлорид одержують таким способом з виходом, який становить 85 % і з хімічною чистотою вище за 99 %. ПРИКЛАД 8: Відбір ліпаз для ферментативного ацилювання 1-(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл) метанаміну Рацемічний 1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метанамін (5 мг; с=10 г/л) і карбонат формули R1O-(CO)-OR1 (10 екв.) розчиняють в 0,5 мл ТБМЕ. 5 мг (с=10 г/л) досліджуваної ліпази потім додають до середовища (E/S співвідношення = 1/1). Реакційну суміш підтримують за температури 30 °C із поворотним перемішуванням зі швидкістю 250 об./хв. протягом 24 годин. Реакційні суміші аналізують за допомогою хірально-фазової ВЕРХ для перевірки енантіоселективності, відповідно до способу: Chiralpak® IС 20 мкм колонка, 250*4.6 ацетонітрил/пропан-2-ол/ДЕА 90/10/0,1 %; 1,3 мл/хв.; 30 °C, 288 нм Результати представлені в наступній таблиці: Ліпаза Pseudomonas cepacia ліпаза II Pseudomonas fluorescens Ліпаза PS 'Amano' SD Ліпаза PS 'Amano' IM Pseudomonas cepacia ліпаза II Pseudomonas fluorescens Ліпаза PS 'Amano' IM Pseudomonas cepacia ліпаза II Pseudomonas fluorescens Ліпаза PS 'Amano' IM Карбонат Продукт ее (%) Конверсія с ее (%) Амін Карбамат (%) (R) (S) Е 59 >99,9 69,8 40 14 4 52 12,3 3,9 91,6 73,8 83,2 83,5 7 11 36 57 97,0 73,4 26 5 33 3,9 44,4 78,2 89,0 8 27 16 17,7 89,6 22 3 12 2,2 11,2 66,1 84,6 5 13 O O IXa O O Ph O O Ph IXb O O O IXc 6 UA 113052 C2 H3 C O H3 C O (S) N O R1O 5 , (IX) IXa: R1 - аліл IXb: R1 = бензил IXc: R1 = етил. a Енантіомерний надлишок ее (en %) = % енантіо Е2 - % енантіо Е1 / % енантіо Е2 + % енантіо Е1 (енантіо Е2 є переважним енантіомером); b Коефіцієнт енантіоселективності Е = ln[(1-c)(1-ee(S)] / ln[(1-c)(1+ee(S)]; с = рівень конверсії = ее(амін) /[ее(карбамат) + ее(амін)]. ФОРМУЛА ВИНАХОДУ 10 1. Спосіб синтезу сполуки формули (IX): H3 C O H3 C O (S) N O R1O 15 , (IX) де R1 являє собою лінійну або розгалужену С1-С6алкільну, алільну або бензильну групу, шляхом енантіоселективного ферментативного ацилювання рацемічного аміну формули (IV): H3 C H3 C 30 O H3C 25 O H3C 20 O O NH2 , (IV) використовуючи ліпазу (EC 3.1.1.3 в міжнародній класифікації ферментів), з карбонатом формули R1O-(CO)-OR1, де R1 є таким, як визначено вище, в кількості в діапазоні від 1 до 15 молярних еквівалентів відносно аміну формули (IV), в органічному або водному розчиннику, суміші органічних розчинників або в суміші органічних і водних розчинників, в концентрації від 5 до 500 г/л сполуки формули (IV) на літр розчинника або суміші розчинників, при співвідношенні E/S від 10/1 до 1/100, за температури від 25 °C до 40 °C. 2. Спосіб синтезу за п. 1, який відрізняється тим, що ліпазу вибирають із ліпаз Pseudomonas fluorescens, Pseudomonas cepacia, підшлункової залози свині, і ліпази PS 'Amano' SD (Burkholderia cepacia) і IМ (іммобілізовані на діатоміті). 3. Спосіб синтезу за п. 2, який відрізняється тим, що ліпаза є ліпазою Pseudomonas серасіа або ліпазою PS 'Amano' IМ. 4. Спосіб синтезу за будь-яким з пп. 1-3, який відрізняється тим, що співвідношення E/S становить від 1/1 до 1/10. 5. Спосіб синтезу за будь-яким з пп. 1-4, який відрізняється тим, що розчинник вибирають із ТБМЕ, ТГФ, 2-МеТГФ і 1,4-діоксану, самостійно або в суміші із буфером з рН=7.6. Спосіб синтезу за будь-яким з пп. 1-5, який відрізняється тим, що R1 є групою етилу, алілу або бензилу. 7. Спосіб синтезу сполуки формули (І): (S) 35 H N CH3 , (І) шляхом ферментативного ацилювання рацемічного аміну формули (IV), вказаного у будь-якому з пп. 1-6, з одержанням карбамату формули (IX): 7 UA 113052 C2 H3 C O H3 C O (S) N O R1O 5 , (IX) де R1 являє собою лінійну або розгалужену С1-С6алкільну, алільну або бензильну групу, який потім відновлюють з використанням відновлювача, вибраного із LiAIH 4 і Red-AI, щоб одержати сполуку формули (І). 8. Спосіб синтезу за п. 7, який відрізняється тим, що сполуку формули (І) потім або поєднують зі сполукою формули (X): H3CO X N H3CO 10 O , (X) де X являє собою атом галогену, або, за присутності відновлювача, піддають реакції відновлювального амінування зі сполукою формули (XI): H3CO N H3CO 15 20 R2 O , (XI) де R2 являє собою групу, вибрану із СНО і CHR3R4, де R3 і R4, кожен, являє собою лінійну або розгалужену (С 1-С6)алкоксигрупу або утворюють, разом з атомом вуглецю, який їх несе, 1,3-діоксанове, 1,3-діоксоланове або 1,3-діоксепанове кільце, з одержанням івабрадину, який потім перетворюють на адитивну сіль з фармацевтично прийнятною кислотою у безводній або в гідратованій формі. 9. Спосіб синтезу за п. 8, який відрізняється тим, що X є атомом йоду. 10. Спосіб синтезу за п. 8, який відрізняється тим, що сполука формули (І), яка використовується в реакції відновлювального амінування, перебуває у формі її гідрохлориду, з одержанням івабрадину у формі гідрохлориду. 11. Спосіб синтезу за п. 8 або п. 10, який відрізняється тим, що реакцію відновлювального амінування зі сполукою формули (XI) здійснюють за присутності дигідрогену, який каталізують паладієм-на-вуглеці. 25 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори російськоюSandrine Pedragosa Moreau, Francois Lefoulon, Francisco Moris Varas, Javier Gonzalez Sabin
МПК / Мітки
МПК: A61K 45/06
Мітки: синтезу, івабрадину, ферментного, синтезі, використання, спосіб, солей, 7s)-1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-n-метилметанаміну
Код посилання
<a href="https://ua.patents.su/10-113052-sposib-fermentnogo-sintezu-7s-1-34-dimetoksibiciklo420okta-135-triehn-7-il-n-metilmetanaminu-ta-vikoristannya-v-sintezi-ivabradinu-ta-jjogo-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб ферментного синтезу (7s)-1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-n-метилметанаміну та використання в синтезі івабрадину та його солей</a>
Попередній патент: Гетероциклічні похідні та їх застосування у лікуванні неврологічних розладів
Наступний патент: Гетероциклічні сполуки, придатні для лікування дисліпідемії
Випадковий патент: Спосіб комплексної оцінки біохемілюмінесценції тканин організму












