Макроциклічні пептиди, які є активними по відношенню до вірусу гепатиту с
Формула / Реферат
1. Сполука формули (І):
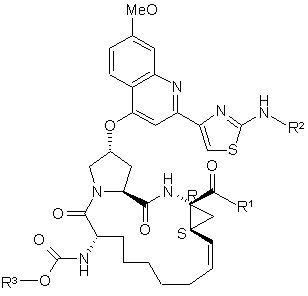 , (I)
, (I)
у якій R1 означає гідрокси або NHSO2R1A, де R1A означає С1-С8алкіл, С3-С7циклоалкіл або С1-С6алкіл-С3-С7циклоалкіл, які всі необов'язково заміщені 1-3 замісниками, вибраними з ряду, який включає галоген, ціано, нітро, ОС1-С6алкіл, амідо, аміно або феніл, або R1А означає С6- або С10арил, необов'язково заміщений 1-3 замісниками, вибраними з ряду, який включає галоген, ціано, нітро, С1-С6алкіл, ОС1-С6алкіл, амідо, аміно або феніл; R2 означає С5-С6циклоалкіл та R3 означає циклопентил; або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка відрізняється тим, що R1 означає гідрокси або NHSO2R1А, де R1А означає С1-С6алкіл, С3-С7циклоалкіл або С1-С6алкіл-С3-С7циклоалкіл, які всі необов'язково заміщені 1-3 замісниками, вибраними з ряду, який включає галоген, нітро або ОС1-С6алкіл, або феніл, необов'язково заміщений 1-3 замісниками, вибраними з ряду, який включає галоген, нітро, С1-С6алкіл або ОС1-С6алкіл.
3. Сполука за п. 2, яка відрізняється тим, що R1 означає NHSO2R1А, де R1А означає метил, етил, циклопропіл, циклобутил, циклопентил, циклопропілметил, циклогексилетил, ССl3, СF3, феніл, 2-фторфеніл або 4-метилфеніл.
4. Сполука за п. 3, яка відрізняється тим, що R1A означає циклопропіл.
5. Сполука за п. 1 або 2, яка відрізняється тим, що R1 означає гідрокси.
6. Сполука за будь-яким одним з пп. 1-5, яка відрізняється тим, що R2 означає циклопентил.
7. Сполука за п. 1, яка відрізняється тим, що має формулу 101:
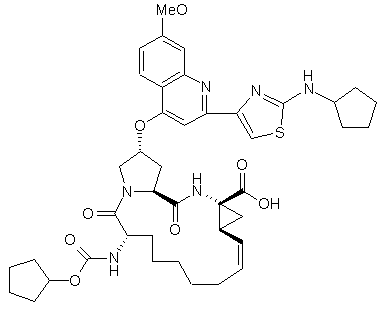 (101).
(101).
8. Сполука за п. 1, яка відрізняється тим, що має формулу 102:
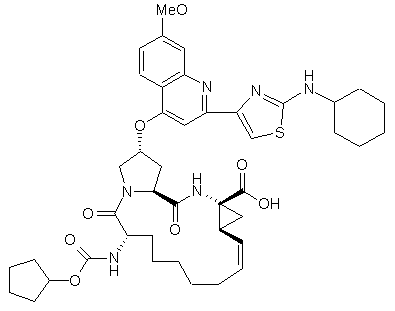 (102).
(102).
9. Сполука за п. 1, яка відрізняється тим, що має формулу 103:
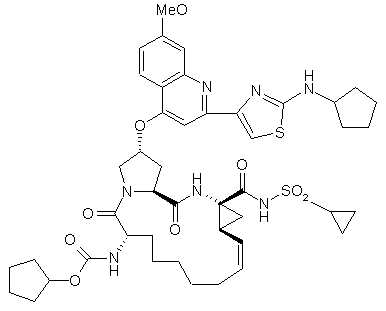 (103).
(103).
10. Фармацевтична композиція, яка містить ефективну відносно вірусу гепатиту С кількість сполуки формули (І) за будь-яким одним з пп. 1-9 або її фармацевтично прийнятної солі у суміші з фармацевтично прийнятним середовищем носія або допоміжною речовиною.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що додатково містить терапевтично ефективну кількість одного або декількох інших агентів, які мають активність по відношенню до HCV.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що інший агент, який є активним по відношенню до HCV, вибирають з: ![]() або пегильованого
або пегильованого ![]() .
.
13. Фармацевтична композиція за п. 11 або 12, яка відрізняється тим, що інший агент, який є активним по відношенню до HCV, являє собою рибавірин.
14. Фармацевтична композиція за будь-яким одним з пп. 11, 12 або 13, яка відрізняється тим, що інший агент, який має активність по відношенню до HCV, вибирають з інгібіторів: гелікази, НS2/3-протеази та внутрішнього сайту входу в рибосому (IRES).
15. Фармацевтична композиція за будь-яким одним з пп. 11, 12 або 13, яка відрізняється тим, що інший агент, який має активність по відношенню до HCV, являє собою інгібітор HCV-полімерази.
Текст
1. Сполука формули (І): C2 2 (11) 1 3 78014 4 фармацевтично прийнятної солі у суміші з фармацевтично прийнятним середовищем носія або допоміжною речовиною. H N N N 11. Фармацевтична композиція за п. 10, яка відріO зняється тим, що додатково містить терапевтично S (102). ефективну кількість одного або декількох інших O H агентів, які мають активність по відношенню до N N OH O HCV. O O 12. Фармацевтична композиція за п. 11, яка відріN зняється тим, що інший агент, який є активним по H O відношенню до HCV, вибирають з: a - інтерферону або пегильованого 9. Сполука за п. 1, яка відрізняється тим, що має a - інтерферону . формулу 103: 13. Фармацевтична композиція за п. 11 або 12, яка MeO відрізняє ться тим, що інший агент, який є активним по відношенню до HCV, являє собою рибавіH рин. N N N 14. Фармацевтична композиція за будь-яким одO ним з пп. 11, 12 або 13, яка відрізняється тим, що S (103). інший агент, який має активність по відношенню O H до HCV, вибирають з інгібіторів: гелікази, НS2/3N SO2 N N протеази та внутрішнього сайту входу в рибосому O H O (IRES). O N 15. Фармацевтична композиція за будь-яким одH O ним з пп. 11, 12 або 13, яка відрізняється тим, що інший агент, який має активність по відношенню до HCV, являє собою інгібітор HCV-полімерази. 10. Фармацевтична композиція, яка містить ефективну відносно вірусу гепатиту С кількість сполуки формули (І) за будь-яким одним з пп. 1-9 або її MeO Даний винахід відноситься до сполук, способів їхнього синтезу, до композицій та способів лікування інфекції, яка викликається вірусом гепатиту С (HCV). Зокрема, представлений винахід відноситься до нових пептидних аналогів, фармацевтичних композицій, які містять такі аналоги, та до способів застосування цих аналогів для лікування інфекції, яка викликається HCV. Вірус гепатиту С (HCV) є основним збудником гепатиту, який не відноситься до А- та В-гепатиту, який передається при переливанні крові й вражає людей у всьому світі. Встановлено, що понад 200 мільйонів людей у світі уражено вірусом. Великий відсоток носіїв стає хронічно інфікованим та у багатьох пацієнтів це приводить до хронічного захворювання печінки, так званого хронічного гепатиту С. У свою чергу, ця гр упа хворих має високий ризик захворювання такою серйозною хворобою печінки, як цироз печінки, печінково-клітинний рак та остання стадія хвороби печінки, яка приводить до смерті. Ме ханізм, за допомогою якого відбувається збереження вірусу HCV в організмі та який обумовлює високий коефіцієнт захворюваності хронічною хворобою печінки, поки недостатньо вивчений. Невідомо, як HCV взаємодіє з імунною системою хазяїна та переборює її дію. Крім того, ще не виявлені також ролі клітинних та гуморальних імунних відповідей у захисті від HCV-ін фекції та при захворюванні гепатитом. Є дані про те, що для профілактики пов'язаного з переливанням крові вірусного гепатиту можна застосовувати імуноглобуліни, однак Центр по контролю захворюваності в цей час не рекомендує для цієї мети застосовува ти лікування з використанням імуноглобулінів. Відсутність ефективної захисної імунної відповіді ускладнює розробку вакцини або адекватних профілактичних заходів після контакту, тому найближчим часом надії в основному покладають на антивірусні засоби. З метою виявлення фармацевтичних агентів, які володіють ефективністю відносно лікування HCV-інфекції, були проведені різні клінічні дослідження за участю пацієнтів, які страждають хронічним гепатитом С. У цих дослідженнях застосовували інтерферон-альфа індивідуально або у поєднанні з іншими антивірусними агентами. Ці дослідження дозволили встановити, що у основної більшості учасників експерименту не було виявлено реакції на такі схеми лікування, а з тих учасників, які виявилися чутливими до лікування, у більшої частини після закінчення лікування відбувався рецидив. Таким чином, до останнього часу терапія з використанням інтерферону (IFN) залишалася єдиним доступним методом лікування пацієнтів, які страждають хронічним гепатитом С, яка мала доведену в клінічних умовах е фективність. Однак ефективність такого лікування зберігається протягом нетривалого періоду часу, і, крім того, лікування інтерфероном викликає серйозні побічні дії (тобто ретинопатію, тиреоідит, гострий панкреа 5 78014 6 тит, депресію), що знижує якість життя пацієнтів, яких піддають лікуванню. У цей час інтерферон у поєднанні з рібавірином запропонований для лікування пацієнтів, які нечутливі до IFN при його індивідуальному застосуванні. Однак побічні дії, які викликаються IFN, не зменшуються при такій спільній терапії. Встановлено, що пегільовані форми Сполуки, запропоновані в даному винаході, інтерферонів, такі як PEG-Intron® та Pegasys®, відрізняються за своєю хімічною будовою та при можуть частково знижувати зазначені шкідливі створенні винаходу раптово було встановлено, що побічні дії, однак антивірусні лікарські препарати вони специфічно інгібують NS3-протеазу HCV та все ще залишаються основним засобом для орамають при цьому незначну інгібувальну активність льного лікування HCV. по відношенню до інших серинових протеаз. Крім Таким чином, існує необхідність у розробці того, сполуки мають активність на культурі клітин ефективних антивірусних агентів для лікування та раптово володіють гарним фармакокінетичним HCV-інфекції, які були б позбавлені недоліків іспрофілем in vivo. нуючи х методів лікування, заснованих на застосуВинахід відноситься до сполук формули (І): ванні фармацевтичних засобів. HCV являє собою укладений в оболонку позитивний ланцюг РНК-ового вірусу сімейства Flaviviridae. Геном HCV, представлений одноланцюговою РНК, складається приблизно з 9500 нуклеотидів та має одну відкриту рамку зчитування (ВРЗ), яка кодує один великий поліпротеїн, який складається приблизно з 3000 амінокислот. У заражених клітинах цей поліпротеїн розщеплюється в багатьох сайтах клітинними та вірусними протеазами з утворенням структурних та неструктурних у якій R1 позначає гідрокси або NHSO2R1A, де R1A (NS) протеїнів. У випадку HCV під дією двох віруспозначає С1-С8алкіл, С3-С7циклоалкіл або С 1них протеаз утворюються зрілі неструктурні протеС6алкіл-С 3-С7циклоалкіл, які всі необов'язково заїни (NS2, NS3, NS4A, NS4B, NS5A та NS5B). Перміщені 1-3 замісниками, обраними з ряду, який ша із зазначених протеаз, яка поки ще включає галоген, ціано, нітро, ОС1-С6алкіл, амідо, недостатньо охарактеризована, розщеплює зв'яаміно або феніл, або R1A позначає С6- або зок NS2-NS3 (далі в контексті даного опису познаС10арил, необов'язково заміщений 1-3 замісникачена як NS2/3-протеаза); друга являє собою серими, обраними з ряду, який включає галоген, ціано, нову протеазу, яка міститься в N-кінцевій області нітро, С1-С6алкіл, ОС1-С6алкіл, амідо, аміно або NS3 (далі позначена як NS3-протеаза), та вона феніл; R2 позначає C5-С6циклоалкіл та R3 познаопосередковує всі наступні розщеплення, які відчає циклопентил; або до їх фармацевтично прийнбуваються по ходу транскрипції NS3, як у цисятних солей. орієнтації у сайті розщеплення NS3-NS4A, так й у Винахід відноситься також до фармацевтичної транс-орієнтації в інших сайтах NS4A-NS4B, NS4Bкомпозиції, яка містить ефективну відносно вірусу NS5A, NS5A-NS5B. Протеїн NS4A, імовірно, має гепатиту С кількість сполуки формули (І) або її множинні функції, та діє в якості кофактора для терапевтично прийнятної солі в суміші з фармацеNS3-протеази та можливо сприяє мембранній ловтично прийнятним середовищем носія або допокалізації NS3 та інших компонентів вірусних репліміжною речовиною. каз. Утворення комплексу протеази NS3 з NS4A, Відповідно до одного з варіантів здійснення імовірно, необхідно для процесування, посилення винаходу фармацевтична композиція, запропонопротеолітичної ефективності у всіх сайтах. Протеїн вана у даному винаході, додатково містить інтерNS3 володіє також нуклеозидтрифосфатазною ферон (пегільований або непегільований) або ріактивністю та РНК-геліказною активністю. NS5B бавірин, або один або кілька інших агентів, які являє собою РНК-залежну РНК-полімеразу, яка володіють активністю по відношенню до HCV, або приймає участь у реплікації HCV. їхню будь-яку комбінацію. Загальна стратегія розробки антивірусних агеЩе одним важливим об'єктом винаходу є спонтів передбачає інактивацію ферментів, які кодусіб лікування інфекції, яка викликається вірусом ються вірусом, які відіграють основну роль у реплігепатиту С у сса вця, який полягає в тому, що ссакації вірусу. вцеві вводять ефективну відносно вірусу гепатиту Нижче наведений перелік заявок на патенти, С кількість сполуки формули (І) або її терапевтичякі були опубліковані протягом останніх декількох но прийнятній солі або описаної вище композиції, років, у яких описані пептидні аналоги, які є інгібііндивідуально або у поєднанні з одним або декільторами NS3-протеази HCV, які за будовою відрізкома наступними компонентами: інтерферон (пегіняються від сполук, запропонованих у даному вильований або непегільований) або рібавірин, або наході: один або кілька інших агентів, які володіють активністю по відношенню до HCV, які у кожному випадку вводять спільно або роздільно. Наступним важливим об'єктом винаходу є спосіб попередження інфекції, яка викликається 7 78014 8 вірусом гепатиту С у ссавця, який полягає в тому, дикал, який містить від 3 до 7 атомів вуглецю, який що ссавцеві вводять ефективну відносно вірусу безпосередньо пов'язаний з алкіленовим радикагепатиту С кількість сполуки формули І або її телом, який містить від 1 до 6 атомів вуглецю; нарапевтично прийнятної солі або описаної вище приклад, циклопропілметил, циклопентилетил, композиції, індивідуально або у поєднанні з одним циклогексилметил, циклогексилетил та циклогепабо декількома наступними компонентами: інтертилпропіл. Наприклад, коли R3A позначає С1ферон (пегільований або непегільований) або ріС6алкіл-С 3-С7циклоалкіл, то ця група пов'язана з бавірин, або один або кілька інших агентів, які воSO2-гр упою через С 1-С6алкіл (тобто алкіленовий лодіють активністю по відношенню до HCV, які фрагмент). вводять спільно або роздільно. Поняття «ОС1-С6алкіл» у контексті даного опиДаний винахід відноситься також до застосусу, індивідуально або у поєднанні з іншим заміснивання описаної вище сполуки формули (І) для приком, позначає замісник -ОС1-С6алкіл, у якому алготування лікувального засобу, призначеного для кіл, як зазначено вище, містить до 6 атомів лікування або попередження інфекції, яка викливуглецю. ОС 1-С6алкіл позначає метокси, етокси, кається вірусом гепатиту С. пропокси, 1-метилетокси, бутокси та 1,1Якщо не зазначене інше, то в контексті даного диметилетокси. Останній замісник звичайно поопису поняття, які використовуються, мають назначають як трет-бутокси. ступні значення: Поняття «фармацевтично прийнятна сіль» поУ тих випадках, коли для позначення абсолюзначає сіль сполуки формули І, яку з медичної точтної конфігурації асиметричного центра викориски зору можна використовувати в контакті із тканитають дескриптори (R) або (S), то позначення віднами людини та нижчих тварин без ознак носиться до всієї сполуки, а не тільки до підвищеної токсичності, подразнення, алергійної замісника. реакції та т.п., яка відповідає прийнятному співвідПозначення «P1, P2 та Р3» у контексті даного ношенню користь/ризик й, як правило, може розопису відноситься до положення амінокислотних чинятися або диспергуватися у воді або олії та має залишків, починаючи із С-кінця пептидних аналогів ефективність при цільовому використанні. Поняття та продовжуючись до N-кінця [тобто Р1 позначає включає фармацевтично прийнятні кислотноположення 1 щодо С-кінця, Р2 позначає положенадитивні солі та фармацевтично прийнятні солі ня 2 щодо С-кінця та т.д. [див. Berger А. та приєднання основ. Перелік прийнятних солей наSchechter I., Transactions of the Royal Society Lonведений, наприклад, у [S.M. Birge та ін., J. Pharm. don series, B257, 1970, cc.249-264]. Sci., 66, 1977, cc.1-19], публікація повністю вклюУ контексті даного опису поняття «(1R, 2S)чена в даний опис як посилання. вініл-АЦКК» відноситься до сполуки формули: Поняття «фармацевтично прийнятна кислотно-адитивна сіль» позначає солі, які зберігають свою біологічну ефективність та властивості вільних основ та які не є небажаними з позицій біології або з інших причин, утворені з неорганічними кислотами, такими як соляна кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана а саме, до (1R, 2S)-1-аміно-2кислота, сульфамінова кислота, азотна кислота, етенілциклопропілкарбонової кислоти. фосфорна кислота та т.п., та з органічними кислоПоняття «галоген» у контексті даного опису тами, такими як оцтова кислота, трихлороцтова значає галогеновий замісник, обраний із групи, яка кислота, трифтороцтова кислота, адипінова кисловключає бром, хлор, фтор або йод. та, альгінова кислота, аскорбінова кислота, аспаПоняття «С1-С6алкіл» або «(низч.) алкіл» у рагінова кислота, бензолсульфонова кислота, контексті даного опису, індивідуально або у поєдбензойна кислота, 2-ацетоксибензойна кислота, нанні з іншим замісником, позначає ациклічні алкімасляна кислота, камфорна кислота, камфорсульні замісники із прямим або розгалуженим ланльфонова кислота, корична кислота, лимонна кисцюгом, які містять від 1 до 6 атомів вуглецю, та лота, диглюконова кислота, етансульфонова кисвключає, наприклад, метил, етил, пропіл, бутил, лота, глутамінова кислота, гліколева кислота, гексил, 1-метилетил, 1-метилпропіл, 2гліцерофосфорна кислота, напівсірчана кислота, метилпропіл, 1,1-диметилетил. енантова кислота, капронова кислота, мурашина Поняття «С1-С8алкіл» у контексті даного опису, кислота, фумарова кислота, 2індивідуально або у поєднанні з іншим замісником, гідроксіетансульфонова кислота (ізетіонова кислопозначає ациклічні алкільні замісники із прямим та), молочна кислота, малеїнова кислота, гідроабо розгалуженим ланцюгом, які містять від 1 до 8 ксималеїнова кислота, яблучна кислота, малонова атомів вуглецю, та включає, наприклад, метил, кислота, мигдальна кислота, мезитиленсульфоноетил, 2,2-диметилбутил, гексил, 1-метилгексил, ва кислота, метансульфонова кислота, нафталінгептил та октил. сульфонова кислота, нікотинова кислота, 2Поняття «С3-С7циклоалкіл» у контексті даного нафталінсульфонова кислота, щавлева кислота, опису, індивідуально або у поєднанні з іншим заміпамова кислота, пектинова кислота, фенілоцтова сником, позначає циклоалкільний замісник, який кислота, 3-фенілпропіонова кислота, пікринова містить від 3 до 7 атомів вуглецю, та включає циккислота, півалінова кислота, пропіонова кислота, лопропіл, циклобутил, циклопентил, циклогексил піровиноградна кислота, саліцилова кислота, стета циклогептил. аринова кислота, бурштинова кислота, сульфаніПоняття «С1-С6алкіл-С 3-С7циклоалкіл» у конлова кислота, винна кислота, паратексті даного опису позначає циклоалкільний ра 9 78014 10 толуолсульфонова кислота, ундеканова кислота Поняття «інгібітор NS3-протеази HCV» у конта т.п. тексті даного опису позначає агент (хімічну сполуПоняття «фармацевтично прийнятна сіль прику або біологічний агент), який має ефективність єднання основи» позначає солі, які зберігають по відношенню до інгібування функції NS3свою біологічну ефективність та властивості вільпротеази HCV у ссавця. Інгібітори NS3-протеази них кислот та які не є небажаними з позицій біолоHCV включають, наприклад, сполуки, описані у гії або з інших причин, утворені з неорганічними [WO 99/07733, WO 99/07734, WO 00/09558, WO основами, такими як аміак або гідроксид, карбонат 00/09543, WO 00/59929 або WO 02/060926], персабо бікарбонат амонію, або катіонами металу, тапективну сполуку, розроблену фірмою Boehringer кого як натрій, калій, літій, кальцій, магній, залізо, Ingelheim, позначену як BILN 2061, яка є вивченою цинк, мідь, марганець, алюміній та т.п. Найбільш в клінічному дослідженні, та перспективні сполуки, кращими є солі амонію, калію, натрію, кальцію та розроблені фірмою Vertex/Eli Lilly, позначені як VXмагнію. Солі, отримані з фармацевтично прийнят950 або LY-570310, які ще не остаточно досліджених органічних нетоксичних основ, включають солі ні. Зокрема, сполуки №2, 3, 5, 6, 8, 10, 11, 18, 19, первинних, вторинних та третинних амінів, четвер29, 30, 31, 32, 33, 37, 38, 55, 59, 71, 91, 103, 104, тинних амінових сполук, заміщених амінів, вклю105, 112, 113, 114, 115, 116, 120, 122, 123, 124, чаючи заміщені аміни, які зустрічаються в природ125, 126 та 127, представлені в [таблиці на них умовах, циклічні аміни та основні іонообмінні стор.224-226 WO 02/060926], можна застосовувати смоли, такі як метиламін, диметиламін, триметиу поєднанні зі сполуками, запропонованими у даламін, етиламін, діетиламін, триетиламін, ізопроному винаході. піламін, трипропіламін, діетаноламін, етаноламін, Поняття «інгібітор полімерази HCV» у контексдіетаноламін, 2-диметиламіноетанол, 2ті даного опису позначає агент (хімічну сполуку діетиламіноетанол, дициклогексиламін, лізин, арабо біологічний агент), який має ефективність по гінін, гістидін, кофеїн, гідрабамін, холін, бетаїн, відношенню до інгібування функції полімерази етилендіамін, глюкозамін, метилглюкамін, теоброHCV у ссавця. Воно відноситься, наприклад, до мін, пурини, піперазин, піперидин, Νінгібіторів NS5В-полімерази HCV. Інгібітори поліетилпіперидин, похідні тетраметиламонію, похідні мерази HCV включають сполуки, які не відносятьтетраетиламонію, піридин, N,N-диметиланілін, Nся до нуклеозидів, наприклад, описані у: метилпіперидин, N-метилморфолін, дициклогекси- [заявці на патент США No.10/198680, який ламін, дибензиламін, Ν,Ν-дибензилфенетиламін, відповідає РСТ/СА02/01127, обидва документи 1-ефенамін, N,N'-дибензилетилендіамін, поліаміподані 18 липня 2002р. (фірма Boehringer Ingelнові смоли та т.п. Найбільш кращими органічними heim), нетоксичними основами є ізопропіламін, діетила- заявці на патент США No.10/198384, який мін, етаноламін, триметиламін, дициклогексилавідповідає РСТ/СА02/01128, обидва документи мін, холін та кофеїн. подані 18 липня 2002р. (фірма Boehringer IngelПоняття «антивірусний агент» у контексті даheim), ного опису позначає агент (хімічну сполуку або - заявці на патент США No.10/198259, яка відбіологічний агент), який має ефективність по відповідає РСТ/СА02/01129, обидва документи поданошенню до інгібування утворення та/або реплікані 18 липня 2002р. (фірма Boehringer Ingelheim), ції вірусу в організмі ссавця. Воно включає агенти, - WO 02/100846 Α1 та WO 02/100851 A2 (обиякі впливають на пов'язані або з хазяїном, або з дві на ім'я фірми Shire), вірусом механізми, необхідні для утворення та/або - WO 01/85172 Α1 та WO 02/098424 Α1 (обидві реплікації вірусу в організмі ссавця. Антивірусні на ім'я фірми GSK), агенти включають, наприклад, рібавірин, аманта- WO 00/06529 та WO 02/06246 А1 (обидві на дин, VX-497 (меримеподіб, фірма Vertex Pharmaім'я фірми Merck), ceuticals), VX-498 (фірма Vertex Pharmaceuticals), - WO 01/47883 та WO 03/000254 (обидві на ім'я левовірин, вірамідин, цеплен (максамін), XTL-001 фірми Japan Tobacco) і та XTL-002 (фірма XTL Biopharmaceuticals). - ЕР 1 256 628 А2 (на ім'я фірми Agouron)]. Поняття «інший агент, який володіє активністю Крім того, інші інгібітори полімерази HCV по відношенню до HCV» у контексті даного опису включають також нуклеозидні аналоги, наприклад, позначає агенти, ефективні відносно зниження або сполуки, описані у: попередження розвитку пов'язаних з гепатитом С - [WO 01/90121 А2 (фірма Idenix), симптомів хвороби. Такі агенти вибирають із: іму- WO 02/069903 А2 (Biocryst Pharmaceuticals номодуляторів, інгібіторів NS3- протеази HCV, Inc.) і інгібіторів полімерази HCV або інгібіторів іншої - WO 02/057287 A2 та WO 02/057425 A2 (обимішені в життєвому циклі HCV. дві на ім'я фірми Merck/Isis)]. Поняття «імуномодулятор» у контексті даного Конкретними прикладами інгібіторів полімераопису позначає агенти (хімічні сполуки або біологізи HCV є JTK-002, JTK-003 та JTK-109 (фірма Jaчні агенти), які мають ефективність відносно підpan Tobacco). вищення або потенціювання реакції імунної систеПоняття «інгібітор іншої мішені в життєвому ми у ссавця. Імуномодулятори включають, циклі HCV» у контексті даного опису позначає наприклад, інтерферони класу І (такі як α-, β-, β- та агент (хімічну сполуку або біологічний агент), який має ефективність по відношенню до інгібування ω-інтерферони, t-інтерферони, консенсусні інтерутворення та/або реплікації HCV у ссавця, яка відферони та азіало-інтерферони), інтерферони кларізняється від інгібування функції NS3-протеази су II (такі як g-інтерферони) та пегільовані інтерHCV. Вони включають агенти, які впливають на ферони. 11 78014 12 пов'язані або з хазяїном, або з вірусом HCV мехатипу І. Воно включає як такі, що зустрічаються в нізми, необхідні для утворення та/або реплікації природних умовах, так й отримані синтетичним HCV в організмі ссавця. Інгібітори іншої мішені в шляхом інтерферони класу І. Приклади інтерфежиттєвому циклі HCV включають, наприклад, агенронів класу І включають α-, β-, ω-інтерферони, tти, які інгібують мішень, обрану з ряду, який вклюінтерферони, консенсусні інтерферони, азіалочає геліказу, NS2/3-протеазу HCV та вн утрішній інтерферони. сайт входу в рибосому (IRES). Конкретним приПоняття «інтерферон класу II» у контексті дакладом інгібіторів іншої мішені в життєвому циклі ного опису позначає інтерферон, обраний із групи HCV є ISIS-14803 (ISIS Pharmaceuticals). інтерферонів, які всі зв'язуються з рецептором Поняття «інгібітор ВІЛ» у контексті даного опитипу II. Приклади інтерферонів класу II включають су позначає агент (хімічну сполуку або біологічний g-інтерферони. агент), який має ефективність по відношенню до Фармацевтичні композиції, запропоновані у інгібування утворення та/або реплікації ВІЛ в оргавинаході, можуть містити одну або кілька додатконізмі ссавця. Воно включає агенти, які впливають вих діючих речовин, наприклад, обраних з антивіна пов'язані або з хазяїном, або з вірусом механірусних агентів, імуномодуляторів, інших інгібіторів зми, необхідні для утворення та/або реплікації ВІЛ NS3-протеази HCV, інгібіторів полімерази HCV, в організмі ссавця. Інгібітори ВІЛ включають, наінгібіторів іншої мішені в життєвому циклі HCV, приклад, нуклеозидні інгібітори, ненуклеозидні інгібіторів ВІЛ, інгібіторів HAV та інгібіторів HBV. інгібітори, інгібітори протеаз, інгібітори злиття та Приклади таких агентів наведені вище в розділі інгібітори інтегрази. «Визначення». Поняття «інгібітор HAV (вірус гепатиту А)» у Нижче представлені конкретні кращі приклади контексті даного опису позначає агент (хімічну деяких таких агентів: сполуку або біологічний агент), який має ефектив- антивірусні агенти: рібавірин та амантадин; ність по відношенню до інгібування утворення - імуномодулятори: інтерферони класу І, інта/або реплікації HAV в організмі ссавця. Воно терферони класу II та пегільовані інтерферони; включає агенти, які впливають на пов'язані або з - інгібітор іншої мішені в життєвому циклі HCV, хазяїном, або з вірусом механізми, необхідні для мішенню такого інгібітору є: NS3-геліказа, NS2/3утворення та/або реплікації HAV в організмі ссавпротеаза HCV або внутрішній сайт входу в рибоця. Інгібітори HAV включають вакцини, які містять сому (IRES); вірус гепатиту А, наприклад, Havrix® (фірма - інгібітори ВІЛ: нуклеозидні інгібітори, ненукGlaxoSmithKline), VAQTA® (фірма Merck) та леозидні інгібітори, інгібітори протеаз, інгібітори Ava xim® (фірма Aventis Pasteur). злиття та інгібітори інтеграз; або Поняття «інгібітор HBV (вірус гепатиту В)» у - інгібітори HBV: агенти, які інгібують вірусн у контексті даного опису позначає агент (хімічну ДНК-полімеразу HBV, або вакцина на основі HBV. сполуку або біологічний агент), який має ефективЯк зазначено вище, спільна терапія передбаність по відношенню до інгібування утворення чає спільне введення сполуки формули (І) або її та/або реплікації НВ в організмі ссавця. Воно фармацевтично прийнятної солі щонайменше з включає агенти, які впливають на пов'язані або з одним додатковим агентом, обраним з наступного хазяїном, або з вірусом механізми, необхідні для ряду: антивірусний агент, імуномодулятор, інший утворення та/або реплікації НВ в організмі ссавця. інгібітор NS3-протеази HCV, інгібітор полімерази Інгібітори HBV включають, наприклад, агенти, які HCV, інгібітор іншої мішені в життєвому циклі HCV, інгібують ДНК-полімеразу вірусу HBV або вакцини інгібітор ВІЛ, інгібітор HAV та інгібітор HBV. Прина основі HBV. Конкретними прикладами інгібіторів клади таких агентів наведені вище в розділі «ВиHBV є ламівудин (Epivir-HBV®), адефовірдипівокзначення». Зазначені додаткові агенти можна посил, ентекавір, FTC (Coviracil®), DAPD (DXG), Lєднувати зі сполуками, запропонованими у FMAU (Clevudine®), AM365 (амрад), Ldt (телбівувинаході, одержуючи лікарський засіб, який місдин), моновалентний-Ld (валторцитабін), АСНтить однократну фармацевтичну дозу. В іншому 126,443 (L-Fd4C) (ахілліон), МСС478 (фірма Eli варіанті зазначені додаткові агенти можна вводити Lilly), рацивір (RCV), фтор-L- та -D-нуклеозиди, пацієнтові індивідуально у вигляді складової часробустафлавон, ICN 2001-3 (ICN), Bam 205 тини багатокомпонентного лікарського засобу, (Novelos), XTL-001 (XTL), іміноцукри (Nonyl-DNJ) наприклад, з використанням набору. Зазначені (фірма Synergy), HepBzyme; імуномодулятори, такі додаткові агенти можна вводити пацієнтові до, як: інтерферон альфа 2b, HE2000 (фірма Hollisодночасно або після введення сполуки формули Eden), Theradigm (епімун), ЕНТ899 (фірма Enzo (І) або його фармацевтично прийнятної солі. Biochem), тімозин альфа-1 (Zadaxin®), вакцину на У контексті даного опису поняття «лікування» основі ДНК HBV (фірма PowderJect), вакцину на позначає введення сполуки або композиції, запрооснові ДНК HBV (фірма Jefferon Center), антиген понованих у даному винаході, для полегшення або HBV (фірма OraGen), BayHep В® (фірма Bayer), усунення симптомів гепатиту С та/або зниження Nabi-HB® (фірма Nabi) та антитіла до вірусу гепавірусного титр у у пацієнта. титу В (фірма Cangene); та вакцини на основі HBV, У контексті даного опису поняття «поперетакі, наприклад, як: Engerix В, Recombivax HB, дження» позначає введення сполуки або композиGenHevac В, Hepacare, Bio-Hep В, TwinRix, Comції, запропонованих у даному винаході, після конva x, He xavac. такту індивідуума з вірусом, але до прояву Поняття «інтерферон класу І» у контексті дасимптомів хвороби та/або до виявлення вірусу в ного опису позначає інтерферон, обраний із групи крові. інтерферонів, які всі зв'язуються з рецептором Краща сполука формули (І) позначає сполуку, 13 78014 14 як вона визначена вище, у якій R1 позначає гідрообласть ушкодження. кси або NHSO2R1A, де R1A позначає С1-С6алкіл, С3Фармацевтична композиція може мати форму С7циклоалкіл або С 1-С6алкіл-С 3-С7циклоалкіл, які стерильного препарату для ін'єкції, наприклад, всі необов'язково заміщені 1-3 замісниками, обрастерильної водної або жиророзчинної суспензії, ними з ряду, який включає галоген, нітро або ОС1яку ін'єкують. Цю суспензію можна одержувати за С6алкіл, або феніл, необов'язково заміщений 1-3 допомогою добре відомих методів з використанзамісниками, обраними з ряду, який включає галоням диспергувальних або змочувальних агентів ген, нітро, С1-С6алкіл або ОС 1-С6алкіл. (таких, наприклад, як Твін 80) та суспендувальних Більш краще, коли сполука формули (І) познаагентів. чає сполуку, як вона визначена вище, у якій R1 Фармацевтичну композицію, запропоновану в позначає гідрокси або NHSO2R1A, де R 1A позначає даному винаході, можна вводити орально у вигляметил, етил, циклопропіл, циклобутил, циклопенді будь-якої прийнятної форми лікарського засобу, тил, циклопропілметил, циклогексилетил, ССІ3, призначеної для орального введення, включаючи CF3, феніл, 2-фторфеніл або 4-метилфеніл. (але не обмежуючись ними) капсули, таблетки та Найбільш краще, коли сполука формули (І) поводні суспензії та розчини. У випадку таблеток для значає сполуку, як вона визначена вище, у якій R1 орального введення носії, які звичайно застосовупозначає гідрокси або NHSO2R1A, де R 1A позначає ють, являють собою лактозу та кукурудзяний крометил, циклопропіл, CF3 або феніл, та в цьому хмаль. Як правило, додають також змащувальні випадку найбільше переважно R1A позначає цикагенти, такі як стеарат магнію. Для орального ввелопропіл. дення у формі капсул прийнятні розріджувачі явНайбільш переважно R1 позначає гідрокси. ляють собою лактозу та безводний кукурудзяний Найбільш переважно R2 позначає циклопенкрохмаль. Коли оральним шляхом вводять водні тил. суспензії, діючу речовину поєднують із емульгуваКращими варіантами здійснення винаходу є льними та суспендувальними агентами. При необвсі сполуки формули (І), які наведені в таблиці 1. хідності можна додавати певні речовини, підсолоВідповідно до іншого варіанта здійснення виджувачі, та/або коригенти та/або барвники. находу фармацевтична композиція, запропоноваІнші придатні наповнювачі або носії для зазнана в даному винаході, може додатково містити чених вище препаративних форм та композицій інший агент, який володіє активністю по відношеннаведені у звичайних фармацевтичних довідниках, ню до HCV. Приклади інших агентів, які володіють наприклад, у [«Remington's Pharmaceutical Sciences», The Science and Practice of Pharmacy, 19-e активністю по відношенню до HCV, включають, aвид. Mack Publishing Company, Easton, Penn., (альфа), β- (бета), δ- (дельта), g- (гама) або ω(1995)]. (омега) інтерферон, рібавірин та амантадин. Для монотерапії з метою попередження та ліВідповідно до іншого варіанта здійснення викування опосередкованої HCV хвороби можна занаходу фармацевтична композиція, запропоновастосовувати дози в діапазоні від приблизно 0,01 на в даному винаході, може додатково містити до приблизно 100мг/кг ваги тіла на день, переважінший інгібітор NS3-протеази HCV. но від приблизно 0,1 до приблизно 50мг/кг ваги Згідно ще одного варіанта здійснення винахотіла на день запропонованої сполуки, яка є інгібіду фармацевтична композиція, запропонована в тором протеази. Як правило, фармацевтичну комданому винаході, може додатково містити інгібітор позицію, запропоновану у винаході, можна вводиполімерази HCV. Відповідно до наступного варіанти від приблизно 1 до приблизно 5 разів на день та здійснення винаходу фармацевтична композиабо в іншому варіанті шляхом безперервної інфуція, запропонована в даному винаході, може додазії. Таке введення можна застосовувати як для тково містити інгібітор інших мішеней життєвого тривалого, так та для екстреного лікування. Кільциклу HCV, включаючи (але не обмежуючись никість діючої речовини, яку можна поєднувати з ми) геліказу, NS2/3-протеазу або внутрішній сайт носіями для одержання однократної дози лікарсьвходу у рибосому (IRES). кого засобу, повинна варіюватися залежно від хаФармацевтичну композицію, запропоновану в зяїна, який підлягає лікуванню, та конкретного даному винаході, можна вводити орально, пареншляху введення. Звичайна композиція може міститерально або за допомогою пристрою для імпланти від приблизно 5 до приблизно 95% діючої речотації. Кращим є оральне введення або введення вини (мас. %). Переважно такі композиції містять за допомогою ін'єкції. Фармацевтична композиція, від приблизно 20% до приблизно 80% діючої речозапропонована в даному винаході, може містити вини. будь-які загальноприйняті нетоксичні фармацевЯк повинно бути очевидно фахівцеві в даній тично прийнятні носії, допоміжні речовини або нагалузі, можна застосовувати й більш низькі або повнювачі. У деяких випадках значення рН компобільш високі дози в порівнянні із зазначеними визиції можна регулювати за допомогою ще. Конкретні дози та схеми лікування будь-якого фармацевтично прийнятних кислот, основ або конкретного пацієнта можуть залежати від різних буферів з метою підвищення стабільності сполуки, факторів, включаючи активність конкретної сполувключеної в композицію або у форму для її ввеки, яку застосовують, віку, ваги тіла, загального дення. У контексті даного опису поняття «парентестану здоров'я, статі, раціону, часу введення, ральний» включає підшкірний, внутрішньошкірний, швидкості виведення, поєднання лікарських засовнутрішньовенний, внутрішньом'язевий, внутрішбів, серйозності та особливостей розвитку хвороньосуглобний, інтрасиновіальний, інтрастернальби, схильності пацієнта до інфекції, та їх визначає ний, інтратекальний шлях введення, введення за лікар. Як правило, лікування починають із невелидопомогою ін'єкції або інфузії, а також введення у 15 78014 16 ких доз, істотно більш низьких, чим оптимальна гент для досліджень. Сполуку формули І можна доза пептиду. Потім дозу підвищують невеликими використовува ти як позитивний контроль для обпорціями до досягнення оптимальної дії в конкретґрунтування модельних аналізів на клітинах або них умовах. Як правило, найбільш переважно ввоаналізів in vitro або in vivo реплікації вірусів. дити сполуку в такому діапазоні концентрацій, які в Нижче винахід проілюстрований на прикладах, цілому забезпечують антивірусну активність, але які не обмежують його об'єм, який заявляється в не мають якої-небудь шкідливої або небезпечної наведеній нижче формулі винаходу. побічної дії. У цілому, сполук у формули І та її проміжні Коли композицію, запропоновану в даному випродукти одержують відомими методами, з виконаході, включають у комбінацію, яка містить спористанням реакційних умов, які, як відомо, є прилуку формули І та один або кілька додаткових тейнятними для реактантів. Деякі такі методи описарапевтичних або профілактичних агентів, то ні у WO 00/09543 та WO 00/09558. сполука та додатковий агент повинні бути присутНа наведеній нижче схемі проілюстрований німи у дозі, яка становить приблизно від 10 до придатний заснований на застосуванні відомих 100% та більш переважно приблизно від 10 до методів процес одержання основного проміжного 80% від дози, яку звичайно застосовують у режимі продукту формули 6а з ациклічних проміжних промонотерапії. дуктів: Коли ці сполуки або їх фармацевтично прийнСхема 1 ятні солі поєднують у препаративній формі з фармацевтично прийнятним носієм, то отриману композицію можна вводити in vi vo ссавцеві, такому як людина, для інгібування NS3-протеази HCV або для лікування або попередження інфекції, яка викликається вірусом HCV. Таке лікування можна здійснювати також при використанні сполуки, запропонованої у винаході, у поєднанні з агентами, які включають (але не обмежуючись ними): a-, b-, d-, w-, t- або g-інтерферон, рібавірин, амантадин; інші інгібітори NS3-протеази HCV; інгібітори полімерази HCV; інгібітори інших мішеней життєвого циклу HCV, які включають (але не обмежуючись ними) геліказу, NS2/3-протеазу або внутрішній сайт входу у рибосому (IRES); або їхні комбінації. Зі сполуками, запропонованими в даному винаході, можна поєднувати інші агенти, одержуючи однократну дозу лікувального засобу. В іншому варіанті ці додаткові агенти можна Схема І: вводити ссавцеві окремо у вигляді складової часСтадії А, В, Г: У цілому метод полягає в настутини багатокомпонентного лікувального засобу. пному: фрагменти P1, Р2 та Р3 можна зв'язувати Якщо фармацевтична композиція містить як за допомогою відомих методів пептидного сполудіючу речовину тільки сполуку, яка запропонована чення, які описані у WO 00/09543 та WO 00/09558. в даному винаході, то такий спосіб може додаткоСтадія Б: Ця стадія включає інверсію конфігуво передбачати введення зазначеному ссавцеві рації 4-гідрокси-замісника. Є кілька шляхів здійсагента, обраного з ряду, який включає імуномодунення цього процесу, як це повинно бути добре лятор, антивірусний агент, інгібітор NS3-протеази відомо фахівцям у даній галузі. Одним із прикладів HCV, інгібітор полімерази HCV або інгібітор інших придатного методу є добре відома реакція Мітсумішеней життєвого циклу HCV, таких як геліказа, нобу [Mitsunobu, Synthesis, січень 1981, с.1-28; NS2/3-протеазa або IRES. Такий додатковий агент Rano та ін. Tet. Lett. 36, 1994, с.3779-3792; Krchnak можна вводити ссавцеві до, одночасно або після та ін. Tet. Lett, 36, 1995, с.6193-6196]. введення композиції, запропонованої в даному Стадія Д: Одержання макроциклу можна здійвинаході. снювати за допомогою реакції обміну олефіну, з Сполуку формули І, яка запропонована в давикористанням каталізатора на основі Ru, наприному винаході, можна застосовувати також як лаклад, описаний у [Miller S.J.; Blackwell H.E.; Grubbs бораторний реагент. Сполуку, яка запропонована R.H. J. Am. Chem. Soc. 118, 1996, с. 9606-9614 (a); в даному винаході, можна застосовувати також Kingsbury J.S.; Harrity J.P.A.; Bonitatebus P.J.; Hovдля усунення або попередження вірусного забрудeyda A.H. J. Am. Chem. Soc., 121, 1999, с.791-799 нення матеріалів, та тим самим вона знижує ризик (б) та Huang J.; Stevens E.D.; Nolan S.P.; Petersen зараження вірусом персоналу лабораторій або J.L.; J. Am. Chem. Soc., 121, 1999, с.2674-2678 (в) медичних установ або пацієнтів, які мають контакт або у WO 00/59929]. Варто мати на увазі також те, із такими матеріалами (наприклад, кров'ю, тканищо для цієї реакції можна використовувати каталінами, хірургічними інструментами та предметами затори на основі інших перехідних металів, таких одягу, лабораторними інструментами та предмеяк Мо. тами одягу, приладами та матеріалами для збору крові). Сполуку формули І, яка запропонована в даному винаході, можна застосовувати також як реа 17 78014 18 тетраметилуронію; ТФК: трифтороцтова кислота; ТГФ: тетрагідрофуран; ТШХ: тонкошарова хроматографія; Тріс/НСІ: гідрохлорид тріс(гідроксиметил)амінометану. Приклад 1 Синтез дипептиду 1с Наступне перетворення основного проміжного продукту формули 6а на сполуки формули (І), запропоновані в даному винаході, докладно описано нижче у прикладах. Представлені в описі сполуки формули (І), у яких R1 позначає NHSO2R1A, одержують сполученням відповідної кислоти формули І (тобто R 1 позначає гідрокси) з відповідним сульфонамідом формули R1ASO 2NH2 у присутності зв'язувального агента в стандартних умовах. Хоча можна застосовува ти кілька загальноприйнятих зв'язувальних агентів, кращими для практики є ТБТУ та ГАТУ. Сульфонаміди надходять у продаж або їх можна одержувати відомими методами. Приклади Даний винахід проілюстрований більш докладно за допомогою прикладів, які не обмежують його об'єм. Інші конкретні шляхи синтезу або розділення описані у [WO 00/09543; WO 00/09558 та WO 00/59929]. Температури наведені у градуса х Цельсія. Відсотки для розчинів являють собою % (мас/об.), а співвідношення в розчинах являють собою співвідношення об'ємів, якщо не зазначено інше. Спектри ядерного магнітного резонансу (ЯМР) реєстрували за допомогою спектрометра фірми Brucker при частоті 400МГц, хімічні зсуви (δ) виражені в част./млн. та віднесені до внутрішнього дейтерієвого розчинника, якщо не зазначено інше. ЯМРспектри всіх кінцевих сполук (інгібіторів) реєстрували у ДМСО-d6, якщо не зазначено інше. Експрес-хроматографію на колонці проводили на силікагелі (Si2) відповідно до методу експресхроматографії Стілла [W.C. Still та ін., J. Org. Chem., 43, 1978, с.2923]. У прикладах використовували наступні скорочення: Вос: трет-бутилоксикарбоніл {Ме3СОС(О)}; БСА: бичачий сироватковий альбумін; ХАПС: 3-[(3холамідопропіл)диметиламоній]-1-пропан сульфонат; СН2СІ2=ДХМ: метиленхлорид; ДЕАД: діетилазодикарбоксилат; ДІАД: діізопропілазодикарбоксилат; ДІПЕА: діізопропілетиламін; ДМАП: диметиламінопіридин; ДМФ: N,Nдиметилформамід; ДМСО: диметилсульфоксид; (S,S)-Et-DUPHOS Rh (COD)OTf: три фторметансульфонат (+)-1,2-бic(2S,5S)-2,5діетилфосфолано)бензол(циклооктадієн) родію (1); EtOH: етанол; EtOAc: етилацетат; ES-MC: масспектрометрія з іонізацією електронним пучком; ГАТУ: [гексафторфосфа т О-7-азабензотриазол-1іл)-1,1,3,3-тетраметилуронію]; РХВД: рідинна хроматографія високого дозволу; МС: масспектрометрія; MALDI-TOF: Matri x Assisted Laser Disorption Ionization-Time of Flight, FAB: бомбардування швидкими атомами; Me: метил; МеОН: метанол; К.Т.: кімнатна температура (18-22°); ТБТУ: тетрафторборат 2-(1Н-бензотриазол-1-іл)-1,1,3,3 Суміш, яка містить Вос-гідроксипролін 1а (50,0г, 216ммолей), гідрохлорид (1R,2S)-вінілАЦКК 1b (42,25г, 238ммолей), ТБТУ (76,36г, 238ммолей) та ДІПЕА (113мл, 649ммолей) у ДМФ (800мл), перемішували при К. Т. у атмосфері азоту. Через 3,5год. розчинник випарювали та залишок екстрагували EtOAc та промивали соляною кислотою (10%), насиченим розчином бікарбонату натрію та соляним розчином. Потім органічну фазу сушили над сульфатом магнію, фільтрували та упарювали, одержуючи олію. Після сушіння олії протягом ночі (18год.) у глибокому вакуумі одержували дипептид 1с у вигляді піни жовтого кольору (72,0г, 94%, чистота >95% за даними РХВД). Приклад 2 Синтез дипептиду 2а Дипептид 1с (72,0г, 203ммоля), трифенілфосфін (63,94г, 243,8ммоля, 1,2екв.) та 4нітробензойну кислоту (41,08г, 245,8ммоля, 1,2екв.) розчиняли в безводному ТГФ (1,4л) та розчин при перемішуванні охолоджували до 0° у атмосфері азоту. Потім по краплях протягом 45хв. додавали ДЕАД (38,4мл, 244ммоля, 1,2екв.) та реакційної суміші давали нагрітися до К.Т. Через 4год. розчинник випарювали та залишок розділяли на 4 порції. Кожну з них хроматографували на силікагелі (зернистість 10-40мкм, діаметр колонки 12см, довжина колонки 16см), використовуючи градієнт від 2:1 гексан/EtOAc до 1:1 гексан/EtOAc та до чистого (100%) EtOAc. Після випарювання розчинників та сушіння в глибокому вакуумі при 70° протягом 1год. одержували складний ефір 2а у вигляді аморфної твердої речовини білого кольору (108,1г, кількісний вихід). Приклад 3 Синтез спиртового дипептиду 3а: Складний нітробензоїловий ефір 2а (108,1г, 203,1ммоля) розчиняли у ТГФ (1,0л) та розчин, який утворився, охолоджували до 0°. Потім швидко додавали розчин моногідрату гідроксиду літію (10,66г, 253,9ммоля) у воді (225мл) та реакційну суміш перемішували при 0° протягом 30хв., після чого основу, яка залишилася, нейтралізували со 19 78014 20 ляною кислотою (1н., 50,8мл). Повільно вносили ацетамідомалонату 4b (7,57г, 40ммолей) додавали додаткову порцію кислоти до зникнення жовтого протягом 1хв. 6-гептенал 4d (4,48г, 40ммолей) у забарвлення (7мл). Потім суміш, яка утворилася, розчині піридину (32мл, 10екв.). Розчин, який упарювали та залишок екстрагували EtOAc утворився, охолоджували до 10° у бані. Додавали протягом 4хв. оцтовий ангідрид (1мл, 3,2екв.). (3´150мл). Екстракт промивали насиченим розчиОтриманий розчин помаранчевого кольору переном бікарбонату натрію (150мл) та соляним розчимішували протягом 3год. при К. Т. та додавали ном (150мл). Органічну фазу сушили над сульфатом магнію - деревним вугіллям, фільтрували іншу порцію етил-2-ацетамідомалонату 4b (2,27г). Суміш, яка утворилася, перемішували при кімнатчерез діатомову землю та упарювали. Після суній температурі ще 11год. Потім додавали лід шіння залишку в глибокому вакуумі одержували (60мл) та розчин перемішували протягом 1,5год., спирт 3а у вигляді безбарвної піни (70,1г, 98%, потім суміш розбавляли 250мл води та екстрагучистота >99% за даними РХВД). Приклад 4 вали двома порціями діетилового ефіру. Ефірний розчин промивали 1н. НСl, насиченим розчином Синтез (2,S)-N-Вос-амінонон-8-енової кислоти NаНСО3, сушили над Na2SO4, концентрували та (4g) очищали за допомогою експрес-хроматографії (EtOAc 40%/гексан), одержуючи сполуку 4е (4,8г, вихід 50%) у вигляді олії світло-жовтого кольору. Стадія Г. До дегазованого (барботирування аргоном протягом 30хв.) розчину Z-етил-2ацетамідо-2,8-нонадіеноату 4е (8,38г, 35ммолей) у безводному етанолі (70мл) додавали (S,S)-EtDUPHOS Rh(COD)OTf (51мг, співвідношення субстрату/каталізатора =496). Суміш поміщали під тиск водню 30 фунтів/кв. дюйм (після 4 циклів Н2вакуум ування) та перемішували у шейкері Парра протягом 2год. Суміш, яка утворилася, упарювали Стадія А. До розчину діетил-2досуха, одержуючи неочищену сполуку 4f, яку заацетамідомалонату 4а, який поступає у продаж, стосовували на наступній стадії без додаткового (100г, 0,46молей) у діоксані (500мл) додавали по очищення. краплях протягом 30-45хв. водний розчин гідроСтадія Д. До розчину неочищеного (S)-етил 2ксиду натрію (1М, 1екв., 460мл). Суміш, яка утвоацетамідо-8-ноненоату 4f (7,3г, 30,3ммоля) у ТГФ рилася, витримували при перемішуванні протягом (100мл) додавали Вос2О (13,2г, 2екв.) та ДМАП 16,5год., потім діоксан випарювали у вакуумі. (740мг, 0,2екв.). Реакційну суміш витримували при Отриманий водний розчин екстрагували 3 порціятемпературі дефлегмації протягом 2,5год. Потім ми по 300мл EtOAc та підкисляли до рН1 концентбільшу частину розчинника ТГФ випарювали, нерованою НС1. Цей розчин залишали для кристаліочищену суміш розбавляли СН 2СІ2 та промивали зації в бані лід-вода. Після появи декількох 1н. НСl для видалення ДМАП. Органічний шар кристалів суміш обробляли ультразвуком, після додатково екстрагували насиченим водним розчичого утворювалася велика кількість осаду. Після ном NаНСОз, сушили над безводним Na2SO4 та фільтрації та сушіння у вакуумі одержували сполуконцентрували у вакуумі. Потім неочищений проку 4b, (62,52г, вихід 72%) у вигляді твердої речодукт розбавляли ТГФ (50мл) та водою (30мл). Довини білого кольору. давали LiОН´Н2О (2,54г, 2екв.) та суміш, яка утвоСтадія Б. До емульсії 7-октен-1,2-діолу 4с, яка рилася, перемішували при К.Т. протягом 25год. надходить у продаж, яку перемішували за допомо(завершення гідролізу підтверджували за допомогою магнітної мішалки (25г, 0,173молей ) та Н2О гою ТШХ). Реакційну суміш концентрували у ваку(100мл) у 1-літровій круглодонній колбі додавали умі для видалення більшої частини розчинника протягом 20хв. водний розчин перйодату натрію ТГФ та розбавляли СН2СІ2. Розчин, який утворив(40,7г, 0,190молей, 1,1екв., у 475мл Н 2О) (слабка ся, промивали 1н. НСl, сушили над безводним екзотермічна реакція). Суміш, яка утворилася, пеNa2SO4 та концентрували у вакуумі. Для видаленремішували при кімнатній температурі протягом ня мінорних домішок та надлишку Вос2О неочищеще 1год. (завершення реакції підтверджували за ний продукт очищали за допомогою експресдопомогою ТШХ). Потім суміш зливали в ділильну хроматографії (у якості елюєнта використовували лійку та водний шар відокремлювали від органічградієнт розчинника від 100% гексану до 100% ного шару. Водний розчин насичували NaCl, злиЕtOАс). Одержували зазначену в заголовку сполували та ще раз відокремлювали від органічної ку 4g у вигляді високоочищеної олії світло-жовтого фракції. Дві органічні фракції поєднували, сушили кольору (5,82г, вихід 71%). 1Н ЯМР (ДМСО, над сульфатом натрію та фільтрували через ватну 400МГц): δ 7,01 (d, J =8Гц, 1H), 5,79 (tdd, Jt =6,7Гц, пробку (у Пастерівскій піпетці), одержуючи сполуку Jd =17,0, 10,2Гц, 1Н), 5,00 (md, Jd =17,0Гц, 1Н), 4d (15,135г, безбарвна олія, вихід 78%). Водний 2 4,93 (md, Jd =10,2Гц, 1Н), 3,83 (m, 1H), 2,00 (q, J розчин екстрагували СН 2СІ , сушили над безвод=6,9Гц, 2H), 1,65-1,5 (m, 2H), 1,38 (s, 9H), 1,35-1,21 ним MgSO4 та концентрували у вакуумі (без нагрі(m, 6H). вання, т.к. tкип 6-гептеналу 153°С), з одержанням Приклад 5 додаткової кількості сполуки 4d (1,957г, безбарвна Синтез трипептиду 5b олія, вихід 10%). Загальний вихід 88%. Стадія В. До твердого етил-2 21 78014 22 Після елюювання каталізатора з колонки розчинник заміняли на чистий ЕtOАс. Про елюювання каталізатора з колонки судили по забарвленню. Виділяли макроциклічний продукт 6а у вигляді безбарвної піни, яку повторно розчиняли в суміші СН2Сl2/гексан (~1:2). Після випарювання розчинника одержували порошок білого кольору (3,362г, вихід 89%). 1 Н ЯМР (CDCl3, 400МГц): δ 1,20-1,50 (m, 6H), 1,43 (s, 9H), 1,53 (dd, J =9,5 та 5,41H), 1,61-1,70 (m, Стадія 1: Розчин хлористого водню в діоксані 1H), 1,76-1,90 (m, 2H), 2,05-2,26 (m, 4H), 2,45 (d, (4н.) додавали до Вос-Р2-Р1-фрагмента 3а (5,32г, J=14,3, 1H), 3,67 (s, 3H), 3,71 (d, J=11,1, 1H), 3,90 15,0ммолей), одержуючи безбарвний розчин. Піс(dd, J=11,1 та 4,3, 1H), 4,43-4,53 (m, 2H), 4,76 (d, ля перемішування при кімнатній температурі розJ=8,6, 1H), 4,86 (bd, J=9,8, 1H), 5,20-5,23 (m, 2H), чинник випарювали та залишок поміщали в глибо5,57 (dt, J=7,0 та 9,8, 1H), 7,32 (bs, 1H). кий вакуум на 3год., одержуючи гідрохлорид Приклад 7 сполуки 5а у вигляді аморфної твердої речовини, Одержання тіосечовин 7 яку використовували без додаткового очищення. Синтез тіосечовини 7а: Стадія 2: Додавали ДІПЕА (2,6мл, 15ммолей) до суміші вищевказаного гідрохлориду Р1-Р2 (15ммолей) у безводному ДХМ (100мл), одержуючи гомогенний розчин. Окремо при перемішуванні додавали ТБТУ (5,30г, 16,5ммоля, 1,1екв.) до розчину С9-лінкера 4g (4,07г, 15,0ммолей) у безводДо розчину трет-бутилізотіоціанту (5,0мл; ному ДХМ (130мл), що приводило до часткового 39,4ммоля) у ДХМ (200мл) додавали циклопентирозчинення реагенту. Додавали ДІПЕА (2,6мл, ламін (4,67мл; 47,3ммоля), а потім додавали ДІЕА 15ммолей), одержуючи через 10хв. практично го(діізопропілетиламін) та реакційну суміш перемімогенний розчин. Потім до цього розчину додавашували при К.Т. протягом 2год. Суміш розбавляли ли розчин Р1-Р2 та ДІПЕА до збільшення лужності ЕtOАс, промивали 10%-вим водним розчином лиреакційної суміші (рН>8, визначення за допомогою монної кислоти (2´), насиченим NaHCO3 (2´), Н2О вологого лакмусового паперу). Після перемішу(2´) та соляним розчином (1´). Органічний шар вання у атмосфері азоту протягом 5год. розчинник сушили над безводним MgSO4, фільтрували та випарювали та залишок екстрагували EtOAc упарювали, одержуючи N-трет-бутил-N'(2´250мл) та промивали розведеною соляною циклопентилтіосечовину у вигляді твердої речовикислотою (0,05н., 400мл), водою (400мл) та насини білого кольору (3,70г; вихід 47%). N-трет-бутилченим розчином бікарбонату натрію (400мл). Потім N'-циклопентилтіосечовину (3,70г) розчиняли в об'єднані органічні фази сушили над сульфатом концентрованій НСl (46мл). Розчин темно-жовтого магнію, фільтрували та упарювали, одержуючи кольору обережно кип'ятили зі зворотним холодисироп жовтого кольору. Неочищений продукт хрольником. Через 40хв. реакційній суміші давали матографували на силікагелі, використовуючи в остудитися до К.Т. та потім охолоджували на льоді якості елюента градієнт від 6:1 EtOAc/гексан до та збільшували лужність до рН9,5 за допомогою 100% EtOAc, після чого одержували необхідний твердого NaHCO3 та насиченого водного розчину трипептидний діен 5b у вигляді піни білого кольору NaHCO3. Продукт екстрагували EtOAc (5,88г, 82%, чистота >95% за даними РХВД ). (3´),об'єднані EtOAc-екстракти промивали Н 2О Приклад 6 (2´) та соляним розчином (1´). Органічний шар Синтез макроциклічного проміжного продукту сушили (MgSO 4), фільтрували та концентрували, 6а: одержуючи тверду речовину бежевого кольору (2,46г, неочищений продукт). Після розтирання неочищеного продукту в гексані/EtOAc (95/5) з наступною фільтрацією одержували Nциклопентилтіосечовину 7а у вигляді твердої речовини білого кольору (2,38г; ви хід 90%). 1 Н ЯМР (400МГц, ДМСО-d6): δ 7,58 (bs, 1Н), 7,19 (bs, 1H), 6,76 (bs, 1H), 4,34 (bs, 1H) , 1,92-1,79 (m, 2H), 1,66-1,55 (m, 2H), 1,55-1,30 (m, 4H). MC; Розчин діену 5b (4,0г, 7,88ммоля) у безводному ДХМ (800мл) дезоксигенували, шляхом барбоes+ 144,9 (M+H)+,es -: 142,8 (M-H)Одержання тіосечовини 7b тування Аr протягом 2год. Потім додавали каталіЗа допомогою описаного вище процесу та з затор Ховейда (Hoveyda) (262мг, 0,434ммоля, використанням циклогексиламіну, який поступає у 5,5мол. %) у ви гляді твердої речовини та реакційпродаж (замість циклопентиламіну), одержували ну суміш кип'ятили зі зворотним холодильником у атмосфері Аr, який надходив з балона. Через тіосечовину 7b 28год. розчин червоно-помаранчевого кольору упарювали до одержання аморфної твердої речовини та потім очищали за допомогою експресхроматографії на силікагелі. Початкова система розчинників являла собою 10% ЕtOАс у СН 2СІ2. Приклад 8 23 Синтез сполуки 101: 78014 24 використовували на наступній стадії без якогонебудь очищення. Стадія В. До розчину циклопентанолу (614мкл, 6,76ммоля) у ТГФ (15мл) додавали по краплях розчин фосгену в толуолі (1,93М, 5,96мл, 11,502ммоля) та суміш перемішували при К.Т. протягом 2год., одержуючи циклопентилхлорформіатний реагент (z). Після цього приблизно половину розчинника видаляли, випарюючи у вакуумі. Розчин, який залишився, світло-жовтого кольору розбавляли, додаючи СН 2СІ2 (5мл), та концентрували до половини його первісного об'єму для гарантії видалення всього надлишкового фосгену. Потім вищевказаний розчин циклопентилхлорформіатного реагенту додатково розбавляли ТГФ (15мл) та додавали дигідрохлорид аміну 8b. Суміш охолоджували до 0° у крижаній бані, значення рН доводили до -8,5-9, додаючи Et3N (по краплях) та реакційну суміш перемішували при 0° протягом 1год. Потім суміш розбавляли EtOAc, промивали водою (1´), насиченим NaHCO3 (2´), Н2О (2´) та соляним розчином (1´). Органічний шар сушили над безводним MgSO4, фільтрували та упарювали у вакуумі, одержуючи піну жовто-бурштинового кольору. Після очищення за допомогою колоночної експрес-хроматографії (використовуючи в якості Стадія А. До розчину, який містить макроцикелюенту градієнт розчинників від 30% гексану до лічний проміжний продукт 6а (13,05г, 27,2ммоля, 20% гексану у EtOAc) одержували складний диме1,0екв.), Ph3P (14,28г, 54,4ммоля, 2,0екв.) та 2тиловий ефір 8с у вигляді піни жовтого кольору, карбоксиметокси-4-гідрокси-7-метоксихінолін [WO вихід 80% (1,27г) та чистота >93%. 00/09543; WO 00/09558 та WO 00/59929] (6,67г, Стадія Г. Складний диметиловий ефір 8с 28,6ммоля, 1,05екв.) у ТГФ (450мл), при 0° по кра(1,17г) розчиняли в суміші ТГФ/МеОН/Н 2О (20мл, плях протягом 15хв. додавали ДІАД (10,75мл, співвідношення 2:1:1) та додавали водний розчин 54,6ммоля, 2,0екв.). Потім крижану баню видаляли NaOH (1,8мл, 1н., 1екв.). Реакційну суміш переміта реакційну суміш перемішували при К.Т. протяшували при К.Т. протягом 1год., а потім упарювали гом 3год. Після завершення перетворення вихіддосуха, одержуючи натрієву сіль 8d у вигляді твеного продукту на необхідні речовини розчинник рдої речовини білого кольору (~1,66ммоля). Сповипарювали у вакуумі, суміш, яка залишилася, луку 8d використовували на наступній стадії без розбавляли EtOAc, промивали насиченим NаНСО3 додаткового очищення. (2´) та соляним розчином (1´), органічний шар Стадія Д. Неочищену натрієву сіль 8d сушили над безводним MgSO4, фільтрували та (1,66ммоля) розчиняли у ТГФ (17мл), додавали упарювали досуха. Після колоночної експресEt3N та суміш охолоджували до 0° у крижаній бані. хроматографії одержували чисту сполуку 7а; коДодавали по краплях ізобутилхлорформіат лонку елюювали спочатку гексаном/EtOAc (50:50), (322мкл, 2,5ммоля) та суміш перемішували при 0° потім СНСІ3/ЕtOАс (95:5) для видалення побічних протягом 75хв. Потім додавали діазометан (15мл) продуктів Рh3РО та ДІАД та елюювання домішок та перемішування продовжували при 0° протягом оцінювали за допомогою ТШХ. Нарешті, з колонки 30хв., а далі при К.Т. протягом ще 1год. Більшу елюювали необхідний продукт 8а за допомогою частину розчинника упарювали досуха у вакуумі, СНСІ3/ЕtOАс (70:30). Як правило, стадію хроматосуміш, яка залишилася, розбавляли ЕtOАс, прографії було потрібно повторювати 2-3 рази доти мивали насиченим NаНСО3 (2´), Н2О (2´) та соляпоки сполуку 8а можна було виділяти у вигляді ним розчином (1´), сушили над безводним MgSO4, високоочищеного твердого продукту білого кольофільтрували та упарювали досуха, одержуючи ру, загальний вихід якого становив 68% (12,8г, сполуку 8е у вигляді світло-жовтої піни (1,2г, чистота 99,5% за даними РХВД). ~1,66ммоля). Проміжний продукт, який представСтадія Б. До розчину захищеного за допомоляє собою діазокетон, 8е використовували на нагою Вос проміжного продукту 8а (1,567г) в СН2СІ2 ступній стадії без додаткового очищення. (15мл) додавали 4н. НСl у діоксані (12мл). РеакСтадія Е. Розчин діазокетону 8е (1,2г, ційну суміш перемішували при К.Т. протягом 1год. 1,66ммоля), розчинений у ТГФ (17мл), охолоджу[У випадку, коли в середині реакційного періоду вали до 0° у крижаній бані. Додавали по краплях утворювався густий гель, додатково вносили 10мл розчин водної НВr (48%, 1,24мл) та реакційну суСН2Сl2]. Після завершення стадії видалення захиміш перемішували при 0° протягом 1год. Потім сної групи розчинники випарювали досуха, одерсуміш розбавляли EtOAc, промивали насиченим жуючи тверду речовину жовтого кольору та пастоNaHCO3 (2´), Н2О (2´) та соляним розчином (1´). подібний продукт. Суміш повторно розчиняли Органічний шар сушили над безводним MgSO4, приблизно у 5% МеОН в СН2Сl2 та повторно упафільтрували та упарювали досуха, одержуючи рювали досуха у вакуумі, одержуючи сполуку 8b у проміжний продукт, який представляє собою aвигляді твердої речовини жовтого кольору, яку 25 78014 26 бромкетон 8f у вигляді піни світло-жовтого кольору 1,14 (m, 24H), 1,14-1,12 (m, 1H). (~1,657ммоля). Приклад 9 Стадія Ж. До розчину бромкетону 8f (2,51г, Використовуючи процес, описаний у прикладі 3,27ммоля) у ізопропанолі (105мл), додавали цик8, але застосовуючи на стадії Ж Nлопентилтіосечовину 7а (565мг, 3,92ммоля) та циклогексилтіосечовину 7b, одержували натрієву реакційну суміш поміщали у попередньо нагріту сіль сполуки 102. масляну баню з температурою 70° та перемішували протягом 1,5год. Потім ізопропанол видаляли у вакуумі та продукт розчиняли у EtOAc. Розчин промивали насиченим NаНСО3, водою та соляним розчином, органічний шар сушили над безводним MgSO4 , фільтрували та випарювали, одержуючи неочищений продукт 8g (1,35г) у вигляді твердої речовини світло-жовтого кольору. Неочищений 1 продукт очищали за допомогою експресН ЯМР (400МГц, ДМСО-d6): δ 8,02 (d, J=9,2Гц, хроматографії на силікагелі (гексан/EtOAc, 1:1), і 1Н), 7,86 (bs, 1H), 7,78 (d, J=7,3Гц, 1H), 7,43 (s, одержували 2,12мг білуватої твердої речовини 2H), 7,27 (d, J=2,2Гц, 1Н), 7,12 (d, J=6,9Гц, 1Н), (вихід 80%). 7,03 (dd, J=9,2, 1,9Гц, 1H), 5,57-5,40 (m, 1H), 5,40 Стадія З. Складний метиловий ефір 8g (1,82г, (s, 1H), 5,26-5,17 (m, 1H), 4,70 (bs, 1H), 4,52-4,35 2,2ммоля) розчиняли у розчині ТГФ/МеОН/Н 2О (m, 2H), 4,29-4,23 (m, 1H), 4,18-4,00 (m, 1H), 3,90 (38/20/18мл) та омиляли за допомогою LiOH´H2O (s, 3H), 3,87-3,65 (m, 1H), 2,42-2,32 (m, 1H), 2,19(935мг, 22,3ммоля). Здійснювали реакцію гідролізу 2,10 (m, 1H), 2,07-1,96 (m, 3H), 1,82-0,95 (m, 28H). протягом 18год. при К.Т. Потім розчин упарювали MC; es + 815,4 (M+H)+, es -: 813,4 (M-H)-. досуха, одержуючи білувату пасту. Пасту розбавПриклад 10 ляли ЕtOАс та соляним розчином. Значення рН Аналіз NS3-NS4A-протеази суміші доводили до 6 за допомогою 1н. НСl. Ферментативний аналіз, який застосовували ЕtOАс-шар відокремлювали та водний шар екстрадля оцінки сполук, запропонованих у даному винагували двічі ЕtOАс. Об'єднані ЕtOАс-екстракти ході, описаний у [WO 00/09543 та WO 00/59929]. промивали деіонізованою водою (2´) та соляним Приклад 11 розчином (1´), сушили (MgSO 4) та упарювали, Аналіз реплікації РНК HCV на культурі клітин одержуючи циклічну трипептидну сполуку 101 у Культура клітин: вигляді твердої речовини жовтого кольору (1,76г; Клітини лінії Huh7, стабільно підтримуючі субвихід 99%). геномний реплікон HCV, створювали відповідно до Перетворення на Na-сіль: описаного раніше методу [Lohman та ін., Science Сполуку 8h (106мг; 0,132ммоля) розчиняли у 285, 1999, стор.110-113] та позначали їх як клітинМеОН (20мл) та додавали 0,01н. розчин NaOH на лінія S22.3 [WO 02/052015]. Клітини лінії S22.3 (13,2мл). Прозорий розчин жовтого кольору розбапідтримували в модифікованому відповідно до вляли водою, заморожували та ліофілізували, методу Дульбеко середовищі Ігла (DMEM), доповодержуючи натрієву сіль сполуки 8h у вигляді неного 10% ФБС та 1мг/мл неоміцина (стандартне аморфної твердої речовини жовто-білого кольору середовище). У процесі аналізу використовували (106мг; вихід 97%). середовище DMEM, доповнене 10% ФБС, яке місМ.С. (електроспрей): 799,3 (М-Н)- 801,4 (М+Н), тить 0,5% ДМСО та не містить неоміцин (середогомогенність за даними РХВД з оберненою фазою вище для аналізу). За 16год. до внесення сполуки (0,06% ТФК; CH3CN: Н2О) 99%. клітини лінії S22.3 обробляли трипсином та розба1 Н ЯМР (400МГц, ДМСО-d6): δ 8,02 (d, J=9,2Гц, вляли до 50000 клітин/мл стандартним середови1H), 7,90 (d, J=6,4Гц, 1Н), 7,76 (s, 1H), 7,44 (bs, щем. По 200мкл (10000 клітин) вносили в кожну 2H), 7,27 (d, J=1,9Гц, 1Н), 7,11 (d, J=7,0Гц, 1Н), лунку 96-лункового планшета. Потім планшет інку7,03 (d, J=9,2Гц, 1H), 5,48 (dd, J=18,4, 9,9Гц, 1H), бували при 37° у а тмосфері з 5% СО2 до наступно5,43 (bs, 1H), 5,15 (dt, J=17,8, 7,63Гц, 1H), 4,70 (bs, го дня. 1H), 4,49-4,34 (m, 2H), 4,34-4,25 (m, 1H), 4,13-4,03 Реагенти та матеріали: (m, 1H), 3,99-3,86 (m, 1H), 3,90 (s, 3H), 2,58-2,44 (m, 1H), 2,42-2,32 (m, 1H), 2,15-1,93 (m, 4H), 1,83Продукт 1 Компанія 2 Wisent Inc. Sigma Gibco-BRL DMEM ДМСО Модифікований за методом Дульбекко ЗФР Фетальна теляча сироватка (ФТС) (сироватка плода корови) Bio-Whittaker Неоміцин (G418) Gibco-BRL Каталожний № 3 10013CV D-2650 14190-136 Умови зберігання 4 4°C К.Т. К.Т. 14-901F -20°С/4°С 10131-027 -20°С/4°С 27 78014 28 Продовження 1 Трипсин-ЕДТК 96-лункові планшети Фільтр з полівініліденфториду (ПВДФ), 0,22мкм Титраційний планшет з поліпропілену із глибокими лунками 2 Gibco-BRL Costar 3 25300-054 3997 4 -20°С/4°С К.Т. Millipore SLGV025LS К.Т. Beckman 267007 К.Т. 10мкл сполуки, яку тестують, (у 100% ДМСО) додавали до 2мл середовища для аналізу до кінцевої концентрації ДМСО 0,5% та розчин обробляли ультразвуком протягом 15хв. та фільтр ували через фільтр типу Millipore з розміром отворів 0,22мкм. 900мкл вносили у ряд А титраційного планшета з поліпропілену із глибокими лунками. Ряди Б-3 містили аліквоти по 400мкм середовища для аналізу (яке містить 0,5% ДМСО) та їх застосовували для приготування серійних розведень (1/2) шляхом переносу по 400мкл із ряду в ряд (у ряд 3 не вносили ніякої сполуки). Середовище для культури клітин аспірирували з 96-лункового планшета, який містить клітини лінії S22.3. По 175мкл середовища для аналізу з відповідним чином розведеною сполукою, яку тестують, переносили з кожної лунки планшета, який містить сполуки, у відповідну лунку планшета, який містить культур у клітин (ряд 3 застосовували в якості «контролю без інгібітору»). Планшет з культурою клітин інкубували при 37° у атмосфері з 5% СО2 протягом 72год. Після 72-годинного періоду інкубації екстрагували загальну клітинну РНК із клітин лінії S22.3, які знаходяться у 96-лунковому планшеті, з використанням набору типу RNeasy 96 [Qiagen®, RNeasy Handbook. 1999]. В цілому, метод полягає в наступному: середовище для аналізу повністю видаляли із клітин та у кожну лунку 96-лункового планшета з культурою клітин додавали по 100мкл RLTбуфера (Qiagen®), який містить 143мМ βмеркаптоетанолу. Мікропланшет обережно струшували протягом 20с. Потім у кожну лунку мікропланшета додавали по 100мкл 70%-вого етанолу та перемішували піпетуванням. Лізат видаляли та вносили в лунки планшета, який містить RNeasy 96 (Qiagen®), який поміщали у вер хню частину блоку із квадратними лунками (Qiagen® SquareWell Block). Планшет з RNeasy 96 запечатували скотчем та пристрій Square-Well Block з планшетом, який містить RNeasy 96, поміщали у тримач та вносили у роторний резервуар центрифуги 4К15С. Зразок центрифугували при 6000об./хв. (~5600´g) протягом 4хв. при кімнатній температурі. Скотч видаляли із планшета та у кожну лунку планшета з RNeasy 96 вносили по 0,8мл RW1буфера [Qiagen® набір RNeasy 96]. Планшет, який містить RNeasy 96, запечатували новим шматком скотча та центрифугували при 6000об./хв. протягом 4хв. при кімнатній температурі. Планшет, який містить RNeasy 96, поміщали у верхню частину іншого чистого блоку із квадратними лунками (типу Square-Well Block), скотч видаляли та у кожну лунку планшета, який містить RNeasy 96, вносили по 0,8мл RPE-буфера [Qiagen® набір RNeasy 96]. Планшет, який містить RNeasy 96, запечатували новим шматком скотча та центрифугували при 6000об./хв. протягом 4хв. при кімнатній температурі. Скотч видаляли та у кожну лунку планшета, який містить RNeasy 96, вносили ще по 0,8мл RPE-буфера [Qiagen® набір Rneasy]. Планшет, який містить RNeasy 96, запечатували новим шматком скотча та центрифугували при 6000об./хв. протягом 10хв. при кімнатній температурі. Скотч видаляли, планшет, який містить RNeasy 96, поміщали у верхню частину адаптера, який містить призначені для збору зразків мікроцентрифужні пробірки об'ємом 1,2мл. РНК елюювали, з додаванням в кожну лунку по 50мкл вільної від РНК-ази води, та запечатували планшет новим шматком скотча та інкубували протягом 1хв. при кімнатній температурі. Планшет потім центрифугували при 6000об./хв. протягом 4хв. при кімнатній температурі. Стадію елюювання повторювали, використовуючи другий об'єм рівний 50мкл вільної від РНКази води. Мікроцентрифужні пробірки із загальною клітинною РНК зберігали при -70°. РНК оцінювали кількісно за допомогою системи STORM® (Molecular Dynamics®), з використанням набору для кількісної оцінки РНК типу RiboGreen® (Molecular Probes®). У цілому, метод полягає в наступному: реагент RiboGreen розбавляли у 200 разів ТЕ (10мМ Трис-НСІ рН=7,5, 1мМ ЕДТК). Як правило, 50мкл реагенту розбавляли 10мл ТЕ. Зразки рибосомальної РНК для побудови стандартної кривої розбавляли в ТЕ до 2мкл/мл та потім попередньо певні кількості (100, 50, 40, 20, 10, 5, 2 та 0мкл) розчину рибосомальної РНК переносили в новий 96-лунковий планшет (COSTAR №3997) та об'єм доводили до 100мкл за допомогою ТЕ. Як правило, колонку 1 96-лункового планшета використовували для побудови стандартної кривої, а інші лунки використовували для кількісної оцінки зразків РНК. По 10мкл кожного зразка РНК, який підлягає кількісній оцінці, переносили у відповідну лунку 96-лункового планшета та додавали по 90мкл ТЕ. У кожну лунку 96-лункового планшета вносили по одному об'єму (100мкл) розведеного реагенту RiboGreen та інкубували протягом 25хв. при кімнатній температурі, захищаючи від світла (10мкл зразка РНК у 200мкл кінцевого об'єму, тобто 20-кратне розведення). Інтенсивність флуоресценції кожної лунки оцінювали за допомогою системи STORM® (Molecular Dynamics®). Стандартні криві одержували на основі відомих кількостей рибосомальної РНК та відповідної їм інтенсивності флуоресценції. Концентрацію РНК в експериментальних зразках визначали, виходячи зі стандартної кривої, та корегували з урахуванням 20-кратного розведення. 29 Реагенти та матеріали: 78014 Продукт DEPC ЕДТК Основа Trizma Trizma-HCl Адаптори із пробірками для збору Набір для кількісної оцінки РНК типу Ribogreen Набір типу RNeasy 96 Блоки із квадратними лунками 30 Компанія Sigma Sigma Sigma Sigma Qiagen Molecular Probe Qiagen Qiagen ОТ-ПЛР у реальному часі здійснювали за допомогою системи для аналізу послідовності АВІ Prism 7700 з використанням набору TaqMan EZ R.T.-PCR (фірми Perkin-Elmer Applied Biosystems®). ОТ-ПЛР оптимізували для кількісної оцінки 5'-IRES РНК HCV за допомогою технології Taqman (фірма Roche Molecular Diagnostics Systems), яка аналогічна методу, описаному раніше у [Martell та ін. J. Clin. Microbiol. 37, 1999, стор.327-332]. Система заснована на 5'®3' нуклеолітичній активності ДНК-полімерази AmpliTaq. У цілому, метод полягає в наступному: для його здійснення використовували фторогенний зонд, який гібридизується, із подвійною міткою (PUTR-зонд), який специфічно ренатурує матрицю між ПЛР-праймерами (праймери 8125 та 7028). 5'-кінець зонда містить флуоресцентний репортер (6-карбоксифлуоресцин [FAM]), а 3'-кінець містить гаситель флуоресценції (6-карбокситетраметилродамін [TAMR A]). Спектр випромінювання репортера FAM заглушували гасителем на неушкодженому зонді, який гібридизується. Розщеплення зонда, який гібридизується, вивільняє репортер, що призводило до підвищення випромінювання флуоресценції. За допомогою аналізатора послідовності типу АВІ Prism 7700 безупинно здійснювали визначення підвищення випромінювання флуоресценції в процесі ПЛРампліфікації, при цьому кількість ампліфікованого продукту прямо пропорційна сигналу. Залежність ампліфікації від часу аналізували на ранній стадії реакції, у момент часу, який відповідає логарифмічній фазі накопичення продукту. Точку, яка пред Каталожний № D5758 E5134 T8524 T7149 19562 R11490 74183 19573 Умови зберігання 4°С К.Т. К.Т. К.Т. К.Т. -20°С К.Т. К.Т. ставляє собою певний поріг виявлення підвищення сигналу флуоресценції, пов'язаного з експонентним збільшенням кількості ПЛР-продукта для аналізатора послідовності, позначали як поріг циклу (Ст). Значення Ст є обернено пропорційним кількості введеної РНК HCV; тобто при однакових умовах ПЛР чим більше вихідна концентрація РНК HCV, тим нижче значення Ст. Стандартну криву будували автоматично за допомогою системи виявлення АВІ Prism 7700 шляхом побудови графіка залежності С т від кожного стандартного розведення з відомою концентрацією РНК HCV. У кожен планшет для здійснення ОТ-ПЛР вносили еталонні зразки для стандартної кривої. РНК реплікону HCV синтезували (за допомогою транскрипції Т7) in vitro, очищали та кількісно оцінювали за величиною ОГ 260. З ура хуванням того, що в 1мкг цієї РНК міститься 2,15´1011 копій РНК, здійснювали такі розведення, щоб одержувати 108, 107, 106, 105, 104, 103 або 102 копій геномної РНК/5мкл. У кожне розведення включали також загальну клітинну РНК лінії Huh-7 (50нг/5мкл). 5мкл кожного еталонного зразка (РНК реплікону +РНК Huh-7) поєднували з 45мкл реагенту Мі х та застосовували у проведеній у реальному часі ОТ-ПЛР. Проведену в реальному часі ОТ-ПЛР здійснювали також з використанням експериментальних зразків, які очищали в 96 лунках планшета, який містить RNeasy, поєднуючи 5мкл кожного зразка загальної клітинної РНК із 45мкл реагенту Мі х. Реагенти та матеріали: Продукт Компанія Набір TaqMan EZ R.T.-PCR РЕ Applied Biosystems Оптичні ковпачки типу MicroAmp РЕ Applied Biosystems Оптичний 96-лунковий реакційний планшет типу РЕ Applied Biosystems MicroAmp Каталожний № Умови зберігання N808-0236 -20°С N801-0935 К.Т. N801-0560 К.Т. Сполука для приготування реагенту Мі х: Компонент 1 Вільна від РНК-ази вода 5´буфер TaqMan EZ Мn(ОАс)2 (25мМ) Об'єм для 1 зразка (мкл) 2 16,5 10 6 Об'єм для одного планшета Кінцева кон(мкл) (об'єм для 91 зразка + центрація «мертвий» об'єм) 3 4 1617 980 1´ 588 3мМ 31 78014 32 Продовження 1 дАТФ(10мМ) дЦТФ(10мМ) дГТФ (10мМ) дУТФ (20мМ) «Прямий» праймер (10мкМ) «Зворотний» праймер (10мкМ) PUTR-зонд (5мкМ) ДНК-полімераза rTth (2,5од./мкл) AmpErase UNG (1од./мкл) Загальний об'єм Послідовність «прямого» праймера (SEQ ID. 1): 5' - ACG CAG ААА GCG ТСТ AGC CAT GGC GTT AGT - 3' Послідовність «зворотного» праймера (SEQ ID NO. 2): 5' - ТСС CGG GGC ACT CGC AAG С АС ССТ АТС AGG - 3' Примітка: Ці праймери забезпечують ампліфікацію області, яка складається з 256 нуклеотидів, яка є присутньою в 5'-нетрансльованій області HCV. Послідовність PUTR-зонда (SEQ ID NO. 3): 6FAM - TGG TCT GCG GAA CCG GTG AGT АСА СС - TAMR A Контролі, які не містять матриці (КНМ): На кожному планшеті по 4 лунки використовували в якості «КНМ». Для одержання таких контролів у кожну лунку замість РНК вносили 5мкл води. Умови проведення реакції у термокомірці: Після завершення ОТ-ПЛР для аналізу даних необхідно визначати поріг виявлення сигналу флуоресценції для ПЛР-планшета і для цього одержували стандартну криву шля хом побудови графіка залежності значення Ct від кількості копій РНК, які застосовують у кожній еталонній реакції. Значення Ct, отримані для зразків, які аналізували, використовували для визначення шляхом інтерполяції кількості копій РНК на основі стандартної кривої. І, нарешті, кількість копій РНК стандартизували (на основі кількісної оцінки РНК, яку екстрагували з лунки із клітинною культурою, за допомогою набору RiboGreen RNA) та виражали у вигляді геномних еквівалентів/мкг загальної РНК [г.е./мкг]. Кількість копій РНК [г.е./мкг] для кожної лунки планшета з культурою клітин приймали за міру кількості РНК HCV, яка реплікується, у присутності різних концентрацій інгібітору. Інгібування у % розраховували за допомогою наступного рівняння: 2 1,5 1,5 1,5 1,5 1 1 2 2 0,5 45 3 147 147 147 147 98 98 196 196 49 4410 4 300мкМ 300мкМ 300мкМ 600мкМ 200нМ 200нМ 200нМ 0,1од./мкл 0,01од./мкл 100 - [(г.е /мкг інг)/(г.е./мкг контр)´100]. Для обробки даних залежності інгібування від концентрації застосовували засновану на моделі Хіла апроксимацію нелінійної кривої, та значення концентрації, яка забезпечує 50%-ву е фективність (50%-ве інгібування) (ЕС50) розраховували за допомогою програмного забезпечення SAS (Statistical Software System; SAS Institute, Inc. Kepi, шт. Північна Кароліна). Приклад 12 Аналізи специфічності Аналізи специфічності, які використовуються для оцінки вибірковості дії зазначеної сполуки, відповідають описаним у [WO 00/09543]. Приклад 13 Фармакокінетичні властивості Сполуки, запропоновані в даному винаході, мають також задовільні фармакокінетичні властивості, такі як значні рівні в плазмі пацюків через 1 та 2год. після орального введення дози 5мг/кг. Більш конкретно, для оцінки рівнів у плазмі пацюків сполук, які тестують, після орального введення застосовували наступний аналіз, заснований на оцінці in vivo абсорбції після орального введення: Матеріали та методи: 1. Метод, який застосовували для угруп ування сполук (відбір за допомогою «касет»): Відбір сполук, призначених для об'єднання в «касету», був заснований на їхній структурній подібності та фізико-хімічних властивостях. Був розроблений метод твердофазної екстракції, який є застосовним для всіх відібраних сполук. Дані початкового тестування, при якому кожну сполуку вводили в плазму пацюків та за допомогою РХВД або РХВД-МС аналізували кожну сполуку, взяту в концентрації 0,5мкм, з визначенням часу утримання, іонної маси та можливості розділення сполук за допомогою РХВД та/або РХВД/МС, використовували для об'єднання 3-4 сполук в одну «касету». 2. Підготовка носія та сполуки для орального введення: Кожна «касета» містила 3-4 сполуки, кожна в концентрації 5 або 4мг/кг. Касету приготовляли у вигляді суспензії для орального введення, яка містить 0,5% водної метилцелюлози та 0,3% поліоксіетилен(20)сорбітанмоноолеату (Твін-80). Об'єм дози, яка вводиться, становив 10мл/кг і її вводили через оральний шлунковий зонд. 33 78014 34 3. Дози, які застосовували, та відбір зразків При оцінці сполук, запропонованих у даному плазми: винаході, за допомогою описаних вище ферментаСамців пацюків Sprague Dawley утримували в тивних аналізів та аналізів клітинних культур, виіндивідуальних клітках протягом ночі, та тварини явлена їхня висока активність. Більш конкретно, мали доступ до водної 10%-вої декстрози. Кожну встановлено, що значення ІС 50 сполук становили «касету» вводили 2 пацюкам. Зразки плазми менше 0,01мкМ при аналізі NS3-NS4A-протеази, а (~1мл) одержували через 1 та 2год. після обробки значення ЕС50 становили менше 0,01мкМ при анав кожного із двох пацюків та поєднували для екстлізі реплікації РНК HCV на культурі клітин. ракції та аналізу. При аналізі специфічності сполук встановлено, 4. Екстракція та аналіз сполук: що сполуки формули І мають вибіркову дію, тобто Для кожної «касети» зразки плазми, отримані вони не володіють вираженою інгібувальною актичерез 1 та 2год., зразки контрольної плазми, зразвністю по відношенню до еластази людських лейки контрольної плазми, у яку вводили всі сполуки, коцитів та катепсина В. кожну в концентрації 0,5мкм, екстрагували за доПри здійсненні фармакокінетичного аналізу на помогою методу твердофазної екстракції. Для попацюках раптово було встановлено, що при викорівняння зразки аналізували за допомогою РХВД ристанні дози 5мг/кг у метоцелі:Твін 20â та РХВД/МС. Концентрації в плазмі визначали на (0,5%:0,3%) одержували високі концентрації в плаоснові однієї концентрації стандарту, яка станозмі. Для сполук 101 та 102 величина площі під вить 0,5мкм. кривою (AUC) становила 16 та 18мкМ-год. відповідно, у той час як для їхніх найближчих аналогів величина AUC становила 0,8-4,5мкМ-год. Це несподіване та важливе підвищення проникнення сполук у плазму пацюків робить ці сполуки дуже перспективними в якості можливих лікувальних засобів, які можна вводити оральним шляхом. Комп’ютерна в ерстка Л.Литв иненко Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMacrocyclic peptides active against hepatitis c virus
Автори англійськоюLlinas-Brunet Montse
Назва патенту російськоюМакроциклические пептиды, проявляющие активность в отношении вируса гепатита с
Автори російськоюЛлинас-Брунет Монтсе
МПК / Мітки
МПК: A61P 31/14, C07K 5/083, A61K 38/21, A61P 43/00, A61K 38/00, C07K 5/087, C07K 5/078, A61K 31/7052, A61K 45/00
Мітки: гепатиту, активними, відношенню, макроциклічні, пептиди, вірусу
Код посилання
<a href="https://ua.patents.su/17-78014-makrociklichni-peptidi-yaki-eh-aktivnimi-po-vidnoshennyu-do-virusu-gepatitu-s.html" target="_blank" rel="follow" title="База патентів України">Макроциклічні пептиди, які є активними по відношенню до вірусу гепатиту с</a>
Попередній патент: Спосіб одержання водного розчину гідроксиламіну
Наступний патент: Спосіб лікування дітей, хворих на бронхіальну астму та цілорічний алергічний риніт
Випадковий патент: Біоконтейнер












