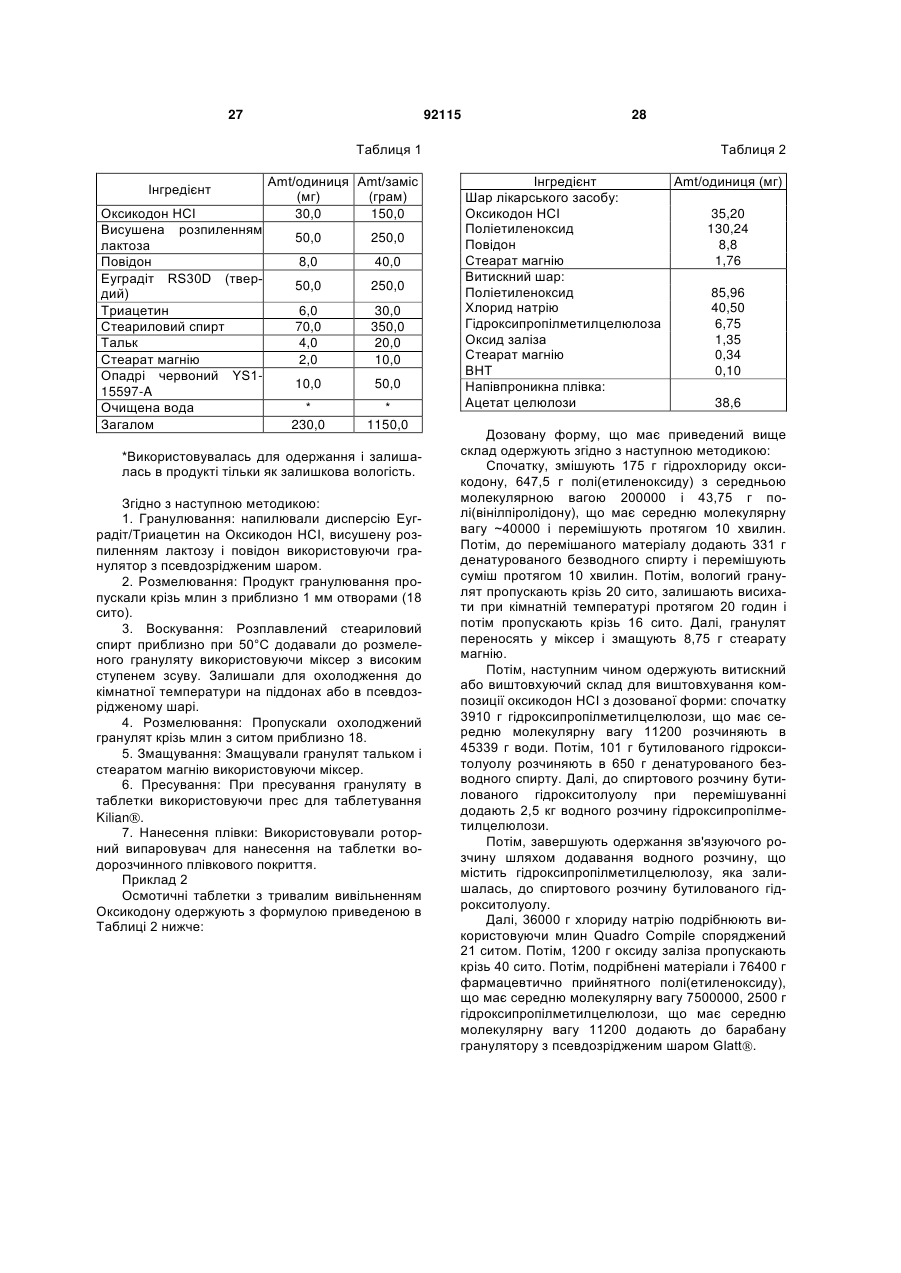
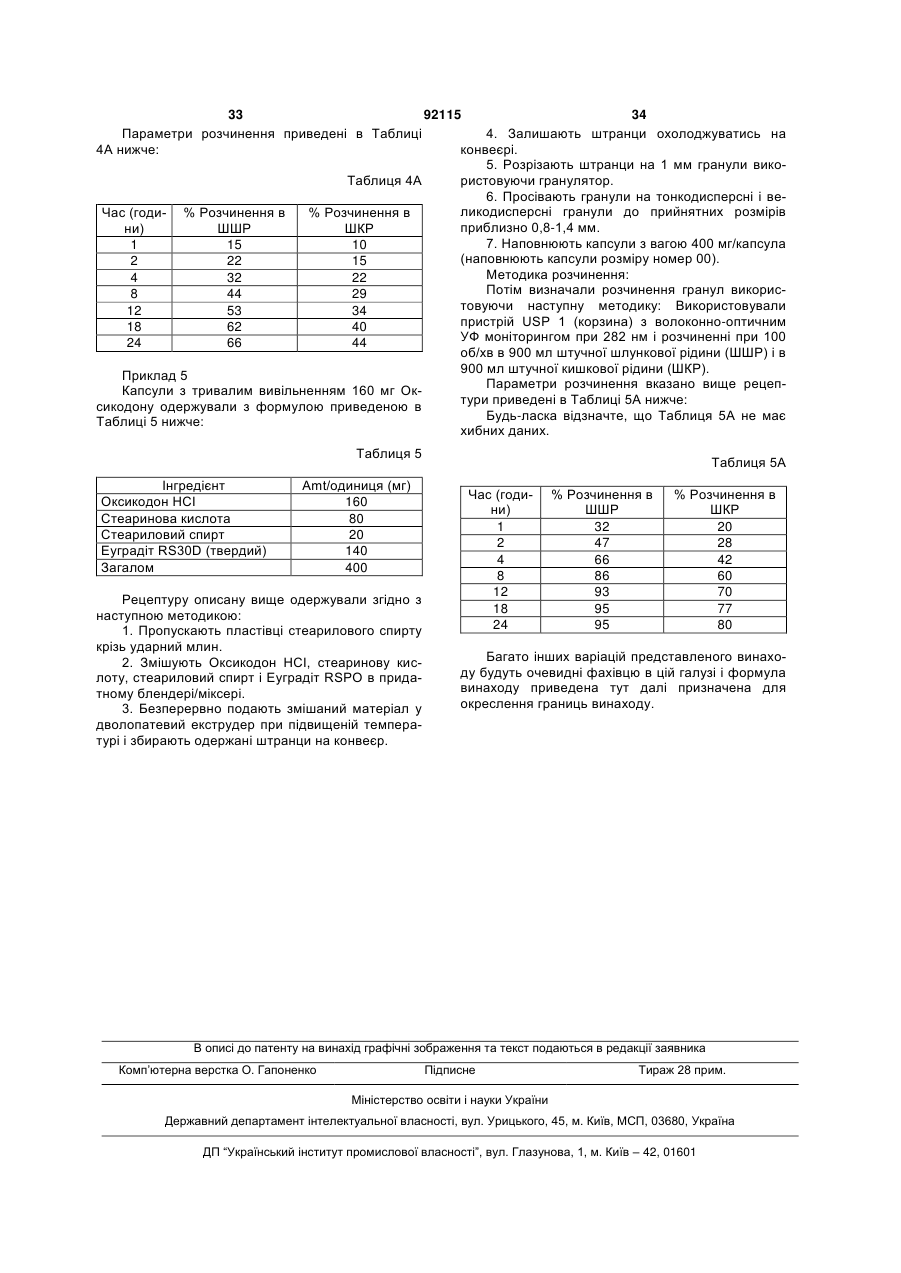
Дозована форма оксикодону, що вводиться один раз на день
Формула / Реферат
1. Пероральна дозована форма тривалого вивільнення для введення один раз на день, що включає:
множину фармацевтично прийнятних частинок, екструдованих з розплаву, що включають суміш від приблизно 5 до приблизно 640 мг оксикодону або його фармацевтично прийнятної солі та матеріалу тривалого вивільнення, що містить (і) матеріал, який вибирають з групи, яка містить акрилові смоли, алкілцелюлози, гідроксіалкілцелюлози і їх суміші, (іі) С12-С36 аліфатичний спирт і (ііі) С12-С40 жирну кислоту;
вказана дозована форма забезпечує значення співвідношення С24/Сmах для оксикодону на рівні від 0,6 до 1,0 після перорального введення на рівноважному рівні вказаним пацієнтам і тривале вивільнення протягом принаймні приблизно 24 годин, так що швидкість вивільнення in vitro становить для оксикодону або його фармацевтично прийнятної солі при вимірюванні методом USP Basket при 100 об./хв. у 900 мл водного буфера при рН від 1,6 до 7,2 при температурі 37 °С, від 0 % до приблизно 40 % через 1 годину, від приблизно 8 % до приблизно 70 % через 4 години, від приблизно 20 % до приблизно 80 % через 8 годин, від приблизно 30 % до приблизно 95 % через 12 годин, від приблизно 35 % до приблизно 95 % через 18 годин, та більше ніж приблизно 50 % через 24 години.
2. Дозована форма за пунктом 1, де фармацевтично прийнятною сіллю оксикодону є гідрохлорид оксикодону.
3. Дозована форма за пунктом 1, яка забезпечує значення Тmах для оксикодону від приблизно 2 до приблизно 17 годин після введення на рівноважному рівні для вказаних пацієнтів.
4. Дозована форма за пунктом 1, яка забезпечує значення Тmах для оксикодону від приблизно 8 до приблизно 16 годин після введення на рівноважному рівні для вказаних пацієнтів.
5. Дозована форма за пунктом 1, яка забезпечує значення Тmах для оксикодону від приблизно 12 до приблизно 16 годин після введення на рівноважному рівні для вказаних пацієнтів.
6. Дозована форма за пунктом 1, в якій кожна частинка включає фармацевтично прийнятну матрицю.
7. Дозована форма за пунктом 6, в якій матриця є, по суті, гомогенною.
8. Дозована форма за пунктом 1, яка забезпечує значення співвідношення С24/Сmах від 0,7 до 0,99, від 0,8 до 0,95 або від 0,7 до 1,00 після введення на рівноважному рівні для вказаних пацієнтів.
9. Дозована форма за пунктом 1, в якій множина фармацевтично прийнятних частинок, екструдованих з розплаву, міститься в желатиновій капсулі.
10. Дозована форма за пунктом 1, в якій множина фармацевтично прийнятних частинок, екструдованих з розплаву, сформована у таблетку.
11. Дозована форма за пунктом 1, де таблетка має плівкове покриття.
12. Дозована форма за пунктом 11, де таблетка є пресованою таблеткою.
13. Дозована форма за будь-яким з пунктів 1-12, де матеріал тривалого вивільнення складається з суміші (і) акрилової смоли, (іі) С12-С36 аліфатичного спирту і (ііі) С12-С40 жирної кислоти.
14. Дозована форма за пунктом 13, де швидкість згаданого вивільнення in vitro є рН залежною.
15. Застосування від приблизно 5 до приблизно 640 мг гідрохлориду оксикодону або його фрамацевтично прийнятної солі при одержанні дозованої форми тривалого вивільнення за пунктом 1.
Текст
1. Пероральна дозована форма тривалого вивільнення для введення один раз на день, що включає: множину фармацевтично прийнятних частинок, екструдованих з розплаву, що включають суміш від приблизно 5 до приблизно 640 мг оксикодону або його фармацевтично прийнятної солі та матеріалу тривалого вивільнення, що містить (і) матеріал, який вибирають з групи, яка містить акрилові смоли, алкілцелюлози, гідроксіалкілцелюлози і їх суміші, (іі) С12-С36 аліфатичний спирт і (ііі) С12-С40 жирну кислоту; вказана дозована форма забезпечує значення співвідношення С24/Сmах для оксикодону на рівні від 0,6 до 1,0 після перорального введення на рівноважному рівні вказаним пацієнтам і тривале вивільнення протягом принаймні приблизно 24 годин, так що швидкість вивільнення in vitro становить для оксикодону або його фармацевтично прийнятної солі при вимірюванні методом USP Basket при 100 об./хв. у 900 мл водного буфера при рН від 1,6 до 7,2 при температурі 37 °С, від 0% до приблизно 40 % через 1 годину, від приблизно 8 % до приблизно 70 % через 4 години, від приблизно 20 % до приблизно 80 % через 8 годин, від приблизно 30 % до приблизно 95 % через 12 годин, від приблизно 35 % до приблизно 95 % через 18 годин, та більше ніж приблизно 50 % через 24 години. 2 (19) 1 3 Дана заявка заявляє пріоритет за попередньою заявкою США № 60/288,211, що подана 02 травня 2001 року, розкриття якої введене в дану заявку як посилання. Галузь винаходу Винахід спрямований на композиції відстроченого вивільнення, що містять оксикодон або його фармацевтично прийнятну сіль, які є прийнятними для введення пацієнтові. Передумови винаходу Опіоїдні композиції тривалого вивільнення, що вводяться один раз на день, розкриті у патентах США № 5,478,577; 5,672,360; 5,958,459; 6,103,261; 6,143,322; 5,965,161; 5,958,452 та 5,968,551. Усі документи, що цитуються в даній заявці, включаючи і наведені вище, введені в дану заявку як посилання у своїй цілісності для всіх цілей. Короткий виклад та об'єкти винаходу Об'єктом даного винаходу є композиція, що містить оксикодон, прийнятна для введення один раз на день, для ефективної терапії болю. Об'єктом переважних втілень даного винаходу є забезпечення фармацевтично прийнятної дозованої форми для перорального введення оксикодону для забезпечення анальгетичної терапії понад його відносно короткий період напівжиття протягом тривалого періоду часу, та такої, що має тривалий період вгамування болю, який становить, принаймні, 24 години. Перераховані вище та інші об'єкти досягаються за допомогою даного винаходу, який спрямований на дозовану форму, що включає анальгетично ефективну кількість оксикодону або його фармацевтично прийнятної солі, та на матеріал відстроченого вивільнення, при цьому дозована форма забезпечує стабільний рівень анальгетичного ефекту протягом, принаймні, приблизно 24 годин після перорального введення пацієнтові - людині; при цьому дозована форма забезпечує стабільне значення співвідношення С24/Сmax для оксидону на рівні від 0,6 до 1,0 після перорального введення пацієнтам на рівноважному рівні. В окремих втіленнях за винаходом дозована форма після введення пацієнтові забезпечує стабільне значення Тmax для оксидону in vivo, що спостерігається через приблизно 2-17 годин (наприклад, від приблизно 2 до приблизно 8 годин) після введення дозованої форми на рівноважному рівні. У деяких втіленнях даного винаходу стабільне значення Тmax для оксидону in vivo знаходиться на рівні від приблизно 6,5 до приблизно 17 годин, від приблизно 8 до приблизно 16 годин, від приблизно 10 до приблизно 16 годин, або від приблизно 12 до приблизно 16 годин після введення дозованої форми на рівноважному рівні. У деяких втіленнях винаходу дозована форма забезпечує стабільний анальгетичний ефект протягом, принаймні, 24 годин після введення дозованої форми пацієнтам на рівноважному рівні; та забезпечує значення співвідношенняя С24/Сmax для оксикидону на рівні від 0,60 до 1,0 після введення на рівноважному рівні у пацієнтів. У деяких втіленнях винаходу дозована форма забезпечує стабільний рівень анальгетичного 92115 4 ефекту протягом, принаймні, 24 годин після введення пацієнтам на рівноважному рівні; та забезпечує значення С24/Сmax для оксикидону від 0,60 до 1,0 або від 0,7 до 1,0 після введення пацієнтам на рівноважному рівні. У деяких втіленнях згідно з винаходом дозована форма забезпечує швидкість вивільнення in vitro оксидону або його фармацевтично прийнятної солі при вимірюванні за допомогою способа USP Basket при швидкості 100 об./хв у 900 мл водного буфера при рН від 1,6 до 7,2 при 37°С від 0% до приблизно 40% протягом 1 години, та від приблизно 8% до приблизно 70%протягом 4 годин, від 20% до приблизно 80% протягом 8 годин, від приблизно 30% до приблизно 95% протягом 12 годин, від приблизно 35% до приблизно 95% протягом 18 годин та більше, ніж 50% протягом 24 годин. У деяких втіленнях пероральна дозована форма для відстроченого вивільнення за даним винаходом забезпечує рівні оксикодону в плазмі крові, які є ефективними протягом дозування кожної години протягом 24 годин, що характеризується значенням W50 для оксикодону протягом періоду від 4 до 24 годин після введення на рівноважному рівні. У деяких втіленнях значення W50 складає, принаймні, 4 години, бажано, принаймні, 12 годин, та більш бажано, принаймні, 18 годин після введення на рівноважному рівні. У деяких втіленнях дозована форма відстроченого вивільнення за даним винаходом включає матрикс, що містить матеріал для відстроченого вивільнення та оксикодон або його фармацевтично прийнятну сіль. У деяких втіленнях матрикс спресовують у таблетку, яку можна необов'язково покривати зверху покриттям, що у доповнення до матеріалу відстроченого вивільнення матриксу може контролювати вивільнення оксикодону або його фармацевтично прийнятної солі з композиції так, що рівні активного інгредієнту в крові підтримуються у терапевтичних межах протягом тривалого періоду часу. У деяких альтернативних втіленнях матрикс піддають інкапсуляції. У деяких втіленнях пероральна дозована форма для відстроченого вивільнення за даним винаходом включає різноманітність фармацевтичного прийнятних матриксів відстроченого вивільнення, що містять оксикодон або його фармацевтично прийнятну сіль, при цьому дозована форма підтримує рівні оксикодону у плазмі крові у терапевтичних межах протягом тривалого періоду часу у випадку введення пацієнтам. Бажано, коли композиції, які готують згідно з даним винаходом, можуть бути представлені у формі таблеток, капсул або у вигляді будь-якої іншої одиничної дозованої форми. У деяких втіленнях пероральна дозована форма для відстроченого вивільнення за даним винаходом представляє собою осмотичну дозовану форму, яка включає один шар або подвійний шар, ядро, що містить оксикодон або його фармацевтично прийнятну сіль; здатний до розширення полімер; напівпроникну мембрану, що оточує ядро; при цьому забезпечується проходження оксикодону або його фармацевтично прийнятної солі, що 5 92115 6 розміщені у напівпроникній мембрані для відстропацієнтові - людині на рівноважному рівні; та для ченого вивільнення такі, що рівні активного інгрезабезпечення значення С24/Сmax для оксикодону на дієнта в крові підтримуються у терапевтичних мерівні від 0,6 до 1,0 після перорального введення жах протягом тривалого періоду часу при введенні вказаним пацієнтам на рівноважному рівні. пацієнтам. Термін "Сmax", як такий, що використовується у У деяких втіленнях пероральні дозовані форданій заявці, представляє собою найвищу конценми для відстроченого вивільнення за даним винатрацію лікарського засобу в плазмі крові, що досяходом включають суттєво гомогенне ядро, що місгається у межах інтервалу дозування. тить оксикодон або його фармацевтично Термін "С24", як такий, що використовується в прийнятну сіль та полімер, здатний до розширенконтексті даної заявки, представляє собою конценя; напівпроникну мембрану, що оточує ядро; та нтрацію лікарського засобу в плазмі крові через 24 пропускний канал для проходження розміщеного у години після введення. напівпроникній мембрані для відстроченого вивіТермін "Тmax" як такий, що використовується в льнення оксикодону або фармацевтично прийнятконтексті даної заявки, представляє собою період, ної солі у терапевтичних межах протягом тривалоякий проходить після введення дозованої форми го періоду часу при введенні пацієнтам. до того, як в плазмі крові буде досягнута найвища У деяких втіленнях за даним винаходом законцентрація у межах інтервалу дозування. безпечується спосіб лікування асоційованих з боТермін "W50" для цілей даного винаходу предлем станів у пацієнтів, що потребують такого лікуставляє собою тривалість періоду часу, протягом вання, такий спосіб включає введення пацієнтові якого концентрації в плазмі крові є рівними максиефективної кількості оксикодону або його фармамальній концентрації або є більшими, ніж на 50% цевтично прийнятної солі у дозованій формі для від згаданої величини. Параметр визначається за відстроченого вивільнення, як описано у даній задопомогою лінійної інтерполяції даних, що піддаявці. ються дослідженню, та представляє собою різниУ деяких втіленнях винахід спрямований на цю у часі між першим (або тільки) підвищенням використання дозованої форми для відстроченого переходу та останнім (або тільки) зниженням певивільнення, що включає фармацевтично прийняреходу у профілі плазми. тний матрикс, який містить оксикодон або його Термін "С24/Сmax співвідношення" для цілей фармацевтично прийнятну сіль та матеріал для даного винаходу визначається як співвідношення відстроченого вивільнення, при виробництві анаконцентрації лікарського засобу в плазмі через 24 льгетичного препарату для перорального введенгодини після введення до найвищої концентрації ня пацієнтам - людям, при введенні один раз на лікарського засобу в плазмі крові, що досягається день для забезпечення анальгетичного ефекту в межах інтервалу дозування. протягом, принаймні, приблизно 24 годин та знаТермін "USP Basket спосіб" представляє сочення С24/Сmax для оксикодону на рівні від 0,6 до бою спосіб Basket, що описаний в Фармакопеї XXII 1,0 після введення вказаному пацієнтові на рівноСША (1990), що введене в дану заявку як посиважному рівні. лання. У деяких втіленнях винахід спрямований на Термін "на рівноважному рівні" означає, що ківикористання пероральної дозованої форми відлькість лікарського засобу, що досягає системи, є строченого вивільнення, що включає двошарове приблизно такою самою, що й кількість лікарського ядро, яке містить шар лікарського засобу, що місзасобу, що виходить з системи. Таким чином, при тить анальгетично ефективну кількість оксикодону "рівноважному рівні" організм пацієнта виводить або його фармацевтичного прийнятної солі; та лікарський засіб при приблизно тій самій швидкосшару для переміщення, що містить осмополімер; ті, з якою лікарський засіб стає доступним системі та напівпроникну стінку, що оточує двошарове пацієнта шляхом абсорбції у кров'яне русло. ядро, яке має пропускний канал, розміщений у Термін "напівпроникна стінка" для цілей даноньому для вивільнення вказаного оксикодону або го винаходу означає, що стінка є проникною для його фармацевтично прийнятної солі; для одерпроходження зовнішньої рідини, такої, як водна жання анальгетичного препарату для пероральноабо біологічна рідина у середовищі використання, го введення пацієнтам - людині для забезпечення включаючи шлунково-кишковий тракт, але є неанальгетичного ефекту протягом, принаймні, 24 проникною для лікарського засобу. годин після перорального введення пацієнтам Термін "полімер, здатний до розширення" для людині на рівноважному рівні; та для забезпеченцілей даного винаходу означає полімер, який при ня значення С24/Сmax для оксикодону на рівні від дії водної або біологічної рідини абсорбує рідину, 0,6 до 1,0 після перорального введення на вказащо приводить до збільшення маси. ному пацієнтові на рівноважному рівні. Термін "значення" для цілей даного винаходу У деяких втіленнях винахід спрямований на при використанні для визначення фармакокінетичвикористання дозованої форми для відстроченого ного значення (наприклад, Тmax) представляє совведення, що включає різноманітні матрикси для бою арифметичне значення, виміряне для попувідстроченого вивільнення, що містять оксикодон ляції пацієнтів. або його фармацевтично прийнятну сіль та матеФраза «фармацевтично прийнятна сіль» ріал для відстроченого вивільнення, для виробнивключає, але не обмежене, солі металів, такі, як цтва анальгетичних препаратів для перорального натрієва сіль, калієва сіль, цезієва сіль, тощо; лувведення пацієнтові один раз на день для забезжно-земельних металів, такі, як сіль кальцію, сіль печення анальгетичного ефекту протягом, примагнію, тощо; солі органічних амінів, такі, як сіль наймні, 24 годин після перорального введення триетиламіну, сіль піридину, сіль піколіну, сіль 7 92115 8 етаноламіну, сіль триетаноламіну, сіль дициклогеВ інших бажаних втіленнях пероральна дозоксиламіну, Ν,Ν'-дибензилетилендіаміну, тощо; солі вана форма для відстроченого вивільнення за неорганічних кислот, такі, як гідрохлоридна, гідроданим винаходом включає від приблизно 10 до бромідна солі, сіль сульфату, фосфату, тощо; солі приблизно 160 мг гідрохлориду оксикодону або органічних кислот, такі, як формат, ацетат, триеквівалентну кількість оксикодону або його фарфторацетат, малеат, фумарат, тартрат, тощо; сумацевтично прийнятної солі, відмінної від гідрохльфонати, такі, метансульфонат, бензолсульфолориду. нат, р-толуолсульфонат, тощо; солі амінокислот, Даний винахід включає спосіб введення від такі, як аргінат, аспаргінат, глутамат, тощо. приблизно 1 до приблизно 640 мг оксикодону або Опис винаходу його фармацевтично прийнятної солі при введенні У деяких втіленнях даного винаходу дозована один раз на день пацієнтові, який цього потребує, форма для відстроченого вивільнення забезпечує для послаблення болю згідно з фармакокінетичшвидкість вивільнення оксикодону або його фарними параметрами, розкритими у даній заявці. мацевтично прийнятної солі при вимірюванні за Бажано, коли спосіб включає введення від прибдопомогою способа USP Basket при 100 об./хв. в лизно 5 до приблизно 500 мг оксикодону або його 900 мл водного буфера при рН від 1,6 до 7,2 при фармацевтично прийнятної солі. температурі 37°С від 0% до 40% протягом 1 годиСпосіб введення згідно з даним винаходом є, ни, від приблизно 8% до приблизно 70% протягом зокрема, прийнятним для лікування гострого та 4 годин, від приблизно 20% до приблизно 80% хронічного болю, асоційованого з таким захворюпротягом 8 годин, від приблизно 30% до приблизванням з летальним кінцем, як рак; хронічний біль но 95% протягом 12 годин, від приблизно 35% до спини; післяопераційний біль. приблизно 95% протягом 18 годин, та більше, ніж Дозовані форми 50% протягом 24 годин. У деяких втіленнях пероральна дозована фоУ деяких втіленнях даного винаходу період рма включає матеріал відстроченого вивільнення, часу, під час якого рівні оксикодону у плазмі крові який введений у матрикс разом з оксикодоном або (після введення на рівноважному рівні) є більшими його фармацевтично прийнятною сіллю, для заабо рівними 75% максимального рівня у плазмі безпечення відстроченого вивільнення оксикодону. Матеріал для відстроченого вивільнення може, крові (Т 0,75Сmах), може складати 4 години або біза бажанням, бути гідрофобним або гідрофільним. льше, бажано 6 годин або більше. Пероральна дозована форма за даним винаходом У деяких втіленнях час, під час якого рівні окможе бути приготовлена як гранули, сфероїдальні сикодону в плазмі крові досягають їх максимальної частинки, мультичастинки, тощо, що включають концентрації (Тmax), складає від 2 до приблизно 17 оксикодон або його фармацевтично прийнятну годин, бажано від приблизно 6,5 годин до приблисіль у матриксі для відстроченого вивільнення, що зно 17 годин, більш бажано від приблизно 8 до може бути спресований у таблетки або інкапсуприблизно 16 годин, та навіть більш бажано від льованим. Пероральна дозована форма за даним приблизно 10 до приблизно 16, або від приблизно винаходом може необов'язково включати інші фа12 до приблизно 16 годин після введення дозовармацевтично прийнятні інгредієнти (наприклад, ної форми на рівноважної рівні. розріджувачі, зв'язувальні агенти, барвники, лубУ деяких втіленнях даного винаходу дозована риканти, тощо). форма забезпечує значення співвідношення У деяких втіленнях пероральна дозована фоС24/Сmax на рівні від 0,6 до 1,0, від 0,7 до 0,99 або рма за даним винаходом може бути осмотичною співвідношення від 0,8 до 0,95 після введення на дозованою формою, що містить композицію для рівноважному рівні та (Тmax) від приблизно 6,5 говиштовхування або переміщення у вигляді одного дин до приблизно 17 годин, від приблизно 8 до з шарів двошарового ядра для виштовхування приблизно 16 годин, від приблизно 10 до приблизоксикодону або його фармацевтично прийнятної но 16 годин або від приблизно 12 годин до прибсолі з дозованої форми, та напівпроникну комполизно 16 годин. В інших втіленнях даного винахозицію стінки, що оточує ядро, при цьому стінка ду дозована форма забезпечує значення має, принаймні, один засіб виходу або пропускний співвідношення С24/Сmax на рівні від 0,7 до 1,0, канал для вивільнення оксикодону з дозованої співвідношення від 0,72 до 0,99 або співвідношенформи. Альтернативно, ядро або осмотична дозоня 0,74 до 0,95 та (Тmax) в межах від 2 до приблизвана форма може містити одношарове ядро, що но 17 годин після введення на рівноважному рівні. включає полімер для контрольованого вивільненУ деяких втіленнях даного винаходу сумісне ня та оксикодон або його фармацевтично прийняпризначення їжі не буде в значній мірі підвищувати тну сіль. або знижувати тривалість абсорбції оксикодону. Бажано, коли дозовані форми за даним винаПероральна дозована форма для відстроченоходом забезпечують анальгетичний ефект протяго вивільнення за даним винаходом включає від гом принаймні 24 годин після введення. приблизно 1 до приблизно 640 мг оксикодону або Матриксні композиції відстроченого вивільйого фармацевтично прийнятної солі (наприклад, нення гідрохлориду оксикодону). Бажано, коли перораВ одному бажаному втіленні даного винаходу льна дозована форма для відстроченого вивільносій відстроченого вивільнення може бути введенення за даним винаходом включає від приблизно ний у матрикс разом з оксикодоном або його фар5 до приблизно 500 мг оксикодону або його фармацевтично прийнятною сіллю, такий матрикс замацевтично прийнятної солі, більш бажано від безпечує відстрочене вивільнення оксикодону. приблизно 10 до приблизно 320 мг оксикодону або його фармацевтично прийнятної солі. 9 92115 10 Список необмежувальних даний винахід матевоски, жирні спирти (такі, як лауриловий, міристиріалів для відстроченого вивільнення, що можуть ловий, стериловий, цетиловий або бажано цетосбути включені в матрикс для відстроченого вивільтеариловий спирт), жирні кислоти, включаючи, нення згідно з винаходом, включає гідрофільні але, не обмежуючись, естери жирних кислот, гліта/або гідрофобні матеріали такі, як камедь, етери цериди жирних кислот (моно-, ди- та тригліцерицелюлози, акрилові смоли, матеріали білкового ди), гідрогенізовані жири, вуглеводні, нормальні походження, воски, шелак, олії, такі, як гідрогенівоски, стеринову кислоту, стеариловий спирт, гідзована касторова олія та гідрогенізована рослинна рофобні та гідрофільні матеріали, що мають вуголія. Проте будь-які фармацевтично прийнятні леводневі скелети. Прийнятні воски включають, гідрофобні або гідрофільні матеріали відстроченонаприклад, бджолиний віск, гліковіск, касторовий го вивільнення, які здатні надавати властивостей віск та карнаубський віск. Для цілей даного винавідстроченого вивільнення оксикодону або його ходу воскоподібні речовини, що звичайно є тверфармацевтично прийнятній солі, можуть викорисдими при кімнатній температурі, мають точку платовуватися згідно з даним винаходом. Бажано, влення в межах від 30 до приблизно 100°С. У щоб полімери для відстроченого вивільнення деяких переважних втіленнях дозована форма включали алкіл целюлози, такі, як етилцелюлоза, включає матрикс для відстроченого вивільнення, полімери акрилової або метакрилової кислоти та що містить оксикодон або його фармацевтично їх співполімери; етери целюлози, зокрема, гідрокприйнятну сіль та, принаймні, одну водорозчинну сиалкілцелюлози (особливо гідроксипропілметил гідроксиалкілцелюлозу, принаймні, один С12-С36, целюлоза) та карбоксиалкілцелюлози. Бажані побажано С14-С22, аліфатичний спирт, та необов'язлімери акрилової та метакрилової кислот та їх ково, принаймні, один поліалкіленгліколь. Гідроксіспівполімери включають метилметакрилат, метиалкілцелюлоза переважно є гідрокси (від С1 до С6) лметакрилат, співполімери метилметакрилату, алкілцелюлозою, такою, як гідроксипропілцелюлоетоксіетилетакрилат, етилакрилат, триметиламоза, гідроксипропілметилцелюлоза та, зокрема, нійетилметакрилат, ціаноетилметакрилати, співгідроксиетилцелюлозою. Кількість, принаймні, одполімер аміноалкілметакрилату, полі(акрилова нієї гідроксиалкілцелюлози у даній пероральній кислота), полі(метакрилова кислота), співполімер дозованій формі може бути визначена, серед іналкіламінуметакрилової кислоти, поших, шляхом оцінки точної швидкості вивільнення лі(метилметакрилат), полі(метакрилова кислооксикодону або його солі, що необхідна. Аліфатита)(ангідрид), поліметакрилат, поліакриламід, почний спирт може бути, наприклад, лауриловим лі(ангідрид метакрилової кислоти), та співполімер спиртом, міристиловим спиртом або стериловим гліцидил метакрилату. Деякі бажані втілення даноспиртом. В особливо бажаних втіленнях даної пего винаходу використовують суміші будь-яких вкароральної дозованої форми, проте, принаймні, заних вище матеріалів для відстроченого вивільодин аліфатичний спирт є цетиловим спиртом або нення у матриксі згідно з винаходом. цетостериловим спиртом. Кількість аліфатичного Матрикс також може включати зв'язуюче. У спирту у даній пероральній дозованій формі може деяких втіленнях зв'язуюче робить свій внесок у бути визначена, як описано вище, при визначенні відстрочене вивільнення оксикодону або його фаточної швидкості вивільнення оксикодону або солі рмацевтично прийнятної солі з матриксу для відоксикодону, що необхідна. Вона може також залестроченого вивільнення. жати, принаймні, від присутності одного поліалкіЯкщо включається додатковий гідрофобний ленгліколю або від його відсутності. При відсутнозв'язувальний матеріал, то його переважно вибисті, принаймні, одного поліалкіленгліколю рають з природних та синтетичних восків, жирних пероральна дозована форма бажано містить від кислот, жирних спиртів та їх сумішей. Приклади приблизно 20 ваг.% до приблизно 50 ваг.% аліфавключають бджолиний віск, стеринову кислоту та тичного спирту. Якщо поліалкіленгліколь присутній стеариловий спирт. Наведений список не означає, у пероральній дозованій формі, то поєднана вага що він є вичерпним. У деяких бажаних втіленнях аліфатичного спирту та поліалкіленгліколю бажано комбінація двох або більше гідрофобних зв'язуваскладає від 20 ваг.% до приблизно 50 ваг.% загальних матеріалів включається у матриксні компольної ваги дозованої форми. зиції. В одному бажаному втіленні співвідношення, Переважні гідрофобні зв'язувальні матеріали, наприклад, кількості, принаймні, однієї гідроксіалщо можуть використовуватися згідно з даним викілцелюлози або акрилової смоли до, принаймні, находом, включають легко засвоювані заміщені одного аліфатичного спирту/поліалкіленгліколю, або незаміщені вуглеводні з довгими ланцюгами визначає, до певної межі, швидкість вивільнення (С8-С50, зокрема, С12-С40), такі, як жирні кислоти, оксикодону або солі оксикодону з композиції. У жирні спирти, гліцеринові естери жирних кислот, деяких втіленнях співвідношення гідроксиалкілцемінеральні та рослинні олії, природні та синтетичні люлози до аліфатичного спирвоски та поліалкіленгліколі. Вуглеводні, що мають ту/поліалкіленгліколю від 1:1 до 1:4 є бажаним, при точку плавлення від 25°С до 90°С, є бажаними. цьому особливо бажаним є співвідношення від 1:2 Вуглеводневі зв'язувальні матеріали, що мають до 1:3. довгі ланцюги, жирні (аліфатичні) спирти є бажаУ деяких втіленнях поліалкілен може бути, наними в деяких втіленнях. Пероральні дозовані фоприклад, поліпропіленгліколем або поліетиленглірми можуть містити до 80 ваг.%, принаймні, одноколем, який є бажаним. Середня молекулярна го довголанцюгового вуглеводню. вага, принаймні, одного поліалкіленгліколю переУ деяких втіленнях гідрофобний зв'язувальний важно знаходиться в межах від 1,000 до 15,000, матеріал може включати природні або синтетичні зокрема, від 1,500 до 12,000. 11 92115 12 Інший прийнятний матрикс для відстроченого бних термопластичних речовин, що є менш гідровивільнення включає алкілцелюлозу (зокрема, фобними, ніж вказана одна або більше водонероетилцелюлозу), аліфатичний спирт від С12 до С36, зчинних воскоподібних речовин. Для того, щоб та необов'язково, поліалкіленгліколь. досягти відстроченого вивільнення індивідуальні У доповнення до вказаних вище інгредієнтів воскоподібні речовини у складі композиції можуть матрикс для відстроченого вивільнення може табути такими, що суттєво не розкладаються та є кож містити прийнятні кількості інших матеріалів, нерозчинними у травних соках шлунково-кишково наприклад, розріджувачів, лубрикантів, зв'язуватракту під час початкових фаз вивільнення. Корисльних речовин, цільових добавок для гранулюванні воскоподібні водонерозчинні зв'язувальні речоня, барвників, смакових агентів та агентів для навини можуть бути такими, що мають таку водороздання ковзкості, що є традиційними у галузі чинність, яка є нижчою, ніж приблизно 1:5,000 фармацевтики. (ваг./ваг). Для того, щоб поліпшити приготування тверПриготування прийнятного екструдованого за дих пероральних дозованих форм для відстрочедопомогою розплавлення матриксу згідно з даним ного вивільнення згідно з даним винаходом у повинаходом може, наприклад, включати етап передальшому аспекті винаходу забезпечується спосіб мішування оксикодону або його фармацевтично приготування твердих пероральних дозованих прийнятної солі разом з матеріалом для відстроформ для відстроченого вивільнення згідно з даченого вивільнення та бажано зв'язувальний маним винаходом, що включає введення оксикодону теріал для одержання гомогенної суміші. Гомогенабо його солі у матрикс для відстроченого вивільну суміш потім підігрівають до температури, нення. На процес введення у матрикс можуть достатньої для, принаймні, пом'якшення суміші, впливати, наприклад, такі фактори, як: достатнього для її екструдування. Одержану гомо(а) утворення гранул, що включає, принаймні, генну суміш потім піддають екструдуванню, наприодин гідрофобний та/або гідрофільний матеріал, клад, використовуючи дволопастевий екструдер, як представлено вище (наприклад, водорозчинну для одержання штранців. Екструдат бажано охогідроксіалкілцелюлозу) разом з оксикодоном або лоджують та розрізають на багато частинок будьйого фармацевтично прийнятною формою; яким з відомих у галузі техніки способів. Частинки (b) перемішування гранул, що містять, приматриксу потім розділяють на одиничні дози. Екстнаймні, один гідрофобний та/або гідрофільний рудат бажано має діаметр від приблизно 0,1 до матеріал з, принаймні, одним С12-С36 аліфатичним приблизно 5 мм та забезпечує відстрочене вивільспиртом, та нення оксикодону або фармацевтично прийнятної (c) необов'язкове ущільнення гранул та надансолі протягом періоду часу, що складає, принаймня їм форми. ні, приблизно 24 години. Гранули можуть бути сформовані за допомоНеобов'язковий процес для приготування розгою будь-якої процедури, що добре знайома спеплавлених екструдованих композицій за даним ціалістові у галузі фармацевтичних композицій. винаходом включає безпосереднє завантаження в Наприклад, в одному бажаному способі гранули екструдер гідрофобного матеріалу відстроченого можуть бути сформовані шляхом вологого гранувивільнення, оксикодону або його солі, та необолювання гідроксіаліклцелюлоза/оксикодон або солі в'язкового зв'язувального матеріалу: підігрівання оксикодону з водою. В особливо бажаному втіленгомогенної суміші; екструдування гомогенної суміні цього процесу кількість води, що додається під ші до утворення штранців, що містять гомогенну час етапу вологого гранулювання, бажано складає суміш; розрізування штранців на багаточисленні від 1,5 до 5 частин, зокрема, від 1,75 до 3,5 частин частинки, що мають розмір від 0,1 мм до 12 мм; на суху вагу оксикодону або солі оксикодону. розділення вказаних частинок на одиничні дози. У Матрикс для відстроченого вивільнення також цьому аспекті винаходу реалізується відносно може бути приготовлений шляхом, наприклад, безперервний процес приготування. грануляції з розплаву або за допомогою техніки Пластифікатори, такі, як ті, що описані вище, екструзії з розплаву. Взагалі, спосіб грануляції з можуть включати екструдований за допомогою розплаву передбачає розплавлення гідрофобного розплавлення матрикс. Пластифікатор бажано зв'язувального матеріалу, що у звичайних умовах включають у кількості від приблизно 0,1 до прибє твердим, наприклад, воску, та введення в нього лизно 30% за вагою матриксу. Інші фармацевтичні роздрібненого лікарського засобу. Для одержання ексципієнти, наприклад, тальк, моно- або полісадозованої форми відстроченого вивільнення може хариди, барвники, смакові агенти, лубриканти, бути необхідно ввести гідрофобний матеріал для тощо, можуть бути включені у матрикс для відвідстроченого вивільнення, наприклад, етилцелюстроченого вивільнення за даним винаходом, яклозу або нерозчинний у воді акриловий полімер у що це є бажаним. Кількості, що включаються, бурозплавлений гідрофобний зв'язувальний матерідуть залежати від бажаної характеристики, якої ал, зокрема, віск. Приклади композицій для віддосягають. строченого вивільнення, що приготовлені при виДіаметр апертури екструдера або вихідного користанні способу грануляції з розплаву, можуть порта може бути відрегульований для варіації тобути знайдені, наприклад, у патенті США вщини екструдованих штранців. Крім того, вихідна №4,861,598. частина екструдера не потребує того, щоб бути Додатковий гідрофобний зв'язувальний матекруглою; вона може бути продовгуватою, прямокуріал може включати одну або більше водонерозтною, тощо. Штранци, що виходять, можуть бути чинних воскоподібних речовин, що, по можливості, розрізані на частинки при використанні гарячого змішані з однією або більшою кількістю воскоподівмонтованого ножа, гільотини, тощо. 13 92115 14 Розплавлений екструдований матрикс мультифармацевтично прийнятної солі, що вивільняється частинкової системи може бути, наприклад, у фонегайно для створення негайного терапевтичного рмі гранул, сфероїдів або маленьких кульок, в заефекту. Оксикодон або його фармацевтично актилежності від розміру отвору екструдера. Для цілей вна сіль, що вивільняється негайно, можуть бути даного винаходу терміни «екструдовані з розплаву вбудовані, наприклад, як окремі мультичастинки у мультичастинки матриксу» та «екструдована(і) з желатиновій капсулі, або можуть бути вкриті з порозплаву матриксна(і) мультичастинкова(і) систеверхні, наприклад екструдовані з розплаву матрима(и)» та «екструдовані з розплаву частинки матксні мультичастинки. риксу» будуть відноситися до множини одиниць, Профіль відстроченого вивільнення екструдобажано у межах одного розміру та/або форми, та ваних з розплаву композицій за даним винаходом таких, що містять один або більше активних агенможе бути змінений, наприклад, шляхом варіютів та один або більше ексципієнтів, що бажано вання кількості матеріалу для відстроченого вивівключають гідрофобний матеріал для відстрочельнення, шляхом варіювання кількості пластифіканого вивільнення, як описано у даній заявці. Бажатора відносно інших компонентів матрикса, но, коли екструдовані з розплаву матриксні мульшляхом варіювання кількості гідрофобного матерітичастинки мають розмір, що знаходиться в межах алу, шляхом включення додаткових інгредієнтів від приблизно 0,1 до приблизно 12 мм у довжину або ексципієнтів, шляхом зміни способу виробницта мають діаметр від приблизно 0,1 до приблизно тва, тощо. 5 мм. Крім того, зрозуміло, що екструдовані з матВ інших втіленнях даного винаходу екструдориксу матриксні мультичастинки можуть мати вані з розплаву композиції готують без включення будь-яку геометричну форму у межах цього інтероксикодону або його фармацевтично прийнятної валу розміру. У деяких втіленнях екструдат можна солі, що додається до екструдату після цього. Такі просто розрізувати на частинки бажаної довжини композиції типово будуть містити оксикодон або та розділяти на одиничні дози терапевтично актийого фармацевтично прийнятну сіль, що перемівного агенту без необхідності етапу сферонізації. шана разом з екструдованим матриксним матеріаВ одному бажаному втіленні пероральні дозолом, а потім суміш таблетують для того, щоб завані форми готують таким чином, що вони вклюбезпечити повільне вивільнення композиції. Такі чають ефективну кількість екструдованих з розпкомпозиції можуть мати переваги, наприклад, коли лаву мультичастинок усередині капсули. фармацевтично активний агент, що включається у Наприклад, множину екструдованих з розплаву композицію, є чутливим до температур, які необматриксних мультичастинок можна поміщати у хідні для пом'якшення гідрофобного матеріалу желатинову капсулу у кількості, достатній для зата/або матеріалу, що викликає відстрочене вивібезпечення ефективної дози для відстроченого льнення. вивільнення при її ковтанні та при контакті з шлунТипові екструзійні продукційні системи, прийнково-кишковим соком. ятні для використання згідно з даним винаходом, В іншому втіленні прийнятна кількість мультивключають прийнятний привідний двигун, що має частинкового екструдату ущільнюється у таблетки змінну швидкість та постійний обертовий контроль, для перорального прийому при використанні трастарт-стоп контролери та амперметр. Крім того, диційного оснащення для таблетування та при продукційна система може включати пульт темпевикористанні стандартних способів. Способи та ратурного контролю, що містить температурні сенкомпозиції для виготовлення таблеток (ущільнених сори, засоби для охолодження та індикатори темта сформованих), капсул (твердих та м'яких желаператури по всій довжині екструдера. Крім того, тинових), пілів також описані у Remington's продукційна система буде включати екструдер, Pharmaceutical Sciences (Arthur Osol, ed.), 1553такий, як дволопастевий екструдер, що складаєть1593 (1980). ся з двох протиобертових лопастей, що включені у Ще в одному втіленні екструдату може бути циліндр або у корпус, що має апертуру або головнадана форма таблеток, як це представлено у ку на його виході. Сировинні матеріали поступають Патенті США 4,957,681 (Klimesch, et.al.). через бункерне завантажувальне устаткування та Необов'язково, матриксні системи мультичасрухаються через корпус за допомогою лопастей та тинок відстроченого вивільнення, таблетки або проштовхуються через головку ектрудера у стренкапсули можуть бути вкриті покриттям відстрочеги, які потім передаються, наприклад за допомоного вивільнення, такими, як покриття для відгою стрічки, що постійно рухається для того, щоб строченого вивільнення, описані в даній заявці. охолодити та направити стренги до гранулятора Такі покриття бажано включають достатню кільабо іншого прийнятного пристрою для передачі кість гідрофобного та/або гідрофільного матеріалу екструдованих джгутів у матриксну мультичастиндля відстроченого вивільнення для досягнення кову систему. Гранулятор може складатися з цилірівня ваги від приблизно 2 до приблизно 25%, хондрів, що обертаються, фіксованого ножа, тощо. ча покриття може більше залежати від такого факПрийнятні інструменти та системи є доступними тора, як, наприклад, бажана швидкість вивільненвід постачальників, таких, як C.W. Brabenderg ня. Instruments, Inc. of South Hackensack, New Jersey. Дозовані форми за даним винаходом можуть Інше прийнятне устаткування є відомим для серетакож включати комбінації екструдованих з розпднього спеціаліста у даній галузі. лаву мультичастинок, що містять оксикодон або Подальший аспект винаходу пов'язаний з прийого фармацевтично прийнятну сіль. Крім того, готуванням екструдованих з розплаву матриксних дозовані форми можуть також включати певну мультичастинок, як описано вище за допомогою кількість терапевтично активного оксикодону або способу, який дає змогу контролювати кількість 15 92115 16 повітря, що включається в екструдований продукт. рилова кислота-етилактрилатний співполімер, або Шляхом контролю кількості повітря, що включаетилцелюлозу. ється в екструдат, можна змінювати швидкість У деяких втіленнях покриття для відстроченого вивільнення оксикодону або фармацевтично прививільнення використовується для сфероїдів відйнятної солі. строченого вивільнення, гранул, або матриксних Таким чином, у подальшому аспекті винаходу мультичастинок. У таких втіленнях покриття відекструдований з розплаву продукт готують спосостроченого вивільнення може включати водонеробом, який суттєво виключає повітря під час фази зчинний матеріал, такий, як (а) віск, або сам по екструзії процесу. Це можна виконати, наприклад, собі або у суміші з жирним спиртом; (b) шелак або при використанні екструдера Лейтриця, що має зеїн. Покриття переважно походить від водної дивакуумне оточення. Екструдовані матриксні мульсперсії гідрофобного матеріалу відстроченого витичастинки, приготовлені згідно з винаходом при вільнення. використанні екструдера Лейстриця під вакуумом, У деяких втіленнях необхідно покривати сфезабезпечують екструдований з розплаву продукт, роїди відстроченого вивільнення, гранули або мащо має різноманітні фізичні характеристики. Зоктриксні мультичастинки, що містять оксикодон або рема, екструдат суттєво не є пористим, коли збійого фармацевтично прийнятну сіль та носій відльшується у розмірі, наприклад, при використанні строченого вивільнення з достатньою кількістю сканувального електронного мікроскопу, що заводної дисперсії, наприклад, алкілцелюлози або безпечує SEM (сканувальний електронний мікрогакрилового полімеру, для одержання рівня ваги раф). Такі суттєво непористі композиції можуть від приблизно 2% до приблизно 50%, наприклад, забезпечувати прискорене вивільнення терапеввід приблизно 2 до приблизно 25%, для того, щоб тично активного агенту у порівнянні з такою самою одержати композицію відстроченого вивільнення. композицією, приготовленою не в умовах вакууму. Покриття може у більшій або у меншій мірі залеSEM матриксних мультичастинок, приготовлених жати від, наприклад, бажаної швидкості вивільпри використанні екструдера під вакуумом, є наднення, від включення пластифікатора у водну дисзвичайно гладким, крім того, мультичастинки маперсію та від способу введення. Целюлозні ють схильність бути більш твердими, ніж мультиматеріали та полімери, включаючи алкілцелюлози, частинки, приготовлені без вакууму. Це є матеріалами відстроченого вивільнення, добре спостерігається як той факт, що для, принаймні, пристосованими для покриття сфероїдів відстродеяких композицій використання екструзії під вакученого вивільнення, гранул або матриксних мульумом забезпечує ектрудовані матриксні мультичатичастинок згідно з винаходом. Тільки як приклад стинки, які є більш залежними від рН, ніж композиможна навести один бажаний алкілцелюлозний ції порівняння, приготовлені без вакууму. полімер, що представляє собою етилцелюлозу, Альтернативно, екструдований з розплаву незважаючи на те, що середній спеціаліст у даній продукт готують при використанні дволапастного галузі знає, що можна також використовувати інші екструдера Верене-Пфлейдерера. полімери целюлози та/або алкілцелюлозні полімеУ деяких втіленнях сферонізуючий агент дори, самі по собі або у будь-якій комбінації, як усе дають до грануляту або матриксних мультичастигідрофобне покриття, або як його частину згідно з нок, а потім піддають сферонізації для одержання винаходом. сфероїдів відстроченого вивільнення. Сфероїди Одна з комерційно достпуних водних суспензій потім необов'язково покривають зверху покриттям етилцелюлози представляє собою Aquacoat відстроченого вивільнення за допомогою способів, (FMC Corp., Philadelphia, Pennsylvania, USA). таких, як ті, що описані вище. Aquacoat готують шляхом розчинення етилцеСферонізуючі агенти, що можуть використовулюлози в органічному розчиннику, що не змішуватися дял приготування композицій матриксних ється з водою, а потім емульгують його у воді у мультичастинок за даним винаходом включають присутності сурфактанту та стабілізатора. Після будь-які, відомі у даній галузі техніки сферонізуючі гомогенізації для одержання субмікронних крапель агенти. Бажаними є похідні целюлози, мікрокрисорганічний розчинник випаровують під вакуумом талічна целюлоза є особливо бажаною. Прийнятна для одержання псевдолатексу. Пластифікатор не мікрокристалічна целюлоза є, наприклад, матеріавводять у псевдолатекс під час фази виготовленлом, що продається як Avicel РН 101 (Trade Mark ня. Таким чином, перед використанням його як FMC Corporation). Сферонізуючий агент переважпокриття необхідно старанно перемішати но включають у кількості від приблизно 1 до прибAquacoat з прийнятним пластифікатором перед лизно 99% від ваги матриксних мультичастинок. використанням. У деяких втіленнях у доповнення до активного Інша дисперсія етилцелюлози є комерційно інгредієнту та сферонізуючого агенту сфероїди доступною як Surelease (Colorcon, Inc., West можуть також містити зв'язуюче. Прийнятні зв'язуPoint, Pennsylvania, USA). Цей продукт готують ючі, такі, як водорозчинні полімери з низькою в'язшляхом введення пластифікатора у дисперсію під кістю, добре відомі середньому спеціалістові у час процесу виготовлення. Гарячий розплав полігалузі фармацевтики. Проте, водорозчинна гідрокмеру, пластифікатор (дибутилсебекат) та стабіліси(нижчий алкіл)целюлоза, така, як гідроксипропізатор (олеїнова кислота) готують як гомогенну лцелюлоза, є бажаними. Додатково (або альтерсуміш, яка потім розводиться лужним розчином нативно) сфероїди можуть містити для одержання водної дисперсії, яка може викориводонерозчинний полімер, зокрема, акриловий стовуватися безпосередньо для сфероїдів відполімер, акриловий співполімер, такий, як метакстроченого вивільнення, гранул або матриксних мультичастинок. 17 92115 18 В інших переважних втіленнях даного винахойого використанні, є такими, що розбухають та є ду матеріал для відстроченого вивільнення, що проникними у водних розчинах та травних соках. включає покриття для відстроченого вивільнення, Eudragit RL/RS дисперсії за даним винаходом представляє собою прийнятний акриловий поліможуть бути перемішані разом з у будь-якому бамер, включаючи, але, не обмежуючись, акрилову жаному співвідношенні для того, щоб отримати кислоту та співполімери метакрилової кислоти, композицію відстроченого вивільнення, що має метилметакрилатні співполімери, етокисетилметабажаний профіль розчинення. Переважні композикрилати, ціаноетилметакрилат, полі(акрилову кисції відстроченого вивільнення можуть бути одерлоту), полі(метакрилову кислоту) співполімер межані, наприклад, з затримуючого вивільнення поктакрилової кислоти алкіламіду, риття, що походить від 100% Eudragit RL, 50% полі(метилметакрилат), поліметакрилат, поEudragit RL та 50% Eudragit RS та 10% лі(метилметакрилат) співполімер, поліакриламід, Eudragit RL: Eudragit 90% RS. Звичайно, спеціаміноалкілметакрилатний співполімер, поаліст у даній області визнає, що можуть також вилі(ангідрид метакрилової кислоти) та гліциділметакористовуватися інші акрилові полімери, такі, як, крилатні співполімери. наприклад, Eudragit L. У тих втіленнях за даним У деяких переважних втіленнях акриловий повинаходом, де покриття включає водну дисперсію лімер складається з одного або більше амоніймегідрофобного матеріалу відстроченого вивільнентакрилатних співполімерів. Амонійметакрилатні ня включення ефективної кількості пластифікатора співполімери добре відомі у даній галузі техніки та у водній дисперсії гідрофобного матеріалу буде описані у National Formulary (NF) XVII як повністю також поліпшувати фізичні властивості покриття полімеризовані співполімери естерів акрилової та для відстроченого вивільнення. Наприклад, оскіметакрилової кислот з низьким вмістом четверльки етилцелюлоза має відносно високий рівень тинних амонійних груп. Для того, щоб одержати температури склування та не утворює м'якої плівбажаний профіль розчинення, може бути необхідки при нормальних умовах покриття, бажано ввоно ввести два або більше амонійметакрилатних дити пластифікатор у етилцелюлозне покриття, співполімерів, що мають різні фізичні властивості, що містить покриття відстроченого вивільнення, такі, як різне молярне співвідношення четвертинперед його використанням як матеріалу для покних амонійних груп до (мет)акрилових естерів. риття. Звичайно, кількість пластифікатора, що Деякі полімери типу естерів метакрилової кисвключається у розчин для покриття базується на лоти є корисними для приготування покриття, що концентрації плівкоутворювача, наприклад, найзалежить від рН, що може використовуватися згідбільш часто вона складає від приблизно 1 до прино з даним винаходом. Наприклад, існує родина близно 50 ваг.% плівкоутворювача. Концентрація співполімерів, синтезованих з діетиламіноетил пластифікатора, проте, може бути правильно виметакрилату та інших нейтральних метакрилових значена тільки після точних експериментів для естерів, що також відомі як співполімери метакриокремого розчину для покриття та способу його лової кислоти або полімерні метакрилати, які є використання. комерційно доступними як Eudragit від Rohm Приклади прийнятних пластифікаторів для GMBH та Co. Kg.Darmastadt, Німеччина. Існує деетилцелюлози включають водонерозчинні пласкілька різних типів Eudragit . Наприклад, Eudragit тифікатори, такі, як дибутилсебекат, діетилфталат, E є прикладом співполімера метакрилової кислоти, триетилцитрат, трибутилцитрат та триацетин, нещо розбухає та розчиняється у кислому середозважаючи на те, що можливо використовувати інші вищі. Eudragit L є співполімером метакрилової киводонерозчинні пластифікатори (такі, як ацетислоти, що не розбухає при рН6. Eudragit S не розбухає при рН7. Eudragit RL та Eudragit RS є пластифікатором для водних дисперсій етилцелютакими, що розбухають у воді та кількість води, що лози за даним винаходом. абсорбується цими полімерами, є такою, що залеПриклади прийнятних пластифікаторів для акжить від рН; проте дозовані форми, які вкриті рилових полімерів за даним винаходом включаEudragit RL та Eudragit RS, є рН-незалежними. ють, але не обмежені, естери лимонної кислоти, У деяких переважних втіленнях акрилове поктакі, як триетилцитрат NF XVI, трибутилцитрат, риття включає суміш двох лакових акрилових дибутилфталат та, можливо, 1,2-пропіленгілколь. смол, що є комерційно доступними від Rohm under Інші пластифікатори, які є перевіреними як прийнTradenames Eudragit RL30D та Eudragit RS30D, ятні для поліпшення еластичності плівок, що утвовідповідно. Eudragit RL30D тa Eudragit RS30D є рюються з акрилових плівок, таких, як лакові розспівполімерами акрилового та метакрилового есчини Eudragit RL/RS, включають терів з низьким вмістом четвертинних амонійних поліетиленгліколі, пропіленгліколь, діетилфталат, груп, молярне співвідношення амонійних груп до касторову олію та триацетин. Триетилцитрат є залишкових нейтральних (мет)акрилових естерів особливо бажаним пластифікатором для водних складає 1:20 у Eudragit RL30D та 1:40 у дисперсій етилцелюлози за даним винаходом. Eudragit RS30D. Молекулярна вага становить У деяких втіленнях непокриті/покриті сфероїди приблизно 150,000. Код позначення RL (висока відстроченого вивільнення, гранули або матриксні проникність) та RS (низька проникність) відноситьмультичастинки, що містять оксикодон або сіль ся до властивостей проникності цих агентів. оксикодону, витримують поки не буде досягнута кінцева точка, при якій сфероїди, гранули або матEudragit RL/RS суміші є нерозчинними у воді та риксні мультичастинки забезпечують стабільне травних соках. Проте, покриття, сформовані при розчинення. Кінцева точка тверднення може бути 19 92115 20 визначена шляхом порівняння профілю розчиненутворення просторового порового пропускного ня (кривої) дозованої форми після витримки в каналу для відстроченого вивільнення. Пропускумовах зберігання при підвищеній температурі, ний канал може мати будь-яку конфігурацію, таку наприклад, принаймні, один місяць при темпераяк кругла, трикутна, квадратна та еліптична для турі 40°С та відносній вологості 75%. Отверджені сприяння відстроченому вивільненню оксикодону композиції описані детально у Патентах США № або його солі з дозованої форми. Дозована форма 5,273,760; 5,286,493; 5,500,227; 5,580,578; може бути приготовлена з одним або більше про5,693,476; 5,681,585; та 6,024,982. Інші приклади пускних каналів, що просторово відокремлені один композицій відстроченого вивільнення, що можуть від одного на одній або більше поверхні дозованої використовуватися згідно з даним винаходом, форми. Пропускний канал та обладнання для включають Патенти США № 5,324,351; 5,356,467; створення пропускного каналу розкрите у патентах та 5,472,712. США № 3,845,770; 3,916,899; 4,063,064 та У доповнення до вказаних вище інгредієнтів, 4,088,864. Пропускні канали, що мають певну просфероїди, гранули або матриксні мультичастинки сторову форму, розміри та адаптовані як пори для можуть також включати прийнятну кількість інших вивільнення шляхом водного витравлювання для матеріалів, наприклад, розріджувачів, лубрикантів, забезпечення пор для вивільнення з певною швизв'язуючих, добавок для поліпшення процесу градкістю, розкриті у Патентах США № 4,200,098 та нуляції, барвників та агентів для надання ковзкос4,285,987. ті, що є традиційними у галузі фармацевтики у У деяких втіленнях двошарове ядро включає кількості до приблизно 50 ваг.% композиції, при шар лікарського засобу з оксикодоном або його бажанні. Кількостіцих додаткових матеріалів бусіллю та шар для переміщення або розкриття. У дуть достатніми для забезпечення бажаного ефекдеяких втіленнях шар лікарського засобу може ту в бажаних композиціях за винаходом. також включати, принаймні, один полімерний гідСпецифічні приклади фармацевтично прийнярогель. Полімерний гідрогель може мати середню тних носіїв та наповнювачів, що можуть викорисмолекулярну вагу від приблизно 500 до приблизно товуватися для створення пероральних дозованих 6,000,000. Приклади полімерних гідрогелів вклюформ описані у «Керівництві з фармацевтичних чають, але не обмежені, мальтодекстриновий понаповнювачів» Американської Фармацевтичної лімер формули (С6Н12О5)n·Н2О, де n дорівнює від 3 Асоціації (1986), що введено у дану заявку як подо 7,500, при цьому мальтодекстриновий полімер силання. має середню молекулярну вагу від 500 до Також встановлено, що додання невеликої кі1,250,000; полі(алкіленоксид) представляє, наприлькості тальку до покриття відстроченого вивільклад, полі(етиленоксид) та полі(пропіленоксид), нення зменшує тенденцію водної дисперсії до злищо мають середню молекулярну вагу від 50,000 до пання під час процесу обробки та діє як агент для 750,000, та більш специфічно представляє собою полірування. полі(етиленоксид), що має середню молекулярну Осмотичні дозовані форми відстроченого вивагу, принаймні, 100,000, 200,000, 300,000 або вільнення 400,000; лужну карбоксиалкілцелюлозу, де лужним Дозовані форми відстроченого вивільнення металом є натрій або калій, алкіл представляє згідно з даним винаходом можуть також бути присобою метил, етил, пропіл або бутил з молекулярготовлені як осмотичні дозовані композиції. Осмоною вагою від 10,000 до 175,000; та співполімер тичні дозовані форми бажано включають двошаетилен-акрилової кислоти, включаючи метакрилорове ядро, що містить шар лікарського засобу та ву та етакрилову кислоту з середньою молекуляршар для доставки або розкриття, де двошарове ною вагою від 10,000 до 500,000. ядро оточене напівпроникною стінкою та необов'яУ деяких втіленнях даного винаходу шар пезково має, принаймні, один пропускний канал, що реміщення або розкриття включає осмополімер. там розміщений. Приклади осмополімерів включають, але не обмеВираз «пропускний канал», як такий, що викожені, члени, вибрані з групи, яка складається з ристовується для цілей даного винаходу, включає поліалкіленоксиду та карбоксіаліклцелюлози. Поапертуру, отвори, пори, пороподібні елементи, ліалкіленоксид має середню молекулярну вагу від через які оксикодон або його сіль можуть викачу1,000,000 до 10,000,000. Поліалкіленоксид може ватися, дифузувати або мігрувати по волокнах, бути членом, вибраним з групи, яка складається з капілярним трубкам, верхньому шару пор, порополіметиленоксиду, поліетиленоксиду, поліпропівим вставкам, мікропоровим членам або поровим леноксиду, поліетиленоксиду, що має середню композиціям. Пропускний канал може також вклюмолекулярну вагу 1,000,000, поліетиленоксиду, що чати сполуку, яка руйнує стінку у рідкому оточенні має середню молекулярну вагу 5,000,000, поліевикористання для одержання, принаймні, одного тиленоксиду, що має середню молекулярну вагу пропускного каналу. Представники сполук для 7,000,000, перехреснозв'язаного поліметиленокутворення пропускного каналу включають посиду, що має молекулярну вагу 1,000,000, та полілі(гліколеву) кислоту або полі(молочну)кислоту, пропіленоксиду, що має середню молекулярну що роз'їдають стінку; желатиновий філамент; рухвагу 1,200,000. Типовий осмополімер карбоксіалікливий у воді полівініловий спирт); вилужувальні лцелюлоза включає представників, що вибрані з сполуки, такі, як рухливі у воді пороутворювальні групи, яка складається з лужної карбоксиалкілцеполісахариди, кислоти, солі або оксиди. Пропусклюлози, карбоксиметилцелюлози натрію, карбокний канал може утворюватися шляхом вилужувансиметилцелюлози калію, карбоксіетилцелюлози ня компоненту із стінки, такого, як сорбітол, саханатрію, карбокисметилцелюлози літію, карбоксіероза, лактоза, мальтоза або фруктоза для тилцелюлози калію, карбоксіалкілгідроксіалкілце 21 92115 22 люлози, карбоксиметилгідроксіетилцелюлози, катощо). Гомогенне ядро оточене напівпроникною рбоксіетилгідроксіетилцелюлози, карбоксиметилстінкою, що має пропускний канал (як визначено гідроксипропілцелюлози. Співполімери, що виковище) для вивільнення оксикодону або його фарристовуються для шару переміщення, мацевтично прийнятної солі. демонструють градієнт осмотичного тиску через У деяких втіленнях напівпроникна стінка вклюнапівпроникну стінку. Осмополімери поглинають чає представника, вибраного з групи, яка складарідину, що потрапляє у дозовану форму і, таким ється з полімеру естеру целюлози, полімеру етеру чином, набухають та розширюються як осмотичцелюлози та полімеру естеру-етеру целюлози. ний гідрогель (що також відомий як осмогель), таТипові представники полімерів стінки включають ким чином, вони виштовхують оксикодон або його представника, вибраного з групи, що складається фармацевтично прийнятну сіль з осмотичної дозоз ацилату целюлози, діацилату целюлози, триациваної форми. лату целюлози, ацетату целюлози, діацетату цеШар для виштовшування може також включалюлози, триацетату целюлози, алкенілатів моно-, ти одну або більше осмотично ефективних сполук, ди та трицелюлози та алкінілатів моно-, ди та трищо також відомі як осмоагенти та як осмотично целюлози. Полі(целюлоза), що використовується ефективні розчини. Вони поглинають рідину з отодля даного винаходу, включає полі(целюлозу), що чуючого середовища, наприклад, з шлунковомає середню молекулярну вагу від 20,000 до кишкового тракту, що потрапляє у дозовану фор7,500,00. му, та впливають на кінетику доставки шару переДодаткові напівпроникні полімери для цілей міщення. Приклади осмотично активних сполук даного винаходу включають ацетат ацетальдегідвключають представників, що вибрані з групи, яка диметилцелюлози, етилкарбамат целюлозаацетаскладається з осмотичних солей та осмотичних ту, ацетат метилкарбаматцелюлози, целюлозадіакарбогідратів. Приклади специфічних осмоагентів цетат, пропілкарбамат, ацетат включають, але не обмежені, хлорид натрію, хлодіетиламіноацетатцелюлози; напівпроникний полірид калію, сульфат магнію, фосфат літію, хлорид амід; напівпроникний поліуретан; напівпроникний літію, фосфат натрію, сульфат калію, сульфат сульфонований полістирен; напівпроникний попенатрію, фосфат калію, глюкозу, фруктозу та мальречно-зв'язаний полімер, утворений шляхом співотозу. садження поліаніону та полікатіону, як розкрито у Шар виштовхування може необов'язково патентах США № 3,173,876; 3,276,586; 3,541,005; включати гідроксипропілалкілцелюлозу, що має 3,541,006 та 3,546,876; напівпроникні полімери, що середню молекулярну вагу від 9,000 до 450,000. розкриті Loeb та Sourirajan у патенті США № Гідроксипропілалкілцелюлоза є представником, 3,546,876; напівпроникні перехресно-зв'язані полівибраним з групи, яка складається з гідроксипростирени; напівпроникний перехресно-зв'язаний пілметилцелюлози, гідроксипропілетилцелюлози, полі(стиренсульфонат натрію); напівпроникні пегідроксипропілізопропілцелюлози, гідроксипропілрехресно-зв'язані полі(вінілбензилтриметил хлобутилцелюлози та гідроксипропілпентилцелюлози. рид амонію); та напівпроникні полімери, що волоШар виштовхування необов'язково може діють рідинною проникністю від 2,5x10-8 до 2,5x10-2 включати нетоксичний пігмент або барвник. Прик(см2/год·атм), що виражається на атмосферу різлади пігментів або барвників включають, але не ниці гідростатичного або осмотичного тиску через обмежені барвниками, перерахованими для застонапівпроникну стінку. Інші полімери, корисні для сування у продуктах харчування та лікарських зацілей даного винаходу, відомі з рівня техніки за собах (FD&C), наприклад, такі, як FD&C No.1 голупатентами США № 3,845,770; 3,916,899; та бий барвник, FD&C No.4 червоний барвник, 4,160,020; та є описаними у Керівництві з загальчервоний оксид заліза, жовтий оксид заліза, діокних полімерів, Scott, J.R. та W.J.Roff, 1971, CRC сид титану, вуглецевий чорний, а також індіго. Press, Cleveland, Ohio. Шар для виштовхування також необов'язково У деяких втіленнях бажано, щоб напівпроникможе включати антиоксидант для інгібування окина стінка була нетоксичною, інертною та підтримуснення інгредієнтів. Деякі приклади включають, вала свою фізичну та хімічну цілісність під час пеале не обмежені, представників, вибраних з групи, ріоду розподілу лікарського засобу. У деяких яка складається з аскорбінової кислоти, аскорбілвтіленнях дозована форма включає зв'язуюче. пальмітату, бутилованого гідроксианізолу, суміші 2 Приклад зв'язуючого включає, але не обмежуєтьта 3 третинного бутил-4-гідроксианізолу, бутилося, терапевтично прийнятний вініловий полімер, ваного гідрокситолуолу, ізоаскорбату натрію, дигіщо має середню молекулярну вагу від 5,000 до дрогуаретової кислоти, сорбату калію, бісульфату 350,000, і є представником, вибраним з групи, яка натрію, метабісульфату натрію, сорбінової кислоскладається з полі-n-вініламіду, полі-nти, аскорбату калію, вітаміну Е, 4-хлоро-2,6вінілацетаміду, полі(вінілпіролідону), що також дитрет.бутилфенолу, альфа-токоферолу та пропіл відомий, як полі-n-вінілпіролідон, полі-nгалату. вінілкапролактон, полі-n-вініл-5-метил-2-піролідон У деяких альтернативних втіленнях дозована та співполімери полі-n-вініл-піролідону з представформа включає гомогенне ядро, що містить оксиником, вибраним з групи, яка складається з вінілакодон або його фармацевтично прийнятну сіль, цетату, вінілового спирту, хлориду вінілу, фториду фармацевтично прийнятний полімер (наприклад, вінілу, бутирату вінілу, лауреату вінілу та стеарату поліетиленоксид), необов'язково дезінтегрант (навінілу. Інші зв'язувальні агенти включають, наприприклад, полівінілпіролідон), необов'язково, енхаклад, гуміарабік, крохмаль, желатин та гідроксипнсер абсорбції (наприклад, жирну кислоту, сурфаропілалкілцелюлозу з молекулярною вагою від ктант, хелатуючий агент, солі жовчних кислот, 9,200 до 250,000. 23 92115 24 У деяких втіленнях дозована форма включає чи на зміни рН у рідині навколишнього середовилубрикант, який може використовуватися під час ща, наприклад, у шлунково-кишковому тракті. Інші виготовлення дозованої форми для запобігання переважні втілення включають рН-залежне покприклеювання до стінок форми. Приклади лубририття, що вивільняє оксикодон або його фармацекантів включають, але не обмежені, стеарат магвтично прийнятну сіль у бажаних ділянках шлунконію, стеарат натрію, стеринову кислоту, стеарат во-кишкового тракту, наприклад, у шлунку або кальцію, олеат магнію, олеїнову кислоту, олеат тонкому кишечнику, так, що забезпечується абсокалію, каприлову кислоту, стеарил фумарат натрію рбційний профіль, який здатний до забезпечення та пальмітат магнію. протягом, принаймні, двадцяти годин або більше У деяких бажаних втіленнях даний винахід годин, анальгетичний ефект пацієнтові. Також мовключає терапевтичну композицію, що містить від жливо створити композицію таким чином, що вона 1 до 640 мг оксикодону або його фармацевтично вивільняє частину дози в одній бажаній ділянці прийнятної солі, від 25 до 500 мг пошлунково-кишкового тракту, наприклад, у шлунку лі(алкіленоксиду), що має середню солекулярну та вивільняє кількість дози, що залишилася, в інвагу від 150,000 до 500,000, від 1 до 50 мг пошій ділянці шлунково-кишкового тракту, наприлі(вінілпіролідону), що має середню молекулярну клад, у тонкому кишечнику. вагу 40,000 та від 0 до 7,5 мг лубриканта. Композиції згідно з винаходом, що використоУ деяких втіленнях винахід також забезпечує вують рН-залежне покриття, можуть також справспосіб введення від 1 до 640 мг оксикодону або ляти ефект повторюваної дії, завдяки чому незайого фармацевтично прийнятної солі шляхом пехищений лікарський засіб наноситься на покриття, рорального введення від 1 до 640 мг оксикодону яке захищає лікарський засіб від дії шлункового або його фармацевтично прийнятної солі пацієнсоку, і при цьому лікарський засіб вивільняється у тові у дозованій формі, що містить напівпроникну шлунку, у той час, як його частина, що залишиластінку, що є проникною для біологічних водних ся, яка захищена покриттям від дії шлункового рідин та непроникною для проходження оксикодосоку вивільняється у нижніх відділах шлунковону або його фармацевтично прийнятної солі, при кишково тракту. Покриття, які є рН-залежними та цьому напівпроникна стінка оточує внутрішній проможуть використовуватися згідно з даним винахостір, що містить оксикодонову лікарську композидом, включають матеріал відстроченого вивільцію, та композицію для вивільнення оксикодону, нення, такий, як, наприклад, шелак, целюлозаацепри цьому оксикодонова лікарська композиція містатфталат (CAP), полівінілацетатфталат (PVAP), тить від 1 до 640 мг оксикодону або його фармагідроксипропілметилцелюлозафталат та співполіцевтично прийнятної солі, від 25 до 500 мг помери естеру метакрилової кислоти, зеїн, тощо. лі(алкіленоксиду), що має середню молекулярну У деяких втіленнях даного винаходу ефективвагу від 150,000 до 500,000, від 1 до 50 мг пона кількість оксикодону або його фармацевтично лі(вінілпіролідону), що має середню молекулярну прийнятної солі у формі, що вивільняється негайвагу 40,000, та від 0 до 7,5 мг лубриканту, при но, включається у композицію. Форма оксикодону цьому композиція для виштовхування оксикодону або солі оксикодону включається у кількості, яка є містить від15 до 250 мг полі(алкіленоксиду), що ефективною для зменшення часу досягнення макмає середню молекулярну вагу від 3,000,000 до симальної концентрації оксикодону у крові (напри7,500,000, від 0 до 75 мг осмоагенту, від 1 до 50 мг клад, плазмі крові), так, що значення Тmax зменшугідроксиалкілцелюлози, від 0 до 10 мг оксиду заліється. Шляхом включення такої ефективної за, від 0 до 10 мг лубриканту та від 0 до 10 мг анкількості оксикодону, що вивільняється негайно тиоксиданту; при цьому пропускний канал у напівабо його солі в одиничній дозі, дослідами показапроникній стінці для проходження оксикодону або но, що відносно високі рівні болю у пацієнтів мойого фармацевтично прийнятної солі з дозованої жуть бути зменшені. У таких втіленнях ефективна форми. Всмоктування рідини через напівпроникну кількість оксикодону або солі оксикодону у формі стінку у дозовану форму спричинює той факт, що негайного вивільнення можуть знаходитися на композиція оксикодону або його фармацевтично покритті таблетки за даним винаходом. Наприприйнятної солі вивільняється, а композиція для клад, якщо відстрочене вивільнення оксикодону виштовхування збільшується в об'ємі та виштовабо солі оксикодону з композиції відбувається захує композицію оксикодону або його солі через вдяки покриттю відстроченого вивільнення, шар пропускний канал, завдяки цим поєднаним операнегайного вивільнення може бути нанесений на ціям, що мають місце у дозованій формі, оксикоповерхню таблеток, де оксикодон або сіль оксикодон або його сіль доставляється в терапевтично дону введена у матрикс відстроченого вивільненефективній дозі при швидкості, що контролюється ня. Спеціаліст у даній області розуміє, що також протягом відстроченого періоду часу. існують інші альтернативні способи введення часДозовані форми за даним винаходом можуть тини оксикодону або солі оксикодону для негайнонеобов'язково бути вкриті одним або більше покго вивільнення у складі композиції. Такі альтернариттями, прийнятними для регуляції вивільнення тиви охоплюються наведеними пунктами або для захисту композиції. В одному втіленні покформули. риття забезпечуються таким чином, щоб дозволиЩе в інших втіленнях дозовані форми відстроти проводити або рН-залежне або рН-незалежне ченого вивільнення за даним винаходом у доповвивільнення, наприклад, коли піддається дії шлуннення до оксикодону або солі оксикодону можуть ково-кишкового соку. Коли є бажаним рНтакож включати неопіоїдний лікарський засіб, який незалежне покриття, то покриття призначене для може або не може впливати синергетично на оксидосягнення оптимального вивільнення, незважаюкодон або сіль оксикодону. Такі неопіоїдні лікарські 25 92115 26 засоби будуть бажано забезпечувати додаткове тифікація таких лікарських засобів описане у патезнеболення, та включають, наприклад, аспірин; нтах США № 5,514,680 (Weber та ін.) ацетомінофен; нестероїдні протизапальні лікарські СОХ-2 інгібітори були описані у даній галузі засоби («NSAID»), наприклад, ібупрофен, кетоптехніки, крім того, описано багато хімічних струкрофен, тощо; N-метил-D-аспартат (NMDA) антаготур для одержання ефекту інгібування циклогенаністи рецепторів, наприклад, морфінові, такі, як зи-2. СОХ-інгібітори описані, наприклад, у патендекстрометорфан або кетамін; інгібітори циклогетах США № 5,616,601; 5,604,260; 5,593,994; нази-ІІ («СОХ-ІІ-інгібітори»); та/або антагоністи 5,550,142; 5,536,752; 5,521,213; 5,475,995; гліцинового рецептора. 5,639,780; 5,604,253; 5,552,422; 5,510,368; У деяких втіленнях даного винаходу винахід 5,436,265; 5,409,944 та 5,130,311. Окремі бажані дозволяє використовувати низькі дози оксикодону інгібітори СОХ-2 включають целекоксид (SCабо солі оксикодону шляхом введення додаткових 58635), DUP-697? Флозулід (CGP-28238), мелокнеопіоїдниї анальгетиків, таких, як NSAID або інгісикам, 6-метокси-2-нафтилоцтову кислоту (6бітор СОХ-2. При використанні знижених кількосMNA), МK-966 (що також відомий як Vioxx), набутей одного або обох лікарських засобів можуть метон (пролікарська форма для 6-MNA), німезулід, бути зменшені побічні ефекти, асоційовані з ефекNS-398, SC-5766, SC-58215, Т-614; або їх комбінативним лікування болю у людини. цію з оксикодоном або сіллю оксикодону. АльтерПрийнятні нестероїдні протизапальні агенти нативно, призначають приблизно від 0,25 мг до 7 г включають ібупрофен, диклофенак, напрофен, на пацієнта на день інгібітора СОХ-2 у комбінації з беноксапрофен, флурбіпрофен, фенопрофен, оксикодоном або сіллю оксикодону. флубуфен, кетопрофен, індопрофен, піропрофен, Ще в інших втіленнях неопіоїдний лікарський карпрофен, оксапрозин, прамопрофен, муропрозасіб може включатися для забезпечення бажанофен, триоксапрофен, супрофен, амінопрофен, го ефекту, відмінного від знеболювання, напритіапрофенова кислота, флупрофен, буклоксова клад, протикашлеві, відхаркувальні, деконгестанткислота, індометацин, саліндак, толметін, зомепіні, антигістамінові лікарські засоби, локальні рак, тіопінак, зідометацин, ацеметацин, фентіазак, анестетики, тощо. кліданак, окспінак, мефенамінова кислота, меклоДодатковий (неопіоїдний) терапевтично активфенамінова кислота флуфенамінова кислота, ніний агент може бути включений у форму відстрофлуміцинова кислота, толфенамінова кислота, ченого вивільнення або форму для негайного видифлуризал, флуфенізал, піроксикам, судоксикам, вільнення. Додатковий лікарський засіб може бути ізоксикам, їх фармацевтично прийнятні солі, їх введений у матрикс для відстроченого вивільненсуміші, тощо. Корисні дози цих лікарських засобів ня разом з оксикодоном або сіллю оксикодону, добре відомі середньому спеціалістові у даній гаможе бути введений у дозовану форму як поролузі. шок, гранулят, тощо, може бути введений як окреАнтагоністи рецепторів N-метил-D-аспартату мий шар відстроченого вивільнення або шар для (NMDA) добре відомі у даній галузі техніки, та охонегайного вивільнення. плюють, наприклад, морфіни, такі, як декстромеПероральні тверді дозовані форми для відторфан або декстрофан, кетамін або їх фармацестроченого вивільнення за даним винаходом мовтично прийнятні солі. Для цілей даного винаходу жуть бути обмеженими опіоїдами. Пероральні тветермін «NMDA антагоніст», він також призначений рді дозовані форми для відстроченого вивільнення для охоплення лікарських засобів, що, принаймні, за даним винаходом можуть бути дозовані на сутчастково інгібують основні внутрішньоклітинні настєво нижчі добові дози у порівнянні з традиційними лідки активації NMDA-рецептора, наприклад, гангпродуктами для негайного вивільнення, без суттєліозидів, такі, як GM1 або GT1b, фенотіазину, такової різниці в анальгетичній ефективності. При пого, як трифторперазин або нафталінсульфонамід, рівнянні добових доз краща ефективність може такий, як N-(6-амінотексил)-5-хлоро-1бути результатом використання пероральних твенафталінсульфонамід. Ці лікарські засоби признардих дозованих форм за даним винаходом у порічені для інгібування розвитку толерантності до внянні з традиційними продуктами негайного вивіта/або залежності від лікарських засобів, що вильнення. кликають звикання, наприклад, наркотичних анаДаний винахід далі може бути більш повно льгетиків, таких, як морфін, кодеїн, тощо, які опиописаний при посиланні на приклади, які його сусані у патентах США № 5,321,012 та 5,556,838 проводжують. Зрозуміло, проте, що наступний (обидва Mayer та ін.) та до лікування хронічного опис є тільки ілюстративним та не може ніяким болю, що описано у патентах США № 5,502,058 чином обмежити узагальнення винаходу, описано(Mayer та ін.). NMDA антагоніст може бути вклюго вище. чений сам по собі або у комбінації з локальними Приклад 1 анестетиками, такими, як лідокаїн, як описано у Матричні таблетки з тривалим вивільненням наведених вище патентах Mayer та ін. Оксикодону одержують зі складом приведеним в Лікування хронічного болю шляхом викорисТаблиці 1 нижче: тання антагоністів гліцинового рецептора та іден 27 92115 28 Таблиця 1 Інгредієнт Оксикодон НСІ Висушена розпиленням лактоза Повідон Еуградіт RS30D (твердий) Триацетин Стеариловий спирт Тальк Стеарат магнію Опадрі червоний YS115597-A Очищена вода Загалом Таблиця 2 Amt/одиниця Amt/заміс (мг) (грам) 30,0 150,0 Інгредієнт Amt/одиниця (мг) Шар лікарського засобу: Оксикодон НСІ 35,20 Поліетиленоксид 130,24 Повідон 8,8 Стеарат магнію 1,76 Витискний шар: Поліетиленоксид 85,96 Хлорид натрію 40,50 Гідроксипропілметилцелюлоза 6,75 Оксид заліза 1,35 Стеарат магнію 0,34 ВНТ 0,10 Напівпроникна плівка: Ацетат целюлози 38,6 50,0 250,0 8,0 40,0 50,0 250,0 6,0 70,0 4,0 2,0 30,0 350,0 20,0 10,0 10,0 50,0 * 230,0 * 1150,0 *Використовувалась для одержання і залишалась в продукті тільки як залишкова вологість. Згідно з наступною методикою: 1. Гранулювання: напилювали дисперсію Еуградіт/Триацетин на Оксикодон НСІ, висушену розпиленням лактозу і повідон використовуючи гранулятор з псевдозрідженим шаром. 2. Розмелювання: Продукт гранулювання пропускали крізь млин з приблизно 1 мм отворами (18 сито). 3. Воскування: Розплавлений стеариловий спирт приблизно при 50°С додавали до розмеленого грануляту використовуючи міксер з високим ступенем зсуву. Залишали для охолодження до кімнатної температури на піддонах або в псевдозрідженому шарі. 4. Розмелювання: Пропускали охолоджений гранулят крізь млин з ситом приблизно 18. 5. Змащування: Змащували гранулят тальком і стеаратом магнію використовуючи міксер. 6. Пресування: При пресування грануляту в таблетки використовуючи прес для таблетування Kilian . 7. Нанесення плівки: Використовували роторний випаровувач для нанесення на таблетки водорозчинного плівкового покриття. Приклад 2 Осмотичні таблетки з тривалим вивільненням Оксикодону одержують з формулою приведеною в Таблиці 2 нижче: Дозовану форму, що має приведений вище склад одержують згідно з наступною методикою: Спочатку, змішують 175 г гідрохлориду оксикодону, 647,5 г полі(етиленоксиду) з середньою молекулярною вагою 200000 і 43,75 г полі(вінілпіролідону), що має середню молекулярну вагу ~40000 і перемішують протягом 10 хвилин. Потім, до перемішаного матеріалу додають 331 г денатурованого безводного спирту і перемішують суміш протягом 10 хвилин. Потім, вологий гранулят пропускають крізь 20 сито, залишають висихати при кімнатній температурі протягом 20 годин і потім пропускають крізь 16 сито. Далі, гранулят переносять у міксер і змащують 8,75 г стеарату магнію. Потім, наступним чином одержують витискний або виштовхуючий склад для виштовхування композиції оксикодон НСІ з дозованої форми: спочатку 3910 г гідроксипропілметилцелюлози, що має середню молекулярну вагу 11200 розчиняють в 45339 г води. Потім, 101 г бутилованого гідрокситолуолу розчиняють в 650 г денатурованого безводного спирту. Далі, до спиртового розчину бутилованого гідрокситолуолу при перемішуванні додають 2,5 кг водного розчину гідроксипропілметилцелюлози. Потім, завершують одержання зв'язуючого розчину шляхом додавання водного розчину, що містить гідроксипропілметилцелюлозу, яка залишалась, до спиртового розчину бутилованого гідрокситолуолу. Далі, 36000 г хлориду натрію подрібнюють використовуючи млин Quadro Compile споряджений 21 ситом. Потім, 1200 г оксиду заліза пропускають крізь 40 сито. Потім, подрібнені матеріали і 76400 г фармацевтично прийнятного полі(етиленоксиду), що має середню молекулярну вагу 7500000, 2500 г гідроксипропілметилцелюлози, що має середню молекулярну вагу 11200 додають до барабану гранулятору з псевдозрідженим шаром Glatt . 29 Барабан приєднують до гранулятору і починають процес гранулювання. Далі, сухі порошки суспендують на повітрі і змішують протягом 10 хвилин. Потім, зв'язувальний розчин розпилюють з 3 форсунок на порошок. Гранулювання контролюють протягом процесу наступним чином: загалом розчин розпилюють із швидкістю 800 г/хв; температура вводу 43°С і потік повітря 4300 м3/г. В кінці розпилення розчину, 45033 г, одержані гранульовані часточки з покриттям піддають висушуванню протягом 35 хвилин. Гранули з покриттям подрібнюють використовуючи млин Quadro Comilg з 8 ситом. Гранулят переносять у очисний барабан Tote і змішують з 281,7 г змащувального агенту, стеарат магнію. Далі, композицію лікарського засобу, що містить гідрохлорид оксикодону і виштовхувальну композицію пресують у двошарові таблетки на таблетувальному пресі Кіlіаn . Спочатку, 176 мг композиції гідрохлориду оксикодону додають до заглиблення матриці і припресовують, потім, додають 135 мг виштовхувальної композиції і шари пресують при тиску головки 3 метричні тони на 11/32 дюйми (0,873 см) діаметру, що містить приведені шари. Двошарові конструкції покривають напівпроникною плівкою. Плівку формують з композиції, що містить 100% ацетату целюлози, що має 39,8% ацетильних груп. Плівкоутворювальну композицію розчиняють в ацетон:вода (95:5 ваг:ваг) з одержанням 4% розчину твердої речовини. Плівкоутворювальну композицію напилюють на і навколо двошарової конструкції в 24 дюймовому (60 см) пристрої Vector Hi-Coater. Далі, просвердлюють один 20 міл (0,508 мм) вихідний канал у напівпроникній плівці з'єднуючи шар оксикодону з зовнішнім шаром дозованої форми. Залишковий розчинник видаляють шляхом висушування протягом 72 годин при 45 °С і вологості 45%. Далі, осмотичні дозовані системи висушують протягом 4 годин при 45°С видаляючи надлишок вологи. Дозовані форми одержані таким чином містять 35,20 мг оксикодон НСІ, 130,24 мг полі(етиленоксиду) з середньою молекулярною вагою 200000, 8,80 мг полі(вінілпіролідону) з середньою молекулярною вагою 40000 і 1,76 мг стеарату магнію. Виштовхувальна композиція містить 85,96 мг полі(етиленоксиду) з середньою молекулярною вагою 7500000, 40,50 мг хлориду натрію, 6,75 мг гідроксипропілметилцелюлози, 1,35 мг червоного оксиду заліза, 0,34 мг стеарату магнію і 0,10 мг бутилованого гідрокситолуолу. Напівпроникна плівка містить 38,6 мг ацетату целюлози, що містить 39,8% ацетильних груп. Дозована форма містить один вихідний канал, 20 міл (0,508 мм). Приклад 3 Осмотичні таблетки з тривалим вивільненням Оксикодону одержують зі складом приведеним в Таблиці 3 нижче: 92115 30 Таблиця 3 Інгредієнт Шар лікарського засобу: Оксикодон НСІ Поліетиленоксид Повідон Стеарат магнію Витискний шар: Поліетиленоксид Хлорид натрію Гідроксипропілметилцелюлоза Оксид заліза Стеарат магнію ВНТ Напівпроникна плівка: Ацетат целюлози Поліетиленгліколь Відсоток Відсоток лікарського засобу 28,8 64,2 6 1 Відсоток витискного шару 63,675 30 5 1 0,25 0,075 Відсоток напівпроникної плівки 95 5 Дозовану форму, що має приведений вище склад одержують згідно з наступною методикою: Спочатку, 1728 г гідрохлориду оксикодону, 3852 г полі(етиленоксиду) з середньою молекулярною вагою 200000 і 360 г полі(вінілпіролідону), що має середню молекулярну вагу 40000 додають до планетарного змішувального бункеру. Потім, сухі матеріли змішують протягом 10 хвилин. Потім, до матеріалу, що перемішується, обережно протягом 15 хвилин додають 1616 г денатурованого безводного етилового спирту. Потім, свіжоодержаний вологий гранулят пропускають крізь 20 сито, залишають висихати при кімнатній температурі протягом 20,5 годин і потім пропускають крізь 16 сито. Далі, гранулят переносять у планетарний міксер і змішують з 8,75 г лубриканту, стеарат магнію. Потім, наступним чином одержують витискний склад: спочатку одержують зв'язувальний розчин шляхом розчинення 3910 г гідроксипропілметилцелюлози, що має середню молекулярну вагу 11200, в 45339 г води. Потім, 101 г бутилованого гідрокситолуолу розчиняють в 650 г денатурованого безводного спирту. Приблизно 2,5 кг розчину гідроксипропілметилцелюлоза/вода додають при перемішуванні до розчину бутилований гідрокситолуол/спирт. Потім, завершують одержання зв'язувального розчину шляхом додавання при постійному перемішуванні розчину гідроксипропілметилцелюлоза/вода до розчину бутилований гідрокситолуол/вода. Далі, подрібнюють 36000 г хлориду натрію використовуючи млин Quadro Compile споряджений 21 ситом для зменшення розміру часточок хлориду натрію. Для зменшення розміру часточок матеріалів може бути використаний струменевий млин з 21 ситом. Потім, 1200 г оксиду заліза пропускають крізь 40 сито. Потім, всі подрібнені матеріали, 76400 г фармацевтично прийнятного полі(етиленоксиду), що має середню молекулярну вагу 7500000, 2500 г гідроксипропіл метил целюлози, що має середню молекулярну вагу 11200 додають до барабану гранулятору з псевдозрідженим шаром Glatt . Барабан приєднують до 31 92115 32 гранулятору і починають процес гранулювання. бутиратацетату целюлози і їм подібні. Плівка таДалі, сухі порошки суспендують на повітрі і змішукож може містити від 0 ваг.% до 40 ваг.% целюлоють протягом 10 хвилин. Потім, зв'язувальний роззи, що вибирають з групи, яка містить гідроксипрочин розпиляють з 3 форсунок на порошок. пілцелюлозу і гідроксипропілметилцелюлозу і від 0 Під час розпилення зв'язувального розчину, ваг.% до 20 ваг.% поліетиленгліколю. Загалом мішечні фільтри збовтують 10 секунд через кожні кількість всіх компонентів, що входять до складу 1,5 хвилин для відокремлення будь-яких можливих плівки еквівалентна 100 ваг.%. Напівпроникні попорошкових відкладень. В кінці розпилення розчилімери корисні для виготовлення плівки дозованої ну, одержані 45033 г часточок з нанесеним покритформи описані в патентах US 3845770; 3916899; тям піддають висушуванню протягом 35 хвилин. 4008719; 4036228 і 4111201. Установку зупиняють і гранули з покриттям видаПлівка в інших переважних втіленнях способів ляють з гранулятору. Гранули з покриттям подрібмістить селективнопроникний етер целюлози, нюють використовуючи Quadro Соmіl з 8 ситом. етилцелюлози. Етилцелюлоза містить етоксигрупи з ступенем заміщення, приблизно від 1,4-3, еквіГранулят переносять у очисний барабан Tote і валентною вмісту етокси 40%-50%, і в'язкістю в змішують з 281,7 г змащувального агенту, стеарат інтервалі від 7 до 100 сантіпуаз або вище. Більш магнію. особливо, плівка містить 45 ваг.%-80 ваг.% етилДалі, лікарську композицію оксикодон НСІ і целюлози, від 5 ваг.% до 30 ваг.% гідроксипропілвиштовхувальну композицію пресували в двошацелюлози і від 5 ваг.% до 30 ваг.% поліетиленглірову таблетку на таблетувальному пресі Kilian . колю, з загальною відсотковим вмістом всіх Спочатку, 434 мг композиції оксикодон НСІ додакомпонентів, що входить до складу плівки, еквівають до заглиблення матриці і припресовують, полентним 100 ваг.%. В іншому втіленні плівка містім, додають 260 мг виштовхувальної композиції і тить 45 ваг.%-80 ваг.% етилцелюлози, від 5 ваг.% шари пресують при тиску головки 3 метричні тони до 30 ваг.% гідроксипропілцелюлози, від 2 ваг.% на 0,700" (1,78 см) 0,375" (0,95 см) овал контакдо 20 ваг.% полівінілпіролідону, із загальним вмістування шаруватої конструкції. том всіх компонентів, що входять до складу плівки, Двошарову конструкцію покривають напівпроеквівалентним 100 ваг.%. никною плівкою. Плівку формують з композиції, що Приклад 4 містить 95% ацетату целюлози, що має 39,8% Капсули з тривалим вивільненням 10 мг Оксиацетильних груп, і 5% поліетиленгліколю, що має кодону одержували з формулою приведеною в середню молекулярну вагу 3350. ПлівкоутворюваТаблиці 4 нижче: льну композицію розчиняють в ацетон:вода (95:5 ваг:ваг) з одержанням 4% розчину твердої речоТаблиця 4 вини. Плівкоутворювальну композицію напилюють на і навколо двошарової конструкції в 24" пристрої Інгредієнт Amt/одиниця (мг) VectorHi Coater. Оксикодон НСІ 10,0 Далі, в напівпроникній плівці просвердлюють Стеаринова кислота 8,25 два 30 міл (0,762 мм) вихідні канали, з'єднуючи Стеариловий спирт 24,75 шар лікарського засобу з зовнішньою дозованою Еуградіт RS30D (твердий) 77 системою. Залишковий розчинник видаляють висушуванням протягом 48 годин при 50°С і вологосЗагалом 120,0 ті 50%. Далі, осмотичні дозовані форми висушують протягом 4 годин при 50°С видаляючи надлишок Рецептуру описану вище одержували згідно з вологи. Дозована форма одержана таким чином наступною методикою: містить 28,8% оксикодон НСІ, 64,2% по1. Пропускають пластівці стеарилового спирту лі(етиленоксиду), що має середню молекулярну крізь ударний млин. вагу 200000, 6% полі(вінілпіролідону), що має се2. Змішують Оксикодон НСІ, стеаринову кисредню молекулярну вагу 40000, і 1% стеарату малоту, стеариловий спирт і Еуградіт RSPO в придагнію. Виштовхувальна композиція містить 63,675% тному блендері/міксері. полі(етиленоксиду), що має середню молекулярну 3. Безперервно подають змішаний матеріал у вагу 7000000, 30% хлориду натрію, 5% гідроксипдволопатевий екструдер при підвищеній темпераропілметилцелюлози, що має середню молекулятурі і збирають одержані штранци на конвеєр. рну вагу 11200, 1% оксиду заліза, 0,075% бутило4. Залишають штранци охолоджуватись на ваного гідрокситолуолу і 0,25% стеарату магнію. конвеєрі. Напівпроникна плівка містить 95 ваг.% ацетату 5. Розрізають штранци на 1 мм гранули викоцелюлози, що містить 39,8% ацетильних груп, і 5,0 ристовуючи гранулятор. ваг.% поліетиленгліколю, що має середню моле6. Просівають гранули на тонкодисперсні і векулярну вагу 3350. Дозована форма містить два ликодисперсні гранули до прийнятних розмірів вихідні канали, 30 міл (0,762 мм) і має швидкість приблизно 0,8-1,4 мм. вивільнення гідрохлориду оксикодону приблизно 5 7. Наповнюють капсули з вагою 120 мг/капсула мг/г. (наповнюють капсули розміру номер 2). Дозована форма в наступних втіленнях може Потім визначали розчинення гранул викорисмістити 65 ваг.%-100 ваг.% полімеру целюлози, де товуючи наступну методику: Використовували полімер вибирають з групи, що містить естер цепристрій USP 1 (корзина) з волоконно-оптичним люлози, діестер целюлози, триетсер целюлози, УФ моніторингом при 282 нм і розчиненні при 100 етер целюлози, естер-етер целюлози, ацетат цеоб/хв в 900 мл штучної шлункової рідини (ШШР) і в люлози, діацетат целюлози, триацетат целюлози, 900 мл штучної кишкової рідини (ШКР). 33 92115 34 Параметри розчинення приведені в Таблиці 4. Залишають штранци охолоджуватись на 4А нижче: конвеєрі. 5. Розрізають штранци на 1 мм гранули викоТаблиця 4А ристовуючи гранулятор. 6. Просівають гранули на тонкодисперсні і великодисперсні гранули до прийнятних розмірів Час (годи- % Розчинення в % Розчинення в приблизно 0,8-1,4 мм. ни) ШШР ШКР 7. Наповнюють капсули з вагою 400 мг/капсула 1 15 10 (наповнюють капсули розміру номер 00). 2 22 15 Методика розчинення: 4 32 22 Потім визначали розчинення гранул викорис8 44 29 товуючи наступну методику: Використовували 12 53 34 пристрій USP 1 (корзина) з волоконно-оптичним 18 62 40 УФ моніторингом при 282 нм і розчиненні при 100 24 66 44 об/хв в 900 мл штучної шлункової рідини (ШШР) і в 900 мл штучної кишкової рідини (ШКР). Приклад 5 Параметри розчинення вказано вище рецепКапсули з тривалим вивільненням 160 мг Октури приведені в Таблиці 5А нижче: сикодону одержували з формулою приведеною в Будь-ласка відзначте, що Таблиця 5А не має Таблиці 5 нижче: хибних даних. Таблиця 5 Інгредієнт Оксикодон НСІ Стеаринова кислота Стеариловий спирт Еуградіт RS30D (твердий) Загалом Amt/одиниця (мг) 160 80 20 140 400 Рецептуру описану вище одержували згідно з наступною методикою: 1. Пропускають пластівці стеарилового спирту крізь ударний млин. 2. Змішують Оксикодон НСІ, стеаринову кислоту, стеариловий спирт і Еуградіт RSPO в придатному блендері/міксері. 3. Безперервно подають змішаний матеріал у дволопатевий екструдер при підвищеній температурі і збирають одержані штранци на конвеєр. Таблиця 5А Час (години) 1 2 4 8 12 18 24 % Розчинення в ШШР 32 47 66 86 93 95 95 % Розчинення в ШКР 20 28 42 60 70 77 80 Багато інших варіацій представленого винаходу будуть очевидні фахівцю в цій галузі і формула винаходу приведена тут далі призначена для окреслення границь винаходу. В описі до патенту на винахід графічні зображення та текст подаються в редакції заявника Комп’ютерна верстка О. Гапоненко Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюOxycodon dosed form, which is adminstered once a day
Автори англійськоюOSHLACK, Benjamin, Wright Curtis, Prater Derek
Назва патенту російськоюДозированная форма оксикодона, которая вводится один раз в день
Автори російськоюОшлак Бенджамин, Райт Куртис, Пратер Дерек
МПК / Мітки
МПК: A61P 25/04, A61K 31/485, A61K 9/24
Мітки: оксикодону, форма, дозована, вводиться, ден
Код посилання
<a href="https://ua.patents.su/17-92115-dozovana-forma-oksikodonu-shho-vvoditsya-odin-raz-na-den.html" target="_blank" rel="follow" title="База патентів України">Дозована форма оксикодону, що вводиться один раз на день</a>