Мукозальна вакцина для імунотерапії захворювань, зумовлених вірусами папіломи людини
Номер патенту: 98254
Опубліковано: 25.04.2012
Автори: Свєшніков Пьотр Гєоргієвіч, Кісєльов Всєволод Івановіч, Пальцев Міхаіл Алєксандровіч
Формула / Реферат
1. Мукозальна вакцина проти захворювань, асоційованих з вірусом папіломи людини, яка містить в ефективній кількості гібридний білок, що складається з онкобілка Е7 вірусу папіломи людини, злитого з білком теплового шоку мікобактерій Hsp70, хітозан у співвідношенні з гібридним білком 1:0,1-10 і фармакологічні прийнятні для виготовлення супозиторіїв добавки.
2. Мукозальна вакцина за п. 1, яка відрізняється тим, що для лікування дисплазії шийки матки, викликаної вірусом папіломи людини, використовується гібридний білок Е7 тип 16-Hsp70 або Е7 тип 18-Hsp70.
3. Мукозальна вакцина за п. 1, яка відрізняється тим, що для лікування анальної кондиломи використовується гібридний білок Е7 тип 16-Hsp70 або Е7 тип 6-Hsp70.
4. Спосіб лікування захворювання, асоційованого з вірусом папіломи людини, що передбачає місцеве застосування мукозальної вакцини за будь-яким з пп. 1-3 у вигляді супозиторія.
5. Спосіб лікування дисплазії шийки матки, викликаної вірусом папіломи людини, що передбачає інтравагінальне введення ефективної кількості мукозальної вакцини за п. 2.
6. Спосіб лікування анальної кондиломи, що передбачає ректальне введення ефективної кількості мукозальної вакцини за п. 3.
Текст
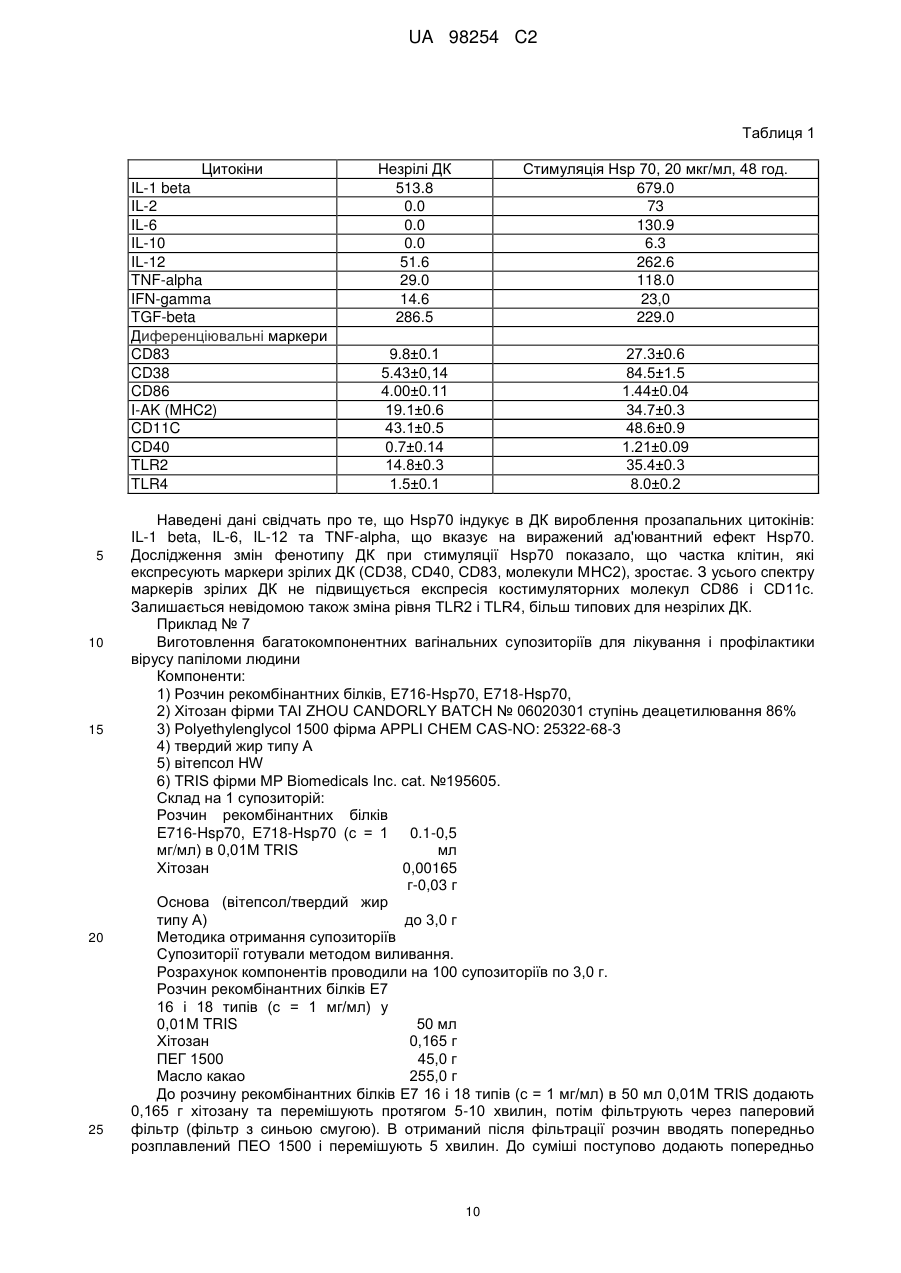
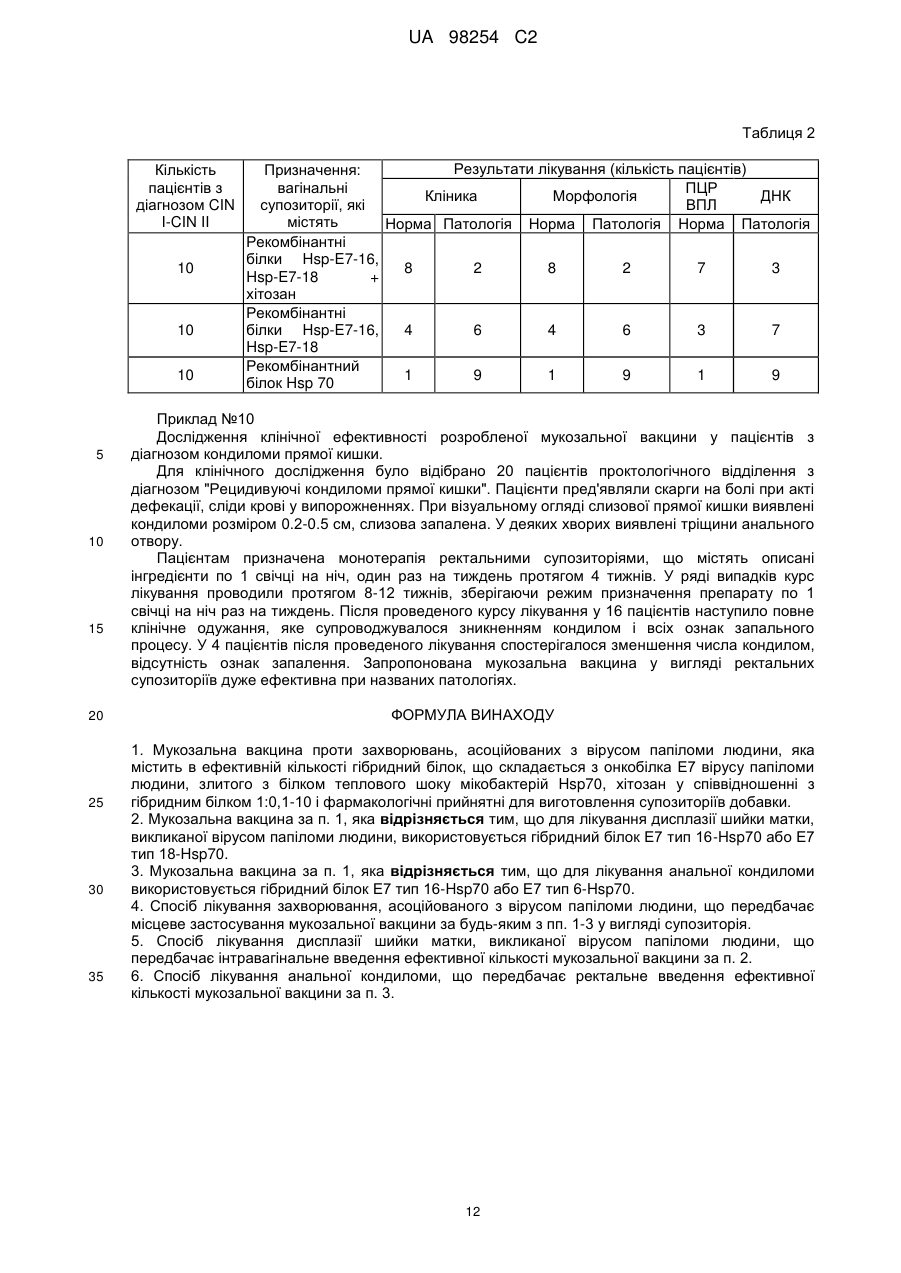
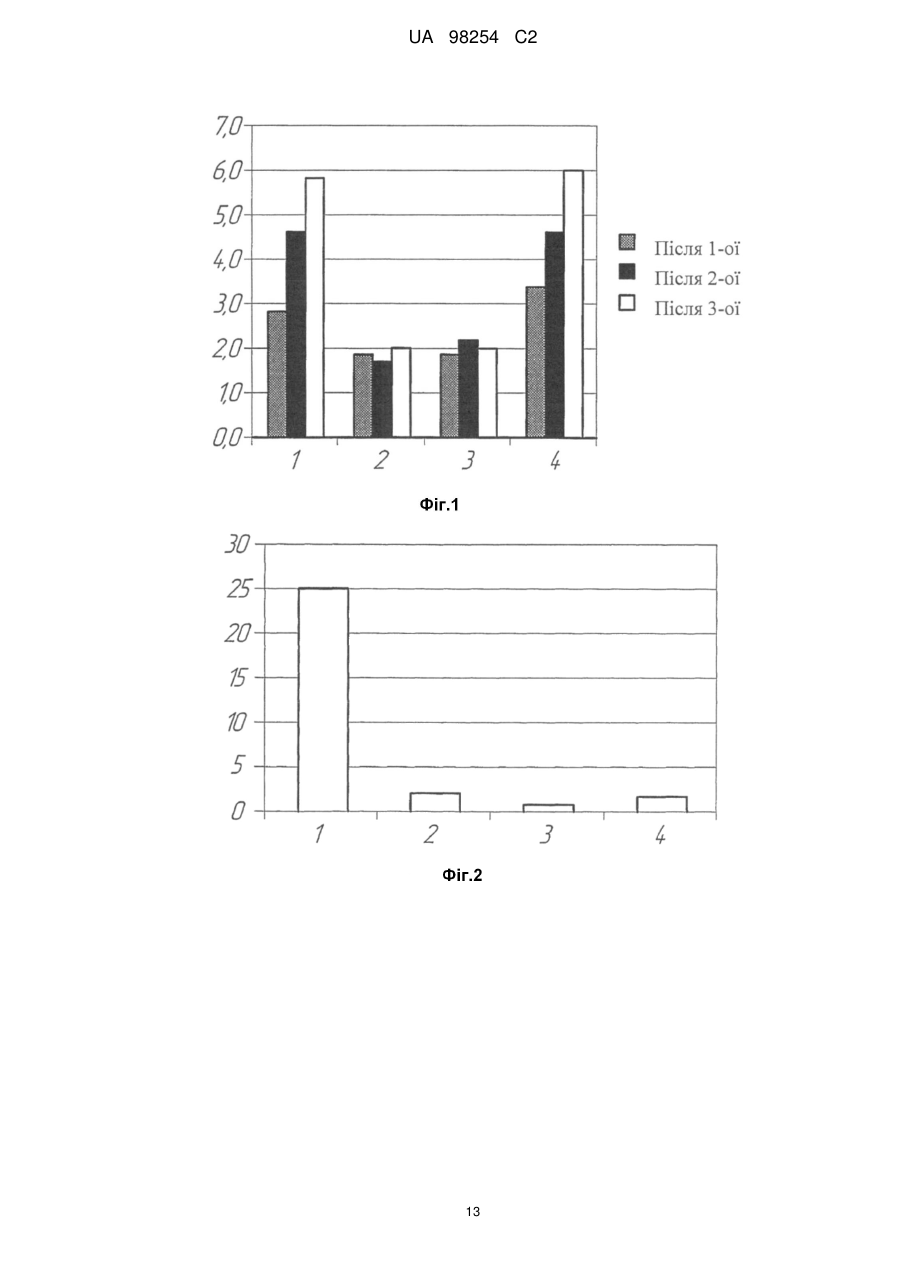
Реферат: Винахід належить до мукозальної вакцини проти захворювань, асоційованих з вірусами папіломи людини (ВПЛ), що містить в ефективній кількості гібридний білок, який складається з онкобілка Е7 вірусу папіломи людини, злитого з білком теплового шоку мікобактерій Hsp70, хітозан у співвідношенні з гібридним білком 1:0,1-10 і фармакологічні прийнятні для виготовлення супозиторіїв добавки. UA 98254 C2 (12) UA 98254 C2 UA 98254 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід відноситься до галузі генної інженерії, конкретно він належить до композиції рекомбінантних білків на основі онкобілка Е7 вірусу папіломи людини, злитого з білком теплового шоку мікобактерій Hsp70 в поєднанні з хітозаном та фармакологічно прийнятними для виготовлення супозиторіїв добавками. Також винахід відноситься до вакцинотерапії захворювань, зумовлених вірусами папіломи людини. В середині 70-х років вперше було висловлено припущення про можливу участь вірусів папіломи людини (ВПЛ) в патогенезі раку шийки матки та розпочато дослідження з ідентифікації вірусу в біопсійному матеріалі. Було встановлено, що в злоякісних пухлинах шийки матки виявляються найбільш часто два типи вірусів - ВПЛ 16 і ВПЛ 18. А в доброякісних ураженнях присутні, в основному, віруси 6 і 11 типів. При подальшому вивченні ролі ВПЛ в неопластичних процесах всі серотипи були розділені на три групи: Низький ступінь онкогенного ризику: 6, 11, 42, 43, 44 Середній ступінь онкогенного ризику: 31, 33, 51, 52, 58 Високий ступінь онкогенного ризику: 16, 18, 45, 56 Нині у ряді досліджень показано, що ДНК ВПЛ виявляється в середньому в 98,9% і 94,7% зразків гостроконечних кондилом і цервікального раку, відповідно. У популяції у здорових жінок ВПЛ виявляються в 35% випадків, причому 6, 11, 16 і 18 типи - тільки в 21,6%. Цікавим для подальшого вивчення виявився і той факт, що більша частина ДНК ВПЛ 16 в клітинах гостроконечних кондилом знаходиться в епісомальній формі, а в зразках цервікального раку інтегрована в клітинний геном. В останні роки у зв'язку з початком застосування профілактичних вакцин проти ВПЛ проведено декілька великомасштабних епідеміологічних досліджень за географічним розподілом різних типів ВПЛ в цервікальних пробах від пацієнтів з інвазивним раком шийки матки (РШМ). Виявилося, що в більшості випадків в усьому світі (65-77%) виявляються ВПЛ 16/18 типів, однак, подальше ранжування типів ВПЛ має яскраво виражені географічні особливості. Так, наприклад, в Китаї наступними за значимістю є ВПЛ 58 і 52 типів, в Африці - ВПЛ тип 45, в Центральній / Південній Америці - ВПЛ тип 31. (Bao Y., Li N., Smith J. and Qiao Y., Human papillomavirus type-distribution in the cervix of Chinese women: a metaanalysis, Int. Journal of STD & AIDS, 19, 2, 106-111; Nubia M., Xavier B., Xavier C. et al., Against which papillomavirus types shall we vaccinate and screen? The international perspective, Int. Journal of Cancer, 2004, 11, 2, 278-285; Ihekweazu C., Worldwide distribution of HPV types in women with normal cervical cytology and in women with cervical adenocarcinoma, Eurosurveillance, 2006, 11, Issue 12). Поширення інфекції відбувається переважно статевим шляхом, досягаючи максимуму інфікування до 30 років. Більше 50% сексуально активного населення світу протягом життя інфікується вірусом папіломи людини, і це є «первинною» подією в патогенезі РШМ. Більшість випадків інфікування закінчується спонтанним одужанням. Однак у деяких випадках розвивається персистуюча інфекція, здатна запускати механізми клітинної трансформації епітеліальних клітин. Так при CIN 1 спостерігається активна реплікація вірусу і його безсимптомне виділення. Перетворення CIN 1 на інвазивний рак відбувається з великою частотою і, як правило, супроводжується інтеграцією вірусної ДНК в геном клітини хазяїна (Киселев В.И., Вирусы папилломы человека в развитии рака шейки матки. M.: Компания «Димитрейд График Групп ®», 2004). ВПЛ високого ступеня онкогенного ризику (переважно 16 і 18 типів) виявляють у 50-80% зразків помірної та тяжкої дисплазії плоского епітелію шийки матки і в 90% інвазивного раку. Важливою обставиною є те, що клінічні прояви ВПЛ-інфекції не виявляються досить тривалий час, проте, наслідки персистенції вірусу від цього не стають легшими. Розвиток легкої і помірної дисплазії у важку відбувається, відповідно, в 10 і 20%» випадків. Така статистика не є фатальною: перехід однієї стадії атипії епітелію в іншу відбувається досить довго, що дає великі можливості в плані діагностики і лікування. Крім того, важливим є той факт, що носійство ВПЛ не є довічним: за даними ВООЗ (2001 р.), при відсутності обтяжуючих чинників протягом 3 років плоскоклітинні внутрішньоепітеліальні ураження низького ступеня тяжкості, що містять ВПЛ, піддаються регресії в 50-62% спостережень . За даними вчених Каліфорнійського університету у 70% молодих ВПЛ-інфікованих жінок ДНК ВПЛ перестає визначатися протягом 24 місяців. Швидкість елімінації значно знижується при інфікуванні декількома видами ВПЛ, а також - при наявності в анамнезі кондилом вульви. У той же час, серед жінок, у яких по меншій мірі 3 рази були отримані позитивні результати визначення ВПЛ, ризик важких онкологічних уражень епітелію зростав у 14 разів. Щорічно у світі реєструється близько 500 000 випадків РШМ, з яких близько 50% закінчуються летальним результатом. У Російській Федерації за даними Міністерства охорони здоров'я у 2002 було зареєстровано 11320 випадків раку шийки матки (Молочков В.А., Киселев В.И., Рудых И.В., Щербо С.H., Папилломавирусная инфекция клиника диагностика лечение, пособие для врачей, M.: Издательский дом «Русский врач», 2004). Слід 1 UA 98254 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначити, що в останні роки значно збільшилася кількість діагнозів раку прямої кишки, також обумовленого вірусами папіломи людини. Особливого поширення цей вид патології отримав серед чоловіків з нетрадиційною сексуальною орієнтацією. Відмічені випадки розвитку раку ротової порожнини при занятті оральним сексом з партнером, інфікованим ВПЛ (News.com / / в мире / /18 ноября 2004, Оральный секс приводит к заболеванию раком). У більшості випадків онкологічній патології передує утворення кондилом слизової прямої кишки, яке супроводжується кровотечами при акті дефекації, запальними процесами і тріщинами анального отвору. Сучасні уявлення про механізм канцерогенезу, обумовленого ВПЛ ВПЛ інфікує і реплікується в епітелії, що підтверджується виявленням епісомального вірусного генома в клітинах базального шару епітелію. Життєвий цикл вірусу тісно пов'язаний з диференціюванням клітини-господаря. Реплікація вірусної ДНК і синтез капсидних білків вірусу відбувається в найбільш диференційованих шарах епітелію, і вірус володіє цілим набором механізмів, що підкоряють своїм інтересам життєдіяльність інфікованої клітини. ДНК вірусу кодує синтез двох білків - Е6 і Е7, які індукують перехід диференційованих клітин в S-фазу клітинного циклу. На стадії активної репродукції вірусу експресія генів Е6 і Е7 регулюється продуктом гена Е2, що є репресором транскрипції цих генів. Саме тому, поки вірус знаходиться в епісомальному стані, спостерігаються доброякісні процеси розростання інфікованих тканин. Ключовою подією в малігнізації клітин є інтеграція вірусу в геном клітин, що супроводжується делецією гена Е2. Ця подія має два важливих наслідки: 1) в епітеліальних клітинах з інтегрованою формою ВПЛ реєструється надекспресія генів Е6 і Е7, тому що в процесі інтеграції втрачається ген Е2, що кодує репресор транскрипції цих генів, 2) будь-які противірусні препарати безсилі зупинити процес пухлинної трансформації, так як інфіковані клітини не містять вірус в традиційному розумінні, і всі лікувальні заходи повинні бути спрямовані на елімінацію клітин з інтегрованою формою генома ВПЛ. Контроль клітинного циклу і диференціювання клітин здійснюється білками Е6 і Е7 за допомогою їх взаємодії та інактивації таких "ключових" білків-регуляторів проліферативної активності та апоптозу клітин як р53 та білок ретинобластоми (pRB). Безконтрольна проліферація інфікованих клітин призводить до накопичення генетичних пошкоджень і, в кінцевому рахунку, до малігнізації. Онкобілок Е7 використовує кілька шляхів для регуляції клітинного циклу. Встановлено, що Е7 здатен утворювати стабільний комплекс з білком pRB, викликаючи його деградацію, що призводить до вивільнення транскрипційного фактора E2F, який стимулює транскрипцію генів, необхідних для реплікації ДНК і S-фази клітинного циклу. Е7 також впливає на активність цілого ряду білків клітинного циклу, як А і E цикліни, cdk2 кіназу та інгібітори циклін-залежної кінази р21 і р27 (Киселев В.И., Киселев О.И., Этиологическая роль вируса папилломы человека в развитии рака шейки матки: генетические и патогенетические механизмы, Цитокины и воспаления, 2003, 2, 4, 31-38; Phelps W.C., Barnes J.A. and Loba D.C., Human papillomavirus: molecular targets and prospects for antiviral therapy, International Antiviral News, 1999, 7, 4-8). Дослідження на тваринах свідчать, що гуморальний імунітет відіграє певну роль у захисті від ВІЛ-інфекції. Модель вірусоподібних часток (virus-like particles - VLP), які самозбираються з основного капсидного білка ВПЛ-L1, широко використовується для вивчення протективної ролі віруснейтралізуючих антитіл. Імунізація тварин VLP захищає їх від експериментальної інфекції гомологічними вірусами. Пасивне перенесення сироватки від мишей, імунізованих VLP, іншим експериментальним тваринам також справляє захисний ефект, що підтверджує протективну роль віруснейтралізуючих антитіл (Tindle R.W., Immune evasion in human papillomavirusassociated cervical cancer, Nature Reviews, 2002, Cancer, 2, 1-7; Zhou J., Liu W.J., Peng S.W. et al. Papillomavirus capsid protein expression level depends on the match between codon usage and tRNA availability, J. Virol, 1999, 73, 4972-4982; Schwarts S. Regulation of human papillomavirus late gene expression, Ups. J. Med. Ski, 2000, 105, 171-192). У випадку інфікування експериментальних імунізованих мишей ВПЛ іншого типу захисний ефект не реєстрували, що свідчить про специфічність спостережуваного явища і відсутність перехресних реакцій між різними типами ВПЛ. Більш того, денатурація VLP призводила до втрати протективних ефектів, що вказує на роль інтактних протективних епітопів в індукції антитілогенезу. Інший пізній ген, що кодує мінорний капсидний білок L2, також досліджувався як потенційний кандидат для профілактичної вакцинації. Було встановлено, що імунізація тварин гібридним рекомбінантним білком L2 індукує високий титр нейтралізуючих антитіл і захищає від експериментальної папіломавірусної інфекції. Таким чином, накопичені до цього часу дані свідчать про те, що капсидні білки ВПЛ є перспективними кандидатами для створення профілактичної вакцини (Nees М. et al. Papillomavirus type 16 oncogenes down-regulate expression of interferon-responsive genes and up 2 UA 98254 C2 5 10 15 20 25 30 35 40 45 50 55 60 regulate proliferation-associated and NF-kB-responsive genes in cervical Keratinocytes. J. Vir., 2001, 75, 4283-4296; Barnard R., Payne E. & McMillan N. A. The human papillomavirus E7 protein is able to inhibit the antiviral and anti-growth functions of interferon-a. Virology, 2000, 277, 411-419). Однак при використанні даних білків для терапевтичної імунізації за сталої, хронічної папіломавірусної інфекції не вдалося отримати хоч якогось значного ефекту. Певно, для лікувальної імунізації необхідна інша стратегія, а саме - індукція антиген-специфічної Т-клітинної імунної відповіді. Наявні дані дозволяють сподіватися, що стимуляція клітинної складової імунітету стосовно неструктурних вірусних білків може призвести до регресії пухлини, яка розвивається. Спостереження, що підтверджують обгрунтованість даного припущення, можна розділити на чотири групи: 1. Зустрічальність ВПЛ - асоційованих захворювань істотно вище серед хворих трансплантаційних клінік (Park J.S. et al. Inactivation of interferon regulatory factor-1 tumor suppressor protein by HPV E7 oncoprotein. Implication for the E7-medated immune evasion mechanism in cervical carcinogenesis. J. Biol. Chem. 2000, 275, 6764-6769) і ВІЛ-інфікованих, тобто у випадках з глибокими порушеннями клітинного імунітету (Frazer I., et al. Systemic administration of bacterial products induces host protective specific immunity to an epithelial tumour antigen. J. Immunol., 2000, 167, 6180-6187, Doan T. et al. Human Papillomavirus Type 16 E7 Oncoprotein Expressed in Peripheral Epithelium Tolerizes E7-Directed Cytotoxic T-Lymphocyte Precursors Restricted through Human (and Mouse) Major Histocompatibility Complex Class I Alleles. J. Virol., 1999, 73, 6166-6170). 2. Експериментальні тварини, імунізовані неструктурними білками ВПЛ, ефективно захищені від ВПЛ інфекції та розвитку неопластичних процесів (Gtannini S. et al. Cytokine expression in squamous intraepithelial lesions of the uterine cervix: implications for the generation of local immunosuppression. Clin. Exp. Immunol., 1998, 113, 183-189). 3. При спонтанній регресії генітальних бородавок спостерігається інтенсивна інфільтрація оточуючих тканин CD4+ (Т-хелпери) і CD8+ (цитотоксичними) T-клітинами (Ressing М.Е. et al. Human CTL epitopes encoded by human papillomavirus type 16 E6 and E7 identified through in vitro and in vivo immunogenicity studies of HLA-A'0201-binding peptides. J. Immunol., 1995, 154. 59345943). 4. Шкірні ушкодження, асоційовані з ВПЛ у хворих, які отримують імуносупресивну терапію, часто зникають при відміні курсу лікування (Lee S.J. et al. Both Е6 and E7 oncoproteins of human papillomavirus 16 inhibit IL-18-induced IFN-y production in human peripheral blood mononuclear and NK cells. J. Immunol., 2001, 167, 497-504). Представлені дані свідчать на користь того, що специфічна стимуляція T-клітинного імунітету може приводити до повної ремісії ВПЛ-асоційованих захворювань. У зв'язку з цим практичне завдання при створенні лікувальної вакцини зводиться до стимуляції Т-клітинного імунітету стосовно неструктурних білків ВПЛ, таких як білки Е6 і Е7. Основна вимога до терапевтичних вакцин полягає в тому, що вони повинні стимулювати клітинну складову специфічного імунітету і блокувати розвиток неопластичних процесів. Теоретично клітинна реакція повинна бути спрямована на вірусні та клітинні білки, які беруть участь у малігнізації епітелію. Однак, незважаючи на інтенсивні дослідження, досить мало відомо про клітинні мішені при пухлинній трансформації, тому більшість експериментальних вакцин спрямовано на продукти генів Е6 і Е7 ВПЛ, роль яких в онкогенезі доведено однозначно. Оскільки білки Е6 і Е7 конститутивно експресуються в більшості клітин РШМ і відсутні в нормальній тканині, ці вірусні онкобілки розглядаються як найбільш перспективні мішені при розробці вакцин для терапії ВПЛ-асоційованих пухлин (Straight S.W., Herman В. & McCance D.J. The E5 oncoprotein of human papillomavirus type 16 inhibits the acidification of endosomes in human keratinocytes. J. Virol., 1995, 69, 3185-3192). Мішенню для імунотерапії пухлин, як правило, є нормальні або мутантні клітинні білки, тоді як білки Е6 і Е7 є абсолютно чужорідними для імунної системи господаря, і в силу цього повинні бути дуже імуногенними (Przepiorka D. and Srivastava P., Heat Shock Proteins - Peptide complexes as immunotherapy for human cancer. Molecular medicine today, 1998, 11, 478-484). Наступна причина, по якій білки Е7 і Е6 розглядаються як перспективні кандидати для вакцинації, полягає в тому, що більшість пухлин в процесі імунотерапії можуть втрачати білки-мішені, вислизаючи, таким чином, від імунної атаки і зберігаючи при цьому свій трансформований статус, тоді розвиток РШМ однозначно обумовлено експресією білків Е6 і Е7, і їх нейтралізація призведе до регресії пухлини. Розробка пептидних вакцин стримується тією обставиною, що до теперішнього часу ще точно не визначені епітопи в білках Е6 і Е7, здатні індукувати цитотоксичний імунітет. Тому основні зусилля зосереджені на конструюванні білкових вакцин з використанням 3 UA 98254 C2 5 10 15 20 25 30 35 40 45 50 55 60 рекомбінантних білків Е7 і Е6. Останні дослідження показують, що кращою мішенню для створення вакцин є білок Е7 ВПЛ 16 і 18 типу для раку шийки матки, і Е7 ВПЛ 6 типу для анальних кондилом, оскільки він володіє найменшою структурною варіабельністю в різних географічних ізолятах ВПЛ і не має сплайсинг-варіантів (Swan D.C., Rajeevan M., Tortolero-Luna G., et al. Human papillomavirus type 16 E2 and E6/E7 variants, Gynecol. Oncol., 2005, 96, (3) 695700). Показано, що рекомбінантний білок Е7 ВПЛ 16 типу здатний індукувати цитотоксичний імунітет, і ін'єкція цього білка в поєднанні з різноманітними ад'ювантами посилює цитотоксичну реакцію. В останні роки особливо популярна нова стратегія підвищення імуногенності Е7, яка полягає у конструюванні гібридних білків. Зокрема, були вивчені імунологічні властивості гібридного білка, що містить повну послідовність білка теплового шоку Hsp70 і білка Е7 ВПЛ. Імуногенність та протективність такої конструкції була істотно вища, ймовірно за рахунок того, що Hsp 70 М. tuberculosis забезпечує ефективну презентацію антигенів. (Becker Т., Hartl R., and Wieland F., CD40, an extracellular receptor for binding and uptake of Hsp70-peptide complexes, J. Cell Biology, 2002, 158, 1277-1285). Відомо, що E7 синтезується в малих кількостях на репродуктивній фазі життєвого циклу ВПЛ. Проте його синтез значно зростає після інтеграції вірусної ДНК в клітинний геном, так як цей процес, як правило, супроводжується втратою гена Е2, що кодує репрессор гена Е7. Незважаючи на це, в організмі не спостерігається індукція специфічного клітинного імунітету щодо білка Е7. Деякі експериментальні моделі дозволяють прояснити дивну здатність онкобілка Е7 індукувати толерантність. Якщо шкірний трансплантат від трансгенної миші, що синтезує Е7 в епітеліальних клітинах, пересадити генетично спорідненій миші, то очікуване відторгнення трансплантата не відбувається. Якщо ж миші ввести стимулюючі утворення протизапальних цитокінів (убиті бактерії або ендотоксини), то настає швидке відторгнення трансплантата. Проте відторгнення трансплантата на фоні введення індукторів цитокінів відбувається тільки в період приживлення трансплантата, а повторна пересадка трансплантата тієї ж миші призводить до відторгнення без додаткової індукції цитокінів. Висловлюються різні припущення про механізми цього явища, однак, всі вони сходяться в одному - антигенпрезентуючі клітини, що поглинають Е7 в зоні цервікального каналу, з якихось причин не можуть пройти всі необхідні етапи дозрівання, мігрувати в лімфатичні вузли та індукувати Т-клітинну імунну відповідь у відношенні цього білка без додаткової стимуляції цитокінового каскаду (Gross G., Joblonska S., Pfister Η. Genital pappiloma-virus infections, 1989.; Frazer I. et al., Systemic administration of bacterial products induces host protective specific immunity to an epithelial tumour antigen, J. Immunol., 2001, 167, 6180-6187). Постійний синтез онкобілків необхідний для підтримки пухлинного фенотипу клітин. Очевидно, що поява в організмі клітин, що несуть чужорідні антигени (Е6 або Е7), має індукувати відповідні імунні реакції. Проте, хворі з цервікальними карциномами мають дуже низький рівень Т-клітинного імунітету щодо Е6 і Е7. При вакцинації цими білками також не спостерігається вираженої реакції, незважаючи на хороші характеристики імунного статусу. Ці спостереження, а також експерименти на тваринах показують, що онкобілок Е7, що синтезується в епітеліальних клітинах, здатний «вислизати» або навіть супресувати імунні реакції відносно себе. При створенні будь-якої протипухлинної вакцини необхідно вирішити кілька принципових завдань. По-перше, визначити мішень, проти якої необхідно індукувати імунні реакції організму. У разі ВПЛ інфекції на загальну думку такою мішенню є білок Е7 (Киселев В.И., Вирусы папилломы человека в развитии рака шейки матки. - М: Компания «Димитрейд График Групп®», 2004). Не менш важливим завданням є вибір ад'юванта для індукції сталого протективного імунітету і способу введення вакцинного препарату. Останній обставині приділяється велика увага, тому що виявилося, що від способу введення вакцини істотно залежить її ефективність. Як вже згадувалося, ВПЛ-інфекції вражають слизові як у випадку раку шийки матки, так і при РРП, і раку прямої кишки. Але розроблені до цього часу вакцинні препарати призначені для підшкірного введення, тобто націлені на специфічну стимуляцію системного імунітету та ігнорують мукозальні імунні реакції (US Patent 6338952 Bl 2002. Stress proteins and uses therefore; Патент РФ № 2229307, Пальцев Μ.Α., Северин Ε.С, Киселев О.И., Киселев В.И., Свешников П.Г., Композиция рекомбинантных белков, способ получения такой композиции, фармацевтический набор реагентов для иммунотерапии и профилактической вакцинации опухолевых заболеваний аногенитальной сферы, способ иммунотерапии и профилактической вакцинации на его основе). На основі американського патенту компанія "Nventa" розробляє 4 UA 98254 C2 5 10 15 20 25 30 35 40 45 50 55 60 ін'єкційну форму вакцинного препарату, що містить білок Е7, «злитий» з білком теплового шоку M.tuberculosis з молекулярною масою 65 kDa. З нашої точки зору істотним недоліком даної конструкції є вибір білка 65 kDa, оскільки є переконливі дані про можливість індукції аутоімунних реакцій у людини при введенні цього білка. Крім того, даний білок теплового шоку поступається за своїми ад'ювантними властивостями білку Hsp 70 M.tuberculosis (Zugel U. and Kaufmann S., Role of heat shock protein in protection from and pathogenesis of infectious deseases, Clinical microbiology reviews, 1999, 12, 1,19-39). У патенті РФ № 2229307 описана розробка вакцини на основі гібридних білків Е7 і Hsp 70 M.tuberculosis. Автори описують ін'єкційну лікарську форму, за допомогою якої вдається домогтися регресії пухлин, індукованих вірусом на експериментальних моделях з перевитими пухлинами. Продемонстрована ефективність вакцинації на цих моделях підтверджує правильність вибору білка Е7 як молекулярної мішені, проти якої індукуються імунні реакції. Однак при цервікальних дисплазіях, що розвиваються у жінок внаслідок хронічної папіломавірусної інфекції шийки матки, індукція системного імунітету не може гарантувати регресію процесів малігнізації, оскільки шийка матки має певну відособленість від системного імунітету в регуляції місцевих імунологічних реакцій. У розвитку анальних кондилом білок Е7 також відіграє основну роль у процесах малігнізації і придушенні місцевих імунологічних реакцій. Тому мукозальна аплікація вакцини повинна призводити до нейтралізації білка Е7 і індукувати регресію патологічних процесів. Крім того, в даний час стає очевидним, що досягти стійкого протективного імунітету за допомогою рекомбінантних вакцин можна тільки при багаторазовій імунізації. Це створює значні організаційні труднощі, так як пацієнту необхідно багаторазово відвідувати клініку для проведення вакцинації. У разі вагінальної вакцинації пацієнт може робити це самостійно. Інша проблема, пов'язана з ін'єкційною формою вакцинації, полягає в тому, що при повторному внутрішньом'язовому введенні чужорідного білка висока ймовірність анафілактичного шоку, що виключається при вагінальному або ректальному способі введення препарату. Нарешті, ще одна перевага мукозальних вакцин полягає в переважній індукції місцевого мукозального імунітету, що і потрібно при патологіях, що вражають слизові, як у випадку з папіломавірусною інфекцією. Як лікарська форма для мукозальної аплікації вакцин розглядаються супозиторії або "спреї", які дозволяють наносити на слизову вакцинний препарат у вигляді ліофілізованого порошку. Автори запропонованого винаходу на основі багаторічних досліджень папіломатозу прийшли до висновку, що оптимальна вакцина для терапії захворювань, асоційованих з вірусами папіломи людини, повинна відповідати таким вимогам: 1. Спосіб введення повинен передбачати стимуляцію місцевого адаптивного і вродженого імунітету, а саме: у разі РШМ - спосіб введення вагінальний; у разі раку прямої кишки - спосіб введення ректальний. 2. З урахуванням низької імуногенності білка Е7 у складі рекомбінантного білка, що є діючою речовиною вакцинного препарату, повинні бути присутніми амінокислотні послідовності білків, що володіють імуномодуляторною дією на утворення цитокінів та поліпшують презентацію антигену Е7. 3. Лікарська форма вакцинного препарату повинна містити інгредієнти, що підвищують адгезію на слизових і спорідненість білкових компонентів вакцини до антигенпрезентуючих клітин. З метою вирішення поставленого завдання в даній роботі були розроблені дві лікарські форми вакцини для імунотерапії ВПЛ - асоційованих патологій. Так, для терапії захворювань аногенітальної сфери розроблені мукозальні вакцини у вигляді супозиторіїв. Для терапії раку шийки матки були розроблені супозиторії, що містять як основні антигени гібридні білки Е7 тип 16 або тип 18, злиті з Hsp70 M.tuberculosis. Гібридний білок являє собою єдиний поліпептидний ланцюг, що складається з першого білка - Е7 ВПЛ типу 16 або 18. Як уже встановлено в даний час, онкобілок Е7 є основним індуктором процесів малігнізації епітеліальних клітин, інфікованих вірусами папіломи людини (Yin Ε.К. and Park J.S., The role of HPV E6 and E7 oncoproteins in HPV-associated cervical carcinogenesis, Cancer Res. Treat., 2005, 37, 6, 319-324). Крім онкогенного потенціалу білок Е7 має виражені імуносупресивні властивості. Саме завдяки білку Е7 трансформованим клітинам вдається "вислизати" від імунних реакцій організму (Kanoda S., Fahey L.M. and Kast W.M., Mechanism used by papillomaviruses to escape the host immune response, Current Cancer Drug Targets, 2007, 7, 79-89). Саме з цих причин білок Е7 є оптимальною мішенню для імунотерапії. Інша частина цього білка представлена білком теплового шоку з M.tuberculosis, володіє високою спорідненістю до антигенпрезентуючих клітин і є потужним індуктором синтезу цітокінів (Przepiorka D. and Srivastava P., Heat Shock Proteins peptide complexes as immunotherapy for human cancer. Molecular medicine today, 1998, 478-484; 5 UA 98254 C2 5 10 15 20 25 30 35 40 45 50 55 60 Becker Т., Hartl F.U., and Wieland F., CD40, an extractllular receptor for binding and uptake of Hsp70 - peptide complexes, The Journal of cell biology, 2002, 158, 7, 1277-1285; Srivastava P., Interaction of Heat ShocK Proteins with peptides and antigen presenting cells: chaperoning of the innate and adaptive immune responses, Annu. Rev. Immunology, 2002, 20, 395-425; Lachmann H.J., Strangeways L., Vyakarmam A. and Evans G. Raising antibodies by coupling peptides PPD and immunizing BCG-sensitized animals. Ciba Found. Symp., 1986, 119, 25-27; Del Giudici G. Hsp 70: a carrier molecule with built-in adjuvanticity, Experimentia, 1994 , 50, 1061-1066). У разі раку прямої кишки доцільно використовувати як антиген білок Е7 тип 6, який частіше за інші типи ВПЛ зустрічається при ураженні слизової прямої кишки. Проведені нами експериментальні дослідження імуногенності гібридних білків при їх аплікації на слизові показали, що в ізольованому вигляді ці білки не здатні індукувати виражений протективний імунітет у відношенні до білків Е7. Нами було зроблено припущення, що причина низької імуногенності поліпептидів полягає у їх нездатності сорбуватися на епітелії слизових, внаслідок чого вони можуть піддаватися швидкій протеолітичній деградації. Для вирішення цієї проблеми було вирішено використовувати комплекси білків з хітозаном. При експериментальній перевірці цього припущення виявилося, що комплекс гібридних білків з хітозаном, який має виражені мукоадгезивні властивості і сприяє активній сорбції антигенів на клітинній поверхні, ефективно індукує як гуморальну, так і клітинну складову імунітету у відношенні до білків Е7. Виходячи з цього, до складу вакцин як адгезивний засіб, що сприяє проникненню антигенів через слизові оболонки і сильний стимулятор неспецифічних імунних реакцій, включений хітозан у співвідношенні білок: хітозан 1-1 до 1-10. Оптимальне співвідношення білка і хітозану у складі лікарської форми було досліджено експериментально. Встановлено, що максимальний ефект в індукції імунологічних реакцій щодо антигенних детермінант білків спостерігався при використанні співвідношення в діапазоні 1-1 до 1-10. При зменшенні або збільшенні концентрації хітозану по відношенню до фіксованого дозування білка спостерігалося зниження ефективності індукції імунологічних реакцій. Для виготовлення супозиторіїв використовувалися такі фармакологічно прийнятні добавки: Вітепсол, масло какао або твердий жир типу А - як ліпофільна основа, поліетиленгліколі різної молекулярної маси - як гідрофільна основа, Ніпагін, ніпазол або аміноглікозиди - як антимікробний засіб, бурштинова кислота і бензоат натрію - як стабілізатори або консерванти, мертиолят та тіомерсал - як стабілізатори та антимікробні засоби (патент RU 2224542 С2 А61 К39/116, 9/02, А61Р 13/00; постанова уряду РФ № 885 від 02.08.1999 p.; патент RU 2150268 А61К9/02, А61К35/74, А61Р15/02; «Мертиолят и вакцинация против гепатита В», журнал «Медицина для всех», №1, 2001; Patrizi Α., Rizzoli L., Vincenzi С. et al. Sensitization to thimerosal in atopic children. Contact Dermatitis, 1999, 40 (2), 974-979). Даний винахід належить також до способів лікування захворювань, асоційованих з вірусом папіломи людини, які передбачають місцеве застосування мукозальної вакцини. Як варіант, для лікування дисплазії шийки матки, викликаної вірусом папіломи людини, використовується гібридний білок Е7 тип 16-Hsp70 або Е7 тип 18-Hsp70, у поєднанні з хітозаном у співвідношенні 1:0.1-10 і фармакологічно прийнятними добавками. Виготовлений супозиторій вводять інтравагінально. В залежності від стадій захворювання супозиторії призначають 2-4 рази з інтервалом у тиждень при легкій дисплазії шийки матки і 4-8 разів з інтервалом в один тиждень з дисплазіями 2-го і 3-го ступеня. Для лікування анальної кондиломи використовується гібридний білок Е7 тип 16-Hsp70 або Е7 тип 6-Hsp70, в поєднанні з хітозаном у співвідношенні 1:0,1-10 і фармакологічно прийнятними добавками. Виготовлений супозиторій вводять ректально. Супозиторії призначають на ніч з періодичністю раз на тиждень. Максимальний клінічний ефект досягається при призначенні 4-8 супозиторіїв. Регіональні варіанти вагінальних супозиторіїв для лікування PLUM З урахуванням особливостей географічного розподілу і для досягнення максимальної ефективності регіональні варіанти для лікування РШМ повинні містити такі комбінації рекомбінантних гібридних білків Е7 Hsp70 у складі вагінального супозиторію: 1. Глобальна пентавалентна вакцина на основі Е716, Е718, Е758, Е731, Е745, злитих з Hsp70; 2. Китайська тетравалентна вакцина на основі Е716, Е718, Е758, Е752, злитих з Hsp70; 3. Латиноамериканська тривалентна вакцина на основі Е716, Е718, Е731, злитих з Hsp70; 4. Африканська тривалентна вакцина на основі Е716, Е718, Е745, злитих з Hsp70; 5. Для решти світу (Європа, Північна Америка, Австралія) бівалентний варіант на основі Е716, Е718, злитих з Hsp70. Таким чином, запропонований винахід дозволяє багатократно підвищити ефективність 6 UA 98254 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікування захворювань, асоційованих з вірусом папіломи людини. Отриманий ефект досягається за рахунок переважної індукції місцевих імунологічних реакцій внаслідок мукозальної аплікації рекомбінантних білків у комплексі з хітозаном. Саме це поєднання активних компонентів вакцини забезпечує їх високу спорідненість до епітеліальних клітин слизових, інфікованих ВПЛ, активне розпізнавання антигенів імунною системою і, як наслідок, індукцію місцевого імунітету стосовно білків Е7, які відіграють ключову роль у розвитку патологічних процесів. Використання запропонованої мукозальної вакцини дозволяє значно знизити вартість лікування в порівнянні з відомими методиками лікування РШМ і РПК. Запропонована вакцина призначена для місцевого застосування, що дозволяє усунути небажані і вкрай небезпечні для життя пацієнта побічні ефекти ін'єкційних препаратів, наприклад, анафілактичний шок. Запропонований метод терапії значно спрощує лікувальний процес пацієнт може проходити курс лікування поза клінікою, самостійно вводячи препарат. Фігура 1. Динаміка сироваткової IgG імунної відповіді при різних способах імунізації мишей РГБ E76-Hsp70, Фігура 2. Величини мукозальної нормованої IgA антитільної відповіді при інтраназальній та підшкірній імунізації мишей РГБ E76-Hsp70, Фігура 3. Рівень секреції IFN-gamma (1) та IL-4 (2) лімфоцитами з пахових лімфовузлів (А) і селезінки (Б), стимульованими в культурі сумішшю рекомбінантних білків Е716 і Е718. Фігура 4. Рівень секреції IFN-gamma (І) і IL-4 (2) лімфоцитами з пахових лімфовузлів, стимульованими в культурі сумішшю рекомбінантних білків Е716 і Е76. ПРИКЛАДИ ЗДІЙСНЕННЯ ВИНАХОДУ Приклад № 1 Приготування вакцинних препаратів на основі рекомбінантних білків для мукозального застосування з хітозаном Рекомбінантні гібридні білки E711-Hsp70, E716-Hsp70, E718-Hsp70, E76-Hsp70 (РГБ) очищали з тілець включення шляхом солюбілізації у 8М сечовині з подальшою металохелатною та іонообмінною хроматографією до гомогенного стану. Ступінь чистоти білка контролювали за допомогою електрофорезу в 10% поліакриламідному гелі в денатуруючих умовах, концентрацію білка визначали за методом Лоурі, використовуючи бичачий сироватковий альбумін в якості стандарту. Перед приготуванням вакцинного препарату рекомбінантний гібридний білок (РГБ) піддавали діалізу для видалення консервантів і стабілізаторів проти фосфатно-сольового буферного розчину (PBS, рН7.2), розбавляли або концентрували до необхідної концентрації та проводили стерилізуючу фільтрацію. Після цих процедур розчини рекомбінантних білків змішували з розчином хітозану в різних пропорціях і використовували для виготовлення супозиторіїв. Приклад №2 Імунізація мишей і взяття проб Використовували дорослих самок мишей (вік 6-8 тижнів) лінії Balb/c (Розплідник РАМН «Столбовая») у кількості 5 штук на групу. Імунізацію проводили тричі з інтервалами в 4 тижні (028-56 день). При проведенні інтраназальної імунізації мишам вводили 20 мкл препарату РГБ з хітозаном (по 10 мкл в кожну ніздрю) за допомогою мікропіпетки під галотановим наркозом. Для вагінальної та ректальної імунізації за допомогою мікропіпетки вводили 10 мкг білка в комплексі з хітозаном в обсязі 20 мкл. Підшкірну імунізацію проводили в холку мишей шляхом ін'єкції 200 мкл суспензії РГБ з Alhydrogel. (Для підшкірної (s.c) вакцинації препарати РГБ адсорбували на 0.5% (вага/вага) гелі алюмінію гідроксиду (Alhydrogel, Brenntag Biosector, Данія) протягом ночі). В обох випадках доза РГБ на кожну імунізацію становила 10 мкг білка на одну мишу. Контрольні групи мишей були імунізовані аналогічним чином з використанням 0.5% (вага/об 'єм) розчину хітозану та 0.5% (вага/вага) розчину Alhydrogel для інтраназального та підшкірного способу введення, відповідно. Проби крові для визначення специфічних IgG брали з ретроорбітальної вени кожної миші за допомогою пастерівської піпетки в обсязі 0.1 мл через 10 днів після першої, другої і третьої імунізації. Після ретракції згустку сироватку відокремлювали низькошвидкісним центрифугуванням і зберігали при температурі -20C до дослідження в ΙΦΑ. Носоглоткові змиви для визначення специфічних IgA отримували через 14 днів після третьої імунізації. З цією метою мишей вбивали методом цервікальної дислокації, декапітували і промивали носоглотку з боку трахеї за допомогою 0.5 мл PBS. Носоглоткові змиви зберігали при температурі -20C до дослідження в ΙΦΑ. Для вивчення Т-клітинної імунної відповіді на рекомбінантні білки і пептидні епітопи мишей вбивали методом цервікальної дислокації через 14 днів після третьої імунізації і асептично витягували легені, селезінку і лімфатичні вузли 7 UA 98254 C2 5 10 15 20 25 30 35 40 45 50 55 60 середостіння. Культури лімфоцитів отримували шляхом акуратного механічного подрібнення тканин, лізису еритроцитів і триразового відмивання клітин низькошвидкісним центрифугуванням в середовищі RPMI 1640 з додаванням 10% фетальної сироватки, 20мМ Lглутаміну та антибіотиків. Приклад № З Порівняння специфічного IgG та IgA антитільної імунної відповіді при інтраназальній та підшкірній імунізації РГБ E76-Hsp70 Мишей імунізували РГБ E76-Hsp70 інтраназально та підшкірно відповідно до протоколу і дозування, описаним у прикладі №3. Середньогеометричні титри (СГТ) IgG і IgA антитіл, специфічних до рекомбінантного білка Е76, у сироватках і носоглоткових змивах, отриманих згідно з процедурою з прикладу №2, визначали за допомогою імуноферментного аналізу (ΙΦΑ). Для визначення сироваткових IgG на 96-лунковому планшеті іммобілізували рекомбінантний білок Е76 з розчину з концентрацією 5 мкг/мл в PBS протягом ночі, проводили титрування мишачих сироваток шляхом триразових послідовних розбавлень і вносили пероксидазний кон'югат козячих антитіл проти IgG (H) миші. Як субстрат використовували ТМБ, оптичну щільність (OD) реєстрували через 15 хв при довжині хвилі 450 нм. Титр специфічних IgG антитіл для кожної сироватки визначали за кінцевою точкою, яка відповідала розведенню сироватки з OD> 0.2. Результати наведені на фігурі 1. Фігура 1 відображує динаміку сироваткової IgG імунної відповіді при різних способах імунізації мишей РГБ E76-Hsp70: Група 1 - E76-Hsp70 + хітозан, інтраназально; Група 2 (контроль) - хітозан, інтраназально; Група 3 (контроль) - гідроксид алюмінію, підшкірно; Група 4 - E76-Hsp70 + гідроксид алюмінію, підшкірно. По осі ординат відкладено логарифм середнього геометричного титру IgG антитіл. Для визначення титру IgA в носоглоткових змивах використовували ІФА, аналогічний описаному вище, однак замість анти-lgG (H) кон'югату застосовували пероксидазний кон'югат козячих антитіл проти IgA (H) миші. Кінцеву точку титрування для кожного змиву визначали як найвище розведення зразка, при якому OD> 0.1. Для мінімізації варіацій, пов'язаних з процедурою отримання носоглоткових змивів, у кожному зразку визначали загальний вміст IgA за допомогою комерційного ІФА набору. У кінцевому підсумку величину мукозальної IgA імунної відповіді виражали як відношення титру специфічних до Е76 IgA антитіл до загального вмісту IgA (вираженого в мікрограмах) в одному і тому ж зразку. Результати наведені на фігурі 2. Фігура 2 показує величину мукозальної нормованої IgA антитільної відповіді при інтраназальній та підшкірній імунізації мишей РГБ Е711-Hsp70. Група 1 - E76-Hsp70 + хітозан, інтраназально; Група 2 (контроль) - хітозан, інтраназально; Група 3 (контроль) - гідроксид алюмінію, підшкірно; Група 4 - E76-Hsp70 + гідроксид алюмінію, підшкірно. Приклад №4 Порівняння специфічної Т-клітинної відповіді при інтравагінальній та підшкірній імунізації сумішшю РГБ E716-Hsp70 і E718-Hsp70 Використовували дорослих самок мишей (вік 8-10 тижнів) лінії Balb/c в кількості 5 штук на групу. Імунізацію проводили 3 рази з інтервалом 10 днів за схемою: 0-10-20 днів. Для інтравагінальної імунізації (i.vag.) мишам вводили 20 мкг суміші РГБ по 10 мкг E716-Hsp70 і E718-Hsp70, відповідно в 16 мкл 0.5% (вага/об'єм) розчину хітозану (Chitosan, Selectchemie AG, Швейцарія) за допомогою мікропіпетки в піхву. Підшкірну імунізацію (s.c.) проводили в холку мишей шляхом ін'єкції 200 мкл суспензії суміші РГБ (20 мкг) з 0.5% (вага/вага) гелем алюмінію гідроксиду (Alhydrogel, Brenntag Biosector, Данія). Контрольні групи мишей були імунізовані аналогічним чином з використанням 0.5% (вага/об'єм) розчину хітозану та 0.5% (вага/вага) розчину Alhydrogel для інтравагінального і підшкірного способу введення, відповідно. Через 14 днів після третьої імунізації мишей вбивали і асептично витягували селезінку та пахові лімфовузли. Культури лімфоцитів отримували шляхом акуратного механічного подрібнення тканин, лізису еритроцитів і триразового відмивання клітин низькошвидкісним центрифугуванням в середовищі RPMI 1640 з додаванням 10% фетальної сироватки, 20 мМ Lглутаміну та антибіотиків. Культури лімфоцитів, отримані з селезінки і пахових лімфовузлів мишей, імунізованих сумішшю РГБ E716-Hsp70 і E718-Hsp70 і контрольних груп, досліджували на предмет секреції інтерферону гамма (IFN-gamma) та інтерлейкіну 4 (IL-4) після стимуляції рекомбінантними білками Е716-Hsp70 і E718-Hsp70 за допомогою наборів ELISPOT (BD Biosciences, Oxford, Великобританія). Дані наведені на фігурі 3. Фігура 3 відображає рівень секреції IFN-gamma (1) та IL-4 (2) лімфоцитами з пахових 8 UA 98254 C2 5 10 15 20 25 30 35 40 45 лімфовузлів (А) і селезінки (Б), стимульованими в культурі сумішшю рекомбінантних білків Е716 і Е718. Мишей імунізували: Сірі стовпчики - E716-HSP70 + E718-HSP70 + хітозан, інтравагінально; Чорні стовпчики - хітозан, інтравагінально; Білі стовпчики - гідроксид алюмінію, підшкірно; Штриховані стовпчики - E716-HSP70 + E718-HSP-70 + гідроксид алюмінію, підшкірно. По осі ординат відкладено кількість цитокін-секретуючих лімфоцитів на 1 млн. клітин. Приклад №5 Порівняння специфічної Т-клітинної відповіді при ректальній та підшкірній імунізації сумішшю РГБ E716-Hsp70 і E76-Hsp70. Використовували дорослих самок мишей (вік 8-10 тижнів) лінії Balb/c в кількості 5 штук на групу. Імунізацію проводили 3 рази з інтервалом 10 днів за схемою: 0-10-20 днів. Для ректальної імунізації (iR) мишам вводили 20 мкг суміші РГБ по 10 мкг E716-Hsp70 і E76-Hsp70, відповідно в 16 мкл 0,5% (вага/об'єм) розчину хітозану (Chitosan, Selectchemie AG, Швейцарія) за допомогою мікропіпетки в пряму кишку. Підшкірну імунізацію (s.c.) проводили в холку мишей шляхом ін'єкції 200 мкл суспензії суміші РГБ (20 мкг) з 0,5% (вага/вага) гелем алюмінію гідроксиду (Alhydrogel, Brenntag Biosector, Данія). Контрольні групи мишей були імунізовані аналогічним чином з використанням 0.5% (вага/об'єм) розчину хітозану та 0.5% (вага/вага) розчину Alhydrogel для ректального і підшкірного способу введення, відповідно. Через 14 днів після третьої імунізації мишей вбивали і асептично витягували пахові лімфовузли. Культури лімфоцитів отримували шляхом акуратного механічного подрібнення тканин, лізису еритроцитів і триразового відмивання клітин низькошвидкісним центрифугуванням в середовищі RPMI 1640 з додаванням 10% фетальної сироватки, 20 мМ Lглутаміну та антибіотиків. Культури лімфоцитів, отримані з пахових лімфовузлів мишей, імунізованих сумішшю РГБ E716-Hsp70 і E76-Hsp70 і контрольних груп, досліджували на предмет секреції інтерферону гамма (IFN-gamma) та інтерлейкіну 4 (IL-4) після стимуляції рекомбінантними білками E716-Hsp70 і E76-Hsp70 за допомогою наборів ELISPOT (BD Biosciences, Oxford, Великобританія). Дані наведено на фігурі 4. Фігура 4 відображає рівень секреції IFN-gamma (1) та IL-4 (2) лімфоцитами з пахових лімфовузлів, стимульованими в культурі сумішшю рекомбінантних білків Е716 і Е76. Мишей імунізували: Сірі стовпчики - E716-HSP70 + E76-HSP70 + хітозан, ректально; Чорні стовпчики - хітозан, ректально; Білі стовпчики - гідроксид алюмінію, підшкірно; Штриховані стовпчики - E716-HSP70 + E76-HSP-70 + гідроксид алюмінію, підшкірно. По осі ординат відкладено кількість цитокін-секретуючих лімфоцитів на 1 млн. клітин. Приклад №6 Ад'ювантна дія Hsp70 M.tuberculosis на клітини імунної системи in vitro Незрілі дендритні клітини (ДК) отримували шляхом перфузії порожнистих кісток задніх кінцівок мишей лінії CBA за допомогою стерильного ізотонічного розчину за стандартною методикою. Клітини промивали тричі і культивували в матрицях з додаванням термоінактивованої фетальної сироватки KPC в середовищі RPMI 1640 (150 000 клітин/мл) протягом 48 годин без стимуляції, а також у присутності Hsp70 в концентрації 25 мкг/мл. Отримані в результаті центрифугування культуральні рідини аналізували на предмет продукції мишачих цитокінів за допомогою імуноферментних наборів фірми R&D Systems (США). Експресію диференцировочних маркерів ДК досліджували методом проточної цитофлюорометрії з використанням моноклональних антитіл виробництва фірми R&D Systems (США). Результати визначення продукції цитокінів (умовні одиниці) та диференцировочних маркерів ДК (% клітин) наведені в таблиці 1: 50 9 UA 98254 C2 Таблиця 1 Цитокіни IL-1 beta IL-2 IL-6 IL-10 IL-12 TNF-alpha IFN-gamma TGF-beta Диференціювальні маркери CD83 CD38 CD86 I-AK (MHC2) CD11C CD40 TLR2 TLR4 5 10 15 20 25 Незрілі ДК 513.8 0.0 0.0 0.0 51.6 29.0 14.6 286.5 Стимуляція Hsp 70, 20 мкг/мл, 48 год. 679.0 73 130.9 6.3 262.6 118.0 23,0 229.0 9.8±0.1 5.43±0,14 4.00±0.11 19.1±0.6 43.1±0.5 0.7±0.14 14.8±0.3 1.5±0.1 27.3±0.6 84.5±1.5 1.44±0.04 34.7±0.3 48.6±0.9 1.21±0.09 35.4±0.3 8.0±0.2 Наведені дані свідчать про те, що Hsp70 індукує в ДК вироблення прозапальних цитокінів: IL-1 beta, IL-6, IL-12 та TNF-alpha, що вказує на виражений ад'ювантний ефект Hsp70. Дослідження змін фенотипу ДК при стимуляції Hsp70 показало, що частка клітин, які експресують маркери зрілих ДК (CD38, CD40, CD83, молекули МНС2), зростає. З усього спектру маркерів зрілих ДК не підвищується експресія костимуляторних молекул CD86 і CD11c. Залишається невідомою також зміна рівня TLR2 і TLR4, більш типових для незрілих ДК. Приклад № 7 Виготовлення багатокомпонентних вагінальних супозиторіїв для лікування і профілактики вірусу папіломи людини Компоненти: 1) Розчин рекомбінантних білків, E716-Hsp70, E718-Hsp70, 2) Хітозан фірми TAI ZHOU CANDORLY BATCH № 06020301 ступінь деацетилювання 86% 3) Polyethylenglycol 1500 фірма APPLI CHEM CAS-NO: 25322-68-3 4) твердий жир типу А 5) вітепсол HW 6) TRIS фірми MP Biomedicals Inc. cat. №195605. Склад на 1 супозиторій: Розчин рекомбінантних білків E716-Hsp70, E718-Hsp70 (с = 1 0.1-0,5 мг/мл) в 0,01M TRIS мл Хітозан 0,00165 г-0,03 г Основа (вітепсол/твердий жир типу А) до 3,0 г Методика отримання супозиторіїв Супозиторії готували методом виливання. Розрахунок компонентів проводили на 100 супозиторіїв по 3,0 г. Розчин рекомбінантних білків Е7 16 і 18 типів (с = 1 мг/мл) у 0,01M TRIS 50 мл Хітозан 0,165 г ПЕГ 1500 45,0 г Масло какао 255,0 г До розчину рекомбінантних білків Е7 16 і 18 типів (с = 1 мг/мл) в 50 мл 0,01M TRIS додають 0,165 г хітозану та перемішують протягом 5-10 хвилин, потім фільтрують через паперовий фільтр (фільтр з синьою смугою). В отриманий після фільтрації розчин вводять попередньо розплавлений ПЕО 1500 і перемішують 5 хвилин. До суміші поступово додають попередньо 10 UA 98254 C2 5 10 15 20 25 30 35 розплавлену гідрофобну основу (вітепсол, жир типу А) і перемішують 30 хвилин. Отриману суміш розливають у попередньо охолоджені супозиторні форми і поміщають в холодильник при -4C. Приклад № 8 Виготовлення багатокомпонентних ректальних супозиторіїв для лікування і профілактики вірусу папіломи людини Компоненти: 1) Розчин рекомбінантних білків E7-16-Hsp70, Е7-6-Hsp70 2) Хітозан фірми TAI ZHOU CANDORLY BATCH № 06020301 ступінь деацетилювання 86% 3) Polyethylenglycol 1500 фірма APPLI CHEM CAS-NO: 25322-68-3 4) твердий жир типу А 5) вітепсол HW 6) Твін-80 до 5% 7) TRIS фірми MP Biomedicals Inc. cat. №195605. Склад на 1 супозиторій: Розчин рекомбінантних білків E716-Hsp70, E76-Hsp70 (с = 1 0,1-0,5 мг/мл) в 0,01M TRIS мл Хітозан 0,00165 г - 0,03 г Основа (вітепсол/твердий жир типу А) до 3,0 г Методика отримання супозиторіїв Супозиторії готували методом виливання. Розрахунок компонентів проводили на 100 супозиторіїв по 3,0 г. Розчин рекомбінантних білків Е7 16 і 18 типів (с = 1 мг/мл) у 0,01M TRIS 50 мл Хітозан 0,165 г ПЕГ 1500 45,0 г Масло какао 255,0 г До розчину рекомбінантних білків Е7 16 і 18 типів (с = 1 мг/мл) в 50 мл 0,01M TRIS додають 0,165 г хітозану та перемішують протягом 5-10 хвилин, потім фільтрують через паперовий фільтр (фільтр з синьою смугою). В отриманий після фільтрації розчин вводять попередньо розплавлений ПЕО 1500 і перемішують 5 хвилин. До суміші поступово додають попередньо розплавлену гідрофобну основу (вітепсол, жир типу А) і перемішують 30 хвилин. Отриману суміш розливають у попередньо охолоджені супозиторні форми і поміщають в холодильник при -4C. Приклад №9 Дослідження клінічної ефективності розробленої мукозальної вакцини у пацієнток з дисплазією шийки матки, зумовленої вірусами папіломи людини тип 16 і 18 Для клінічних досліджень були відібрані три групи пацієнток з діагнозом дисплазії шийки матки (CIN І) і (CIN II). Кожна група складалася з 10 чоловік. Діагноз дисплазія шийки матки був встановлений на підставі клінічного обстеження і лабораторного аналізу зразків епітелію шийки матки на носійство ВПЛ 16 і 18 типів. Кожній пацієнтці призначали курс лікування вагінальними супозиторіями різного складу 1 раз на тиждень протягом 4 тижнів. У ряді випадків курс лікування проводили протягом 8-12 тижнів, зберігаючи режим призначення препарату по 1 свічці на ніч раз на тиждень. Після завершення курсу лікування пацієнток обстежили за допомогою кольпоскопії, проводили морфологічні дослідження клітин шийки матки і лабораторний аналіз ПЦР на наявність ДНК ВПЛ 16 і 18 типів. 11 UA 98254 C2 Таблиця 2 Кількість пацієнтів з діагнозом CIN I-CIN II 10 10 10 5 10 15 20 25 30 35 Результати лікування (кількість пацієнтів) Призначення: вагінальні ПЦР Кліника Морфологія ДНК супозиторії, які ВПЛ містять Норма Патологія Норма Патологія Норма Патологія Рекомбінантні білки Hsp-E7-16, 8 2 8 2 7 3 Hsp-E7-18 + хітозан Рекомбінантні білки Hsp-E7-16, 4 6 4 6 3 7 Hsp-E7-18 Рекомбінантний 1 9 1 9 1 9 білок Hsp 70 Приклад №10 Дослідження клінічної ефективності розробленої мукозальної вакцини у пацієнтів з діагнозом кондиломи прямої кишки. Для клінічного дослідження було відібрано 20 пацієнтів проктологічного відділення з діагнозом "Рецидивуючі кондиломи прямої кишки". Пацієнти пред'являли скарги на болі при акті дефекації, сліди крові у випорожненнях. При візуальному огляді слизової прямої кишки виявлені кондиломи розміром 0.2-0.5 см, слизова запалена. У деяких хворих виявлені тріщини анального отвору. Пацієнтам призначена монотерапія ректальними супозиторіями, що містять описані інгредієнти по 1 свічці на ніч, один раз на тиждень протягом 4 тижнів. У ряді випадків курс лікування проводили протягом 8-12 тижнів, зберігаючи режим призначення препарату по 1 свічці на ніч раз на тиждень. Після проведеного курсу лікування у 16 пацієнтів наступило повне клінічне одужання, яке супроводжувалося зникненням кондилом і всіх ознак запального процесу. У 4 пацієнтів після проведеного лікування спостерігалося зменшення числа кондилом, відсутність ознак запалення. Запропонована мукозальна вакцина у вигляді ректальних супозиторіїв дуже ефективна при названих патологіях. ФОРМУЛА ВИНАХОДУ 1. Мукозальна вакцина проти захворювань, асоційованих з вірусом папіломи людини, яка містить в ефективній кількості гібридний білок, що складається з онкобілка Е7 вірусу папіломи людини, злитого з білком теплового шоку мікобактерій Hsp70, хітозан у співвідношенні з гібридним білком 1:0,1-10 і фармакологічні прийнятні для виготовлення супозиторіїв добавки. 2. Мукозальна вакцина за п. 1, яка відрізняється тим, що для лікування дисплазії шийки матки, викликаної вірусом папіломи людини, використовується гібридний білок Е7 тип 16-Hsp70 або Е7 тип 18-Hsp70. 3. Мукозальна вакцина за п. 1, яка відрізняється тим, що для лікування анальної кондиломи використовується гібридний білок Е7 тип 16-Hsp70 або Е7 тип 6-Hsp70. 4. Спосіб лікування захворювання, асоційованого з вірусом папіломи людини, що передбачає місцеве застосування мукозальної вакцини за будь-яким з пп. 1-3 у вигляді супозиторія. 5. Спосіб лікування дисплазії шийки матки, викликаної вірусом папіломи людини, що передбачає інтравагінальне введення ефективної кількості мукозальної вакцини за п. 2. 6. Спосіб лікування анальної кондиломи, що передбачає ректальне введення ефективної кількості мукозальної вакцини за п. 3. 12 UA 98254 C2 13 UA 98254 C2 14 UA 98254 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюMucosal vaccine for immune therapy of diseases conditioned by human papilloma viruses
Автори англійськоюKiselev, Vsevolod Ivanovich, Sveshnikov, Petr Georgievich, Paltsev, Mikhail Alexandrovich
Назва патенту російськоюМукозальная вакцина для иммунотерапии заболеваний, обусловленных вирусами папилломы человека
Автори російськоюКиселев Всеволод Иванович, Свешников Петр Георгиевич, Пальцев Михаил Александрович
МПК / Мітки
МПК: A61K 39/39, A61P 31/12, A61P 35/00, C12N 15/37, C12N 15/62, A61K 39/12, A61K 9/02
Мітки: захворювань, мукозальна, вірусами, імунотерапії, папіломи, зумовлених, людини, вакцина
Код посилання
<a href="https://ua.patents.su/17-98254-mukozalna-vakcina-dlya-imunoterapi-zakhvoryuvan-zumovlenikh-virusami-papilomi-lyudini.html" target="_blank" rel="follow" title="База патентів України">Мукозальна вакцина для імунотерапії захворювань, зумовлених вірусами папіломи людини</a>
Попередній патент: Спосіб отримання та відбору антивидових моноклональних антитіл
Наступний патент: Газорозрядна електронна гармата
Випадковий патент: Спосіб профілактики та лікування отруєнь гербіцидами групи симтриазину