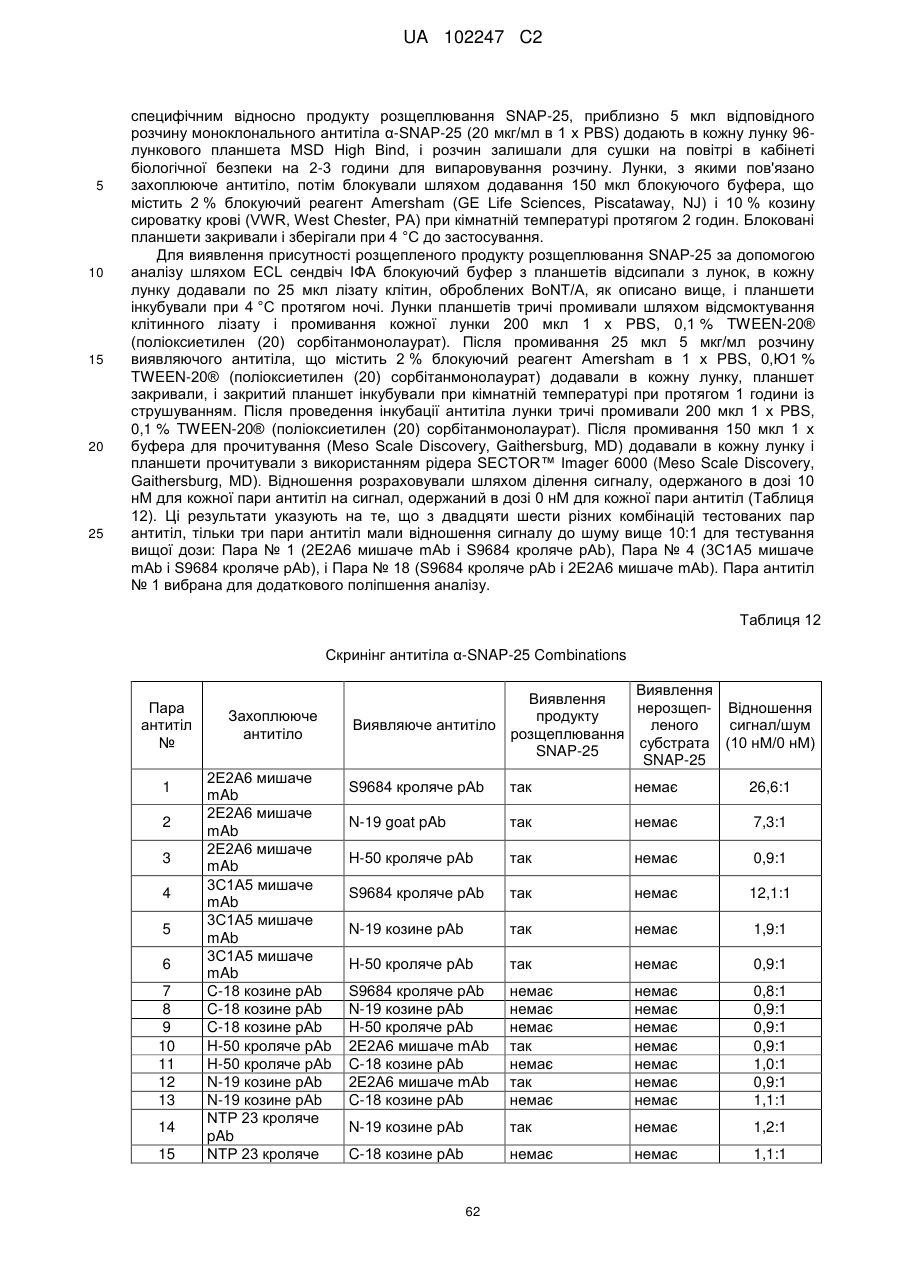
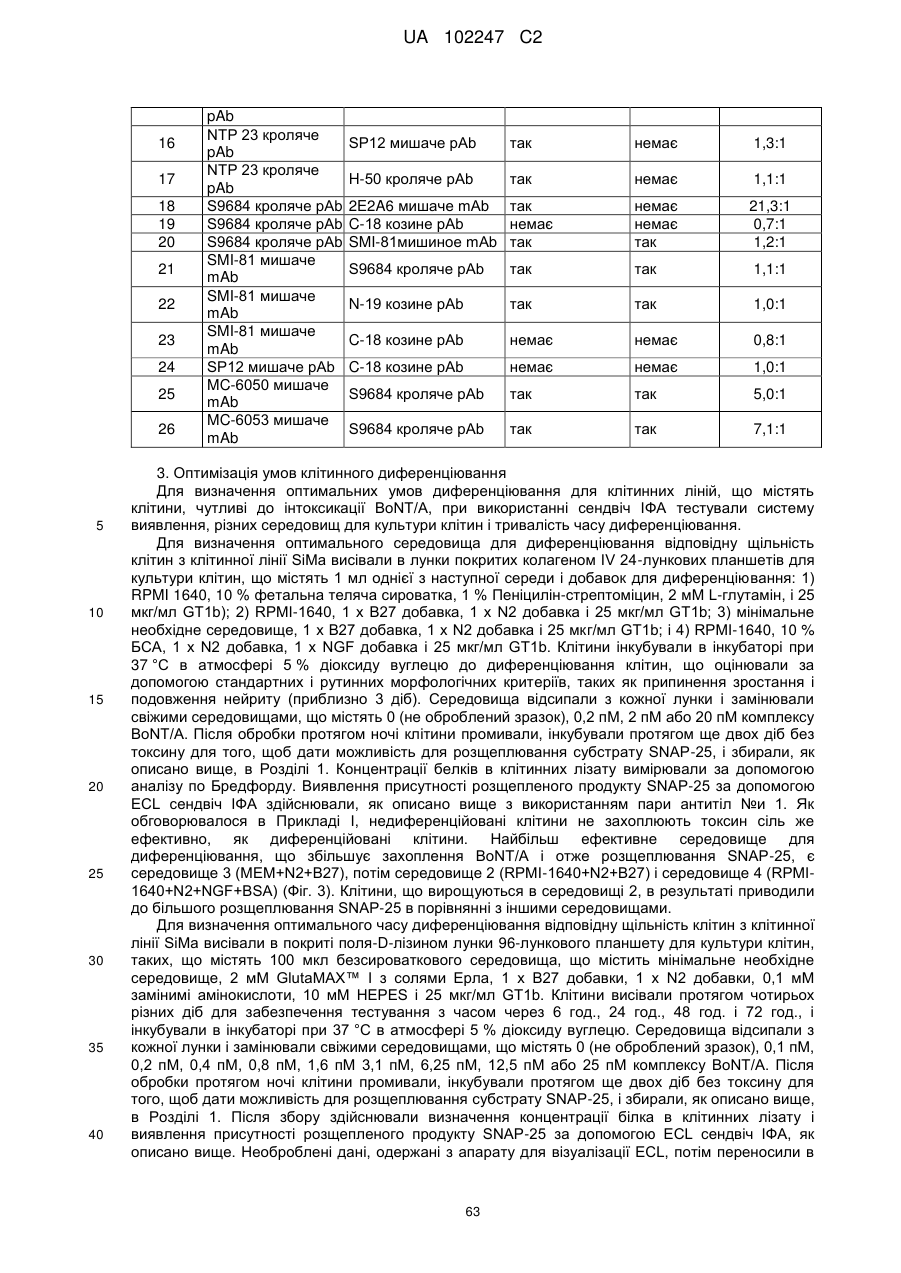
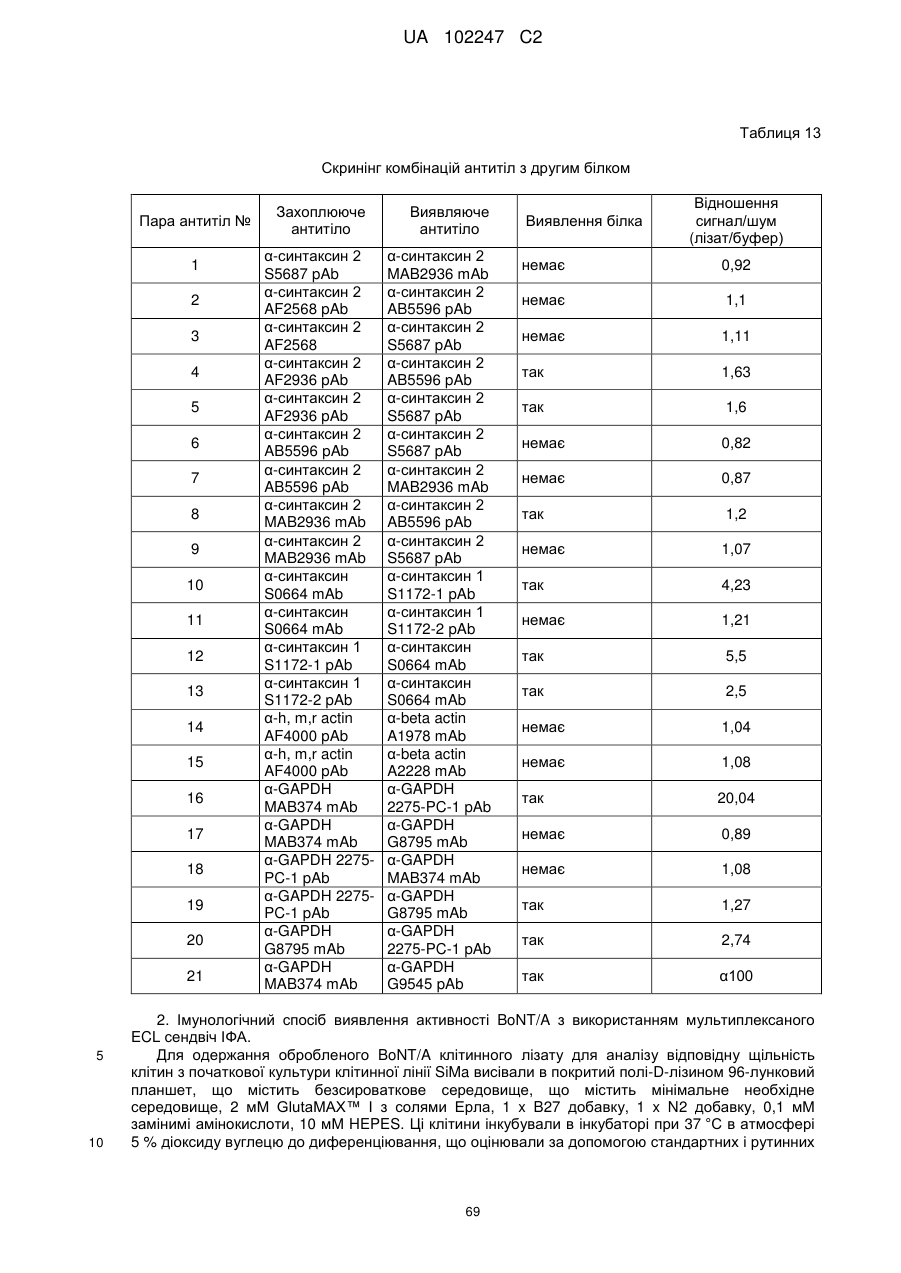
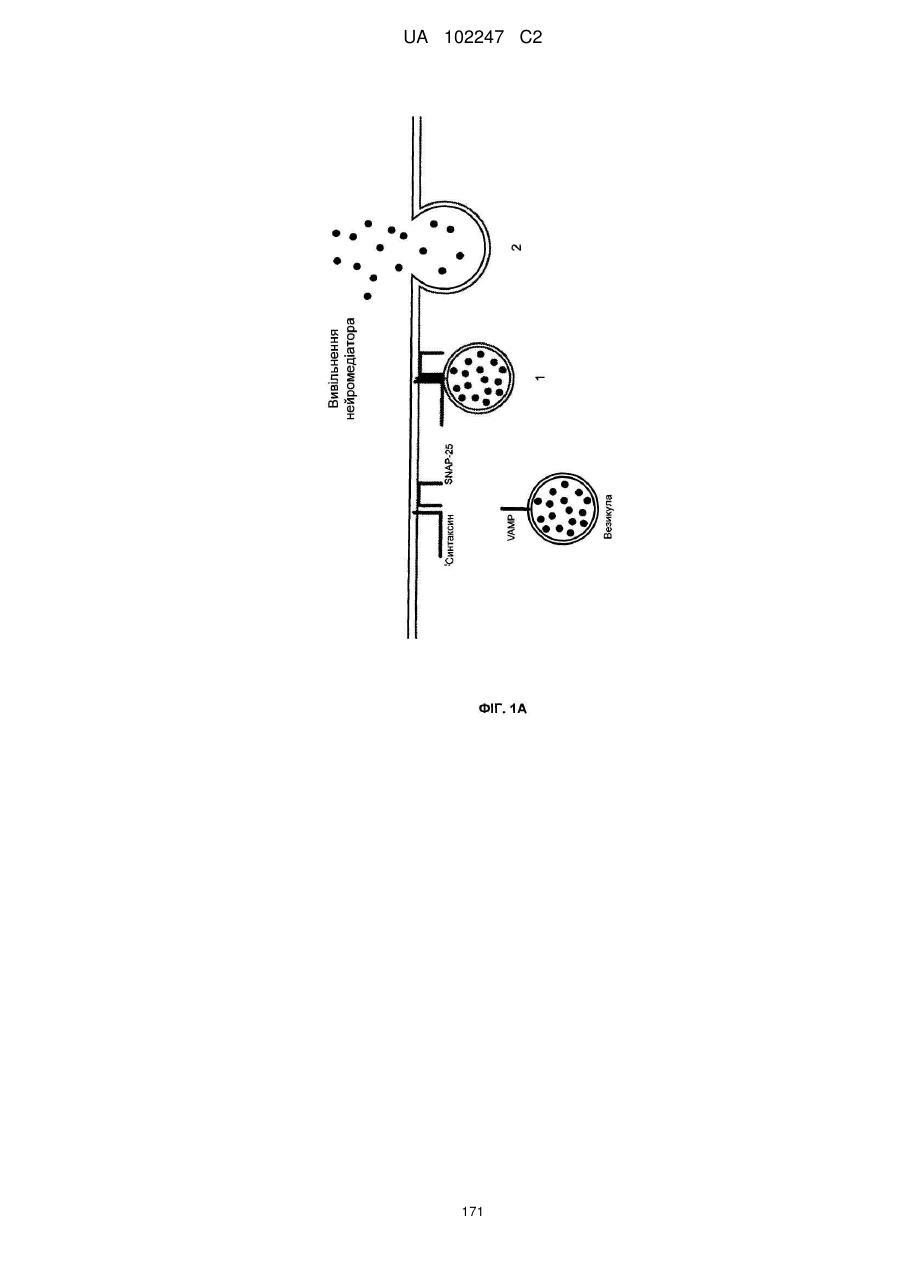
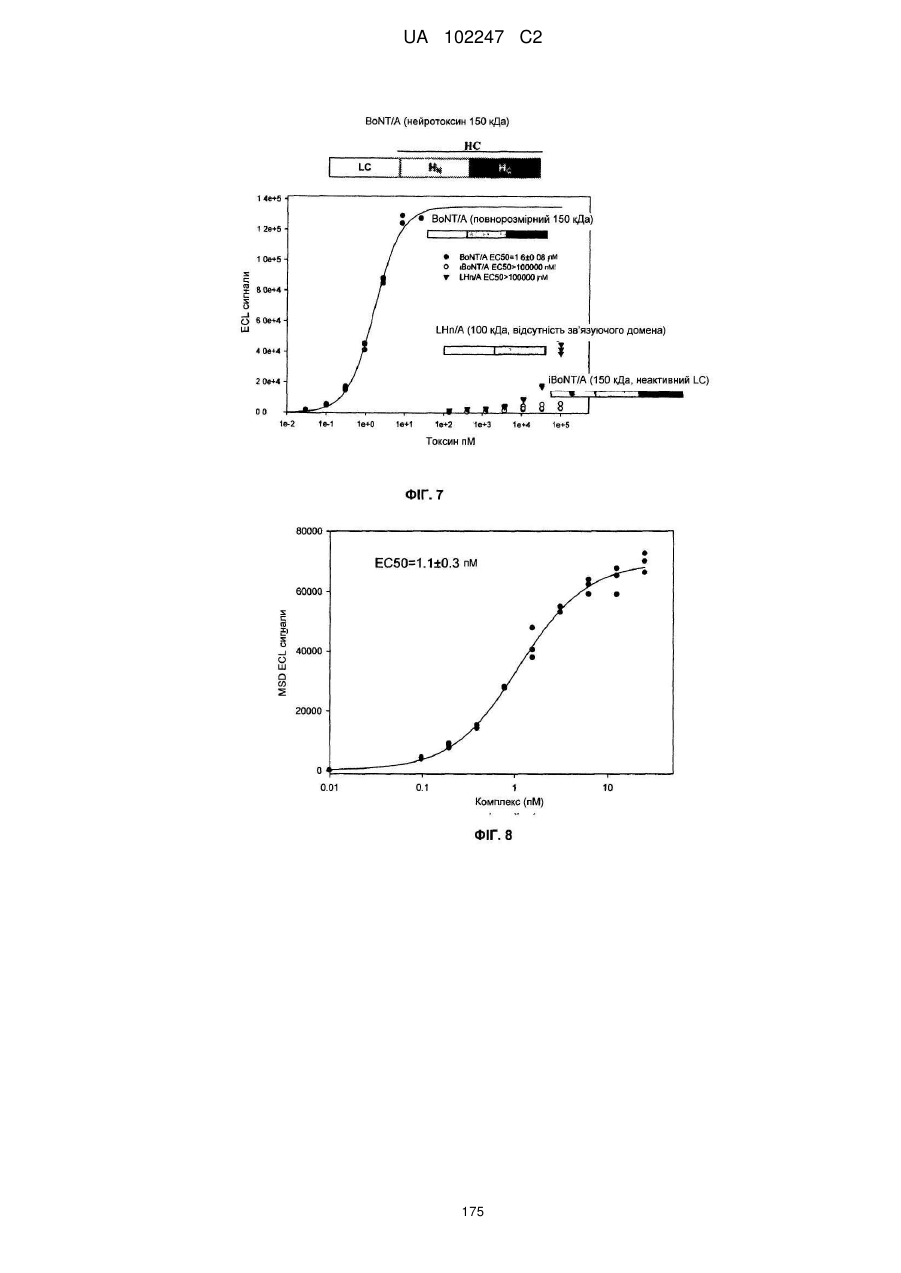
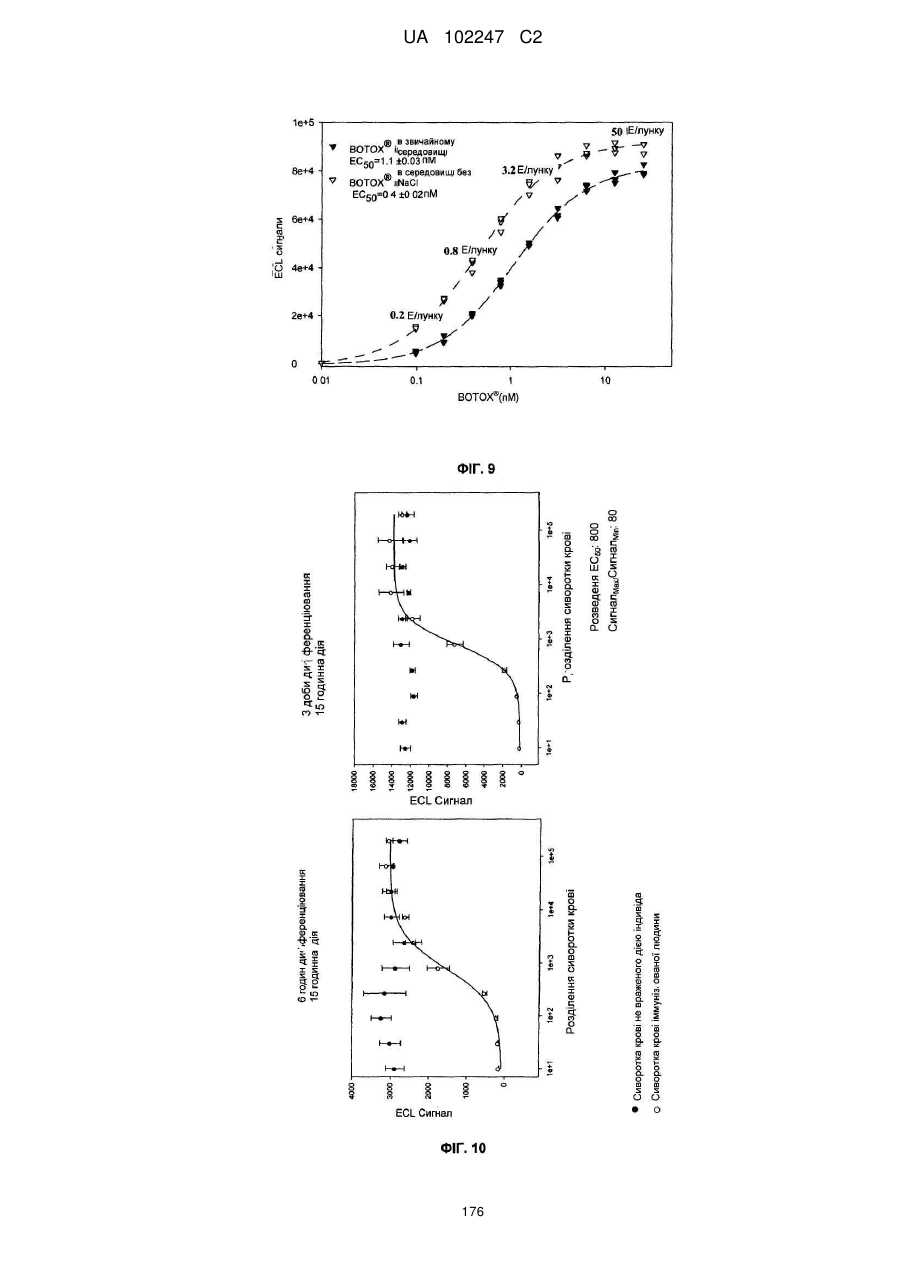
Імунологічні аналізи активності ботулінічного токсину серотипу а
Номер патенту: 102247
Опубліковано: 25.06.2013
Автори: Аокі Кей Роджер, Вонг Ліна С., Ванг Йоан, Фернандес-Салас Естер, Ходгес Д., Діан, Герей Паттон Е.
Формула / Реферат
1. Композиція, що містить носій, гнучкий лінкер і антиген SNAP-25, де гнучкий лінкер містить щонайменше три амінокислоти, і антиген SNAP-25 містить SEQ ID NO: 148.
2. Композиція за п. 2, яка відрізняється тим, що амінокислотна послідовність гнучкого лінкера і антигену SNAP-25 є SEQ ID NO: 38.
3. Виділене антитіло a-SNAP-25, яке відрізняється тим, що виділене антитіло a-SNAP-25 зв'язується з епітопом, що містить С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A продукту розщеплювання SNAP-25;
де антитіло a-SNAP-25 має константу швидкості асоціації для епітопа, що не містить С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A продукту розщеплювання SNAP-25, складову менше 1 × 101 М-1 с-1; і
де антитіло a-SNAP-25 має рівноважну константу дисоціації для епітопа, складову менше 0,450 нМ.
4. Виділене антитіло a-SNAP-25 за п. 3, яке відрізняється тим, що епітоп є SEQ ID NO: 32.
5. Виділене антитіло a-SNAP-25, що містить:
а) варіабельну область важкого ланцюга, що містить: SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 80 або SEQ ID NO: 82; і
б) варіабельну область легкого ланцюга, що містить: SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90 або SEQ ID NO: 92.
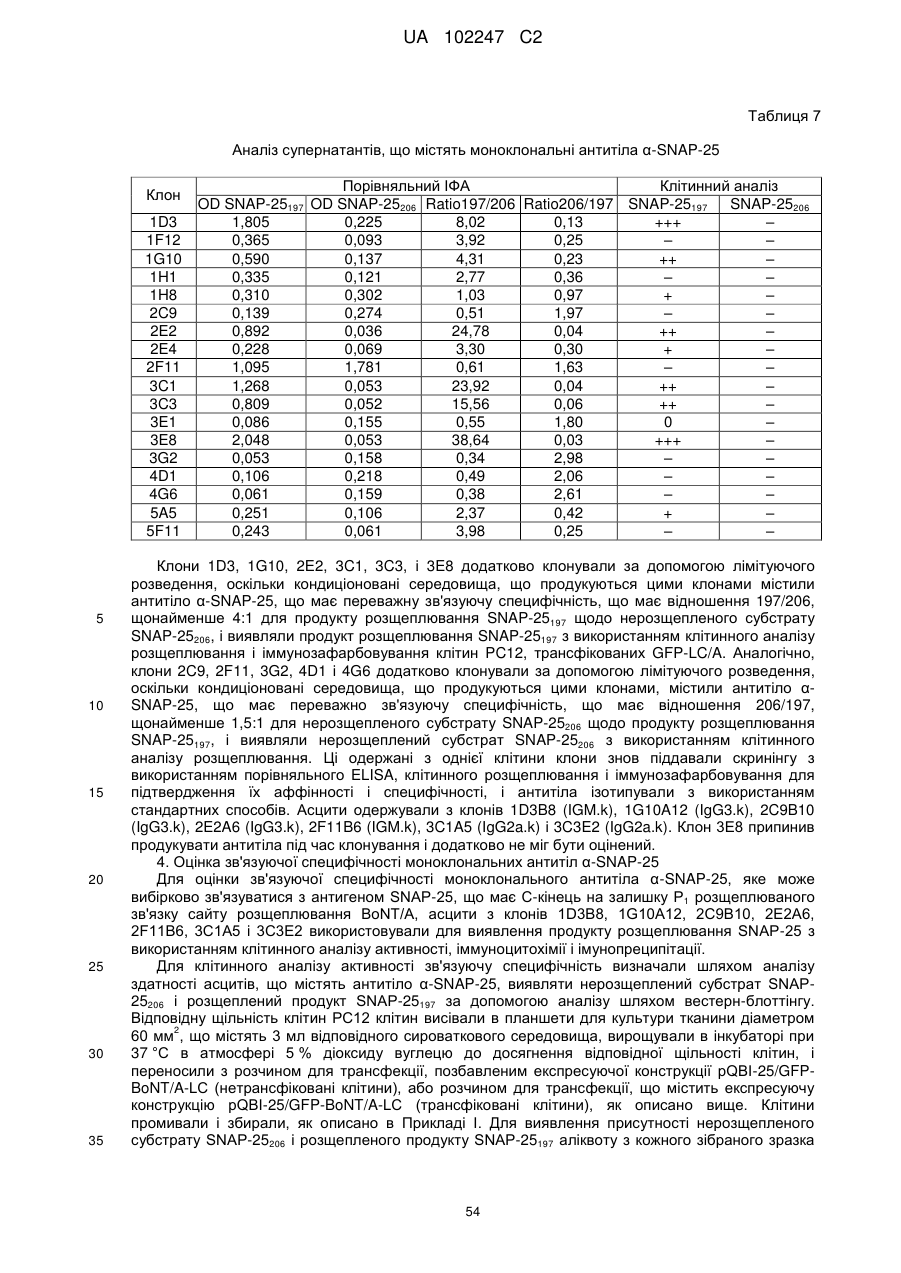
6. Виділене антитіло a-SNAP-25, що містить:
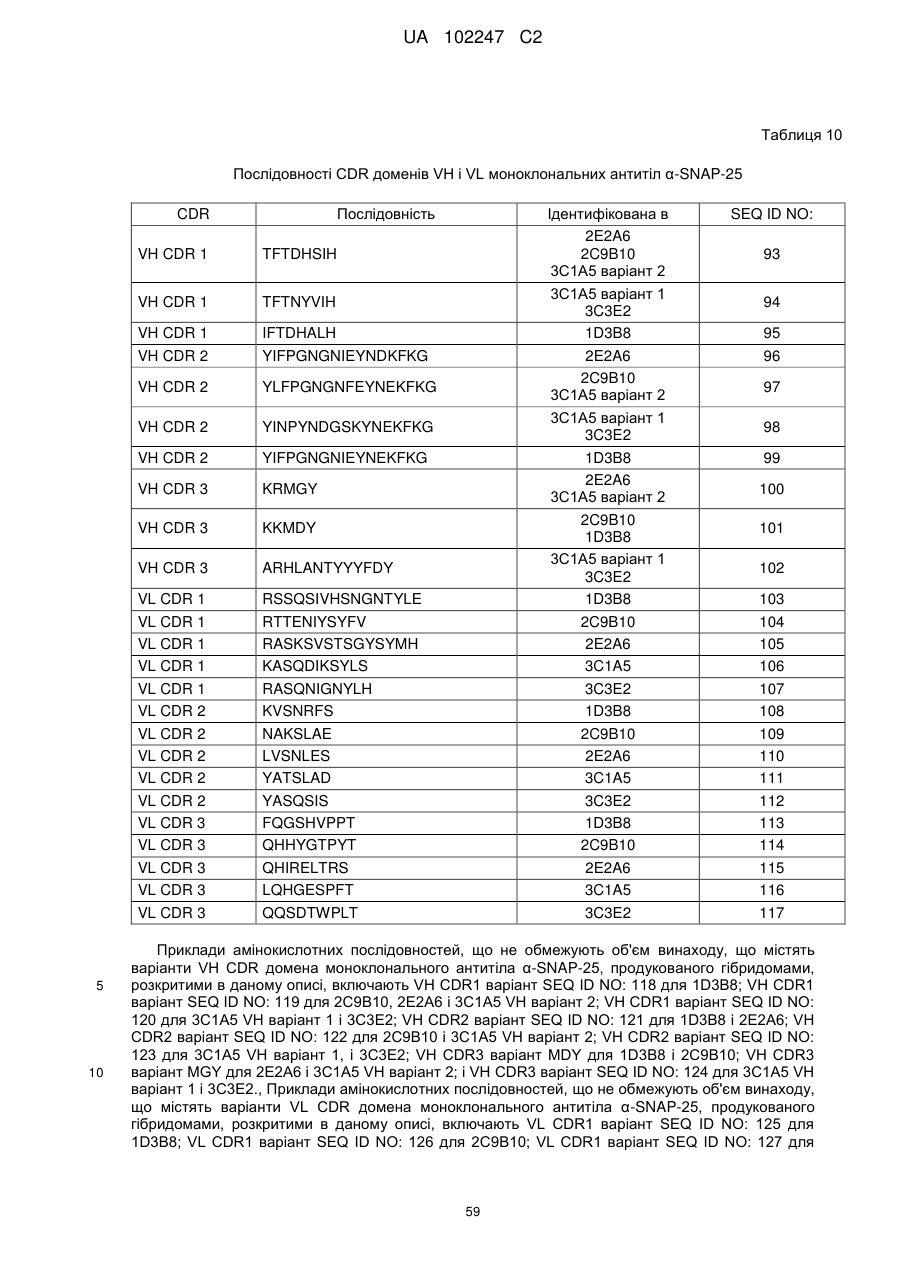
а) варіабельну область важкого ланцюга, що містить: SEQ ID NO: 93, SEQ ID NO: 121 або SEQ ID NO: 100; і
б) варіабельну область легкого ланцюга, що містить: SEQ ID NO: 105, SEQ ID NO: 110 або SEQ ID NO: 115.
7. Виділене антитіло a-SNAP-25, що містить щонайменше VH CDR3 з SEQ ID NO: 100, VH CDR3 з SEQ ID NO: 101 або VH CDR3 з SEQ ID NO: 102.
8. Спосіб виявлення активності BoNT/A, що включає стадії:
а) обробки клітини із стабільної клітинної лінії зразком, що містить BoNT/A, де клітина із стабільної клітинної лінії чутлива до інтоксикації BoNT/A в концентрації BoNT/A приблизно 500 пМ або менше;
б) виділення з обробленої клітини компонента SNAP-25, що містить продукт розщеплювання SNAP-25, що має С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A;
в) приведення в контакт компонента SNAP-25 з антитілом a-SNAP-25, пов'язаним з твердофазним носієм,
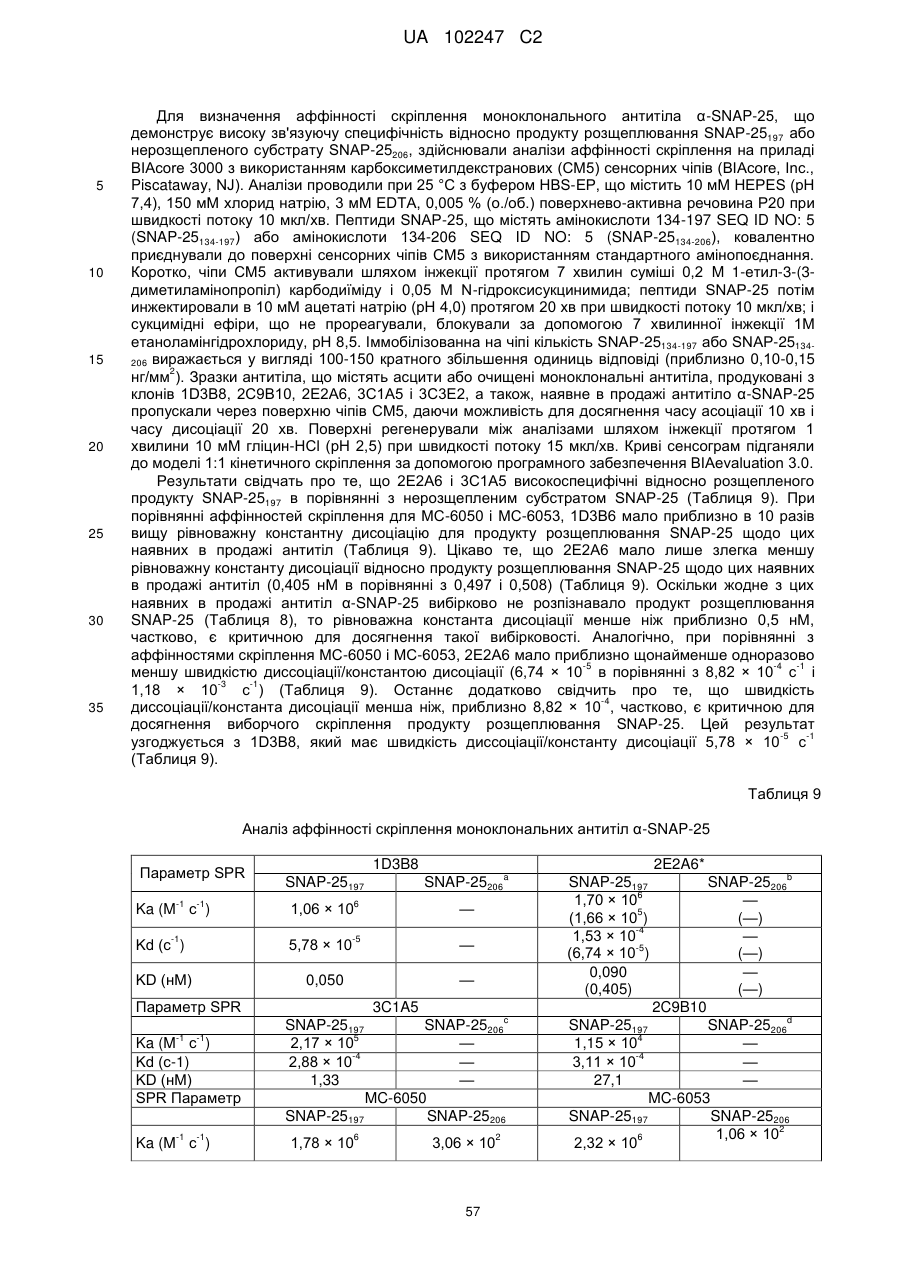
де антитіло a-SNAP-25 зв'язується з епітопом, що містить С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A продукту розщеплювання SNAP-25, де антитіло a-SNAP-25 має константу швидкості асоціації для епітопа з SNAP-25, що не містить С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A продукту розщеплювання SNAP-25, складову менше 1 × 101 М-1 с-1; і антитіло a-SNAP-25 має рівноважну константу дисоціації для епітопа,складову менше 0,450 нМ;
г) виявлення наявності комплексу антиген-антитіло, що містить антитіло a-SNAP-25 і продукт розщеплювання SNAP-25, що має С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A;
де виявлення за допомогою комплексу антиген-антитіло є показником активності BoNT/A.
9. Спосіб за п. 8, який відрізняється тим, що продукт розщеплювання SNAP-25 є SNAP-25197.
10. Спосіб за п. 8, який відрізняється тим, що присутність комплексу антиген-антитіло виявляють з використанням сендвіч ІФА.
11. Спосіб за п. 8, який відрізняється тим, що спосіб має відношення сигналу до шуму на нижній асимптоті щонайменше 3:1 і відношення сигналу до шуму на верхній асимптоті щонайменше 10:1.
12. Спосіб за п. 8, який відрізняється тим, що зразок містить максимально 100 пМ BoNT/A.
13. Спосіб за п. 8, який відрізняється тим, що клітина із стабільної клітинної лінії чутлива до інтоксикації BoNT/A в концентрації BoNT/A приблизно 100 пМ або менше.
14. Спосіб за п. 8, який відрізняється тим, що спосіб здійснюють в моноплексному варіанті або мультиплексному варіанті.
15. Спосіб визначення імунорезистентності до BoNT/A у ссавця, що включає стадії:
а) додавання BoNT/A до тестованого зразка, одержаного у ссавця, тестованого на наявність або відсутність антитіл, нейтралізуючих a-BoNT/A;
б) обробки клітини із стабільної клітинної лінії тестованим зразком, де клітина із стабільної клітинної лінії чутлива до інтоксикації BoNT/A;
в) виділення з оброблених клітин компонента SNAP-25, що містить продукт розщеплювання SNAP-25, що має С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A;
г) приведення в контакт компонента SNAP-25 з антитілом a-SNAP-25, пов'язаним з твердофазним носієм;
де антитіло a-SNAP-25 зв'язується з епітопом, що містить С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A продукту розщеплювання SNAP-25, де антитіло a-SNAP-25 має константу швидкості асоціації для епітопа з SNAP-25, що не містить С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A продукту розщеплювання SNAP-25, складову менше 1 × 101 М-1 с-1; і антитіло a-SNAP-25 має рівноважну константу дисоціації для епітопа, складову менше 0,450 нМ;
д) виявлення наявності комплексу антиген-антитіло, що містить антитіло a-SNAP-25 і продукт розщеплювання SNAP-25, що має С-кінцевий глутамін розщеплюваного зв'язку сайта розщеплювання BoNT/A;
e) повторення стадій б-д з негативним контрольним зразком замість тестованого зразка, де негативний контрольний зразок містить BoNT/A і сироватку, про яку відомо, що вона не містить нейтралізуючі антитіла a-BoNT/A; і
ж) порівняння кількості комплексу антиген-антитіло, виявленого на стадії д, з кількістю комплексу антиген-антитіло, виявленого на стадії e,
де виявлення меншої кількості комплексу антиген-антитіло, виявленого на стадії д, в порівнянні з кількістю комплексу антиген-антитіло, виявленого на стадії e, є показником присутності нейтралізуючих антитіл a-BoNT/A.
16. Спосіб виявлення активності ботулінічного токсину серотипу А (BoNT/A) у зразку, який відрізняється тим, що спосіб включає наступні стадії:
а) приведення в контакт клітини із стабільної клітинної лінії експресії SNAP-25 поліпептиду, що містить переважно щонайменше фрагмент людського SNAP-25, що містить SEQ ID NO: 5, що розщеплюється на BoNT/A зразком, що можливо містить BoNT/A, де стабільна клітинна лінія чутлива до інтоксикації BoNT/A в концентрації BoNT/A приблизно 500 пМ або менше на літр культурального середовища, як показано ферментативним розщепленням вказаного SNAP-25 поліпептиду BoNT/A з отриманням фрагмента вказаного SNAP-25 поліпепдиту, що містить С-кінець амінокислотної послідовності SEQ ID NO: 38;
б) виділення поліпептидів з клітини;
в) приведення в контакт поліпептидів з моноклональним антитілом, що специфічно зв'язується з пептидом SEQ ID NO: 38, де вказане специфічно зв'язується з епітопом, що містить вказаний фрагмент вказаного SNAP-25 поліпептиду, що містить С-кінець амінокислотної послідовності SEQ ID NO: 38 з рівноважною константою дисоціацією, зі складовою менше 0,450 нМ, і де вказане антитіло має константу швидкості асоціації для епітопа з інтактним SNAP-25 поліпептидом, що містить SEQ ID NO: 5, що має складову менше 1 × 101 М-1 с-1; та
г) виявлення наявності комплексу антиген-антитіло, що містить антитіло та фрагмент вказаного SNAP-25 поліпептиду, що містить С-кінець амінокислотної послідовності SEQ ID NO: 38, де висока кількість комплексу антиген-антитіло виявлена висока кількість ВоМТ/А у зразку.
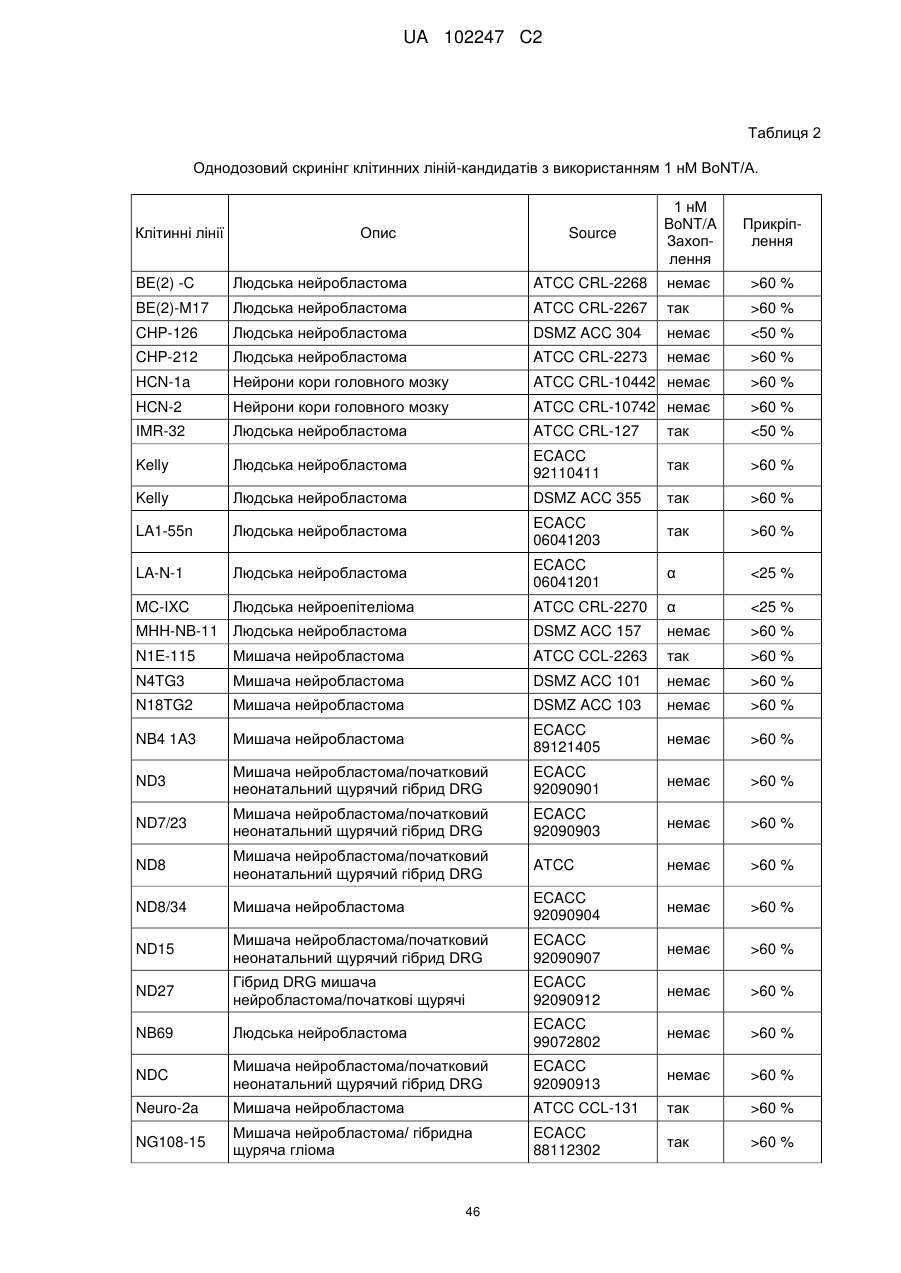
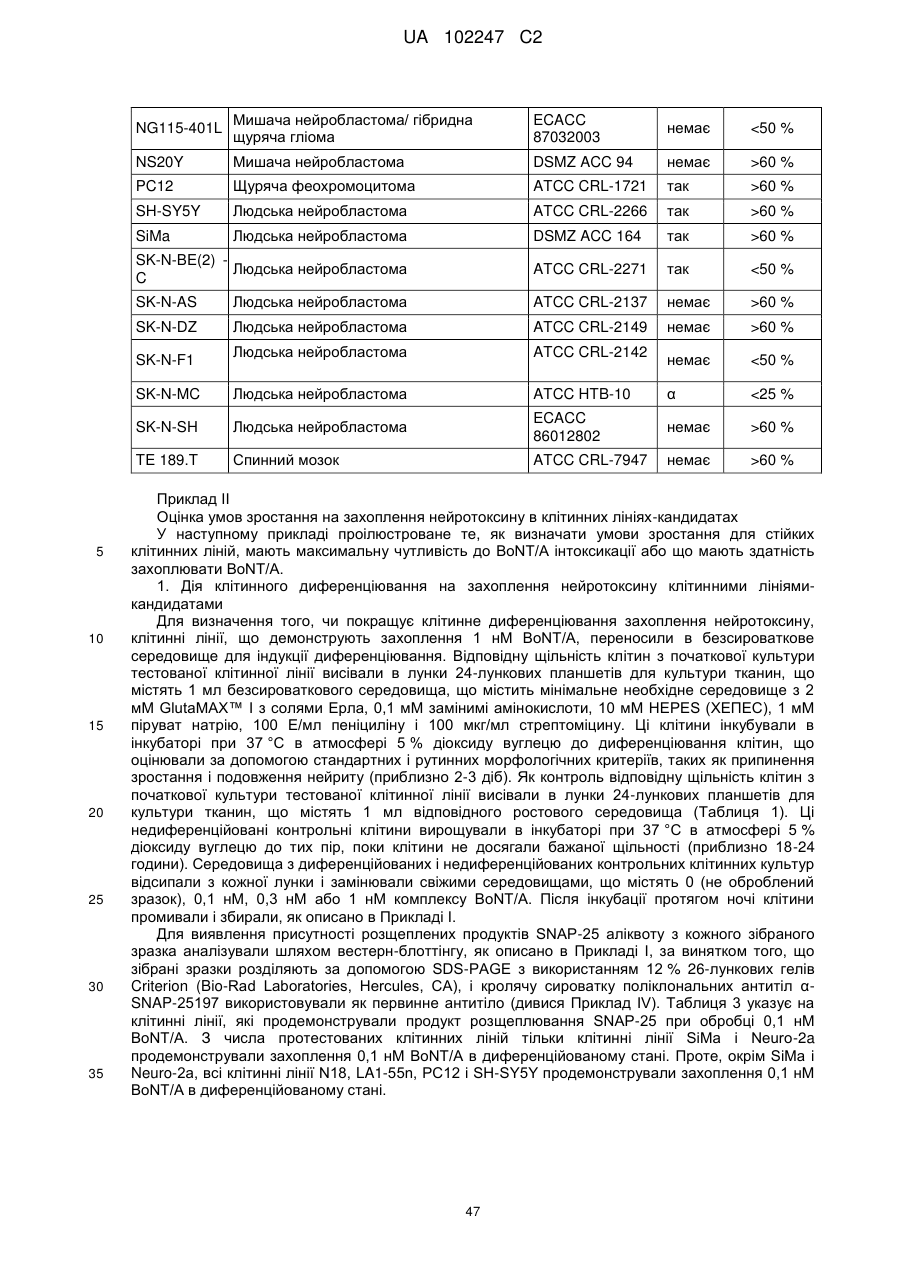
Текст
Реферат: Винахід стосується розкриття композиції SNAP-25, способу одержання антитіл -SNAP-25, які зв'язуються з епітопом, що містить С-кінець на залишку Р1 розщеплюваного зв'язку сайта розщеплювання BoNT/A продукту розщеплювання SNAP-25, антитіл -SNAP-25, які зв'язуються з епітопом, що містить С-кінець на залишку Р1 розщеплюваного зв'язку сайта розщеплювання BoNT/A продукту розщеплювання SNAP-25, способів виявлення активності BoNT/A і способів виявлення нейтралізуючих антитіл -BoNT/A. UA 102247 C2 (12) UA 102247 C2 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 У даній заявці на патент заявлений пріоритет відповідно до 35 U.S.C. (Збірка законів США) § 119(e) щодо попередньої заявки на патент США № 61/036723 поданої 14 березня 2008 року, яка включена тут шляхом посилання. Здатність клостридіальних токсинів, таких як, наприклад, ботулінічні нейротоксини (BoNTs), BoNT/A, BoNT/B, BoNT/C1, BoNT/D, BoNT/E, BoNT/F і BoNT/G і правцевого нейротоксину (TENT) інгібувати нейрональне проведення широко використовується в терапевтичних і косметичних застосуваннях, наприклад William J. Lipham, Cosmetic and Clinical Applications of Botulinum Toxin (Slack, Inc., 2004). Клострідіальні токсини, наявні в продажі у вигляді фармацевтичних композицій, включають препарати BoNT/A, такі як, наприклад BOTOX® (Allergan, Inc., Irvine, CA), DYSPORT®/RELOXIN®, (Ipsen Ltd., Slough, England), PURTOX® (Mentor Corp., Santa Barbara, CA), XEOMIN® (Merz Pharmaceuticals, GMBH., Frankfurt, Germany), NEURONOX® (Medy-Tox, Inc., Ochang-myeon, South Korea), BTX-A (Biogen-tech Ltd., University, Yantai, Shandong, China); і препарати BoNT/B, такі як, наприклад MYOBLOC®/NEUROBLOC® (Solstice Neurosciences, Inc., South San Francisco, CA). Як приклад, BOTOX® в даний час схвалений в США для лікування шийної дистонії у дорослих людей для зменшення тяжкості аномального положення голови і болю в шиї, що асоціюються з шийною дистонією; для лікування важкої первинної пахвової пітливості, яка не адекватно управляється за допомогою місцевих агентів; і для лікування косоокості і блефароспазму, що асоціюються з дистонією, включають доброякісний ессенціальний блефароспазм або розлади VII нерва у пацієнтів у віці від 12 років. В даний час біоаналіз LD50 (середньої летальної дози) у мишей, тест на летальність, залишається "золотим стандартом", використовуваним всіма фармацевтичними виробниками для виразу сили їх препаратів. S. S. Arnon et al., JAMA 285: 1059-1070 (2001). Фактично, одиниці на ярликах фармацевтичних препаратів є одиницями LD50, одержаними на мишах, і кількість тварин, необхідних для одержання статистично значущих даних LD50, є великою. Перевага біоаналізу LD50 на мишах полягає в тому, що він вимірює всі стадії, необхідні для захоплення ботулінічного токсину (наприклад, пов'язання токсину з рецептором клітинної поверхні, інтерналізацію комплексу токсин-рецептор, транслокація легкого ланцюга в цитоплазму, розщеплювання легким ланцюгом субстрату), замість визначення активності тільки для частини цього процесу інтоксикації, такого як, наприклад аналізи in vitro, які вимірюють тільки ферментативну активність легкого ланцюга. На жаль, біоаналіз LD 50 на мишах має безліч недоліків, що включають високу вартість проведення унаслідок великої кількості потрібних лабораторних тварин, втрата специфічності, оскільки все серотипи BONT викликають однакові вимірювані результати, і можливість неточності в тому випадку, якщо не використовують великі групи тварин. Додатково, групи, що працюють з тваринами, випробовують тиск з боку регулюючих органів в США (FDA/NICEATM/ICCVAM) і в Европі (MHRA і EDQM), а також тиск виявляється на фармацевтичні компанії, що проводять продукти на основі ботулінічного нейротоксину, що полягає в скороченні тестування на тваринах і, що важливіше, заміни біоаналізу LD50 на мишах при виробництві продукту. Регулюючі органи зобов'язують фармацевтичні компанії застосовувати принцип три "R" відносно тестування сили ботулінічних нейротоксинів: "Зменшити, Поліпшити, Замінити" (Reduce, Refine, Replace). D. Straughan, Progress in Applying the Three Rs to the Potency Testing of Botulinum Toxin Type A, Altern. Lab. Anim. 34(3): 305-313 (2006). Останніми роками декілька стадій вже зробили для зменшення і поліпшення біоаналізу LD50 на мишах для стандартизації протоколу і одержання більш узгоджених даних з використанням меншої кількості тварин на аналіз. Таким чином, простий, надійний, валидійований, що приймається державними регулюючими органами аналіз активності ботулінічного токсину, який може оцінювати інтегрованість всіх стадій, необхідних для поглинання ботулінічного токсину, може мати значну цінність, оскільки такий аналіз, не заснований на тваринах, може зменшити потребу в тестуванні на тваринах, і ослабити всі недоліки, вартісні характеристики і етичні аспекти, що асоціюються з цим типом аналізу, заснованим на тваринах. У даному описі запропоновані нові композиції, клітини і способи аналізу активності ботулінічного токсину А, корисні для різних видів промисловості, таких як, наприклад фармацевтична і харчова промисловість, а також забезпечуючі переваги. Такі композиції, клітини і способи не використовують живих тварин або тканини, відібрані у живих тварин, але можуть оцінювати всі стадії, необхідні для дії нейротоксину. Докладний опис фігур Фіг. 1 демонструє схему моделі вивільнення нейромедіатора і інтоксикації клостридіальним токсином, що існує в даний час, в нейронах центральної нервової системи і периферичної нервової системи. Фіг. 1A демонструє схему механізму вивільнення нейромедіатора в нейронах центральної нервової системи і периферичної нервової системи. Процес вивільнення може бути описаний за 1 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою двох стадій: 1) зашторювання везикули, при якому білок SNARE (soluble Nethylmaleimide sensitive factor attachment receptor), пов'язаний з везикулою, що містить молекули нейромедіатора, приєднується до пов'язаного з мембраною білка SNARE, розташованого на мембрані цитоплазми; і 2) вивільнення нейромедіатора, при якому везикула зливається з мембраною цитоплазми і молекули нейромедіатора екзоцитирують. Фіг. 1B демонструє схему механізму інтоксикації для правцевого і ботулінічного токсину в нейронах центральної нервової системи і периферичної нервової системи. Цей процес інтоксикації може бути описаний за допомогою чотирьох стадій: 1) пов'язання з рецептором, де клостридіальний токсин зв'язується з комплексом клостридиального рецептора і ініціює процес інтоксикації; 2) інтерналізація комплексу, при якому після скріплення токсину везикула, що містить комплекс токсин/рецептор, ендоцитує в клітину; 3) транслокація легкого ланцюга, при якому, як вважають, відбуваються множинні події, що включають зміни pH усередині везикули, утворення пор, що містять домен HN важкого ланцюга клостридіального токсину, відділення легкого ланцюга клостридіального токсину від важкого ланцюга, і вивільнення легкого ланцюга і 4) ферментативна модифікація мішені, де легкий ланцюг клостридіального токсину протеолітично розщеплює його субстрати-мішені SNARE, такі як, наприклад SNAP-25, VAMP або Syntaxin, таким чином, запобігаючи зашторювання везикулам і вивільненню нейромедіатора. Фіг. 2 демонструє порівняння захоплення BoNT/A в чотирьох клітинних лініях за допомогою аналізу шляхом вестерн-блоттінгу. Фіг. 2A демонструє графік виявлення продукту розщеплювання SNAP-25 виходячи з кількості BoNT/A, використовуваної для обробки клітинної лінії. Дані аналізували в програмі SigmaPlot з використанням 4-х параметричних логістичних моделей, і значення EC 50 (середньої ефективної концентрації) одержували для кожної клітинної лінії. Розташування виявлених сигналів продуктів розщеплювання SNAP-25 було наступним: SiMa>> Neuro-2a>LA1-55n> PC12. Фіг. 2B демонструє відношення сигнал/шум для необроблених сигналів при концентрації 300 пM в порівнянні з 0 пM і 1,2 пM в порівнянні з 0 пM, що розраховуються для аналізу. Клітини SiMa забезпечували найбільше відношення сигнал/шум і найменші значення EC 50. Фіг. 3 демонструє оптимізацію середовищ для клітинного диференціювання для стійких клітинних ліній, корисних в імунологічному способі виявлення активності BoNT/A, розкритому в даному описі. Фіг. 4 демонструє оптимізацію часу для клітинного диференціювання для стійких клітинних ліній, придатних в імунологічному способі виявлення активності BoNT/A, розкритому в даному описі Фіг. 5 демонструє оптимізацію обробки BoNT/A клітин стійких клітинних ліній, корисних в імунологічному способі виявлення активності BoNT/A, розкритому в даному описі. Результати указують на те, що EC50 менше ніж 2 пM досягається з будь-якою з тестованих обробок BoNT/A. Фіг. 6 демонструє чутливість імунологічного способу виявлення активності BoNT/A, розкритого в даному описі. Результати вказують на те, що захоплення BoNT/A клітинами займає менше ніж одну хвилину перед продукцією значних кількостей продукту розщеплювання SNAP25 в порівнянні з фоновим значенням. Фіг. 7 демонструє специфічність імунологічного способу виявлення активності BoNT/A, розкритого в даному описі. Результати указують на те, що імунологічні способи виявлення активності BoNT/A, розкриті в даному описі, можуть вимірювати всі стадії, залучені в інтоксикацію BoNT/A. Фіг. 8 демонструє криву залежності відповіді від дози для диференційованих клітин SiMa, оброблених комплексом BoNT/A, з використанням імунологічного способу виявлення активності BoNT/A, розкритого в даному описі. Фіг. 9 демонструє результати імунологічного способу визначення активності BoNT/A для виготовленого фармацевтичного продукту BoNT/A з використанням імунологічного способу виявлення активності BoNT/A, розкритого в даному описі. Фіг. 10 демонструє виявлення нейтралізуючих антитіл α-BoNT/A у людській сироватці крові з використанням імунологічного способу виявлення активності BoNT/A, розкритого в даному описі. Докладний опис винаходу У даному описі запропоновані нові аналізи для визначення присутності або відсутності активного BoNT/A в зразку і для визначення активності/сили препарату BoNT/A. Нові клітинні аналізи, розкриті в даному описі засновані на клітинах, реагентах і способах детекції, що дозволяє визначати в аналізі пікомолярні кількості BoNT/A в зразку. Клітинні аналізи, розкриті в даному описі, зменшують необхідність в дослідженнях токсичності на тваринах, в той же час 2 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 служать для аналізу множинних функцій BoNT/A, а саме, скріплення і клітинного захоплення токсину, транслокації в клітинний цитозоль, і протеазну активністі. Як додатково обговорюється нижче, нові способи і композиції можуть бути використані для аналізу неочищених зразків і зразків в партіях, а також високоочищених дволанцюжкових токсинів і виготовлених продуктів токсинів і додатково застосовні для форматів автоматизованого високопродуктивного аналізу. Таким чином, в одному з аспектів, розкритих в даному описі, запропоновані композиції для продукції антитіл α-SNAP-25, які можуть зв'язуватися з епітопом, що містить C-кінець (карбоксильний) на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25. Композиції можуть містити ад'ювант і композицію, що включає антиген SNAP-25, носій, пов'язаний з антигеном SNAP-25, або носій, пов'язаний з гнучкою вставкою, пов'язаною з антигеном SNAP-25, де гнучкий лінкер розташовується між антигеном SNAP-25 і носієм. Представляється, що будь-який і всі антигени SNAP-25, що запускають імунну відповідь, продукуючий атитіло α-SNAP-25, що може зв'язуватися з епітопом, що містить Cкінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25, можуть бути корисні як антиген SNAP-25, що включає без обмеження антиген SNAP-25, що походить з того, що зустрічається в природі SNAP-25, антиген SNAP-25, що походить з того, що не зустрічається в природі SNAP-25, і антиген SNAP-25, що містить імунореактивний фрагмент SNAP-25, SNAP-25 з того, що зустрічається в природі SNAP-25 або SNAP-25, що не зустрічається в природі. Антигени SNAP-25, корисні для продукції α-SNAP-25, які можуть зв'язуватися з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25, включають без обмеження антигени SNAP-25, що містять пептид SNAP-25, що має карбоксильований Cкінцевий глутамін, пов'язаний з несучим пептидом, включає без обмеження SEQ ID NO: 38. Інші композиції, корисні для одержання антитіл α-SNAP-25, які можуть зв'язуватися з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25, включають без обмеження композицію, що містить носій, пов'язаний з гнучким лінкером, пов'язаною з карбоксильованим C-кінцевим глутаміном антигена SNAP-25, де гнучкий лінкер розташовується між антигеном SNAP-25 і носієм. Передбачається, що будь-який і всі ад'юванти можуть бути корисні в такій композиції, що включають без обмеження поліетиленгліколь (PEG), монометоксиполіетиленгліколь (mPEG), полівиниловий спирт (PVA), повний і неповний ад'ювант Фрейнда. У ще одному аспекті, розкритому в даному описі запропоновані способи продукції антитіла α-SNAP-25, яке може зв'язуватися з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A. Аспект цього способу включає стадії (а) введення тварині композиції, розкритої в даному описі; (б) відбору у тваринного зразка, що містить антитіло α-SNAP-25 або клітини, що продукують антитіло α-SNAP-25; і (в) виділення антитіла α-SNAP-25 із зразка. Розкриті способи корисні для одержання моноклональних антитіл α-SNAP-25, які можуть зв'язуватися з епітопом, що містить C-кінець глутаміну продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, або поліклональних антитіл α-SNAP-25, які можуть зв'язуватися з епітопом, що містить C-кінець глутаміну продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A. В ще одному аспекті, розкритому в даному описі, запропоновано антитіло α-SNAP-25, яке може зв'язуватися з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25. Такі антитіла α-SNAP-25 включають антитіла, що зустрічаються в природі і не зустрічаються в природі, а також, моноклональні антитіла α-SNAP-25 або поліклональні антитіла α-SNAP-25. Моноклональні антитіла α-SNAP-25, корисні як антитіла α-SNAP-25, які зв'язуються з епітопом, що містить Cкінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, включають без обмеження моноклональні антитіла α-SNAP-25, продуковані з гібридомних клітинних ліній 1D3B8, 2C9B10, 2E2A6, 3C1A5 і 3C3E2. У ще одному аспекті, розкритому в даному описі, запропоновані способи виявлення активності BoNT/A. Аспект цього способу включає стадії (а) обробки клітини із стабільної клітинної лінії зразком BoNT/A, де клітина із стабільної клітинної лінії чутлива до інтоксикації BoNT/A; (б) виділення з обробленої клітини компоненту SNAP-25, що містить продукт розщеплювання SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A; (в) приведення в контакт компоненту SNAP-25 з антитілом α-SNAP-25, яке може зв'язуватися з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25; і (г) виявлення присутності комплексу антитіло-антиген, що містить антитіло α-SNAP-25 і продукт розщеплювання SNAP-25; 3 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 де виявлення за допомогою комплексу антитіло-антиген є показником активності BoNT/A. Антитіло α-SNAP-25 із стадії (c) можливо може бути пов'язано з твердофазним носієм. У ще одному аспекті, розкритому в даному описі, запропоновані способи виявлення активності BoNT/A. Аспект цього способу включає стадії (a) обробки клітини із стабільної клітинної лінії зразком, BoNT/A, де клітина із стабільної клітинної лінії може захоплювати BoNT/A; (б) виділення з обробленої клітини компоненту SNAP-25, SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A; (в) приведення в контакт компоненту SNAP-25 з антитілом α-SNAP-25, яке може зв'язуватися з епітопом, що містить Cкінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25; і (г) виявлення присутності комплексу антитіло-антиген, що містить антитіло α-SNAP-25 і продукт розщеплювання SNAP-25; де виявлення за допомогою комплексу антитіло-антиген є показником активності BoNT/A. Антитіло α-SNAP-25 із стадії (c) необов'язково може бути пов'язано з твердофазним носієм. У ще одному аспекті, розкритому в даному описі, запропоновані способи визначення іммунорезистентності до BoNT/A у ссавця. Аспект цього способу включає стадії (a) додавання BoNT/A до тестованого зразка одержаного у ссавця, тестованого на наявність або відсутність антитіл, нейтралізуючих α-BoNT/A; (б) обробки клітини із стабільної клітинної лінії тестованим зразком, де клітина із стабільної клітинної лінії чутлива до інтоксикації BoNT/A; (в) виділення з оброблених клітин компоненту SNAP-25, що містить продукт розщеплювання SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A; (г) приведення в контакт компоненту SNAP-25 з антитілом α-SNAP-25, яке може зв'язуватися з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25; (д) виявлення присутності комплексу антитіло-антиген, що містить антитіло α-SNAP-25 і продукт розщеплювання SNAP-25; (е) повторення стадій (а) -(д) з негативним контрольним зразком замість тестованого зразка і (ж) порівняння кількості комплексу антитіло-антиген, виявленого на стадії (д), з кількістю комплексу антитіло-антиген, виявленого на стадії (е), де виявлення меншої кількості комплексу антитіло-антиген, виявленого на стадії (д), в порівнянні з кількістю комплексу антитіло-антиген, виявленого на стадії (е), є показником присутності α-BoNT/A нейтралізуючих антитіл. Антитіло α-SNAP-25 із стадії г може необов'язково бути пов'язане з твердофазним носієм. Контрольний зразок на стадії е також може включати позитивний контрольний зразок додатково до негативного контрольного зразка. Токсини клостридій, продуковані Clostridium botulinum, Clostridium tetani, Clostridium baratii і Clostridium butyricum, найширше використовуються в терапевтичному лікуванні і косметичній обробці людей і інших ссавців. Штами C. botulinum продукують сім що відрізняються антигенами серотипов ботулінічних токсинів (BoNTs), які ідентифікують шляхом вивчення спалахів ботулізму у людей (BoNT/A, BoNT/B, Вont/e і BoNT/F), тварин (BoNT/C1 і BoNT/D), або виділені з грунту (BoNT/G). Хоча всі сім серотипів ботулінічного токсину мають схожу структуру і біологічні властивості, кожен з них також демонструє гетерогенні характеристики, такі як, наприклад різні фармакологічні властивості. Навпаки, правцевий токсин (TENT) продукується однорідною групою C. tetani. Два інших види клостридій C. baratii і C. butyricum також продукують токсини, схожі на BoNT/F і BoNT/E, відповідно. Кожен з клостридіальних токсинів транслюється у вигляді одноланцюгового поліпептиду з масою приблизно 150 кДа, який потім розщеплюється шляхом протеолітичного розщеплювання усередині дисульфідної петлі протеазою, що зустрічається в природі, такою як, наприклад ендогенна протеаза клостридіального токсину або протеаза, що зустрічається в природі, продукується в навколишньому середовищі. Цей посттрансляційний процесінг дозволяє одержувати дволанцюжкову молекулу, що містить легкий ланцюг масою приблизно 50 кДа (LC), і важкий ланцюг масою приблизно 100 кДа (HC), що утримуються разом за допомогою одиничного дисульфідного зв'язку і нековалентних взаємодій. Кожна із зрілих дволанцюжкових молекул містить три функціонально різних домена: 1) ферментативний домен, розташований в LC, який включає область металлоппротеази, що має залежну від цинку ендопептидазну активність, яка специфічно націлена на кірові компоненти апарату вивільнення нейромедіатора; 2) домен транслокації, що міститься в N-кінцевий половині HC (HN), який полегшує вивільнення LC з внутріклітинних везикул в цитоплазму клітини-мішені; і 3) зв'язуючий домен, виявлений в Cкінцевій половині HC (HC), який визначає зв'язуючу активність і зв'язуючу специфічність токсину відносно рецепторного комплексу, розташованого на поверхні клітини-мішені. Зв'язуюча транслоціююча і ферментативна активності цих трьох функціональних доменів всі 4 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 разом необхідні для тоскичності. Хоча не всі деталі цього способу точно відомі, загальний механізм клітинної інтоксикації, за допомогою якого клостридіальні токсини проникають в нейрон і інгібують вивільнення нейромедіатора є схожим незалежно від серотипу або підтипу. Хоча автори винаходу не бажали обмежуватися наступним описом, механізм інтоксикації може бути описаний таким чином, що містить щонайменше чотири стадії: 1) пов'язання з рецептором, 2) інтерналізація комплексу, 3) транслокація легкого ланцюга, і 4) ферментативна модифікація мішені (Фіг. 1). Процес ініціюється, коли домен HC клостридіального токсину зв'язується з токсин-специфічною рецепторною системою, розташованою на поверхні мембрани цитоплазми клітини-мішені. Вважають, що специфічність скріплення рецепторного комплексу досягається частково шляхом специфічних комбінацій гангліозидів і білкових рецепторів, які по різному включають кожен з рецепторних комплексів клостридіального токсину. Після скріплення комплекси токсин/рецептор інтерналізуються шляхом ендоцитозу, і інтерналізовані везикули сортуються за допомогою специфічних внутріклітинних шляхів. Стадія транслокації запускається закислянням везикули компартмента. Цей процес ініціює важливі залежні від pH структурні перегрупування, які збільшують гідрофобність, сприяють утворенню пор і полегшують розділення важкого і легкого ланцюгів токсину. Після розділення ендопептидази легкого ланцюга токсину вивільняється з внутріклітинної везикули в цитозоло, де специфічно націлюється на кірові компоненти апарату вивільнення нейромедіатора. Ці кірові білки, що є мембранним білком (VAMP) /синаптобревін, що асоціюється з везикулою, білком 25 кДа (SNAP25) і синтаксин, що асоціюється з синаптосомами, необхідні для синаптического заякорювання везикули і злиття з нервовим закінченням, і є членами сімейства розчинних чутливих до Nетилмалеіміду білкових рецепторів, що приєднують чинник (SNARE). BoNT/A і BoNT/E розщеплюють SNAP-25 в С-кінцевий області, вивільняючи амінокислотний фрагмент завдовжки дев'ять або двадцять шість амінокислот, відповідно, і BoNT/C1 також розщеплює SNAP-25 біля С-кінця, вивільняючи фрагмент завдовжки вісім амінокислот. Ботулінові серотипи BoNT/B, BoNT/D, BoNT/F і BoNT/G, і правцевий токсин діють на консервативний центральний фрагмент VAMP, і вивільняють N-кінцевий фрагмент VAMP в цитозоль. BoNT/C1 розщеплює синтаксин в одному місці біля поверхні цитозольной мембрани. Селективний протеолиз синаптических SNARE відповідає за блокування вивільнення нейромедіатора, викликаного клостридіальними токсинами in vivo. Білок SNARE, націлений на клостридіальні токсини, є звичайним для екзоцитозу в різних не нейрональних типах клітин; у цих клітинах, таких як в нейронах, активність пептидази легкого ланцюга інгібує екзоцитоз, наприклад Yann Humeau et al., How Botulinum and Tetanus Neurotoxins Block Neurotransmitter Release, 82(5) Biochimie. 427-446 (2000); Kathryn Turton et al., Botulinum and Tetanus Neurotoxins: Structure, Function and Therapeutic Utility, 27(11) Trends Biochem. Sci. 552-558. (2002); Giovanna Lalli et al., The Journey of Tetanus and Botulinum Neurotoxins in Neurons, 11(9) Trends Microbiol. 431-437 (2003). Аспекти даного опису включають, частково, композицію для продукції антитіл α-SNAP-25, які можуть зв'язуватися з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A. Інші аспекти даного опису включають, частково, композицію, що викликає імунну відповідь, для продукції антитіл α-SNAP25, які можуть зв'язуватися з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25. Використовуваний тут термін "композиція, що викликає імунну відповідь" відноситься до композиції, що містить антиген SNAP-25, який при введенні тварині стимулює імунну відповідь проти антигена SNAP25, таким чином, продукуючи антитіло α-SNAP-25, яке може зв'язуватися з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25. Термін "імунна відповідь" відноситься до будь-якої відповіді імунної системи тварини на композицію, що викликає імунну відповідь. Приклади імунних відповідей включають клітинний, а також локальний і системний гуморальний імунітет, такий як, наприклад відповіді CTL, що включають антиген-специфічну індукцію CD8+CTL, хелперніе відповіді, Tклітинні відповіді, що включають T-клітинні проліферативні відповіді і вивільнення цитоконів, і Bклітинні відповіді, що включають, наприклад відповідь продукуючі антитіла. Термін "індукція імунної відповіді" відноситься до введення композиції, що викликає імунну відповідь, або кодуючого полінуклеотиду композицію, що викликає імунну відповідь, де на імунну відповідь виявляється вплив, наприклад, він стимулюється, ініціюється або індукується. Композиція містить антиген SNAP-25. Використовуваний тут термін "антиген" відноситься до молекули, яка викликає імунну відповідь і включає без обмеження пептиди, полісахариди і коньюгати ліпідів, такі як наприклад ліпопротеїни і гліколіпіди. Використовуваний тут термін "антиген SNAP-25" відноситься до будь-якого антигену, який має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, який може викликати імунну відповідь. 5 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антиген SNAP-25, використовуваний в композиції, що викликає імунну відповідь, має бути достатньо великим для того, щоб бути по суті унікальним за послідовністю, таким чином, зменшуючи можливість продукції антитіл, що мають перехресну реактивністю відносно антигенів, що відрізняються від SNAP-25. Додатково, антиген SNAP-25, використовуваний в композиції, що викликає імунну відповідь, має бути достатньо невеликим для того, щоб запускати імунну відповідь тільки по суті проти SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, таким чином, збільшуючи вірогідність продукції антитіл α-SNAP-25, які можуть розрізняти SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, від SNAP-25, позбавленого C-кінця на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. Крім того, також вельми бажано продукувати антитіла α-SNAP-25 одиничної амінокислотної послідовності з добрим виходом, які мають відтворювану вибірковість і зв'язуються з прийнятною авідністю для того, щоб дати можливість для розробки високочутливого аналізу. Послідовність, що оточує сайт розщеплювання BoNT/A, представленого в SNAP-25, позначається як P5–P4–P3–P2–P1–P1’–P2’–P3’–P4’–P5", де P1–P1" позначає розщеплюваний зв'язок. Після розщеплювання під дією BoNT/A продукти розщеплювання, що утворюються в результаті, містять фрагмент, що включає послідовність P5–P4–P3–P2–P1, і фрагмент, включаючий P1’–P2’– P3’–P4’–P5". Таким чином, використовуваний тут термін "SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A" відноситься до будь-якого SNAP-25, що має залишок P1 на своїй С-кінцевій амінокислоті. Наприклад Q197–R198 людського SNAP-25 (SEQ ID NO: 5) демонструє розщеплюваний зв'язок P1–P1" для сайту розщеплювання BoNT/A. Сам по собі "SNAP-25, що має C-кінцевий глутамін розщеплюваного зв'язку сайту розщеплювання BoNT/A" може бути будь-яким продуктом розщеплювання SNAP-25, що має глутамін на своїй С-кінцевій амінокислоті, де глутамін представляє Q197 розщеплюваного зв'язку. Як ще один приклад K204–H205 Torpedo marmorata SNAP-25 (SEQ ID NO: 16) представляє розщеплюваний зв'язок P1–P1" для сайту розщеплювання BoNT/A. Сам по собі "SNAP-25, що має C-кінцевий лізин розщеплюваного зв'язку сайту розщеплювання BoNT/A" може бути будьяким продуктом розщеплювання SNAP-25, що має лізин на своїй С-кінцевій амінокислоті, де лізин є K204 розщеплюваного зв'язку. Антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A з сайту розщеплювання BoNT/A, може бути модифікований для посилення імуногенності антигена SNAP-25, гаптену або будь-якої іншої антигенної сполуки, що є імуногенною, неімуногенною або слабо імуногенною, коли не асоціюється з модифікацією. У аспекті цього втілення C-кінцевий залишок P1 розщеплюваного зв'язку антигену SNAP-25 може бути карбоксильований. Карбоксилювання збільшує бажані імуногенні властивості антигену SNAP-25 в двох аспектах. По-перше, оскільки заряджені амінокислоти підсилюють – імуногенність, то додавання групи COO до С-кінцевого залишку збільшує загальну імуногенність антигену SNAP-25. По-друге, оскільки залишок P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A знаходиться в зарядженому стані при розщеплюванні, то додавання – групи COO до С-кінцевого залишку краще імітуватиме реальний антиген, проти якого розробляється антитіло α-SNAP-25, розкрите в даному описі, для пов'язання з ним. У одному з аспектів цього втілення N-кінцевий залишок антигена SNAP-25 може бути модифікований шляхом додавання амінокислоти, адаптованої для приєднання антигену SNAP25 до білка-носія, такому як, наприклад гемоціанін лімфи равлика (KLH), овальбумін (OVA), тиреоглобулін (THY), бичачий сироватковий альбумін (BSA), соєвий трипсиновий інгібітор (STI) або множинний антигенний пептид (MAP). Наприклад, цистеїновий залишок може бути поміщений в N-кінець для кон'югації білка-носія KLH. Таким чином, як втілення антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати довжину, наприклад, щонайменше 5, щонайменше 6, щонайменше 7, щонайменше 8, щонайменше 9, щонайменше 10, щонайменше 11, щонайменше 12, щонайменше 13, щонайменше 14, щонайменше 15, щонайменше 16, щонайменше 17, щонайменше 18, щонайменше 19, щонайменше 20, щонайменше 25, або, щонайменше 30 амінокислот. У ще одному втіленні антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати довжину, наприклад максимально 5, максимально 6, максимально 7, максимально 8, максимально 9, максимально 10, максимально 11, максимально 12, максимально 13, максимально 14, максимально 15, максимально 16, максимально 17, максимально 18, максимально 19, максимально 20, максимально 25, або максимальні 30 амінокислот. У ще одному втіленні антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати довжину, наприклад 7-12 амінокислот, 10-15 амінокислот 6 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 або 13-18 амінокислот. У ще одному втіленні антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, містить SEQ ID NO: 32. У аспектах цього втілення антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, містить SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 147, або SEQ ID NO: 148. У ще одному втіленні антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, містить SEQ ID NO: 38. У ще одному втіленні антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, містить SEQ ID NO: 39. У аспектах цього втілення антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, містить SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 або SEQ ID NO: 44. У ще одному втіленні антиген SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, містить SEQ ID NO: 45. Передбачається, що будь-який і всі антигени SNAP-25, що запускають імунну відповідь, продукуючого антитіла α-SNAP-25, яке зв'язується з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть бути корисні як антиген SNAP-25. Таким чином, варіанти N-кінцевої послідовності, SEQ ID NO, що містять: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 147, або SEQ ID NO: 148 можуть бути корисні як антиген SNAP-25 для запуску імунної відповіді, продукуючого антитіла α-SNAP-25, яке зв'язується з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A. Таким чином, у втіленні антиген SNAP-25 може мати, щонайменше 1, щонайменше 2, щонайменше 3, щонайменше 4, або, щонайменше 5 амінокислотних замін, делецій або вставок щодо антигенів SNAP-25, SEQ ID NO, що містять: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 147 або SEQ ID NO: 148. У ще одному втіленні антигенSNAP-25 може мати, щонайменше 70 %, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 % або, щонайменше 95 % амінокислотну ідентичність з антигенами SNAP-25, SEQ ID NO, що містять: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 147 або SEQ ID NO: 148. Передбачається, що один або більше ніж один носій може бути пов'язаний з антигеном SNAP-25 для посилення імуногенності антигену SNAP-25, який є імуногенним, неімуногенним або слабо імуногенним, будучи не асоційованим з носієм. Винаходи, що не обмежують об'єм, приклади включають, наприклад гемоціанин лімфи равлика (KLH), овальбумін (OVA), тиреоглобулін (THY), бичачий сироватковий альбумін (BSA), соєвий трипсиновий інгібітор (STI) або множинний антигенний пептид (MAP). Як добре відомо в області техніки, неантигенний або слабо антигенний антиген може стати антигенним шляхом пов'язання антигена з носієм. Різні інші носії і способи скріплення антигена з носієм добре відомі в області техніки. Дивися, наприклад Harlow and Lane, вище, 1998a; Harlow and Lane, вище, 1998b; і David W. Waggoner, Jr. et al., Immunogenicity-enhancing carriers and compositions thereof and methods of з використанням the same, публікація заявки на патент США №. 20040057958 (25 березня 2004 року). Епітоп також може бути одержаний шляхом експресії епітопу у вигляді злитого білка. Способи експресії поліпептидного злиття добре відомі фахівцям в даній області техніки, як описано, наприклад в Ausubel et al., Current Protocols in Molecular Biology (Supplement 47), John Wiley & Sons, New York (1999). Як С-кінцевого кінця антигена SNAP-25 може бути залишком P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, носій має бути пов'язаний з N-кінцем антигену SNAP-25. Передбачається, що один або більш ніж один гнучкий лінкер може бути пов'язаний з антигеном SNAP-25 для посилення імуногенності антигена SNAP-25, який є імуногенним, неімуногенним або слабо імуногенним, будучи не асоційованим з гнучкими лінкерами. Гнучкий лінкер збільшує загальну довжину пептиду антигену SNAP-25 і забезпечує гнучкість, таким чином полегшуючи правильну презентацію антигену SNAP-25 імунним клітинам. Як приклад, що не обмежуєоб'єм винахід, композиція може містити антиген SNAP-25, пов'язаний з одним або більш ніж одним гнучким лінкером в тандемі для більш хорошої презентації антигену SNAP-25 імунним клітинам, таким чином полегшуючи імунну відповідь. Гнучкий лінкер, що містить пептид, має довжину щонайменше одну амінокислоту, і містить 7 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 не заряджену амінокислоту з невеликими R групами бічного ланцюга, таку як, наприклад гліцин, аланін, валін, лейцин або серин. Таким чином, втілення гнучкого лінкера може мати довжину, наприклад щонайменше 1, щонайменше 2, щонайменше 3, щонайменше 4, щонайменше 5, щонайменше 6, щонайменше 7, щонайменше 8, щонайменше 9, або, щонайменше 10 амінокислот. У ще одному втіленні гнучкий лінкер може мати довжину, наприклад щонайменше 1, максимально 2, максимально 3, максимально 4, максимально 5, максимально 6, максимально 7, максимально 8, максимально 9, або максимальні 10 амінокислот. У ще одному втіленні гнучкий лінкер може мати довжину, наприклад 1-3 амінокислоти, 2-4 амінокислоти, 3-5 амінокислот, 4-6 амінокислот або 5-7 амінокислот. Винаходи, що не обмежують об'єм, приклади гнучкого лінкера включають, наприклад G-спейсери, такі як GGG, GGGG (SEQ ID NO: 55), і GGGGS (SEQ ID NO: 56) або A-спейсери, такі як AAA, AAAA (SEQ ID NO: 57) і AAAAV (SEQ ID NO: 58). Гнучкий лінкер зв'язаний в рамці прочитування з антигеном SNAP-25 у вигляді злитого білка. Як обговорювалося вище, гнучкий лінкер використовується, частково, для збільшення загольної довжини пептиду антигену SNAP-25. Наприклад антиген SNAP-25 з 5-10 амінокислот може мати загальну довжину, збільшену шляхом скріплення гнучкого лінкера з 3-5 амінокислот з N-кінцем антигена SNAP-25. Як ще один приклад антиген SNAP-25 з 5-10 амінокислот може мати загальну довжину, збільшену шляхом скріплення гнучкого лінкера з 4-6 амінокислот з Nкінцем антигену SNAP-25. Як ще один приклад антиген SNAP-25 з 5-10 амінокислот може мати загальну довжину, збільшену шляхом скріплення гнучкого лінкера з 7-10 амінокислот з N-кінцем антигену SNAP-25. Як ще один приклад антиген SNAP-25 з 7-12 амінокислот може мати загальну довжину, збільшену шляхом скріплення гнучкого лінкера з 1-3 амінокислот з N-кінцем антигену SNAP-25. Як ще один приклад антиген SNAP-25 з 7-12 амінокислот може мати загальну довжину, збільшену шляхом скріплення гнучкого лінкера з 4-6 амінокислот з N-кінцем антигену SNAP-25. Збільшена довжина, що забезпечується гнучким лінкером, дає можливість для вибору антигену SNAP-25 малого розміру, таким чином збільшуючи вірогідність того, що антиген SNAP-25 запускатиме тільки імунну відповідь по суті проти SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, таким чином збільшуючи вірогідність продукції антитіл α-SNAP-25, які можуть відрізняти SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, від SNAP-25, позбавленого C-кінця на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. Передбачається, що композиції, розкриті в даному описі, можуть можливо містити антиген SNAP-25, розкритий в даному описі, і один або більш ніж один ад'ювант. Використовуваний тут термін "ад'ювант", використовуваний з посиланням на композицію SNAP-25, відноситься до будь-якої речовини або суміші речовин, яка збільшує або диверсифікує імунну відповідь на антиген SNAP-25. Ад'ювант може, наприклад, служити для зменшення кількості імунізацій або кількості антигена, потрібного для захисної імунізації. Застосування ад'ювантів в композиції, що викликає імунну відповідь, добре відомо. Основне завдання цих ад'ювантів полягає в тому, щоб дати можливість для збільшення імунної відповіді. Ад'юванти, що не обмежують об'єм винаходу, включають, наприклад ліпосоми, масляні фази, що включають без обмеження ад'юванти Фрейнда, такі як, повний ад'ювант Фрейнда (FCA); неповний ад'ювант Фрейнда (FIA); сапогенінові глікозиди, такі як, наприклад сапоніни; карбопол; N-ацетилмураміл-L-аланіл-Dізоглутамін (зазвичай відомий як мурамілдипептид або "MDP"); і ліпополісахарид (LPS). Такі ад'юванти загалом використовуються у формі емульсії з водною фазою, або, зазвичай, можуть складатися з водорозчинних неорганічних солей. Ці неорганічні солі можуть полягати, наприклад з гідроксиду алюмінію, сульфату цинку, колоїдного гідроксиду заліза, ортофосфату кальцію або хлориду кальцію. Гідроксид алюмінію (Al(OH) 3) є зазвичай використовуваний ад'ювант. В даний час, єдиний схвалений FDA ад'ювант для використання людьми є солі алюмінію (алюм), використовувані для "запасання" антигенів шляхом осадження антигенів. Приведені вище ад'юванти всього лише є прикладами. Фактично в композиції SNAP-25, розкритій в даному описі, може бути використаний будь-який ад'ювант, а також ад'ювант, що задовольняє необхідним вимогам для індукції імунної відповіді. Носій, розкритий в даному описі, також може служити як ад'ювант. Конкретні ад'юванти і способи їх одержання і застосування описані, наприклад в Gupta et al. Vaccine, 11: 993-306, 1993; Arnon, R. (Ed.) Synthetic Vaccines 1:83-92, CRC Press, Inc., Boca Raton, Fla., 1987; і David W. Waggoner, Jr. et al., Immunogenicity-Enhancing Carriers and Compositions Thereof and Methods of З використанням the Same, публікація заявки на патент США №. 20040057958 (25 березня 2004 року). Додаткові ад'юванти включають будь-яку сполуку, описану в розділі 7 (стор. 141227) в "Vaccine Design, The Subunit and Ад'ювант Approach" (eds. Powell, M. F. and Newman, M. J.) Pharmaceutical Biotechnology, Volume 6, Plenum Press (New York). Приклади з даних вказівок 8 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 включають мурамілдіпептид (MDP) і Montanide 720. Молекули, такі як поліїнозин:цитозин (Poly I:C) або плазмідна ДНК, що містить мотиви CPG, також можуть бути введені як ад'юванти в комбінації з антигенами, інкапсульованими в мікрочастках. У ще одному прикладі ад'ювант є агент, який полегшує проникнення антигенної сполуку в цитоплазму клітини, таке як листеріолізин, стрептолізин або їх суміш. Таким чином, у втіленні композиція SNAP-25 містить антиген SNAP-25, що має карбоксильований глутамін С-кінцевий, пов'язаний з несучим пептидом. У аспектах цього втілення антиген SNAP-25, що має карбоксильований глутамін С-кінцевий, містить SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 147 або SEQ ID NO: 148. У ще одному аспекті цього втілення антиген SNAP-25 містить SEQ ID NO: 38. У аспектах цього втілення несучим пептидом є гемоціанин лімфи равлика (KLH), овальбумін (OVA), тиреоглобулін (THY), бичачий сироватковий альбумін (BSA), соєвий трипсиновий інгібітор (STI) або множинний антигенний пептид (MAP). У ще одному втіленні композиція SNAP-25 містить антиген SNAP-25, що має карбоксильований C-кінцевий лізин, пов'язаний з несучим пептидом. У аспектах цього втілення антиген SNAP-25, що має карбоксильований C-кінцевий лізин, містить SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 або SEQ ID NO: 44. У ще одному аспекті цього втілення антиген SNAP-25 містить SEQ ID NO: 45. У аспектах цього втілення несучим пептидом, є гемоціанін лімфи равлика (KLH), овальбумін (OVA), тиреоглобулін (THY), бичачий сироватковий альбумін (BSA), соєвий трипсиновий інгібітор (STI) або множинний антигенний пептид (MAP). У ще одному втіленні композиція SNAP-25 містить антиген SNAP-25, що має карбоксильований C-кінцевий глутамін, пов'язаний з одним або більш ніж одним гнучким лінкером, і несучим пептид, де гнучкі лінкери розташовані між антигеном SNAP-25 і несучим пептидом. У аспектах цього втілення антиген SNAP-25, що має карбоксильований C-кінцевий глутамін, містить SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 147, або SEQ ID NO: 148. У ще одному втіленні антиген SNAP-25 містить SEQ ID NO: 46. У аспектах цього втілення несучим пептидом є гемоціанин лімфи равлика (KLH), овальбумін (OVA), тиреоглобулін (THY), бичачий сироватковий альбумін (BSA), соєвий трипсиновий інгібітор (STI) або множинний антигенний пептид (MAP). У аспектах цього втілення гнучкий лінкер є G-спейсер або A-спейсер. У ще одному втіленні композиція SNAP-25 містить антиген SNAP-25, що має карбоксильований C-кінцевий лізин, пов'язаний з гнучким лінкером, і несучий пептид, де гнучкий лінкер розташовується між антигеном SNAP-25 і несучим пептидом. У аспектах цього втілення антиген SNAP-25, що має карбоксильований C-кінцевий лізин, містить SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 або SEQ ID NO: 44. У ще одному аспекті цього втілення антиген SNAP-25 містить SEQ ID NO: 47. У аспектах цього втілення несучим пептидом є гемоціанін лімфи равлика (KLH), овальбумін (OVA), тиреоглобулін (THY), бичачий сироватковий альбумін (BSA), соєвий трипсиновий інгібітор (STI) або множинний антигенний пептид (MAP). У аспектах цього втілення гнучкий лінкер є G-спейсер або A-спейсер. Аспекти даного опису включають частково спосіб продукції антитіл α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25. Антитіло α-SNAP-25, яке зв'язується з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть бути одержані за допомогою широкої різноманітності способів, які добре відомі в області техніки. Специфічні протоколи одержання і використання антитіл, а також виявлення і вимірювання антитілозв'язуючої специфічності, зв'язуючими аффінності і зв'язуючою авідності добре відомі в області техніки. Дивися, наприклад Antibodies: A Laboratory Manual (Edward Harlow & David Lane, eds., Cold Spring Harbor Laboratory Press, 2nd ed. 1998a); і З використанням Antibodies: A Laboratory Manual: Portable Protocol No. I (Edward Harlow & David Lane, Cold Spring Harbor Laboratory Press, 1998b); Molecular Cloning, A Laboratory Manual, 2001; і Current Protocols in Molecular Biology, 2004; David Anderson et al., Therapeutic Polypeptides, Nucleic Acids Encoding Same, and Methods of Use, U.S. Patent 7,034,132 (Apr. 25, 2005); і Beatriz M. Carreno et al., Antibodies Against CTLA4, U.S. Patent 7,034,121 (Apr. 25, 2006). Як винахід прикладу поліклональних антитіл, що не обмежує об'єм α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть бути одержані шляхом ін'єкції тварині, такій як, наприклад кролик, коза, миша або інший ссавець, одній або більш ніж одній ін'єкції композиції, розкритої в даному описі. Як ще один винахід прикладу, що не обмежує 9 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 об'єм, поліклональні антитіла α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть бути одержані шляхом ін'єкції в яйце, таке як, наприклад куряче яйце, одній або більш ніж одній ін'єкції композиції, розкритої в даному описі. Титр антитіла в імунізованій тварині можна контролювати протягом часу за допомогою стандартних способів, таких як за допомогою іммуноферментного аналізу (ELISA) з використанням іммобілізованного антигену або клітинного аналізу активності. За бажання поліклональні антитіла α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть бути виділені у ссавця (з корови) і додатково очищені за допомогою добре відомих способів, таких як аффінна хроматографія на білці А, з одержанням фракції IGG, або за допомогою аффінного очищення проти пептиду, використовуваного для продукції антитіл. Як ще один приклад, що не обмежує об'єм винахіду, моноклональне антитіло α-SNAP-25, яке зв'язується з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, може бути одержане з використанням гібридомної технології. Дивися, наприклад розділ 6 в Monoclonal Antibodies, стор. 196-244, Harlow & Lane, вище, 1998a; і розділ 7 Growing Hybridomas, стор. 245-282, Harlow & Lane, вище, 1998a; і Goding, стор. 59-103, Monoclonal Antibodies: Principles and Practice, Academic Press (1986). У цьому способі тварині-господареві, такій як, наприклад миша, хом'як або інша відповідна тварина-господар типово вводять одну або більш ніж одну ін'єкцію антигенe SNAP-25, розкритого в даному описі, для того, щоб викликати продукцію лімфоцитів, що продукують або здатних продукувати антитіло α-SNAP-25, яке специфічно зв'язується з SNAP25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. Титр антитіла у імунізованої тварини можна контролювати протягом часу за допомогою стандартних способів, таких як за допомогою іммуноферментного аналізу (ELISA) з використанням іммобілізованного антигену, або клітинного аналізу активності. Альтернативно, лімфоцити можуть бути імунізовані in vitro з використанням відповідної лінії культури клітин. У відповідний момент часу після імунізації, наприклад коли титр антитіл є найвище, клітини, що продукують антитіло, виділяють з тварини. Як правило, лімфоцити периферичної крові використовують в тому випадку, якщо бажані клітини людського походження, або використовують клітини селезінки, або клітини лімфатичних вузлів, якщо як джерела бажані ссавці, що відрізняються від людей. Виділені клітини, що продукують антитіло, зливають з імморталізованною клітинною лінією з використанням відповідного агента для злиття, такого як поліетиленгліколь, з одержанням клітини гібридоми. Імморталізованні клітинні лінії зазвичай є трансформованими клітинами ссавця, зокрема клітини мієломи гризунів, корів і людей. Типово, клітинну лінію мишачої мієломи зливають із спленоцитами, відібраними відповідним чином у імунізованої миші, з утворенням гібридоми. Переважні імморталізованні клітинними лініями є клітинні лінії мишачої мієломи, які чутливі до культурального середовища, що містить гіпоксантин, аміноптерин і тимідин (HAT). Будь-яка з безлічі мієломних клітинних ліній може бути використана як партнер злиття відповідно до стандартних способів, наприклад лінії мієломи P3NS1/1-Ag4-1, P3-x63-Ag8.653 або Sp2/O-Ag14. Гібридомні клітини, що виникають в результаті злиття, потім відбирають з використанням середовища HAT, яке вбиває клітини мієломи, що не зливаються і непродуктивно зливаються (спленоцити, що не зливаються, гинуть через декілька діб в культурі з огляду на те, що вони не трансформовані). Культуральне середовище, в якому ростуть гібридомні клітини, потім може бути проаналізована відносно присутності моноклональних антитіл α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A. Наприклад супернатанти гібридоми можуть бути відібрані з використанням α-SNAP-25 позитивних середовищ в аналізі імунопреципітації, аналізі скріплення in vitro, такому як, іммуноферментний аналіз (ELISA), або в клітинному аналізі активності. Такі способи і аналізи добре відомі в області техніки. Дивися, наприклад розділ 11 Immunoprecipitation, стор. 421-470, Harlow & Lane, вище, 1998a; розділ 12 Immunoblotting, стор. 471-510, Harlow & Lane, вище, 1998a; розділ 14 Immunoassays, стор. 553-612, Harlow & Lane, вище, 1998a. Додаткові дослідження потім можуть бути проведені для визначення того, чи є антитіло також нереактивним відносно SNAP-25, позбавленого C-кінця на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. Аффінність скріплення моноклонального антитіла α-SNAP-25 також може бути визначена, наприклад за допомогою аналізу Ськетчарда. Дивися, наприклад Peter J. Munson and David Rodbard, Ligand: A Versatile Computerized Approach For Characterization of Ligand-Binding Systems, 107(1) Anal. Biochem. 220-239 (1980). Після ідентифікації бажаних клітин гібридоми способи обмежуючого розведення використовують для 10 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 виділення клонів, що походять з одиничної клітини до одержання клональної клітинної лінії, експресуючої бажане моноклональне антитіло. Це антитіло достатньо вибіркове відносно SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, і що пов'язує з достатньо високою авідністю, вибрано для подальшого встановлення характеристик і дослідження. Як ще одна альтернатива одержання моноклонального антитіла α-SNAP-25, яке зв'язується з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, здійснюють шляхом скринінгу рекомбінантної комбінаторної іммуноглобулінової бібліотеки, такий як, наприклад бібліотека антитіл на основі фагового дисплею, з пептидом SNAP-25, і виділяють члени іммуноглобулінової бібліотеки, які зв'язуються з SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. Набори для одержання і скринінгу бібліотек на основі фагового дисплею є у продажу, такі як, наприклад the Recombinant Phage Antibody System (Amersham GE Healthcare, Piscataway, NJ); і SurfZAP™ Phage Display Kit (Stratagene, La Jolla, CA). Додатково, приклади способів і реагентів, корисні для одержання і скринінгу бібліотеки дисплею антитіл можна знайти, наприклад в Ladner et al. патент США 5223409; Borrebaeck et al. патент США 5712089; Griffiths et al. патент США 5885793; Griffiths et al. патент США 5962255; McCafferty et al. патент США 5969108; Griffiths et al. патент США 6010884; Jespers et al. патент США 6017732; Borrebaeck et al. патент США 6027930; Johnson et al. патент США 6140471; McCafferty et al. патент США 6172197, кожен з яких включений тут шляхом посилання. Аспекти даного опису включають, частково, збір зразка, що містить антитіло α-SNAP-25 або клітини, що продукують антитіло α-SNAP-25. Використовуваний тут термін "зразок, що містить антитіло α-SNAP-25 або клітини, що продукують антитіло α-SNAP-25" відноситься до будь-якого біологічного матеріалу, що містить або потенційно містить щонайменше одне антитіло α-SNAP25, яке зв'язуються з епітопом, що містить C-кінець на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25. Передбачається, що будьякий і всі зразки, які можуть містити антитіло α-SNAP-25, яке зв'язується з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть бути використані в цьому способі, що включають без обмеження кров, плазму крові, сироватку крові і лімфотичну рідину. Також передбачається, що будь-яка клітина, здатна продукувати антитіло α-SNAP-25, яке зв'язується з C-кінцем, що містить епітоп, на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, може бути використана в цьому способі, що включає без обмеження, клітини CD8, клітину CTL, хелперну T-клітину і B-клітину. Різноманітність добре відомих способів може бути використано для відбору у індивіда зразка, що містить антитіло αSNAP-25 або клітини, що продукують антитіло α-SNAP-25, наприклад Harlow & Lane, 1998a; і Harlow & Lane, 1998b. Аналогічно, різноманітність добре відомих способів може бути використано для обробки зразка для виділення антитіла α-SNAP-25, яке зв'язується з C-кінцем, що містить епітоп, на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A. Спосіб для відбору зразка може бути вибраний на основі типу антитіла, що виділяється. Як винахід прикладу, що не обмежує об'єм, коли виділяють поліклональні антитіла α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, відповідний зразок може бути зразком крові, що містить таке антитіло α-SNAP-25, тоді як при виделени моноклональних антитіл α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, відповідний зразок може бути клітиною, що продукує антитіло α-SNAP25, такою як клітина селезінки або гібридоми. Аспекти даного опису включають, частково, виділення із зразка антитіла α-SNAP-25, яке зв'язується з C-кінцем, що містить епітоп, на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25. Способи виділення такого антитіла α-SNAP-25, такого як, наприклад поліклональне антитіло α-SNAP-25, яке зв'язується з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, або моноклональне антитіло α-SNAP-25, яке зв'язується з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, добре відомі фахівцям в даній області техніки. Дивися, наприклад Harlow and Lane, вище, 1998a; і Harlow and Lane, вище, 1998b. Наприклад, такі поліклональні антитіла α-SNAP-25 можуть бути виділені із зразка за допомогою добре відомих способів, таких як, наприклад аффінна хроматографія з використанням білка A 11 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 або білка G, яка дозволяє одержати перш за все фракцію IGG імунної сироватки крові. Потім, або альтернативно, специфічний антиген SNAP-25 може бути іммобілізований на колонці або магнітних частинках для очищення поліклональних антитіл α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, за допомогою іммуноаффінної хроматографії. Моноклональні антитіла α-SNAP-25, які зв'язуються з C-кінцем, що містить епітоп, на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть бути виділені з культурального середовища або асцитної рідини за допомогою звичайних способів очищення імуноглобулінів, таких як, наприклад білок A-сефароза, гідроксіапатитна хроматографія, гель-електрофорез, діаліз або аффінна хроматографія. Таким чином, у втіленні спосіб продукції антитіла α-SNAP-25, яке зв'язується з C-кінцем, що містить епітоп, на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, включає стадії (a)введення тварині композиції, що містить антиген SNAP-25, що має карбоксильований C-кінцевий глутамін, пов'язаний з пептидом-носієм; (б) відбору у тваринного зразка, що містить антитіло α-SNAP-25 або клітини, що продукують антитіло α-SNAP-25; і (в) виділення компоненту антитіла α-SNAP-25 із зразка. У аспекті цього втілення антитіло αSNAP-25, яке зв'язується з C-кінцем, що містить епітоп, на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25, є поліклональне антитіло. У ще одному аспекті цього втілення антитіло α-SNAP-25, яке зв'язується з C-кінцем, що містить епітоп, на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, є моноклональне антитіло. У ще одному аспекті цього втілення продуковані моноклональні антитіла α-SNAP-25, які зв'язуються з C-кінцем, що містить епітоп, на залишку P1 з розщеплюваного зв'язку сайту розщеплювання BoNT/A продукту розщеплювання SNAP-25, мають підтип IGG. У інших аспектах цього втілення композиція SNAP25 додатково містить ад'ювант, такий як, наприклад поліетиленгліколь (PEG), монометоксиполіетиленгліколь (mPEG) або полівініловий спирт (PVA). У ще одному втіленні спосіб продукції антитіл α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, включає стадії (a) введення тварині композиції, що містить пептид SNAP-25, що має карбоксильований C-кінцевий глутамін, пов'язаний з гнучким лінкером, і несучий пептид, де гнучкий лінкер розташовується між пептидом SNAP-25 і несучим пептидом; (б) відбору у тваринного зразка, що містить антитіло α-SNAP-25 або клітини, що продукують антитіло α-SNAP-25; і (в) виділення антитіла α-SNAP-25 із зразка. У аспекті цього втілення антитіла α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, є поліклональні антитіла. У ще одному аспекті цього втілення антитіла α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, є моноклональні антитіла. У ще одному аспекті цього втілення продуковані моноклональні антитіла α-SNAP-25, які зв'язуються з C-кінцем, що містить епітоп, на залишку P1 продукту розщеплювання SNAP-25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A, мають підтип IGG. У інших аспектах цього втілення композиція SNAP-25 додатково містить ад'ювант, такий як, наприклад поліетиленгліколь (PEG), монометоксиполіетиленгліколь (mPEG) або полівіниловий спирт (PVA). Аспекти даного опису включають, частково, виділене антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. Використовуваний тут термін "виділені" відноситься до виділення молекули з її природного оточення за допомогою людського втручання. Використовуваний тут термін "антитіло" відноситься до молекули, продлуцируючої імунною системою у відповідь на конкретний антиген, який специфічно зв'язується з цим антигеном, і включає антитіло, що зустрічається в природі, і антитіло, що не зустрічається в природі. Використовуваний тут термін ―α-SNAP-25" є синонімом "анти-SNAP-25" і відноситься до антитіла, яке зв'язується з антигеном SNAP-25. Наприклад, антитілом можуть бути поліклональне антитіло, моноклональне антитіло, димір, мультимір, мультиспецифічне антитіло, гуманізоване антитіло, химерне антитіло, біфункціональне антитіло, асоційоване з клітиною антитіло, таке як рецептор Ig, лінійне антитіло, діатіло або мінітіло, до тих пір, поки фрагмент демонструє бажану біологічну активність, і їх одноланцюгові похідні. Антитіло може бути повнорозмірною молекулою імуноглобуліну, що містить домени VH і VL, а також константний домен легкого ланцюга (CL) і 12 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 константні домени важкого ланцюга, CH1, CH2 і CH3, або імунологічно активний фрагмент повнорозмірної молекули імуноглобуліну, такої як, наприклад Fab фрагмент, F(ab') 2 фрагмент, Fc фрагмент, Fd фрагмент, Fv фрагмент. Антитіло може походити з будь-якого виду хребетної тварини (наприклад людини, кози, коня, осла, миші, щура, кролика або курчати), і може мати будь-який тип (наприклад IGG, IGE, IGM, IGD і IGA), клас (наприклад IGA, IGD, IGE, IGG і IGM) або підклас (IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2). Загальний опис структури антитіла, що зустрічається в природі, не зустрічається в природі антитіла і його антигенних фрагментів, що зв'язуються із сполукум, наприклад в Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrabeck, Antibody Engineering, 2d ed.(Oxford University Press 1995), кожна з яких включена тут шляхом посилання. Антитіла, що зустрічаються в природі, зазвичай є гетеротетрамірні глікопротеїнами приблизно 150000 дальтон, складаються з двох ідентичних легких (L) ланцюгів і двох ідентичних важких (H) ланцюгів. Кожен легкий ланцюг пов'язаний з важким ланцюгом за допомогою одного ковалентного дисульфідного зв'язку, хоча кількість дисульфідних зв'язків розрізняється між важкими ланцюгами різних ізотипів імуноглобуліну. Кожен важкий і легкий ланцюг також має регулярно розташовані міжланцюгові дисульфідні містки. Кожен важкий ланцюг має з одного кінця варіабільний домен (VH), за яким слідує безліч константних доменів. Кожен легкий ланцюг має варіабільний домен з одного кінця (VL) і константний домен з іншого кінця. Константний домен легкого ланцюга суміщений з першим константним доменом важкого ланцюга, і варіабільний домен легкого ланцюга суміщений з варіабільним доменом важкого ланцюга. Вважають, що конкретні амінокислотні залишки утворюють простір між варіабільними доменами легкого ланцюга і важкого ланцюга. Повний сайт розпізнавання антигена і скріплення антигена міститься у варіабільних доменах антитіла, тобто Fv фрагмент. Цей фрагмент включає димір одного варіабільного домена важкого ланцюга (VH) і одного варіабільного домена легкого ланцюга (VL) в тісній нековалентній асоціації. Кожен домен містить чотири скелетні області (FR), які в основному приймають конфігурацію α-листа, зв'язані трьома гіперваріабільними областями, які утворюють петлі, що зв'язують, і в деяких випадках створюючі частину структури α-листа. Кожна гіперваріабільна область містить амінокислотну послідовність, відповідну гіперваріабільним ділянкам (CDR). В сукупності, вона є тривимірною конфігурацією шести областей CDR, які визначають антигензв'язуючий сайт на поверхні диміра VH–VL, який визначає антигензв'язуючу специфічність. Дивися, наприклад Cyrus Chothia, et al., Conformations of Immunoglobulin Hypervariable Regions, Nature 342(6252): 877-883 (1989); Elvin A. Kabat, et al Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991), кожна з яких включена тут шляхом посилання. Константні домени антитіла не залучені безпосередньо в пов'язання антитіла з антигеном, але демонструють різні еффекторні функції, такі як участь антитіла в залежній від антитіла клітинній цитотоксичності. Антиген-мішень як правило має один або більш ніж один сайт скріплення, також званий епітопами, який розпізнається утвореним CDR антигензв'язуючим сайтом. Використовуваний тут "епітоп" є синонімом "антигенної детермінанти" і відноситься до сайту на антигені-мішені, такий як, наприклад пептид, полісахарид або липідомістяща молекула, здатна до специфічного пов'язання з імуноглобуліном або T-клітинним рецептором або іншої взаємодії з молекулою. Кожне антитіло, яке специфічно зв'язується з епітопом, що відрізняється, має структуру, що відрізняється. Таким чином, один антиген може мати більш ніж одне відповідне антитіло. Поліклональні антитіла відносяться до гетерогенної популяції молекул антитіл, які містять щонайменше два види антитіл, здатних зв'язуватися з конкретним антигеном. Відповідно до визначення поліклональне антитіло включає два різні антитіла, які зв'язуються з щонайменше двома різними епітопами. Використовуваний тут термін "моноклональне антитіло" або "моноклональні антитіла" відносяться до гомогенної популяції молекул антитіл, які містять тільки один вид антитіл, здатний зв'язуватися з конкретним антигеном, тобто індивідуальні антитіла, складові популяції, ідентичні за винятком можливих мутацій, що зустрічаються в природі, які можуть бути представлені в мінорних кількостях. Відповідно до визначення моноклональне антитіло зв'язується з одиничним епітопом. Моноклональні антитіла є високоспецифічними, оскільки направлені проти одиничного антигенного сайту. Крім того, в протилежність поліклональним антитілам, кожне моноклональне антитіло направлене проти одиничної детермінанти на антигені. Додатково до своєї специфічності моноклональні антитіла сприятливі в тому, що вони можуть синтезуватися без домішок інших антитіл. Визначення "моноклональні" указує на характер антитіла, одержаного з по суті гомогенної популяції антитіл, і його не слід розглядати, як вимогу продукції антитіла за допомогою якого-небудь конкретного 13 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 чину. Наприклад моноклональні антитіла, використовувані відповідно до даного опису, можуть бути одержані за допомогою гібридомної технології, вперше описаної Kohler et al (1975) Nature 256:495, або можуть бути одержані за допомогою способів рекомбінантної ДНК (дивися, наприклад: патент США № 4816567; патент США №. 5807715). Моноклональні антитіла також можуть бути виділені з бібліотек фагового антитіла з використанням способів, описаних, наприклад Clackson et al (1991) Nature, 352:624-628; Marks et al (1991) J. Mol. Biol., 222:581-597. Таким чином, у втіленні антитіло α-SNAP-25 містить варіабільний домен важкого ланцюга (VH) і варіабільний домен легкого ланцюга (VL), які вибірково зв'язуються з SNAP-25, що має Cкінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. У аспекті цього втілення варіабільний домен важкого ланцюга (VH) є SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 80 або SEQ ID NO: 82. У ще одному аспекті цього втілення варіабільний домен легкого ланцюга (VL) є SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90 або SEQ ID NO: 92. У ще одному втіленні антитіло α-SNAP-25 містить CDR1 область, CDR2 область, CDR3 область варіабільного домена важкого ланцюга (VH), або будь-яку їх комбінацію, яка вибірково зв'язується з SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. У аспекті цього втілення CDR1 область варіабільного домена важкого ланцюга (VH) є SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 118, SEQ ID NO: 119 або SEQ ID NO: 120. У ще одному аспекті цього втілення CDR 2 область варіабільного домена важкого ланцюга (VH) є SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 121, SEQ ID NO: 122, або SEQ ID NO: 123. У ще одному аспекті цього втілення CDR 3 область варіабільного домена важкого ланцюга (VH) є SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102 або SEQ ID NO: 124. У ще одному втіленні антитіло α-SNAP-25 містить CDR1 область, CDR2 область, CDR3 область варіабільного домена легкого ланцюга (VL) або будь-яку їх комбінацію, яка вибірково зв'язується з SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. У аспекті цього втілення CDR1 область варіабільного домена легкого ланцюга (VL) є SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128 або SEQ ID NO: 129. У ще одному аспекті цього втілення CDR2 область варіабільного домена легкого ланцюга (VL) є SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111 або SEQ ID NO: 112. У ще одному аспекті цього втілення CDR3 область варіабільного домена легкого ланцюга (VL) є SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116 або SEQ ID NO: 117. У ще одному втіленні антитіло α-SNAP-25 специфічно зв'язується з епітопом, що містить SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. У аспекті цього втілення епітоп містить SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 147 або SEQ ID NO: 148. У аспекті цього втілення епітоп містить SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 або SEQ ID NO: 44. Як обговорювалося вище, послідовність, що оточує сайт розщеплювання BoNT/A, представлена в SNAP-25, позначається P5–P4–P3–P2–P1–P1’–P2’–P3’–P4’–P5", де P1–P1" є розщеплюваним зв'язком. При розщеплюванні під дією BoNT/A продукти розщеплювання, що утворюються в результаті, містять фрагмент, що включає послідовність P5–P4–P3–P2–P1, і фрагмент, включаючий P1’–P2’–P3’–P4’–P5". Використовуваний тут термін "антитіла α-SNAP-25, які зв'язуються з епітопом, що містить C-кінець на залишку P1 продукту розщеплювання SNAP25 з розщеплюваного зв'язку сайту розщеплювання BoNT/A" відноситься до антитіл α-SNAP-25, які вибірково зв'язуються з будь-яким фрагментом продукту розщеплювання SNAP-25, що містить послідовність P5–P4–P3–P2–P1, але не до будь-якого фрагмента продукту розщеплювання SNAP-25, що містить послідовність P1’–P2’–P3’–P4’–P5", або до будь-якого SNAP-25, що має інтактний розщеплюваний зв'язок P1–P1" сайту розщеплювання BoNT/A. Використовуваний тут термін "антитіло α-SNAP-25197" відноситься до антитіла, яке вибірково зв'язується з SNAP-25, що має на C-кінцевий залишок P1, який відповідає глутаміну 197 в SEQ ID NO: 5. Використовуваний тут термін "антитіло α-SNAP-25204" відноситься до антитіла, яке вибірково зв'язується з SNAP-25, що має C-кінцевий залишок P1, який відповідає лізину 204 в SEQ ID NO: 16. Використовуваний тут термін "вибірково" відноситься до того, що має унікальну дію або вплив, або вступаючому у взаємодію тільки одним чином або тільки з одним об'єктом. Використовуваний тут термін "вибірково зв'язується", коли застосовується з посиланням на антитіло, відноситься до різного пов'язання антитіла з вказаним епітопом-мішенню, таким чином, що антитіло по суті не надає перехресної взаємодії з епітопами, що відрізняються від 14 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 епітопів-мішеней. Мінімальний розмір визначеного тут пептидного епітопа складає приблизно п'ять амінокислот, і пептидний епітоп типово містить щонайменше 5, щонайменше 6, щонайменше 7, щонайменше 8, щонайменше 9, щонайменше 10, щонайменше 15 або, щонайменше 20 амінокислот. Пептидний епітоп може бути переривистим, тобто він містить амінокислотні залишки, які не є сусідніми з первинною структурою пептиду, але разом приносяться в епітоп завдяки вторинній, третинній або четвертинній структурі пептиду. Крім того, також відзначають, що епітоп може містити фрагмент молекули, що відрізняється від амінокислотної послідовності, такий як, наприклад вуглеводневе угрупування, ліпідне угрупування, таке як ліпопротеїни або гліколіпіди, або хімічно модифіковане амінокислотне угрупування, таке як амінокислота, що фосфорилює. У аспектах цього втілення антитіло αSNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може вибірково зв'язуватися з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, що містить щонайменше 5, щонайменше 6, щонайменше 7, щонайменше 8, щонайменше 9, щонайменше 10, щонайменше 15 або, щонайменше 20 амінокислот. У інших аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може вибірково зв'язуватися з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, що містить максимально 5, максимально 6, максимально 7, максимально 8, максимально 9, максимально 10, максимально 15 або максимальні 20 амінокислот. Виборче скріплення включає зв'язуючі властивості, такі як, наприклад аффінність скріплення, специфічність скріплення і авидність скріплення. Дивися David J. King, Applications and Engineering of Monoclonal Antibodies, pp. 240 (1998). Аффінність скріплення відноситься до тривалого проміжку часу, протягом якого антитіло залишається на сайті скріплення епітопа, і може бути розглянута як сила, з якою антитіло зв'язується зі своїм епітопом. Аффінність скріплення може бути описана як рівноважна константа дисоціації антитіла (KD), яка визначається як відношення Kd/Ka в стані рівноваги. Де Ka є константою швидкості асоціації антитіла і Кd є константою швидкості дисоціації антитіла. Аффінність скріплення визначається як асоціацією, так і дисоціацією і самостійно ні висока асоціація, ні низька дисоціація не можуть забезпечити високу аффінність. Константа швидкості асоціації (Ka), або швидкість асоціації (Kon) вимірює кількість скріпленнь в одиницю часу, або схильність антитіла і антигена оборотно -1 -1 асоціювати в комплекс антитіло-антиген. Константа швидкості асоціації виражається в M с , і розраховується таким чином: [Ab] x [Ag] x Kon. Чим більша константа швидкості асоціації, тим швидше антитіло зв'язується зі своїм антигеном, або вище за аффінність скріплення між антитілом і антигеном. Константа швидкості дисоціації (Kd) або швидкість дисоціації (Koff) вимірює кількість подій дисоціації в одиницю часу або схильність комплексу антитіло-антиген оборотно розділятися (диссоціювати) на молекули, що становлять, а саме антитіло і антиген. -1 Константа швидкості дисоціації виражається в с , і розраховується таким чином: [Ab+Ag] x Koff. Чим менша константа швидкості дисоціації, тим тісніше зв'язано антитіло зі своїм антигеном або вище за аффінність скріплення між антитілом і антигеном. Рівноважна константа дисоціації (KD) вимірює швидкість, з якою утворюються нові комплекси антитіло-антиген, і вона дорівнює швидкості, з якою комплекси антитіло-антиген диссоціюють в рівновазі. Рівноважна константа дисоціації виражається в M, і визначається як Koff/Kon=[Ab] x [Ag]/[Ab+Ag], де [Ab] є молярною концентрацією антитіла, [Ag] є молярною концентрацією антигена, і [Ab+Ag] є молярною концентрацією комплексу антитіло-антиген, де всі концентрації є такими, що система знаходиться в рівновазі. Чим менше рівноважна константа дисоціації, тим тісніше зв'язано антитіло зі своїм антигеном, або вище за аффінність скріплення між антитілом і антигеном. Таким чином, у втіленні аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту 5 розщеплювання BoNT/A, може мати константу швидкості асоціації, наприклад менше ніж 1 × 10 -1 -1 6 -1 -1 7 -1 -1 8 -1 -1 M с , менше ніж 1 × 10 M с , менше ніж 1 × 10 M с , або менше ніж 1 × 10 M с . У ще одному втіленні аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту 5 розщеплювання BoNT/A, може мати константу швидкості асоціації, наприклад більш ніж 1 × 10 -1 -1 6 -1 -1 7 -1 -1 8 -1 -1 M с , більш ніж 1 × 10 M с , більш ніж 1 × 10 M с або більш ніж 1 × 10 M с . У інших аспектах аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання 5 -1 -1 8 -1 -1 6 BoNT/A, може мати константу швидкості асоціації від 1 × 10 M с до 1 × 10 M с , від 1 × 10 -1 -1 8 -1 -1 5 -1 -1 7 -1 -1 6 -1 -1 7 -1 M с до 1 × 10 M с , від 1 × 10 M с до 1 × 10 M с або від 1 × 10 M с до 1 × 10 M с 15 UA 102247 C2 1 . 5 10 15 20 25 30 35 40 45 50 55 60 У ще одному втіленні аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту -3 -1 розщеплювання BoNT/A, може мати константу швидкості дисоціації менше ніж 1 × 10 с , -4 -1 -5 -1 менше ніж 1 × 10 с або менше ніж 1 × 10 с . У інших аспектах цього втілення аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть мати константу -4 -1 -4 -1 швидкості дисоціації, наприклад менше ніж 1,0 × 10 с , менше ніж 2,0 × 10 с , менше ніж 3,0 -4 -1 -4 -1 -4 -1 -4 -1 × 10 с , менше ніж 4,0 × 10 с , менше ніж 5,0 x 10 с , менше ніж 6,0 × 10 с , менше ніж 7,0 -4 -1 -4 -1 -4 -1 × 10 с , менше ніж 8,0 × 10 с або менше ніж 9,0 × 10 с . У ще одному втіленні аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати константу -3 -1 -4 -1 -5 швидкості дисоціації, наприклад більш ніж 1 × 10 с , більш ніж 1 × 10 с або більш ніж 1 × 10 -1 с . У інших аспектах цього втілення аффінність скріплення антитіла α-SNAP-25, яке вибірково 1 зв'язується з епітопом SNAP-25, що має C-кінець на залишку P розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати константу швидкості дисоціації, наприклад більш ніж 1,0 × -4 -1 -4 -1 -4 -1 -4 -1 -4 10 с , більш ніж 2,0 × 10 с , більш ніж 3,0 × 10 с , більш ніж 4,0 × 10 с , більш ніж 5,0 × 10 -1 -4 -1 -4 -1 -4 -1 -4 с , більш ніж 6,0 × 10 с , більш ніж 7,0 × 10 с , більш ніж 8,0 × 10 с або більш ніж 9,0 × 10 -1 с . У ще одному втіленні, аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть мати рівноважну константу дисоціації менше ніж 0,500 нМ. У аспектах цього втілення аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, можуть мати рівноважну константу дисоціації, наприклад менше ніж 0,500 нМ, менше ніж 0,450 нМ, менше ніж 0,400 нМ, менше ніж 0,350 нМ, менше ніж 0,300 нМ, менше ніж 0,250 нМ, менше ніж 0,200 нМ, менше ніж 0,150 нМ, менше ніж 0,100 нМ або менше ніж 0,050 нМ. У ще одному втіленні аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати рівноважну константу дисоціації більш ніж 0,500 нМ. У аспектах цього втілення аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати рівноважну константу дисоціації, наприклад більш ніж 0,500 нМ, більш ніж 0,450 нМ, більш ніж 0,400 нМ, більш ніж 0,350 нМ, більш ніж 0,300 нМ, більш ніж 0,250 нМ, більш ніж 0,200 нМ, більш ніж 0,150 нМ, більш ніж 0,100 нМ або більш ніж 0,050 нМ. У ще одному втіленні аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати константу швидкості асоціації для інтактного SNAP-25, 0 -1 -1 1 -1 -1 2 -1 -1 наприклад менше ніж 1 × 10 M с , менше ніж 1 × 10 M с , менше ніж 1 × 10 M с , менше 3 -1 -1 4 -1 -1 ніж 1 × 10 M с або менше ніж 1 × 10 M с . У ще одному втіленні аффінність скріплення антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може мати константу швидкості 0 -1 -1 1 асоціації для інтактного SNAP-25, наприклад максимально 1 × 10 M с , максимально 1 × 10 -1 -1 2 -1 -1 3 -1 -1 4 -1 -1 M с , максимально 1 × 10 M с , максимально 1 × 10 M с або максимально 1 × 10 M с . Зв'язуюча специфічність є здатністю антитіла розрізняти молекулу, що містить його епітоп, і молекулу, яка не містить цей епітоп. Один з шляхів вимірювання зв'язуючої специфічності полягає в порівнянні Kon швидкості асоціації антитіла для молекули, що містить його епітоп, відносно Kon швидкості асоціації антитіла для молекули, яка не містить цей епітоп. Наприклад порівняння константи швидкості асоціації (Ka) антитіла α-SNAP-25 для епітопа SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, відносно SNAP25, що не містить цей епітоп, такого як, наприклад епітоп SNAP-25, що не містить C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, або епітоп SNAP-25, що має інтактну P1–P1" розщеплюваний зв'язок сайту розщеплювання BoNT/A. У аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має константу швидкості 0 -1 -1 асоціації (Ka) для SNAP-25, що не містить його епітоп(и), наприклад менше ніж 1 × 10 M с , 1 -1 -1 2 -1 -1 3 -1 -1 менше ніж 1 × 10 M с , менше ніж 1 × 10 M с , менше ніж 1 × 10 M с або менше ніж 1 × 4 -1 -1 10 M с . У інших аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має константу швидкості асоціації (Ka) для SNAP-25, що не містить 16 UA 102247 C2 0 5 10 15 20 25 30 35 40 45 50 55 60 -1 -1 1 -1 -1 його епітоп(и), наприклад максимально 1 × 10 M с , максимально 1 × 10 M с , максимально 2 -1 -1 3 -1 -1 4 -1 -1 1 × 10 M с , максимально 1 × 10 M с або максимально 1 × 10 M с . У інших аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має константу швидкості асоціації (Ka) для свого епітопа відносно SNAP-25, що не містить цей епітоп, наприклад щонайменше в 2 рази більше, щонайменше в 3 рази більше, щонайменше в 4 рази більше, щонайменше в 5 разів більше, щонайменше в 6 разів більше, щонайменше в 7 разів більше, щонайменше в 8 разів більше або, щонайменше в 9 разів більше. У додаткових аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має константу швидкості асоціації (Ka) для свого епітопа в порівнянні з SNAP-25, що не містить цей епітоп, наприклад щонайменше в 10 разів більше, щонайменше в 100 разів більше, щонайменше в 1000 разів більше або, щонайменше в 10000 разів більше. У інших аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має константу швидкості асоціації (Ka) для свого епітопа в порівнянні з SNAP-25, що не містить цього епітопа, наприклад, максимально в 1 раз більше, максимально в 2 рази більше, максимально в 3 рази більше, максимально в 4 рази більше, максимально в 5 разів більше, максимально в 6 разів більше, максимально в 7 разів більше, максимально в 8 разів більше або максимально в 9 разів більше. У інших аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має константу швидкості асоціації (Ka) для свого епітопа в порівнянні з SNAP-25, що не містить цього епітопа, наприклад максимально в 10 разів більше, максимально в 100 разів більше, максимально в 1000 разів більше або максимально в 10000 разів більше. Зв'язуюча специфічність антитіла α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, також може бути охарактеризована як відношення, при якому антитіло α-SNAP-25 може відрізняти свій епітоп SNAP-25 від SNAP-25, що не містить цей епітоп, такий як, наприклад епітоп SNAP-25, позбавлений C-кінця на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, або епітоп SNAP-25, що має інтактний розщеплюваний зв'язок P1–P1" сайту розщеплювання BoNT/A. У аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має відношення зв'язуючої специфічності для його епітопа SNAP-25 до SNAP-25, що не містить цей епітоп, наприклад щонайменше 2:1, щонайменше 3:1, щонайменше 4:1, щонайменше 5:1, щонайменше 64:1, щонайменше 7:1, щонайменше 8:1, щонайменше 9:1, щонайменше 10:1, щонайменше 15:1, щонайменше 20:1, щонайменше 25:1, щонайменше 30:1, щонайменше 35:1 або, щонайменше 40:1. У інших аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має відношення зв'язуючої специфічності для його епітопа SNAP-25 до SNAP-25, позбавленого C-кінця на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, наприклад щонайменше 2:1, щонайменше 3:1, щонайменше 4:1, щонайменше 5:1, щонайменше 6:1, щонайменше 7:1, щонайменше 8:1, щонайменше 9:1, щонайменше 10:1, щонайменше 15:1, щонайменше 20:1, щонайменше 25:1, щонайменше 30:1, щонайменше 35:1 або, щонайменше 40:1. У інших аспектах цього втілення антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, має відношення зв'язуючої специфічності для його епітопа SNAP-25 до SNAP-25, що має інтактний розщеплюваний зв'язок P1–P1" сайту розщеплювання BoNT/A, наприклад щонайменше 2:1, щонайменше 3:1, щонайменше 4:1, щонайменше 5:1, щонайменше 64:1, щонайменше 7:1, щонайменше 8:1, щонайменше 9:1, щонайменше 10:1, щонайменше 15:1, щонайменше 20:1, щонайменше 25:1, щонайменше 30:1, щонайменше 35:1 або, щонайменше 40:1. Авідність скріплення, також відома як функціональна аффінність, відноситься до сукупності функціональної сили скріплення між мульвалентним антитілом і його антигеном. Молекули антитіла можуть мати більш ніж один сайт скріплення (наприклад 2 для IGG, 10 для IGM), і безліч антигенів містять більш ніж один антигенний сайт. Хоча авідність скріплення антитіла залежить від аффінностей скріплення індивідуальних сайтів скріплення антитіла, авідність скріплення більш ніж аффінність скріплення, оскільки всі взаємодії антитіло-антиген повинні порушуватися одночасно для того, щоб антитіло повністю диссоціювало. Передбачається, що антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку 17 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A, може вибірково зв'язуватися з будьяким і всіма епітопами для цього антитіла. Таким чином, у втіленні антитіло α-SNAP-25 є антитілом α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. У аспектах цього втілення антитіло α-SNAP-25 є антитілом α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінцевий глутамін, або антитіло αSNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінцевий лізин. У інших аспектах цього втілення антитіло α-SNAP-25 є антитілом α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінцевий залишок P1, відповідний глутаміну 197 в SEQ ID NO: 5, або антитіло α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має C-кінцевий залишок P1, відповідний лізину 204 в SEQ ID NO: 16. У інших аспектах цього втілення антитіло α-SNAP-25 є антитілом α-SNAP-25, яке вибірково зв'язується з епітопом SNAP-25, що має а Cкінцеву амінокислотну послідовність SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 147, або SEQ ID NO: 148. Аспекти даного опису включають, частково, імунологічний спосіб виявлення активності BoNT/A. Імунологічні способи, розкриті в даному описі, можуть бути оцінені за допомогою декількох параметрів, що включають, наприклад правильність, точність, межу виявлення (LOD), межі кількісного визначення (LOQ), діапазон, специфічність, вибірковість, лінійність, міцність і придатність системи. Правильність способу полягає у вимірюванні акуратності аналітичного способу, або близькість вимірюваного значення і значення, яке признається, як загальноприйняте правильне значення, або прийнятне референсне значення. Точністю способу є ступінь згоди між результатами індивідуальних тестів, коли спосіб застосовується повторно відносно безлічі відібраних зразків з гомогенного зразка. Сама по собі точність оцінює 1) варіабільність усередині аналізу; 2) варіабільність протягом доби (повторюваність); і 3) варіабільність між добами (внутрішньолабораторна точність); і 4) варіабільність між лабораторіями (відтворюваність). Коефіцієнт варіації (CV%) є кількісною мірою точності, вираженою щодо середнього значення, що виявляється або теоретичного. Імунологічний спосіб, розкритий в даному описі, має бути здатний виявляти відносну присутність комплексу антитіло α-SNAP-25-антиген, що містить SNAP-25, що має C-кінець на залишку P1 розщеплюваного зв'язку сайту розщеплювання BoNT/A. Межа виявлення (LOD) способу відноситься до концентрації аналита, яка викликає сигнал, який істотно відрізняється від негативного контролю або бланку, і є найменшою концентрацією аналіту, яка може відрізнятися від фону. Таким чином, у втіленні імунологічного спосібу, розкритого в даному описі, може виявляти LOD для BoNT/A в кількості, яка істотно відрізняється від негативного контролю або бланка. У аспекті цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 10 нг або менше, 9 нг або менше, 8 нг або менше, 7 нг або менше, 6 нг або менше, 5 нг або менше, 4 нг або менше, 3 нг або менше, 2 нг або менше, 1 нг або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 900 пг або менше, 800 пг або менше, 700 пг або менше, 600 пг або менше, 500 пг або менше, 400 пг або менше, 300 пг або менше, 200 пг або менше, 100 пг або менше BoNT/A. У додаткових аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 90 пг або менше, 80 пг або менше, 70 пг або менше, 60 пг або менше, 50 пг або менше, 40 пг або менше, 30 пг або менше, 20 пг або менше, 10 пг або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 9 пг або менше, 8 пг або менше, 7 пг або менше, 6 пг або менше, 5 пг або менше, 4 пг або менше, 3 пг або менше, 2 пг або менше, 1 пг або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 0,9 пг або менше, 0,8 пг або менше, 0,7 пг або менше, 0,6 пг або менше, 0,5 пг або менше, 0,4 пг або менше, 0,3 пг або менше, 0,2 пг або менше, 0,1 пг або менше BoNT/A. У ще одному аспекті цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 10 нМ або менше, 9 нМ або менше, 8 нМ або менше, 7 нМ або менше, 6 нМ або менше, 5 нМ або менше, 4 нМ або менше, 3 нМ або менше, 2 нМ або менше або 1 нМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 900 пМ або менше, 800 пМ або менше, 700 пМ або менше, 600 пМ або менше, 500 пМ або менше, 400 пМ або менше, 300 пМ або менше, 200 пМ або менше або 100 пМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 100 пМ або менше, 90 пМ або менше, 80 пМ або менше, 70 пМ або менше, 60 пМ або менше, 50 пМ або менше, 40 пМ або менше, 30 пМ або менше, 20 пМ 18 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 або менше або 10 пМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 10 пМ або менше BoNT/A, 9 пМ або менше, 8 пМ або менше, 7 пМ або менше, 6 пМ або менше, 5 пМ або менше, 4 пМ або менше, 3 пМ або менше, 2 пМ або менше або 1 пМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 1000 фМ або менше, 900 фМ або менше, 800 фМ або менше, 700 фМ або менше, 600 фМ або менше, 500 фМ або менше, 400 фМ або менше, 300 фМ або менше, 200 фМ або менше або 100 фМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 100 фМ або менше, 90 фМ або менше, 80 фМ або менше, 70 фМ або менше, 60 фМ або менше, 50 фМ або менше, 40 фМ або менше, 30 фМ або менше, 20 фМ або менше або 10 фМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOD, наприклад 10 фМ або менше, 9 фМ або менше, 8 фМ або менше, 7 фМ або менше, 6 фМ або менше, 5 фМ або менше, 4 фМ або менше, 3 фМ або менше, 2 фМ або менше або 1 фМ або менше ніж ботулінічний нейротоксин A. Межі кількісного визначення (LOQ) є найменшою і найвищою концентраціями аналіту в зразку або пробі, які можуть бути зміряні з прийнятним рівнем правильності і точності. Нижня межа кількісного визначення відноситься до найменшої дози, яку спосіб виявлення може вимірювати систематично щодо фону. Верхня межа кількісного визначення є найвищою дозою, яку спосіб виявлення може вимірювати систематично до насичення сигналу. Лінійним діапазоном способу є площа між нижньою і верхньою межами кількісного визначення. Лінійний діапазон розраховується шляхом віднімання нижньої межі кількісного визначення з верхньої межі кількісного визначення. Використовуваний тут термін "відношення сигналу до шуму для нижньої асимптоти" відноситься до сигналу, що виявляється в способі на нижній межі виявлення, розділенного на фоновий сигнал. Використовуваний тут термін "відношення сигналу до шуму для верхньої асимптоти" відноситься до сигналу, що виявляється в способі на верхній межі виявлення, розділенного на фоновий сигнал. Таким чином, у втіленні імунологічного спосібу, розкритого в даному описі, може виявляти LOQ для BoNT/A в кількості, яка істотно відрізняється від негативного контролю або бланка. У аспекті цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 10 нг або менше, 9 нг або менше, 8 нг або менше, 7 нг або менше, 6 нг або менше, 5 нг або менше, 4 нг або менше, 3 нг або менше, 2 нг або менше, 1 нг або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 900 пг або менше, 800 пг або менше, 700 пг або менше, 600 пг або менше, 500 пг або менше, 400 пг або менше, 300 пг або менше, 200 пг або менше, 100 пг або менше BoNT/A. У додаткових аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 90 пг або менше, 80 пг або менше, 70 пг або менше, 60 пг або менше, 50 пг або менше, 40 пг або менше, 30 пг або менше, 20 пг або менше, 10 пг або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 9 пг або менше, 8 пг або менше, 7 пг або менше, 6 пг або менше, 5 пг або менше, 4 пг або менше, 3 пг або менше, 2 пг або менше, 1 пг або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 0,9 пг або менше, 0,8 пг або менше, 0,7 пг або менше, 0,6 пг або менше, 0,5 пг або менше, 0,4 пг або менше, 0,3 пг або менше, 0,2 пг або менше, 0,1 пг або менше BoNT/A. У ще одному аспекті цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ наприклад 10 нМ або менше, 9 нМ або менше, 8 нМ або менше, 7 нМ або менше, 6 нМ або менше, 5 нМ або менше, 4 нМ або менше, 3 нМ або менше, 2 нМ або менше, або 1 нМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 900 пМ або менше, 800 пМ або менше, 700 пМ або менше, 600 пМ або менше, 500 пМ або менше, 400 пМ або менше, 300 пМ або менше, 200 пМ або менше або 100 пМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 100 пМ або менше, 90 пМ або менше, 80 пМ або менше, 70 пМ або менше, 60 пМ або менше, 50 пМ або менше, 40 пМ або менше, 30 пМ або менше, 20 пМ або менше або 10 пМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 10 пМ або менше BoNT/A, 9 пМ або менше, 8 пМ або менше, 7 пМ або менше, 6 пМ або менше, 5 пМ або менше, 4 пМ або менше, 3 пМ або менше, 2 пМ або менше або 1 пМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 1000 фМ або менше, 900 фМ або менше, 800 фМ або менше, 700 фМ або менше, 600 фМ або менше, 500 фМ або менше, 400 фМ або менше, 300 фМ або менше, 200 фМ або менше або 100 фМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має 19 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 LOQ, наприклад 100 фМ або менше, 90 фМ або менше, 80 фМ або менше, 70 фМ або менше, 60 фМ або менше, 50 фМ або менше, 40 фМ або менше, 30 фМ або менше, 20 фМ або менше або 10 фМ або менше BoNT/A. У інших аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має LOQ, наприклад 10 фМ або менше, 9 фМ або менше, 8 фМ або менше, 7 фМ або менше, 6 фМ або менше, 5 фМ або менше, 4 фМ або менше, 3 фМ або менше, 2 фМ або менше або 1 фМ або менше BoNT/A. Імунологічний аналіз, корисний для практичного застосування аспекту розкритих способів, повинен мати точність не більш ніж 50 %. У аспектах цього втілення імунологічний аналіз має точність не більш ніж 50 %, не більш ніж 40 %, не більш ніж 30 %, або не більш ніж 20 %. У інших аспектах цього втілення імунологічний аналіз має точність не більш ніж 15 %, не більш ніж 10 %, або не більш ніж 5 %. У інших аспектах цього втілення імунологічний аналіз має точність не більш ніж 4 %, не більш ніж 3 %, не більш ніж 2 %, або не більш ніж 1 %. Імунологічний аналіз, корисний для практичного застосування аспекту розкритих способів, повинен мати правильність, щонайменше 50 %. У аспектах цього втілення імунологічний аналіз має правильність щонайменше 50 %, щонайменше 60 %, щонайменше 70 % або, щонайменше 80 %. У інших аспектах цього втілення імунологічний аналіз має правильність в меншій мірі 85 %, щонайменше 90 % або, щонайменше 95 %. У інших аспектах цього втілення імунологічний аналіз має правильність щонайменше 96 %, щонайменше 97 %, щонайменше 98 % або, щонайменше 99 %. Імунологічний спосіб, розкритий в даному описі, повинен мати відношення сигналу до шуму для нижньої асимптоти, яке є статистично значущим, і відношення сигналу до шуму для верхньої асимптоти, яке є статистично значущим. У аспектах цього втілення імунологічний спосіб, розкритий в даному описі, має відношення сигналу до шуму для нижньої асимптоти, наприклад, щонайменше 3:1, щонайменше 4:1,по меншій мірі 5:1, щонайменше 6:1, щонайменше 7:1, щонайменше 8:1, щонайменше 9:1, щонайменше 10:1, щонайменше 15:1 або, щонайменше 20:1. У інших аспектах цього втілення імунологічний спосіб має відношення сигналу до шуму для верхньої асимптоти, наприклад, щонайменше 10:1, щонайменше 15:1, щонайменше 20:1, щонайменше 25:1, щонайменше 30:1, щонайменше 35:1, щонайменше 40:1, щонайменше 45:1, щонайменше 50:1, щонайменше 60:1, щонайменше 70:1, щонайменше 80:1, щонайменше 90:1, або, щонайменше 100:1, щонайменше 150:1, щонайменше 200:1, щонайменше 250:1, щонайменше 300:1, щонайменше 350:1, щонайменше 400:1, щонайменше 450:1, щонайменше 500:1, щонайменше 550:1 або, щонайменше 600:1. Специфічність способу визначає здатність способу для вимірювання віжповідного аналіту, з виключенням інших компонентів, таких як наприклад частково активний або не активний аналіт. Вибірковість способу описує здатність аналітичного способу розрізняти різні речовини в зразку. Лінійністю способу є його здатність викликати результати, які безпосередньо або за допомогою добре певного математичного перетворення пропорційні концентрації аналіту в зразку. Таким чином, втілення імунологічного способу, розкритого в даному описі, може відрізняти повністю активний BoNT/A від частково активного BoNT/A, що має, наприклад 70 % або менше, 60 % або менше, 50 % або менше, 40 % або менше, 30 % або менше, 20 % або менше, або 10 % або менше активності повністю активного BoNT/A. Надійністю способу є відтворюваність результатів тесту одержаних для ідентичних зразків в нормальних (відсутність відхилень) умовах тесту. Робостність способу є мірою його здатності не змінюватися під дією невеликих, але навмисних варіацій в параметрах способу і вона приведена як показник надійності способу при нормальному застосуванні. Таким чином, тоді як надійність оцінює неминучі зміни, робостність оцінює навмисні зміни. Типові параметри, що оцінюються міцністю і робостністью, включають дії заморожування/відтавання, час інкубації, температура інкубації, термін придатності реагенту, приготування зразка, зберігання зразка, номер клітинного пасажу, безліч токсинів, варіабільність між очищеннями, і варіабільність між реакціями утворення розриву. Параметри робостності для клітинних аналізів включають бланк для клітин (початок, середина і кінець заморожування), рівень пасажу клітин, щільність клітинного засівання, щільність концентрованої суспензії клітин (скільки діб культурі), вік клітин в колбі (час очікування до висівання), час інкубації, різні чашки, надмірні кількості сироватки крові і джерело реагентів. Системна придатність способу є визначенням якості аналізу, що включає якість реагентів і приладів, додатковий час на аналіз референсного стандарту. Системна придатність накладається відповідно до вказівок FDA, вказуючому на те, що устаткування, електроніка, якість аналізу і аналізовані зразки складають цілісну систему. Системна стабільність може бути оцінена шляхом тестування паралельності, яка при відкладанні на графіці залежності відповіді від логарифма дози, серійних розведень референсних зразків і серійних розведень зразків повинна привести до одержання паралельних кривих. 20 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 Аспекти даного опису включають, частково, клітину із стабільної клітинної лінії. Використовуваний тут термін "клітина" відноситься до будь-якої еукаріотичної клітини, чутливої до інтоксикації BoNT/A, або будь-якої еукаріотичної клітини, яка може захоплювати BoNT/A. Термін клітина охоплює клітини різних організмів, таких як, наприклад клітини миші, щура, свині, корови, коня, примату і людини; з різноманітності типів клітин, таких як, наприклад нейрональні і не нейрональні; і можуть бути виділені з або частини гетерогенної клітинної популяції, тканини або організму. Використовуваний тут термін "стійка клітинна лінія" є синонімом "імморталізована лінія клітин", або "трансформована лінія клітин" і відноситься до культури клітин, вибраних для необмеженого ділення з клітинної популяції, що походить з організму, тканини або органу. За визначенням стійка клітинна лінія виключає культуру первинних клітин. Використовуваний тут термін "первинними клітинами" є клітини, зібрані безпосередньо зі свіжих тканин або органів, і що не мають потенціалу до необмеженого ділення. Стійка клітинна лінія може містити гетерогенну популяцію клітин або однорідну популяцію клітин. Стійка клітинна лінія, що походить з одиничної клітини, називається клональною клітинною лінією. Стійка клітинна лінія може бути такою клітинною лінією, в якої клітини ендогенно експресують всі компоненти, необхідні для того, щоб клітини могли зазнати загальний клітинний механізм, за допомогою якого BoNT/A протеолітично розщеплює субстрат SNAP-25, і що охоплює пов'язання BoNT/A з рецептором BoNT/A, інтерналізацію комплексу нейротоксин/рецептор, транслокацію легкого ланцюга BoNT/A з внутріклітинної везикули в цитоплазму і протеолітичне розщеплювання SNAP-25. Альтернативно, стійка клітинна лінія може може бути клітинною лінією, клітинам в якій з екзогенного джерела вводять щонайменше один компонент, необхідний клітинам для того, щоб зазнати загальний клітинний механізм, за допомогою якого BoNT/A протеолітично розщеплює субстрат SNAP-25, і що охоплює пов'язання BoNT/A з рецептором BoNT/A, інтерналізацію комплексу нейротоксин/рецептор, транслокацію легкого ланцюга BoNT/A з внутріклітинної везикули в цитоплазму і протеолітичне розщеплювання SNAP-25. Також відносно генетично сконструйованої клітинної лінії, клітини з такої стійкої клітинної лінії можуть, наприклад експресуватиекзогенний FGFR2, екзогенний FGFR3, екзогенний SV2, екзогенний SNAP-25 або будь-яку їх комбінацію. Аспекти даного опису включають, частково, клітину із стабільної клітинної лінії, чутливу до інтоксикації BoNT/A. Використовувані тут терміни "клітина(и), чутлива(і) до інтоксикації BoNT/A", "клітина(и), чутлива(і) до інтоксикації BoNT/A" або "клітина(и) із стабільної клітинної лінії, чутлива(і) до інтоксикації BoNT/A" відносяться до клітини, яка(і) може(уть) зазнати загальний клітинний механізм, за допомогою якого BoNT/A протеолітичні розщеплює субстрат SNAP-25, і що охоплює пов'язання BoNT/A з рецептором BoNT/A, інтерналізацію комплексу нейротоксин/рецептор, транслокацію легкого ланцюга BoNT/A з внутріклітинної везикули в цитоплазму і протеолітичне розщеплювання SNAP-25. За визначенням клітина(и), чутлива(і) до інтоксикації BoNT/A, повинна(і) експресувати, або бути сконструйованою(ими) для експресії, щонайменше одного рецептора BoNT/A і щонайменше одного субстрату SNAP-25. Використовувані тут терміни "клітина(и), яка(і) можуть захоплювати BoNT/A" або "клітина(и), складова(і) стійкої клітинної лінії, яка може захоплювати BoNT/A" відносяться до клітин, які можуть зазнавати загальний клітинний механізм, за допомогою якого BoNT/A протеолітично розщеплює субстрат SNAP-25, і що охоплює пов'язання BoNT/A з рецептором BoNT/A, інтерналізацію комплексу нейротоксин/рецептор, транслокацію легкого ланцюга BoNT/A з внутріклітинної везикули в цитоплазму і протеолітичне розщеплювання SNAP-25. За визначенням клітина(и), яка(і) може(уть) захоплювати BoNT/A, повинна(і) експресувати або бути сконструйованою(ими) для експресії, щонайменше одного рецептора BoNT/A і щонайменше одного субстрата SNAP-25. Таким чином, у втіленні клітини із стабільної клітинної лінії чутливі до інтоксикації BoNT/A. У аспектах цього втілення клітини із стабільної клітинної лінії чутливі до інтоксикації BoNT/A в концентрації, наприклад приблизно 500 пМ або менше, приблизно 400 пМ або менше, приблизно 300 пМ або менше, приблизно 200 пМ або менше або приблизно 100 пМ або менше BoNT/A. У інших аспектах цього втілення клітини із стабільної клітинної лінії чутливі до інтоксикації BoNT/A в концентрації, наприклад приблизно 90 пМ або менше, приблизно 80 пМ або менше, приблизно 70 пМ або менше, приблизно 60 пМ або менше, приблизно 50 пМ або менше, приблизно 40 пМ або менше, приблизно 30 пМ або менше, приблизно 20 пМ або менше A або приблизно 10 пМ або менше BoNT/A. У інших аспектах клітини із стабільної клітинної лінії чутливі до інтоксикації BoNT/A в концентрації, наприклад приблизно 9 пМ або менше, приблизно 8 пМ або менше, приблизно 7 пМ або менше, приблизно 6 пМ або менше, приблизно 5 пМ або менше, приблизно 4 пМ або менше, приблизно 3 пМ або менше, приблизно 2 пМ або менше або приблизно 1 пМ або менше BoNT/A. У інших аспектах клітини із стабільної клітинної 21 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 лінії чутливі до інтоксикації BoNT/A в концентрації, наприклад приблизно 0,9 пМ або менше, приблизно 0,8 пМ або менше, приблизно 0,7 пМ або менше, приблизно 0,6 пМ або менше, приблизно 0,5 пМ або менше, приблизно 0,4 пМ або менше, приблизно 0,3 пМ або менше, приблизно 0,2 пМ, або приблизно 0,1 пМ або менше BoNT/A. Використовуваний тут термін "приблизно" при якісній оцінці заявленої суті, кількості, відсотка, або термін відноситься до діапазону плюс або хвилин десять відсотків щодо величини заявленої суті, відсотка, параметра або терміну. У ще одному втіленні клітини, складові стійкої клітинної лінії, можуть захоплювати BoNT/A. У аспектах цього втілення клітини, складові стійкої клітинної лінії, можуть захоплювати, наприклад приблизно 500 пМ або менше, приблизно 400 пМ або менше, приблизно 300 пМ або менше, приблизно 200 пМ або менше або приблизно 100 пМ або менше BoNT/A. У інших аспектах цього втілення клітини, складові стійкої клітинної лінії, мають здатністю захоплювати приблизно 90 пМ або менше, приблизно 80 пМ або менше, приблизно 70 пМ або менше, приблизно 60 пМ або менше, приблизно 50 пМ або менше, приблизно 40 пМ або менше, приблизно 30 пМ або менше, приблизно 20 пМ або менше або приблизно 10 пМ або менше BoNT/A. У інших аспектах клітини, складові стійкої клітинної лінії, мають здатністю захоплювати приблизно 9 пМ або менше, приблизно 8 пМ або менше, приблизно 7 пМ або менше, приблизно 6 пМ або менше, приблизно 5 пМ або менше, приблизно 4 пМ або менше, приблизно 3 пМ або менше, приблизно 2 пМ або менше або приблизно 1 пМ або менше BoNT/A. У інших аспектах клітини, складають стійку клітинну лінію, мають здатністю захоплювати приблизно 0,9 пМ або менше, приблизно 0,8 пМ або менше, приблизно 0,7 пМ або менше, приблизно 0,6 пМ або менше, приблизно 0,5 пМ або менше, приблизно 0,4 пМабо менше, приблизно 0,3 пМ або менше, приблизно 0,2 пМ або менше або приблизно 0,1 пМ або менше BoNT/A. Аспекти даного опису включають, частково, BoNT/A. Використовуваний тут термін "BoNT/A" є синонімом "ботулінічного нейротоксину серотипу A" або "ботулінічного нейротоксину типу A" і відноситься до BoNT/A, що зустрічаються в природі або до BoNT/A, що не зустрічаються в природі, і включає комплекс BoNT/A, що містить приблизно 150 кДа нейротоксин BoNT/A і асоційовані нетоксичні білки (NAP), а також сам нейротоксин BoNT/A масою приблизно 150 кДа. Приклади, що не обмежують об'єм винаходу комплексів BoNT/A включають, наприклад 900-кДа комплекс BoNT/A, 500-кДа комплекс BoNT/A, 300-кДа комплекс BoNT/A. Винаходи, що не обмежують об'єм, приклади нейротоксину BoNT/A масою приблизно 150 кДа включають, наприклад SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4. Використовуваний тут термін "зустрічається в природі BoNT/A" відноситься до будь-якого BoNT/A, що продукується за допомогою способу, що зустрічається в природі, включає без обмеження ізоформи BoNT/A, що продукуються в результаті модифікації посттрансляції, альтернативного сплайсингу транскрипту або спонтанної мутації, і підтипи BoNT/A, такі як, наприклад підтип BoNT/A1, підтип BoNT/A2, підтип BoNT/A3, підтип BoNT/A4 і підтип BoNT/A5. Що зустрічається в природі BoNT/A включає без обмеження SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, або варіанти, в яких заміщені, видалені або додані, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 амінокислот з SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 або SEQ ID NO: 4. Наявні в продажі фармацевтичні композиції що зустрічається в природі BoNT/A включають без обмеження BOTOX® (Allergan, Inc., Irvine, CA), DYSPORT®/RELOXIN®, (Ipsen Ltd., Slough, England), PURTOX® (Mentor Corp., Santa Barbara, CA), XEOMIN® (Merz Pharmaceuticals, GMBH., Frankfurt, Germany), NEURONOX® (Medy-Tox, Inc., Ochang-myeon, South Korea), BTX-A. Використовуваний тут термін "не зустрічається в природі BoNT/A" відноситься до будь-якого BoNT/A, структура якого модифікована за допомогою людської маніпуляції, що включає без обмеження BoNT/A із зміненою амінокислотною послідовністю, одержаний за допомогою генетичної інженерії з використанням випадкового мутагенезу або раціонального дизайну, і BoNT/A, одержаний за допомогою хімічного синтезу in vitro. Приклади, що не обмежують об'єм винаходу, BoNT/A, що не зустрічаються в природі описані, наприклад в Steward, L.E. et al., Posttranslational Modifications and Clostridial Neurotoxins, патент США № 7223577; Dolly, J.O. et al., Activatable Clostridial Toxins, патент США № 7419676; Steward, L.E. et al., Clostridial Neurotoxin Compositions and Modified Clostridial Neurotoxins, US 2004/0220386; Steward, L.E. et al., Modified Clostridial Toxins With Enhanced Targeting Capabilities For Endogenous Clostridial Toxin Receptor Systems, U.S. Patent Publication No. 2008/0096248; Steward, L.E. et al., Modified Clostridial Toxins With Altered Targeting Capabilities For Clostridial Toxin Target Cells, публікація заявки на патент США № 2008/0161543; Steward, L.E. et al., Modified Clostridial Toxins With Enhanced Translocation Capabilities and Altered Targeting Activity For Clostridial Toxin Target Cells, публікація заявки на 22 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 патент США № 2008/0241881, кожен з яких включений тут шляхом посилання. Таким чином, у втіленні активність BoNT/A, що виявляється, відбувається з BoNT/A, що зустрічається в природі. У аспектах цього втілення активність BoNT/A, що виявляється, відбувається з ізоформи BoNT/A або підтипу BoNT/A. У аспектах цього втілення активність BoNT/A, що виявляється, відбувається з BoNT/A of SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 або SEQ ID NO: 4. У інших аспектах цього втілення активність BoNT/A, що виявляється, відбувається з BoNT/A, що має, наприклад щонайменше 70 %, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 % або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 або SEQ ID NO: 4. У інших аспектах цього втілення активність BoNT/A, що виявляється, відбувається з BOTOX®, DYSPORT®/RELOXIN®, PURTOX®,, XEOMIN®, NEURONOX® або BTX-A. У ще одному втіленні активність BoNT/A, що виявляється, відбувається з BoNT/A, що не зустрічається в природі. У інших аспектах цього втілення активність BoNT/A, що виявляється, походить з варіанту BoNT/A, що не зустрічається в природі, має, наприклад, щонайменше 70 %, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 % або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 або SEQ ID NO: 4. У інших аспектах цього втілення активність BoNT/A, що виявляється, походить з варіанту BoNT/A, що не зустрічається в природі, має, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш несуміжних амінокислотних замін, делецій або вставок відносно SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 або SEQ ID NO: 4. У інших аспектах цього втілення активність BoNT/A, що виявляється, походить з варіанту BoNT/A, що не зустрічається в природі, має, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш суміжних амінокислотних замін, делецій або вставок відносно SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 або SEQ ID NO: 4. Аспекти даного опису включають, частково, SNAP-25. Використовуваний тут термін "SNAP25" відноситься до того, що зустрічається в природі SNAP-25 або не зустрічається в природі SNAP-25, який переважно розщеплюється BoNT/A. Використовуваний тут термін "переважно розщеплюється" відноситься до того, що швидкість розщеплювання BoNT/A свого субстрату щонайменше на один порядок вище, ніж швидкість розщеплювання BoNT/A будь-якого іншого субстрату. У аспектах цього втілення швидкість розщеплювання BoNT/A свого субстрату щонайменше на два порядки вище, щонайменше на три порядки вище, щонайменше на чотири порядки вище або, щонайменше на п'ять порядків вище, ніж швидкість розщеплювання будьякого іншого субстрата BoNT/A. Використовуваний тут термін "зустрічається в природі SNAP-25" відноситься до будь-якого SNAP-25, що продукується за допомогою способу, що зустрічається в природі, включає без обмеження ізоформи SNAP-25, що продукуються в результаті модифікації посттрансляції, альтернативного сплайсингу транскрипту або спонтанної мутації, і підтипи SNAP-25. SNAP-25, що зустрічається в природі включає без обмеження SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24, або варіанти, в яких заміщені, видалені або додані, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш за амінокислоти з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. Використовуваний тут термін "не зустрічається в природі SNAP-25" відноситься до будьякого SNAP-25, структура якого модифікована за допомогою людської маніпуляції, що включає без обмеження SNAP-25, одержаний шляхом генетичної інженерії з використанням випадкового мутагенезу або раціонального дизайну, і SNAP-25, одержаний за допомогою хімічного синтезу in vitro. Приклади, що не обмежують об'єм винаходи SNAP-25, що не зустрічаються в природі описані, наприклад в Steward, L.E. et al., FRET Protease Assays for Clostridial Toxins, патент США 7332567; Fernandez-Salas et al., Lipohilic Dye-based FRET Assays for Clostridial Toxin Activity, публікація патенту США 2008/0160561, кожен з яких включений тут шляхом посилання. SNAP25, що не зустрічається в природі може бути заміщений, мати делецію або вставку, наприклад 1 23 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш за амінокислоти з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. Таким чином, у втіленні SNAP-25 є SNAP-25, що зустрічається в природі. У аспектах цього втілення SNAP-25 є ізоформа SNAP-25 або підтип SNAP-25. У аспектах цього втілення що зустрічається в природі SNAP-25 є SNAP-25, що зустрічається в природі з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У інших аспектах цього втілення SNAP-25 є таким, що зустрічається в природі SNAP-25, що має, наприклад щонайменше 70 % ідентичність амінокислот, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 % або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У ще одному втіленні SNAP-25 є SNAP-25, що не зустрічається в природі. У інших аспектах цього втілення SNAP-25 є таким, що не зустрічається в природі SNAP-25, що має, наприклад, щонайменше 70 %, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 % або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 або SEQ ID NO: 4. У інших аспектах цього втілення SNAP-25 є таким, що не зустрічається в природі SNAP-25, що має, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш несуміжних амінокислотних замін, делецій або вставок відносно SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У інших аспектах цього втілення SNAP-25 є таким, що не зустрічається в природі SNAP-25, що має, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш суміжних амінокислотних замін, делецій або вставок відносно SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. SNAP-25 може бути ендогенним SNAP-25 або екзогенний SNAP-25. Використовуваний тут термін "ендогенний SNAP-25" відноситься до SNAP-25, в природі представлений в клітини, оскільки в природі він закодований в клітинному геномі, таким чином, що клітина сама експресує SNAP-25 без необхідності зовнішнього джерела SNAP-25 або зовнішнього джерела генетичного матеріалу, кодуючого SNAP-25. Експресія ендогенного SNAP-25 може здійснюватися з або без стимуляції з навколишнього середовища, такий як, наприклад клітинне диференціювання. За визначенням ендогенний SNAP-25 може бути що тільки зустрічається в природі SNAP-25 або його варіанти. Наприклад наступні стійкі клітинні лінії експресують ендогенний SNAP-25: BE(2)M17, Kelly, LA1-55n, N1E-115, N4TG3, N18, Neuro-2a, NG108-15, PC12, SH-SY5Y, SiMa і SK-NBE(2) -C. Використовуваний тут термін "екзогенний SNAP-25" відноситься до SNAP-25, експресуючого в клітини шляхом введення зовнішнього джерела SNAP-25 або зовнішнього джерела генетичного матеріалу кодуючого SNAP-25, за допомогою людської маніпуляції. Експресія екзогенного SNAP-25 може здійснюватися з або без стимуляції з навколишнього середовища, такого як, наприклад клітинне диференціювання. Як винахід прикладу клітини, що не обмежує об'єм, із стабільної клітинної лінії можуть експресувати екзогенний SNAP-25 шляхом тимчасової або стабільної трансфекції SNAP-25. Як ще один винахід прикладу клітини, що не обмежує об'єм, із стабільної клітинної лінії можуть експресувати екзогенний SNAP-25 шляхом білкової трансфекції SNAP-25. Екзогенний SNAP-25 може бути SNAP-25, що зустрічається в природі або його варіанти, або SNAP-25, що не зустрічається в природі або його варіанти. Таким чином, у втіленні клітини із стабільної клітинної лінії експресують ендогенний SNAP25. У аспектах цього втілення ендогенний SNAP-25, експресується клітинами із стабільної 24 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітинної лінії, є SNAP-25, що зустрічається в природі. У інших аспектах цього втілення ендогенний SNAP-25, експресується клітинами із стабільної клітинної лінії, є SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У інших аспектах цього втілення ендогенний SNAP-25, експресується клітинами із стабільної клітинної лінії, є SNAP-25, що зустрічається в природі, такий як, наприклад ізоформа SNAP-25 або підтип SNAP-25. У інших аспектах цього втілення ендогенний SNAP-25, експресується клітинами із стабільної клітинної лінії, є SNAP-25, що зустрічається в природі, що має, наприклад щонайменше 70 % ідентичність амінокислот, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 % або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У ще одному втіленні клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії екзогенного SNAP-25. У аспекті цього втілення клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії SNAP-25, що зустрічається в природі. У інших аспектах цього втілення клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії що зустрічається в природі SNAP-25 з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У інших аспектах цього втілення клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії що зустрічається в природі SNAP-25, такого як, наприклад ізоформа SNAP-25 або підтип SNAP-25. У інших аспектах цього втілення клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії що зустрічається в природі SNAP-25, що має, наприклад, щонайменше 70 % ідентичність амінокислот, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 %, або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У ще одному аспекті втілення клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії SNAP-25, що не зустрічається в природі. У інших аспектах цього втілення клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії SNAP-25, що не зустрічається в природі, що має, наприклад, щонайменше 70 %, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 % або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У інших аспектах цього втілення клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії що не зустрічається в природі SNAP-25, що має, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш несуміжних амінокислотних замін, делецій або вставок відносно SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. У інших аспектах цього втілення клітини із стабільної клітинної лінії сконструйовані для тимчасової або стабільної експресії SNAP-25, що не зустрічається в природі, що має, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш суміжних амінокислотних замін, делецій або вставок відносно SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 або SEQ ID NO: 24. Аналізи, які виявляють розщеплювання субстрату BoNT/A після дії на BoNT/A, можуть бути 25 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 використані для оцінки того, чи експресує клітина ендогенний або екзогенний SNAP-25. У цих аналізах утворення продукту розщеплювання SNAP-25 може бути виявлене в клітинах, експресуючих SNAP-25 після обробки BoNT/A. Приклади, що не обмежують об'єм винаходу, специфічного аналізу шляхом вестерн-блоттінгу, а також добре охарактеризовані реагенти, умови і протоколи легко доступні з комерційних джерел, які включають без обмеження Amersham Biosciences, Piscataway, NJ; Bio-Rad Laboratories, Hercules, CA; Pierce Biotechnology, Inc., Rockford, IL; Promega Corporation, Madison, WI, і Stratagene, Inc., La Jolla, CA. Зрозуміло, що ці і аналогічні аналізи розщеплювання SNAP-25 можуть бути корисні для ідентифікації клітин, експресуючих ендогенний або екзогенний SNAP-25. Приклади, що не обмежують об'єм винаходу аналізів шляхом вестерн-блоттінгу з використанням антитіла, яке розпізнає продукт розщеплювання SNAP-25 під дією BoNT/A або розщеплені і не розщеплені форми SNAP-25, може бути використаний для аналізу захоплення BoNT/A. Приклади антитіл α-SNAP-25, корисних для цих аналізів, включають без обмеження αSNAP-25 мишине моноклональне антитіло SMI-81 (Sternberger Monoclonals Inc., Lutherville, MD) α-SNAP-25 мишине моноклональне антитіло CI 71.1 (Synaptic Systems, Goettingen, Germany) αSNAP-25 мишине моноклональне антитіло CI 71.2 (Synaptic Systems, Goettingen, Germany) αSNAP-25 мишине моноклональне антитіло SP12 (Abcam, Cambridge, MA) α-SNAP-25 кролячу поліклональну антисироватка (Synaptic Systems, Goettingen, Germany) α-SNAP-25 кролячу поліклональну антисироватку (Abcam, Cambridge, MA) і α-SNAP-25 кролячу поліклональну антисироватку S9684 (Sigma, St Louis, MO). Аспекти даного опису включають, частково, рецептор BoNT/A. Використовуваний тут термін "рецептор BoNT/A" відноситься до рецептора BoNT/A або рецептору BoNT/A, що не зустрічається в природі, який переважно взаємодіє з BoNT/A таким чином, що викликає відповідь на інтоксикацію BoNT/A, що зустрічається в природі. Використовуваний тут термін "переважно взаємодіє" відноситься до того, що рівноважна константа дисоціації (KD) BoNT/A відносно рецептора BoNT/A щонайменше на один порядок менше, ніж константа дисоціації BoNT/A щодо будь-якого іншого рецептора на клітинній поверхні. Рівноважна константа дисоціації, специфічний тип константи рівноваги, який вимірює здатність комплексу BoNT/Aрецептор BoNT/A оборотно розділятися (диссоціювати) на складові його молекули, а саме BoNT/A і рецептор BoNT/A, розраховується як KD=Ka/Kd в рівновазі. Константа асоціації (Ka) розраховується як Ka=[C]/[L][R], і константа дисоціації (Kd) розраховується як Kd=[L][R]/[C], де [L] дорівнює молярній концентрації BoNT/A, [R] є молярною концентрацією рецептора BoNT/A, і [C] є молярною концентрацією комплексу BoNT/A-рецептор BoNT/A, і де всі концентрації є такими, коли система знаходиться в рівновазі. Чим менша константа дисоціації, тим тісніше зв'язаний BoNT/A зі своїм рецептором, або вище за аффінність скріплення між BoNT/A і рецептором BoNT/A. У аспектах цього втілення константа дисоціації BoNT/A для рецептора BoNT/A щонайменше на два порядки менше, щонайменше на три порядки менше, щонайменше на чотири порядки менше або, щонайменше на п'ять порядків менше ніж константа дисоціації BoNT/A відносно будь-якого іншого рецептора. У інших аспектах цього втілення аффінність скріплення BoNT/A, що переважно взаємодіє з рецептором BoNT/A, може мати рівноважну константу дисоціації (KD), наприклад 500 нМ або менше, 400 нМ або менше, 300 нМ або менше, 200 нМ, або менше 100 нМ або менше. У інших аспектах цього втілення аффінність скріплення BoNT/A, що переважно взаємодіє з рецептором BoNT/A, може мати рівноважну константу дисоціації (KD), наприклад of 90 нМ або менше, 80 нМ або менше, 70 нМ або менше, 60 нМ, 50 нМ або менше, 40 нМ або менше, 30 нМ або менше, 20 нМ або менше, 10 нМ або менше. Використовуваний тут термін "викликає відповідь на інтоксикацію BoNT/A" відноситься до здатності рецептора BoNT/A взаємодіяти з BoNT/A з утворенням комплексу нейротоксин/рецептор і подальшою інтерналізацією цього комплексу в клітинну цитоплазму. Використовуваний тут термін рецептор BoNT/A", що "зустрічається в природі, відноситься до будь-якого рецептора BoNT/A, що продукується за допомогою процесу, що зустрічається в природі, включає без обмеження ізоформи рецепторп BoNT/A, що продукуються в результаті модифікації посттрансляції, альтернативного сплайсингу транскрипту або спонтанної мутації, і підтипу рецептора BoNT/A. Рецептор BoNT/A, що зустрічається в природі, включає без обмеження рецептор чинника зростання фібробластів 2 (FGFR2), рецептор чинника зростання фібробластів 3 (FGFR3), глікопротеїн синаптичних везикул 2 (SV2) і складний гангліозид, такий як GT1b, такий як гангліозид, визначений в Ester Fernandez-Salas, et al., Botulinum Toxin Screening Assays, публікація патенту США № 2008/0003240; Ester Fernandez-Salas, et al., Botulinum Toxin Screening Assays, публікація патенту США № 2008/0182799; Min Dong et al., SV2 is the Protein Receptor for Botulinum Neurotoxin A, Science (2006); S. Mahrhold et al, The Synaptic Vesicle Protein 2C Mediates the Uptake of Botulinum Neurotoxin A into Phrenic Nerves, 580(8) FEBS 26 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 Lett. 2011-2014 (2006), кожен з яких включений тут шляхом посилання. FGFR2, що зустрічається в природі включає без обмеження SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 і SEQ ID NO: 70, варіанти, в яких заміщені, видалені або додані, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш за амінокислоти з SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 і SEQ ID NO: 70. Що зустрічається в природі FGFR3 включає без обмеження SEQ ID NO: 25, SEQ ID NO: 26, і SEQ ID NO: 27 або варіанти, в яких заміщені, видалені або додані, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш за амінокислоти з SEQ ID NO: 25, SEQ ID NO: 26 і SEQ ID NO: 27. Що зустрічається в природі SV2 включає без обмеження SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30 і SEQ ID NO: 31, варіанти, в яких заміщені, видалені або додані, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш за амінокислоти з SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30 і SEQ ID NO: 31. Використовуваний тут термін варіант рецептора BoNT/A", що "не зустрічається в природі, відноситься до будь-якого рецептора BoNT/A, що продукується за допомогою людської маніпуляції або дизайну, включає без обмеження рецептор BoNT/A, що одержується за допомогою генетичної інженерії з використанням випадкового мутагенезу або раціонального дизайну, і рецептор BoNT/A, що одержується шляхом хімічного синтезу. Приклади варіантів BoNT/A, що не зустрічаються в природі, що не обмежують об'єм винаходу, включають, наприклад консервативні варіанти рецептора BoNT/A, не консервативні варіанти рецептора BoNT/A, химерні варіанти рецептора BoNT/A і активні фрагменти рецептора BoNT/A. Використовуваний тут термін рецептор BoNT/A", що "не зустрічається в природі, відноситься до будь-якого рецептора BoNT/A, структура якого модифікована за допомогою людської маніпуляції, що включає без обмеження рецептор BoNT/A, що одержується шляхом генетичної інженерії з використанням випадкового мутагенезу або раціонального дизайну, і рецептор BoNT/A, що одержується шляхом хімічного синтезу in vitro. Приклади рецептора BoNT/As, що не зустрічається в природі, що не обмежують об'єм винаходу, описані, наприклад в Ester Fernandez-Salas, et al., Botulinum Toxin Screening Assays, публікація патенту США № 2008/0003240; Ester Fernandez-Salas, et al., Botulinum Toxin Screening Assays, публікація патенту США № 2008/0182799, кожен з яких включений тут шляхом посилання. Рецептор BoNT/A, що не зустрічається в природі, може мати заміщення, видалення або додавання, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш за амінокислоти з SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 або SEQ ID NO: 70. Таким чином, у втіленні рецептором BoNT/A є рецептор BoNT/A, що зустрічається в природі, такий як, наприклад FGFR2, FGFR3 або SV2. У аспектах цього втілення рецептор BoNT/A є ізоформою рецептора BoNT/A або підтип рецептора BoNT/A. У аспектах цього втілення рецептором BoNT/A, що зустрічається в природі, є рецептор BoNT/A SEQ ID NO, що зустрічається в природі: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 або SEQ ID NO: 70. У інших аспектах цього втілення рецептором BoNT/A є рецептор BoNT/A, що зустрічається в природі, має, наприклад щонайменше 70 % ідентичність амінокислот, щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 % або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 або SEQ ID NO: 70. У ще одному втіленні рецептором BoNT/A є рецептор BoNT/A, що не зустрічається в природі, такий як, наприклад, генетично сконструйований FGFR2, генетично сконструйований FGFR3 або генетично сконструйований SV2. У інших аспектах цього втілення рецептором BoNT/A є рецептор BoNT/A, що не зустрічається в природі, має, наприклад щонайменше 70 %, 27 UA 102247 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше 75 %, щонайменше 80 %, щонайменше 85 %, щонайменше 90 %, або, щонайменше 95 % ідентичність амінокислот з SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 або SEQ ID NO: 70. У інших аспектах цього втілення рецептором BoNT/A є рецептор BoNT/A, що не зустрічається в природі, має, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш несуміжних амінокислотних замін, делецій, або вставок відносно SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 або SEQ ID NO: 70. У інших аспектах цього втілення рецептором BoNT/A є рецептор BoNT/A, що не зустрічається в природі, має, наприклад 1 або більш, 2 або більш, 3 або більш, 4 або більш, 5 або більш, 6 або більш, 7 або більш, 8 або більш, 9 або більш, 10 або більш, 20 або більш, 30 або більш, 40 або більш, 50 або більш, або 100 або більш суміжних амінокислотних замін, делецій або вставок відносно SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 або SEQ ID NO: 70. Рецептор BoNT/A може бути ендогенним рецептором BoNT/A або екзогенний рецептор BoNT/A. Використовуваний тут термін "ендогенний рецептор BoNT/A" відноситься до рецептора BoNT/A, в природі представлений в клітині, оскільки він в природі кодується в клітинному геномі, таким чином, що клітина сама експресує рецептор BoNT/A без необхідності зовнішнього джерела рецептора BoNT/A або зовнішнього джерела генетичного матеріалу, кодуючого рецептор BoNT/A. Експресія ендогенного рецептора BoNT/A може здійснюватися з або без стимуляції з навколишнього середовища, такої як, наприклад клітинне диференціювання або активація промотора. Наприклад наступні стійкі клітинні лінії експресують, щонайменше один ендогенний рецептор BoNT/A: BE(2)-M17, Kelly, LA1-55n, N1E-115, N4TG3, N18, Neuro-2a, NG108-15, PC12, SH-SY5Y, SiMa і SK-N-BE(2) -C. Ендогенний рецептор BoNT/A тільки може бути рецептором BoNT/A, що зустрічається в природі, або його варіанти, що зустрічаються в природі. Використовуваний тут термін "екзогенний рецептор BoNT/A" відноситься дорецептора BoNT/A, експресуючого в клітини шляхом введення зовнішнього джерела рецептора BoNT/A або зовнішнього джерела генетичного матеріалу, кодуючого рецептор BoNT/A за допомогою людської маніпуляції. Експресія екзогенного рецептора BoNT/A може здійснюватися за рахунок або без стимуляції з навколишнього середовища, такого як, наприклад клітинне диференціювання або активація промотора. Як приклад, що не обмежує об'єм винаходу, у клітини із стабільної клітинної лінії можуть експресувати один або більш ніж один екзогенний рецептор BoNT/A шляхом тимчасової або стабільної трансфекції молекули полінуклеотиду, кодуючого рецептор BoNT/A, такого як, наприклад FGFR2, FGFR3 або SV2. Як ще один приклад, що не обмежує об'єм винахіду, у клітини із стабільної клітинної лінії можуть експресувати один або більш ніж один екзогенний рецептор BoNT/A шляхом білкової трансфекції рецептора BoNT/A, такого як, наприклад FGFR2, FGFR3 або SV2. Екзогенний рецептор BoNT/A може бути рецептором BoNT/A, що зустрічається в природі, або його варіанти, що зустрічаються в природі, або рецептор BoNT/A, що не зустрічається в природі, або його варіанти, що не зустрічаються в природі. Таким чином, у втіленні клітини із стабільної клітинної лінії експресують ендогенний рецептор BoNT/A. У аспектах цього втілення ендогенний рецептор BoNT/A, експресується клітинами із стабільної клітинної лінії, є рецептор BoNT/A, що зустрічається в природі. У інших аспектах цього втілення ендогенний рецептор BoNT/A, експресується клітинами із стабільної клітинної лінії, є SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69 або SEQ ID NO: 70. У інших аспектах цього втілення ендогенний рецептор BoNT/A, експресується клітинами із стабільної клітинної лінії, є рецептор BoNT/A, що зустрічається в природі, такий як, наприклад ізоформа рецептора BoNT/A або підтип рецептора BoNT/A. У інших аспектах цього втілення ендогенний рецептор BoNT/A, експресується клітинами із стабільної клітинної лінії, є рецептор BoNT/A, що зустрічається в природі, має, наприклад, щонайменше 70 % ідентичність амінокислот, щонайменше 75 %, щонайменше 80 %, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;immuno-based botulinum toxin serotype a activity assays
Автори англійськоюFernandez-Salas, Ester, Wang, Joanne, Garay, Patton, E., Wong, Lina, S., Hodges, D., Dianne, Aoki, Kei, Hoger
Назва патенту російськоюИммунологические анализы активности ботулинического токсина серотипа а
Автори російськоюФернандес-Салас Эстер, Ванг Йоан, Герей Паттон Э., Вонг Лина С., Ходгес Д., Диан, Аоки Кей Роджер
МПК / Мітки
МПК: A61P 25/00, G01N 33/569, A61K 39/395, C07K 16/12
Мітки: імунологічні, серотипу, ботулінічного, аналізі, активності, токсину
Код посилання
<a href="https://ua.patents.su/179-102247-imunologichni-analizi-aktivnosti-botulinichnogo-toksinu-serotipu-a.html" target="_blank" rel="follow" title="База патентів України">Імунологічні аналізи активності ботулінічного токсину серотипу а</a>
Попередній патент: Поглинаючий виріб (варіанти)
Наступний патент: Спосіб одержання дабігатрану
Випадковий патент: Матрична таблетка для тривалого вивільнення гліклазиду та процес виготовлення такої таблетки