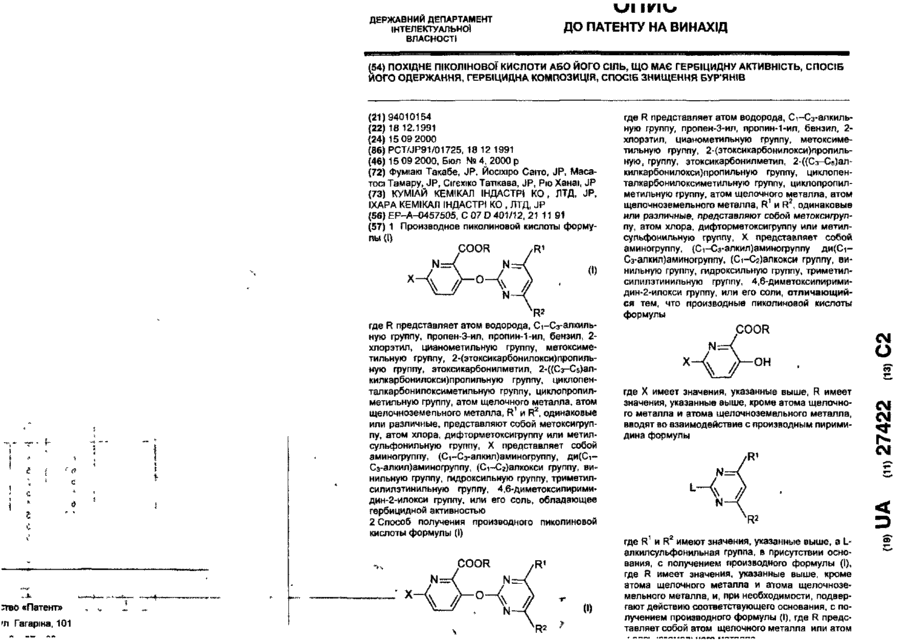
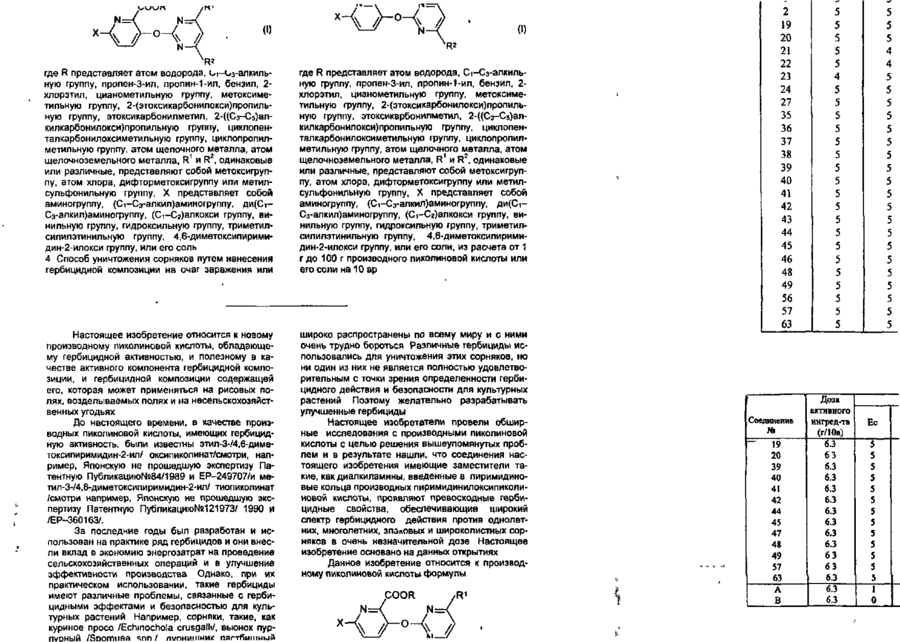
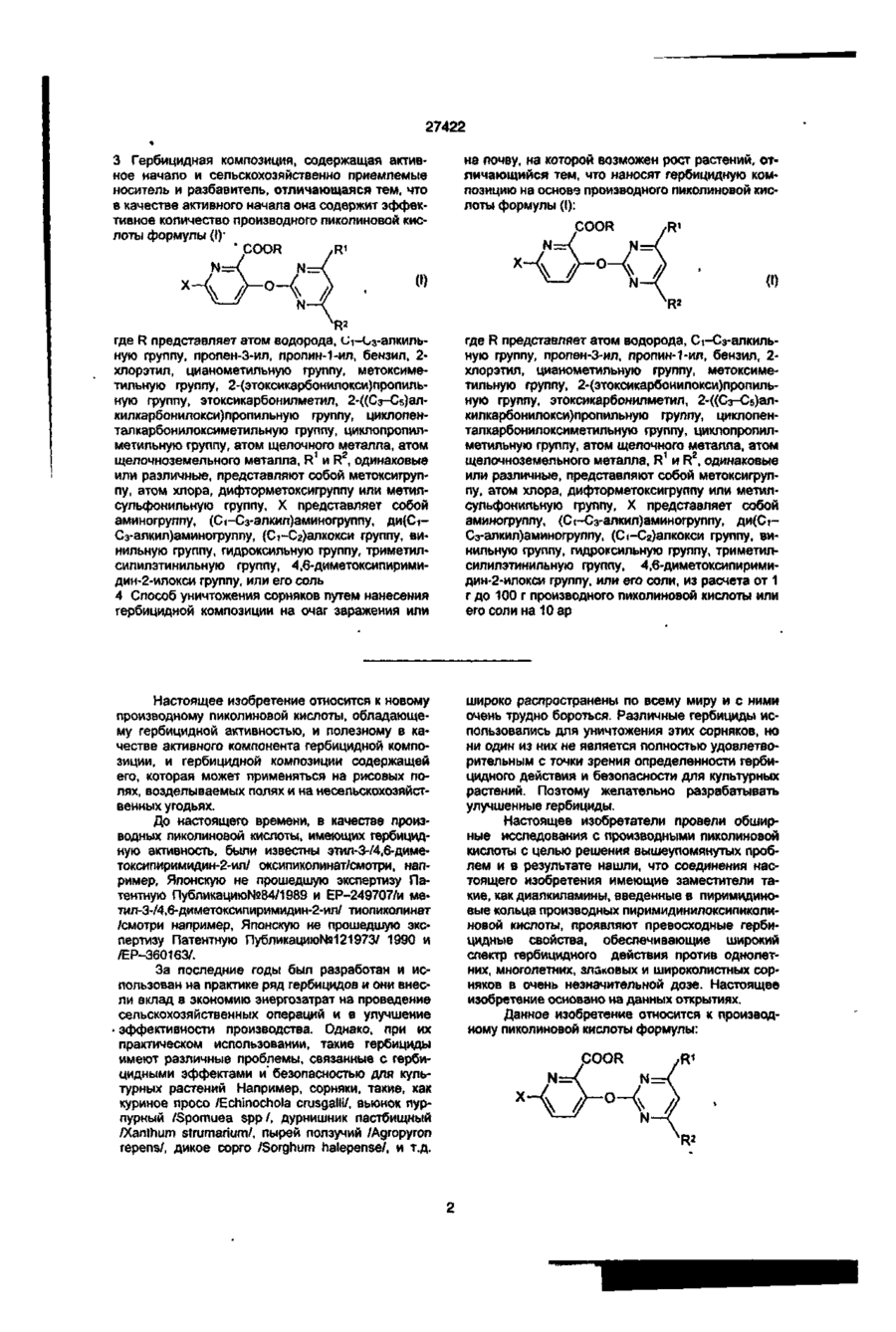
Похідне піколінової кислоти або його сіль, що має гербіцидну активність, спосіб його одержання, гербіцидна композиція, спосіб знищення бур’янів
Номер патенту: 27422
Опубліковано: 15.09.2000
Автори: Фуміакі Такабе, Ріо Ханаі, Йосіхіро Саіто, Сігєхіко Татікава, Масатосі Тамару
Текст
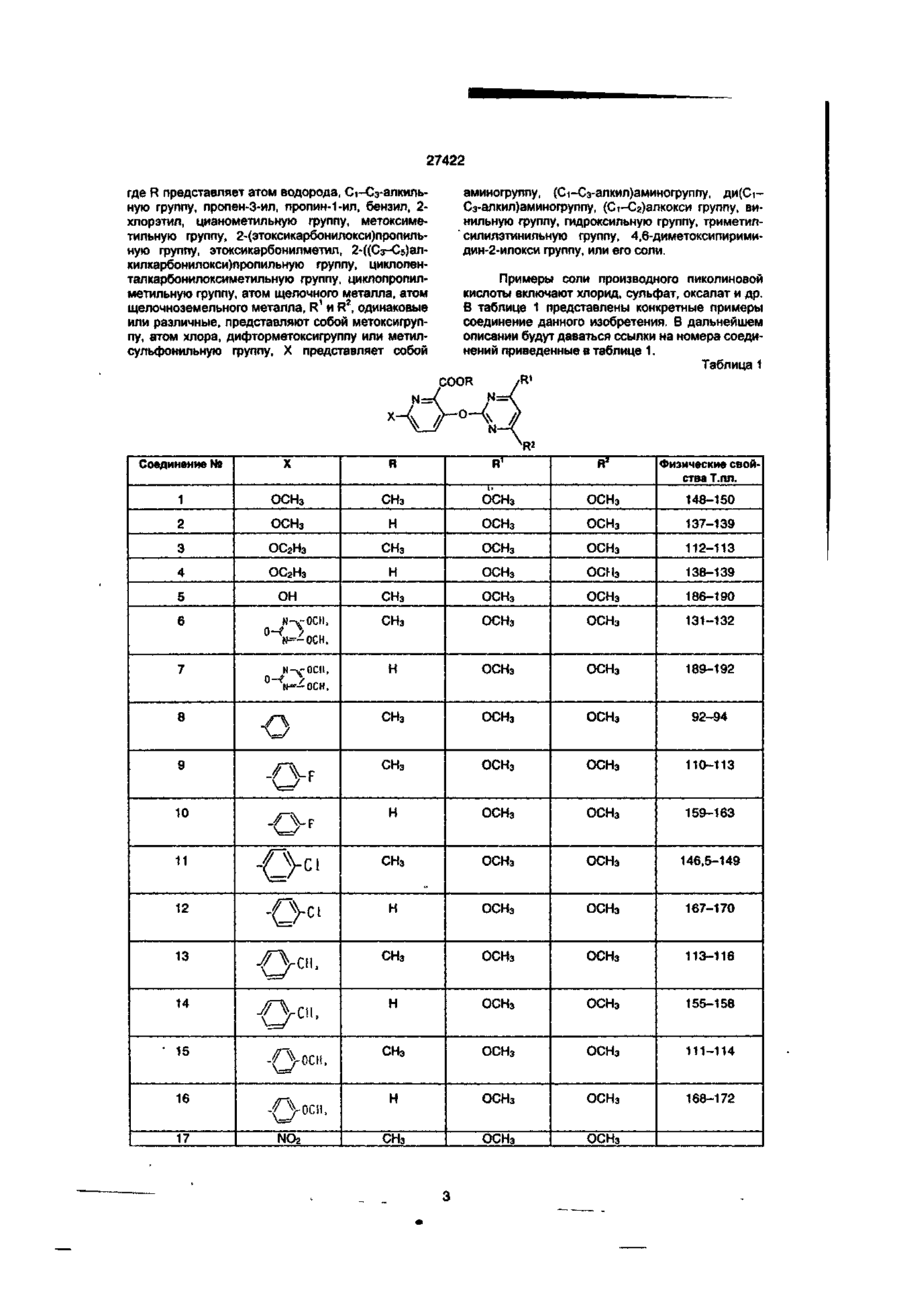
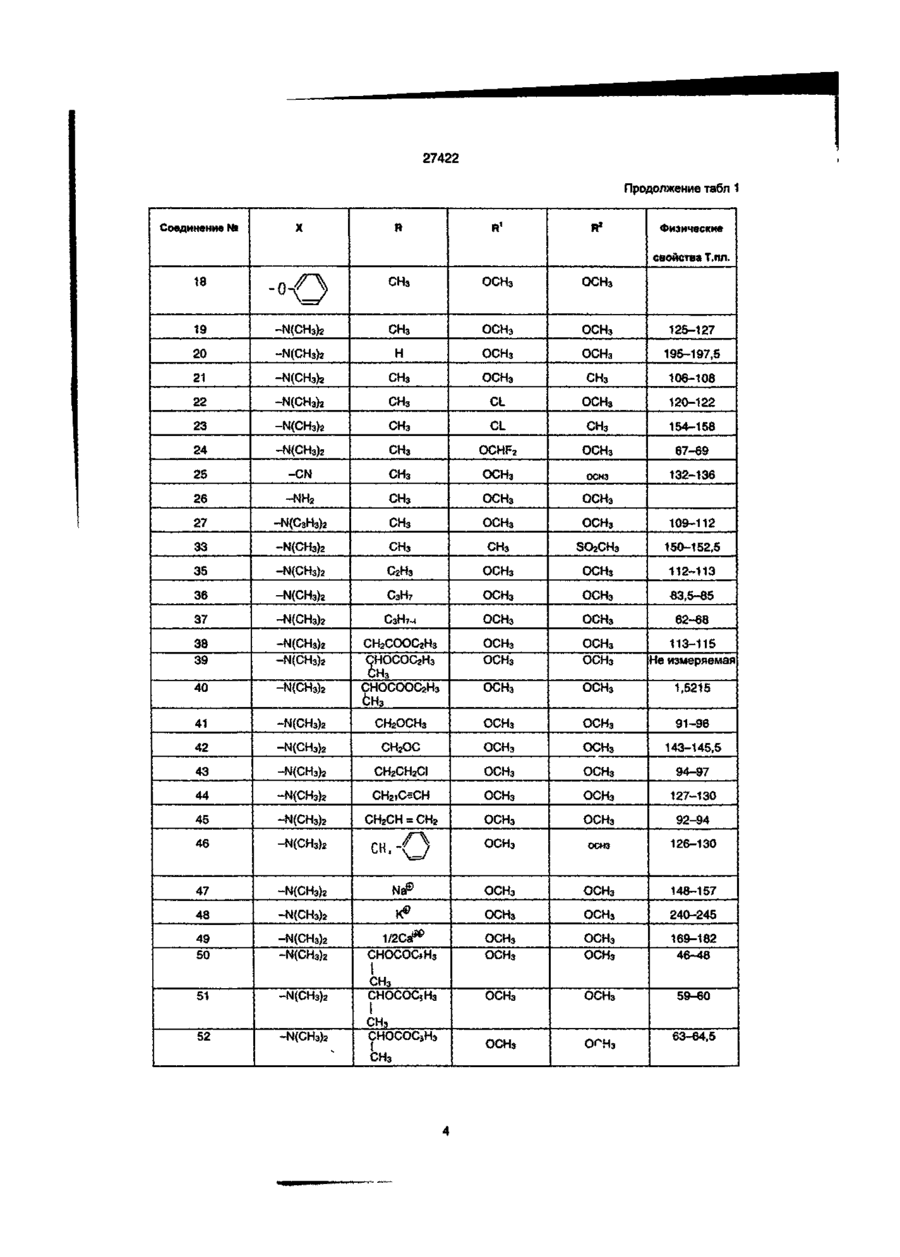
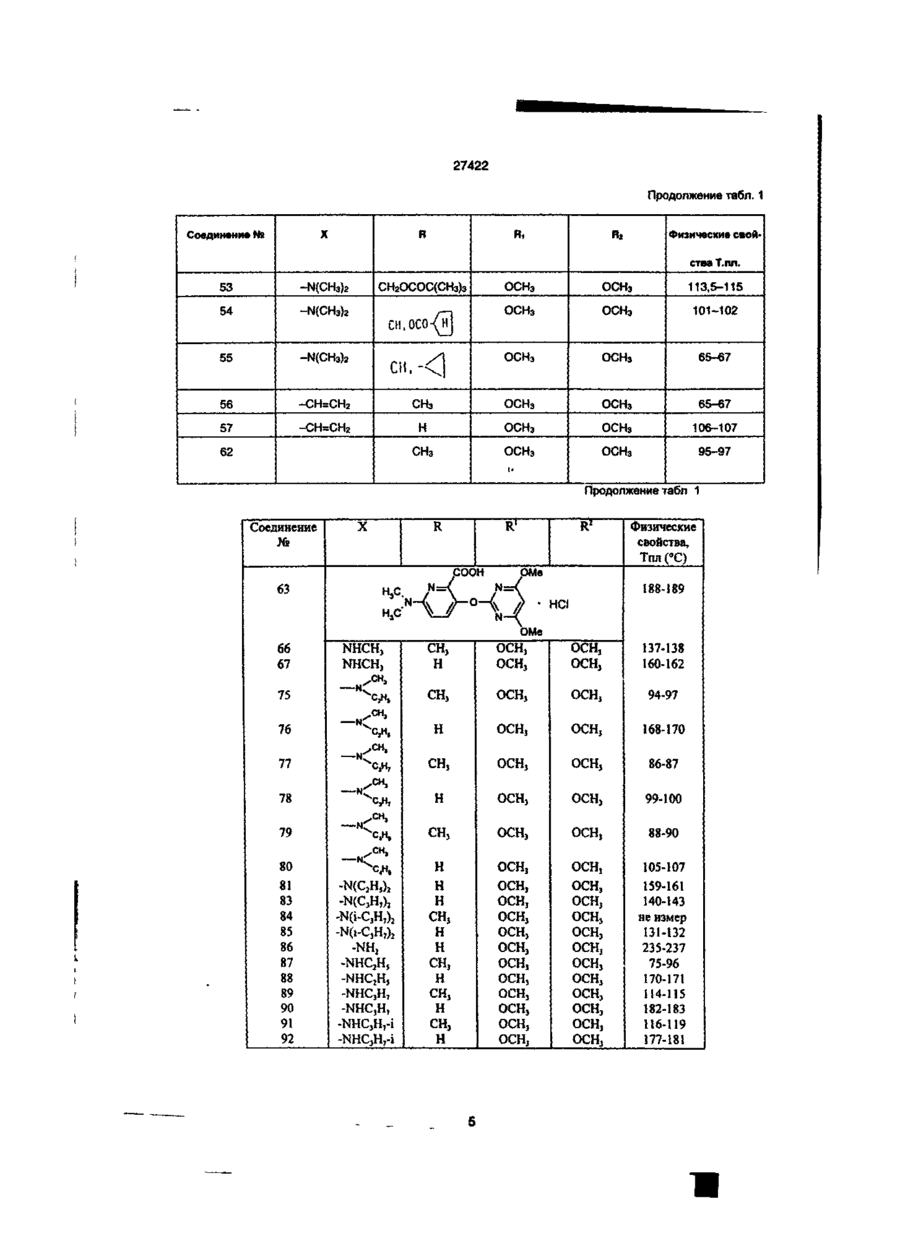
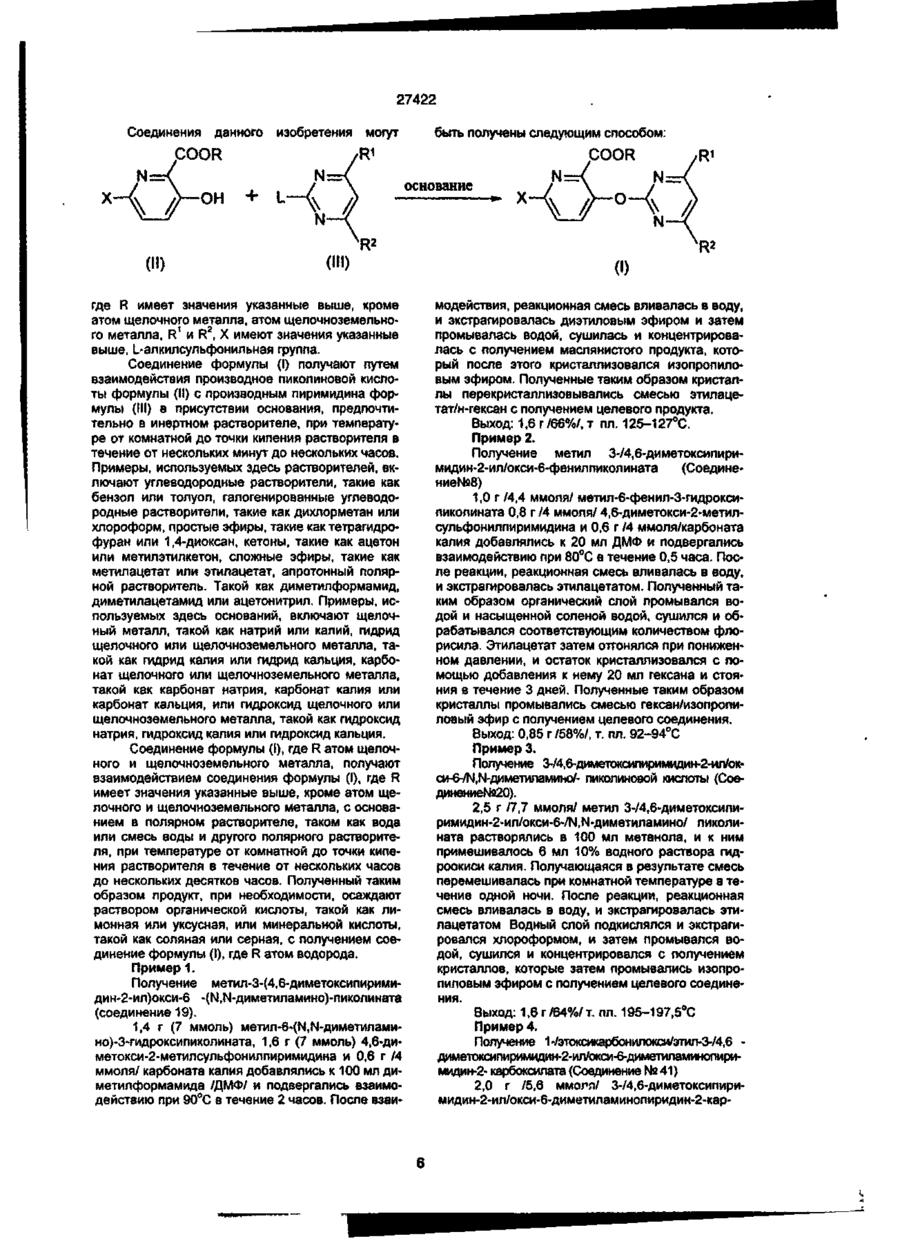
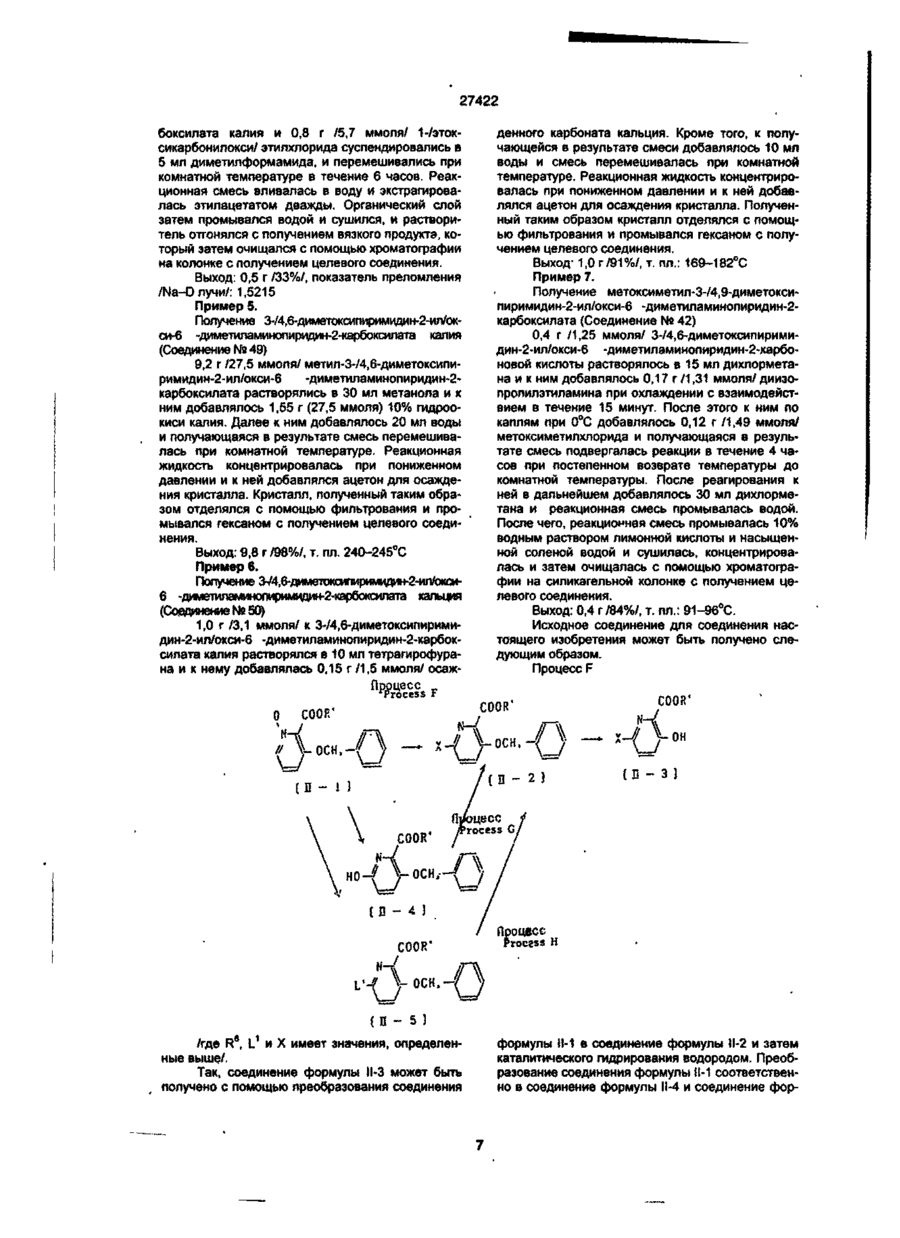
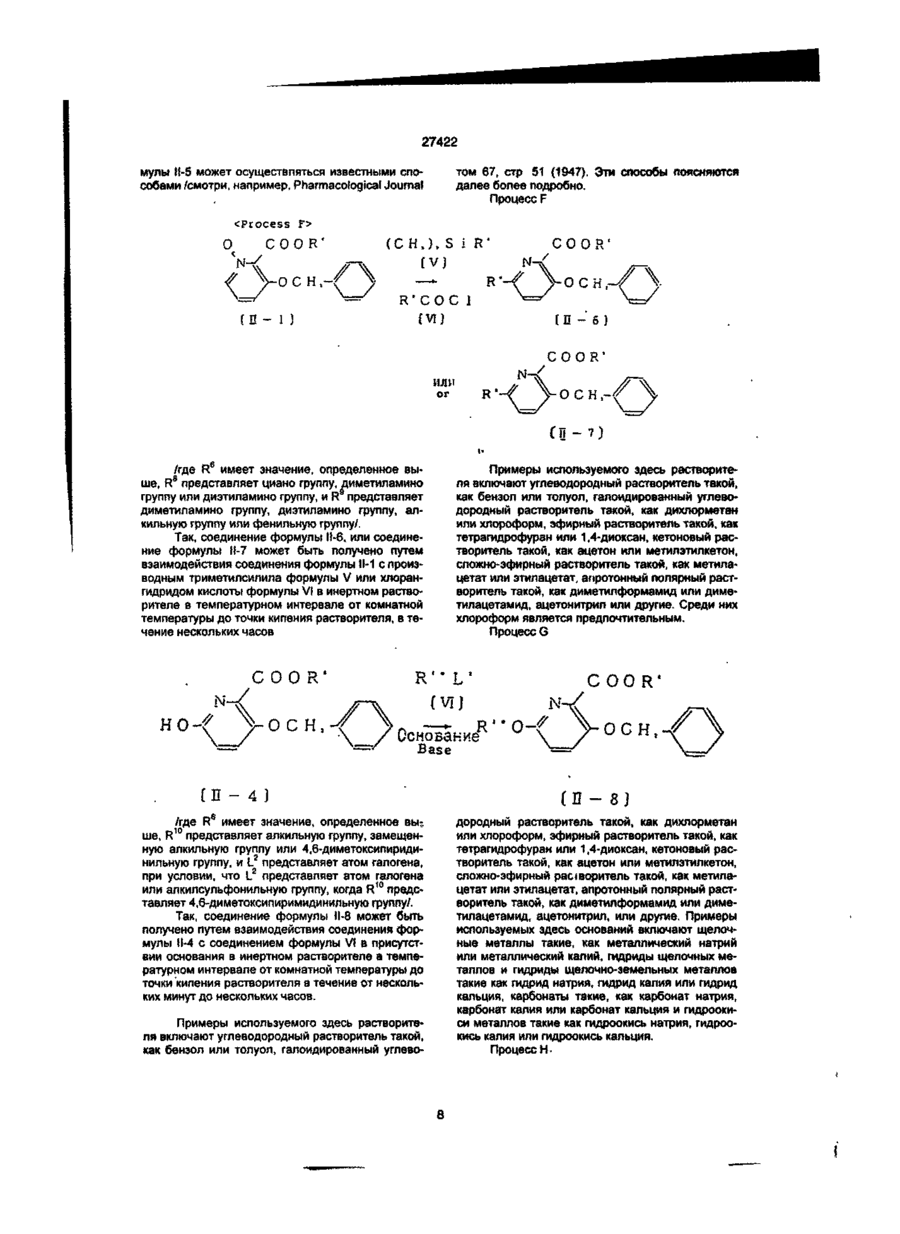
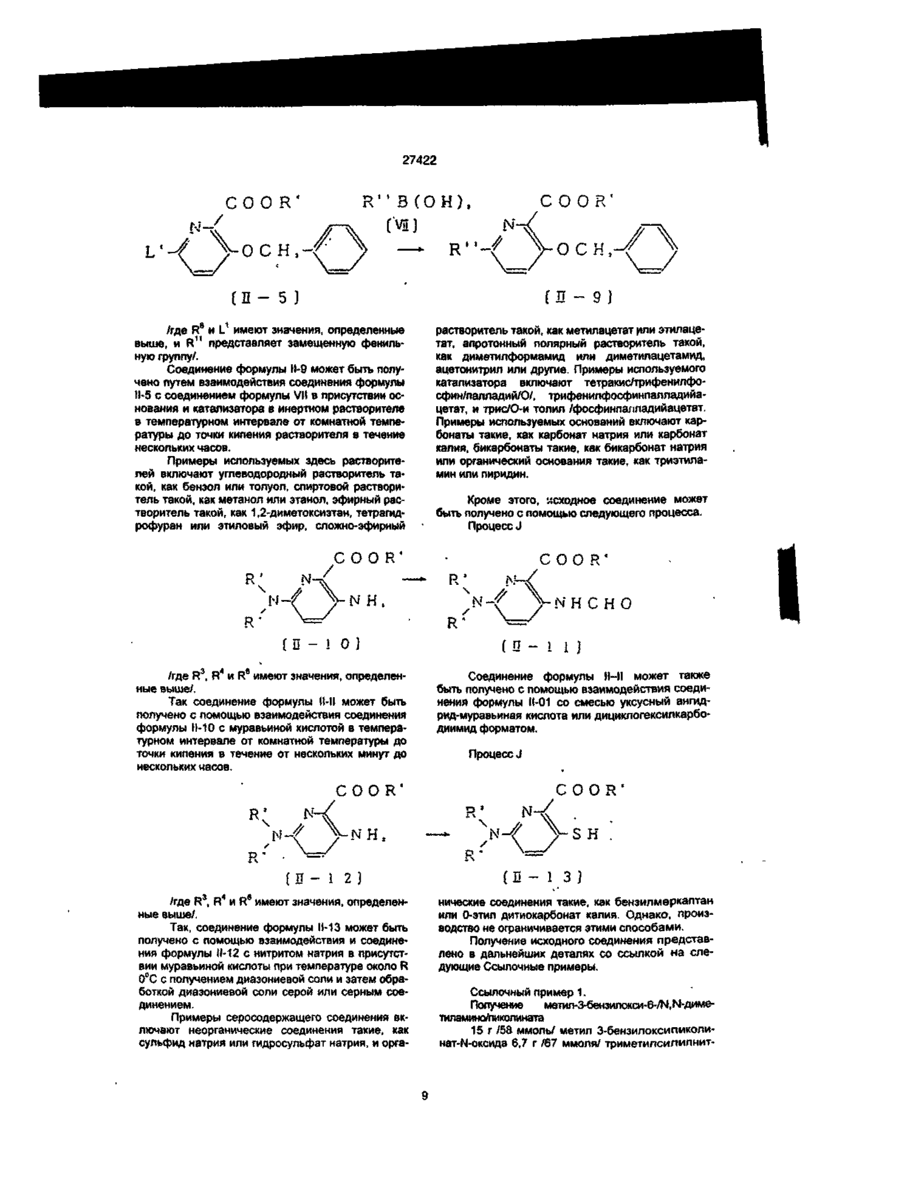
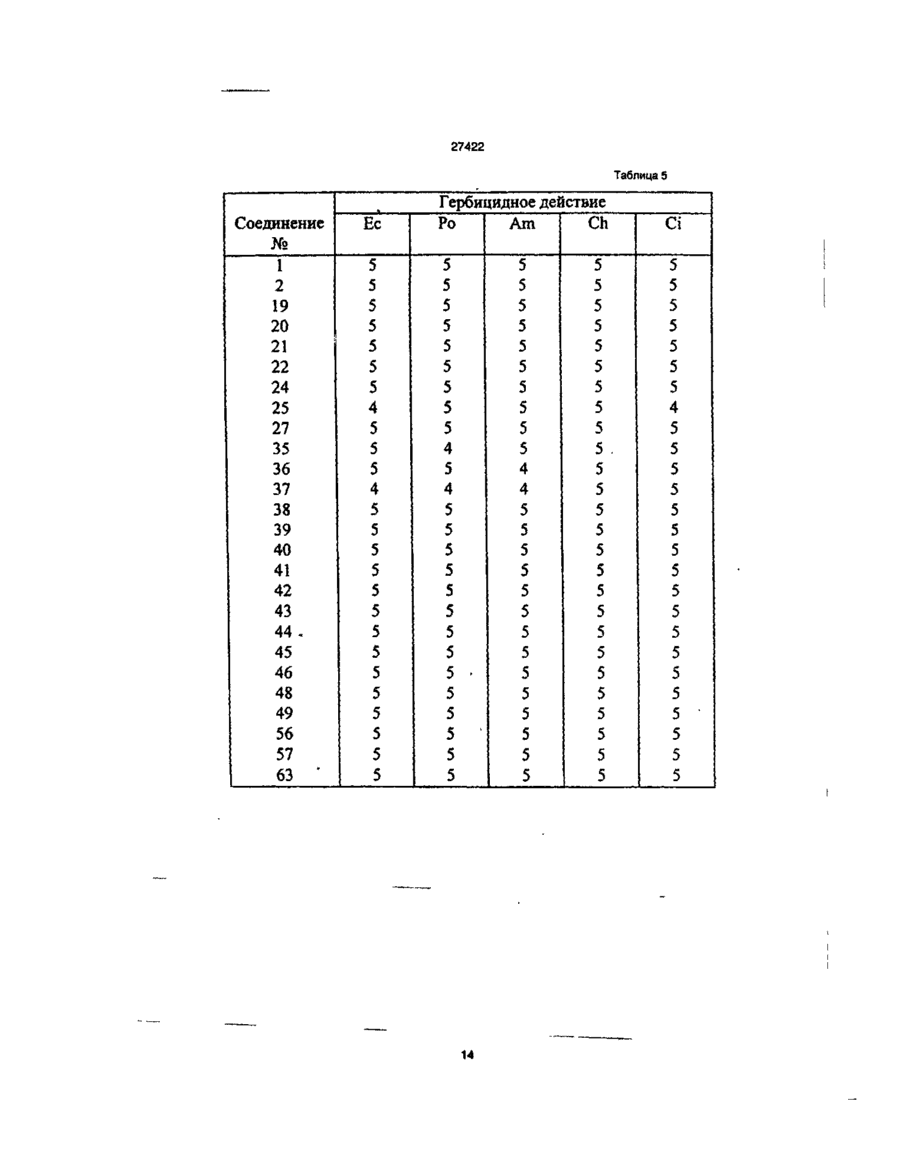
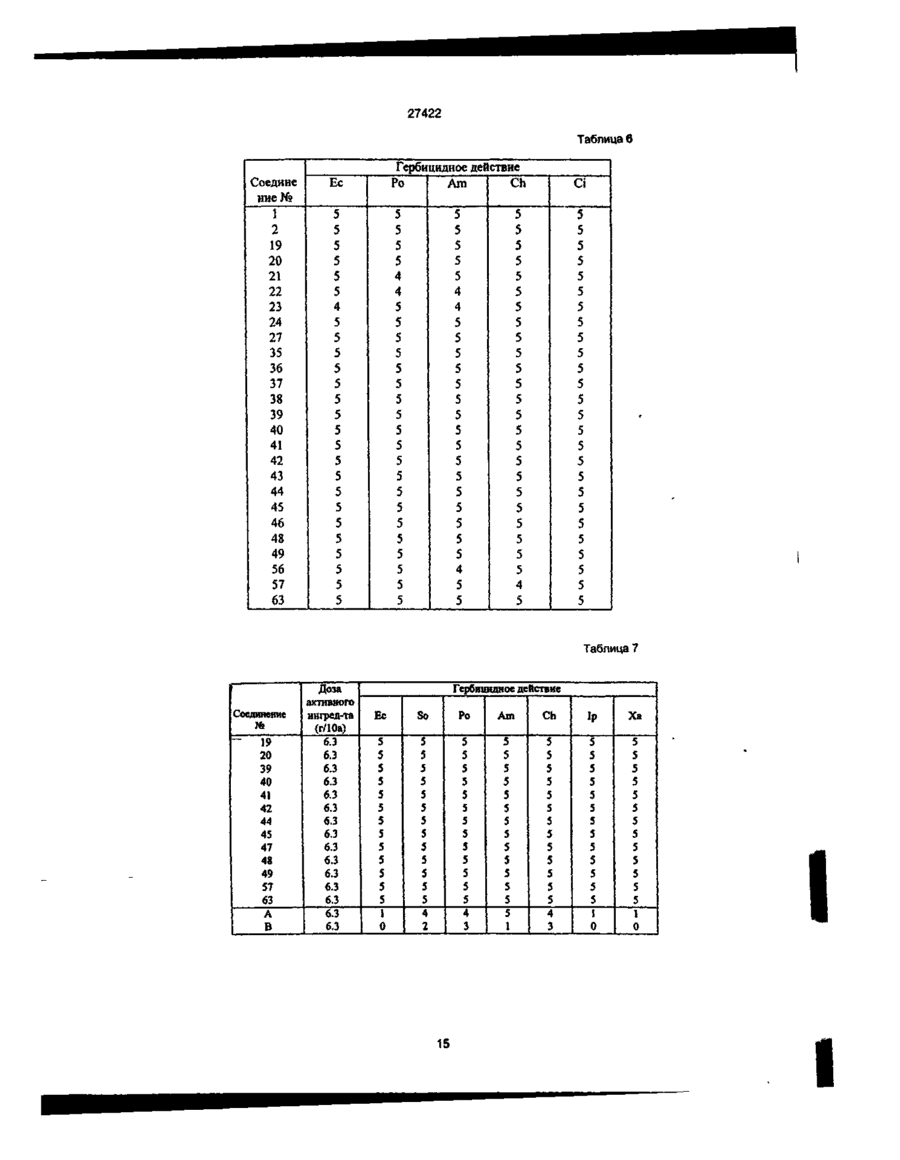
1. Производное пиколиновой кислоты формулы (I): COOR где R представляет атом водорода, Сі-Сз-алкильную группу, пропен-3-ил, пропин-1-ил, бензил, 2хлорэтил, цианометильную группу, метоксиметильную группу, 2-(этоксикарбонилокси)пропильную группу, этоксикарбонилметил, 2-((Сз~С5)алкилкарбонилокси)пропильную группу, циклопенталкарбонилоксиметильную группу, циклопропилметильную группу, атом щелочного металла, атом щелочноземельного металла, R1 и R2, одинаковые или различные, представляют собой метоксигруппу, атом хлора, дифторметоксигруппу или метилсульфонильную группу, X представляет собой аминогруппу, (Сі-Сз-алкил)аминогруппу, ди(Сі~ Сз-алкил)аминогруппу, (Сі-Сг)алкокси группу, ви» нильную группу, гидроксильную группу, триметилсилилэтинильную группу, 4,6-диметоксипиримидин-2-илокси фуппу, или его соль, обладающее гербицидной активностью. 2.Способ получения производного пиколиновой кислоты формулы (і): 0) где R представляет атом водорода, Сі-С3-алкильную группу, пропен-3-ил, пропин-1-ил, бензил, 2хлорэтил, цианометильную группу, метоксиметильную группу, 2-(этоксикарбонилокси)пропильную,,группу, этоксикарбонилметил, 2-((Сз-Сб)алкилкарбонилокси)пропильную группу, циклопенталкарбонилоксиметильную группу, циклопропилметильную группу, атом щелочного металла, атом щелочноземельного металла, R1 и R2, одинаковые или различные, представляют собой метоксигрулпу, атом хлора, дифторметоксигруппу или метилсульфонильную группу, X представляет собой аминогруппу, (Сі~Сз-алкил)аминогруппу, ди(СіСз-алкил)аминогруплу, (Сі-Сг)алкокси группу, винильную группу, гидроксильную фуппу, триметилсилилэтинильную группу, 4,6-диметоксипиримидин-2-илокси группу, или его соли, отличающийся тем, что производные пиколиновой кислоты формулы COOR см О со где X имеет значения, указанные выше, R имеет значения, указанные выше, кроме атома щелочного металла и атома щелочноземельного металла, вводят во взаимодействие с производным пиримидина формулы где R1 и R2 имеют значения, указанные выше, a Lалкилсульфонильная группа, в присутствии основания, с получением производного формулы (I), где R имеет значения, указанные выше, кроме атома щелочного металла и атома щелочноземельного металла, и, при необходимости, подвергают действию соответствующего основания, с получением производного формулы (I), где R представляет собой атом щелочного металла или атом щелочноземельного металла. см см 1 см S T 27422 З Гербицидная композиция, содержащая активное начало и сельскохозяйственно приемлемые носитель и разбавитель, отличающаяся тем, что в качестве активного начала она содержит эффективное количество производного пиколиновой кислоты формулы (!)• * COOR на почву, на которой возможен рост растений, отличающийся тем, что наносят гербицидную композицию на основе производного пиколиновой кислоты формулы (I): COOR Х-/ч /W Л—О\\ /г • (О где R представляет атом водорода, иі-с 3 -алкильную группу, пропен-3-ил, пропин-1-ил, бензил, 2хлорэтил, цианометильную группу, метоксиметильную группу, 2-(этоксикарбонилокси)пропильную группу, этоксикарбонилметил, 2-((Сз-С5)алкилкарбонилокси)пропильную группу, циклопенталкарбонилоксиметильную группу, циклопропилметильную группу, атом щелочного металла, атом щелочноземельного металла, R1 и R2, одинаковые или различные, представляют собой метоксигруппу, атом хлора, дифторметоксигруппу или метилсульфонильную группу, X представляет собой аминогруппу, (Сі-Сз-алкил)аминогруппу, ди(СіСз-алкил)аминогруппу, (Сі-Сг)алкокси группу, винильную группу, гидроксильную группу, триметилсилилэтинильную группу, 4,6-диметоксипиримидин-2-илокси группу, или его соль 4 Способ уничтожения сорняков путем нанесения гербицидной композиции на очаг заражения или где R представляет атом водорода, Сі-Сз-алкильную группу, пропен-3-ил, пропин-1-ил, бензил, 2хлорэтил, цианометильную группу, метоксиметильную группу, 2-(этоксикарбонилокси)пропильную группу, этоксикарбонилметил, 2-((Сз-С5)алкилкарбонилокси)пропильную группу, циклопенталкарбонилоксиметильную группу, циклопропилметильную группу, атом щелочного металла, атом щелочноземельного металла, R1 и R2, одинаковые или различные, представляют собой метоксигрулпу, атом хлора, дифторметоксигруппу или метилсульфонильную группу, X представляет собой аминогруппу, (Сі-Сз-алкил)аминогруппу, ди(СіСэ-алкил)аминогруппу, (Сі-Сг)алкокси группу, винильную группу, гидроксильную группу, триметилсилилэтинильную группу, 4,6-диметоксипиримидин-2-илокси группу, или его соли, из расчета от 1 г до 100 г производного пиколиновой кислоты или его солина 10 ар Настоящее изобретение относится к новому производному пиколиновой кислоты, обладающему гербицидной активностью, и полезному в качестве активного компонента гербицидной композиции, и гербицидной композиции содержащей его, которая может применяться на рисовых полях, возделываемых полях и на несельскохозяйственных угодьях. До настоящего времени, в качестве производных пиколиновой кислоты, имеющих гербицидную активность, были известны этил-3-/4,6-диметоксипиримидин-2-ил/ оксипиколинат/смотри, например, Японскую не прошедшую экспертизу Патентную Публикацию№84/1989 и ЕР-249707/и метил-3-/4,б-диметоксипиримидин-2-ил/ тиопиколинат /смотри например, Японскую не прошедшую экспертизу Патентную Публикацию№121973/ 1990 и /ЕР-360163/. За последние годы был разработан и использован на практике ряд гербицидов и они внесли вклад в экономию энергозатрат на проведение сельскохозяйственных операций и в улучшение ' эффективности производства. Однако, при их практическом использовании, такие гербициды имеют различные проблемы, связанные с гербицидными эффектами и" безопасностью для культурных растений Например, сорняки, такие, как куриное просо /Echinochola crusgaHi/, вьюнок пурпурный /Spomuea spp/, дурнишник пастбищный /Xanthum strumarium/, пырей ползучий /Agropyron repens/, дикое сорго /Sorghum halepense/, и т.д. широко распространены по всему миру и с ними очень трудно бороться. Различные гербициды использовались для уничтожения этих сорняков, но ни один из них не является полностью удовлетворительным с точки зрения определенности гербицидного действия и безопасности для культурных растений. Поэтому желательно разрабатывать улучшенные гербициды. Настоящее изобретатели провели обширные исследования с производными пиколиновой кислоты с целью решения вышеупомянутых проблем и в результате нашли, что соединения настоящего изобретения имеющие заместители такие, как диалкиламины, введенные в пиримидиновые кольца производных пиримидинилоксипиколиновой кислоты, проявляют превосходные гербицидные свойства, обеспечивающие широкий спектр гербицидного действия против однолетних, многолетних, злаковых и широколистных сорняков в очень незначительной дозе. Настоящее изобретение основано на данных открытиях. Данное изобретение относится к производному пиколиновой кислоты формулы: 27422 где R представляет атом водорода, Сі-Сз-алкильную группу, пропен-3-ил, пропин-1-ил, бензил, 2хлорэтил, цианометильную группу, метоксиметильную группу, 2-(этоксикарбонилокси)пропильную группу, этоксикарбонилметил, 2-((Сз-С5)алкилкарбонилокси)пропильную группу, циклопенталкарбонилоксиметильную группу, циклопропилметильную группу, атом щелочного металла, атом щелочноземельного металла, R1 и R2, одинаковые или различные, представляют собой метоксигруппу, атом хлора, дифторметоксигруппу или метилсульфонильную группу, X представляет собой аминогруппу, (Сі-Сз-алкил)аминогруппу, ди(СіСз-алкил)аминофуппу, (Сі-Сг)алкокси группу, винильную группу, гидроксильную группу, триметил' силилэтинильную группу, 4,6-диметоксипиримидин-2-илокси группу, или его соли. Примеры соли производного пиколиновой кислоты включают хлорид, сульфат, оксалат и др. В таблице 1 представлены конкретные примеры соединение данного изобретения. В дальнейшем описании будут даваться ссылки на номера соединений приведенные в таблице 1. Таблица 1 COOR /R1 Ч5-°ЛІ Соединение № X R R1 R2 Физические свойства Т.пл. 1 ОСНз СНз ОСНз ОСНз 148-150 2 ОСНз Н ОСНз ОСНз 137-139 3 ОС2Нз СНз ОСНз ОСНз 112-113 4 ОС2Нз Н ОСНз ОСНз 138-139 5 ОН СНз ОСНз ОСНз 186-190 СНз ОСНз ОСНз 131-132 Н ОСНз ОСНз 189-192 СНз ОСНз ОСНз 92-94 6 7 8 N-v-OCII. 0~? > W--OCH. N-4-0CII, о-е > -о 9 -Q-F СНз ОСНз ОСНэ 110-113 10 -OF Cl Н ОСНз ОСНз 159-163 СНз ОСНз ОСНз 146,5-149 Н ОСНз ОСНз 167-170 11 -D 12 -Q-C! 13 -Q-cii. СНз ОСНз ОСНз 113-116 14 феи. Н ОСНз ОСНз 155-158 ' 15 -Q-OCII. СНз ОСНз ОСНэ 111-114 16 -Qocn. Н ОСНз ОСНз 168-172 СНз ОСНз ОСНз 17 NO2 27422 Продолжение табл 1 Соединение NS 18 n X п1 R2 Физические свойства Т.пл. -о СНз ОСН 3 ОСНз 19 -N(CH3)2 CH 3 ОСНз ОСНз 125-127 20 -N(CH3)2 H ОСНз ОСНз 195-197,5 21 -N(CH3)2 CH 3 ОСНз СНз 106-108 22 -N(CH3)2 CH 3 CL ОСНз 120-122 23 -N(CH3)2 CH 3 CL СНз 154-158 24 -N(CH3)2 CH 3 OCHF 2 ОСНз 67-69 25 -CN CH 3 ОСНз ОСНЭ 132-136 26 -NH2 CH 3 ОСН 3 ОСНз 27 -N(C 3 H 3 )2 СНз ОСН 3 ОСНз 109-112 33 -N(CH3)2 CH 3 СНз SO 2 CH 3 150-152,5 35 -N(CH3)2 С 2 Нз ОСНз ОСНз 112-113 36 -N(CH3)2 C3H7 ОСНз ОСНз 63,5-85 37 -N(CH3)2 С 3 Н 7 -ц ОСНз ОСНз 62-68 38 39 -N(CH3)2 -N(CH3)2 ОСНз ОСН 3 ОСНз ОСНз 113-115 Не измеряемая 40 -N(CH3)2 CH 2 COOC 2 H 3 СНОСОСгНэ СН 3 СНОСООСгНз ОСНэ ОСНз 1,5215 41 -N(CH3)2 СНгОСНз ОСНз ОСНз 91-96 42 -N(CH3)2 СН2ОС ОСНз ОСНз 143-145,5 43 -N(CH3)2 СНгСНгС! ОСНз ОСНз 94-97 44 -N(CH3)2 CH 2 iO=CH ОСНз ОСНз 127-130 45 -N(CH3)2 СН 2 СН = СН 2 ОСН 3 ОСНз 92-94 46 -N(CH3)2 Г -/Л Н ОСНз ОСНЗ 126-130 47 -N(CH3)2 ОСН Э ОСНз 148-157 48 -N{CH3)2 К® ОСНз ОСНз 240-245 49 50 -N(CH3)2 -N(CH3)2 1/2Са^ СНОСОСэНз ОСНз ОСНз ОСНз ОСНз 169-182 46-48 -N(CH3)2 СНз CHOCOCjH 3 ОСНз ОСНз 59-60 -N(CH3)2 СНз СНОСОСзНз ОСНз О^Нз 51 52 бНз I I СНз 63-64,5 27422 Продолжение табл. 1 R X Соединение Ma R. Физические свой Па ства Т.пл. 53 -N(CH 3 ) 2 СН2ОСОС(СНз)з ОСНэ ОСНэ 113,5-115 54 -N(CH 3 ) 2 сн.осо-^и] ОСНз ОСНэ 101-102 55 -N(CH 3 ) 2 сн.-О ОСНз ОСНз 65-67 56 -CH=CH 2 СНз ОСНз ОСНз 65-67 57 —CH=CH2 Н ОСНз ОСНз 106-107 СНз ОСНз ОСНз 95-97 62 і» Продолжение табл 1 Соединение R1 R X COOH 63 Rz Физические свойства, Тпл(°С) OMe 188-189 НС HCI н'с CH, H OMe OCH, OCH, OCH, OCHj 137-138 160-162 CH, OCHj OCH, 94-97 H OCH, OCH, 168-170 CH, OCH, OCHj 86-87 H OCH, OCH, 99-100 79 CHj OCH, OCH, 88-90 80 81 83 84 85 86 87 88 89 90 91 92 H H H CH, H H CH, H CH, H OCH, OCH, 105-107 OCH, OCH, OCH, OCH, OCH, OCH, OCH, OCH, OCHj OCH, OCH, OCH, OCH, OCHj 159-161 140-143 не измер 131-132 235-237 75-96 170-171 114-115 182-183 116-119 177-181 66 67 NHCHj NHCH, 75 76 77 78 N > S *CH ~NC -N(C2H,)2 -N(CjH 7 ) 2 -N(i-C 3 H 7 ) 2 -N(i-C,H 7 ) 2 -NH2 -NHC2H5 -NHC2H, -NHC,H7 -NHC,H7 -NHCjH 7 -i -NHCjH 7 -i CHj H OCHJ OCH, OCHj OCHJ OCHJ OCHJ OCH, OCHj 27422 Соединения данного COOR изобретения могут быть получены следующим способом: /W COOR R' основание где R имеет значения указанные выше, кроме атом щелочного металла, атом щелочноземельно1 2 го металла. R и R , X имеют значения указанные выше, L-алкилсульфонильная группа. Соединение формулы (I) получают путем взаимодействия производное пиколиновой кислоты формулы (ІІ) с производным пиримидина формулы (III) в присутствии основания, предпочтительно в инертном растворителе, при температуре от комнатной до точки кипения растворителя в течение от нескольких минут до нескольких часов. Примеры, используемых здесь растворителей, включают углеводородные растворители, такие как бензол или толуол, галогенированные углеводородные растворители, такие как дихлорметан или хлороформ, простые эфиры, такие как тетрагидрофуран или 1,4-диоксан, кетоны, такие как ацетон или метилэтилкетон, сложные эфиры, такие как метилацетат или этилацетат, апротонный полярной растворитель. Такой как диметилформамид, диметилацетамид или ацетонитрил. Примеры, используемых здесь оснований, включают щелочный металл, такой как натрий или калий, гидрид щелочного или щелочноземельного металла, такой как гидрид калия или гидрид кальция, карбонат щелочного или щелочноземельного металла, такой как карбонат натрия, карбонат калия или карбонат кальция, или гидроксид щелочного или щелочноземельного металла, такой как гидроксид натрия, гидроксид калия или гидроксид кальция. Соединение формулы (I), где R атом щелочного и щелочноземельного металла, получают взаимодействием соединения формулы (I), где R имеет значения указанные выше, кроме атом щелочного и щелочноземельного металла, с основанием в полярном растворителе, таком как вода или смесь воды и другого полярного растворителя, при температуре от комнатной до точки кипения растворителя в течение от нескольких часов до нескольких десятков часов. Полученный таким образом продукт, при необходимости, осаждают раствором органической кислоты, такой как лимонная или уксусная, или минеральной кислоты, такой как соляная или серная, с получением сое* динение формулы (I), где R атом водорода. Пример 1. Получение метил-3-(4,6-диметоксипиримидин-2-ил)окси-6 -(Ы,М-диметиламино)-пиколината (соединение 19). 1,4 г (7 ммоль) метил-6-(Ы,М-диметиламино)-3-гидроксипиколината, 1,6 г (7 ммоль) 4,6-диметокси-2-метилсульфонилпиримидина и 0,6 г /4 ммоля/ карбоната калия добавлялись к 100 мл диметилформамида /ДМФ/ и подвергались взаимодействию при 90°С в течение 2 часов. После взаи модействия, реакционная смесь вливалась в воду, и экстрагировалась диэтиловым эфиром и затем промывалась водой, сушилась и концентрировалась с получением маслянистого продукта, который после этого кристаллизовался изопропиловым эфиром. Полученные таким образом кристаллы перекристаллизовывались смесью этилацетат/н-гексан с получением целевого продукта. Выход: 1,6 г/66%/, т пл. 125-127°С. Пример 2. Получение метил 3-/4,6-диметоксипиримидин-2-ил/окси-6-фенилпиколината (Соединение№8) 1,0 г /4,4 ммоля/ метил-6-фенил-З-гидроксипиколината 0,8 г /4 ммоля/ 4,6-диметокси-2-метилсульфонилпиримидина и 0,6 г /4 ммоля/карбоната калия добавлялись к 20 мл ДМФ и подвергались взаимодействию при 80°С в течение 0,5 часа. После реакции, реакционная смесь вливалась в воду, и экстрагировалась этилацетатом. Полученный таким образом органический слой промывался водой и насыщенной соленой водой, сушился и обрабатывался соответствующим количеством флорисила. Этилацетат затем отгонялся при пониженном давлении, и остаток кристаллизовался с помощью добавления к нему 20 мл гексана и стояния в течение 3 дней. Полученные таким образом кристаллы промывались смесью гексан/изопропиловый эфир с получением целевого соединения. Выход: 0,85 г/58%/, т. пл. 92-94°С Пример 3. Получение 3-/4,6-диметоксипиримидин-2-ил/окси-6-/Ы,М-диметиламиио/- пиколиновой кислоты (Соединение№20). 2,5 г /7,7 ммоля/ метил 3-/4,6-диметоксипиримидин-2-ил/окси-6-/Ы,Ы-диметиламино/ пиколината растворялись в 100 мл метанола, и к ним примешивалось 6 мл 10% водного раствора гидроокиси калия. Получающаяся в результате смесь перемешивалась при комнатной температуре в течение одной ночи. После реакции, реакционная смесь вливалась в воду, и экстрагировалась этилацетатом Водный слой подкислялся и экстрагировался хлороформом, и затем промывался водой, сушился и концентрировался с получением кристаллов, которые затем промывались изопропиловым эфиром с получением целевого соединения. Выход: 1,6 г /64%/ т, пл. 195-197,5°С Пример 4. Получение 1-/этоксикарбонилокси/этил-3-/4,6 диметоксипиримидин-2-ил/окси-б-диметиламинопиримидин-2- карбоксилата (Соединение № 41) 2,0 г /5,6 ммогя/ 3-/4,6-диметоксипиримидин-2-ил/окси-6-диметиламинопиридин-2-кар 27422 боксилата калия и 0,8 г /5,7 ммоля/ 1-/этоксикарбонилокси/ этилхлорида суспендировались в 5 мл диметилформамида, и перемешивались при комнатной температуре в течение 6 часов. Реакционная смесь вливалась в воду и экстрагировалась этилацетатом дважды. Органический слой затем промывался водой и сушился, и растворитель отгонялся с получением вязкого продукта, который затем очищался с помощью хроматографии на колонке с получением целевого соединения. Выход: 0,5 г /33%/, показатель преломления /Na-Олучи/: 1,5215 Пример 5. Получение 3-/4,6-диметоксипиримидин-2-ип/окси-6 -диметиламинопиридин-2-кар6оксилата калия (Соединение № 49) 9,2 г /27,5 ммоля/ метил-3-/4,6-диметоксипиримидин-2-ил/окси-6 -диметиламинопиридин-2карбоксилата растворялись в 30 мл метанола и к ним добавлялось 1,55 г (27,5 ммоля) 10% гидроокиси калия. Далее к ним добавлялось 20 мл воды и получающаяся в результате смесь перемешивалась при комнатной температуре. Реакционная жидкость концентрировалась при пониженном давлении и к ней добавлялся ацетон для осаждения кристалла. Кристалл, полученный таким образом отделялся с помощью фильтрования и промывался гексаном с получением целевого соединения. Выход: 9,8 г /98%/, т. пл. 240-245°С Пример 6. Получение 374,6-диметокоіпиримидин-2-ил/окси6 -диметиламинслиримидин-2-карбоксилата кальция (Соединение № 50) 1,0 г /3,1 ммоля/ к 3-/4,6-диметоксипиримидин-2-ил/окси-б -диметиламинопиридин-2-карбоксилата калия растворялся в 10 мл тетрагирофурана и к нему добавлялась 0,15 г /1,5 ммоля/ осаж ч О COOR' о- • и/ денного карбоната кальция. Кроме того, к получающейся в результате смеси добавлялось 10 мл воды и смесь перемешивалась при комнатной температуре. Реакционная жидкость концентрировалась при пониженном давлении и к ней добавлялся ацетон для осаждения кристалла. Полученный таким образом кристалл отделялся с помощью фильтрования и промывался гексаном с получением целевого соединения. Выход- 1,0 г/91%/, т. пл.: 169-182°С Пример 7. Получение метоксиметил-3-/4,9-диметоксипиримидин-2-ил/окси-6 -диметиламинопиридин-2карбоксилата (Соединение № 42) 0,4 г /1,25 ммоля/ 374,6-диметоксипиримидин-2-ил/окси-6 -диметиламинопиридин-2-харбоновой кислоты растворялось в 15 мл дихлорметана и к ним добавлялось 0,17 г /1,31 ммоля/ диизопропилэтиламина при охлаждении с взаимодействием в течение 15 минут. После этого к ним по каплям при 0°С добавлялось 0,12 г /1,49 ммоля/ метоксиметилхлорида и получающаяся в результате смесь подвергалась реакции в течение 4 часов при постепенном возврате температуры до комнатной температуры. После реагирования к ней в дальнейшем добавлялось 30 мл дихлорметана и реакционная смесь промывалась водой. После чего, реакционная смесь промывалась 10% водным раствором лимонной кислоты и насыщенной соленой водой и сушилась, концентрировалась и затем очищалась с помощью хроматографии на силикагельной колонке с получением целевого соединения. Выход: 0,4 г/84%/, т. пл.: 91-96°С. Исходное соединение для соединения настоящего изобретения может быть получено следующим образом. Процесс F цесс rocess F COOR' •-O осн ОСН -0 П - 2 } (Б - ! ) и COOR' ОН {В - 3 ) Процесс COOR' b o c e S S -6---0 (Б - 4 ) / -С і' Н L'-fV COOR' ОСН, (Б - 5 ) e 1 J ° /где R , L и X имеет значения, определенные выше/. Так, соединение формулы Н-3 может быть получено с помощью преобразования соединения Процесс frocgss H формулы 11-1 в соединение формулы Н-2 и затем каталитического гидрирования водородом. Преобразование соединения формулы 11-1 соответственно в соединение формулы Н-4 и соединение фор 27422 мулы 11-5 может осуществляться известными способами /смотри, например, Pharmacological Journal том 67, стр 51 (1947). Эти способы поясняются далее более подробно. Процесс F ^ COOR' осн 1> --0 іП - 1 } ( C H J , S і R' COOR' (V} RX0C1 (VI) (П - 6} COOR* или OCHr or (ЇЇ-?) /где R имеет значение, определенное выше, R8 представляет циано группу, диметиламино группу или диэтиламино группу, и R представляет диметиламино группу, диэтиламино группу, алкильную группу или фенильную группу/. Так, соединение формулы tl-6, или соединение формулы 1 - может быть получено путем 17 взаимодействия соединения формулы 11-1 с производным триметилсилила формулы V или хлорангидридом кислоты формулы VI в инертном растворителе в температурном интервале от комнатной температуры до точки кипения растворителя, в течение нескольких часов Примеры используемого здесь растворителя включают углеводородный растворитель такой, как бензол или толуол, галоидированный углеводородный растворитель такой, как дихлорметан или хлороформ, эфирный растворитель такой, как тетрагидрофуран или 1,4-диоксан, кетоновый растворитель такой, как ацетон или метилэтилкетон, сложно-эфирный растворитель такой, как метилацетат или этилацетат, апротонный полярный растворитель такой, как диметилформамид или диме» тилацетамид, ацетонитрил или другие. Среди них хлороформ является предпочтительным. Процесс G COOR' осн, COOR 4 Основание Base [П - 4 ) 6 /где R имеет значение, определенное выше, R10 представляет алкильную группу, замещенную алкильную группу или 4,6-диметоксипиридинильную группу, и L2 представляет атом галогена, при условии, что L2 представляет атом галогена или алкилсульфонильную группу, когда R10 представляет 4,6-диметоксипиримидинильную группу/. Так, соединение формулы Н-8 может быть получено путем взаимодействия соединения формулы II-4 с соединением формулы VI в присутствии основания в инертном растворителе в температурном интервале от комнатной температуры до точки кипения растворителя в течение от нескольких минут до нескольких часов. Примеры используемого здесь растворителя включают углеводородный растворитель такой, как бензол или толуол, галоидированный углево СП 8) дородный растворитель такой, как дихлорметан или хлороформ, эфирный растворитель такой, как тетрагидрофуран или 1,4-диоксан, кетоновый растворитель такой, как ацетон или метилэтилкетон, сложно-эфирный растворитель такой, как метилацетат или этилацетат, апротонный полярный растворитель такой, как диметилформамид или диметилацетамид, ацетонитрил, или другие. Примеры используемых здесь оснований включают щелочные металлы такие, как металлический натрий или металлический калий, гидриды щелочных металлов и гидриды щелочно-земельных металлов такие как гидрид натрия, гидрид калия или гидрид кальция, карбонаты такие, как карбонат натрия, карбонат калия или карбонат кальция и гидроокиси металлов такие как гидроокись натрия, гидроокись калия или гидроокись кальция. Процесс Н • 27422 R'' С О 0 R ' С О О Рч' В (О И ), ОСИ (П — 5 J (її /где R6 и L1 имеют значения, определенные выше, и R11 представляет замещенную фенильную группу/. Соединение формулы 11-9 может быть получено путем взаимодействия соединения формулы 11*5 с соединением формулы VII в присутствии основания и катализатора в инертном растворителе в температурном интервале от комнатной температуры до точки кипения растворителя в течение нескольких часов. Примеры используемых здесь растворителей включают углеводородный растворитель такой, как бензол или толуол, спиртовой растворитель такой, как метанол или этанол, эфирный растворитель такой, как 1,2-диметоксиэтан, тетрагидрофуран или этиловый эфир, сложно-эфирный растворитель такой, как метилацетат или этилацетат, апротонный полярный растворитель такой, как диметилформамид или диметилацетамид, ацетонитрил или другие. Примеры используемого катализатора включают тетракис/трифенилфосфин/палладий/О/, трифенилфосфинпалладийацетат, и трис/О-и толил /фосфинпалладийацетат. Примеры используемых оснований включают карбонаты такие, как карбонат натрия или карбонат калия, бикарбонаты такие, как бикарбонат натрия или органический основания такие, как триэтиламин или пиридин. Кроме этого, исходное соединение может быть получено с помощью следующего процесса. Процесс J С О О R' R \ С О О R€ N-: (її - і 0 ) /где R3, R4 и R6 имеют значения, определенные выше/. Так соединение формулы 1 - 1 может быть 11 получено с помощью взаимодействия соединения формулы 11-10 с муравьиной кислотой в температурном интервале от комнатной температуры до точки кипения в течение от нескольких минут до нескольких часов. 9} NHCHO (0-1 1) Соединение формулы ІМІ может также быть получено с помощью взаимодействия соединения формулы 11-01 со смесью уксусный ангидрид-муравьиная кислота или дициклогексилкарбодиимид форматом. Процесс J COOR' N-: R * • — (Л - 1 2 ] 3 4 6 /где R , R и R имеют значения, определенные выше/. Так, соединение формулы 11-13 может быть получено с помощью взаимодействия и соединения формулы 11-12 с нитритом натрия в присутствии муравьиной кислоты при температуре около R 0°С с получением диазониевой соли и затем обработкой диазониевой соли серой или серным соединением. Примеры серосодержащего соединения включают неорганические соединения такие, как сульфид натрия или гидросульфат натрия, и орга нические соединения такие, как бензилмеркаптан или 0-этил дитиокарбонат калия. Однако, производство не ограничивается этими способами. Получение исходного соединения представлено в дальнейших деталях со ссылкой на следующие Ссылочные примеры. Ссылочный пример 1. Получение метил-3-бензишкси-6-/г>І,гФдиметиламино/пиколината 15 г /58 ммоль/ метил 3-бензилоксипиколинат-М-оксида 6,7 г /67 ммопя/ триметилсилилнит 27422 рила и 8,3 г /61 ммоль/ N.N-диметилкарбамоил хлорида добавлялись к 100 мл метиленхлориде и смеси давалась возможность стоять при комнатной температуре при перемешивании Полученный органический слой промывался водой, сушился и концентрировался, и полученный таким образом остаток очищался с помощью хроматографии на колонке с получением целевого соединения. Выход: 2,4 г /14%/, т. пл.; 71,5-73 °С Ссылочный пример 2. Таким же образом, как представлено выше, получался метил-3-бензилокси-6-цианопиколинат. Выход: 3,1 г/20%/, т. пл. 103,5-105°С Ссылочный пример 3. Получение метил-3-бензилокси-6-метоксипиколината. 5,0 г /19 ммоля/ метил-3-бензилокси-6-гидроксипиколината, 2,1 г /19 ммоля/ этилбромида и 2,9 г /21 ммоля/ карбоната калия добавлялись к 100 мл ДМФ и получающаяся в результате смесь подвергалась взаимодействию при 80°С в течение 5 часов. После реакции, реакционная смесь вливалась в воду и экстрагировалась этилацетатом, промывалась водой, сушилась и концентрировалась. Остаток, полученный таким образом, очищался с помощью хроматографии на колонке с получением целевого соединения. Выход: 4,1 г /74%/ т. пл. 45-46°С Ссылочный пример 4. Получение метил-3-бензилокси-6-фенилпиколината. 0,6 г /0,5 ммоля/ тетракис/трифенилфосфин/ палладия /О/ и 5 мл 1,2-диметоксиэтана загружались в 100 мл трехгорлую колбу снабженную термометром, охлаждающей трубкой и трубкой для ввода азота. После этого, 2,7 г /10,0 ммоля/ метил-3-бензилокси-6-хлорпиколината растворялись в 1,2-диметоксиэтана /20 мл/ под струей азота и добавлялись в колбу за один раз. После перемешивания получающейся в результате смеси при комнатной температуре в течение 3 часов, 1,8 г /15,0 ммоля/ фенилборной кислоты растворялось в 1,2 б диметоксиэтане /15 мл/ и добавлялись к реакционной смеси, которая затем перемешивалась в течение 1 часа. Далее, к реакционной смеси добавлялся 2 м водный раствор карбоната натрия /40 мл/ и получающаяся в результате смесь нагревалась с обратным холодильником в течение 50 минут. После охлаждения, к реакционной смеси добавлялось соответствующее количество воды и смесь экстрагировалась этилацетатом. Органический слой, полученный таким образом, промывался водой и насыщенной соленой водой, сушился и концентрировался, и полученный таким образом остаток очищался с помощью хроматографии на колонке с получением целевого соединения. Получение метил-6-/М,Ы-диметиламино/-3гидроксипиколината. 2,3 г /8 ммоля/ метил-3-бензилокси-6-/М,Ыдиметиламино/пиколината и 0,3 г 10% палладия на угле добавлялись к 100 мл этилацетата и смесь гидрировалась при нормальном давлении, после реакции, реакционный продукт фильтровался и концентрировался с получением кристалла. Выход 1,4 г /92%/ т. пл. 118,5-120°С Конкретные примеры исходных соединений, полученных таким же образом, как в ссылочных примерах 1-6 перечислены в таблице 2. Гербицидная композиция настоящего изобретения включает производное пиколиновой кислоты, имеющее формулу (І), в качестве эффективного ингредиента. Когда соединение настоящего изобретения используется в качестве гербицида на рисовых полях, возвышенных полях, садах и несельскохозяйственных угодьях, активный ингредиент может использоваться в соответствующих препаративных формах в зависимости от его использования. В основном, активный ингредиент может использоваться в различных препаративных формах таких, как дуст, смачиваемый порошок эмульгируемый концентрат и гранулы с помощью разбавления инертной жидкостью или твердым носителем или необъязательно с помощью смешивания с поверхностно-активным веществом, диспергирующим агентом или вспомогательным веществом. Например, дуст получается с помощью смешивания и пульверизации активного ингредиента с твердым носителем. Смачиваемый порошок может получаться с помощью смешивания и пульверизации активного ингредиента с твердым носителем, поверхностно-активным веществом и диспергирующим агентом. Эмульгируемый концентрат может получаться с помощью смешивания активного ингредиента с жидким носителем, поверхностно активным веществом и диспергирующим агентом. Гранулы могут получаться с помощью смешивания и грануляции активного ингредиента с твердым носителем, поверхностно-активным веществом, диспергирующим агентом и вспомогательным веществом, или с помощью смешивания, и грануляции твердого носителя, поверхностно-активного вещества, диспергирующего агента и вспомогательного вещества. В качестве носителя, предназначенного для использования в этих препаративных формах, могут быть перечислены твердые носители, такие как тальк, бентонит, глина, каолин, диатомовая земля, белая сажа, вермикулит, гашеная известь, кремнеземный песок, сульфат аммония или мочевина, или жидкий носитель такой, как изопропанол, ксилол, циклогексанон, изофорон или метил нафталин. В качестве поверхностно-активного вещества и диспергирующего агента могут быть перечислены, например, соль сложного эфира спирта и серной кислоты, алкиларилсульфонат, конденсат нафталинсульфоната и формалина, лигнинсульфонат, полиоксиэтиленгликолевый эфир, полиоксиэтиленалкилариловый эфир или полиоксиэтиленсорбитолмоноалкилат. В качестве вспомогательного вещества могут быть перечислены, например, карбоксиметил целлюлоза, полиэтиленгликоль или аравийская камедь. Выход 1,9 г/59,4%/ Ссылочный пример 5. Получение метил-3-гидрокси-6-фенилпиколината. 1,9 г метил-3-бензилокси-6-фенилпиколината восстанавливался с помощью смеси 10% палладий на угле /метанол, и получающийся в результате продукт очищался с помощью хроматографии на колонке с получением целевого соединения. Выход: 1,0 г /76,9%/, т.пл. 100-101°С Ссылочный пример 6. 10 27422 Соотношение активного ингредиента необязательно выбирается в зависимости от его использования, и обычно оно от 0,01 до 10% по весу, предпочтительно от 0,05 до 5% по весу, в случае дустовой или гранулярной препаративной формы и от 1 до 50% по весу, предпочтительно от 5 до 20% по весу, в случае эмульгируемого концентрата и смачиваемой порошкообразной препаративной формы, но оно не ограничивается ими. При практическом использовании, перед применением по отношению к листве, почве или водной поверхности, гербицид настоящего изобретения может разбавляться до подходящей концентрации или применяться непосредственно. Гербицид настоящего изобретения применяется в дозе от 0,1 г до 5 кг, предпочтительно от 1 г до 1 кг активного ингредиента на 10 ар. В случае применения в жидком виде таком, как эмульгируемый концентрат и смачиваемая порошок, активный ингредиент разбавляется до концентрации от 0,1 до 50000 млн. долл. предпочтительно от 10 до 10,000 млн. дол., но она не ограничивается ими. Если это желательно, соединение настоящего изобретения может использоваться в комбинации с инсектицидами, стерилизаторами, другими гербицидами, агентами регулирующими рост растений, удобрениями или аналогичными. Сейчас, будут даны типичные примеры препаративной формы для гербицидной композиции настоящего изобретения. В этих примерах термин "часть", обозначает "часть по весу". Пример препаративной формы I (дуст). 1 часть соединения№20 и 99 частей диатомовой земли равномерно перемешивалась и пульверизировалась до получения дуста. Пример препаративной формы 2/смачиваемый порошок/. 10 частей Соединения№19, 0,5 части полиоксиэтиленалкиларилового эфира, 0,5 части конденсата нафталинсульфоната натрия и формалина, 20 частей диатомовой земли и 69 частей глины равномерно смешивалась и пульверизировались до получения смачиваемого порошка. Пример препаративной формы 3 /смачиваемый порошок/. 10 частей Соединения№1 0,5 части полиоксиэтиленапкиларилового эфира, 0 5 части конденсата нафталинсульфоната натрия и формалина, 20 частей диатомовой земли, 5 частей Карплекса 80 и 64 части глины равномерно смешивались и пульверизировались до получения смачиваемого порошка. Пример препаративной формы 4 /эмульгируемый концентрат/. 30 частей соединения№20, 60 частей эквивалентного количества смеси ксилола и изофорона и 10 частей полиоксиэтиленалкиларилового эфирного полимера и соль металла алкилбензолсульфоновой кислоты равномерно смешивались и перемешивались для получения эмульгируемого концентрата. Пример препаративной формы 5 /гранулы/. 10 частей Соединения№3, 80 частей наполнительного агента, содержащего 1:3 смесь талька и бентонита, 5 частей белой сажи, 5 частей полиоксиэтиленалкиларилового эфирного полимера и соль металла алкилбензолсульфоновой кислоты и 10 частей воды полностью перемешивались до получения пастообразного материала. Пастообразный материал затем экструдировался через сито с отверстиями 0,7 мм в диаметре, и экструдированный продукт сушился и разрезался на кусочки длиной 0,5-1 мм для получения гранул. Соединение настоящего изобретения, имеющее общую формулу І, является эффективным для уничтожения различных вредных сорняков, растущих на возвышенных полях, в небольших дозах, причем примеры сорняков включают широколистные сорняки такие, как вьюнок пурпурный (Parnoca sp), дурнишник пастбищный (Xanthum strumarium), гооец перечный (Polygonum lapathifotium), щирица (Amaranthus viridis), марь белая (Chenopodium album), звездчатка (Stellaria media), канатник Теофраста (Abutilon theophrastl), и грудинка колючая (Sida spinosa), многолетние и однолетние сорняки (Cyperaceous) такие как пурпурная сыть (Cyperus rotunaus), желтая осока (Kyllinga brevifolia), сыть длинная (Cyperus microtna) и сыть вееровидная (Cyperus iria), и злаковые сорняки такие как пырей ползучий (Agropyron repens), дикое сорго (Sorghum halepense), куриное просо (Echinochloa crusgalli), росичка кровяная (Oigetaria sp.), щетинник коленчатый (Setana sp.), щетинник зеленый (Setaria viridis), иэлевзина индийская (Eleusina indica). Соединение настоящего изобретения является также эффективным гербицидом для вредных сорняков растущих на несельскохозяйственных угодьях, таких как лиана райграс многоукосный (Lolium multitlorum), eulalia (Miscanthus sinensis), cogongrass (Imperata cylindrica), коммелина (Commelina communis), портулак (Portulaca oteracea), arrowroot (Pueraria lobata), золотарник высокий (Solidago altissima) и череда ветвистая (Bidens frondosa). Соединение настоящего изобретения проявляет превосходное гербицидное действие при очень небольшой дозе на однолетние сорняки такие, как куриное просо (Echinochloa crusgalli), сыть вееровидная (Cyperus difformis) и монохория (Monochoria vaginalis), и многолетние сорняки такие как Sagittaria pigmaca Cyperus serotinus, Eleocharis kuroguwai, камыш (Scirpus hotarui) и Alisma canaliculatus растущие на рисовых полях, в широком диапазоне от стадии прорастания до стадии роста. Сейчас, эффективность гербицидного действия соединений настоящего изобретения будет представлена со ссылкой на следующие Примеры Испытания. В примерах испытаний, в качестве сравнительных примеров использовались следующие соединения. Соединение А: этил-3-/4,6-диметоксипиримидин-2-ил/оксипиколинат (Соединение описано в Японской Не прошедшей экспертизу Патентной публикации№84(1989) Соединение В: метил-3-/4,6-диметоксипиримидин-2-ил/тиопиколинат (Соединение описано в Японской не прошедшей Экспертизу патентной публикации№121973 (1990). Пример испытания 1. Испытание гербицидной эффективности на рисовом поле, обработка почвы. В пластиковый лоток (площадь поверхности : 100 см2) наполненной почвой рисового поля, пос 11 I 27422 него высевали куриное просо (Ее), горец перечный (Ро), щирицу (Am), марь белую (Сп) и сыть вееровидную (Сі) И закрывали почвой, в течение 2-х недель они выращивались в теплице Смачиваемый порошок, приготовленный в соответствии с примером препаративной формы 2, разбавлялся водой, и наносился сверху с помощью распылителя небольшого размера на всю листву растения в количестве 100 л/10 ар таким образом, чтобы применить 100 г активного ингредиента на 10 ар Растения затем содержались в теплице и оценка гербицидной эффективности проводилась на 14-й день после обработки в соответствии с оценкой, представленной выше в таблице 3 Результаты показаны в следующей таблице б Пример испытания 4 Испытание гербицидной эффективности на возвышенном поле, обработка листвы при небольшой дозе Пластиковый лоток (площадь поверхности 600 см2) наполнялся почвой возвышенного поля, в него высевали куриное просо (Ее), дикое сорго (So), горец перечный (Ро), щирицу (Am), марь белую (Сп), вьюнок пурпурный (Ip) и дурнишник пастбищный (Ха) и закрывали землей, в течение 2-х недель они выращивались в теплице Заданное количество смачиваемого порошка, приготовленного в соответствии с Примером препаративной формы 2 разбавлялось водой, и наносилось сверху, с помощью распылителя небольшого размера, на всю листву растения в количестве 100 л/10 ар Растения затем выращивались в теплице и оценка гербицидного эффекта проводилась на 14-й день после обработки в соответствии с оценкой представленной выше в таблице 3 Результаты показаны в следующей таблице 7 ле взмучивания и разравнивания высевались куриное просо (Ее), шжохория (Мо) и камыш (Sc), и заливалась вода до глубины 3 см На следующий день, смачиваемый порошок приготовленный в соответствии с Примером препаративной формы 2, разбавлялся водой, и по каплям наносился на поверхность воды таким образом, чтобы применить 100 г активного ингредиента на 10 ар Растения затем содержались в теплице, и оценка эффективности гербицидного действия проводилась на 21-й день после обработки в соответствии с оценками представленными в таблице 3 Результаты показаны в следующей таблице 4 Пример испытания 2 (Испытание гербицидного эффекта на возвышенном поле, обработка почвы) Пластиковый лоток (площадь поверхности 100 см2) наполнялся почвой рисового поля, в него высевали куриное просо (Ее), горец перечный (Ро), щирицу (Am), марь белую (Сп) и сыть вееровидную (Сі) И закрывали почвой Смачиваемый порошок, приготовленный в соответствии с примером препаративной формы 2 разбавлялся водой, и с помощью распылителя небольшого размера равномерно наносился на поверхность почвы в количестве 100 л/10 ар таким образом, чтобы применить 100 г активного ингредиента на 10 ар Растения затем выращивались в теплице, и оценка гербицидного эффзкта проводилась на 20-й день после обработки в соответствии с оценкой, представленной выше в таблице 3 Результаты показаны в следующей таблице 5 Пример испытания 3 Испытание гербицидной эффективности на возвышенном поле, обработка листвы Пластиковый лоток (площадь поверхности 100 см2) наполнялся почвой возвышенного поля, в Таблица 2 соосн, R'J 71 5-73 Н И8 5-120 CHjPh 103 5-105 Н N(CH,), Температура плавления, "С CHjPh Промежуточное соединение 100-Ю1 140-143 84 5-86 127-130 142-145 124 5-127 82-85 12 27422 Таблица 3 Гербицидные эффекты /степень регулирования роста Индекс № Гербицидный эффект Гербицидный эффект Гербицидный эффект Гербицидный эффект Гербицидный эффект Гербицидный эффект 5 4 3 2 r 1 ' 0 не меньше 90% не меньше 70% и меньше, чем не меньше 50% и меньше, чем не меньше 30% и меньше, чем не меньше 10% и меньше, чем от 0 до меньше, чем 10% 90% 70% 50% 30% Таблица 4 Соединение № 1 2 3 4 19 20 21 22 23 24 27 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 56 57 63 Ее 5 5 5 Гербицидное действие Мо 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 13 Sc 5 5 5 5 5 5 4 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 27422 Таблица 5 Соединение № 1 2 19 20 21 22 24 25 27 35 36 37 38 39 40 41 42 43 44, 45 46 48 49 56 57 63 ° Ее Гербицидное действие Ро Ch Am 5 5 5 5 5 5 5 4 5 5 5 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 4 5 4 5 5 5 5 5 5 5 5 5 • 5 5 5 ' 5 5 14 5 5 5 5 5 5 5 5 5 5 4 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5. 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 Сі 5 5 5 5 5 5 5 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 • 5 5 5 27422 Таблица б Соедине Ее 1 2 Гербицидное действие Ро Ch Am 5 5 5 5 19 20 21 22 23 24 27 35 36 37 38 39 40 41 42 43 44 45 46 48 49 56 57 63 5 5 5 5 4 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 4 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 4 5 5 5 5 5 5 5 5 Сі 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 4 5 5 5 5 5 5 5 5 5 5 5 5 5 5 5 Таблица 7 Соединение № 20 39 40 41 42 44 45 47 48 49 57 63 А В Доза активного ингред-та (г/10а) 6.3 6.3 6.3 6.3 6.3 6.3 6.3 6.3 6.3 6.3 6.3 6.3 6.3 6.3 6.3 Гербицидное действие Ее So Ро Am Ch ІР Xa 5 5 5 5 5 5 5 5 5 5 5 5 5 І 0 5 5 5 5 5 5 5 5 5 5 5 5 5 4 2 5 5 5 5 5 5 5 5 5 5 5 5 5 4 3 5 5 5 5 5 5 5 5 5 5 5 5 5 5 1 5 5 5 5 5 5 5 5 5 5 5 5 5 5 1 0 5 5 5 5 5 5 5 5 5 5 5 5 5 1 0 15 5 5 5 5 5 5 5 5 5 5 5 5 4 3 I 27422 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м Ужгород, вул. Гагаріна, 101 (03122) 3 - 7 2 - 8 9 (03122) 2 - 5 7 - 0 3 16
ДивитисяДодаткова інформація
Назва патенту англійськоюThe picolinic acid derivative or the salt thereof, having herbicide activity, the method for obtaining thereof, the herbicide composition and the method for weed eracidation
Автори англійськоюFumiaki Takabe, Josikhiro Siato, Masatosi Tamaru, Sigekhiko Tatikava, Rio Khanai
Назва патенту російськоюПроизводное пиколиновой кислоты или его соль, обладающее гербицидной активностью, способ его получения, гербицидная композиция, спосиб уничтожения бурьянов
Автори російськоюФумиаки Такабе, Йосихиро Саито, Масатоси Тамару, Сигехико Татикава, Рио Ханаи
МПК / Мітки
МПК: A01P 13/00, A01N 43/54, C07D 401/12
Мітки: кислоти, одержання, піколінової, похідне, спосіб, гербіцидну, бур'янів, композиція, знищення, гербіцидна, має, активність, сіль
Код посилання
<a href="https://ua.patents.su/18-27422-pokhidne-pikolinovo-kisloti-abo-jjogo-sil-shho-maeh-gerbicidnu-aktivnist-sposib-jjogo-oderzhannya-gerbicidna-kompoziciya-sposib-znishhennya-buryaniv.html" target="_blank" rel="follow" title="База патентів України">Похідне піколінової кислоти або його сіль, що має гербіцидну активність, спосіб його одержання, гербіцидна композиція, спосіб знищення бур’янів</a>
Попередній патент: Нагрівний пристрій для установлення в доступному контейнері, що самопідігрівається, і нерознімний несучий елемент
Наступний патент: Мембрана преса для поділу рідких та твердих речовин
Випадковий патент: Спосіб моделювання пародонтиту у щурів