Біологічний спосіб одержання 7-амінодезацетоксицефалоспоранової кислоти (7-адса)
Номер патенту: 41292
Опубліковано: 17.09.2001
Автори: Крофорд Лорілі, Макейда Філліс К., Рембоусек Джон А., Кондер Майкл Дж.
Формула / Реферат
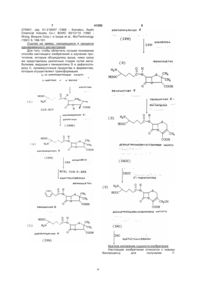
1. Биологический способ получения 7-аминодезацетоксицефалоспорановой кислоты (7-ADCA), включающий следующие стадии:
а) поддержание штамма Penicillium chrysogenum, который продуцирует изопенициллин N, в культуральной среде, способной обеспечивать его рост, и добавление в указанную культуральную среду адипинат-содержащего сырья, содержащего адипиновую кислоту или одну, или несколько ее солей и сложных эфиров, которые могут усваиваться и утилизироваться указанным штаммом Penicillium chrysogenum с продуцированием адипоил-6-аминопенициллиновой кислоты (адипоил-6-АРА), посредством чего продуцируется указанная адипоил-6-АРА;
где указанный штамм Penicillium chrysogenum трансформирован ДНК, кодирующей экспандазу, способную использовать в качестве субстрата указанную адипоил-6-АРА, вследствие чего в результате ее экспрессии указанная адипоил-6-АРА, продуцируемая указанным штаммом, также впоследствии подвергается in situ расширению цикла с образованием адипоил-7-аминодезацетоксицефалоспорановой кислоты (адипоил-7-ADCA); и
б) взаимодействие указанной адипоил-7-ADCA с адипоилацилазой, посредством чего удаляется адипоильная боковая цепь, и образуется 7-ADCA продукт; и указанный продукт далее выделяют.
2. Биологический способ по п. 1, где адипинат-содержащее сырье представляет собой динатрия адипинат.
3. Биологический способ по п. 1, где кодирующая экспандазу ДНК происходит из Streptomyces clavuligerus.
4. Биологический способ по п. 1, где кодирующая экспандазу ДНК происходит из штамма Streptomyces clavuligerus ATCC 27064.
5. Биологический способ по п. 1, где адипоилацилаза происходит из Pseudomonas species.
6. Биологический способ по п. 1, где используемые штаммы Penicillium chrysogenum культивируют при температуре между 20°С и 30°С, предпочтительно 25°С.
7. Биологический способ по п. 1, где адипинат-содержащее сырье может быть добавлено до или, альтернативно, после инокуляции Penicillium chrysogenum, предпочтительно до указанной инокуляции.
Текст
1. Биологический способ получения 7аминодезацетоксицефалоспорановой кислоты (7ADCA), включающий следующие стадии: а) поддержание штамма Penicillium chrysogenum, который продуцирует изопенициллин N, в культуральной среде, способной обеспечивать его рост, и добавление в указанную культуральную среду адипинат-содержащего сырья, содержащего адипиновую кислоту или одну, или несколько ее солей и сложных эфиров, которые могут усваиваться и утилизироваться указанным штаммом Penicillium chrysogenum с продуцированием адипоил-6-аминопенициллиновой кислоты (адипоил6-АРА), посредством чего продуцируется указан C2 2 (11) 1 3 41292 4 пориновая кислота /7-ADCA/, которая может быть вом нового способа ферментации с высокими титизображена следующей формулой: рами, причем упомянутое соединение пенициллина является приемлемым субстратом для ферментной системы экспандазы, которая образуется in situ тем же микроорганизмом, который образует соединение пенициллина, и которое трансформируется для экспрессии упомянутой системы фермента экспандазы. Экспандаза затем Обычно 7-ADCA получают из пенициллина С, с высоким выходом расширяет кольцо соединения и требуется четыре или пять химических стадий, пенициллина до соединения цефалоспорина. И, чтобы расширить систему пенициллинового кольчто важно для второго критического момента, боца от 5-членного до 6-членного кольца, которое ковая цепь соединения пенициллина, теперь характеризует цефалоспорины. Как типично для соединения цефалоспорина, способна удаляться полностью химического синтеза, этот способ имепри действии другой ферментной системы с удиет серьезные недостатки. К их числу относятся вительно высоким выходом. Неожиданным ренеобходимость многостадийного и комплексного зультатом этого уникального биопроцесса, котопроцесса, высокая стоимость реагентов, проблерый составляет суть настоящего изобретения, мы обработки сточных вод, содержащих значиявляется производство 7-ADCA с удивительно тельные количества побочных продуктов, обравысоким выходом. зующихся в результате процесса, и очистка 2. Краткое описание прототипа исходного материала перед началом химической Cantwеll et al., в Сurr. Genet. /1990/ 17:213-221, обработки. Поэтому продолжаются поиски микропредложили биопроцесс для получения 7-ADCA биологического или ферментативного процесса, посредством расширения кольца пенициллина V с который обеспечил бы осуществление расширепоследующим ферментативным гидролизом полуния ферментного кольца и отщепление боковой чающегося в результате дезацетоксицефалоспоцепи с образованием 7-ADCA на более экономичрина V с образованием 7-ADCA. Такое предложеной основе, чем химический способ, который исние основано на наличии клонированного пользуется сейчас. пенициллином N гена экспандазы /сеfЕ/ из S. claСоответственно, настоящее изобретение каvuligerus, Kovacevic еt а1., J. Bacteriol. /1989/ сается, в особенности, области получения ключе171:754-760, и патент США 5070020. Однако, так вого промежуточного соединения цефалоспорина как экспандаза проявляет активность на пеницил7-ADCA, и более конкретно - к области биопролине N, своем природном субстрате, но не на пецесса для получения 7-ADCA. нициллине V, предложение требует приемов генСначала поиски удачного биопроцесса для ной инженерии для получения получения 7-ADCA были безуспешны, особенно с модифицированного гена экспандазы, который точки зрения коммерческого масштаба. Например, может расширять кольцо пенициллина. Однако, хотя возможно получить 6-аминопенициллиновую Cantwell et at., не добились требуемой модификакислоту /6-АРА/ прямой ферментацией и/или ции, и они только преуспели в трансформации ферментативной обработкой пенициллина G, поPenicillium chrysogenum с cefE-геном из Streptomyсле чего остается только необходимость расшиces сlаvuligerus и экспрессии низкого уровня феррения кольца, чтобы получить 7-ADCA, найдено, мента DAOCS /экспандазы/. что, к несчастью, ферменты Cephalosporiun или Фермент экспандаза хорошо изучен в технике Streptomyces, которые осуществляют расширение как с точки зрения его активности, так и его послекольца при обычном обмене в этих микроорганиздовательности. Например, в патентах США мах, не приемлют 6-АРА в качестве субстрата. 4510246 и 4536476, Wolfe, циклаза, эпимераза и Эти ферменты, которые все вместе относят в техферменты расширения кольца выделены отдельнике a DAOCS или экспандазе, определяются как но из бесклеточного экстракта прокариотных проферменты, которые катализируют расширение дуцирующих β-лактам организмов, включая Strepкольцевых структур пенама, обнаруженных в моtomyces сlаvuligerus, чтобы дать устойчивые лекулах типа пенициллина, до цеф-3-ем-колец, ферментные реагенты. Заявка на Европейский найденных в цефалоспоринах. Далее здесь такие патент ЕР-А-O 366354 описывает очищенный ферменты будут упоминаться как "фермент эксфермент экспандазу, выделенный из S. пандаза". сlаvuligerus, который отличается концевой группой Субстратом, на котором фермент экспандаза и аминокислотным составом, и упоминается, что проявляет активность, является пенициллин N, его молекулярная масса составляет около 34600 который при расширении кольца дает дезацетокдальтон. Это, однако, находится в противоречии с сицефалоспорин С /DAOC/. В таком случае, чтобы молекулярной массой, равной 29000, приписыполучить 7-ADCA, необходимо только отщепить ваемой этому же ферменту в патенте США боковую (D)-α-аминоадипоиловую цепь, но эта 4536476. Заявка на Европейский патент ЕР-А-O боковая цепь оказывает упорное сопротивление 233715 раскрывает выделение и создание карты ферментативному отщеплению, давая только неэндонуклеазного ограничения фермента экспанприемлемо низкие выходы. дазы, полученной из S. clаvuligerus трансформаВ соответствии с настоящим изобретением цию и экспрессию в хозяине упомянутого ферменвозможно осуществить элективный биопроцесс, в та, и примеры расширения кольца субстрата котором образуется соединение пенициллина пенициллина N с использованием упомянутого (имеющее боковую адипоильную цепь) посредстфермента. Патент США 5070020 раскрывает по 2 5 41292 6 следовательность ДНК, кодирующую фермент N, но не пенициллинов G и V. Даже в этом случае экспандазу, полученную из S. сlаvuligerus и опипенициллин N имеет боковую цепь в положении 7, сывает трансформацию штамма P. chrysogenum с которая не может быть отщеплена ферментативвектором экспрессии, содержащим упомянутую но с образованием 7-ADCA, как по способу напоследовательность ДНК, за счет чего получают стоящего изобретения. Настоящее изобретение экспрессию фермента экспандазы. Хотя предпоосновывается на поразительном открытии, что лагается, что этот фермент пригоден для экспанадипоильная боковая цепь может быть эффективсии субстратов и иных, чем пенициллин N, примено присоединена штаммом P. chrysogenum, и что фермент экспандаза, экспрессированный in situ, ров такой экспансии не приводится. может эффективно использовать это соединение Описанная выше работа сосредоточивает в качестве субстрата для расширения кольца до внимание на ферменте экспандазе, полученной из адипоил-7-АDСА, и что адипоильная боковая цепь прокариотного S. Сlаvuligerus. Этот же фермент, или по крайней мере фермент, явно имеющий ту затем может быть эффективно удалена с поможе активность по расширению кольца, также подщью еще одного фермента с образованием 7вергается экспрессии штаммами эукариотного ADCA. Хотя отдельные выделенные фрагменты Cephalasporium асrеmonіum (также называемого настоящего изобретения могут быть найдены в Aсrеmonіum chrysogenum). Однако, в таких штампрототипах, нельзя предположить, что их можно соединить и получить непредвиденные результамах активность экспандазы экспрессируется биты, которые получают по способу настоящего изофункциональным геном /cefEF/, который также бретения. экспрессирует активность DАСS /гидроксилазы/, Например, в технике известен способ получеестественной функцией которой является конверния 6-адипоилпенициллиновой кислоты, см. Ballio, сия дезацетоксицефалоспориновой кислоты A. et al., Nature, /1960/, 185, 97-99. Ферментатив/DАОС/ - продукта фермента экспандазы - в дезное расширение 6-адипоилпенициллиновой киацетилцефалоспорин С /DАС/. Результатом являслоты іn vitrо также известно в технике, см. Baldется один, но бифункциональный фермент - эксwin et al., Tetrahedron /1987/ 43, 3009-3014; и ЕР-Апандаза/гидроксилаза. Хотя предприняты усилия О 268343. Также известно и ферментативное отпо разделению активностей этих двугенных прощепление боковых адипоильных цепей; см. Maдуктов, успех пока не достигнут. Например, заявка tsuda еt al., J.Bact. /1987/ 169, 5815-5820. на Европейский патент ЕР-А-O 281391 раскрывает Адипоильная боковая цепь имеет строение выделение и идентификацию ДНКСООН-(СН2)4-CO-, в то время как ближайшая родпоследовательности гена DAOCS/DACS, полученственная боковая цепь представляет собой глутаного из С. acremonium АТСС 11550, вместе с соответствущими аминокислотными последовательрил и имеет строение СООН-(СН2)3-СО-. Ферменностями ферментов. Penicillium тативное отщепление боковых глутариловых цепей известно в технике, см. например, Shibuya трансформируется и экспрессирует ферменты, et al., Aqric. Biol. Chem. /1981/ 45, 1561-1567; Maоднако, попытки конверсии пенициллинов G и V в tsuda and Коmаtsu, J. Bact. /1985/ 163, 1222-1228; соответствующие цефалоспорины нигде не деMatsuda etal., J. Васt. /1987/ 169, 5815-5820; Jap. монстрируется. Кроме того, несмотря на предпо53-086084 /1978 - Ваnyu Pharmaceutical Co. Ltd./; и ложение, что техника генной инженерии дает легJap. 52-128293 /1977 - Ваnyu Pharmaceutical Co. кий способ разделения генетической информации, Ltd./. кодирующий DAOCS, и DАСS, и их раздельного Также, заявка ЕРА-А-O 453048 описывает вираження, фактических примеров такого разделения не приводится. способы улучшения отщепляющей адипоил акФермент DAOCS/DACS (экспандативности глутарилацилазы, полученной с помощью Pseudomonas S У-77-1. При замещении разза/гидроксилаза) из С. асrеmonіum также хорошо изучен в технике как в отношении его активности, личных аминокислот в некоторых так и в отношении его свойств и генетической поместоположениях в пределах альфасубъединицы, следовательности. Например, в патентах США наблюдают увеличение степени отщепления ади4178210, 4248966 и 4307192, Demain, различные поила /из адипоилсерина/ в три-пять раз. Следует исходные материалы типа пенициллина обрабаотметить, что хотя заявка ЕР-А-О 453048 привотывают бесклеточным экстрактом С асrеmonіum дит примеры ацилазы с улучшенной активностью по отношению к адипоильным боковым цепям, в который эпимеризует и экспандирует кольцо с образованием антибиотика типа цефалоспорина. ней не описаны какие-либо пути /ни химические, ни какие-либо биопроцессы, аналогичные описанWu-Kuang Yeh в патенте США 4753881 описывает ным в настоящем описании/, в соответствии с кофермент С. асrеmonіum с точки зрения его торыми на первой стадии можно генерировать свойств, таких как изоэлектрическая точка, молекулярная масса, аминокислотные остатки, соотадипоилцефалоспорин. В технике известно, что когда присутствует ношение активностей гидроксилазы и экспандазы боковая (D)-α-аминоадипоильная цепь, в первую и пептидные фрагменты. очередь (D)-аминоацидоксидазой удаляют аминоПрототипы, описанные выше, имеют дело только с одним аспектом настоящего изобретения, группу и укорачивают боковую цепь, оставляя боковую глутариловую /GL-7/ цепь, и глутариловую т.е., с трансформацией штамма P. chrysogenum боковую цепь удаляют другим ферментом геном, экспрессирующим фермент экспандазу, и /глутарилацилазой/. Такое двухстадийное отщепполучением экспрессии этого фермента. В технике, однако, используют экспрессированный ферление раскрывается в патенте США 3960662. Matsuda, в заявке на Европейский, патент ЕР-А-O мент только для расширения кольца пенициллина 3 7 41292 275901; Jар. 61-218057 /1988 - Коmаtsu, Asahi Chemical Industry Co./; ВОИС 90/12110 /1990 Wong, Biopure Corp./; и Isoqai et al., Bio/Technology /1991/ 9, 188-191. Ссылка на заявку, находящуюся в процессе одновременного рассмотрения Для того, чтобы облегчить лучшее понимание способа настоящего изобретения и изучение прототипов, которые обсуждались выше, ниже сразу же представлены различные стадии путей метаболизма, ведущие к пенициллину G и цефалоспорину С, промежуточным продуктам и ферментам, которые осуществляют трансформации. 8 Краткое изложение сущности изобретения Настоящее изобретение относится к новому биопроцессу для получения 7 4 9 41292 10 аминодззацетоксицеaфалоспориновой кислоты /7при этом упомянутая клетка-хозяин содержит векADCA/, который включает стадии: тор экспрессии, содержащий ДНК, кодирующую 1. Выдержки в культуральной среде, способэкспандазный фермент, происходящий из Strepной поддерживать его рост, штамма Penicillium tomyces clavuligerus АТСС 27064, и промотор, коchrysogenum, который продуцирует изопеницилторый стимулирует экспрессию этой ДНК, кодилин N, и добавления к упомянутой культуральной рующей экспандазу, и содержащий промотор гена среде адипинатного сырья (питания), содержащеIPNS Penicillium chrysogenum. В частности, наго адипиновую кислоту или одну, или большее стоящее изобретение относится к способу вырачисло, ее солей и эфиров, которые способны асщивания клетки-хозяина рекомбинантного Penicilсимилироваться и быть использованными упомяlium chrysogenum в условиях, подходящих для нутым штаммом Penicillium chrysogenum для проэкспрессии гена, при этом упомянутая клетка рекомбинантного хозяина включает вектор экспресдуцирования адипоил-6-аминопенициллиновой сии рекомбинантной ДНК, содержащей плазмиду кислоты /адипоил-6-АРА/, в результате чего проpPenFTSO, как описано далее. дуцируется упомянутая адипоил-6-АРА; Подробное описание изобретения на этой стадии штамм Penicillium chrysogenum трансформируется ДНК, кодирующей фермент Первым аспектом настоящего изобретения экспандазу, использующую адяпоил-6-АРА в качеявляется новый биопроцесс для получения 7стве субстрата, после чего продуцированная этим аминодезацзтоксицефалоспориновой кислоты /7штаммом адипоил-6-АРА, in situ расширяет кольцо АDСА/, ключевого промежуточного соединения с образованием адиполи-7-АDСА; и при получении синтетических коммерческих це2. Приведения в контакт упомянутой адипоилфалоспоринов, которая может быть представлена 7-ADCA с адипоилацилазой, посредством чего следующей структурной формулой: удаляется боковая адипоильная цепь и образуется продукт 7-АDСА; и упомянутый продукт затем выделяют. Здесь используются термины, имеющие указанные далее значения. "Адипоил-6-АРА" означает [2S-(2α,5α,6β)]-3,3диметил-7-оксо-6-[(гексан-1,6-диоил)амино]-4-тиа1-азабицикло-[3.2.0] гептан-2-карбоновую кислоту; Помимо цефалоспоринового ядра отличии "адипоил-7-ADCA" означает 7-[(гексан-1,6тельными чертами 7-АDСА являются группа 7диоил)амино]-3-метил-8-оксо-5-тиа-1-азабициклоамино- и 3-мeтилгруппа. Группа 7-амино- является (4.2.0)-окт-2-aн-2-карбоновую кислоту. такой группой, которая может быть превращена в В частности, настоящее изобретение относитлюбые производные, которые образуют боковые ся к новому биопроцессу для получения 7цепи, и таким образом является основанием для аминодезацетоксипефалоспориновой кислоты /7синтеза различных коммерческих цефалоспориАDСА/, изложенному выше, в котором адипинатнов. 3-Метильная группа обычно, но не всегда ное сырье представляет собой динатрийадипинат, как в случае цефалексина - должна быть превраДНК, кодирующая фермент экспандазу, получена щена в некоторую другую боковую цепь, чтобы из Streptomyces clavuligerus АТСС 27064, и для синтезировать коммерческий цефалоспорин. которого адипоилацелаза получена из вида Pseu7-ADCA - продукт способа настоящего изобреdomonas. тения - может быть сопоставлена с цефалоспориНастоящее изобретение относится также к ном С - еще одним ключевым промежуточным вектору экспрессии рекомбинантной ДНК, содерсоединением цефалоспорина - который может жащему ДНК, кодирующую фермент экспандазу, быть изображен структурной формулой: происходящую из Streptomyces clavuligerus АТСС 27064, и промотор, который стимулирует экспрессию этой ДНК, кодирующей экспандазу, включая плазмиду рРеn-FTSO, как описано далее. Настоящее изобретение, кроме того, относится к клетке-хозяину Penicillium chrysogenum, трансформированного вектором экспрессии, содержащим рекомбинантную ДНК, кодирующую Для такого промежуточного соединения для фермент экспандазу, происходящую яз Streptomyкоммерческих цефа-лоспоринов может быть приces clavuligerus АТСС 27064, и промотор, который емлема 3-ацетилоксиметильная боковая цепь. стимулирует экспрессию этой ДНК, кодирующей Однако, 7-(D)-α-аминоадипоильная боковая цепь экспандазу, и содержащий промотор гена IPNS не приемлема для дальнейшего синтеза и должна Penicillium chrysogenum. В частности, настоящее быть отщеплена, чтобы дать приемлемую 7изобретение относится к клетке-хозяину Penicilаминогруппу. К несчастью, 7-(D)-αlium chrysogenum, трансформированного вектором аминоадапоильная боковая цепь всегда отщепляэкспрессии рекомбинантной ДНК, содержащим ется с большим трудом как химическими так и плазмиду pPen-FTSO, как описано далее. биохимическими способами. Настоящее изобретение относится еще к споОпределения собу, включающему стадию выращивания клеткиВ настоящем описаний, и в частности, в разхозяина рекомбинантного Penicillium chrysogenum деле "Предпочтительные варианты осуществлев условиях, подходящих для генной экспрессии, 5 11 41292 12 ния изобретения", использованы некоторые терсмеси, и пептоны. Требования производства примины, значения которых указаны далее. дают особое значение выходу и легкости выделе7-ADCA 7-Аминодезацетоксицефалоспориновая ния, и таким образом, предпочтительными средакислота ми в такой ситуации могут быть меласса, как 6-АРА 6-Аминопенициллиновая кислота источник углерода, и соевая мука и аминокислоты DAOC Дезацетоксицефалоспориновая кислота в качестве источника азота. DAOCS DAOC синтетаза К культуральной сореде обычно добавляются DAC Дезацетилцефалоспорин С питательные неорганические соли, и такие соли DAСS DAC синтетаза включают соли, способные дать следующие ионIPNS Синтетаза изопенициллина N ные компоненты: натрий, калии, аммоний, кальТрис Трис [гидроксиметил] аминометан ций, фосфат, сульфат, хлор-ион, бром-ион, нитЭДта Этилендиаминтетрауксусная кислота рат, карбонат, железо двухвалентное, железо DEPC Диэтилпирокарбонат трехвалентное, магний, марганец и т.п. МикроТE Буфер Трис/ЭДТА элементы обычно также существенны для роста, SSC Буфер соль (хлорид натрия)/цитрат развития и метаболизма Penicillium chrysogenum, натрия и могут быть добавлены непосредственно в кульSDS Додецилсульфат натрия туральную среду, если они не введены уже в каПЭГ Полиэтиленгликоль честве примесей, по существу, с другими ингредиКультура Penicillium chrysogenum ентами культуральной среды. Первая стадия способа настоящего изобретеШтаммы Penicillium chrysogenum могут быть ния представляет собой стадию выдержки в кульполучены в оборудовании небольшого объема, туральной среде, способной поддерживать его таком как встряхиваемые колбы емкостью 1 л, в рост, штамма Penicillium chrysogenum, который таком оборудовании желательно получать только продуцирует изопенициллин N, и добавления к небольшие количества 7-АDСА. Когда нужно поупомянутой культуральной среде адипинатного лучить большие количества адипоил-7-ADCA, тосырья, содержащего адипиновую кислоту или ее гда будут использоваться ферментеры большого соли и эфиры. Адипинатное сырье может быть размера в условиях глубинной аэробной фермендобавлено к культуральной среде после инокулятации. ции Р. chrysogenum, но предпочтительно, чтобы При осуществлении крупномасштабного полуоно уже присутствовало в культуральной среде в чения адипоил-7-АDСА споры Penicillium chryто время, когда происходит инокуляция. Адипиноsogenum хранят на "косячках" агара. Споры с агавая кислота или ее соли и эфиры имеют свойство ра используют для инокулирования вегетационной ассимилироваться и использоваться упомянутым среды небольшого объема. Вегетационную среду штаммом Р. chrysogenum для образования адипоинкубируют, и получают обильную, свежую, активно растущую культуру микроорганизма. Эту вегеил-6-АРА; при этом упомянутый штамм Р. chryтативную поросль затем используют в качестве sogenum трансформирован ДНК, кодирующей акинокулянта для ферментационной среды большотивность экспандазного фермента, после чего, в го масштаба. В некоторых случаях может быть результате ее экспрессии, упомянутая адипоил-6желательно включить еще одну, следующую, веАРА in situ является расширяющей кольцо и образует адипоил-7-АDСА. гетационную среду в качестве инокулянта для Другие виды рода Penicillium, кроме вида chryферментационной среды. Такую вегетационную sogenum, продуцируют изопенициллин N. Однако, среду второй фазы обычно используют тогда, коисторически все штаммы самого высокого продугда объем ферментационной среды значительно цирования изопенициллина N разрабатывались, с больше объема первой вегетационной среды. В помощью хорошо известных технических приемов таком случае споры микроорганизма сначала выулучшения штамма, из вида chrysogenum. При ращивают в небольшом объеме вегетационной среды, чтобы получить инокулянт для вегетационсуществующей практике настоящее изобретение ной среды большего объема. В вегетационной ограничено штаммами Penicillium chrysogenum, среде большего объема концентрация микрооргахотя его применимость к другим видам очевидна. Любой депозитный штамм Penicillium chrysogenum низмов становится достаточной, чтобы инициировать быстрое начало ферментации в ферментере или из другого доступного источника такого штамбольшого размера. Вегетационная среда может ма является подходящим отправным моментом иметь тот же состав, что и ферментационная средля осуществления способа настоящего изобреда, или она может содержать дополнительные тения. ингредиенты для стимулирования роста и развиКультуральная среда, способная поддержития микроорганизма в небольшом объеме. вать рост штамма Penicillium chrysogenum, котоШтаммы Penicillium chrysogenum используерый продуцирует изопенициллин N, имеет тип, который был бы удобен в обращении для специамые в способе настоящего изобретения, наиболее листа. Например, выращивание может выполэффективно выращиваются при температуре от няться по способу глубинной аэробной фермента20° до 30°С, но оптимальный выход будет получен ции, и используемая среда будет выбираться из при температурах между 22° и 28°С, предпочтичисла доступных подходящих сред. Типичная сретельно - при 25°С. да использует источники углерода, такие как саМаксимальное образование адипоил- 7-АDСА хароза, глюкоза и крахмал; источники азота, такие имеет место тогда, когда штамм Penicillium chryкак соевая мука и овсяная мука, хлопковое масло, sogenum выращивают в больших резервуарах в арахисовая мука и различные аминокислоты, их течение 10-30 суток, предпочтительно - в течение 6 13 41292 14 15-25. суток. Однако, когда выращивание осущевыше, т.е., перед инокуляцией, добавлять к друствляют в небольшой аппаратуре, такой, как гим ингредиентам ферментативной среды для встряхиваемые колбы емкостью 250 мл, рост миквыращивания адипинатное сырье. Необязательроорганизма происходит быстрее, и он образует но, адипинатное сырье может быть добавлено в адипоил-7-ADCA за более короткое время, напритечение некоторого времени после инокуляции, мер, за 4-15 суток, чаще - за 5-7 суток. например, в 1, 2 и/или 3 день после инокуляции. Если конечная величина рН в ферментерах Адипинатное сырье представляет собой адипинобольшого объема достигает 8,0 или выше, это вую кислоту или одну, или большее число, солей может неблагоприятно воздействовать на выход ила эфиров адипиновой кислоты, которые способадипоил-7-ADCA. В таких случаях желательно ны ассимилироваться и использоваться штаммом контролировать величину рН в процессе ферменPenicillium chrysogenum, который выращивают для тации. Оказывается, что рН достигает такого продуцирования адипоил-7-АРА. Адипиновая киуровня раньше времени максимального образоваслота, соли и эфиры могут использоваться по одния адипоил-7-ADCA, и рН может быть снижена ному или в любом сочетании. Предпочтительна добавлением в ферментационную среду подходинатриевая соль, хотя подходящими являются дящей кислоты или буферного вещества. также соли калия и смешанные соли натрия. МоОбразование адипоил-7-ADCA может быть отжет быть использован метиловый эфир, но этилослежено хроматографической проверкой образцов вый эфир является водонерастворимым. Соль ферментационной среды. или эфир адипиновой кислоты должны быть такиПри осуществлении глубинной аэробной ферми, чтобы они могли быть ассимилированы и утиментации через культуральную среду пропускает лизованы штаммом Penicillium chrysogenum для получения адипоил-6-АРА. Например, сама адистерильный воздух, чтобы получить более эффекпиновая кислота может быть подходящей, даже тивный рост штамма Penicillium chrysogenum и увеличенное образование адипоил- 7-АDСА. Объхотя она не растворяется в воде, если при подхоем воздуха, пропускаемого через культуральную дящей величине рН образуется способная ассисреду, обычно составляет по крайней мере примилироваться соль. близительно 0,2 объема в минуту на объем кульПодходящие ферменты экспандазы туральной среды. Однако, увеличение скорости Штамм Penicillium chrysogenum, который выпропускания воздуха часто может оказать благоращен и обеспечен адипинатным сырьем, как опиприятное влияние на получение адипоил-7-ADCA. сано выше, так что он продуцирует адипоил-6Штамм Penicillium chrysogenum, как правило, АРА, является также штаммом, который трансформирован ДНК, кодирующей активность ферпомимо адипоил-7-АDСА, будет продуцировать мента экспандазы, после чего, как результат эксмного побочных продуктов и метаболитов. Так как прессии, упомянутая адипоил-6-АРА in situ некоторые из них являются неустойчивыми кислотами, желательно при извлечении адиполи-7расширяет кольцо с образованием адипоил-7ADCA из ферментационной среды обрабатывать АDСА. весь ферментационный бульон до кислой рН на Адипоил-6-АРА продуцируется внутриклеточкороткое время, чтобы разрушить некоторые из но выращенным с адипинатным сырьем Penicillium образовавшихся примесей. Адипоил-7-ADCA chrysogenum. В таком внутриклеточном состоянии, продукт ферментации - извлекают из фильтрот.е., in situ, трансформированный Penicillium chryванного обработанного таким образом ферментаsogenum такжке экспрессирует ДНК, кодирующую ционного бульона, и затем необязательно отдеактивность фермента экспандазы, после чего ляют от других компонентов ферментационной фермент действует на адипоил-6-АРА как субсреды хроматографией на ионообменной смоле, и страт, и расширяет ее кольцо с образованием далее возможна хроматографическая очистка, адипоил-7-ADCA. если необходимо, перед следующей стадией Новый биопроцесс настоящего изобретения ферментного отщепления адипоильной боковой включает в свой объем трансформацию штамма цепи. Также возможно осуществить такое ионноPenicillium chrysogenum описанного выше типа с обменное хроматографическое разделение после любой ДНК, кодирующей активность фермента того, как осуществят отщепление боковой цепи. экспандазы, после чего, как результат экспрессии, Одним из наиболее важных побочных продуктов, адипоил-6-АРА in situ расширяет кольцо с образокоторый создает проблему при разделении, являванием адипоил-7-АDСА. Таким образом, ДНК, с ется адипоил-6-АРА, и чтобы сделать разделение которой трансформируется Penicillium chryболее легким, возможно разрушить этот побочный sogenum должна выражать фермент, обладающий продукт химически или ферментативно. Сначала не только активностью фермента экспандазы, как отфильтрованный ферментационный бульон подэто понимается в технике, т.е., способностью вергают предварительной очистке, которая может расширять кольцо изопенициллина N до DАОС, но включать экстракцию сначала не смешивающимся способностью расширять кольцо адипоил-6-АРА с водой органическим растворителем, таким как ндо адипоил-7-АDСА. Однако, на основании подобутанол или амилацетат, чтобы удалить примеси. бия боковых цепей, ожидается, что любой ферЭкстрагированный бульон затем может быть очимент экспандазы будет способен работать в нощен далее, предварительно, хроматографией над вом биопроцессе настоящего изобретения. В активированным углем. разделе описания прототипов уже отмечалось,. Добавление адипинатного сырья. что фермент экспандазы, происходящий из StrepПредпочтительно во время ферментативного tomyces clavuligerus АТСС 27064, имеет полновыращивания Penicillium chrysogenum, как описано стью известную последовательность, как и карту 7 15 41292 16 эндонуклеазной рестрикции. Однако, как оказалось, тот же фермент, полученный из S. clavuligerus NRRL 3585, как сообщается, имеет другую молекулярную массу, но последовательность не представлена. Эти ферменты экспандазы, уже идентифицированные в технике, являются пригодными для нового биопроцесса настоящего изобретения. Другие, еще не идентифицированные ферменты Грибы экспандазы, происходящие из других штаммов S. clavuligerus, или даже из микроорганизмов других Cephalosporium асrеmоnium родов, такие могут оказаться подходящими для Cephalosporium sp. осуществления нового биопроцесса настоящего Emericellopsis изобретения. Процедуры идентифинации таких Paecilomyces Scopulariopsis новых штаммов и родов пригодных микроорганизDiheterospora мов, как и выделения предполагаемых ферментов экспандазы, и подтверждения, что они являются Spiroidium подходящими для применения в способе настояAnoxiopsis щего изобретения, являются простыми и доступАктиномицеты Streptomyces clavuligerus ными для специалистов. Скрининг бесклеточных S. lipmanii экстрактов кандидатов в новые штаммы и родов S. wadayamensis пригодных микроорганизмов может быть сделан S. todorominensis надежным и воспроизводимым способом путем S. filipinensis cephamycini добавления упомянутых экстрактов к субстрату S. heteromorphus адипоил-6-АРА в присутствии известных кофактоS. panayensis ров DАОСS, которые включают ионы железа S. griseus /Fe2+/, аскорбат, α-кетоглутарат и аденозинтриS. cattleva фосфат /АТФ/. Субстрат адипоил-6-АРА может Nocardia lactamdurans быть получен в достаточных количествах при пиДругие бактерии тании адипинатным сырьем нетрансформированFlavobacterium sр. ного Penicillium chrysogenum по способу, аналоAlcaligenes denitrificans гичному способу, подробно описанному далее. Нужный экспандазный фермент присутствует, Mycoplana bullata если образуется адипоил-7-ADCA, прясутствие Providencia rettgeri которой может быть установлено методом хромаLysobacter lactamgenus тографии. Экспандазы организмов, перечисленных выТакже возможно, используя хорошо известные ше, являются только кандидатами для дальнейприемы рекомбинантной техники, генерировать ших исследований, и может оказаться, что не все пробы ДНК, основанных на последовательности они будут подходящими для нового способа настоящего изобретения. Например, применение экспандазы S. clavuligerus и С. асremonium, например, чтобы выделить ДНК-содержимое предтаких ферментов, которые обладают как активнополагаемых для применения микроорганизмов, стью экспандазы, так и активностью гидроксилазы, подходящих для продуцирования экспандазы, таких как ферменты из C. acremonium, могут в подходящей для использования в способе нарезультате синтеза дать гидроксилированную стоящего изобретения. адипоил-7-АDСА, т.е., DАС с адипоильной бокоПотенциальные источники ферментов экспанвой цепью. дазы Выделение фрагментов ДНК, кодирующих активность экспандазы Ферменты экспандазы, как уже отмечалось, представляют собой ферменты, которые каталиСразу же, как только установлено присутствие зируют расширение ненамного кольца обнаруженнужного фермента экспандазы по способу, опиного в молекулах типа пенициллина до цеф-3-емсанному выше, выясняется, какие методики - проколец /которые обнаружены в цефалоспорияах/. стые и хорошо известные в технике - нужны для Любой организм, продуцирующий метаболиты, выделения ДНК, кодирующей активность ферменкоторые содержат цефемное кольцо, является, та экспандазы. Конструируют пробы ДНК на осноследовательно, потанциальным источником ДНК, ве известных последовательностей и неполных последовательностей генов, кодирующих феркодирующей экспандазу. Примеры таких организменты экспандазы, которые будут гибридизиромов приведены ниже, но этот список представлен только для примера, и не должен рассматриватьваться с низкой кодирующей фермент ДНК, котося как исчерпывающий. рую выделяют. Составление таких проб основано на знании последовательности аминокислот и нуклеотидных оснований, кодирующей фермент экспандазы, так же, как и предпочтительных кодонов конкретного микроорганизма. Подробное описание типичной процедуры такого типа, используемой для геномной ДНК Streptomyces clavuligerus ATCC 27064, представлено далее. 8 17 41292 18 Выделение ДНК, кодирующей активность фермента экспандазы, сопровождается применением методик рестрикции и лигирования, хорошо известных в технологии рекомбинантной ДНК. Необходимо иметь карту эндонуклеазной рестрикции генома микроорганизма, чтобы можно было получить и выделить подходящий рестрикционный фрагмент. Рестрикционные карты для S. clavuligerus и C. acremonium уже доступны, так, в Конструкция Cantwell замещает С на Т, в то первом случае используют рестрикционные фервремя как в конструкции настоящего изобретения менты Ваm НІ и Sal I, и электрофорез обеспечиС сохраняется; таким образом, последовательвает фрагменты нужного размера. - 1,8-2,2 кb. ность промотора IPNS, непосредственно примыТрансформация штамма Penicillium chryкающая к исходному кодону АТG, точно подходит sogenum под пару к той, которая встречается с геном IPNS Как только получены фрагменты ДНК, кодиестественного происхождения. Возможно, что рующие активность экспандазы, они могут быть промотор прототипа, хотя он отличается только вставлены /лигированы/ в плазмиду или в другой одним нуклеотидным основанием, может привести вектор экспрессии, вместе с фрагментами ДНК, к более низкой эффективности трансляции, и, в включающими промоторы, трансляционные актирезультате, к более низкому уровни экспрессии вирующие последовательности, маркеры устойчигена экспандазы. вости, регуляторные последовательности, элеДругие отличия заключаются в участках променты космид, и любые другие мотора или гена, включенных в конструкции. Конпоследовательности ДНК, которые делают возструкция Cantwell содержит участок промотора можной или способствуют трансформации, стимуIPNS 5' BamHI-Xbal 3', в то время как вектор налируют экспрессию генного продукта, и облегчают стоящего изобретения содержит участок промотовыделение трансформантов. Вектор экспрессии, ра 5' Ncol - Ncol 3' (Dies, et al., /1990/, J. Biol. Chem. который составлен таким образом, затем исполь265, 16358-16365). Это дает в результате доползуют для достижения трансформации штамма нительные 250 bрs на окончании 5' промотора Penicillium chrysogenum и внутримолекулярной IPNS в конструкции Cantwell. Однако, этот участок экспрессии активности фермента экспандазы. находится в открытом считываемом остове гена Технические приемы для достижения трансфорсинтетазы АСV (в направлении 3'-5') выше гена мации и экспрессии хорошо известны в технике, и IPNS. подробное описание таких типичных процедур Конструкция Cantwell также содержит ген приводится далее. Streptomyces от ATG до сайта 3' BamHI гена, в то Как уже подробно отмечалось выше, штамм время как вектор настоящего изобретения содертрансформированного Penicillium chrysogenum жит АТG до сайта Sall 3' гена (Kovacevic et al. экспрессирует фермент экспандазу внутриклеточ/1989/, - J.Васtеriol., 171, 754-760). Это дает в рено, который затем действует in situ на адипоил-6зультате приблизительно 1000 bps, дополняющих АРА-субстрат и расширяет ее кольцо до адипоилокончание 3' в конструкции Cantwell. Конструкция 7-АDСА. настоящего изобретения содержит еще участок Новый трансформант гена экспандазы, расположенный выше, до сайта Специфический трансформант Penicillium BamHI 5' АТG; однако, он отделяется от считыchrysogenum, экспрессирующий ген экспандазы, ваемого остова гена экспандазы промотором который; представляет собой предпочтительный ІРNS. вариант осуществления настоящего изобретения, Еще одно отличие построения настоящего является новым относительно таких конструкций, изобретения от описанного в прототипе относится существующих в технике, как конструкция, опик избирательной способности маркера, который санная в Cantwell et al. /1990/ Current Genetic, 17, используется. Применение слияния промотора 213-221. В обеих конструкциях для связывания Penicillium IPNS с флеомицином в конструкции промотора с геном экспандазы используют мутанастоящего изобретения ведет к выбору в пользу генез in Vitro. В конструкции Cantwell манипуляция интеграции размножающихся копий или в пользу вводит сайт Ndel в АТG гена экспандазы, который интеграции в локусах, что обеспечивает высокий лигируют в сайт Xbal в окончании 3' промотора уровень экспрессии, и таким образом, потенциIPNS линкером Xbal/Ndel. В конструкции настояально может дать более высокий процент трансщего изобретения сайт Ncol создается в АТG-гена формантов, которые экспрессируют ген экспандаэкспандазы, и лигируется в сайт Ncol в окончании зы на высоком уровне. 3' линкера IPNS. Это создает в таких конструкциях Новый трансформант описанного выше типа в местах соединения промотора и генаприведенпредставляет собой Penicillium chrysogenum, ные далее последовательности. идентифицированный как РС100. Его таксономические характеристики обычно включают продуцирование широко разрастающихся колонии, от сине-зеленого до зеленого цвета, однородной бархатистости с желтыми вкраплениями; обратную диффузию желтого в агар; конидиальные головки, ветвящиеся по всем частям гладкой поверхности; эллиптические конидии длиной 3-4 мм. 9 19 41292 20 Приемлемые условия выращивания для P. chryкие неподвижные ферментные системы дают преимущества, заключающиеся в легкости удаления sogenum предполагают использование твердой фермента и многократном использовании. Другим среды, содержащей моногидрат лактозы - 1,5% примером такого технологического процесса яв(вес/объем); экстракт замоченной кукурузы - и,5% ляется процесс, имеющий отношение к мембран(о/о); пептон - 0,5% (вес/объем); NaCl - 0,4% ным реакторам. Предпочтительным способом (вес/объем); MgSO4·7Н2О - 0,55% (вес/объем); приведения реагентов в контакт является способ с КН2РО4 - 0,06% (вес/объем); FeCl3·6Н2О - 0,0005% применением колонок с ферментом. (вес/объем); CuSO4·5H2O - 0,0002% (вес/объем); Ферменты адипоилацилазы, пригодные для агар - 0,3% (вес/объем), в одном литре дистилистадий отщепления рованной воды, рН 4,8. P. chrysogenum, только что описанный и обозначенный PC100, депонирован Существует ряд ферментов с известной спеАmerican Type Culture Collection /ATCC/, 12301 цифичностью к адипоильным боковым цепям. РеРаrкlawn Drive, Rосkville, Maryland 20852, под результаты, полученные с адипоилацилазой, досгистрационным номером ATCC 74182 /дата депотупной коммерчески от RAЕV Corp., подробно зита: получен 21 августа 1992, и жизнеспособописаны далее в рабочих примерах. В литературе ность проверена 27 августа 1992/. сообщается о семи других ферментах, которые Отщепление адипоильной боковой цепи удаляют адипоильные боковые цепи из молекул Следующая стадия нового биопроцесса натипа цефалоспорина. Шесть из этих семи ферстоящего изобретения заключается в отщеплении ментов представляет собой вид Pseudomonas, и седьмой является видом Bacillus. Между опредеадипоильной боковой цепи адипоил-7-АDСА, что ленными ферментами Pseudomonad существует требует обработки продукта предшествующей некоторoе подобие, но все семь различаются до стадии системой с ферментом адипоилацилазой. некоторой степени по своим физикоКак уже отмечалось выше, одним из существенбиологическим свойствам. Некоторые характериных преимуществ настоящего изобретения являстики этих ферментов приведены ниже. ется способность выполнять все стадии, ведущие к образованию адипоил-7-АDСА, в одном процессе ферментации. Это достижение дает исключительно возросшую эффективность ввиду отсутствия выделения и частичной очистки промежуточных продуктов при переходе от одной к другой стадии процесса. Однако, на этой последней стадии не присутствует фермент адипоилацелазы, т.е., не генерируется in situ в первоначальной фрментативной культуре. Если новый биопроцесс настоящего изобретения выполняют по периодической схеме, тогда будет необходимо выделять и частично очищать продукт первой стадии, и предварительные процедуры для этого уже описаны выше. Тем не менее, способ настоящего изобретения может быть осуществлен любым путем, который эффективно дает контакт адипоилацилазы и Все вышеупомянутые ферменты адипоилациадипоил-7-АDСА таким образом, чтобы могла лазы являются применимыми в новом биологичепроизойти ферментативная конверсия этого соском процессе настоящего изобретения. Другие единения до 7-АDСА. Таково определение термиадипоилацилазы, пригодные для способа настояна "контакт" в его широком смысле. Возможно исщего изобретения, могут быть легко обнаружены пользовать бесклеточный бульон сырой адипоилпри испытании предполагаемых подходящих 7-АDСА в качестве загрузки, и обрабатывать его ферментов против адипоил-7-ADCA, фактического по периодическому способу бульоном сырой адисубстрата, на котором они должны работать. Попоилацилазы. Такое приближение обеспечивает ложительный результат является надежным и некоторую эффективность, поскольку не требует воспроизводимым способом определения того, какой-либо существенной первоначальной очистки что фермент-кандидат пригоден для способа нареагентов. Конечно, возможны модификации. Настоящего изобретения. Субстрат может быть попример, реагенты могут быть очищены до любой лучен простым способом при реакции ангидрида желательной степени, прежде, чем будут привеадипиновой кислоты с 7-ADCA, для чего испольдены в контакт друг с другом. Также, лучше было зуется модификация методики, изложенной в бы осуществлять процесс непрерывным спосоSzewczuk and Wellman-Bednawska, Сlin. Chim. Acta бом, а не периодическим. Контактирование самих /1978/ 84. 19-26. Ангидрид адипиновой кислоты реагентов может быть модифицировано различможет быть получен в СООТВЕТСТВИИ со спосоными путями при сохранении улучшений в технобом Albertson and Lundmark, описанным в J. логическом процессе. Так, может быть использоМасrомоl. Sci. Chem. /1990/ А27, 397-412. 7-ADCA ван неподвижный фермент, например, в виде доступна из некоторых коммерческих источников, колонки, содержащей адипоилацилазу, причем включая E.R. Squibb & Sоns, Ltd., NJ и Interchem адипоил-7-АDСА пропускают через колонку. НеCorp., NJ. подвижный фермент также может быть добавлен к раствору адипоил-7-ADCA в виде суспензии. Та 10 21 41292 22 Если желательно выполнить грубый скрининг либо путей /ни химических, ни биопроцесса, в чемферментов-кандидатов с использованием экслибо аналогичного настоящему описанию/, котопресс-колориметрии, субстрат адипоил-7-ADCA рыми можно, в первую очередь, генерировать можно заменить колориметрическим субстратом, адипоилцефалоспорин. таким как адипоил-РАВА /п-аминобензойная киОписание предпочтительных вариантов изобретения слота/ или ади-поил-РNА /п-нитроанилин/. ОтщепДалее приводится подробное описание неколение боковой цепи дает вид, генерирущий ократорых предпочтительных вариантов осуществлеску, и присутствие такого вида и концентрация ния настоящего изобретения, но эти варианты легко определяются колориметром. Более подпредставляют только иллюстрации, и никоим обробная информация об этих и других подходящих разом не является ограничениями настоящего колориметрических способах дается в Marellі, L.P. изобретения. /1968/ J.Pharm. Sci. 57:2172-2173; Szasz, G /1969/ Пример 1 Clin. Chem. 15:124-136; Szewchuk, A., et al. /1980/ Условия выращивания Penicillium chrysogenum Anal. Biochem. 103:166-169; и в Reyes, F., et al. /1989/ J. Рharmа. Pharmacol. 41:136-137. Штамм Penicillium chrysogenum, применяемый Сравнивают N-концевые аминокислотные пов этих методиках, хранят на пластинах, содержаследовательности фермента RAEV с большими щих среду LCSB, составленную из моногидрата субединицами acyll и GK16 ферментов, приведенлактозы - 1,5% (вес/объем); экстракта вымоченной ных выше в таблице. Результаты сравнения дакукурузы - 0,5% (объемн.); пептона - 0,5% ются ниже /где круглые скобки указывают мень(вес/объем); NaCl - 0,4% (вес/объем); MgSO4·7Н2О шую, чем окончательная, принадлежность/. - 0,05% (вес/объем); КН2РО4 - 0,06% (вес/объем); FeCl3·6Н2О - 0,0005% (вес/объем); CuSO4·5H2O 0,0002% (вес/объем); агара - 3,0% (вес/объем); в одном литре дистилированной воды, рН 4,8. После выдержки в течение 12 суток при 25°С и относительной влажности 65% единичные колонии удаляют и помещают в 2 мл стерилизованной воИз представленных последовательностей ды в пробирки с винтовой верхней частью, содерочевидно, что все три пептида являются родстжащие стеклянные шарики. После мацерации повенными. Однако, белок, имеющий N-концевую росли культуры путем вращательных движений последовательность, подобную показанным выше, суспензию используют для инокуляции в склянки с не обязательно обладает адипоилацилазной акрисом. Склянки с рисом содержат в 250 мл своего тивностью, как в случае ацилазы пенициллина G, объема 25 г конвертированного риса Uncle Ben's, продуцированной штаммом Arthrobасtеr. С другой натуральное длинное зерно которого промыто стороны, существуют адипоилацилазы, пригодные тремя-четырьмя объемами дистиллированной для способа настоящего изобретения, которые не воды в течение семи минут, при перемешивании показывает достаточной гомологии к вышеупомякаждые 30 секунд, и затем высушено до содержанутой N-концевой последовательности. Например, ния воды в рисе приблизительно 25%. После 12показано, что фермент Asahiacyl и ацилаза Fujiдневной выдержки при 25°С и относительной sawa B.laterosporus JI, упомянутые в приведенной влажности 65% споры вымывают из риса 50 мл выше таблице, которые обладают некоторой акстерильной воды. Суспензий спор используют для тивностью адипоил-7-АDСА-ацилазы, не являются инокуляции культуры в жидкую среду, и также для частью гомологии последовательностей других заготовки лиофилов культуры, хранящихся при ферментов, упомянутых выше. Поэтому объем 4°С. Споры добавляет в равный объем 5% сливок настоящего изобретения в отношении адипоилаи лиофилизют в стерильных ампулах. цилаз, пригодных для второй стадии нового биоИспользуют двухстадийную ферментации во процесса, определяется тем, способен или нет встряхиваемых колбах для получения пеницилликандидат-фермент отщеплять боковую адипоильнов или для продуцирования мицелия, как источную цепь от адипоил-7-АDСА, свойсвтво, которое ников РНК или ДНК. Стадию посева начинают доможет быть легко и надежно определено, как подбавлением 1 х 108 спор в 500 мл колбу с 50 мл робно описано выше. среды, составленной из глюкозы - 3,0% Возможны другие подходы к поиску подходя(вес/объем); pharmamedia -1,0% (вес/объем); эксщих адипоилацилаз. Например, заявка на Евротракта замоченной кукурузы - 3,0% (объемн.); пейский патент ЕРА-А-О 453048 описывает спососульфата аммония - 0,2% (вес/объем); СаСО3 бы улучшения активности отщепления адипоила 0,5% (вес/объем); безводного монокалийфосфата глутарилацилазы, продуцированной Pseudomonas - 0,05% (вес/объем); лактозы - 1% (вес/объем); SY-77-І. При замещении различных аминокислот в первичных сухих дробей - 1,0% (вес/объем); в однекоторых местах в пределах альфаном литре дистиллированной воды. Инкубацию субъединицы, наблюдают увеличение скорости осуществляют при 25°С и относительной влажноотщепления адипоила /от адипоилсерина/ в тристи 65% на круговой качалке с диаметром размаха пять раз. Такие улучшенные ферменты также бы70 мм при 220 об/мин. После 48-часовой инкубали бы подходящими для применения в настоящем ции начинают стадию продуцированяя путем пеизобретении. Следует отметить, что хотя заявка реноса 2 мл вегетационного посевного материала ЕР-А-0453048 очевидно демонстрирует ацилазу с в 500 мл колбу с 35 мл среды следующего состаулучшенной активностью по отношению к адипова: КН2РО4 - 0,05% (вес/ объем), К2SО4 - 0,5% ильным боковым цепям, в ней не описано каких(вес/объем); (NH4)2SO4 - 1,0% (вес/объем); лактоза 11 23 41292 24 растворяют в 0,3 мл ТЕ буфера с 0,03 мл 3М аце- 12,0% (вес/объем); pharmamedia - 2,75% тата натрия, и добавляют 2,5 объема этанола, (вес/объем); СаСО3 /осажденный/ - 1,0% чтобы снова осадить РНК. Конечный осадок рас(вес/обьем); свинное сало - 1,% (объемн.), содертворяют в 0,1 мл буфера ТЕ, и концентрацию РНК жатся в одном литре дистиллированной воды, рН определяют спэктрофотометрически, используя 6,6. После обработки в автоклаве, но до инокуляпоглощение при 260 нм. ции, добавляет стерильный 25% адипинат натрня Пример 3 /рН 6.6/, и получают окончательную концентрацию Условия выращивания Streptomyces clavuадипината натрия 2,5%. Инкубацию, а затем инокуляция, проводят в тех же условиях, что и на ligerus Здесь используют штамм Streptomyces стадии посева, в течение 5-7 дней. Пример 2 clavuligerus ATCC 27064. Штамм хранят на плаВыделение геномной ДНК Penicillium и общей стинах, состоящих из дрожжевого экстракта - 4 г; ДНК солодового экстракта - 10 г; глюкозы - 4 г; агара Вегетационную мицелиальную поросль из 4820 г; в одном литре дистиллированной воды, рН часовой культуры, полученной как описано выше, 7,2. После 5-тиднавного выращивания при 30°С собирают фильтрацией через марлю, заморажидобавляют в чашки 2 мл стерильной воды, и вывают в жидком азоте и лиофилизуат в течение ращенную культуру соскабливает с поверхности ночи. Высушенный мицелий измельчают с песком агара. Полученную в результате суспензию перепестиком в ступке, и снова суспендируют в 25 мл носят в стерильную про бирку с завинчивающейся 100 мМ LiCI, 50 мМ ЭДТА, 10 мМ Триc - рН 8,0, 4% пробкой /screw-tор/, содержащую стеклянные шаSDS. После нагревания суспензии до 50-55°С на рики. После мацерации поросли культуры круговодяной бане /60°С/ смесь экстрагируют сначала выми движениями суспензию используют для иноIM Трис /рН 8/, насыщенным фенолом, затем смекуляции культуры в жидкую среду. Суспензию сью фенола с хлороформом /1:1 по объему/ натакже используют для длительного хранения сыщенной трис, и затем хлороформом. РНК осажкультуры при -70°С после добавления глицерина дают из водной фазы добавлением равного до 15% конечного объема. объема холодного 6М LiCI, и затем оставляют Когда мицелий требуется для генерации просмесь на два-три часа при -20°С. После центрифутопласта для трансформации или для источника гирования при 12000 х g в течение 20 минут при ДНК, штаммы выращивают в 1 л колбе с 200 мл 4ºC супернатант делают 66% (объемн.) этанолом УЕМЕ среды, составленной из дрожжевого экси охлаждают до -20°С в течение 15 минут, чтобы тракта - 3 г; пептона - 5 г; солодового экстракта -3 осадить ДНК. После центрифугирования, описанг; глюкозы - 10 г; сахарозы - 340 г; MgCl2 · 6HgO ного выше, осадок ДНК промывают 70% этанолом, 1,02 г; глицина - 5 г; агара - 18 г; в одном литре сушат и снова суспендируют в буфере ТЕ /10 мМ дистиллированной воды. Инкубацию осуществляТрис-НСІ, рН 7,5, 1 мМ ЭДТА/. Концентрацию ДНК ют на круговой качалке при 220 об/мин при 28°С. оценивают путем сравнения с изестными ДНКПример 4 Выделение геномной ДНК Streptomyces стандартами при окрашивании брометидом при Вегетационную поросль 48-часовой культуры, электрофорезе в агарозном студне. полученную так, как описано выше, собирают ценКультуры Penicillium chrysogenum, описанные выше в примере 1, выращивают в течение 96 чатрифугированием при 22100 х g в течение 10 мисов в 35 мл ферментативной среды /условия нут. Клетки снова суспендируют в 10 мл буфера ферментации описаны ранее/, при 25°С на кругоТЕ, добавляют 10 мг лизоцима, и смесь инкубирувой качалке при 220 об/мин. Мицелий собирают ют при 30°С в течение 15 минут. Затем добавляют фильтрацией через фильтр Whatfman #I при поодин мл ТВ /рН 8/, насыщенного фенолом, и 1,5 ниженном давлении и промывают приблизительно мл 5М NaCl, и смесь осторожно инвертируют в 50 мл воды. Мицелий сразу же соскабливают с течение 20 минут. Фазы разделяют при 12000 х g фильтра, снова суспендируют в 5 мл "расслаив течение 10 минут, после чего водный слой удавающего буфера" /"breaking buffer"/ /50 мМ Трисляют и переносят в свежую пробирку. Добавляют НСl pH 7,4,150 мМ NаСІ, 5 мМ ЭДТА рН 8,0, 5% равный объем хлороформа, и смесь осторожно SDS/, замораживают в жидком азоте и лиофилиинвертируют в течение 10 минут. Фазы снова раззуют. После лиофилизации в течение ночи добавделяют центрифугированием при 12000 х g в теляют 5 мл воды, содержащей 0,1% DEPC, и 5 мл чение 10 минут, водный слой удаляют и снова IМ Трис /рН 8/ насыщенного смесью фепереносят в свежую пробирку. Осторожно добавнол:хлороформ:(изоамиловый спирт) /50:50:1/, и ляют два объема изопропанола, выпавшую ДНК смесь оставляют таять при 37°С в течение 20 миизвлекают и снова растворяют в минимальном нут при встряхивании. Смесь центрифугируют при объеме буфера ТЕ. Добавляют РНК А /RNASE A/ 12000 х g в течение десяти минут при 4°С, водный до конечной концентрации 20 мг/мл, и раствор слой удаляют, и вновь экстрагируют сначала 1М инкубируют при 50°С в течение одного часа. ЗаТрис /рН 8/, насыщенным смесью фетем добавляют протеазу К до конечной конценнол:хлороформ:(изоамиловый спирт) /50:50:1/, и трации 100 мг/мл, вместе со 100 мМ NaCI и 0,4% затем ІМ Трис /рН 8/, насыщенным фенолом, и в SDS, - и смесь инкубируют при 37°С в течение третью очередь - хлороформом. С конечным вододного часа. Раствор снова экстрагируют равным ным слоем соединяют равный объем 6М LiCI, и объемом ТЕ /рН 8/, насыщенным фенолом, и зараствор оставляют при -20°С минимум на четыре тем еще один раз хлороформом. ДНК после кочаса. Общую РНK осаждают центрифугированием нечной экстракции извлекают после добавления при 12000 х g в течение 20 минут при 4°С, осадок двух объемов изопропанола, и концентрацию оп 12 25 41292 26 ределяют спектрофотометрически, используя посмесь осторожно вращают и помещают на лед на глощение при 260 нм. десять минут. Затем добавляет 30 мл 5М ацетата Пример 5 калия, рН 4,8, хорошо перемешивают, и образовавшуюся смесь помещают на лед еде на десять Создание генной библиотеки, и выделение фрагмента ДНК, содержащего ген экспандазы минут. Клеточные осколки осаждают центрифугированием при 4000 х g в течение десяти минут при Streptomyces clavuligerus Геномная ДНК Streptomyces clavuligerus, полу4°С, и полученный в результате супернатант ченная по ранее описанной методике, переварифильтруют через фильтр из марли. К осветленновается с ферментами рестрикции BАm НI и Sаl I. му супернатанту добавляет изопропанол /0,6 объПереваренную ДНК подвергают электрофорезу на емов/ чтобы осадить плазмидную ДНК, и осадок 0,8% геле агарозы, и фрагменты 1,8-2,2 Kb элюиформирует в процессе инкубации при комнатной руют и лигируют в ДНК рUС18, которая предваритемпературе в течение 20 минут. Плазмидную тельно переварена с Вam HI Sal І. Используют ДНК осаждают при 4000 х g в течение 20 минут разбавление лигирующей смеси, чтобы транспри 4°С, и затем промывают 70% этанолом и суформировать компетентные клетки 1M109, исшат короткое время. Осадок снова суспендируют пользуя электропорацию /Gene Pulser, Віо-Rad, в 9 мл буфера TЕ, затем добавляют 10 г CsCl и Rtchmond, СА/. Получение компетентных клеток и 0,387 мл раствора бромэтида - 10 мг/мл. Этот расусловия электропорации выдерживают в соответтвор центрифугируют при 313100 х g в течение 24 ствии с рекомендациями изготовителей. Преобрачасов. Полученную в результате плазмидную позующую смесь высевают на пластины LB, содерлосу в хлористом цезии визуализуют ультрафиожащие 100 мг/мл ампициллина и 75 мл 2% X-Gal. летовым светом, выделяют, и затем удаляют После инкубации в течение ночи при 37°С рекомбромэтид, используя для экстракции воду, насыбинантные колонии идентифицируют по их обесщенную бутанолом. СеСІ затем удаляют из прецвечиванию вследствие инактивации плазмидного парата плазмиды путем диализа против ТЕ вектора активности гена бета-галактозидазы. Бесбуфеpa, и наконец, концентрирует ДНК. используя цветные колонии пикируют в свежие пластины LВ, ПЭГ /МW 8000/. Концентрацию ДНК определяют содержащие 100 мг/мл ампициллина. После выспектрофотометрически, используя поглощение ращивания в течение ночи при 37°С колонии пепри 260 нм. реносят на нитроцеллюлозу и гибридизируют с Пример 7 Построение вектора трансформации Penicilпробой, продуцированной полимеразной ценной lium pPenFTSO. реакцией, которая соответствует опубликованной Вектор трансформации Penicillium конструипоследовательности гена экспандазы рует с резистантным геном флеомицина в качестStreptomyces clavuligerus из оснований 52-918 ве доминантного избирательного маркера. Это (Kovaceic et al. /1989/ J. Bacteriol. 171: 754-760; и осуществляют, выделяя сначала фрагмент 660 bp, патент США 5070020). Мочение продукта цепной содержащий резистантный ген флеомицина реакции полимеразы выполняет в ходе реакции /причем флеомицин связывает ген протеина Strepслучайно выбранным драйвером с (32р) dСТР_и toalloteichus hindustanus/, и к тому же, присоедиOligolabelling Kit, по рекомендации изготовителей ненный к терминатору СI цитохрома дрожжей, из /Fharmacia, Piscataway, New Jersey/. Реакцию гибBam HI/Bgl II провара плазмиды рUT713/CAYL ридизации выполняют в присутствии 106 СРМ раToulouse Cedex, Франция/ путем электрофореза и диоактивно помеченной пробы, 30% формамида, элюирования из агарозных студней. Выделенный 5Х SSC /0,15 М NaCI, 0,015 М цитрата натрия рН фрагмент лигируют в сайт Bam HI вектора 7/, 0,1% SDS 5Х Denhardt's /5 г фиколла, 5 г полирSELECT*I /Promega Corporation/, и ориентацию винилпирролидона и 5 г BSA на 500 мл штамма гена определяют анализом фермента рестрикции. 50Х/ и 100 мг/мл ДНК тимуса теленка, в течение Далее, вставляют фрагмент 550 bр Pst I, содерночи при 37°С. Некоторые трансформанты сильно жащий сайт лямбда cos, который дает возможгибридизуют к пробе. В одной колонии подтверность пспользовать вектор для образования косждают содержание вектора, несущего ген экспанмиды, когда включаются вставки дазы, путем анализа рестрикции фермента, и эта соответствующего размера. Затем из провара Nco плазмида обозначается pFTSO-1. I/Bam HI геномного клона, содержащего ген IPNS, Пример 6 выделяют фрагмент 1,5 kb Nco I/Bam HI, содерВыделение плазмидной ДНК жащий участок промотора гена синтетазы PenicilКультуры Е соli, содержащие плазмиду, выращивают в 500 мл бульона LВ [20 г/л основы lium chrysogenum изопенициллина N /ІРNS/ бульона LВ (Gibco, Раis-Ley, Шотландия )], с 15 /методом электрофореза и элюирования из агамг/мл тетрациклина в течение 12-16 часов при розных студней/. Выделенный фрагмент промото37°С на круговой качалка при 220 об/мин. Клетки ра ІРNS лигируют в переваренный вектор Bam HI осаждает центрифугированием при 4000 х g в теNco I находится в исходном кодоне ATG гена речение десяти минут при 4°С. Клеточный осадок зистантного флеомицина. Этот вектор обозначаснова суспендируют в 18 мл глюкозного буфера ется pUTZ-2. /50 мМ глюкозы, 25 мМ Трис рН 8,0, 10 мМ ЭДТА/, Фрагмент 1,645 kb, содержащий, ген экспани добавляют 2 мл 40 мг/мл лизоцима /Sigma, St. дазы Streptomyces clavuligerus, очищают от проваLouis МО/ в глюкозном буфере, перемешивают, и ра Bam HI и pFTSO-I /вектор, описанный ранее/ смесь инкубируют при комнатной температуре в посредством электрофореза и элюирования из течение 15 минут. Добавляют 40 мл свежеприго0,8% геля агарозы. Выделенный фрагмент лигитовленного раствора 0,2 N NaOH, 1% SDS, и руют в вектор pSELECT /Promega Corporation/, 13 27 41292 28 также проваренный с Bam HI и Sal I. Этот вектор фосфорамидитирования - /Pharmacia Gene переваривается рFTSO-8. Новый сайт Nсо І созAssembler аппаратура/, и олигопоследовательдается в начальном кодоне АТG гена экспандазы ность имеет следующий вид: путем сайт-направленного мутагенеза рFTSO-8 Посл. ID № 9 при использовании in vitro мутагенезной системы, 5' АTCTCTTTTCTAATACCTTCACCATGGGTGAGATTGTACGTGATCCC 3'. меняющей сайты /АІtеrеd Sites*/ /Promega CorporaМутагенез подтверждается анализом ферменtion/. Мутагенез выполняет по инструкции произта рестрикции. Далее, фрагмент 1,4 kb Bam HI водителя. Строят олигонуклеотид для комплемен /Nco I, содержащий промотор b -тубулина Penicillium, лигируют выстроенный сайт Nco I в ATG гена экспандазы в Bam HI /Nco I переваренного вектора pFTSO-8 /вектор описан ранее в примере 7/. Этот вектор обозначают btFTSO-8. Фрагмент 1,4 kb та кодирующей последовательности участка ДНК в исходном кодоне АТG из опубликованной последовательности гена экспандазы /Kovacevic et al., /1990/ Journal of Bacteriology, 171, p. 39523958/. Олигонуклеотид синтезируют приемами химии цианоэтилфосфорамидитирования /Pharmacia Gene Assembler приборы/, и олигопоследовательность выглядит следующим образом: последов. ID № 8 3' СGАGАСGАТСАGТGАGАGТССАТGGАСАСGАСGG 5'. Мутагенез подтверждается анализом фермента рестрикции. Далее, фрагмент 1,2 кb Nco I, содержащий участок промотора гена синтетазы изопенициллина N Penicillium chrysogenum, выделяют /электрофорезом и элюированием из гелей агарозы/ из провара Nco I геномного клона, содержащего ген ІРNS. Участок промотора ІРNS лигируют в вектор pFТSO-8 в новый сайт Nco I, созданный мутагенезом в начальном кодоне ATG гена экспандазы. Ориентации промотора относительно гена экспандазы устанавливают анализом фермента рестрикции. Это сочетание /cassette/ - промотор ІРNS: ген экспандазы - затем перемещают в виде фрагмента Bam HI /Sal I в разрезанный Bam HI / Sal I вектор трансформации pUTZ-2 Penicillium, описанный выше. Конечная конструкция обозначается pPenFTSO. Пример 8 Клонирование промотора lium. Ген b b Bam HI /Nco I, содержащий промотор b тубулина, также лигируют в Bam HI /Nco I переваренного вектора pUTZ-2 /вектор описан ранее в примере 7/. Такое лигирование располагает про мотор b -тубулина прямо перед резистантным геном флеомицина. Этот вектор обозначает рСІ-6. Далее, фрагмент 2,4 kb Bam HI /Hind III из вектора bbtFTSO-8, который содержит кассету тубулинового промотора гена экспандазы, лигируют в Bam HI / Hind III переваренного вектора рСI-6, чтобы получить конечный вектор трансформации Penicillium, в котором ген экспандазы Streptomyces и резистантного маркера флеомици на экспрессируот из промотора b -тубулина. Этот вектор обозначазт pTS-2. Пример 9 Клонирование промотора Penicillium. /GАР/ Ген глицеральдегид-3-фосфатдегидрогеназы GАР Penicillium клонируют из лямбда-геномной библиотеки, используя ген GАР из Aspergillus niger в качестве пробы гибридизации. Четыре потенциальных позитива исследуют далее с PCR продуктом, генерированным из праймеров для участка 5' гена GАР Cephalosporium /Kimura, Н., et al., /1991/, J. Ferm. and Bioeng., 71, 145-150/. Олигонуклеотиды для праймеров цепной реакции полимеразы /PCR/ синтезируют приемами химии цианоэтилфосфорамидитирования /Pharmacia Gene Assembler приборы/, и олигопоследовательности являются следующими: послед. ID № 10 -тубулина Penicil -тубулина Penicillium клонируют из ге номной библиотеки Penicillium, исплоьзуя ген b тубулина Aspergillus niger в качестве пробы гибри дизации. Последовательность гена b -тубулина Aspergillus niger идентифицирует участок с 91% гомологии, начиная с начального кодона ATG. Последовательнсти, содержащие функциональный промотор, выделяют между начальным кодоном и сайтом Bam HI на 1,4 kb. Построение вектора трансформации, несуще 5' CGCGGATCCCGGCATCAACGGCTTCGGTCGTAT 3', послед. ID № 11 5' CGCGGATCCGGGCACGCGCATGGACATGCCAGTG 3'. Один из четырех предполагаемых позитивов кросс-гибридизируют в продукт PCR. Фрагмент 4 kb Bam HI из этого геномного клона лигируют в Bam HI расщепленного вектора pSELECT /Promega Corporation/ для секвенирования. Этот вектор обозначают pTS-O. Секвенирование этого фрагмента идентифицирует кодон инициатора ATG путем сравнения с известной последовательностью гена GАР цефалоспорина. Построение вектора трансформации, несущего промотор GАР Penicillium Для построения промотора GАР Penicillium с геном экспандазы Penicillium создают новый сайт Nco I в АТG гена GAP Penicillium путем сайтнаправленного мутагенеза in vitro, используя вектор рТS-O. Мутагенез осуществляет по инструкции изготовителя. Конструируют олигонуклеотид, ко го промотор b -тубулина Penicillium. Фрагмент 2,0 kb Xba I/Hind III, содержащий промотор b -тубулина Penicillium., лигируют в вектор pSelect /Promega Corporation/, также переваренный с XbaI/Hind III. Новый сайт Nco I создают в начальном кодоне АТG сайт-направленным мутагенезом, используя in vitro мутагенезную систему, меняющую сайты /Promega Corporation/. Мутагенез выполняют по инструкции изготовителя. Конструируют олигонуклеотид, комплементарно к сайтовому участку исходного ATG, но который содержит некоторые изменения для создания сайта Nco I, и используют для мутагенеза. Синтезирует олигонуклеотид приемами химии цианоэтил 14 29 41292 30 торый комплемeнтарeн кодирующей последоваИспользуют высокоэффективную жидкостную тельности участка ДНК в начальном кодоне АТG хроматографию /ВЭЖХ/, чтобы проконтролирогена GАР, но сочетая с изменением оснований, вать образование адипоил-6-АРА в не трансфорчтобы создать сайт Nco I. Олигонуклеотид синтемированном штамме Р.chrysogenum, который зирует приемами химии цианоэтилфосфорамидииспользуют, и образование адипоил-7-АDСА в тирования /оборудование Pharmacia Gene Assemштамме трансформированного Р. chrysogenum bler/, и олигопоследовательность имеет который используют. Анализ проводят на системе следующий вид: Waters с 625 системой подачи растворителя, депослед. ID № 12 тектор 490Е с переменной длиной волны, уста5' САGТАААСGСААССАТGGТТGTССАG 3'. новленный на 220 нм и 254 нм, с системой данных Мутагенез подтверждается анализом фермен825 Maxima, и колонкой Novo-C18 в качестве нета рестрикции. Далее, фрагмент 1,9 kb NcoI/Bam подвижной фазы. Подвижная фаза /при скорости HI из рТS-O, который содержит промотор GAP, потока 1 мл/мин/ состоит из 2% метанола и 98% лигируют в Nco I / Bam HI переваренного вектора 0,010 М KH2PO4, изократно рН 7,0 - 5 минут, и меpFTSO-8 /вектор описан ранее в примере 7/ для танола в 0,010 М КН2РО4 с линейным градиентом позиционирования промотора GAP с геном экс2-40% - 15 минут. Количество адипоил-6-АРА оппандазы Streptomyces. Этот вектор обозначают ределяют, используя стандартную кривую поглоpTS-O-I. Далее, фрагмент 3,0 kb Bam HI / Hind III щения стандарта пенициллина N при 220 нм, и из вектора pTS-O-I, который содержит кассету количество адипоил-7-АDСА определяют, исполь(промотор GАР) : (экспандаза), лигируют в Bam HI зуя / Hind III переваренного вектора pCІ-6 /вектор опистандартную кривую стандарта дезацетоксисан ранее в примере 8/, и получают конечные векцефалоспорина С при 254 нм. тор трансформации Penicillium pSD-І, в котором Анализ чувствительности адипоил-6-АРА и ген экспандазы Streptomyces экспрессирован из адипоил-7-ADCA к обработке пенициллиназой промотора GАР. осуществляет, добавляя к фильтратам I единицу Пример 10 пенициллиназы I или пенициллиназы III на мл, и Трансформация Penicillium chrysogenum инкубируя при комнатной температуре в течение Протопласты из описанного выше штамма 10-30 минут. Эти образцы пропускают при идентиPenicillium chrysogenum генерируют путем инокучных условиях ВЭЖХ, описанных выше. ляции 50 мл бульона CM I X 107 спорами в течеАнализ УФ-спектров продуктов адипоил-6-АРА ние 67 часов при 25°С на круговой качалке при и адипоил-7-АDСА осуществляют, используя сис220 об/мин. Мицелии собирают фильтрацией на тему Waters с системой 510 подачи растворителя, марлевых фильтрах, переносят в 500 мл колбы и фотодиодным детектором, с системой данных 990 снова суспендируют в 25 мл КМР /0,7М КСІ, 0,8 М и колонкой Novo-C18 в качестве неподвижной фаманнита, 0,02 М КН2РО4, рН 6,3/, содержащей 100 зы. Используют подвижную фазу, идентичную мг новоцима 234 /Novo Biolabs, Ваgsvaerd, Дания/ описанной выше. и ставят для инкубации при 30°С и 100 об/мин. Выделение большого количества продукта Сферопласты отделяют фильтрацией через марадипоил-7-ADCA из цельного ферментационного левые фильтры и фильтры из стекловолокна и бульона делают, используя систему Waters с 510 осаждают центрифугированием при 350 х g в тесистемой подачи растворителя, фотодиодным чение 10 минут. Сферопласты затем промывают детектором 990, системой данных 990 и препаратри раза 10 мл буфера КМР, и затем снова сустивной колонкой mBondapak C18 в качестве непендируют в КМРС/КМР с 50 мл СаСl2/ до конценподвижной фазы. Подвижная фаза /при скорости трации 5 х 107 клеток/мл, и оставляет при комнатпотока 5 мл/мин/ изократная - 0,010 М КН2РО4 рН ной температуре на 20 минут. Для трансформации 7,0, в течение 35 минут. Пик поглощения, соответPenicillium 200 мл суспензии сферопласта добавствующий времени удержания адипоил-7-ADCA ляет к ДНК /5 мг вектор ДНК в 6,2 мл КМРС с 5 продукта, собирают, используя коллектор фракмг/мл гепарина/ вместе с 50 мл РРС /40% ПЭГ, ций. МW3500, 20 мМ КH2PO4, pH 6,3, 5% CaCl2; добавПример 12 ляет непосредственно перед применением/ и Проверка биоактивности трансформационную смесь инкубируют на льду в Антибиотическую активность продуктов фертечение 30 минут, добавляют 1 мл свежепригоментации адипоил-6-АРА и адипоил-7-ADCA, вытовленного РРС, и смесь переносят В 50 мл расделенных ВЭЖХ, определяют, используя диффуплавленного /50°С/ регенерационного агара /СМ зионную биопробу на агаре /agar diffusion плюс 1,3 М манннта и 3% агара/. Трансформациbioassay/. Двадцать мл выделенного продукта наонную смесь затем распределяют в две чашки носят на 5 мм диски на пластинах агара LB /20 г на Петри. После регенерации в течение 24 часов при л основного бульона LB с 3% агара /Clbco, Paisley, 25°С пластины накрывают ОL /1% пептона в 1% Шотландия/, засеянные Bacillus subtilus ATCC агара/, содержащим 100 мг флюомицина на 50 мл 33677, или суперчувствительным штаммом Е. соlі ОL. Количество покрывающего материала равно /поставляемого проф. Arnold L. Demain, MIT/. Bacilколичеству регенерационного агара. Пластины lus subtilus использудт в качестве индикаторного инкубирует при 25°С в течение 7-14 дней, и наштамма для проверки продукта адипоил-6-АРА, и блюдают генерацию колоний трансформанта. суперчувствительный штамм Е. соlі используют в Пример 11 качестве индикаторного штамма для проверки ВЭЖХ-анализ продуктов ферментации адипоадипоил-7-ADCA. После 15-часового инкубироваил-6-АРА и адипоил-7-ADCA ния при 37°С гало подавленной поросли индика 15 31 41292 32 торной бактерии вокруг диска указывает, что протрометре IВМ-АF-350 /в Fourier Transform mode/. дукты проявляют биоактивность. Контрольные Образцы состоят из 50 мг продукта адипоил-7образцы в этом эксперименте включают дезацеADCA из ферментационного бульона в 0,5 мл D20 токсицефалоспорин С, цефалоспорин С, пени(99,8% D, Aldrich), или в 0,5 мл DMCO-d6 (99,0% D, циллин V, и в качестве контрольного образца для Aldrich), трубки 5 мм, 350°К. Данные ЯМР подтвeрждают определeние продукта как адипоил-7подтверждения b -лактамных структур - агар, ADCA. содержащий пенициллиназу, или не содержащий Пример 16 пенициллиназу. Оценка альтернативных ферментов адипоиПример 13 лацилазы Проверка фермента RAEV В дополнение к исследованиям, используюОчищенный продукт адипоил-7-ADСА из щим фермент RAEV, демонстрируется удаление цельного ферментационного бульона использует боковой адипоильной цепи из адипоил-7-ADCA /и В качестве субстрата для определения специфидругих соединений с адипоилом/ с помощью ферческой активности фермента RAEV /доступен ментов, полученных из ряда микробных источникоммерчески от RAEV Corp./. Реакционную смесь, ков. На начальной стадии штаммы Pseudomonas содержащую 10 мM субстрата, 1 мг фермента SE-83 и SЕ-495 /депонированные в Fermentation RAEV, 5% глицерина в 0,16 М KH2PO4 в общем Research Institute под регистрационными номераобъеме 50 мл, инкубируют при 37°С. Отбирают 5 ми FERM BP-817 и FERM BP-818 соответственно/ мл алиКВОТЫ БО временных точках 0, 1, 3, 5, 10, и штамм Pseudomonas SY-77-1 /депонированный 20 и 30 минут, разбавляв 35 мл 0,010 М KH2PO4, Nothern Regional Research Laboratory под регистрН 3,5, и замораживают при -70°С, перед аналирационным номером NNRL B-8070/ выращивают в зом методом ВЭЖХ при условиях, описанных ратечение 72 часов в среде, содержащей HyCase нее. SF - 2,0% (вес/объем); мононатрийглутамат - 0,5% Активность фермента RAEV по отношению к (вес/объем); дрожжевой экстракт 0,5% колориметрированному субстрату адипоил-n(вес/объем); порошок вымоченной кукурузы - 0,2% аминобензойной кислоты проверяют, используя 5 (вес/объем); хлопковое масло - 0,5% (вес/объем); мМ субстрата, 8,25 мг фермента RAEV, 10% глии глутаровую кислоту - 0,1% (вес/объем). Клетки церина в 0,065 М KH2PO4, рН 7,0, в общем объеме собирают центрифугированием и промывают 50 50 мл в течение 30 минут при 37°С. Реакцию вымМ фосфатным буфером, рН 8,0; затем их снова полняют в 96-ячеичной чашке микротитратора. суспендируют в буфере, и делают проницаемыми Пятьдесят мл 1 M NaNO2, разбавленного 0,25 М внешние мембраны путем добавления небольшоуксусной кислотой в соотношении 1:100, добавляго объема хлороформа. Аликвоты суспензии клеют, чтобы закончить реакцию, и реакционную ток затем смешивают с адипоил-п-нитроанилином смесь оставляют при комнатной температуре на 3 /аd-РNА/ и инкубируют при 30°С в течение 2-18 минуты. Добавляют 100 мл раствора в воде гидчасов. После инкубации смеси подкисляют путем рата мононатриевой соли 4-амино-5-гидрокси-2,7добавления 10% (объемн.) уксусной кислоты. Занасфталиндисульфоновой кислоты (10 мг/мл), тем колориметрическим способом определяют разбавленного 0,5 М NаНСО3 в соотношении освободившийся п-нитроанилин после его конвер1:100, и немедленно определяют окраску при 515 сии в диазосоединение, используя реагенты, нм, используя EL 312 Bio-kinetic Plate Reader предложенные в форме комплекта Sigma Chemical /приборы ВiоТек/. Сомраnу для испытаний гаммаПример 14 глутамилтрансферазы /Sigma product number 545ВЭЖХ-анализ продукта реакции форманта А. Относительные активности трех штаммов соRAEV ставляет 100%, 85,5% и 48% для SЕ-495, SE-83 и Все проверки фермента RAEV /коммерчески SY-77-1 соответственно. Используя способы, подоступного от RAEV Corp./, в которых используют добные описанным выше для фермента RAEV, субстрат адипоил-7-ADCA, при контроле методом демонстрируют также активность SЕ-83 и SE-495 ВЭЖХ работают с системой Waters с системой bна адипоил-7-ADCA. Продуцирование подачи растворителя 625, детектором 490Е c перeменной длиной волны на 203 нм, и 254 нм, сислактамазы SY-77-1 предотвращает проявление темой данных 825 Max-а и колонкой Novo-С18 в дезацилирующей активности этого штамма отнокачестве неподвижной фазы. Подвижная фаза сительно адипоил-7-ADCA. /при скорости потока 1 мл/мин/ состоит из 2% меПодобным способом также демонстрируют танола и 98% 0,010 М KH2PO4, рН 3,5 - 5 минут продуцирование адипоилацилазы для двухгрибизократно, и метанола в 0,010 М KH2PO4 рН 3,5, с ных штаммов /Altemaria sp. MА-133, АТСС № линейным градиентом 2-40% - 15 минут. Исполь20492 и Aspergillus sp. МА-13, АТСС № 20491, ссылка - патент США 4141790 Meiji Seika Kaisha зуют стандарт 7-ADCA, чтобы контролировать Ltd./ и штаммов трехбактериальных время удержания продукта реакции. Количество /Brevibacterium, АТСС № 14649; Achromobacterium, продукта реакции вычисляют, используя стандартную кривую стандарта 7-ADCA при 254 нм. АТСС № 14648 и Flavobacterium, АТСС № 14650/, Пример 15 которые описаны как продуценты ацилазы цефа13С-ЯМР-анализ продукта ферментации адилоспорина С в патенте США 3239394, Merk & Co., поил-7-ADCA Inc. Спектры 13С-ЯМР /широкополосный протонСписок последовательностей. ный сдвиг/ получают при 75,4 Мгц /7,1 Т/ на спек/2/ Информация о последовательности ID № 1 16 33 41292 34 /і/ Характеристика последовательности /і/ Характеристика последовательности /А/ Длина: 14 пар оснований /А/ Длина: 22 аминокислоты /В/ Тип: нуклеокислота /В/ Тип: аминокислота /С/ Двухцепочечная /С/ Одноцепочечная /D/ Топология: линейная /D/ Топология: линейная /ii/ Тип молекулы: ДНК /геномная/ /ii/ Тип молекулы: пептид /xi/ Описание последовательности: послед. ID /хi/ Описание последовательности: послед. ID № 1 ТСТАGАСАСС ATGG №7 /2/ Информация о последовательности ID № 2 /і/ Характеристика последовательности /А/ Длина: 16 пар основании /В/ Тип: нуклеокислота /2/ Информация о последовательности ID № 8 /С/ Двухцепочечная /i/ Характеристика последовательности /D/ Топология: линейная /А/ Длина: 34 пары оснований /ii/ Тип молекулы: ДНК /геномная/ /В/ Тип: нуклеокислота /хi/ Описание последовательности: послед. ID /С/ Одноцепочечная № 2 GTGAGAGTTG ATGGAC /D/ Топология: линейная /2/ Информация о последовательности ID № 3 /ii/ Тип молекулы: ДНК /геномная/ /i/ Характеристика последовательности: /хi/ Описание последовательности: послед. ID /А/ Длина: 16 пар оснований № 8 CGAGAGGATC АGТGАGАGТС CATGGACACG ACGG /В/ Тип: нуклеокислота /2/ Информация о последовательности ID № 9 /С/ двухцепочечная /i/ Характеристика последовательности /D/ Топология: линейная /А/ Длина: 47 пар оснований /ii/ Tип молекулы: ДНК /геномная/ /В/ Тип: нуклеокислота /хi/ Описание последовательности: послед. ID /С/ Одноцепочечная № 3 TCTAGACACT ATGGAC /D/ Топология: линейная /2/ Информация о последовательности ID № 4 /ii/ Тип молекулы: ДНК /геномная/ /i/ Характеристики последовательности /xi/ Описание последовательности: послед. ID /А/ Длина: 16 пар оснований № 9 АТСТСТТТТС ТААТАССТТС ACCATGGGTTG АGАТТGТАСG /В/ Тип: нуклаокислота ТGАТССС /С/ Двухцепочечная /2/ Информация о последовательности ID № /D/ Топология: линейная 10 /ii/ Тип молекулы: ДНК /геномная/ /i/ Характеристика последовательности /xi/ Описание последовательности: послед. ID /А/ Длина: 33 пары оснований № 4 TCTAGACACC ATGGAC /В/ Тип: нуклеокислота /2/ Информация о последовательности ID № 5 /С/ Одноцепочечная /і/ Характеристика последовательности /D/ Топология: линейная /А/ Длина: 22 аминокислоты /ii/ Тип молекулы: ДНК /геномная/ /В/ Тип: аминокислота /хі/ Описание последовательности: послед. ID /С/ Одноцепочечная № 10 CGCGGATCCC GGCATCAACG GCTTCGGTCG TAT /D/ Топология: линейная /2/ Информация о последовательности ID № /ii/ Тип молекулы: пептид 11 /xi/ Описание последовательности: послед. ID /i/ Характеристика последовательности №5 /А/ Длина: 34 пары оснований /В/ Тип: нуклеокислота /С/ Одноцепочечная /D/ Топология: линейная /ii/ Тип молекулы: ДНК /геномная/ /2/ Информация о последовательности ID № 6 /хі/ Описание последовательности: послед. ID /i/ Характеристика последовательности № 11 CGCGGATCCG GGCACGCGCA TGGACATGCC АGTG /А/ Длина: 22 аминокислоты /2/ Информация о последовательности ID № /В/ Тип: аминокислота 12 /С/ Одноцепочечная /i/ Характеристика последовательности /D/ Топология: линейная /А/ Длина: 26 пар оснований /ii/ Тип молекулы: ДНК /геномная/ /В/ Тип: нуклеокислота /xi/ Описание последовательности: послед. ID /С/ Одноцепочечная №6 /D/ Топология: линейная /ii/ Тип молекулы: ДНК /геномная/ /хі/ Описание последовательности: послед. ID № 12 CAGTAAACGC ААССАТGGTТ GTCCAG /2/ Информация о последовательности ID № 7 17 35 41292 36 _______________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 18
ДивитисяДодаткова інформація
Назва патенту англійськоюBiological method for obtaining 7-aminodesacetoxycephalosporanic acid (7-adca)
Автори англійськоюCONDER MICHAEL J, CRAWFORD LORILEE, MCADA PHYLLIS C, RAMBOSEK JOHN A
Назва патенту російськоюБиологический способ получения 7-аминодезацетоксицефалоспорановой кислоты (7-adca)
Автори російськоюКондер Майкл Дж., Крофорд Лорили, Макейда Филлис К., Рембоусек Джон А.
МПК / Мітки
МПК: C12N 15/09, C12N 1/15, C12P 35/00, C12N 15/00, C12N 9/02, C12N 9/78, C12P 37/00
Мітки: 7-амінодезацетоксицефалоспоранової, біологічний, одержання, 7-адса, кислоти, спосіб
Код посилання
<a href="https://ua.patents.su/18-41292-biologichnijj-sposib-oderzhannya-7-aminodezacetoksicefalosporanovo-kisloti-7-adsa.html" target="_blank" rel="follow" title="База патентів України">Біологічний спосіб одержання 7-амінодезацетоксицефалоспоранової кислоти (7-адса)</a>
Попередній патент: Фторовані похідні 17b-заміщеного-4-aзa-5a-андростан-3-ону і фармацевтична композиція на їх основі
Наступний патент: Спосіб одержання карбонату лужного металу, спосіб одержання карбонату натрію та спосіб очистки розсолу – водного розчину хлориду натрію
Випадковий патент: Фармакологічна композиція для лікування і профілактики захворювань пародонта