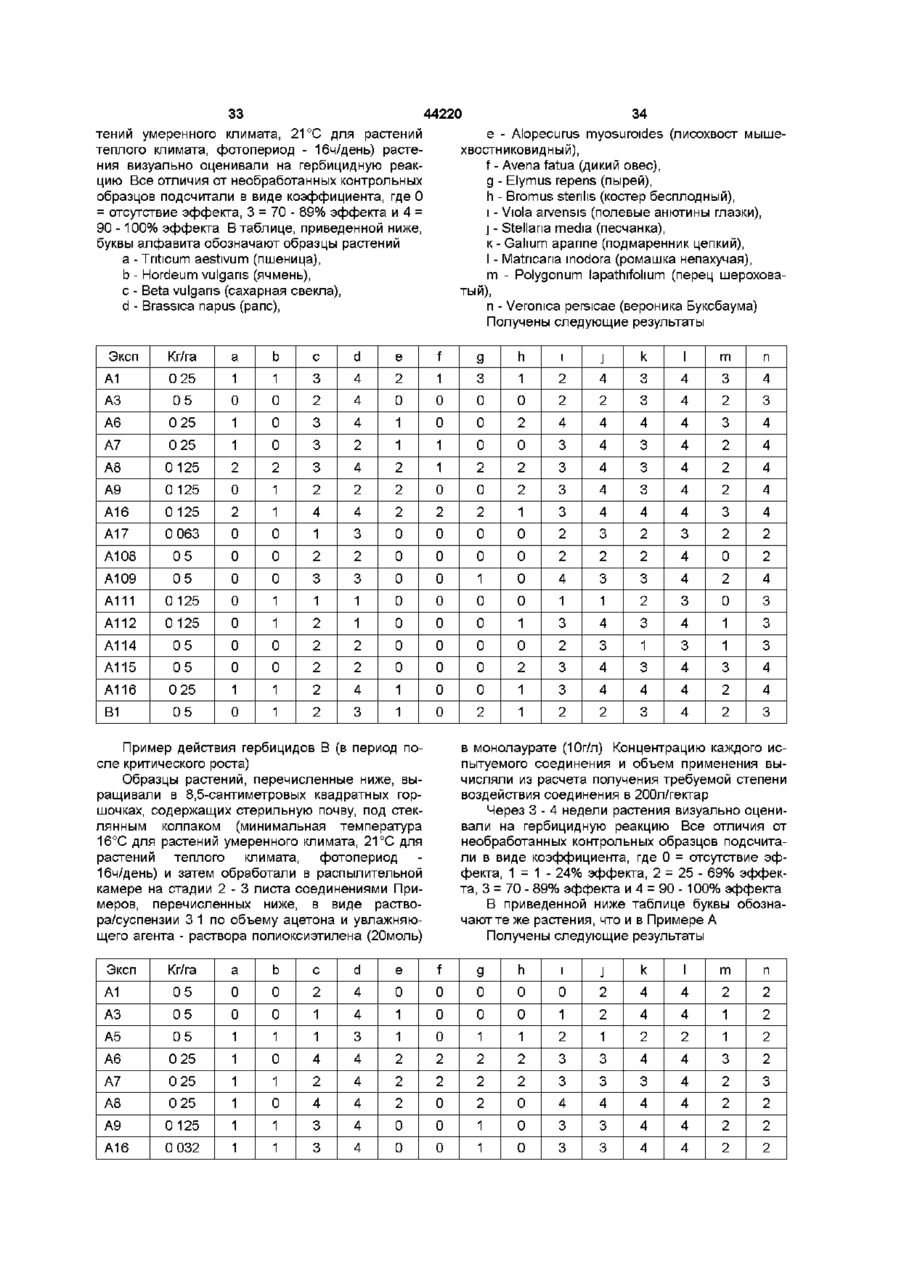
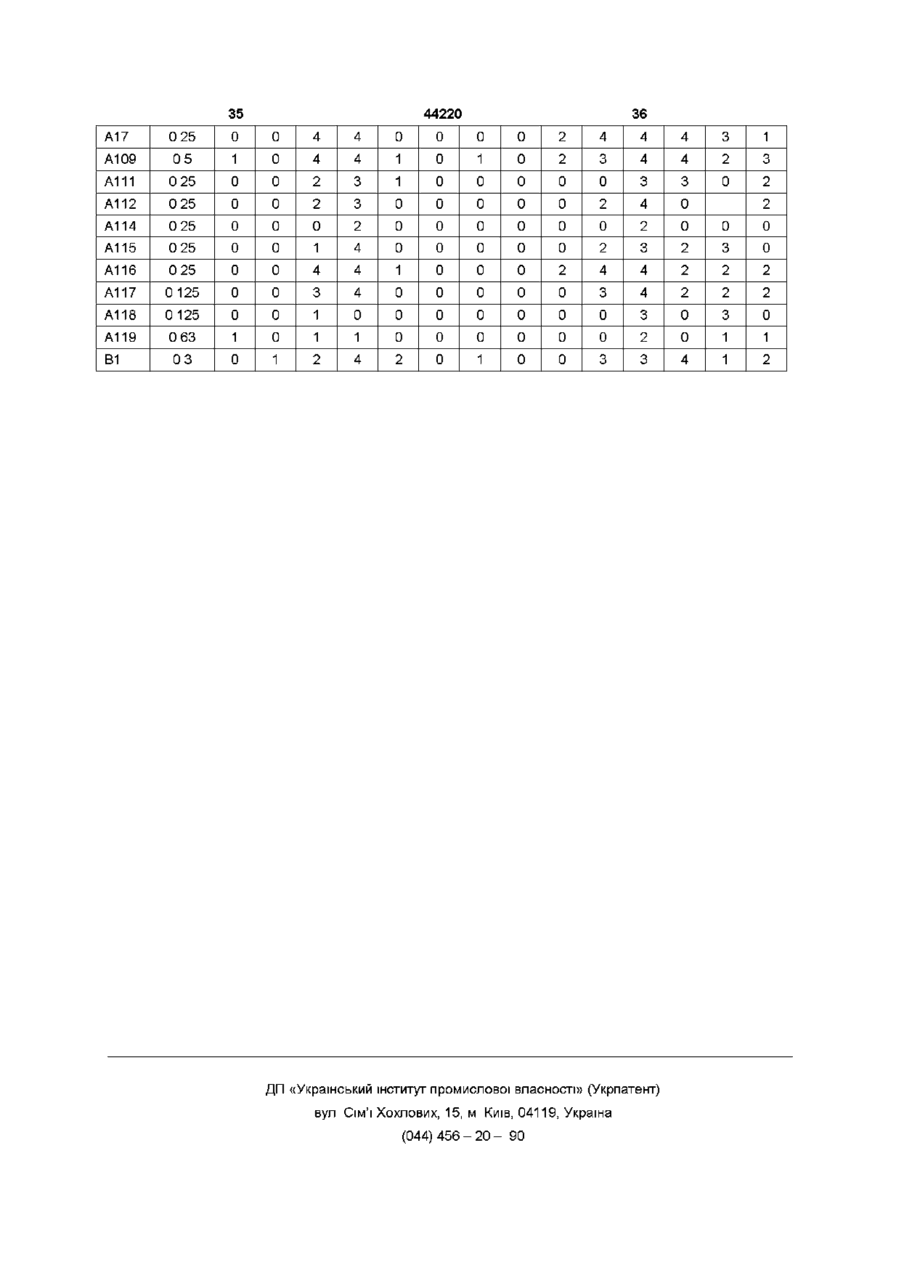
Сульфонаміди,що мають гербіцидну активність,спосіб їх одержання, гербіцидна композиція та спосіб боротьби з бур’янами
Номер патенту: 44220
Опубліковано: 15.02.2002
Автори: Девід Едвард Сондерс, Грехем Пітер Джонс, Пітер Стюарт Гейтс
Формула / Реферат
1. Сульфонамиды формулы:
и их соли, где
А представляет собой замещенное или незамещенное бензольное кольцо, или 5-звенное, или 6-звенное замещенное или незамещенное гетероароматическое кольцо;
Q представляет собой -О-, -S- или группу -СХХ'-;
Χ и X', которые могут быть одинаковыми или различными, представляют собой каждая водород, галоген, циано, возможно замещенный алкил с 1-8 атомами углерода, или группу -ORa, -SRa или -CORb, или одна из групп Χ или X' представляет собой гидрокси, а другая - одну из описанных выше групп, или Χ и X' обе представляют собой О или S;
Ra - алкил с 1-8 атомами углерода, фенильная группа или алканоил с 1-8 атомами углерода;
Rb - алкил с 1-8 атомами углерода, или группа -ORc или -ΝRcRd;
Rc и Rd, которые могут быть одинаковыми или различными, представляют собой каждая водород или алкил с 1-8 атомами углерода;
Υ - азот или группа CR9;
R1 - алкил с 1-8 атомами углерода незамещенный или замещенный галогеном, циано, ацилом, или амино возможно замещенный группой, выбранной из алкила с 1-4 атомами углерода и ацила, или незамещенный или замещенный фенил, или гетероциклическая группа;
R2 - водород или алкил с 1-4 атомами углерода;
R3 и R4, которые могут быть одинаковыми или различными, представляют собой каждая алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода или галоген; и
R9 представляет собой водород
при условии, что если Q представляет собой -О- или -S-, кольцо А представляет собой 5-звенное замещенное или незамещенное гетероароматическое кольцо,
проявляющие гербицидную активность.
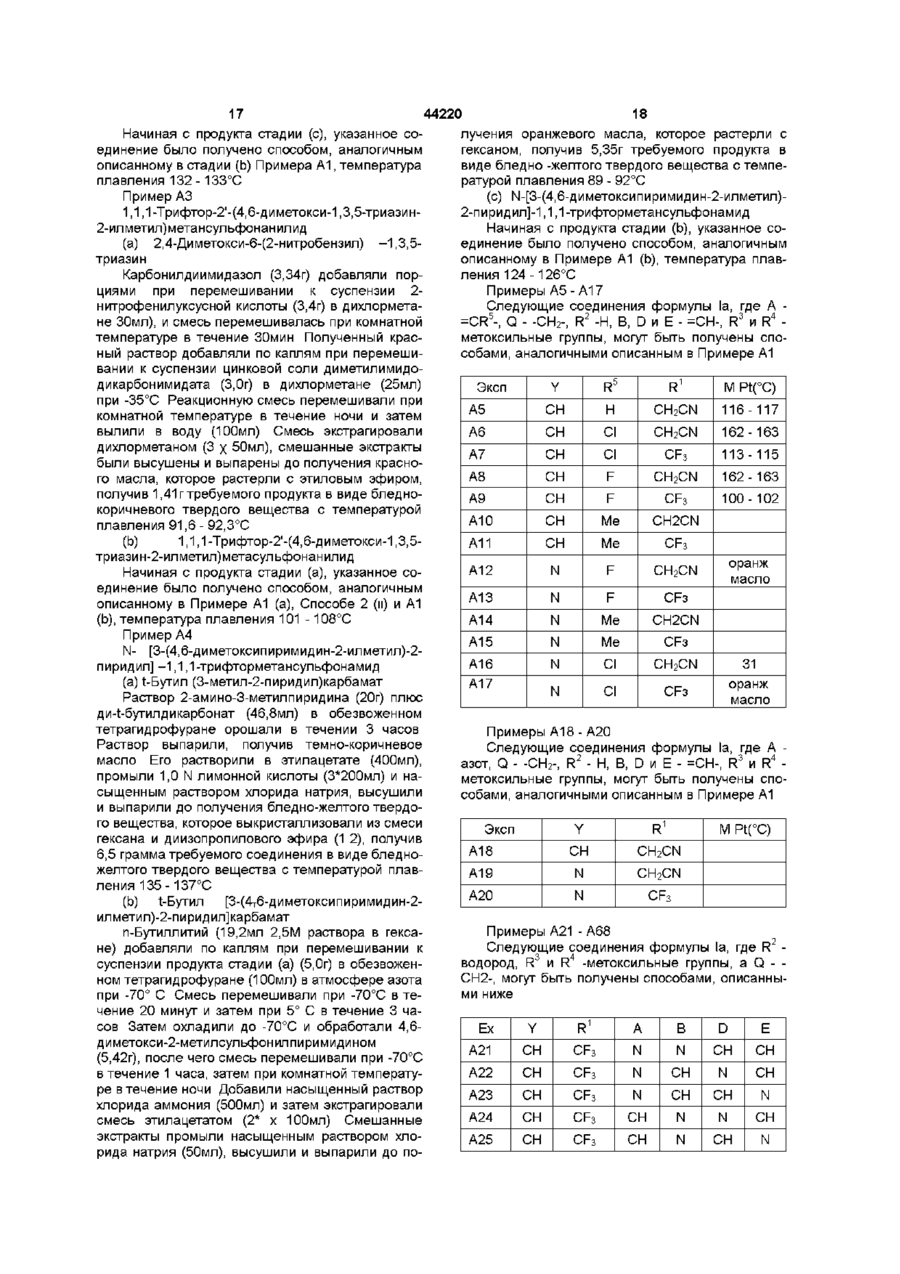
2. Сульфонамиды по п. 1, отличающиеся тем, что R1 - метил, хлорметил, бромметил, цианметил, трифторметил, (метилкарбамоил)метил, (тиокарбамоил)метил, метоксикарбонилметил, 2-хлорфенил, метоксикарбониламино или триазолтриазолил.
3. Сульфонамиды по любому из п. 1 или 2, отличающиеся тем, что R2 - водород.
4. Сульфонамиды по любому из пп. 1-3, отличающиеся тем, что каждая из групп R3 - метил, метокси или хлор, и R4 метил или метокси.
5. Сульфонамиды по любому из пп. 1-4, отличающиеся тем, что А - фенил, возможно замещенный фтором, хлором, бромом, метилом, метокси или этокси, или пиразолил, возможно замещенный одной или более метиловыми группами.
6. Сульфонамиды по любому из пп. 1-5, отличающиеся тем, что -Q- -СН2-, -СН(СН3)-,-S- или -O-.
7. Гербицидная композиция, содержащая активный ингредиент и как минимум один подходящий носитель и/или поверхностно-активный агент, отличающаяся тем, что активный ингредиент представляет собой как минимум одно соединение сульфонамида формулы (I)
или его соль, где
А представляет собой замещенное или незамещенное бензольное кольцо, или 5-звенное, или 6-звенное замещенное или незамещенное гетероароматическое кольцо;
Q представляет собой -О-, -S- или группу -СХХ'-;
Χ и X', которые могут быть одинаковыми или различными, представляют собой каждая водород, галоген, циано, возможно замещенный алкил с 1-8 атомами углерода, или группу -ORa, -SRa или -СОRb, или одна из групп Χ или X' представляет собой гидрокси, а другая - одну из описанных выше групп, или Χ и X' обе представляют собой О или S;
Ra - алкил с 1-8 атомами углерода, фенильная группа или алканоил с 1-8 атомами углерода;
Rb - алкил с 1-8 атомами углерода, или группа -ORc или -NRcRd;
Rc и Rd, которые могут быть одинаковыми или различными, представляют собой каждая водород или алкил с 1-8 атомами углерода;
Υ - азот или группа CR9,
R1 - алкил с 1-8 атомами углерода незамещенный или замещенный галогеном, циано, ацилом или амино, возможно замещенный группой, выбранной из алкила с 1-4 атомами углерода и ацила, или незамещенный или замещенный фенил, или гетероциклическая группа;
R2 - водород или алкил с 1-4 атомами углерода;
R3 и R4, которые могут быть одинаковыми или различными, представляют собой каждая алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода или галоген; и
R9 представляет собой водород;
при условии, что если Q представляет собой -О- или -S-, кольцо А представляет собой 5-звенное замещенное или незамещенное гетероароматическое кольцо.
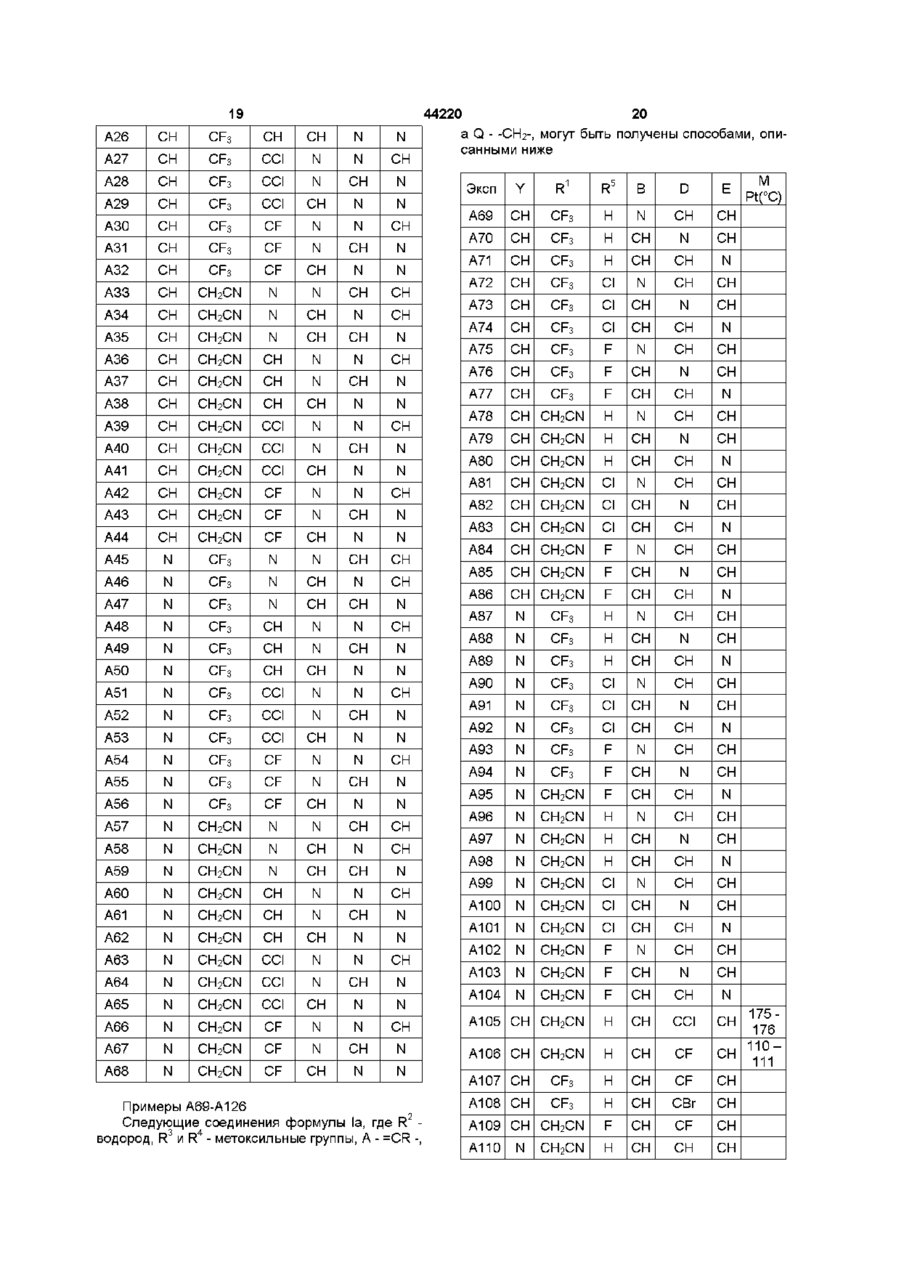
8. Гербицидная композиция по п. 7, отличающаяся тем, что R1 - метил, хлорметил, бромметил, цианметил, трифторметил, N-метилацетамидо, тиоацетамидо, метоксикарбонилметил, 2-хлорфенил, метоксикарбониламино или триазолтриазолил.
9. Гербицидная композиция по любому из пп. 7-8, отличающаяся тем, что R2-водород.
10. Гербицидная композиция по любому из пп. 7-9, отличающаяся тем, что каждая из групп R3-метил, метокси или хлор, и R4 метил или метокси.
11. Гербицидная композиция по любому из пп. 7-10, отличающаяся тем, что А - фенил, возможно замещенный фтором, хлором, бромом, метилом, метокси или этокси, или пиразолил, возможно замещенный одной или более метиловыми группами.
12. Гербицидная композиция по любому из пп. 7-11, отличающаяся тем, что Q-CH2-, -СН(СН3)-, -S- или -О-.
13. Способ борьбы с сорняками на зараженных или подверженных заражению территориях, включающий обработку упомянутых территорий гербицидной композицией, отличающийся тем, что территории обрабатывают гербицидной композицией, содержащей в качестве активного ингредиента эффективное количество как минимум одного соединения сульфонамида формулы (I):
или его соли, где
А представляет собой замещенное или незамещенное бензольное кольцо, или 5-звенное, или 6-звенное замещенное или незамещенное гетероароматическое кольцо;
Q представляет собой -О-, -S- или группу -СХХ'-;
Χ и X', которые могут быть одинаковыми или различными, представляют собой каждая водород, галоген, циано, возможно замещенный алкил с 1-8 атомами углерода, или группу -ORa, -SRa или -CORb, или одна из групп Χ или X' представляет собой гидрокси, а другая - одну из описанных выше групп, или Χ и X' обе представляют собой О или S;
Ra - алкил с 1-8 атомами углерода, фенильная группа или алканоил с 1-8 атомами углерода;
Rb - алкил с 1-8 атомами углерода, или группа –ORc или –NRcRd;
Rc и Rd, которые могут быть одинаковыми или различными, представляют собой каждая водород или алкил с 1-8 атомами углерода;
Υ - азот или группа CR9;
R1 - алкил с 1-8 атомами углерода незамещенный или замещенный галогеном, циано, ацилом или амино, возможно замещенный группой, выбранной из алкила с 1-4 атомами углерода и ацила, или незамещенный или замещенный фенил, или гетероциклическая группа;
R2 - водород или алкил с 1-4 атомами углерода;
R3 и R4, которые могут быть одинаковыми или различными, представляют собой каждая алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода или галоген; и
R9 представляет собой водород;
при условии, что если Q представляет собой ,-O- или -S-, кольцо А представляет собой 5-звенное замещенное или незамещенное гетероароматическое кольцо.
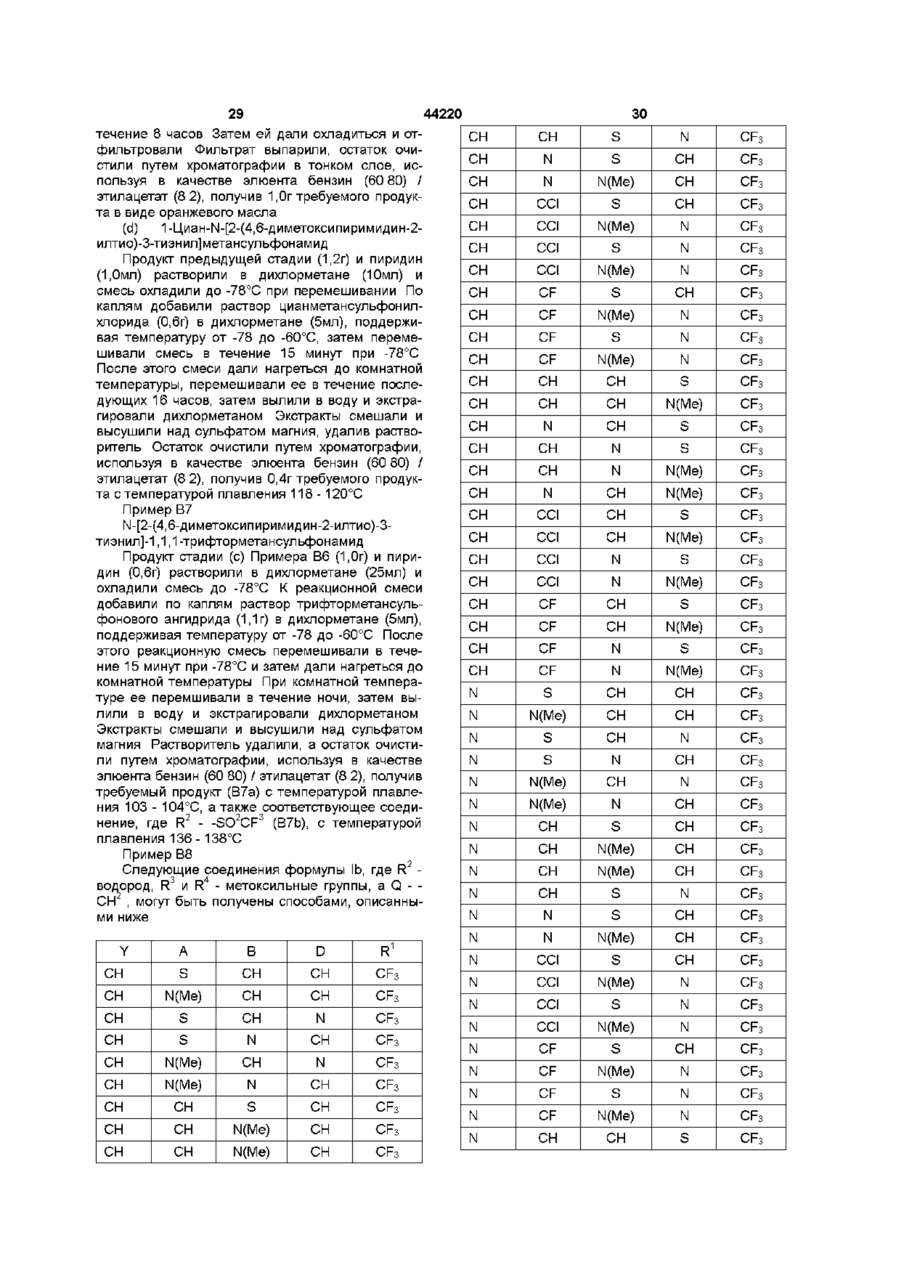
14. Способ борьбы с сорняками по п. 13, отличающийся тем, что R1 - метил, хлорметил, бромметил, цианметил, трифторметил, N-метилацетамидо, тиоацетамидо, метоксикарбонилметил, 2-хлорфенил, метоксикарбониламино или триазолтриазолил.
15. Способ борьбы с сорняками по п. 13 или п. 14, отличающийся тем, что R2 - водород.
16. Способ борьбы с сорняками по любому из пп. 13-15, отличающийся тем, что каждая из групп R3 - метил, метокси или хлор, и R4 метил или метокси.
17. Способ борьбы с сорняками по любому из пп. 13-16, отличающийся тем, что А - фенил, возможно замещенный фтором, хлором, бромом, метилом, метокси или этокси, или пиразолил, возможно замещенный одной или более метиловыми группами.
18. Способ борьбы с сорняками по любому из пп. 13-17, отличающийся тем, что Q-CH2-, -СН(СН3)-, -S- или -О-.
19. Способ получения сульфонамида формулы (I):
где А представляет собой замещенное или незамещенное бензольное кольцо, или 5-звенное, или 6-звенное замещенное или незамещенное гетероароматическое кольцо;
Q представляет собой -О-, -S- или группу -СХХ'-;
Χ и X1, которые могут быть одинаковыми или различными, представляют собой каждая водород, галоген, циано, возможно замещенный алкил с 1-8 атомами углерода, или группу -ORa, -SRa или -CORb, или одна из групп Χ или X' представляет собой гидрокси, а другая - одну из описанных выше групп, или Χ и X' обе представляют собой О или S;
Ra - алкил с 1-8 атомами углерода, фенильная группа или алканоил с 1-8 атомами углерода;
Rb - алкил с 1-8 атомами углерода, или группа –ORc или -NRcRd;
Rc и Rd, которые могут быть одинаковыми или различными, представляют собой каждая водород или алкил с 1-8 атомами углерода;
Υ - азот или группа CR9;
R1 - алкил с 1-8 атомами углерода незамещенный или замещенный галогеном, циано, ацилом или амино возможно замещенный группой, выбранной из алкила с 1-4 атомами углерода и ацила, или незамещенный или замещенный фенил, или гетероциклическая группа;
R2 - водород или алкил с 1-4 атомами углерода;
R3 и R4, которые могут быть одинаковыми или различными, представляют собой каждая алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода или галоген; и
R9 представляет собой водород;
при условии, что если Q представляет собой -О- или -S-, кольцо А представляет собой 5-звенное замещенное или незамещенное гетероароматическое кольцо, в котором амин формулы:
где А, Q, Υ и R2R4 как описаны выше, подвергают реакции с подходящим сульфоновым ангидридом формулы (R1SO2)2O или сульфонилгалогеном формулы R1SO2Hal, где Hal - атом галогена, а R1 как описан выше, с получением требуемого продукта.
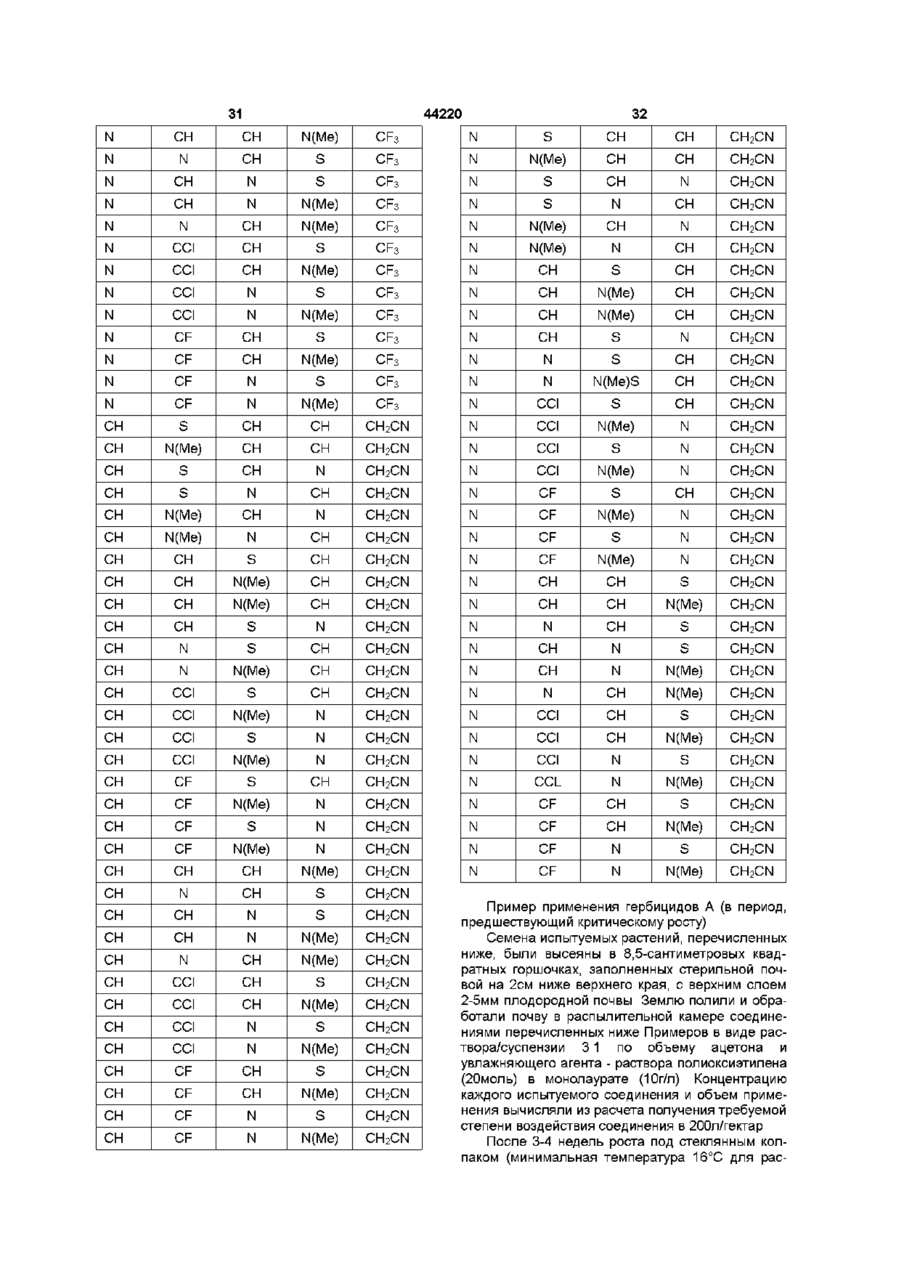
20. Способ получения сульфонамида по п. 19, отличающийся тем, что R1 - г
метил, хлорметил, бромметил, цианметил, трифторметил, N-метилацетамидо, тиоацетамидо, метоксикарбонилметил, 2-хлорфенил, метоксикарбониламино или триазолтриазолил.
21. Способ получения сульфонамида по п. 19 или п. 20, отличающийся тем, что R2 - водород.
22. Способ получения сульфонамида по любому из пп. 19-21, отличающийся тем, что каждая из групп R3 - метил, метокси или хлор, и R4 метил или метокси.
23. Способ получения сульфонамида по любому из пп. 19-22, отличающийся тем, что А - фенил, возможно замещенный фтором, хлором, бромом, метилом, метокси или этокси, или пиразолил, возможно замещенный одной или более метиловыми группами.
24. Способ получения сульфонамида по любому из пп. 19-23, отличающийся тем, что Q- -СН2-, -СН(СН3)-, -S- или -О-.
Текст
1 Сульфонамиды формулы >2 и их соли, где А представляет собой замещенное или незамещенное бензольное кольцо, или 5-звенное, или 6звенное замещенное или незамещенное гетероароматическое кольцо, Q представляет собой -О-, -S- или группу -СХХ'-, X и Xі, которые могут быть одинаковыми или различными, представляют собой каждая водород, галоген, циано, возможно замещенный алкил с 1-8 атомами углерода, или группу -ORa, -SRa или COR , или одна из групп X или X' представляет собой гидрокси, а другая - одну из описанных выше групп, или X и X' обе представляют собой О или S, Ra - алкил с 1-8 атомами углерода, фенильная группа или алканоил с 1-8 атомами углерода, R - алкил с 1-8 атомами углерода, или группа ORC или -NRcRd, Rc и Rd, которые могут быть одинаковыми или различными, представляют собой каждая водород или алкил с 1-8 атомами углерода, Y - азот или группа CR9, R1 - алкил с 1-8 атомами углерода незамещенный или замещенный галогеном, циано, ацилом, или амино возможно замещенный группой, выбранной из алкила с 1-4 атомами углерода и ацила, или незамещенный или замещенный фенил, или гетероциклическая группа, R2 - водород или алкил с 1-4 атомами углерода, R3 и R4, которые могут быть одинаковыми или различными, представляют собой каждая алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода или галоген, и R9 представляет собой водород при условии, что если Q представляет собой -Оили -S-, кольцо А представляет собой 5-звенное замещенное или незамещенное гетероа ром этическое кольцо, проявляющие гербицидную активность 2 Сульфонамиды по п 1, отличающиеся тем, что R1 - метил, хлорметил, бромметил, цианметил, трифторметил, (метилкарбамоил)метил, (тиокарбамоил)метил, метоксикарбонил метил, 2хлорфенил, метоксикарбониламино или триазолтриазолил 3 Сульфонамиды по любому из п 1 или 2, отличающиеся тем,что R2 - водород 4 Сульфонамиды по любому из пп 1-3, отличающиеся тем, что каждая из групп R3 - метил, метокси или хлор, и R4 метил или метокси 5 Сульфонамиды по любому из пп 1-4, отличающиеся тем, что А - фенил, возможно замещенный фтором, хлором, бромом, метилом, метокси или этокси, или пиразол ил, возможно замещенный одной или более метиловыми группами 6 Сульфонамиды по любому из пп 1-5, отли О 44220 чающиеся тем, что -Q- -CH2-, -CH(CH3)-,-S- или О7 Гербицидная композиция, содержащая активный ингредиент и как минимум один подходящий носитель и/или поверхностно-активный агент, отличающаяся тем, что активный ингредиент представляет собой как минимум одно соединение сульфонамида формулы (I) (I) или его соль, где А представляет собой замещенное или незамещенное бензольное кольцо, или 5-звенное, или 6звенное замещенное или незамещенное гетероароматическое кольцо, Q представляет собой -О-, -S- или группу -СХХ'-, X и Xі, которые могут быть одинаковыми или различными, представляют собой каждая водород, галоген, циано, возможно замещенный алкил с 1-8 атомами углерода, или группу -ORa, -SRa или CORb, или одна из групп X или X представляет собой гидрокси, а другая - одну из описанных выше групп, или X и X обе представляют собой О или S, Ra - алкил с 1-8 атомами углерода, фенильная группа или алканоил с 1-8 атомами углерода, Rb - алкил с 1-8 атомами углерода, или группа ORC или -NRcRd, Rc и Rd, которые могут быть одинаковыми или различными, представляют собой каждая водород или алкил с 1-8 атомами углерода, Y - азот или группа CR9, R1 - алкил с 1-8 атомами углерода незамещенный или замещенный галогеном, циано, ацилом или амино, возможно замещенный группой, выбранной из алкила с 1-4 атомами углерода и ацила, или незамещенный или замещенный фенил, или гетероциклическая группа, R2 - водород или алкил с 1-4 атомами углерода, R3 и R4, которые могут быть одинаковыми или различными, представляют собой каждая алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода или галоген, и R9 представляет собой водород, при условии, что если Q представляет собой -Оили -S-, кольцо А представляет собой 5-звенное замещенное или незамещенное гетероа ром этическое кольцо 8 Гербицидная композиция по п 7, отличающаяся тем, что R1 - метил, хлорметил, бромметил, цианметил, трифторметил, N-метилацетамидо, тиоацетамидо, метоксикарбонил метил, 2хлорфенил, метоксикарбониламино или триазолтриазолил 9 Гербицидная композиция по любому из пп 7-8, отличающаяся тем, что ^-водород 10 Гербицидная композиция по любому из пп 7-9, отличающаяся тем, что каждая из групп R3метил, метокси или хлор, и R4 метил или метокси 11 Гербицидная композиция по любому из пп 7 10, отличающаяся тем, что А - фенил, возможно замещенный фтором, хлором, бромом, метилом, метокси или этокси, или пиразолил, возможно замещенный одной или более метиловыми группами 12 Гербицидная композиция по любому из пп 711, отличающаяся тем, что Q-CH2-, -CH(CH3)-, -Sили -О13 Способ борьбы с сорняками на зараженных или подверженных заражению территориях, включающий обработку упомянутых территорий гербицид ной композицией, отличающийся тем, что территории обрабатывают гербицидной композицией, содержащей в качестве активного ингредиента эффективное количество как минимум одного соединения сульфонамида формулы (I) (I) или его соли, где А представляет собой замещенное или незамещенное бензольное кольцо, или 5-звенное, или 6звенное замещенное или незамещенное гетероароматическое кольцо, Q представляет собой -О-, -S- или группу -СХХ'-, X и X, которые могут быть одинаковыми или различными, представляют собой каждая водород, галоген, циано, возможно замещенный алкил с 1-8 атомами углерода, или группу -ORa, -SRa или CORb, или одна из групп X или X представляет собой гидрокси, а другая - одну из описанных выше групп, или X и X обе представляют собой О или S, Ra - алкил с 1-8 атомами углерода, фенильная группа или алканоил с 1-8 атомами углерода, Rb - алкил с 1-8 атомами углерода, или группа ORC или -NR c R d , Rc и Rd, которые могут быть одинаковыми или различными, представляют собой каждая водород или алкил с 1-8 атомами углерода, Y - азот или группа CR9, R1 - алкил с 1-8 атомами углерода незамещенный или замещенный галогеном, циано, ацилом или амино, возможно замещенный группой, выбранной из алкила с 1-4 атомами углерода и ацила, или незамещенный или замещенный фенил, или гетероциклическая группа, R2 - водород или алкил с 1-4 атомами углерода, R3 и R4, которые могут быть одинаковыми или различными, представляют собой каждая алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода или галоген, и R9 представляет собой водород, при условии, что если Q представляет собой ,-Оили -S-, кольцо А представляет собой 5-звенное замещенное или незамещенное гетероа ром этическое кольцо 14 Способ борьбы с сорняками по п 13, отличающийся тем, что R1 - метил, хлорметил, бромметил, циэнметил, трифторметил, Nметилэцетэмидо, тиоэцетэмидо, метоксикэрбо 44220 нилметил, 2-хлорфенил, метоксикарбониламино или триазолтриазолил 15 Способ борьбы с сорняками по п 13 или п 14, отличающийся тем, что R2 - водород 16 Способ борьбы с сорняками по любому из пп 13-15, отличающийся тем, что каждая из групп R3 - метил, метокси или хлор, и R4 метил или метокси 17 Способ борьбы с сорняками по любому из пп 13-16, отличающийся тем, что А - фенил, возможно замещенный фтором, хлором, бромом, метилом, метокси или этокси, или пиразол ил, возможно замещенный одной или более метиловыми группами 18 Способ борьбы с сорняками по любому из пп 13-17, отличающийся тем, что Q-CH2-, -СН(СНз)-, -S-или -О19 Способ получения сульфонамида формулы (I) где А представляет собой замещенное или незамещенное бензольное кольцо, или 5-звенное, или 6-звенное замещенное или незамещенное гетероароматическое кольцо, Q представляет собой -О-, -S- или группу -СХХ'-, X и X , которые могут быть одинаковыми или различными, представляют собой каждая водород, галоген, циано, возможно замещенный алкил с 1-8 атомами углерода, или группу -ORa, -SRa или CORb, или одна из групп X или X представляет собой гидрокси, а другая - одну из описанных выше групп, или X и X обе представляют собой О или S, Ra - алкил с 1-8 атомами углерода, фенильная группа или алканоил с 1-8 атомами углерода, Rb - алкил с 1-8 атомами углерода, или группа ORC или -NRcRd, Rc и Rd, которые могут быть одинаковыми или различными, представляют собой каждая водород или алкил с 1-8 атомами углерода, Y - азот или группа CR9, R1 - алкил с 1-8 атомами углерода незамещенный или замещенный галогеном, циано, ацилом или амино возможно замещенный группой, выбранной Данное изобретение касается гербицидных сульфонамидов, процессов их получения и содержащих их композиций Заявки ЕР363040 и W091/10653 описывают гербицидные сульфонанилиды, связанные с представленными в настоящем изобретении С одной стороны, изобретение представляет новые сульфонамиды формулы из алкила с 1-4 атомами углерода и ацила, или незамещенный или замещенный фенил, или гетероциклическая группа, R2 - водород или алкил с 1-4 атомами углерода, R3 и R4, которые могут быть одинаковыми или различными, представляют собой каждая алкил с 1-4 атомами углерода, алкокси с 1-4 атомами углерода или галоген, и R9 представляет собой водород, при условии, что если Q представляет собой -Оили -S-, кольцо А представляет собой 5-звенное замещенное или незамещенное гетероа ром этическое кольцо, в котором амин формулы ,2 (П) где A, Q, Y и R R как описаны выше, подвергают реакции с подходящим сульфоновым ангидридом формулы (R SCbhO или сульфонилгалогеном формулы R SC^Hal, где Hal - атом галогена, a R1 как описан выше, с получением требуемого продукта 20 Способ получения сульфонамида по п 19, отличающийся тем, что R1 - г метил, хлорметил, бромметил, цианметил, трифторметил, N-метилацетамидо, тиоацетамидо, метоксикарбонил метил, 2-хлорфенил, метоксикарбониламино или триазолтриазолил 21 Способ получения сульфонамида по п 19 или п 20, отличающийся тем, что R2 - водород 22 Способ получения сульфонамида по любому из пп 19-21, отличающийся тем, что каждая из групп R3 - метил, метокси или хлор, и R4 метил или метокси 23 Способ получения сульфонамида по любому из пп 19-22, отличающийся тем, что А - фенил, возможно замещенный фтором, хлором, бромом, метилом, метокси или этокси, или пиразол ил, возможно замещенный одной или более метиловыми группами 24 Способ получения сульфонамида по любому из пп 19-23, отличающийся тем, что Q- -СН2-, СН(СНз)-, -S- или -О и их соли, где А представляет собой замещенное или незамещенное бензольное кольцо или 5-звенное замещенное или незамещенное гетероа ром этическое кольцо, Q - -О-, -S- или группа -СХХ'-, 44220 8 X и Xі, которые могут быть одинаковыми или (метоксил или этоксил), гидроксильная, азотная, различными, представляют собой каждая водомеркаптановая, аминогруппа, замещенная аминородную, галогеновую, циановую, возможно замегруппа, карбамоильная, замещенная карбамоильщенную алкильную группу, или группу -ORa, -SRa ная, тиокарбамоильная, замещенная тиокарбамоили -CORb, или одна из групп X и X представляет ильная, циановая, ацильная, арильная или собой гидроксильную, а другая - одну из описангетероарильная группы Особенно предпочтиных выше групп, или X и X обе представляют сотельны замещенные алкилсодержащие группы, бой =0 или =S, включающие хлорметил, бромметил, дихлорметил, трифторметил, дифторметоксил, цианметил, Ra - возможно замещенная алкильная, арильметоксиэтил и этоксиэтил ная или ацильная группа, Rb - возможно замещенная алкильная или Любая алкеновая или алкиновая группа в моарильная группа, или группа -ORC или -NRcRd, лекуле содержит предочтительно 2-6 атомов углерода, например винил, аллил или пропаргил Rc и R d , которые могут быть одинаковыми или Любая такая алкеновая или алкиновая группа явразличными, представляют собой каждая водоляется предпочтительно незамещенной, хотя при родную или возможно замещенную алкильную или желании она может быть замещена, например, арильную группу, галогеном Y - азот или группа CR9, R1 - возможно замещенная алкильная, алкеЛюбая циклоалкильная группа в молекуле соновая, алкиновая, циклоалкильная, арильная, гедержит предпочтительно 3-7, лучше 5-6 атомов тероциклическая, бензогетероциклическая или углерода, наиболее предпочтительны циклопенаминогруппа, тановая или циклогексановая группы, лучше незамещенные R2 - водородная, возможно замещенная алкильная или карбоксильная группа, или группа Любая арильная группа в молекуле - предпочSO2R1, тительно фенольная группа, желательно замещенная одной или более алкильной, алкоксильR3 и R4, которые могут быть одинаковыми или ной, алкоксикарбонильной или алкилтиогруппой, различными, представляют собой каждая водосодержащей 1-4 атома углерода (которые сами родную, галогеновую, возможно замещенную алтакже могут быть замещены), атомами галогена, кильную, алкоксильную, циклоалкильную или амициановыми группами, аминосульфонильными ногруппу, или возможно замещенную группами или азотными группами, особенно предгетероциклическую группу, и почтительна фенольная группа, замещенная одR9 представляет собой водородную или возним или более атомами хлора, брома или фтора, можно замещенную алкильную группу, и/или одной или более метильной, метоксильной, при условии, что если Q представляет собой трифторметил ьной, метилтио-, метоксикарбоО- или -S-, кольцо А представляет собой 5нильной, этоксикарбонильной или азотной групзвенное замещенное или незамещенное гетероапами роматическое кольцо Если А является 5-звенным гетероа ром этичеЛюбая гетероциклическая группа в молекуле, ским кольцом, то это предпочтительно замещенотличная от кольца А,-предпочтительно фурилоное или незамещенное тиофеновое, фурановое, вый, тиэниловый или азотсодержащий гетероцикл, пиррольное, тиазольное, изотиазольное, пиранапример 5-ти или 6-ти звенный (пиррольный, зольное, имидазольное, оксазольное или изоксаоксазольный, изоксазольный изотиазольный, пизольное кольцо римидиновый, триазольный или имидазольный) R1 преимущественно представляет собой пириВ кольце А заместители атома углерода дильную, фурильную, тиэнильную или бицикличепредпочтительно галогеновая, циановая группа скую гетероциклогруппу (тиазолотриазольную, или группа - COOR10 (где R10 представляет собой триазолопиримидиновую или пиразолопиримидиводородную или возможно замещенную алкильновую группу) ную группу), или возможно замещенную алкильную, алкоксильную, арилоксильную, гетероциклокЛюбая бензогетероциклогруппа - предпочтисильную или аминогруппу Предпочтительными из тельно бензотиофеновая, бензодиоксольная, хиэтих групп заместителей являются фторированнолиновая, хиназольная, бензотиазольная или ные и хлорированные дигидробензофурановая группа Заместители атома азота в кольце А - предЛюбой атом галогена, представленный в мопочтительно замещенная или незамещенная аллекуле - предпочтительно фтор, хлор или бром кильная, алкоксильная, амино- или арильная Любая замещенная аминогруппа в молекуле группа, особенно метальная группа может быть моно- или дизамещенной, например, алкилом, содержащим 1-4 атома углерода, алкеЛюбая алкильная группа, представленная в нилом, содержащим 2-4 атома углерода, карбамолекуле, состоит предпочтительно из 1-8 атомов моилом или карбоксильным ацилом, алкоксикаруглерода, лучше из 1-6, оптимально - из 1-4 Особонилом, алкилкарбамоилом или бенно предпочтительны алкильные или алкилсодержащие группы, включающие метил, этил, пдиалкилкарбамоилом, в котором любая алкильная пропил, изопропил, п-бутил, t-бутил, метоксил, группа содержит 1 -4 атома углерода этоксил и п-пропоксил Термин "ацил" здесь обозначает остаток карбоновой, сульфоновой или фосфорсодержащей Если алкильная группа в молекуле замещена, кислоты, например алканоил, алкеноил, алкиноил, это может быть, например, один или более атомов циклоалканоил, аралканоил, ароил, карбамоил, галогена (фтор, хлор или бром), алкоксильная или тиокарбамоил, алкоксикарбонил, сульфонил, алкилтиогруппа, содержащая 1-4 атома углерода 44220 10 сульфамоил и фосфонил, в которых любая алгде Y, R и R описаны выше, a L - остаточная кильная, алкеновая, алкиновая или арильная группа, образуя требуемое соединение группа может быть замещенной или незамещенОстаточная группа L может быть любой из ной подходящих групп, но предпочтительно - атомом Особенно предпочтительны группы, которые галогена, особенно хлора, или метил сул ьфон ильмогут представлять R1, включающие метил, хлорной группой метил, бромметил, цианметил, трифторметил, Участвующие в реакции основания - предпоч2,2,2-трифторэтил, (метил карбамоил)метил и тительно алкиллитий (t-бутиллитий), и реакция (тиокарбамоил)метил обладает желаемым эффектом в подходящем R2 предпочтительно представляет собой ворастворителе, таком кактетрагидрофуран Дород Соединения формулы II, где R2 представляет R и R - желательно водород, метил, метоксобой водород, могут также быть приготовлены сил или хлор Особенно предпочтительно, чтобы разложением соответствующих нитросоединений R3 и R4 были идентичны, оптимально - метоксильформулы ные группы O2N Q _ Н_ . R3 Кольцо А - предпочтительно бензольное (возможно замещенное фтором, хлором, бромом, ме(V) тилом, метоксилом или этоксилом), пиридиновое или пиразольное (возможно замещенное одной или более метильными группами) Q - предпочтительно -СН2-, -СН(СНз)-, -S- или где A, Q, Y, R и R описаны выше -ОБолее эффективное разложение происходит в Соли соединений формулы I - предпочтительприсутствии хлорида олова или при использовано образованы сильными основаниями, такие как нии железа в растворе кислоты, особенно в трифщелочнометаллические соли (калия и натрия) и торуксусной кислоте и/или ангидриде, известными аминовые соли (триэтиламин, диизопропиламин, методами При этой процедуре сначала образуетциклогексиламин или пиперидиновые соли) Осося соединение, в котором нитрогруппа превращабенно предпочтительными соединениями, согласется в группу -NHCOCF3, которая затем преврано изобретению, являются соединения приведенщается в аминогруппу при воздействии ные в перечисленных ниже примерах основания, такого как карбонат калия С другой стороны, изобретение включает проСоединения формулы II могут при желании цесс приготовления сульфонамида формулы І, в быть превращены в другие соединения формулы котором соответствующий амин формулы II известными методами Например, соединения .2 формулы II, где X или X' представляют собой алкильную группу, могут быть получены из соответ(П) ствующих соединений формулы II, где Q представляет собой группу -СН2-, a R - водород, путем первоначальной защиты аминогруппы, то есть взаимодействием соединения с ди-tбутилдикарбонатом, и последующим воздействигде A, Q, Y и R - R описаны выше, реагирует ем на защищенное соединение алкилирующего с подходящим сульфоновым ангидридом формуагента, такого как метил иод ид, в присутствии лы (R1SO2hO или сульфонилгалогенидом формусильного основания, а затем снятием защиты лы R1SO2Hal, где Hal - атом галогена, a R1 - опиаминогруппы посредством трифторуксусной кисан выше, образуя требуемое соединение слоты Реакция приводит к желаемому эффекту в присутствии основания, например органического Соединения формулы V могут сами быть приоснования, такого как пиридин готовлены при помощи процесса, в котором соСоединения формулы II могут сами быть приединение формулы готовлены при помощи процесса, в котором замещенный амин формулы (VI) (III) где A, Q и R описаны выше, реагирует в присутствии основания с соединением формулы (IV) где А описано выше, a Hal представляет атом галогена, реагирует в присутствии основания с соединением, соответствующим формуле IV, где R3 и R4 описаны выше, но L представляет собой группу -QH, где Q описано выше Соединения формулы V могут также быть получены при помощи процесса, в котором нитросоединение формулы (VII) R4 О 11 44220 12 где А, В, D и Q описаны выше, a L представИсходные материалы в вышеописанных проляет собой остаточную группу (предпочтительно цессах, в особенности соединения формул III, IV, хлор или имидазол-1-группу), реагирует в присутVI, VII и VIII, являются известными соединениями ствии основания с соединением формулы или могут быть получены с помощью процессов, 3 4 3 4 R C(=NH)YHC(=NH)R , где Y, R и R описаны выаналогичных широко известным процессам полуше чения сходных соединений Основание - предпочтительно диизопропилэСоли соединений формулы I могут быть полутиламин чены известными способами из соответствующих 1 чистых соединений путем воздействия на них подСоединения формулы I, где R представляет ходящих оснований в подходящем растворителе собой группу формулы (например, эфире) К О R 2 Соединения формулы І, в которых R отличен от водорода, могут также быть получены из солей /ч соединений формулы I путем известных реакций с R ' "•"•"" \Т ~~~ \~- ___ *(""її •"''~' іч ^О подходящим алкилирующим или ацилирующим могут быть получены с помощью процесса, в 2 агентом, содержащим нужную группу R котором соответствующее соединение формулы I, 1 где R представляет собой группу формулы Соединения формулы I являются гербицидоCH3OCOCHR6, где R6, который описан выше, peaактивными против большого числа повсеместно 7 Я 7 Я распространенных и травяных сорняков, но отногирует с амином формулы R R NH, где R и R сительно безопасными для определенных кульописаны выше, образуя требуемое соединение тур Таким образом, они могут быть использованы Реакция приводит к желаемому эффекту в в качестве селективных гербицидов, особенно для присутствии подходящего умеренного основания, контроля сорняков при выращивании злаков, санапример спирта или метанола харной свеклы или других культур, таких как пшеИсходные материалы формулы І, в вышеопиница, ячмень, кукуруза, соя, рапс, хлопок или рис санном процессе, в котором R2 отличен от водоВ соответствии с этим, с другой стороны, народа, могут быть получены реакцией соединения стоящее изобретение предоставляет способ формулы II, где R2 - водород, в присутствии осноборьбы с сорняками в заросших ими местах или в вания с сульфонилхлоридрм формулы местах, где есть опасность их сильного разрастаCIO2SCHR6CO2CH3 ния, который предусматривает применение к укагде R описан выше, образуя требуемое созанным сорнякам эффективного количества одноединение го или более соединений формулы I Участвующее в реакции основание - предпочЖелательная степень применения соединетительно третичное органическое основание, наний формулы I или их солей колеблется от 0,001 пример, пиридин, при этом реакция приводит к до 2кг/га, предпочтительно от 0,005 до 1 кг/га и желаемому результату в присутствии подходященаиболее предпочтительно от 0,01 до 0,5кг/га го умеренного основания, например, дихлорметана С другой стороны, изобретение предоставляет композицию, которая включает одно или более Исходные материалы формулы І, в вышеопи2 соединений изобретения в сочетании с подходясанном процессе, в котором R отличен от водощим носителем и/или поверхностно-активным рода, могут также быть получены из соответстагентом вующих соединений, в которых R2 - водород, с помощью известной технологии ацилирования Композиции обычно содержат от 0,01 до 99%вес настоящих соединений и выпускаются Соединения формулы I, где R1 представляет первоначально в виде концентратов, содержащих собой группу формулы от 0,5 до 99%вес , предпочтительно от 0,5 до 85% S R6 и наиболее предпочтительно от 10 до 50%вес II I соединений Такие концентраты при необходимо| - Т ^ ц ^ — — ^ — — - ^ д - | "і—і сти разбавляются перед применением таким обмогут быть получены с помощью процесса, в разом, чтобы активный компонент составлял от котором соединение цианалкила формулы I, где 0,01 до 5%вес применяемого состава R1 представляет собой группу формулы NCCHR6, Носителем может быть вода, в этом случае в присутствии соответствующего умеренного расможет также присутствовать органический раствотвора, реагирует с сульфидом водорода ритель, хотя обычно он не используется Жидкая Соединения формулы II, где А представляет суспензия концентрата может быть образована 2 собой N-метилпиразольное кольцо, a R - водопутем размешивания соединения в воде с увлажрод, могут также быть получены при помощи проняющим агентом и суспензирующщим агентом, цесса, в котором диметиламиноакрилонитрил т е ксантановой смолой формулы Носителем может также быть несмешиваемый с водой органический растворитель, т е углевоNC дород с температурой кипения 130 - 270°С, например, ксилен, в котором соединение растворя(VIO) ется или суспензируется Эмульгируемый концентрат, содержащий несмешиваемый с водой растворитель, может быть образован при помощи где Q, Y, R и R описаны выше, реагирует с поверхностно-активного агента таким образом, что метил гидразином в уксусной кислоте, образуя требуемое соединение 13 44220 14 концентрат ведет себя как самоэмульгируемое как 2,4,7,9-тетраметил-5-децин-4,7-диол, или этокмасло при примешивании воды силированные ацетиленгликоли Носитель может также быть смешиваемым с Поверхностно-активные агенты могут также водой органическим растворителем, например, 2включать катионные агенты, например, ал килметоксиэтанол, метанол, пропиленгликоль, диэтии/или арилзамещенные четвертичные аммониеленгликоль, моноэтиловый эфир диэтиленгликовые соединения, такие как цетилтриметиламмоля, метилформамид или диметилформамид нийбромид, или этоксилированные третичные жирные амины Носитель может также быть твердым, хорошо размельчаемым или гранулируемым Примеры Предпочтительные поверхностно-активные подходящих твердых носителей - известняк, глиагенты включают сульфаты этоксилированных ны, песок, слюда, мел, аттапульгит, диатомит, жирных спиртов, сульфонаты лигнина, алкилперлит, сепиолит, кремнеземы, силикаты, лигноарильные сульфонаты, соли сульфонированных сульфонаты и твердые удобрения Носитель монафталенформальдегидных конденсатов, соли жет иметь натуральную или синтетическую основу сульфонированных фенолоформальдегидных или может быть получен модифицированием наконденсатов, олеоил-Ы-метилтаурид натрия, дитурального материала алкилсульфосукцинаты, алкилфенол-этоксилаты и жирные алкилэтоксилаты Смачиваемые порошки, растворимые или диспергируемые в воде, могут быть получены при Настоящие активные соединения, особенно смешивании измельченного соединения с измельприводимые в ниже перечисленных примерах, ченным носителем или разбрызгивании расплавмогут смешиваться с другими пестицидами, т е ленного соединения по измельченному носителю, гербицидами, фунгицидами или инсектицидами, примешивании увлажняющего агента и диспергиили регуляторами роста растений, в особенности рующего агента и последующем измельчении с другими гербицидами Подходящие гербициды всей порошковой смеси включают триэтазин, линурон, МСРА, дихлорпроп, изоксабен, дифлуфеникан, метолахлор, флуомеАэрозольная композиция может быть получетурон, оксифторфен, фомесафен, бентазон, прона при смешивании соединения с газомметрин, норфлуразон, хломазон, ЕРТС, имазахин, вытеснителем, т е полигалогенированным алкаболее предпочтительны изопротурон, метабенном, таким как дихлорфторметан, а также с расзтиазурон, трифлуралин, иоксинил, бромоксинил, творителем беназолин, мекопроп, флуроксипир, алахлор, Термин "поверхностно-активный агент" исацифторфен, лактофен, метрибузин и пендиметапользуется в широком смысле и включает мателин, и наиболее предпочтительны этофумесат и риалы, называемые эмульгирующими агентами, фенмедифам диспергирующими агентами и увлажняющими агентами Такие агенты хорошо известны в техноНастоящие соединения могут использоваться логии для растений, почв, земельных или водных участков, особенно на территориях, где растут или Используемые поверхностно-активные агенты должны прорасти с/х культуры Соединения акмогут включать анионные поверхностно-активные тивны как в период до, так и после критического агенты, например, моно- или диэфиры фосфорной состояния кислоты с этоксилатом жирного спирта или соли таких эфиров, сульфаты жирных спиртов, такие Изобретение иллюстрируется следующими как додецилсульфат натрия, сульфаты этоксилипримерами рованных жирных спиртов, сульфаты этоксилироПример А ванных алкилфенолов, сульфаты лигнина, сульR2 фонаты жидких углеводородов, сульфонаты алкиларилов, такие как алкилбензольные сульфонаты или низшие алкилнафталеновые сульфонаты, соли сульфонированных нафталенформальдегидных конденсатов, соли сульфонированных фенолоформальдегидных конденсатов, или более сложные сульфонаты, такие как амидные сульфонаты, например, сульфонированный продукт конденсации олеиновой кислоты и N-метилтаурина, или диалкилсульфосукцинаты, такие как натриевый сульфонат диоктилсукцината Поверхностно-активные агенты могут также включать неионные агенты, например, продукты конденсации сложных эфиров жирных кислот, жирные спирты, амиды жирных кислот или алкилзамещенные фенолы с этиленоксидом, сложные жирные эфиры поливодородных простых эфиров спиртов, такие как сорбитовые эфиры жирных кислот, продукты конденсации таких эфиров с этиленоксидом, такие как полиоксиэтиленсорбитовые эфиры жирных кислот, блоксополимеры этиленоксида и пропиленоксида, ацетиленгликоли, такие (la) R4 Пример А1 1 т 1 т 1 -Трифтор-21(4,6диметоксипиримидин-2-ил метил) метансульфона нилид (а) 2-(4,6-Диметоксипиримидин-2илметил)анилин Способ 1 п-Бутил лития (21мл 2,5М в гексане) добавляли по каплям при перемешивании к раствору отолуидина (5,35г) в обезвоженном тетрагидрофуране (100мл) при -70°С в атмосфере азота Полученную суспензию нагрели до 5°С, получив блед 15 44220 16 но-желтый раствор Обезвоженный диоксид угле(Ь) 1,1,1-Трифтор-2'-(4,6-диметоксипиримидинрода пропускали через смесь в течение 6 минут 2-илметил)метансульфон-анилид Растворитель удалили при перемешивании в усТрифторметансульфоновый ангидрид (1,12г) ловиях глубокого вакуума при комнатной темперадобавляли по каплям при перемешивании к растуре, получив белое твердое вещество Его разтвору 2-(4,6-диметоксипиримидин-2мешали в виде суспензии в чистом илметил)анилина (0,98г) плюс пиридин (0,31 г) в тетрагидрофуране и охладили до -70°С в атмообезвоженном дихлорметане (15мл) при -70°С в сфере азота t-Бутил лития (70мл 1,6М в пентане) атмосфере азота Полученный оранжевый расдобавляли по каплям в течение 15 минут Смеси твор перемешивали при -75°С в течение 2 часов и затем дали нагреться до -15°С и перемешивали затем дали нагреться до комнатной температуры при этой температуре в течение 75 минут Смесь и перемешивали в течение последующего часа охладили до -70°С и добавляли по каплям раствор Смесь промыли водой, высушили и выпарили до 4,6-диметокси-2-метилсульфонилпиримидина получения красного масла Очистка методом хро(Юг) в тетрагидрофуране Смесь перемешивали матографии и перекристаллизация из 60/80 петпри -75°С в течение бОмин и затем при комнатной ролейного эфира дали 0,4г продукта в виде белотемпературе в течение ночи Растворитель удаго твердого вещества с температурой плавления лили под вакуумом и к остатку добавили 2 N соля99-100°С ную кислоту в атмосфере азота при охлаждении Пример А2 ледяной водой Затем добавили 250мл воды, и 1 1,1-Трифтор-2'-[1-(4,6-диметоксипиримидинмутный раствор был выщелочен насыщенным 2-ил)этил'1метансульфонанилид раствором бикарбоната натрия и экстрагирован (a) t-Бутил [2-(4,6-диметоксипиримидин-2этиловым эфиром (2 х 400мл) Смешанные эксилметил)фенил]карбамат тракты были промыты насыщенным раствором Раствор продукта стадии (а) Примера А (21,1 г) хлорида натрия, высушены и выпарены до полуи ди-трет-бутил-дикарбонат (24г) орошали в обезчения оранжевого масла, которое было очищено воженном тетрагидрофуране (250мл) в атмосфере путем хроматографии, в результате чего получено азота в течение 4 часов Растворитель выпарили 2кг продукта в виде желтого твердого вещества с до получения коричневого масла, которое затем температурой плавления 82 - 84°С выкристаллизовали из гексана (200мл), получив 28г требуемого соединения в виде светлоСпособ 2 коричневого твердого вещества с температурой (і) 4,6-Диметокси-2-(2-нитробензил)пиримидин плавления 98 - 100°С Этилдиизопропиламин (240мл) добавляли по каплям при перемешивании к суспензии дигидро(b) t-Бутил [2-[1-(4,6-диметоксипиримидин-2хлорида диметилмалонимидата (73,2г) в дихлорил)этил]фенил карбамат метане (400мл) при -40°С в атмосфере азота, Продукт вышеописанной стадии (а) (1г) рассмесь перемешивали при -40°С в течение 25 митворили в обезвоженном тетрагидрофуране нут до получения суспензии А 2(20мл) и добавляли тетраметилэтилендиамин Нитрофенилуксусную кислоту (65,16г) добавляли (1,1мл) в атмосфере азота Раствор охладили до порциями при перемешивании к суспензии карбо70°С и добавляли по каплям 1,7М раствор tнилдиимидазола (53,Зг) в дихлорметане (400мл) бутиллития в пентане (4,3мл) Смесь затем перепри комнатной температуре Полученный раствор мешивали при температуре около -20°С в течение перемешивали в течение 10 минут и добавляли по 1 часа Затем ее охладили до -70°С и добавили каплям более ЗОмин к суспензии А при -40°С метилиодид (0,45г) Реакционной смеси дали наСмесь перемешивали при -40°С в течение послегреться до 0°С и добавили насыщенный раствор дующих 45 минут и затем при комнатной темперахлорида аммония (25мл) Смесь экстрагировали туре в течение ночи, после чего полученный растетрагидрофураном (3 х 50мл), затем смешанные твор промыли водой (400мл), 2N HCI (400мл) и экстракты высушили и выпарили до получения насыщенным раствором бикарбоната натрия бледно-коричневого твердого вещества, после (400мл), высушили и выпарили до получения растирания которого с гексаном получили 0,73г оранжевого твердого вещества Затем его разметребуемого продукта с температурой плавления шали с пропан-2-олом (50мл) в течение 10 минут и 119-121 °С отфильтровали Твердое вещество промыли 50мл (c) 2-[1-(4,6-Диметоксипиримидин-2пропан-2-ола и затем высушили до получения ил)этил]анилин 32,6г требуемого продукта в виде желтого твердоПродукт стадии (Ь) (5,0г) добавляли ктрифтого вещества с температурой плавления 92 - 93°С руксусной кислоте (25мл) и полученный раствор перемешивали при комнатной температуре в те(и) 2-(4,6-Диметоксипиримидин-2-ил метил) чение 3 часов Раствор выпарили, остаток растеранилин ли в порошок с диизопропиловым эфиром и охлаПродукт стадии (і) (32,6г) добавляли при педили в бане из двуокиси углерода-ацетона ремешивании к суспензии дигидрата хлорида олоТвердое вещество отфильтровали и промыли ва (133г) в этаноле (300мл) После орошения в диизопропиловым эфиром до получения 3,5г третечение 2 часов раствор вылили в ледяную воду буемого продукта с температурой плавления 136 (2500мл) и экстрагировали этилацетатом (3 х 139°С 500мл) Смешанные экстракты промыли насыщенным раствором хлорида натрия, высушили и (d) 1,1,1-Трифтор-2'-[1-(4,6выпарили до получения 24,Зг требуемого продукта диметоксипиримидин-2в виде коричневого твердого вещества с темпераил)этил]метансульфонанилид турой плавления 82 - 84°С 17 44220 18 Начиная с продукта стадии (с), указанное солучения оранжевого масла, которое растерли с единение было получено способом, аналогичным гексаном, получив 5,35г требуемого продукта в описанному в стадии (Ь) Примера А1, температура виде бледно -желтого твердого вещества с темпеплавления 132- 133°С ратурой плавления 89 - 92°С Пример A3 (с) І\І-[3-(4,6-диметоксипиримидин-2-илметил)2-пиридил]-1,1,1-трифторметансульфонамид 1,1,1-Трифтор-2'-(4,6-диметокси-1,3,5-триазин2-илметил)метансульфонанилид Начиная с продукта стадии (Ь), указанное со(a) 2,4-Диметокси-6-(2-нитробензил) -1,3,5единение было получено способом, аналогичным триазин описанному в Примере А1 (Ь), температура плавления 124- 126°С Карбонилдиимидазол (3,34г) добавляли порциями при перемешивании к суспензии 2Примеры А5 - А17 нитрофенилуксусной кислоты (3,4г) в дихлорметаСледующие соединения формулы la, где А 5 2 3 4 не 30мл), и смесь перемешивалась при комнатной =CR -, Q - -СН2-, R -Н, В, D и Е - =СН-, R и R температуре в течение ЗОмин Полученный красметоксильные группы, могут быть получены споный раствор добавляли по каплям при перемешисобами, аналогичными описанным в Примере А1 вании к суспензии цинковой соли диметилимидо5 1 дикарбонимидата (3,0г) в дихлорметане (25мл) Эксп Y R R M Pt(°C) при -35°С Реакционную смесь перемешивали при А5 СН Н CH2CN 116-117 комнатной температуре в течение ночи и затем вылили в воду (100мл) Смесь экстрагировали А6 СН CI CH2CN 162-163 дихлорметаном (3 х 50мл), смешанные экстракты А7 СН CI 113-115 CF3 были высушены и выпарены до получения красного масла, которое растерли с этиловым эфиром, А8 СН F CH2CN 162-163 получив 1,41 г требуемого продукта в виде бледноА9 СН F 100-102 CF3 коричневого твердого вещества с температурой плавления 91,6-92,3°С А10 СН Me CH2CN (b) 1,1,1-Трифтор-2'-(4,6-диметокси-1,3,5триазин-2-илметил)метасульфонанилид Начиная с продукта стадии (а), указанное соединение было получено способом, аналогичным описанному в Примере А1 (а), Способе 2 (и) и А1 (Ь), температура плавления 101 - 108°С Пример А4 N- [3-(4,6-диметоксипиримидин-2-илметил)-2пиридил] -1,1,1-трифторметансульфонамид (a) t-Бутил (3-метил-2-пиридил)карбамат Раствор 2-амино-З-метилпиридина (20г) плюс ди-1:-бутилдикарбонат (46,8мл) в обезвоженном тетрагидрофуране орошали в течении 3 часов Раствор выпарили, получив темно-коричневое масло Его растворили в этилацетате (400мл), промыли 1,0 N лимонной кислоты (3*200мл) и насыщенным раствором хлорида натрия, высушили и выпарили до получения бледно-желтого твердого вещества, которое выкристаллизовали из смеси гексана и диизопропилового эфира (1 2), получив 6,5 грамма требуемого соединения в виде бледножелтого твердого вещества с температурой плавления 135- 137°С (b) t-Бутил [3-(4т6-диметоксипиримидин-2илметил)-2-пиридил]карбамат п-Бутиллитий (19,2мл 2,5М раствора в гексане) добавляли по каплям при перемешивании к суспензии продукта стадии (а) (5,0г) в обезвоженном тетрагидрофуране (100мл) в атмосфере азота при -70° С Смесь перемешивали при -70°С в течение 20 минут и затем при 5° С в течение 3 часов Затем охладили до -70°С и обработали 4,6диметокси-2-метилсульфонил пиримидином (5,42г), после чего смесь перемешивали при -70°С в течение 1 часа, затем при комнатной температуре в течение ночи Добавили насыщенный раствор хлорида аммония (500мл) и затем экстрагировали смесь этилацетатом (2* х 100мл) Смешанные экстракты промыли насыщенным раствором хлорида натрия (50мл), высушили и выпарили до по А11 СН Me CF3 А12 N F CH2CN А13 N F CF3 А14 N Me CH2CN А15 N Me CF3 А16 А17 N CI CH2CN N CI CF3 оранж масло 31 оранж масло Примеры А18- А20 Следующие соединения формулы la, где А азот, Q - -СН2-, R2 - Н, В, D и Е - =СН-, R3 и R4 метоксильные группы, могут быть получены способами, аналогичными описанным в Примере А1 Y R1 А18 СН CH2CN А19 N CH2CN А20 N CF3 Эксп М Pt(°C) Примеры А21 - А68 ,2 Следующие соединения формулы la, где R водород, R3 и R4 -метоксильные группы, a Q - СН2-, могут быть получены способами, описанными ниже Y R1 A В D E А21 СН CF3 N N CH CH А22 СН CF3 N CH N CH А23 СН CF3 N CH CH N А24 СН CF3 CH N N CH А25 СН CF3 CH N CH N Ех 19 A26 СН CF3 CH CH N N A27 СН CF3 CCI A28 СН CF3 CCI N N CH N CH N A29 СН CF3 CCI CH N N АЗО СН CF3 CF N N CH А31 СН CF3 CF N CH N А32 СН CF3 CF CH N N АЗЗ СН CH2CN N N CH CH А34 СН CH2CN N CH N CH А35 СН CH2CN N CH CH N А36 СН CH2CN CH N N CH А37 СН CH2CN CH N CH N А38 СН CH2CN CH CH N N А39 СН CH2CN CCI N N CH А40 СН CH2CN CCI N CH N А41 СН CH2CN CCI CH N N А42 СН CH2CN CF N N CH А43 СН CH2CN CF N CH N А44 СН CH2CN CF CH N N А45 N CF3 N N CH CH А46 N CF3 N CH N CH А47 N CF3 N CH CH N А48 N CF3 CH N N CH А49 N CF3 CH N CH N А50 N CF3 CH CH N N А51 N CF3 CCI N N CH А52 N CF3 CCI N CH N А53 N CF3 CCI CH N N А54 N CF3 CF N N CH А55 N CF3 CF N CH N А56 N CF3 CF CH N N А57 N CH2CN N N CH CH А58 N CH2CN N CH N CH А59 N CH2CN N CH CH N А60 N CH2CN CH N N CH А61 N CH2CN CH N CH N А62 N CH2CN CH CH N N А63 N CH2CN CCI N N CH А64 N CH2CN CCI N CH N А65 N CH2CN CCI CH N N А66 N CH2CN CF N N А67 N CH2CN CF N А68 N CH2CN CF CH 44220 20 a Q - -CH2-, могут быть получены способами, описанными ниже Эксп Y R1 R5 в D E А69 СН CF3 H N CH CH А70 СН CF3 H CH N CH А71 СН CF3 H CH CH N А72 СН CF3 Cl N CH CH А73 СН CF3 Cl CH N CH А74 СН CF3 Cl CH CH N А75 СН CF3 F N CH CH А76 СН CF3 F CH N CH А77 СН CF3 F CH CH N А78 СН CH2CN H N CH CH А79 СН CH2CN H CH N CH А80 СН CH2CN H CH CH N А81 СН CH2CN Cl N CH CH А82 СН CH2CN Cl CH N CH А83 СН CH2CN Cl CH CH N А84 СН CH2CN F N CH CH А85 СН CH2CN F CH N CH А86 СН CH2CN F CH CH N CH M CH ИГС) А87 N CF3 H N А88 N CF3 H CH N CH А89 N CF3 H CH CH N А90 N CF3 Cl N CH CH А91 N CF3 Cl CH N CH А92 N CF3 Cl CH CH N А93 N CF3 F N CH CH А94 N CF3 F CH N CH А95 N CH2CN F CH CH N А96 N CH2CN H N CH CH А97 N CH2CN H CH N CH А98 N CH2CN H CH CH N А99 N CH2CN Cl N CH CH А100 N CH2CN Cl CH N CH А101 N CH2CN Cl CH CH N А102 N CH2CN F N CH CH А103 N CH2CN F CH N CH А104 N CH2CN F CH CH N CH А105 СН CH2CN H CH CCI CH CH N А106 СН CH2CN H CH CF N N А107 СН CF3 H CH CF 175176 110CH 111 CH А108 СН CF3 Примеры А69-А126 Следующие соединения формулы la, где R2 водород, R3 и R4 - метоксильные группы, А - =CR -, H CH CBr CH А109 СН CH2CN F CH CF CH А110 H CH CH CH N CH2CN 21 A111 CH CF3 F CH CF CH A112 СН СН2СІ F CH CF CH A113 СН Me F CH CF CH Cl CH CCI CH A115 СН CH2CN F CH CMe CH A116 СН CH2CI Cl CH CH CH N CH 2 CN Cl CH CCI CH A118 СН CH 2 CN F CH C(OMe) CH A114 СН CH2CN A117 A119 СН CH 2 CN Оме CH CF CH A120 СН CH 2 CN F CH C(OEt) CH A121 N CH2CI F CH CH CH A122 СН CH2CI F CH CH CH A123 СН CH 2 Br F CH CH CH A124 СН CH 2 CF F CH CH CH A125 СН CH2CF3 Cl CH CH CH 161 163 189190 115116 141 142 138139 137138 141 142 153154 Примеры А126- А127 Следующие соединения формулы la, где R2 водород, R3 и R4 - метоксильные группы, А - =CR-, a Q - -СНМе-, могут быть получены способами, описанными ниже Эксп Y R1 R5 в D Е А126 СН CH2CN Н СН СН СН А127 СН CH2CN CI СН СН СН м Pt(°C) 133135 133135 Пример В Пример В1 |\|-[3-(4т6-диметоксипиримидин-2-илтио)-1,5диметил-1 Н-пиразол-4-ил]-1,1,1трифторметаметанесульфонамид и N-[5-(4,6диметоксипиримидин-2-илтио)-1,3-диметил-1 Нпиразол-4-ил]-1,1,1 -трифторметане сульфонамид (а) 5-(4,6-Диметоксипиримидин-2-илтио)-3метил-4-нитро-1 Н-пиразол 4,6-Диметокси-2-меркатопириминин (4,65г) растворяли в воде, содержащей гидроксид калия (1,7г в 75мл воды) Затем добавляли по каплям 1,4-динитро-З-пиразол (4,65г), растворенный в минимальном количестве этанола Осевшую после экзотермической реакции смесь перемешивали в течение 45 минут Твердый осадок отфильтровали, промыли водой и высушили, получив 6,3г 44220 22 требуемого продукта с температурой плавления 175-6°С (b) 5-(4,6-Диметоксипиримидин-2-илтио)-1,3диметил-4-нитро-1 Н-пиразол и 3-(4,6диметоксипиримидин-2-илтио)-1,5-диметил-4нитро-1 Н-пиразол Продукт стадии (а) (3,15г) добавляли порциями при перемешивании к кашице 60% гидрида натрия (0,47г) в обезвоженном диметилформамиде (20мл) с охлаждением в ледяной бане По окончании добавления реакционную смесь перемешивали в течение 10 минут при комнатной температуре Затем по каплям добавляли иодметан (1,7г), смесь перемешивали при комнатной температуре в течение 2,5 часов, затем вылили в ледяную воду (50мл) После этого экстрагировали этилацетатом (3 х 50мл) Смешанные экстракты промыли водой и высушили над сульфатом магния Фильтрация с последующим выпариванием превратила сырой продукт в масло Сырой продукт подвергли хроматографии в тонком слое на силикагеле, используя смесь 1 1 этилацетата и 40 - 60°-ного бензина в качестве элюента Два новых продукта были разделены Выпаривание фракций, содержащих чистые продукты, дает два различных твердых материала Хроматография в тонком слое на пластинах силикагеля, использующая злюент в виде смеси 1 1 этилацетата и 40 - 60°-ного бензина, дает один продукт с Rf около 0,75 (т е 5-(4,6диметоксипиримидин-2-илтио -1,3-диметил-4нитро-1 Н-пиразол), а другой - с Rf около 0,3 (т е 3(4,6-диметоксипиримидин-2-илтио)-1,5-диметил-4нитро-1 Н-пиразол Выход первого продукта - 1,3г, температура плавления 124-5°С Выход второго продукта - 0,82г, температура плавления 155-6°С (c) 3-(4,6-Диметоксипиримидин-2-илтио)-1,5диметил-1 ІЧ-пиразол-4-амин и 5-(4,6Диметоксипиримидин-2-илтио)-1,3-диметил-1 Nпиразол-4-амин Смесь продукта стадии (b) (Rf 0,3) (2,4г) и дигидрата хлорида олова (8,7г) в этаноле (100мл) перемешивали при орошении в течение 4 часов Затем этанол удалили под вакуумом Остаток размешали в воде (100мл) и выщелочили твердым гидрокарбонатом натрия Добавили этилацетат (100 мл) и эмульсию отфильтровали Затем органический слой отделили Твердые вещества промыли свежими порциями этилацетата (всего 75мл), а водный слой экстрагировали еще два раза этилацетатом (2 х 50мл) Смешанные органические слои промыли водой (50мл), затем разделили После высушивания над сульфатом магния этилацетат выпарили до получения кристаллизующегося масла Сырой продукт очистили путем хроматографии в тонком слое на силикагеле с этилацетатом в качестве элюента Новый продукт с Rf 0,3 отделили Выпаривание фракций, содержащих чистый новый продукт, дало 1,33г твердого вещества с температурой плавления 104-5°С Подобная процедура была проделана для получения второго изомера с выходом 2,6г, температура плавления 74 - 75°С (d) І\І-[3-(4,6-диметоксипиримидин-2-илтио)1,5-диметил-11\1-пиразол-4-ил1-1,1,1 23 44220 24 трифторметансульфонамид (В1а)и N-[5-(4,6Смесь диметилацеталя диметилформамида диметоксипиримидин-2-илтио)-1,3-диметил-1 N(5,8г) и 2-(4,6-диметоксипиримидин-2пиразол-4-ил]-1,1,1 -трифторметансульфонамид илтио)ацетонитрила (5,1 г) перемешивали при (Bib) 100°С на масляной бане в течение 5 часов Реакционную смесь оставили стоять при комнатной Трифторметансульфоновый ангидрид (1,2г) в температуре на ночь После растирания сырого обезвоженном дихлорметане (10мл) добавляли по продукта (твердое вещество) с диизопропиловым каплям при перемешивании к раствору аминопиэфиром получили требуемый продукт в виде желразола (Rf 0,3, 1,2г), полученному на стадии (с), и того твердого вещества с выходом 5,4г пиридина (0,33г) в обезвоженном дихлорметане (30мл) при -60°С (на бане из сухого льда/ацетона) (b) 4-(4,6-Диметоксипиримидин-2-илтио)-1По окончании добавления смеси дали медленно метилпиразол-3-амин и 4-(4,6нагреться до комнатной температуры, и перемедиметоксипиримидин-2-ил-тио)-1-метил пиразол-5шивание продолжали всю ночь Полученный темамин но-красный раствор разбавили до 100мл свежим Продукт стадии (а) (2,6г) смешали с ледяной дихлорметаном, промыли водой (25мл), 1 М НСІ уксусной кислотой (10мл) и добавляли по каплям (25мл) и водой (25мл) и затем отделили, а органиметилгидразин (1,0г) Смесь затем нагревали до ческий слой высушили над сульфатом магния 100°С на масляной бане в течение 3 часов, дали После фильтрации с последующим выпариванием охладиться и вылили в воду (100мл) После этого образовалось темно-красное полутвердое вещесмесь нейтрализовали гидрокарбонатом натрия и ство Хроматография в тонком слое на силикагеле экстрагировали этилацетатом (3 х 75мл) Смес элюентом в виде смеси 1 1 этилацетата и 60 - 80 шанные органические слои промыли водой (30мл), бензина дала новый продукт с Rf 0,5 Выпариваразделили и высушили над сульфатом магния ние фракций, содержащих чистый новый продукт, После фильтрации и последующего выпаривания дало требуемый продукт (ВІа) в виде белого тверполучили масло Хроматография в тонком слое на дого вещества с выходом 0,83г, температура силикагеле с чистым этилацетатом в качестве плавления 203-4°С элюента дала по существу один компонент (Rf 0,3) Чистые фракции смешали и выпарили до Подобная процедура была проделана для попревращения в грязно-белое твердое вещество с лучения второго изомера (Bib) с выходом 1,8г, выходом 2,2г 1HNMR показывает смесь 50/50 температура плавления 145-6°С двух возможных изомерных продуктов ПолученПример В2 ные изомеры затем разделили методом жидкост1-Циан-1\1-[3-(4,6-диметоксипиримидин-2ной хроматографии высокого разрешения После илтио)-1,5-диметил-1 Н-пиразол-4выпаривания фракций, содержащих отдельные ил]метансульфонамид (В2а) и 1-циан-1\1-[5-(4,6чистые изомеры, получили оба продукта в виде диметоксипиримидин-2-илтио)-1,3-диметил-1 Нпочти бесцветных кристаллов пиразол-4-ил]метансульфонамид (В2Ь) Аминопиразол из стадии (с) Примера В1 (Rf Один полученный продукт (А) имел выход 0,3, 0,8г) растворили в обезвоженном дихлорме480мг, температуру плавления 110-111 °С (те 4тане (10мл) при перемешивании Добавили обез(4,6-Диметоксипиримидин-2-илтио) -1воженный пиридин (0,23г) Смесь охладили до метилпиразол-3-амин) Другой полученный про78°С (на бане из сухого льда/ацетона), затем додукт (В) (те 4-(4,6-диметоксипиримидин-2-илтио)бавляли по каплям цианметансульфонилхлорид 1-метилпиразол-З-амин) имел выход 800мг и тем(0,4г, 0,00285моль) Смеси дали медленно напературу плавления 160 - 161 °С греться до комнатной температуры и перемеши(c) 1 -Циан-І\І-[4-(4,6-диметоксипиримидин-2вали в течение двух дней Затем ее разбавили до илтио)-1 -метил-1 Н-пиразол-5100мл этилацетатом и промыли водой, 1М HCI и ил]метансульфонамид и 1-циан-1\1-[4-(4,6водой, разделили и органический слой высушили диметоксипиримидин-2-илтио)-1-метил1Ннад сульфатом магния После фильтрации и выпиразол-3-ил]-метансульфонамид паривания получили сырой продукт ХроматограПиразол (А) из стадии (Ь) (475мг) растворили фия в тонком слое на силикагеле с диэтиловым в дихлорметане (10мл) при перемешивании Заэфиром в качестве элюента дала новый продукт с тем смесь охладили до -78°С (баня из сухого Rf 0,4 (приблизительно) Чистые фракции смешальда/ацетона) и добавили пиридин (0,15мл) Чели и выпарили до получения требуемого продукта рез шприц по каплям добавили цианметансуль(В2а) в виде желтого твердого вещества (700мг) с фонилхлорид (250мг) в дихлорметане (1мл) Сметемпературой плавления 166 - 7°С си дали медленно нагреться до комнатной температуры и перемешивали в течение ночи Подобная процедура была проделана для поПосле разбавления до 100мл этилацетатом смесь лучения второго изомера (В2Ь) в виде твердого промыли водой (30мл), разбавленной соляной вещества с выходом 1,6г кислотой (2 х 30мл) и насыщенным раствором Пример ВЗ хлорида натрия (30мл) Органический слой отде1-Циан-1\1-[4-(4т6-диметоксипиримидин-2лили и высушили над сульфатом магния После илтио)-1 -метил-1 Н-пиразол-5-ил]фильтрации с последующим выпариванием полуметансульфонамид (ВЗа) и 1-циан-1\1-[4-(4,6чили грязно-белое твердое вещество (те 1-циандиметоксипиримидин-2-илтио)-1-метил-1 Н|\|-[4-(4,6-диметоксипиримидин-2-илтио)-1-метилпиразол-3-ил]метансульфонамид (ВЗЬ) 1Н-пиразол-5-ил]-метансульфонамид) (ВЗа), кото(а) 2-(4,6-Диметоксипиримидин-2-илтио)-3рое перекристаллизовали из этанола, с выходом (диметиламино)акрило-нитрил 350мг, температура плавления 206-7°С Другой 25 44220 26 изомер (ВЗЬ) был получен подобным методом, вили иодметан (2,6г) одной порцией, вызвав бурначиная с пиразола (В) из вышеописанной стадии ную экзотермическую реакцию Смесь перемеши(Ь), с выходом 650мг, температура плавления 147вали при температуре окружающей среды в о течение ночи, затем разбавили до 100мл водой и экстрагировали диэтиловым эфиром (4 порции по Пример В4 50мл) Смешанные экстракты промыли водой г\1-[3-(4,6-диметокси-1,3,5-триазин-2-илметил)(30мл), высушили над сульфатом магния, от1,5-диметил-1 Н-пиразол-4-ил]-1,1,1фильтровали и выпарили, получив 3,2г требуемотрифторметансульфонамид го продукта, состоящего из смеси изомеров, в ви(a) Диэтил (5-метил-4-нитропиразол-3де жирного твердого вещества ил)малонат Диэтилмалонат (9,4г) добавляли по каплям (e) (1,5-диметил-4-нитро-1 Н-пиразол-3при перемешивании, с охлаждением на ледяной ил)уксусная кислота и (1,3-Диметил-4-нитро-1 Нбане, к кашице гидрида натрия (2,3г 60%) в обезпиразол-5-ил) уксусная кислота воженном тетрагидрофуране (100мл) Смесь пеПродукт предыдущей стадии (3,2г) смешали с ремешивали в течение 10 минут при температуре этанолом (25мл) Добавили раствор гидроксида ледяной бани, затем маленькими порциями в текалия (1,7г) в воде (25мл) и перемешивали смесь чение более 10 минут добавляли 1,5-динитро-Зпри орошении в течение 3 часов Затем выпарили метилпиразол (5,0г), поддерживая температуру 10 ее почти до сухого состояния и разбавили до 50мл - 12°С, после чего смесь перемешивали в течение водой Раствор подкислили концентрированной 30 минут при комнатной температуре В течение 5 кислотой и выпарили, остаток растворили в этилминут постоянно добавляли ледяную уксусную ацетате, промыли водой и высушили над сульфакислоту, затем разбавили смесь этилацетатом том магния После фильтрации и выпаривания (400мл), промыли водой (2 порции по 30мл) Орполучили 2,56г требуемого продукта, состоящего ганический слой отделили и высушили над сульиз смеси изомеров, в виде оранжевого твердого фатом магния После фильтрации с последующим вещества выпариванием получили масло, которое затем (f) 2-(1,3-Диметил-4-нитро-1 Н-пиразол-5отвердили путем растирания с 60 - 80°-ным бенилметил)-4,6-диметокси-1,3,5-триазин и 2-(1,5зином до превращения в 7,5г требуемого продукта диметил-4-нитро-1Н-пиразол-3-илметил)-4,6в виде бледно-желтого твердого вещества с темдиметокси-1,3,5-триазин пературой плавления 100 - 102°С Продукт предыдущей стадии (2,56г) растворили в атмосфере азота в обезвоженном дихлорме(b) (5-Метил-4-нитропиразол-3-ил)уксусная китане (50мл), атмосфера азота была сохранена слота для всех последующих операций Добавили карСмесь гидроксида калия (5,9г), продукт пребонилдиимидазол (2,0г) и перемешивали смесь в дыдущей стадии (7,5г) и 50% водный раствор этатечение 30 минут, перед тем как добавить по капнола (100мл) перемешивали при орошении в телям к перемешиваемой смеси цинковую соль дичение 1,5 часа, затем дали охладиться, выпарили метилимидодикарбонимидата (2,1 г) и дихлормепочти до сухого состояния, разбавили водой тан (50мл) при -35°С По окончании смеси дали (100мл) и подкислили концентрированной соляной нагреться до комнатной температуры и перемекислотой Результирующую смесь нагревали при шивали в течение ночи Добавили воду (50мл) и около 80°С в течение 1/2 часа После охлаждения дихлорметан (50мл) и отфильтровали смесь Засмесь выпарили до сухого состояния Остаток обтем ее разделили и водный слой экстрагировали работали этилацетатом (100мл) и промыли водой дихлорметаном (3 порции по 30мл) Смешанные (2 порции по 20мл) Органический слой отделили органические слои промыли водой и высушили и высушили над сульфатом магния После фильтнад сульфатом магния После выпаривания полурации и выпаривания получили 3,85г требуемого чили 3,8г сырого продукта Хроматография в тонпродукта в виде желтого твердого вещества ком слое на силикагеле с этилацетатом в качестве (c) Метил (5-метил-4-нитропиразол-3элюента дала два новых продукта, Rf 0,6 и Rf окоил)ацетат ло 0,4 Фракции, содержащие продукты, были выПродукт предыдущей стадии (3,85г) растворипарены до получения ли в метаноле (75г), содержащем несколько капель концентрированной серной кислоты ПереRf 0,6 1,0г 2-(1,3-диметил-4-нитро-1Нмешиваемую смесь кипятили при орошении в имидазол-5-ил)-4,6-диметокси-1,3,5-триазина, в течении 2 часов, затем дали охладиться Метанол виде кристаллического твердого вещества, и удалили под вакуумом, а остаток растворили в Rf 0,4 1,0г 2-(1,5-диметил-4-нитро-1Нэтилацетате и промыли водой Органический слой имидазол-3-ил)-4,6-диметокси-1,3,5-триазина, отделили и высушили над сульфатом калия Потемпература плавления около 145°С сле фильтрации с последующим выпариванием (д) 2-(4-Амино-1,5-диметил-1 Н-имидазол-3получили 4,Ог требуемого продукта в виде твердоилметил)-4,6-диметокси-1,3,5-триазин го вещества цвета сливок, температура плавления 10%-й палладий на древесном угле (около 132-3°С 10мг) суспендировали в воде (5мл) и добавили раствор боргидрида натрия (0,13г) в воде (5мл) (d) Метил(1,5-диметил-4-нитро-1 Н-пиразол-3Через смесь пропустили газообразный азот и доил)ацетат и метил (1,3-диметил-4-нитро-1 Нбавляли по каплям продукт предыдущей стадии Rf пиразол-5-ил)ацетат 0,4 (0,5г) в метаноле (30мл) в течение 5мин Продукт предыдущей стадии (3,3г) добавляли Смесь оставили при комнатной температуре на 30 при перемешивании к смеси карбоната калия минут, после чего добавили уксусную кислоту (2,5г) и диметилформамида (30мл) Затем доба 27 44220 28 (1мл) Смесь отфильтровали, промыли свежим ли и высушили над сульфатом магния, удалив метанолом, выпарили почти до сухого состояния, растворитель Остаток очистили методом хромаостаток разбавили до 15мл водой, нейтрализоватографии, используя в качестве элюента бензин ли безводным гидрокарбонатом натрия, экстраги(60 80) / этилацетат (8 2), получив 5,0г требуемого ровали етилацетатом (З порции по 30мл) и высупродукта с температурой плавления 160-2°С шили над сульфатом магния После фильтрации и (d) 5-(4,6-диметоксипиримидин-2-илтио)-1,2выпаривания получили 400мг требуемого продукдиметил-1 Н-имидазол-4-амин та в виде оранжевого вязкого маслаю Продукт предыдущей стадии (5,4г) растворили в метаноле (200мл), добавили карбонат калия (п) 1\1-[3-(4,6-диметокси-1,3,5-триазин-2(1,5г), и реакционную смесь нагревали при орошеилметил)-1,5-диметил-1 Н-пиразол-4-ил]-1,1,1нии в течение 6 часов Затем ее отфильтровали, трифторметансульфонамид удалили растворитель и остаток перекристаллиПродукт предыдущей стадии (0,4г) и пиридин зовали из ацетонитрила, получив 2,6г требуемого (0,13мл) смешали и охладили до -60°С в дихлорпродукта метане (15мл) Медленно по каплям добавили трифторметансульфоновый ангидрид (0,43г) в (e) 1-циан-1\1-[5-(4,6-диметоксипиримидин-2дихлорметане (5мл), затем смеси дали медленно илтио)-1,2-диметил-1 Н-имидазол-4нагреться до комнатной температуры, при которой ил]метансульфонамид ее перемешивали в течение 24 часов Затем ее Продукт предыдущей стадии (1,0г) растворили промыли водой (10мл), разделили и высушили в дихлорметане (10мл), добавили пиридин (0,Зг), и над сульфатом магния После фильтрации с пореакционную смесь охладили до -45°С Затем доследующим выпариванием получили 100мг требавили одной порцией цианметилсульфонилхлобуемого продукта в виде бледно-желтого вязкого рид (0,5г) и перемешивали смесь в течение помасла следующих 30 минут при -45°С После этого ей дали нагреться до комнатной температуры и пеПример В5 ремешивали при комнатной температуре в тече1-циан-1\1-[5-(4,6-диметоксипиримидин-2ние ночи Затем ее вылили в воду, экстрагировали илтио)-1,2-диметил-1 Н-имидазол-4этилацетатом и очистили путем хроматографии, ил]метансульфонамид используя в качестве элюента бензин (60 80) / (a) 1,2-диметил-4-бром-5-нитро-1Н-имидазол и этилацетат (8 2), получив 0,7г требуемого продук1,2-диметил-5-бром-4-нитро-1 Н-имидазол та с температурой плавления 223 - 225°С 2-Метил-4-бром-5-нитроимидазол (35г) растворили в водном растворе гидроксида натрия Пример В6 (7г) По каплям добавили диметилсульфат (21,Зг) 1-Циан-1\1-[2-(4,6-диметоксипиримидин-2при комнатной температуре, и реакционную смесь илтио)-3-тиэнил]метансульфонамид перемешивали в течение 2 часов После этого (a) 4,6-Диметокси-2-(3-нитро-2-тиэнилтио) пирезультирующий осадок отфильтровали, промыли римидин водой и высушили, получив ЗЗг смеси изомеров, Гидроксид натрия (1,2г) растворили в воде которую разделили при помощи хроматографии, (50мл), добавили 4,6-диметокси-2используя в качестве элюента бензин (60 80) / меркаптопиримидин (5,3г) и перемешивали смесь этилацетат (8 2), при этом получили 9,4г 1,2при комнатной температуре в течение 15 минут 2диметил-4-бром-5-нитро-1Н-имидазола с темпеХлор-3-нитротиофен (5,0г), растворенного в этаратурой плавления 98-9°С и 19,3г 1,2-диметил-5ноле (50мл), добавили при перемешивании, после бром-4-нитро-1Н-имидазола с температурой чего смесь перемешивали при комнатной темпеплавления 160- 162°С ратуре в течение 6 часов Результирующий осадок отфильтровали, промыли водой и высушили, по(b) 5-(4,6-диметоксипиримидин-2-илтио)-1,2лучив 7,6г требуемого продукта с температурой диметил-4-нитро-1 Н-имидазол плавления 199-201 °С 4,6-Диметокси-2-меркаптопиримидин (3,0г) растворили в водном растворе гидроксида натрия (b) І\І-[2-(4,6-диметоксипиримидин-2-илтио)-3(0,7г в 100мл воды) 1,2-Диметил-5-бром-4-нитротиэнил]-2,2,2-трифторапетамид 1 Н-имидазол (3,9г), растворенный в этаноле Продукт предыдущей стадии (2,0г) растворили (50мл), добавили по каплям, и затем смесь перев трифторуксусной кислоте (50мл) и добавили мешивали при комнатной температуре в теччение трифторуксусный ангидрид (5,0мл) и порошок же6 часов Осадок отфильтровали, промыли водой, леза (1,8г) Реакционную смесь перемешивали высушили и перекристаллизовали из ацетонитрипри нагревании до 70°С и держали при этой темла, получив 3,1 г требуемого продукта с темперапературе в течение 8 часов, после чего ее оттурой плавления 228-30°С фильтровали, фильтрат вылили в смесь льда с водой, подщелочили 5 N раствором гидроксида (c) 2,2,2-трифтор-п-[5-(4,6натрия, экстрагировали этилацетатом, высушили диметоксипиримидин-2-илтио)1,2-диметил-1 Ннад сульфатом магния и выпарили Продукт криимидазол-4-илІацетамид сталлизовали, получив 1,2г требуемого продукта с Продукт предыдущей стадии (7,0г), трифтотемпературой плавления 88 - 90°С руксусную кислоту (130мл), трифторуксусный ангидрид (18мл) и порошок железа (5,0г) нагрели (c) 2-(4,6-диметоксипиримидин-2при перемешивании до 70°С и оставили смесь при илтио)тиофен-3-амин этой температуре на 8 часов Затем ее отфильтПродукт предыдущей стадии (2,2г) растворили ровали, фильтрат вылили в смесь льда с водой, в метаноле (30мл), добавили карбонат калия подщелочили 5 N раствором гидроксида натрия и (1,0г), реакционную смесь нагрели при перемешиэкстрагировали этилацетатом Экстракты смешавании до 40°С и держали при этой температуре в 29 44220 течение 8 часов Затем ей дали охладиться и отфильтровали Фильтрат выпарили, остаток очистили путем хроматографии в тонком слое, используя в качестве элюента бензин (60 80) / этилацетат (8 2), получив 1,0г требуемого продукта в виде оранжевого масла (d) 1-Циан-1\1-[2-(4,6-диметоксипиримидин-2илтио)-3-тиэнил]метансульфонамид Продукт предыдущей стадии (1,2г) и пиридин (1,0мл) растворили в дихлорметане (10мл) и смесь охладили до -78°С при перемешивании По каплям добавили раствор цианметансульфонилхлорида (0,6г) в дихлорметане (5мл), поддерживая температуру от -78 до -60°С, затем перемешивали смесь в течение 15 минут при -78°С После этого смеси дали нагреться до комнатной температуры, перемешивали ее в течение последующих 16 часов, затем вылили в воду и экстрагировали дихлорметаном Экстракты смешали и высушили над сульфатом магния, удалив растворитель Остаток очистили путем хроматографии, используя в качестве элюента бензин (60 80) / этилацетат (8 2), получив 0,4г требуемого продукта с температурой плавления 118 - 120°С Пример В7 г\1-[2-(4,6-диметоксипиримидин-2-илтио)-3тиэнил]-1,1,1-трифторметансульфонамид Продукт стадии (с) Примера В6 (1,0г) и пиридин (0,6г) растворили в дихлорметане (25мл) и охладили смесь до -78°С К реакционной смеси добавили по каплям раствор тр и фтор метан сул ьфонового ангидрида (1,1 г) в дихлорметане (5мл), поддерживая температуру от -78 до -60°С После этого реакционную смесь перемешивали в течение 15 минут при -78°С и затем дали нагреться до комнатной температуры При комнатной температуре ее перемшивали в течение ночи, затем вылили в воду и экстрагировали дихлорметаном Экстракты смешали и высушили над сульфатом магния Растворитель удалили, а остаток очистили путем хроматографии, используя в качестве элюента бензин (60 80) / этилацетат (8 2), получив требуемый продукт (В7а) с температурой плавления 103 - 104°С, а также соответствующее соединение, где R2 - -SO2CF3 (B7b), с температурой плавления 136 - 138°С Пример В8 Следующие соединения формулы Ib, где R2 водород, R3 и R4 - метоксильные группы, a Q - СН , могут быть получены способами, описанными ниже Y СН СН СН СН СН СН СН СН СН А S N(Me) S S N(Me) N(Me) СН СН СН В СН СН СН N СН N S N(Me) N(Me) D СН СН N СН N СН СН СН СН R1 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 30 CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH CH N N N N N N N N N N N N N N N N N N N N N CH N N CCI CCI CCI CCI CF CF CF CF CH CH N CH CH N CCI CCI CCI CCI CF CF CF CF S N(Me) S S N(Me) N(Me) CH CH CH CH N N CCI CCI CCI CCI CF CF CF CF CH S S N(Me) S N(Me) S N(Me) S N(Me) S N(Me) CH CH CH N N CH CH CH N N CH CH N N CH CH CH N CH N S N(Me) N(Me) S S N(Me) S N(Me) S N(Me) S N(Me) S N(Me) CH N CH CH CH N N N CH N N N S N(Me) S S N(Me) N(Me) S N(Me) S N(Me) S N(Me) S N(Me) CH CH N CH N CH CH CH CH N CH CH CH N N N CH N N N S CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 CF3 44220 31 N 32 СН СН N(Me) CF3 N S CH CH CH2CN N N СН S CF3 N N(Me) CH CH CH2CN N СН N S CF3 N S CH N CH2CN N СН N N(Me) CF3 N S N CH CH2CN N N СН N(Me) CF3 N N(Me) CH N CH2CN N CCI СН S CF3 N N(Me) N CH CH2CN N CCI СН N(Me) CF3 N CH S CH CH2CN N CCI N S CF3 N CH N(Me) CH CH2CN N CCI N N(Me) CF3 N CH N(Me) CH CH2CN N CF СН S CF3 N CH S N CH2CN N CF СН N(Me) CF3 N N S CH CH2CN N CF N S CF3 N N N(Me)S CH CH2CN N CF N N(Me) CF3 N CCI S CH CH2CN CH S СН CH CH2CN N CCI N(Me) N CH2CN СН N(Me) СН CH CH2CN N CCI S N CH2CN СН S СН N CH2CN N CCI N(Me) N CH2CN СН S N CH CH2CN N CF S CH CH2CN СН N(Me) СН N CH2CN N CF N(Me) N CH2CN СН N(Me) N CH CH2CN N CF S N CH2CN СН СН S CH CH2CN N CF N(Me) N CH2CN СН СН N(Me) CH CH2CN N CH CH S CH2CN СН СН N(Me) CH CH2CN N CH CH N(Me) CH2CN СН СН S N CH2CN N N CH S CH2CN СН N S CH CH2CN N CH N S CH2CN СН N N(Me) CH CH2CN N CH N N(Me) CH2CN СН CCI S CH CH2CN N N CH N(Me) CH2CN СН CCI N(Me) N CH2CN N CCI CH S CH2CN СН CCI S N CH2CN N CCI CH N(Me) CH2CN СН CCI N(Me) N CH2CN N CCI N S CH2CN СН CF S CH CH2CN N CCL N N(Me) CH2CN СН CF N(Me) N CH2CN N CF CH S CH2CN СН CF S N CH2CN N CF CH N(Me) CH2CN СН CF N(Me) N CH2CN N CF N S CH2CN СН СН CH N(Me) CH2CN N CF N N(Me) CH2CN СН N CH S CH2CN СН СН N S CH2CN СН СН N N(Me) CH2CN СН N CH N(Me) CH2CN СН CCI CH S CH2CN СН CCI CH N(Me) CH2CN СН CCI N S CH2CN СН CCI N N(Me) CH2CN СН CF CH S CH2CN СН CF CH N(Me) CH2CN СН CF N S CH2CN СН CF N N(Me) CH2CN Пример применения гербицидов А (в период, предшествующий критическому росту) Семена испытуемых растений, перечисленных ниже, были высеяны в 8,5-сантиметровых квадратных горшочках, заполненных стерильной почвой на 2см ниже верхнего края, с верхним слоем 2-5мм плодородной почвы Землю полили и обработали почву в распылительной камере соединениями перечисленных ниже Примеров в виде раствора/суспензии 3 1 по объему ацетона и увлажняющего агента - раствора полиоксиэтилена (20моль) в монолаурате (Юг/л) Концентрацию каждого испытуемого соединения и объем применения вычисляли из расчета получения требуемой степени воздействия соединения в 200л/гектар После 3-4 недель роста под стеклянным колпаком (минимальная температура 16°С для рас 33 44220 34 тений умеренного климата, 21 °С для растений є - Alopecurus myosuroides (лисохвост мышетеплого климата, фотопериод - 16ч/день) растехвостниковидный), ния визуально оценивали на гербицидную реакf - Avena fatua (дикий овес), цию Все отличия от необработанных контрольных g - Elymus repens (пырей), образцов подсчитали в виде коэффициента, где 0 h - Bromus stenhs (костер бесплодный), = отсутствие эффекта, 3 = 70 - 89% эффекта и 4 і - Viola arvensis (полевые анютины глазки), 90 -100% эффекта В таблице, приведенной ниже, j - Stellana media (песчанка), буквы алфавита обозначают образцы растений к - Gahum aparme (подмаренник цепкий), I - Matncana modora (ромашка непахучая), а - Tnticum aestivum (пшеница), m - Polygonum lapathifohum (перец шероховаb - Hordeum vulgans (ячмень), тый), с - Beta vulgans (сахарная свекла), d - Brassica napus (рапс), n - Veronica persicae (вероника Буксбаума) Получены следующие результаты Эксп Кг/га а b с d е f h і k I m n А1 0 25 1 1 3 4 2 1 g 3 1 2 J 4 3 4 3 4 A3 05 0 0 2 4 0 0 0 0 2 2 3 4 2 3 А6 0 25 1 0 3 4 1 0 0 2 4 4 4 4 3 4 А7 0 25 1 0 3 2 1 1 0 0 3 4 3 4 2 4 А8 0 125 2 2 3 4 2 1 2 2 3 4 3 4 2 4 А9 0 125 0 1 2 2 2 0 0 2 3 4 3 4 2 4 А16 0 125 2 1 4 4 2 2 2 1 3 4 4 4 3 4 А17 0 063 0 0 1 3 0 0 0 0 2 3 2 3 2 2 А108 05 0 0 2 2 0 0 0 0 2 2 2 4 0 2 А109 05 0 0 3 3 0 0 1 0 4 3 3 4 2 4 А111 0 125 0 1 1 1 0 0 0 0 1 1 2 3 0 3 А112 0 125 0 1 2 1 0 0 0 1 3 4 3 4 1 3 А114 05 0 0 2 2 0 0 0 0 2 3 1 3 1 3 А115 05 0 0 2 2 0 0 0 2 3 4 3 4 3 4 А116 0 25 1 1 2 4 1 0 0 1 3 4 4 4 2 4 В1 05 0 1 2 3 1 0 2 1 2 2 3 4 2 3 Пример действия гербицидов В (в период после критического роста) Образцы растений, перечисленные ниже, выращивали в 8,5-сантиметровых квадратных горшочках, содержащих стерильную почву, под стеклянным колпаком (минимальная температура 16°С для растений умеренного климата, 21 °С для растений теплого климата, фотопериод 16ч/день) и затем обработали в распылительной камере на стадии 2 - 3 листа соединениями Примеров, перечисленных ниже, в виде раствора/суспензии 3 1 по объему ацетона и увлажняющего агента - раствора полиоксиэтилена (20моль) Эксп в монолаурате (Юг/л) Концентрацию каждого испытуемого соединения и объем применения вычисляли из расчета получения требуемой степени воздействия соединения в 200л/гектар Через 3 - 4 недели растения визуально оценивали на гербицидную реакцию Все отличия от необработанных контрольных образцов подсчитали в виде коэффициента, где 0 = отсутствие эффекта, 1 = 1 - 24% эффекта, 2 = 25 - 69% эффекта, 3 = 70 - 89% эффекта и 4 = 90 -100% эффекта В приведенной ниже таблице буквы обозначают те же растения, что и в Примере А Получены следующие результаты Кг/га а b с d е f і I m n 0 0 2 4 0 0 0 0 J 2 k 05 g 0 h А1 4 4 2 2 A3 05 0 0 1 4 1 0 0 0 1 2 4 4 1 2 А5 05 1 1 1 3 1 0 1 1 2 1 2 2 1 2 А6 0 25 1 0 4 4 2 2 2 2 3 3 4 4 3 2 А7 0 25 1 1 2 4 2 2 2 2 3 3 3 4 2 3 А8 0 25 1 0 4 4 2 0 2 0 4 4 4 4 2 2 А9 0 125 1 1 3 4 0 0 1 0 3 3 4 4 2 2 А16 0 032 1 1 3 4 0 0 1 0 3 3 4 4 2 2 A17 0 25 A109 05 A111 0 25 A112 0 25 A114 0 25 A115 0 25 A116 0 25 A117 0 125 A118 0 125 A119 0 63 B1 03 35 0 1 0 0 0 0 0 0 0 1 0 4422С 0 0 0 0 0 0 0 0 0 0 1 4 4 2 2 0 1 4 3 1 1 2 4 4 3 3 2 4 4 4 0 1 4 0 1 1 0 0 0 1 0 0 0 2 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 2 2 0 0 0 0 2 0 0 0 0 4 3 0 2 0 2 4 3 0 0 3 36 4 4 3 4 2 3 4 4 3 2 3 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044) 456 - 20 - 90 4 4 3 0 0 2 2 2 0 0 4 3 2 0 0 3 2 2 3 1 1 1 3 2 2 0 0 2 2 0 1 2
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A01P 13/00, A01N 43/90, C07D 239/32
Мітки: боротьби, гербіцидну, гербіцидна, сульфонаміди,що, активність,спосіб, мають, одержання, композиція, спосіб, бур'янами
Код посилання
<a href="https://ua.patents.su/18-44220-sulfonamidishho-mayut-gerbicidnu-aktivnistsposib-kh-oderzhannya-gerbicidna-kompoziciya-ta-sposib-borotbi-z-buryanami.html" target="_blank" rel="follow" title="База патентів України">Сульфонаміди,що мають гербіцидну активність,спосіб їх одержання, гербіцидна композиція та спосіб боротьби з бур’янами</a>