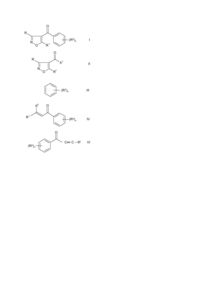
Похідні 4-бензоїлізоксазолу, що мають гербіцидну активність, гербіцидна композиція, спосіб боротьби з ростом бур’янів
Номер патенту: 29380
Опубліковано: 15.11.2000
Автори: Кейн Пол А., Робертс Девід Алан, Кремп Сусан Мері
Текст
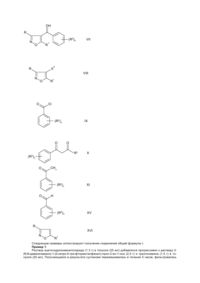
Данное изобретение относится к производным 4-бензоилизоксазола, обладающим гербицидной активностью, к способу их получения, гербицидным композициям, содержащим производные 4-бензоилизоксазола и к их использованию в качестве гербицидов. В патенте США № 4173650 (American Cyanamid Co) описано производное 4-бензоилизоксазола формулы (А): O F (A) N CH3 O которое используется как промежуточное соединение для получения соединений, обладающих противовоспалительной активностью. В этом же патенте также раскрыты производные 4-бензоилизоксазола формулы (Б): R 1 R 2 O R 3 5 R N O R R 6 , 4 (Б) где R1, R2, R3, R4, R5 каждый независимо выбирается из группы, содержащей атом водорода, атом галогена, (С1-С4)алкильную группу, (С1-С4)алкоксильную группу, трифторметильную группу и трихлорметильную группу, при условии, что по крайней мере два радикала среди R1, R2, R3, R4, R5 должны быть атомами водорода, но не все из R1, R2, R3, R4, R5 являются атомами водорода; и R6 представляет собой (С1-С4)алкильную группу, а также производные 4-бензоилизоксазола формулы (В): C(O)R 6 R1 R 2 N O R R 3 5 , (B) R 4 где R1, R2, R3, R4, R5 принимают значения, указанные выше. В статье D. Grothaus (J. Amer. Chem. Soc. 1936, 58, p. 1334) описано получение 5-амино-4-бензоилизоксазола формулы (Г): O Br (Г) N O NH2 Однако ни в одном из вышеупомянутых источников не описывается применение производных 4-бензоилизоксазола в качестве гербицидов. Наиболее близким за совокупностью признаков является Европейский патент ЕР № 0418175, в котором раскрываются производные 4-бензоилизоксазола формулы (Д): O (R2)n , (Д) N O R1 где R1 представляет собой прямую или разветвленную алкильную, алкенильную или алкинильную группу, содержащую до 6 атомов углерода, которые необязательно замещены одним или более атомами галогена; или циклоалкильную группу, содержащую от 3 до 6 атомов углерода необязательно замещенную одной или более группами R3 или одним или более атомами галогена или естерной группой COOR31; или циклоалкенильную группу, содержащую 5 или 6 атомов углерода необязательно замещенную одной или более группами R3 или одним или более атомами галогена или естерной группой COOR31; или арильную или аралкильную (например, бензильная группа) группу, преимущественно формулы (R2)q-фенил-[-CR3R4-]p(арильная группа замещена от 6 до 10 атомов углерода; аралкильная группа в общем замещена от 7 до 11 атомов углерода) или; группу СООR3; или альдегидную или ацильную группу СОR3; или цианогруппу; или нитрогруппу; или аминогруппу NR3R4; или атом галогена (F, Cl, Br, I); и R2 представляет собой нитрогруппу; или цианогруппу; или атом галогена (F, Cl, Br, I); или группу R5; или сульфенильную, сульфинильную или сульфонильную группы S(O)m R5; или сульфамоильную группу SO2NR3R4; или группу COOR3; или альдегидную или ацильную группу COR3; или карбамоильную или тиокарбамоильную группу CONR3R4 или CSNR3R4; или алкоксильную группу OR5; или алкильную группу (от 1 до 3 атомов углерода), замещенную группой OR5; и R3 и R4 могут быть одинаковыми или разными и каждый из них представляет собой атом водорода или прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода, которые необязательно замещены одним или более атомами галогена; R31 принимает значения, определенные для радикала R3, но не является атомом водорода R5 представляет собой прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода, которые необязательно замещены одним или более атомами галогена; m представляет собой 0, 1 или 2; n представляет собой целое число от 1 до 5; р представляет собой 0 или 1; q представляет собой 0 или целое число от 1 до 5; при условии, что (а) когда R1 представляет собой (С1-С4)алкильную группу, n представляет собой целое число от 1 до 3 и R2 выбирается из группы, состоящей из атома галогена, (С1С4)алкильной группы, (С1-С4)алкоксильной группы, трифторметильной и трихлорметильной группы, соединение не должно присутствовать в смеси с соединением формулы (Е): 1 O R N O (R2)n , (E) где R1 представляет собой (С1-С4)алкильную группу, n представляет собой целое число от 1 до 3 и R2 выбирается из группы, состоящей из атома галогена, (С1-С4)алкильной группы, (С1-С4)алкоксильной группы, трифторметильной и трихлорметильной группы; (b) когда R1 является группой NH2, (R2)n не является 4бром; (с) когда R1 является метилом, (R2)n не является 4-фтор; или их агрохимически приемлемые соли, которые обладают гербицидной активностью. Композиции на основе этих производных 4-бензоилизоксазола формулы (Д) обладают необходимой гербицидной активностью, но их активность в некоторых случаях недостаточна. В основу изобретения была поставлена задача получить соединения, обладающие значительной гербицидной активностью. Поставленная задача решается синтезом новых производных 4-бензоилизоксазола общей формулы (I), которые отличаются по структуре от известных производных 4-бензоилизоксазола тем, что они содержат заместитель в 3-ем положении. Таким образом, настоящее изобретение касается производных 4-бензоилизоксазола общей формулы (I): O (R2)n R , (I) N O R1 где R= (C1-C6)алкил, трифторметил, -СО2R3, 4 -СОR , -CN, галоген или CONH2; R1= (C1-C6)алкил или (С3-С6)циклоалкил; R2= нитро, галоген, трифторметил, -SR4, 4 4 4 3 4 -SOR , -SO2R или -OR ; R , R = (C1-C6)алкил; n= 1, 2, 3, при условии, что R и R1 не представляют одновременно метильную группу, и их агрохимически приемлемые соли, которые обладают гербицидной активностью. Кроме того, в некоторых случаях заместители R, R1, R2, R3, R4 способствуют оптической изомерии и/или стереоизомерии. Все такие изомеры также охватываются настоящим изобретением. Под термином "агрохимически приемлемые соли" имеются в виду соли, катионы которых являются известными и используются в технике для образования солей для использования в сельском хозяйстве или садоводстве. Предпочтительно соли являются растворимыми в воде. Подходящие соли, образуемые соединениями формулы (I), которые обладают кислотными свойствами, то есть соединениями, содержащими одну или более карбоксигрупп, включают соли щелочных металлов (например, натриевую и калиевую), соли щелочно-земельных металлов (например, кальция и магния), аммониевые соли и соли аминов (например, диэтаноламина, триэтаноламина, октиламина, диоктилметиламина и морфолина). Очевидно, что когда в настоящем изобретении дается ссылка на соединение формулы (I), имеется в виду, что такая ссылка включает и соли, когда контекст это позволяет. Гербицидные композиции, включающие соединения формулы (I), в которой R и R1 представляют одновременно метильную группу, и использование таких соединений для борьбы с ростом сорняков составляют часть данного изобретения, как это определяется здесь далее. Соединения формулы (I), которые представляют особый интерес, включают следующие: A) 3-метил-4-(2-нитро-4-трифторметилбензоил)изоксазол; В) 3-(1-метилэтил)-4-(2-нитро-4-трифторметилбензоил)изоксазол; С) Этил 4-(2-нитро-4-трифторметилбензоил) изоксазол-3-карбоксилат; D) 3-бром-4-(2-нитро-4-трифторметилбензоил)изоксазол; Е) 4-(2-нитро-4-трифторметилбензоил)-3-триформетилизоксазол; F) 5-циклопропил-3-метил-4-(2-нитро-4-трифторметилбензоил)изоксазол; G) Этил 5-метил-4-(2-нитро-4-трифторметилбензоил)-изоксазол-3- карбоксилат; H) 5-метил-4-(2-нитро-4-трифторметилбензоил)-изоксазол-3- карбоксамид; I) Этил 5-циклопропил-4-(2-нитро-4-трифторметилбензоил)- изоксазол-3-карбоксилат; J) 3-Циано-5-метил-4-(2-нитро-4-трифторметилбензоил)-изоксазол; К) Этил 4-(2-хлор-4-метилсульфонилбензоил)-5- циклопропилизоксазол-3-карбоксилат; L) Этил 5-циклопропил-4-(4-метилсульфонил-2-трифторметилбензоил)-изоксазол-3-карбоксилат; М) Метил 4-(2-хлор-4-метилсульфонилбензоил)-5- циклопропилизоксазол-3-карбоксилат; N) 4-(2-хлор-4-метилсульфонилбензоил)-5-циклопропил- изоксазол-3-карбоксамид; О) Этил 5-циклопропил-4-(2-метилсульфонилбензоил)-изоксазол-3- карбоксилат; Р) Метил 5-циклопропил-4-(4-метилсульфонил-2-трифторметилбензоил)-изоксазол-3-карбоксилат; Q) Этил 5-циклопропил-4-(2-нитро-4-метилсульфонилбензоил)- изоксазол-3-карбоксилат; R) Этил 5-циклопропил-4-(2,3-дихлор-4-метилсульфонилбензоил)-изоксазол-3-карбоксилат; S) Этил 4-(2-хлор-3-метокси-4-метилсульфонилбензоил)-5-циклопропилизоксазол-3-карбоксилат; Т) 4-(2-хлор-4-метилсульфонилбензоил)-3-циано-5- циклопропилизоксазол; U) Этил 4-(4-хлор-2-метилсульфонилбензоил)-5- циклопропилизоксазол-3-карбоксилат; V) Этил 4-(4-хлор-2-нитробензоил)-5-циклопропилизоксазоил-3-карбоксилат; W) Этил 4-(4-хлор-2-трифторметилбензоил)-5- циклопропилизоксазол-3-карбоксилат; Х) Этил 5-циклопропил-4-(2-метилсульфенил-4-трифторметилбензоил)-изоксазол-3-карбоксилат; Y) Этил 5-циклопропил-4-(4-метилсульфенил-2-трифторметилбензоил)-изоксазол-3-карбоксилат; Z) Этил 5-циклопропил-4-(2-метилсульфинил-4-трифторметилбензоил)-изоксазол-3-карбоксилат; АА) Этил 5-циклопропил-4-(4-метилсульфинил-2-трифторметилбензоил)-изоксазол-3-карбоксилат; ВВ) Этил 5-циклопропил-4-(2-метилсульфонил-4-трифторметилбензоил)-изоксазол-3-карбоксилат; СС) Этил 5-циклопропил-4-(2-фтор-4-метилсульфонилбензоил)-изоксазол-3-карбоксилат; DD) Этил 4-(2-хлор-4-этилсульфонилбензоил)-5- циклопропилизоксазол-3-карбоксилат; ЕЕ) Этил 4-(4-бром-2-метилсульфонилбензоил)-5- циклопропилизоксазол-3-карбоксилат; FF) Этил 4-(2-бром-4-метилсульфонилбензоил)-5- циклопропилизоксазол-3-карбоксилат; GG) Этил 4-(2-хлор-2-метилсульфонилбензоил)-5- циклопропилизоксазол-3-карбоксилат; НН) Этил 4-(2-хлор-4-метилсульфинилбензоил)-5- циклопропилизоксазол-3-карбоксилат; II) 3-Ацетил-4-(2-хлор-4-метилсульфонилбензоил)-5- циклопропилизоксазол; JJ) Изопропил 4-(2-хлор-4-метилсульфонилбензоил)-5-циклопропилизоксазол-3-карбоксилат; КК) Метил 4-(4-хлор-2-метилсульфонилбензоил)-5-циклопропилизоксазол-3-карбоксилат; LL) Метил 5-циклопропил-4-(2-метилсульфонил-4-трифторбензоил)-изоксазол-3-карбоксилат; ММ) Метил 4-(4-хлор-2-метилсульфонилбензоил)-5-циклопропилизоксазол-3-карбоксилат; NN) Метил 4-(2-хлор-2-метилсульфинилбензоил)-5-циклопропилизоксазол-3-карбоксилат. Буквы от А до NN приписаны соединениями для идентификации и последующей ссылки на них. Соединения общей формулы I могут быть получены с помощью применения или приспособления известных методов (т.е. способ, используемых до сих пор или описанных в литературе), например, способов описанных здесь ниже. Согласно одному из аспектов настоящего изобретения соединения общей формулы I, в которой R, R1, R2 и n имеют значения, определенные здесь выше, могут получаться с помощью взаимодействия соединений общей формулы II, показанной здесь ниже, где R и R1 имеют значения, определенные выше, и Х1 представляет галоген (предпочтительно, атом хлора), с соединениями общей формулы III, показанной ниже, где R2 и n имеют значения, определенные выше, в присутствии катализатора кислоты Льюиса, например, хлористого алюминия. Реакция обычно проводится в инертном растворителе, при температуре от 0оС до 100оС. Согласно следующему аспекту настоящего изобретения соединения общей формулы I, где R, R1, R2 и n имеют значения, определенные выше, могут быть получены путем взаимодействия соединений общей формулы IV, показанное ниже, где R1, R2 и n имеют значения определенные выше и Х2 представляет собой группу формулы -N(R7)2, или -SR7, где R7 представляет алкильную группу с прямой или разветвленной цепью с числом атомов углерода до 4, с соединениями общей формулы V: RC(X1)=NOH (V) где R и Х1 имеют значения, определенные выше, в присутствии органического основания, например, триэтиламина или пиридина, в инертном растворителе, например, толуоле. Реакция также может осуществляться в присутствии катализатора, такого как молекулярные сита или фторидные ионы, такие как фтористый калий, в инертном растворителе, таком как дихлорметан. Согласно еще одному признаку настоящего изобретения соединения общей формулы I, где R, R1, R2 и n имеют значения, определенные выше, могут получаться с помощью реакции соединений общей формулы VI, показанной ниже, где R1, R2 и n имеют значения, определенные выше, с соединениями формулы V, где R и Х1 имеют значения, определенные выше, в присутствии органического основания или катализатора в инертном растворителе таком, как дихлорметан. Реакция может осуществляться в присутствии катализатора, такого как молекулярные сита, или фторидного иона, такого как фторид калия. Согласно следующему признаку настоящего изобретения соединения общей формулы I, где R, R1, R2 и n имеют значения, определенные выше, могут быть получены с помощью окисления соединений общей формулы VI, показанной ниже, где R, R1, R2 и n имеют значения, определенные выше, с превращением гидроксигруппы в кетоновую группу, например, с помощью смеси, полученной из трехокиси хрома, водной серной кислоты и ацетона. Согласно следующему признаку настоящего изобретения соединения общей формулы I, где R, R1, R2 и n имеют значения, определенные выше, могут получаться с помощью металлирования соединений общей формулы VIII, показанной здесь ниже, где R и R1 имеют значения, определенные выше, и Х3 представляет бром или иод, например, с н-бутиллитием в инертном растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре от –78оС до 0оС, с последующей обработкой бензоилхлоридом общей формулы IX: показанной ниже, в которой R2 и n имеют значения, определенные выше. Согласно дальнейшему признаку настоящего изобретения соединения общей формулы I, где R, R1, R2 и n имеют значения, определенные выше, могут получаться с помощью реакции соли соединений общей формулы Х, показанной ниже, где R1, R2 и n имеют значения, определенные выше, с соединением общей формулы V. Обычно реакция проводится в инертном полярном растворителе, например, толуоле, от 0оС до 80оС. Предпочтительные соли включают натриевую или магниевую соли. Промежуточные соединения, используемые при получении соединений общей формулы I, могут быть получены с помощью применения или приспособления известных способов, например, способов, описанных ниже. Промежуточные соединения общей формулы IV могут приготавливаться реакцией ацетофенона общей формулы XI, показанной здесь выше, где R2 и n имеют те же значения, что и выше, с амидацеталем общей формулы XII: R1C(OR7)2X3 , (XII) где R1, R7 имеют значения, указанные выше, а Х3 представляет собой группу формулы N(R7)2, где R7 имеет значения, указанные выше, необязательно в присутствии инертного растворителя, такого как толуол, при температуре от комнатной до температуры нагревания с обратным холодильником смеси. Альтернативно промежуточные соединения общей формулы IV могут приготавливаться реакцией енамина общей формулы XIII: R1 R3 = CH2 , (XIII) где R1 и Х3 имеют вышеуказанные значения, с бензоилхлоридом общей формулы IX в присутствии органического основания, такого, как триэтиламин в инертном растворителе, таком, как толуол или дихлорметан при температуре от –20оС до комнатной температуры. Промежуточные соединения формулы VI могут приготавливаться металлированием соответствующего ацетилена общей формулы XIV: R1C = CH, XIV 1 где R имеет значение, указанное выше с использованием, например, n-бутиллития в качестве инертного растворителя, такого как простой эфир или тетрагидрофуран при температуре от –78оС до 0оС, с последующей реакцией полученной таким образом соли металла с бензоилхлоридом общей формулы IX. Промежуточные соединения формулы VII могут приготавливаться металлированием соединения общей формулы VIII с, например n-бутиллитием в инертном растворителе, таком, как простой эфир или тетрагидрофуран при температуре от –78оС до 0оС с последующей обработкой бензальдегидом общей формулы XV, указанным здесь выше с R2 и n являются такими же, как и указанные выше. Промежуточные соединения общей формулы VIII могут приготавливаться галогенированием соединений общей формулы XVI, показанных здесь выше, где R и R1 являются теми же, что и выше, например, нагреванием с бромом или йодом в присутствии концентрированной азотной кислоты. Сельскохозяйственно приемлемые соли могут приготавливаться из соединений общей формулы I применением или приспособлением известных методов. Соединения формул II, III, V, IX, X, XI, XII, XIII, XIV, XV и XVI известны или могут приготавливаться применением или приспособлением известных методов. Специалисты в данной области техники понимают, что некоторые соединения общей формулы I могут приготавливаться взаимным превращением других соединений общей формулы I, и такие взаимные превращения составляют еще дополнительные признаки настоящего изобретения. Примеры таких взаимных превращений включают: Соединения, в которых R, или R2 представляют собой цианогруппу, могут приготавливаться из соединений, в которых R и R2 представляют собой группу -CO2R3, где R3 является другим по сравнению с водородом с помощью гидролиза до соответствующей карбоновой кислоты, в которой R3 представляет собой водород, конверсии до соответствующего гелоидангидрида галогена кислоты, например, обработкой тионилхлоридом или оксалилхлоридом, обработкой аммиаком для получения амида, и дегидратацией, например, с помощью хлорокиси фосфора. Соединения, в которых R или R2 представляют группу -COR5 могут приготавливаться из соответствующих соединений, в которых R или R2 представляют цианогруппу, путем реакции с органометаллическим реагентом, реактивом Гриньяра соответствующей структуры. Соединения, в которых R2 представляет собой -SOR5 или -SO2R5 могут быть получены с помощью окисления соединений, в которых R2 представляет – R5, с использованием, например, m-хлорнадбензойной кислоты с инертным растворителем, таком как дихлорметан, при температуре от –40оС до 0оС. Соединения, в которых R или R2 представляет -CO2R3, где R3 представляет алкильную группу, могут превращаться в другие соединения, в которых R или R2 представляет -CO2R3, с помощью сложной переэтерификации или трансэтерификации сложноэфирной группы, например, с помощью взаимодействия соединения, в котором R или R2 представляет собой -CO2CH3 с алкоголятной солью формулы M-OR3 (где М представляет катион металла, например, натрия или калия), где R3 не является группой СН3 в спиртовом растворителе R3OH, необязательно в присутствии кислотного катализатора, такого как серная кислота или эфират трехфтористого бора. Реакция предпочтительно осуществляется при температуре от 15оС до температуры дефлегмации смеси. O R N (R2)n O R I 1 O R X1 N II 1 R O (R2)n 2 X III O R1 (R2)n IV O (R2)n C C – R1 VI OH R (R2)n N O R R VII 1 X 3 VIII N 1 O R O Cl (R2)n O (R2) IX O R1 X n CH3 O (R2)n XI (R2)n XV H O R XVI N O 1 R Следующие примеры иллюстрируют получение соединений общей формулы I. Пример 1. Раствор ацетогидроксимоилхлорида (1,3 г) в толуоле (25 мл) добавлялся прогрессивно к раствору 3(N,N-диметиламино)-1-(2-нитро-4-три-фторметилфенил)-проп-2-ен-1-она (2,0 г) и триэтиламина (1,5 г) в толуоле (25 мл). Получающаяся в результате суспензия перемешивалась в течение 5 часов, фильтровалась и фильтрат выпаривался досуха. Остаток подвергался хроматографии с элюированием смесью бензина и этилацетата. Продукт перекристаллизовывался из циклогексана, давая соединение А), (0,66 г) в форме белого твердого вещества, т.пл. 104оС. С использованием аналогичного способа следующие соединения общей формулы I приготавливались из соответствующим образом замещенных исходных материалов: Соед. R R В 1-метилэтил C 1 2 (R ) т.пл. ЯМР Н 2-NO2-4-CF3 92oC CO2Et H 2-NO2-4-CF3 65oC D Br H 2-NO2-4-CF3 115oC E CF3 H 2-NO2-4-CF3 117oC G CO2Et CH3 2-NO2-4-CF3 62oC I CO2Et Циклопропил 2-NO2-4-CF3 (CDCl3)=1,1 (т, 3Н) 1,2–1,5 (м, 4Н) 2,7 (м, 1Н), 3,9 (кв, 2Н), 7,5 (д, 1Н), 7,9 (д,1Н) 8,4 (с, 1Н) K CO2Et Циклопропил 2-Cl-4-SO2Me 110oC L CO2Et Циклопропил 2-CF3-4-SO2Me 124,5–126oC M CO2Me Циклопропил 2-Cl-4-SO2Me 143–144оС О СО2Et Циклопропил 2-SO2Me 97–98oC P CO2Me Циклопропил 2-CF3-4-SO2Me 152,5–153оС Q CO2Et Циклопропил 2-NO2-4-SO2Me 131–132oC R CO2Et Циклопропил 2,3-Cl2-4-SO2Me 202–203oC S CO2Et Циклопропил 2-Cl-3-MeO-4-SO2Me Соед. R R U CO2Et Y W 1 2 130–132oC Продолжение (R ) т.пл. ЯМР Циклопропил 2-SO2Me-4-Cl 118–119oC CO2Et Циклопропил 2-NO2-4-Cl 83–84oC CO2Et Циклопропил 2-CF3-4-Cl 59–60oC Пример 2. Раствор н-бутиллития в гексане (2,5 М, 20 мл) добавлялся по каплям к раствору 5-циклопропил-4йод-3-метилизоксазола (12,4 г) в простом эфире (200 мл), при поддержании температуры ниже –60оС. Смесь перемешивалась в течение 1 часа, и по каплям добавлялся раствор 2-нитро-4-трифторметилбензоилхлорида (12,68 г) в эфире (100 мл) при поддержании температуры ниже –60оС. Смесь перемешивалась в течение 1 часа и оставлялась подогреваться до 0оС. Добавлялась соляная кислота (2М, 150 мл) и слои отделялись. Органический слой промывался водой, насыщенным раствором метасубисульфата натрия, водой, сушился (безводным сульфатом натрия) и фильтровался. Фильтрат выпаривался досуха, и остаток растирался со смесью бензина и эфира (5:1) и фильтровался. Твердое вещество перекристаллизовывалось из циклогексана, давая соединение F) (11,3 г) в виде белого твердого вещества, т. пл. 110оС. Пример 3. Смесь этил 5-метил-4-(2-нитро-4-трифторметилбензоил)-изоксазол-3- карбоксилата (30 г) и концентрированного водного аммиака (60 мл) перемешивалась при комнатной температуре на протяжении ночи. Добавлялась вода (200 мл), и смесь экстрагировалась эфиром. Объединенные экстракты промывались водой, сушились (безводным сульфатом натрия) и фильтровались. Фильтрат выпаривался досуха, и остаток очищался с помощью хроматографии на силикагеле с элюированием смесью этилацетата и бензина (1:5), давая соединение Н (0,44 г) в виде белого твердого вещества, т. пл. 144оС. Следуя аналогичному способу приготовления следующее соединение общей формулы I из замещенного соответственно исходного материала: 1 Соединение № R R N CONH2 Циклопропил (R )n 2 т.пл. 2-Cl-4-SO2Me 202–203oC Пример 4. Смесь 5-метил-4-(2-нитро-4-трифторметилбензоил)-изоксазол-3- карбоксамида (1,2 г) и хлорокси фосфора (10 мл) перемешивалась при комнатной температуре в течение 1,5 часов и в течение 1 часа при 50–60оС. Смесь выливалась в воду (50 мл), при охлаждении, если необходимо, и экстрагировалась в дих лорметане. Объединенные экстракты промывались водой, сушились (безводным сульфатом натрия) и фильтровались. Фильтрат выпаривался досуха, а остаток очищался с помощью хроматографии на силикагеле с элюированием смесью этилацетата и бензина (1:5). Продукт перекристаллизовывался из циклогексана, давая соединение J/ (0,65 г) в виде не совсем белого твердого вещества, т. пл. 104оС. Следуя аналогичному способу, следующее соединение общей формулы I получалось из соответствующих замещенных исходных материалов: 1 Соед. R R T CN Циклопропил (R )n 2 т.пл. 2-Cl-4-SO2Me 123–123,5oC Пример 5. Смесь 3-циклопропил-3-диэтиламино-1-[2-(метилтио)-4-трифторметилфенил]-проп-2-ен-1-она (9,4 г), этил хлороксимидоацетата (6,0 г) и 4А молекулярного сита (35 г) в дихлорметане перемешивалась в течение 60 часов. Смесь фильтровалась, и фильтрат выпаривался досуха, и остаток перекристаллизовывался из н-гексана, давая соединение Х/ (3,6 г) в виде не совсем белого твердого вещества, т. пл. 97–98оС. С использованием аналогичного способа следующие соединения общей формулы I приготавливались из соответствующих замещенных исходных материалов: (R )n 2 т.пл. ЯМР Циклопропил 2-CF3-4-SMe 97–98oC CO2Et Циклопропил 2-F-4-SO2Me 116–117oC DD CO2Et Циклопропил 2-Cl-4-SO2E 136–137oC EE CO2Et Циклопропил 2-SO2Me-4-Br 93–95oC FF CO2Et Циклопропил 2-Br-4-SO2Me 139–140oC GG CO2Et Циклопропил 2-Cl-4-SMe 75–76oC H COCH3 Циклопропил 2-Cl-4-SO2Me 121,5оС Соед. № R R Y CO2Et CC 1 Пример 6. 3-Хлорнадоксибензойная кислота (1,9 г) добавлялась к раствору этил 5-циклопропил-4-[2-(метилтио)4-трифторметилбензоил]-изоксазол-3- карбоксилата (2,7 г) в дихлорметане при поддержании температуры ниже –10оС. Смесь перемешивалась при –5оС в течение 1,5 часов и ей давали возможность подогреваться до комнатной температуры. Добавлялся раствор метабисульфита натрия в воде, и слои разделялись. Органический слой промывался водой, сушился (безводным сульфатом натрия) и фильтровался. Фильтрат выпаривался досуха, и остаток очищался с помощью хроматографии на двуокиси кремния с элюированием смесью этилацетата и гексана (1:3), давая соединение Z/ (1,2 г) в виде белого твердого вещества, т. пл. 140–141оС. Следуя аналогичному способу из соответствующих замещенных исходных материалов получали следующие соединения общей формулы I. (R )n 2 т.пл. ЯМР Циклопропил 2-CF3-4-SOMe 65–66oC CO2Et Циклопропил 2-SO2Me-4-CF3 101–102oC HH CO2Et Циклопропил 2-Cl-4-SOMe 100–101oC NN CO2Me Циклопропил 2-SOMe-4-Cl 82–83oC Соед. № R R AA CO2Et BB 1 Пример 7. Гидрид натрия (0,15 г) добавлялся к изопропанолу. Данная процедура сопровождалась добавлением метил 4-(2-хлор-4-метилсульфонилбензоил)-5-циклопропилизоксазол-3-карбоксилата (1,9 г). Смесь перемешивалась и нагревалась в условиях дефлегмации в течение 2,5 часов, охлаждалась, и добавлялась вода. Смесь экстрагировалась этилацетатом, и органический слой промывался водой, сушился (безводным сульфатом натрия) и фильтровался. Фильтрат выпаривался досуха. Остаток растирался эфиром и фильтровался. Твердое вещество обрабатывалось этилацетатом и фильтровалось. Фильтрат пропускался через короткую колонку из двуокиси кремния, и элюат выпаривался досуха, давая соединение JJ/ (0,25 г) в виде белого твердого вещества, т.пл. 149–150оС. Пример 8. Смесь магния (0,35 г) и четыреххлористого углерода (0,5 мл) в метаноле подогревалась до тех пор, пока магний не растворялся. Добавлялся 1-(4-хлор-2-метилсульфонилфенил)-3-циклопропилпропан-1,3дион (4,0 г), и смесь перемешивалась и нагревалась в условиях дефлегмации в течение 2 часов. Затем она охлаждалась и выпаривалась досуха. Остаток растворялся в дихлорметане, и добавлялся раствор метил хлор-оксимидоацетата (2,75 г) в дихлорметане. Смесь перемешивалась при комнатной температуре на протяжении ночи, промывалась соляной кислотой (2 М), водой, сулилась (безводным сульфатом натрия) и фильтровалась. Фильтрат выпаривался досуха, а остаток растирался с эфиром и фильтровался. Твердое вещество перекристаллизовывалось из этанола, давая соединение KK/ (1,7 г) в виде бледно-оранжевого твердого вещества, т. пл. 146–147оС. При проведении процесса аналогичным образом следующие соединения общей формулы I получались из соответствующих замещенных исходных материалов: (R )n 2 т.пл. ЯМР Циклопропил 2-SO2Me-4-CF3 130–131oC Циклопропил 2-SMe-4-Cl 112–113oC Соед. № R R LL CO2Me MM CO2Me 1 Следующие примеры иллюстрируют получение промежуточных соединений, относящихся к настоящему изобретению: Пример 1(а). Смесь 2-нитро-4-трифторметил-ацетофенона (10 г) и диметилформамид-диметилацеталя (20 мл) нагревалась в условиях дефлегмации в течение 2 часов, затем выпаривалась досуха, и остаток смешивался с циклогексаном (20 мл), фильтровался, давая 3-(N,N-диметиламино)-1-(2-нитро-4-трифторметилфенил)-проп-2ен-1-он, (12,1 г), в виде красного твердого вещества, т. пл. 107оС. Пример 2(а). Смесь диэтил 2-нитро-4-трифторметилбензоилмалоната (74,2 г), концентpиpованной серной кислоты (30 мл), воды (170 мл) и ледяной уксусной кислоты (250 мл) нагревалась в условиях дефлегмации в течение 2 часов, затем охлаждалась, подщелачивалась водным раствором гидроокиси натрия (2 М) и экстрагировалась диэтиловым эфиром. Органическая фаза промывалась водой, сушилась над безводным сульфатом натрия и фильтровалась. Фильтрат выпаривался досуха, и получающийся остаток перекристаллизовывался из смеси диэтилового эфира и н-гексана (1:10 объем/объем), давая 2-нитро-4-трифторметилацетофенон (30,4 г), в виде не совсем белого твердого вещества, т. пл. 65оС. Пример 3(а). Смесь магниевой стружки (4,94 г) и четыреххлористого углерода (2 мл) в этаноле (35 мг) подогревалась до 50оС до тех пор, пока не начиналась реакция. Затем осторожно при перемешивании добавлялся диэтиловый эфир (150 мл). Затем по каплям добавлялся раствор диэтилмалоната (32,5 г) в диэтиловом эфире (50 мл), смесь затем перемешивалась и нагревалась в условиях дефлегмации в течение 2 часов. После охлаждения смеси добавлялся диэтиловый эфир (150 мл). По каплям добавлялся раствор 2-нитро4-трифторметилбензоилхлорида (50,7 г) в диэтиловом эфире (100 мл). Смесь нагревалась в условиях дефлегмации в течение 2 часов. После охлаждения добавлялась соляная кислота (2 М, 200 мл) и слои разделялись. Органический слой промывалсяводой, сушился (безводным сульфатом натрия) и фильтровался. Фильтрат выпаривался досуха, давая диэтил 2-нитро-4-трифторметилбензоилмалонат (72,6 г) в виде не совсем белого твердого вещества, т. пл. 60оС. Пример 4(а). Смесь 2-нитро-4-трифторметилбензоилхлорида (8,0 г) в трифенилфосфина (16,5 г) в сухом ацетоне (75 мл) обрабатывалась бис-трифенилфосфин-тетрагидроборатом меди (I) (19,8 г). Получающаяся в результате суспензия перемешивалась в течение 1 часа, фильтровалась и промывалась диэтиловым эфиром. Фильтрат выпаривался досуха, а получающийся остаток подвергался хроматографии с элюированием смесью диэтилового эфира и н-гексана (1:5, объем/объем); давая 2-нитро-4-трифторметилбензольдегид (5,81 г) в виде не совсем белого твердого вещества, т. пл. 63оС. Пример 5(а). Концентрированная азотная кислота (10 мл) добавлялась по каплям к перемешанной нагретой смеси йода (23,8 г) и 5-циклопропил-3- метилизоксазола (24,6 г, содержащей 20% 3-циклопропил-5- метилизоксазола) при поддержании температуры в интервале 90–95оС. Смесь перемешивалась и нагревалась при 95– 100оС в течение 1 часа. Смесь охлаждалась, выливалась в ледяную воду и экстрагировалась эфиром. Объединенные экстракты промывались водным насыщенным раствором бикарбоната натрия, водным раствором метанбисульфата натрия (насыщенным), водой, сушились над (безводным сульфатом натрия) и фильтровались. Фильтрат выпаривался досуха, а остаток растирался с бензилом и фильтровался. Твердое вещество перекристаллизовывалось из бензила, давая 5-циклопропил-4-иод-3-метилизоксазол (25,6 г) в виде белого твердого вещества, т. пл. 71оС. Пример 6(а). Смесь 1-циклопропилбутан-1,3-диона (65,3 г), гидроксиламина гидрохлорида (36,6 г) и безводного карбоната калия (71,8 г) в этаноле (375 мл) перемешивалась и нагревалась в условиях дефлегмации в течение 2 часов. Смесь охлаждалась и фильтровалась, и фильтрат выпаривался досуха. Остаток перегонялся при пониженном давлении, давая 5-циклопропил-3-метилизоксазол, содержащий приблизительно 20% 3-циклопропил-5-метилизоксазола (51,85 г) в виде прозрачного масла, т. пл. 74оС (12 мм рт. ст.). Пример 7(а). Раствор 2-нитро-4-трифторметилацетофенона (20,7 г) и диметилацетамид-диметилацеталя (13,2 г) в толуоле (100 мл) перемешивался и нагревался в условиях дефлегмации на протяжении ночи. Далее до полнительно добавлялся диметилацетамид-диметилацеталь (13,2 г), и смесь перемешивалась и нагревалась в условиях дефлегмации в течение 1,5 часов. Смесь охлаждалась, промывалась водой, сушилась (безводным сульфатом натрия) и фильтровалась. Фильтрат выпаривался досуха, а остаток растирался со смесью эфира и циклогексана (1:20) и фильтровался. Желтое твердое вещество перекристаллизовывалось из циклогексана, давая 3-диметиламино-1-(2-нитро-4-трифторметилфенил)-бут-2-ен-1-он (13,95 г) в виде желтого твердого вещества, т. пл. 122оС. Пример 8(а). 2-нитро-4-трифторметилбензоилхлорид (9,4 г) добавлялся по каплям к охлажденной смеси 1-циклопропил-1 лиэтиламиноэтена (5,1 г) и триэтиламина (3,7 г) в толуоле (100 мл) при поддержании температуры ниже 10оС. Смесь затем перемешивалась при комнатной температуре в течение 1 часа. Суспензия обрабатывалась обеспечивающим активированным углем и фильтровалась. Фильтрат выпаривался, и остаток очищался с помощью хроматографии на силикагеле с элюированием смесью этилацетата и дихлорметана (1:9), давая 3-циклопропил-3-диэтиламино-1-(2-нитро-4-трифторметилфенил)-проп-2-ен-1он (4,1 г) в виде красного масла с его 1Н ЯМР (в CDCl3); дающим пики при d=0,7–1,8 (м., 11Н), 3,5 (кв., 4Н), 5,0 (с., 1Н), 7,5 (д., 1Н), 7,7 (д., 1Н), и 7,95 (с., 1Н). При проведении аналогичного способа получались следующие соединения из соответствующих замещенных исходных материалов: COCl NEt2 R1 O NEt2 1 + (R2) n R n (R )n 2 ЯМР Циклопропил 2-Cl-4-SO2Me (CDCl3): 0,6–1,8 (м., 11Н), 3,0 (c., 3H), 3,5 (кв., 4Н), 5,05 (с., 1Н), 7,4 (2, 1Н), 7,65 (д., 1Н), 7,75 (с., 1Н). Циклопропил 2-CF3-4-SO2Me (CDCl3): 0,5–1,8 (м., 11Н), 3,1 (c., 3H), 3,5 (кв., 4Н), 5, (с., 1Н), 7,5 (д., 1Н), 7,95 (д., 1Н), 7,95 (д., 1Н), 8,05 (с., 1 ) R 1 (R2) (R )n 2 ЯМР Циклопропил 2-SO2Me (CDCl3): 0,7–1,8 (м., 11Н), 3,4 (c., 3H), 3,5 (кв., 4Н), 5,1 (с., 1Н), 7,2–7,5 (м., 3Н), 7,75–8,0 (м., 1Н). Циклопропил 2-NO2-4-SO2Me Сырое красное масло в дальнейшем неочищенное Циклопропил 2,3-Cl2-4-SO2Me (CDCl3): 0,5–1,8 (м., 11Н), 3,25 (c., 3H), 3,55 (кв., 4Н), 5,0 (с., 1Н), 7,3 (д., 1Н), 7,9 (д., 1Н) Циклопропил 2-Cl-3-OMe-4-SO2Me (CDCl3): 0,6–1,8 (м., 11Н), 3,2 (c., 3H), 3,5 (кв., 4Н), 4,0 (с., 3Н), 5,0 (c, 1Н), 7,1 (д., 1Н), 7,65 (д., 1Н), Циклопропил 2-SO2Me-4-Cl Сырое красное масло без дальнейшей очистки Циклопропил 2-CF3-4-Cl (CDCl3): 0,5–1,7 (м., 11Н), 3,45 (кв., 4H), 5,0 (с., 1Н), 7,3 (c., 2Н), 7,4 (c., 1Н). Циклопропил 2-SMe-4-CF3 Сырое оранжевое масло без дальнейшей очистки Циклопропил 2-CF3-4-SMe Сырое оранжевое масло без дальнейшей очистки Циклопропил 2-F-4-SO2Me Сырое красное масло без дальнейшей очистки Циклопропил 2-SO2Me-4-BrСырое красное масло без дальнейшей очистки R 1 Циклопропил 2-Cl-4-SO2Et Сырое красное масло без дальнейшей очистки Циклопропил 2-Br-4-SO2Me (CDCl3): 0,6–1,9 (м., 11Н), 3,05 (c., 3H), 3,55 (кв., 4Н), 5,05 (c., 1Н), 7,4 (д., 1Н), 7,7 (д., 1Н), 7,95 (c., 1H). Циклопропил 2-Cl-4-SMe (CDCl3): 0,5–1,8 (м., 11Н), 2,45 (c., 3H), 3,45 (кв., 4Н), 5,15 (c, 1Н), 6,9 (д., 1Н), 7,0 (д., 1Н), 7,25 (д., 1Н). Пример 9(а). Раствор четыреххлористого титана (10,4 г) в н-гексане (30 мл) добавлялся по каплям при перемешивании к раствору циклопропилметилкетона (8,4 г) и диэтиламина (43,9 г) в н-гексане (100 мл) при поддержании температуры ниже 25оС. Смесь перемешивалась в течение 5 часов, фильтровалась и фильтрат упаривался досуха, давая 1-циклопропил-1-диэтиламиноэтен (5,3 г) в виде бледно-желтого масла, с его 1Н ЯМР (CDCl3), дающим пики d = 0,5–0,8 (м., 4Н), 1,1 (т., 6Н), 1,4 (м., 1Н), 3,2 (кв., 4Н), 3,45 (с., 1Н), 3,5 (с., 1Н). Пример 10(а). Смесь магния (1,5 г) и четыреххлористого углерода (0,5 мл) в метаноле перемешивалась до тех пор, пока магний полностью не растворялся. т-Бутил 3-циклопропил-3-оксопропионат (11,3 г) добавлялся к смеси и она перемешивалась и нагревалась при температуре дефлегмации в течение 2 часов. Смесь упаривалась досуха и остаток растворялся в толуоле, 4-хлор-2- метилсульфонилбензоилхлорид добавлялся и смесь перемешивалась при комнатной температуре в течение ночи. Она промывалась соляной кислотой и сушилась азеотропным удалением воды. 4-Толуолсульфоновая кислота (0,5 г) добавлялась смесь нагревалась при температуре дефлегмации в течение 5 часов. Охлажденный раствор промывался водой, сушился (безводным сульфатом натрия) и фильтровался. Фильтрат упаривался досуха, давая 1-(4-хлор-2метилсульфонилфенил)-3-циклопропил-пропан-1,3-дион (16,2 г) в виде оранжевого масла, ЯМР (CDCl3): 0,8–1,2 (м., 4Н), 1,5–1,9 (м., 1Н), 3,3 (с., 3Н), 5,8 (с., 1Н), 7,3–7,6 (м., 2Н), 7,9 (с., 1Н). Поступая подобным образом, получали следующие соединения из соответственно замещенных исходных материалов. O O R1 (R2)n (R )n 2 ЯМР Циклопропил 2-SO2Me-4-CF3 (CDCl3): 0,8–1,4 (м., 4Н), 1,5–1,8 (м., 1H), 3,3 (с., 3Н), 5,85 (с., 2Н), 7,5 (д., 1Н), 7,8 (д., 1Н), 8,2 (с., 1Н). Циклопропил 2-SMe-4-Cl (CDCl3): 0,7–1,35 (м., 4Н), 1,4–1,9 (м., 1H), 2,4 (с., 3Н), 6,1 (с., 2Н), 7,0–7,9 (м., 3Н). R 1 Бензоилхлориды получались путем нагревания соответственно замещенных бензойных кислот при температуре дефлегмации с тионилхлоридом в течение 3 часов. Избыток тионилхлорида удалялся упариванием и бензоилхлориды использовались непосредственно без дополнительной очистки. Пример 11(а). Перманганат калия (316 г) добавлялся при перемешивании к суспензии 4-бром-2-метилсульфенилтолуола (90,5 г) в воде, при этом смесь поддерживалась при температуре дефлегмации. Смесь перемешивалась и нагревалась при температуре дефлегмации в течение 3 часов. Смесь фильтровалась и остаток промывался водой. Фильтрат охлаждался до комнатной температуры и экстрагировался этилацетатом. Водный раствор подкислялся до рН 1, насыщался хлористым натрием и экстрагировался этилацетатом. Органический слой промывался водой, сушился (безводным сульфатом натрия) и фильтровался. Фильтрат упаривался досуха, давая 4-бром-2-метилсульфонилбензойную кислоту (44,6 г) в виде светло-коричневого масла, т. пл. 220–220,5оС. Поступая подобным образом, получали следующие соединения из соответственно замещенных исходных веществ: 4-хлор-2-метилсульфонилбензойную кислоту; ЯМР (CDCl3 + DMSO-d6): 3,35 (с., 3Н), 7,5–7,8 (м., 2Н), 7,9 (с., 1Н), 8,2–8,6 (шир., с., 1Н); 2-хлор-4-метилсульфонилбензойную кислоту, т. пл. 187–189оС. Пример 12(а). Перекись водорода (30%) добавлялась к охлажденному раствору 2-метилсульфенил-4-трифторметилбензойной кислоты (6,0 г) и ангидриду уксусной кислоты (3,6 мл) в уксусной кислоте при 10оС. Смесь оставалась нагреваться медленно до комнатной температуры и перемешивалась в течение 0,5 часа. Она перемешивалась и нагревалась при 65оС в течение 3 часов. После охлаждения смесь выливалась в лед и экстрагировалась простым эфиром. Органический слой промывался водой, водным раствором сернокислого железа, сушился (безводным сульфатом магния) и фильтровался. Фильтрат упаривался досуха, давая 2-метилсульфонил-4-трифторметилбензойную кислоту (5,54 г) в виде белого твердого вещества, т. пл. 155,5–156,5оС. Пример 13(а). n-Бутиллитий (2,5 М раствор в гексане; 25 мл) добавлялся в инертной атмосфере к перемешиваемому раствору 4-бром-3- метилсульфенилбензотрифторида (16,4 г) в простом эфире до тех пор, пока сохранялась температура ниже 70оС. Смесь перемешивалась при –70оС в течение 2 часов и затем выливалась на таблетки твердой двуокиси углерода. Смесь перемешивалась в течение 10 минут и добавлялся водный раствор соляной кислоты. Слои отделялись и водный слой экстрагировался эфиром. Объединенные органические слои промывались водой, сушились (безводным сульфатом магния) и фильтровались. Фильтрат упаривался и остаток растирался с циклогексаном, давая 2-метилсульфенил-4- трифторметилбензойную кислоту (12,4 г) в виде белого твердого вещества, ЯМР [(CDCl3)+DMSO-d6)]: 2,45 (с., 3Н), 7,2 (д., 1Н), 7,3 (с., 1Н), 8,0 (д., 1Н), 10,7–11,1 (шир., с., 1Н). Пример 14(а). т-Бутилнитрит (4 мл) добавлялся к смеси 5-хлор-2-метиланилина (4 г) и диметилдисульфида (26,3 г) в хлороформе. После начала реакции одновременно добавлялись т-бутилнитрит (17,7 мл) и 5-хлор-2-метиланилин (16 г). Смесь перемешивалась при комнатной температуре в течение 2 часов и оставлялась стоять в течение ночи. Смесь промывалась водой, водным раствором соляной кислоты (2 М), водой, сушилась (безводным сульфатом магния) и фильтровалась. Фильтрат упаривался досуха, давая 4-хлор-2- метилсульфенилтолуол (24,6 г) в виде красного масла, ЯМР (CDCl3): 2,13 (с., 3Н), 2,2 (с., 3Н), 6,85 (с., 2Н), 7,0 (с., 1Н). Поступая подобным образом, получали следующие соединения из соответственно замещенных веществ: 4-бром-3-метилсульфенилбензотрифторид, т. кип. 84–88оС при 2 мм Но; 2-фтор-4-метилсульфенилтолуол, ЯМР (CDCl3): 2,2 (с., 3Н), 2,45 (с., 3Н), 6,6–6,7 (м., 3Н). Пример 15(а). Охлажденный раствор нитрида натрия (5,8 г) в концентрированной серной кислоте (50 мл) добавлялся по каплям к перемешиваемому раствору 4-метил-3-метилсульфениланилина (12,8 г) в ледяной уксусной кислоте при 20оС. Полученная в результате суспензия добавлялась к смеси меди (I) бромида (12 г), водного раствора соляной кислоты (48–50%) и льда. Смесь перемешивалась при комнатной температуре в течение 3 часов, затем разбавлялась водой и экстрагировалась этилацетатом. Органический слой промывался водой, водным раствором гидроокиси натрия (2 М), сушился (безводным сульфатом магния) и фильтровался. Фильтрат упаривался досуха. Остаток растирался с горячим циклогексаном и фильтровался. Фильтрат упаривался досуха, давая 4-бром-2-метилсульфенилтолуол (8,6 г) в виде коричневого масла, ЯМР (CDCl3): 2,15 (с., 3Н), 2,2 (с., 3Н), 6,5–7,1 (м., 3Н). Пример 16(а). Концентрированная соляная кислота (128 мл) медленно добавлялась к суспензии 2-метилсульфенил-4-нитротолуола (36,6 г) в метаноле. Порошкообразное железо (36 г) добавлялось при перемешивании при поддержании температуры ниже 50оС. Смесь перемешивалась при комнатной температуре в течение 4 часов. Смесь выливалась в воду, нейтрализовалась (добавлением карбоната натрия), фильтровалась, и остаток экстрагировался дихлорметаном. Водный слой экстрагировался дихлорметаном, и объединенные органические слои промывались водным раствором хлористого натрия, сушились (безводным сульфатом магния) и фильтровались. Фильтрат выпаривался досуха, и остаток очищался с помощью хроматографии на двуокиси кремния с элюированием смесью этилацетата и н-гексана, давая 4-метил-3-метилсульфениланилин (12,8 г) в виде оранжевого твердого вещества, ЯМР (CDCl3): 2,2 (с., 3Н), 2,35 (с., 3Н), 3,45 (с., 2Н), 6,1–6,9 (м., 3Н). Пример 17(а). Раствор 4-хлор-2-трифторметилиодбензола (100 г) в эфире добавлялся к суспензии магния (8 г) в эфире с такой скоростью, чтобы поддерживать смесь в условиях дефлегмации. Смесь перемешивалась в условиях дефлегмации в течение 1 часа, а затем охлаждалась до 0оС. Двуокись углерода пропускалась в перемешиваемую смесь в течение 3 часов. Добавлялась соляная кислота (2 М), и получающиеся в результате слои разделялись. Органический слой промывался водой, а затем экстрагировался в водный раствор карбоната натрия, и данный водный экстракт подкислялся до рН 1 и экстрагировался эфиром. Эфирный слой промывался насыщенным раствором хлорида натрия и сушился (безводным сульфатом магния), и растворитель выпаривался, давая 4-хлор-2-трифторметилбензойную кислоту (57,1 г) в виде коричневого твердого вещества, т. пл. 106,5–108оС. Согласно одному из аспектов настоящего изобретения предлагается способ борьбы с ростом сорняков (то есть нежелательной растительности) в локусе, который предусматривает применение по отношению к локусу гербицидно эффективного количества, по крайней мере, одного производного изоксазола об щей формулы I. Для данной цели производные изоксазола обычно используют в форме гербицидных композиций (т.е. в сочетании с совместимыми разбавителями или носителями и/или поверхностно-активными агентами, подходящими для использования в гербицидных композициях), например, как описаны здесь ниже, и эти композиции также составляют часть изобретения. Соединения общей формулы I показывают гербицидную активность в отношении двудольных (т.е. широколистных) и однодольных (например, травянистых сорняков при применении до и/или после появления всходов (пред- и/или послевсходовое применение). Под термином "предвсходовое применение" подразумевается применение к почве, в которой присутствуют семена сорняков или сеянцы до появления всходов сорняков выше поверхности почвы. Термин "послевсходовое применение" означает применение к наземным или открытым частям сорняков, которые проросли выше поверхности почвы. Например, соединения общей формулы I могут использоваться для борьбы с ростом широколистных сорняков, например, Abutilon theophrasti, Amaranthus retroflexus, Bidens pilosa, Chenopodium album, Galium aparine, Ipomoea spp., например Ipomoea purpurea, Sesbania exaltata, Sinapis arvensis, Solanum nigrum, Viola arvensis и Xanthium strumari и m, и травянистых сорняков, например, Alopecurus myosuroides, Digitaria sanguinalis, Echinochloa crus-galli, Ilensine indica и Setaria spp., Setaria faberii и Setaria viridis, и Sorghum halepenst, и осок, например, Cyperus esculentus, Cyperus iria, Cyperus rotundus и Eleocharis acicularis. Применяемые количества соединений общей формулы I изменяются в зависимости от характера сорняков, используемых композиций, времени применения, климатических и почвенных условий и (когда они используются для подавления роста сорняков в областях произрастания культурных растений) характера сельскохозяйственной культуры. При применении к областям произрастания культур степень применения должна быть достаточной для подавления роста сорняков и не вызывать при этом существенного ущерба культуры. Обычно с учетом указанных факторов хорошие результаты дают нормы расхода между 0,01 кг и 5 кг активного вещества на гектар. Однако следует понимать, что могут использоваться более высокие или более низкие нормы расхода в зависимости от конкретных проблем или факторов, с которыми сталкиваются при борьбе с сорняками. Соединения общей формулы I могут использоваться для селективного подавления роста сорняков, например, для подавления роста видов, упомянутых выше, при пред- или послевсходовых применениях прямым или косвенным образом, например, с помощью прямого или косвенного (направленного или ненаправленного) опрыскивания по отношению к локусу, подверженному заражению или заряженному сорняками, которым является используемая область или площадь, или, площадь, которую предполагается использовать, для выращивания сельскохозяйственных культур, например, злаковых, например, пшеницы, ячменя, овса, кукурузы и риса, соевых бобов, кормовых бобов и низкорослой фасоли, гороха, люцерны, хлопка, земляного ореха, льна, лука, моркови, капусты, масличного рапса, подсолнечника, сахарной свеклы, и долголетние или засеваемые пастбищные угодья, перед или после посева культуры, или перед или после появления всходов культур. Для селективного уничтожения сорняков в локусе, зараженном сорняками, которым является используемая или предполагаемая к использованию площадь для выращивания сельскохозяйственных культур, например, культур, упомянутых выше, особенно подходящими являются нормы расхода между 0,01 кг и 4 кг, и предпочтительно между 0,01 кг и 2,0 кг активного вещества на гектар. Соединения общей формулы I могут также использоваться для подавления роста сорняков, особенно, сорняков, указанных выше, с помощью пред- или послевсходового применения в плодовых садах или питомниках и других областях с произрастанием деревьев, например, лесах, лесопарках, и плантациях, например, сахарного тростника, масляничной пальмы и каучуковых плантациях. Для данной цели они могут применяться непосредственным или косвенным образом (например, при непосредственном или косвенном опрыскивании) по отношению к сорнякам или к почве, в которой ожидается их появление, перед или после посадки деревьев или плантаций, при нормах расхода между 0,25 кг и 5,0 кг, и предпочтительно между 0,5 кг и 4,0 кг активного материала на гектар. Соединения общей формулы I могут также использоваться для подавления роста сорняков, особенно, тех, что указаны выше, на участках, которые не являются площадью, засаживаемыми культурами, но на которых тем не менее желательно подавление сорняков. Примерами таких невозделываемых под сельскохозяйственные культуры площадей включают аэродромы, промышленные участки, железные дороги, обочины шоссейных дорог, берега рек, ирригационные и другие водные пути, участки, засаженные кустарником, паровые или невозделываемые земли, особенно места, где необходимо подавлять рост сорняков, для того, чтобы снизить риск пожаров. Когда соединения используются для таких целей, при которых части желателен общий гербицидный эффект, активные соединения обычно применяются при уровнях доз выше, чем те, которые используются в областях возделывания культурных растений, о которых говорилось ранее. Точная доза вероятно зависит от характера обрабатываемой растительности и от необходимого эффекта. Особенно подходящими для данной цели является пред- или послевсходовое применение, и предпочтительно предвсходовое применение, непосредственными или косвенным образом (например, при непосредственном или косвенном опрыскивании или опылении) при нормах расхода между 1,0 и 20,0 кг, и предпочтительно между 6,0 и 10,0 кг активного вещества на гектар. Когда используются для борьбы с ростом сорняков с помощью предвсходового применения, соединения общей формулы I могут вводиться в почву, в которой ожидается появление сорняков. Очевидно понятно, что когда соединения общей формулы I используются для подавления роста сорняков с помощью послевсходового применения, т.е. путем применения к наземным или открытым частям проросших сорня ков, соединения общей формулы I также обычно будут входить в контакт с почвой, и могут также затем обеспечивать предвсходовое подавление позднее прорастающих сорняков в почве. Когда требуется особенно продолжительное подавление сорняков, применение соединений общей формулы I может, если необходимо, повториться. Согласно еще одному аспекту настоящего изобретения предоставляются композиции, подходящие для гербицидного использования, включающие одно или более производных изоксазола общей формулы I в сочетании с, и предпочтительно гомогенно диспергированным в композиции, одним или более совместимыми гербицидно приемлемыми разбавителями или носителями и/или поверхностно-активными агентами (т.е. разбавителями или носителями и/или поверхностно-активными агентами типа, обычного принятого в данной области техники, подходящими для использования в гербицидных композициях, и которые совместимы с соединениями общей формулы I). Термин "гомогенно или равномерно диспергированный" используется для того, чтобы охватить композиции, в которых соединения общей формулы I растворяются в других компонентах. Термин "гербицидные композиции" используется в широком смысле для включения не только композиций, которые готовы для использования в качестве гербицидов, но также и концентратов, которые должны разбавляться перед использованием. Предпочтительно композиции содержат от 0,05 до 90% по весу одного или более соединений общей формулы I. Гербицидные композиции могут содержать как разбавитель или носитель, так и поверхностно-активный (например, смачивающий, диспергирующий или эмульгирующий) агент. Поверхностно-активные агенты, которые могут присутствовать в гербицидных композициях настоящего изобретения, могут быть ионного или неионного типов, например, сульфорицинолеаты, четвертичные аммониевые производные, продукты на основе конденсатов окиси этилена и алкил- и полиарил- фенолами, например, нонил- или октил-фенолами, или эфиры карбоновых кислот и ангидросорбитолов, которые сделаны растворимыми с помощью этерификации свободных гидрокси групп путем конденсации с окисью этилена, соли щелочных и щелочноземельных металлов и эфиров серной кислоты и сульфоновых кислот, такие как динонил- и диоктил-натриевые сульфоносукцинаты, и щелочные и щелочно-земельно-металлические соли производных сульфоновых кислот с высоким молекулярным весом, такие как лигносульфонаты натрия и кальция, и алкилбензолсульфонаты натрия и кальция. Подходящим образом, гербицидные композиции согласно настоящему изобретению могут включать до 10%, например, от 0,05% до 10%, поверхностно-активного агента, но, если необходимо, гербицидные композиции согласно настоящему изобретению могут включать более высокие пропорции поверхностно-активного агента, например, до 15% в жидких эмульгируемых суспензионных концентратах, и до 25% в жидких водо-растворимых концентрациях. Примерами подходящих твердых разбавителей или носителей являются силикат алюминия, тальк, кальцинированная окись магния, кизельгур, трикальцийфосфат, порошкообразная пробка, адсорбент – сажа, и глины, такие как каолин и бентонит. Твердые композиции (которые могут принимать форму дустов, гранул или смачиваемых порошков) предпочтительно приготавливаются путем измельчения соединений общей формулы I с твердыми разбавителями или с помощью пропитки твердых разбавителей или носителей растворами соединений общей формулы I в летучих растворителях, выпаривания растворителей и, если необходимо, измельчения продуктов с тем, чтобы получить порошки. Гранулярные препаративные формы могут приготавливаться с помощью абсорбирования соединений общей формулы I (растворенных в подходящих растворителях, которые могут быть, если необходимо, летучими) на твердых разбавителях или носителях в форме гранул и, если необходимо, выпаривания растворителей, или путем гранулирования композиции в виде порошка, полученных как описано выше. Твердые гербицидные композиции, особенно смачиваемые порошки и гранулы, могут содержать смачивающие и диспергирующие агенты (например, типов, описанных выше), которые могут также, когда они являются твердыми, служить в качестве разбавителей или носителей. Жидкие композиции согласно изобретению могут иметь форму водных, органических или водно-органических растворов, суспензий и эмульсий, которые могут включать поверхностно-активный агент. Подходящие жидкие разбавители для включения в жидкие композиции включают воду, гликоли, тетрагидрофурфуриловый спирт, ацетофенон, циклогексанон, изофорон, толуол, ксилол, минеральные, животные и растительные масла и легкие ароматические и нафтеновые фракции нефти (и смеси этих разбавителей). Поверхностно-активные агенты, которые могут присутствовать в жидких композициях, могут быть ионными или неионными (например, типов, описанных выше), и могут, когда они являются жидкими, также служить в качестве разбавителей или носителей. Порошки, диспергируемые гранулы и жидкие композиции в виде концентратов могут разбавляться водой или другими подходящими разбавителями, например, минеральными или растительными маслами, особенно в случае концентратов, в которых разбавителем или носителем является масло, давая композиции готовые к использованию. При желании жидкие композиции соединений общей формулы I могут использоваться в виде самоэмульгирующихся концентратов, содержащих активные вещества, растворенные в эмульгирующих агентах, совместимых с активными веществами, причем простое добавление воды к таким концентратам дает композиции готовые к употреблению. Жидкие концентраты, в которых разбавителем или носителем является масло, могут использоваться без дополнительного разбавления при использовании приемов электростатического распыления или опрыскивания. Гербицидные композиции согласно настоящему изобретению могут также содержать при желании обычные вспомогательные добавки, такие как адгезивы, защитные коллоиды, загустители, агенты способствующие проникновению, стабилизаторы, комплексообразующие агенты, (связывающие металлы в хелатный комплекс), агенты антислеживания, окрашивающие агенты и ингибиторы коррозии. Эти вспомогательные добавки также могут служить в качестве носителя или разбавителей. Предпочтительными гербицидными композициями согласно настоящему изобретению являются водные суспензионные концентраты, которые включают от 10 до 70% одного или более соединений формулы I, от 2 до 10% поверхностно-активного агента, от 0,1 до 5% загустителя и от 15 до 87,9% воды; смачиваемые порошки, которые включают от 10 до 90% одного или более соединений общей формулы I, от 2 до 10% поверхностно-активного агента и от 8 до 88% твердого разбавителя или носителя; растворимые порошки, которые включают от 10 до 90% одного или более соединений общей формулы I, от 2 до 40% карбоната натрия и от 0 до 88% твердого разбавителя; жидкие водорастворимые концентраты, которые включают от 5 до 50%, например, 10–30% одного или более соединений общей формулы I, от 5 до 25% поверхностно-активного агента и от 25 до 90%, например, 45–85% смешиваемого с водой растворителя, например, диметилформамида, или смеси смешиваемого с водой растворителя и воды; жидкие эмульгируемые суспензионные концентраты, которые включают от 10 до 70% одного или более соединений общей формулы I, от 5 до 15% поверхностно-активного агента от 0,1 до 5% загустителя и от 10 до 84,9% органического растворителя; гранулы, которые включают от 1 до 90%, например 2–10% одного или более соединений общей формулы I, от 0,5 до 7%, например 0,5–2% поверхностно-активного агента и от 3 до 98,5%, например, 88–97,5% гранулярного носителя, и эмульгируемые концентраты, которые включают 0,05–90%, и предпочтительно, от 1 до 60% одного или более соединений общей формулы I, от 0,01 до 10%, и предпочтительно от 1 до 10% поверхностно-активного агента и от 9,99 до 99,94%, и предпочтительно от 39 до 98,99% органического растворителя. Гербицидные композиции согласно настоящему изобретению могут также включать соединения общей формулы I в сочетании с, а предпочтительно равномерно диспергированного в, одном или более другими пестицидно активными соединениями, и, если желательно, одним или более совместимыми пестицидно приемлемыми разбавителями или носителями, поверхностно-активными агентами и обычными вспомогательными добавками, описанными выше. Примеры других пестицидно активных соединений, которые могут включать в композиции, или использоваться в сочетании с гербицидными композициями настоящего изобретения включают гербициды, например, для увеличения спектра подавляемых видов сорняков, например, алахлор [2-хлор-2',6'-диэтил-N-(метокси-метил)-ацетанилид], атразин (2-хлор-4-этиламино-6изопропиламино-1,3,5-триазин), бромоксинил (3,5-дибром-4-гидроксибензонитрил), хлортолурон [N'-(3хлор-4-метилфенил)-N,N-диметилмочевина], цианазин [2-хлор-4-(1-циано-1-метилэтиламино)-6-этиламино1,3,5-триазин], 2,4-D(2,4-дихлорфенокси-уксусная кислота), дикамба (3,6-дихлор-2- метоксибензойная кислота), дифензокват (1,2-диметил-3,5-дифенилпиразолевые соли), флампропметил [метил(+)-2-(N-бензоил3- хлор-4-фторанилино)-пропионат], флуометурон [N'-(3-трифторметилфенил)-N,N-диметилмочевина], изопротурон [N'-(4-изопропилфенил)-N,N-диметилмочевина], инсектициды, например, карбаматы, например, метил N-(1-бутил-карбамоил-бензимидазол-2-ил) карбамал, и триазолы, например, 1-(4-хлор-фенокси)-3,3-диметил-1-(1,2,4-триазол-1-ил)-бутан-2-он. Пестицидно активные соединения и другие биологически активные материалы, которые могут включать в композиции, или использоваться в сочетании с гербицидными композициями настоящего изобретения, например, те, что упоминались ранее, и которые являются кислотами, могут при желании использоваться в форме обычных производных, например, солей щелочных металлов и аминов и сложных эфиров. Согласно следующему аспекту настоящего изобретения предоставляются промышленные изделия, включающие, по крайней мере, одно из производных изоксазола общей формулы I, или, в зависимости от того, что предпочитается, гербицидную композицию, описанную выше, и, предпочтительно, гербицидный концентрат, который должен разбавляться перед употреблением, включающий, по крайней мере, одно из производных изоксазола общей формулы I, внутри контейнера для указанного выше производного или производных общей формулы I, или указанной гербицидной композиции, и инструкции, прилагаемые к указанному контейнеру, описывающие способ, которым следует использовать указанное выше производное или производное общей формулы I и гербицидную композицию, содержащую в нем, для подавления роста сорняков. Контейнеры обычно могут быть представлены типов, обычно используемых для хранения химических веществ, которые являются твердыми при обычных температурах окружающей среды, и гербицидных композиций, особенно в форме концентратов, например, консервные банки и цилиндры из металла, которые могут быть изнутри покрыты лаком, и из пластиновых материалов, бутылки из стекла и пластических материалов, и, когда содержимое контейнера является твердым, например, представляет гербицидные композиции в виде гранул, коробки или ящики, например, из картона, пластиковых материалов и металла, или мешки. Контейнеры обычно имеют достаточную емкость для того, чтобы содержать количества производного изоксазола или гербицидных композиций достаточные для обработки, по крайней мере, одного акра земли для подавления роста деревьев на ней, но и не превышают размер, который является удобным для обычных методов обращения с ним. Инструкции, связанные физически с контейнером, могут быть, например, непосредственно напечатаны на контейнере или на этикетке или ярлыке, прикрепленных к нему. Предписания обычно указывают, что содержимое контейнера, после разбавления, если это необходимо, предназначается к применению для подавления роста сорняков при нормах расхода между 0,01 кг и 20 кг активного вещества на гектар при применении по способу и для целей, описанных выше. Следующие примеры иллюстрируют гербицидные композиции согласно настоящему изобретению: Пример С1. Смачиваемый порошок приготавливался из: – активный ингредиент – (соединение А): 50% вес/вес – нонилфенол/конденсат окиси этилена, содержащий 9 ммоль окиси этилена на ммоль фенола: 5 вес/вес – двуокись кремния с микродисперсными частицами: 5 вес/вес, – синтетический силикат магния – носитель: 40% вес/вес с помощью абсорбирования конденсата на двуокиси кремния, смешения с другими ингредиентами и измельчения смеси на молотковой мельнице, давая смачиваемый порошок. Пример С2. Водный суспензионный концентрат приготавливался из: – активный ингредиент – (соединение А): 50% вес/вес – конденсат нонилфенола и окиси этилена, содержащий 9 ммоль окиси этилена на ммоль фенола: 1 вес/вес – натриевая соль поликарбоновой кислоты: 0,2 вес/объем – этиленгликоль: 5% вес/объем, – полисахаридная ксантановая камедь – загуститель: 0,15% вес/объем – вода до 100% по объему с помощью тщательного смешения ингредиентов и измельчения на шаровой мельнице в течение 24 часов. Пример С3. Жидкий эмульсионный концентрат приготавливался из: – активный ингредиент – (соединение А): 50% (по массе) – ксилен: 75% (по массе) – N,N-диметилформамид: 15% (по массе) – "сопрол-2680" (смесь неионогенного и анионогенного ПАВ): 5% (по массе), указанные выше компоненты подвергаются гомогенному смешиванию. Пример С4. Гранулированный смачивающийся порошок (дуст) приготавливался из: – активный ингредиент – (соединение А): 75% (по массе) – "Изобан № 1" (фирменное наименование анионогенного ПАВ): 10% (по массе) – "Ваирекс-N" (фирменное наименование анионогенного ПАВ): 5% (по массе) – "Карплекс № 80" (фирменное наименование белой сажи): 10% (по массе) указанные выше компоненты подвергаются гомогенному смешиванию и измельчению. Аналогичные смачиваемые порошки, водные концентраты, жидкие эмульсионные концентраты и т.п. могут приготавливаться, как описано выше, при замене изоксазола (соединение А) другими соединениями общей формулы (I). Характерные представители соединений общей формулы (I) использовались для применения в качестве гербицидов в соответствии со следующими процедурами. Способ использования соединений, обладающих гербицидными свойствами: Соответствующие количества соединений, используемых для обработки растений, растворялись в ацетоне, давая растворы, эквивалентные норме расхода до 4000 г испытываемых соединений на гектар (г/га). Эти растворы применялись при распылении 260 литpов жидкости на гектар. а) Предвсходовое подавление сорняков Семена (сорняков и сельскохозяйственных культур) высеивались в горшки с суглинисто-песчаной почвой. Соединения изобретения применялись по отношению к поверхности почвы, как описано выше. в) Послевсходовое подавление сорняков Виды сорняков выращивались до тех пор, пока они не будут готовы для опрыскивания соединениями, используемыми для обработки растений. Стадии роста растений при опрыскивании были следующими: 1) Широколистные сорняки: Abutilon theophrasti 1–2 листа Amaranthus retroflexus 1–2 листа Galium aparine 1–2 мутовки или листьев Sinapsis arvensis 2 листа Ipomoea purpurea 1–2 листа 2) Травянистые сорняки: Alopecurus myosuroides 2 листа Avena fatua 1–2 листа Echinochloa crus-galli 2–3 листа Setaria viridis 2–3 листа 3) Осоки: Cuperus esculentus 3 листа. с) Толерантность культуры Соединения изобретения применялись до появления всходов, как в случае (а), или после появления всходов (стадия 3 листа) по отношению к сельскохозяйственным культурам, как описано выше. Единственный горшок с каждым из видов растений предназначался для каждой обработки, при этом использовался контроль без опрыскивания и контроль с опрыскиванием только ацетоном. После обработки, горшки хранились в теплице, и поливались сверху. Спустя 17–20 дней после опрыскивания производилась визуальная оценка фитотоксичности. Результаты подавления сорняков выражались в виде процентного снижения роста или уничтожения сорняков в сравнении с растениями в контрольных горшках. Толерантность сельскохозяйственной культуры выражалась в виде процента повреждений, причиняемого культуре. Соединения данного изобретения при использовании в дозе 4 кг/га или менее, показали превосходный уровень гербицидной активности вместе с толерантностью культуры в опытах на сорняках, используемых в предыдущих экспериментах. При применении перед появлением всходов в дозе 4000 г/га соединения B, D, E и F дали, по крайней мере, 70% уменьшение роста, одного или более видов сорняков. При применении после появления всходов при дозе 4000 г/га соединения A, C, D, E и F давали 90% снижение роста одного или более видов сорняков. При применении до появления всходов в дозе 1000 г/га соединения G, H, I, J, K, L, M, N, O, P, Q, R, S, T, U, V, W, X, Y, Z, AA, BB, CC, DD, EE, FF, GG, HH, II, JJ, KK, LL, MM и NN давали не менее 90% уменьшения роста одного или более видов сорняков. При применении после появления всходов в количестве 1000 г/га соединения G, I, J, K, L, M, N, O, P, Q, R, S, T, U, V, W, X, Y, Z, AA, BB, CC, DD, EE, FF, GG, HH, II, JJ, KK, LL, MM и NN давали не менее 90% уменьшения роста одного или более видов сорняков. Толерантность культуры наблюдалась на не менее, чем на одном из видов злаковых культур в опытах до появления или после появления всходов, причем, менее, чем 30% ущерб показывает, что соединения обладают хорошим потенциалом в смысле селективного подавления сорняков в посевах злаковых культур. Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 4-benzoylizoxazole with herbicidal activity, herbicidal composition, method to control weed growth
Автори англійськоюCramp Susane Mary, ROBERTS David Alan
Назва патенту російськоюПроизводные 4-бензоилизоксазола, обладающие гербицидной активностью, гербицидная композиция, способ борьбы с ростом сорняков
Автори російськоюКрэмп Сусан Мэри, Робертс Дэвид Алан
МПК / Мітки
МПК: C07D 261/08, A01N 43/80, C07D 261/10, C07D 261/18, C07D 261/14
Мітки: 4-бензоїлізоксазолу, ростом, боротьби, мають, спосіб, гербіцидну, активність, похідні, бур'янів, композиція, гербіцидна
Код посилання
<a href="https://ua.patents.su/19-29380-pokhidni-4-benzolizoksazolu-shho-mayut-gerbicidnu-aktivnist-gerbicidna-kompoziciya-sposib-borotbi-z-rostom-buryaniv.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-бензоїлізоксазолу, що мають гербіцидну активність, гербіцидна композиція, спосіб боротьби з ростом бур’янів</a>
Попередній патент: Фармацевтична композиція для інгаляції та спосіб її одержання
Наступний патент: Каталізатор для гідрокрекінгу вуглеводнів і спосіб гідрокрекінгу вуглеводнів
Випадковий патент: Фіточай № 22 "при каменях у жовчному міхурі"