Фармацевтична композиція співкристалів трамадолу і коксибів
Формула / Реферат
1. Фармацевтична композиція, що містить співкристал (рац)-трамадолу-НСl-целекоксибу (1:1) і щонайменше один полімерний підсилювач розчинності.
2. Фармацевтична композиція за п. 1, в якій полімерний підсилювач розчинності вибирають з прищепленого співполімеру полівінілкапролактам-полівінілацетат-поліетиленгліколь або інших гідрофільних полімерів, таких як коповідон, повідон, полоксамери, циклодекстрин, поліетиленгліколь і лауроїл макрогол-32 гліцериди ЕР, переважно вибирають з прищепленого співполімеру полівінілкапролактам-полівінілацетат-поліетиленгліколь або інших гідрофільних полімерів, які вибирають з коповідону, повідону або полоксамерів.
3. Фармацевтична композиція за будь-яким з пп. 1 або 2, в якій полімерний підсилювач розчинності являє собою прищеплений співполімер полівінілкапролактам-полівінілацетат-поліетиленгліколь.
4. Фармацевтична композиція за будь-яким з пп. 1 або 2, в якій полімерний підсилювач розчинності являє собою співполімер коповідону.
5. Фармацевтична композиція за будь-яким з пп. 1-4, в якій вміст полімерного підсилювача розчинності, що використовується в композиції, знаходиться в діапазоні від 2 до 50 % ваг., переважно від 8 до 12 % ваг. або близько 8 % ваг.
6. Фармацевтична композиція за будь-яким з пп. 1-5, що має лікарську форму, яку вибирають з таблетки, порошкових капсул, або сформульована способом сухого гранулювання, суспендування і сухого вальцювання, переважно в таблетованій формі і найбільш переважно у вигляді таблетки, що виробляється способом прямого пресування.
7. Фармацевтична композиція за п. 1 в таблетованій формі, що містить співкристал (рац)-трамадолу-НСl-целекоксибу (1:1) і щонайменше один полімерний підсилювач розчинності, яку отримують способом прямого пресування.
8. Фармацевтична композиція за будь-яким з пп. 1-7, що додатково містить щонайменше один полімер-сурфактант.
9. Фармацевтична композиція за п. 8, в якій полімер-сурфактант вибирають з мікроінкапсульованого полісорбату 80, мікроінкапсульованого поліоксилу 40 -гідрогенізованої касторової олії і лаурилсульфату натрію.
10. Фармацевтична композиція за будь-яким з пп. 1-9, що містить щонайменше один додатковий фармацевтично прийнятний наповнювач, наприклад наповнювач, дезінтегруючу речовину і/або змащувальну речовину.
11. Фармацевтична композиція за п. 10, в якій наповнювач вибирають з цукру, такого як ксиліт, сорбіт, ізомальт, еритрит, сахароза, фруктоза, декстроза і найбільш переважно висушений розпиленням маніт і сімейство лактози, або з нерозчинних наповнювачів, таких як фосфат кальцію, карбонат кальцію або мікрокристалічна целюлоза, наприклад МСС 102 (90 мкм) і МСС 200 (200 мкм), або з інших сполук, таких як силікатована мікрокристалічна целюлоза або композиції, що містить мікрокристалічну целюлозу, колоїдний діоксид кремнію, натрію крохмалю гліколят і стеарилфумарат натрію, переважно вибирають з цукру, такого як ксиліт, сорбіт, ізомальт, еритрит, сахароза, фруктоза, декстроза, найбільш переважно висушений розпиленням маніт і сімейство лактози, або вибирають з мікрокристалічної целюлози, найбільш переважно вибирають з висушеного розпиленням маніту і мікрокристалічної целюлози.
12. Фармацевтична композиція за п. 10 або 11, в якій змащувальну речовину вибирають з стеарилфумарату, магнію стеарату, тальку, гідрофільного колоїдного діоксиду кремнію і переважно вибирають з стеарилфумарату і тальку,
і/або в якій дезінтегручу речовину вибирають з кросповідону, кроскармелози натрію, натрію крохмалю гліколяту, заздалегідь желатинізованого крохмалю, крохмалю, полакриліну калію, гідроксипропілцелюлози з низькою мірою заміщення (L-HPC), кальцію карбоксиметилцелюлози, альгінової кислоти, переважно є кросповідоном.
13. Фармацевтична композиція за будь-яким з пп. 1-12, в якій співкристал (рац)-трамадолу-НСl і целекоксибу (1:1) характеризується порошковою рентгенограмою з піками [2q] при 7,1, 9,3, 10,2, 10,7, 13,6, 13,9, 14,1, 15,5, 16,1, 16,2, 16,8, 17,5, 18,0, 19,0, 19,5, 19,9, 20,5, 21,2, 21,3, 21,4, 21,8, 22,1, 22,6, 22,7, 23,6, 24,1, 24,4, 25,2, 26,1, 26,6, 26,8, 27,4, 27,9, 28,1, 29,1, 29,9, 30,1, 31,1, 31,3, 31,7, 32,5, 32,8, 34,4, 35,0, 35,8, 36,2 і 37,2 [°], при цьому значення 2θ отримані з використанням випромінювання міді (СuKаl 1,54060Å); і/або
в якій співкристал (рац)-трамадолу-НСl і целекоксибу (1:1) характеризується наявністю смуг абсорбції в інфрачервоному спектрі з перетворенням Фур'є при 3481,6 (m), 3133,5 (m), 2923,0 (m), 2667,7 (m), 1596,0 (m), 1472,4 (m), 1458,0 (m), 1335,1 (m), 1288,7 (m), 1271,8 (m), 1168,7 (s), 1237,3 (m), 1168,7 (s), 1122,6 (s), 1100,9 (m), 1042,2 (m), 976,8 (m), 844,6 (m), 820,1 (m), 786,5 (m) 625,9 (m) см-1; і/або
співкристал (рац)-трамадолу-НСl і целекоксибу (1:1) має орторомбічні елементарні комірки з наступними розмірами:
а=11,0323(7) Å
b=18,1095 (12) Å
с=17,3206(12) Å; і/або
ендотермічний гострий пік співкристала (рац)-трамадолу-НСl і целекоксибу (1:1), відповідний температурі плавлення, починається в точці 164 °C.
14. Спосіб отримання пероральної фармацевтичної композиції за будь-яким з пп. 1-13, в якому здійснюють наступні стадії:
(a) змішування співкристала (рац)-трамадолу-НСl-целекоксибу (1:1) щонайменше з одним полімерним підсилювачем розчинності і, необов'язково, з одним або більше наповнювачем, дезінтегруючою речовиною або полімерним сурфактантом або з будь-якою їх комбінацією;
(b) необов'язкове додавання щонайменше однієї змащувальної речовини;
(c) пряме пресування таблеток з суміші, отриманої на стадії (а), або з суміші з доданням змащувальної речовини зі стадії (b).
15. Фармацевтична композиція за будь-яким з пп. 1-13, призначена для лікування болю, переважно гострого болю, хронічного болю, нейропатичного болю, ноцицептивного болю, болю від легкого і помірного до важкого, гіпералгезії, болю, пов'язаного з центральною сенсибілізацією, алодинії або болю при раку, в тому числі болю при діабетичній нейропатії і діабетичній периферичній нейропатії і остеоартриті, фіброміалгії, ревматоїдному артриті, анкілозуючому спондиліті, плечолопатковому періартриті або попереково-крижовому радикуліті.
Текст
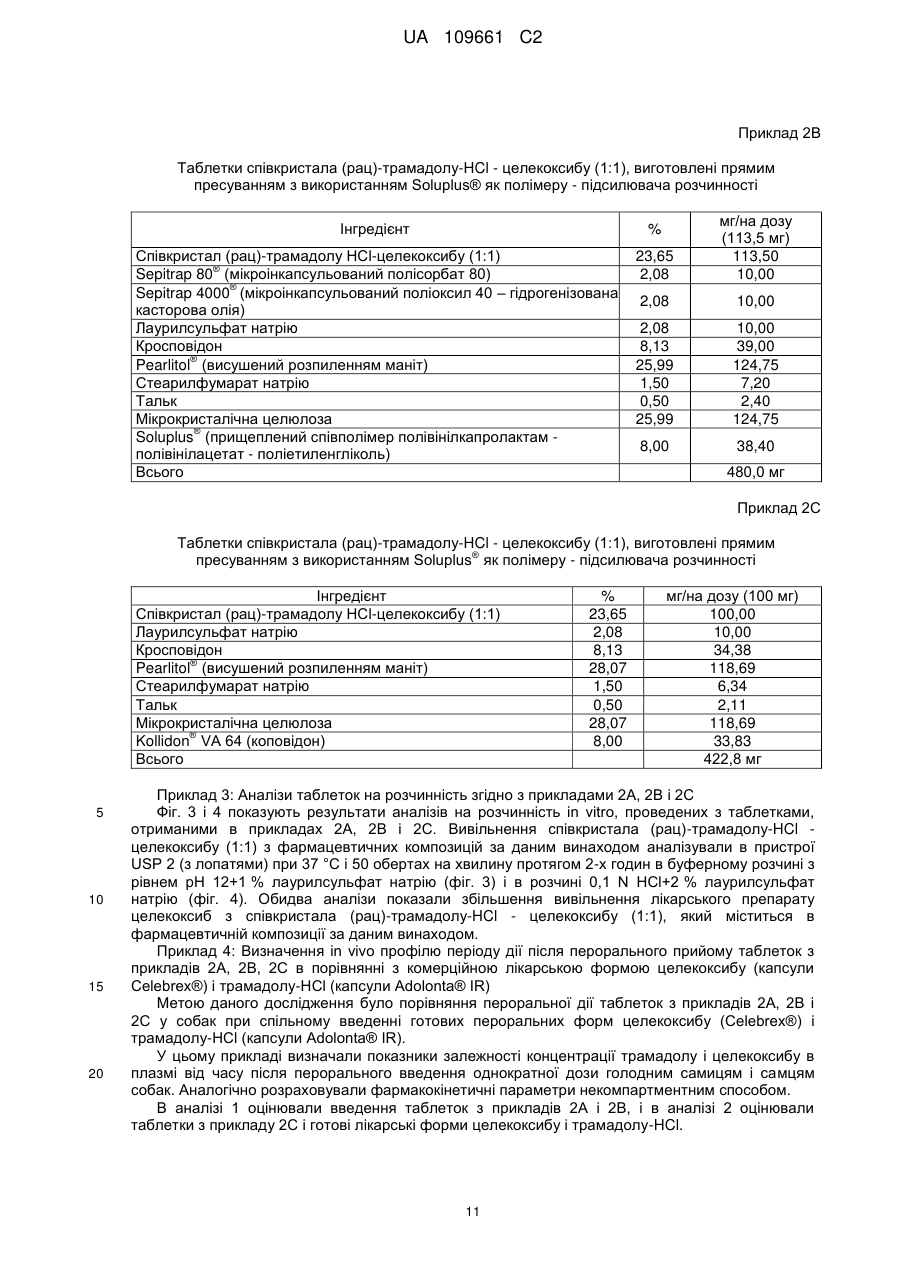
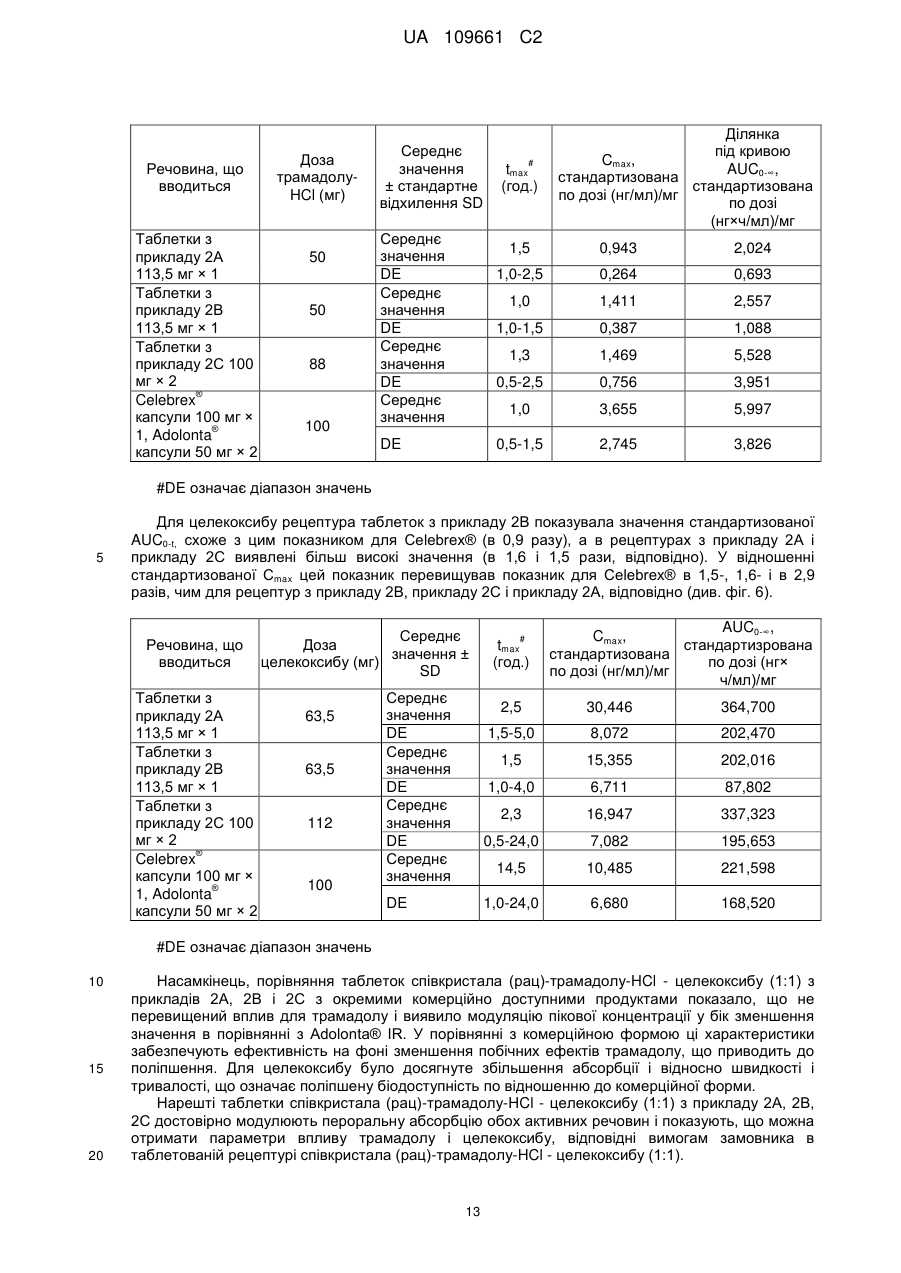
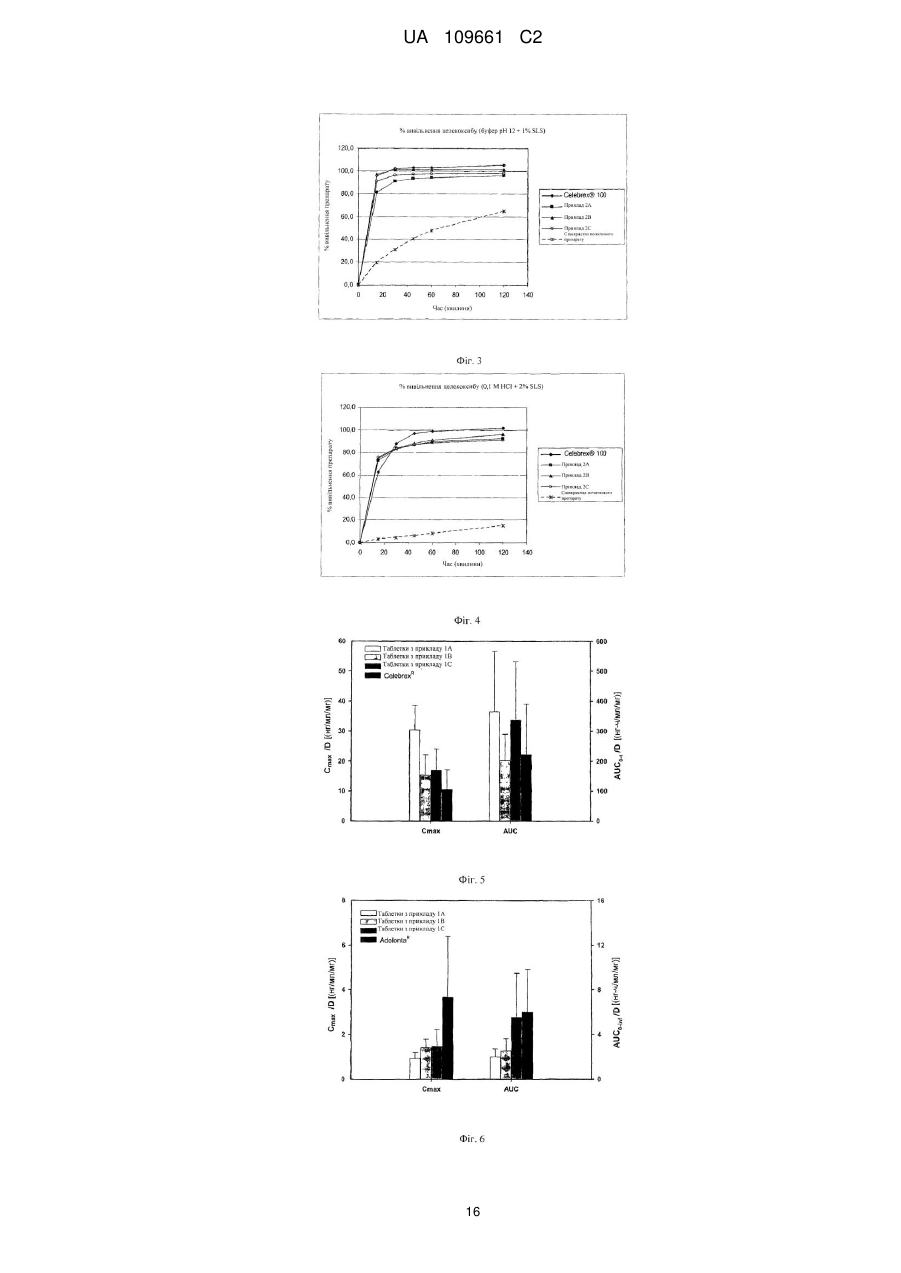
Реферат: Даний винахід стосується пероральних фармацевтичних композицій, що містять співкристали трамадолу і целекоксибу, способів їх отримання і їх застосування як лікарських засобів, більш конкретно, для лікування болю. UA 109661 C2 (12) UA 109661 C2 UA 109661 C2 5 10 15 20 25 30 35 Даний винахід стосується пероральних фармацевтичних композицій, що містять співкристали трамадолу і целекоксибу, способів їх отримання, і їх застосування як лікарських засобів, більш конкретно, для лікування болю. Біль являє собою комплексну реакцію, яка функціонально поділяється на сенсорні, вегетативні, рухові і афективні компоненти. Сенсорний аспект включає в себе інформацію про локалізацію і інтенсивність стимулу, а адаптивний компонент може вважатися активацією ендогенної модуляції болю і плануванням рухової реакції уникнення. Афективний компонент приблизно включає в себе оцінку больового неприємного відчуття і загрози стимулу, а також негативних емоцій, викликаних пам'яттю і обставинами хворобливих стимулів. Больові стани загалом можна розділити на хронічні і гострі. Хронічний біль включає в себе нейропатичний біль і хронічні запальні болі, такі як артрит, болі невідомого походження, наприклад, фіброміалгія. Причиною гострого болю звичайно є пошкодження тканини ненейрогенного характеру, наприклад, пошкодження тканин при хірургічному втручанні або запаленні, або мігрень. Множина відомих ліків, корисних для лікування або контролю болю, включають опіоїди, при цьому похідні морфіну показані для лікування хронічного і гострого болю у людини від помірної до важкої міри. Знеболюючий ефект досягається за допомогою їх дії на морфінові рецептори, переважно, на μ-рецептори. Одним з морфінових похідних, що показали дуже хороші результати при пероральному введенні, є трамадол. Трамадол має хімічну назву 2(диметиламінометил)-1-(3-метоксифеніл)циклогексанол і наступну формулу: На цій структурі показані два різних хіральних центри і, отже, вона може існувати у вигляді різних діастереоізомерів, з яких трамадол є цис-діастереоізомером: (1R, 2R) або (1S, 2S), які також називаються (+)-трамадолом і (-)-трамадолом, обидва з яких надають свою дію різними шляхами. Незважаючи на широке застосування, препарат трамадол як і раніше виявляє ряд побічних ефектів (більшість з яких залежать від дози), таких як затвердіння, діарея, запаморочення, сонливість, сухість у роті, головний біль, нудота, безсоння, блювання, слабкість. Таким чином, для досягнення знеболюючого ефекту при лікуванні болю деяку перевагу буде мати зниження необхідної дози трамадолу (наприклад, за допомогою нової лікарсько-орієнтованої форми і/або рецептури, що включає в себе трамадол). Ще однією загальновідомою аналгетичною сполукою є целекоксиб. Целекоксиб являє собою протизапальний і знеболюючий лікарський засіб, і є одним з найчастіше застосовуваних препаратів в лікуванні хронічних запальних захворювань опорно-рухового апарату. Целекоксиб під хімічною назвою 4-[5-(4-метилфеніл)-3-(трифторметил)піразол-1-іл]бензолсульфонамід має наступну формулу: 1 UA 109661 C2 5 10 15 20 25 30 35 40 45 50 55 60 Целекоксиб являє собою пероральний високо селективний інгібітор циклооксигенази-2 (COX-2), який призначають для полегшення симптомів при лікуванні остеоартриту, ревматоїдного артриту і анкілозуючого спондиліту (Goldenberg ММ. (1999). Селективний інгібітор циклооксигенази-2 целекоксиб застосовують для лікування ревматоїдного артриту і остеоартриту. (Clin. Ther. 21, 1497-513). Властивість високої селективності дозволяє целекоксибу і іншим інгібіторам ЦОГ-2 зменшувати запалення (біль) при мінімальних шлунковокишкових побічних реакціях (наприклад, виразки шлунка), які часто виникають з неселективними нестероїдними протизапальними препаратами (НПЗП). Фермент циклооксигеназа відповідає за утворення простагландинів. Виділяють дві ізоформи: ЦОГ-1 і ЦОГ-2. Виявлено, що ЦОГ-2 являє собою ізоформу ферменту, яка індукується прозапальними стимулами, і передбачається, що ЦОГ-2 насамперед відповідає за синтез простаноїдних медіаторів болю, запалення і лихоманок. ЦОГ-2 також бере участь в процесах овуляції, імплантації і закриття артеріального протоку, регуляції функції нирок і центральної нервової системи (індукція лихоманки, сприйняття болю і когнітивні функції). Вона також може грати важливу роль в загоєнні виразки. ЦОГ-2 була виявлена в тканинах, що оточують виразку шлунка у людини, але не встановлене її значення для загоєння виразки. Добре відомо, що целекоксиб практично нерозчинний у воді, що ставить явні обмеження на його використання в фармацевтичних препаратах. Целекоксиб являє собою молекулу дуже слабої кислоти (pKa 11,1) (http://www.medsafe. govt. nz/profs/Datasheet/з/Celebrexcap. htm), яка у всіх фізіологічних діапазонах рН не є іонізованою формою. Цей препарат володіє високою проникністю, але має дуже низьку розчинність у воді (7 мкг/мл) (Neelam Seedher, Somm Bhatia, 2003 "Solubility enhancement of Cox-2 Inhibitors Using various Solvent Systems", AAPS Pharm.Sci. Tech, 4(3), 1-9). Ці фізико-хімічні властивості примушують відносити целекоксиб до класу II в системі біофармацевтичної класифікації (BCS) (Mehran Yazdanian, Katherine Briggs, Corinne Jankovskty, Amale Hawi, 2004, "The High solubility" Definition of the Current FDA Guidance on Biopharmaceutical Classification System May Be Too Strict for Acidic Drugs", Pharm Res, 21 (2), 295). Отже, міра пероральної абсорбції целекоксибу мабуть, обмежена його поганою розчинністю і низькою швидкістю розчинення, що приводить до недостатньої розчинності в рідинах шлунково-кишкового тракту (Susan K. Paulson, Margaret В. Vaughn, Susan M. Jessen, Yvette Lawal, Christopher J. Gresk, Bo Yan, Timothy J. Maziasz, Chyung S. Cook. Aziz Karim, 2001, "Pharmacokinetics of Celecoxib after Oral Administration in Dogs and Humans: Effect of Food Site of Absorption", J. Pharmacol. & Experim Therapeutics, 297(2), 638-645). Лікарська форма для перорального введення, що продається під назвою Целебрекс (Celebrex®) містить кристалічну форму целекоксибу (вільна кислота) і має абсолютну біодоступність в діапазоні від 20 до 40 % у собак із зниженою абсорбцією (Susan K. Paulson et al., 2001; див. вище). Така мала біодоступність обмежує поширення і доставку препарату в орган-мішень, і, отже, ефективність цього препарату. Недавно опублікована заявка PCT WO 2010/043412 в прикладі 4 описує нові співкристали трамадолу і целекоксибу, які являють собою співкристали (рац)-трамадол-HCl - целекоксиб (1:1), і в згаданому прикладі 4 детально наведені їх властивості. Цей співкристал утворює дуже стабільну і лікарсько-орієнтовану нову хімічну структурну одиницю, яка забезпечує новий спосіб поліпшення властивостей трамадолу, особливо відносно лікування болю. У порівнянні з целекоксибом і трамадолом співкристали виявляють явний синергізм при показаннях, пов'язаних з болем. Додатково, передбачається, що співкристал може показувати (in vivo) поліпшену біодоступність для дії целекоксибу в порівнянні з введенням одного лише целекоксибу і в порівнянні з введенням фізичної суміші целекоксибу і трамадолу. Проте, в даній галузі поки відсутня яка-небудь конкретна описана фармацевтична рецептура, яка дозволить демонструвати ці переваги або навіть посилити ці переваги згаданого нового співкристала у випадку реального медичного застосування цього нового співкристала, наприклад, при його використанні як ліків для людини. Відповідно, існує потреба в рецептурі цього нового співкристала, згаданого як приклад 4 в опублікованій заявці WO 2010/043412, яка зберігає властивості співкристала або навіть здатна їх поліпшувати. У зв'язку з цим загальною метою даного винаходу є отримання пероральної рецептури, що містить співкристал (рац)-трамадол-HCl і целекоксиб (1:1), згідно з описом WO 2010/043412, приклад 4. Бажана пероральна рецептура, будучи метою даного винаходу, повинна зберігати співкристалічну структуру (рац)трамадолу-HCl і целекоксибу (1:1). Ця властивість має або може мати ту перевагу, що зберігаються поліпшені властивості, що залишаються в кристалічній структурі співкристала, і загалом збереження кристалічних структур в пероральній рецептурі часто є вельми корисним. 2 UA 109661 C2 5 10 15 20 25 30 35 40 45 50 55 Додатковими властивостями бажаної пероральної рецептури, що являє собою мету даного винаходу, які також можуть мати достатню перевагу, є підвищення стабільності і/або розчинності активних речовин, що містяться в співкристалі. Особливо бажані поліпшення/перевага рецептури співкристала (рац)-трамадолу-HCl целекоксибу (1:1) будуть включати в себе: - збереження властивостей і фізичних характеристик створених співкристалів, - поліпшення фізико-хімічних властивостей співкристалів для підвищення абсорбції і/або біодоступності, - легку доступність, простоту виробництва, - можливість підвищення швидкості розчинення, особливо при розчиненні у водному фізіологічному середовищі, - модуляцію пероральної абсорбції для обох активних речовин, - збереження або поліпшення біодоступності трамадолу і поліпшення розчинності целекоксибу як такого або будь-якої фармацевтичної композиції, що містить целекоксиб, - однаковий вплив для трамадолу і/або поліпшення абсорбції целекоксибу як такого або будь-якої фармацевтичної композиції, що містить трамадол або целекоксиб, відповідно, - не залежне від розміру частинок співкристала його існування, або - по суті відсутність агломератів і/або по суті збереження відсутності агломератів, або при введенні пацієнту: - зменшення варіабельності вмісту в крові у різних суб'єктів і в одного суб'єкта, або - вияв хорошої швидкості абсорбції (наприклад, підвищення рівня вмісту в плазмі або ділянці під кривий AUC), або - вияв високої максимальної концентрації в плазмі (наприклад, Cmax), або - вияв зменшеного часу досягнення пікової концентрації препарату в плазмі (t max), або - вияв зміни періоду напіввиведення сполуки (t2), в залежності від переваги напряму цих змін. Інші бажані поліпшення/переваги нової пероральної композиції будуть включати ефективність (підвищення ефективності) при захворюваннях або симптомах, які присутні або пов'язані з болем і його підтипами, зокрема, при захворюваннях або симптомах, для яких недостатньо поточне лікування, наприклад, попереково-крижовий радикуліт або плечелопатковий періартрит, або при болях, пов'язаних з центральною сенсибілізацією (синдром центрального болю). Найбільш бажані нові лікарсько-орієнтовані форми повинні поєднувати більше однієї і більшість з вказаних переваг. Ця мета була досягнута шляхом отримання (пероральної) фармацевтичної композиції, що містить співкристал (рац)-трамадол-HCl - целекоксиб (1:1) і щонайменше один підсилювач розчинності полімеру. Переважно така фармацевтична композиція буде містити співкристал (рац)-трамадол-HCl - целекоксиб (1:1) в кількості від 10 до 50 % ваг., переважно від 15 до 40 % ваг., найбільш переважно від 20 до 30 % ваг. Як більш детально показано в експериментальній частині опису, в одному з прикладів (пероральна) фармацевтична композиція згідно з винаходом виявляє однакову дію трамадолу і в той же час може модулювати пікові концентрації трамадолу у бік зменшення значень в порівнянні з комерційним продуктом трамадолу Адолонта (Adolonta®), тим самим забезпечуючи ефективність при одночасному зниженні побічних ефектів. У відношенні целекоксибу (пероральна) фармацевтична композиція згідно з винаходом також виявляє збільшену абсорбцію, що приводить до поліпшення біодоступності. "Полімер - підсилювач розчинності" стосується полімерів, здатних поліпшувати систему пероральної доставки погано розчинної активної речовини (наприклад, целекоксибу). Приклади включають в себе прищеплений співполімер полівінілкапролактам -полівінілацетат поліетиленгліколь, коповідон або циклодекстрин. Полімером - підсилювачем розчинності можна вважати такі полімери, включення яких в рецептуру приводить до вивільнення речовини, що має коефіцієнт розчинення >1 в порівнянні з рецептурою, що не містить якого-небудь із згаданих прикладів (див. приклад 1 і фіг. 1 і 2.). Загалом, функція "полімеру - підсилювача розчинності" визначається його назвою і складається в підвищенні розчинності, особливо ліків, що вводяться перорально. Це поняття є загальновживаним і зрозумілим в даній галузі (див., наприклад, публікацію під заголовком (і відповідний реферат) авторів Kim and Park, американський журнал Drug Delivery, Vol. 2, № 2, (2004) стор. 113-130 (18).) Співвідношення (1:1), вказане у винаході, означає, що молекулярне співвідношення (рац)трамадолу - HCl і целекоксибу в співкристалі становить 1:1. 3 UA 109661 C2 5 10 15 20 25 30 35 40 45 50 55 60 У фармацевтичній композиції за даним винаходом переважно збережена структура співкристала в рецептурі і при розчиненні в ній підвищується швидкість вивільнення целекоксибу і/або трамадолу в порівнянні з одним співкристалом. Очевидно, що це являє собою збільшення біодоступності в порівнянні з очищеною лікарською сировиною целекоксибу і трамадолу і з препаратами порівняння. Також рецептура співкристала (рац)-трамадолу-HCl целекоксибу (1:1) має підвищену стабільність. У переважному варіанті здійснення процентна частка співкристала (рац)-трамадолу-HCl целекоксибу (1:1) з фармацевтичної композиції згідно з винаходом, розчинена в фізіологічній рідині або в рідині, що імітує фізіологічні рідини (наприклад, 0,1 N розчин HCl з 2 % SLS (лаурилсульфат натрію), або в буферному розчині з рівнем рН 12 з 1 % SLS), зокрема, особливо в лужній рідині, протягом перших 30 хвилин буде складати більш ніж 85 % і/або протягом перших 45 хвилин буде складати більш ніж 90 % (наприклад, в тесті USP на розчинність з лопаттю-мішалкою). У переважному варіанті здійснення "полімери - підсилювачі розчинності" вибирають з наступного: прищеплений співполімер капролактам-полівінілацетат - поліетиленгліколь (Soluplus® (Солюплюс)) або інші гідрофільні полімери, такі як коповідон (співполімер 1-вініл-2піролідону і вінілацетату; Kollidon® VA 64 (Коллідон)), повідон, полоксамери (неіонні співполімери поліоксіетилену-поліоксипропілену, наприклад, p.exLutrol® (Лутрол)), циклодекстрин (Kleptose® (Клептоза)), поліетиленгліколь і його похідні (ПЕГ) і гліцерилбегенат (Gelucire® (Гелуцир)), або вибирають з прищепленого співполімера полівінілкапролактам полівінілацетат - поліетиленгліколь (Soluplus®) або інших гідрофільних полімерів, таких як коповідон (співполімер 1-вініл-2-піролідону і вінілацетату; Kollidon® VA 64), повідон, полоксамери (неіонні співполімери поліоксіетилену-поліоксипропілену р.ex Lutrol®), циклодекстрин (Kleptose®), поліетиленгліколю і його похідних (ПЕГ) і лауроїл макрогол-32 гліцеридів EP (Gelucire 44/14®). Переважно, "полімери - підсилювачі розчинності" вибирають з наступного: прищеплений співполімер капролактам - полівінілацетат - поліетиленгліколь (Soluplus®) або інші гідрофільні полімери, вибирані з коповідону (співполімер 1-вініл-2піролідону і вінілацетату; Kollidon® VA 64), повідону або полоксамерів (неіонні співполімери поліоксіетилену-поліоксипропілену, наприклад, p.ex Lutrol®) або з подібних до перелічених вище, або вибирають з прищепленого співполімера полівінілкапролактам - полівінілацетат поліетиленгліколь (Soluplus®) або інших гідрофільних полімерів, які вибирають з коповідону (співполімери 1-вініл-2-піролідону і вінілацетату; Kollidon® VA 64), повідону або полоксамерів (неіонні співполімери поліоксіетилену -поліоксипропілену, наприклад, p.ex Lutrol®), або подібних до перелічених вище. Найкращі результати були отримані з Soluplus® і коповідоном (Kollidon® VA 64). Відповідно, в одному з переважних варіантів здійснення фармацевтичної композиції згідно з винаходом полімер - підсилювач розчинності вибирають з прищепленого співполімера полівінілкапролактам - полівінілацетат - поліетиленгліколь або інших гідрофільних полімерів, таких як коповідон, повідон, полоксамери, циклодекстрин, поліетиленгліколь і лауроїл макрогол32 гліцериди EP, і переважно вибирають з прищепленого співполімера полівінілкапролактам полівінілацетат - поліетиленгліколь або інших гідрофільних полімерів, які вибирають з коповідону, повідону або полоксамерів. В іншому варіанті здійснення фармацевтичної композиції за даним винаходом полімер - підсилювач розчинності вибирають з прищепленого співполімера капролактам - полівінілацетат - поліетиленгліколь або інших гідрофільних полімерів, таких як коповідон, повідон, полоксамери, циклодекстрин, поліетиленгліколь і гліцерилбегенат, і переважно вибирають з прищепленого співполімера капролактам полівінілацетат - поліетиленгліколь або інших гідрофільних полімерів, які вибирають з коповідону, повідону або полоксамерів, або подібних до перелічених вище. У дуже переважному варіанті здійснення фармацевтичної композиції за даним винаходом полімер - підсилювач розчинності являє собою прищеплений співполімер полівінілкапролактам . полівінілацетат - поліетиленгліколь (Soluplus®) В іншому варіанті здійснення фармацевтичної композиції за даним винаходом полімер - підсилювач розчинності являє собою прищеплений співполімер капролактам - полівінілацетат - поліетиленгліколь (Soluplus®). Soluplus® (зареєстрована торгова марка BASF Corporation) являє собою прищеплений співполімер полівінілкапролактам - полівінілацетат - поліетиленгліколь. В іншому дуже переважному варіанті фармацевтичної композиції згідно з винаходом полімером - підсилювачем розчинності є коповідон. Коповідон являє собою співполімер 1-вініл-2-піролідону і вінілацетату. Комерційним продуктом як приклад є Kollidon® VA 64 (зареєстрований товарний знак компанії BASF ® Corporation). Kollidon VA 64 (коповідон) являє собою співполімер вінілпіролідону-вінілацетату, 4 UA 109661 C2 5 10 15 20 25 30 35 40 45 50 55 60 який розчинний у воді і спирті. Співвідношення вінілпіролідон:вінілацетат в співполімері становить 6:4. Цей полімер є високо гідрофільним, що приводить до більш сильного зволоження співкристала трамадолу і целекоксибу і до поліпшення розчинності препарату. Кількість полімеру - підсилювача розчинності, що використовується в фармацевтичній композиції згідно з винаходом, знаходиться в діапазоні від 2 до 50 % ваг., переважно від 8 до 12 % ваг. Очевидно, немає помітного збільшення в швидкості вивільнення целекоксибу при підвищенні рівня вмісту в фармацевтичній композиції згідно з винаходом полімеру підсилювача розчинності в межах 8-12 % ваг. Тому, з урахуванням цих результатів, переважний рівень вмісту полімеру - підсилювача розчинності буде складати близько 8 % ваг. Відповідно, в переважному варіанті здійснення фармацевтичної композиції за даним винаходом вміст полімеру - підсилювача розчинності, що використовується в рецептурі згідно з винаходом, знаходиться в межах від 2 до 50 % ваг., переважно від 8 до 12 % ваг. або близько 8 % ваг. Можна створювати рецептуру співкристала (рац)-трамадолу-HCl - целекоксибу (1:1) у вигляді таблеток, отриманих способом прямої компресії, який добре відомий в даній галузі. Це найбільш відповідна технологія виробництва, оскільки вона є менш агресивною по відношенню до структури співкристала, мабуть, показує найкращі результати по поліпшенню розчинності, а також являє собою найбільш економічний спосіб, щонайменше один з найбільш економічних способів виробництва. Крім того, рецептуру співкристалів (рац)-трамадолу-HCl - целекоксибу (1:1) можна створювати у вигляді порошкових капсул, сухого грануляту, суспензій і способом сухого вальцювання. В іншому переважному варіанті здійснення форму фармацевтичної композиції згідно з винаходом вибирають з таблетки, порошкової капсули, або композицію створюють шляхом сухого гранулювання, суспендування і сухого вальцювання, переважно, в таблетованому вигляді, і найбільш переважно, у вигляді таблетки, що проводиться способом прямого пресування. Відповідно, в іншому переважному варіанті здійснення фармацевтичну композицію згідно з винаходом виробляють в таблетованій формі, що містить співкристал (рац)-трамадолу-HCl целекоксибу (1:1) і щонайменше один полімер - підсилювач розчинності, і згадану таблетку отримують способом прямого пресування. Паралельний аспект винаходу стосується (пероральної) фармацевтичної композиції у вигляді таблетки, що містить співкристал (рац)-трамадолу-HCl - целекоксибу (1:1), яку отримують способом прямого пресування, і згадана таблетка переважно містить щонайменше один полімер - підсилювач розчинності (як указано вище), або перед прямим пресуванням виготовляють суміш, для чого перед впливом прямого пресування цю композицію найбільш переважно змішують щонайменше з одним полімером - підсилювачем розчинності. Фармацевтична композиція переважно буде містити співкристал (рац)-трамадолу-HCl целекоксибу (1:1) в кількості від 10 до 50 % ваг., переважно від 15 до 40 % ваг., найбільш переважно від 20 до 30 % ваг. З метою підвищення розчинності целекоксибу співкристал (рац)-трамадолу-HCl целекоксибу (1:1) можна змішувати (наприклад, з полімером - підсилювачем розчинності) і здійснювати пряме пресування щонайменше з одним полімером - підсилювачем розчинності. У таблетках, виготовлених способами прямого пресування або змішування/прямого пресування, поліпшене вивільнення целекоксибу. Таким чином, спосіб прямого пресування рекомендований з економічних міркувань і для запобігання можливим структурним змінам співкристала. У деяких переважних варіантах здійснення, що розглядають пряме пресування, сила стиснення, що прикладається в ході прямого пресування, може складати від 0,5 кН до 75 кН. Поверхнево-активні речовини (або полімери - сурфактанти) можуть сприяти підвищенню розчинності препарату. Сурфактанти можна вибирати з аніонних, катіонних або нейтральних речовин. Вибирають наступні сурфактанти/полімери: лаурилсульфат натрію (SLS), Sepitrap 80® (мікроінкапсульований полісорбат 80) і Sepitrap 4000® (мікроінкапсульований поліоксил 40 гідрогенізована касторова олія). Переважно фармацевтична композиція за даним винаходом буде містити сурфактант/сурфактанти в кількості від 1 до 20 % ваг., переважно від 2 до 15 % ваг., найбільш переважно від 3 до 10 % ваг. В іншому переважному варіанті здійснення фармацевтична композиція за даним винаходом, що містить співкристал (рац)-трамадолу-HCl - целекоксибу (1:1), додатково містить щонайменше один сурфактант, переважно, сурфактант - полімер, який вибирають з мікроінкапсульованого полісорбату 80, мікроінкапсульованого поліоксилу 40 - гідрогенізованої касторової олії і лаурилсульфату натрію. У таких переважних варіантах здійснення фармацевтична композиція за даним винаходом, що містить співкристал (рац)-трамадолу-HCl 5 UA 109661 C2 5 10 15 20 25 30 35 40 45 50 55 60 целекоксибу (1:1) і щонайменше один полімер - підсилювач розчинності, яку отримують способом прямого пресування, додатково містить щонайменше один сурфактант, переважно полімер - сурфактант, який вибирають з мікроінкапсульованого полісорбату 80, мікроінкапсульованого поліоксилу 40 - гідрогенізованої касторової олії і лаурилсульфату натрію. Для способу прямого пресування необхідні відповідні реологічні параметри і відповідна стисливість суміші, що створюється, а також відповідна однорідність суміші для забезпечення правильного дозування і належної продуктивності в промислових масштабах. Звичайними інгредієнтами рецептури таблеток є наповнювачі. При виборі наповнювача необхідно враховувати деформаційну поведінку наповнювача і реологічні властивості. Для отримання збалансованої формули використовують сипкі наповнювачі, що спільно обробляються, спеціально призначені для прямого пресування, загальновідомі наповнювачі з властивостями пластичної деформації. Крім того, також необхідно враховувати розчинність наповнювачів у воді, що буде сприяти добрій дезінтеграції таблетки і швидкому розчиненню активного фармацевтичного інгредієнта (API). Розчинні наповнювачі вибирають з сімейства цукрів, таких як ксиліт, сорбіт, ізомальт, еритрит, сахароза, фруктоза, глюкоза, і найбільш переважним є висушений розпиленням маніт і сімейство лактози; для створення рецептури співкристала використовують як нерозчинний наповнювач фосфат кальцію, карбонат кальцію і найбільш переважно мікрокристалічну целюлозу (МСС): MCC 102 (90 мкм) і MCC 200 (200 мкм) або такі сполуки, як силікатизована мікрокристалічна целюлоза або Prosolv® Easytab (композит, що містить мікрокристалічну целюлозу, колоїдний діоксид кремнію, крохмаль натрію і стеарилфумарат натрію) або Prosolv SMCC (композит силікатизованої мікрокристалічної целюлози). Вибрані для прикладів наповнювачі являють собою висушений розпиленням маніт і мікрокристалічну целюлозу, які є наповнювачами з хорошою текучістю. Ковзні речовини (лубриканти-наповнювачі) можна вводити в рецептуру з метою оптимізації реологічних властивостей рецептури і запобігання адгезії пробивних штампів під час компресії. Ковзні речовини можна вибирати з стеарилфумарату, магнію стеарату, тальку, гідрофільного колоїдного діоксиду кремнію (Aerosil® 200). Вибраними для прикладів ковзними речовинами є стеарилфумарат і тальк. Дезінтегруючу речовину можна вводити в рецептуру для полегшення руйнування таблетки у водному середовищі на більш дрібні фрагменти, сприяючи тим самим більш швидкому вивільненню лікарської субстанції. Дезінтегруюча речовина може діяти за допомогою трьох основних механізмів: набухання, капілярного просочення і деформації. Дезінтегруючу речовину можна вибирати з кросповідону, натрію кроскармелози, натрію крохмалю гліколяту, заздалегідь желатинізованого крохмалю, крохмалю, полакриліну калію, гідроксипропілцелюлози з низькою мірою заміщення (L-HPC), кальцію карбоксиметилцелюлози, альгінової кислоти. Вибраною для прикладів дезінтегруючою речовиною є кросповідон. Таким чином, в переважному варіанті здійснення фармацевтичної композиції за даним винаходом ця композиція містить щонайменше один додатковий фармацевтично прийнятний наповнювач, такий як наповнювач, дезінтегруюча речовина і/або ковзна речовина. У переважному варіанті здійснення фармацевтичної композиції за даним винаходом наповнювач вибирають з цукру, такого як ксиліт, сорбіт, ізомальт, еритрит, сахароза, фруктоза, декстроза, і найбільш переважними є висушений розпиленням маніт і сімейство лактози, або з нерозчинних наповнювачів, таких як кальцію фосфат, кальцію карбонат або мікрокристалічна целюлоза, наприклад, MCC 102 (90 мкм) і MCC 200 (200 мкм) або з інших сполук, таких як силікатизована мікрокристалічна целюлоза або композиції, що містять мікрокристалічну целюлозу, колоїдний діоксид кремнію, крохмаль натрію і стеарилфумарат натрію, переважно вибирають з цукру, такого як ксиліт, сорбіт, ізомальт, еритрит, сахароза, фруктоза, декстроза, при цьому найбільш переважними є висушений розпиленням маніт і сімейство лактози, або вибирають з мікрокристалічної целюлози, і найбільш переважно вибирають з висушеного розпиленням маніту і мікрокристалічної целюлози. Переважний вміст наповнювача/наповнювачів в фармацевтичній композиції за даним винаходом вибирають в діапазоні від 20 до 80 % ваг., переважно від 30 до 70 % ваг. або від 40 до 60 % ваг. У переважному варіанті здійснення фармацевтичної композиції згідно з винаходом ковзну речовину вибирають з стеарилфумарату, магнію стеарату, тальку, гідрофільного колоїдного діоксиду кремнію (наприклад, Aerosil® 200), і переважно вибирають з стеарилфумарату і тальку. Вміст ковзної речовини/речовини в фармацевтичній композиції за даним винаходом переважно буде складати від 0,5 до 10 % ваг., переважно від 1 до 5 % ваг. У переважному варіанті здійснення фармацевтичної композиції за даним винаходом дезінтегруючу речовину вибирають з кросповідону, натрію кроскармелози, натрію крохмалю 6 UA 109661 C2 5 10 15 20 25 30 35 40 45 50 55 60 гліколяту, заздалегідь желатинізованого крохмалю, крохмалю, полакриліну калію, гідроксипропілцелюлози з низькою мірою заміщення (L-HPC), кальцію карбоксиметилцелюлози, альгінової кислоти, переважно, кросповідону. Вміст дезінтегруючої речовини в фармацевтичній композиції за даним винаходом переважно буде складати від 1 до 20 % ваг., переважно від 2 до 15 % ваг., найбільш переважно від 3 до 10 % ваг. Найбільш переважно співкристал (рац)-трамадолу-HCl і целекоксибу (1:1), який міститься в (пероральній) фармацевтичній композиції за даним винаходом являє собою співкристал (рац)трамадолу-HCl і целекоксибу (1:1), опис і властивості якої (а також приклади отримання) наведені в прикладі 4 заявки WO 2010/043412. Таким чином, в найбільш переважному варіанті здійснення фармацевтичної композиції за даним винаходом співкристал (рац)-трамадолу-HCl і целекоксибу (1:1), що міститься в (пероральній) фармацевтичній композиції, виявляє характер рентгенівської порошкової дифракції з списами [2θ] при 7,1, 9,3, 10,2, 10,7, 13,6, 13,9, 14,1, 15,5, 16,1, 16,2, 16,8, 17,5, 18,0, 19,0, 19,5, 19,9, 20,5, 21,2, 21,3, 21,4, 21,8, 22,1, 22,6, 22,7, 23,6, 24,1, 24,4, 25,2, 26,1, 26,6, 26,8, 27,4, 27,9, 28,1, 29,1, 29,9, 30,1, 31,1, 31,3, 31,7, 32,5, 32,8, 34,4, 35,0, 35,8, 36,2 і 37,2 [°]. Значення 2θ були отримані з використанням мідного випромінювання (CuKa1 1,54060Å). Додатково в найбільш переважному варіанті здійснення фармацевтичної композиції за даним винаходом співкристал (рац)-трамадолу-HCl і целекоксибу (1:1), що міститься в (пероральній) фармацевтичній композиції, показує смуги абсорбції в інфрачервоному спектрі з перетворенням Фур'є при 3481,6 (m), 3133,5 (m), 2923,0 (m), 2667,7 (m), 1596,0 (m), 1472,4 (m), 1458,0 (m), 1335,1 (m), 1288,7 (m), 1271,8 (m), 1168,7 (s), 1237,3 (m), 1168,7 (s), 1122,6 (s), 1100,9 -1 (m), 1042,2 (m), 976,8 (m), 844,6 (m), 820,1 (m), 786,5 (m) 625,9 (m) см . Додатково в найбільш переважному варіанті здійснення фармацевтичної композиції за даним винаходом співкристал (рац)-трамадолу-HCl і целекоксибу (1:1), що міститься в (пероральній) фармацевтичній композиції, має ромбічні елементарні осередки з наступними розмірами: а=11,0323 (7) Å b=18,1095 (12) Å с=17,3206 (12) Å Додатково в найбільш переважному варіанті здійснення фармацевтичної композиції за даним винаходом співкристал (рац)-трамадолу-HCl і целекоксибу (1:1), що міститься в (пероральній) фармацевтичній композиції, показує ендотермічний гострий пік співкристала, відповідний температурі плавлення, що починається в точці 164 °C. Інший варіант здійснення даного винаходу стосується способу виробництва пероральної фармацевтичної композиції згідно з винаходом, як описано вище, і вказаний спосіб містить наступні етапи: (a) змішування співкристала (рац)-трамадолу-HCl - целекоксибу (1:1) (як описано, наприклад, в прикладі 4 з WO 2010/043412), щонайменше з одним полімером - підсилювачем розчинності і, необов'язково, з одним або більше наповнювачем, дезінтегруючою речовиною або полімером - сурфактантом, або з будь-якою їх комбінацією; (b) необов'язкове додання щонайменше однієї ковзної речовини; (с) пряме пресування таблеток з суміші, отриманої на етапі (а) або з суміші з доданням ковзної речовини з етапу (b). У переважному варіанті здійснення способу згідно з винаходом в суміш з етапу (а) підмішують наповнювач. Фармацевтичні композиції згідно з даним винаходом корисні для лікуванні болю, переважно гострого болю, хронічного болю, нейропатичного болю, ноцицептивного болю (вісцерального і/або соматичного болю), болю від легкого і помірного до важкого, гіпералгезії, болю, пов'язаного з центральною сенсибілізацією, алодинії або болю при раку, в тому числі болю при діабетичній нейропатії і діабетичній периферичній нейропатії і остеоартриті, фіброміалгії, ревматоїдному артриті, анкілозуючому спондиліті, плечелопатковому періартриті або попереково-крижовому радикуліті. Таким чином, ще в одному аспекті винахід також стосується фармацевтичної композиції згідно з даним винаходом, що містить співкристал (рац)-трамадолу-HCl і целекоксибу (1:1) для лікування болю, переважно гострого болю, хронічного болю, нейропатичного болю, ноцицептивного болю (вісцерального і/або соматичного болю), болю від легкого і помірного до важкого, гіпералгезії, болю, пов'язаного з центральної сенсибілізацією, алодинії або болю при раку, в тому числі болю при діабетичній нейропатії і діабетичній периферичній нейропатії і остеоартриту, фіброміалгії, ревматоїдному артриті, анкілозуючому спондиліті, плечелопатковому періартриті або попереково-крижовому радикуліті. У іншому аспекті винахід 7 UA 109661 C2 5 10 15 20 25 30 35 також стосується використання фармацевтичної композиції по справжньому винаходу, що містить співкристал (рац)-трамадолу-HCl і целекоксибу (1:1), у виробництві лікарського засобу для лікування болю, переважно гострого болю, хронічного болю, нейропатичного болю, ноцицептивного болю (вісцерального і/або соматичного болю), болю від легкого і помірного до важкого, гіпералгезії, болю, пов'язаного з центральної сенсибілізацією, алодинії або болю при раку, в тому числі болю при діабетичній нейропатії і діабетичній периферичній нейропатії і остеоартриту, фіброміалгії; ревматоїдному артриті, анкілозуючому спондиліті, плечелопатковому періартриті або попереково-крижовому радикуліті. У додатковому аспекті винахід також стосується способу лікування болю, переважно гострого болю, хронічного болю, нейропатичного болю, ноцицептивного болю (вісцерального і/або соматичного болю), болю від легкого і помірного до важкого, гіпералгезії, болю, пов'язаного з центральною сенсибілізацією, алодинії або болю при раку, в тому числі болю при діабетичній нейропатії і діабетичній периферичній нейропатії і остеоартриту, фіброміалгії; ревматоїдному артриті, анкілозуючому спондиліті, плечелопатковому періартриті або попереково-крижовому радикуліті, за допомогою введення потребуючому цього пацієнту достатньої кількості співкристала шляхом застосування фармацевтичної композиції згідно з винаходом, як описано вище. По визначенню Міжнародної асоціації по вивченню болю (IASP) "біль" являє собою "неприємне сенсорне і емоційне переживання, пов'язане з реальним або потенційним пошкодженням тканини або що описується в термінах такого пошкодження (IASP, класифікація хронічних болів, 2-е видання, IASP Press (2002), 210). Незважаючи на те, що біль завжди суб'єктивний, його причини або синдроми можуть бути класифіковані. По одній класифікації для позначення підтипів болю загальний больовий синдром розділяють на підтипи гострого і хронічного болю або, в залежності від інтенсивності болю, на легкий, помірний і сильний біль. В інших термінах загальний больовий синдром також розділяють на "ноцицептивний" біль (пов'язаний з активацією ноцицепторів), "нейропатичний" (викликаний пошкодженням або порушенням функції нервової системи) і біль, пов'язаний з центральною сенсибілізацією (центральний больовий синдром). Відповідно до визначення IASP "алодинія" являє собою "біль, зумовлений стимулом, який звичайно не викликає болю" (IASP, класифікація хронічних болів, 2-е видання, IASP Press (2002), 210). Незважаючи на те, що симптоми алодинії ймовірно асоціюються з симптомами нейропатичного болю, це не є обов'язковим, оскільки зустрічаються симптоми алодинії, не пов'язані з нейропатичним болем, хоча в деяких районах алодинія поширена ширше, ніж нейропатичний біль. Додатково IASP відмічає наступні відмінності між "алодинією", "гіпералгезією" і "гіперпатією" (IASP, класифікація хронічних болів, 2-е видання, IASP Press (2002), 212): Алодинія Гіпералгезія Гіперпатія 40 45 50 55 Знижений пороговий рівень Типи стимулу і реакції відрізняються Підвищена реакція Інтенсивність стимулу і реакції однакові Підвищений пороговий рівень; Інтенсивність стимулу і реакції можуть підвищена реакція бути однаковими або відрізнятися Відповідно до визначення IASP "нейропатією" називають "первинне ураження або дисфункцію нервової системи" (IASP, класифікація хронічних болів, 2-е видання, IASP Press (2002), 211). Нейропатичний біль може мати центральне або периферичне походження. "Ишіалгія (попереково-крижовий радикуліт)" або "неврит сідничного нерва" означає у винаході набір симптомів, що включають в себе біль, зумовлений подразненням сідничного нерва або його корінців. "Плечелопатковий періартрит" або "адгезивний капсуліт" означає у винаході симптом, при якому з'єднувальна тканина, що оточує плечовий суглоб або безпосередньо плечову капсулу, викликає хронічні болі при запаленні і виникненні тугорухливості суглоба. "Анкілозуючий спондиліт" або "хвороба Бехтерева" є хронічним запальним артритом і аутоімунним захворюванням. При цьому в основному вражаються суглоби хребта і крижовоклубове зчленування в ділянці таза, що приводить до можливого зрощення хребта. "Болі, пов'язані з центральною сенсибілізацією"/"центральний больовий синдром" в даній заявці означають неврологічний стан, викликаний пошкодженням або дисфункцією центральної нервової системи (ЦНС), яка включає в себе мозок, стовбур мозку і спинний мозок. Цей синдром може бути викликаний inter alia інсультом, розсіяним склерозом, пухлинами, епілепсією, травмою головного або спинного мозку або хворобою Паркінсона. "Ноцицептивним болем" називають вид болю, викликаного активацією ноцицепторів. Цей вид болю можна розділити на соматичний і вісцеральний болі. "Вісцеральний біль" являє собою 8 UA 109661 C2 5 10 15 20 25 30 35 40 45 50 55 60 біль, звичайно виникаючий в органах, тоді як "(глибокий) соматичний біль" локалізується в зв'язках, сухожиллях, кістках, кровоносних судинах, фасціях і м'язах. Добова доза для застосування у людини і тварин відносно використання фармацевтичної композиції згідно з винаходом може варіювати в залежності від чинників, які основані на приналежності до відповідного виду, або від інших чинників, таких як вік, стать, вага і міра тяжкості хвороби і так далі. Добова доза для людини переважно складає від 20 до 1000 мг, переважно від 50 до 250 міліграмів співкристала (рац)-трамадолу-HCl і целекоксибу (1:1), що містяться в фармацевтичній композиції за даним винаходом, яку можна вводити протягом одного або декількох прийомів в день. У переважному варіанті здійснення лікарська форма фармацевтичної композиції за даним винаходом (наприклад, таблетка) містить від 50 до 250 (або від 100 до 150) мг співкристала (рац)-трамадолу-HCl і целекоксибу (1:1). Застосування фармацевтичної композиції за даним винаходом (описаної вище) або відповідного способу лікування переважно пов'язане з болем, в тому числі з ноцицептивним болем (в тому числі з соматичним і вісцеральним болем). Ці переважні варіанти здійснення винаходу також можуть бути пов'язані з нейропатичним болем і/або з болем, зумовленим центральною сенсибілізацією (так званий "центральний больовий синдром"). Застосування фармацевтичної композиції за даним винаходом (описаної вище) або відповідного способу лікування переважно також може бути пов'язане з гострим і хронічним болем. Застосування фармацевтичної композиції за даним винаходом (описаної вище) або відповідного способу лікування, переважно можуть бути також пов'язані з болем від легкого до помірного і сильним болем. Далі даний винахід показаний за допомогою наступних фігур і прикладів. Цей ілюстративний матеріал наведений виключно як приклади і не обмежує об'єм винаходу. Короткий опис фігур: Фіг. 1: Скринінгове дослідження полімерів - підсилювачів розчинності. Порівняльні дані розчинності in vitro. Фіг. 2: Скринінгове дослідження полімерів - підсилювачів розчинності. Коефіцієнт вивільнення лікарської речовини. Фіг. 3: Порівняльні дані розчинності in vitro (буферний розчин рН 12+1 % SLS (лаурилсульфат натрію)). Фіг. 4: Порівняльні дані розчинності in vitro (0,1 N розчин HCl+2 % SLS (лаурилсульфат натрію)). Фіг. 5: Порівняльні фармакокінетичні параметри трамадолу (Сmax і AUC) в трьох рецептурах (рац)трамадолу - целекоксибу (1:1) і комерційні доступні рецептури. Фіг. 6: Порівняльні фармакокінетичні параметри целекоксибу (С max і AUC) в трьох рецептурах (рац)-трамадолу - целекоксибу (1:1) і комерційні доступні рецептури. ПРИКЛАДИ Приклад 1: Скринінгове дослідження полімерів - підсилювачів розчинності Мета даного дослідження полягала в оцінці ефекту включення різних полімерних інгредієнтів в рецептуру співкристала (рац)-трамадолу-HCl - целекоксибу (1:1) в тесті на профіль розчинності. Були приготовані різні таблетовані форми, в тому числі співкристал (рац)трамадолу-HCl - целекоксибу (1:1), основа для пресування (що містить мікроінкапсульований полісорбат 80, мікроінкапсульований поліоксил 40 - гідрогенізовану касторову олію, лаурилсульфат натрію, кросповідон, висушений розпиленням маніт, мікрокристалічну целюлозу і натрію стеарилфумарат), і проведено тестування різних полімерних інгредієнтів. Тестували наступні полімерні інгредієнти: полоксамери (неіонні співполімери поліоксіетилену-поліоксипропілену: Lutrol®), повідон (Plasdone K30), коповідон (співполімер 1вініл-2-піролідону і вінілацетату; Kollidon® VA 64), прищеплений співполімер полівінілкапролактаму - полівінілацетату - поліетиленгліколю (Soluplus®) і циклодекстрин (Kleptose®). Згідно з способом, описаним в прикладах 2, були підготовлені різні рецептури. Отримані після пресування різні таблетки тестували з визначенням профілю розчинності. Тест з отриманням кривої розчинності in vitro проводили на пристрої USP III (з лопатями) при 37 °C і 50 обертах на хвилину з фосфатним буфером 0,04 М рН 12 в кількості 1000 мл. в 9 UA 109661 C2 5 10 15 20 кожному флаконі протягом 45 хв. Результати тесту з кривими розчинності показані в фіг. 1. Швидке зростання розчинності було отримане при включенні в таблетки повідону, коповідону або Soluplus®. Включення Lutrol® спричиняло сповільнення розчинності в порівнянні з розчинністю таблеток, які не містять який-небудь полімер. Розраховували співвідношення кількості розчиненого целекоксибу в точках 15 хвилин і 30 хвилин в різних рецептурах з полімерним інгредієнтом і без полімерного інгредієнта, виходячи з результатів, отриманих в тесті з кривими розчинності. На фіг. 2 показані різні співвідношення. На основі отриманих результатів можна вважати полімерами - підсилювачами розчинності полімери, включення яких в рецептуру приводить до вивільнення з коефіцієнтом розчинності >1, в порівнянні з рецептурою без якого-небудь із згаданих полімерів. Приклад 2: Фармацевтичні рецептури/таблетки, виготовлені згідно з винаходом Таблетки за даним винаходом були виготовлені згідно з описаним нижче способом. Співкристал (рац)-трамадолу - целекоксибу (1:1) з прикладу 4 заявки WO 2010/043412 на першому етапі змішували з мікроінкапсульованим полісорбатом 80, мікроінкапсульованим поліоксилом 40 - гідрогенізованою касторовою олією, з лаурилсульфатом натрію, кросповідоном, висушеним розпиленням манітом, мікрокристалічною целюлозою і коповідоном (співполімером 1-вініл-2-піролідону/вінілацетату) або Soluplus. Після цього першого етапу змішування в суміш вводили ковзну речовину, додаючи стеарилфумарат натрію і тальк. Пластифіковану суміш на роторному таблетувальному пресі пресували в таблетки, що містять 113,5 мг співкристала (рац)-трамадолу HCl - целекоксибу (1:1) (480 мг в одній таблетці). Приклад 2А Таблетки співкристала (рац)-трамадолу-HCl - целекоксибу (1:1), виготовлені прямим пресуванням з використанням коповідону як полімеру - підсилювача розчинності Інгредієнт % Співкристал (рац)-трамадолу HCl-целекоксибу (1:1) ® Sepitrap 80 (мікроінкапсульований полісорбат 80) ® Sepitrap 4000 (мікроінкапсульований поліоксил 40 – гідрогенізована касторова олія) Лаурилсульфат натрію Кросповідон ® Pearlitol (висушений розпиленням маніт) Стеарилфумарат натрію Тальк Мікрокристалічна целюлоза ® Kollidon VA 64 (коповідон) Всього 23,65 2,08 мг/на дозу (113,5 мг) 113,50 10,00 2,08 10,00 2,08 8,13 25,99 1,50 0,50 25,99 8,00 10,00 39,00 124,75 7,20 2,40 124,75 38,40 480,0 мг 10 UA 109661 C2 Приклад 2В Таблетки співкристала (рац)-трамадолу-HCl - целекоксибу (1:1), виготовлені прямим пресуванням з використанням Soluplus® як полімеру - підсилювача розчинності Інгредієнт % Співкристал (рац)-трамадолу HCl-целекоксибу (1:1) ® Sepitrap 80 (мікроінкапсульований полісорбат 80) ® Sepitrap 4000 (мікроінкапсульований поліоксил 40 – гідрогенізована касторова олія) Лаурилсульфат натрію Кросповідон ® Pearlitol (висушений розпиленням маніт) Стеарилфумарат натрію Тальк Мікрокристалічна целюлоза ® Soluplus (прищеплений співполімер полівінілкапролактам полівінілацетат - поліетиленгліколь) Всього 23,65 2,08 мг/на дозу (113,5 мг) 113,50 10,00 2,08 10,00 2,08 8,13 25,99 1,50 0,50 25,99 10,00 39,00 124,75 7,20 2,40 124,75 8,00 38,40 480,0 мг Приклад 2С Таблетки співкристала (рац)-трамадолу-HCl - целекоксибу (1:1), виготовлені прямим ® пресуванням з використанням Soluplus як полімеру - підсилювача розчинності Інгредієнт Співкристал (рац)-трамадолу HCl-целекоксибу (1:1) Лаурилсульфат натрію Кросповідон ® Pearlitol (висушений розпиленням маніт) Стеарилфумарат натрію Тальк Мікрокристалічна целюлоза ® Kollidon VA 64 (коповідон) Всього 5 10 15 20 % 23,65 2,08 8,13 28,07 1,50 0,50 28,07 8,00 мг/на дозу (100 мг) 100,00 10,00 34,38 118,69 6,34 2,11 118,69 33,83 422,8 мг Приклад 3: Аналізи таблеток на розчинність згідно з прикладами 2А, 2В і 2С Фіг. 3 і 4 показують результати аналізів на розчинність in vitro, проведених з таблетками, отриманими в прикладах 2А, 2В і 2С. Вивільнення співкристала (рац)-трамадолу-HCl целекоксибу (1:1) з фармацевтичних композицій за даним винаходом аналізували в пристрої USP 2 (з лопатями) при 37 °C і 50 обертах на хвилину протягом 2-х годин в буферному розчині з рівнем рН 12+1 % лаурилсульфат натрію (фіг. 3) і в розчині 0,1 N HCl+2 % лаурилсульфат натрію (фіг. 4). Обидва аналізи показали збільшення вивільнення лікарського препарату целекоксиб з співкристала (рац)-трамадолу-HCl - целекоксибу (1:1), який міститься в фармацевтичній композиції за даним винаходом. Приклад 4: Визначення in vivo профілю періоду дії після перорального прийому таблеток з прикладів 2A, 2B, 2C в порівнянні з комерційною лікарською формою целекоксибу (капсули Celebrex®) і трамадолу-HCl (капсули Adolonta® IR) Метою даного дослідження було порівняння пероральної дії таблеток з прикладів 2А, 2В і 2С у собак при спільному введенні готових пероральних форм целекоксибу (Celebrex®) і трамадолу-HCl (капсули Adolonta® IR). У цьому прикладі визначали показники залежності концентрації трамадолу і целекоксибу в плазмі від часу після перорального введення однократної дози голодним самицям і самцям собак. Аналогічно розраховували фармакокінетичні параметри некомпартментним способом. В аналізі 1 оцінювали введення таблеток з прикладів 2А і 2В, і в аналізі 2 оцінювали таблетки з прикладу 2C і готові лікарські форми целекоксибу і трамадолу-HCl. 11 UA 109661 C2 5 10 15 20 25 30 35 40 45 50 55 Фармакокінетичні параметри з обох аналізів були стандартизовані по дозі, що вводиться для порівняння їх фармакокінетичних кривих. Приклад 4a: Аналіз 1 У цьому аналізі оцінювали вплив на плазму і фармакокінетику трамадолу і целекоксибу у 3 самців і 3 самиць собак породи бігль після перорального введення натщесерце однократної дози таблеток з прикладів 2А і 2В. Кількість співкристала (рац)-трамадолу-HCl-целекоксибу в кожній рецептурі становила 113,5 мг, що відповідало 50 мг трамадолу-HCl і 63,5 мг целекоксибу. Застосовували перехресну схему з перервою між введеннями 1 тиждень. Зразки забирали до точки часу 48 годин після введення. Для трамадолу загальне середнє значення часу, протягом якого виявляли максимальну концентрацію в плазмі (tmax), становило 1,5 години для таблеток з прикладу 2А і 1,0 година для таблеток з прикладу 2B, і передбачається, що абсорбція трамадолу відбувається швидко і не залежить від рецептури. Швидкість впливу як загальне середнє значення C max становила 47,2 нг/мл для таблеток з прикладу 2А і 70,5 нг/мл для таблеток з прикладу 2B, і тривалість впливу як загальне середнє значення AUC0-∞ становила 101,2 нг×ч/мл при введенні таблеток з прикладу 2А і 127,8 нг×ч/мл для таблеток з прикладу 2B. Для целекоксибу загальне середнє значення часу, протягом якого виявляли максимальну концентрацію в плазмі (tmax), становило 2,5 години для таблеток з прикладу 2А і 1,5 години для таблеток з прикладу 2B. Швидкість впливу як загальне середнє значення C max для целекоксибу становила 1933,3 нг/мл для таблеток з прикладу 2А і 975,0 нг/мл для таблеток з прикладу 2B. Тривалість впливу як загальне середнє значення AUC0-t становила 23158,5 нг×ч/мл для таблеток з прикладу 2А і 12828,0 нг×ч/мл для таблеток з прикладу 2B. Приклад 4b: Аналіз 2 Метою другого дослідження була оцінка і порівняння впливу і фармакокінетики трамадолу і целекоксибу у 3 самців і 3 самиць собак породи бігль після однократного перорального введення натщесерце дози таблеток з прикладу 2C в порівнянні з одночасним введенням комерційно доступних рецептур трамадолу-HCl (капсули Adolonta® IR) і целекоксибу (капсули Celebrex®). Співкристал (рац)-трамадолу-HCl - целекоксибу (1:1) вводили в кількості 2 таблеток по 100 мг з прикладу 2С, що відповідає 88 мг трамадолу-HCl і 112 мг целекоксибу. Для порівняння спільно вводили 2 капсули по 50 мг трамадолу-HCl (Adolonta® IR) і 1 капсулу 100 мг целекоксибу (Celebrex®). Застосовували перехресну схему з перервою між введеннями 1 тиждень. Зразки забирали до точки часу 48 годин після введення. Як і в попередньому аналізі 1, для трамадолу були отримані схожі загальні середні значення Tmax, а саме 1,3 год. для рецептури з прикладу 2C і 1,0 год. для Adolonta®, що дозволяє передбачити, що абсорбція трамадолу відбувається швидко і не залежить від рецептури. Швидкість впливу трамадолу як загальне значення Cmax становила 129,3 нг/мл для таблеток з прикладу 2С і 365,5 нг/мл для Adolonta®. Для трамадолу тривалість загального впливу AUC0-∞ становила 486,5 нг×ч/мл при введенні таблеток з прикладу 2С і 599,7 нг×ч/мл для Adolonta®. Для целекоксибу загальне середнє значення часу, протягом якого виявляли максимальну концентрацію в плазмі (Тmax), становило 2,3 години для таблеток з прикладу 2С і 14,5 години для Celebrex®. Швидкість впливу як загальне середнє значення Cmax становила 1898,1 нг/мл для таблеток з прикладу 2С і 1048,5 нг/мл для Celebrex®. Тривалість загального впливу AUC0-∞ становила 37780,2 нг×ч/мл при введенні таблеток з прикладу 2С і 22159,8 нг×ч/мл при введенні Celebrex®. Приклад 4c: Підсумкові дані доклінічної фармакокінетики у собаки При порівнянні стандартизованої тривалості впливу Adolonta® і трамадолу в трьох рецептурах співкристала (рац)-трамадолу-HCl - целекоксибу (1:1) 2А, 2В і 2С були відмічені схожі характеристики загального впливу AUC0-∞ для рецептури з прикладу 2C (відмінності в 0,9 разу). З іншого боку, інші дві рецептури з прикладу 2А і прикладу 2B показали більш низькі значення AUC0-∞: відмінності в 0,3 і 0,4 рази, відповідно. У відношенні стандартизованої C max всі рецептури виявляли більш низьку швидкість впливу (від 0,3 до 0,4 разів) в порівнянні з Adolonta®. Зниження максимальної концентрації в плазмі буде забезпечувати більш високу безпеку трамадолу відносно побічних дій на ЦНС. Схожі значення t max отримані для згаданих рецептур і Adolonta® (див. фіг. 5). 12 UA 109661 C2 Речовина, що вводиться Таблетки з прикладу 2А 113,5 мг × 1 Таблетки з прикладу 2В 113,5 мг × 1 Таблетки з прикладу 2С 100 мг × 2 ® Celebrex капсули 100 мг × ® 1, Adolonta капсули 50 мг × 2 Доза трамадолуHCl (мг) 50 50 88 100 Середнє значення ± стандартне відхилення SD Середнє значення DE Середнє значення DE Середнє значення DE Середнє значення # tmax (год.) Ділянка під кривою Cmax, AUC0-∞, стандартизована стандартизована по дозі (нг/мл)/мг по дозі (нг×ч/мл)/мг 1,5 2,024 1,0-2,5 0,264 0,693 1,0 1,411 2,557 1,0-1,5 0,387 1,088 1,3 1,469 5,528 0,5-2,5 0,756 3,9511,0 3,655 5,997 0,5-1,5 DE 0,943 2,745 3,826 #DE означає діапазон значень 5 Для целекоксибу рецептура таблеток з прикладу 2B показувала значення стандартизованої AUC0-t, схоже з цим показником для Celebrex® (в 0,9 разу), а в рецептурах з прикладу 2А і прикладу 2C виявлені більш високі значення (в 1,6 і 1,5 рази, відповідно). У відношенні стандартизованої Cmax цей показник перевищував показник для Celebrex® в 1,5-, 1,6- і в 2,9 разів, чим для рецептур з прикладу 2B, прикладу 2C і прикладу 2A, відповідно (див. фіг. 6). Речовина, що вводиться Таблетки з прикладу 2А 113,5 мг × 1 Таблетки з прикладу 2В 113,5 мг × 1 Таблетки з прикладу 2С 100 мг × 2 ® Celebrex капсули 100 мг × ® 1, Adolonta капсули 50 мг × 2 Середнє Доза значення ± целекоксибу (мг) SD 63,5 63,5 112 100 Середнє значення DE Середнє значення DE Середнє значення DE Середнє значення # tmax (год.) AUC0-∞, Cmax, стандартизрована стандартизована по дозі (нг× по дозі (нг/мл)/мг ч/мл)/мг 2,5 364,700 1,5-5,0 8,072 202,470 1,5 15,355 202,016 1,0-4,0 6,711 87,802 2,3 16,947 337,323 0,5-24,0 7,082 195,653 14,5 10,485 221,598 1,0-24,0 DE 30,446 6,680 168,520 #DE означає діапазон значень 10 15 20 Насамкінець, порівняння таблеток співкристала (рац)-трамадолу-HCl - целекоксибу (1:1) з прикладів 2А, 2В і 2С з окремими комерційно доступними продуктами показало, що не перевищений вплив для трамадолу і виявило модуляцію пікової концентрації у бік зменшення значення в порівнянні з Adolonta® IR. У порівнянні з комерційною формою ці характеристики забезпечують ефективність на фоні зменшення побічних ефектів трамадолу, що приводить до поліпшення. Для целекоксибу було досягнуте збільшення абсорбції і відносно швидкості і тривалості, що означає поліпшену біодоступність по відношенню до комерційної форми. Нарешті таблетки співкристала (рац)-трамадолу-HCl - целекоксибу (1:1) з прикладу 2A, 2B, 2C достовірно модулюють пероральну абсорбцію обох активних речовин і показують, що можна отримати параметри впливу трамадолу і целекоксибу, відповідні вимогам замовника в таблетованій рецептурі співкристала (рац)-трамадолу-HCl - целекоксибу (1:1). 13 UA 109661 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Фармацевтична композиція, що містить співкристал (рац)-трамадолу-НСl-целекоксибу (1:1) і щонайменше один полімерний підсилювач розчинності. 2. Фармацевтична композиція за п. 1, в якій полімерний підсилювач розчинності вибирають з прищепленого співполімеру полівінілкапролактам-полівінілацетат-поліетиленгліколь або інших гідрофільних полімерів, таких як коповідон, повідон, полоксамери, циклодекстрин, поліетиленгліколь і лауроїл макрогол-32 гліцериди ЕР, переважно вибирають з прищепленого співполімеру полівінілкапролактам-полівінілацетат-поліетиленгліколь або інших гідрофільних полімерів, які вибирають з коповідону, повідону або полоксамерів. 3. Фармацевтична композиція за будь-яким з пп. 1 або 2, в якій полімерний підсилювач розчинності являє собою прищеплений співполімер полівінілкапролактам-полівінілацетатполіетиленгліколь. 4. Фармацевтична композиція за будь-яким з пп. 1 або 2, в якій полімерний підсилювач розчинності являє собою співполімер коповідону. 5. Фармацевтична композиція за будь-яким з пп. 1-4, в якій вміст полімерного підсилювача розчинності, що використовується в композиції, знаходиться в діапазоні від 2 до 50 % ваг., переважно від 8 до 12 % ваг. або близько 8 % ваг. 6. Фармацевтична композиція за будь-яким з пп. 1-5, що має лікарську форму, яку вибирають з таблетки, порошкових капсул, або сформульована способом сухого гранулювання, суспендування і сухого вальцювання, переважно в таблетованій формі і найбільш переважно у вигляді таблетки, що виробляється способом прямого пресування. 7. Фармацевтична композиція за п. 1 в таблетованій формі, що містить співкристал (рац)трамадолу-НСl-целекоксибу (1:1) і щонайменше один полімерний підсилювач розчинності, яку отримують способом прямого пресування. 8. Фармацевтична композиція за будь-яким з пп. 1-7, що додатково містить щонайменше один полімер-сурфактант. 9. Фармацевтична композиція за п. 8, в якій полімер-сурфактант вибирають з мікроінкапсульованого полісорбату 80, мікроінкапсульованого поліоксилу 40 - гідрогенізованої касторової олії і лаурилсульфату натрію. 10. Фармацевтична композиція за будь-яким з пп. 1-9, що містить щонайменше один додатковий фармацевтично прийнятний наповнювач, наприклад наповнювач, дезінтегруючу речовину і/або змащувальну речовину. 11. Фармацевтична композиція за п. 10, в якій наповнювач вибирають з цукру, такого як ксиліт, сорбіт, ізомальт, еритрит, сахароза, фруктоза, декстроза і найбільш переважно висушений розпиленням маніт і сімейство лактози, або з нерозчинних наповнювачів, таких як фосфат кальцію, карбонат кальцію або мікрокристалічна целюлоза, наприклад МСС 102 (90 мкм) і МСС 200 (200 мкм), або з інших сполук, таких як силікатована мікрокристалічна целюлоза або композиції, що містить мікрокристалічну целюлозу, колоїдний діоксид кремнію, натрію крохмалю гліколят і стеарилфумарат натрію, переважно вибирають з цукру, такого як ксиліт, сорбіт, ізомальт, еритрит, сахароза, фруктоза, декстроза, найбільш переважно висушений розпиленням маніт і сімейство лактози, або вибирають з мікрокристалічної целюлози, найбільш переважно вибирають з висушеного розпиленням маніту і мікрокристалічної целюлози. 12. Фармацевтична композиція за п. 10 або 11, в якій змащувальну речовину вибирають з стеарилфумарату, магнію стеарату, тальку, гідрофільного колоїдного діоксиду кремнію і переважно вибирають з стеарилфумарату і тальку, і/або в якій дезінтегручу речовину вибирають з кросповідону, кроскармелози натрію, натрію крохмалю гліколяту, заздалегідь желатинізованого крохмалю, крохмалю, полакриліну калію, гідроксипропілцелюлози з низькою мірою заміщення (L-HPC), кальцію карбоксиметилцелюлози, альгінової кислоти, переважно є кросповідоном. 13. Фармацевтична композиція за будь-яким з пп. 1-12, в якій співкристал (рац)-трамадолу-НСl і целекоксибу (1:1) характеризується порошковою рентгенограмою з піками [2] при 7,1, 9,3, 10,2, 10,7, 13,6, 13,9, 14,1, 15,5, 16,1, 16,2, 16,8, 17,5, 18,0, 19,0, 19,5, 19,9, 20,5, 21,2, 21,3, 21,4, 21,8, 22,1, 22,6, 22,7, 23,6, 24,1, 24,4, 25,2, 26,1, 26,6, 26,8, 27,4, 27,9, 28,1, 29,1, 29,9, 30,1, 31,1, 31,3, 31,7, 32,5, 32,8, 34,4, 35,0, 35,8, 36,2 і 37,2 [°], при цьому значення 2θ отримані з використанням випромінювання міді (СuKаl 1,54060Å); і/або в якій співкристал (рац)-трамадолу-НСl і целекоксибу (1:1) характеризується наявністю смуг абсорбції в інфрачервоному спектрі з перетворенням Фур'є при 3481,6 (m), 3133,5 (m), 2923,0 (m), 2667,7 (m), 1596,0 (m), 1472,4 (m), 1458,0 (m), 1335,1 (m), 1288,7 (m), 1271,8 (m), 1168,7 (s), 14 UA 109661 C2 5 10 15 20 1237,3 (m), 1168,7 (s), 1122,6 (s), 1100,9 (m), 1042,2 (m), 976,8 (m), 844,6 (m), 820,1 (m), 786,5 (m) -1 625,9 (m) см ; і/або співкристал (рац)-трамадолу-НСl і целекоксибу (1:1) має орторомбічні елементарні комірки з наступними розмірами: а=11,0323(7) Å b=18,1095 (12) Å с=17,3206(12) Å; і/або ендотермічний гострий пік співкристала (рац)-трамадолу-НСl і целекоксибу (1:1), відповідний температурі плавлення, починається в точці 164 °C. 14. Спосіб отримання пероральної фармацевтичної композиції за будь-яким з пп. 1-13, в якому здійснюють наступні стадії: (a) змішування співкристала (рац)-трамадолу-НСl-целекоксибу (1:1) щонайменше з одним полімерним підсилювачем розчинності і, необов'язково, з одним або більше наповнювачем, дезінтегруючою речовиною або полімерним сурфактантом або з будь-якою їх комбінацією; (b) необов'язкове додавання щонайменше однієї змащувальної речовини; (c) пряме пресування таблеток з суміші, отриманої на стадії (а), або з суміші з доданням змащувальної речовини зі стадії (b). 15. Фармацевтична композиція за будь-яким з пп. 1-13, призначена для лікування болю, переважно гострого болю, хронічного болю, нейропатичного болю, ноцицептивного болю, болю від легкого і помірного до важкого, гіпералгезії, болю, пов'язаного з центральною сенсибілізацією, алодинії або болю при раку, в тому числі болю при діабетичній нейропатії і діабетичній периферичній нейропатії і остеоартриті, фіброміалгії, ревматоїдному артриті, анкілозуючому спондиліті, плечолопатковому періартриті або попереково-крижовому радикуліті. 15 UA 109661 C2 16 UA 109661 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 17
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions of co-crystals of co-crystals of tramadol and coxibs
Автори англійськоюSoler Ranzani, Luis, Falivene Aldea, Albert
Автори російськоюСолер Рансани Луис, Фаливене Альдеа Альберт
МПК / Мітки
МПК: A61K 9/20, A61K 31/135, A61K 31/415, C07C 59/64
Мітки: фармацевтична, коксибів, композиція, трамадолу, співкристалів
Код посилання
<a href="https://ua.patents.su/19-109661-farmacevtichna-kompoziciya-spivkristaliv-tramadolu-i-koksibiv.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція співкристалів трамадолу і коксибів</a>
Попередній патент: Заміщені 5-фтор-1н-піразолопіридини та їх застосування
Наступний патент: Фармацевтичні та/або дієтичні композиції на основі коротколанцюгових жирних кислот
Випадковий патент: Спосіб прогнозування метаболічних порушень та ожиріння у хворих на артеріальну гіпертензію з урахуванням поліморфізму генів