Підкислення карбоксилату
Номер патенту: 112462
Опубліковано: 12.09.2016
Автори: де Хан Андре Бан'є, ван Брюґел Ян, Янсен Петер Паул, Серда Баро Аґустін, роот Віллем Якоб
Формула / Реферат
1. Спосіб отримання карбонової кислоти підкислюванням водного розчину рідини, яка містить сіль карбонової кислоти, що охоплює наступні етапи:
- забезпечують водний розчин сировини, яка містить карбоксилат магнію;
- забезпечують газову сировину, яка містить газоподібний хлорид гідрогену; та
- підкислюють карбоксилат до карбонової кислоти введенням водного розчину сировини в контакт із газовою сировиною, отримуючи таким чином потік водного розчину, який містить карбонову кислоту та хлорид магнію,
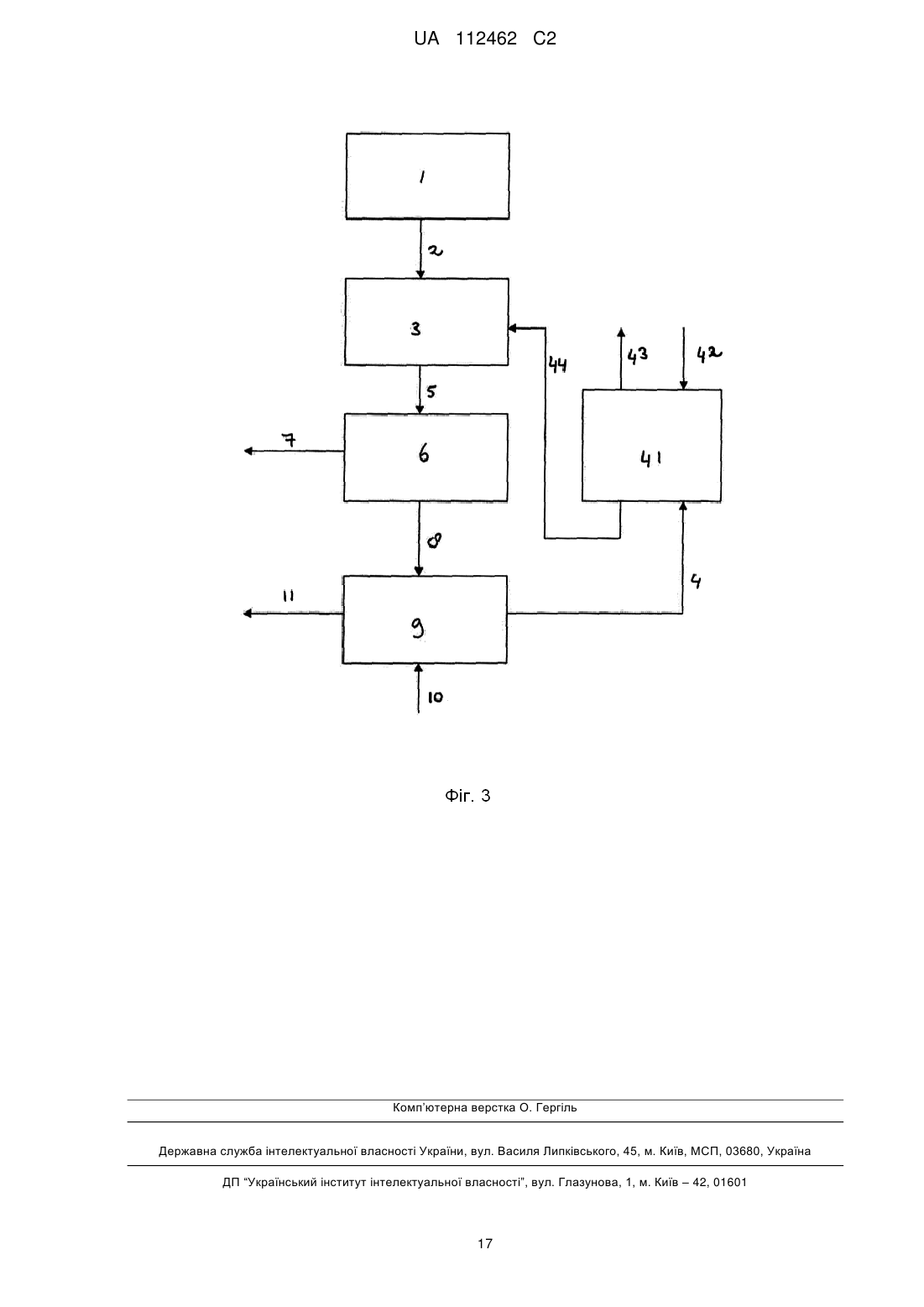
де газова сировина, яка містить газоподібний хлорид гідрогену, отримана з етапу термічного розкладу, де водний розчин, який містить хлорид магнію, піддавали температурі принаймні 300 °C, таким чином, розкладаючи хлорид магнію до оксиду магнію та хлорид гідрогену, отже, отримуючи твердий оксид магнію та газ, який містить газоподібний хлорид гідрогену.
2. Спосіб за п. 1, де газова сировина містить газоподібний хлорид гідрогену та газоподібну воду.
3. Спосіб за п. 2, де співвідношення мас хлориду гідрогену і води в газовій сировині дорівнює 1:10-1:4, краще - 1:5-1:4.
4. Спосіб за будь-яким із попередніх пунктів, який далі охоплює етап відокремлення, де карбонова кислота та сіль хлориду, присутні в потоці водного розчину, відокремлені одна від одної, у такий спосіб отримуючи потік продукту карбонової кислоти та водний розчин або суспензію хлориду магнію, де водний розчин або суспензію хлориду магнію надано як рідину, яка містить хлорид магнію, до етапу термічного розкладу.
5. Спосіб за п. 4, де етап відокремлення містить етап екстракції або етап осаджування.
6. Спосіб за будь-яким із попередніх пунктів, де водний розчин сировини має температуру 20-150 °C, краще - 60-120 °C.
7. Спосіб за будь-яким із попередніх пунктів, де водний розчин сировини має температуру 80-120 °C під атмосферним тиском.
8. Спосіб за будь-яким із попередніх пунктів, де температура водного розчину сировини дорівнює 1-50 °C, краще на 3-25 °C вище температури газової сировини.
9. Спосіб за будь-яким з попередніх пунктів, де газова сировина далі містить принаймні 25 мас. % інертного газу, краще - інертного газу, вибраного з групи, яка містить N2, О2, СО2 та їх суміші.
10. Спосіб за будь-яким з попередніх пунктів, де газова сировина містить принаймні 2 мас. % хлориду гідрогену.
11. Спосіб за будь-яким із попередніх пунктів, де карбонат вибрано із групи, яка містить наступне: лактат, сукцинат, пропіонат, 3-гідроксипропіонат, гідроксибутират, цитрат, фумарат, ітаконат, адипат, акрилат, левулінат, малеат, 2,5-фурангідрогенкарбонат, ацилат та лактилат жирних кислот та/або суміші цього, краще - з групи, яка містить наступне: лактат, сукцинат, пропіонат, 2,5-фурангідрогенкарбонат та 3-гідроксипропіонат, зокрема, з групи лактату та сукцинату.
12. Спосіб за будь-яким із попередніх пунктів, де спосіб далі містить етап отримання водного розчину сировини за допомогою етапу ферментації.
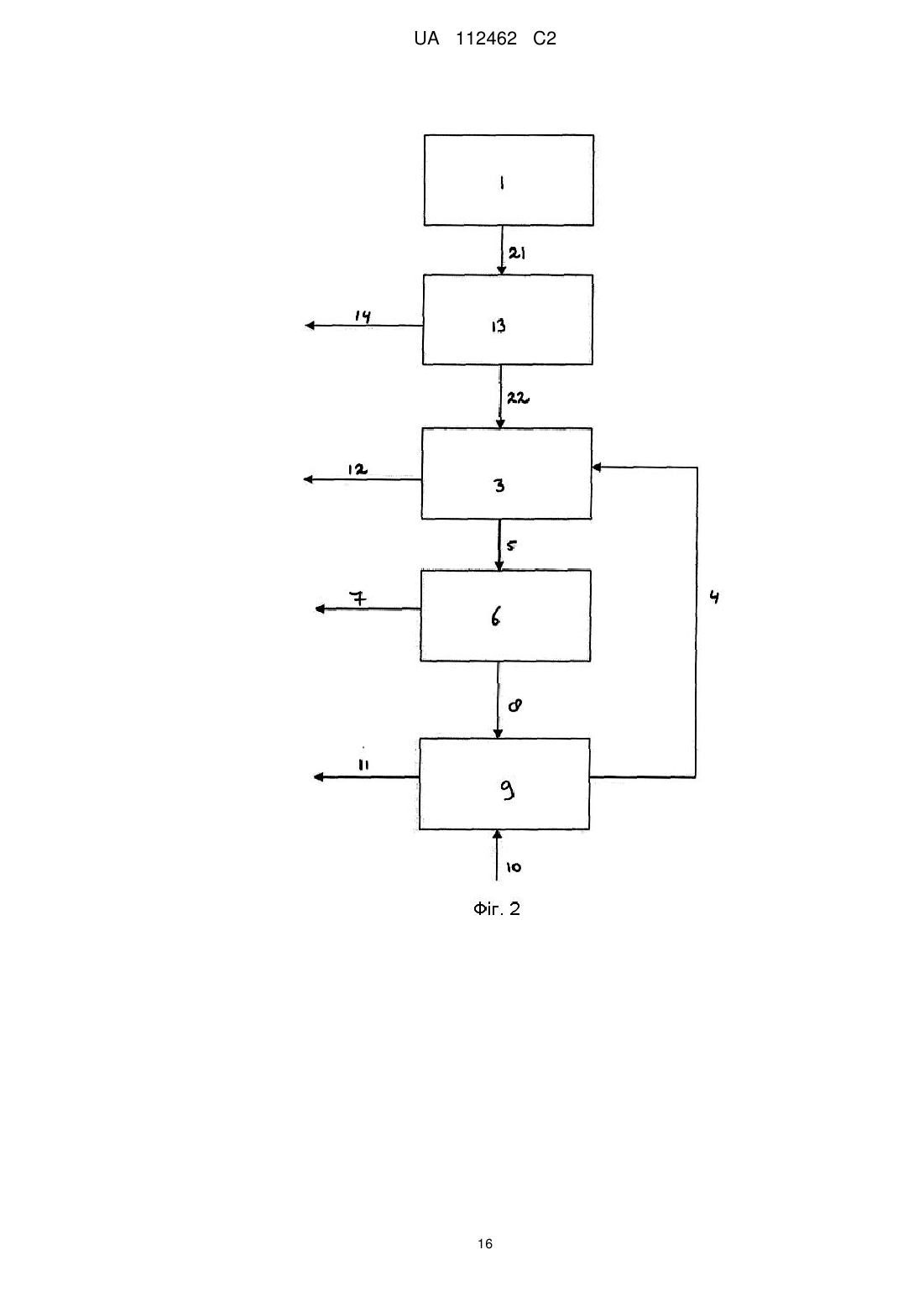
13. Спосіб за п. 12, де етап концентрування проводили після етапу ферментації та перед етапом підкислювання, що призводить до температури водного розчину сировини принаймні 60 °C.
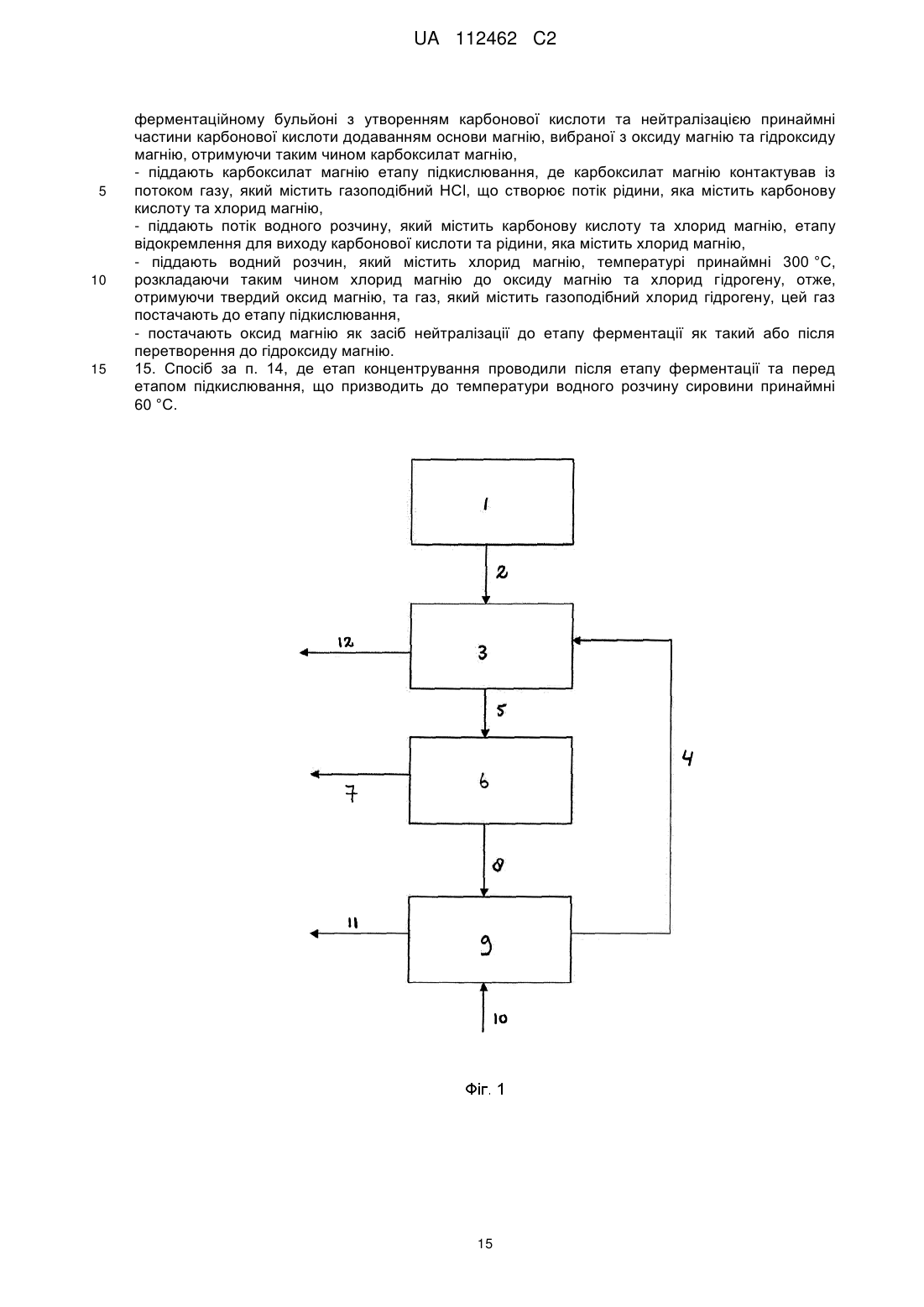
14. Спосіб за будь-яким із попередніх пунктів, який є інтегрованим способом, який охоплює наступні етапи:
- піддають джерело карбону етапу ферментації для створення карбонової кислоти, цей етап ферментації містить етапи бродіння джерела карбону за допомогою мікроорганізмів у ферментаційному бульйоні з утворенням карбонової кислоти та нейтралізацією принаймні частини карбонової кислоти додаванням основи магнію, вибраної з оксиду магнію та гідроксиду магнію, отримуючи таким чином карбоксилат магнію,
- піддають карбоксилат магнію етапу підкислювання, де карбоксилат магнію контактував із потоком газу, який містить газоподібний НСl, що створює потік рідини, яка містить карбонову кислоту та хлорид магнію,
- піддають потік водного розчину, який містить карбонову кислоту та хлорид магнію, етапу відокремлення для виходу карбонової кислоти та рідини, яка містить хлорид магнію,
- піддають водний розчин, який містить хлорид магнію, температурі принаймні 300 °C, розкладаючи таким чином хлорид магнію до оксиду магнію та хлорид гідрогену, отже, отримуючи твердий оксид магнію, та газ, який містить газоподібний хлорид гідрогену, цей газ постачають до етапу підкислювання,
- постачають оксид магнію як засіб нейтралізації до етапу ферментації як такий або після перетворення до гідроксиду магнію.
15. Спосіб за п. 14, де етап концентрування проводили після етапу ферментації та перед етапом підкислювання, що призводить до температури водного розчину сировини принаймні 60 °C.
Текст
Реферат: Заявлений винахід стосується способу отримання карбонової кислоти підкислюванням водного розчину сировини, яка містить карбонатну сіль. Цей спосіб охоплює наступні етапи: - забезпечують водний розчин сировини, яка містить карбоксилат магнію; - забезпечують газову сировину, яка містить газоподібний хлорид гідрогену; та UA 112462 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 112462 C2 - підкислюють карбоксилат до карбонової кислоти введенням водного розчину сировини в контакт із газовою сировиною, отримуючи таким чином потік водного розчину, який містить карбонову кислоту та хлорид магнію, де газова сировина, яка містить газоподібний хлорид гідрогену, отриманий з етапу термічного розкладу; де водний розчин, який містить хлорид магнію, піддавали температурі принаймні 300 °C, таким чином, розкладаючи хлорид магнію до оксиду магнію та хлориду гідрогену, отже, отримуючи твердий оксид магнію та газ, який містить газоподібний хлорид гідрогену. UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід стосується способу отримання карбонової кислоти підкислюванням кислотою рідинного постачання, яке містить магній карбонат. Карбонові кислоти, як-то молочна кислота та бурштинова кислота, можна виробляти через ферментацію мікроорганізмами джерела карбону, як-то вуглеводи або гліцерин. У такому способі ферментації джерело вуглеводу типово піддано бродінню з мікроорганізмом для створення карбонової кислоти. Рідину, де джерело вуглеводу піддають бродінню, названо ферментаційним бульйоном або ферментаційним середовищем. Утворення карбонової кислоти протягом ферментації призводить до зменшення pH ферментаційного бульйону. Оскільки таке зменшення pH може пошкоджувати процесу метаболізму мікроорганізмів, загальною практикою є додавати засіб нейтралізації, тобто основу, до ферментаційного середовища для нейтралізації pH або для підтримання оптимальної величини рН для мікроорганізму. Як результат, карбонова кислота, отримана у ферментаційних середовищах, типово присутня у вигляді карбонатної солі. Хоч є мікроорганізми, які до певної міри, є стійкими до кислотних середовищ, тому ферментацію можна робити при низькому pH (наприклад, при pH 3), навіть у таких способах, принаймні, частину карбонової кислоти отримують як карбонатну сіль. Щоб вилучити карбонову кислоту з ферментаційного бульйону після ферментації, потрібна технологія спадного потоку. При такій технології карбонатну сіль потрібно у ферментаційному бульйоні перетворювати до карбонової кислоти. Цього можна досягати реакцією карбонатної солі з кислотою, отримуючи карбонову кислоту та сіль. Підкислення карбонатних солей можна проводити різними кислотами, як-то сульфатна кислота та хлоридна кислота (також інколи стосовно водного розчину гідроген хлориду). У WO0017378 описано спосіб отримання молочної кислоти, де розчин магній лактату вироблено способом ферментації. Розчин підкислено розчином гідроген хлориду для створення розчину, який містить молочну кислоту та магній хлорид. Цей розчин піддавали етапу концентрування, молочну кислоту видаляли з розчину екстракцією, та отриманий розчин магній хлориду піддавали етапу термічного розкладу, отримуючи твердий оксид магнію та потік газу, який містить HCl, та воду. Потік газу, який містить HCl та воду, потім абсорбували у воді з утворенням водного розчину HCl, приблизно, при 20 мас. %, який рециклізовано до етапу підкислювання. Оксид магнію можна постачати до етапу ферментації. Тоді як спосіб WO00/17378 є привабливим теоретично, оскільки він дозволяє рециркуляцію сполук магній хлориду, він має ряд незручностей для промислового застосування. Дуже значною незручністю є те, що концентрації HCl у водному розчині завжди слід бути відносно низькою. При адсорбції газоподібного гідроген хлориду у воді отриманому розчину HCl слід бути азеотропним (азеотропний розчин HCl/вода). У результаті концентрація HCl, отримана в такому водному розчині HCl, не може бути вищою ніж концентрація HCl азеотропного HCl та води, яка при кімнатній температурі, приблизно, дорівнює 20 мас. %. Як відомо спеціалісту, азеотропний розчин HCl/вода є залежним від температури. Азеотропний розчин HCl та води містить 21,8 мас. % HCl при 81 °C, 20,2 мас. % HCl при 109 °C та 19,7 мас. % HCl при 116 °C. До того ж, якщо тільки зроблено додаткові виміри, як-то азеотропна або екстрактивна дистиляція, концентрацію розчину HCl обмежено, приблизно, до 20 мас. %. Вищевказані додаткові виміри потребують дорогого устаткування та значної кількості енергії, отже, є небажаними. Верхня межа концентрації HCl 20 мас. % означає, що в реакції підкислювання розчину магній карбонату на кожний грам ефективного HCl, додано до системи 4 грами води. Присутність таких великих кількостей води є несприятливим із ряду причин. По-перше, це призводить до низької концентрації кислоти, що заважає вилученню кислоти, отже, зменшує вихід кислоти. Крім того, розчин магній хлориду, який залишається, також має відносно низьку концентрацію, це означає, що при застосуванні цього розчину до етапу термічного розкладу потрібно випаровувати велику кількість води в етапі термічного розкладу або в попередньому етапі концентрування. Крім того, більший об'єм води в етапі екстракції WO00/17378 призводить до більшої кількості органічного екстрагенту у водній фазі, що є небажаним щодо наступного етапу термічного розкладу та втрат екстрагенту. Отже, існує потреба щодо способу, який демонструє сприятливу рециркуляцію магній хлориду в способі в WO00/17378 без його незручностей. Згідно із заявленим винаходом запропоновано такий спосіб. Заявлений винахід стосується способу отримання карбонової кислоти підкислюванням постачання рідини, яка містить карбонатну сіль, цей спосіб полягає в наступних етапах: - забезпечення постачання рідини, яка містить магній карбонат; - забезпечення постачання газу, яке містить газоподібний гідроген хлорид; та 1 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 - підкислення карбонату до карбонової кислоти введенням рідинного постачання в контакт із постачанням газу, отримуючи таким чином потік рідини, який містить карбонову кислоту та магній хлорид, де постачання газу, яке містить газоподібний гідроген хлорид, отриманий з етапу термічного розкладу, де водну рідину, яка містить магній хлорид піддавали нагріванню, принаймні, до температури 300 °C, таким чином розкладаючи магній хлорид до оксиду магнію та гідроген хлориду, отримуючи таким чином твердий оксид магнію та газ, який містить газоподібний гідроген хлорид. У цьому способі комбінація етапу термічного розкладу та забезпечення потоку газу, який містить газоподібний HCl, до постачання рідини, яка містить магній карбонат, робить спосіб ефективним стосовно застосування апаратури та вимог, що дозволяє додавання кислоти при обмеження розбавлення рідини, яка містить магній карбонат. Подальші переваги заявленого винаходу та конкретні його втілення будуть зрозумілими з подальшої деталізації. Несподівано було знайдено, що звертання за допомогою до підкислювання при застосуванні газоподібного HCl, отриманого з етапу термічного розкладу, збільшену кількість HCl адсорбовано постачанням рідини, яка містить магній карбонат, ніж було б зроблено еквівалентною кількістю води. Не бажаючи обмежуватися теорією, уважаємо, що кількість HCl, яка може абсорбуватися постачанням рідини, підвищено реакцією HCl із карбонатною сіллю. Отже, спосіб винаходу ефективно порушує азеотропну суміш вода/HCl без дорогого встаткування або витрачання значної енергії. Уведенням рідинного постачання в контакт із постачанням газу газоподібний гідроген хлорид буде абсорбовано постачанням рідини, тоді як можна запобігати додаванню великих кількостей води, що призводить до зменшення розбавлення підкисленого розчину. Зокрема, кількість води, доданої протягом підкислювання, зменшено в порівнянні із застосуванням постачання водного HCl. Оскільки отримано менш розбавлений потік рідини, слід випаровувати меншу кількість води, щоб отримати відповідно високу концентрацію карбонової кислоти, що призводить до зменшених витрат випаровування. Крім того, наступні етапи очищення можна проводити набагато ефективніше та в значно меншому встаткуванні, коли є менше води. Крім того, генерований розчин магній хлориду, який також має вищу концентрацію, робить цю технологію більш ефективною. Цей спосіб згідно з винаходом по суті є несподіваним, оскільки потоки газу, утворені при термічному розкладі магній хлориду, звичайно, містять газоподібну воду, яка виникає, наприклад, з розчину, який піддавали етапу термічного розкладу. Отже, слід очікувати, коли потік газу, який містить газоподібну HCl та воду, надано до постачання рідини, яке містить магній карбонат, кислота та вода, присутні в потоку газу, будуть абсорбовані в постачання рідини, що призводить до істотного розбавлення. Однак, внаслідок селективної абсорбції HCl, описаної вище, кількість абсорбованої води в системі є нижчою очікуваної. Отже, у порівнянні зі способом описаним у WO00/17378, де потік газу абсорбували у воді, а потім це постачали до етапу підкислювання, у способі згідноз винаходом показано несподіване зменшення кількості води, постаченої до реакції підкислювання. Крім того, як відомо спеціалісту, у способі згідно з винаходом дозволено застосування меншої апаратури, що зменшує пов'язані кошти. У способі згідно з винаходом забезпечено постачання рідини, яка містить магній карбонат. Термін "карбонат", який тут застосовано, стосується спряженої основи карбонової кислоти, яку звичайно можна зображати формулою RCOO . Термін "відповідна карбонова кислота карбонату" стосується карбонової кислоти, яку можна отримати підкисленням карбонату. Це також може стосуватися підкисленого карбонату. Карбонову кислоту, що відповідає карбонату, звичайно можна зображати формулою RCOOH. Постачання рідини може бути у вигляді водного розчину або водної суспензії (наприклад, кашки). Присутність твердої речовині у водному постачанні до певної міри може залежати від застосованого встаткування та здатності до перекачування рідинного постачання (тобто тверда речовина не повинна заважати постачанню рідини насосом у абсорбційний пристрій), що відомо спеціалісту. Приклади твердої речовини, яка може бути присутньою у вигляді суспензії, є карбоновою кислотою у твердій формі та/або магній карбонатом у твердій формі. З технологічних причин переважним для постачання рідини є водний розчин. Концентрація магній карбонату в рідині для постачання не є критичною, але типово дорівнює типово 50-750 г/л. При постачанні рідини з ферментаційного способу концентрація, як є меншою 50 г/л, не є кращою. Величини понад 750 г/л можуть бути небажаними, оскільки тоді постачальна рідина може ставати занадто в'язкою та/або містити занадто багато твердої речовини, щоб бути достатньо здатною для перекачування. 2 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 Постачальна рідина, може окрім магній карбонату також може містити певні кількості карбонової кислоти, оскільки, наприклад, вона походить з етапу ферментації, проведеному при низькому pH. Постачальна рідина містить магній карбонат. Краще, коли карбонат є моно-, ди- або трикарбонатом, який містить принаймні, 2 - 8 атоми карбону (карбонати C2-C8), але заявлений винахід також пристосовано для більш довгих карбонатів із кількістю атомів карбону більше 8. Карбонати C2-C8 можна вибирати із групи, яка містить наступне: лактат, сукцинат, пропіонат, 3гідроксипропіонат, гідроксибутират, цитрат, фумарат, ітаконат, адипат, акрилат, левулінат, малеат, терефталат та 2,5-фурангідрогенкарбонат. Краще карбонову кислоту вибирати із групи, яка містить наступне: лактат, сукцинат, 2,5-фурангідрогенкарбонат, пропіонат та 3гідроксипропіонат. Зокрема, хороші результати отримували застосуванням лактату та сукцинату. Указані вище магній карбонати, які також можна дуже добре підкислювати способом згідно із заявленим винаходом, можуть бути, наприклад, наступними: магнієві солі жирної кислоти (ацилати жирної кислоти) та/або магнієві солі моно- та/або ди-лактилату (лактилатестер жирної кислоти). Вищевказані магнієві солі жирних кислот та лактилат-солі можна вибирати з магнієвої солі жирної кислоти або лактилат-естеру наступного: капронова, каприлова, капринова, лауринова, міристинова, пальмитинова, стеаринова та олеїнова кислота та/або їх суміші. Залежно від розчинності магній хлориду та карбонової кислоти, створеної після підкислення, магній хлорид може осаджуватися в адсорбційному пристрої або секції швидше ніж діє карбонова кислота. Тоді краще, щоб магній хлорид знов розчинити перед уведенням до реактору для термогідролізу. З технологічних причин переважним для постачання рідини є водний розчин. Якщо вибрано такий карбонат, що його відповідна карбонова кислота має розчинність нижчу розчинності магній хлориду, зокрема, розчинність нижчу 60 г/100 г води при 20 °C (більш переважно нижче 30 г/100 г води, навіть ще більш переважно нижче 15 г/100 г води), карбонова кислота може осаджуватися раніше магній хлориду. Розчин магній хлориду тоді можна відокремлювати від осадженої карбонової кислоти, та, якщо бажано, безпосередньо постачати до реактору для термогідролізу. Термін "розчинність", як застосовано вище, стосується максимальної кількості маси сполуки, яка може бути розчиненою в певній кількості води при 20 °C. Постачання газу, який містить газоподібний гідроген хлорид, отримано з етапу термічного розкладу, де водну рідину, яка містить магній хлорид, піддавали температурі, принаймні, 300 °C, розкладаючи таким чином магній хлорид до оксиду магнію та гідроген хлориду, отже, отримуючи твердий оксид магнію та газ, який містить газоподібний гідроген хлорид. Постачання газу до реакції підкислювання звичайно містить принаймні, 1 мас. %, краще, принаймні, 2 мас. %, ще краще, принаймні, 5 мас. % гідроген хлориду, що базовано на загальній масі газу. Концентрація менше 1 мас. % звичайно є небажаною, оскільки така концентрація потребує застосування дуже великих газових труб для постачання газу до постачання рідини для підтримання ефективного підкислювання. Хоч високі концентрації гідроген хлориду у постачанні газу звичайно є бажаними, у постачанні газу практично слід містити гідроген хлориду 20 мас. % або менше. Придатна концентрація HCl у постачанні газу дорівнює 7-12 мас. %. Концентрація HCl газу, отриманого в термогідролізі магній хлориду типово зменшується в цьому діапазоні, хоч концентрація або етапи розбавлення з деякої причини можливо будуть бажаними для роботи з вищими або нижчими концентраціями HCl. Крім того, залежно від композиції газу, постачання газу звичайно містить принаймні, 25 мас. % інертного газу, зокрема, інертного газу, вибраного з групи, яка містить N 2, CO2 та їх суміші (як-то повітря). Це може, наприклад, бути результатом термогідролізу, проведеного в присутності інертних газів, наприклад, у присутності повітря. Термін "інертний газ", який тут застосовано, стосується газу, який не реагує, конденсує або абсорбує постачання рідини протягом підкислювання, та залишається як газ після контактування з постачанням рідини. Концентрація інертного газу може бути вищою, наприклад, принаймні, 50 мас. В одному втіленні постачання газу може містити 40-80 мас. % газу азоту. Постачання газу може містити до 95 мас. % інертного газу. В одному втіленні застосовано постачання газу, отриманого в термогідролізі MgCl2, яке містить 40-50 мас. % N2, 0-5 мас. % O2 та 5-15 мас. % CO2. В одному втіленні потік газу, який містить HCl, постачений до реакції підкислювання, містить газоподібну воду. Якщо потік газу, який містить HCl, походить від термічного розкладу розчину магній хлориду, потік продукту розкладу звичайно буде містити газоподібну воду в додаванні до газоподібного HCl. Незважаючи на те, що можливо видалити воду з потоку газу, винятковою 3 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 відмітною ознакою винаходу є надавати потік газу з етапу термічного розкладу до етапу підкислювання без проміжного видалення води. В одному втіленні потік газу, постачений до реакції підкислювання, містить газоподібну воду та газоподібний HCl, де співвідношення гідроген хлориду до маси води в постачанні газу є між 1:10 та 1:0,1, наприклад, між 1:6 та 1:3. Зокрема, співвідношення HCl/H 2O може бути між 1:10 та 1:4, зокрема, між 1:6 та 1:4, більш переважно, між 1:5 та 1:4. Потік газу постачений до реактору підкислювання, наприклад, може містити принаймні, 5 мас. % води, більш переважно, принаймні, 10 мас. % води, ще більш переважно принаймні, 20 мас. % води. Максимальна кількість води може дорівнювати 90 мас. %. В одному втіленні кількість води є в діапазоні 25-50 мас. %. Кількості води в потоці газу в окремому випадку слід залежати, серед іншого, від кількості води в розчині магній хлориду та кількості інертного газу, присутнього протягом термічного розкладу. При отриманні постачання газу термічним розкладом розчину магній хлориду розчин магній хлориду краще містить 15-40 мас. %, ще краще - 25-30 мас. % магній хлориду. Надто низькі концентрації MgCl2 не є бажаними внаслідок високих коштів енергії, залученої до випаровування води протягом термогідролізу. В одному втіленні постачанню газу, отриманого термогідролізом 20-40 мас. % розчину магній хлориду, звичайно слід мати співвідношення гідроген хлориду до маси води (співвідношення HCl/H2O), яке дорівнює, принаймні, 1:10 та не більше - 1:4. Якщо застосовано концентрацію магній хлориду 25-30 мас. %, тоді звичайно слід мати співвідношення HCl/H2O між 1:6 та 1:4, зокрема, між 1:5 та 1:4. У цьому випадку постачання газу типово містить 5-15 мас. % HCl та 30-45 мас. % води. Взагалі, водному постачанню слід мати температуру в діапазоні 20-150 °C. Однак, знайдено, що в переважному втіленні винаходу температура постачання рідини підвищено. Знайдено, що застосування підвищеної температури призводить до підвищеної селективності абсорбції HCl із потоку газу в порівнянні з абсорбцією води з потоку газу. Конкретніше, при підвищеній температурі постачання рідини газоподібний HCl ще адсорбовано з потоку газу до великого розміру, тоді як абсорбція або конденсація води, яка також присутня в потоці газу, зменшено навіть, коли спосіб застосовано під атмосферним тиском. Це означає, що при підвищенні температури постачання рідини в способі згідно з винаходом запобігали, крім того, розбавленню постачання рідини. Отже, в одному втіленні заявленого винаходу постачання рідини, яке контактує з потоком реакції газоподібного підкислювання, має температуру, принаймні, 60 °C, більш переважно принаймні, 75 °C. Найкраще, коли постачання рідини має температуру 80-120 °C. Температура постачання газу не є особливо критичною. Краще, коли вона дорівнює 20 °C або є вищою, ще краще, коли - вище 75 °C. Коли температура постачання газу є відносно низькою, наприклад, нижче 20 °C, або інколи при 75 °C або нижче, вода, яка присутня в постачанні газу, може конденсуватися в постачанні рідини, також залежно від температури постачання рідини. Крім того, постачання газу краще має температуру 150 °C або менше. Вищі температури будуть потребувати дорогого встаткування для проведення адсорбції, наприклад, зробленого з матеріалу, стійкого стосовно кислотної корозії та температури. Постачання газу може мати температуру, наприклад, 80-120 °C. Як буде обговорено більш детально нижче, етап термічного розкладу має місце при температурі, принаймні, 300 °C. В одному втіленні потік газу, отриманого з етапу термічного розкладу, постачено до етапу теплообміну, де температура потоку газу знижено до величини в діапазоні 80-150 °C, зокрема 80-120 °C. Потік газу при цій температурі можна надавати безпосередньо до етапу підкислювання. Температуру, при якій проведено підкислювання, головним чином, визначено температурою постачання карбонату. Температура постачання газу має відносно малу дію на температуру підкислювання в порівнянні з температурою постачання карбонату. В одному втіленні температура постачання карбонату є вищою на 1-50 °C ніж температура постачання газу, ще краще - 3-25 °C, наприклад, - 5-15 °C. Така температурна різниця може підсилювати конденсацію газоподібної води в області, де постачання газу входить до адсорбційної колонки. Температура при етапі підкислювання має місце там, де постачання рідини контактує з постачанням газу, краще дорівнює, принаймні, 60 °C, більш переважно, принаймні, 75 °C. Найкраще, температура при етапі підкислювання має місце в діапазоні 80-120 °C. Як пояснено вище, вибором придатної температури для способу згідно з винаходом, зокрема, для рідинного розчину магній карбонату, можна збільшити селективність абсорбції HCl із потоку газу в порівнянні з абсорбцією води з потоку газу. 4 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 60 Залежно від кількості води у потоці газу та вибору температури переважно вибирати температуру таким чином, щоб, принаймні, 50 мас. % газоподібної води, присутньої в постачанні газу не було конденсовано в постачанні рідини, ще краще, принаймні, 75 мас. %, найкраще, принаймні, 85 мас. %, тоді як абсорбцію HCl з потоку газу підтримано. Частині газоподібній води, яка не була конденсована, слід залишати постачання рідини у вигляді газоподібної води. Кількість адсорбованої з потоку газу HCl звичайно дорівнює, принаймні, 90 % HCl, присутньої в потоці газу, більш переважно, принаймні, 95 %, ще більш переважно, принаймні, 99 %. Кількість наданої HCl також визначено кількістю нейтралізованого карбонату. В одному втіленні підкислення робили, застосовуючи надлишок HCl. Краще, щоб надлишок був малим, тоді отриманий продукт не є надто кислотним, що не може бути бажаним щодо подальшої обробки розчину. Селективність способу абсорбції HCl із потоку газу в порівнянні із селективністю для води з потоку газу також може бути під впливом тиску в пристрої адсорбції, де проведено підкислювання. Зниженням тиску в пристрої адсорбції та/або підвищенням температури постачання рідини, як розглянуто вище, кількість адсорбованої води можна зменшити, тоді як кількість адсорбованої кислоти не зменшено. Тиск, близький до атмосферного, звичайно є придатним, тоді як злегка знижений тиск також може бути привабливим. Абсорбцію, наприклад, можна робити при величині 0,5-2 бар, зокрема, - 0,8-1 бар, наприклад, - 0,9-1 бар. Знайдено, що проведення реакції підкислювання при температурі 80-120 °C під (близько) атмосферним тиском є дуже придатним для отримання високої селективності абсорбції HCl із потоку газу в порівнянні з абсорбцією води з вищевказаного потоку газу. В одному втіленні температура та тиск способу згідно з винаходом вибрано таким чином, що підвищено не тільки селективність абсорбції HCl із потоку газу в порівнянні з абсорбцією води з потоку газу, але також випарено із системи додаткову воду, що має наслідком подальше зростання концентрації. Не бажаючи обмежуватися теорією, уважаємо, що додатковою перевагою абсорбції газоподібного гідроген хлориду в постачанні рідини є те,що енергія, вивільнена в постачанні рідини та/або постачанні газу, обумовлена адсорбцією HCl водою. Дисоціація HCl до H+ та Cl- є екзотермічною реакцією. Енергія, вивільнена в результаті дисоціації, буде розігрівати постачання рідини та внаслідок цього зменшувати кількість води, адсорбованої рідиною, як описано вище. Наступні параметри грають роль у визначенні селективності абсорбції HCl в порівнянні з абсорбцією води з газоподібного постачання, та внаслідок цього кількості води адсорбованої протягом етапу підкислювання: Вища температура, нижчий тиск, та вищі концентрації HCl призводять до зменшення кількості адсорбованої води, та/або, де придатно, до збільшення кількості випарюваної води. Нижчі температури, вищі тиски та нижчі концентрації HCl призводять до збільшення кількості адсорбованої води, та/або, де придатно, до зменшення кількості випарюваної води. Спираючись на цю інформацію, спеціаліст слід розуміти як керувати балансом води протягом підкислювання та може регулювати кількість входження та виходу води із системи за потребами. Хоч взагалі бажано отримувати потік рідини, який має високу концентрацію, у певних утіленнях це можна обмежувати, що обумовлено небажаним осаджуванням магній хлориду. Підкислювання можна проводити в будь-якому пристрої, придатному для адсорбції HCl у водній рідині. Внаслідок кислотних умов етапу підкислювання пристрій краще робити з матеріалу, стійкого до кислоти, як-то пластмаса або придатна марка дуплекс-сталі. Форма пристрою не є головною. Постачання газу, наприклад, надавали до пристрою при або біля його дна, тоді як постачання рідини надавали до колонки при або біля її верху. Приклади придатних пристроїв адсорбції - колонки (наприклад, насадні колонки, барботажні колонки), скрубери (наприклад, венчурні скрубери), тарілчасті абсорбери та апарати з мішалкою. Спеціаліст у рівні техніки знає, як вибрати придатний пристрій адсорбції. Продукт етапу підкислювання є водною рідиною, також указаний тут як потік рідини, який містить розчинений магній хлорид та карбонову кислоту. Водна рідина може бути наступним: розчин, кашка, суспензія або емульсія. Карбонова кислота може бути, принаймні, частково у твердій формі, внаслідок осаджування, але вона також може бути в рідинній формі. В одному втіленні водна рідина звичайно має концентрацію магній хлориду в діапазоні 5 - 50 мас. %, зокрема, в діапазоні 10 - 40 мас. %, більш переважно - в діапазоні 20 - 35 мас. %. В одному втіленні водна рідина містить карбонову кислоту в кількості 5 - 60 мас. %, краще в діапазоні 10 - 50 мас%, ще краще - в діапазоні 20-40 мас. %. Карбонова кислота може бути 5 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 присутньою у водному середовищі в розчиненій формі або в нерозчиненій формі, наприклад, у вигляді часточок, утворених осаджуванням або кристалізацією. Формі, у якій карбонова кислота є присутньою, слід залежати від природи кислоти. Водний рідинний продукт можна обробляти різними способами, які більш детально слід розглянути нижче. У способі згідно з винаходом, постачання газу, яке містить газоподібний гідроген хлорид, отриманий з етапу термічного розкладу, де водну рідину, яка містить магній хлорид, піддавали температурі, принаймні, 300 °C, таким чином розкладаючи магній хлорид до оксиду магнію та гідроген хлориду, отже, отримуючи твердий оксид магнію та газ, як містить газоподібний гідроген хлорид. Термічний розклад хлоридів є загально відомим зі сталеливарної промисловості, де ферум(III)хлорид (FeCl3) термічно розкладають до ферум(II)оксиду (Fe 2O3) та газу хлору (Cl2). У цій галузі також відомий термічний розклад MgCl2 до HCl та MgO, наприклад, з GB 793,700. Придатна апаратура для термічного розкладу відома в рівні техніки. Наприклад, можна застосовувати випалювальну піч для розпилювального матеріалу або випалювальну піч для псевдозрідженого шару. Таку апаратуру, наприклад, можна отримати на SMS Siemag. Термічний розклад робили при температурі, принаймні, 300 °C, яка є мінімальною температурою розкладу MgCl2. Краще термічний розклад робити при температурі, принаймні, 350 °C, наприклад, 350-450 °C. Внаслідок вартості енергії краща температура - нижче 1000 °C, ще краще - нижче 800 °C. Наприклад, температура, при якій робили термічний розклад може бути 350-600 °C. Краще, коли розчин магній хлориду, який піддавали етапу термічного розкладу має концентрацію MgCl2 15-40 мас. %, ще краще - 25-35 мас. %. Занадто високі кількості магній хлориду в розчині, може призводити до осаджування магній хлориду після входження до пристрою для термогідролізу. Етап термічного розкладу робили способами, які відомі врівні техніки, які не потребують тут роз'яснення. Етап термічного розкладу генерує потік газу, який містить HCl та оксид магнію. В одному втіленні потік газу, отриманий з етапу термічного розкладу, який має температуру в діапазоні вказаному вище, постачали до етапу теплообміну, де температуру потоку газу знижено до величини в діапазоні 80-150 °C, зокрема, 80-120 °C. Потік газу із цією температурою можна постачати безпосередньо до етапу підкислювання. Оксид магнію (MgO) типово отримано у вигляді порошку. В одному втіленні оксид магнію гідратовано водою, наприклад, гасінням MgO водою, таким чином формуючи суспензію магній гідроксиду (Mg(OH)2. Магній гідроксид переважно рециклізували для застосування в способі ферментації. Наприклад, Mg(OH)2 можна застосовувати як засіб нейтралізації в способі ферментації. Альтернативно, Mg(OH)2 спочатку перетворювали до магній карбонату (MgCO 3), який тоді застосовували як засіб нейтралізації в способі ферментації. HCl, отриманий в етапі термічного розкладу, рециклізовано застосуванням його в етапі підкислювання, який детально описано вище. Згадані вище етапи способу можуть бути складовими більшого способу, де потік рідини із пристрою адсорбції далі обробляли та магній хлорид обробляли, щоб зробити придатними знов для застосування або рециклізації. Відповідно, спосіб винаходу може, крім того, охоплювати етап відокремлення, де карбонову кислоту та магній хлорид, присутні в потоці рідини, відокремлювали один від одного, наприклад, відокремленням карбонової кислоти з потоку рідини, за умови, щоб залишався розчин магній хлориду. Етап відокремлення типово призводить до потоку продукту карбонової кислоти та водної рідини, яка містить магній хлорид. Вищевказана водна рідина, яка містить магній хлорид, може бути суспензією, але краще є розчином, який краще придатний для термічного розкладу в реакторі для термогідролізу. Можна застосовувати будь-який спосіб, придатний для відокремлення карбонової кислоти від магній хлориду. Наприклад, карбонову кислоту та магній хлорид можна відокремлювати осаджуванням, що більш детально описано нижче. У ще одному втіленні карбонову кислоту та магній хлорид можна відокремлювати способами екстрагування карбонової кислоти з розчину магній хлориду. Цей спосіб також більш детально описано нижче. У подальшому втіленні карбонову кислоту та магній хлорид відокремлено іншими способами ніж осаджуванням та/або екстракцією. Перевагою способу згідно з винаходом, де є етап відокремлення, є те, що це призводить до підвищеного виходу карбонової кислоти. При застосуванні етапу підкислювання винаходу потік рідини буде мати підвищену концентрацію карбонової кислоти. Така підвищена концентрація 6 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 60 звичайно призведе до більш ефективного відокремлення та/або виділення карбонової кислоти, отже, підвищуючи вихід. Комбінація етапу підкислювання та етапу термогідролізу є надзвичайно бажаним стосовно водного балансу в способі винаходу. При проведенні безперервного способу відсутня потреба додавати воду в будь-яких описаних вище етапах, отже, можливо тримання концентрованого розчину карбонату. Як описано вище, це не тільки заощаджує енергію, обумовлену відсутністю випаровування або меншим випаровуванням води протягом способу, але також може підвищувати вихід карбонової кислоти. Наприклад, у випадку додаткової води, доданої до постачання рідини в етапі підкислювання (наприклад, застосуванням розчину HCl), цю додаткову воду слід було б випаровувати протягом етапу термічного розкладу або протягом етапу попереднього концентрування, що потребувало б додаткової енергії. Крім того, попередженням розбавлення потоку рідини, етапу відокремлення слід бути більш ефективним за умови відсутності або наявності дуже малих кількостей карбонової кислоти, присутньої в розчині магній хлориду. Це є важливим, оскільки будь-який залишок карбонової кислоти в розчині магній хлориду буде спопелятися та, отже, призводити до зменшення загального виходу карбонової кислоти. Крам того, якщо застосовано спосіб відокремлення, який охоплює екстракцію, присутність великої кількості води буде призводити до підвищеної кількості речовини екстракції, який розчиняється у водній фазі, та внаслідок цього постаченого до етапу термічного розкладу, де він буде спопелятися, що призведе до втрати екстрагенту. Кращий спосіб винаходу - безперервний спосіб. Однак, його можна проводити як періодичний спосіб. Спосіб може охоплювати етап ферментації, де сформовано постачання рідини, яка містить карбонатну сіль. Такий етап типово містить підетапи бродіння джерела карбону способами мікроорганізму для створення ферментаційного середовища, яке охоплює карбонову кислоту та (частково) нейтралізацію ферментаційного середовища для отримання бажаного pH додаванням засобу нейтралізації, краще магній основи, що створює карбонатну сіль. Потім біомасу можна відокремлювати з ферментаційного середовища, наприклад, (ультра)фільтрацією, центрифугуванням або декантацією біомаси або осаджуванням магній карбонату з ферментаційного середовища. Як описано вище, оксид магнію, отриманий в етапі термічного розкладу, можна рециклізувати в етапі ферментації як засіб нейтралізації або його попередник. В одному втіленні винаходу, зокрема, де ферментація дає розчин із низькою концентрацією карбонату, краще проводити етап концентрування між етапом ферментації та етапом підкислювання. Етап концентрування звичайно асоційовано зі збільшенням температури постачання рідини, яка містить магній карбонат, та, отже, є конкретно привабливим, де бажано виконувати етап підкислювання при підвищеній температурі, наприклад, при температурі, принаймні, 60 °C, як розглянуто вище. Спосіб згідно з винаходом є конкретно придатним для інтегрування з іншими етапами способу. Приклади способів, які охоплюють етапи способу згідно з винаходом присутні у фігурах. На Фіг. 1 ілюстровано одне втілення заявленого винаходу. Спосіб ферментації проводили у ферментаційному реакторі (1), отримуючи карбонову кислоту. Магній основу додано протягом ферментації (не показано), що призвело до створення магній карбонату. Потік продукту (2), який містить магній карбонат видалено з ферментаційного реактора, та постачено до реактора підкислювання. Якщо бажано, проміжні етапи очищення, як-то видалення біомаси, можна робити способами, які відомі в рівні техніки. Постачання рідини, яка містить магній карбонат, постачено до реактору підкислювання (3), де це контактувало з потоком газу (4) отриманого з етапу термічного розкладу (9). У реакторі підкислювання (3) магній карбонат перетворено до карбонової кислоти та магній хлориду реакцією з газоподібним HCl. Потік, який містить інертний газ, та звичайно також газоподібну H 2O, видалено через лінію (12). Потік (5), який містить карбонову кислоту та магній хлорид, піддавали етапу відокремлення (6). На фігурі це показано як таке, що відбувається в реакторі відокремлення, але, залежно від способу відокремлення це також може мати місце в реакторі підкислювання. В етапі відокремлення (6) генеровано потік (7), який містить карбонову кислоту та потік (8), який є водною рідиною, яка містить магній хлорид. Потік (8) постачено до пристрою термічного розкладу (9), де магній хлорид перетворено до HCl та MgO із додаванням інертного газу через лінію (10). Потік газу, який містить HCl (4), постачено до реактору підкислювання (3). MgO, який видалено через лінію (11), якщо бажано, може реагувати з водою, створюючи розчин, який містить магній гідроксид, який рециклізували до ферментаційного реактора (1). 7 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 На фігурі 2 показано варіації способу на фігурі 1, де етап концентрування (13) вставлено між етапом ферментації (1) та етапом підкислювання (3). Потік продукту (21), який містить магній карбонат, видалено з ферментаційного реактора (1), та постачено до концентратора (13). Надлишок води видалено через лінію (14), та концентрований потік продукту (22) постачено до етапу підкислювання (3). Як розглянуто раніше, привабливе втілення способу згідно з винаходом є таким, де етап концентрування постачав концентровану рідину з температурою, принаймні, 60 °C, зокрема, принаймні, 75 °C, більш переважно - в діапазоні 80-120 °C, що приводило до високої селективності абсорбції HCl у постачанні рідини в порівнянні з абсорбцією води з постачання газу. На фігурі 3 ілюстровано порівняльний спосіб, де, у порівнянні зі способом згідно з винаходом на фігурі 1, постачання газу видаленого з етапу термічного розкладу (9) через лінію (4) не постачали до етапу підкислювання (3), але замість цього постачали до реактору абсорбційного відокремлення (41), де це контактувало з водою через лінію (42), що призвело до водного розчину HCl, який постачено до реактору підкислювання (3). Інертний газ видалено через лінію (43). На цій фігурі ілюстровано, що додатково до інших незручностей цього порівняльного способу, цей спосіб також потребує застосування додаткової апаратури, чого не потрібно для способу згідно з винаходом. К указано вище, в одному втіленні спосіб згідно з винаходом охоплює етап піддавання потоку рідини, який містить карбонову кислоту та магній хлорид, етапу відокремлення для виходу водної рідини, зокрема, водного розчину, який містить магній хлорид та карбонову кислоту. В одному втіленні етап відокремлення є етапом екстракції, який полягає в екстрагуванні карбонової кислоти з водної суміші в органічну рідину, таким чином отримуючи органічний розчин карбонової кислоти та залишкову водну рідину, яка містить магній хлорид. У переважному втіленні карбонову кислоту потім екстраговано з органічного розчину карбонової кислоти до водної рідини, таким чином, отримуючи водний розчин карбонової кислоти та вторинну органічну рідину. Отже, у переважному втіленні етап відокремлення охоплює подальшу екстракцію кислоти з водного потоку до органічної рідини, а потім - зворотна екстракція кислоти з органічної рідини у воду, отже, створюючи водний розчин карбонової кислоти. Це також можливо, однак, без проведення етапу зворотної екстракції, але відокремлюючи кислоту з органічної рідини іншими способами, наприклад, випаровуванням або дистиляцією. В одному втіленні органічна рідина, застосована в етапі екстракції, містить органічний розчинник, вибраний із групи, яка містить кетони та етери. Краще, коли органічна рідина містить принаймні, 90 мас. % органічного розчинника, краще, принаймні, 95 мас. %, ще краще, принаймні, 99 мас. %. В одному втіленні органічна рідина - органічний розчинник. Необов'язково малі кількості води можуть бути присутніми в першій органічній рідині, зокрема, коли рідина (частково) містить рециклізуваний органічний розчинник з етапу рециркуляції після екстракції. Знайдено, що ці кетони та етери є привабливими в способі екстракції, оскільки вони демонструють високе співвідношення розподілу, що призводить до високого виходу кислоти. Краще в заявленому винаході застосовувати кетони, зокрема, - кетони C5+, переважно, - кетони C5-C8. C5+ позначає кетони принаймні, з 5 атомами карбону. Також можна застосовувати суміші. Застосування кетонів C9+ є менш переважним, оскільки вважають, що ці сполуки призводять до більших забруднень у кінцевому продукті. Знайдено, що застосування метилізобутил-кетону (MIBK) є дуже привабливим. Кетон також є переважними, оскільки вони є стабільними в умовах способу, у якому вони не реагують або суттєво не розкладаються, отже, не надають зростання забруднень та дозволяють стабільний спосіб операції. Також можна застосовувати етери, зокрема, етери C3-C6. Однак, знайдено, що вони є менш переважними, оскільки, зокрема, застосування етерів призводить до більшої втрати розчинника та більших забруднень у кінцевому продукті. У межах групи етеру застосування метил-трет-бутил-етеру (MTBE) та діетилетеру (DEE) може бути переважним, але менш переважним ніж застосування кетонів. В одному втіленні заявленого винаходу карбонову кислоту можна відокремлювати від магній хлориду осаджуванням після підкислювання магній карбонату HCl. У цьому випадку спосіб винаходу може далі містити наступні етапи: - необов'язково етап концентрування, де потік рідини, яка містить карбонову кислоту та MgCl2, концентрували; - осадження карбонової кислоти з розчину, який містить карбонову кислоту та MgCl 2, таким чином отримуючи осад карбонової кислоти та розчин MgCl2, 8 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 де карбонова кислота, яка відповідає карбонату, має розчинність у воді при 20 °C 60 г/100 г води або менше, та ще краще, коли карбонат - сукцинат. Спосіб винаходу, який охоплює ці етапи, нижче вказано як спосіб осаджування винаходу. Постачання рідини нижче вказано як розчин або суспензія карбонату. Потік рідини нижче вказано як розчин, який містить карбонову кислоту та MgCl2 (або просто розчин). Терміни підкислювання та підкислення застосовано почергово в повній деталізації. Спосіб осаджування винаходу детально описано нижче. Він охоплює деякі частини, які також описано вище. Винахідниками знайдено, що додавання HCl до магнієвої солі карбонової кислоти та наступне осаджування карбонової кислоти з розчину призводить до дуже ефективного відокремлення карбонової кислоти з розчину магній карбонату. Зокрема, знайдено, що бурштинова кислота може осаджуватися з розчину карбонату, підкисленого HCl, з дуже високою ефективністю. Без промивання, обмеженого будь-якою теорією, винахідники вважають, що висока ефективність осаджування обумовлена конкретно високою дією висолювання MgCl2 у розчині. Цю дію можна приписувати зменшенню розчинності карбонової кислоти, обумовленому створенням MgCl 2, коли розчин магнієвої солі підкислено HCl. Зокрема, очікувану дію висолювання спричинено конкретною комбінацією HCl, магнію та карбонової кислоти. Оскільки дії висолювань звичайно важко передбачити, конкретно висока дія висолювання, спостережена в способі осаджування винаходу, відбулася як несподіванка для винахідників. Отже, при застосуванні способу осаджування винаходу осад карбонової кислоти може призводити до високого виходу з розчину магній карбонату, цей розчин, наприклад, є ферментаційною сумішшю, отриманою в способі ферментації. Крім того, отриманий осад карбонової кислоти має відносно високу чистоту, оскільки етап осаджування в способі осаджування винаходу не призводить до осаджування великих кількостей сполук, відмінних від карбонової кислоти. Крім того, розчин магній хлориду отримано шляхом етапу термічного розкладу. Крім того, конкретний вибір HCl та магній карбонату забезпечував зменшення відходів солі та додаткових матеріалів, що потребувало підкислення, зокрема, коли згідно з винаходом, це комбінували з етапом термічного розкладу, отриману з якого HCl знов застосовували в етапі підкислення. Термін "осадження", який тут застосовано, стосується створення твердого матеріалу, виходячи із цілком розчиненого стану. Карбонову кислоту можна осаджувати в кристалічній формі або аморфній формі. Також можна очистити карбонову кислоту осадженням карбонової кислоти згідно зі способом осаджування винаходу. У випадку, коли розчин магній карбонату містить розчинені забруднення, осадження карбонової кислоти типово відокремлює карбонову кислоту від таких забруднень. Термін "розчин, який підлягає осадженню", який тут застосовано, стосується розчину, який піддано осадженню Типово, цей термін стосується розчину, який містить карбонову кислоту та MgCl2, отримані після підкислення, необов'язково потім розчин піддавали етапу концентрування та/або етапу, де додавали додатковий MgCl2. Однак, у випадку другого або подальшого етапу осаджування, термін " розчин, який підлягає осадженню" стосується розчину MgCl 2, отриманому після останнього етапу осаджування, потім цей розчин необов'язково підлягає етапу концентрування та/або етапу, де додано додатковий MgCl2. Такі розчини MgCl2 можуть ще містити карбонову кислоту, яку можна отримати наданням його другому або подальшому етапу осаджування. У способі осаджування можна застосовувати будь-який магній карбонату, який у підкисленій формі (тобто, де є відповідна карбонова кислота) має розчинність у воді близьку або нижче MgCl2. Отже, карбонова кислота, осаджена в способі осаджування винаходу, має розчинність у воді 60 г/100 г води або менше при 20 °C. Карбонові кислоти, які мають розчинність у воді значно вищу ніж MgCl2, не є придатними для осадження способом осаджування винаходу, оскільки в цьому випадку будуть осаджуватися великі кількості MgCl 2, коли отримано осадження не придатної для відокремлення карбонової кислоти. Краще, коли карбонова кислота, яка відповідає карбонату, має розчинність нижчу ніж у MgCl2, яку визначено у воді при 20 °C, тобто має розчинність у воді меншу 54,5 г/100 г води при 20 °C (безводне). Ще краще, коли карбонова кислота має розчинність значно нижчу розчинності MgCl2, за умови, щоб MgCl2 не осаджували разом із карбоновою кислотою з розчину в етапі осаджування. Отже, краще, коли карбонова кислота має розчинність у воді при 20 °C меншу 30 г/100 г води, ще краще - менше 15 г/100 г води, найкраще - менше 10 г/100 г води. 9 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 В одному втіленні карбонову кислоту, осаджену способом осаджування винаходу можна вибирати із групи, яка містить наступне: бурштинова кислота, ітаконова кислота, лимонна кислота та фумарова кислота. Осаджена карбонова кислота також може бути адипіновою кислотою. Кращою карбоновою кислотою є бурштинова кислота, оскільки конкретно придатну дію висолювання спостерігали для цієї конкретної кислоти. Бурштинова кислота має розчинність 6,75 г/100 г води при 20 °C. Відповідно, магній карбонат можна вибирати із групи, яка містить наступне: магній сукцинат, магній ітаконат, магній фумарат, магній цитрат та магній адипат. Магній карбонат, передбачений у способі осаджування винаходу, можна отримувати в способі ферментації. Магній карбонат можна постачати у твердій (наприклад, кристалічній) формі. Альтернативно, магній карбонат може бути в розчиненій формі, наприклад, як складова розчину або суспензії. Такий розчин або суспензія, які містять розчинений магній карбонат, може бути водним та, зокрема, його можна отримати в способі ферментації. Прикладом суспензії може бути, наприклад, суспензія, яка містить розчинений магній карбонат та нерозчинну біомасу, якто ферментаційний бульйон. З практичних причин верхня межа концентрації магній карбонату може бути 20 мас. %, наприклад, у випадку магній карбонату - сукцинату. У випадку сукцинату розчин потребує концентрацію, вищу 20 мас. %, щоб мати температур 75 °C, яка є шкідливою для устаткування, що обумовлено присутністю HCl. Для значно більшого виходу карбонової кислоти, що можливо після підкислення та осаджування, краще, щоб концентрація карбонату при підкисленні була можливо високою. У випадку розчину магній карбонату верхню межу концентрації магній карбонату визначено розчинністю магній карбонат. У випадку суспензії карбонату типово здатність суспензії до перемішування визначає верхню межу. У випадку, коли карбонат - твердий корж, відокремлення твердого від рідини та отримання налиплої води, типово визначають верхню межу. Комбінація згаданої вище вихідної концентрації буде сприятливо впливати, коли протягом етапу осаджування MgCl2 залишається в розчині та осаджується можливо більше карбонової кислоти. Коли розчин або суспензія магній карбонату, отримані зі способу ферментації, не мають достатньо високої концентрації магній карбонату, розчин можна концентрувати, наприклад, випаровуванням. Спосіб осаджування винаходу охоплює етап підкислення, де магній карбонат підкислено газоподібним HCl, таким чином отримуючи розчин, який містить карбонову кислоту та MgCl2. Цей етап детально описано вище. Підкислення типово супроводжено надлишком HCl. Краще, коли надлишок є малим, за умови, щоб розчин MgCl2, отриманий після осаджування, не мав високу кислотність, яка є небажаною при подальшій обробці цього розчину. Наприклад, застосований надлишок HCl може бути таким, щоб отриманий розчин MgCl2 після осаджування мав pH 1 або вище, як-то, приблизно, pH 1,5. Спосіб осаджування винаходу може охоплювати етап концентрування, де отриманий розчин після підкислення HCl концентрували. Вища концентрація карбонової кислоти в розчині буде підвищувати ефективність осаджування карбонової кислоти. Етап концентрування можна супроводжувати випаровуванням. Спосіб осаджування винаходу, крім того, охоплює осадження карбонової кислоти з розчину, отриманого в етапі підкислення або, якщо це присутнє, з розчину, отриманого в етапі концентрування. Цей етап можна назвати (першим) етапом осаджування. Осаджування можна робити будь-яким способом, який відомий у рівні техніки, як-то реактивне осаджування або охолодження, концентрування, випаровування розчину до осадження або додавання антирозчинника до розчину для осаджування. Осаджування, обумовлене підкисленням магній карбонату HCl, можна назвати реактивним осаджуванням. У реактивному осаджуванні осаджування відбувається протягом підкислення. Отже, підкислення магній карбонату та осадження таким чином отриманої карбонової кислоти робили як один етап. Відповідно, у переважному втіленні спосіб осаджування винаходу охоплює тільки етапи постачання магній карбонату, отриманого в способі ферментації (як описано вище); та підкислення магній карбонату HCl, як описано вище, таким чином, отримуючи осад карбонової кислоти та розчин MgCl2. Отже, етап осаджування може призводити до створення суспензії з осадом карбонової кислоти, присутньої в розчині MgCl2. Реактивне осаджування можна проводити вибором, за умов щоб у етапі підкислення могло відбуватися безпосереднє осаджування карбонової кислоти. Спеціалісту слід розуміти, як визначити такі умови. Зокрема, концентрацію магній карбонату можна вибрати таку, щоб 10 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 підкислення HCl призводило до концентрації карбонової кислоти, вищої насиченої концентрації карбонової кислоти. Етап осаджування також можна робити охолодженням розчину для осадження, наприклад, розчин, утворений в етапі підкислення, або, якщо це присутнє, з розчину, отриманого в етапі концентрування. Цей тип осаджування можна назвати осаджування охолодженням. Етап охолодження може потребувати, щоб розчин для осадження спочатку нагрівали до температури, при якій по суті весь MgCl2 та карбонова кислота були розчиненими. Розчин для осадження можна охолоджувати від температури, вищої температури зародження кристалу карбонової кислоти в розчині, до температури, нижчої температури зародження кристалу карбонової кислоти в розчині. Температура зародження кристалу є вищою температури, при якій утворюються тверді речовини, зокрема, осад. Ця температура є залежною від концентрації MgCl2, карбонової кислоти та присутності інших компонентів. Отже, неможливо надавати єдину величину температури для зародження кристалу. Однак, взагалі, розчин для осадження охолоджено від температури, принаймні, 35 °C до температури менше 30 °C, краще, принаймні, від 40 °C до температури менш 25 °C. У випадку охолодження осаджуванням концентрація карбонової кислоти до охолодження краще є близькою до розчинності, що є економічно здійсненним. Концентрація карбонової кислоти, наприклад, може дорівнювати 0-100 г/л або нижчою (або 0-50 г/л або нижчою) розчинності карбонової кислоти. Крім того, осаджування можна створювати концентруванням розчину, який містить карбонову кислоту та MgCl2, краще - випаровуванням. Випаровування частини розчиннику з розчину, який містить карбонову кислоту та MgCl2, буде призводити до вищої концентрації карбонової кислоти та більшій дії висолювання, яке збільшує осаджування. Крім того, осаджування можна створювати додаванням антирозчинника до розчину для осадження. Антирозчинники є сумісними з розчином або розчинними в розчині для осадження. Прикладами антирозчинників є наступні: спирти, зокрема, спирти C1-C3, наприклад, метанол, етери, зокрема, C2-етери, наприклад, диметилетер, та кетони, зокрема, кетони C2-C4, наприклад, ацетон. Краще, коли отриманий розчин MgCl2 після осаджування можна піддавати другому та/або наступному етапу осаджування, таким чином створюючи додатковий осад карбонової кислоти та другий та/або наступний розчин MgCl2. Другий або наступний етап осаджування можна проводити для отримання, принаймні, частини карбонової кислоти, яка залишається в розчині MgCl2, отриманому в попередньому етапі осаджування. У цьому випадку етап осаджування винаходу можна назвати першим етапом осаджування. Розчин MgCl2, отриманий у першому осаджуванні способу осаджування, може ще містити малі кількості карбонової кислоти. Щоб знов отримати, принаймні, частину цієї карбонової кислоти, можна робити другий етап осаджування. Такий другий етап осаджування можна робити в умовах, подібних умовам у першому етапі осаджування, охоплюючи етап концентрування та/або додавання MgCl2 перед етапом осаджування. У переважному втіленні спосіб осаджування винаходу охоплює першу реакцію осаджування, яка є етапом реактивного осаджування, після чого розчин MgCl2, отриманий у цьому етапі, піддавали етапу охолодження та/або випаровування. Етап охолодження та/або випаровування далі є етапами осаджування, де осаджено додаткову карбонову кислоту. Перед будь-яким етапом осаджування до розчину для осадження можна додавати магній хлорид. Цей розчин може бути розчином, який містить магній карбонат (у випадку реактивного осаджування) або розчином, який містить карбонову кислоту та магній хлорид (який отримано в етапі підкислення). Такий доданий магній хлорид може підвищувати дію висолювання, таким чином, збільшуючи осаджування карбонової кислоти. В одному втіленні магній карбонат, передбачений у способі осаджування винаходу, отримано в способі ферментації. У такому способі ферментації джерело вуглеводу типово для створення карбонової кислоти зброджують способами мікроорганізму. Потім протягом ферментації додають магній основу як засіб нейтралізації для постачання магнієвої солі карбонової кислоти. Прикладами придатних магній основ є магній гідроксид (Mg(OH) 2), магній карбонат (MgCO3) та магній гідрогенкарбонат (Mg(HCO3)2). Перевагою застосування Mg(OH)2 як основи є те, що цю сполуку можна постачати способом осаджуванням винаходу. Застосування MgCO3 також може бути бажаним, та його можна легко отримувати перетворенням Mg(OH) 2, отриманим у способі осаджування винаходу. Крім того, застосування MgCO 3 або Mg(OH)2 є бажаним, оскільки гідроксид та карбонат несподівано мають негативний вплив на дію висолювання способу осаджування винаходу (будь-який карбонат після нейтралізації може залишати розчин як газоподібний CO2). 11 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 Спосіб ферментації може містити етап очищення, де кристалізований із ферментаційного бульйону магній карбонат потім може розчинятися у воді з утворенням водного розчину, який типово має вищу концентрацію карбонату ніж ферментаційний бульйон. Такий етап очищення може мати перевагу, тому що можна отримувати вищий вихід у першому етапі осаджування, що обумовлено вищою концентрацією магній карбонату, зокрема, коли карбонат - сукцинат. Кристалізація може охоплювати, принаймні, один етап концентрування, як-то етап випаровування води, етап охолодження, етап уведення запалу кристалізації, етап відокремлення, етап промивання та етап перекристалізації. Концентрування можна робити як окремий етап або разом із кристалізацією (наприклад, випаровування-кристалізація). В одному втіленні заявлений винахід стосується комплексного способу, який охоплює наступні етапи: - піддавання джерела карбону етапу ферментації для створення карбонової кислоти, цей етап ферментації містить етапи бродіння джерела карбону способами мікроорганізму у ферментаційному бульйоні для створення карбонової кислоти та нейтралізації, принаймні, частини карбонової кислоти додаванням магній основи, вибраної з оксиду магнію та магній гідроксиду, таким чином отримуючи магній карбонат, - піддавання магній карбонату етапу підкислювання, де магній карбонат контактував із потоком газу, який містить газоподібний HCl, для створення потоку рідини, яка містить карбонову кислоту та магній хлорид, - піддавання потоку рідини, який містить карбонову кислоту та магній хлорид, етапу відокремлення для виходу карбонової кислоти та рідини, яка містить магній хлорид, - піддавання водної рідини, яка містить магній хлорид до температури, принаймні, 300 °C, таким чином розкладаючи магній хлорид до оксиду магнію та гідроген хлориду, отже, отримуючи твердий оксид магнію та газ, який містить газоподібний гідроген хлорид, цей газ постачали до етапу підкислювання, - постачання оксиду магнію як засобу нейтралізації до етапу ферментації як такий або після перетворення до магній гідроксиду. В одному втіленні етап концентрування проводили після етапу ферментації та перед етапом підкислювання, що призводить до постачання рідини з температурою, принаймні, 60 °C. Різні етапи способу згідно із цим утіленням винаходу можна проводити як описано більш детально вище. Спеціалісту слід розуміти, що різні аспекти заявленого винаходу, які описано вище в різних розділах, можна комбінувати. Винахід та певні втілення винаходу ілюстровано наступними прикладами та/або втіленнями без обмеження щодо цього або в такий спосіб. Приклад 1: Отримання газоподібного потоку HCl Газоподібний потік, який містить HCl, (постачання газу) отримували випаровуванням 765 г/год. 18 мас% розчину HCl у воді в підігрітий 930 г/год. потік газоподібного азоту при температурі 95 °C. Цей газоподібний потік HCl призначено бути схожим до газоподібного потоку HCl, отриманого термогідролізом 25-30 мас% розчину магній хлориду у воді. Отже, отриманий газоподібний потік HCl містив 8 мас % HCl, 37 мас % води та 55 мас % азоту. Хоч газоподібні потоки HCl, отримані в способі термогідролізу, типово містять додаткові сполуки, зокрема, інші гази, як-то кисень та карбон діоксид, та забруднення, як-то летючі карбонові кислоти, газоподібний потік HCl, отриманий у цьому прикладі, уважали достатньо схожим із такими газоподібними потоками HCl, за умов щоб доказ принципу, показаний у прикладах 2-6 при застосуванні цього газу, стосувався газоподібних потоків HCl, отриманих у способі термогідролізу. Приклад 2: Адсорбція водою та підкислення відокремленого - порівняльне У цьому експерименті газоподібний потік HCl прикладу 1 абсорбували у воді, щоб отримати розчин, який містить HCl, цей розчин застосовували для підкислення розчину магній сукцинату. Адсорбцію газоподібного потоку HCl у воді робили в окремій скляній колонці довжиною 1,1 м та внутрішнім діаметром 45 мм. Секцію активної адсорбції колонки (95 см) оснащували скляними кільцями Рашига діаметром 4 мм та висотою 4 мм. Внутрішню температуру колонки вимірювали та контролювали для підтримання температури 95 °C. Демінералізовану воду вводили до верху та газоподібний потік HCl до дна колонки. Колонку приводили до дії газоподібним потоком HCl як безперервною фазою та протіканням демінералізованої води через кільця Рашига. Рівень розділу фаз біля дна колонки спостерігали візуально та контролювали через клапан із ручним керуванням у підкисленому водному потоці, який залишав дно колонки. Виснаженому газоподібному потоку HCl дозволяли залишати верх колонки. 12 UA 112462 C2 5 10 15 20 25 30 35 40 45 50 55 60 Застосований газоподібний потік HCl (1695 г/год., 95 °C) отримували згідно із прикладом 1. Він контактував в описаному вище пристрої із зустрічним потоком демінералізованої води (825 г/год.) при температурі 95 °C. Зразки відбирали з водної донної фази. Визначена концентрація HCl у цьому зразку дорівнювала 18 мас%. Отриманий розчин, який містив HCl, потім застосовували, щоб підкисляти розчин 20 мас% магній сукцинату. Цей розчин постачання магній сукцинату (водну суміш) отримували додаванням магній гідроксиду (58 г) до розчину 118 г бурштинової кислоти в 664 г води та перемішували до повного розчинення. Цей розчин призначено бути схожим на розчин магній сукцинату, отриманий у способі ферментації. Хоч розчин магній сукцинату, отриманий у способі ферментації, звичайно містить інші сполуки ніж магній сукцинат, як-то відносно велику кількість забруднення, розчин магній сукцинату, отриманий у цьому прикладі, уважали достатньо схожим до такого розчину сукцинату, отриманого в способі ферментації, щоб показати доказ принципу, що винахід працює. Потім 100 г отриманого розчину магній сукцинату підкислювали додаванням 60 г розчину, який містить HCl (18 мас%), при температурі 95 °C. Визначали композицію підкисленої суміші та знайшли, що вона містить 11 мас % бурштинової кислоти, 8 мас% магній хлориду та
ДивитисяДодаткова інформація
Автори англійськоюCerda Baro, Agustin, van Breugel, Jan, Groot, Willem Jacob, de Haan, Andre, Banier, Jansen, Peter Paul
Автори російськоюСерда Баро Агустин, ван Брюгел Ян, Гроот Виллем Якоб, дэ Хан Андрэ Банье, Янсэн Пэтер Паул
МПК / Мітки
МПК: C07C 57/13, C07C 53/122, C07C 59/01, C07C 61/00, C07C 55/10, C07C 57/145, C07C 59/195, C07C 59/08, C07C 57/04, C07C 57/15, C07C 51/02, C07C 59/265, C07C 55/14
Мітки: підкислення, карбоксилату
Код посилання
<a href="https://ua.patents.su/19-112462-pidkislennya-karboksilatu.html" target="_blank" rel="follow" title="База патентів України">Підкислення карбоксилату</a>
Попередній патент: Система подавання енергії для портативного пристрою для утворення аерозолю
Наступний патент: Інтегрально-ізокінетичний багатофазний пробовідбірник
Випадковий патент: Спосіб регенерації розчинів сірчаної кислоти для травлення чорних металів