Спосіб визначення лізоцимної активності сироватки крові
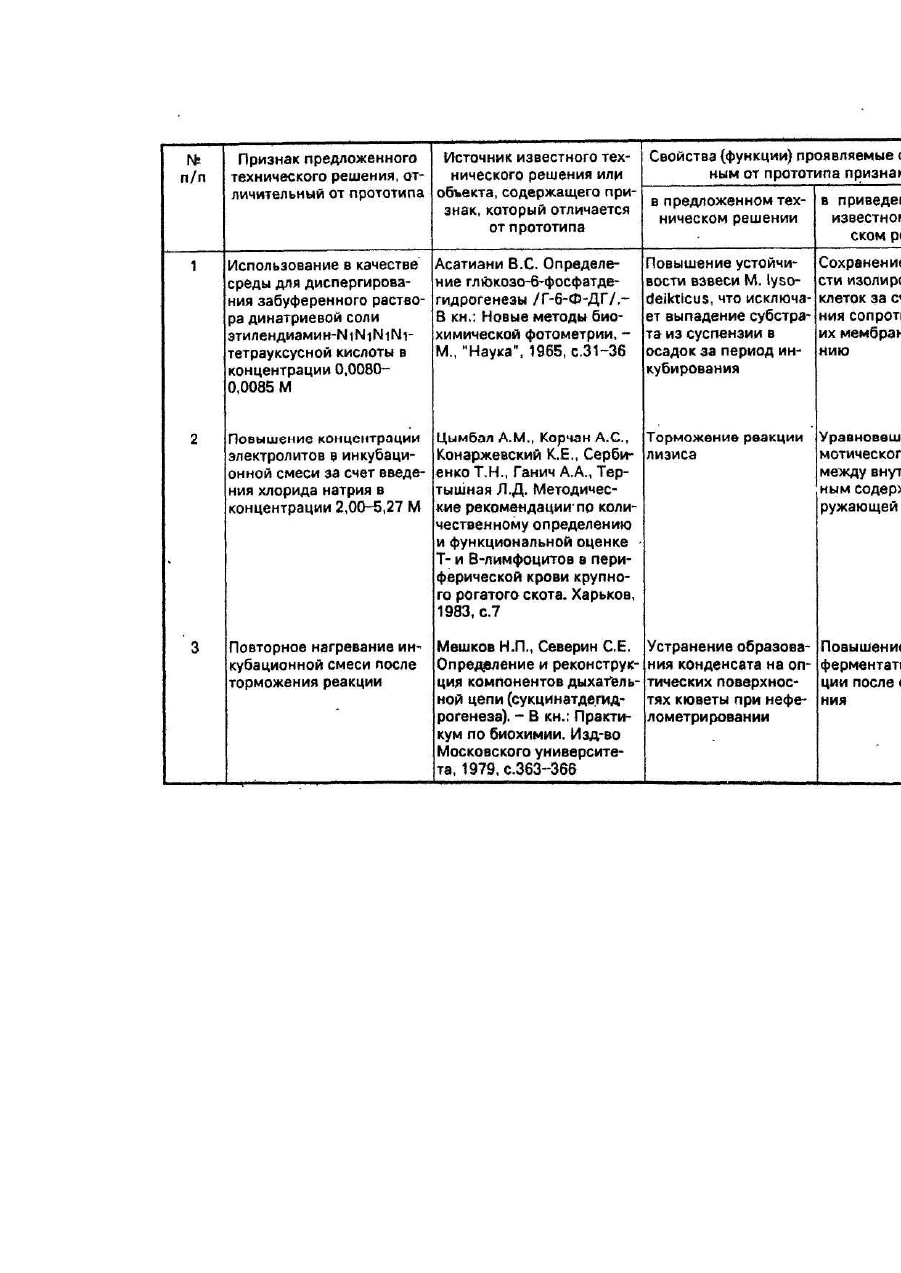
Номер патенту: 19316
Опубліковано: 25.12.1997
Автори: Захаров Володимир Васильович, Кутіков Євген Самойлович
Формула / Реферат
Изобретение относится к области животноводства, в частности, к способам определения состояния естественной резистентное™ организма сельскохозяйственных животных, и может быть использовано при оценке эффективности технологических систем производства животноводческой продукции на промышленной основе.
Известен способ нефелометрического определения лизоцимной активности сыворотки крови, основанный на ее способности подвергать лизису Micrococcus lysodeikticus [1].
К недостаткам этого известного способа следует отнести то, что при определении лизоцимной активности этим способом используют нативную сыворотку крови, которую не подвергают предварительному термическому инактивированию. Тем самым определяют общую лизоцимную активность без дифференцированного определения лизоцимной активности термостабильных и термолабильных факторов сыворотки крови. В результате этого оценка состояния естественной резистентности организма по лизоцимной активности носит ограниченный характер.
Субстратом служит суточная культура Μ. lysodeikticus, производимая не централизованно, а выращивания каждым исследователем независимо друг от друга. Это снижает уровень стандартизированности субстрата, что, в конечном итоге, отрицательно сказывается на точности и сопоставимости определений.
Инкубирование субстрата в присутствии и отсутствие сыворотки крови не завершается торможением лизина М. lysodeikticus, который продолжается в течение всего периода нефелометрирования. Это приводит к завышению фактической величины лизоцимной активности сыворотки крови. При этом величины завышения носят нерегулярный характер.
М. lysodeikticus, служащий субстратом, взвешивается в 1/15 Μ фосфатном буфере, образуя дисперсную систему, которая характеризуется недостаточной устойчивостью: часть субстрата в процессе инкубирования выпадает из взвеси в осадок. Это отрицательно сказывается на точности и чувствительности известного способа.
В качестве прототипа выбран способ определения лизоцимной активности сыворотки крови, с помощью которого наряду с общей лизоцимной активностью раздельно определяют лизоцимные активности термостабильных и термолабильных факторов. Диспергированный в 1/15 Μ фосфатном буфере, рН 7,2 М. lysodeikticus раздельно и совместно инкубируют с интактной и инактивированной сывороткой крови. Торможение лизиса бактерий осуществляют путем охлаждения инкубационной смеси. Измерение величины гидролиза субстрата проводят методом нефелометрирования. По величине гидролиза субстрата оценивают общую лизоцимную активность и лизоцимную активность термостабильных факторов, а по разности между этими величинами, выраженными в микрограммах лизоцима в 1-ом мл. - лизоцимную активность термолабильных факторов сыворотки крови [2].
Однако существующий способ характеризуется, сравнительно низкой чувствительностью, в результате чего определяемые величины лизоцимной активности имеют невысокие значения, а лизоцимная активность термолабильных факторов сыворотки крови телят первого полугодия жизни вообще оказывается на пределе разрешения способа (ниже 0,1 мкг/мл).
Сравнительно низкая чувствительность этого способа обусловлена недостаточной устойчивостью дисперсной системы, что приводит к частичному выпадению М. lysodeikticus из взвеси в осадок. В течение одного часа инкубирования более половины массы диспергированного в 1/15 Μ фосфатном буфере субстрата оседает. Снижение концентрации субстрата во взвеси понижает величину субстрат-ферментных отношений и, как следствие этого, уменьшает скорость катализируемого гидролиза, что и является непосредственной причиной относительно низкой чувствительности способа.
Помимо этого, к недостаткам известного способа следует отнести его сравнительно невысокую точность, что обусловлено, в частности, пенообразовании, возникающим при ресуспендировании перед нефелометрированием осевшего в процессе инкубирования субстрата. Образующиеся при этом в жидкой фазе инкубационной среды пузырьки существенно снижают коэффициент светопропускания образцов, В количественном отношении эти изменения носят нерегулярный характер и не поддаются стандартизации.
Сравнительно низкая точность известного способа связана также с существенным расхождением величин светопропускания параллельных образцов одной и той же рабочей пробы. Это обусловлено разным уровнем диспергированности субстрата в момент нефелометрирования. Хотя эти расхождения возникают сравнительно редко, они носят нерегулярный характер и значительны по своей величине.
Кроме того, относительно низкая точность способа является следствием высоких уровней контролей на фермент, обусловленных введением в инкубационную систему значительных объемов испытуемой сыворотки (0,5 мл сыворотки крупного рогатого скота при общем объеме инкубационной смеси в пробирке 2,0 мл).
К причинам сравнительно низкой точности известного способа следует помимо этого отнести и недостаточную эффективность приема торможения реакции лизиса с помощью погружения образцов в водяную баню с тающим льдом. Это особенно заметно при высоких значениях концентрации лизоцима в сыворотке крови (свыше 1 мкг/мл) на фоне проведения массовых анализов, предполагающих одномоментную затрату значительного количества времени (около 1-го часа) на нефелометрирование. Величина прироста лизоцимной активности с момента завершения инкубирования по отношению к активности за период инкубирования в этом случае может достигать сравнительно высоких величин (более 17%). При этом фактическая лизоцимная активность завышается неодинаково даже для образцов, исследуемых в одной партии.
Прием торможения реакции лизиса не обеспечивает необходимую точность способа не только в результате недостаточной его эффективности, но и вследствие образования конденсата на оптических поверхностях кюветы в момент нефелометрирования.
Образование конденсата обусловлено разностью температур между окружающей средой, в которой проводят измерения, и кюветной, содержащей образец, охлажденный до 0 - +1°С. Конденсат на поверхности кюветы существенно понижает величины светопропускания образцов, повышая разброс этих показателей на уровне параллелей. При протирании оптических поверхностей кюветы непосредственно перед нефелометрированием конденсат может образоваться повторно. Поэтому такой способ удаления его является недостаточно надежным. Кроме этого он значительно удлиняет время нефелометрирования, что также в конечном итоге негативно сказывается на точности способа.
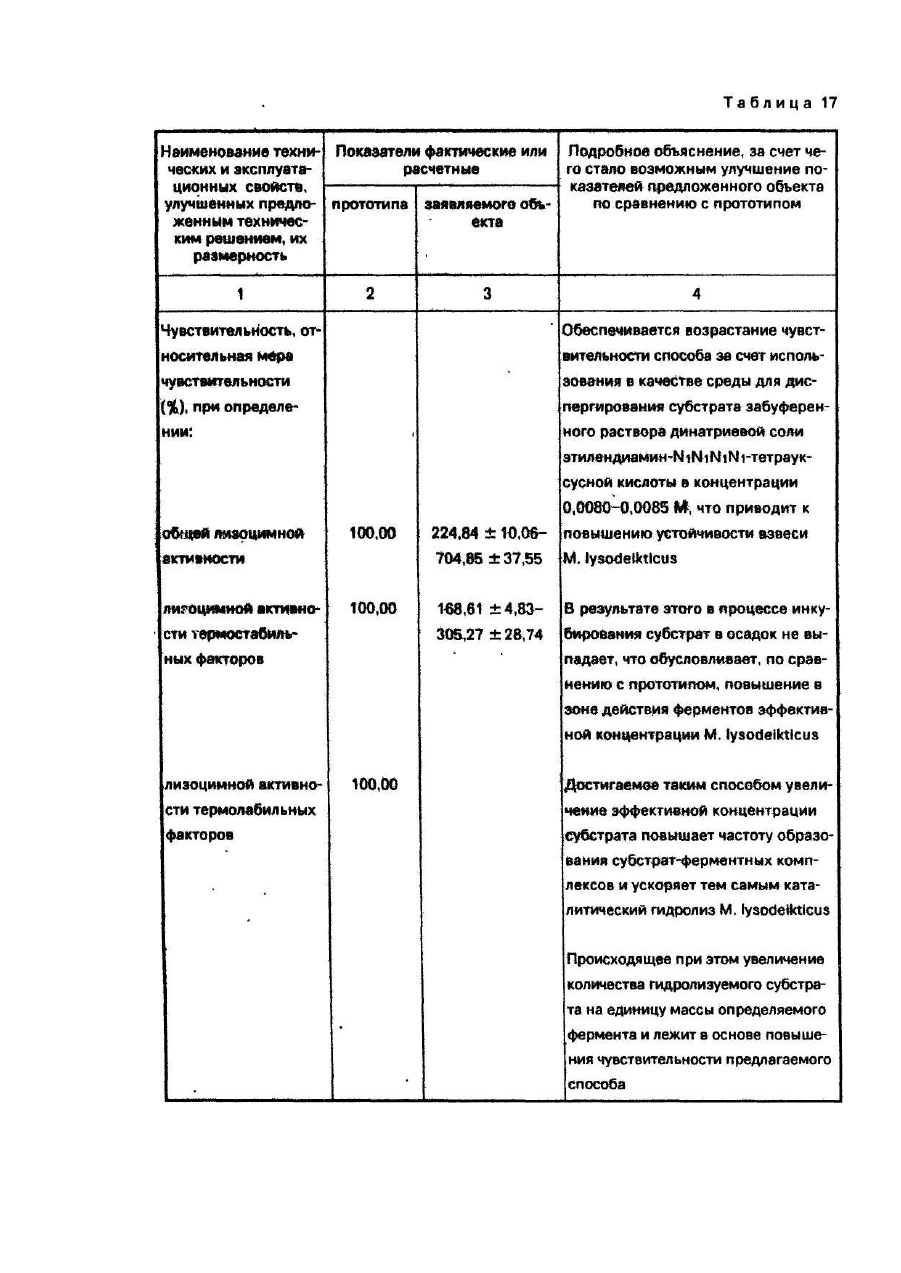
Задачей настоящего изобретения является повышение чувствительности и точности способа определения лизоцимной активности, уменьшение используемых объемов исследуемой сыворотки крови.
Поставленная задача решается тем, что в способе определения лизоцимной активности сыворотки крови, включающем раздельное и совместное инкубирование М. lysodeikticus с интактной и инактивированной сывороткой крови, торможение лизиса бактерий путем охлаждения инкубационной смеси, определение методом нефелометрирования общей лизоцимной активности в инкубационной системе, содержащей интактную сыворотку, и лизоцимной активности термостабильных факторов - в системе, содержащей инактивированную сыворотку, с последующей оценкой по разнице между этими величинами активности термолабильных факторов сыворотки крови, согласно изобретению:
а) в качестве среды для диспергирования М. lysodeikticus используют забуференный раствор динатриевой соли этилендинамин-N1N1N1N1-тетрауксусной кислоты в концентрации 0.0080-0.0085M;
б) концентрацию электролитов в инкубационной смеси повышают непосредственно после начала торможения реакции лизиса в водяной бане с тающим льдом за счет введения хлорида натрия в концентрации 2,00-5,25 М;
в) инкубационную смесь после торможения реакции непосредственно перед нефелометрированием нагревают повторно.
Забуференный раствор динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты обеспечивает повышение устойчивости взвеси, что исключает выпадение субстрата из суспензии в осадок за период инкубирования.
Повышение концентрации электролитов в инкубационной смеси за счет введения хлорида натрия обеспечивает торможение реакции лизиса.
Повторное нагревание инкубационной смеси после торможения реакции обеспечивает устранение образования конденсата на оптических поверхностях кюветы при нефелометрировании.
Сущность предложенного способа определения лизоцимной активности сыворотки крови заключается в следующем. Сыворотку крови, полученную после ретракции кровяного сгустка, отделяют центрифугированием на центрифуге типа ОС - 6М при 5000 об/мин в течение 30 мин и разделяют затем на две равные порции. Одну из порций сыворотки подвергают термическому инактивированию под резиновой пробкой при 55,9-56,0°С в течение 29-30 мин в водной глицериновой бане ультратермостата ТЛ-150. Инактивированную сыворотку используют для определения лизоцимной активности термостабильных факторов. Порцию неинактивированной (интактной) сыворотки крови используют для определения общей лизоцимной активности. В качестве субстрата применяют лиофилизированную биомассу культуры М. lysodeikticus марки А, выпускаемую Олайнским заводом химических реактивов. Препарат микроорганизмов взвешивают в дисперсной среде, представляющей 0,0080-0,085 Μ (оптимум 0,0080 М) раствор динатриевой соли этилендиамин-N1N1N1N1-тетрауксусной кислоты, забуференный до рН 7,20 трис-(оксиметил)-аминометаном, из расчета 1,4 мг биомассы на 1 мл среды для диспергирования. Взвесь микроорганизмов с момента ее приготовления и до зарядки инкубационной системы постоянно перемешивают на магнитной мешалке типа ММ ЗМ.
При определении общей лизоцимной активности заряжают инкубационную систему, в которую включают: рабочую пробу, состоящую из 0,25 мл неинактивированной сыворотки и 1,50 мл субстрата (в 2-х параллелях); контроль на субстрат, состоящий из 0,25 мл 0,15 Μ NaCl и 1,50 мл субстрата (в 2-х параллелях); контроль на сыворотку крови, состоящий из 0,25 мл неинактивированной сыворотки и 1,50 мл дисперсной среды (в 2-х параллелях); и контроль на реактивы, состоящий из 0,25 мл 0,15 Μ NaCI и 1,50 мл дисперсной среды (в 2-х параллелях).
При определении лизоцимной активности термостабильных факторов заряжают такую же инкубационную систему, как и при определении общей лизоцимной активности. Однако в этом случае в инкубационную систему вводят не интактную сыворотку крови, а в тех же количествах сыворотку крови, подвергнутую предварительному термическому инактивированию.
Стеклянные пробирки с рабочими пробами и контролями закрывают резиновыми пробками. Содержимое пробирок перемешивают и подвергают термостатированному инкубированию при 37,0-39,0°С в течение 59-60 мин в выносной бане ультратермостата типа ТЛ -150. После завершения инкубирования пробирки погружают в водяную баню с тающим льдом и в каждую из них добавляют по 0,25 мл 2,00-4,27 Μ (оптимум 4,80 М) NaCI с последующим перемешиванием содержимого. Непосредственно перед нефелометрированием пробирки последовательно, одну за другой, извлекают из водяной бани с тающим льдом, помещают на 40 с в водяную баню микротермостата типа МТ-Ш при 40-45°С (оптимум 40°С) и содержимой их без предварительного перемешивания переносят в колориметрическую кювету, имеющую рабочую длину 3,070 мм. Нвфелометрирование рабочих проб и контролен проводят против дистиллированной воды при зеленом светофильтре (540 нм) на однолучевом фотоэлектрическом колориметре типа КФК-2.
Полученные величины светопропускания используют а качестве исходных при расчете показателей лизоцимной активности. Для определения общей лизоцимной активности используют данные нефелометрирования инкубационной системы, содержащей неинактивированные образцы сыворотки крови. Вычисление лизоцимной, активности термостабильных факторов проводят по данным, полученным при нефелометрировании инкубационной системы, в которую были включены образцы сыворотки крови, подвергнутые термическому инактивированию. Оба показателя лизоцимной активности вычисляют в процентах светопропускания по единой формуле:
Тла=(Траб.пр. - ТК суб.) + (ТК реакт. - ТК сыв.),
где Тла - лизоцимная активность, % светопропускання;
Траб. пр. - коэффициент пропускания рабочей пробы, %;
ТК суб. - коэффициент пропускания контроля на субстрат, %;
ТК сыв. - коэффициент пропускания контроля не сыворотку крови, %;
ТК реакт. - коэффициент пропускания контроля на реактивы, %.
Рассчитанные в процентах светопропускания величины общей лизоцимной активности и лизоцимной активности термостабильных факторов с помощью калибровочного графика выражают числом микрограммов лизоцима в 1 мл сыворотки крови. После перевода показателей лизоцимной активности в единицы измерения концентрации лизоцима от общей лизоцимной активности отнимают лизоцимную активность термостабильных факторов. Полученная разность является лизоцимной активностью термолабильных факторов сыворотки крови.
Показатели лизоцимной активности сыворотки крови крупного рогатого скота, определенные предлагаемым способом, находятся в следующих пределах:
- общая лизоцимная активность 0,522-1,292 мкг/мл;
- лизоцимная активность термостабильных факторов - 0,162-0,540 мкг/мл;
- лизоцимная активность термолабильных факторов - 0.279-0,900 мкг/мл.
Относительная точность разработанного способа составляет 3%, а его максимальная погрешность при среднем значении лизоцимной активности, равном 0,713 мкг/мл, и гарантированной вероятности Ρ 0.05 находится на уровне 0,008 мкг/мл.
Чувствительность предлагаемого способа соответствует 6,85 · 10-10 M.
Используемый объем исследуемой сыворотки крови крупного рогатого скота, необходимый для определения заявляемым способом в 2-х параллелях общей лизоцимной активности и лизоциммых активностей термостабильных и термолабильных факторов, в расчете на один образец равен 2,0 мл.
Предложенный способ иллюстрируется следующими примерами его осуществления.
Пример 1. Определяли предлагаемым способом общую лизоцимную активность и лизоцимные активности термостабильных и термолабильных факторов сыворотки крови бычка инв, №702t черно-пестрой породы в возрасте 20-ти месяцев живой массой 385 кг, принадлежащего опытному хозяйству "Украинка" НИИ животноводства Лесостепи и Полесья УССР. Определение вели в десяти независимых параллелях. Сыворотку инактивировали при 56°С в течение 30 мин. Субстрат диспергировали в 0,0080 Μ растворе динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты, забуференном до рН 7,2 трис-(оксиметил)-амино-метаном. Интактную и инактивированную сыворотку крови в количестве 0,25 мл в расчете на пробирку в присутствии и отсутствие субстрата инкубировали при 38°С в течение 60 мин, реакцию лизиса после завершения инкубирования дополнительно тормозили 2,00 Μ растворрм NaCI, образцы непосредственно перед нефелометрированием нагревали в водяной бане при 40°С в течение 40 с. В качестве конечного результата определения показателей лизоцимной активности принимали средние арифметические величины, установленные на основе десяти независимых испытаний сыворотки.
Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,682: термостабильных факторов - 0,273; термолабильных факторов - 0,411.
Пример 2. В условиях примера 1 субстрат диспергировали в 0,0085 Μ растворе динатриевой соли этилендиамин-тетра-уксусной кислоты, забуференном до рН 7,2 трис-(оксиметил)-аминометаном.
Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,655; термостабильных факторов - 0,273; термолабильных факторов - 0,386.
Пример 3. В условиях примера 2 реакцию лизиса после завершения инкубирования дополнительно тормозили 5,27 Μ раствором.
Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,653; термостабильных факторов - 0,251; термолабильных факторов - 0,402.
Пример 4. В условиях примера 3 образцы непосредственно перед нефелометрированием нагревали в водяной бане при 45°С.
Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,655; термостабильных факторов - 0,296; термолабильных факторов - 0,354.
Результаты опытов 1-4 показывают, что при использовании предельных значений режимов признаков предложенного технического решения, отличительных от прототипа, полученные величины показателей лизоцимной активности сыворотки крови являются близкими.
Пример 5. Общую лизоцимную активность и лизоцимные активности термостабильных и термолабильных факторов сыворотки крови определяли известным способом, принятым в качестве прототипа. В условиях примера 4 субстрат диспергировали в 1/15 Μ фосфатном буфере рН 7,2, сыворотку крови в инкубационную систему вводили в количестве 0,5 мл на пробирку, дополнительного торможения лизиса раствором NaCI, а также повторного нагревания образцов в водяной бане непосредственно перед их нефелометрированием не проводили.
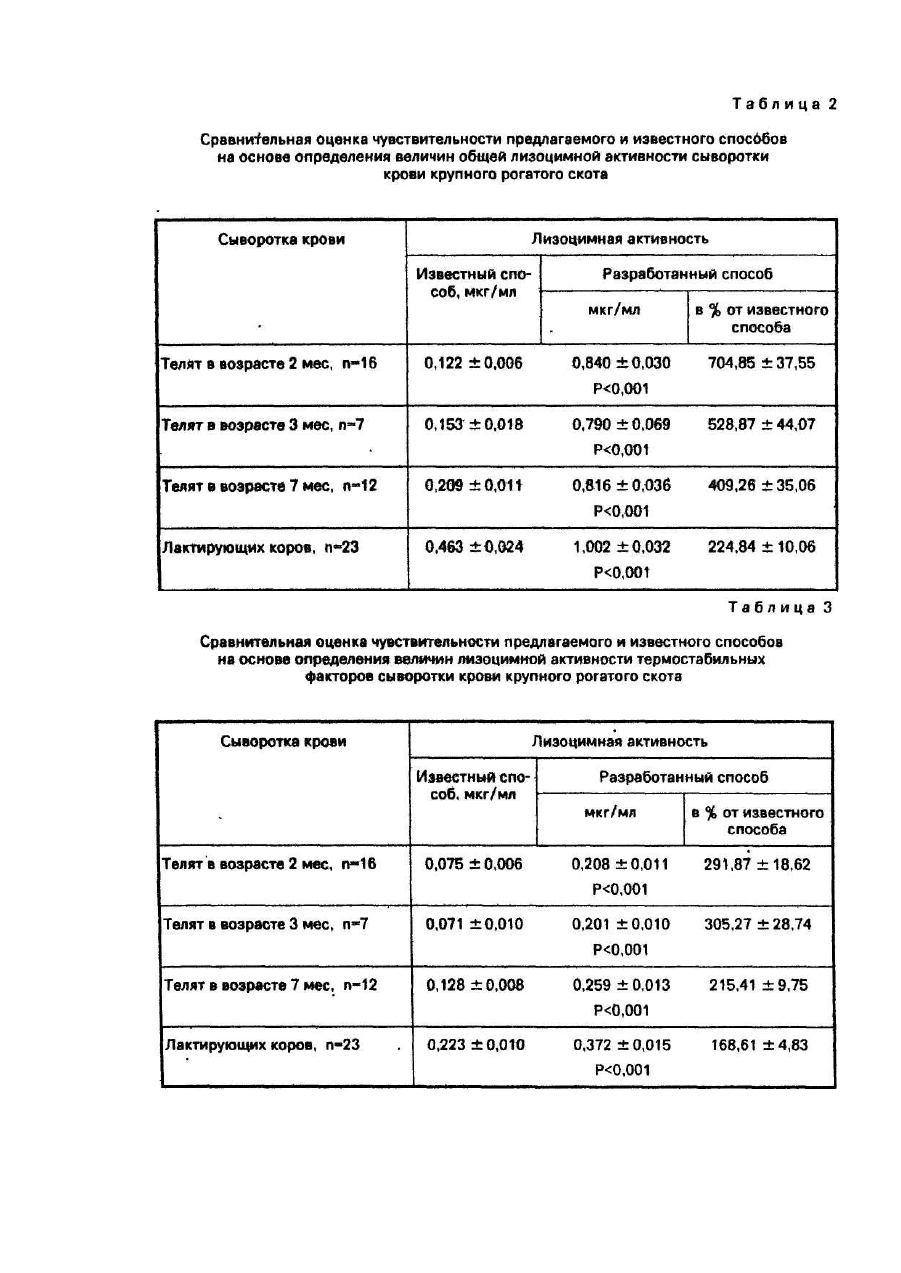
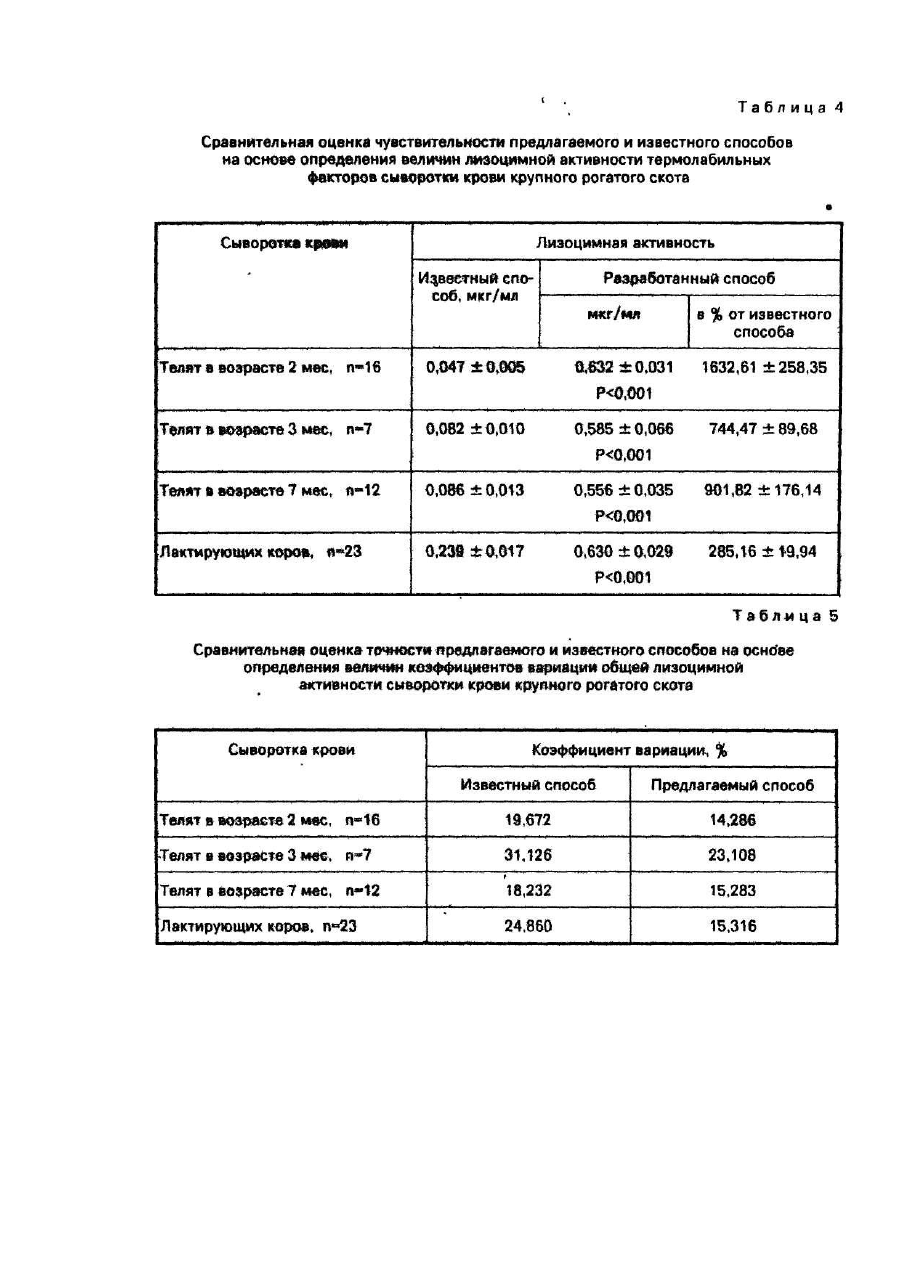
Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,246; термостабильных факторов - 0,136; термолабильных факторов - 0,110. То есть, чувствительность предлагаемого способа (пример 1 -4) при определении общей лизоцимной активности и лизоцимных активностей термостабильных и термолабильных факторов была выше чувствительности прототипа (пример 5) в кратное количество раз и составило в среднем соответственно 268,8%; 200,9% и 352,9% по отношению к уровню, определенному известным способом. При этом количество сыворотки крови, расходуемое на определение показателей лизоцимной активности предлагаемым способом, по сравнению с известным, было в 2 раза меньшим.
Пример 6. Сыворотку крови получали от 16 телочек черно-пестрой породы в возрасте 2-х месяцев и 7 телочек той же породы в возрасте 3-х месяцев опытного хозяйства "Кутузовка" НИИ животноводства Лесостепи и Полесья УССР; 12 бычков симментальской породы Харьковской области и 23 лактирующих коров симментальской породы, принадлежащих колхозу "Большевик" Валковского района Харьковской области. Показатели лизоцимной активности, полученной сыворотки крови определяли известным способом в условиях примера 5 и предлагаемым способом в условиях примера 1. В условиях примера 1 реакцию лизиса после завершения инкубирования дополнительно тормозили 4,80 Μ раствором NaCI.
Результаты определения общей лизоцимной активности и лизоцимных активностей термостабильных и термолабильных факторов представлены в табл. 2,3,4. В этих же таблицах приведены результаты сравнения величин показателей лизоцимных активностей, определенных известным и предлагаемым способами, выраженные в процентах по отношению к известному способу. Уровни лизоцимных активностей, определенные предлагаемым способом, были выше в кратное количество раз по сравнению с величинами, определенными известным способом, что свидетельствует о получении положительного эффекта - повышении чувствительности способа определения лизоцимной активности. Наибольший эффект повышения чувствительности предлагаемого способа достигнут при определении лизоцимной активности термолабильных факторов: чувствительность предлагаемого способа по сравнению с известным в случае определения термолабильных факторов сыворотки крови телят 2-х месячного возраста увеличилась в 16 раз.
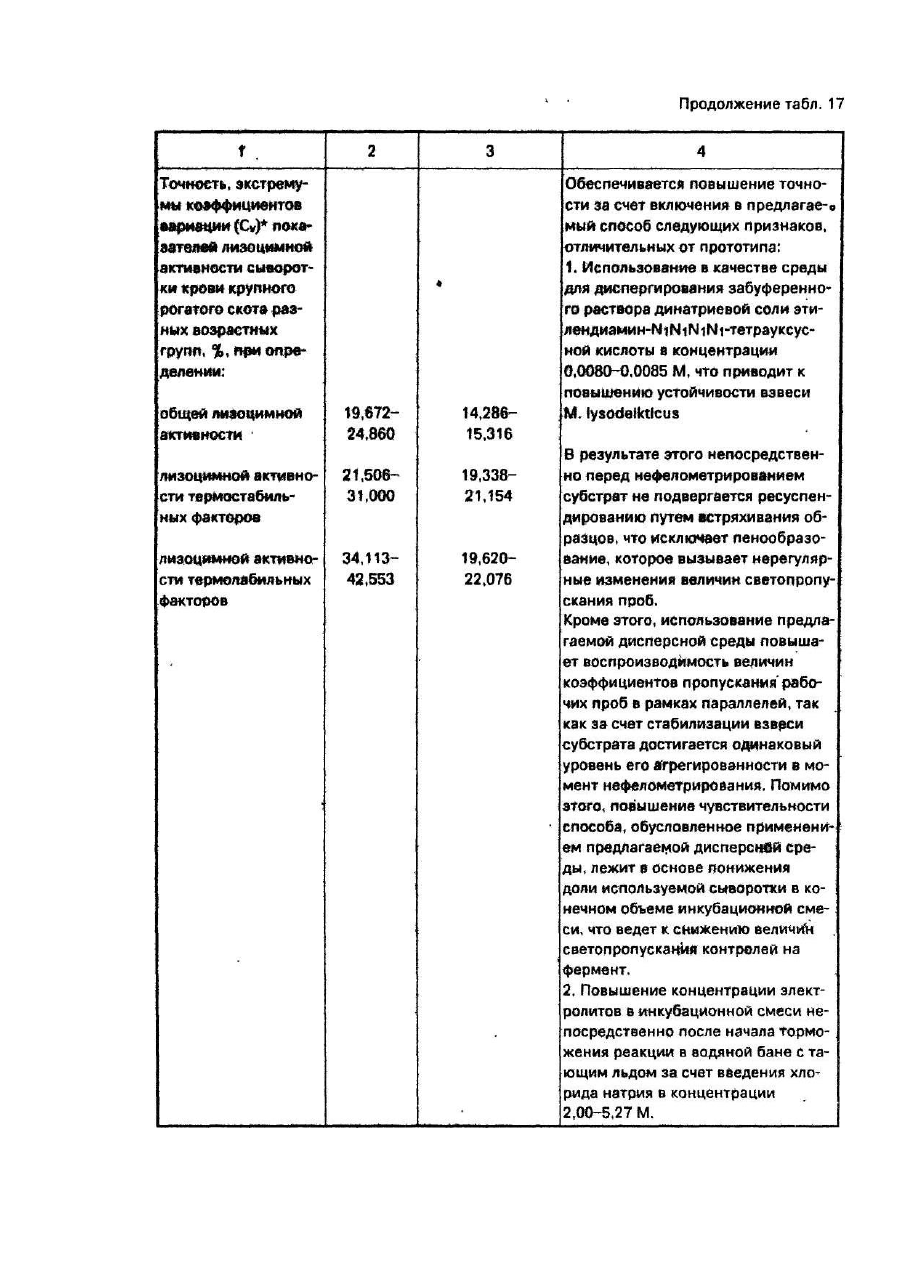
Коэффициенты вариации представлены в табл. 5, 6, 7. Как в случае общей лизоцимной активности, так и в случае лизоцимных активностей термостабильных и термолабильных факторов, коэффициенты вариации показателей, полученных известным способом, были выше таковых, полученных предлагаемым. Поскольку величины коэффициента вариации - связаны с точностью измерения обратной зависимостью, можно заключить, что предлагаемый способ по сравнению с известным, при определении всех трех показателей лизоцимной активности, имел более высокую точность.
Пример 7. В условиях примера 6 предлагаемым способом в 32-х независимых испытаниях определяли лизоцимную активность стандартного раствора лизоцима, не подвергнутого предварительному термическому инактивированию. Стандартный раствор лизоцима приготовляли из лиофилизированного препарата лизоцима яичного белка трехкратной кристаллизации НПО "Биохимреактив" Олейнского завода химреактивов. Кристаллический лизоцим растворяли в 0,15 Μ NaCl из расчета 713 мкг в 1 литре.
Испытуемый стандартный раствор имел лизоцимную активность равную 0,713 ± 0,004 мкг/мл с коэффициентом вариации - 2,935%, то есть относительная точность предлагаемого способа была не хуже 3,000%. Максимальная погрешность (Δ= tm) оценки генерального параметра (лизоцимной активности) при уровне значимости (Р) < 0,05 составляла 0,008 мкг/мл.
Таким образом, среднее арифметическое лизоцимной активности, определенной предлагаемым способом, при гарантированной вероятности Ρ < 0,05, находится в доверительном интервале: 0,713 ±0,008 мкг/мл.
Чувствительность разработанного способа соответствует 6,85 · 10-10 М.
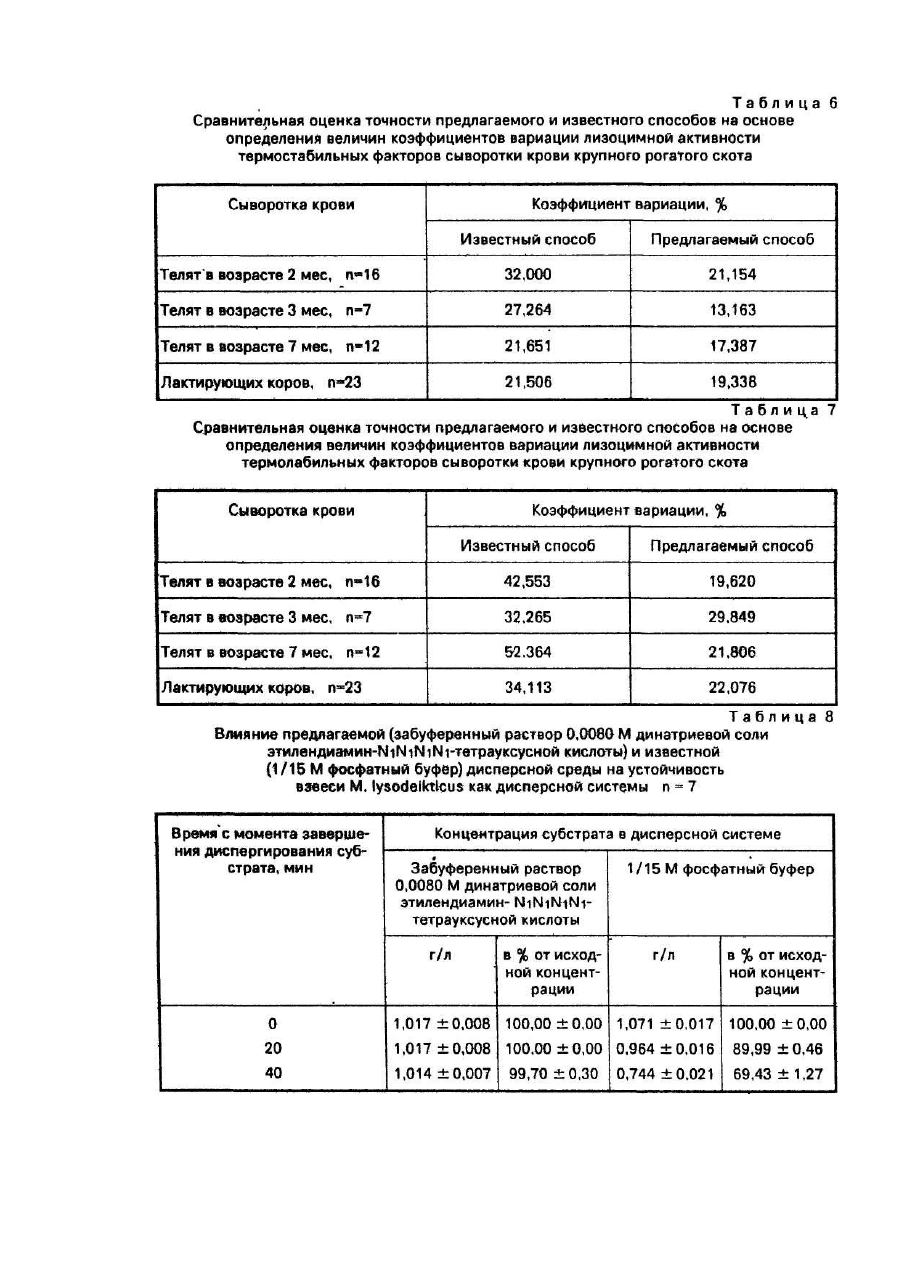
Пример 8. Определяли устойчивость как дисперсной системы взвеси М. lysodeikticus в зависимости от применяемой дисперсной среды. В качестве дисперсной среды испытывали забуференный до рН 7,2 0,0080 Μ раствор динатриевойсоли этилекдиамин- N1N1N1N1-тетрауксусной кислоты (предлагаемое техническое решение) и 1 /15 Μ фосфатный буфер, рН 7,2 (прототип).
М. lysodeikticus в сравниваемых дисперсных средах взвешивали из расчета 1:4 мг/мл и поддерживали в диспергированном состоянии за счет постоянного перемешивания суспензии на 2-х магнитных мешалках типа ММЗМ. Режим перемешивания контролировали инструментально и поддерживали на одинаковом уровне. Полученные таким образом субстраты использовали для зарядки образцов, которые по прописям, предусмотренным известным и предлагаемым способами, соответствовали контролю на субстрат. Для этого в стеклянные пробирки вводили 1,5 мл взвеси микроорганизмов и 0,5 мл 0,15 Μ раствора NaCI. Пробирки закрывали резиновыми пробками и их содержимое перемешивали. Инкубирование проводили без встряхивания в течение 1 часа с определением через каждые 20 мин концентрации микробных тел, находящихся во взвешенном состоянии.
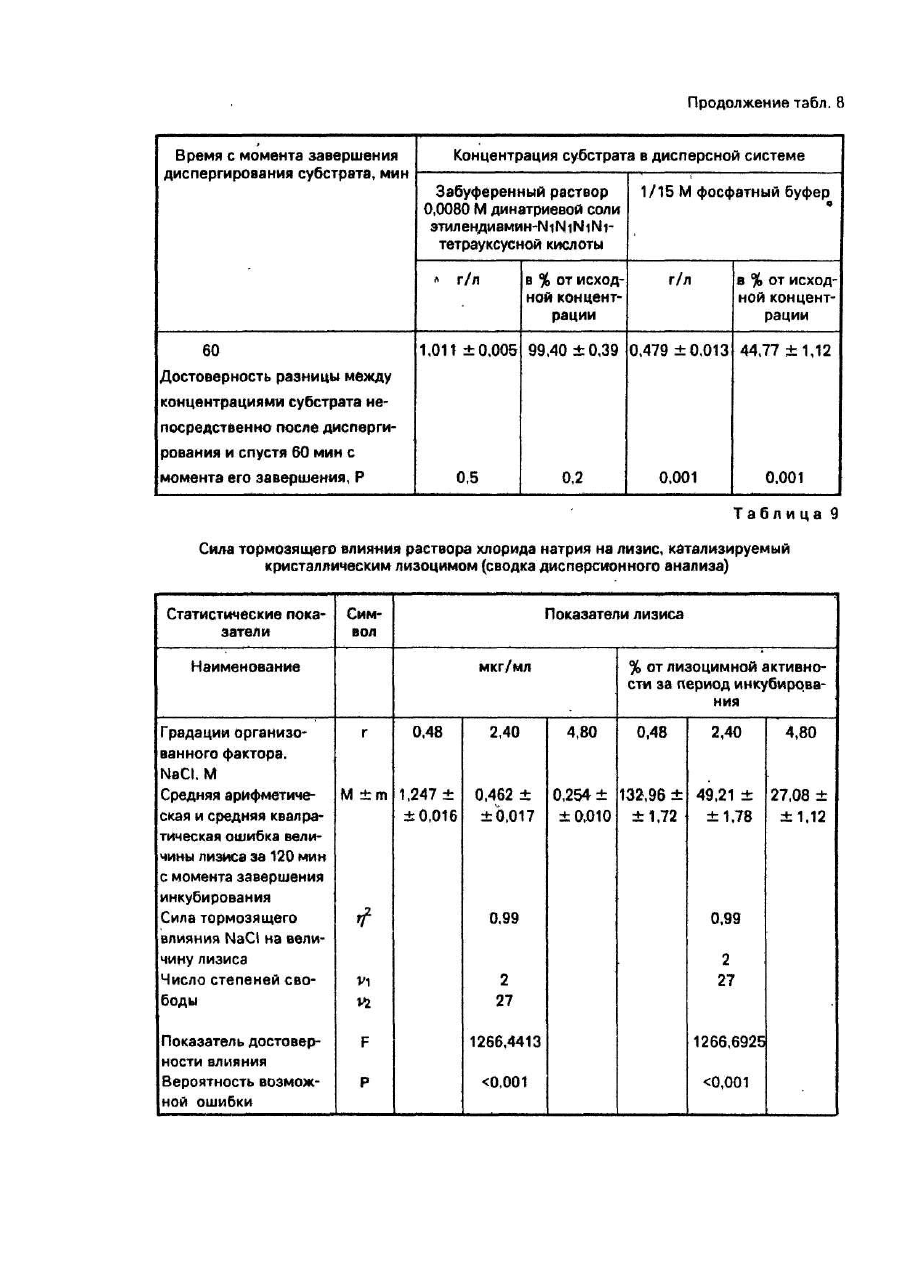
Результат определения устойчивости взвеси как дисперсной системы в зависимости от предлагаемой (забуференный раствор 0,0080 Μ динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты) и известной (1/15 Μ фосфатный буфер) дисперсных сред представлены в табл. 8.
Как видно из таблицы, в известной и предлагаемой дисперсных средах концентрации микробных тел в момент начала инкубирования были близки к расчетным значениям и практически не различались между собой. Через 1 час инкубирования концентрация в 1/15 Μ фосфатном буфере, используемом в качестве дисперсной среды, в результате оседания микробных тел значимо изменилась. Она снизилась более чем в 2 раза и составила 44,77 + 1,12% от исходной. За этот же период времени концентрация биомассы М. lysodeikticus в предлагаемой дисперсной среде не претерпела значимых изменений: во взвешенном состоянии после 1 часа инкубирования находилось 99,40 + 0.39% исходного количества микроорганизмов. Следовательно, в отличие от 1/15 Μ фосфатного буфера (известный способ), забуференный раствор 0,0080 Μ динатриевой соли этилендиамин-N1N1N1N1-тетрауксусной кислоты (предлагаемый способ) обеспечивает высокую устойчивость взвеси М. lysodeikticus как дисперсной системы.
Пример 9. Определяли влияние концентрации электролитов на скорость расщеплення М. lysodeikticus под действием кристаллического лизоцима с целью испытания эффективности разработанного способа торможения лизоцимной реакции. В условиях примера 7 предлагаемым способом в 42-х независимых испытаниях определяли лизоцимную активность раствора кристаллического лизоцима, содержащего 0,938 мкг ферманта в 1-ом мл 0,15 Μ NaCI. После завершения термостатированного инкубирования, которое продолжалось в течение 1-го часа при 38°С, реакцию лизиса тормозили путем повышения концентрации электролитов, в инкубационной среде. Концентрацию электролитов повышали за счет добавления к содержимому каждой пробирки по 0,25 мл раствора NaCI. При этом в первые 14 образцов вводили раствор NaCI концентрацией 0,48 М, во вторые 14 образцов - концентрацией 2,40 М и в остальные 14 образцов - раствор концентрацией 4,80 М, образуя в эксперименте три градации изучаемого фактора. По 4 образца из каждой градации помещали в водяную баню с тающим льдом и сразу же после этого нефелометрировали. Тем самым определяли величину лизоцимной активности за период термостатированного инкубирования для каждой из трех градаций. Оставшиеся образцы, по 10 в каждой градации, помещали в камеру суховоздушного термостата при температуре 30°С. Образцы извлекали из термостата через 120 мин и погружали в водяную баню с тающим льдом, после чего их нефелометрировали. Полученные экспериментальные данные исследовали с помощью однофакторного дисперсионного анализа, позволяющего определить силу влияния концентрации электролитов на скорость лизоцимной реакции.
После одного часа инкубирования при 38°С с добавлением непосредственно перед нефелометрированием раствора NaCI лизоцимная активность образцов во всех трех градациях оказалась одинаковой и составила 0,038+0,010 мкг/мл. Следовательно, концентрация электролитов, изменившаяся в сравнительно широких пределах, не оказывает прямого влияния на нефелометрическую характеристику образцов.
Результаты последующего этапа лизиса, который проходил в течение 130 мин при 30°С, представлены в табл. 9. Как видно из этой таблицы, лизоцимная реакция, протекавшая в присутствии дополнительно введенных электролитов, имела скорость. обратную концентрации этих электролитов. Следовательно, повышение концентрации электролитов вызывает эффект торможения лизоцимной реакции. При этом тормозящее влияние оказывается очень сильным (0,99) и высокодостоверным (Р < 0,001).
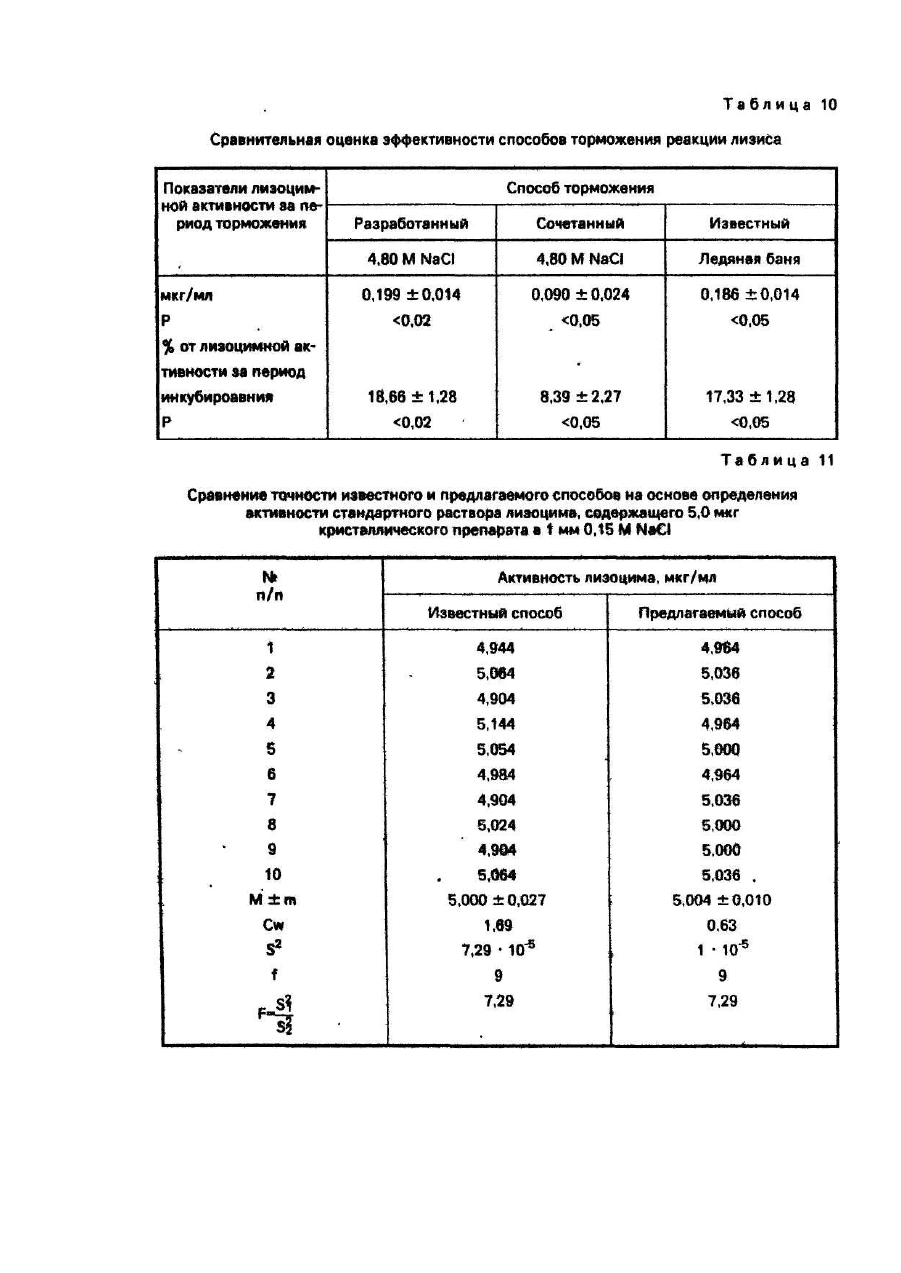
Пример 10. В условиях примера 9 в 9-ти независимых испытаниях реакцию лизиса тормозили тремя способами: известным - путем погружения образцов в водяную баню с тающим льдом; разработанным за счет добавления в каждую из пробирок по 0.25 мл 4,80 Μ раствора NaCI и сочетанным, который включал в себя погружение образцов в водяную баню с тающим льдом с последующим добавлением в каждую из пробирок по 0,25 мл 4,80 Μ раствора NaCI. Образцы с момента начала торможения помещали в суховоздушный термостат при 30°С и через 1 час инкубирования нефелометрировали.
Как видно из табл. 10 известный и предлагаемый способы торможения реакции лизиса близки по своей эффективности. Сочетанное их применение повышает надежность торможения реакции. При этом эффективность торможения, по сравнению с действием каждого из этих способов в отдельности, возрастает в 2 раза, что является достоверным (Р < 0,05).
Пример 11. С целью испытания эффективности разработанного способа устранения конденсатообразования на оптических поверхностях колориметрической кюветы 34 параллельные пробы заряжали по схеме, которая предусмотрена предлагаемым способом для контроля на реактивы. 5 проб сразу после зарядки подвергали нефелометрированию (вариант 1). Остальные пробы погружали в водяную баню с тающим льдом и через 10 мин после погружения 9-ть образцов нефелометрировали, извлекая каждую последующую пробу из водяной бани непосредственно перед измерением (вариант 2). Вариант 3 отличался от варианта 2 тем, что при нефелометрировании 10-ти проб оптические поверхности колориметрической кюветы непосредственно перед измерением однократно протирали. Оставшиеся 10 образцов последовательно один за другим извлекали из водяной бани с тающим льдом, погружали в водяную баню микротермостата МТ-03 при температуре 40°С на 40 с и без предварительного протирания колориметрической кюветы нефелометрировали (вариант 4).
В условиях варианта 1, при котором отсутствует образование конденсата на оптических поверхностях кюветы, нефелометрирование образцов без предварительного охлаждения в бане с тающим льдом дало величину светопропускания, равную 100,0 ±0,0%.
Перенесение образцов в колориметрическую кювету после предварительного их охлаждения в водяной бане с тающим льдом вызвало на оптических поверхностях интенсивное образование конденсата (вариант 2). Это привело к резкому падению коэффициента светопропускания образцов, который понизился до уровня 76,9±3.9%. Понижение светопропускания образцов в результате конденсатообразования явилось высокодостоверным (Р < 0,001). В условиях варианта 2 предварительное однократное протирание оптических поверхностей кюветы перед нефелометрированием снижает нежелательный эффект понижения светопропускания образцов, но не устраняет его полностью. Светопропускание подготовленных таким способом образцов (вариант 3) находилось на уровне 94,5 ±2,2% и достоверно отличалось от результатов, полуденных в варианте 1 (Р < 0,05).
Испытание предлагаемого способа устранения конденсатообразования, который заключается в нагревании предварительно охлажденных образцов в течение 40 с в водяной бане при температуре 40°С непосредственно перед нефелометрированием, показало, что коэффициент светопропускания образцов был равен 100,0 ± 0,0%, то есть конденсатообразование, снижающее точность данного способа, с помощью предлагаемого приема было полностью устранено.
Пример 12. С целью сравнения точности известного и предлагаемого способов проводили определение этими способами активности стандартного раствора кристаллического лизоцима в 0,15 Μ NaCl. Концентрация лизонима в стандартном растворе составляла 5,0 мкг/мл. Каждым из сравниваемых способов измеряли в 10-ти независимых определениях активности лизоцима одного и тога же стандартного раствора.
Результаты сравнения точности известного и предлагаемых способов приведены в табл. 11. Из этих данных видно, что известный способ дает ошибку средней арифметической (m) и дисперсию полученных n результатов (S2) соответственно в 3 и в 7 раз выше, чем предлагаемый метод. При этом критерий F составляет 7,29. а степени свободы f1 и f2 равняются 9 и 9 соответственно.
Из этого следует, что точность предлагаемого способа по сравнению с известным при определении активности лизоцима выше и этот вывод является высокодостоверным (Р < 0,01).
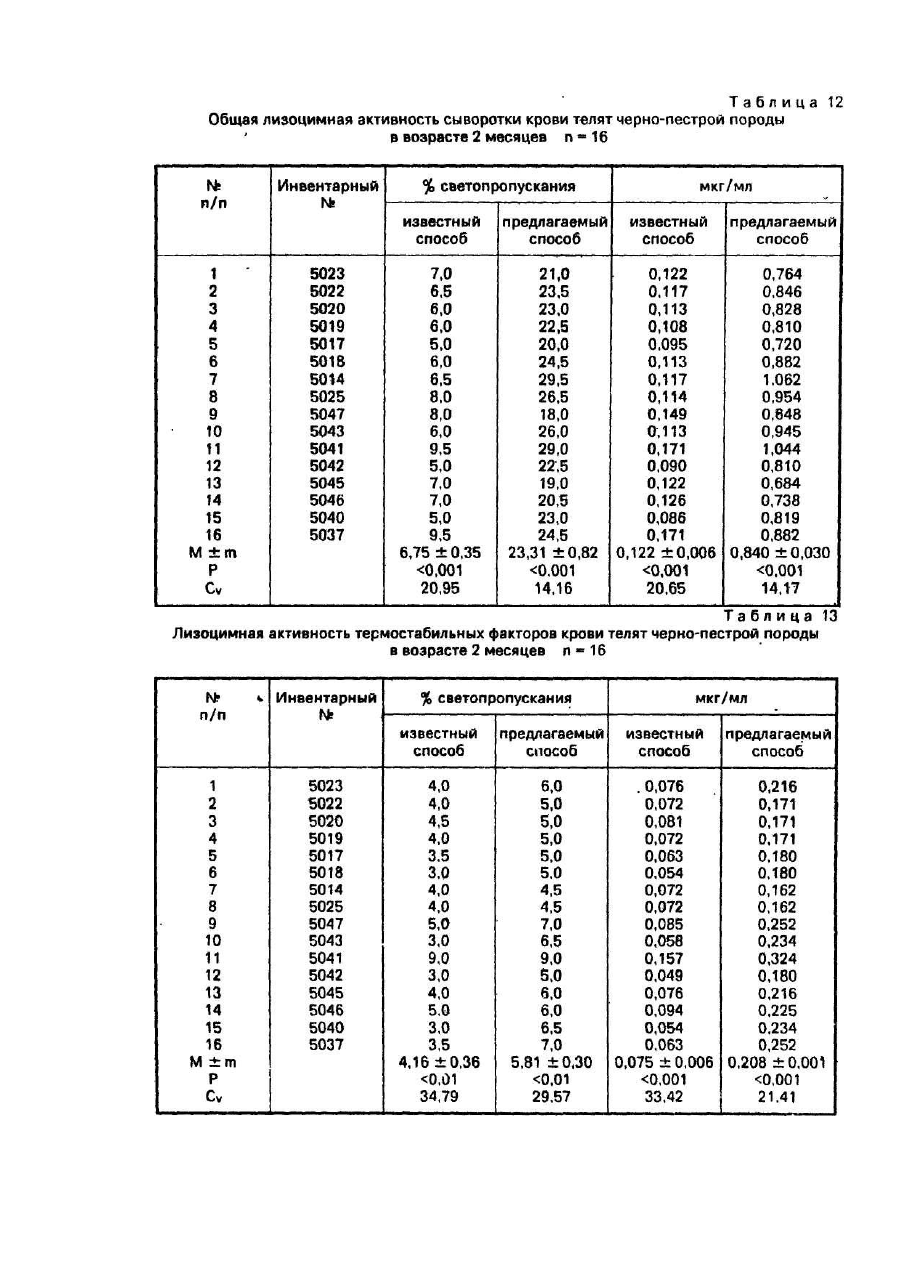
Пример 13. Для сравнения чувствительности и точности известного и предлагаемого способовпроводили определение общей лизоцимной активности и лизоцимной активности термостабильных и термолабильных факторов сыворотки крови телят черно-пестрой породы в возрасте 2-х месяцев в количестве 16 голов, принадлежащих опытному хозяйству "Кутузовка" Института животноводства УААН,
Результаты определений приведены в табл. 12, 13, 14. Как видно из данных, приведенных в этих таблицах, как на уровне средних значений по представленным выборкам, так и при рассмотрении параметров установленных для каждого животного в отдельности, предлагаемый способ, по сравнению с известным, обеспечивает одним и тем же количеством ферментного препарата (сыворотки крови) увеличение в несколько раз количества гидролизуемого субстрата и это увеличение обусловлено возрастанием скорости реакции гидролиза, а не является следствием перевода одной размерности (% светопропускания) в другую размерность (мкг/мл).
Иными словами, в предлагаемом способе отношение результата воздействия (количество расщепленного субстрата) и самому воздействию (количество сыворотки крови) существенно выше, чем в способе-прототипе, на этом основании можно сделать вывод, что предлагаемый способ, по сравнению с известным, имеет более высокую чувствительность.
За счет более высокой чувствительности предлагаемый способ позволяет надежно определить показатель, который находится за пределами разрешения известного способа: как видно из табл. 14 лизоцимная активность термолабильных факторов сыворотки крови теленка инв. № 5041 находится за пределами разрешения известного способа и составляет 0,014 мкг/мл. В отличие от известного способа предлагаемым способом этот параметр определяется как значимый (0,720 мкг/мл). Следовательно, предлагаемый способ отличается не только более высокой чувствительностью, но и имеет более высокую характеристику по параметру: порог чувствительности, то есть для предлагаемого способа минимальная концентрация лизоцимактивных факторов сыворотки крови, активность которых может быть определена, достоверно заметно ниже, чем для способа-прототипа.
Поскольку заявляемый способ и способ-прототип предназначены для определения лизоцимной активности сыворотки крови, а не активности лизоцима (а это разные показатели), приведенные данные, полученные именно при определении лизоцимной активности сыворотки крови, позволяют сделать однозначный вывод, предлагаемый способ имеет более высокую чувствительность, нежели известный.
Из табл. 12, 13. 14 также следует, что коэффициенты вариации (Cv) при определении параметров лизоцимной активности сыворотки крови во всех случаях были существенно выше при использовании известного способа. Между точностью способа и коэффициентом вариации имеет место обратная зависимость. При этом коэффициент вариации является предпочтительной относительной мерой точности для случаев, когда сравнивают точности измерений показателей, различающихся по своей величине. Проводимое в этом примере сопоставление точности способов подпадает именно под это условие.
Исходя из этого можно заключить, что при измерении параметров лизоцимной активности сыворотки крови точность предлагаемого способа выше способа-прототипа.
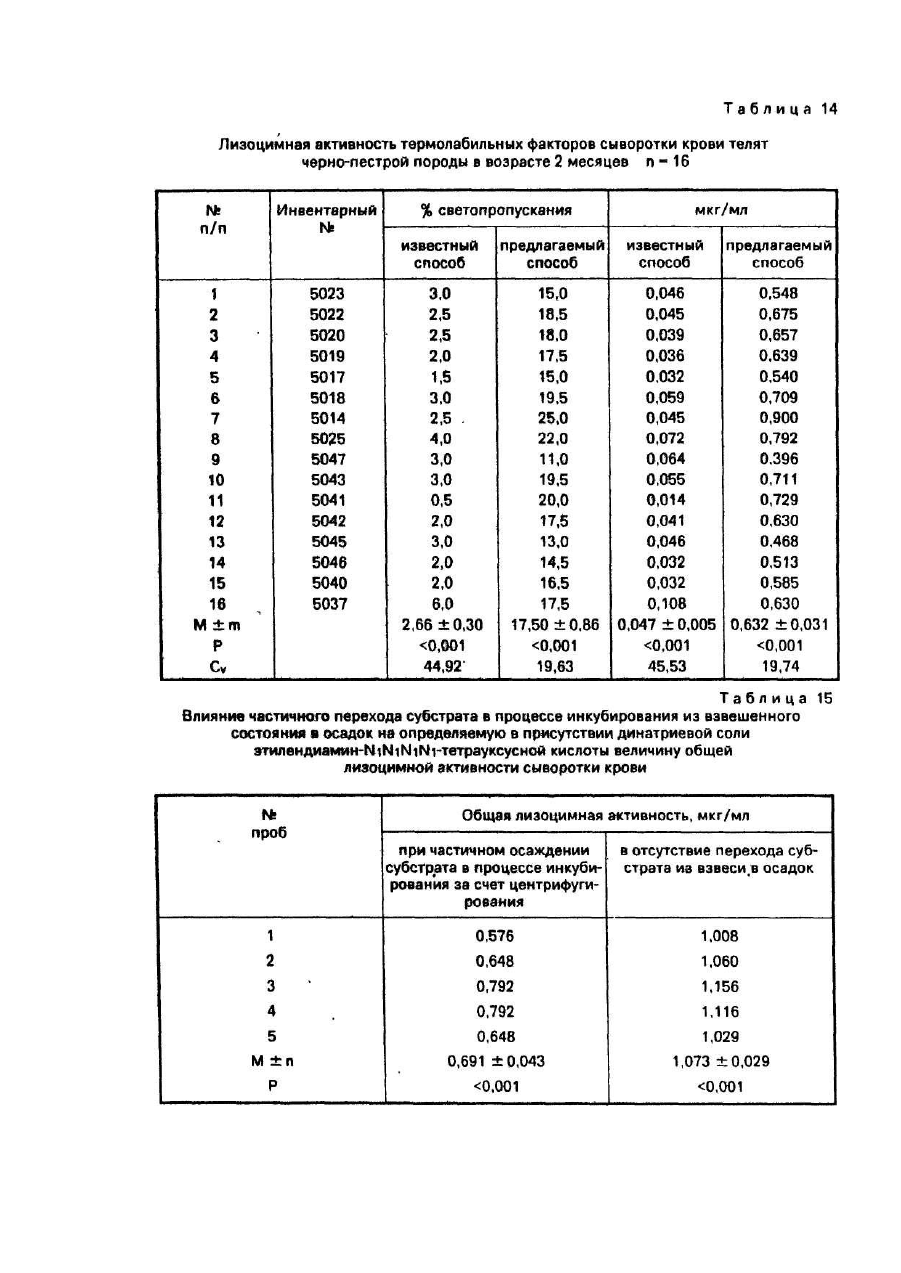
Пример 14. С целью демонстрации механизма, обеспечивающего возрастание чувствительности предлагаемого способа за счет повышения устойчивости взвеси субстрата в период инкубирования, что достигается использованием в качестве среды для диспергирования М. lysodeikticus забуференного раствора динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты, проводили определение общей лизоцимной активности сыворотки крови крупного рогатого скота, закончившего рост. Определение осуществляли по прописи предлагаемого способа, предусматривающего применение буферной системы, содержащий динатриевую соль этилендиамин- N1N1N1N1-тетрауксусной кислоты. Отличительной особенностью определения лизоцимной активности являлось то, что инкубирование образцов осуществляли в центробежном поле центрифуги, обеспечивающим частичное осаждение субстрата в процессе инкубирования, что следует рассматривать как моделирование осаждения субстрата, которое имеет место в способе-прототипе. Полученные величины сопоставляли с лизоцимной активностью тех же образцов сыворотки крови. Однако в этом случае определяли активность этих образцов хотя и в строго аналогичных условиях, но без применения приема центрифугирования в период инкубирования. Субстрат в этих образцах в течение всего инкубирования находился в стабильно взвешенном состоянии и не переходил в осадок. Все остальные условия определения лизоцимной активности, за исключением центрифугирования, в опыте и контроле были строго одинаковыми.
Как видно из табл. 15, частичное осаждение субстрата в процессе инкубирования существенно и достоверно снижает величины лизоцимной активности.
Полученные данные позволяют сделать следующий вывод. Достоверно более высокие значения лизоцимной активности сыворотки крови, получаемые для одних и тех же образцов предлагаемым способом являются результатом стабилизации взвеси субстрата в период инкубирования за счет применения динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты. Понижение стабильности взвеси субстрата как дисперсной системы вызывает снижение лизоцимной активности сыворотки крови.
Пример 15. При определении параметров лизоцимной активности сыворотки крови теленка черно-пестрой породы в возрасте 2 месяцев, инв. №5023, принадлежащего с.х. "Кутузовка" НИИЖ ЛиП УССР, установлено:
1. Для интактной сыворотки:
Траб.пр. = 38,0% и 38,5% светопропускания
Тк суб. = 18,01% и 18,0% светопропускания
Тк сыв. = 99,0% и 99,0% светопропускания
Тк реакт. = 100,0% и 100,0% светопропускания
2. Для инактивированной сыворотки:
Траб.пр. = 24,0% и 24,0% светопропускания
Тк суб. = 19,0% и 19,0% светопропускания
Тк сыв. = 99,0% и 99,0% светопропускания
Тк реакт. = 100,0% и 100,0% светопропускания,
где Траб. пр. - коэффициент пропускания контроля на реактивы, %.
Полученные исходные экспериментальные величины подставляем в формулу, предназначенную для расчета лизоцимной активности в процентах светопропускания (Тла). Формула имеет следующий вид:
В результате получаем следующие уравнения:
1. Для интактной сыворотки:
Полученные величины соответствуют общей лизоцимной активности сыворотки крови в % светопропускания (1 и 2 параллели).
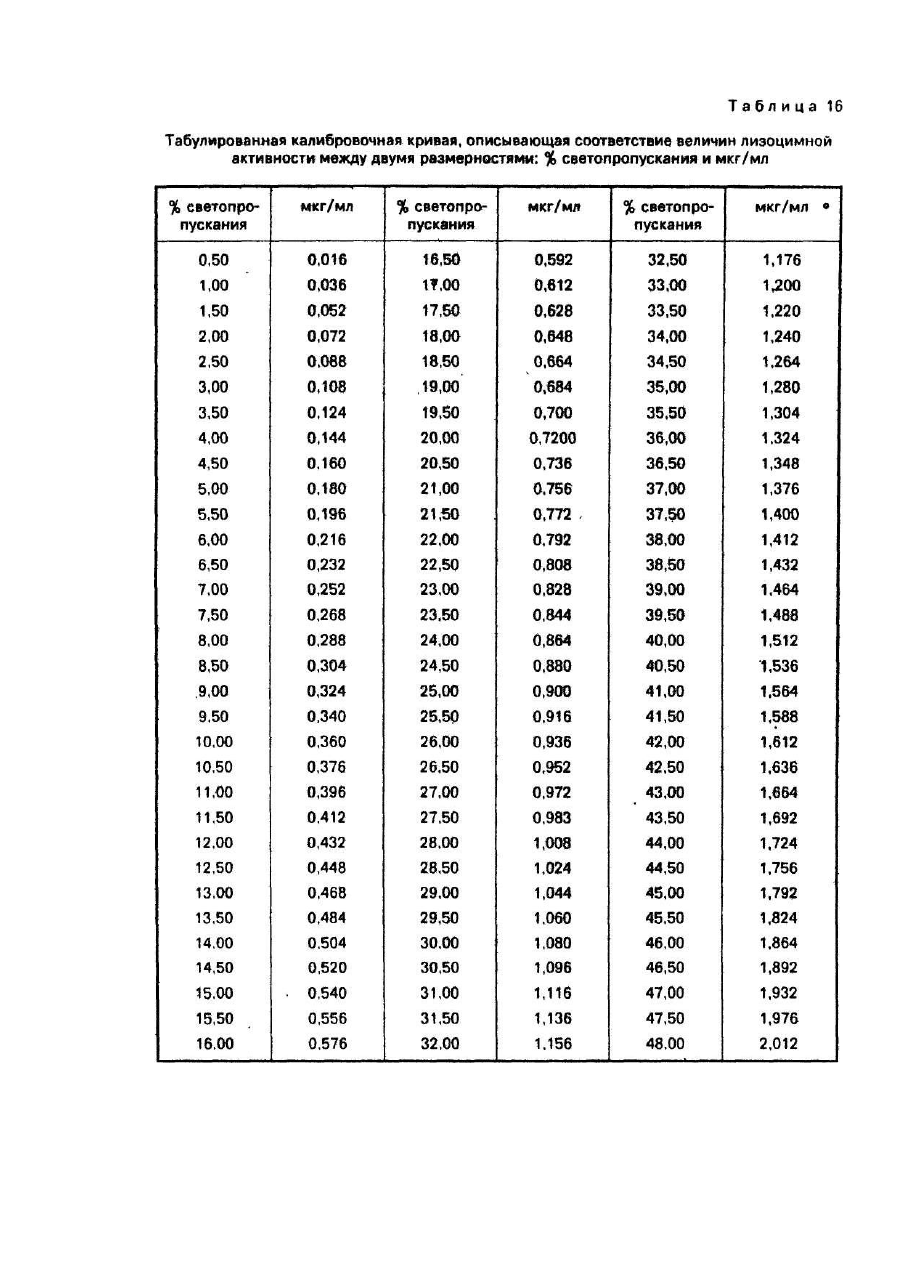
Рассчитанные в % светопропускания величины общей лизоцимной активности и лизоцимной активности термостабильных факторов с помощью табулированной калибровочной кривой (см. табл. 16) переводим в размерность: мкг/мл. При этом следует иметь в виду, что данные табл. 16 получены на конкретной спектрофотометрической аппаратуре (КФК-2-УХЛ 4,2; №8505958). Для каждого прибора эти соответствия между двумя размерностями лизоцимной активности (% светопропускания и мкг/мл) устанавливаются отдельно.
В результате расшифровки по табл. 16 величин лизоцимной активности, выраженных в % светопропускания, получаем:
1. Для интактной сыворотки: 0,756 мкг/мл и 0,772 мкг/мл, в среднем - 0,764 мкг/мл, что принимаем в качестве общей лизоцимной активности сыворотки крови, выраженной в единицах, мкг/мл.
2. Для инактивированной сыворотки: 0,216 мкг/мл и 0,216 мкг/мл в среднем - 0,216 мкг/мл, что принимаем в качестве лизоцимной активности термостабильных факторов сыворотки крови, выраженной в единицах мкг/мл.
Путем вычитаний из величины общей лизоцимной активности величины лизоцимной активности термостабильных факторов получаем значение лизоцимной активности термолабильных факторов сыворотки крови: 0,764 мкг/мл - 0,216 мкг/мл=0,548 мкг/мл. Окончательный результат: сыворотка крови теленка черно-пестрой породы в возрасте 2-х месяцев, инвентарный №5023, принадлежащего с.х. "Кутузовка" Института животноводства УААН, имеет общую лизоцимную активность 0,764 мкг/мл, лизоцимную активность термостабильных факторов - 0,216 мкг/мл; лизоцимную активность термостабильных факторов - 0,548 мкг/мл.
Данный пример служит образцом для выполнения расчетной части предлагаемого способа определения лизоцимной активности сыворотки крови.
Текст
Изобретение относится к области животноводства, в частности, к способам определения состояния естественной резистентное™ организма сельскохозяйственных животных, и может быть использовано при оценке эффективности технологических систем производства животноводческой продукции на промышленной основе. Известен способ нефелометрического определения лизоцимной активности сыворотки крови, основанный на ее способности подвергать лизису Micrococcus lysodeikticus [1]. К недостаткам этого известного способа следует отнести то, что при определении лизоцимной активности этим способом используют нативн ую сыворотку крови, которую не подвергают предварительному термическому инактивированию. Тем самым определяют общую лизоцимную активность без дифференцированного определения лизоцимной активности термостабильных и термолабильных факторов сыворотки крови. В результате этого оценка состояния естественной резистентности организма по лизоцимной активности носит ограниченный характер. Субстратом служит суточная культура Μ. l ysodeikticus, производимая не централизованно, а выращивания каждым исследователем независимо друг от друга. Это снижает уровень стандартизированности субстрата, что, в конечном итоге, отрицательно сказывается на точности и сопоставимости определений. Инкубирование субстрата в присутствии и отсутствие сыворотки крови не завершается торможением лизина М. l ysodeikticus, который продолжается в течение всего периода нефелометрирования. Это приводит к завышению фактической величины лизоцимной активности сыворотки крови. При этом величины завышения носят нерегулярный характер. М. lysodeikticus, служащий субстратом, взвешивается в 1/15 Μ фосфатном буфере, образуя дисперсную систему, которая характеризуется недостаточной устойчивостью: часть субстрата в процессе инкубирования выпадает из взвеси в осадок. Это отрицательно сказывается на точности и чувстви тельности известного способа. В качестве прототипа выбран способ определения лизоцимной активности сыворотки крови, с помощью которого наряду с общей лизоцимной активностью раздельно определяют лизоцимные активности термостабильных и термолабильных факторов. Диспергированный в 1/15 Μ фосфатном буфере, рН 7,2 М. lysodeikticus раздельно и совместно инкубируют с интактной и инактивированной сывороткой крови. Торможение лизиса бактерий осуществляют п утем охлаждения инкубационной смеси. Измерение величины гидролиза субстрата проводят методом нефелометрирования. По величине гидролиза субстрата оценивают общую лизоцимную активность и лизоцимную активность термостабильных факторов, а по разности между этими величинами, выраженными в микрограммах лизоцима в 1-ом мл. - лизоцимную активность термолабильных факторов сыворотки крови [2]. Однако существующий способ характеризуется, сравнительно низкой чувствительностью, в результате чего определяемые величины лизоцимной активности имеют невысокие значения, а лизоцимная активность термолабильных факторов сыворотки крови телят первого полугодия жизни вообще оказывается на пределе разрешения способа (ниже 0,1 мкг/мл). Сравнительно низкая чувствительность этого способа обусловлена недостаточной устойчивостью дисперсной системы, что приводит к частичному выпадению М. lysodeikticus из взвеси в осадок. В течение одного часа инкубирования более половины массы диспергированного в 1/15 Μ фосфатном буфере субстрата оседает. Снижение концентрации субстрата во взвеси понижает величину субстрат-ферментных отношений и, как следствие этого, уменьшает скорость катализируемого гидролиза, что и является непосредственной причиной относительно низкой чувствительности способа. Помимо этого, к недостаткам известного способа следует отнести его сравнительно невысокую точность, что обусловлено, в частности, пенообразовании, возникающим при ресуспендировании перед нефелометрированием осевшего в процессе инкубирования субстрата. Образующиеся при этом в жидкой фазе инкубационной среды пузырьки существенно снижают коэффициент светопропускания образцов, В количественном отношении эти изменения носят нерегулярный характер и не поддаются стандартизации. Сравнительно низкая точность известного способа связана также с существенным расхождением величин светопропускания параллельных образцов одной и той же рабочей пробы. Это обусловлено разным уровнем диспергированности субстрата в момент нефелометрирования. Хотя эти расхождения возникают сравнительно редко, они носят нерегулярный характер и значительны по своей величине. Кроме того, относительно низкая точность способа является следствием высоких уровней контролей на фермент, обусловленных введением в инкубационную систему значительных объемов испытуемой сыворотки (0,5 мл сыворотки крупного рогатого скота при общем объеме инкубационной смеси в пробирке 2,0 мл). К причинам сравнительно низкой точности известного способа следует помимо этого отнести и недостаточную эффективность приема торможения реакции лизиса с помощью погружения образцов в водяную баню с тающим льдом. Это особенно заметно при высоких значениях концентрации лизоцима в сыворотке крови (свыше 1 мкг/мл) на фоне проведения массовых анализов, предполагающих одномоментную затрату значительного количества времени (около 1-го часа) на нефелометрирование. Величина прироста лизоцимной активности с момента завершения инкубирования по отношению к активности за период инкубирования в этом случае может достигать сравнительно высоких величин (более 17%). При этом фактическая лизоцимная активность завышается неодинаково даже для образцов, исследуемых в одной партии. Прием торможения реакции лизиса не обеспечивает необходимую точность способа не только в результате недостаточной его эффективности, но и вследствие образования конденсата на оптических поверхностях кюветы в момент нефелометрирования. Образование конденсата обусловлено разностью температур между окружающей средой, в которой проводят измерения, и кюветной, содержащей образец, охлажденный до 0 - +1°С. Конденсат на поверхности кюветы существенно понижает величины светопропускания образцов, повышая разброс этих показателей на уровне параллелей. При протирании оптических поверхностей кюветы непосредственно перед нефелометрированием конденсат может образоваться повторно. Поэтому такой способ удаления его является недостаточно надежным. Кроме этого он значительно удлиняет время нефелометрирования, что также в конечном итоге негативно сказывается на точности способа. Задачей настоящего изобретения является повышение чувстви тельности и точности способа определения лизоцимной активности, уменьшение используемых объемов исследуемой сыворотки крови. Поставленная задача решается тем, что в способе определения лизоцимной активности сыворотки крови, включающем раздельное и совместное инкубирование М. l ysodeikticus с интактной и инактивированной сывороткой крови, торможение лизиса бактерий путем охлаждения инкубационной смеси, определение методом нефелометрирования общей лизоцимной активности в инкубационной системе, содержащей интактную сыворотку, и лизоцимной активности термостабильных факторов - в системе, содержащей инактивированную сыворотку, с последующей оценкой по разнице между этими величинами активности термолабильных факторов сыворотки крови, согласно изобретению: а) в качестве среды для диспергирования М. lysodeikticus используют забуференный раствор динатриевой соли этилендинамин-N1N1N1N1-тетрауксусной кислоты в концентрации 0.0080-0.0085M; б) концентрацию электролитов в инкубационной смеси повышают непосредственно после начала торможения реакции лизиса в водяной бане с тающим льдом за счет введения хлорида натрия в концентрации 2,00-5,25 М; в) инкубационную смесь после торможения реакции непосредственно перед нефелометрированием нагревают повторно. Забуференный раствор динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты обеспечивает повышение устойчивости взвеси, что исключает выпадение субстрата из суспензии в осадок за период инкубирования. Повышение концентрации электролитов в инкубационной смеси за счет введения хлорида натрия обеспечивает торможение реакции лизиса. Повторное нагревание инкубационной смеси после торможения реакции обеспечивает устранение образования конденсата на оптических поверхностях кюветы при нефелометрировании. Сущность предложенного способа определения лизоцимной активности сыворотки крови заключается в следующем. Сыворотку крови, полученную после ретракции кровяного сгустка, отделяют центрифугированием на центрифуге типа ОС - 6 М при 5000 об/мин в течение 30 мин и разделяют затем на две равные порции. Одну из порций сыворотки подвергают термическому инактивированию под резиновой пробкой при 55,9-56,0°С в течение 29-30 мин в водной глицериновой бане ультратермостата ТЛ-150. Инактивированную сыворотку используют для определения лизоцимной активности термостабильных факторов. Порцию неинактивированной (интактной) сыворотки крови используют для определения общей лизоцимной активности. В качестве субстрата применяют лиофилизированную биомассу культуры М. lysodeikticus марки А, выпускаемую Олайнским заводом химических реактивов. Препарат микроорганизмов взвешивают в дисперсной среде, представляющей 0,0080-0,085 Μ (оптимум 0,0080 М) раствор динатриевой соли этилендиамин-N1N1N1N1-тетрауксусной кислоты, забуференный до рН 7,20 трис-(оксиметил)аминометаном, из расчета 1,4 мг биомассы на 1 мл среды для диспергирования. Взвесь микроорганизмов с момента ее приготовления и до зарядки инкубационной системы постоянно перемешивают на магнитной мешалке типа ММ ЗМ. При определении общей лизоцимной активности заряжают инкубационную систему, в которую включают: рабочую пробу, состоящую из 0,25 мл неинактивированной сыворотки и 1,50 мл субстрата (в 2-х параллелях); контроль на субстрат, состоящий из 0,25 мл 0,15 Μ NaCl и 1,50 мл субстрата (в 2-х параллелях); контроль на сыворотку крови, состоящий из 0,25 мл неинактивированной сыворотки и 1,50 мл дисперсной среды (в 2-х параллелях); и контроль на реактивы, состоящий из 0,25 мл 0,15 Μ NaCI и 1,50 мл дисперсной среды (в 2-х параллелях). При определении лизоцимной активности термостабильных факторов заряжают такую же инкубационную систему, как и при определении общей лизоцимной активности. Однако в этом случае в инкубационную систему вводят не интактную сыворотку крови, а в тех же количествах сыворотку крови, подвергнутую предварительному термическому инактивированию. Стеклянные пробирки с рабочими пробами и контролями закрывают резиновыми пробками. Содержимое пробирок перемешивают и подвергают термостатированному инкубированию при 37,0-39,0°С в течение 59-60 мин в выносной бане ультратермостата типа ТЛ -150. После завершения инкубирования пробирки погружают в водяную баню с тающим льдом и в каждую из них добавляют по 0,25 мл 2,00-4,27 Μ (оптимум 4,80 М) NaCI с последующим перемешиванием содержимого. Непосредственно перед нефелометрированием пробирки последовательно, одну за другой, извлекают из водяной бани с тающим льдом, помещают на 40 с в водяную баню микротермостата типа МТ-Ш при 40-45°С (оптимум 40°С) и содержимой их без предварительного перемешивания переносят в колориметрическую кювету, имеющую рабочую длин у 3,070 мм. Нвфелометрирование рабочих проб и контролен проводят против дистиллированной воды при зеленом светофильтре (540 нм) на однолучевом фотоэлектрическом колориметре типа КФК-2. Полученные величины светопропускания используют а качестве исходных при расчете показателей лизоцимной активности. Для определения общей лизоцимной активности используют данные нефелометрирования инкубационной системы, содержащей неинактивированные образцы сыворотки крови. Вычисление лизоцимной, активности термостабильных факторов проводят по данным, полученным при нефелометрировании инкубационной системы, в которую были включены образцы сыворотки крови, подвергнутые термическому инактивированию. Оба показателя лизоцимной активности вычисляют в процентах светопропускания по единой формуле: Тла=(Траб.пр. - ТК суб.) + (ТК реакт. - ТК сыв.), где Тла - лизоцимная активность, % светопропускання; Траб. пр. - коэффициент пропускания рабочей пробы, %; ТК суб. - коэффициент пропускания контроля на субстрат, %; ТК сыв. - коэффициент пропускания контроля не сыворотку крови, %; ТК реакт. - коэффициент пропускания контроля на реактивы, %. Рассчитанные в процентах светопропускания величины общей лизоцимной активности и лизоцимной активности термостабильных факторов с помощью калибровочного графика выражают числом микрограммов лизоцима в 1 мл сыворотки крови. После перевода показателей лизоцимной активности в единицы измерения концентрации лизоцима от общей лизоцимной активности отнимают лизоцимную активность термостабильных факторов. Полученная разность является лизоцимной активностью термолабильных факторов сыворотки крови. Показатели лизоцимной активности сыворотки крови крупного рогатого скота, определенные предлагаемым способом, находятся в следующи х пределах: - общая лизоцимная активность 0,522-1,292 мкг/мл; - лизоцимная активность термостабильных факторов - 0,162-0,540 мкг/мл; - лизоцимная активность термолабильных факторов - 0.279-0,900 мкг/мл. Относительная точность разработанного способа составляет 3%, а его максимальная погрешность при среднем значении лизоцимной активности, равном 0,713 мкг/мл, и гарантированной вероятности Ρ 0.05 находится на уровне 0,008 мкг/мл. Чувствительность предлагаемого способа соответствуе т 6,85 · 10-10 M. Используемый объем исследуемой сыворотки крови крупного рогатого скота, необходимый для определения заявляемым способом в 2-х параллелях общей лизоцимной активности и лизоциммых активностей термостабильных и термолабильных факторов, в расчете на один образец равен 2,0 мл. Предложенный способ иллюстрируется следующими примерами его осуществления. Пример 1. Определяли предлагаемым способом общую лизоцимную активность и лизоцимные активности термостабильных и термолабильных факторов сыворотки крови бычка инв, №702t черно-пестрой породы в возрасте 20-ти месяцев живой массой 385 кг, принадлежащего опытному хозяйству "Украинка" НИИ животноводства Лесостепи и Полесья УССР. Определение вели в десяти независимых параллелях. Сыворотку инактивировали при 56°С в течение 30 мин. Субстрат диспергировали в 0,0080 Μ растворе динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты, забуференном до рН 7,2 трис(оксиметил)-амино-метаном. Интактную и инактивированную сыворотку крови в количестве 0,25 мл в расчете на пробирку в присутствии и отсутствие субстрата инкубировали при 38°С в течение 60 мин, реакцию лизиса после завершения инкубирования дополнительно тормозили 2,00 Μ растворрм NaCI, образцы непосредственно перед нефелометрированием нагревали в водяной бане при 40°С в течение 40 с. В качестве конечного результата определения показателей лизоцимной активности принимали средние арифметические величины, установленные на основе десяти независимых испытаний сыворотки. Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,682: термостабильных факторов 0,273; термолабильных факторов - 0,411. Пример 2. В условиях примера 1 субстрат диспергировали в 0,0085 Μ растворе динатриевой соли этилендиамин-тетра-уксусной кислоты, забуференном до рН 7,2 трис-(оксиметил)-аминометаном. Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,655; термостабильных факторов 0,273; термолабильных факторов - 0,386. Пример 3. В условиях примера 2 реакцию лизиса после завершения инкубирования дополнительно тормозили 5,27 Μ раствором. Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,653; термостабильных факторов 0,251; термолабильных факторов - 0,402. Пример 4. В условиях примера 3 образцы непосредственно перед нефелометрированием нагревали в водяной бане при 45°С. Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,655; термостабильных факторов 0,296; термолабильных факторов - 0,354. Результаты опытов 1-4 показывают, что при использовании предельных значений режимов признаков предложенного технического решения, отличительных от прототипа, полученные величины показателей лизоцимной активности сыворотки крови являются близкими. Пример 5. Общую лизоцимную активность и лизоцимные активности термостабильных и термолабильных факторов сыворотки крови определяли известным способом, принятым в качестве прототипа. В условиях примера 4 субстрат диспергировали в 1/15 Μ фосфа тном буфере рН 7,2, сыворотку крови в инкубационную систему вводили в количестве 0,5 мл на пробирку, дополнительного торможения лизиса раствором NaCI, а также повторного нагревания образцов в водяной бане непосредственно перед их нефелометрированием не проводили. Сыворотка крови имела лизоцимную активность, мкг/мл: общую - 0,246; термостабильных факторов 0,136; термолабильных факторов - 0,110. То есть, чувствительность предлагаемого способа (пример 1 -4) при определении общей лизоцимной активности и лизоцимных активностей термостабильных и термолабильных факторов была выше чувствительности прототипа (пример 5) в кратное количество раз и составило в среднем соответственно 268,8%; 200,9% и 352,9% по отношению к уровню, определенному известным способом. При этом количество сыворотки крови, расходуемое на определение показателей лизоцимной активности предлагаемым способом, по сравнению с известным, было в 2 раза меньшим. Пример 6. Сыворотку крови получали от 16 телочек черно-пестрой породы в возрасте 2-х месяцев и 7 телочек той же породы в возрасте 3-х месяцев опытного хозяйства "Кутузовка" НИИ животноводства Лесостепи и Полесья УССР; 12 бычков симментальской породы Харьковской области и 23 лактирующих коров симментальской породы, принадлежащих колхозу "Большевик" Валковского района Харьковской области. Показатели лизоцимной активности, полученной сыворотки крови определяли известным способом в условиях примера 5 и предлагаемым способом в условиях примера 1. В условиях примера 1 реакцию лизиса после завершения инкубирования дополнительно тормозили 4,80 Μ раствором NaCI. Результаты определения общей лизоцимной активности и лизоцимных активностей термостабильных и термолабильных факторов представлены в табл. 2,3,4. В этих же таблицах приведены результаты сравнения величин показателей лизоцимных активностей, определенных известным и предлагаемым способами, выраженные в процентах по отношению к известному способу. Уровни лизоцимных активностей, определенные предлагаемым способом, были выше в кратное количество раз по сравнению с величинами, определенными известным способом, что свидетельствует о получении положительного эффекта повышении чувствительности способа определения лизоцимной активности. Наибольший эффект повышения чувствительности предлагаемого способа достигнут при определении лизоцимной активности термолабильных факторов: чувстви тельность предлагаемого способа по сравнению с известным в случае определения термолабильных факторов сыворотки крови телят 2-х месячного возраста увеличилась в 16 раз. Коэффициенты вариации представлены в табл. 5, 6, 7. Как в случае общей лизоцимной активности, так и в случае лизоцимных активностей термостабильных и термолабильных факторов, коэффициенты вариации показателей, полученных известным способом, были выше таковых, полученных предлагаемым. Поскольку величины коэффициента вариации - связаны с точностью измерения обратной зависимостью, можно заключить, что предлагаемый способ по сравнению с известным, при определении всех тре х показателей лизоцимной активности, имел более высокую точность. Пример 7. В условиях примера 6 предлагаемым способом в 32-х независимых испытаниях определяли лизоцимную активность стандартного раствора лизоцима, не подвергнутого предварительному термическому инактивированию. Стандартный раствор лизоцима приготовляли из лиофилизированного препарата лизоцима яичного белка трехкратной кристаллизации НПО "Биохимреактив" Олейнского завода химреактивов. Кристаллический лизоцим растворяли в 0,15 Μ NaCl из расчета 713 мкг в 1 литре. Испытуемый стандартный раствор имел лизоцимную активность равную 0,713 ± 0,004 мкг/мл с коэффициентом вариации - 2,935%, то есть относительная точность предлагаемого способа была не хуже 3,000%. Максимальная погрешность (Δ= tm) оценки генерального параметра (лизоцимной активности) при уровне значимости (Р) < 0,05 составляла 0,008 мкг/мл. Таким образом, среднее арифметическое лизоцимной активности, определенной предлагаемым способом, при гарантированной вероятности Ρ < 0,05, находится в доверительном интервале: 0,713 ±0,008 мкг/мл. Чувствительность разработанного способа соответствует 6,85 · 10-10 М. Пример 8. Определяли устойчивость как дисперсной системы взвеси М. lysodeikticus в зависимости от применяемой дисперсной среды. В качестве дисперсной среды испытывали забуференный до рН 7,2 0,0080 Μ раствор динатриевой соли этилекдиамин- N1N1N1N1-тетрауксусной кислоты (предлагаемое техническое решение) и 1 /15 Μ фосфатный буфер, рН 7,2 (прототип). М. lysodeikticus в сравниваемых дисперсных средах взвешивали из расчета 1:4 мг/мл и поддерживали в диспергированном состоянии за счет постоянного перемешивания суспензии на 2-х магнитных мешалках типа ММЗМ. Режим перемешивания контролировали инструментально и поддерживали на одинаковом уровне. Полученные таким образом субстраты использовали для зарядки образцов, которые по прописям, предусмотренным известным и предлагаемым способами, соответствовали контролю на субстрат. Для этого в стеклянные пробирки вводили 1,5 мл взвеси микроорганизмов и 0,5 мл 0,15 Μ раствора NaCI. Пробирки закрывали резиновыми пробками и их содержимое перемешивали. Инкубирование проводили без встряхивания в течение 1 часа с определением через каждые 20 мин концентрации микробных тел, находящихся во взвешенном состоянии. Результат определения устойчивости взвеси как дисперсной системы в зависимости от предлагаемой (забуференный раствор 0,0080 Μ динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты) и известной (1/15 Μ фосфатный буфер) дисперсных сред представлены в табл. 8. Как видно из таблицы, в известной и предлагаемой дисперсных средах концентрации микробных тел в момент начала инкубирования были близки к расчетным значениям и практически не различались между собой. Через 1 час инкубирования концентрация в 1/15 Μ фосфатном буфере, используемом в качестве дисперсной среды, в результате оседания микробных тел значимо изменилась. Она снизилась более чем в 2 раза и составила 44,77 + 1,12% от исходной. За этот же период времени концентрация биомассы М. lysodeikticus в предлагаемой дисперсной среде не претерпела значимых изменений: во взвешенном состоянии после 1 часа инкубирования находилось 99,40 + 0.39% исходного количества микроорганизмов. Следовательно, в отличие от 1/15 Μ фосфатного буфера (известный способ), забуференный раствор 0,0080 Μ динатриевой соли этилендиамин-N1N1N1N1-тетрауксусной кислоты (предлагаемый способ) обеспечивает высокую устойчивость взвеси М. l ysodeikticus как дисперсной системы. Пример 9. Определяли влияние концентрации электролитов на скорость расщеплення М. l ysodeikticus под действием кристаллического лизоцима с целью испытания эффективности разработанного способа торможения лизоцимной реакции. В условиях примера 7 предлагаемым способом в 42-х независимых испытаниях определяли лизоцимную активность раствора кристаллического лизоцима, содержащего 0,938 мкг ферманта в 1-ом мл 0,15 Μ NaCI. После завершения термостатированного инкубирования, которое продолжалось в течение 1-го часа при 38°С, реакцию лизиса тормозили путем повышения концентрации электролитов, в инкубационной среде. Концентрацию электролитов повышали за счет добавления к содержимому каждой пробирки по 0,25 мл раствора NaCI. При этом в первые 14 образцов вводили раствор NaCI концентрацией 0,48 М, во вторые 14 образцов - концентрацией 2,40 М и в остальные 14 образцов раствор концентрацией 4,80 М, образуя в эксперименте три градации изучаемого фактора. По 4 образца из каждой градации помещали в водяную баню с тающим льдом и сразу же после этого нефелометрировали. Тем самым определяли величину лизоцимной активности за период термостатированного инкубирования для каждой из трех градаций. Оставшиеся образцы, по 10 в каждой градации, помещали в камеру суховоздушного термостата при температуре 30°С. Образцы извлекали из термостата через 120 мин и погружали в водяную баню с тающим льдом, после чего их нефелометрировали. Полученные экспериментальные данные исследовали с помощью однофакторного дисперсионного анализа, позволяющего определить силу влияния концентрации электролитов на скорость лизоцимной реакции. После одного часа инкубирования при 38°С с добавлением непосредственно перед нефелометрированием раствора NaCI лизоцимная активность образцов во все х трех градациях оказалась одинаковой и составила 0,038+0,010 мкг/мл. Следовательно, концентрация электролитов, изменившаяся в сравнительно широких пределах, не оказывает прямого влияния на нефелометрическую характеристику образцов. Результаты последующего этапа лизиса, который проходил в течение 130 мин при 30°С, представлены в табл. 9. Как видно из этой таблицы, лизоцимная реакция, протекавшая в присутствии дополнительно введенных электролитов, имела скорость. обратную концентрации этих электролитов. Следовательно, повышение концентрации электролитов вызывает эффект торможения лизоцимной реакции. При этом тормозящее влияние оказывается очень сильным (0,99) и высокодостоверным (Р < 0,001). Пример 10. В условиях примера 9 в 9-ти независимых испытаниях реакцию лизиса тормозили тремя способами: известным - путем погружения образцов в водяную баню с тающим льдом; разработанным за счет добавления в каждую из пробирок по 0.25 мл 4,80 Μ раствора NaCI и сочетанным, который включал в себя погружение образцов в водяную баню с тающим льдом с последующим добавлением в каждую из пробирок по 0,25 мл 4,80 Μ раствора NaCI. Образцы с момента начала торможения помещали в суховоздушный термостат при 30°С и через 1 час инкубирования нефелометрировали. Как видно из табл. 10 известный и предлагаемый способы торможения реакции лизиса близки по своей эффективности. Сочетанное их применение повышает надежность торможения реакции. При этом эффективность торможения, по сравнению с действием каждого из этих способов в отдельности, возрастает в 2 раза, что является достоверным (Р < 0,05). Пример 11. С целью испытания эффективности разработанного способа устранения конденсатообразования на оптических поверхностях колориметрической кюветы 34 параллельные пробы заряжали по схеме, которая предусмотрена предлагаемым способом для контроля на реактивы. 5 проб сразу после зарядки подвергали нефелометрированию (вариант 1). Остальные пробы погружали в водяную баню с тающим льдом и через 10 мин после погружения 9-ть образцов нефелометрировали, извлекая каждую последующую пробу из водяной бани непосредственно перед измерением (вариант 2). Вариант 3 отличался от варианта 2 тем, что при нефелометрировании 10-ти проб оптические поверхности колориметрической кюветы непосредственно перед измерением однократно протирали. Оставшиеся 10 образцов последовательно один за другим извлекали из водяной бани с тающим льдом, погружали в водяную баню микротермостата МТ-03 при температуре 40°С на 40 с и без предварительного протирания колориметрической кюветы нефелометрировали (вариант 4). В условиях варианта 1, при котором отсутствует образование конденсата на оптических поверхностях кюветы, нефелометрирование образцов без предварительного охлаждения в бане с тающим льдом дало величину светопропускания, равную 100,0 ±0,0%. Перенесение образцов в колориметрическую кювету после предварительного их охлаждения в водяной бане с тающим льдом вызвало на оптических поверхностях интенсивное образование конденсата (вариант 2). Это привело к резкому падению коэффициента светопропускания образцов, который понизился до уровня 76,9±3.9%. Понижение светопропускания образцов в результате конденсатообразования явилось высокодостоверным (Р < 0,001). В условия х варианта 2 предварительное однократное протирание оптических поверхностей кюветы перед нефелометрированием снижает нежелательный эффект понижения светопропускания образцов, но не устраняет его полностью. Светопропускание подготовленных таким способом образцов (вариант 3) находилось на уровне 94,5 ±2,2% и достоверно отличалось от результатов, полуденных в варианте 1 (Р < 0,05). Испытание предлагаемого способа устранения конденсатообразования, который заключается в нагревании предварительно охлажденных образцов в течение 40 с в водяной бане при температуре 40°С непосредственно перед нефелометрированием, показало, что коэффициент светопропускания образцов был равен 100,0 ± 0,0%, то есть конденсатообразование, снижающее точность данного способа, с помощью предлагаемого приема было полностью устранено. Пример 12. С целью сравнения точности известного и предлагаемого способов проводили определение этими способами активности стандартного раствора кристаллического лизоцима в 0,15 Μ NaCl. Концентрация лизонима в стандартном растворе составляла 5,0 мкг/мл. Каждым из сравниваемых способов измеряли в 10ти независимых определениях активности лизоцима одного и тога же стандартного раствора. Результаты сравнения точности известного и предлагаемых способов приведены в табл. 11. Из этих данных видно, что известный способ дает ошибку средней арифметической (m) и дисперсию полученных n результатов (S2) соответственно в 3 и в 7 раз выше, чем предлагаемый метод. При этом критерий F составляет 7,29. а степени свободы f1 и f2 равняются 9 и 9 соответственно. Из этого следует, что точность предлагаемого способа по сравнению с известным при определении активности лизоцима выше и этот вывод является высокодостоверным (Р < 0,01). Пример 13. Для сравнения чувствительности и точности известного и предлагаемого способов проводили определение общей лизоцимной активности и лизоцимной активности термостабильных и термолабильных факторов сыворотки крови телят черно-пестрой породы в возрасте 2-х месяцев в количестве 16 голов, принадлежащих опытному хозяйству "Кутузовка" Института животноводства УААН, Результаты определений приведены в табл. 12, 13, 14. Как видно из данных, приведенных в этих таблицах, как на уровне средних значений по представленным выборкам, так и при рассмотрении параметров установленных для каждого животного в отдельности, предлагаемый способ, по сравнению с известным, обеспечивает одним и тем же количеством ферментного препарата (сыворотки крови) увеличение в несколько раз количества гидролизуемого субстрата и это увеличение обусловлено возрастанием скорости реакции гидролиза, а не является следствием перевода одной размерности (% светопропускания) в другую размерность (мкг/мл). Иными словами, в предлагаемом способе отношение результата воздействия (количество расщепленного субстрата) и самому воздействию (количество сыворотки крови) существенно выше, чем в способе-прототипе, на этом основании можно сделать вывод, что предлагаемый способ, по сравнению с известным, имеет более высокую чувствительность. За счет более высокой чувстви тельности предлагаемый способ позволяет надежно определить показатель, который находится за пределами разрешения известного способа: как видно из табл. 14 лизоцимная активность термолабильных факторов сыворотки крови теленка инв. № 5041 находится за пределами разрешения известного способа и составляет 0,014 мкг/мл. В отличие от известного способа предлагаемым способом этот параметр определяется как значимый (0,720 мкг/мл). Следовательно, предлагаемый способ отличается не только более высокой чувстви тельностью, но и имеет более высокую характеристику по параметру: порог чувствительности, то есть для предлагаемого способа минимальная концентрация лизоцимактивных факторов сыворотки крови, активность которых может быть определена, достоверно заметно ниже, чем для способа-прототипа. Поскольку заявляемый способ и способ-прототип предназначены для определения лизоцимной активности сыворотки крови, а не активности лизоцима (а это разные показатели), приведенные данные, полученные именно при определении лизоцимной активности сыворотки крови, позволяют сделать однозначный вывод, предлагаемый способ имеет более высокую чувствительность, нежели известный. Из табл. 12, 13. 14 также следует, что коэффициенты вариации (Cv) при определении параметров лизоцимной активности сыворотки крови во всех случаях были существенно выше при использовании известного способа. Между точностью способа и коэффициентом вариации имеет место обратная зависимость. При этом коэффициент вариации является предпочтительной относительной мерой точности для случаев, когда сравнивают точности измерений показателей, различающихся по своей величине. Проводимое в этом примере сопоставление точности способов подпадает именно под это условие. Исходя из этого можно заключить, что при измерении параметров лизоцимной активности сыворотки крови точность предлагаемого способа выше способа-прототипа. Пример 14. С целью демонстрации механизма, обеспечивающего возрастание чувствительности предлагаемого способа за счет повышения устойчивости взвеси субстрата в период инкубирования, что достигается использованием в качестве среды для диспергирования М. lysodeikticus забуференного раствора динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты, проводили определение общей лизоцимной активности сыворотки крови крупного рогатого скота, закончившего рост. Определение осуществляли по прописи предлагаемого способа, предусматривающего применение буферной системы, содержащий динатриевую соль этилендиамин- N1N1N1N1-тетрауксусной кислоты. Отличительной особенностью определения лизоцимной активности являлось то, что инкубирование образцов осуществляли в центробежном поле центрифуги, обеспечивающим частичное осаждение субстрата в процессе инкубирования, что следует рассматривать как моделирование осаждения субстрата, которое имеет место в способе-прототипе. Полученные величины сопоставляли с лизоцимной активностью тех же образцов сыворотки крови. Однако в этом случае определяли активность этих образцов хотя и в строго аналогичных условиях, но без применения приема центрифугирования в период инкубирования. Субстрат в этих образцах в течение всего инкубирования находился в стабильно взвешенном состоянии и не переходил в осадок. Все остальные условия определения лизоцимной активности, за исключением центрифугирования, в опыте и контроле были строго одинаковыми. Как видно из табл. 15, частичное осаждение субстрата в процессе инкубирования существенно и достоверно снижает величины лизоцимной активности. Полученные данные позволяют сделать следующий вывод. Достоверно более высокие значения лизоцимной активности сыворотки крови, получаемые для одних и тех же образцов предлагаемым способом являются результатом стабилизации взвеси субстрата в период инкубирования за счет применения динатриевой соли этилендиамин- N1N1N1N1-тетрауксусной кислоты. Понижение стабильности взвеси субстрата как дисперсной системы вызывает снижение лизоцимной активности сыворотки крови. Пример 15. При определении параметров лизоцимной активности сыворотки крови теленка чернопестрой породы в возрасте 2 месяцев, инв. №5023, принадлежащего с.х. "Кутузовка" НИИЖ ЛиП УССР, установлено: 1. Для интактной сыворотки: Траб.пр. = 38,0% и 38,5% светопропускания Тк суб. = 18,01% и 18,0% светопропускания Тк сыв. = 99,0% и 99,0% светопропускания Тк реакт. = 100,0% и 100,0% светопропускания 2. Для инактивированной сыворотки: Траб.пр. = 24,0% и 24,0% светопропускания Тк суб. = 19,0% и 19,0% светопропускания Тк сыв. = 99,0% и 99,0% светопропускания Тк реакт. = 100,0% и 100,0% светопропускания, где Траб. пр. - коэффициент пропускания контроля на реактивы, %. Полученные исходные экспериментальные величины подставляем в формулу, предназначенную для расчета лизоцимной активности в процентах светопропускания (Тла). Формула имеет следующий вид: В результате получаем следующие уравнения: 1. Для интактной сыворотки: Полученные величины соответствуют общей лизоцимной активности сыворотки крови в % светопропускания (1 и 2 параллели). Рассчитанные в % светопропускания величины общей лизоцимной активности и лизоцимной активности термостабильных факторов с помощью табулированной калибровочной кривой (см. табл. 16) переводим в размерность: мкг/мл. При этом следует иметь в виду, что данные табл. 16 получены на конкретной спектрофотометрической аппаратуре (КФК-2-УХЛ 4,2; №8505958). Для каждого прибора эти соответствия между двумя размерностями лизоцимной активности (% светопропускания и мкг/мл) устанавливаются отдельно. В результате расшифровки по табл. 16 величин лизоцимной активности, выраженных в % светопропускания, получаем: 1. Для интактной сыворотки: 0,756 мкг/мл и 0,772 мкг/мл, в среднем - 0,764 мкг/мл, что принимаем в качестве общей лизоцимной активности сыворотки крови, выраженной в единицах, мкг/мл. 2. Для инактивированной сыворотки: 0,216 мкг/мл и 0,216 мкг/мл в среднем - 0,216 мкг/мл, что принимаем в качестве лизоцимной активности термостабильных факторов сыворотки крови, выраженной в единицах мкг/мл. Путем вычитаний из величины общей лизоцимной активности величины лизоцимной активности термостабильных факторов получаем значение лизоцимной активности термолабильных факторов сыворотки крови: 0,764 мкг/мл - 0,216 мкг/мл=0,548 мкг/мл. Окончательный результат: сыворотка крови теленка чернопестрой породы в возрасте 2-х месяцев, инвентарный №5023, принадлежащего с.х. "Кутузовка" Института животноводства УААН, имеет общую лизоцимную активность 0,764 мкг/мл, лизоцимную активность термостабильных факторов - 0,216 мкг/мл; лизоцимную активность термостабильных факторов - 0,548 мкг/мл. Данный пример служит образцом для выполнения расчетной части предлагаемого способа определения лизоцимной активности сыворотки крови.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determination of lysozyme activity of blood serum
Автори англійськоюKutikov Yevhen Samoilovych, Zakharov Volodymyr Vasyliovych
Назва патенту російськоюСпособ определения лизоцимной активности сыворотки крови
Автори російськоюКутиков Евгений Самойлович, Захаров Владимир Васильевич
МПК / Мітки
МПК: G01N 33/579, C12Q 1/02
Мітки: визначення, крові, спосіб, лізоцимної, сироватки, активності
Код посилання
<a href="https://ua.patents.su/19-19316-sposib-viznachennya-lizocimno-aktivnosti-sirovatki-krovi.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення лізоцимної активності сироватки крові</a>
Попередній патент: Ізолюючий дихальний апарат
Наступний патент: Каталізатор для селективного відновлення оксидів азоту аміаком та спосіб його одержання
Випадковий патент: Спосіб підвищення резистентності печінки до гострих токсичних уражень в експерименті