Інгібітор атеросклеротичного потовщення внутрішньої оболонки судин
Номер патенту: 39095
Опубліковано: 15.06.2001
Автори: САКАСІТА Мітсуакі, Кітахара Масакі, СІБАЗАКІ Тосіє, Саіто Ясусі, ТОЙОДА Кіомі
Формула / Реферат
1. Ингибитор атеросклеротического утолщения внутренней оболочки сосудов, представляющий соединение общей формулы (1)
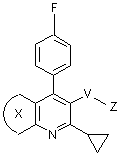 (1)
(1)
где
V-Z представляет собой группу, выбранную из
CH2OH, CO2Et, CHO, ![]()
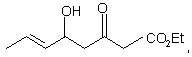
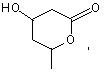
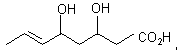
![]()
Х представляет собой
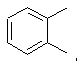
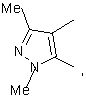
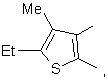
2. Ингибитор по п.1, отличающийся тем, что представляет собой соединение общей формулы (1а)
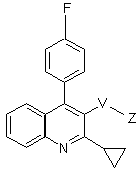
(1а)
где
V-Z представляет собой группу, выбранную из
CH2OH, CO2Et, CHO, ![]()



![]()
3. Ингибитор по п.1, отличающийся тем, что представляет собой соединение общей формулы (1б)
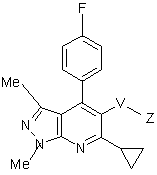 (1б)
(1б)
где V-Z представляет собой группу, выбранную из
CH2OH, CO2Et, CHO, ![]()



![]()
4. Ингибитор по п.1, отличающийся тем, что представляет собой соединение общей формулы (1в)

(1в)
где V-Z представляет собой группу, выбранную из
CH2OH, CO2Et, CHO, ![]()



![]()
5. Ингибитор по п.1, отличающийся тем, что представляет собой (Е)-3,5-дигидрокси-7-[4'-(4"-фторфенил)-2'-циклопропилхинолин-3'-ил]гепт-6-еновую кислоту, ее лактон, натриевую или кальциевую соль, или С1-С3 алкиловый эфир.
6. Ингибитор по п.1, отличающийся тем, что представляет собой (Е)-3,5-дигидрокси-7-[6'-циклопропил-4'-(4"-фторфенил)-1',3'-диметилпиразоло[3,4-b]пиридин-5'-ил]гепт-6-еновую кислоту, ее лактон, натриевую или кальциевую соль, или С1-С3 алкиловый эфир.
7. Ингибитор по п.1, отличающийся тем, что представляет собой (Е)-3,5-дигидрокси-7-[6'-циклопропил-3'-этил-4'-(4"-фторфенил)-2'-метилтиено[2,3-b]пиридин-5'-ил]гепт-6-еновую кислоту, ее лактон, натриевую или кальциевую соль, или С1-С3 алкиловый эфир.
Текст
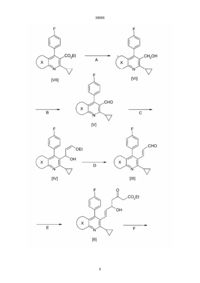
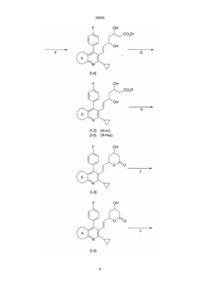
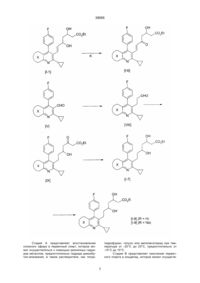
1. Ингибитор атеросклеротического утолщения внутренней оболочки сосудов, представляющий соединение общей формулы (І) Me Me N Et , N , S Me 2. Ингибитор по п.1, отличающийся тем, что представляет собой соединение общей формулы (Іа) F F V N C2 где V-Z представляет собой группу, выбранную из (I) где V-Z представляет собой группу, выбранную из CHO, CH2OH, CO2Et, CHO, CHO, HO CH2OH, CO2Et, CHO, OH OH O O O O HO , OH O OH O OH OH CO2H Х представляет собой , OH , , OH C O 2Et OH CO 2 Et Зоя OH , CO2H , , UA CO2Et CO2Et 39095 (13) , (Іа) (11) X N Z . 3. Ингибитор по п.1, отличающийся тем, что представляет собой соединение общей формулы (Іб) (19) V Z 39095 где V-Z представляет собой группу, выбранную из CHO, CH2OH, CO2Et, CHO, HO OH CO2Et (Іб) где V-Z представляет собой группу, выбранную из OH CH2OH, CO2Et, CHO, OH HO O OH OH CO2 H , , OH OH CO 2Et , F V Z N OH CO 2Et 7. Ингибитор по п.1, отличающийся тем, что представляет собой (Е)-3,5-дигидрокси-7-[6'циклопропил-3'-этил-4'-(4"-фторфенил)-2'-метилтиено[2,3-b]пиридин-5'-ил]гепт-6-еновую кислоту, ее лактон, натриевую или кальциевую соль, или С1-С3 алкиловый эфир. Et S OH , , 6. Ингибитор по п.1, отличающийся тем, что представляет собой (Е)-3,5-дигидрокси-7-[6'-циклопропил-4'-(4"-фторфенил)-1',3'-диметилпиразоло[3,4-b]пиридин-5'-ил]гепт-6-еновую кислоту, ее лактон, натриевую или кальциевую соль, или С1С3 алкиловый эфир. 4. Ингибитор по п.1, отличающийся тем, что представляет собой соединение общей формулы (Ів) Me O , . 5. Ингибитор по п.1, отличающийся тем, что представляет собой (Е)-3,5-дигидрокси-7-[4'-(4"фторфенил)-2'-циклопропилхинолин-3'-ил]гепт-6еновую кислоту, ее лактон, натриевую или кальциевую соль, или С1-С3 алкиловый эфир. O O CO2Et OH CO2H CHO, O O , (Ів) _______________________ руется такими факторами риска, как гиперлипидемия. Сообщалось, что ингибиторы HMG-CoA редуктазы подавляют атеросклеротическое утолщение внутренней оболочки сосудов в результате значительного уменьшения холестерина сыворотки в животной модели (Biochim. Biophis. Acta, 960, 294-302 (1988)), но клинические испытания не подтвердили эффективности такого воздействия. В качестве более эффективного ингибитора атеросклеротического утолщения внутренней оболочки сосудов необходимо лекарственное средство, способное оказывать непосредственное воздействие на такое атеросклеротическое поражение. В литературе сообщалось об ингибирующем действии, оказываемом на клетки гладких мышц лекарственным средством, противодействующим фактору роста тромбоцитов (PDGF), или лекарственным средством, противодействующим фактору роста фибробластов (FGF) (Life Science 28, 16411646, (1981); J. Pharm. Exp.Ther., 248, 1167-1174) (1989)), об ингибирующем действии кальциевых антагонистов на миграцию клеток гладких мышц под влиянием PDGF тромбоксана В4 и интерлейкина-1 (Atherosclerosis, 72, 213-219 (1988)), об ингибирующем действии RGD пептидов на адгезию клеток (J. Cell Biol 112, 335-344 (1981), об ингибирующем действии ингибитора синтеза тромбоксана на повторный стеноз после РТСА. (Atherosclerosis, 661-665, (1990). Однако все эти воз Предметом настоящего изобретения является ингибитор атеросклеротического утолщения внутренней оболочки сосудов, который представляет производное пиридина, обладающее сильным ингибирующим действием в отношении HMG-CoA редуктазы, а также сильным ингибирующим действием в отношении пролиферации клеток гладких мышц внутренней оболочки аорты (ІSMC), происходящей в процессе атеросклеротического утолщения внутренней оболочки сосудов, в отношении миграции клеток гладких мышц срединного слоя аорты (M-SMC) и в отношении адгезии кровяных клеток (таких, как лимфоциты, лейкоциты и макрофаги) к эндотелиальным клеткам. Считается, что утолщение внутренней оболочки коронарной артерии является одной из основных причин инфаркта миокарда и стенокардии. Предполагается, что атеросклеротическое утолщение внутренней оболочки сосудов начинается с адгезии моноцитов или тромбоцитов к эндотелиальным клеткам, которое стимулируется цитокинезом и накоплением липидов и далее развивается под действием миграции М-SMC из срединного слоя во внутреннюю оболочку сосудов, пролиферации клеток гладких мышц во внутренней оболочке и увеличения внеклеточного материала вследствие патологической и пролиферативной активации или модуляции клеток гладких мышц. Подобная активация клеток стимули 2 39095 действия лекарственных средств направлены против тромбоцитов или стимулирующих факторов, таких, как цитокинез, при этом не существует лекарственного средства, которое оказывало бы непосредственное воздействие на патологические клетки гладких мышц, пораженных атеросклерозом. Фактор миграции клеток гладких мышц, выделяемый из этих клеток, оказывает более сильное стимулирующее действие на миграцию, чем PDGF, при этом считается, что он тесно связан с возникновением и прогрессированием атеросклероза Atherosclerosis, T2, 213-226, (1991), но не было обнаружено лекарственного средства, которое бы подавляло такую миграцию клеток гладких мышц. Кроме того, пролиферативное состояние ISMC, которое не может подавляться простагландином І2 (Atherosclerosis, 73, 67-69 (1988), считается важным показателем атеросклероза. Однако, не существует лекарственного средства, которое бы ингибировало такое пролиферативное состояние. Сообщалось, что ингибиторы HMG-CoA редуктазы оказывают подавляющее действие на пролиферацию фибробластов, клеток гладких мышц и лимфоцитов (J. Biol. Chem, 259, 1546-1551 (1384); там же, 255, 5134-5140; Biochim. Biophys. Acta.,1051, 138-143 (1990), а также подавляют активацию лимфоцитов (Int. J. Immunopharmac., II, 863-869 (1069)). Однако такое ингибирующее действие не является вполне удовлетворительным, поэтому существует потребность в лекарственном средстве, которое было бы более эффективным и более избирательным в отношении целевых клеток, в частности I-MG, макрофагов и моноцитов. В основу изобретения поставлена задача создания более эффективного ингибитора атеросклеротического утолщения внутренней оболочки сосудов, позволяющего интенсифицировать адгезию кровяных клеток, таких, как ланоциты, макрофаги к эндотелиальным клеткам и подавлять миграцию клеток гладких мышц срединного слоя аорты, и тем самым подавлять начальную стадию атеросклеротического утолщения внутренней оболочки сосудов. Поставленная задача достигается путем синтеза новых производных пиридина, обладающих сильным ингибирующим действием в отношении HMG-CoA редуктазы, а также сильным ингибирующим действием в отношении пролиферации клеток гладких мышц внутренней оболочки аорты (I-SMC), в отношении миграции клеток гладких мышц срединного слоя аорты (M-SMC). Указанные соединения имеют общую формулу (I) F CHO, CH2OH, CO2Et, CHO, OH HO O O O CO2Et OH OH CO2H OH CO 2 Et , Х представляет собой Me Me N Et , N , S Me В предпочтительном варианте реализации изобретения ингибитор может представлять собой соединение общей формулы (Іа) F V Z N (Ia) где V-Z представляет собой группу, выбранную из CHO, CH2OH, CO2Et, CHO, OH HO O O O CO2Et OH OH , , OH , OH CO 2 Et X , OH CO2H V , , , Z Еще в одном предпочтительном варианте реализации изобретения ингибитор может представлять собой соединение общей формулы (Іб) N (I) где V-Z представляет собой группу, выбранную из 3 39095 OH OH CO 2 Et Наиболее предпочтительными ингибиторами являются следующие соединения: (Е)-3,5-дигидрокси-7-[4'-(4"-фторфенил)-2'циклопропилхинолин-3'-ил]гепт-6-еновая кислота, ее лактон, натриевая или кальциевая соль или С1-С3 алкиловый эфир; (Е)-3,5-дигидрокси-7-[6'-циклопропил-4'-(4"фторфенил)-1',3'-диметилпиразоло[3,4-b]-пиридин-5'ил]гепт-6-еновая кислота, ее лактон, натриевая или кальциевая соль или С1-С3 алкиловый эфир; (Е)-3,5-дигидрокси-7-[6'-циклопропил3'-этил-4'-(4"-фторфенил)-2'-метилтиено [2,3-b]пиридин-5'-ил]гепт-6-еновая кислота, ее лактон, натриевая или кальциевая соль или С1 Сз алкиловый эфир. Такие соединения могут иметь, по крайней мере, один или два асимметричных атома углерода и, следовательно, по меньшей мере, два или большее число оптических изомеров. Таким образом, соединения вышеуказанной формулы (I) включают все оптические изомеры и их смеси. Соединения настоящего изобретения могут быть сильнодействующим ингибитором адгезии кровяных клеток (таких , как моноциты, макрофаги) к эндотелиальным клеткам и могут подавлять начальною стадию атеросклеротического утолщения внутренней оболочки сосудов. Кроме того, они способны подавлять миграцию клеток гладких мышц срединного слоя под действием PDGF и под действием кондиционированной среды клеток гладких мышц (SMC-CM), которая может содержать фактор миграции клеток гладких мышц системы стимуляции произвольного движения. Кроме того, соединения по настоящему изобретению ингибируют поглощение 3Н-тимидина клетками гладких мышц и таким образом подавляют репликацию ДНК, в результате чего достигается эффективное подавление пролиферации клеток. Такие воздействия являются более сильными в отношении I-SMC чем в отношении MSMC. Из вышесказанного следует, что соединение по настоящему изобретению подавляет пролиферацию клеток гладких мышц во внутренней оболочке аорты, которая представляет наиболее важную стадию атеросклеротического утолщения внутренней оболочки сосудов. Соединения настоящего изобретения, то есть мевалоколактоны формулы (I), можно получить в результате осуществления следующих реакций. В формулах реакций X, V и Z имеют значения, указанные выше для формулы (I). (Iб) где V-Z представляет собой группу, выбранную из CHO, CH2OH, CO2Et, CHO, OH HO O O O CO2Et , , OH OH CO2H , OH OH CO 2 Et , Еще в одном предпочтительном варианте реализации изобретения ингибитор может представлять собой соединение общей формулы (Ів) F Et V Z Me S N , (Ів) где V-Z представляет собой группу, выбранную из CHO, CH2OH, CO2Et, CHO, OH HO O O O CO2Et OH , , OH CO2H , , 4 39095 5 39095 6 39095 Стадия А представляет восстановление сложного эфира в первичный спирт, которое может осуществляться с помощью различных гидридов металлов, предпочтительно гидрида диизобутил-алюминия, в таком растворителе, как тетра гидрофуран, толуол или метиленхлорид при температуре от -20°С до 20°С, предпочтительно от -10°С до 10°С. Стадия В представляет окисление первичного спирта в альдегид, которое может осуществ 7 39095 ляться с помощью различных оксидантов. Предпочтение отдается такому методу, при осуществлении которого реакция проводится с использованием хлорхромата пиридиния в метиленхлориде при температуре от 0oС до 25oС, а также методу, в соответствии с которым реакция (реакция окисления Сверна) проводится с использованием оксалилхлорида, диметилсульфоксида и третичного амина (такого, как триэтиламин), и методу, в соответствии с которым реакция выполняется с использованием комплексного соединения триоксида серы и пиридина. Стадия С представляет синтез производного 3-этокси-1-гидрокси-2-пропена, которое можно получить в результате взаимодействия соединения (V) с соединением лития, образуемым путем предварительной обработки цис-1-этокси-2-(три-нбутилстаннил)этилена бутиллитием в тетрагидрофуране. При проведении реакции предпочтение отдается низкой температуре в интервале от -60°С до -78°С. Стадия D представляет синтез еналя посредством кислотного гидролиза. При использовании кислотного катализатора, которым предпочтительно является пара-толуолсульфокислота, хлористоводородная кислота или серная кислота, эта реакция может проводиться в смеси растворителей, состоящей из воды и тетрагидрофурана или этанола, при температуре от 10°С до 25°С. Производное 3-этокси-1-гидрокси-2-пропена, полученное на стадии С, можно без очистки использовать на стадии D, производя лишь удаление одновременно образовавшегося тетра-н-бутилолова. Стадия Е представляет реакцию присоединения еналя (III) и сложного эфира ацетоуксусной кислоты. Эта реакция предпочтительно проводится с использованием гидрида натрия и н-бутиллития, используемых в качестве основания, в тетрагидрофуране при температуре от -80°С до 0°С, предпочтительно от -30°С до -10°С. Стадия F представляет реакцию, при осуществлении которой сложный эфир кетокарбоновой кислоты (II) восстанавливается с помощью различных восстановителей. В соответствии с этой реакцией карбонильная группа восстанавливается с помощью борогидрида натрия, цианоборогидрида натрия, борогидрида цинка, дисиамилборана, диборана, трет-бутиламиноборана, пиридин-боранового комплекса, дициклогексил-борана, тексилборана, 9-борабицикло(3.3.1)нонана, диизопинокамфенилборана или трифтор-бутилборогидрида лития, в результате чего получают соответствующий сложный эфир дигидроксикарбоновой кислоты (I-І). Эта реакция может осуществляться в растворителе, выбираемом из углеводорода, галогенированного углеводорода, С1-4спирта, простого эфира и смесей этих растворителей, при температуре от -100°С до 50°С, предпочтительно от -73°С до 30°С. В противном случае можно использовать триалкилборан, такой, как три-н-бутилборан или триэтилборан и борогидрид натрия, при низкой температуре, как это описывается в журнале "J. Amer.Chem.Sos.", 105, 593 (1383). Кроме того, как указывается в «Tetrahedron Letters», 28,155, (1987), можно предпочтительно получить эритропродукт, обладающий более сильным действием в биологическом отношении, в результате использования алкоксидиалкилборана, такого, как метоксидиэтилборан или этоксидиэтилборан. Эту реакцию можно осуществлять с использованием смеси растворителей, включающей С1-4 спирт и тетрагидрофуран, при температуре от -80°С до -50°С, предпочтительно от -72°С до -68°С. Стадия G представляет гидролиз сложного эфира, и эта реакция может осуществляться с использованием эквимолярного количества основания, предпочтительно гидроксида калия или гидроксида натрия, в смеси растворителей, включающей воду и метанол или этанол, при температуре от 10°С до 25°С. Полученная на этой стадии свободная кислота может взаимодействовать с приемлемым основанием с образованием соли. Стадия Н представляет дегидратацию свободной оксикислоты (І-2) с образованием мевалонолактона, и эта реакция может осуществляться в результате нагрева с обратным холодильником в бензоле или толуоле при одновременном удалении образовавшейся воды или в результате добавления приемлемого осушителя, такого как молекулярное сито. В противном случае эта реакция может осуществляться с использованием лактонообразующего вещества, такого, как карбодиимид, предпочтительно водорастворимый карбодиимид, например, N-циклогаксил-N'-[2'-(метилморфолин) этил]-карбодиимидо-пара-толуолсульфонат, в сухом метиленхлориде при температуре от 10°С до 35°С, предпочтительно от 20°С до 25°С. Стадия J представляет гидрогенизацию двойной связи, соединяющей мевалонолактоновую часть с гетероциклическим кольцом, которую можно осуществлять с использованием каталитического количества палладия-на-угле или родия-на-угле в таком растворителе, как метанол, этанол, тетрагидрофуран или ацетонитрил, при температуре от 0°С до 50°С, предпочтительно от 10°С до 25°С. Стадия К представляет реакцию получения a,b-ненасыщенного кетона в результате избирательного окисления сложного эфира дигидроксикарбоновой кислоты, которое может осуществляться с использованием активированного диоксида марганца в таком растворителе, как простой этиловый эфир, тетрагидрофуран, бензол или толуол, при температуре от 20°С до 80°С, предпочтительно от 40°С до 80°С. В противном случае соединение формулы (І - 6) можно синтезировать из альдегида формулы (V) с помощью реакции сочетания Задсворта - Зимонса (J.Amer.Chem.Soc., 107, 3731, (1985). Кроме того, это соединение можно синтезировать из еналя формулы (III) (Tetrahedron Letters, 26, 2951 (1385). Соединение формулы (I -7) также можно получить путем добавления двойного количества аниона сложного эфира ацетоуксусной кислоты, производя эту операцию так же, как на стадии Е, к альдегиду (VIII), синтезированному из альдегида формулы (V) с помощью непрерывной 8 39095 реакции Виттига (WO-8402131), в результате чего образуется сложный эфир кетокарбоновой кислоты (IX), и последующего восстановления карбоксильной группы так же, как на стадии Р. Кроме того, аналогичным образом можно получить фармакологически приемлемые соли, такие, как соли калия или кислые соли кальция, сложные эфиры, такие, как сложные метиловые эфиры, сложные н-пропиловые эфиры, сложные изопропиловые эфиры, сложные циклопропиловые эфиры, сложные н-бутиловые эфиры, сложные изобутиловые эфиры, сложные втор-бутиловые эфиры, сложные трет-бутиловые эфиры, сложные н-пентиловые эфиры, сложные изопентиловые эфиры или сложные н-гексиловые эфиры, и соли аммония, соли триметиламина, соли диэтиламина, соли пиперазина, соли морфолина, соли пиперидина, соли аурамина, соли диаурамина или соли триметамина, этих соединений. Соединения по настоящему изобретению обладают не только высоким ингибирующим действием в отношении биосинтеза холестерина в том случае, когда HMG-CoA редуктаза выступает в качестве фермента, ограничивающего скорость роста, но и ингибирующим действием в отношении миграции M-SMC, пролиферации 1-SMC и адгезии кровяных клеток к эндотериальным клеткам, как показывают результаты испытаний, приводимые ниже. Таким образом, соединения по настоящему изобретению являются полезными лечебными средствами против гиперлипидемии, гиперлипопротеинемии и атеросклероза. Из этих соединений могут быть изготовлены различные приемлемые составы в зависимости от способа введения. Соединения по настоящему изобретению могут вводиться в форме свободных кислот или в форме физиологически гидролизуемых и приемлемых сложных эфиров или лактонов либо в форме фармацевтически приемлемых солей. Фармацевтический состав по настоящему изобретению предпочтительно вводят перорально в виде самого соединения по настоящему изобретению или в виде порошков, гранул, таблеток и капсул, получаемых в результате смешения соединения по настоящему изобретению с фармацевтически приемлемым носителем, включая такое связующее, как гидроксипропилцеллюлоза, сироп, аравийская камедь, желатин, сорбит, трагант, поливинилпирролидон или карбоксиметил-целлюлозно-кальциевый комплекс, такой наполнитель, как лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит, глицин или порошкообразная Испытуемое соединение 1 кристаллическая целлюлоза, такую смазку, как стеарат магния, тальк, полиэтиленгликоль или диоксид кремния, и такой дезинтегратор, как картофельный крахмал. Однако, фармацевтический состав по настоящему изобретению не ограничивается пероральным введением и пригоден для парентерального введения. Например, он может вводиться в ферме суппозитория, изготовленного с использованием масляной основы, такой, как масло какао, полиэтиленгликоль, ланолин или триглицерид жирной кислоты, трансдермальной лечебной основы, изготавливаемой из жидкого парафина, белого вазелина, высшего спирта, макроголовой мази, гидрофильной мази или гидрогелевого основного материала, а также в форме состава для инъекций, изготавливаемого с использованием одного или нескольких материалов, выбираемых из группы, включающей полиэтиленгликоль, гидрогелевый основный материал, дистиллированную воду, дистиллированную воду для инъекций, и наполнитель, такой, как лактоза или кукурузный крахмал, либо в форме состава, предназначенного для введения через слизистую оболочку, такую, как слизистая оболочка глаза и слизистая оболочка рта. Кроме того, соединения по настоящему изобретению можно соединять с основными ионообменными смолами, способными связывать желчные кислоты, которые при этом не адсорбируются желудочно-кишечным трактом. Суточная доза соединения формулы (I) составляет от 0,05 до 500 мг, предпочтительно от 0,5 до 50 мг для взрослого человека. Ее введение производится один - три раза в день. Эта доза, несомненно, может изменяться в зависимости от возраста, веса и состояния больного. Ниже приводится более детальное описание настоящего изобретения со ссылкой на примеры, демонстрирующие ингибирующее действие соединений по настоящему изобретению в отношении атеросклеротического утолщения внутренней оболочки сосудов. Испытуемые соединения по настоящему изобретению (испытуемые соединения 1-3) и сравнительные соединения (правастатин, описываемый в публикации нерассмотренного патента Японии № 185275/1982 или в Европейском патенте № 65835, и симвастатин, описываемый в публикации нерассмотренного патента Японии № 122373/1984 или в Европейском патенте № 33536) имеют следующие химические структуры: Испытуемое соединение 2 9 Испытуемое соединение 3 39095 Правастатин Симвастатин Справочный пример (Е) -транс-6-(2'-[4"-(4"'(фторфенил)-1",3"-диметил-6"-)-1'" метилэтил)пиразоло[3,4-b]-пиридин5"-ил]этенил)4-гидрокси-3,4,5,6-тетрагидро-2Н-пиран-2-он (соединение I-3b-1). Аналогичным образом были получены испытуемые соединения 1, 2 и 3 из следующих промежуточных соединений (Vlla-1, Vllb-2 и Vllc-1): Соединение Vlla-1 Метил-2-циклопропил-4-(4'-фторфенил)хинолин-3-ил-карбоксилат Соединение Vllb-2 Метил-6-циклопропил-1,3-диметил-4-(4'-фторфенил)пиразоло[3,4-b]пиридин-5-ил-карбоксилат Соединение Vllc-1 Метил-6-циклопропил-3-этил-4-(4'-фторфенил)-2-метилтиено[2,3-b]пиридин-5-ил-карбоксилат. Это соединение было получено с использованием в качестве исходного материала метил-2циклопропил-5-этил-3-(4'-фторфенил)-6-метилтиено[2,3- b]пиридин-3-ил-карбоксилата (соединение Vllb-1) в результате осуществления стадий с А по Н. (VII) o X Vlla-1 Температура плавления, С 113,5-116,5 , Me Vllb-2 121-123 N , N Me Vllc-1 168-169 Испытуемое соединение 1(І-3а-1) (Е)-транс-6-{2'[2''-циклопропил-4"(4"'-фторфенил)хинолин-3"-ил]этенил}-4-гидрокси-3,4,5,6тетрагидро-2Н-пиран-2-он Испытуемое соединение 2 (l-3b-2) (Е)-транс-6-{2'[6"-циклопропил-1",3"-диметил-4"-(4"'-фторфенил)пиразоло[3,4-b]-пиридин-5" ил]этенил}-4-гидрокси-3,4,5,6-тетрагидро-2Н-пиран-2-он Испытуемое соединение 3 (I-3с-1) (Е)-транс-6-(2'-[2"-циклопропил-5"-этил-3"(4'"-фторфенил)-6"-метилтиено[2,3-b]-пиридин-3"ил]этенил)-4-гидрокси-3,4,5,6-тетрагидро-2Н-пиран-2-он 10 39095 Стадия А 4-(4'-фторфенил)-5-гидроксиметил-1,3-диметил-6-(1'-метил-этил)-пивазоло[3,4-b]-пиридин (соединение Vl-b-1) 5,0 г (0,014 моля) соединения Vllb-1 растворяли в сухом толуоле, производя эту операцию в атмосфере азота, и охлаждали до 0°С в ледяной бане. К этому раствору по каплям добавляли 35 мл раствора толуола, содержащего 16 мас.% гидрида диизобутилалюминия, после чего эту смесь перемешивали в течение 2 часов при температуре 0°С. После подтверждения посредством тонкослойной хроматографии полного исчезновения соединения Vllb-1 для окончания реакции к указанной смеси добавляли при 0oС насыщенный раствор хлорида аммония. К реакционной смеси добавляли простой этиловый эфир, после чего отделяли органический слой. К желатинированному веществу добавляли водный раствор гидроксида натрия с целью его растворения, после чего полученный раствор экстрагировали простым этиловые эфиром. Экстракт простого этилового эфира собирали, сушили над безводным сульфатом магния и фильтровали, а растворитель отгоняли с образованием 3,9 г целевого продукта желтоватого цвета. Выход: 88%, температура плавления: 174175°С. Аналогичным образом были получены следующие соединения: (VI) X Vla-1 o Температура плавления, С 120-126 , Me Vlb-2 168-170 N , N Me Vlc-1 118-120 Стадия В [4-(4'-фторфенил)-1,3-диметил-6-(1'-метиленэтил)пиразоло[3,4-b]пиридин-5-ил]-карбоксиальдегид (соединение Vb-1) 4,2 г (19 ммолей) хлорхромата пиридиния, 0,69 г безводного ацетата натрия и 3,8 г (12 ммолей) соединения VIb-1 суспендировали в 50 мл сухого дихлорметана при комнатной температуре. Реакционный раствор перемешивали в течение одного часа, после чего добавляли к нему 100 мл простого этилового эфира и тщательно переме шивали. Реакционную смесь фильтровали под вакуумом через слой целита, после чего фильтрат выпаривали до сухого состояния при пониженном давлении. Остаток очищали посредством хроматографии на колонках из силикaгеля (элюент хлороформ), в результате чего было получено 2,9 г целевого продукта желтоватого цвета. Выход: 78%, температура плавления: 144-146°С. Аналогичным образом были получены следующие соединения. 11 39095 (V) o X Va-1 Температура плавления, С 150,1-151,6 , Me Vb-2 149-151 N , N Me Vc-1 174-176 регоняли при пониженном давлении, при этом отгоняли растворитель, что позволило получить в основном частое соединение IVb -1. Стадия D Соединение IVb -1, полученное на стадии С, растворяли в 70 мл тетрагидрофурана и к этому раствору добавляли 20 мл воды и 3 г паратолуолсульфокислоты. Эту смесь перемешивали в течение 2 часов при комнатной температуре. Реакционный раствор тщательно нейтрализовали водным раствором гидроксида натрия, а затем несколько раз экстрагировали простым диэтиловым эфиром. Экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. После этого растворитель отгоняли при пониженном давлении. Остаток очищали посредством хроматографии на колонках из силикагеля (элюент - смесь этилацетата и н-гексана = 1/9 (в объемном отношении)), в результате чего был получен целевой продукт желтого цвета. Стадия С и D (Е)-3-[4'-(4"-фторфенил)-1',3'-диметил-6'(1"метилэтил)-пиразоло[3,4-b]пиридин-5'-ил]-пропенальдегид (соединение III-1) Стадия С 1,45 г (40 ммолей) цис-1-этокси-2-(три-н-бутилстаннил)этилена растворяли в 50 мл сухого тетрагидрофурана, после чего полученный раствор охлаждали до -78°С в потоке азота. К этому раствору по каплям добавляли 26 мл (40 ммолей) раствора 15 мас.% н-бутиллития в н-гексане. Эту смесь перемешивали в течение 20 минут. Затем раствор, содержащий 2,5 г (8 ммолей) соединения Vb, растворенного в 20 мл сухого тетрагидрофурана, по каплям добавляли к вышеуказанной смеси. Реакционную смесь перемешивали в течение одного часа при температуре -78°С, после чего для окончания реакции добавляли 26 мл насыщенного раствора хлорида аммония. Органический слой экстрагировали простым диэтиловым эфиром, эфирный экстракт промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, а остаток подвергали жидкостному разделению между н-гексаном и ацетонитрилом, после чего слой ацетонитрила пе Количество: 2,2 г (выход: 79%), температура плавления: 133-134°С. Аналогичным образом были получены следующие соединения: 12 39095 (III) o X ІІla-1 Температура плавления, С 141,3-144,1 , Me N ІІlb-2 135-137 , N Me ІІlc-1 136-138 Стадия Е Этил-/Е/-7-[4'-(4"-фторфенил)-1',3'-диметил6'-(1"-метилэтил)-пиразоло[3,4-b]-пиридин-5-ил]-5гидрокси-3-оксогепт-6-еноат (соединение llb-1) 1,25 г 60% гидрида натрия промывали высушенным петролейным эфиром, сушили в потоке азота, а затем суспендировали в 200 мл сухого тетрагидрофурана. Полученную суспензию охлаждали до -15°С в атмосфере азота, после чего к ней по каплям добавляли 3,9 мл (30 ммолей) этилацетоацетоната. Эту смесь перемешивали в течение 15 минут. Затем к ней по каплям добавляли 20 мл (30 ммолей) раствора 15 мас.% н-бутиллития в н-гексане и перемешивали смесь в течение 30 минут. Кроме того, в эту смесь по каплям добавляли раствор, содержащий 2,1 г (6,1 ммоля) соединения llb-1, растворенного в сухом тетрагид рофуране, и перемешивали в течение одного часа. К реакционной смеси добавляли 10 мл насыщенного водного раствора хлорида аммония при температуре -15°С, после чего ее трижды экстрагировали простым диэтиловым эфиром. Эфирный раствор промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, а затем выпаривали до сухого состояния при пониженном давлении. Остаток очищали посредством хроматографии. На колонках из силикагеля (элюент - смесь этилацетата и хлороформа = 1/9 (в объемном отношении)), в результате чего было получено 2,5 г (выход: 83%) целевого продукта белого цвета. Температура плавления: 95-98°С. Аналогичным образом были получены следующие соединения. (II) o X ІІa-1 Іlb-2 Температура плавления, С 91,0-93,0 , Me N , N Масляное вещество Me Іlc-1 Масляное вещество 13 39095 Стадия F Этил-(Е)-7-[4'-(4''-фторфенил)-1',3'-диметил6'-(1"-метилэтил)-пиразоло[3,4-b]-пиридил-5'-ил]3,5-дигидроксигепт-6-еноат (соединение I-1b-1) 2,32 г (4,96 ммоля) соединения llb -1 растворяли в 20 мл этанола, выполняя эту операцию в атмосфере азота, после чего полученный раствор охлаждали до 0°С. Затем к нему добавляли 740 мг (20 ммолей) борогидрида натрия и перемешивали смесь в течение одного часа. К этой смеси добавляли 10% водный раствор хлористоводородной кислоты, что позволяло произвести тщательную нейтрализацию смеси. Эту смесь трижды экстрагировали простым этиловым эфиром. Эфирный раствор промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, а затем выпаривали до сухого состояния при пониженном давлении. Остаточное масло очищали посредством хроматографии на колонках из силикагеля (элюент - смесь этанола и хлороформа = 3/97 (в объемном отношении), что позволило получить чистый целевой продукт в виде бесцветного вязкого масла. Количество: 1,81 г (выход: 78%). Спектр ЯМР (d частей на миллион CDCI3) : 1,28 (т, J= 8 Гц, 3Н), 1,32 (д, J = 8 Гц, 6Н), 1,4-1,8 (м, 1Н), 1,92 (с, 3Н), 2,2-2,6 (м, 3Н), 2,9-3,8 (м, 2Н), 3,42 (7 гептет, J = 8 Гц, 1Н), 4,06 (с, 3Н), 4,1-4,6 (м, 4Н), 5,1-5,5 (м, 1Н), 6,4-6,7 (м, 1Н), 6,9-7,3 (м, 4Н). Аналогичным образом были получены следующие соединения. (І-1) o X I-Ia-1 Температура плавления, С 100-104 , Me I-Iб -2 N , N Масляное вещество Me I-Ic-1 105-108 чение одного часа. Затем при пониженном давлении отгоняли этанол и добавляли к остатку 2 мл воды. Полученную смесь экстрагировали простым этиловым эфиром. Водный слой сушили вымораживанием, что позволило получить 180 мг (31%) гигроскопичного порошка желтоватого цвета. Температура плавления: 258-264°С (разложение). Стадия G Натриевая соль (Е)-7-[4'-(4"-фторфенил)1',3'-диметил-6'-(1"-метилэтил)пиразоло-[3,4-b] пиридин-5'-ил]-3,5-дигидроксигепт-6-еноевой кислоты (соединение I-2b-1) 200 мг (0,43 ммоля) соединения I-1b-1 растворяли в 2 мл этанола и к полученному раствору по каплям добавляли 0,85 мл 0.5 водного раствора гидроксида натрия. Эту смесь продолжали перемешивать при комнатной температуре в те Аналогичным образом были получены следующие соединения. 14 39095 F (І-5) o X І-5a-1 Температура плавления, С 197-199 (разложение) , Me І-5b-2 N , N 230-237 (разложение) Me І-5c-1 212-216 (разложение) (Е)-7-[4'-(4"-фторфенил)-1',3'-диметил-6'-(1"метилэтил)-пиразоло [3,4-b] пиридин-5'-ил] -3,5-дигидроксигепт-6-еноевая кислота (соединение I-2b-1) 0,25 г (0,53 ммоля) соединения I-1b-1 растворяли в 3 мл этанола и к полученному раствору по каплям добавляли 1,06 мл 0,5 н. водного раствора гидроксида натрия. Этанол отгоняли при пониженном давлении, а к остатку добавляли 3 мл дистиллированной воды. После этого смесь экстрагировали простым этиловым эфиром. Водный слой тщательно нейтрализовали 1% хлористоводородной кислотой, а затем экстрагировали простым этиловым эфиром. Эфирный слой сушили над безводным сульфатом магния и перегоняли при пониженном давлении с образованием целевого продукта. Количество: 0,21 г (выход 90%). Спектр импульсного ЯМР (ДМСО- d6) d частей на миллион: 1,29 (д, J = 7 Гц, 6Н), 1,33 (с, 3Н), 2,1-2,3-(м, 2Н), 2,4-2,6 (н, 1Н), 3,0-3,6 (м, 4Н), 3,96 (с, 3Н), 4,34,8 (м, 2Н), 5,2-5,6 (м, 1Н), 6,3-6,6 (м, 1Н), 7,2-7,4 (м, 4Н), 11,5-12,0 (широкий синглет, 1Н). Стадия Н (Е)-транс-6-(2'-[4"-(4"'-фторфенил)-1",3"-диметил-6"-1"'-метилэтил)пиразоло[3,4-b]-пиридин 5"-ил]этенил)-4-гидрокси-3,4,5,6-тетрагидро-2Н-пиран-2-он (соединение I-3b-1) 130 мг (0,29 ммоля) соединения I-2b-1 растворяли в 6 мл дихлорметана и к полученному раствору добавляли 125 мг (0,29 ммоля)-N-циклогексил-N'-(2"-метилморфолиноэтил)карбодиимид-ртолуолсульфоната. Полученную смесь перемешивали при комнатной температуре в течение 2 часов, после чего при пониженном давлении отгоняли растворитель до сухого состояния. Остаточное масло очищали посредством тонкослойной хроматографии на силикагеле (элюент - смесь гексана и этилацетата = 9/1 (в объемном отношении)), что позволило получить чистый целевой продукт в виде бесцветного вязкого масла. Количество: 47 мг (выход: 39%). Спектр импульсного ЯМР (CDCl3) d частей на миллион: 1,33 (д, J= 6,8 Гц, 6Н), 1,4-1,5 (м, 1Н), 1,6-1,7 (м, 2Н), 1,33 (с, 3Н), 2,5-2,6 (м,1Н), 2,68 (двойной дублет, J = 18 Гц, J = 5 Гц, 1Н), 3,39 ( 7 гептет, J = 6,8 Гц, 1Н), 4,07 (с, 8Н), 4,1-4,2 (м, 1Н), 5,1-5,2 (м, 1Н), 5,31 (двойной дублет, J =16 Гц, J=6 Гц, 1Н), 6,61 (двойной дублет, J = 16 Гц, J = 1,5 Гц, 1Н), 7,1-7,3 (м, 4Н). Аналогичным образом были получены следующие соединения. 15 39095 (І-3) o X І-3a-1 Температура плавления, С 199-201 , Me І-3b-2 122-127 N , N Me І-3c-1 164-166 Пример 1 Ингибирующее действие в отношении миграции клеток гладких мышц срединного слоя аорты (M-SMC) Ингибирующее действие соединений по настоящему изобретению в отношении миграции М SMC определяли с помощью следующих методов. Срезы срединного слоя грудной аорты самца крысы вида "Sprague Dawley" культивировали в среде Игла, модифицированной Дульбеко (DME), содержащей 10% сыворотки плода коровы ( FBS ), при температуре 37°С в атмосфере, состоящей из 95% воздуха в 5% углекислого газа в течение 3 или 4 недель. Клетки гладких мышц срединного слоя аорты, выращенные из срезов срединного слоя артерии, инокулировали путем разделения плотности клеток в отношении 1:2 с целью получения стабильной субкультуры. После трех- или четырехкратной инокуляции соединенные клетки обрабатывали трипсином и суспендировали в вышеуказанной среде при плотности клеток, равной 500000 клеткам на мл. К взвеси клеток добавляли испытуемое соединение, растворенное в диметилсульфоксиде (ДМСО), в результате чего конечная концентрация ДМСО составила 0,2%, после чего взвесь клеток предварительно инкубировали при температуре 37°С в течение 30 минут. Для получения контрольной пробы добавляли один ДМСО в такой же концентрации. В нижнее отделение камеры Бойдена, разделенной нитроцеллюлозной мембраной, вводили 10 мг/мл фактора роста тромбоцитов /PDGF/ или среды DME, представляющей 10% среду DME, стандартизированную клетками гладких мышц (SMC-CM), полученную в результате 48-часовой стандартизации, которую использовали в качестве фактора миграции. В верхнее отделение указанной камеры вводили 1 мл взвеси клеток и производили инкубацию при температуре 37°С в течение 4 часов в условиях культивирования. Для получения холостой пробы в нижнее отделение вводили среду DME без фактора миграции. После четырехчасовой инкубации удаляли клетки, прилипшие к верхней стороне нитроцеллюлозной мембраны, а клетки, переместившиеся к нижней стороне мембраны, фиксировали и окрашивали красителем "Diff Quick". Число переместившихся клеток подсчитывали в 10 полях с помощью светового микроскопа при 400кратном увеличении. Полученные результаты представляли в виде среднего значения числа клеток в трех камерах, полученного в каждом случае, а величину ингибирования (%) высчитывали в соответствии со следующей формулой: Ингибирование (%) = 100 - {(Т-В) / (С-В) х x 100}, где В - число клеток в холостой пробе, С - число клеток в контрольной пробе и Т - число клеток в пробе, содержащей испытуемое соединение. Результаты приведены в таблице 1 . Соединения по настоящему изобретению продемонстрировали сильное ингибирующее действие в отношении миграции M-SMC по сравнению со сравнительным соединением. 16 39095 Таблица 1 Ингибирование (%) PDGF SMC-CM Концентрация лекарственного средства (М) Испытуемое соединение 1 -5 10 77,8 10-5 28,4 Испытуемое соединение 2 Испытуемое соединение 3 98,2 100 32,8 41,7 Правастатин 61,8 26,2 Пример 2 Ингибирующее действие в отношении пролиферации клеток гладких мышц внутренней оболочки и срединного слоя аорты (I-SMC и М-SMC ) Ингибирующее действие соединений по настоящему изобретению в отношении пролиферации I-SMC и M-SMC определяли с помощью следующих методов. При использовании среды DME, содержащей 10% сыворотки плода коровы и антибиотик, срезы срединного слоя аорты, полученные у здорового японского белого кролика, и срезы пораженного участка внутренней оболочки аорты, выделенные из срединного слоя, взятого у японского белого кролика, пораженного атеросклерозом, культивировали так же, как это описывалось в примере 1. После двух- или трехкратной инокуляции соединенные клетки обрабатывали трипсином и суспендировали в вышеуказанной среде, так что плотность клеток составляла 20000 клеток/мл. Затем производили посев 10000 клеток, которые культивировали в чашке с 24 ячейками. После инкубации в течение 6 часов вышеуказанную среду заменяли 0,5 мл контрольной среды или среды, содержащей испытуемое соединение. В это время подсчитывали число клеток, первоначально прикрепившихся к чашке, которое принимали за исходное число клеток (I). К среде добавляли испытуемое соединение, как это описано в примере 1. Для получения контрольной пробы вводили один ДМСО так, чтобы конечная концентрация составила 0,2%. Замену среды производили через каждые 2 дня, при этом в первый, второй, третий, пятый и седьмой день клетки обрабатывали трипсином и суспендировали в изотоническом растворе, после чего определили число клеток с помощью счетчика Каултера. Результаты представлены в виде среднего числа клеток в трех ячейках, полученного в каждом случае, а величину ингибирования (%) процесса увеличения числа клеток со второго по пятый день высчитывали в соответствии со следующей формулой. Ингибирование (%) = 100 - {(Т5/Т2) / (С5/С2)х х 100}, где Т2 и Т5 представляют число клеток соответственно во второй и пятый день в среде, содержащей испытуемое соединение, а С2 и С5 представляют число клеток соответственно во второй и пятый день в контрольной среде. Полученные результаты приведены в таблице 2. Соединения по настоящему изобретению продемонстрировали сильное ингибирующее действие в отношении пролиферации как I-SMC, так и М-SMC по сравнению со сравнительным соединением. Кроме того, ингибирующее действие с отношением пролиферации I-SMC было выше по своей эффективности, чем в отношении пролиферации М-SMC. Таблица 2 Ингибирование (%) Внутренняя оболочка Средний слой Концентрация лекарственного средства (М) 10-6 10-5 10-6 10-5 Испытуемое соединение 1 36,4 98,1 6,3 91,5 Испытуемое соединение 2 84,6 98,2 4,7 86,5 Испытуемое соединение 3 100 100 31,5 100 Правастатин 1,3 1,3 8,7 -11,7 оболочки и срединного слоя аорты определяли с помощью следующих методов. M-SMC и I-SMC получали из срединного слоя аорты здорового японского белого кролика и из внутренней оболочки аорты японского белого кролика, страдающего атеросклерозом, как это указывалось в примере 2. После трех- или четырехкратной инокуляции соединенные клетки об Пример 3 Ингибирующее действие в отношении поглощения 3Н-тимидина клетками гладких мышц внутренней оболочки и срединного слоя аорты (I-SMC и M-SMC) Ингибирующее действие соединения по настоящему изобретению в отношении поглощения 3 Н-тимидина клетками гладких мышц внутренней 17 39095 ность 3H измеряли с помощью жидкостного сцинтилляционного счетчика и определяли содержание белка. рабатывали трипсином и суспендировали в среде DME, содержащей 10% сыворотки плода коровы и антибиотик, так что плотность клеток составляла 40000 клеток/мл. Высевали 10000 клеток в чашку с 48 ячейками. После культивирования в течение 4 дней вышеуказанную среду заменяли контрольной средой или средой, содержащей испытуемое соединение, аналогичное используемому в примере 2, после чего культивирование продолжали в течение 24 часов. Затем добавляли m1 Сi (37 МВg) 3 H-тимидина и продолжали культивирование в течение 3 часов. Клетки трижды промывали фосфатно-солевым буферным раствором (PBS ) и обрабатывали охлажденной 5% трихлоруксусной кислотой (ТСА). Нерастворимую фракцию промывали охлажденной ТСА и растворяли в 0,5 N водном растворе гидроксида калия. Радиоактив Результаты высчитывали в виде величины радиоактивности на 1 мг белка и представляли в качестве среднего значения для 3 ячеек. Величину ингибирования (%) высчитывали в соответствии со следующей формулой. Ингибирование (%) = 100 -Т/С х 100 Полученные результаты приведены в таблице 3. Соединения по настоящему изобретению продемонстрировали сильное ингибирующее действие в отношении поглощения 3H-тимидина фракцией ДНК в клетках гладких мышц внутренней оболочки и срединного слоя аорты по сравнению со сравнительным соединением. Таблица 3 Ингибирование (%) Внутренняя оболочка -6 Срединный слой Концентрация лекарственного средства (М) 10 10 10-6 10-5 Испытуемое соединение 1 32,2 83,1 46,7 30,8 Испытуемое соединение 2 11,7 91,5 36,4 88,4 Испытуемое соединение 3 69,9 94,1 53,6 92,2 Правастатин -7,0 -7,2 8,7 -34,3 Пример 4 Ингибирующее действие в отношении адгезии лейкозных клеток (HL-60) Ингибирующее действие соединений по настоящему изобретению в отношении адгезии клеток HL-60 определяли с помощью следующих методов. Клетки HL-60 культивировали в среде RPMI 1640, содержащей 10% сыворотки плода коровы и антибиотик, при температуре 37°С в атмосфере, состоящей из 35% воздуха и 5% углекислого газа, после чего эти клетки высевали в чашку с 6 ячейками в количестве 2 мл на каждую ячейку при плотности клеток, равной 1000000/мл. Испытуемое соединение, растворенное в ДМСО, добавляли в таком количестве, что конечная концентрация ДМСО достигала 0,2%, и продолжали инкубацию в течение 48 часов в качестве предварительной обработки. Затем 500000 клеток высевали в чашку с 24 ячейками, добавляли 0,02 мм форбол-миристат-ацетата (ТРА), растворенного в этаноле, в количестве 1/250 (в объемном отношении) культуральной среды и продолжали культивирование в -5 течение 12 часов. Вслед за этим клетки промывали фосфатно-солевым буферным раствором, клетки, прикрепившиеся к ячейкам чашки, удаляли путем обработки трипсином и суспендировали в изотоническом растворе, после чего определяли число клеток с помощью счетчика Каултера. Контрольное испытание выполняли при добавлении одного ДМСО. Результаты представляли в виде среднего значения числа клеток в трех ячейках, полученного во время предварительной обработки, а величину ингибирования (%) высчитывали в соответствии со следующей формулой: Ингибирование (%) адгезии = 100 - Т/С х 100, где Т - число клеток в среде, содержащей испытуемое соединение, С - число клеток в контрольной среде. Полученные результаты приведены в таблице 4. Соединения по настоящему изобретению продемонстрировали сильное ингибирующее действие в отношении клеток HL-60 под действием ТСА по сравнению со сравнительным соединением. Таблица 4 Ингибирование (%) Концентрация лекарственного средства (М) -7 -6 -5 10 10 10 Испытуемое соединение 1 1,0 12,3 98,7 Испытуемое соединение 3 4,8 92,2 96,4 Правастатин -2,8 Пример 5 Ингибирующее действие соединений по настоящему изобретению в отношении адгезии клеток J774-Mф определяли с помощью следующих методов. Ингибирующее действие в отношении адгезии макрофагов J774-(J774-Mф) 18 39095 1000000 клеток высевали в чашку с 6 ячейками и культивировали в 1 мл среды DME, содержащей 10% сыворотки плода коровы и антибиотик, при температуре 37°С в атмосфере, состоящей из 95% воздуха и 5% углекислого газа, в течение 2 дней. Затем культивирование продолжали в контрольной среде, содержащей 0,2% ДМСО, или в среде, содержащей испытуемое соединение, что представляло предварительную обработку. Затем клетки удаляли резиновым скребком и суспендировали в вышеуказанной среде, 200000 клеток высевали в чашку с 24 ячейками и культивировали в течение 12 часов. После этого клетки, прикрепившиеся к ячейкам чашки, удаляли резиновым скребком и с помощью счетчика Каултера определяли число клеток. Результаты представляли в виде среднего значения числа клеток в трех ячейках, полученного в каждом случае во время предварительной обработки, а величину ингибирования (%) адгезии высчитывали в соответствии со следующей формулой. Ингибирование (%) адгезии = 100 - Т/С х х 100, где Т - число клеток в среде, содержащей испытуемое соединение, С - число клеток в контрольной среде. Полученные результаты приведены в таблице 5. Соединения по настоящему изобретению продемонстрировали сильное ингибирующее действие в отношении адгезии клеток J774-Mф. Таблица 5 Ингибирование (%) Концентрация лекарственного средства -6 -5 10 10 Испытуемое соединение 1 53,0 14,2 Испытуемое соединение 3 32,2 32,4 Правастатин 40,0 41,3 Симвастатин 48,5 48,6 Соединения по настоящему изобретению оказывают ингибирующее действие на HMGСоА редуктазу и ингибируют атеросклеротическое утолщение внутренней оболочки сосудов, поэтому они являются полезными профилактическими средствами, предупреждающими воз никновение коронарных болезней сердца, таких, как стенокардия, инфаркт миокарда, повторный стеноз после РТСА, сокращение цереброваскулярных сосудов после внутримозгового кровоизлияния и облитерирующий склеротический артериит. Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 19
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitor of antisclerotic thickening of inner coat of vessels
Автори англійськоюSAITO Yasushi, KITAHARA Masaki, SARASHITA Mitsuaki, SHIBAZAKI TashIE, TOYODA Kiomi
Назва патенту російськоюИнгибитор атеросклеротического утолщения внутренней оболочки сосудов
Автори російськоюСАИТО Ясуси, КИТАХАРА Масаки, САКАСИТА Митсуаки, СИБАЗАКИ Тосие, ТОЙОДА Киоми
МПК / Мітки
МПК: A61P 9/08, A61P 9/10, A61K 31/435, A61K 31/44, A61K 31/437, C07D 471/04, C07D 495/04, C07D 215/38, A61K 31/47, C07D 215/18, A61K 31/4365, C07D 491/056, A61P 43/00, C07D 215/22, A61K 31/4725, C07D 405/06, C07D 215/14, A61P 9/00, C07D 215/54
Мітки: потовщення, оболонки, інгібітор, судин, внутрішньої, атеросклеротичного
Код посилання
<a href="https://ua.patents.su/19-39095-ingibitor-aterosklerotichnogo-potovshhennya-vnutrishno-obolonki-sudin.html" target="_blank" rel="follow" title="База патентів України">Інгібітор атеросклеротичного потовщення внутрішньої оболонки судин</a>