Видозмінене людське антитіло або видозмінений фрагмент людського антитіла, які мають специфічність до людського поліморфного епітеліального муцину (рем), конструкція днк (варіанти)
Формула / Реферат
1. Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела, обладающие специфичностью к человеческому полиморфному эпителиальному муцину (РЕМ), в котором указанное видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела содержит
(і) по меньшей мере одну переменную область тяжелых цепей, содержащую следующие три CDR:
и
(ii) по меньшей мере одну переменную область легких цепей, содержащую следующие три CDR:
2. Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по п. 1, где указанное видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела является одноцепочечным антителом.
3. Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по п. 1, имеющие по меньшей мере одну переменную область тяжелых цепей, содержащую всю последовательность аминокислот
.
4. Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по п. 1, имеющие по меньшей мере одну переменную область легких цепей, содержащую всю последовательность аминокислот:
.
5. Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по любому из предшествующих пунктов, где РЕМ представляет собой шарики жира человеческого молока (HMFG).
6. Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по любому из предшествующих пунктов, обладающие специфичностью, эквивалентной специфичности гамма-1, каппа анти-HMFG моноклонального антитела "HMFG1".
7. Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по любому из предшествующих пунктов, имеющие по меньшей мере одну наименьшую переменную область тяжелых цепей, содержащую полную последовательность аминокислот
,
и имеющие по меньшей мере одну наименьшую переменную область легких цепей, содержащую полную последовательность аминокислот
.
8. Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по любому из пунктов 1-7, связанные с агентом или включающие в себя агент, способный задерживать или прекращать рост раковых клеток, или связанные с агентом, который можно обнаруживать внутри тела человека.
9. Конструкция ДНК, отличающаяся тем, что кодирует переменную область тяжелых цепей видоизмененного человеческого антитела, как указано в любом из пп. 1-8.
10. Конструкция ДНК по п. 9, отличающаяся тем, что эта конструкция включает нуклеотидную последовательность
.
11. Конструкция ДНК по п. 9 или 10, отличающаяся тем, что включает нуклеотидную последовательность, содержащуюся в депонированном штамме E.coli NCTC 12411.
12. Конструкция ДНК, отличающаяся тем, что кодирует переменную область легких цепей видоизмененного человеческого антитела, как определено в любом из пп. 1-8.
13. Конструкция ДНК по п. 12, отличающаяся тем, что содержит полную нуклеотидную последовательность
.
14. Конструкция ДНК по п. 12 или 13, отличающаяся тем, что включает нуклеотидную последовательность, содержащуюся в депонированном штамме E.coli NCTC 12412.
15. Конструкция ДНК по любому из пп. 9-14, отличающаяся тем, что включает нуклеотидные последовательности
.
16. Конструкция ДНК по любому из пп. 9-15, отличающаяся тем, что включает нуклеотидные последовательности
.
Текст
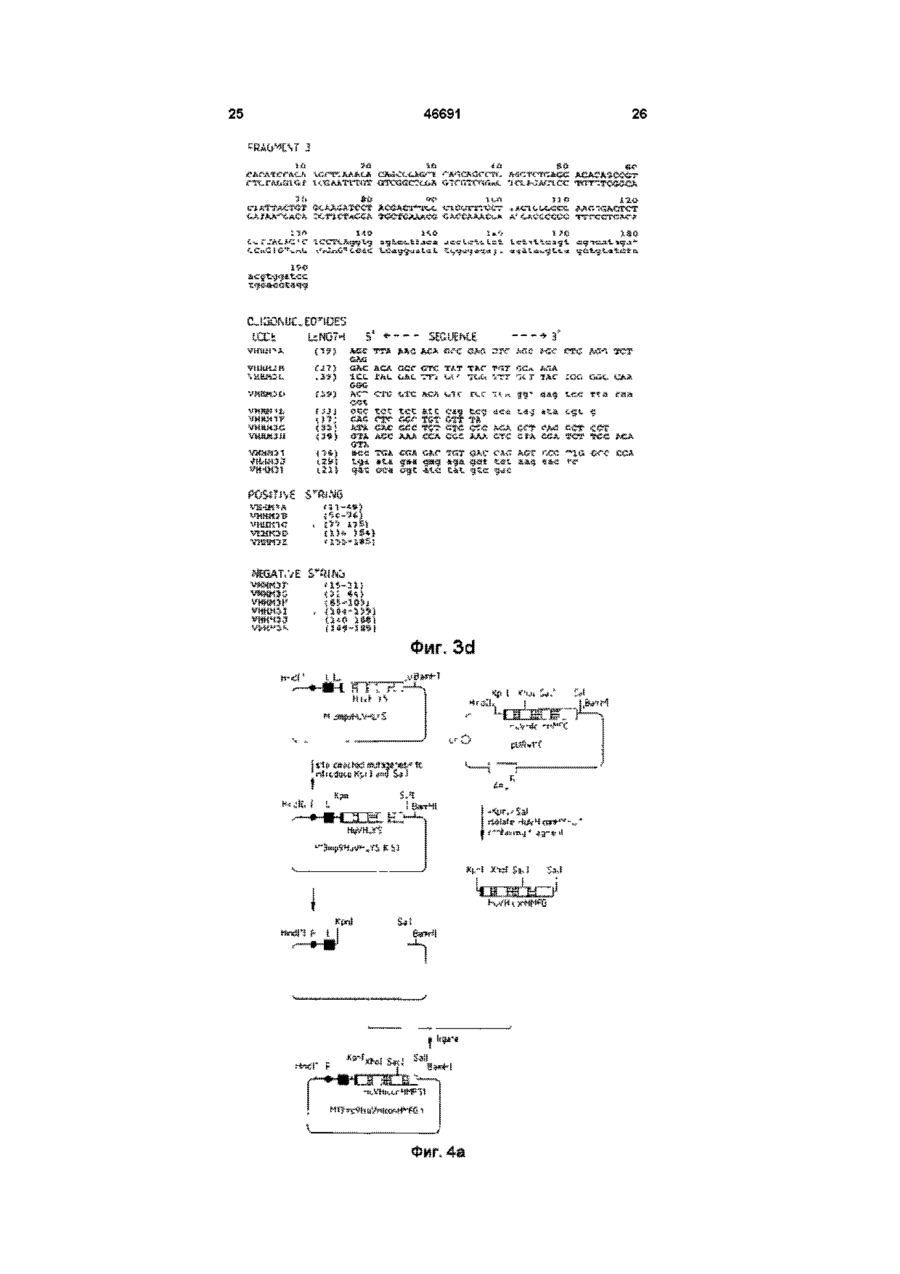
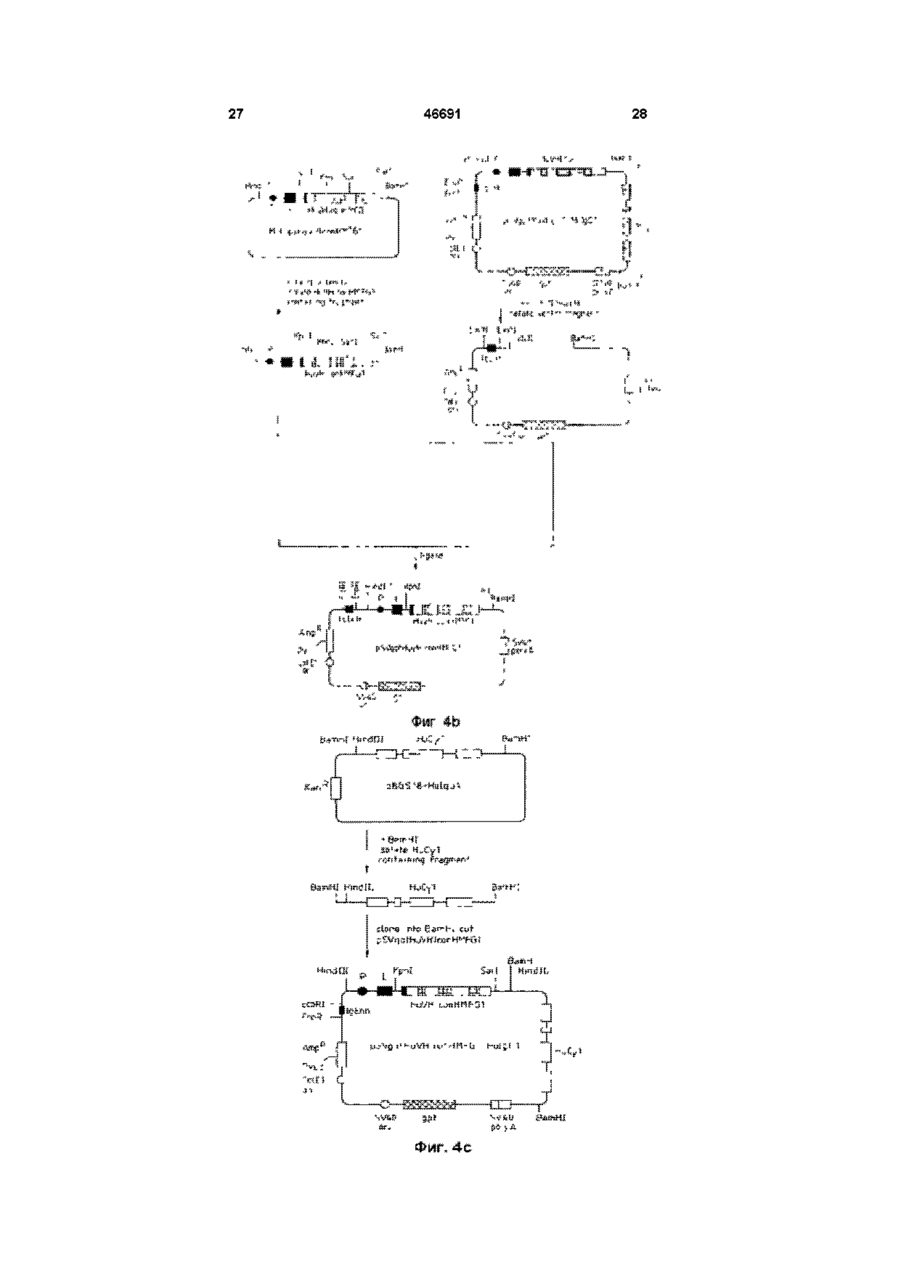
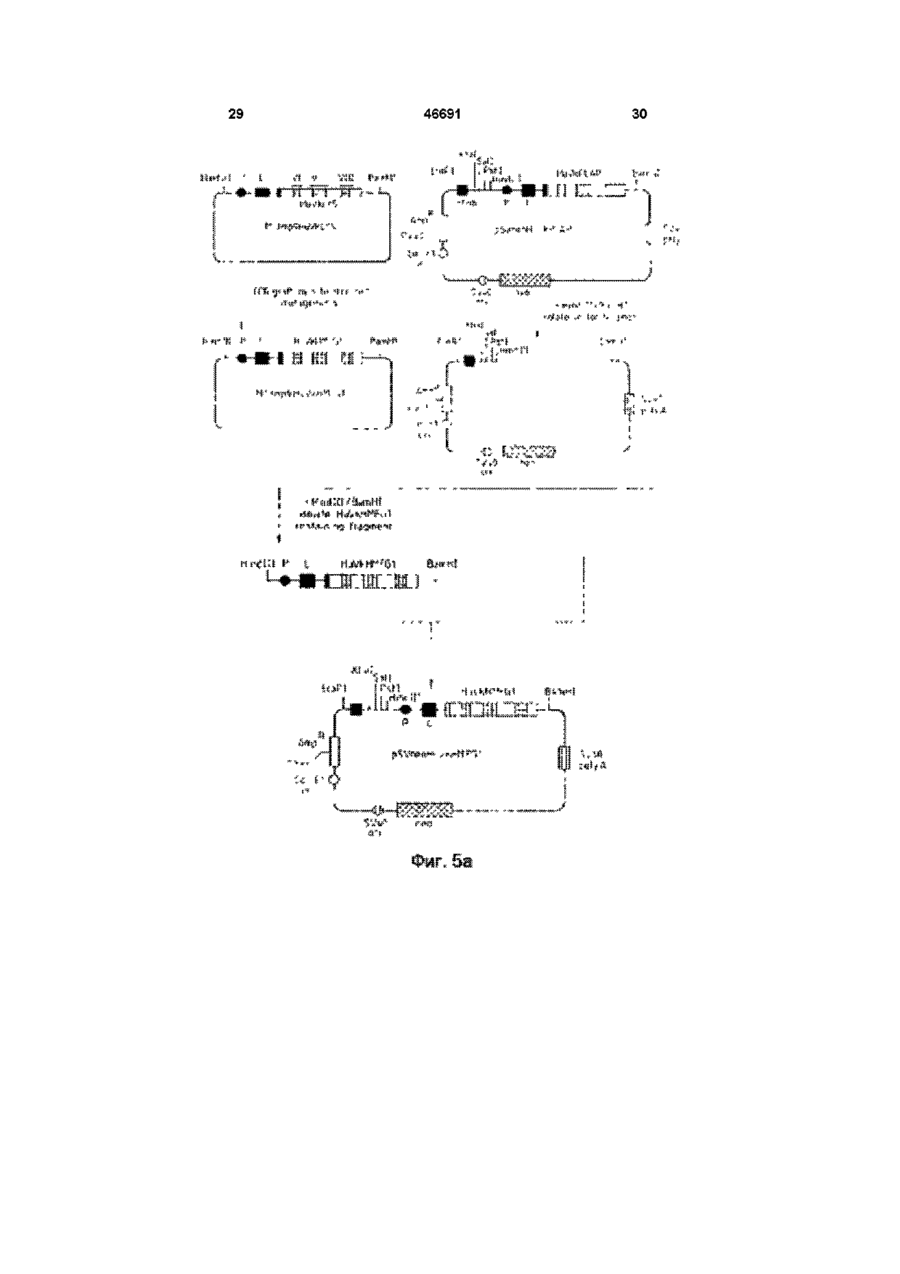
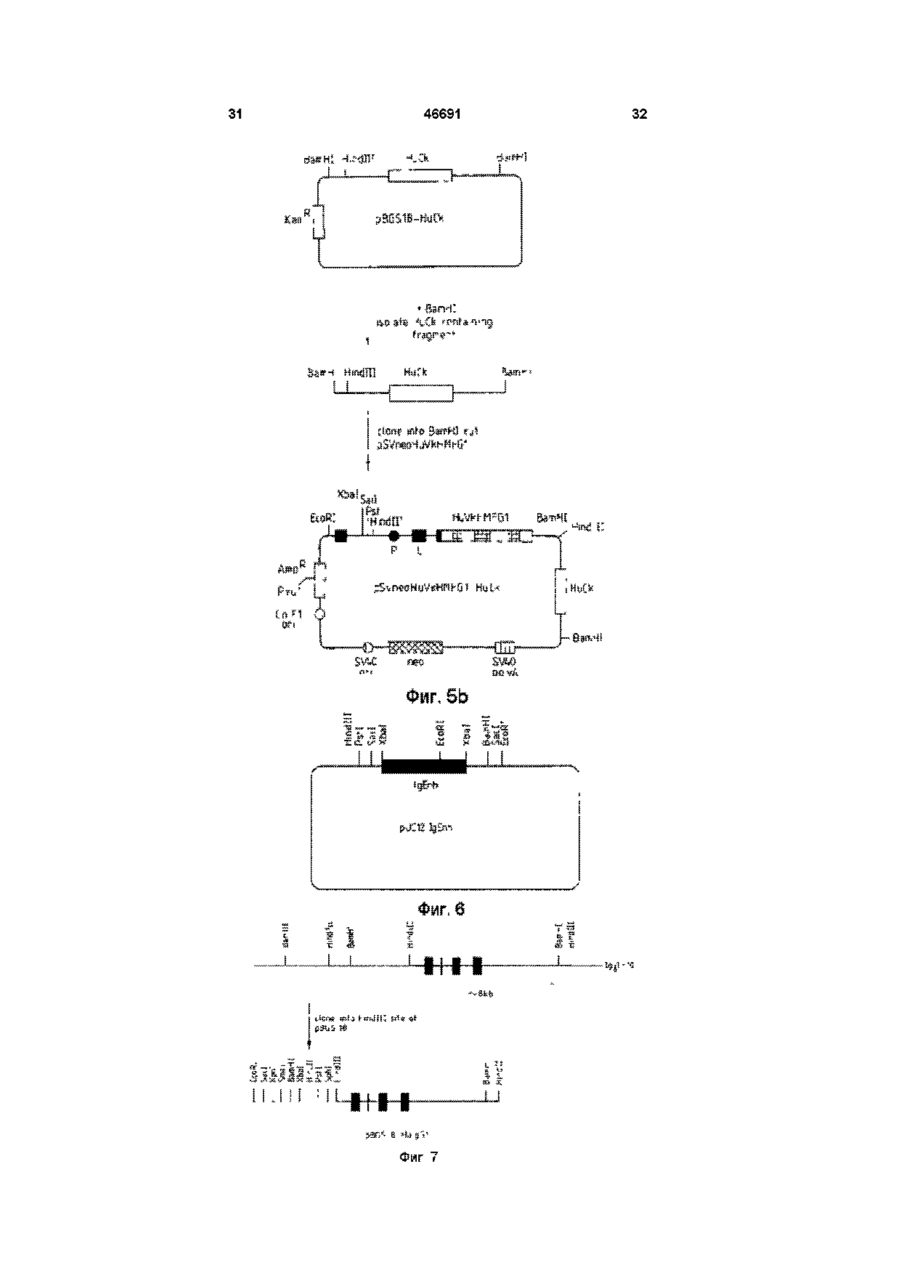
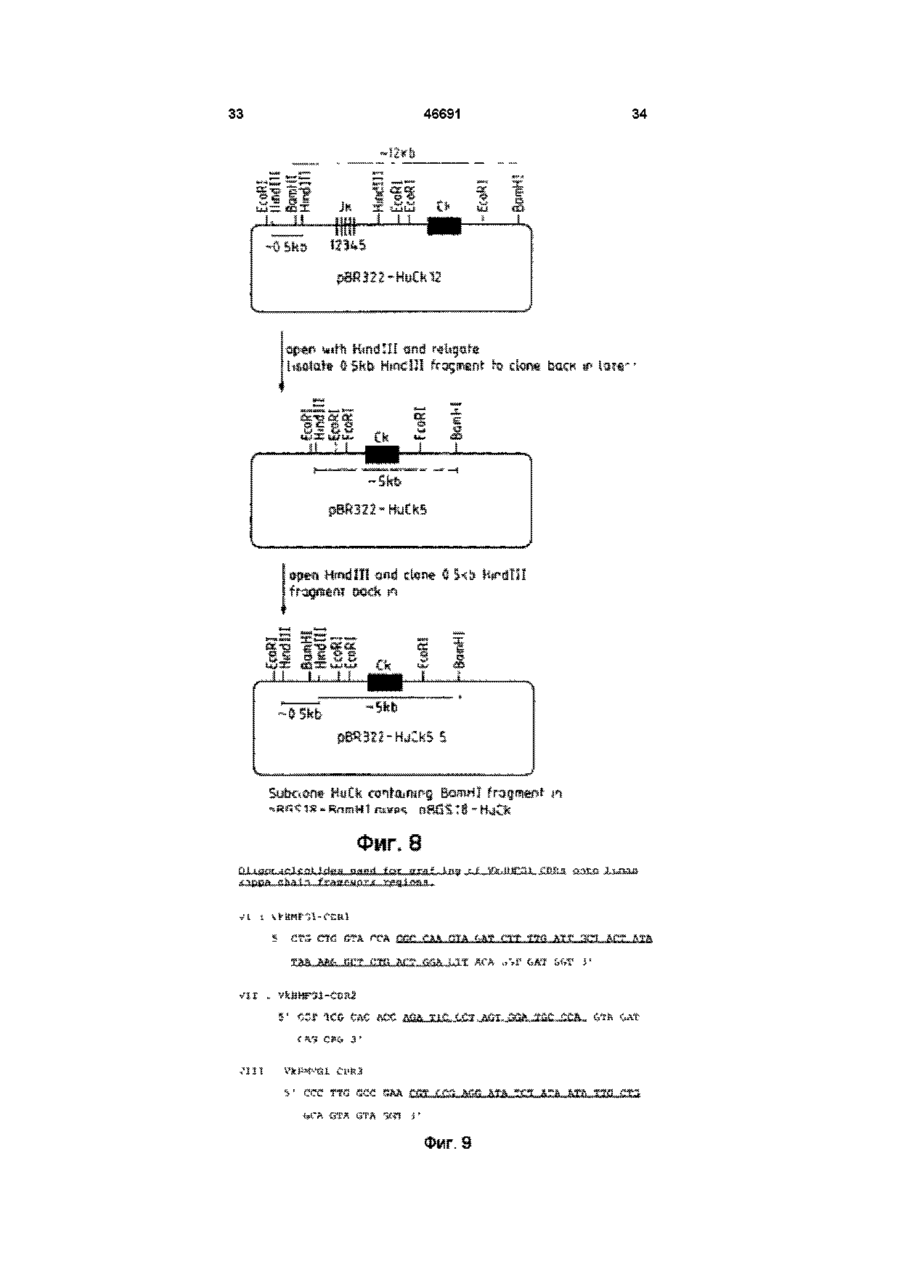
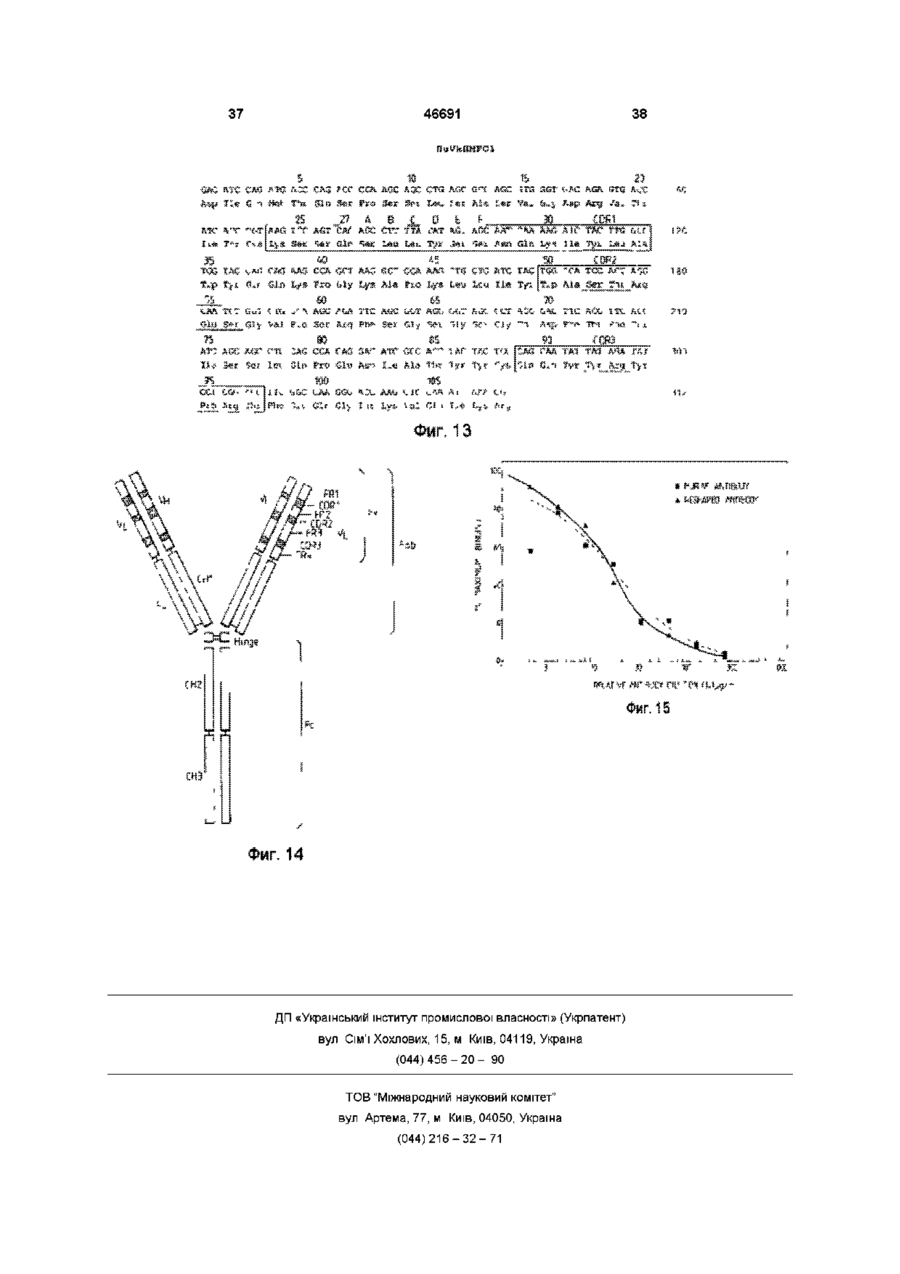
1 Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела, обладающие специфичностью к человеческому полиморфному эпителиальному муцину (РЕМ), в котором указанное видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела содержит (і) по меньшей мере одну переменную область тяжелых цепей, содержащую следующие три CDR CDR1:AlaTyrTrpl!eGlu CDR2: Glu lie Lsu Pro Gly Ser Asn Asn Ser Arg Tyr Asn Glu Lys Phs Lys Gly CDR3: Ser Tyr Asp Phe Ala Trp Phe Ala Tyr и (м) по меньшей мере одну переменную область легких цепей, содержащую следующие три CDR CDR1: Lys Ser Ser Gin Ser Leu Leu Tyr Ser Ser Asn Gin Lys lie Tyr Leu Ala CDR2; Trp Ala Ser Thr Arg Glu Ser CDR3. Gin Gin Tyr Tyr Arg Tyr Pro Arg Thr. 2 Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по п 1, где указанное видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела является одноцепочечным антителом 3 Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по п 1, имеющие по меньшей мере одну переменную область тяжелых цепей, содержащую всю последовательность аминокислот Gin Val Gin Leu Val Gin Ser Gly Aia Glu Val Lys Lys Pro Gly Ala Ser Val Lys Vai Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ala Tyr Trp lie Giu Trp Val Arg Gin Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Glu H Leu Pro Gly e Ser Asn Asn Ser Arg Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Val Thr Arg Asp Thr Ser Thr Asn Thr Ala Tyr Met Gtu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Tyr Asp Phe Aia Trp Phe Ala Tyr Trp Gly Gin Gly Thr Leu Val Thr Val Ser Ser 4 Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по п 1, имеющие по меньшей мере одну переменную область легких цепей, содержащую всю последовательность аминокислот Asp lie Gin Met Thr Gin Ser Pro Ser Ser Leu Ser Ala Ser Val Giy Asp Arg Val Thr ile Thr Cys Lys Ser Ser Gin Ser Leu Leu Tyr Ser Ser Asn Gin Lys He Tyr Leu Ala Trp Tyr Gin Gin Lys Pro Gly Lys Aia Pro Lys Lsu Leu lie Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val Pro Ser Arg Phe Ser Giy Ser Giy Ser Giy Thr Asp Phe Thr Phe Thr !!e Ser Ser Leu Gin Pro Gilt Asp He Ala Thr Tyr Tyr Cys Gin Gin Tyr Tyr Arg Tyr Pro Arg Thr Phe Giy Gin Giy Thr Lys Vai Giu He Lys Arg 5 Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по любому из предшествующих пунктов, где РЕМ представляет собой шарики жира человеческого молока (HMFG) 6 Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по любому из предшествующих пунктов, обладающие специфичностью, эквивалентной специфичности гамма-1, каппа анти-HMFG моноклонального антитела "HMFG1" 7 Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по любому из предшествующих пунктов, имеющие по меньшей мере одну наименьшую переменную область тяжелых цепей, содержащую полную последовательность аминокислот Gin Vai Gin Leu Vai Gin Ser Giy Ala Giu Val Lys Lys Pro Giy Ala Ser Vai Lys Vai Ser Cys Lys Ala Ser Giy Tyr Thr Phe Ser Ala Tyr Trp lie Glu Trp Val Arg Gin Aia Pro G!y Lys Gly Leu Glu Tip Vai Gly Glu lie Leu Pro Giy Ser Asn Asn Ser Arg Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Val Thr Arg Asp Thr Ser Thr Asn Thr Aia Tyr Met Gtu Leu Ser Ser Leu Arg Ser Glu Asp Thr Afa Val Tyr Tyr Cys Ala Arg Ser Tyr Asp Phe Ala Trp Phe A!a Tyr Trp Giy Gin Giy Thr Leu Vai Thr Vai Ser Ser и имеющие по меньшей мере одну наименьшую переменную область легких цепей, содержащую О (О (О 46691 полную последовательность аминокислот Asp lie Gin Met Thr Gin Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Vai Thr lie Thr Cys Lys Ser Ser Gin Ser Leu Leu Tyr Ser Ser Asn Gin Lys He Tyr Leu Ala Trp Tyr Gin Gin Lys Pro Gly Lys Ala Pro Lys Leu Leu Ite Tyr Trp Ala Ser Thr Arg Glu Ser Giy Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr lie Ser Ser Leu Gin Pro Glu Asp lie Ala Thr Tyr Tyr Cys Gin GJn Tyr Tyr Arg Tyr Pro Arg Thr Phe Gly Gin Gly Thr Lys Val Glu lie Lys Arg 8 Видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела по любому из пунктов 1-7, связанные с агентом или включающие в себя агент, способный задерживать или прекращать рост раковых клеток, или связанные с агентом, который можно обнаруживать внутри тела человека 9 Конструкция ДНК, о т л и ч а ю щ а я с я тем, что кодирует переменную область тяжелых цепей видоизмененного человеческого антитела, как указано в любом из пп 1-8 10 Конструкция Д Н К по п 9, о т л и ч а ю щ а я с я тем, что эта конструкция включает нуклеотидную последовательность сад gtg сад ctg gig сад tct ggg gca gag gtg aaa aag cct ggg gcc tea gtg aag gig tec іде aag get tct ggctecace tic agt gcc tac tgg ata gag tgg gtg еде сад get cca gga aag ggc etc gag tgg gtc gaa gag ай tta cct gga agt aat aat tct ада tac aat gag aag ttc aag ggc cga gtg аса gtc act ада дас аса tec аса аас аса gcc tac atg gag etc age age ctg agg tct gag дас аса gcc gtc tat tac tgt gca ада tec tac gac ttt gcc tgg tti get tac tgg ggc caa ggg act ctg gtc аса gtc tec tea 11 Конструкция ДНК по п 9 или 10, о т л и ч а ю щ а я с я тем, что включает нуклеотидную последовательность, содержащуюся в депонированном штамме Е coh NCTC 12411 12 Конструкция ДНК, о т л и ч а ю щ а я с я тем, что кодирует переменную область легких цепей видоизмененного человеческого антитела, как определено в любом из пп 1-8 13 Конструкция Д Н К по п 12, о т л и ч а ю щ а я с я тем, что содержит полную нуклеотидную последовательность gac ate сад atg асе сад age cca age age ctg age gcc age gtg ggt дас ада gtg асе ate асе tgt aag tec agt сад age ctt tta tat agt age aat caa aag ale tac ttg gcc tgg tac сад сад aag cca ggt aag get cca aag ctg ctg ate tac tgg gca tec act agg gaa tct ggt gtg cca age ада ttc age ggt age ggt age ggt ace gac ttc ace ttc ace ate age age etc сад cca gag gac ate gcc aec tac tac tgc сад caa tat tat ада tat cct egg acg ttc ggc caa ggg ace aag gtg gaa ate aaa cgt 14 Конструкция Д Н К по п 12 или 13, о т л и ч а ю щ а я с я тем, что включает нуклеотидную последовательность, содержащуюся в депонированном штамме Е coh NCTC 12412 15 Конструкция Д Н К по любому из пп 9-14, о т л и ч а ю щ а я с я тем, что включает нуклеотидные последовательности і) gcc tac tgg ata gag li) gag att tta cct gga agt aat aat tct aga tac aat gag aag ttc aag gcg HI) tec tac gac ttt gcc tgg ttt get tac iv) aag tec agt cag age ctt tta tat agt age aat caa aag ate tacttggcc v) tgg gca tec act agg gaa tct vi) cag caa tat tat aga tat cct egg acg 16 Конструкция Д Н К по любому из пп 9-15, о т л и ч а ю щ а я с я тем, что включает нуклеотидные последовательности cag gtg сад ctg gtg сад tct ggg gca gag gtg aaa aag cct ggg gcc tea gtg aag gtg tec tgc aag get tct ggc tac ace ttc agt gcc tac tgg ata gag tgg gtg еде сад get cca gga aag ggc etc gag tgg gtc gaa gag att tta cct gga agt aat aat tct aga tac aat gag aagttcaag ggc cga gtg аса gtc act ада дас аса tec аса аас аса gcc tac atg gag etc age age ctg agg tct gag gac аса gcc gtc tat tac tgt gca aga tec tac gac ttt gcc tgg ttt get tac tgg ggc caa ggg act ctg gtc аса gtc tec tea Настоящее изобретение относится к специфическим связующим и, в частности, к полипептидам, содержащим последовательности оснований аминокислот, которые специфически связываются с другими белковыми или небелковыми материалами В частности, изобретение касается получения таких специфических связующих с помощью генной инженерии Структура антитела Молекулы естественного антитела состоят из двух идентичных полипептидов тяжелой цепи и двух идентичных полипептидов с легкой цепью, которые обычно ковалентно соединены дисульфидными связями На фиг 4 схематически изображена типичная структура антитела класса IgG каждая из цепочек свернута в несколько дискретных доменов N-концевые домены из всех цепей имеют переменную последовательность и поэтому называются переменными областями (Vобластями) V-области одной тяжелой (VH) и одной легкой (VL) цепи связаны между собой, образуя участок связывания антигена Модуль, образованный объединенными доменами VH и VL, называется переменным Фрагментом (Fv) антитела С-концы тяжелых и легких цепей имеют более постоянную последовательность и поэтому называются постоянными областями Постоянные области тяжелых цепей состоят из нескольких доменов, например постоянная область тяжелой цепи гамма-изотипа (IgG) состоит из трех доменов (СН1, СН2, СНЗ) и замковой области, которая соединяет домены СН1 и СН2 Замки этих двух тяжелых цепей ковалентно соединены между собой дисульфидными мостиками Легкие цепи имеют один постоянный домен, который плотно прилегает к домену СН1 Постоянные области молекулы антитела участвуют в выполнении таких функций эффектора как комплементный лизис и очистка Клеточной Цитотоксичностью, Зависящей от Антител (ADCC) Классическая ферментация антитела папаином протеазы дает три фрагмента Один фрагмент содержит домены СН2 и СНЗ и, поскольку он легко кристаллизуется, то его назвали фрагментом Fc Другие два Фрагмента получили название Fab фрагментов gac ate cag atg ace cag age cca age age ctg age gcc age gtg ggt gac aga gtg ace ate ace tgt aag tec agt cag age ctt tta tat agt age aat caa aag ate tac ttg gee tgg tac сад сад aag cca ggt aag get cca aag ctg ctg ate tac tgg gca tec act agg gaa tct ggt gtg cca age agattcage ggt age ggt age ggt aec gac ttc ace ttc ace ate age age etc cag cca gag gac ate gcc ace tae tac tgc cag caa la! tat aga tat cct egg acgttcggc caa ggg ace aag gtg gaa ate aaa cgt (связывающих антигены), они идентичны и содержат всю легкую цепь в сочетании с VH и 46691 доменом СН1, При использовании пепсина протеолитичесное расщепление таково, что два Fab остаются соединенными замком и образуют Фрагмент (Fab) Каждый из доменов представлен отдельным экзоном на генетическом уровне Каждая из переменных областей содержит по 3 кластера гиперпеременных остатков в рамках более постоянных последовательностей Эти гиперпеременные области взаимодействуют с антигеном и называются Областями, Определяющими Комплементарность (CDR) Более постоянные последовательности называются Рамочными Областями (FR), см Kabat et al (1987) Рентгенография антител показала, что CDR образуют петли, выходящие из верхней части молекулы, в то время как FR образуют структурную бета-пластовую рамку Модифицированные антитела В соответствии с одним вариантом своего осуществления настоящее изобретение относится к так называемым "видоизмененным" или "переделанным" антителам человека, то есть к иммуноглобулинам, имеющим по существу человеческие постоянные и рамочные области, но в которых области, определяющие комплементарность (CDR) соответствуют областям, обнаруженным в нечеловеческом иммуноглобулине, а также соответствующим видоизмененным фрагментам антител Общие принципы получения таких видоизмененных человеческих антител и фрагментов в настоящее время хорошо известны, см Jones et al (1986), Riechmann et al (1988), Verhoeyen et al (1988), EP-A-239400 (Winter) Подробный перечень соответствующих ссылок приведен ниже Видоизмененные человеческие антитела и фрагменты особенно полезны при диагностике и лечении болезней человека in vivo, поскольку основные белки в организме человека менее склонны к индуцированию отрицательных реакций при введении в организм человека, а необходимая специфичность, придаваемая CDR, может быть выращена в организме животного-носителя, например мыши, из которой затем легче получить антитела с выбранной специфичностью Гены переменных областей могут быть клонированы из антитела против белка человека, a CDR трансплантированы в рамку переменной области с использованием метода генной инженерии для получения видоизмененного человеческого антитела или фрагмента Для достижения такого результата необходимо идентифицировать и последовательно расположить меньшей мере CDR в выбранное нечеловеческом антителе против белка человека, а также предпочтительно всю последовательность переменной области для того, чтобы идентифицировать потенциально важные взаимодействия между CDR и рамкой Антитела, полученные к шарикам жира человеческого молока (HMFG), обычно в делипидированном состоянии, могут отличаться широким спектром реактивности по отношению к неоплазмам эпителиального происхождения, в частности к раку груди, яичника, матки и легких, см Taylor-Papadimitnou et al (1981) и Arkhe et al (1981) Известно одно хорошо описанное антитело, обозначаемое HMFG1, которое связывается с компонентом HMFG, обнаруживаемым в некоторых тканях тела, некоторых раковых тканях и в моче, это антитело получило наименование полиморфного эпителиального муцина (РЕМ), см Gendler et al, 1988 Считается, что связывание охватывает пептидное ядро РЕМ Соответствующая полезная специфичность может быть достигнута выращиванием антител на раковых клетках, например на клетках рака груди В документе ЕР-А2-0369816 (The University of Melbourne, Xing et al) описаны мононлональные антитела, специфичные для человеческого полиморфного эпителиального муцина, которые связываются с определенной последовательностью оснований аминокислот, в документе EP-H2-03698I6 предлагается "гуманизировать" описанные антитела по методу Riechmann et a I (1988) Однако, Xing et a 1 не описывают практического получения таких видоизмененных анти-РЕМ антител В соответствии с одним вариантом осуществления настоящего изобретения предлагается синтетический специфический полиморфный эпителиальный муцин (РЕМ) и, в частности, синтетический специфический связующий полипептид, обладающий антиспецифичностью относительно шариков жира человеческого молока (HMFG), содержащий одну или более CDR, изображенных на фиг 1 и 2 Под термином "синтетический" понимается, что полипептид получают по технологии реномбинанта ДНК и по меньшей мере в атом смысле он отличается от естественно возникающего или естественно индуцированного специфического связующего, имеющего идентичную специфичность Альтернативно, синтетический полипептид был получен путем искусственной сборки последовательности оснований аминокислот для получения новой молекулы или молекулы, идентичной естественной Синтетический полипептид может быть эквивалентным целому обычному антителу, или эквивалентным многоцепочечному или одноцепочечному фрагменту такого антитела, или может просто представлять собой материал, включающий в себя одну или более последовательностей, придающих необходимую специфическую связующую способность В соответствии с важным вариантом осуществления настоящего изобретения предлагается видоизмененное человеческое антитело, или видоизмененный фрагмент человеческого антитела, обладающий анти-РЕМ специфичностью и, в частности, имеющий антиHMFG специфичность, и содержащий одну или более CDR, изображенных на фиге 1 и 2 Предпочтительно видоизмененное антитело или Фрагмент по настоящему изобретению содержит все 3 CDR, показанные на фиг 1, в рамках переменной области тяжелых цепей человека, альтернативно или дополнительно, видоизмененное антитело или фрагмент по настоящему изобретению содержит все 3 CDR, 46691 показанные на фиг 2, в рамках переменной области легких цепей человека Еще один вариант осуществления настоящего изобретения представляет собой видоизмененное антитело или видоизмененный Фрагмент антитела, содержащий белковую последовательность оснований, показанную на фиг 12 и (или) на фиг 13 Другие важные варианты осуществления настоящего изобретения представляют собой вектор экспрессии, включающий в себя последовательность оснований ДНК, показанную на фиг 12 и (или) фиг 13, а также вектор экспрессии, включающий в себя последовательность оснований ДНК, кодирующую одну или более белковых последовательностей, обозначенных CDR на фиг 1 и (или) фиг 2 Важным аспектом настоящего изобретения является стабильная линия клеток носителя, содержащая посторонний ген, который заставляет линию клеток носителя вырабатывать специфическое связующее по настоящему изобретению Это может быть стабильная линия клеток носителя, содержащая посторонний ген, который кодирует по меньшей мере одну из последовательностей аминокислотных оснований, обозначенных CDR на фиг 1 и (или) на фиг 2, вместе с белковой рамкой, которая дает возможность закодированной последовательности аминокислотных оснований Функционировать в качестве CDR, обладающей специфичностью по отношению к HMFG В соответствии с настоящим изобретением предлагается также бессмертная линия клеток млекопитающего, или дрожжи, или другая эукариотная клетка, или пронариотная клетка такая как бактерия, вырабатывающая видоизмененное антитело или фрагмент по настоящему изобретению Еще один важный аспект настоящего изобретения заключается в синтетическом специфическом связующем, видоизмененном человеческом антителе или видоизмененном фрагменте человеческого антитела, обладающем специфичностью, эквивалентной специфичности гамма-1, каппа анти-HMFG моноклокального антитела "HMFG1" В соответствии с настоящим изобретением предлагаются также две новых плазмиды, pSVgptHuVHHMFG1-HulgG1 и pSVneo-HuVkHMFGIHuCk, эти плазмиды можно использовать при получении синтетического специфического связующего, видоизмененного человеческого антитела или видоизмененного фрагмента человеческого антитела Эти плазмиды содержатся в новых штаммах Е coll NCTC 12411 и NCTC 12412 соответственно Другими аспектами настоящего изобретения являются а) Последовательность оснований ДНК, кодирующая переменную область тяжелых цепей видоизмененного человеческого антитела, обладающая специфичностью по отношению к HMFG, и содержащаяся в Е coh NCTC 12411 б) Последовательность оснований ДНК, кодирующая переменную область легких цепей 8 видоизмененного человеческого антитела, обладающую специфичностью по отношению к HMF6, и содержащаяся в Е coh NCTC 12412 в) Переменная область тяжелых цепей видоизмененного человеческого антитела, обладающая специфичностью по отношению к HMFG, и получаемая с помощью вектора экспрессии, содержащегося в Е coh NCTC 12411 г) Переменная область легких цепей видоизмененного человеческого антитела, обладающая специфичностью по отношению к HMFG, и получаемая с помощью вектора экспрессии, содержащегося в Е coh NCTC 12412 д) Видоизмененное человеческое антитело или видоизмененный Фрагмент человеческого антитела, содержащие по меньшей мере одну переменную область по пунктам в) или г) Следовательно, конкретный вариант осуществления настоящего изобретения представляет собой видоизмененное человеческое антитело или видоизмененный фрагмент человеческого антитела, обладающие анти-HMFG специфичностью и включающие в себя комбинацию из CDR (которые могут быть например клонированы из мышиного анти-HMFG иммуноглобулина), имеющих последовательности аминокислотных оснований, обозначенных соответственно CDR1, CDR2 и CDR3 на фиг 1 и 2, которые соответственно представляют переменную область тяжелых цепей (VH) и переменную область легких цепей (Vk) мышиного анти-HMFG моноклинального антитела, которые авторы клонировали и расположили в последовательности В случае целого антитела или фрагмента, содержащего по меньшей мере одну переменную область тяжелых цепей и по меньшей мере одну переменную область легких цепей, видоизмененное антитело или фрагмент предпочтительно содержит все шесть CDR из источника кроме человека, для более эффективного осуществления связывания, CDR должны быть предпочтительно расположены относительно друг друга таким же образом как это происходит в оригинальном нечеловеческом антителе, например VH CDR должны быть в человеческой VH рамке и втом порядке в котором они естественно возникают в нечеловеческом антителе Для специалистов в данной области техники очевидно, что последовательности CDR и окружающие рамочные последовательности могут подвергаться модификациям и изменениям без существенного снижения специфической связывающей способности Такие модификации и изменения могут быть либо на генетическом уровне, либо в последовательности аминокислотных оснований, либо и там и там Соответственно, настоящее изобретение охватывает синтетические с видоизмененные) антитела и фрагменты, Функционально эквивалентные описанным в настоящем описании и имеющим точно очерченные генетические или аминокислотные последовательности Настоящее изобретение можно также применять при получении би-специфических антител, имеющих две части Fab различной 46691 специфичности, и в которых одна из специфичности образована видоизмененной человеческой переменной областью цепей, включающей в себя одну или более CDR, показанных на фиг 1 и 2 Настоящее изобретение можно также применять при получении так называемых одноцепочечных антител (см например Genex EPА-281604), а также для антител, связанных с полисахаридами (см Hybntech EP-A-315456), и других модифицированных антител Можно использовать любые человеческие постоянные области (например типа гамма 1,2,3 или 4) Фрагментами антител, сохраняющими полезные специфические связывающие свойства, могут быть фрагменты (Fab), Fab, Fv, VH или Vk Эти Фрагменты могут быть произведены из целого видоизмененного антитела, например путем протеазного усвоения, или по методу генной инженерии Важным аспектом настоящего изобретения является видоизмененное человеческое антиHMFG антитело или его фрагмент, как указано выше, соединенные с агентом, способным задерживать или прекращать рост раковых клеток, или содержащие этот агент, или с визуализирующим агентом, который можно обнаруживать внутри тела человека Настоящее изобретение также включает в себя инъецируемые составы, содержащие какую-либо из таких комбинаций в фармацевтически приемлемом носителе, например в физиологическом растворе, плазмоэа-мвнителе или липосомах Настоящее изобретение также включает в себя применение, в методе терапии или визуализации рака у человека, видоизмененного человеческого анти-HMFG антитела или его Фрагмента как описано выше Кроме того, настоящее изобретение включает в себя использование такого антитела или фрагмента для изготовления медикамента для терапевтического применения при ослаблении рана у людей, или использование такого антитела или Фрагмента при изготовлении диагностического состава для диагностики in vivo у людей Область Fc антитела, которая сама использует имеющиеся в теле пути и механизмы, такие как комплементный лизис и зависящая от антитела клеточная цитотоксичность, может быть использована для отрицательного воздействия на рост раковых клеток В этом варианте осуществления изобретения с видоизмененным антителом не нужно связывать никакой дополнительный реактив Примеры агентов, способных отрицательно воздействовать на рост раковых клеток, включают в себя такие радиоизотопы как иттрий 90 и йод 131, такие лекарства как метотренсат, такие токсины как рицин или его части, а также Ферменты, которые могут превратить неактивное лекарство в активное в месте связывания антитела Примеры визуализирующих агентов включают в себя такие изотопы, генерирующие гамма-лучи, 10 как индий 111 и технеций 99, такие радиоизотопы, генерирующие позитроны, как медь 64, а также такие пассивные агенты как барий, действующие как контрастные вещества для рентгеновских лучей, а также гадолиний при ЯМР/ЭСР сканировании Для сцепления такого металлического вещества как радиоизотоп со специфическим связующим по настоящему изобретению может потребоваться применение фактора сопряжения или компенсирующего агента Создано множество подходящих компенсирующих агентов, см например патенты США 4824986, 4831175, 4923985 и 4622420 Методики использования компенсирующих агентов описаны например в патентах США 4454106, 4722892, а также в работах Мої et al (1988), McCall et al (1990), Deshpande et al (1990) и Meares et al (1990) Использование радиомеченых антител и фрагментов при визуализации и терапии рака человека описано например в документе ЕР 35265 Может оказаться полезным использовать радиомеченое антитело или фрагмент, обладающие специфичностью к раку, в сочетании с неспецифическим агентом, помеченным другим изотопом, для создания контрастного фона при так называемой визуализации вычитанием Реагенты антител по настоящему изобретению можно использовать для идентифицирования, например путем сывороточной пробы или визуализации и (или) для лечения РЕМ-продуцирующих видов рака Такие виды рана могут возникать например в виде рака груди, яичника, матки и легких, или могут проявляться в качестве таких жидкостей как плевральные выпоты Получение модифицированного антитела Те части областей VH и VL, которые обычно (Kabat, I987) обозначают как CDR, не могут являться единственными признаками, которые необходимо перенести из нечеловеческого моноклонального антитела Иногда улучшенные характеристики антитела в смысле специфичности и (или) сродства могут быть получены в видоизмененном человеческом антителе, если в видоизмененном человеческом антителе сохраняются определенные нечеловеческие рамочные последовательности Цель состоит в том, чтобы сохранить важную трехмерную структуру белка, связанную с CDR, которая поддерживается контактами с остатками рамки Обычным отправным пунктом, с которого начинается получение видоизмененного антитела по настоящему изобретению, является клетка (предпочтительно бессмертная клеточная линия), полученная от животного-носителя (например мыши), которая представляет собой антитело, обладающее специфичностью против HMFG или РЕМ Такая клеточная линия может представлять собой например гибридомную клеточную линию, полученную по обычной технологии моноклонального антитела Янтитело предпочтительно' обладает высоким сродством и высокой специфичностью по отношению к HMFG, поскольку следует ожидать того, что некоторая 11 46691 12 потеря сродства и (или) специфичности может использующих вектор или векторы экспрессии, и в возникнуть при переносе этих свойств на последующем культивировании человеческое антитело или фрагмент при трансформированной клеточной линии или использовании методик по настоящему организма для получения видоизмененного изобретению За счет выбора человеческого антитела или фрагмента высокоспецифичного антитела в качестве Далее в настоящем описании в качестве родительского повышается вероятность того, что примера подробно даны этапы, с помощью конечное видоизмененное антитело или фрагмент которых можно получить соответствующие будут также проявлять хорошие связующие векторы экспрессии Работа с материалом ДНК в свойства соответствующим образом оборудованной лаборатории является сейчас хорошо Следующий этап представляет собой разработанной практикой, и специалисты в данной клонирование кДНК из клетки, выражающей области хорошо знакомы с необходимыми для признаки выбранного нечеловеческого антитела, этого методиками У поставщиков лабораторных составление последовательности и материалов можно приобрести различные идентификацию генов переменной области, библиотеки геномов и кДНК, плазмиды, включающих в себя последовательности, ограничивающие ферменты, а также различные кодирующие CDR Применяемые реактивы и среды, необходимые для таких работ экспериментальные методики можно Например, библиотеки геномов и кДНК можно рассматривать как обычные в данной области приобрести у фирмы Clontech Laboratories Inc техники, хотя они все еще являются трудоемкими Приведенные ниже этапы даны лишь в качестве Если цель состоит в том, чтобы получить руководства для читателя настоящего описания, и видоизмененное завершенное человеческое настоящее изобретение ни в коем случае не антитело, или по меньшей мере Фрагмент такого зависит от наличия одного или более антитела, который будет содержать как тяжелые специальных исходных материалов На практике так и легкие переменные домены, то необходимо опытный специалист имеет для своего выбора составить последовательность кДНК, связанной с широкий диапазон материалов и может обоими этими доменами использовать и адаптировать описанную в После того как выполнен анализ литературе технологию, применяя накопленный соответствующей последовательности или опыт и материалы, которые можно очень легко последовательностей кДНК, необходимо получить достать в научной среде Например, многие один или более воспроизводимых векторов плазмиды попадают в эту категорию они экспрессии, содержащих последовательность настолько широко применяются и распространены ДНК которая кодирует по меньшей мере среди ученых, что теперь их можно рас-матривать переменный домен антитела, этот переменный как обычные материалы домен содержит человеческие рамочные области, а также одну или более CDR, производные от Ниже приведено, в качестве примера, выбранного нечеловеческого анти-HMFG подробное описание методики, используемой для антитела Последовательность ДНК в каждом получения видоизмененных анти-HMFG векторе должна включать в себя соответствующие человеческих антител со ссылкой на прилагаемые регуляторные последовательности, необходимые рисунки, на которых для обеспечения эффективной транскрипции и Фиг 1 - кодирование последовательности трансляции гена, в частности последовательности кДНК для переменной области мышиных тяжелых стимулятора и лидера, оперативно связанной с цепей, обладающей анти-HMFG специфичностью, последовательностью переменного домена В показаны 3 классические CDR, а также типичной методике получения видоизмененного последовательность аминокислотных оснований, антитела или Фрагмента по настоящему соответствующая коду кДНК изобретению может понадобиться получить два Фиг 2 - кодирование последовательности таких вектора экспрессии - один содержащий кДНК для переменной области мышиных легких последовательность ДНК для видоизмененной цепей, обладающей анти-HMFG специфичностью человеческой легкой цепи, и другой, содержащий Фиг За схема синтетического последовательность ДНК для видоизмененной видоизмененного человеческого VH гена со человеческой тяжелой цепи Векторы экспрессии специфичностью HMFG1 (генная кассета должны обладать способностью к HuVHIconHMFGI), содержащего 3 фрагмента трансформированию выбранной клеточной линии, Фиг За и 36 последовательность в которой будет происходить получение соответствующих фрагментов по фиг За, а также видоизмененного антитела или фрагмен-та Такая олигонуклеотиды, используемые при сборке клеточная линия может например представлять каждого фрагмента собой стабильную непроизводящую клеточную Фиг 4а, 46 и 4в - маршрутная карта получения линию миеломы, примеры которой (такие как NSO вектора экспрессии, кодирующего и sp2-0) можно свободно приобрести, видоизмененную человеческую тяжелую цепь, альтернативно можно использовать такие включающую в себя CDR по Фиг 1 бактериальные системы как Е coh в качестве Фиг 5а и 56 - подобная маршрутная карта носителя экспрессии для видоизмененного трансформирования для получения вектора антитела или фрагмента Окончательные стадии экспрессии, кодирующего видоизмененную методики заключаются в трансформировании человеческую легкую цепь, включающую в себя выбранной клеточной линии или организма, CDR по фиг 2 13 Фиг 6 - плазмида pUCI2-lgEnh, содержащая последовательность гена-усилителя, используемую в маршрутных картах по фиг 4а 56 Фиг7 - источник плазмиды pBGS18-HulgG1, используемой в маршрутной карте по фиг 4в Фиг 8 - источник плазмиды pBGS18-HuCk, используемой в маршрутной карте по фиг 56 Фиг 9 - две синтетических олигонунлеотидных последовательности I и II, используемые при клонировании последовательностей кДНК по фиг 1 и 2 Фиг 10 две синтетических олигонуклеотидных последовательности III и IV, используемые для введения ограничивающих участков Крп I и Sal І в M13mp9HuVHLYS соответственно, в маршрутной карте по фиг 4а Фиг 11- три синтетических олигонуклеотидных последовательности VI, VII и VIII, используемые для трансплантации Vk HMFG1 CDR на человеческие рамочные области VK REI в маршрутной карте по фиг 5а Фиг 12 и 13 - последовательности кДНК и аминокислотных оснований полученных видоизмененных человеческих переменных областей тяжелых и легких цепей соответственно Фиг 14 схематическое изображение структуры типичной молекулы антитела (иммуноглобулин) Фиг 15 графическое изображение относительной специфической анти-HMFGI связывающей активности полученного видоизмененного человеческого антитела Экспериментальные методики, необходимые для реализации настоящего изобретения, сами по себе не представляют собой необычной технологии Методики клонирования и мутагенеза выполнялись как описано например в Verhoeyen et al (1988), Riechmann et al (1988) и ЕР-Я-239400 (Winter) Синтез "de novo" видоизмененного человеческого гена с переменной областью тяжелых цепей (фиг За - Зг) был выполнен с помощью обычной методики, с использованием набора длинных перекрывающих олигонуклеотидов (см также Jones et al, 1988) Лабораторное оборудование и реактивы для синтезирования длинных олигонуклеотидов легкодоступны, и по мере того как развиваются методики в этой области, синтезирование все более длинных последовательностей становится осуществимым Имеются подробные лабораторные руководства, охватывающие все главные аспекты рекомбинантной методики ДНК, например Sambrook et al "Molecular cloning" (1989) С помощью настоящего изобретения связывающие антиген области анти-HMFG антитела (HMFG1) мыши были трансплантированы на рамочные области человека Полученное видоизмененное человеческое антитело (HuHMFGi) обладает такими же связывающими характеристиками как исходное антитело мыши Такие видоизмененные антитела можно использовать для диагностики и лечения in vivo рака у человека, например рака матки и груди, 46691 14 ожидается, что эти антитела по меньшей мере уменьшат проблему, связанную с иммунной реакцией больного, которая часто наблюдается после введения нечеловеческого антитела Такие же преимущества показаны для видоизмененного антитела САМРАТН-1 в работе Hale et al (1988) 1 Планирование и определение последовательности генов с переменной областью у мыши ДНК-посланник была отделена от мышиной гибридомной линии, которая секретирует гамма-1, каппа анти-HMFB антитело "HMFG1" (см TaylorPapadimitnou et al, 1981 и Arkhe et al, 1901) Первая нитка кДНК была синтезирована путем первичной обработки олито-нунлеотидами I и II (см фиг 9) комплементарно к 5' концам эгзонов СН1 и Ск соответственно Вторая нитка кДНК была получена как описано в работе Gubler and Hoffmann (1983) Обработанные киназой соединители EcoRI были пришиты к тяжелоцепочечной двухниточной кДНК, а соединители Pst1 - к легкоцепочечной двухниточной кДНК (и та и другая были сначала обработаны метилазой EcoRI или Pst1 для защиты возможных внутренних участков) с последующим клонированном в EcoRI или Pst1разрезанную PUC9 (Vieira et al, 1982) и трансформированием Е coh штамм TGZ (GibSOn, 1984) Колонии, содержащие кодирование генов для мышиной HMFG1 VH (MoVHHMFGI) и для мышиной анти-HMFG VK (MoVkHMFGI), были идентифицированы путем гибридизации колоний с помощью 2 зондов, состоящих соответственно из 32Р-меченой первой нитки кДНК HMFG1 VH и Vfc Позитивные клоны характеризовались получением плазмиды, после чего проводили усвоение EcoRI или Pstl и анализ с помощью 1,5% геля агарозы Полноразмерные вставки (около 45Q пн) были субклони-рованы в участок EcoRI или Pstl в M13mpl8 (Norrander et al, 1983) Это позволило получить клоны со вставками в обеих ориентациях, что облегчает определение нуклеотидной последовательности во всей вставке с помощью метода завершения дидеокси цепи (Sangeretal, 1977) Нуклеотидные последовательности и их трансляция в аминокислотные последовательности генов с областями переменной зрелости MoVHHMFGI и MoVkHMFGI показаны на фиг 1 и 2 Вставки 450пн включали в себя сигнальную последовательность и 5' нетранслированные последовательности и соединители (на фигурах не показано) 2 Трансплантирование мышиных HMFG1 CDR на участки человеческой рамки Необходимые для достижения этого обычные методики очень полно описаны в работе Jones et al (1986), Verhoeyen et al (1988), Riechmann et al (1988), а также в EP-A-2394OO (Winter) а) Легкая цепь Основной конструкцией, используемой для видоизменения человеческой легкой цепи, был M13mp9HuVkl_YS (Riechmann et al, 1988), который содержит рамочные области с последовательностями, основанными на 46691 16 15 рамочных областях переменных областей с использован для замены HuVHLYS в конструкции легкой цепью человеческого протеина ВепсеM13mp9HuVHLS (Verhoeyen et al 1988), в JonesREI (Eppetal, 1974) результате чего получается вектор В этой конструкции CDR (фиг 5а) были M13mp9HuVHIconHMFG1 (фиг 4а) заменены с помощью мес-тонаправленного 3 Сборка видоизмененных генов мутагенеза олигонуклеотидами VI, VII и VIII, человеческого антитела в векторах экспрессии кодирующими HMFG1 каппа цепь CDR, Следующая стадия включала в себя окруженными с боков 12 нуклеотидами (на каждом использование мышиного гена-усилителя с конце, кодирующем соответствующие остатки тяжелой цепью IgEnh, описанного в работе человеческих рамок Эти олигонуклеотиды Neuberger et al (1983), где этот ген-усилитель показаны на фиг 11, мутагенез проводили как содержится в 1 кб Xbal Фрагменте плазмиды psvописано в работе Riechmann et al (1988) Vu1 700 пн Xba1/EeoRI субфрагмент этого Полученный видоизмененный человеческий ген с Фрагмента 1 kb Xbal достаточен для придания переменной областью легкой цепи (HuVkHMFGI) активности гену-усилителю показан на фиг 13 Альтернативным источником этого генаб) тяжелая цепь усилителя является плаз-мида pSVneoHuVkPLAP (фиг 5а), разновидность которой была Видоизмененный человеческий ген с депонирована в штамм Е coh в соответствии с переменной областью тяжелой цепи был получен Будапештским договором 19 апреля 1990 года в с помощью синтеза "de novo" В вышеупомянутых качестве NCTC 12390 В том виде, в котором она экспериментах, опубликованных в работе Jones et была депонирована, эта плазмида также содержит al, CDR грызунов с тяжелой цепью были человеческий ген с постоянной областью каппатрансплантированы на рамочные области цепи (клонированный на участке ВатН1) человеческой переменной области NEW с тяжелой цепью В работах Verhoeyen et al (1988) и Видоизмененные человеческие гены, Riecnmann et al (1988) была показана важность полученные как описано выше в разделах 2(а) и того, что человеческая рамка должна 2(6), были иссечены из векторов М13 в качестве поддерживать CDR грызунов в структуре, фрагментов Hmdlll-BamBHI Гены с переменной подобной той, которая возникает в областью тяжелой цепи были клонированы в первоначальном антителе грызуна, и то, что вектор на основе pSV2gpt (Mulligan et al, 1981), a определенные взаимодействия между CDR и гены с переменной областью легкой цепи были рамкой могут быть критическими Отсюда следует, клонированы в вектор на основе psV2neo что чем более несхожими являются (Southern et al, 1981) векторов экспрессии, причем последовательности рамок грызунов и человека, оба этих вектора содержали иммуноглобулиновыи тем меньше шансов трансплантата CDR на то, ген-усилитель IgEnh с тяжелой цепью В векторе чтобы "быть принятым" экспрессии антитела на основе pSV2gpt (фиг 46 4в), содержащий фрагмент ген-усилитель Сравнение между мышиной Xba1/EcoRI был клонирован в единственный последовательностью аминокислот переменной участок EcoRI вектора pSV2gpt (после области с тяжелой цепью HMFG1 (фиг 1) с лигирования соединителей EcoRI к заполненным человеческой областью NEW (использованное в на конце Xbal фрагмента) работе Verhoeyen et al, 1988) выявило 44% различий между соответствующими рамочными В векторе экспрессии антитела на основе областями Гораздо лучшая гомология была pSVneo (фиг 5а - 56), содержащий фрагмент генобнаружена при сравнении с человеческими усилитель был сначала клонирован в pUC12 переменными областями с тяжелой цепью (Vieira et al, 1982), в результате чего получилась подгруппы I (Kabat et al, 1987), человеческая плазмида pUC12-lgEnh (фиг 6) Затем генVHNEW принадлежит к подгруппе II усилитель может быть вырезан в виде фрагмента 700 пн EcoRI/Hmdlll (при этом подойдет любая Поэтому авторы решили синтезировать ориентация гена-усилителя) Этот фрагмент 700 человеческий ген с переменной областью тяжелой пн EcoRI/Hmdlll присутствует в плазмиде цепи подгруппы I, содержащий CDR с тяжелой pSVneoHuVkPLAP, используемой для цепью (HMFG1) Авторы сконструировали консенсусную последовательность для клонирования фрагмента, содержащего человеческих переменных областей с тяжелой HuVkHMFGI и описанного в разделе 2а, см фиг 5а цепью подгруппы I на основе информации о и 56 Участок Hmdlll в оригинале pSV2gpt был последовательностях этой подгруппы из работы удален Можно использовать pSV2gpt в качестве Kabat el al, 1987 Оптимальное использование альтернативного вектора для экспрессии легкой кодона было взято из последовательностей цепи, поскольку на практике нет необходимости в мышиных генов с постоянной областью (эти гены селекции пео выражены в линии мышиной миеломы) Ген HuVHIconMFGI был соединен с человеческой постоянной областью гамма 1 Существует всего 14% различий между (Takahashi et al, 1982), первоначально рамочными последовательностями HMFGI VH и клонированной в виде фрагмента 8 кб Hmdlll в VH этой человеческой консенсусной последоваучасток Hmdlll pBGS18 (Spratt et al, 1986), а затем тельности VH подгруппы I (Hu VH Icon) в вектор экспрессии pSV2gpt в виде фрагмента Полученный видоизмененный ген был обозначен BamHI (фиг 4в и 7), Следует отметить, что в HuVHIconHMFGI, он изображен на фиг 12, синтез работе Takanashi et al (1982) имеется ошибка на гена отдельно описан ниже в разделе (в) Заново фиг1, последние (З1) два участка представляют синтезированный ген HuVHIconHMFGI был 17 46691 18 собой BamHI, за которыми следует Hindlll, а не олигонуклеотидов, использованных для сборки, наоборот Это подтверждено в работе Flanagan et показаны на фиг 36, Зв и Зг al (1982) Перед сборкой фрагментов концы 5' Ген HuVkHMFI был соединен с человеческой синтетических олигонуклео-тидов приходилось постоянной областью С каппа (Hieter et al, 1980), фосфорилировать для облегчения лигирования также клонированной в виде фрагмента BamHI Фосфорилирование выполняли следующим (фиг 56 и 8) Источник человеческой Ск, образом эквимолярные количества (50 пмоль) используемой на фиг 8, приведен в работе Hieter олигонуклеотидов были сгруппированы и et al (1980) Фрагмент 12kb BamHI из эмбрионной обработаны киназой в 40 мкл реакционного ДНК (клонированный в гамма Сп28 векторной буфера с 8 единицами полинуклеотидной киназы системе) был субклонирован в участке BamHI в течение 30 - 45 минут при температуре 37°С плазмиды PBR322 Реакцию прекращали путем нагревания в течение 5 минут при температуре 70°С и осаждения 4 Синтез "de novo" гена HuVHIconHMFGI этанолом Ренатурацию ДНК производили Авторы решили синтезировать ген, растворением осадка в 30 мкл буфера, кодирующий человеческий ген с переменной содержащего 7мМ TnsC1 pH 7,5, ЮмМ 2областью подгруппы I (Kabat et al, 1987), и с CDR меркапто-этанола, с добавлением 5 мМ АТФ В из VHHMFGI (фиг1) Коротко говоря, следствии смесь помещали в водяную баню при синтетический ген спроектирован таким образом, температуре 65°С на 5 минут, а затем охлаждали что может заменить ген HuVHLYS в имеющемся до 30°С в течение 1 часа MgCI добавляли до векторе M13mp9HuVHLYS Вектор получения окончательной концентрации 10 мМ MI3mp9HuVHLYS был подвергнут мутагенезу для Затем добавляли Т4 ДНК-лигазу и помещали того, чтобы содержать участок Kpnl и Sail в смесь при температуре 37°С на 30 минут (или на соответствующих местах (см также фиг 4а), чтобы ночь при температуре 16°С) После этого позволить клонирование вновь синтезированного реакционную смесь нагревали в течение 10 минут гена в виде Фрагмента Kpnl-Sail при температуре 70°С После осаждения Генная последовательность была этанолом осадок растворяли в сконструирована как описано выше в пункте 2(6) и изображено на фиг 12 Для облегчения замены перерабатывающем буфере и разрезали с этого гена на ген HuVHLYS в Mi3mp9HuVHLYS помощью Hindlll и BamHI Смесь разделяли на 2% (Vemoeyen et al, 1988, см также фиг 4а), к этому агарозном геле, и фрагмент, длина которого гену были добавлены удлинения 5' и 3" соответствует правильно собранной кассете, Удлинение 5' содержит 37 пн главного интрона и отделяли с помощью электроэлюирования 11 пн второй половины главного эгзона (как в Фрагменты (1, 2, 3) лигировали в pEMBL9 M13mp9HuVHLYS), он также имеет участок Kpnl (разрезанном с помощью Hmdlll/BamHI), в на самом конце 5' Удлинение 3' содержит 38 результате чего получали векторы pUR4107, нетранслированных нуклеотидов (как в pUR4108 и pUR4109 соответственно MI3mp9HuVHLYS) и оканчивается участком Sail Последовательность вставок проверяли с помощью последовательного анализа (в обеих M13mp9HuVHLYS был модифицирован ориентациях) Фрагмент 1 отделяли от pUR4107 участконаправленным мутагенезом с помощью путем расщепления с помощью Kpnl/Xhol, a олигонуклеотидов III и IV для того, чтобы фрагмент 2 отделяли от pUR4108 путем содержать участок Kpnl и Sail в соответствующих расщепления с помощью Xhol/Sacl, после чего местах с см фиг 4а и фиг 10) Этот вектор получил они были лигированы в PUR41O9, разрезанном с наименование M13mp9HuVHLYS(K, S) Это помощью Kpnl/Sad, при трехфрагментном позволило клонировать ген HuVHIconHMFGI в лигировании Полученная плазмида получила виде Фрагмента Kpnl-Sall в разрезанном с наименование PUR4110 (см фиг 4а) помощью Kpnl-Sall векторе M13mp9HuVHLYS(K,S) Последовательный анализ показал, что вставка По практическим соображениям было решено содержала нужный ген HuVHIconHMFGI Этот ген синтезировать ген в виде трех фрагментов клонировали в вектор экспрессии, производный от (кассет), которые были затем собраны в один pSV2gpt, как показано на фиг 46 и 4в Вектор завершенный ген pSV2gptMoVHLYS-MolgG1 (Verhoeyen et al, 1988) был использован как источник вектора на основе Каждый фрагмент содержит одну из трех CDR pSVgpt, содержащего ген-усилитель igEnh VHHMFG1 и может быть легко клонирован или удален с использованием имеющихся или заново 5 экспрессия в клетках миеломы введенных уникальных ограничивающих участков Совместное заражение плазмидами (см фиг За) Каждый фрагмент был удлинен на экспрессии pSVgptHuVHIconHMFG1-HulgG1 и конце 5і И 3' для создания участка Hindlll и BamHI pSVneoHuVkHMFG1-HuCk (фиг4в и 56) в клетки соответственно, для того чтобы обеспечить миеломы NSO выполняли с помощью клониро-вание в pEMBL9 (Dente et al, 1983) электропорации (Potter et al, 1984), после Кодирующая нить каждого Фрагмента была линеаризации с помощью Pvul Трансфектомы разделена по олигонуклеотидам со средней выбирали в среде, содержащей микофенольную длиной 33 основания То же было сделано для кислоту, для отбора клеток, выражающих генный некодирующей нити таим образом, что продукт gpt, и отсеивали для получения антител и олигонуклеотиды перекрывались примерно на анти-HMFG активности с помощью биопроб ELISA 50% с олигонуклео-тидами кодирующей нити Были получены и субклонированы путем ограничивающего разбавления клоны, давшие Последовательности каждого фрагмента и 19 46691 20 положительные результаты в обеих пробах, BSA/PBSM (PBS + 0,01 % мертиолат) при чистые клоны были снова подвергнуты пробе на комнатной температуре в течение 1 часа на анти-HMFG активность, и самые лучшие тарелочном вибраторе Небольшие самарийпродуцирующие клоны были выращены в кобальтовые магниты, заделанные в бессывороточной среде для получения антител пластмассовое основание, использовались для осаждения гранул на боковых сторонах 6 Депонированные плазмиды углублений в тарелке для того, чтобы удалить Плазмиды, содержащие штаммы Е coh, и жидкость и осуществить однократную промывку с используемые в вышеприведенной методике, помощью 150 мкл PBSTM (PBSM + 0,15% Tween были депонированы, в соответствии с 20) После этого производили определение положениями Будапештского договора, в связанного антитела с помощью 50мкл национальную коллекцию типов культур II июля соединенной щелочной фосфатазой козлиной IgG 1990 года следующим образом (Н + L) (Jackson) против белка человека, NCTC 12411 К12, TG1 Е coh, содержащая используемой при разбавлении 1/1000 в 1% плазмиду pSVgptHuVHIconHMFG1-HulgG1 с растворе BSA в PBSTM в течение 1 часа при идентифицированная для целей депонирования комнатной температуре Гранулы трехкратно просто как pSVgpt-HuVHHMFG1-HulgG1) промывали в PBSTM Проявление цвета NCTC 12412 К12, TG1 Е coh, содержащая проводили с помощью 200мкл плазмиду pSVneo-HuVkHMFG1-HuCk 7 Связывающая способность нитрофенилфоефата (таблетки субстрата Sigma видоизмененных человеческих антител щелочной фосфатазы) в 1М диэтаноламиновом буфере при рН 9,8 Значения оптической Полезный способ демонстрации связывающей плотности считывали на считывающем устройстве способности видоизмененного антитела состоит в "Dynatech" при 410 нм после переноса показе того, что оно имеет такую же кривую Фиксированных объемов надосадочной жидкости разбавления антитела при связывании с (обычно 150мкл) на минротитровальную пластину антигеном, адсорбированным на сплошной с плоскодонным углублением Для исследования поверхности Такие кривые создавали следующим мышиных антител использовался коньюгант в образом, используя родительское мышиное антивиде кроличьей антимышиной IgG (Sigma) HMFG антитело и видоизмененное человеческое антитело, полученное в соответствии с Кривые разбавления антител для мышиных нижеприведенной методикой видоизмененных антител HMFG показаны на фиг 15 Максимальное связывание было отмечено 0,5мл 10% вес/об активированных тосилом при большом избытке антитела, а в М280 магнитных гранул (Dynal, Wirral, UK) отрицательных контрольных пробах связывание соединили с молочным муцином (10 единиц как отсутствовало Концентрации антител, в мкг/мл, определено в иммунопробе для HMFG1, в которой определяли с помощью абсорбционных нормальная человеческая сыворотка измерений в ультрафиолетовых лучах при 280нм регистрирует 100 - 200 единиц на мл) Молочный Для обоих антител разбавление равное 1 было муцин был получен из человеческого грудного установлено эквивалентным 1 мкг/мл Две кривые молока по методу Burcheil et al (1987) Уровень сходны между собой, что указывает на муцина был выбран для обеспечения значительный и полезный уровень эффективности соответствующей активности при пробах с связывания для видоизмененного антитела по использованием гранул Соединение происходило настоящему изобретению в 2,5 мл 0,5М боратного буфера при рН 9,5, плюс 2,5 мл муцина в фосфатно-буферном ЛИТЕРаТУРА физиологическом растворе, рН 7,2 (PBS) в 1 Arkhe et al (1981) - Int J Cancer, 28, P 23 течение 22 часов при температуре 37°С и слабом 29 вращении Блокирование оставшихся активных 2 Burcheil et al (1987) - Cancer Res, 47, p участков выполняли добавлением 1мл 10% 5476 альбумина бычьей сыворотки (BSA, Sigma) в 3 Dente et al (1983) - Nucleic AcidS Res II, P FBSA (PBS + 0,02% азид натрия) с последующей 1645-1655 инкубацией в течение 7 часов при температуре 4 Epp et al (1974) - Eur, J Biochem 45, P 513 37°С Избыточный белок вымывали после -524 использования самарий-кобальтового магнита для 5 Flanagan et al (1982) - Nature, 300, P 709 грануляции Дальнейшую промывку проводили 713 трехкратно в промывочном буфере (0,1 М 6 Gendler et 31 (1988) - J Biol, Chem , 236 фосфата натрия, рн 8,0, 0,1% Tween 20, 0,5% P 12820-12823 BSA) и четырехкратно в прополаскивающем 7 Gibson T (1984) - PnD tnesis, LMB-MRC буфере (PBS + 0,1% BSA, 0,1% мертиолат) Cambridge Гранулы хранили в прополаскивающем буфере 8 Gubler et al (1983) - Gene, 25, P 263 - 269 при 10% вес /об (оценка производилась путем 9 Hale etal (1988)-Lancet, 2, p 1394 анализа сухого веса) 10 Hieter etal (1980)-Cell, 22, P 197-207 Связывание антител измерялось по серии 11 Jones et al (1986) - Nature, 321, P 522 - 525 двойных разбавлений проб антител (полученных 12 Kabat et al (1987) - in Sequences of Proteins взвешиванием в критических капсулах) Пробы по of Immunological Interest, p ix-US Dept of Health and 50 мкл подвергали повторяющейся инкубации в Human Services микротитро-вальных резервуарах с помощью 50 13 Mulligan et ai (1981) - Proc natn Acad Sci мкл 0,05% вес /об суспензии гранул в 1% U S A , 78 P 2072 - 2076 21 46691 22 14 Neuberger et al (1983) - EMBO Journal, 2, P -597 1373-1378 21 Southern et al (1981) - J molec appl Genetics, 1 P 327-345 15 Norrander et al (1983) - Gene, 26, P 101 106 22 Spratt et al (1936) - Gene, 41, P 337 - 342 16 Potter et al (1984) - PNAS, 81, P 7161 23 Takahashi et al (1982) - Cell, 29, P 671 7163 679 17 Riecnmann et al (1988) - Nature, 332, P 323 24 Taylor-Papadimitnou et al (1981) - Int J -327 Cancer, 28, P 1 7 - 2 1 18 Sambrook et al (1989) - Molecular Cloning, 25 Verhoeyen et al (1988) - Science, 239, P 2nd Edition, Cold Spring Harbour Laboratory Press, 1534-1536 New York 26 Vieira et al (1982) - Gene, 19, P 259 - 268 19 Sangeretal (1977) - PNAS USA, 74, P 5463 27 Winter (1987) - EP-A-239400 -5467 28 Xms et al (1990) - EP-A2-369816 20 Saul etal (1978)-J biol Chem 253, P 585 1Г. 23 46691 ю flS fi w 24 25 46691 ш'і'г L І 26 27 46691 28 29 46691 ЗО 31 46691 i,b£Fs* itJi iith, 32 33 46691 34 35 36 46691 p *- П|£ Г. 11 37 46691 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 38
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 39/395
Мітки: муцину, днк, конструкція, людського, варіанти, специфічність, видозмінений, видозмінене, людське, поліморфного, епітеліального, фрагмент, антитіла, рем, антитіло, мають
Код посилання
<a href="https://ua.patents.su/19-46691-vidozminene-lyudske-antitilo-abo-vidozminenijj-fragment-lyudskogo-antitila-yaki-mayut-specifichnist-do-lyudskogo-polimorfnogo-epitelialnogo-mucinu-rem-konstrukciya-dnk-varianti.html" target="_blank" rel="follow" title="База патентів України">Видозмінене людське антитіло або видозмінений фрагмент людського антитіла, які мають специфічність до людського поліморфного епітеліального муцину (рем), конструкція днк (варіанти)</a>
Попередній патент: Спосіб одержання n-(бета-гідроксіетил)нікотинаміду
Наступний патент: Біциклічні сполуки, фармацевтична композиція на їх основі та їх використання як лікарських засобів
Випадковий патент: Руйнівний матеріал