Композиція кладрибіну (варіанти), кладрибін-циклодекстриновий комплекс, застосування кладрибін-циклодекстринового комплексу (варіанти), суміш
Формула / Реферат
1. Фармацевтична композиція, що включає насичений кладрибін-циклодекстриновий комплекс, рецептований у тверду пероральну або трансмукозну лікарську форму, причому вказана композиція головним чином вільна від надлишку циклодекстрину, що перевищує мінімальну кількість, яка необхідна для максимізування кількості кладрибіну у комплексі.
2. Фармацевтична композиція, що включає насичений кладрибін-циклодекстриновий комплекс, рецептований у тверду пероральну або трансмукозну лікарську форму, причому вказана композиція головним чином вільна від надлишку циклодекстрину, що перевищує кількість, яка необхідна для утримання головним чином всього кладрибіну у комплексі.
3. Композиція за п. 1 або 2, яка відрізняється тим, що насичений кладрибін-циклодекстриновий комплекс рецептований у тверду пероральну лікарську форму.
4. Композиція за п. 1, 2 або 3, яка відрізняється тим, що циклодекстрин являє собою ![]() -циклодекстрин, гідроксипропіл-
-циклодекстрин, гідроксипропіл-![]() -циклодекстрин, гідроксипропіл-
-циклодекстрин, гідроксипропіл-![]() -циклодекстрин, диметил-
-циклодекстрин, диметил-![]() -циклодекстрин, довільно метильований
-циклодекстрин, довільно метильований ![]() -циклодекстрин, карбоксиметил-
-циклодекстрин, карбоксиметил-![]() -циклодекстрин або сульфобутил-
-циклодекстрин або сульфобутил-![]() -циклодекстрин.
-циклодекстрин.
5. Композиція за п. 1, 2 або 3, яка відрізняється тим, що циклодекстрин являє собою ![]() -циклодекстрин.
-циклодекстрин.
6. Композиція за п. 1, 2 або 3, яка відрізняється тим, що циклодекстрин являє собою гідроксипропіл-![]() -циклодекстрин.
-циклодекстрин.
7. Композиція за п. 5, яка відрізняється тим, що комплекс включає 1:2 кладрибін:![]() -циклодекстриновий комплекс.
-циклодекстриновий комплекс.
8. Композиція за п. 4, 5 або 6, яка відрізняється тим, що масове співвідношення кладрибіну і циклодекстрину становить від приблизно 1:35 до приблизно 1:50.
9. Композиція за п. 5, яка відрізняється тим, що масове співвідношення кладрибіну і ![]() -циклодекстрину становить приблизно 1:46.
-циклодекстрину становить приблизно 1:46.
10. Композиція за п. 6, яка відрізняється тим, що масове співвідношення кладрибіну і гідроксипропіл-![]() -циклодекстрину становить приблизно 1:42.
-циклодекстрину становить приблизно 1:42.
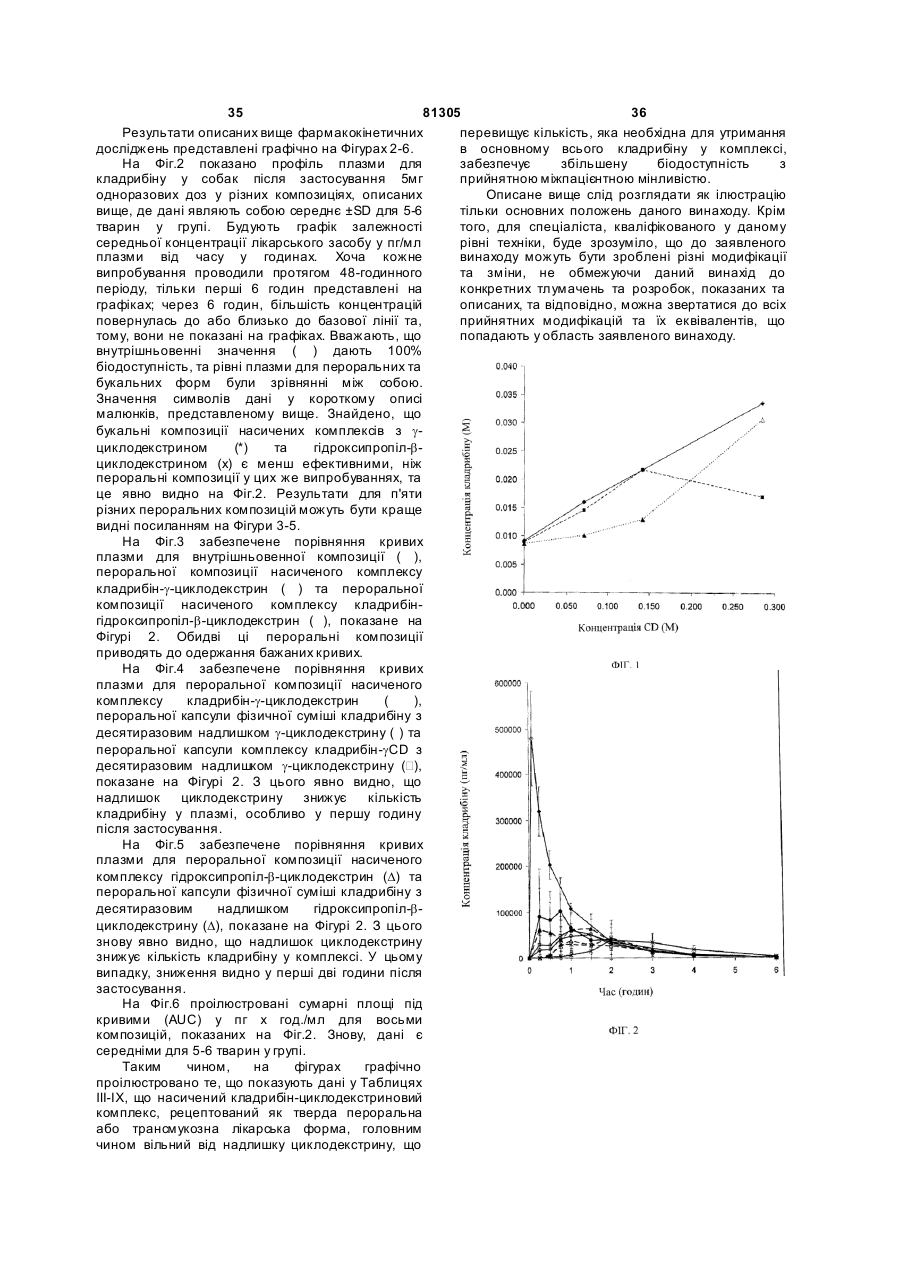
11. Композиція за будь-яким з пп. 2-6, яка відрізняється тим, що приблизне молярне співвідношення кладрибіну і циклодекстрину відповідає точці, розташованій на діаграмі фазової розчинності для насичених комплексів кладрибіну у змінних концентраціях циклодекстрину.
12. Композиція за п. 11, яка відрізняється тим, що циклодекстрин являє собою ![]() -циклодекстрин та точку беруть з частини діаграми фазової розчинності, що показує утворенння 1:2 комплексу кладрибін:
-циклодекстрин та точку беруть з частини діаграми фазової розчинності, що показує утворенння 1:2 комплексу кладрибін:![]() -циклодекстрин.
-циклодекстрин.
13. Застосування насиченого кладрибін-циклодекстринового комплексу в утворенні твердої пероральної лікарської форми або трансмукозної лікарської форми, яка головним чином вільна від надлишку циклодекстрину, що перевищує мінімальну кількість, яка необхідна для максимізування кількості кладрибіну у комплексі, для застосування при лікуванні симптомів кладрибінчутливого стану.
14. Застосування насиченого кладрибін-циклодекстринового комплексу в утворенні твердої пероральної лікарської форми або трансмукозної лікарської форми, яка головним чином вільна від надлишку циклодекстрину, що перевищує мінімальну кількість, яка необхідна для утримання головним чином всього кладрибіну у комплексі, для застосування при лікуванні симптомів кладрибінчутливого стану.
15. Застосування за п. 13 або 14, яке відрізняється тим, що кладрибінчутливий стан вибраний з групи, що включає розсіяний склероз, ревматоїдний артрит та лейкемію.
16. Застосування за п. 15, яке відрізняється тим, що кладрибінчутливий стан являє собою розсіяний склероз.
17. Застосування за п. 13, 14, 15 або 16, яке відрізняється тим, що насичений кладрибін-циклодекстриновий комплекс рецептований у тверду пероральну лікарську форму.
18. Застосування за будь-яким з пп. 13-17, яке відрізняється тим, що циклодекстрин являє собою ![]() -циклодекстрин, гідроксипропіл-
-циклодекстрин, гідроксипропіл-![]() -циклодекстрин, гідроксипропіл-
-циклодекстрин, гідроксипропіл-![]() -циклодекстрин, диметил-
-циклодекстрин, диметил-![]() -циклодекстрин, довільно метильований
-циклодекстрин, довільно метильований ![]() -циклодекстрин, карбоксиметил-
-циклодекстрин, карбоксиметил-![]() -циклодекстрин або сульфобутил-
-циклодекстрин або сульфобутил-![]() -циклодекстрин.
-циклодекстрин.
19. Застосування за будь-яким з пп. 13 - 17, яке відрізняється тим, що циклодекстрин являє собою ![]() -циклодекстрин.
-циклодекстрин.
20. Застосування за будь-яким з пп. 13-17, яке відрізняється тим, що циклодекстрин являє собою гідроксипропіл-![]() -циклодекстрин.
-циклодекстрин.
21. Застосування за п. 18, 19 або 20, яке відрізняється тим, що масове співвідношення кладрибіну і циклодекстрину становить від приблизно 1:35 до приблизно 1:50.
22. Застосування за п. 19, яке відрізняється тим, що масове співвідношення кладрибіну і ![]() -циклодекстрину становить приблизно 1:46.
-циклодекстрину становить приблизно 1:46.
23. Застосування за п. 20, яке відрізняється тим, що масове співвідношення кладрибіну і гідроксипропіл-![]() -циклодекстрину становить приблизно 1:42.
-циклодекстрину становить приблизно 1:42.
24. Застосування за п. 19, яке відрізняється тим, що комплекс включає 1:2 кладрибін:![]() -циклодекстриновий комплекс.
-циклодекстриновий комплекс.
25. Застосування насиченого кладрибін-циклодекстринового комплексу в утворенні твердої пероральної лікарської форми або трансмукозної лікарської форми, яка головним чином вільна від надлишку циклодекстрину, що перевищує мінімальну кількість, яка необхідна для максимізування кількості кладрибіну у комплексі, для підвищення пероральної або трансмукозної біодоступності кладрибіну.
26. Застосування насиченого кладрибін-циклодекстринового комплексу в утворенні твердої пероральної лікарської форми або трансмукозної лікарської форми, яка головним чином вільна від надлишку циклодекстрину, що перевищує мінімальну кількість, яка необхідна для утримання головним чином всього кладрибіну у комплексі, для підвищення пероральної або трансмукозної біодоступності кладрибіну.
27. Застосування за п. 25 або 26, яке відрізняється тим, що насичений кладрибін-циклодекстриновий комплекс рецептований у тверду пероральну лікарську форму.
28. Застосування за п. 25, 26 або 27, яке відрізняється тим, що циклодекстрин являє собою ![]() -циклодекстрин, гідроксипропіл-
-циклодекстрин, гідроксипропіл-![]() -циклодекстрин, гідроксипропіл-
-циклодекстрин, гідроксипропіл-![]() -циклодекстрин, диметил-
-циклодекстрин, диметил-![]() -циклодекстрин, довільно метильований
-циклодекстрин, довільно метильований ![]() -циклодекстрин, карбоксиметил-
-циклодекстрин, карбоксиметил-![]() -циклодекстрин або сульфобутил-
-циклодекстрин або сульфобутил-![]() -циклодекстрин.
-циклодекстрин.
29. Застосування за п. 25, 26 або 27, яке відрізняється тим, що циклодекстрин являє собою ![]() -циклодекстрин.
-циклодекстрин.
30. Застосування за п. 25, 26 або 27, яке відрізняється тим, що циклодекстрин являє собою гідроксипропіл-![]() -циклодекстрин.
-циклодекстрин.
31. Застосування за п. 28, 29 або 30, яке відрізняється тим, що масове співвідношення кладрибіну і циклодекстрину становить від приблизно 1:35 до приблизно 1:50.
32. Застосування за п. 29, яке відрізняється тим, що масове співвідношення кладрибіну і ![]() -циклодекстрину становить приблизно 1:46.
-циклодекстрину становить приблизно 1:46.
33. Застосування за п. 30, яке відрізняється тим, що масове співвідношення кладрибіну і гідроксипропіл-![]() -циклодекстрину становить приблизно 1:42.
-циклодекстрину становить приблизно 1:42.
34. Застосування за п. 29, яке відрізняється тим, що комплекс включає 1:2 кладрибін:![]() -циклодекстриновий комплекс.
-циклодекстриновий комплекс.
35. 1:2 Кладрибін:![]() -циклодекстриновий комплекс.
-циклодекстриновий комплекс.
36. Суміш 1:1 кладрибін:![]() -циклодекстринового комплексу та 1:2 кладрибін:
-циклодекстринового комплексу та 1:2 кладрибін:![]() -циклодекстринового комплексу, де 1:2 комплекс є домінуючим.
-циклодекстринового комплексу, де 1:2 комплекс є домінуючим.
Текст
1. Фармацевтична композиція, що включає насичений кладрибін-циклодекстриновий комплекс, рецептований у тверду пероральну або трансмукозну лікарську форму, причому вказана композиція головним чином вільна від надлишку циклодекстрину, що перевищує мінімальну кількість, яка необхідна для максимізування кількості кладрибіну у комплексі. 2. Фармацевтична композиція, що включає насичений кладрибін-циклодекстриновий комплекс, рецептований у тверду пероральну або трансмукозну лікарську форму, причому вказана композиція головним чином вільна від надлишку циклодекстрину, що перевищує кількість, яка необхідна для утримання головним чином всього кладрибіну у комплексі. 3. Композиція за п. 1 або 2, яка відрізняється тим, що насичений кладрибін-циклодекстриновий комплекс рецептований у тверду пероральну лікарську форму. 4. Композиція за п. 1, 2 або 3, яка відрізняється gтим, що циклодекстрин являє собою b -циклодекстрин, циклодекстрин, гідроксипропіл 3 81305 4 для застосування при лікуванні симптомів надлишку циклодекстрину, що перевищує кладрибінчутливого стану. мінімальну кількість, яка необхідна для 14. Застосування насиченого кладрибінмаксимізування кількості кладрибіну у комплексі, циклодекстринового комплексу в утворенні твердої для підвищення пероральної або трансмукозної пероральної лікарської форми або трансмукозної біодоступності кладрибіну. лікарської форми, яка головним чином вільна від 26. Застосування насиченого кладрибіннадлишку циклодекстрину, що перевищує циклодекстринового комплексу в утворенні твердої мінімальну кількість, яка необхідна для утримання пероральної лікарської форми або трансмукозної головним чином всього кладрибіну у комплексі, лікарської форми, яка головним чином вільна від для застосування при лікуванні симптомів надлишку циклодекстрину, що перевищує кладрибінчутливого стану. мінімальну кількість, яка необхідна для утримання 15. Застосування за п. 13 або 14, яке головним чином всього кладрибіну у комплексі, відрізняє ться тим, що кладрибінчутливий стан для підвищення пероральної або трансмукозної вибраний з групи, що включає розсіяний склероз, біодоступності кладрибіну. ревматоїдний артрит та лейкемію. 27. Застосування за п. 25 або 26, яке 16. Застосування за п. 15, яке відрізняється тим, відрізняє ться тим, що насичений кладрибінщо кладрибінчутливий стан являє собою розсіяний циклодекстриновий комплекс рецептований у склероз. тверду пероральну лікарську форму. 17. Застосування за п. 13, 14, 15 або 16, яке 28. Застосування за п. 25, 26 або 27, яке відрізняє ться тим, що насичений кладрибінвідрізняє ться тим, що циклодекстрин являє циклодекстриновий комплекс рецептований у g -циклодекстрин, собою гідроксипропіл- b тверду пероральну лікарську форму. циклодекстрин, гідроксипропіл- g -циклодекстрин, 18. Застосування за будь-яким з пп. 13-17, яке відрізняє ться тим, що циклодекстрин являє диметил- b -циклодекстрин, довільно g -циклодекстрин, b -циклодекстрин, карбоксиметилсобою гідроксипропіл- b метильований b -циклодекстрин циклодекстрин, гідроксипропіл- g -циклодекстрин, або сульфобутил- b циклодекстрин. диметил- b -циклодекстрин, довільно 29. Застосування за п. 25, 26 або 27, яке метильований b -циклодекстрин, карбоксиметилвідрізняє ться тим, що циклодекстрин являє b -циклодекстрин або сульфобутил- b собою g -циклодекстрин. циклодекстрин. 30. Застосування за п. 25, 26 або 27, яке 19. Застосування за будь-яким з пп. 13 - 17, яке відрізняє ться тим, що циклодекстрин являє відрізняє ться тим, що циклодекстрин являє собою гідроксипропіл- b -циклодекстрин. собою g -циклодекстрин. 31. Застосування за п. 28, 29 або 30, яке 20. Застосування за будь-яким з пп. 13-17, яке відрізняє ться тим, що масове співвідношення відрізняє ться тим, що циклодекстрин являє кладрибіну і циклодекстрину становить від собою гідроксипропіл- b -циклодекстрин. приблизно 1:35 до приблизно 1:50. 21. Застосування за п. 18, 19 або 20, яке 32. Застосування за п. 29, яке відрізняється тим, відрізняє ться тим, що масове співвідношення що масове співвідношення кладрибіну і g кладрибіну і циклодекстрину становить від циклодекстрину становить приблизно 1:46. приблизно 1:35 до приблизно 1:50. 33. Застосування за п. 30, яке відрізняється тим, 22. Застосування за п. 19, яке відрізняється тим, що масове співвідношення кладрибіну і що масове співвідношення кладрибіну і g b -циклодекстрину гідроксипропілстановить циклодекстрину становить приблизно 1:46. приблизно 1:42. 23. Застосування за п. 20, яке відрізняється тим, 34. Застосування за п. 29, яке відрізняється тим, що масове співвідношення кладрибіну і що комплекс включає 1:2 кладрибін: g гідроксипропіл- b -циклодекстрину становить циклодекстриновий комплекс. приблизно 1:42. 35. 1:2 Кладрибін: g -циклодекстриновий комплекс. 24. Застосування за п. 19, яке відрізняється тим, 36. Суміш 1:1 кладрибін: g -циклодекстринового що комплекс включає 1:2 кладрибін: g циклодекстриновий комплекс. комплексу та 1:2 кладрибін: g -циклодекстринового 25. Застосування насиченого кладрибінкомплексу, де 1:2 комплекс є домінуючим. циклодекстринового комплексу в утворенні твердої пероральної лікарської форми або трансмукозної лікарської форми, яка головним чином вільна від Даний винахід відноситься до композиції, що включає кладрибін-циклодекстриновий комплекс, рецептований у тверду пероральну лікарську форму або трансмукозну лікарську форму та до способу збільшення пероральної та трансмукозної біодоступності кладрибіну. 5 81305 6 Кладрибін, який являє собою кислотонизьку біодоступність [дивись, наприклад, J. нестійкий лікарський засіб, має хімічну структур у, Liliemark та інші, J. Clin. Oncol, 10(10): 1514-1518, яка представлена нижче: 1992], та субоптимальну міжпацієнтну мінливість [дивись, наприклад, J. Liliemark, Clin. Pharmacokinet, 32 (2): 120-131, 1997]. Дивись також, A. Tarasuik, та інші, що описують низьку абсорбцію та рН-залежну нестійкість [Arch. Immunol, et Therapiae Exper., 42: 13-15, 1994]. Циклодекстрини являють собою циклічні олігосахариди, що складаються з циклічних a-(1 4) зв'язаних D-глюкопіранозних одиниць. Циклодекстрини з шістьма - вісьмома одиницями позначені як a-, b- та g-циклодекстрин, відповідно. Число одиниць визначає розмір конусоподібної порожнини, яка характеризує циклодекстрини та у Ця сполука також відома як 2-хлор-2'яку лікарські засоби можуть бути включені з деоксиаденозин або 2-CdA. утворенням стійких комплексів. Відомо багато Кладрибін являє собою антіметаболіт, який похідних a-, b- та g-циклодекстринів, у яких одна використовують при лікуванні або більше гідроксильних груп замінена/замінені лімфопроліферативних розладів. Його ефірними групами або іншими радикалами. Таким використовували для лікування чином, ці сполуки являють собою відомі експериментальних лейкемій, таких як L1210, та комплексоутворюючі агенти та раніше клінічно для лейкозу ворсистих клітин та хронічної використовувалися у області фармацевтики для лимфоцитарної лейкемії, а також утворення сполук включення з водо-нерозчинними макроглобулінемії Вальденстрома. Його також лікарськими засобами й, таким чином, для їх використовували як імунодепресивний засіб та як розчинення у водному середовищі. засіб для лікування багатьох аутоімунних станів, В останній час, [Schultz та інші, у Патенті США що включають ревматоїдний артрит, запальну №6,194,395 В1], описали комплексоутворювання хворобу кишечнику (наприклад, хвороба Крона, та солюбілізацію кладрибіну циклодекстрином. виразковий коліт) та розсіяний склероз [дивись, Патент Schultz та інших головним чином звертає наприклад, J. Liliemark, Clin. Pharmacokinet, 32(2): увагу на проблеми, притаманні описаним раніше 120-131, 1997]. Було також досліджено, або водним композиціям кладрибіну, зокрема для експериментально або клінічно у лікуванні, підшкірного та внутрішньо-м'язового введення. наприклад, лімфом, гістиоцитозу клітин Schultz та інші знайшли, що кладрибін не тільки Лангерганса, червоної вовчанки, хронічного значно більш розчинний у водному середовищі, бляшкового псоріазу, синдрому Сезаря (Sezary коли він рецептований з циклодекстрином, але syndrome), синдрому Бінга-Нееля (Bing-Neel також є і більш стійким проти гідролізу, що syndrome), рецидивної гліоми та солідних пухлин. каталізують кислотою, коли він об'єднаний з Пероральна доставка лікарських засобів циклодекстрином. Досліджено, що останній факт зазвичай є кращою ніж парентеральна доставка приносить певну користь у реципуванні твердих завдяки багатьом причинам, таким як, пероральних лікарських форм, тому що сполука насамперед, контактність хворого, або з цінових звичайно піддається гідролізу у кислому рН вмісту або терапевтичних міркувань. Контактність шлунку. Schultz та інші, здається, не описують хворого підвищується, оскільки пероральні ніякої фактичної роботи у зв'язку з твердими лікарські форми зменшують кількість повторних пероральними лікарськими формами. Фактично, візитів до закладів з охорони здоров'я, або вони описують тільки спосіб одержання твердих дискомфорт ін'єкцій або тривалий інфузійний час, лікарських форм, який являє собою процес пов'язані з деякими активними лікарськими екструзії з розплаву, у якому кладрибін та засобами. У час, коли витрати на охорону здоров'я циклодекстрин змішують з іншими постійно зростають, важливого значення необов'язковими добавками та потім нагрівають набувають знижені витрати, пов'язані з поки не відбудеться плавлення. Крім того, широкі пероральним або трансмукозним застосуванням, у дозувальні інтервали від 1мг до 15мг кладрибіну порівнянні з витратами при парентеральному та від 100мг до 500мг циклодекстрину, застосуванні. Витрата при парентеральному перераховані у цьому патенті, не забезпечують застосуванні є значно вищою через вимогу, що ніякої точності у тому, яка певна кількість спеціаліст з охорони здоров'я застосовує циклодекстрину знаходиться з даною кількістю кладрибін у закладі з охорони здоров'я, яка також кладрибіну у твердій пероральній лікарській включає всі супутні витрати, пов'язані з таким формі. Справді, ці дозувальні інтервали застосуванням. Крім того, у деяких випадках, включають багато комбінацій, які можуть бути терапевтичні міркування, такі як необхідність у прийнятними як суміші, але не прийнятними для повільному вивільненні кладрибіну впродовж утворення комплексу. Наприклад, співвідношення тривалого періоду часу, практично можуть бути 1мг кладрибіну до 500мг циклодекстрину містить досягнуті тільки шляхом пероральної або занадто багато циклодекстрину, внаслідок чого трансмукозної доставки. лікарський засіб не легко залишав би комплекс та Однак, дотепер пероральна або трансмукозна досягав його терапевтичної функції. З іншого боку, доставка кладрибіну була неприйнятною через 15мг кладрибіну та тільки 100мг циклодекстрину 7 81305 8 було б недостатньо для зв'язування у комплекс кислоти, даний рівень техніки не пропонує, як цієї кількості кладрибіну. максимізувати або підвищити позитивний вплив Патент Schultz та інших запропонував комплексоутворення на біодоступність та покращити стабільність кладрибіну у пероральних мІжпацієнтну мінливість, коли комплекс необхідно лікарських формах шляхом його застосовувати у твердій пероральній лікарській об'єднання/комплексоутворення з формі або трансмукозній лікарській формі. циклодекстрином, але не описали покращення На сьогоднішній день знайдено, що надлишок пероральної біодоступності лікарського засобу циклодекстрину інгібує абсорбцію кладрибіну з завдяки такій можливості; фактично, цей патент не твердої пероральної лікарської форми або описує або не пропонує спосіб для підвищення трансмукозної лікарської форми, що включає або максимізації біодоступності кладрибіну з кладрибін-циклодекстриновий комплекс, та що твердої пероральної лікарської форми кладрибіну тверда пероральна або трансмукозна лікарська та циклодекстрину, або композицію, спеціально форма насиченого кладрибін-циклодекстринового розроблену для цього. Крім того, Schultz та інші не комплексу покращує пероральну та/або запропонували кладрибін/циклодекстрин трансмукозну біодоступність та/або досягає нижчої комбінації для трансмукозного застосування, які, у міжпацієнтної та/або внутріпацієнтної мінливості формі, призначеній для застосування через лікарського засобу. слизові оболонки, що покривають носові, ротові, Даний винахід забезпечує фармацевтичну вагінальні або ректальні порожнини, на відміну від композицію, що включає насичений кладрибінрото-шлункового шляху, значно менше циклодекстриновий комплекс, рецептований у підвищують біодоступність цього лікарського тверду пероральну лікарську форму або засобу, коли він застосовуються з допомогою такої трансмукозну лікарську форму, який головним лікарської форми. чином вільний від надлишку циклодекстрину, що Багато дослідників вивчали розчинність перевищує мінімальну кількість, необхідну для специфічних лікарських засобів у воді, що містить максимізування кількості кладрибіну у комплексі. У різні концентрації вибраних циклодекстринів для певному аспекті даного винаходу, ця того, щоб продемонструвати, що збільшення фармацевтична композиція включає насичений концентрацій циклодекстринів підвищує кладрибін-циклодекстриновий комплекс, розчинність лікарських засобів при вибраних рецептований у тверду пероральну лікарську температурах та рН рівнях, як наприклад, описано форму або трансмукозну лікарську форму, який у [патенті Schultz та інших]. Дослідження способом головним чином вільний від надлишку фазової розчинності також були проведені різними циклодекстрину, що перевищує мінімальну дослідниками для того, щоб пояснити природу кількість, необхідну для утримання в основному утворення комплексів, наприклад, чи утворюють всього кладрибіну у комплексі. Ця композиція циклодекстрин та лікарський засіб 1:1 комплекс забезпечує кладрибін у його найбільш або 1:2 комплекс; дивись, наприклад, [Harada та термодинамічно-активному стані у той час, коли інші, Патент США №4,497,803], що відноситься до він контактує зі слизовою оболонкою шлунка (у комплексів включення антибіотиків випадку пероральної лікарської форми) або з ланкацидинової групи з циклодекстрином, та ректальною, вагінальною, букальною або носовою [Shinoda та інші, Патент США №4,478,995], що слизовою оболонкою (у випадку трансмукозних відноситься до комплексу солі приєднання кислоти лікарських форм). (2'-бензилоксикарбоніл)феніл-транс-4Даний винахід також забезпечує спосіб гуанідинометил-циклогексанкарбоксилату з підвищення пероральної або трансмукозної циклодекстрином. біодоступності кладрибіну, що включає У фармацевтичному рівні техніки сталою застосування до пацієнта, якому необхідне таке практикою є використання надлишку лікування, фармацевтичної композиції, що циклодекстрину у твердих лікарських формах, у включає насичений кладрибін-циклодекстриновий яких циклодекстрин використовують для комплекс, рецептований у тверду пероральну покращення розчинності лікарських засобів, якщо лікарську форму або трансмукозну лікарську розчинність не така, що надлишок циклодекстрину форму, який головним чином вільний від надлишку привів би до занадто великої лікарської форми. циклодекстрину, що перевищує мінімальну Здоровий глузд підказує, що для твердої кількість, необхідну для максимізування кількості пероральної лікарської форми, особливо кислотокладрибіну у комплексі. В особливому аспекті нестійкого лікарського засобу, такого як кладрибін, даного способу, композиція, що застосовується, надлишок циклодекстрину, як очікується, захистив включає насичений кладрибін-циклодекстриновий би лікарський засіб у кислому середовищі шлунку комплекс, рецептований у тверду пероральну та, в ідеалі, доставив би його через стінку лікарську форму або трансмукозну лікарську кишок/слизову оболонку шлунка все ще форму, який головним чином вільний від надлишку захищеним як комплекс з циклодекстрином. У циклодекстрину, що перевищує мінімальну кровообігу, вдалині від згубного впливу кислоти кількість, необхідну для утримання в основному шлунку, цей лікарський засіб потім, як очікується, всього кладрибіну у комплексі. дисоціювався би від комплексу та виконав би свою Крім того, даний винахід забезпечує спосіб терапевтичну функцію. покращення біодоступності кладрибіну з твердої У той час як Schultz та інші описують, що пероральної лікарської форми або трансмукозної кладрибін-циклодекстриновий комплекс покращує лікарської форми у сса вця, якому необхідне таке розчинність у воді та стійкість кладрибіну до лікування кладрибіном, цей спосіб включає: (а) 9 81305 10 визначення мінімальної кількості циклодекстрину, насичений буккальний комплекс кладрибінщо необхідна для утворення комплексу з гідроксипропіл-b-циклодекстрин; ( ) насичений вибраною кількістю кладрибіну та для утримання пероральний комплекс кладрибін-g-циклодекстрин; вказаної вибраної кількості кладрибіну у комплексі; ( ) пероральна капсула фізичної суміші кладрибіну (b) об'єднання кількості кладрибіну, що перевищує з десятиразовим надлишком g-циклодекстрину; ()ٱ вказану вибрану кількість, з вказаною мінімальною пероральна капсула комплексу кладрибіну з кількістю циклодекстрину у водному середовищі; десятиразовим надлишком g-циклодекстрину; ( ) (с) видалення незакомплексованого кладрибіну з насичений пероральний комплекс кладрибінкомплексаційного середовища; (d) видалення води гідроксипропіл-b-циклодекстрин; та (D) пероральна з одержаного розчину для отримання насиченого капсула фізичної суміші кладрибіну з кладрибін-циклодекстринового комплексу; (e) десятиразовим надлишком гідроксипропіл-bрецептування вказаного сухого насиченого циклодекстрину. кладрибін-циклодекстринового комплексу у тверду На Фіг.3 представлено порівняння кривих пероральну лікарську форму або трансмукозну плазми для кладрибіну у собак після застосування лікарську форму, яка головним чином вільна від 5мг одноразових доз кладрибіну, з даними, що надлишку циклодекстрину, що перевищує показують графік залежності середньої мінімальну кількість, яка необхідна для концентрації, у пг/мл, ±SD для 5-6 тварин у групі, максимізації кількості кладрибіну у комплексі; та (f) від часу, у годинах, після застосування наступних застосування лікарської форми перорально або композицій кладрибіну: ( ) внутрішньовенне (i.v.) трансмукозно до цього ссавця. В особливому болюсне вливання, ( ) насичений пероральний аспекті даного способу, стадія (e) включає комплекс кладрибін-g-циклодекстрин, та (D) рецептування вказаного сухого насиченого насичений пероральний комплекс кладрибінкладрибін-циклодекстринового комплексу у тверду гідроксипропіл-b-циклодекстрин. пероральну лікарську форму або трансмукозну На Фіг.4 представлено порівняння кривих лікарську форму, яка головним чином вільна від плазми для кладрибіну у собак після перорального надлишку циклодекстрину, що перевищує застосування 5мг одноразових доз кладрибіну, з мінімальну кількість, яка необхідна для утримання даними, що показують графік залежності в основному всього кладрибіну у комплексі. середньої концентрації, у пг/мл, ±SD для 5-6 Більш того, даний винахід забезпечує тварин у групі, від часу, у годинах, після лікування станів, що реагують на застосування застосування наступних композицій кладрибіну: ( ) кладрибіну, у ссавців шля хом застосування до них насичений пероральний комплекс кладрибін-gкомпозиції даного винаходу. Також забезпечується циклодекстрин; ( ) пероральна капсула фізичної використання кладрибіну у приготуванні цих суміші кладрибіну з десятиразовим надлишком gфармацевтичних композицій даного винаходу для застосування для лікування симптомів кладрибінциклодекстрину; та ( )ٱпероральна капсула чутливи х станів та для підвищення пероральної комплексу кладрибіну з десятиразовим надлишком або трансмукозної біодоступності кладрибіну. g-циклодекстрину. В одному особливому втіленні, даний винахід На Фіг.5 представлено порівняння кривих забезпечує новий 1:2 комплекс кладрибін: gплазми для кладрибіну у собак після перорального циклодекстрин, який є особливо кращим. У застосування 5мг одноразових доз кладрибіну, з відповідному втіленні, забезпечується суміш 1:1 даними, що показують графік залежності комплексу кладрибін: g-циклодекстрин та 1:2 середньої концентрації, у пг/мл, ±SD для 5-6 комплексу кладрибін : g-циклодекстрин, у якій 1:2 тварин у групі, від часу, у годинах, після комплекс є домінуючим. застосування наступних композицій кладрибіну: ( ) Більш повна оцінка даного винаходу та його насичений пероральний комплекс кладрибінбагатьох супутніх переваг буде легко зрозуміла гідроксипропіл-b-циклодекстрин; та (D) пероральна шляхом посилання на наступний детальний опис капсула фізичної суміші кладрибіну з та супровідні малюнки, де: десятиразовим надлишком гідроксипропіл-bНа Фіг.1 показано графічне представлення циклодекстрину. результатів дослідження фазової розчинності, де На Фіг.6 проілюстровано графік залежності побудований графік залежності різних молярних середньої сумарної площі під кривою (AUC), у концентрацій циклодекстрину (CD) від різних пг´год./мл, для кладрибіну у група х 5-6 собак, від молярних концентрацій кладрибіну, при цьому ( ) часу, у годинах, після застосування кожної з являє собою гідроксипропіл-b-циклодекстрин, ( ) композицій, описаних до Фіг.2, де символи являє собою гідроксипропіл-b-циклодекстрин з приймають значення, показані у тому розділі. доданою гідроксипропіл-метилцелюлозою, та ( ) Наступні визначення та основні являє собою g-циклодекстрин. формулювання застосовні по всьому даному описі На Фіг.2 показано криві плазми для кладрибіну винаходу та пунктах Формули винаходу. у собак після застосування 5мг одноразових доз Патенти, опубліковані заявки та наукова кладрибіну з даними, що показують графік література, на які посилаються у цьому описі, залежності середньої концентрації кладрибіну у усталюють знання спеціалістів, кваліфікованих у плазмі, у пг/мл, ±SD для 5-6 тварин у групі, від даному рівні техніки, та внесені у даний опис як часу, у годинах, після застосування наступних посилання у їх повноті з тим самим розміром, ніби композицій кладрибіну: ( ) внутрішньовенне (i.v.) кожен з них, показаний специфічно та окремо, болюсне вливання; (*) насичений буккальний вбудований як посилання. Будь-яке протиріччя між комплекс кладрибін: g-циклодекстрин; (х) 11 81305 12 кожним посиланням, процитованим у цьому описі, дозволяють включати тільки перераховані стадії та специфічним вченням цієї специфікації буде або елементи або компоненти. вирішений на користь останнього. Більш того, Як використано у цьому описі винаходу, будь-яке протиріччя між зрозумілим у даному рівні форми однини специфічно також включають техніки визначенням слова або фрази та форми множини термінів, до який вони визначенням слова або фрази, яке специфічновідносяться, поки зміст ясно не показує інше. подається у цьому описі, буде вирішений на Термін "приблизно" використовується у користь останнього. даному описі в значенні близько, в районі, Термін "комплекс", як використано у даному орієнтовно або біля. Коли термін "приблизно" описі, означає сполуку включення, у якій використовують у поєднанні з числовими гідрофобна частина молекули кладрибіну (азотзначеннями, це змінює той ряд розширенням вмісне кільце системи) вставлена у гідрофобну границь вище та нижче вказаних числових порожнину молекули циклодекстрину. значень. В основному, термін "близько" або Як використано у цьому описі, у проміжній "приблизно" використовують у даному описі для фразі або у основній частині пункту Формули корекції числового значення вище та нижче винаходу, терміни "включає(ють)" та "що встановленого значення на відхилення у 20%. включає(ють)" слід інтерпретувати як такі, що Термін "насичений", коли його використовують мають необмежене значення. Тобто, терміни слід у поєднанні з комплексом кладрибіну у інтерпретувати синонімічно з фразами "що циклодекстрині, означає, що комплекс є має(ють), принаймні" або "що включає(ють), насиченим кладрибіном, тобто, комплекс містить принаймні". Коли використовують у контексті опису максимальну кількість кладрибіну, яка може бути способу, термін "що включає" значить, що спосіб закомплексована даною кількістю циклодекстрину включає, принаймні, перераховані стадії, але може у використаних умовах комплексоутворення. включати і додаткові стадії. Коли використовують у Дослідження фазової розчинності може бути контексті опису композиції, термін "що включає" використано для одужання цієї інформації, як значить, що композиція включає, принаймні, описано більш детально нижче. (Умови для перераховані елементи або компоненти, але може комплексоутворення також описані більш також включати додаткові елементи або детально нижче). Альтернативно, насичений компоненти. комплекс може бути досягнутий емпірично шляхом Терміни "складається головним чином з" або простого додавання кладрибіну до водного "що складається головним чином з" мають розчину вибраного циклодекстрину до утворення частково обмежені значення, тобто, вони не осаду (незакомплексованого кладрибіну); дозволяють включення стадій або елементів або зрозуміло, що осад потім видаляють та розчин компонентів, які б суттєво змінили основні ліофілізують для одержання сухого насиченого характеристики способу або композиції; комплексу. наприклад, стадії або елементи або компоненти, Вираз "головним чином", як у "головним чином які б суттєво впливали на бажані властивості вільний" або "головним чином весь", означає у композицій, описаних у цьому описі, тобто, спосіб межах 20% точно розрахованої кількості. У або композиція обмежені певними стадіями або випадку виразу "головним чином вільна від матеріалами та тими, які не суттєво впливають на надлишку циклодекстрину, що перевищує основні та нові характеристики даного винаходу. мінімальну кількість, яка необхідна для утримання Основні та нові характеристики у цьому описі головним чином всієї кількості кладрибіну у являють собою забезпечення насиченого комплексі", мінімальна кількість циклодекстрину, кладрибін-циклодекстринового комплексу у яка необхідна для утримання кладрибіну у твердій пероральній лікарській формі або комплексі може бути одержана з досліджень трансмукозній лікарській формі, яка головним фазової розчинності, як пояснено більш детально чином вільна від надлишку циклодекстрину, що нижче. Фактична кількість циклодекстрину повинна перевищує мінімальну кількість, яка необхідна для бути у межах 20% від її мінімуму, плюс або мінус, максимізування кількості кладрибіну у комплексі, переважно у межах 10% від її мінімуму, плюс або для того, щоб забезпечити покращену мінус, навіть ще краще у межах 5% від її мінімуму, біодоступність та/або більш низьку міжпацієнтну плюс або мінус, та повинна утримувати принаймні мінливість після застосування. У особливому 90% або більше, переважно принаймні 95% або втіленні даного винаходу, основні та нові більше, лікарського засобу у комплексі. З іншого характеристики даного винаходу являють собою боку, коли використовують вираз "головним чином забезпечення насиченого кладрибінвільна від надлишку циклодекстрину, що циклодекстринового комплексу у твердій перевищує мінімальну кількість, яка необхідна для пероральній лікарській формі або трансмукозній максимізування кількості кладрибіну у комплексі", лікарській формі, яка головним чином вільна від може бути використана менша ніж зазначена вище надлишку циклодекстрину, що перевищує кількість циклодекстрину та, як результат, більша мінімальну кількість, яка необхідна для утримання кількість кладрибіну може бути присутня у в основному всієї кількості кладрибіну у комплексі, лікарській формі у незакомплексованому вигляді. що забезпечує особливо підвищену біодоступність Це може відбуватися шляхом використання менш та/або низьку внутріпацієнтну та/або міжпацієнтну концентрованого розчину циклодекстрину для мінливість після застосування. реакції комплексоутворення та/або шляхом Терміни "складається з" та "складається" проведення комплексоутворення на вищому кінці являють собою обмежену термінологію та температурного ряду, що запропонований нижче. 13 81305 14 Однак, особливо кращим вважається Даний винахід забезпечує композиції, також як використання достатньої кількості циклодекстрину і способи одержання та використання для утримання головним чином всього кладрибіну фармацевтичних композицій, корисні для у комплексі, й, таким чином, мінімізування кількості досягнення бажаних фармакокінетичних незакомплексованого кладрибіну у лікарській властивостей. Такі композиції походять з формі. відкриття, що розчини циклодекстрину та Термін "міжпацієнтна мінливість" відноситься кладрибіну, у яких кладрибін знаходиться у його до мінливості серед пацієнтів, до яких найвищому термодинамічному стані, при застосовують лікарський засіб. Термін нанесенні на слизову оболонку, через яку вони "внутріпацієнтна мінливість" відноситься до абсорбуються (шлункову, носову, ректальну, мінливості, що зазнав окремий пацієнт, коли букальну, сублінгвальну або вагінальну), пов'язані отримував дози препарату у різний час. з покращеною абсорбцією кладрибіну, що Як використано у цьому описі, перерахування відображається більш високою біодоступністю числового ряду для змінної величини направлене та/або більш низькою міжпацієнтною мінливістю. передати, що винахід може використовуватися на Припустимо, без намагання таким чином практиці зі змінними значеннями, рівними будьобмежити даний винахід, що при розчиненні якому значенню з цього ряду. Таким чином, для (наприклад, шляхом контакту з рідиною, такою як змінної, яка є по суті дискретною, змінна величина рідина організму) сухі композиції насиченого може бути рівна будь-якому цілому значенню комплексу кладрибін-циклодекстрин, що не містять числового ряду, що включає кінцеві точки ряду. надлишку циклодекстрину, утворюють локально Аналогічно, для змінної, яка є по суті насичений розчин кладрибіну, у якому кладрибін безперервною, змінна величина може бути рівна знаходиться у стані найвищої термодинамічної будь-якому дійсному значенню числового ряду, що активності (ΗΤΑ), таким чином сприяючи абсорбції. включає кінцеві точки ряду. Як приклад, змінна, Кладрибін має достатньо низьку, хоча і не можна яка описана як та, що має значення у межах між 0 сказати незначну, властиву йому розчинність у та 2, може являти собою 0, 1 або 2 для змінних, які воді. Вільний кладрибін, утворений з розкладу є по суті дискретними, та може являти собою 0,0, цього комплексу у насиченому водному розчині, 0,1, 0,01, 0,001, або будь-яке інше дійсне значення намагається досягти більш стабільного рівня для змінних, які є по суті безперервними. активності, та, якщо був би присутній надлишок У описі винаходу та п унктах Формули циклодекстрину, кладрибін намагався б досягти винаходу, форми однини включають форми більшої стабільності шляхом повторного множини термінів, поки зміст ясно не вказує на комплексоутворення з циклодекстрином. інше. Як використано у цьому описі, поки Контролюючи кількість циклодекстрину для того, конкретно не вказане інше, слово "або" щоб лікарська форма була головним чином вільна використовують у "включаючому" значенні "та/або" від надлишку циклодекстрину, що перевищує та у "не включаючому'* значенні "або/або". кількість, яка необхідна для утримання кладрибіну Технічні та наукові терміни, використані у у комплексі, кладрибіну буде нелегко у локально цьому описі, мають значення, що традиційно насиченому розчині знову об'єднатися з зрозумілі спеціалісту, кваліфікованому у даному циклодекстрином. Тому, цей кладрибін буде рівні техніки, до якого даний винахід належить, намагатися досягти стану нижчої термодинамічної поки не зазначене інше. У цьому описі зроблено активності/більшої стабільності шляхом посилання на різні способи та матеріали, відомі абсорбування через слизову оболонку шлунка (у спеціалісту, кваліфікованому у даному рівні випадку твердої пероральної лікарської форми) техніки. Стандартні роботи, на які посилаються, або через носову, букальну, вагінальну або що викладають основні принципи фармакології, ректальну слизову оболонку (у випадку включають роботу [Goodman та Gilman The трансмукозної лікарської форми). Цей підхід Pharmacological Basis of Therapeutics. 10те показаний нижче зокрема для підвищення видання, McGraw Hill Companies Inc., New York біодоступності, можливо шляхом уникнення або (2001)]. мінімізації інгібування абсорбції кладрибіну, яке Нижче зроблено детальні посилання до було б результатом присутності надлишку специфічних втілень даного винаходу. Хоча даний циклодекстрину. У присутності великої кількості винахід буде описаний у поєднанні з цими надлишкового циклодекстрину, кладрибін у специфічними втіленнями, слід розуміти, що вони розчині, як очікується, знову об'єднався би з не обмежують даний винахід до таких специфічних циклодекстрином. Тоді він не буде досягати втілень. Навпаки, вони направлені на те, щоб оптимальної біодоступності, тому що важливо, що охопити варіанти, модифікації та еквіваленти, які кладрибін виходить з комплексу, у який він можуть бути включені у суть та об'єм даного інкапсульований, якщо цей лікарський засіб винаходу, як це визначено у прикладеній Формулі повинен здійснювати свою терапевтичну функцію. винаходу. У наступному описі, численні специфічні Приймаючи до уваги описане вище, очевидно, деталі викладені для того, щоб забезпечити що для створення оптимальних фармацевтичних вичерпне розуміння даного винаходу. Даний композицій, у твердій пероральній або винахід може бути застосований без деяких або трансмукозній лікарській формі, ці лікарські форми всіх ци х специфічних деталей. У інших випадках, повинні бути рецептовані для вивільнення добре відомі операції процесу не описані детально локалізованого насиченого розчину кладрибіну для того, щоб зайво не ускладнювати розуміння при контакті цих твердих лікарських форм з суті даного винаходу. рідиною організму на слизовій оболонці, у якому 15 81305 16 кладрибін знаходиться у його ΗΤΑ стані. Для температурі або при легкому нагріванні (до забезпечення такого локалізованого насиченого приблизно 50°С або навіть до 60°С). Надлишок розчину in vivo , важливо спочатку визначити кладрибіну, якщо є, потім видаляють та далі оптимальне співвідношення кладрибіну до вимірюють концентрацію кладрибіну у комплексі. циклодекстрину, при чому це співвідношення Виміряна концентрація являє собою концентрацію називається у даному описі як ΗΤΑ насичення кладрибіну для даної концентрації співвідношення, для використання у твердій циклодекстрину. Цей спосіб повторюють для лікарській формі. У випадку букальної лікарської різних відомих концентрацій циклодекстрину, поки форми, високо концентрований розчин, створений не отримають декілька точок кривої. Кожна точка шляхом розчинення насиченого комплексу у кривої являє собою насичену концентрацію мінімальній кількості води та розміщення цього кладрибіну, розчиненого у циклодекстрині відомої розчину у букальній порожнині, може здійснювати концентрації. Ці точки кривої потім наносять на той самий ефект. графік для того, щоб показати концентрацію ΗΤΑ співвідношення встановлюється насичення кладрибіну по відношенню до різних емпірично та визначається як співвідношення використаних концентрацій циклодекстрину. Ця кладрибіну до певного циклодекстрину, яке крива являє собою діаграму фазової розчинності, відповідає максимальній кількості кладрибіну, яка яка може бути використана для визначення може бути закомплексована даною кількістю кількості насичення кладрибіну для будь-якої циклодекстрину. ΗΤΑ співвідношення може бути специфічної концентрації циклодекстрину, яка визначене використовуючи емпіричний спосіб, використана для утворення насиченого кладрибінтакий як дослідження фазової розчинності для циклодекстринового комплексу у даній сукупності визначення концентрації насичення кладрибіну, умов комплексоутворення. який може бути солюбілізований з допомогою Спеціаліст, кваліфікований у даному рівні розчинів циклодекстрину різних концентрацій. техніки, зможе оцінити, що концентрації, при яких Отже, цей спосіб встановлює концентрації, при утворюються насичені кладрибін-циклодекстринові яких утворюється насичений кладрибінкомплекси (і, таким чином, також ΗΤΑ циклодекстриновий комплекс. Відмічено, що співвідношення), можуть бути визначені шляхом молярне співвідношення, представлене точкою на різних альтернативних методів. Таким чином, кривій фазової розчинності, показує скільки молів будь-який спосіб, відомий у даній області, що є циклодекстрину є тим мінімумом, який необхідний прийнятним для визначення цих концентрацій, для утримання лікарського засобу у комплексі, у входить в область даного винаходу. даних умовах; потім це співвідношення може бути Знайдено, що бажані фармакологічні перетворене у масове співвідношення. Наприклад, властивості (покращена біодоступність та/або якщо діаграма фазової розчинності показує, що нижча міжпацієнтна та/або внутріпацієнтна 9молів даного циклодекстрину необхідне для мінливість) пов'язані з комплексами включення утримання головним чином всього кладрибіну у цього винаходу. насиченому комплексі, тоді помножуючи кількість Циклодекстрини у межах даного винаходу молів кладрибіну на його молекулярну масу та включають природні циклодекстрини a-, b та gпомножуючи кількість молів циклодекстрину на циклодекстрин, та їх похідні, закрема, похідні, у його молекулярну масу, можна прийти до яких одна або більше гідрокси груп заміщені, співвідношення продуктів у вигляді прийнятно наприклад, групами: алкіл, гідроксиалкіл, оптимізованого масового співвідношення. карбоксиалкіл, алкілкарбоніл, Дослідження фазової розчинності також дає карбоксиалкоксиалкіл, алкілкарбонілоксиалкіл, інформацію про природу утвореного кладрибіналкоксикарбонілалкіл або гідрокси-(моно або циклодекстринового комплексу, наприклад, чи поліалкокси)алкіл; та у яких кожна алкільна або комплекс являє собою 1:1 комплекс (1 молекула алкіленова частина переважно містить до шести лікарського засобу закомплексована з 1 атомів вуглецю. Заміщені циклодекстрини в молекулою циклодекстрину) або 1:2 комплекс (1 основному можуть бути одержані у змінних молекула лікарського засобу закомплексована з 2 ступенях заміщення, наприклад, від 1 до 14, молекулами циклодекстрину). переважно від 4 до 7; ступінь заміщення являє У відповідності до даного винаходу, можна собою приблизну середню кількість груп-замісників почати визначення, використовуючи або на молекулі циклодекстрину, наприклад, циклодекстрин або кладрибін як фіксовану змінну приблизну кількість гідроксипропільних гр уп у величину, до якої додають надлишок іншого для випадку молекули гідроксипропіл-bвизначення різних ΗΤΑ точок графіку (що циклодекстрину, та всі такі зміни входять у показують насичені кладрибін-циклодекстринові область даного винаходу. Заміщені комплекси), та намалювати одержану ΗΤΑ лінію. циклодекстрини, які можуть бути використані у Аналогічно, кладрибін додають до водного даному винаході, включають поліефіри, розчину, що має відому концентрацію наприклад, як описано у [Патенті США циклодекстрину, в умовах, знайдених емпірично, №3,459,731]. Додаткові приклади заміщених для сприяння утворенню комплексу. У одному циклодекстринів включають прості ефіри, у яких втіленні концентрований розчин, наприклад, атом водню однієї або більше циклодекстринових приблизно 27% для g-циклодекстрину та гідрокси груп заміщений на групи: С1-6алкіл, приблизно 40% для гідроксипропіл-bгідрокси-С 1-6алкіл, карбокси-С1-6алкіл або С1циклодекстрину, є особливо кращим. В основному, 6алкілоксикарбоніл-С 1-6алкіл або їх змішані прості комплексоутворення проводять при кімнатній ефіри. Зокрема, такі заміщені циклодекстрини 17 81305 18 являють собою прості ефіри, у яких атом водню Циклодекстрини для комплексоутворення з однієї або більше циклодекстринових гідрокси груп кладрибіном, що заслуговують більшої уваги, заміщений на групи: С1-3алкіл, гідрокси-С 2-4алкіл включають: g-циклодекстрин; гідроксиалкіл, або карбокси-С1-2алкіл або ще краще на групи: наприклад, гідроксиетил або гідроксипропіл, метил, етил, гідроксиетил, гідроксипропіл, похідні b- та g-циклодекстрину; карбоксиалкіл, гідроксибутил, карбоксиметил або карбоксиетил. наприклад, карбоксиметил або карбоксиетил, Термін "С1-6алкіл" слід розуміти як групу, що похідні b- або g-циклодекстрину; b-циклодекстрин включає лінійний та розгалужений насичені сульфобутиловий простий ефір; дим етил-bвуглеводневі радикали, що містять від 1 до 6 циклодекстрин; та довільно метильований bатомів вуглецю, такі як метил, етил, 1-метилетил, циклодекстрин. 2-Гідроксипропіл-b-циклодекстрин 1,1-диметилетил, пропіл, 2-метилпропіл, бутил, (ΗΡbCD), 2-гідроксипропіл-g-циклодекстрин пентил, гексил та подібні. Інші циклодекстрини, (HPgCD), довільно метильований b-циклодекстрин, що, як припускають, можуть використовуватися з диметил-b-циклодекстрин, b-циклодекстрин тією ж метою, включають глюкозил-bсульфобутиловий простий ефір, карбоксиметил-bциклодекстрин та мальтозил-b-циклодекстрин. циклодекстрин (CMbCO), карбоксиметил-gОсобливо корисними у даному винаході є bциклодекстрин (CMgCD) та сам g-циклодекстрин циклодекстринові прості ефіри, такі як диметил-b(gCD) є циклодекстринами особливої важливості, циклодекстрин, як описано у [Cyclodextrins of the особливо g-циклодекстрин та гідроксипропіл-bFuture, том 9, №8, стор.577-578 Μ. Nogradi (1984)], циклодекстрин, найбільш особливо gдовільно метильований b-циклодекстрин та циклодекстрин. поліефіри, такі як гідроксипропіл-b-циклодекстрин, Композиції насиченого кладрибінгідроксиетил-b-циклодекстрин, гідроксипропіл-gциклодекстринового комплексу для використання циклодекстрин та гідроксиетил-g-циклодекстрин, у даному винаході можуть бути одержані в умовах, також як і сульфобутилові прості ефіри, особливо що сприяють утворенню комплексу у рідкому b-циклодекстриновий сульфобутиловий простий середовищі, як описано та показано у цьому описі. ефір. Крім простих циклодекстринів, також можуть Одержані рідкі композиції потім можуть бути бути використані розгалужені циклодекстрини та перетворені у суху форму, прийнятну для циклодекстринові полімери. Інші циклодекстрини застосування у вигляді твердої пероральної або описані, наприклад, у [Chemical and Pharmaceutical трансмукозної лікарської форми. Bulletin 28: 1552-1558 (1980); Yakugyo Jiho №6452 Спеціаліст, кваліфікований у даному рівні (28 March 1983); Angew. Chem. Int. Ed. Engl. 19: техніки, зможе побачити, що багато підходів є 344-362 (1980); Патентах США №№ 3,459,731 та доступними у даній області для одержання 4,535,152; Європейських Патентах №№ ЕР композицій, як викладено у цьому описі. Один 0149197А та ЕР0197571А; РСТ Міжнародній доступний спосіб, показаний як приклад у цьому Патентній Заявці №WO90/12035; та Патентній описі, включає стадії змішування кладрибіну у Заявці Великої Британії GB 2,189,245]. Інші водному розчині циклодекстрину, підпримуючи посилання, що описують циклодекстрини для комплексаційне середовище при кімнатній використання у композиціях відповідно до даного температурі, при перемішуванні, протягом від винаходу, та які забезпечують способи одержання, приблизно 6 до приблизно 24 годин, тобто, очищення та аналізу циклодекстринів, включають протягом достатнього часу для підтримання наступні: [Cyclodextrin Technology Jozsef Szejtli, рівноваги, відділяючи незакомплексований Khiwer Academic Publishers (1988) у розділі кладрибін, якщо він є (наприклад, шляхом Cyclodextrins in Pharmaceuticals; Cyclodextrin фільтрування або центрифугування), та Chemistry M. L. Bender та інших, Springer-Verlag, ліофілізації або висушування сублімацією Berlin (1978); Advances in Carbohydrate Chemistry, насиченого розчину з утворенням суміші твердого том 12, під ред.. М. L. Wolfram, Academic Press, насиченого кладрибін-циклодекстринового New York у розділі "The Schardinger Dextrins" комплексу. Dexter French, стор.189-260; Cyclodextrins and their Висушування сублімацією, також відоме як Inclusion Complexes J. Szejtli, Akademiai Kiado, ліофілізація, складається з трьох основних стадій: Budapest, Hungary (1982); I. Tabushi, Acc. Chem. спочатку стадія замороження, потім первинна Research, 1982, 15, стор.66-72; W. Sanger, стадія висушування та, на кінець, вторинна стадія Angewandie Chemie, 92, стор.343-361 (1981); A. P. висушування. Приклад 2, представлений нижче, Croft та інші, Tetrahedron, 39, стор.1417-1474 забезпечує подробиці ліофілізації як виконано на (1983); Irie та інші, Pharmaceutical Research, 5, партіях, описаних у цьому описі. Ця процедура стор.713-716 (1988); Pitha та інші, Int. J. Pharm. 29, далі може бути оптимізована, слідуючи 73 (1986); Патенти США №№ 4,659,696 та принципам, описаним [Xiaolin (Charlie) Tang та 4,383,992; Патента Німеччини №№> DE 3,118,218 Michael J. Pikal у Pharmaceutical Research, том 21, та DE-3,317,064; та Європейський Патент № ЕР №2, February 2004, 191-200], що включене у цей 0094157А. Патенти, що описують опис як посилання у всій повноті та ним можна гідроксиалкільоване похідне bта gкеруватися. циклодекстрину, включають Pitha Патенти США Фармацевтичні композиції відповідно до №№ 4,596,795 та 4,727,064, Müller Патенти США даного винаходу можуть необов'язково включати №№ 4,764,604 4,870,060 та Müller та інших Патент один або більше наповнювачів або інших США №6,407,079]. фармацевтично інертних компонентів. Однією з переваг даного винаходу, однак, є те, що лікарські 19 81305 20 форми кладрибіну, як подано у цьому описі, 2 хвилин для того, щоб дозволити абсорбцію можуть бути одержані з мінімальною кількістю через букальну слизову оболонку. Проте, в наповнювачів, що необхідні для утворення форми основному тверді трансмукозні лікарські форми є та виробництва у певній формі, такій як таблетка кращими у порівнянні з різкими формами. або пластир. Наповнювачі можуть бути вибрані з У певних випадках, пероральна абсорбція або тих, що не впливають на кладрибін, циклодекстрин трансмукозна абсорбція може бути додатково або утворення комплексу. полегшені додаванням різних наповнювачів та Лікарські форми оптимально рецептують у допоміжних речовин для підвищення розчинності фармацевтично прийнятний наповнювач з будьабо для збільшення проникнення, наприклад, якими добре відомими фармацевтично шляхом модифікації мікросередовища, або прийнятними носіями, розріджувачами, шляхом додавання мукоадгезивних носіїв для зв'язуючими речовинами, лубрікантами, покращення контакту між системою доставки та дезінтегрантами, поглиначами, ароматизаторами, тканиною слизової оболонки. барвниками та наповнювачами [дивись Handbook Букальну доставку лікарського засобу можна of Pharmaceutical Excipients, Marcel Dekker Inc., здійснювати шляхом розміщення букальної New York та Basel (1998); Lachman та інші., ред., лікарської одиниці між нижньою щелепою та The Theory and Practice oflndusnpo6a Pharmacy, 3пероральною слизовою оболонкою, що тє вид., (1986); Lieberman та інші., ред., розтащована до неї навпроти, пацієнта, що Pharmaceutical Dosage Forms, Marcel Dekker Inc., піддають терапії лікарським засобом. Можуть бути New York та Basel (1989); та The Handbook of використані наповнювачі або зв'язуючі речовини, Pharmaceutical Excipients, 3-тє вид., American придатні для букального застосування лікарського Pharmaceutical Association та Pharmaceutical Press, засобу, та вони включають будь-які такі матеріали, 2000); дивись також Remington's Pharmaceutical відомі у даному рівні техніки, такі як, наприклад, Sciences, 18-те вид., Gennaro, Mack Publishing Co., будь-яка рідина, гель, розчинник, рідкий Easton, PA (1990) та Remington: The Science and розріджувач, солюбілізатор або подібні, які є Practice of Pharmacy, Lippincott, Williams & Wilkins, нетоксичними та не взаємодіють з іншими (1995)]. Проста тверда пероральна або компонентами композиції руйнівним способом. трансмукозна лікарська форма складається з Тверду лікарську одиницю виготовляють таким насиченого кладрибін-циклодекстринового чином, щоб вона розчинялася поступово впродовж комплексу, спресованого з невеликою кількістю завчасно встановленого періоду часу, щоб вона (наприклад, приблизно 1% за масою) прийнятної створювала суттєво насичений розчин лікарського зв'язуючої речовини або лубріканту, тип у стеарату засобу у слині букальної порожнини, що дозволяє магнію. абсорбцію кладрибіну через слизову оболонку, де У особливих втіленнях, насичений кладрибіндоставка лікарського засобу забезпечується циклодекстриновий комплекс використовують для головним чином впродовж всього періоду часу. трансмукозного або перорального застосування Букальна лікарська одиниця може додатково кладрибіну. включати лубрікант для полегшення виробництва, Як використано у даному описі, "слизова такий як, наприклад, стеарат магнію або подібний. оболонка" означає епітеліальні оболонки, що Додаткові компоненти, які можуть бути включені у покривають носову, оральну, вагінальну та букальну одиницю, включають, серед інших, ректальну порожнини, а також оболонки, що ароматизатори, агенти, що посилюють покривають шлунок (шлункова слизова оболонка). проникнення, розріджувачі, зв'язуючі речовини та Як використано у даному описі, мукозний та подібні. Решта букальної лікарської одиниці може трансмукозний використовують взаємозамінно. включати полімерний носій, що біоруйнується, та Трансмукозні способи доставки та форми добре будь-які наповнювачі, які можуть бути відомі у даному рівні техніки. Вони включають необхідними, наприклад, зв'язуючі речовини, букальні та сублінгвальні таблетки, ромбовидні дезінтегруючі агенти, лубріканти, розріджувачі, таблетки, клейкі пластері, гелі, розчини або спреї ароматизатори, барвники та подібні, та/або (порошкові, рідинні або аерозольні), та супозиторії додаткові активні агенти. або піни (для ректального або вагінального Букальний носій може включати полімер, що застосуваня). Трансмукозні способи доставки та має достатню клейкість для забезпечення того, що форми не включають способи та форми для лікарська одиниця прилипне до букальної слизової перорального використання, які призначені для оболонки на необхідний період часу, тобто період проковтування та просто називаються у цьому часу, протягом якого кладрибін повинен бути описі пероральними лікарськими формами, доставленим через букальну слизову оболонку. незважаючи на той факт, що вони зрозуміло Крім того, полімерний носій є таким, що поступово доставляють лікарський засіб через шлункову "біоруйнується", тобто полімер гідролізується при слизову оболонку. Якщо форма для застосування заданій швидкості при контакті з вологою. Можуть через слизову оболонку є рідкою, вона може бути бути використані будь-які полімерні носії, які є одержана розчиненням насиченого комплексу у фармацевтично прийнятними, забезпечують як мінімальній кількості води, наприклад, 500мг прийнятний ступінь прилипання, так і бажаний профіль вивільнення лікарського засобу, та є насиченого комплексу з HPbCD у 0,5мл води сумісними з кладрибіном для того, щоб (50%мас./мас., розчин), або 500мг насиченого gCD застосовуватися, та будь-які інші компоненти, які комплексу у 1,0мл води. Кілька крапель такого можуть бути присутніми у букальній лікарській розчину може бути введено у букальну порожнину одиниці. В основному, полімерні носії включають та повинно утримуватися там впродовж приблизно 21 81305 22 гідрофільні (водорозчинні та водорозбухаємі) форма, особливо букальна таблетка або полімери, які приклеюються до вологої поверхні пластинка або диск, що має переважно час букальної слизової оболонки. Приклади розпаду приблизно 15-30 хвилин, або букальний полімерних носіїв, придатних у даному випадку, пластир (у якому лікарський засіб вивільнюється включають полімери та сополімери акрилової тільки з боку, яким цей пластир приклеєний до кислоти, наприклад, ті, що відомі як "карбомери", букальної слизової оболонки, в той час як інша сторона є непроникною). Букальне застосування наприклад, CarbopolÒ . Інші прийнятні полімери включають, серед інших, гідролізований може бути використане з винаходів Nagai та інших, описаних у [Патентах США №№ 4,226,848 та полівініловий спирт, оксиди поліетилену 4,250,163], обидва з яких включені у цей опис як (наприклад, Sentry PolyoxÒ ), поліакрилати Ò посилання у їх повноті та ними можна керуватися. (наприклад, Gantrez ), вінілові полімери та Таким чином, букальна таблетка, що прилипає на сополімери, полівінілпіролідон, декстран, гуарову слизовій оболонці, у цьому описі може бути смолу, пектини, крохмалі та целюлозні полімери, рецептована для застосування, включаючи: (а) такі як гідроксипропіл метилцелюлоза (наприклад, полімерну матрицю, що водорозбухає та прилипає MethocelÒ ), гідроксипропіл-целюлоза (наприклад, Ò до слизової оболонки, яка включає приблизно від Klucel ), прості ефіри гідроксипропіл-целюлози, 50% до приблизно 95% за масою простого ефіру гідроксиетил-целюлоза, карбоксиметил-целюлоза целюлози та приблизно від 50% до приблизно нартію, метил-целюлоза, етил-целюлоза, ацетат95% за масою гомо- або сополімеру акрилової фталат целюлози, ацетат-бутират целюлози, та кислоти або його фармацевтично прийнятну сіль, подібні. Лікарська одиниця повинна містити тільки та (b) дисперговану у ній, прийнятну кількість насичений кладрибін-циклодекстриновий кладрибіну, як насичений комплекс з 2комплекс. Однак, у деяких випадках може бути гідроксипропіл-b-циклодекстрином або gбажано, щоб вона вкючала один або більше циклодекстрином. В ідеалі, для зберігання вказаних вище носіїв та/або один або більше стабільності ця таблетка є безводною. додаткових компонентів. Наприклад, лубрікант Способи та фармацевтичні композиції, може бути включений для полегшення способу представлені у цьому описі, пропонують нові виробництва лікарських одиниць; лубріканти також терапевтичні методи для лікування пацієнтів, які може оптимізувати швидкість руйнування та потік потребують лікування кладрибіном. Як показано у лікарського засобу. Якщо лубрікант присутній, він цьому описі, даний винахід звертається до буде міститися у інтервалі від 0,01мас.% до проблем низької біодоступності, що традиційно приблизно 2мас.%, краще приблизно від пов'язані з пероральним застосуванням 0,01мас.% до 1,0мас.%, лікарської одиниці. кладрибіну. Альтернативно, орошлункового шляху Прийнятні лубріканти включають, серед інших, можна уникнути повністю застосуванням стеарат магнію, стеарат кальцію, стеаринову трансмукозної форми доставки. кислоту, стеарилфумарат натрію, тальк, Композиції даного винаходу є особливо гідрогенізовані рослинні масла та поліетилен придатними як способи лікування будь-якої гліколь. кладрибін-чутливої хвороби. Деякі хворобливі Насичений кладрибін-циклодекстриновий стани, що реагують на кладрибін, добре описані у комплекс також може застосовуватися у літературі (дивись нижче). Для будь-якого відповідності з даним винаходом у формі цільового хворобливого стану, використовують супозиторій або пін для вагінального або ефективну кількість оптимізованого кладрибінректального застосування. Ці композиції можуть циклодекстринового комплексу (наприклад, бути одержані добре відомими способами, ефективну кількість для лікування розсіяного наприклад, у випадку супозиторій, шляхом склерозу, ревматоїдного артриту або лейкемії). змішування насиченого комплексу з прийнятним Термін "Терапевтично ефективна кількість" неподразнюючим наповнювачем або зв'язуючою або "ефективна кількість" використовують для речовиною, яка є твердою при звичайних того, щоб вказати на лікування у дозах, температурах, але рідкою при вагінальній або ефективних для досягнення терапевтичного ректальній температурі і, тому, буде плавитися у результату, якого прагнули. Терапевтично вапні або прямій кишці з вивільненням лікарського ефективні дози, описані у літературі, включають засобу. Такі матеріали включають масло кокао та дози для лейкозу ворсистих клітин (0,09мг/кг/день поліетилен-гліколі. впродовж 7 днів), для розсіяного склерозу (від Традиційні зв'язуючі речовини та носії приблизно 0,04 до приблизно 1,0мг/кг/день [дивись включають, наприклад, поліалкілен-гліколі або Патент США №5,506,214]); для інших хвороб, тригліцериди [наприклад, PEG 1000 (96%) та PEG [дивись також Патенти США №№ 5,106,837 4000 (4%)]. Такі супозиторії можуть бути утворені з (аутогемолітична анемія); 5,310,732 (запальна сумішей, що містять активні інгредієнти у інтервалі хвороба кишечнику); 5,401,724 (ревматоїдний від приблизно 0,5мас/мас.% до приблизно артрит); 5,424,296 (злоякісна астроцитома); 10мас/мас.%; краще від приблизно 1мас/мас.% до 5,510,336 (гістиоцитоз); 5,401,724 (хронічна приблизно 2мас/мас.%. мієломна лейкемія); та 6,239,118 (атеросклероз)]. Для інтраназального застосування можуть Крім того, різні дозувальні кількості та бути використані порошковий спрей, гель або дозувальні режими описані у літературі для мазь, переважно порошкова форма насиченого застосування при лікуванні розсіяного склерозу; комплексу. [дивись, наприклад: Romine та інші, Proceedings of Більш того, для застосування людьми, the Association of American Physicians, том 111, найбільший інтерес становить букальна лікарська 23 81305 24 №1, 35-44 (1999); Selby та інші, The Canadian активних інгредієнтів для лікування кладрибінJournal of Neurological Sciences, 25, 295-299 (1998); чутливого стану. Додатковий активний інгредієнт Tortorella та інші, Current Opinion in Investigational буде використовуватися шляхом застосування та з Drugs, 2 (12), 1751-1756 (2001); Rice та інші, дозувальними кількостями та частотою, Neurology, 54, 1145-1155 (2000); та Karlsson та прийнятною для кожного додаткового активного інші, British Journal of Haematology, 116, 538-548 інгредієнту та стану, що лікують. Наприклад, при (2002)]; всі з яких включені у даний опис як лікуванні розсіяного склерозу, інші корисні посилання у їх повноті та ними можна керуватися. лікарські засоби включають інтерферон-бета Більш того, шля х застосування, для якого (RebifÒ , Betaseron Ò /BetaferonÒ , AvonexÒ ), терапевтично ефективні дози вивчені у літературі, ідентичний до білку природного походження, слід взяти до уваги. В той час як дані композиції знайденого у тілі людини; глатірамер ацетат оптимізують біодоступність кладрибіну після (СорахоnеÒ ), випадковий ланцюг (полімер) перорального або трансмукозного застосування, амінокислот глутамінової кислоти, лізину, аланіну слід зауважити, що не очікується, що навіть та тирозину; наталізумаб (AntegrenÒ ), оптимальна біодоступність з пероральних або моноклональне антитіло; алемтузумаб (Campathтрансмукозних лікарських форм досягне 1НÒ ), гуианізоване анті-CD52 моноклональне біодоступності, одержаної після антитіло; 4-амінопіридин (також відомий як 4-АР та внутрішньовенного застосування, особливо в Фампрідин), лікарський засіб, що блокує калієві початкові моменти часу; дивись, наприклад, Фіг.3, канали у нейронах; та амантадин, анті-вірусний представлену нижче. Таким чином, часто є агент, який покращує м'язовий контроль та знижує прийнятним підвищення дози, запропонованої для м'язову тугор ухливість та використовується для внутрішньовенного застосування, для досягнення полегшення симптомів стомлення при розсіяному прийнятної дози для введення у тверду склерозі, ціль, для якої також може бути корисним пероральну лікарську форму або трансмукозну пемолін (CylertÒ ) та L-Карнітин (продукт лікарську форму. У цей час, передбачено, що для природного походження). При лікуванні лейкозу лікування розсіяного склерозу 10мг кладрибіну у ворсистих клітин, додаткові активні інгредієнти такій розчинній твердій лікарській формі, як можуть включати інтерферон-альфа, пентостатин, насичений кладрибін-циклодекстриновий флударабін, рітуксімаб (анті-СD 20 моноклональне комплекс, могло б застосовуватися один раз на антитіло) та анті-CD22 рекомбінантний день впродовж п'яти-семи днів у перший місяць, а імунотоксин BL 22; інші додаткові активні потім повторюватися впродовж іншого періоду інгредієнти можуть бути оцінені при інших типах п'яти-семи днів у другий місяць, що лейкемій. При лікуванні ревматоїдного артриту, супроводжувалося б десятьма місяцями без існує багато інших активних інгредієнтів, які лікування. Альтернативно, пацієнт міг би можуть бути вибрані. Вони включають NSAIDS застосовувати 10-мг-дозу один раз на день (нестероїдні протизапальні лікарські засоби), які є впродовж п'яти-семи днів на місяць протягом трьох типів: саліцилати, такі як аспірин, традиційні шести місяців, що супроводжувалося б NSAIDS, такі як ібупрофен та індометацин, та вісімнадцятьма місяцями без лікування. Для СОХ-2 інгібітори, такі як целекоксиб (CelebrexÒ ), додаткової інформації, що стосується дозування, рофекоксиб (VioxxÒ ), мелоксикам (MobicÒ ), [дивись також Попередню Патентну Заявку США валдекоксиб (BextraÒ ), люміракоксиб (PrexigeÒ ) та № ________ [IVAX0021-P-USA/Attorney Docket No. еторікоксиб (АгсохіаÒ ). Інші лікарські засоби, 033935-011], та Попередню Патентну Заявку США корисні у лікуванні ревматоїдного артриту, які № ________ [IVAX0022-P-USA/Attorney Docket No. можуть бути використані у зв'язку з даним 033935-012], обидві названі "Cladribine Regimen for винаходом, включають DMARDS, глюкокортикоїди, Treating Multiple Sclerosis", обидві подані 25 модифікатори біологічної реакції та не-NSAID березня 2004] та включені у даний опис як анальгетики. DMARDS являють собою хворобопосилання у їх повноті. модифікуючі протиревматичні лікарські засоби, які Крім того, кваліфікованому спеціалісту слід включають метотрексат, плаквеніл, лефлуномід прийняти до уваги, що терапевтично ефективна (Ara vaÒ ), салазосульфапіридин, золото, кількість кладрибіну, застосування якої описано у пеніциламід, циклоспорін, метил-циклофосамід та даному описі, може бути знижена або підвищена імуран. Глюкокортикоїди включають дексаметазон, шляхом точного підбору та/або застосуванням преднізолон, тріамцинолон та багато інших. кладрибіну відповідно до даного винаходу з іншим Модифікатори біологічної реакції (які відновлюють активним інгредієнтом. Тому, даний винахід здатність імунної системи боротися з хворобою) забезпечує спосіб пристосування включають етанерсепт (ЕnrеlÒ ), інгібітор фактору застосування/лікування до певних крайніх потреб, некрозу пухлини, інфліксімаб (RemicadeÒ ), який є специфічних у кожного окремого ссавця. також анті-TNF лікарським засобом, анакінра Терапевтично ефективні кількості можуть бути (KineretÒ ), селективний IL-1 блокатор, та НumіrаÒ , легко визначені, наприклад, емпірично, починаючи моноклональне антитіло людини, яке являє собою з відносно низьких кількостей та поетапно інший анті-TNF лікарський засіб. He-NSAID підвищуючи кількість засобу з одночасним аналгетики включають ацетамінофен, а також оцінюванням позитивного ефекту. наркотичні анальгетики, такі як Як зазначено у попередньому розділі, дигідроксикодеїнон, оксикодон та пропоксифен. застосування кладрибіну у відповідності з даним Загалом кажучи, ті лікарські засоби, які працюють винаходом може супроводжуватися за механізмом, що відрізняється від механізму дії застосуванням одного або більше додаткових 25 81305 26 кладрибіну, є надзвичайно корисними для фільтруванням. Кількість кладрибіну у суп утньої терапії з кладрибіновою композицією, комплексаційному розчині вимірювали для представленою у цьому описі. Ті лікарські засоби, одержання одного з результатів обробки даних які є ефективними для перорального або (точки на кривій). Цей процес повторювали з трансмукозного застосування та які є сумісними з різними відомими концентраціями циклодекстрину розчинними кладрибіновими комплексами у поки не одержали декілька точок кривої. Ці точки одиничній лікарській формі, можуть бути включені кривої потім нанесли на графік, при чому кожна з у розчинні лікарські форми; у противному випадку, цих точок представляє максимальну кількість звичайно, їх слід застосовувати окремо у кладрибіну, яка може бути закомплексована кількостях, з частотою та шляхами застосування, певною концентрацією циклодекстрину, тобто прийнятними для них. кожна точка являє собою насичений кладрибінЯк використано у даному описі, "лікування" циклодекстриновий комплекс. Точки на лінії, означає зменшення, запобігання, загальмовування побудованій за результатами обробки даних, розвинення, контролювання, полегшення та/або являють собою ΗΤΑ співвідношення. Будь-яка анулювання симптомів у пацієнта, до якого точка на цій лінії являє собою специфічний, застосовували сполуку даного винаходу, у однозначний насичений кладрибінпорівнянні з симптомами пацієнта, якого не циклодекстриновий комплекс. Спеціаліст, лікували відповідно до даного винаходу. кваліфікований у даному рівні техніки, повинен Практикуючому лікарю слід взяти до уваги, що розуміти, що подібні результати будуть одержані, комплекси, композиції, лікарські форми та якщо надлишок циклодекстрину додавати до способи, представлені у цьому описі, повинні розчинів кладрибіну відомої концентрації. використовува тися у супроводі з постійними Як приклад, одержали розчини клінічними дослідженнями, що проводяться циклодекстрину змінних концентрацій та зробили кваліфікованим у даній області спеціалістом насиченими кладрибіном шляхом забезпечення (терапевтом або ветеринаром) для визначення кладрибіну у надлишку. Насичені розчини наступної терапії. Таке дослідження буде циклодекстрину для даного циклодекстрину при допомагати та інформувати про оцінку, чи даній концентрації циклодекстрину проілюстровані потрібно підвищити, зменшити або продовжувати у Таблиці І, представленій нижче. застосовувати певну лікувальну дозу, та/або змінити спосіб застосування. Способи даного винаходу призначені для використання будь-яким суб'єктом/пацієнтом, який Циклодекстрин Кладрибін-НРbCD) (Проба А) Кладрибін-НРbCD та може випробувати позитивні ефекти способів (0,1%) (Проба В даного винаходу. Таким чином, у відповідності з Моляр. М Моляр. конц. Абсорбція мг/мл Абсорбція мг/мл даним винаходом, терміни "суб'єкти", також як і конц. "пацієнти", включають людей, також як і нелюдські 0,00 0,140 2,610 0,0091 0,137 2,550 0 суб'єкти, зокрема одомашнених тварин. 0,018 0,169 3,139 0,011 0,146 2,711 0 Будь-які прийнятні матеріали та/або способи, 0,035 0,191 3,554 0,0124 0,175 3,262 0 відомі спеціалістам, кваліфікованим у даній 0,071 0,245 4,570 0,016 0,223 4,149 0 області, можуть бути використані при здійсненні 0,142 0,333 6,211 0,0217 0,332 6,185 0 даного винаходу. Однак, кращі матеріали та 0,285 0,514 9,381 0,0335 0,259 4,831 0 способи описані. Матеріали, реагенти та подібне, на які зроблені посилання у наступному описі та прикладах, можуть бути одержані з комерційних джерел, якщо не зазначено інше. Наступні приклади призначені для додаткової ілюстрації певних кращих втілень даного винаходу та не обмежують його. Спеціалісти, кваліфіковані у даному рівні техніки, дізнаються або будуть здатні встановити, використовуючи не більше, ніж рутинне експериментування, прийнятні еквіваленти до певних речовин та процедур, представлених у цьому описі. Приклади Приклад 1 Дослідження фазової розчинності Дослідження фазової розчинності виконували наступним чином. Надлишок кладрибіну додали до розчинів циклодекстрину різних концентрацій: gциклодекстрину (gCD) або гідроксипропіл-bциклодекстрину (HPbCD) та обробили комплекс як описано у Прикладі 2, представленому нижче. Крім того, у одному наборі експериментів, досліджували вплив гідроксипропілметилцелюлози (НРМС) на комплексоутворення. Надлишковий, нерозчинений кладрибін видалили Будують графік залежності молярних концентрацій кладрибіну до циклодекстрину, показаних у Таблиці І, та представляють графічно як Фіг.1. Побудовані лінії для кладрибін-НРbСD, кладрибін-gCD та 0,1% НРМС, та кладрибін-gСD являють собою максимальну солюбілізацію кладрибіну для умов, при яких тестували, тобто, ΗΤΑ співвідношення концентрації кладрибіну до концентрації циклодекстрину. Площа над кожною з побудованих ліній являє собою умови, при яких присутній надлишок нерозчиненого кладрибіну. Площа під кожною з побудованих ліній являє собою умови, при яких циклодекстрин знаходиться у надлишку у порівнянні з тією кількістю, яка необхідна для утримання комплексу у розчині. Зрозуміло, дані у Таблиці І та на Фіг.1 показують, що НРМС, відомий агент для полегшення комплексоутворенння, не має ніякого ефекту при нижчій концентрації та має негативний ефект при вищій концентрації. ΗΤΑ гра фік для кладрибін-НРbCD, показаний на Фіг.1, є майже лінійним; це є ознакою 1:1 комплексу, у якому одна молекула лікарського 27 81305 28 засобу утворює комплекс з однією молекулою циклодекстрину змішують при перемішуванні при циклодекстрину. На Фіг.1 також показано, що кімнатній температурі впродовж приблизно дев'яти додатковий циклодекстрин необхідний для годин. Суміш досягає рівноваги. Надлишковий, утримання кладрибіну у комплексі. Наприклад, у незакомплексований кладрибін, якщо є, видаляють фільтруванням. Для утворення випадку g-циклодекстрину, приблизно 0,10моль твердого насиченого кладрибінgCD необхідно для утримання приблизно 0,01моль циклодекстринового комплексу, водні кладрибінкладрибіну у його насиченому комплексі; у випадку циклодекстринові розчини сушать ліофілізуванням HPbCD, приблизно 0,10моль циклодекстрину перед включенням у тверді букальні або необхідно для утримання приблизно 0,017моль пероральні таблетки. Процедура ліофілізування кладрибіну у його насиченому комплексі. Однак, у включає стадію замороження шляхом швидкого випадку gCD, розчинність лікарського засобу приведення комплексаційного розчину до значно підвищується при вищій концентрації температури від приблизно -40°С до приблизно циклодекстрину; при молярній концентрації gCD 80°С на період часу від приблизно 2 до 4 годин, приблизно 0,15, нахил лінії змінюється, показуючи краще від приблизно 3 до 4 годин, наприклад, утворення 1:2 комплексу кладрибіну до температура дорівнює приблизно -45°С впродовж циклодекстрину, тобто, одна молекула кладрибіну приблизно 200 хвилин, що супроводжується утворює комплекс з 2 молекулами g-CD, які значно первинною стадією висушування при приблизно оточують та захищають молекулу кладрибіну. 25°С впродовж приблизно 80-90 годин, звичайно Дві молекули g-CD прикріплені водневим при низькому тиску, та потім вторинною стадією зв'язком одна до другої при високій концентрації висушування при приблизно 30°С впродовж циклодекстрину та включають у порожнину між приблизно 15-20 годин. ними молекулу кладрибіну. Думаємо, що це є Продукт, одержаний за вказаною вище поступовий процес, у якому спочатку утворюється основною процедурою, може бути 1:1 комплекс, а потім друга g-CD молекула проаналізований з допомогою HPLC приєднується водневим зв'язком до g-CD у 1:1 (використовуючи H ypersil ODS 3-мікронну колонку комплексі, утворюючи 1:2 комплекс. Звичайно, та рухому фазу на основі ацетонітрилу, з УФ найчастіше одержать суміш 1:1 та 1:2 комплексів, детектуванням при 264нм) для того, щоб але домінування 1:2 комплексу є кращим. Таким визначити масове співвідношення кладрибіну до чином, у випадку g-CD, молярна концентрація циклодекстрину у кінцевому продукті. Композиції приблизно 0,20 циклодекстрину утримує кінцевих продуктів можуть бути далі приблизно 0,017моль кладрибіну у його охарактеризовані способами, відомими у даному насиченому комплексі. При вищих концентраціях рівні техніки, включаючи, наприклад, перевірку циклодекстрину та лікарського засобу, тоді, існує ознак, встановлення загального вмісту домішок з менша різниця між gCD та HPbCD у кількості допомогою HPLC, встановлення вмісту води, циклодекстрину, необхідній для даної кількості використовуючи Karl Fischer тітратор, визначення кладрибіну, та g-CD розчиняє пропорційно більше профілю розчинності з допомогою стандартного кладрибіну, ніж це робить HPbCD. Так як 1:2 способу, наприклад, використовуючи комплекс, утворений при вищій концентрації g-CD, USPApparatus II прилад та УΦ детектування є більш сильним комплексом, ніж 1:1 комплекс, при 264нм, встановлення однорідності вмісту та кладрибін, утворений у насиченому розчині, коли виконання кількісного дослідження з допомогою такий 1:2 комплекс вивільнює лікарський засіб у HPLC аналізу активного інгредієнту. рідину організму у слизовій оболонці, є навіть Частина В: більш нестабільним, тобто має навіть більшу Дві партії продукту кладрибін/циклодекстрин, термодинамічну активність, ніж кладрибін, FD02, у якому використали g-CD, та FD03, у якому вивільнений з 1:1 комплексу, сприяючи навіть використали HPbCD, одержали за описаною вище більшому руху лікарського засобу через слизову процедурою, як показано нижче: оболонку. Комплекс з gCD є також кращим, тому Очищену воду (585мл для FD02 та 575мл для що gCD є природним циклодекстрином, таким FD03) помістили 1-літрову скляну посудину для чином, показує менше випадків токсичності один кожної партії. Зважили g-циклодекстрин (116г) та 2проти другого. Більш того, у випадку твердих гідроксипропіл-b-циклодекстрин (115г) та повільно пероральних лікарських форм, думають, що 1:2 додавали до перемішуваної води впродовж 30 комплекс з g-CD буде краще захищати кладрибін хвилин. Зважили кладрибін (2,53г для FD02 та від впливу шлункової кислоти, тому що він здатний 2,76г для FD03) та додали до відповідних в значній мірі оточити молекулу лікарського засобу перемішуваних розчинів циклодекстрину. Розчини циклодекстрином і, таким чином, однозначно обробляли ультразвуком впродовж 20 хвилин. добре підходить для цілей даного винаходу. Одержаний прозорий розчин перемішували при Приклад 2 кімнатній температурі впродовж 9 годин. Потім ці Одержання кладрибін-циклодекстринового розчини залили у 100-мл ліофілізаційні пробірки комплексу (по 20мл розчину у кожну пробірку) та заповнені Частина А: пробірки частково закупорили. Ліофілізація Кладрибін утворює комплекс або з HPbCD або включала замороження при -45°С впродовж з gCD наступним основним способом. приблизно 3,3 годин, фазу первинного Водну суспензію кладрибіну, у надлишку, та висушування при -25°С при тиску 100мторр концентрований розчин (приблизно 27% для gвпродовж приблизно 85,8 годин, та фазу циклодекстрину та приблизно 40% для HPbCD) 29 81305 30 вторинного висушування при 30°С впродовж собака. Дані, одержані з цієї моделі, як очікується, приблизно 17,5 годин, як зазначено нижче: будуть типовими для людини. Насичений кладрибін-циклодекстриновий Цикл ліофілізації комплекс, як одержано у Прикладі 2, Частина В, FD02 та FD03, використовували для одержання пероральних та (мТорр) Стадія Процес Температура Тиск букальних таблеток. Матеріали Час (години) 1 Завантаження 4°С комплексу пропустили через #18 меш (0,9мм) сито 2 Витримування 4°С зі стеаратом магнію, змішували впродовж п'яти Не застосовувався 2,0 3 Перехідна стадія -45°С хвилинНета спресовали, використовуючи 10-ти застосовувався 2,0 4 Заморожування -45°С міліметрові формблоки. 10-ти міліметрові таблетки Не застосовувався 3,3 5 Перехідна стадія -25°С мали зверху невелику опуклість та знизу плоску 100 2,2 6 Первинне висушування -25°С форму із скошеною крайкою. Композиції для 100 85,8 виробництва були наступними: 7 Перехідна стадія 30°С 50 4,0 8 Вторинне висушування 30°С 50 17,5 9 Кінцева обробка 30°С Пробірки закриті у вакуумі FD02 та FD03 партії кладрибін/циклодекстрин, одержані за описаною вище процедурою, проаналізували з допомогою HPLC (використовуючи H ypersil ODS 3-мікронну колонку та рухому фазу на основі ацетонітрилу, з УФ детектуванням при 264нм) та емпірично визначили, що вони мають наступні характеристики: Масове Комплекс Маса: маса співвідношення 2,53г:116,0г 1 :46 Кладрибін: g-CD 2,76г:115,0г 1 :42 Кладрибін: HPbCD Ці продукти проаналізували методом DSR та методом дифракції рентгенівських променів для визначення будь-якого вільного кладрибіну у ліофілізованому матеріалі. Важливо, що зразки не показали ніякого переходу у області 210°С-230°С, яка пов'язана з плавленням кристалічного кладрибіну. У обох випадках, ніякої значної термічної активності не зафіксували у області 210°С-230°С, припускаючи, що комплекси, одержані в кінці ліофілізації, не мають ніякої значної кількості вільного кристалічного кладрибіну, приймаючи до уваги чутливість аналітичного методу (до 3%мас./мас.). Цей висновок підтверджується відсутністю піків для кристалічного кладрибіну на розгортці дифракції рентгеновських променів для обох комплексів FD02 та FD03. Як зазначено вище, ці комплекси кладрибінщиклодекстрин мають кладрибінщиклодекстрин масові співвідношення приблизно 1:46 для комплексу кладрибін:gциклодекстрин та приблизно 1:42 для комплексу кладрибін:гідроксипропіл-b-циклодекстрин. Кладрибін:циклодекстрин масові співвідношення, близькі до масових співвідношень, наприклад, від приблизно 1:35 до приблизно 1:50, є найбільш бажаними. Ці співвідношення можуть змінюватися в залежності від певного використовуваного циклодекстрину та кількості циклодекстрину у комплексаційному розчині, а також температури утворення комплексу. Приклад 3 Фармакокінетичні дослідження Біодоступність кладрибіну, закомплексованого з g-CD або HPbCD, оцінили на моделі - гончий Партія № Інгредієнт Кладрибін/g-CD комплекс Кладрибін/2-HPbCD комплекс Стеарат магнію Всього Номер серії FD02 FD03 RDT мг/т 2 2 * Ця кількість комплексу містить приблизно 5мг кладрибіну/таблет Властивість готової таблетки Середня маса Твердість Крихкість Товщина Розклад Таблетка з комплексом кладрибін:gциклодекстрин RDT-0418/C 237,0мг 4,0Кр 0,5% 3,8мм 8 хвилин Дослідження біодоступності та фармакокінетики проводили на моделі - гончий собака, як описано нижче. Безпородних гончих собак чоловічої статі (названі як РМ01-РМ06), одержаних з IDRI (Dunakeszi, Hungary), тримали на лабораторній дієті та воду давали без обмежень. Тих же собак використовували у всьому дослідженні для того, щоб мінімізувати міжта внутрі-суб'єктну мінливість. Дослідження біодоступності та фармакокінетики проводили наступним чином. У першому тестовому періоді, 5мг кладрибіну (0,25мг/мл у ізотонічному сольовому розчині) застосовували внутрішньовенно до суб'єктів, яких випробовували. Зразки крові збирали у різні інтервали часу впродовж 48 годин. У другому тестовому періоді, половина суб'єктів одержувала таблетки букально, як описано вище, що містять насичений комплекс кладрибін-g-CD або -HPbCD. Зразки крові серії збирали впродовж 48 годин. Третій тестовий період повторив другий тестовий період за виключенням того, що суб'єкти, які раніше одержували g-циклодекстринові букальні таблетки, тепер одержували гідроксипропіл-bциклодекстринові букальні таблетки, при цьому реципієнти гідроксипропіл-b-циклодекстринових таблеток з другого періоду тепер одержували g Таб 31 81305 32 циклодекстринові букальні таблетки. Четвертий та На перших часових точках після п'ятий тестові періоди повторювали другий та внутрішньовенного застосування, плазмові третій тестові періоди за виключенням того, що концентрації перевищували верхню межу таблетки давали перорально. калібрувальної кривої. Таким чином, нижчу Рівні кладрибіну у крові вимірювали з кількість зразку ввели знову для підтвердження допомогою HPLC та LC/MS/MS методів. Систему лінійної відповіді детектору. Так як співвідношення аналізу TopFit 2.0 Фармакокінетичних та стандарт/внутрішній стандарт залишалось тим Фармакодинамічних данних використовували для самим при відповідній відповіді детектору, могли фармакокінетичного аналізу данних. Результати бути прийняті концентрації вище ніж 100нг/мл. Для дослідження біодоступності для контрольного розрахунку середнього, стандартного відхилення (внутрішньовенного) та кладрибінта CV%, використовували програмне циклодекстринового комплексів представлені у забезпечення Excel 5.0. Рівні, нижче ніж границя Таблицях III-VII та підсумовані у Таблиці VIII. кількісного аналізу не приймалися. Середні та S.D. Заголовки колонок у Таблиці III визначені значення розрахували тільки для концентрацій, наступним чином: виміряних після внутрішньовенного застосування. Спочаткова являє собою екстрапольоване значення наприкінці болюсного вливання; Сперша являє собою першу виміряну концентрацію через 5 хвилин після застосування дози; t½ кінцеве являє собою напів-період кінцевого елімінування; AUD являє собою площу під кривою, одержаною з виміряних даних, проінтегрованих з допомогою лінійної формули трапецій; AUDexcт. являє собою екстрапольовану площу з останньої виміряної часової точки до нескінченності; AUC являє собою AUD, що екстраполюють до нескінченності; СІзаг. являє собою загальний кліренс (доза/AUC); та MRTзaг. являє собою середній час утримання. Заголовки колонок у Таблицях IV-VII визначені наступним чином: Сmax являє собою максимальну виміряну концентрацію; Тmах являє coбою чaс до Cmax; t½ кінцеве являє собою напів-період кінцевого елімінування; AUD являє собою площу під кривою, одержаною з виміряних даних, проінтегрованих з допомогою лінійної формули трапецій AUDeкст. являє собою екстрапольовану площу з останньої виміряної часової точки до нескінченності; AUC являє собою AUD, екстрапольовану до нескінченності; MRTзar. являє собою середній час утримання; та F являє собою біодоступність, виражену у %. Площі піків, калібрувальні криві, значення точності, прецизійності та концентрації визначали, використовуючи Analyst Software 1.1 (ΡΕ SCIEX, Foster City, US). Для розрахунку середнього та стандартного відхилення використовували програмне забезпечення Excel 5.0. Калібрувальну криву побудували, використовуючи співвідношення концентрації аналіту та внутрішнього стандарту до співвідношення їх площ піків. Пряму лінію підганяють до експериментальних точок з допомогою лінійного регресивного аналізу за методом зважених найменших квадратів. Використана схема зважування була 1/концентрація в квадраті як пг/мл плазми. 33 81305 34 застосуванні цих двох композицій, період розчинення був довше для комплексу кладрибінгуциклодекстрин у порівнянні з комплексом кладрибін:НР-b-циклодекстрин. Хоча максимальні концентрації та профілі абсорбції показали високу між-суб'єктну мінливість, як після букального, так і після перорального застосувань, загальні відкриття (AUC) показали набагато нижчу мінливість. Пероральна біодоступність виявилась гарною: 50±3% та 45±5% для комплексів gциклодекстрину та гідроксипропіл-bциклодекстрину, відповідно. Значення букальної біодоступності були нижче: 37±10% для комплексу g-циклодекстрину та 30±4,5% для комплексу гідроксипропіл-b-циклодекстрину. Результати з додаткових порівняльних фармакокінетичних досліджень собак комплексу gциклодекстрину та суміші представлені у Таблиці IX, показаній нижче. Стовпчик "Пероральний комплекс" описує результати абсолютної біодоступності 5мг кладрибіну у 2,5г gциклодекстрину; це приблизно 10-ти разова кількість циклодекстрину у насиченому комплексі з 5мг кладрибіну. Ця композиція була такою ж самою як і у стовпчику "Пероральна суміш", за виключенням того, що комплекс був предсформований на відміну від тільки змішування компонентів. Результати для стовпчиків "Пероральна суміш" та "Пероральний комплекс" є порівнянними, показуючи, що з таким Фармакокінетичний аналіз виконано на основі великим надлишком циклодекстрину, комплекс кривих залежності окремої концентрації у плазмі утворюється у процесі розчинення, заважаючи до часу. Розрахували середнє та S.D. параметрів, розчиненню та завдаючи негативного впливу на одержаних з окремих даних. Лінійну формулу біодоступність. Використовували як і раніше тих трапецій використали для розрахунку площі під самих собак та ті ж самі експериментальні методи. кривою залежності концентрації у плазмі до часу Ці результати показують, що використання від 0 до останньої виміряної концентрації (AUD). надлишку циклодекстрину є таким, що приводить Використовуючи термінальну лінію регресії, площу до зворотних результатів, тобто насичений (AUCt-), екстрапольовану до нескінченності, кладрибін-циклодекстриновий комплекс головним розрахували наступним чином: чином вільний від надлишку циклодекстрину, що AUCt-=Срозрах./lz перевищує кількість, яка необхідна для утримання де: Срозрах. являє собою оцінену концентрацію в основному всього кладрибіну у комплексі, при у плазмі з допомогою лінії регресії у останній точці умові підвищеної біодоступності та зниженої часу взяття проби з виміряною концентрацією, яка міжпацієнтної мінливості. вище межи визначення кількісного аналізу, та lz являє собою константу швидкості, розраховану з лінії регресії. Точки, що визначають лінію регресії, тобто Біодоступність 5мг кладрибіну у 2,5 термінальну фазу, вибрали шляхом візуального Доза комплексу: мг кладри Собака визначення лінійного сегменту однологарифмічної Букальна Пероральна Пероральна суміш 1 кривої (кривої з логарифмічним масштабом на таблетка таблетка капсулі a одній вісі). Загальну площу під кривою (AUC) РМ01 30,0 51,9 35,3 розрахували шляхом додавання часткових площ: РМ02 50,0 49,6 29,5 AUC=AUD+AUC t-. AUC значення нормували РМ3 50,6 52,6 27,4 фактичною дозою, даною у певний період. Для РМ04 27,5 50,0 24,9 розрахунку біодоступності, значення РМ05 29,9 17,0* 36,1 букальної/пероральної AUC/доза розділили на значення внутрішньовенної AUC/доза. РМ06 33,1 45,4 42,3 Одержали криві залежності окремої Середнє 36,9 49,9 34,2 концентрації у плазмі до часу. Маленьку міжS.D. 10,6 2,8 6,8 суб'єктн у мінливість визначили після CV% 29 6 20 внутрішньовенного застосування. Після дуже швидкого початкового зниження, напів-період *: виключено з розрахунку середнього кінцевого елімінування кладрибіну становив а: надлишок циклодекстрину, ~10х, ніж для насиченого комплекс приблизно 10 годин. Середній загальний кліренс цих дослідженнях становить ~2,5мг з 5мг кладрибіну. виявився рівним 17мл/хвилина/кг. При букальному 35 81305 36 Результати описаних вище фармакокінетичних перевищує кількість, яка необхідна для утримання досліджень представлені графічно на Фігурах 2-6. в основному всього кладрибіну у комплексі, На Фіг.2 показано профіль плазми для забезпечує збільшену біодоступність з кладрибіну у собак після застосування 5мг прийнятною міжпацієнтною мінливістю. одноразових доз у різних композиціях, описаних Описане вище слід розглядати як ілюстрацію вище, де дані являють собою середнє ±SD для 5-6 тільки основних положень даного винаходу. Крім тварин у групі. Будують графік залежності того, для спеціаліста, кваліфікованого у даному середньої концентрації лікарського засобу у пг/мл рівні техніки, буде зрозуміло, що до заявленого плазми від часу у годинах. Хоча кожне винаходу можуть бути зроблені різні модифікації випробування проводили протягом 48-годинного та зміни, не обмежуючи даний винахід до періоду, тільки перші 6 годин представлені на конкретних тлумачень та розробок, показаних та графіках; через 6 годин, більшість концентрацій описаних, та відповідно, можна звертатися до всіх повернулась до або близько до базової лінії та, прийнятних модифікацій та їх еквівалентів, що тому, вони не показані на графіках. Вважають, що попадають у область заявленого винаходу. внутрішньовенні значення ( ) дають 100% біодоступність, та рівні плазми для пероральних та букальних форм були зрівнянні між собою. Значення символів дані у короткому описі малюнків, представленому вище. Знайдено, що букальні композиції насичених комплексів з gциклодекстрином (*) та гідроксипропіл-bциклодекстрином (х) є менш ефективними, ніж пероральні композиції у цих же випробуваннях, та це явно видно на Фіг.2. Результати для п'яти різних пероральних композицій можуть бути краще видні посиланням на Фігури 3-5. На Фіг.3 забезпечене порівняння кривих плазми для внутрішньовенної композиції ( ), пероральної композиції насиченого комплексу кладрибін-g-циклодекстрин ( ) та пероральної композиції насиченого комплексу кладрибінгідроксипропіл-b-циклодекстрин ( ), показане на Фігурі 2. Обидві ці пероральні композиції приводять до одержання бажаних кривих. На Фіг.4 забезпечене порівняння кривих плазми для пероральної композиції насиченого комплексу кладрибін-g-циклодекстрин ( ), пероральної капсули фізичної суміші кладрибіну з десятиразовим надлишком g-циклодекстрину ( ) та пероральної капсули комплексу кладрибін-gCD з десятиразовим надлишком g-циклодекстрину (), показане на Фігурі 2. З цього явно видно, що надлишок циклодекстрину знижує кількість кладрибіну у плазмі, особливо у першу годину після застосування. На Фіг.5 забезпечене порівняння кривих плазми для пероральної композиції насиченого комплексу гідроксипропіл-b-циклодекстрин (D) та пероральної капсули фізичної суміші кладрибіну з десятиразовим надлишком гідроксипропіл-bциклодекстрину (D), показане на Фігурі 2. З цього знову явно видно, що надлишок циклодекстрину знижує кількість кладрибіну у комплексі. У цьому випадку, зниження видно у перші дві години після застосування. На Фіг.6 проілюстровані сумарні площі під кривими (AUC) у пг x год./мл для восьми композицій, показаних на Фіг.2. Знову, дані є середніми для 5-6 тварин у групі. Таким чином, на фігурах графічно проілюстровано те, що показують дані у Таблицях III-IX, що насичений кладрибін-циклодекстриновий комплекс, рецептований як тверда пероральна або трансмукозна лікарська форма, головним чином вільний від надлишку циклодекстрину, що 37 81305 38
ДивитисяДодаткова інформація
Назва патенту англійськоюFormulation of cladribine (variants), cladribine-cyclodextrin complex, use of cladribine-cyclodextrin complex, mixture
Автори англійськоюBodor Nicholas S.
Назва патенту російськоюКомпозиция кладрибина (варианты), кладрибин-циклодекстриновый комплекс, применение кладрибин-циклодекстринового комплекса (варианты), смесь
Автори російськоюБодор Николас С.
МПК / Мітки
МПК: A61P 25/00, A61K 31/52, A61K 9/20, A61K 47/08
Мітки: кладрибіну, застосування, кладрибін-циклодекстриновий, суміш, варіанти, комплекс, кладрибін-циклодекстринового, композиція, комплексу
Код посилання
<a href="https://ua.patents.su/19-81305-kompoziciya-kladribinu-varianti-kladribin-ciklodekstrinovijj-kompleks-zastosuvannya-kladribin-ciklodekstrinovogo-kompleksu-varianti-sumish.html" target="_blank" rel="follow" title="База патентів України">Композиція кладрибіну (варіанти), кладрибін-циклодекстриновий комплекс, застосування кладрибін-циклодекстринового комплексу (варіанти), суміш</a>
Попередній патент: Композиція кладрибіну (варіанти), спосіб її одержання, кладрибін-циклодекстриновий комплекс та його застосування
Наступний патент: Спосіб термо-механічної обробки гарячекатаної чорнової стрічки, отриманої на лінії безперервного лиття тонкого слябу, і система для змотування та розмотування її
Випадковий патент: Одноразовий медичний шприц