C-арилглікозидні інгібітори sglt2 і процес лікування з їх використанням
Формула / Реферат
1. Сполука формули І
 І
І
або її фармацевтично прийнятні сіль, комплексна сполука, стереоізомер чи естерні проліки.
2. Фармацевтичний склад, який містить сполуку формули І і відповідний фармацевтично прийнятний носій.
3. Фармацевтична комбінація, яка містить сполуку формули І і принаймні один терапевтичний засіб, вибраний із сукупності, що складається із антидіабетичного засобу, засобу від ожиріння, антигіпертензивного засобу, антиатеросклеротичного засобу і засобу зниження ліпідів.
4. Фармацевтична комбінація за п. 3, яка містить сполуку формули І і принаймні один антидіабетичний засіб.
5. Комбінація за п. 4, де антидіабетичним засобом є принаймні один засіб, вибраний із сукупності, що складається із бігуаніду, сульфонілсечовини, інгібітора глюкозидази, гамма-агоніста PPAR, подвійного альфа/гамма-агоніста PPAR, інгібітора аР2, інгібітора DPP4, інсуліносенсибілізатора, глюкагоноподібного пептиду-1 (GLP-1), інгібітора РТР1В, інгібітора глікогенфосфорилази, інгібітора глюкозо-6-фосфатази, інсуліну і меглітиніду.
6. Комбінація за п. 4, де антидіабетичним засобом є принаймні один засіб, вибраний із сукупності, що складається із метформіну, глібуриду, глімепіриду, гліпіриду, гліпізиду, хлорпропаміду, гліклазиду, акарбози, міглітолу, піоглітазону, троглітазону, розиглітазону, інсуліну, ізаглітазону, репаглініду, натеглініду, мураглітазару і пеліглітазару.
7. Комбінація за п. 4, яка містить сполуку формули І у масовому відношенні до антидіабетичного засобу, що лежить в інтервалі приблизно від 0,01 до 300:1.
8. Комбінація за п. 3, де засобом від ожиріння є принаймні один засіб, вибраний із сукупності, що складається з бета-3-адренергічного агоніста, інгібітора ліпази, інгібітора повторного поглинання серотоніну, ліків на основі тиреоїдного бета-рецептора, агоніста 5НТ2С, антагоніста MCHR1, агоніста рецептора меланокортину, антагоніста рецептора гормону концентрації меланіну, модулятора рецептора галаніну, антагоніста аорексину, агоніста ССК, антагоніста NPY1 або NPY5, модулятора NPY2 або NPY4, агоніста фактора вивільнення кортикотропіну, модулятора гістамінового рецептора-3 (Н3), інгібітора 11-бета-HSD-1, модулятора адинопектинового рецептора, інгібітора повторного поглинання моноаміну, циліарного нейротрофічного фактора, нейротрофічного фактора мозкового походження, модулятора лептину або лептинового рецептора, антагоніста канабіноїдного-1 рецептора та анорексичного засобу.
9. Комбінація за п. 8, де засобом від ожиріння є принаймні один засіб, вибраний із сукупності, що складається із римонабанту, орлістату, сибутраміну, топірамату, дексамфетаміну, фентерміну, фенілпропаноламіну та мазиндолу.
10. Комбінація за п. 3, де засобом зниження ліпідів є принаймні один засіб, вибраний із сукупності, що складається із інгібітора МТР, інгібітора СЕТР, інгібітора HMG СоА-редуктази, інгібітора скваленсинтетази, похідної фібринової кислоти, позитивного регулятора LDL-рецепторної активності, інгібітора ліпоксигенази та інгібітора АСАТ.
11. Комбінація за п. 10, де засобом зниження ліпідів є принаймні один засіб, вибраний із сукупності, що складається із правастатину, ловастатину, зимвастатину, аторвастатину, церивастатину, флувастатину, нізвастатину, візастатину, атавастатину, розувастатину, фенофібрату, гемфіброзилу, клофібрату й авазимібу.
12. Комбінація за п. 10, яка містить сполуку формули І у масовому відношенні до засобу зниження ліпідів, що лежить в інтервалі приблизно від 0,01 до 300:1.
13. Процес лікування або затримування розвитку чи настання діабету, діабетичної ретинопатії, діабетичної нервопатії, діабетичної нефропатії, затриманого загоєння ран, інсуліностійкості, гіперглікемії, гіперінсулінемії, підвищених рівнів вільних жирних кислот або гліцерину в крові, гіперліпідемії, ожиріння, гіпертригліцеридемії, синдрому X, діабетичних ускладнень, атеросклерозу або гіпертензії, або для підвищення рівнів ліпопротеїду високої густини у крові, в якому вводять терапевтично ефективну кількість сполуки формули І.
14. Процес за п. 13, в якому вводять одночасно або послідовно терапевтично ефективну кількість принаймні одного додаткового терапевтичного засобу, вибраного із сукупності, що складається із антидіабетичного засобу, засобу від ожиріння, антигіпертензивного засобу, антиатеросклеротичного засобу і засобу зниження ліпідів.
15. Процес лікування діабету II типу, в якому вводять терапевтично ефективну кількість сполуки формули І самостійно або в комбінації принаймні з одним іншим терапевтичним засобом, вибраним із сукупності, що складається із антидіабетичного засобу, засобу для лікування ускладнень від діабету, засобу від ожиріння, антигіпертензивного засобу, антитромбоцитного засобу, антиатеросклеротичного засобу і гіполіпідемічного засобу.
16. Сполука, яка має структуру
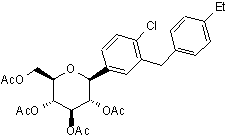 .
.
Текст
1. Сполука формули І Et 2 (19) 1 3 88647 4 вастатину, нізвастатину, візастатину, атавастатину, розувастатину, фенофібрату, гемфіброзилу, клофібрату й авазимібу. 12. Комбінація за п. 10, яка містить сполуку формули І у масовому відношенні до засобу зниження ліпідів, що лежить в інтервалі приблизно від 0,01 до 300:1. 13. Процес лікування або затримування розвитку чи настання діабету, діабетичної ретинопатії, діабетичної нервопатії, діабетичної нефропатії, затриманого загоєння ран, інсуліностійкості, гіперглікемії, гіперінсулінемії, підвищених рівнів вільних жирних кислот або гліцерину в крові, гіперліпідемії, ожиріння, гіпертригліцеридемії, синдрому X, діабетичних ускладнень, атеросклерозу або гіпертензії, або для підвищення рівнів ліпопротеїду високої густини у крові, в якому вводять терапевтично ефективну кількість сполуки формули І. 14. Процес за п. 13, в якому вводять одночасно або послідовно терапевтично ефективну кількість принаймні одного додаткового терапевтичного засобу, вибраного із сукупності, що складається із антидіабетичного засобу, засобу від ожиріння, антигіпертензивного засобу, антиатеросклеротичного засобу і засобу зниження ліпідів. 15. Процес лікування діабету II типу, в якому вводять терапевтично ефективну кількість сполуки формули І самостійно або в комбінації принаймні з одним іншим терапевтичним засобом, вибраним із сукупності, що складається із антидіабетичного засобу, засобу для лікування ускладнень від діабету, засобу від ожиріння, антигіпертензивного засобу, антитромбоцитного засобу, антиатеросклеротичного засобу і гіполіпідемічного засобу. 16. Сполука, яка має структуру Дана заявка претендує на корисний ефект від пріоритету попередньої заявки на Патент США №60/612,599 від 23 вересня 2004, вміст якої включений тут в усій його повноті шляхом посилання. Даний винахід стосується С-арилглікозидів, що є селективними інгібіторами наявних у нирках Na-залежних транспортерів глюкози і процесу лікування діабету чи розладів за допомогою таких Сарилглікозидів, використовуваних як самостійно, так і в комбінаціях з одним чи більше терапевтичними засобами інших типів. На діабет II типу (NIDDM) в усьому світі страждає приблизно 100млн. людей. Цей діабет характеризується наявністю у хворого гіперглікемії внаслідок надмірного печінкового продукування глюкози і загальним опором інсуліну, корінні причини яких досі не з'ясовано. Протистояти розвитку діабетичних ускладнень і руйнуванню бета-клітин на розвиненій стадії хвороби можна шляхом послідовного регулювання рівнів глюкози у плазмі хворих на діабет. Глюкоза плазми звичайно фільтрується в ниркових клубочках і активно реабсорбується у проксимальному нирковому канальці. В епітеліальних клітинах нирок раннього сегмента S1 ниркового кортикального проксимального канальця відбувається 90% повторного поглинання глюкози в нирках. Головним транспортером, відповідальним за це повторне поглинання глюкози, є, очевидно, білок SGLT2, що складається із 672 амінокислот, містить 14 сегментів, що перекривають товщину мембрани, та експресується, головним чином, у ранньому сегменті S1 ниркових проксимальних канальців. Субстратна специфічність, залежність від натрію і місце розташування білка SGLT2 добре узгоджуються з властивостями високомісткого, низькоафінного і натрій-залежного транспортера глюкози, знайденого раніше і дослідженого в кортикальних проксимальних канальцях нирок людини. Крім того, в дослідженнях з гібридного виснаження білок SGLT2 був визнаний домінуючим співтранспортером Na+ і глюкози в сегменті S1 проксимального канальця, оскільки фактична вся Na-залежна активність транспортування глюкози, кодована в м-РНК із кіркової речовини нирок щурів, інгібується протизмістовним олігонуклеотидом, специфічним до SGLT2 щура. У людей мутації в SGLT2 були пов'язані зі спадковими формами ниркової глікозурії, надаючи таким чином додаткове свідчення щодо першорядної ролі білка SGLT2 у реадсорбції глюкози в нирках. У таких пацієнтів ниркова морфологія і ниркова функція в іншому є цілком нормальними. Інгібування білка SGLT2 повинно було б знижувати рівні глюкози плазми внаслідок підвищеної експресії глюкози у хворих на діабет. Білок SGLT1, інший Na-залежний співтранспортер глюкози, котрий на амінокислотному рівні є на 60% ідентичним білку SGLT2, експресується в тонкій кишці і в більш дистальному сегменті S3 ниркового проксимального канальця. Попри їхню подібність послідовностей, людські білки SGLT1 і SGLT2 є біохімічно розрізнюваними. Введення флоризину, специфічного інгібітора SGLT-активності, дає підтвердження цієї концепції in vivo у декількох діабетичних моделей гризунів і одній діабетичній моделі собаки тим, що стимулює екскрецію глюкози, знижує глюкозу плазми у стані голодування і нагодованому стані і стимулює споживання глюкози без гіпоглікемічних побічних ефектів. При цьому протягом двотижневого лікування флоризином не спостерігалося шкідливої побічної дії на іонний баланс плазми, ниркову функцію і ниркову морфологію. Крім того, не спостері Et Cl AcO O AcO OAc OAc . 5 галося також гіпоглікемічних та інших шкідливих ефектів при введенні флоризину нормальним тваринами, не зважаючи на наявність у них глікозурії. Танабе Сеяку (Tanabe Seiyaku) повідомляв про те, що введення інгібітора ниркових SGLT білків протягом 6 місяців поліпшувало рівні глюкози плазми у стані голодування і нагодованому стані, секрецію та споживання інсуліну в опасистих моделях NIDDM-діабету щурів і протистояло розвитку нефропатії і невропатії при відсутності гіпоглікемічних і ниркових побічних ефектів. Загальні інгібітори SGLT1- і SGLT2-активності є для застосування в терапевтичних цілях нецікавими, оскільки інгібування SGLT1 може давати також шкідливі наслідки, як це було показано спадковим синдромом зниженого всмоктування глюкози та галактози (GGM), при котрому мутація у співтранспортері SGLT1 призводила до погіршення поглинання глюкози в кишечнику і до загрозливих для життя діареї та зневоднення. Очікується, що селективне інгібування SGLT2 у хворих на діабет дозволить нормалізувати глюкозу плазми шляхом збільшення екскреції глюкози в сечі і тим самим - поліпшення чутливості до інсуліну і затримки розвитку діабетичних ускладнень при відсутності значних гастроінтестинальних побічних ефектів. У зв'язку з вищеописаними обставинами, відкриття сполук, селективних до транспортера SGLT2, може продемонструвати корисність лікування та профілактики ними хвороб або розладів, пов'язаних з регулюванням рівнів глюкози в плазмі, і зокрема, діабету. Згідно з даним винаходом пропонується Сарилглікозидна сполука, яка має таку структуру, що виражається формулою І: Методика А В С 88647 6 Сполукою за формулою І можуть бути в тому числі її фармацевтично прийнятні солі, комплексні сполуки, стереоізомери та їхні естерні проліки. Сполука за формулою І володіє активністю селективного інгібітора білка SGLT2 і, отже, може використовуватися для лікування та профілактики хвороб і розладів, пов'язаних з регулюванням рівнів глюкози в плазмі. До числа таких хвороб і розладів належать, зокрема, діабет та мікро- і макросудинні ускладнення діабету. Таким чином, даним винаходом пропонуються сполука за формулою І, фармацевтичні склади, в яких така сполука може використовуватися, а також процеси застосування такої сполуки. Зокрема, даним винаходом пропонується фармацевтичний склад, який містить терапевтично ефективну кількість сполуки за формулою І окремо або в комбінації з фармацевтично прийнятним носієм. Крім того, процес згідно з даним винаходом призначається для лікування або затримування розвитку чи настання зазначених у даному описі хвороб або розладів і включає у себе введення терапевтично ефективної кількості сполуки за формулою І пацієнту-людині, що потребує такого лікування. Сполука згідно з даним винаходом може використовуватися відокремлено або в комбінації із засобом чи засобами, які вживаються в описаних тут галузях терапії. Крім того, пропонується процес лікування зазначених у даному описі хвороб, який включає у себе введення пацієнту-людині, що потребує такого лікування, терапевтично ефективної кількості сполуки за формулою І і протидіабетичного засобу іншого типу і/або терапевтичного засобу іншого типу, котрим може бути, наприклад, гіполіпідемічний засіб. У наведеній нижче таблиці сполука згідно з винаходом (сполука 1, колонка 4) порівнюється зі сполуками, що мають подібні їй структури, за кількома показниками, що стосуються їхньої корисності і комерційної життєздатності. Структури сполук 1 (згідно з винаходом) і 3-5 подані нижче. Властивість 5 Зменшення глюкози плазми у діабетичних STZ щурів на 5 годину після введення оральної дози 0,1мг/кг, у відсотках від контроль- 34% них тварин, які отримували лише носій Стабільність у прототипному складі Так Кластогенна активність in vitro Так Номер сполуки 4 3 1(1) 60% 59% 62% Так Так Ні Так Ні 7 Як показано у наведеній вище порівняльній таблиці, лише сполука за формулою І демонструє сприятливі характеристики в усіх досліджених категоріях показників. Інакше кажучи, лише сполука за формулоюІ демонструє сприятливе зниження глюкози плазми у діабетичних щурів (активність лікарського засобу), стабільність у прототипному складі (тривалість зберігання) і негативний результат у дослідженнях на кластогенну активність in vitro (знижений онкогенний потенціал). Індивідуальний протокол для порівняльних досліджень I. Методика досліджень А: визначення ефекту глюкози крові у діабетичних щурів, оброблених стрептоцотоцином Для прогнозування впливу сполук, включених у подану вище порівняльну таблицю, на глюкозу плазми був проведений описаний нижче аналіз. Самців щурів породи Sprague Dawley (Charles River) масою тіла 250-275г робили діабетичними шляхом одноразової внутрішньоперитонеальної ін'єкції стрептоцотоцину (Sigma) з дозою 65мг/кг, приготованого у свіжоохолодженому (4°С) 0,01М цитратному буфері. Через чотири дні тварин знекровлювали у нагодованому стані. Всю кров збирали через кінчик хвоста й аналізували на вміст глюкози методом окислювання глюкози глюкометром Glucometer Elite (Bayer). Середні рівні глюкози в крові лежали в межах 450-550мг/дл. У день проведення експерименту досліджувану сполуку розчиняли в носії, що складався із 5% m-піролу, 20% PEG 400 і 20ммоль дифосфату натрію. Щурів зважували, поділяли випадковим чином на 4 групи по 6 тварин у кожній групі і пероральним шляхом вводили контрольним особинам носій, а решті тварин - 0,1мг/кг досліджуваної сполуки. Загальний об'єм пероральної дози, що вводилася через шлунковий зонд, складав 1мл/кг ма 88647 8 си тіла. Після введення цих доз їжу із кліток забирали, і щурам упродовж експерименту давали в необмеженій кількості воду. Зразки крові відбирали із кінчика хвоста на 0, 30, 60, 120, 180, 240 and 300 хвилинах після введення препаратів. Вміст глюкози в крові аналізували методом окислювання глюкози глюкометром Glucometer Elite (Bayer). А. Статистичний аналіз даних Обчислення середніх рівнів глюкози в крові і зміну їх у відсотках від кількості носію в кожній точці часу проводили за допомогою програми Microsoft Excel. Статистичний аналіз (Т тести або ANOVA з наступним тестом Фішера (Fisher's test), що порівнювали медикаментозні групи тварин з контрольними) проводили за допомогою програми Microsoft Excel та програми статистичної обробки даних StatView. Статистично значущою вважалася величина р менше 0,05. II. Методика досліджень В: визначення стабільності нестійкого щодо окислювання терапевтичного засобу при наявності звичайно використовуваних твердих ексципієнтів в умовах прискореного старіння Для оцінки хімічної стабільності сполуки 3 при наявності звичайно використовуваних твердих ексципієнтів і типових антиоксидантів була застосована така методика. Лікувальну речовину розтирали в порошок товкачиком у ступці з відповідним антиоксидантом, а потім змішували в сухому стані з ексципієнтами, переліченими в наведеній нижче таблиці. У цих дослідах як антиоксиданти використовувалися метабісульфіт натрію і бутильований гідроксиланізол (ВНА: butylated hydroxyl anisol). BHA використовували у двох кількостях - 0,01%(мас.) і 0,5%(мас), а метабісульфіт натрію використовували в кількості 0,01%(мас). Пляшечки зі зразками, 9 88647 що зберігалися при температурі 40°С, відносній вологості 73% і HIL/uv, продували киснем і герметично закривали. Суміші (А-D) ліків з ексципієнтами за 1 і 3 тижні перед HPLC аналізом поміщали в різні умови прискореного старіння, перелічені в 10 другій таблиці. Сполуки, котрі не виказували очевидної окисної нестабільності (сполуки 1, 4 і 5), були визначені як хімічно стабільні при наявності ексіципієнтів, які звичайно використовуються у твердих лікарських формах. Таблиця 1 Ексиципієнти, які звичайно використовуються при наявності та відсутності антиоксидантів, використовуваних в дослідах з оцінки стабільності сумішей-прототипів ліків з ексципієнтами Інгредієнт Сполука 3 Гідролактоза Мікрокристалічна целюлоза PVP Попередньо желатинований крохмаль Crospovidone XL-1 0 Етер гліколевої кислоти натрієвого крохмалю Стеарат магнію Двоокис кремнію Стеарилфумарат натрію Антиоксидант Суміш ліків з ексципієнтами,%(мас.) А В С D 12,9 12,9 12,9 12,9 59,6 21,4 59,6 21,4 20,0 42,7 20,0 42,7 5,0 5,0 20,0 20,0 2,0 2,0 2,0 2,0 0,5 0,5 0,5 0,5 0,5 0,5 0,01 0,01 Таблиця 2 Умови для досліджень стабільності сумішей ліків з ексципієнтами в умовах прискореного старіння Умови 5°С (в закритому стані) 25°С, відносна вологість 60% (в закритому стані) 40°С, відносна вологість 75%-О2- (в закритому стані) 25°C-O2-HlL/uv (в закритому стані) III. Методика досліджень С: дослідження цитогенетики в клітинах яєчника китайського хом'ячка Дуже бажано якомога раніше виявляти ті потенційні терапевтичні засоби, котрі можуть бути онкогенними для людини. Одним із ранніх способів виявлення потенційної канцерогенності даної сполуки є дослідження її кластогенності in vitro1. Для прогнозування in vitro кластогенної активності сполук терапевтичного призначення застосовували таку методику. Кластогенність прогнозували шляхом визначення здатності досліджуваних сполук викликати структурні ушкодження хромосом у клітинах яєчника китайського хом'ячка (СНО: Chinese hamster ovary). При цьому якщо ушкодження хромосом значно перевищували фоновий рівень, це вважалося свідченням того, що дана сполука мала кластогенний потенціал. Виявлення суттєво підвищеного рівня хромосомного ушкодження вважалося в даних дослідженнях індикатором генетичного ушкодження. A. Носій випробуваного зразка і контрольні зразки Час, тижні 0 1 3 1 3 1 3 1 3 Як контрольний носій використовували диметилсульфоксид (DMSO). Позитивними контрольними речовинами служили мітоміцин С для 3годинної і 20-годинної експозиції без S9 активації і циклофосфамід для 3-годинної експозиції печінковими ферментами S9 щура. Як мітоміцин С, так і циклофосфамід розбавляли стерильною водою. B. Введення досліджуваної сполуки Вибір концентрації Готували по два маточні розчини досліджуваних сполук у DMSO - один з високою концентрацією, а інший з низькою концентрацією. Після обробки клітин СНО збирали аліквоти носійного контролю та розчинів низького і високого дозування, слідом за чим проводили аналіз для визначення концентрації досліджуваної сполуки. Вибір концентрацій ґрунтувався на результатах аналізу GLP-нерозчинності, зміщуваності і визначення інтервалу цитотоксичності (АТР: аденозинтрифосфат) з досліджуваною сполукою. При встановленні верхньої межі розчинності досліджуваної сполуки у DMSO, цей розчин у DMSO додавали до культурального середовища для визначення 11 88647 впливу на рН та осмоляльність. В аналізі з визначення інтервалу цитотоксичності тестували одинадцять концентрацій досліджуваної сполуки як при наявності (3 години), так і при відсутності (20 годин) печінкових ферментів (S9) щура. Найвищою в цих тестах була концентрація 10ммоль, 5000мкг/мл, або межі розчинності. Ґрунтуючись на результатах аналізу розчинності, зміщуваності і визначення інтервалу цитотоксичності (АТР: аденозинтрифосфат), було вибрано шість концентрацій для проведення тестів у повних цитогенетичних дослідженнях. Концентрації досліджуваних зразків Маточний розчин досліджуваної сполуки в DMSO мав концентрацію, що в 100 разів перевиГрупа обробки щувала найвищу концентрацію випробуваного зразка у повному аналізі. Дослідженням піддавали шість концентрацій. Реакція на цитотоксичність дози, що спостерігалася в дослідженнях з визначення інтервалу цитотоксичності, визначала коефіцієнт послідовного розбавляння для п'яти нижчих доз. Загальний об'єм дози 50мкл (маточний розчин плюс DMSO) додавали до 5мл культурального середовища для всіх груп обробки. Схема експерименту Для кожної групи обробки готували по дві культури. Експеримент проводили за такою схемою: 3 год. з S9 DMSO Концентрація А досліджуваної сполуки Концентрація В досліджуваної сполуки Концентрація С досліджуваної сполуки Концентрація D досліджуваної сполуки Концентрація Е досліджуваної сполуки Концентрація F досліджуваної сполуки Мітоміцин С Мітоміцин С Циклофосфамід Колба 3 год. без S9 1-2 3-4 5-6 7-8 9-10 11-12 13-14 15-16 17-18 19-20 21-22 23-24 25-26 27-28 29-30 31-32 D. Порядок проведення тестування Клітинну лінію СНО виводили із біопсії яєчників самиці китайського хом'ячка. Використовувані в цьому аналізі первісні клітини (CHO-WBL) отримувалися від лабораторії д-ра С. Вольфа із Каліфорнійського університету в Сан-Франциско (Dr. S. Wolff, University of California, San Francisco). Ці клітини після їх одержання піддавали субклонуванню для підтримування їхньої каріотипічної стабільності. Використовувана клітинна лінія має середню тривалість циклу від 12 до 14 годин і модальне хромосомне число 21. За стабільністю каріотипу і можливим забрудненням мікоплазми клітин вели регулярний моніторинг. E. Ідентифікація Усі використовувані в даних дослідженнях колби і пробірки з культурами маркували цифровими номерами. Центрифужні пробірки для збирання, гіпотонічної обробки і фіксації клітин позначали номерами, ідентичними з номерами відповідних колб. Крім того, такі самі номера, що й центрифужні пробірки, приписували мікроскопічним препаратам, приготованим із фіксованих клітин. Мікроскопічні препарати кодував незалежний спостерігач для забезпечення об'єктивності цитогенному аналізу на хромосомні аберації. Кодованим мікроскопічним препаратам призначали постійні номера. F. Методика експерименту Оцінку хромосомної аберації проводили за стандартними методиками2-6, шляхом піддавання СНО клітинних культур дії мінімум чотирьох концентрацій досліджуваного зразка, а також позитивного контрольного зразка і контрольного зразка 12 20 год. Концентрація роз- Кінцева номінальна без S9 чину дози, концентрація, мг/мл мг/мл 33-34 35-36 37-38 39-40 41-42 43-44 45-46 0,01 0,1 47-48 0,005 0,05 1 10 носія. У неактивованій піддослідній системі обробка тривала приблизно 3 години і 20 годин, а в S9активованій піддослідній системі експозиція тривала 3 години7,8. Метаболічна S9-активація Екзогенна система метаболічної активації (S9) складалася із Aroclor 1254-індукованої (постмітохондріальної) фракції S9 печінки щура, а також солей і кофакторів. Кінцева концентрація S9, солей і кофакторів в екзогенній системі метаболічної активації (S9) становила 10мкл/мл (1% (об.)) Aroclor 1254-індукованої (постмітохондріальної) фракції S9 печінки щура, 2,5ммоль МgСІ2×6Н2О, 1,25ммоль глюкозо-6-фосфату, 10,3 ммоль KСІ, 1ммоль NADP (нікотинамід-аденін-динуклеодитфосфату) і 12,8ммоль Na2HPO4. Готування клітин-мішеней CHO-WBL клітини з експоненціальним ростом висівали у середовище 5А Мак-Коя (McCoy's 5А), доповнене 10% фетальної телячої сироватки, Lглутаміном (2ммоль), пеніциліном G (100 одиниць/мл) і стрептоміцином (100мкг/мл) з густиною приблизно 0,5´106 клітин/25см2 колбу. Колби інкубували при приблизно 37°С у зволоженій атмосфері приблизно 5% СО2 у повітрі упродовж 16-24 годин. Обробка клітин-мішеней На наступний день після ініціації культури культуральне середовище заміняли свіжим. Клітини з 3- і 20-годинними експозиціями без метаболічної активації піддавалися обробці шляхом введення доз у повне середовище, описане вище. У клітин з 3-годинними експозиціями і метаболічною S9-активацією середовище було ідентичним опи 13 саному вище за винятком того, що воно не містило фетальної телячої сироватки і містило S9, солі і кофактори. Після 3-годинної обробки з метаболічною активацією і без неї середовище відсмоктували, а клітини промивали фосфат-буферизованим фізіологічним розчином, підживлювали повним середовищем і повертали до інкубатора. Збирання метафазних клітин Клітини збирали в єдиний час - приблизно через 20 годин з моменту початку обробки. Цей період відповідав приблизно 1,5 разовому клітинному циклу із приблизно 13 годин8. За 2-3 години перед збиранням клітин до культур додавали Colcemid® y кінцевій концентрації 0,1мкг/мл. Клітини збирали шляхом трипсинізації, а потім - центрифугування, і від зібраних культур відбирали аліквоти для визначення кількості клітин і відсотка життєздатних клітин. Отримані величини кількості клітин і відсотка життєздатності використовували для визначення інгібування росту клітин по відношенню до контрольного зразканосія (цитотоксичність). До решти клітин для їх набухання додавали 0,075М KСІ, тричі поспіль промивали фіксаційною сумішшю (метанол : льодяна оцтова кислота, 3:1 (об.)), закривали кришкою і зберігали протягом ночі чи довше при температурі в інтервалі 2-8°С. Для готування мікроскопічних препаратів клітини збирали шляхом центрифугування і повторно суспендували у свіжій фіксаційній суміші. Суспензію фіксованих клітин накладали на предметні стекла мікроскопу і сушили на повітрі. Мікроскопічні препарати забарвлювали барвником Гімзе (Giemsa) і закріпляли на предметному столику мікроскопа. G. Аналіз хромосомної аберації На основі отриманих результатів стосовно цитотоксичності вибирали мінімум три концентрації для аналізу хромосомної аберації. У загальному випадку концентрації, що зменшували кількість підрахованих клітин або мітотичний індекс більш, ніж на 50%, не приймалися для оцінки хромосомної аберації, оскільки мало місце свідчення того, що надмірна цитотоксичність може викликати хромосомні аберації, які не мають відношення до прямого кластогенного ефекту досліджуваного зразка.9-10 Мінімум по 500 клітин від кожного мікроскопічного препарату і по два таких препарати на колбу оцінювали на частоту клітин у мітозі (мітотичний індекс), і мінімум по 100 мітотичних клітин оцінювали на частоту числових аберацій (поліплоїдію й ендоредуплікацію). Від кожної колби дублікату по 50 метафаз із різних препаратів підраховували на структурні хромосомні аберації двома незалежними методиками оцінки. При цьому оцінювали тільки ті метафази, котрі містили 21±2 хромосом. Результати цих двох незалежних оцінок об'єднували, отримуючи 100 метафаз на колбу і 200 метафаз на концентрацію для структурних хромосомних аберацій. Авторами помічені ті випадки, коли ці числа було неможливо отримати через цитотоксичність і коли спостерігалося ³50% аберантних метафаз у перших 25 метафазах на препарат. Н. Статистичний аналіз даних 88647 14 Кількості і типи виявлених аберацій, відсоток структурно ушкоджених клітин (відсоток аберантних клітин) у загальній дослідженій клітинній популяції і середня кількість аберацій на клітину були обчислені і наведені тут для кожної групи обробки. В отриманих даних були наявні хроматидні та ізохроматидні пробіли, котрі проте не були включені у загальний відсоток клітин з однією чи більше абераціями, а також у частоту структурних аберацій на клітину. Статистичний аналіз частоти аберантних клітин (структурних або числових) проводили за допомогою точного тесту Фішера (Fisher's exact test). Тест Фішера використовували для порівняння по парах частоти аберантних клітин кожної з груп обробки з частотою контрольної групи, що отримувала розчинник. Якщо тест Фішера давав позитивні результати на будь-якому рівні дози досліджуваного зразка, то для вимірювання відповіді на дозу проводили тест Кочрана-Армітеджа (Cochran-Armitage test). При інтерпретації даних досліджуваний зразок розглядали як такий, що викликає позитивну реакцію, якщо відсоток клітин з абераціями зростав у відповідь на дозу, причому статистично значущими (p£0,05) були не менше однієї концентрації. Проте, величини, які були статистично значущими, але не перевищували інтервалу історично негативного або носійного контролів, можна було вважати біологічно незначущими. Досліджувані зразки, які не показали статистично значущого зростання в абераціях, були віднесені до розряду негативних. І. Критерій прийнятності аналізу Повний аналіз на хромосомні аберації вважався прийнятним, якщо він задовольняв переліченим нижче критеріям. 1) Культури з позитивним контролем повинні були демонструвати зростання частоти хромосомної аберації, яка є статистично значущою на 5% рівні. 2) Відсоток ушкоджених метафаз у контрольних культурах, що отримували носії, не повинен був перевищувати (в середньому) 6%. 3) Досліджуваний зразок принаймні при найвищій дозі повинен показувати деяку цитотоксичність (тобто зниження підрахованої кількості клітин або мітотичного індексу). Якщо цитотоксичність не спостерігалася при найвищій концентрації, але досліджуваний зразок був на межі розчинності або на межі його концентрації дозування (тобто 10ммоль чи 5000мкг/мл), або на межі його об'єму (20%), то проведений аналіз вважався прийнятним. J. Критерії для позитивної реакції Реакція на досліджувану сполуку вважалася позитивною, якщо задовольнялися перелічені нижче критерії. 1) Точний тест Фішера показував статистично значуще (р
ДивитисяДодаткова інформація
Назва патенту англійськоюC-aryl glucoside sglt2 inhibitors and method of treatment using thereof
Автори англійськоюWashburn William, Meng Wei
Назва патенту російськоюC-арилгликозидные ингибиторы sglt2 и процесс лечения с их использованием
Автори російськоюВошберн Вильям, Менг Вей
МПК / Мітки
МПК: C07H 7/00, A61K 31/70, C07H 15/04
Мітки: лікування, процес, sglt2, c-арилглікозидні, інгібітори, використанням
Код посилання
<a href="https://ua.patents.su/19-88647-c-arilglikozidni-ingibitori-sglt2-i-proces-likuvannya-z-kh-vikoristannyam.html" target="_blank" rel="follow" title="База патентів України">C-арилглікозидні інгібітори sglt2 і процес лікування з їх використанням</a>
Попередній патент: Способи одержання 3-о-захищених морфінонів і 3-о-захищених морфінондієнолкарбоксилатів, а також композиція для окислення спирту до кетону
Наступний патент: Інгібітори c-fms кінази
Випадковий патент: Рекламний пристрій