Молекула, яка інгібує ангіогенез, і її застосування в лікуванні і діагностиці раку
Формула / Реферат
1. Інгібуюча ангіогенез молекула, вибрана з групи, яка складається з антитіла Н33, продукованого гібридомою 13Н33, депонованою 22 жовтня 2003 року в Німецькій колекції мікроорганізмів і клітинних культур GmbH під реєстраційним номером DSM АСС2622, а також його фрагментів і похідних, які мають ту ж специфічність, що і Н33.
2. Інгібуюча ангіогенез молекула за п. 1, вибрана з групи, що складається з
a) гуманізованого антитіла на основі антитіла Н33, яке має ту ж специфічність, що і Н33;
b) химерного антитіла на основі антитіла Н33, яке має ту ж специфічність, що і Н33;
c) фрагмента Н33, вибраного з
(і) Fab-фрагмента;
(іі) Fv-фрагмента;
(ііі) однодоменного антигензв'язувального фрагмента;
(iv) scFv, димеру scFv, тримеру scFv і більш великих агрегацій scFv;
( V ) V HН;
d) рекомбінантного антитіла, що має специфічність Н33; і
e) людського моноклонального антитіла, яке має ту ж специфічність, що і Н33.
3. Інгібуюча ангіогенез молекула за пп. 1 або 2, де вказана молекула
a) блокує ангіогенез in vitro і in vivo;
b) запобігає пухлинному росту in vivo;
c) знижує рекрутинг макрофагів у пухлинах; і
d) блокує взаємодію JAM-C з JAM-B.
4. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для отримання лікарського засобу.
5. Гібридома 13Н33, депонована в Німецькій колекції мікроорганізмів і клітинних культур GmbH під реєстраційним номером DSM АСС2622, яка продукує інгібуючу ангіогенез молекулу.
6. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для отримання терапевтичної композиції для лікування раку.
7. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для отримання діагностичної композиції для діагностики раку.
8. Застосування за п. 6, де рак являє собою солідну пухлину.
9. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для отримання лікарського засобу для запобігання у пацієнтів взаємодії JAM-B/JAM-C.
10. Фармацевтична композиція, яка містить інгібуючу ангіогенез молекулу за будь-яким з пп. 1-3 разом з прийнятним наповнювачем, носієм або розріджувачем.
11. Діагностична композиція, яка містить інгібуючу ангіогенез молекулу за будь-яким з пп. 1-3 разом з прийнятним наповнювачем, носієм або розріджувачем.
12. Діагностична комнозиція за п. 11, де інгібуюча ангіогенез молекула є міченою.
13. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для інгібування ангіогенезу.
14. Застосування діагностичної композиції за будь-яким з пп. 11 або 12 в діагностиці раку in vivo.
Текст
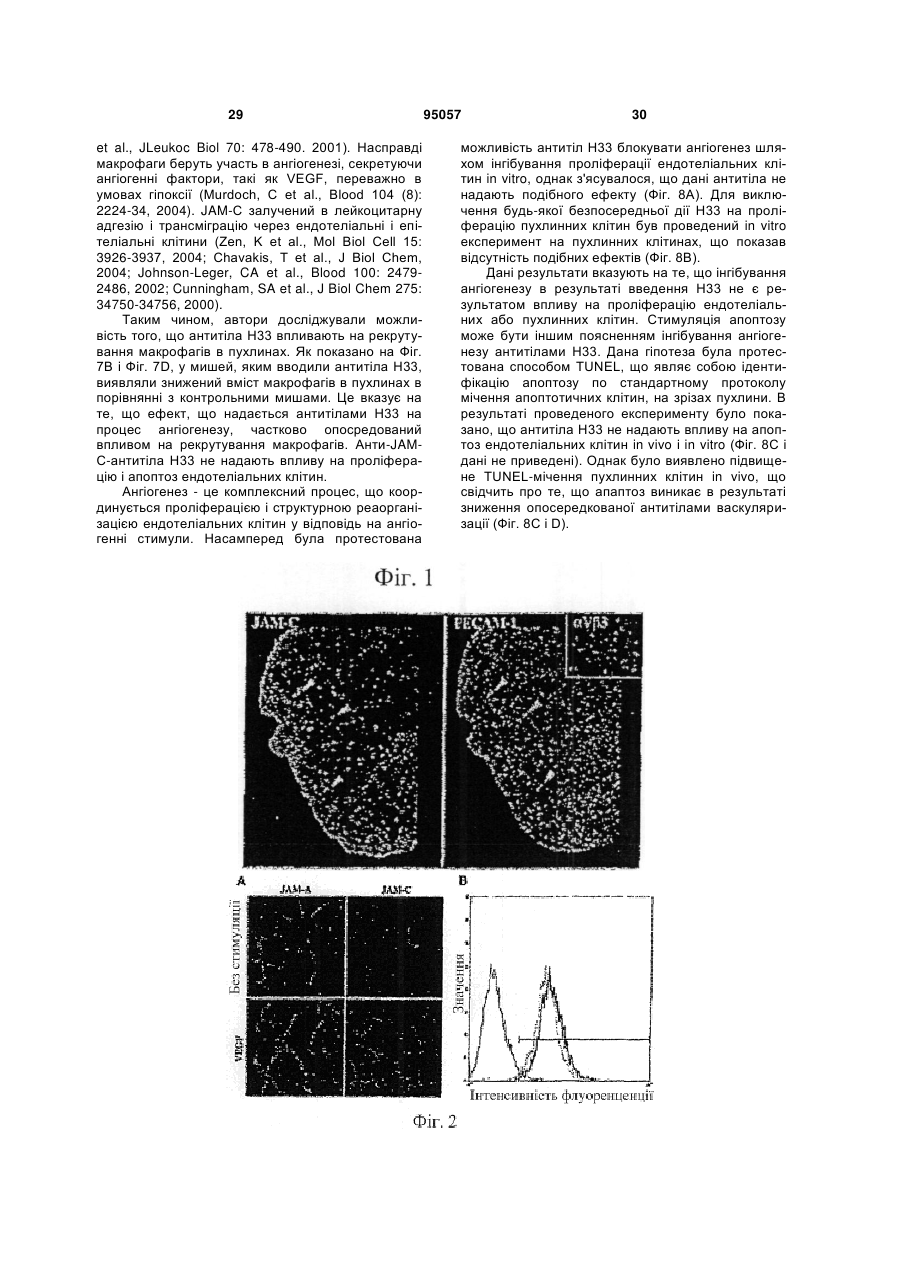
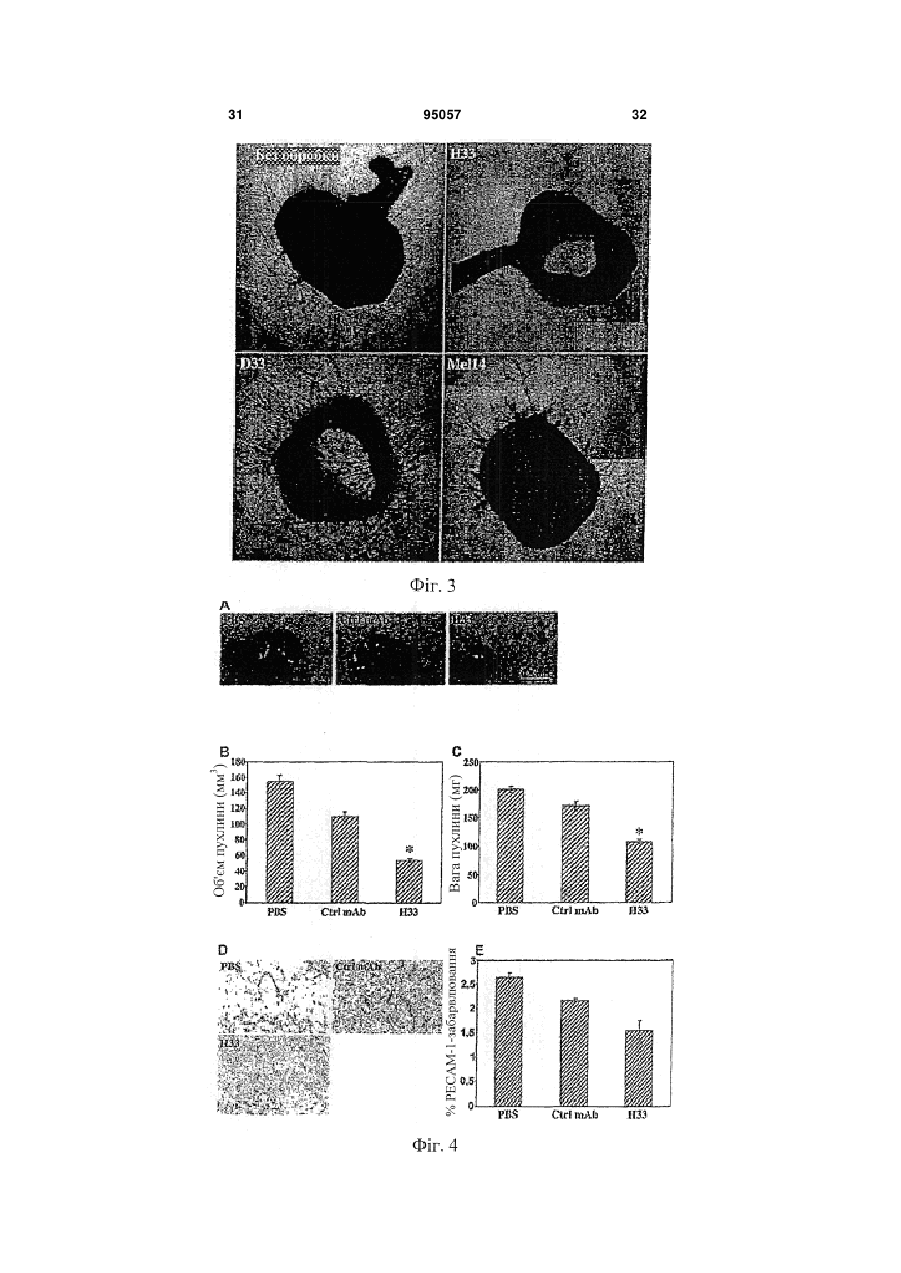
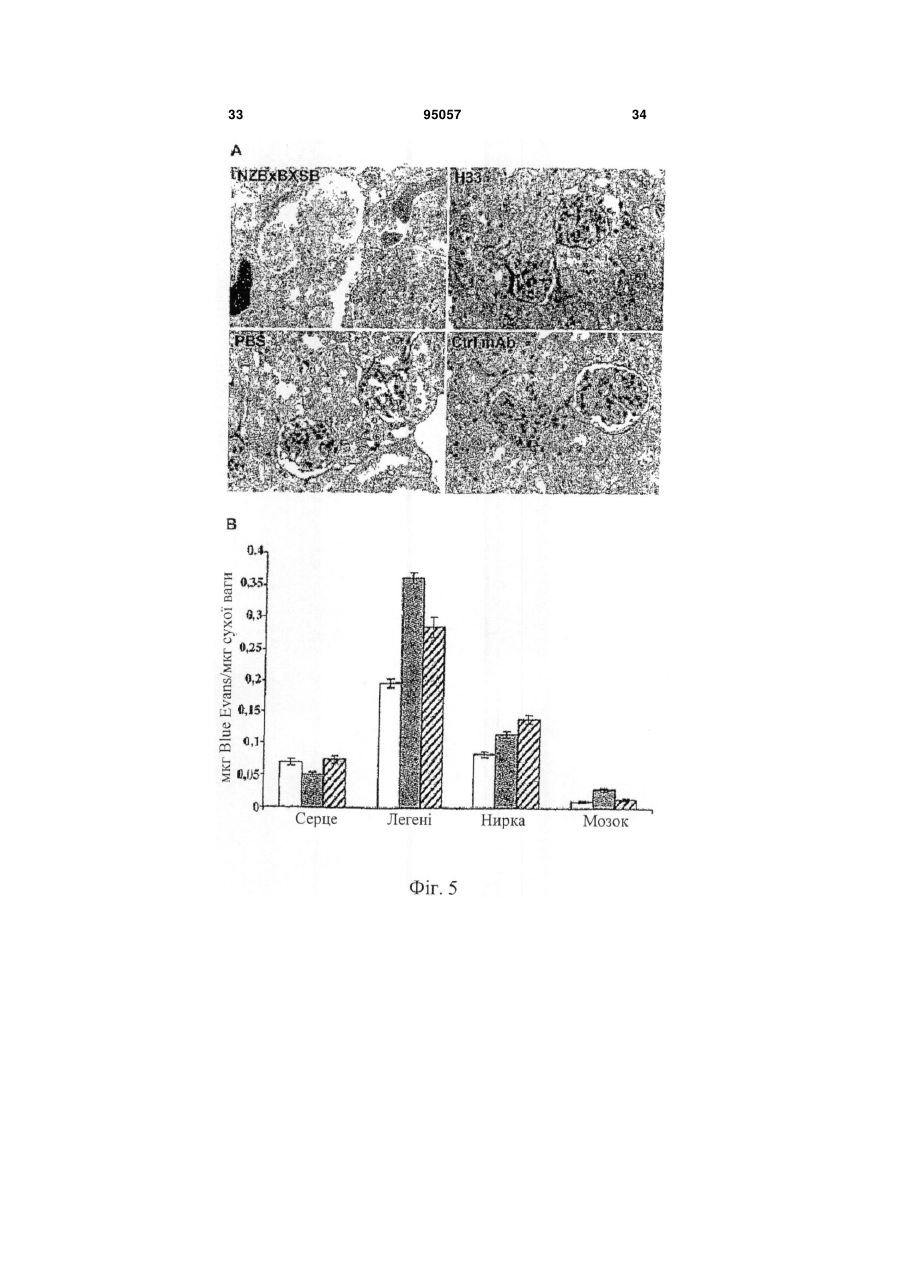
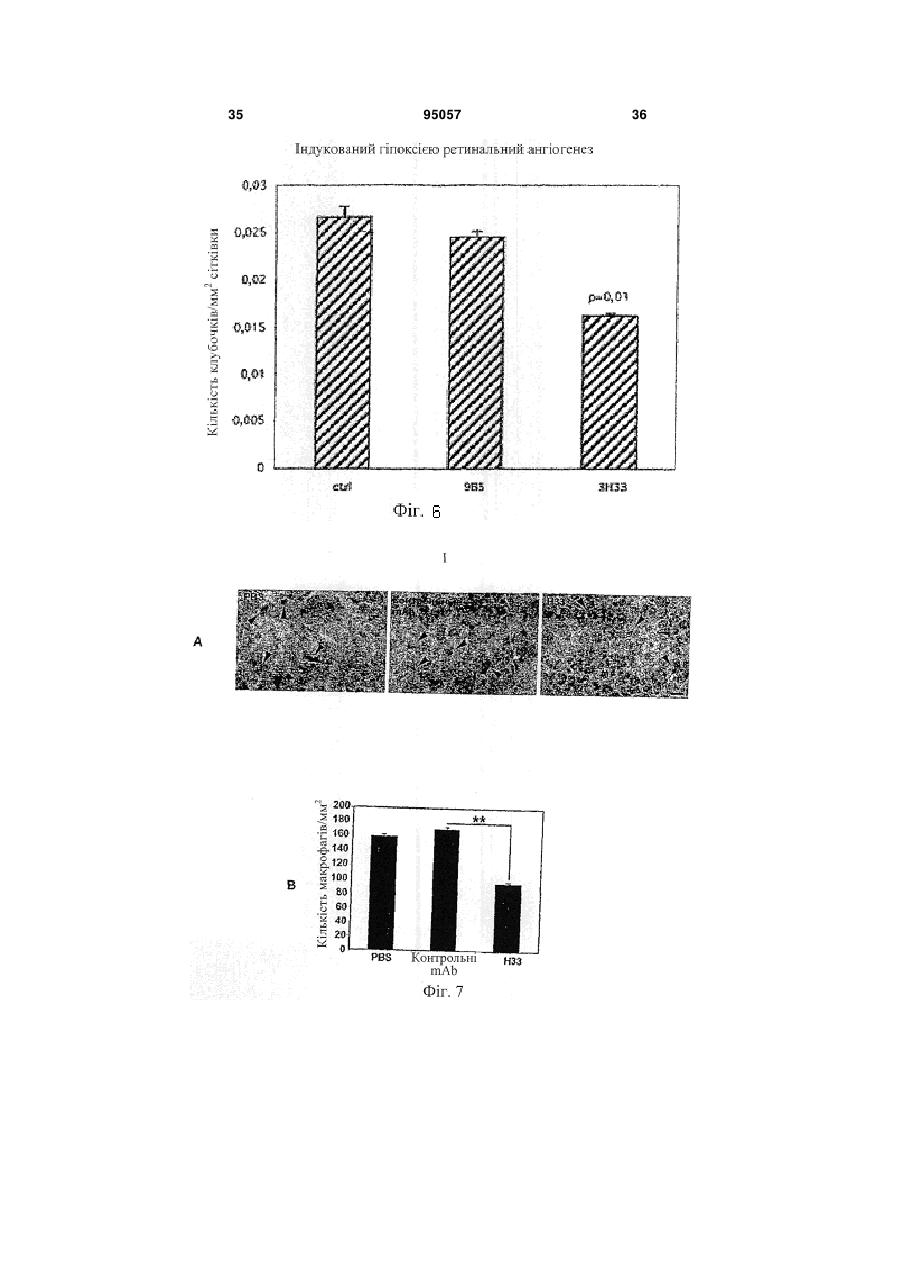
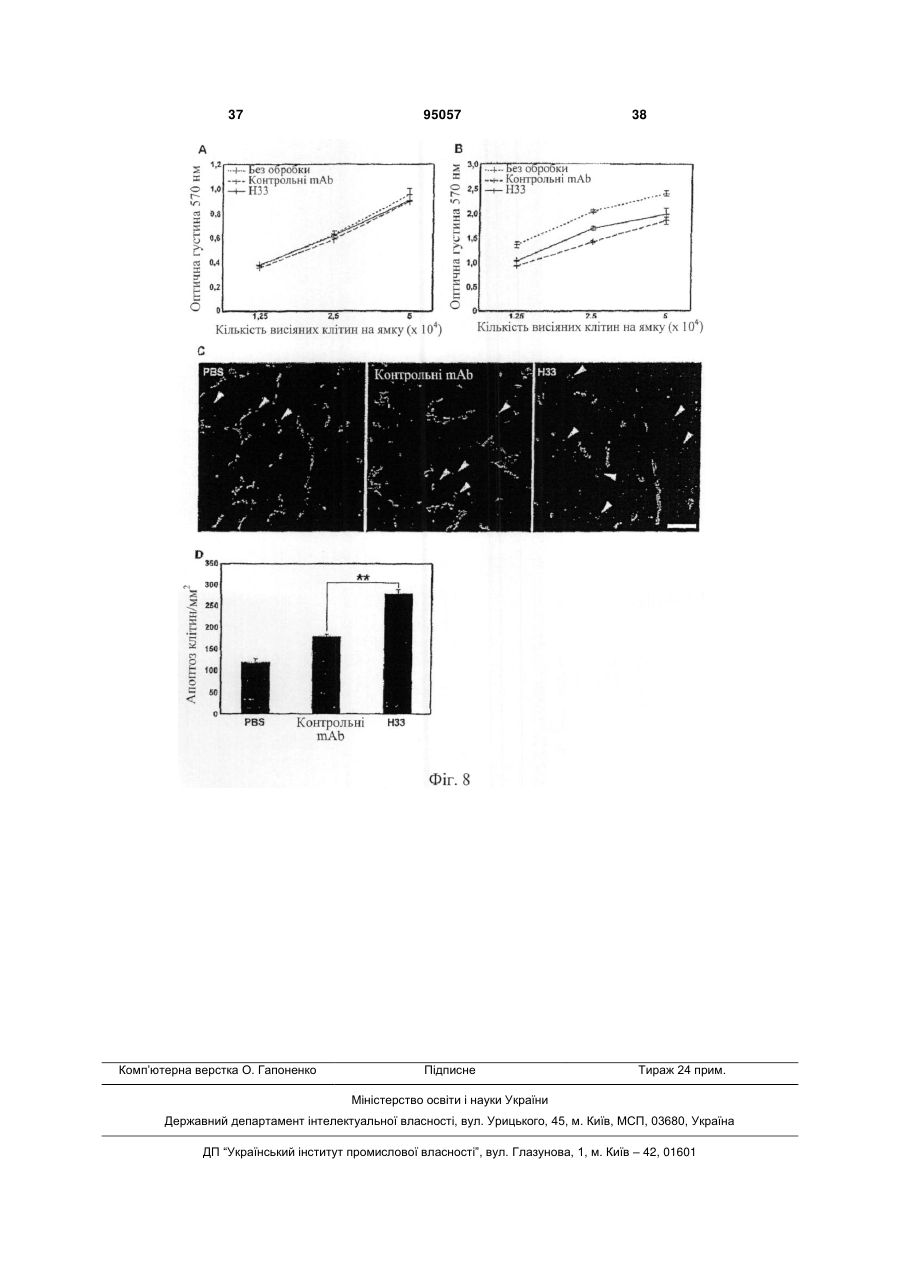
1. Інгібуюча ангіогенез молекула, вибрана з групи, яка складається з антитіла Н33, продукованого гібридомою 13Н33, депонованою 22 жовтня 2003 року в Німецькій колекції мікроорганізмів і клітинних культур GmbH під реєстраційним номером DSM АСС2622, а також його фрагментів і похідних, які мають ту ж специфічність, що і Н33. 2. Інгібуюча ангіогенез молекула за п. 1, вибрана з групи, що складається з a) гуманізованого антитіла на основі антитіла Н33, яке має ту ж специфічність, що і Н33; b) химерного антитіла на основі антитіла Н33, яке має ту ж специфічність, що і Н33; c) фрагмента Н33, вибраного з (і) Fab-фрагмента; (іі) Fv-фрагмента; (ііі) однодоменного антигензв'язувального фрагмента; (iv) scFv, димеру scFv, тримеру scFv і більш великих агрегацій scFv; ( V ) V HН; d) рекомбінантного антитіла, що має специфічність Н33; і e) людського моноклонального антитіла, яке має ту ж специфічність, що і Н33. 3. Інгібуюча ангіогенез молекула за пп. 1 або 2, де вказана молекула a) блокує ангіогенез in vitro і in vivo; b) запобігає пухлинному росту in vivo; c) знижує рекрутинг макрофагів у пухлинах; і d) блокує взаємодію JAM-C з JAM-B. 4. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для отримання лікарського засобу. 5. Гібридома 13Н33, депонована в Німецькій колекції мікроорганізмів і клітинних культур GmbH під реєстраційним номером DSM АСС2622, яка продукує інгібуючу ангіогенез молекулу. 6. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для отримання терапевтичної композиції для лікування раку. UA (21) a200606752 (22) 19.11.2004 (24) 11.07.2011 (86) PCT/EP2004/013247, 19.11.2004 (31) 03026629.0 (32) 19.11.2003 (33) EP (31) 10/738,123 (32) 18.12.2003 (33) US (46) 11.07.2011, Бюл.№ 13, 2011 р. (72) ІМХОФ БЕАТ А., CH, ОРРАН-ЛЬОН МІШЕЛЬ, CH (73) МЕРК СЕРОНО С.А., CH (56) JOHNSON-LEGER CAROLINE A ET AL: "Junctional adhesion molecule-2 (JAM-2) promotes lymphocyte transendothelial migration" BLOOD, vol. 100, no. 7, 1 October 2002 (2002-10-01), pages 2479-2486. URRAND-LIONS MICHEL ET AL: "JAM-2, a novel immunoglobulin superfamily molecule, expressed by endothelial and lymphatic cells" JOURNAL OF BIOLOGICAL CHEMISTRY, vol. 276, no. 4, 26 January 2001 (2001-01-26), pages 2733-2741. LIANG TONY W ET AL: "Vascular endothelialjunctional adhesion molecule (VE-JAM)/JAM 2 interacts with T, NK, and dendritic cells through JAM 3." JOURNAL OF IMMUNOLOGY (BALTIMORE, MD. : 1950) 15 FEB 2002, vol. 168, no. 4, 15 February 2002 (2002-02-15), pages 1618-1626. ARRATE M P ET AL: "Cloning of human junctional adhesion molecule 3 (JAM3) and its identification as the JAM2 counter-receptor." THE JOURNAL OF BIOLOGICAL CHEMISTRY. 7 DEC 2001, vol. 276, no. 49, 7 December 2001 (2001-12-07), pages 45826-45832. NAIK MEGHNA U ET AL: "Signaling through JAM-1 and alphavbeta3 is required for the angiogenic action of bFGF: dissociation of the JAM-1 and alphavbeta3 complex." BLOOD. 15 SEP 2003, vol. 102, no. 6, 15 September 2003 (2003-09-15), pages 2108-2114. WO A 03006673 (23.01.2003). WO A 0053749 (14.09.2000). 2 (19) 1 3 95057 4 7. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для отримання діагностичної композиції для діагностики раку. 8. Застосування за п. 6, де рак являє собою солідну пухлину. 9. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для отримання лікарського засобу для запобігання у пацієнтів взаємодії JAMB/JAM-C. 10. Фармацевтична композиція, яка містить інгібуючу ангіогенез молекулу за будь-яким з пп. 1-3 разом з прийнятним наповнювачем, носієм або розріджувачем. 11. Діагностична композиція, яка містить інгібуючу ангіогенез молекулу за будь-яким з пп. 1-3 разом з прийнятним наповнювачем, носієм або розріджувачем. 12. Діагностична комнозиція за п. 11, де інгібуюча ангіогенез молекула є міченою. 13. Застосування інгібуючої ангіогенез молекули за будь-яким з пп. 1-3 для інгібування ангіогенезу. 14. Застосування діагностичної композиції за будьяким з пп. 11 або 12 в діагностиці раку in vivo. Даний винахід стосується молекул, здатних інгібувати ангіогенез, терапевтичних композицій і діагностичних наборів, що включають в себе одну або більше з подібних молекул, і застосування вказаних молекул в медицині зокрема, в лікуванні і діагностиці раку, зокрема солідних пухлин. Викладене далі являє собою відкритий авторами винаходу спосіб отримання подібних молекул. Ангіогенез, тобто формування нових кровоносних судин з попередньої судинної мережі є фундаментальним процесом в загоєнні ран, розмноженні і ембріональному розвитку. Ангіогенез також є найважливішим процесом в формуванні пухлин. Нові кровоносні судини забезпечують пухлину речовинами, необхідними для здійснення неконтрольованого мітозу. У процесі ангіогенезу ендотеліальні клітини проліферують, мігрують в нову тканину і формують інтерендотеліальні сполуки, що приводить до утворення судинної трубки. Даний процес ініціюється і скеровується ангіогенними факторами. VEGF- і ангіопоетин-опосередкована передача сигналу приводить до втрати контакту перицитів і ендотеліальних клітин, приводячи до проліферації останніх і їх інтеграції з позаклітинним матриксом, опосередкованої інтегринами. Було показано, що інтегрини v3 і v5 беруть участь в розвитку кровоносних судин і ангіогенезі шляхом сигнальних крос-взаємодій з ангіогенними факторами. Крім взаємодій ендотеліальних клітин з позаклітинним матриксом, важливим для формування судинної трубки є регуляція міжендотеліальних контактів. Так, адгезивна молекула VE-кадхерин відіграє роль в ремоделюванні судинної мережі і підтримці цілісності кровоносних судин. У дослідженні що дало початок даному винаходу, були відкриті з'єднувальні адгезивні молекули JAM-B і JAM-C. Ці молекули локалізовані в судинах в ділянці міжклітинних контактів і залучені до трансендотеліальної міграції лейкоцитів. Далі було виявлено, що взаємодія між JAM-B і JAM-C також відіграє важливу роль в ангіогенезі. На основі даних результатів заявники зробили спробу виявити нові молекули, здатні інгібувати ангіогенез. Для цього вони скористалися способом, що складається з наступних етапів: a) вибору групи молекул-кандидатів; b) тестування вказаних молекул на їх здатність блокувати зв'язування JAM-B з JAM-C; c) тестування позитивних молекул на їх здатність блокувати ангіогенез in vivo; і d) відбору молекул, позитивних в тестах in vivo, як молекули, інгібуючих ангіогенез. Для тестування молекул на їх здатність інгібувати ангіогенез in vivo молена скористатися тестом на реваскуляризацію сітківки згідно з прикладом 4. Згідно з даним винаходом було знайдено, що не всі молекули, здатні блокувати зв'язування JAM-B і JAM-C між собою, здатні також інгібувати ангіогенез. Таким чином, додатковий тест по пункту (d) (дивіться вище) необхідний для ідентифікації цільових молекул. Для ідентифікації підмножини молекул, прийнятних для використання в цілях, заявлених в даному винаході вищеописаний спосіб може бути доповнений етапом тестування позитивних молекул на їх здатність інгібувати пухлинний ріст in vivo. Приклад тесту на інгібування пухлинного росту in vivo викладений в прикладі 5. Результатом етапу, відповідного ізоляції або продукуванню інгібуючих ангіогенез молекул, є фактичне отримання бажаних молекул. Набір молекул, які можуть бути протестовані в даному способі може бути різноманітним. Це може бути, наприклад, популяція анти-JAM-B- або антиJAM-C-антитіл. Отримання антитіл відрізняється простотою методології, що не вимагає яких-небудь навичок, що виходять за рамки традиційних способів, і обговорюється, наприклад, в роботі Kohler & Milstein, Nature 256: 495-497 (1975). Таким чином, фахівець в даній галузі здатний отримати вказаний набір молекул без додаткового залучення небажаного методологічного навантаження. Тестування молекул на їх здатність блокувати зв'язування JAM-B і JAM-C між собою може бути проведено, наприклад, шляхом інкубації клітин, які експресують JAM-B або JAM-C на своїй поверхні з міченими розчинними формами JAM-C або JAM-B, відповідно, в присутності молекул, що тестуються, і подальшої оцінки зниження ефективності мічення клітин по відношенню до контрольних клітин, які інкубувалися за відсутності молекул, що тестуються. Молекули, в присутності яких спостерігається зниження кількості візуалізованої мітки по відношенню до контрольних клітин, які експресують молекули JAM-B або JAM-C і зв'язують мічені JAMB або JAM-C, але позбавлені поверхнево-зв'язаної 5 молекули, що тестується, відбираються як позитивні. Прийнятними мітками можуть бути флуоресцентні, радіоактивні або біотинові мітки, і всі вони відомі фахівцям в даній галузі. Прийнятними способами візуалізації мітки, зниження її кількості або її зникнення є проточна цитометрія, біохімічні способи або ферментний імуносорбентний аналіз (ELISA). Молекули, здатні інгібувати зв'язування JAM-B і JAM-C, далі тестуються на їх здатність інгібувати ангіогенез in vivo. Для вирішення цієї задачі можуть бути використані різні способи. Проте, приведений в прикладі 4 тест на реваскуляризацію сітківки підходить особливо добре, оскільки в даній моделі ремоделювання судинної мережі залежить насамперед від ендотеліальних клітин, а не від факторів мікрооточення. Альтернативними тестами є аналіз на хоріо-алантоїсній мембрані, тест ішемія-реперфузія або трансплантація навантаженого ангіогенними факторами матригелю. Ці тести добре відомі фахівцям в даній галузі У доповнення або замість тестування здатності інгібувати ангіогенез in vivo, кандидатні молекули можуть бути протестовані на їх здатність інгібувати пухлинний ріст in vivo. Приклад прийнятної методики виконання подібного тесту приведений в прикладі 5. Застосування вищеописаного способу привело зрештою до ідентифікації антитіла Н33, продукованого гібридомою 13Н33, депонованою 22 жовтня 2003 року в Німецькій колекції мікроорганізмів і клітинних культур GmbH під реєстраційним номером DSM ACC2622 як інгібуючої ангіогенез молекули згідно з винаходом. Було показано, що антиJАМ-С-антитіла Н33 можуть блокувати ангіогенез in vitro і in vivo і пухлинний ріст in vivo. Вони також зменшують рекрутування макрофагів в пухлинну тканину. Вони також здатні блокувати зв'язування JAM-B з JAM-C. Н33 не впливає на процеси проліферації або апоптозу. Таким чином, винахід відноситься до застосування антитіла Н33 як лікарський засіб, зокрема, для лікування раку, зокрема солідних пухлин. Додатково винахід стосується фрагментів і похідного Н33, що використовуються як лікарські засоби. Подібними фрагментами і похідними можуть бути, зокрема, Fab-фрагменти, Fv-фрагменти, однодоменні антигензв'язувальні фрагменти, рекомбінантні антитіла зі специфічністю Н33, scFv-фрагменти і їх агрегати, VHH-фрагменти, гуманізовані похідні Н33, химерні антитіла, як мінімум, що мають специфічність Н33, або мають таку специфічність людські антитіла. Прийнятним способом отримання останніх є продукування в організмі трансгенних мишей або інших тваринах, як буде описано нижче. Далі винахід стосується фрагментів і похідних антитіл, які зберігають антигензв'язувальну здатність антитіла в цілому. Такі фрагменти і похідні не були описані раніше і є, таким чином, новими. Функціональні антигензв'язувальні фрагменти можуть бути отримані шляхом протеолізу антитіл (розщеплення папаїном або пепсином, а також 95057 6 інші ензиматичні підходи) з утворенням Fabфрагментів, Fv-фрагментів або окремих доменів. Як альтернативна методика може бути використана рекомбінантна технологія. Fab-фрагменти (Fragment antigen binding, антигензв'язувальні фрагменти) - це антигензв'язувальні домени молекули антитіла, що містять VH+CH1 і CL+VL. Домени CL і СН1 пов'язані міжланцюжковим дисульфідним зв'язком. Молекулярна вага гетеродимера складає звичайно близько 50 кДа. Fab-фрагменти можуть бути отримані шляхом розщеплення нативної молекули антитіла папаїном. Мінімальним фрагментом, що цілком зберігає антигензв'язувальний сайт повного антитіла IgG, є 30-кДа гетеродимер, що складається з варіабельних доменів легкого і важкого ланцюгів (VL і VH, відповідно). Цей гетеродимер, який називається Fv (Fragment variable, варіабельний фрагмент), ще зберігає здатність зв'язувати антиген. Інший фрагмент являє собою однодоменний антигензв'язувальний фрагмент (dAb) або VH. Одноланцюжкові Fv-фрагменти можуть бути отримані шляхом рекомбінантної технології У scFv-фрагменті домени VH і VL з'єднані гідрофільним гнучким пептидним лінкером. ScFv-фрагменти можуть бути зібрані в комплекси: димери (діантитіла), тримери (триантитіла) або більш великі агрегати, мономерні одиниці яких можуть мати одну і ту ж або різну специфічність. Наступним типом фрагментів антитіл є VHHфрагменти, що містять найменші доступні інтактні антигензв'язувальні фрагменти. VHH можуть бути отримані шляхом протеолізу важких ланцюгів антитіл імунізованих тварин сімейства верблюдових або з використанням рекомбінантної технології. При використанні технології рекомбінантної ДНК, по суті полінуклеотид, що кодує V-домен Набо L-ланцюга антитіла Н33, може бути злитий з полінуклеотидом, що кодує константну ділянку переважно людського Н- або L-ланцюга. Для експресії отриманих таким чином повнорозмірних Набо L-ланцюгів також може бути додана послідовність, що кодує сигнальну пептид, необхідну для секреції білка. Для продукції інгібуючих ангіогенез молекул згідно з винаходом використовуються експресуючі касети, в яких злитий нуклеотид згідно з винаходом зв'язаний з відповідною контрольною послідовністю, що забезпечує регуляцію транскрипції і трансляції в хазяйських клітинах, а також рекомбінантні вектори, що містять полінуклеотид, який кодує подібну експресуючу касету. Полінуклеотиди згідно з винаходом, тобто молекули, які інгібують ангіогенез і мають специфічність Н33. таким чином, можуть бути легко отримані як широко відомими способами технології рекомбінантної ДНК, так і шляхом хімічного синтезу ДНК. Рекомбінантні ДНК-конструкти можуть бути отримані і введені в хазяйські клітини широко відомими способами технології рекомбінантної ДНК і генної інженерії Прийнятними хазяйськими клітинами в рамках даного винаходу можуть бути прокаріотичні або еукаріотичні клітини. Серед прийнятних еу 7 карioтичних клітин можна назвати, наприклад, рослинні клітини, клітини дріжджів, таких як Saccharomyces, клітини комах, таких як Drosophila або Spodoptera, і клітини ссавців, такі як HeLa. СНО, 3Т3, С127, ВНK, COS і т. д. Існує ряд способів трансфекції прокаріотичних або еукаріотичних клітин векторами, що містять химерний ДНК-конструкт, що кодує химерний Igланцюг. Переважний спосіб введення вектора в лімфоїдні клітини - сферобластне злиття (дивіться Gillies et al. (1989) Biotechnol. 7: 798-804). Альтернативними способами є електропорація або кальцій-фосфатна преципітація. Інші прийнятні способи продукування імунокон'югатів включають в себе отримання послідовності РНК, що кодує конструкт, і її трансляцію у прийнятній системі in vitro або in vivo. Після експресії білки згідно з винаходом можуть бути виділені з використанням стандартних способів очищення білків (дивіться, наприклад, патент США №5650150). У тому випадку, коли важкий і легкий ланцюги комбінують в молекулі згідно з винаходом, важкий ланцюг варіабельної ділянки переважно коекспресується з відповідним легким ланцюгом. Для злитих білків, що містять декілька поліпептидних ланцюгів, може бути використано більше одного експресуючого вектора. Котранфекційні способи, в яких використовується, наприклад, більше одного вектора, часто дозволяють досягти доставки обох векторів в цільову клітину. Як альтернатива, іноді корисне використання єдиного вектора, що кодує декілька поліпептидів для коекспресії в одній і тій же клітині. Далі може бути зручно експресувати білки згідно з винаходом як одноланцюжкові молекули. Наприклад, варіабельна ділянка антитіла може бути експресована як одноланцюжкове антитіло або sFv-фрагмент, факультативно злитий з неімуноглобуліновим білком. У іншому втіленні важкий ланцюг (злитий з цитокіном або нативний) комбінують з легким (або важким) ланцюгом (злитим з цитокіном або нативним), з утворенням моновалентних і дивалентних імунокон'югатів. VL і VH-ділянки можуть бути зв'язані дисульфідним або пептидним зв'язком, в залежності від того, як сконструйовані відповідні їм нуклеотидні послідовності. Як правило, V-ділянки пов'язані дисульфідним зв'язком, якщо вони кодуються нуклеотидною послідовністю з різних ДНК-конструктів. Навпаки, V-ділянки пов'язані пептидним зв'язком, якщо вони являють собою єдиний поліпептидний ланцюг, що кодується єдиною нуклеотидною послідовністю. У деяких втіленнях згідно з винаходом, варіабельні ділянки легких і важких ланцюгів можуть бути з'єднані з константними ділянками легкого і важкого ланцюгів, відповідно. Можуть бути використані як каппа, так і лямбда-типи константних ділянок легких ланцюгів. Конструкція експресуючих векторів згідно з винаходом і трансформація хазяйських клітин можуть бути виконані з використанням стандартних способів молекулярної біології. 95057 8 Інгібуючі ангіогенез молекули згідно з винаходом, отримані з використанням подібних прокаріотичних і еукаріотичних експресуючих систем, можуть бути виділені і очищені з клітин або культуральних супернатантів з використанням протеїн А-сефарози і протестовані на JAM-Cзв'язуючу активність шляхом вимірювання їх інгібіторної активності, що виражається в здатності конкурувати з Н33 за зв'язування з розчинним JAM-C, нанесеним на мікротитрувальні планшети, добре відомими способами конкурентного ELISAаналізу. Варіабельні домени імуноглобулінів щура, що залишилися, можуть бути імуногенними для людини, і внаслідок цього ефективність терапії антитілами може бути знижена. Для зниження імуногенності може бути використаний ряд добре відомих способів, таких як «маскування» і «гуманізація», що передбачає внесення ряду амінокислотних замін згідно з тим, як описано в патенті W02004055056. Далі може бути виконаний скринінг на афінність зв'язування згідно з описаним вище тестуванням на здатність конкурувати з Н33. Як альтернатива, надлюдські Т-клітинні епітопи можуть бути піддані мутуванню таким чином, щоб вони відповідали власним людським епітопам, присутнім в людських антитілах (дивіться, наприклад, патент США № 5712120). Представляючі собою частину винаходу VL і VH-вмісні антитіла Н33 включають в себе як мінімум одну гуманізовану послідовність, що знижує, таким чином, імуногенність антитіла при введенні людині. Подальше продукування антитіл в хазяйських клітинах і їх очищення можуть бути виконані згідно з викладеним вище. Відповідно до іншого аспекту винаходу варіабельна ділянка антитіла Н33 або подібна молекула може бути кон'югована з неімуноглобуліновою частиною, або безпосередньо, або через Fcфрагмент. Зокрема, неімуноглобуліновим фрагментом може бути цитокін, такий як інтерлейкін, якийнебудь гемопоетичний фактор, лімфокін, інтерферон або хемокін. Інтерлейкіном можливо, наприклад, інтерлейкін-2 або інтерлейкін-12. Гемопоетичним фактором і лімфокіном можуть бути, наприклад, гранулоцитарно-макрофагальний колонієстимулюючий фактор (ГМ-КСФ) і лімфотоксин, відповідно. Інтерфероном може бути, наприклад, інтерферон-, інтерферон- або інтерферон. У деяких втіленнях даного винаходу злитий білок включає в себе другу неімуноглобулінову частину, таку як другий цитокін. У даному винаході передбачене також застосування антитіла Н33 або його фрагментів або похідних для отримання лікарських засобів для блокування зв'язування JAM-B/JAM-C в організмі пацієнта. Подібне блокування може включати в себе націлювання на клітини, які експресують JAM-C на своїй поверхні, шляхом введення пацієнту антитіл, що мають варіабельні ділянки згідно з винаходом. У одному з втілень клітиною-мішенню є пухлинна клітина. 9 Відповідно до подальших аспектів винаходу блокування JAM-C/JAM-B-взаємодія може бути досягнута при використанні нуклеїнової кислоти, що кодує варіабельну ділянку, або клітин, що містять цю нуклеїнову кислоту - будь-який з цих об'єктів може бути введений пацієнту. Для клінічного використання на людині може бути корисно модифікувати щурячі антитіла Н33 для зниження або мінімізації їх імуногенності. Також як і у разі мишачих антитіл, ряд способів для досягнення цієї мети був описаний в літературі. Подібні способи включають в себе отримання химерних антитіл, що містять мишачі або щурячі варіабельні ділянки і людські константні ділянки, отримання одноланцюжкових антитіл, що містять різні зв'язувальні послідовності отримані з мишачих або щурячих антитіл, отримання антигензв'язувальних фрагментів мишачих або щурячих антитіл, які через їх малий розмір потенційно менше імуногенні отримання людських моноклональних антитіл і отримання «гуманізованих» антитіл. У результаті гуманізування отримують неімуногенні антитіла з повним збереженням антигензв'язувальних здатностей батьківської надлюдської молекули антитіла. Відсутність імуногенності дозволяє багато разів вводити препарат антитіл без небажаних імунологічних реакцій на нього. У літературі описані різні способи отримання гуманізованих антитіл. Наприклад, гуманізовані антитіла можуть бути отримані (а) шляхом введення тільки надлюдських CDR-ділянок при збереженні людського каркаса варіабельних і константних ділянок (Jones et al., Nature 321: 522-25 (1986); Verhoeyen et al., Science 239: 1534-1536 (1988)); або (b) шляхом введення цілих надлюдських варіабельних доменів (для збереження лігандзв'язувальної активності) під «маскою» подібних людським послідовностей, що отримуються шляхом заміни залишків, які експонуються таким чином, що отримана антигенна структура нагадує відповідну людську, що і приводить до зниження імуногенності отриманого продукту (подібний підхід також називають «маскуванням» антитіл (Padlan, Molec. Immun. 28: 489-498 (1991); Padlan, Molec. Immun. 31 (3): 169217 (1994)). Збереження нелюдських мишачих або щурячих залишків в каркасі людських варіабельних доменів дозволяє зберегти правильні зв'язуючі функції отриманого гуманізованого антитіла. Було показано, що використання гуманізованих антитіл потенційно знижує або повністю елімінує імуногенність антитіла, що вводиться, в ксенореципієнті, таким чином збільшуючи біодоступність антитіл і знижуючи імовірність пов'язаних з небажаними імунологічними реакціями побічних ефектів, що, в свою чергу, дозволяє вводити препарат антитіла багато разів. Крім цього, синтез вищеописаних scFv-фрагментів, а також інших фрагментів антитіл, таких як Fv, Fd, Fab, Fab' і Р(аb)'2-фрагментів, отриманих з антитіл з бажаною специфічністю, являє собою інший відомий спосіб отримання цільових фрагментів, що мають меншу імуногенність, ніж інтактні антитіла. Істотним є те, що одноланцюжкові антитіла і фрагменти антитіл 95057 10 можуть бути внаслідок меншого розміру менш імуногенні ніж інтактні антитіла. Також відомим фактом є і те, що рекомбінантні білки, в тому числі антитіла, глікозилюються порізному, в залежності від хазяйської клітинної системи. Глікозилювання антитіл Н33 може збільшувати їх час напівжиття і/або знижувати імуногенність, що важливо для їх клінічного використання. Антитіла Н33 також можуть бути використані в конкурентному скринінгу для ізоляції «людських моноклональних антитіл» або «рекомбінантних людських антитіл», що мають таку ж або близьку до Н33 специфічність. У своїй основі джерелом людських антитіл може бути гібридома, трансфектома або трансгенна тварина, в тому числі трансгенна миша, здатна продукувати різні ізотипи антитіл проти JAM-C (в тому числі анти-JAM-C IgG, IgA і/або IgE) шляхом V-D-J-рекомбінації і перемикання ізотипу (наприклад, згідно з викладеним в патентах ЕР1471938 і US2004208873). Подібною трансгенною твариною може бути також трансгенний кролик, здатний продукувати поліклональні антитіла згідно з описаним в патенті США 2003/0017534. Термін «людське моноклональне антитіло» відноситься до антитіл, які мають єдину антигенну специфічність і складаються з варіабельних і константних ділянок, що кодуються імуноглобуліновими генами зародкової лінії людини. У одному з втілень моноклональне людське антитіло з ідентичною Н33 специфічністю продукується гібридомою, отриманою шляхом злиття імморталізованих клітин з В-клітинами, отриманими з трансгенної тварини, відмінної від людини (наприклад, з трансгенної миші), зародкова лінія якої містить трансгени людських важких і легких ланцюгів. Переважною тваринною системою для отримання гібридом є мишача система. Продукування гібридом в організмі мишей є поширеною процедурою. Протоколи імунізації і способи виділення спленоцитів імунізованих тварин добре відомі в даній галузі Клітини-партнери злиття (наприклад, клітини мишачої мієломи) і технологія злиття також добре відомі. У переважному втіленні людські моноклональні антитіла проти JAM-C, які мають ідентичну Н33 специфічність, можуть бути отримані з використанням трансгенних мишей, які частково володіють людською імунною системою, що є переважним в порівнянні з мишачою системою, відомою під назвою «HuMAb»-миші (Lonberg, et al. (1994) Nature 368 (6474): 856-859). Відповідно до цього у мишей спостерігається знижена експресія мишачих IgM або мишачих каппа-легких ланцюгів, і у відповідь на імунізацію, введені трансгени людських легких і важких ланцюгів зазнають перемикання ізотипу і соматичне мутування, що приводить до синтезу високоафінних людських IgG-каппа (Lonberg, N. et al. (1994), дивіться вище; рев'юйоване в книзі Lonberg, N. (1994) Handbook of Experimental Pharmacology 113: 49-101; Lonberg, N. and Huszar, D. (1995) Intern. Rev. Immunol. Vol. 13:65-93, and Harding, F. and Lonberg, N. (1995) Arm. Ν. Υ Acad. Sci. 764: 536-546). Отримання HuMAb-мишей детально описане в публікаціях 11 Taylor, L. et al. (1992) Nucleic Acids Research 20: 6287-6295; Chen, J. et al. (1993) International Immunology 5: 647-656; Tuaillon et al. (1993) Proc. Natl. Acad. Sci. USA 90: 3720-3724; Choi et al. (1993) Nature Genetics 4: 117-123; Chen, J. et al. (1993) EMBO J. 12: 821-830; Tuaillon et al. (1994) J. Immunol. 152: 2912-2920; Lonberg, N. et al. (1994) Nature 368 (6474): 856-859; Lonberg, N. (1994) Handbook of Experimental Pharmacology 113: 49101; Taylor, L. et al. (1994) International Immunology 6: 579-591; Lonberg, N. and Huszar, D. (1995) Intern. Rev. Immunol. Vol. 13: 65-93; Harding, F. and Lonberg, N. (1995) Ann. Ν. Υ Acad. Sci. 764: 536546; Fishwild, D. et al. (1996) Nature Biotechnology 14: 845-851. Дивіться патенти США, які йдуть далі: Lonberg, Ν., Kay, R. M. і GenPharn International: №№ 5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299 і 5770429; Surani et al: патент США № 5545807; міжнародні публікації №№ WO 98/24884, опубліковано 11 червня 1998 року; WO 94/25585, опубліковано 10 листопада 1994 року; WO 93/1227, опубліковано 24 червня 1993 року; WO 92/22645, опубліковано 23 грудня 1992 року; WO 92/03918, опубліковано 19 березня 1992 року. Переважно миші HuMAb мають JKD-розрив в легких каппа-ланцюгах (згідно з Chen et al. (1993) EMBO J. 12: 821-830), CMD-розрив в ендогенних локусах важких ланцюгів (згідно з описаним в прикладі 1 міжнародної заявки WO 01/14424, Korman et al.), KСо5-трансген людських легких каппаланцюгів (згідно Fishwild et al. (1996) Nature Biotechnology 14:845-851), а також НСо7-трансген людських важких ланцюгів (згідно з патентом США № 5770429, Lonberg, N. and Kay, або НСо12трансген (згідно з описаним в прикладі 2 патенту WO01/14424, Korman et al.). Як альтернатива, для отримання анти-JАМ-Сантитіла зі специфічністю Н33 можуть бути використані миші які несуть людські імуноглобулінові гени на транс-хромосомному фрагменті. Отримання подібних транс-хромосомних мишей було описане в патенті W097/07671, Tomizuka et al. Тваринами, що переважно використовуються для цих цілей, є миші, у яких деякі людські імуноглобулінові гени доставляються як трансгени, тоді як інші - як транс-хромосоми, такі наприклад, як миші які несуть трансген людських легких ланцюгів (наприклад, KСо5-трансген каппа-ланцюгів) і транс-хромосому людських важких ланцюгів (наприклад, SC20 транс-хромосому), згідно з описаним в патенті W002/43478, Ishida et al. Для отримання повністю людських моноклональних антитіл проти JAM-C, що мають специфічність Н33, миші HuMAb можуть бути імунізовані очищеним антигеном JAM-C, складом, збагаченим JAM-C, і/або клітинами, продукуючими JAM-C, і/або рекомбінантним JAM-C згідно з описаним Lonberg, N. et al. (1994) Nature 368 (6474): 856-859; Fishwild, D. et al. (1996) Nature Biotechnology 14: 845-851 and W098/24884. Переважним є використання мишей, до часу першої ін'єкції тижнів, що досягли віку 6-16. Наприклад, для імунізації може бути використана внутрішньочеревинна ін'єкція JAM-C. 95057 12 Для продукування людських моноклональних антитіл проти JAM-C мишачі спленоцити можуть бути виділені і піддані процедурі злиття з клітинами лінії мишачої мієломи поліетиленгліколем (ПЕГ), відповідно до стандартних протоколів. Отримані гібридоми потім піддають скринінгу на їх здатність продукувати антигенспецифічні антитіла згідно з добре відомими методиками. Людські антитіла згідно з винаходом, що мають специфічність Н33, можуть бути отримані у вибраних для експресії клітинах трансфектоми з використанням, наприклад, добре відомого в даній галузі поєднання технології рекомбінантної ДНК і генної трансфекції (Morrison, S. (1985) Science 229: 1202). У даному винаході можуть бути використані антитіла Н33, а також їх фрагменти і похідні що володіють здатністю блокувати зв'язування JAM-B і JAM-С і інгібувати ангіогенез in vivo. Огляд з питань отримання фрагментів антитіл і злитих білків, які містять антитіла, приведений у Joosten, V. et al., Microb. Cell Fact. 2(1):1 (2003). Способи отримання фрагментів і похідних антитіл широко відомі і можуть бути відтворені фахівцем в даній галузі без залучення небажаного додаткового методологічного навантаження. Наприклад, для експресії антитіла Н33 або його фрагментів кодуючі часткові або повнорозмірні послідовності легких і важких ланцюгів ДНК можуть бути отримані відповідно до стандартних молекулярно-біологічних протоколів (в тому числі за допомогою ампліфікації способом ПЛР, сайтнаправленого мутагенезу) і вставлені в експресуючі вектори таким чином, що клоновані гени будуть оперативно зв'язані з послідовностями, що забезпечують транскрипційний і трансляційний контролі. У даному контексті під словосполученням «оперативно зв'язані» мається на увазі, що гени антитіл ліговані у вектор таким чином, що регулюючі транскрипцію і трансляцію регуляторні послідовності вектора здатні виконувати свої функції регуляції транскрипції і трансляції генів антитіл. Експресуючий вектор і контрольні послідовності вибирають таким чином, щоб вони були сумісні з вибраними для експресії хазяйськими клітинами. Гени легкого і важкого ланцюгів молекули антитіла можуть бути клоновані в різні вектори або, що більш поширено, в один експресуючий вектор. Гени антитіла клонують в експресуючий вектор згідно зі стандартними протоколами (таким як лігування по комплементарних між геном антитіла і експресуючим вектором «липких кінцях» однойменних рестрикційних сайтів, або затуплення кінців і лігування в тому випадку, якщо відповідних рестрикційних сайтів немає). Важкі і легкі ланцюги антитіл, що обговорюються тут, можуть бути використані для створення повнорозмірних генів антитіл будь-якого з ізотипів шляхом клонування відповідних фрагментів в експресуючі вектори, що вже містять константні ділянки легких і важких ланцюгів бажаного ізотипу, таким чином, що в згаданому векторі VH-сегмент оперативно зв'язаний з СН-сегментом, а VLсегмент оперативно зв'язаний з CL-сегментом. 13 У доповнення до цього або як альтернатива рекомбінантний експресуючий вектор може кодувати сигнальну послідовність, що полегшує секрецію ланцюгів антитіла з хазяйських клітин. Ген ланцюга антитіла може бути клонований у вектор таким чином, що сигнальний пептид «в рамці» зв'язаний з N-кінцем ланцюга антитіла. Сигнальним пептидом може бути імуноглобуліновий сигнальний пептид або гетерологічний сигнальний пептид (тобто сигнальний пептид з неімуноглобулінового білка). У доповнення до генів ланцюгів імуноглобулінів, рекомбінантні експресуючі вектори згідно з винаходом кодують сигнальні послідовності які контролюють експресію генів імуноглобулінових ланцюгів в хазяйських клітинах. Термінологічне словосполучення «регуляторна послідовність» включає в себе промотори, енхансери і інші елементи контролю експресії (такі наприклад, як сигнали поліаденілювання), контролюючі транскрипцію або трансляцію генів ланцюгів антитіл. Подібні регуляторні послідовності описані наприклад, в книзі Goeddel; Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990). Фахівці в даній галузі повинні брати до уваги, що дизайн експресуючого вектора, включаючи вибір регуляторних послідовностей, може залежати від таких факторів, як хазяйські клітини, вибрані для трансформації бажаний рівень експресії білка і т. д. Переважними регуляторними елементами для клітин ссавців є вірусні елементи, що забезпечують високий рівень експресії білка, такі як промотори і/або енхансери, отримані з цитомегаловіруса (ЦМВ), Simian Virus 40 (SV40), аденовірусів (наприклад, головний пізній аденовірусний промотор (AdMLP)) і поліомавіруав. Як альтернатива, можуть бути використані невіру сні промотори, такі як убіквітиновий промотор або -глобіновий промотор. У доповнення до генів імуноглобулінових ланцюгів і регуляторних послідовностей, рекомбінантні експресуючі вектори для експресії ангіогенезінгібуючих молекул згідно з винаходом можуть містити додаткові послідовності такі як послідовності регулюючі реплікацію вектора в хазяйських клітинах (наприклад, точки початку реплікації) і гени селективних маркерів. Введення останніх полегшує селекцію хазяйських клітин, в яких трансфекція вектором пройшла ефективно (дивіться, наприклад, патенти США (Axel et al.) №№ 4399216, 4634665 і 5179017). Так, звичайно введення гена селективного маркера забезпечує хазяйським клітинам, в яких трансфекція (введення вектора) пройшла успішно, резистентність до різних препаратів, таких як G418, гігроміцин або метотрексат. Переважні гени селективних маркерів включають в себе ген дигідрофолатредуктази (DHFR) (для використання в dhfr-клітинах з селекцією/ампліфікацією на основі метотрексату) і neoген (для селекції на основі G418). Для експресії легких і важких ланцюгів, експресуючий вектор (вектори), що кодує легкі і важкі ланцюги, відповідно, трансфікуються в хазяйські 95057 14 клітини по стандартних методиках. Різні форми терміну «трансфекція» мають на увазі широкий спектр методик, що широко використовуються для введення екзогенної ДНК в прокаріотичну або еукаріотичну хазяйську клітину, таких як електропорація, кальцій-фосфатна преципітація, DEAEдекстранова трансфекція і т. д. Незважаючи на те, що молекули згідно з винаходом можуть бути експресовані як в прокаріотичних, так і в еукаріотичних хазяйських клітинах, експресія в еукаріотичних клітинах, найбільш переважно в хазяйських клітинах ссавців, більш переважна, оскільки подібні еукаріотичні клітини, найбільш переважно клітини ссавців, з більшою, ніж прокаріотичні клітини, імовірністю, зможуть синтезувати, забезпечити правильний фолдинг і секретувати імунологічно активне антитіло, його фрагмент або похідне. Переважні для експресії рекомбінантних антитіл згідно з винаходом хазяйські клітини ссавців включають в себе СНО-клітини (включаючи dhfrCHO клітини, описані в публікації Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77: 42164220, що використовуються в сполученні з селективним маркером DHFR, як описано, наприклад, в публікації R. J. Kaufman and P. A. Sharp (1982) Mol. Biol. 159: 601-621), мієломні клітини NS/0, клітини COS, HEK293 і SP2.0. Зокрема, в сполученні з мієломними клітинами NS/0 використовується інша переважна експресуюча система GS (глутамінсинтетаза), описана в патентах WO 87/04462, WO 89/01036 і ЕР 338841. Коли рекомбінантні експресуючі вектори, що кодують гени антитіл, вводять в хазяйські клітини ссавців, продукти експресії отримують шляхом культивування хазяйських клітин протягом періоду, достатнього для експресії продукту в хазяйських клітинах або, більш переважно, для секретування продукту в культуральне середовище, в якому ростуть клітини-хазяї Продукти експресії можуть бути виділені з культурального середовища по стандартних протоколах очищення білків. Як альтернатива, клоновані гени антитіла можуть бути експресовані в інших експресуючих системах, включаючи прокаріотичні клітини, такі як мікроорганізми, в тому числі Е. соlі, і для продукування scFv-антитіл, algi, а також клітини комах. Далі, антитіла можуть бути отримані з використанням трансгенних тварин, наприклад, з використанням молока овець і кроликів або яєць курей, або з використанням трансгенних рослин. Дивіться, наприклад, Verma, R., et al. (1998). Antibody engineering: Comparison of bacterial, yeast, insect and mammalian expression systems. J. Immunol. Meth. 216: 165-181; Pollock, et al. (1999). Transgenic milk as a method for the production of recombinant antibodies. J. Immunol. Meth. 231: 147-157; and Fischer, R., et al. (1999). Molecular farming of recombinant antibodies in plants. Biol. Chem. 380: 825-839. Антитіла зв'язуються зі своїми антигенами переважно за допомогою певних амінокислотних залишків, локалізованих в шести ділянках легких і важких ланцюгів - «ділянках, що визначають комплементарність» (Complementarity Determining Regions, CDR). Відповідно до цього, амінокислот 15 ний склад CDR-ділянок володіє більшою різноманітністю амінокислотних залишків, ніж амінокислотний склад антитіл за межами CDR-ділянок. Оскільки CDR-ділянки відповідають за велику частину взаємодій «антиген-антитіло», можна експресувати рекомбінантні антитіла, мімікруючі можливості природних антитіл, шляхом конструювання експресуючих векторів, що включають в себе CDRкодуючі послідовності ДНК природного антитіла, в цьому випадку Н33, вміщених в каркас послідовностей іншого антитіла з іншими властивостями (дивіться, наприклад, Riechmann, L. et al., 1998, Nature 332: 323-327; Jones, P. et al., 1986, Nature 321: 522-525; and Queen, С et al., 1989, Proc. Natl. Acad. See. U. S. A. 86: 10029-10033). Подібні каркасні послідовності можуть бути отримані на основі даних послідовностей, які є в публічних базах ДНК, що включають в себе імуноглобулінові гени зародкової лінії. Дані послідовності зародкової лінії будуть відрізнятися від «зрілих» послідовностей відповідної геномної ДНК, оскільки не містять повністю зібраних генів варіабельних ділянок, що формуються шляхом V (D) J-рекомбінації в процесі дозрівання В-клітин. Послідовності ДНК зародкової лінії також будуть відрізнятися від послідовностей, що кодують високоафінні антитіла вторинного репертуару, що містять соматичні мутації протягом всієї варіабельної ділянки, як правило, однак, кластеризованi в CDR-ділянках. Наприклад, соматичні мутації відносно рідкі на N-кінці каркасної ділянки 1 і на С-кінці каркасної ділянки 4. Більш того, багато які соматичні мутації не впливають значного чином на зв'язуючі властивості антитіла. Таким чином, для отримання інтактного рекомбінантного антитіла, що володіє схожими з природним антитілом зв'язувальними здатностями, отримання повної послідовності ДНК даного антитіла не є необхідним (дивіться патент WO 99/45962). Для даної мети звичайно достатньо часткової послідовності легкого і важкого ланцюгів, яка повністю покриває CDR-ділянки. Часткова послідовність використовується для визначення того, які з V- і J-сегментів відповідають рекомбінантним генам антитіла. Далі послідовність ДНК зародкової лінії використовується для заповнення відсутніх ділянок варіабельних ділянок. У процесі дозрівання білка лідерні послідовності легкого і важкого ланцюгів розщеплюються і не впливають на властивості антитіла, що утворюється. Для додання відсутніх послідовностей клоновану кДНК можна комбінувати з синтетичними олігонуклеотидами шляхом лігування або ПЛР-ампліфікації. Як альтернатива, вся варіабельна ділянка може бути синтезована на основі набору коротких олігонуклеотидів, що перекриваються, скомбінованих шляхом ПЛР-ампліфікації, з утворенням повністю синтетичного клону варіабельної ділянки. Даний процес володіє рядом переваг, таких як елімінація або включення певних рестрикційних сайтів або оптимізація певних кодонів. У даній заявці словосполучення «інгібуючі ангіогенез молекули» відноситься до Н33 і всіх його фрагментів і похідних, що зберігають ідентичну або схожу специфічність згідно із заявленим. 95057 16 Винахід також відноситься до застосування інгібуючих ангіогенез молекул, таких як Н33, їх фрагментів і похідних для складання терапевтичних або діагностичних композицій для лікування або діагностики раку, зокрема солідних пухлин. Винахід також стосується терапевтичних або діагностичних композицій для лікування або діагностики раку, зокрема, солідних пухлин, що містить терапевтично або діагностично ефективні кількості однієї або декількох інгібуючих ангіогенез молекул згідно з винаходом, і прийнятний наповнювач, носій, розчинник або іншу добавку. Фахівець в галузі терапії раку буде здатний підібрати згадані терапевтично або діагностично ефективні кількості. Композиція може також містити комбінацію двох і більше інгібуючих ангіогенез молекул згідно з винаходом. Фармацевтичні композиції згідно з винаходом можуть також бути включені до складу комбінованої терапії, тобто скомбіновані з іншими препаратами. Наприклад, комбінований терапевтичний режим може включати в себе як мінімум один хіміотерапевтичний препарат, як мінімум один протизапальний препарат або як мінімум один імуносупресант. У іншому втіленні інгібуючі ангіогенез молекули можуть бути використані в поєднанні з радіотерапією. У іншому втіленні інгібуючі ангіогенез молекули можуть бути використані в поєднанні з препаратами (одним або більше) інших антитіл, зокрема, з препаратами (одним або більше) людських антитіл, таких, наприклад, як анти-VЕGF-антитіла. Режими дозування підбираються таким чином, щоб забезпечити оптимум бажаної відповіді (наприклад, оптимум терапевтичної відповіді). Так, може бути введений одиничний болюс, або доза може бути розділена на декілька менших, що вводяться через деякий часовий інтервал, або доза може бути пропорційно зменшена або збільшена в залежності від особливостей терапевтичної ситуації. Особливо важливим є складання парентеральних композицій в лікарській дозованій формі для простоти введення і стандартизації дозування. Використовуване тут словосполучення «лікарська дозована форма» стосується фізично дискретних одиниць, прийнятних як універсальні дозовані форми для введення пацієнтам; кожна одиниця містить певну кількість активного компонента, підібраного таким чином, щоб досягти бажаного терапевтичного ефекту при введенні активного компонента у вигляді лікарської форми, яка також містить необхідний фармацевтичний носій. Специфікація одиниць дозованих форм згідно з винаходом диктується і напряму залежить від (а) унікальних характеристик активного компонента і бажаного терапевтичного ефекту, і (b) обмежень, характерних власне для даної галузі, таких як активний компонент для лікування чутливості. Словосполучення «парентеральне введення» і «введений (а, e, і) парентерально», що використовуються в даній заявці означають способи введення, відмінні від ентерального і топічного, що звичайно являють собою ін'єкції або інфузі'і, і 17 включають в себе, без обмежень, внутрішньовенні, внутрішньом'язов, внутрішньоартеріальні, інтратекальні, інтракапсулярні, інтраорбітальні, внутрішньосерцеві, внутрішньошкірні, внутрішньочеревинні, транстрахеальні, підшкірні, субкутикулярнi, внутрішньосуглобові, субкапсулярнi, субарахноїдальні, інтраспінальні, епідуральні і інтрастернальні ін'єкції і інфузії. Інгібуючі ангіогенез молекули згідно з винаходом можуть бути включені в фармацевтичну композицію разом з прийнятним наповнювачем, носієм або розчинником. Приклади прийнятних водних і неводних носіїв, які можуть бути включені в фармацевтичні композиції згідно з винаходом, включають в себе воду, етанол, поліоли (такі як гліцерин, пропіленгліколь, поліетиленгліколь і т. д.), прийнятні суміші вищеназваних компонентів, рослинні олії, такі як оливкова олія, і придатний для ін'єкцій органічний складний ефір, таке як етилолеат. Дані композиції можуть містити також різні добавки, такі як консерванти, зволожувальні агенти, емульгатори і диспергуючі агенти. Запобігання мікробному зараженню композиції може бути досягнуте як стерилізаційними процедурами, так і за допомогою включення до складу композиції різних антибактерійних і протигрибкових засобів, таких як парабен, хлорбутанол, фенол, сорбінова кислота і т. д. Також може бути бажане включення в композицію ізотонічних агентів, таких як цукор, хлорид натрію і т. д. В доповнення до цього пролонговане всмоктування може бути досягнуте шляхом включення агентів, інгібуючих всмоктування, таких як моностеарат алюмінію і желатин. У тому випадку, якщо препарати згідно з винаходом використовуються як фармацевтичні агенти, що вводяться людині або тварині вони можуть бути введені окремо або в складі фармацевтичної композиції що містить, наприклад, від 0,01 до 99,5% (більш переважно, від 0,1 до 90%) активного інгредієнта, в комбінації з фармацевтично прийнятним носієм. Незалежно від типу введення, для інгібуючих ангіогенез молекул згідно з винаходом, які можуть використовуватися у прийнятній гідратованій формі і/або фармацевтичних композицій згідно з винаходом, можуть бути підібрані фармацевтично прийнятні дозовані форми за допомогою відомих фахівцям в даній галузі загальноприйнятих способів. Реальні рівні дозування активних інгредієнтів фармацевтичних композицій згідно з винаходом можна варіювати таким чином, щоб досягнути бажаного терапевтичного ефекту у даного пацієнта в даній композиції і при даному способі введення без небажаних токсичних ефектів. Вибраний рівень дозування буде залежати від різних фармакокінетичних факторів, включаючи активність конкретних композицій згідно з винаходом або складного ефіру, солей або амідів сполук, їх що складають, типу введення, часу введення, швидкості виведення даного компонента, тривалості лікування, інших препаратів, речовин і/або матеріалів, що використовуються в комбінації з даною композицією, віку, статі, стану, загального статусу 95057 18 здоров'я і анамнезу пацієнта, а також інших факторів, відомих в різних галузях медицини. Лікуючий лікар або ветеринар, що має базовий досвід в своїй галузі може легко визначити ефективні кількості необхідної фармацевтичної композиції. Наприклад, лікар або ветеринар може почати терапію препаратами згідно з винаходом з доз, менших по відношенню до необхідних для досягнення бажаного терапевтичного ефекту, поступово збільшуючи дозування доти, поки бажаний ефект не буде досягнутий. Як правило, прийнятною добовою дозою композиції є мінімальна доза, необхідна для досягнення терапевтичного ефекту. Подібна ефективна доза, як правило, залежить від вказаних вище факторів. Прийнятним типом введення може бути внутрішньовенне, внутрішньом'язове, внутрішньочеревинне або підшкірне, переважно здійснюване в ділянки тіла, проксимальної до сайту-мішені. Також ефекторна добова доза терапевтичної композиції може бути введена у вигляді однією двох, трьох, чотирьох, п'яти, шести або більшої кількості суб-доз протягом доби через певні проміжки часу, необов'язково в лікарській дозованій формі. Незважаючи на те, що препарат згідно з винаходом може бути введений сам по собі переважним є його введення в складі фармацевтичної композиції. Наприклад, при використанні Н33 як інгібуючої ангіогенез молекули дозування може бути визначене або підібране шляхом вимірювання кількості циркулюючих Н33 в біологічній пробі в різні моменти часу після введення за допомогою антиідіотипових антитіл проти Н33 або з використанням інших специфічних способів для детекції Н33, наприклад, за допомогою ELISA-аналізу з використанням покриття плашок JAM-C. Терапевтичні композиції можуть бути введені також за допомогою медичного обладнання, відомого в даній галузі. Наприклад, в переважному втіленні терапевтичні композиції згідно з винаходом можуть бути введені за допомогою безголкового гіподермічного ін'єкційного апарату, такого як прилади, описані в патентах США №№ 5399163; 5383851; 5312335; 5064413; 4941880; 4790824; 4596556. Приклади широко відомих імплантатів і модулів, які можуть бути корисні в контексті згідно з винаходом, викладені в наступних патентах: патенті США № 4487603, що описує імплантовану мікроінфузійну помпу для забезпечення вивільнення ліків з контрольованою швидкістю; патенті США № 4486194, що описує терапевтичний пристрій для введення лікарських засобів через шкіру; патенті США № 4447233, що описує інфузійну помпу для доставки лікарських засобів з точною швидкістю інфузії; патенті США № 4447224, що описує різні імплантаційні інфузійні апарати для безперервної доставки; патенті США № 4439196, що описує осмотичну систему доставки. Фахівцям в даній галузі відома безліч інших подібних імплантатів, систем доставки і модулів. У деяких втіленнях інгібуючі ангіогенез молекули згідно з винаходом можуть використовуватися у вигляді лікарських форм, які забезпечують необхідний розподіл активного компонента in vivo. 19 Наприклад, багато які високо гідрофільні компоненти не здатні подолати гематоенцефалічний бар'єр (ВВВ). Для забезпечення проникнення терапевтичних препаратів згідно з винаходом через гематоенцефалічний бар'єр (у разі необхідності) вони можуть бути доставлені за допомогою ліпосом. Способи отримання ліпосом описані наприклад, в патентах США №№ 4522811, 5374548 і 5399331. Ліпосоми можуть включати в себе одну або декілька речовин, що селективно транспортуються до специфічних органів або тканин, тим самим поліпшуючи направлену доставку ліків (дивіться, наприклад, V. V. Ranade (1989) J. Clin. Pharmacol. 29: 685). Приклади подібних речовин включать в себе фолат або біотин (дивіться, наприклад, патент США № 5416016, Low et al.); манозиди (Umezawa et al. (1988) Biochem. Biophys. Res. Commun. 153: 1038); антитіла (P. G. Bloeman et al. (1995) FEBS Lett. 357: 140; M. Owais et al. (1995) Antimicrob. Agents Chemother. 39: 180); рецептор до поверхневого білка A (Briscoe et al. (1995) Am. J. Physiol. 1233: 134), різні форми якого можуть бути використані для доставки активних препаратів згідно з винаходом, так само, як і останні можуть містити їх самі по собі в складі своєї структури; p120 (Schreier et al. (1994) J. Biol. Chem. 269:9090); дивіться також К. Keinanen; Μ. L. Laukkanen (1994) FEBS Lett. 346:123; J. J. Killion; I. J. Fidler (1994) Iirmiunomethods 4: 273. У одному з втілень згідно з винаходом, для доставки інгібуючих ангіогенез молекул використовуються ліпосоми; в більш переважному втіленні ліпосоми включають в себе речовини, що селективно транспортуються до специфічних органів або тканин. У найбільш переважному втіленні терапевтичні препарати в ліпосомах доставляються шляхом болюсної ін'єкції в ділянку тіла, проксимальну по відношенню до цільового сайту, наприклад, до ділянки локалізації пухлини. Композиція повинна бути рідкою, володіючи в'язкістю, що дозволяє вводити композицію за допомогою шприца. Композиція повинна бути стабільною в умовах отримання і зберігання, а також повинна бути захищена від контамінуючого впливу мікроорганізмів, таких як бактерії і гриби. Ефективне дозування і режими дозування для інгібуючих ангіогенез молекул згідно з винаходом залежать від захворювання або стану, що підлягає лікуванню, і можуть бути визначені фахівцями в даній галузі. «Терапевтично ефективне дозування» в протипухлинній терапії може бути визначене на основі об'єктивної пухлинної відповіді яка може бути повною або частковою. Повна відповідь (complete response, CR) має на увазі відсутність клінічних, радіологічних і яких-небудь інших ознак захворювання. Часткова відповідь (partial response, PR) має на увазі зменшення розміру пухлини більш ніж на 50%. Середній час до прогресії - величина, що характеризує тривалість об'єктивної пухлинної відповіді. «Терапевтично ефективне дозування» в протипухлинній терапії також може бути визначене на основі здатності стабілізувати прогресію захворювання. Здатність сполуки інгібувати ріст пухлини 95057 20 може бути оцінена за допомогою тваринних модельних систем, що дозволяють передбачати ефективність препарату для лікування людських пухлин. Терапевтично ефективна кількість терапевтичної сполуки може зменшити розмір пухлини або іншим способом поліпшити стан пацієнта. Фахівець, що володіє основними навичками в даній галузі здатний визначити дану кількість, виходячи з таких факторів, як маса тіла пацієнта, тяжкість симптомів захворювання, конкретної композиції або вибраного типу введення. Відповідно до цього пацієнти, що отримали лікування композиціями згідно з винаходом, можуть додатково отримувати лікування іншими терапевтичними агентами (до, одночасно або після введення препаратів згідно з винаходом) для підвищення терапевтичного ефекту молекул згідно з винаходом. Далі даний винахід відноситься до застосування препаратів даного винаходу в діагностиці. Мічені антитіла, наприклад, можуть використовуватися для встановлення локалізації пухлинних вогнищ в організмі пацієнта. Способи мічення антитіл з використанням радіоактивних, парамагнітних або інших міток добре відомі в даній галузі. У особливому втіленні даний винахід пов'язаний зі способом діагностики захворювань, асоційованих з JAM-C, за допомогою ex vivo або in vitro детекції JAM-C в біологічних пробах, таких як проби тканин, проби клітин або проби біологічних рідин організму. Це може бути виконане, наприклад, за допомогою способів, які забезпечують контакт тестованої проби, факультативно - разом з контрольною пробою, з антитілами Н33, їх фрагментами або похідними, в умовах, що забезпечують можливість утворення комплексу між Н33 і JAM-C. Далi, утворення комплексу може бути детектоване (наприклад, з використанням ELISA). У разі паралельного використання контрольної проби комплекс може бути детектований в обох пробах, і будь-яка статистично значуща різниця в рівні формування комплексів між двома пробами буде вказувати на присутність JAM-C в тестованій пробі. Даний винахід буде далі описаний за допомогою нижченаведених прикладів. Дані приклади мають лише ілюстративні цілі і ніяким чином не обмежують відповідних аспектів винаходу. У даних прикладах використовується наступний ілюстративний матеріал: На Фіг. 1 показано, що JAM-C експресується в кровоносних судинах людської пухлини печінки. Експресію JAM-C аналізували на панелі ангіогенних пухлин. Транскрипти, що кодують JAM-C, не виявляються в нормальній печінці. Імунозабарвлювання заморожених зрізів анти-JAM-Сантитілом виявляє експресію JAM-C в субпопуляції кровоносних судин (указано на малюнку стрілками). Фарбування поліклональним антитілом проти РЕСАМ-1, що дозволяє візуалізувати судинні структури, показане на правій панелі; ангіогенні характеристики пухлини контролювали з допомогою анти-v3-фарбування. На Фіг. 2 показано, що JAM-C рекрутується в ділянку міжендотеліальних контактів клітин HUVEC після стимуляції VEGF. (А) Клітини HUVEC 21 стимулювали рекомбінантним VEGF-165, фіксували формальдегідом і візуалізували локалізацію JAM-C анти-JAM-С-моноклональними антитілами. Як контроль використовувалося анти-JAM-Αфарбування. Після VEGF-165-стимуляції ділянки, багаті JAM-C, локалізувалися в ділянці міжклітинних контактів, тоді як згадана стимуляція не надавала впливу на локалізацію JAM-Α. (В) В результаті проведеного FACS-аналізу було показано, що подібне збагачення ділянок міжклітинних контактів молекулами JAM-C відбувається в результаті їх релокалізації, оскільки рівень експресії JAM-C не змінювався після VEGF-опосередкованої (тонка лінія - негативний контроль; пунктирна лінія - необроблені клітини; товста лінія - клітини, оброблені VEGF). На Фіг. 3 показано, що анти-JAM-Смоноклональне антитіло блокує ангіогенез in vitro. Кільця з мишачих аорт ростили між двома шарами матригелю в присутності або за відсутності антиJАМ-С-моноклональних антитіл (50 мкг/мл), і неоваскуляризація візуалізувалася 12 днів опісля. Ілюстрації являють собою світлові мікрофотографії репрезентативних мікросудин кілець аорт, або необроблених (А, n=11), або оброблених антиJАМ-С-моноклональними антитілами Н33 (В, n=11) і D33 (С, n=6), або оброблених підібраними по ізотипу контрольними антитілами Mel14 (D, n=6). Тільки антитіла Н33 блокували ріст кровоносних судин. На Фіг. 4 показано, що анти-JАМ-С-антитіла гальмують пухлинний ріст і знижують пухлинну васкуляризацію. Мишам однократно підшкірно вводили клітини LLC1 і далі кожний другий деньанти-JAM-С-антитіла або підібрані по ізотипу контрольні антитіла (150 мкг). (А) Макроскопічний вигляд 12-денної пухлини LLC1, що зросла у контрольних мишей (PBS або підібрані по ізотипу контрольні антитіла), або у мишей, яким вводили анти-JАМ-С-антитіла Н33. Пухлини мишей, яким вводили анти-JАМ-С-антитіла Н33, демонстрували знижений об'єм (В) і вагу (С). Мікросудини візуалізували шляхом імунозабарвлювання на РЕСАМ-1 (D) і підраховували за допомогою комп'ютерного аналізу (Е). *р
ДивитисяДодаткова інформація
Назва патенту англійськоюAngiogenesis inhibiting molecule and use thereof in the treatment and diagnosis of cancer
Автори англійськоюImhof Beat A., Aurrand-Lions Michel
Назва патенту російськоюМолекула, которая ингибирует ангиогенез, и ее применение в лечении и диагностике рака
Автори російськоюИмхоф Беат А., Орран-Льон Мишель
МПК / Мітки
МПК: C12N 5/20, A61K 39/395, C07K 16/28, G01N 33/577, A61P 35/00
Мітки: інгібує, молекула, застосування, діагностиці, яка, лікуванні, раку, ангіогенез
Код посилання
<a href="https://ua.patents.su/19-95057-molekula-yaka-ingibueh-angiogenez-i-zastosuvannya-v-likuvanni-i-diagnostici-raku.html" target="_blank" rel="follow" title="База патентів України">Молекула, яка інгібує ангіогенез, і її застосування в лікуванні і діагностиці раку</a>
Попередній патент: Спосіб виготовлення труб з композиційних волокнистих матеріалів
Наступний патент: Модуль-детектор гамма-випромінювання для застосування в порталах
Випадковий патент: Спосіб виготовлення прямошовних електрозварних профільних труб