Співкристали l-проліну і лимонної кислоти з (2s,3r,4r,5s,6r)-2-(3-((5-(4-фторфеніл)тіофен-2-іл)метил)-4-метилфеніл)-6-(гідроксиметил)тетрагідро-2н-піран-3,4,5-тріолом
Формула / Реферат
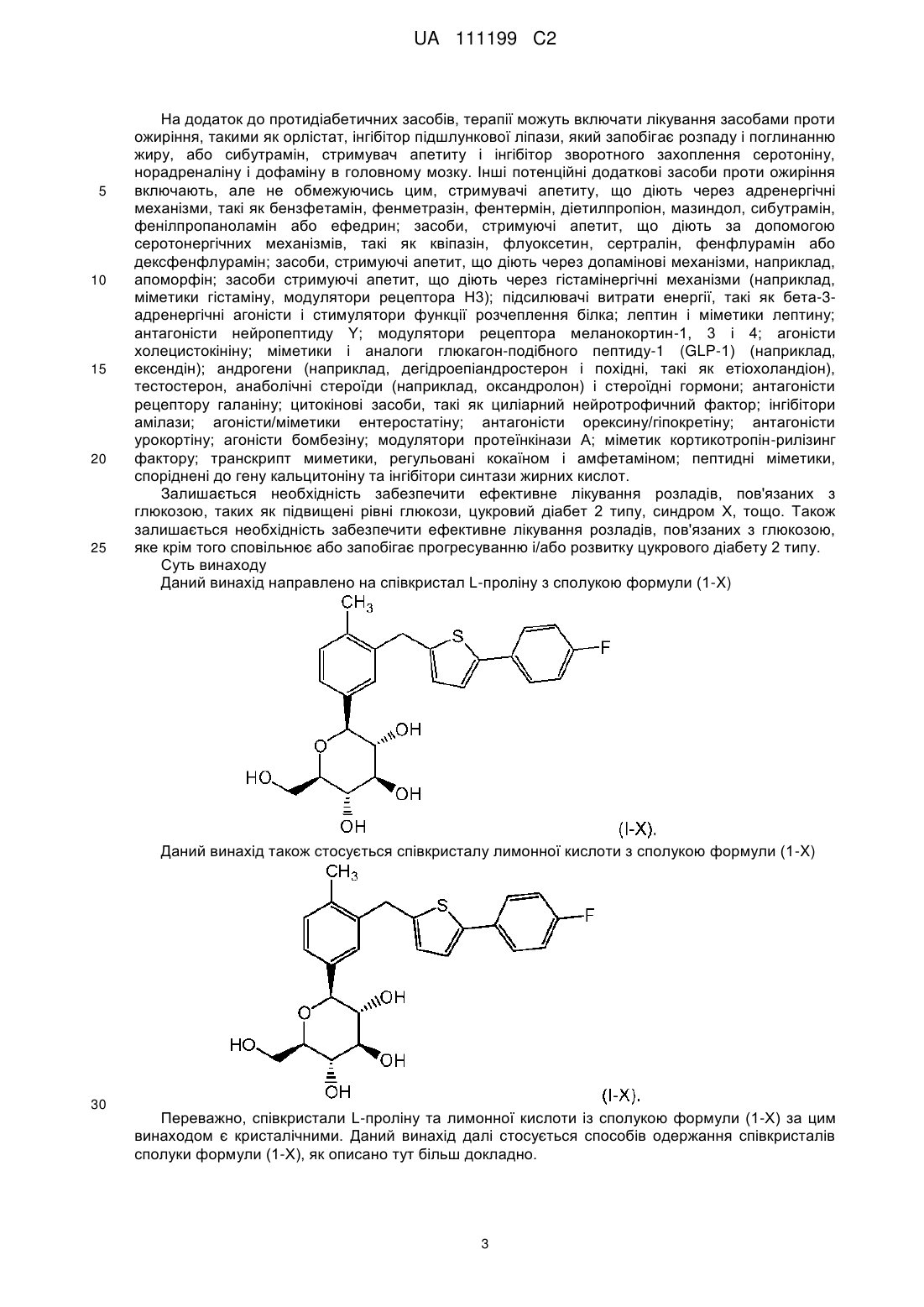
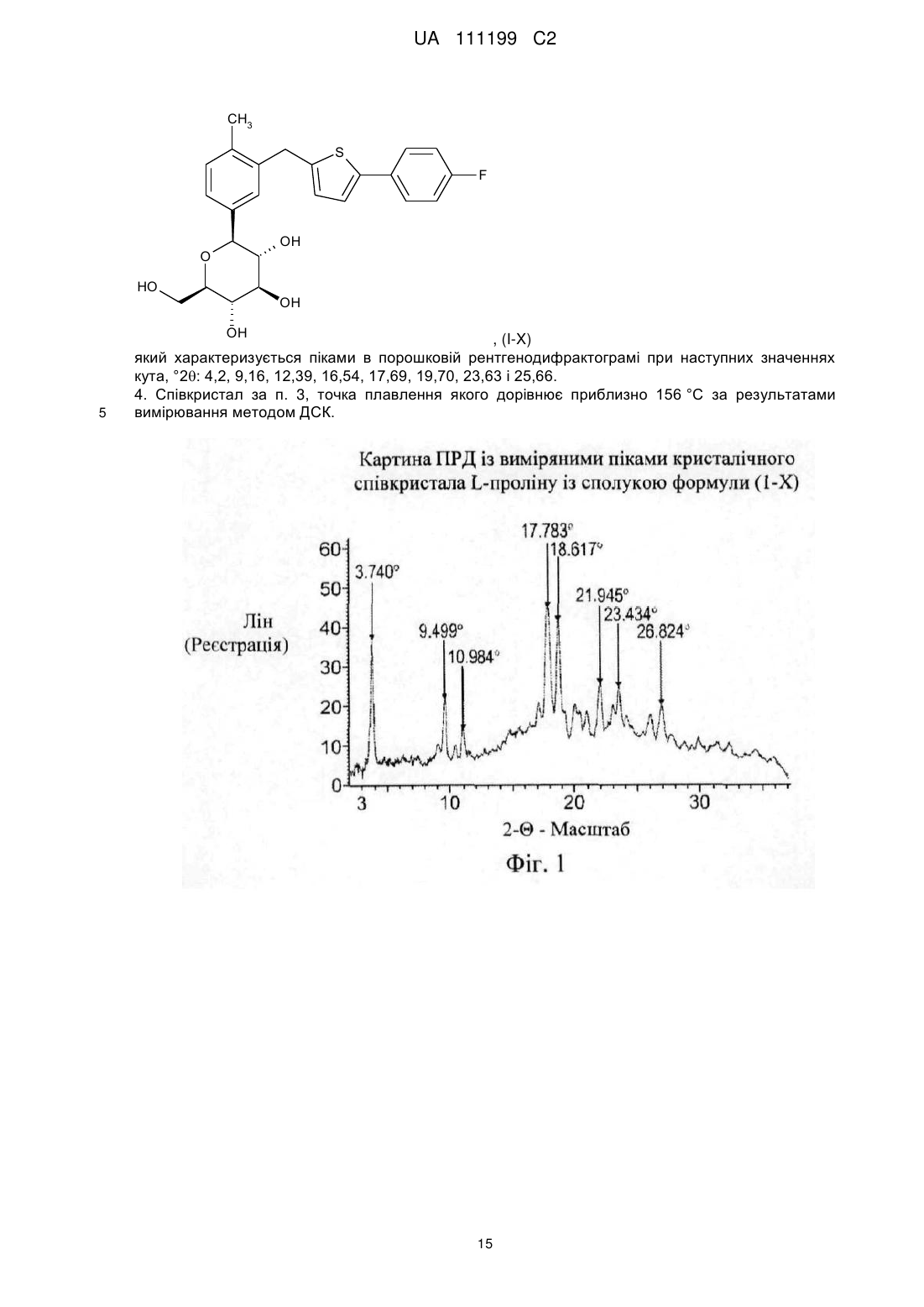
1. Співкристал L-проліну і сполуки формули (I-Х)
 , (I-X)
, (I-X)
який характеризується піками в порошковій рентгенодифрактограмі при наступних значеннях кута, °2q: 3,74, 9,50, 10,98, 17,78, 18,62, 21,94, 23,43 і 26,82.
2. Співкристал за п. 1, точка плавлення якого дорівнює 188 °C, за результатами вимірювання методом ДСК.
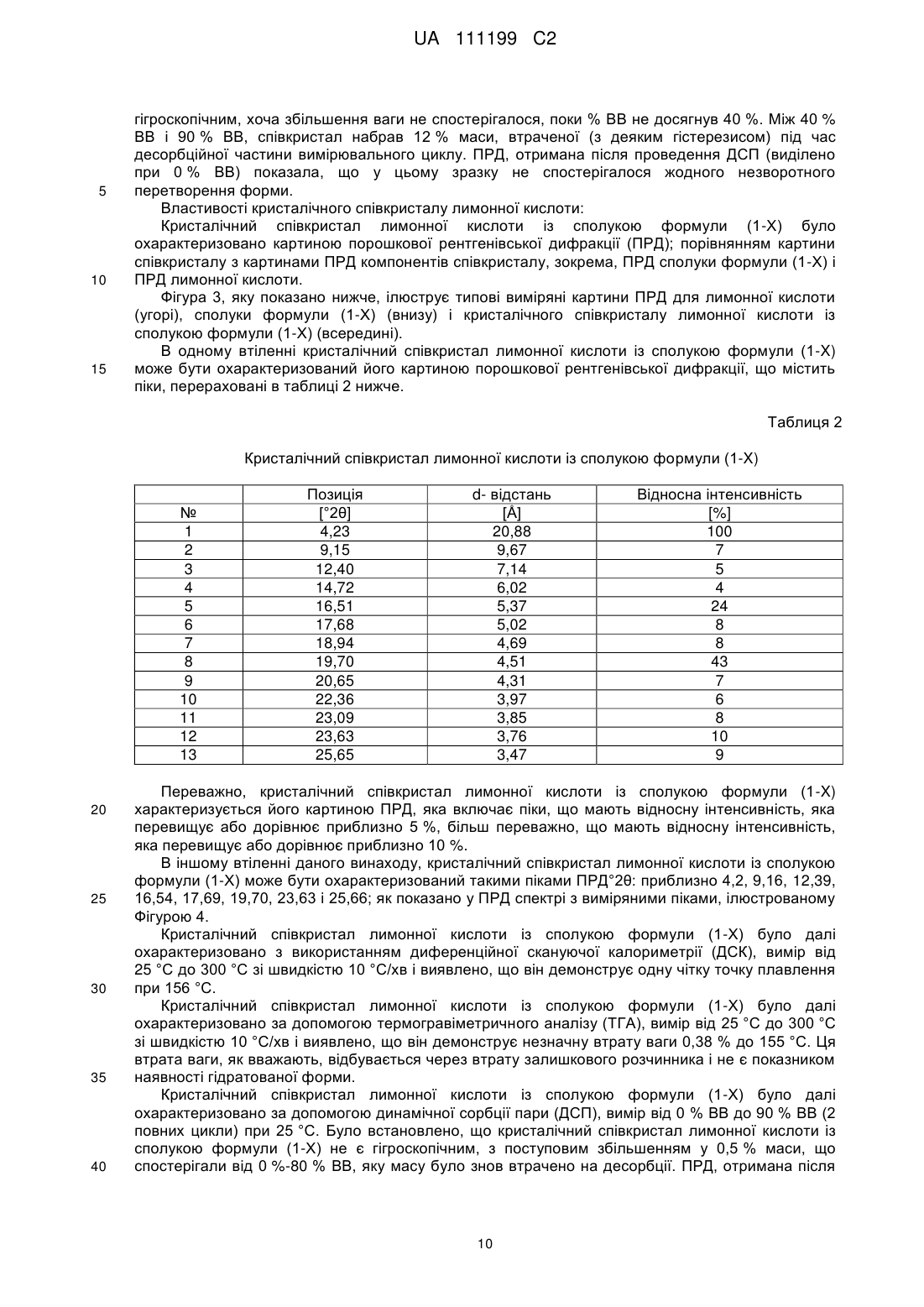
3. Співкристал лимонної кислоти і сполуки формули (I-Х)
 , (I-X)
, (I-X)
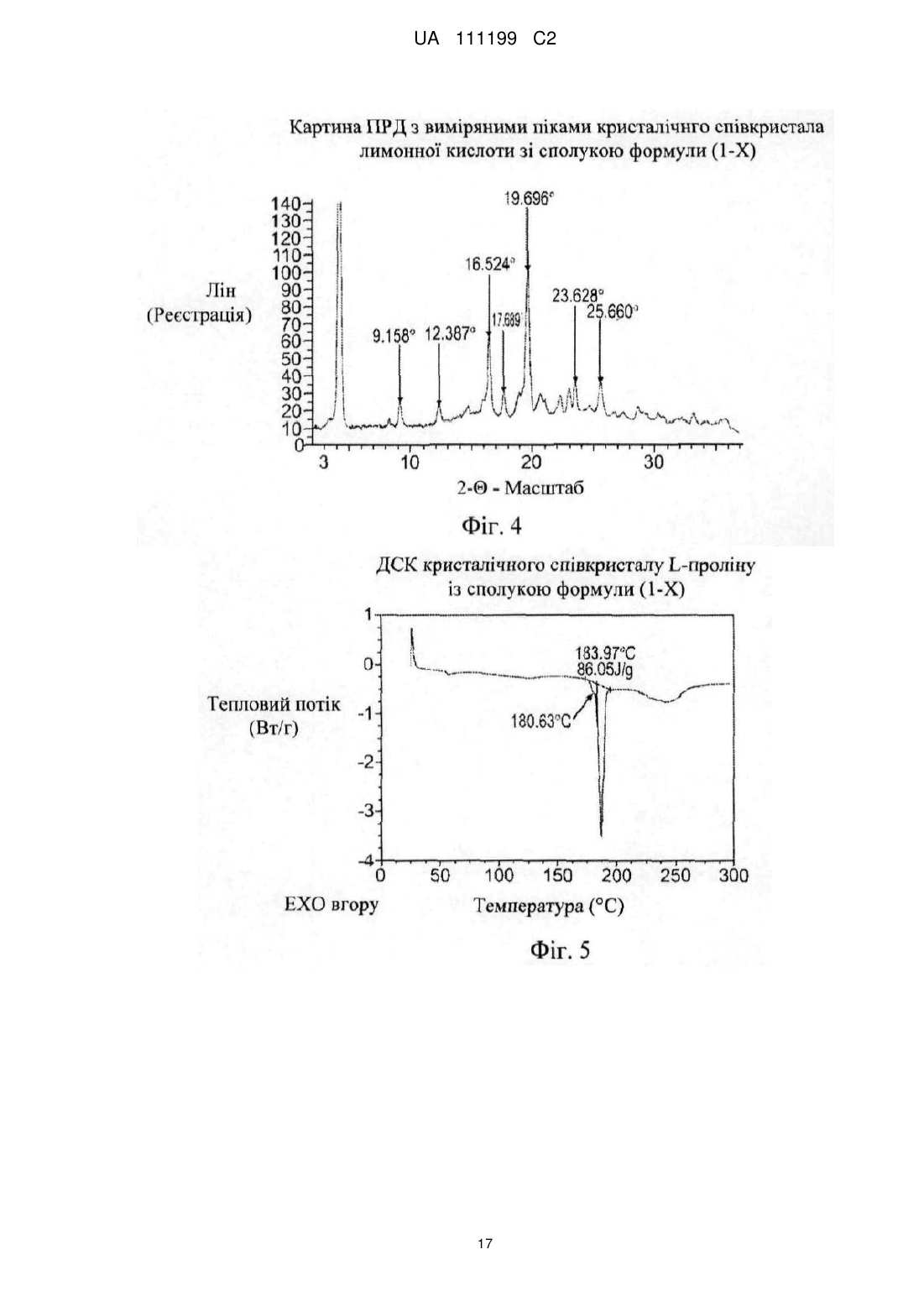
який характеризується піками в порошковій рентгенодифрактограмі при наступних значеннях кута, °2q: 4,2, 9,16, 12,39, 16,54, 17,69, 19,70, 23,63 і 25,66.
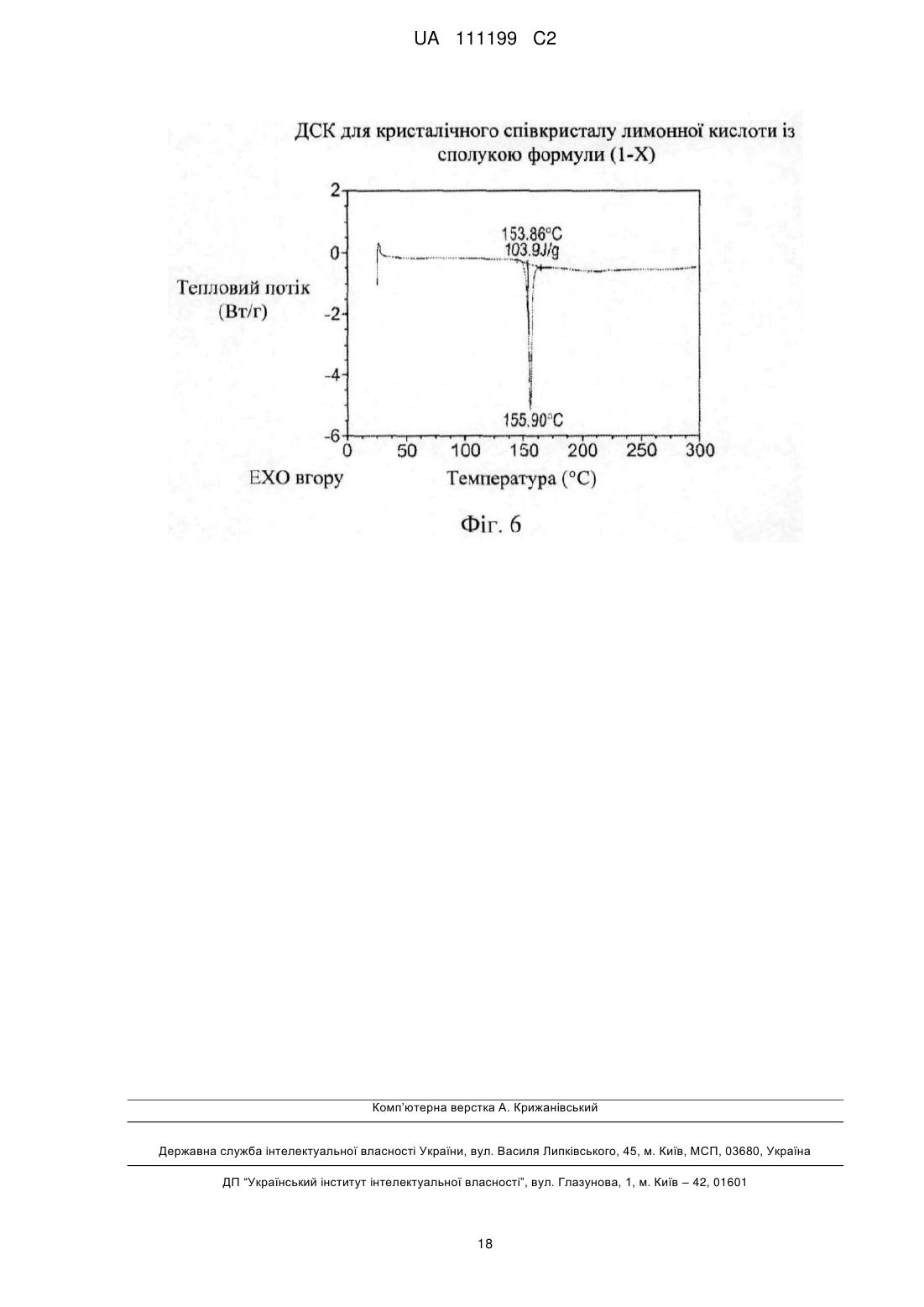
4. Співкристал за п. 3, точка плавлення якого дорівнює приблизно 156 °C за результатами вимірювання методом ДСК.
Текст
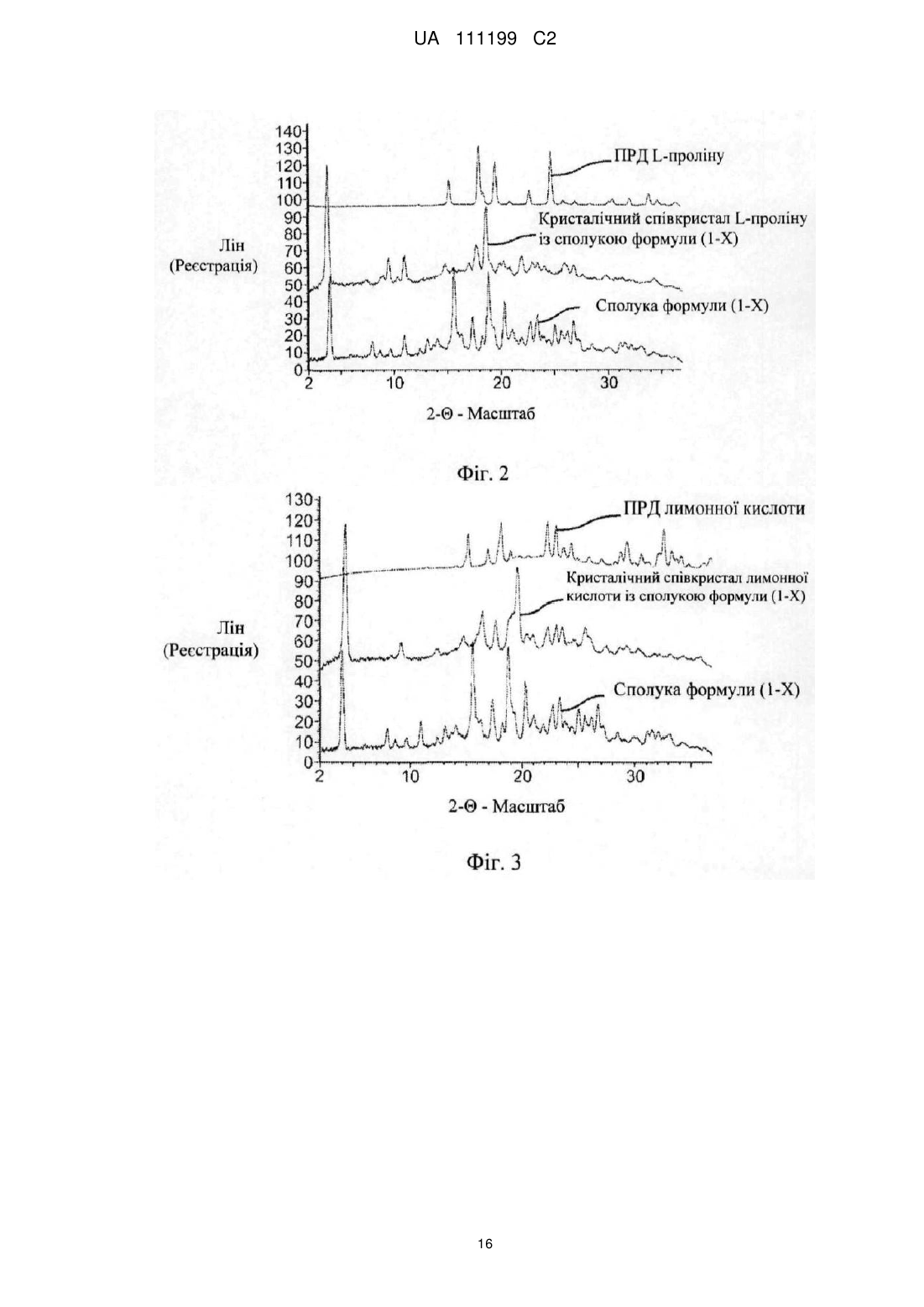
Реферат: Даний винахід спрямований на співкристали (2S,3R,4R,5S,6R)-2-(3-((5-(4-фторфеніл)тіофен-2іл)метил)-4-метилфеніл)-6-(гідроксиметил)тетрагідро-2Н-піран-3,4,5-тріолу з L-проліном та лимонною кислотою, фармацевтичні композиції, які містять вказані співкристали, та їх застосування в лікуванні опосередкованих глюкозою розладів, таких як цукровий діабет 2-го типу та синдром X. UA 111199 C2 (12) UA 111199 C2 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки Дана заявка вимагає пріоритет попередньої заявки США 61/483, 887, поданої 9 травня 2011, яка включена сюди за допомогою посилання у всій своїй повноті. Галузь техніки, до якої належить винахід Даний винахід спрямований на співкристали L-проліну та лимонної кислоти з (2S, 3R, 4R, 5S, 6R)-2-(3-((5-(4-фторфеніл)тіофен-2-іл)метил)-4-метилфеніл)-6-(гідроксиметил)тетрагідро2Н-піран-3,4,5-триолом, фармацевтичні композиції, що містять вказані співкристали та їх використання в лікуванні розладів, пов'язаних з глюкозою, таких як цукровий діабет 2 типу і синдром X. Рівень техніки Цукровий діабет - це медичний термін для присутності підвищеної глюкози в крові. Люди з діабетом або не виробляють інсулін, виробляють занадто мало інсуліну або не реагують на інсулін, що призводить до накопичення глюкози в крові. Найбільш поширеною формою діабету є діабет 2 типу, який колись називали діабетом дорослих або інсулінонезалежним діабетом (ІНЦД), що може бути відповідальним за >90 % діабету у дорослих. Проте, оскільки у молодшого населення все частіше зустрічається надмірна вага або ожиріння, діабет 2 типу стає все більш поширеним в підлітків і дітей. Діабет може також посилатися на гестаційний цукровий діабет, діабет 1 типу або автоімунний діабет, який колись називали юнацьким діабетом і діабет 1,5 типу, також відомий як латентний автоімунний діабет у дорослих або LADA. Діабет може виникнути через погані звички харчування або відсутність фізичної активності (наприклад, сидячий спосіб життя), генетичні мутації, пошкодження підшлункової залози, піддавання дії ліків (наприклад, лікування СНІДу) або хімікатів (наприклад, стероїдів) або захворювання (наприклад, муковісцидоз, синдром Дауна, синдром Кушинга). Два рідкісні типи генетичних дефектів, що призводять до діабету, називаються діабетом дорослого типу у молодих (MODY) і атиповим цукровим діабетом (ADM). Цукровий діабет 2 типу (інсулінонезалежний цукровий діабет або ІНЦД) є порушенням обміну речовин, що включає дисрегуляцію метаболізму глюкози і резистентності до інсуліну, і довгострокові ускладнення, пов'язані з очами, нирками, нервами і кровоносними судинами. Цукровий діабет 2 типу зазвичай розвивається в зрілому віці (середній вік або пізніше) і описується як нездатність організму або виробити достатньо інсуліну (ненормальна секреція інсуліну) або його нездатність ефективно використовувати інсулін (опір до дії інсуліну в органахмішенях і тканинах). Зокрема, пацієнти, які страждають на цукровий діабет 2 типу, мають відносну недостатність інсуліну. Тобто, у цих пацієнтів рівні інсуліну в плазмі складають від нормальних до високих в абсолютному вираженні, хоча вони нижчі за прогнозовані для рівня присутньої в плазмі глюкози. Цукровий діабет 2 типу характеризується такими клінічними ознаками або симптомами: постійно підвищена концентрація глюкози в плазмі або гіперглікемія; поліурія; полідипсія і/або ненажерливість; хронічні мікросудинні ускладнення, такі як ретинопатія, нефропатія і нейропатія, та макросудинні ускладнення, такі як гіперліпідемія і гіпертонія, які можуть призвести до сліпоти, термінальної стадії ниркової недостатності, ампутації кінцівок та інфаркту міокарда. Синдром X, також званий синдромом резистентності до інсуліну (IRS), метаболічним синдромом, або метаболічним синдромом Х, це розлад, який представляє фактори ризику для розвитку цукрового діабету 2 типу та серцево-судинних захворювань, включаючи нетолерантність до глюкози, гіперінсулінемію та інсулінорезистентність, гіпертригліцеридемію, гіпертонію і ожиріння. Діагноз цукровий діабет 2 типу включає в себе оцінку симптомів і вимір глюкози в сечі і крові. Визначення рівня глюкози в крові необхідно для постановки точного діагнозу. Зокрема, визначення рівня глюкози в крові натщесерце є стандартним використовним підходом. Проте, тест на толерантність до глюкози (OGTT) вважається більш чутливим, ніж рівень глюкози в крові натщесерце. Цукровий діабет 2 типу пов'язаний з порушенням пероральної толерантності до глюкози (ОГТ). OGTT таким чином може допомогти в діагностиці цукрового діабету 2 типу, хоча в цілому не є необхідним для діагностики цукрового діабету (Emancipator K, Am J Clin Pathol 1999 Nov.; pp. 665-674, т. 112 (5):665-74;. цукровий діабет 2 типу, Decision Resources Inc., March 2000). OGTT дозволяє оцінку секреторної функції бета-клітин підшлункової залози і чутливості до інсуліну, що допомагає в діагностиці цукрового діабету 2 типу та оцінeнні тяжкості або прогресування захворювання (наприклад, CAUMO, А., et al., J Clin Endocrinol Metab. 2000, pp. 4396-4402, Vol. 85 (11)). Більш конкретно, OGTT є надзвичайно корисним у встановленні ступеню гіперглікемії у хворих з множинними межовими рівнями глюкози в крові натщесерце, що не були діагностовані як діабетики. Крім того, OGTT корисний при тестуванні пацієнтів з 1 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 симптомами цукрового діабету 2 типу, де можливий діагноз аномального вуглеводного обміну має бути чітко встановлений або спростований. Таким чином, порушення толерантності до глюкози діагностується в осіб, які мають натщесерце рівні глюкози в крові менше, ніж ті, які потрібні для діагностики цукрового діабету 2 типу, але мають відповідь глюкози в плазмі протягом OGTT між нормальною і діабетичною. Порушення толерантності до глюкози вважається переддіабетичним станом, і порушення толерантності до глюкози (як визначається за допомогою OGTT) є сильним знаком для передбачення розвитку цукрового діабету 2 типу (HAFFNER С.М. Diabet Med. 1997 Aug; 14 Suppl 3:S12-8). Цукровий діабет 2 типу є прогресуючим захворюванням, пов'язаним зі зниженням функції підшлункової залози і/або іншими процесами, пов'язаними з інсуліном, погіршеним підвищеними рівнями глюкози в плазмі. Таким чином, цукровий діабет 2 типу, як правило, має пролонговану переддіабетичну фазу і різні патофізіологічні механізми можуть призвести до патологічної гіперглікемії та порушення толерантності до глюкози, наприклад, порушень в утилізації та ефективності глюкози, дії інсуліну і/або виробництві інсуліну в переддіабетичному стані (GOLDBERG, R.B., Med Clin North Am 0,1998 Jul; pp. 805-821, Vol… 82 (4)). Переддіабетичний стан, пов'язаний з порушенням толерантності до глюкози, може також бути пов'язаний зі схильністю до черевного ожиріння, інсулінорезистентності, гіперліпідемії, і високого кров'яного тиску, тобто з синдромом Х (GROOP Л, et al., Am J Hypertens. 1997 Sep;10(9 Pt 2): 172S-180S; HAFFNER, S.M… J Diabetes Complications, 1997 Mar-Apr; pp69-76, Vol. 11 (2); BECK-NIELSEN, H., et al., Diabet Med. 1996 Sep;13(9 Suppl 6):S78-84). Таким чином, недосконалий вуглеводний обмін має вирішальне значення в патогенезі цукрового діабету 2 типу та порушеній толерантності до глюкози (DIUNNEEN, SF, Diabet Med, 1997 Aug, 14 Suppl 3: S19-24). Насправді, континуум від порушеної толерантності до глюкози і порушеної глюкози натщесерце до повного цукрового діабету 2 типу існує (Ramlo-Halsted, BA, et al., Prim Care, 1999 Dec; pp. 771-789, Vol. 26 (4)). Раннє втручання у осіб з ризиком розвитку цукрового діабету 2 типу, зосереджене на зниженні патологічної гіперглікемії або порушеної толерантності до глюкози, може запобігти або затримати прогресування до цукрового діабету 2 типу і пов'язаних з ним ускладнень і/або синдрому X. Таким чином, за рахунок ефективного лікування порушення пероральної толерантності до глюкози і/або підвищених рівнів глюкози в крові, можна запобігти або інгібувати прогресування захворювання до цукрового діабету 2 типу або синдрому X. Типове лікування порушень глюкози, в тому числі цукрового діабету 2 типу і синдрому Х, фокусується на підтримці рівня глюкози в крові якомога ближче до нормального, наскільки це можливо, і включає в себе дієту і фізичні вправи, і, коли це необхідно, лікування антидіабетичними ліками, інсуліном або їх комбінацією. Цукровий діабет 2 типу, який не можна стримати дієтотерапією, лікують пероральними антидіабетичними ліками, включаючи, але не обмежуючись, сульфонілсечовини (наприклад, не обмежуючись першим поколінням: хлорпропамід, толазамід, толбутамід; другим поколінням: глибурід, гліпізид і третього покоління: глімепірид), бігуаніди (наприклад, метформін), тіазолідиндіони (наприклад, розиглітазон, піоглітазон, троглітазон), інгібітори альфа-глюкозидази (наприклад, акарбоза, міглітол), меглітинід (наприклад, репаглінід), інші інсулін-сенсибілізуючі складові, та/або інші засоби проти ожиріння (наприклад, орлістат або сибутрамін).Для синдрому X антидіабетичні засоби додатково комбінують з фармакологічними засобами для лікування супутніх захворюваностей (наприклад, гіпотензивними засобами для гіпертензії, гіполіпідемічними засобами для гіперліпідемії). Терапії першого ряду зазвичай включають метформін і сульфонілсечовини, а також тіазолідиндіони. Монотерапія метформіном є вибором першого ряду, зокрема, для лікування хворих на діабет 2 типу, що також страждають на ожиріння і/або дисліпідемію. За відсутності адекватної відповіді на метформін часто проводять лікування метформіном в комбінації з препаратами сульфонілсечовини, тіазолідиндіонами або інсуліном. Монотерапія сульфонілсечовиною (включаючи всі покоління ліків) також є поширеним варіантом першого ряду. Інший вибір терапії першого ряду може бути тіазолідиндіони. Пацієнтам, що не реагували належним чином на пероральну протидіабетичну монотерапію, дають комбінації цих засобів.Коли глікемічний контроль не може бути додержаний самими пероральними антидіабетиками, використовують інсулінотерапію або в якості монотерапії або в комбінації з пероральними протидіабетичними засобами. Ті самі стратегії, необов'язково в поєднанні з додатковими стратегіями (наприклад, анти-гіпертензивною) можуть бути використані для лікування синдрому X. 2 UA 111199 C2 5 10 15 20 25 На додаток до протидіабетичних засобів, терапії можуть включати лікування засобами проти ожиріння, такими як орлістат, інгібітор підшлункової ліпази, який запобігає розпаду і поглинанню жиру, або сибутрамін, стримувач апетиту і інгібітор зворотного захоплення серотоніну, норадреналіну і дофаміну в головному мозку. Інші потенційні додаткові засоби проти ожиріння включають, але не обмежуючись цим, стримувачі апетиту, що діють через адренергічні механізми, такі як бензфетамін, фенметразін, фентермін, діетилпропіон, мазиндол, сибутрамін, фенілпропаноламін або ефедрин; засоби, стримуючі апетит, що діють за допомогою серотонергічних механізмів, такі як квіпазін, флуоксетин, сертралін, фенфлурамін або дексфенфлурамін; засоби, стримуючі апетит, що діють через допамінові механізми, наприклад, апоморфін; засоби стримуючі апетит, що діють через гістамінергічні механізми (наприклад, міметики гістаміну, модулятори рецептора Н3); підсилювачі витрати енергії, такі як бета-3адренергічні агоністи і стимулятори функції розчеплення білка; лептин і міметики лептину; антагоністи нейропептиду Y; модулятори рецептора меланокортин-1, 3 і 4; агоністи холецистокініну; міметики і аналоги глюкагон-подібного пептиду-1 (GLP-1) (наприклад, ексендін); андрогени (наприклад, дегідроепіандростерон і похідні, такі як етіохоландіон), тестостерон, анаболічні стероїди (наприклад, оксандролон) і стероїдні гормони; антагоністи рецептору галаніну; цитокінові засоби, такі як циліарний нейротрофичний фактор; інгібітори амілази; агоністи/міметики ентеростатіну; антагоністи орексину/гіпокретіну; антагоністи урокортіну; агоністи бомбезіну; модулятори протеїнкінази A; міметик кортикотропін-рилізинг фактору; транскрипт миметики, регульовані кокаїном і амфетаміном; пептидні міметики, споріднені до гену кальцитоніну та інгібітори синтази жирних кислот. Залишається необхідність забезпечити ефективне лікування розладів, пов'язаних з глюкозою, таких як підвищені рівні глюкози, цукровий діабет 2 типу, синдром X, тощо. Також залишається необхідність забезпечити ефективне лікування розладів, пов'язаних з глюкозою, яке крім того сповільнює або запобігає прогресуванню і/або розвитку цукрового діабету 2 типу. Суть винаходу Даний винахід направлено на співкристал L-проліну з сполукою формули (1-X) Даний винахід також стосується співкристалу лимонної кислоти з сполукою формули (1-X) 30 Переважно, співкристали L-проліну та лимонної кислоти із сполукою формули (1-X) за цим винаходом є кристалічними. Даний винахід далі стосується способів одержання співкристалів сполуки формули (1-X), як описано тут більш докладно. 3 UA 111199 C2 5 10 15 20 25 30 35 40 45 Ілюстративною щодо цього винаходу є фармацевтична композиція, яка містить фармацевтично прийнятний носій і співкристал-затравку сполуки формули (1-X), як описано тут. Ілюстрацією цього винаходу є фармацевтична композиція, виготовлена шляхом змішування співкристалу-затравки сполуки формули (1-X), як описано тут, і фармацевтично прийнятного носія. Ілюструє цей винахід спосіб одержання фармацевтичної композиції, що включає змішування співкристалу-затравки сполуки формули (1-X), як описано тут, і фармацевтично прийнятного носія. Даний винахід також спрямований на способи лікування і/або профілактики розладів, пов'язаних з глюкозою, вказані способи включають введення суб'єкту, який цього потребує, кристалічного співкристалу сполуки формули (1-X), як описано тут. Короткий опис креслень Фіг. 1 ілюструє типовий спектр ПРД L-проліну (угорі), сполуки формули (1-X) (внизу) і кристалічних співкристалів L-проліну з сполукою формули (1-X) (всередині). Фігура 2 ілюструє типовий спектр ПРД з виміряними піками для кристалічного співкристалу L-проліну із сполукою формули (1-X). Фігура 3 ілюструє типовий спектр ПРД лимонної кислоти (угорі), сполуки формули (1-X) (внизу) і кристалічного співкристалу лимонної кислоти із сполукою формули (1-X) (всередині) Фігура 4 ілюструє типовий спектр ПРД з виміряними піками для кристалічних співкристалів лимонної кислоти з сполукою формули (1-X). Фігура 5 ілюструє типовий скан ДСК для кристалічного співкристалу L-проліну із сполукою формули (1-X). Фігура 6 ілюструє типовий скан ДСК для кристалічного співкристалу лимонної кислоти із сполукою формули (1-X). Докладний опис винаходу Даний винахід спрямований на співкристали сполуки формули (1-X) (також відомої як (2S, 3R, 4R, 5S, 6R)-2-(3-((5-(4-фторфеніл)тіофен-2-іл)метил)-4метилфеніл)-6-(гідроксиметил)тетрагідро-2H-піран-3,4,5-триол). Більш конкретно, даний винахід спрямований на співкристал L-проліну з сполукою формули (1-X) і співкристал лимонної кислоти з сполукою формули (1-X). В одному з втілень даного винаходу, співкристал L-проліну зі сполукою формули (1-X) є кристалічним.В іншому втіленні даного винаходу, співкристал лимонної кислоти із сполукою формули (I-X) є кристалічним. Сполука формули (1-X) проявляє інгібуючу активність проти натрій-залежного транспортера глюкози, такого як, наприклад SGLT2. Сполука формули (1-X), може бути одержана у відповідності зі способом, описаним у Nomura, С. et al., патентна публікація США 2005/0233988 A1, опублікована 20.10.2005, яка включена сюди шляхом посилання. Даний винахід також спрямований на способи лікування і/або профілактики розладів, пов'язаних з глюкозою (переважно - цукрового діабету 2 типу), вказані способи включають введення суб'єкту, який цього потребує, співкристалу сполуки формули (1-X), як описано тут. Використованим тут позначенням "*" будемо позначати присутність стереогенного центру. Коли сполуки за даним винаходом мають принаймні один хіральний центр, вони можуть відповідно існувати у вигляді енантіомерів. Коли сполуки володіють двома або більше хіральними центрами, вони можуть додатково існувати у вигляді діастереомерів. Слід розуміти, що всі такі ізомери та їх суміші включені в обсяг даного винаходу. Переважно, де сполука присутня у вигляді енантіомеру, енантіомер присутній в енантіомерному надлишку, що є вищим ніж або дорівнює приблизно 80 %, більш переважно, у енантіомерному надлишку, що є вищим 4 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 60 ніж або дорівнює приблизно 90 %, ще більш переважно, у енантіомерному надлишку, що є вищим ніж або дорівнює приблизно 95 %, ще більш переважно, в енантіомерному надлишку, що є вищим ніж або дорівнює приблизно 98 %, найбільш переважно, у енантіомерному надлишку, що є вищим ніж або дорівнює приблизно 99 %. Аналогічно, де сполука присутня у вигляді діастереомеру, діастереомер присутній у діастереомерному надлишку, що є вищим ніж або дорівнює приблизно 80 %, більш переважно, у діастереомерному надлишку, що є вищим ніж або дорівнює приблизно 90 %, ще більш переважно, у діастереомерному надлишку, що є вищим ніж або дорівнює приблизно 95 %, ще більш переважно, у діастереомерному надлишку, що є вищим ніж або дорівнює приблизно 98 %, найбільш переважно, у діастереомерному надлишку, що є вищим ніж або дорівнює приблизно 99 %. Крім того, деякі з кристалічних форм сполук за даним винаходом можуть існувати у вигляді поліморфів і, як такі, повинні бути включені в даний винахід. Крім того, деякі з сполук за даним винаходом можуть утворювати сольвати з водою (тобто гідрати) або звичайними органічними розчинниками, і такі сольвати також повинні бути охоплені обсягом даного винаходу. Використаний тут, якщо не вказано інше, термін "виділена форма" мусить означати, що сполука присутня у формі, яка є окремою від будь-якої твердої суміші з іншою сполукою (іншими сполуками), системи розчинників або біологічного середовища. В одному втіленні даного винаходу, співкристал L-проліну з сполукою формули (1-X) присутній у виділеній формі. В іншому втіленні даного винаходу, співкристал лимонної кислоти із сполукою формули (1-X) присутній в виділеній формі. Використаний тут, якщо не вказано інше, термін "по суті чиста форма" мусить означати, що молярний відсоток домішок в виділеній кристалічній формі є нижчим ніж приблизно 5 молярних відсотків, переважно є нижчим ніж приблизно 2 молярних відсотків, більш переважно, є нижчим ніж приблизно 0,5 молярних відсотків, найбільш переважно, є нижчим ніж приблизно 0,1 молярних відсотків. В одному втіленні даного винаходу співкристал L-проліну із сполукою формули (1-X) присутній як по суті чиста форма. В іншому втіленні даного винаходу співкристал лимонної кислоти із сполукою формули (1-X) присутній як по суті чиста форма. Даний винахід також спрямований на способи лікування і профілактики (переважно, запобігання розвитку) розладів, пов'язаних з глюкозою, що включає введення суб'єкту, який цього потребує, терапевтично ефективної кількості будь-якого з співкристалів сполуки формули (1-X), як описано тут. Методи даних винаходів спрямовані на лікування і/або профілактику (включаючи затримку в прогресуванні або початку) "розладів, пов'язаних з глюкозою". Використаний тут термін "розлади, пов'язані з глюкозою" мусить визначатися як будь-який розлад, що характеризується за допомогою, або розвивається в результаті, підвищених рівнів глюкози. Розлади, пов'язані з глюкозою, включають цукровий діабет, діабетичну ретинопатію, діабетичну нейропатію, діабетичну нефропатію, уповільнене загоєння ран, резистентність до інсуліну, гіперглікемію, гіперінсулінемію, підвищені рівні в крові жирних кислот, підвищені рівні в крові глюкози, гіперліпідемію, ожиріння, гіпертригліцеридемію, синдром Х, діабетичні ускладнення, атеросклероз або гіпертонію. Зокрема, "розлад, пов'язаний з глюкозою" є цукровим діабетом (тип 1 і тип 2 цукровим діабетом тощо), діабетичними ускладненнями (наприклад, діабетичною ретинопатією, діабетичною невропатією, діабетичною нефропатією), ожирінням, або гіперглікемією після їжі. В одному втіленні даного винаходу, розлад, пов'язаний з глюкозою, вибраний з групи, що складається з цукрового діабету, діабетичної ретинопатії, діабетичної невропатії, діабетичної нефропатії, уповільненого загоєння ран, резистентності до інсуліну, гіперглікемії, гіперінсулінемії, підвищених рівнів жирних кислот в крові, гіперліпідемії, ожиріння, гіпертригліцеридемії, синдрому X, ускладнень діабету, атеросклерозу і гіпертонії. В іншому втіленні даного винаходу, розлад, пов'язаний з глюкозою, вибраний з групи, що складається з цукрового діабету 1 типу, цукрового діабету 2 типу, діабетичної ретинопатії, діабетичної невропатії, діабетичної нефропатії, ожиріння і гіперглікемії після їжі. В іншому втіленні даного винаходу, розлад, пов'язаний з глюкозою, вибраний з групи, що складається з цукрового діабету 1 типу, цукрового діабету 2 типу, діабетичної ретинопатії, діабетичної невропатії, діабетичної нефропатії, ожиріння і уповільненого загоєння ран. В іншому втіленні даного винаходу, розлади, пов'язані з глюкозою, вибирають з групи, що складається з поганого глікемічного контролю, цукрового діабету 2 типу, синдрому X, гестаційного діабету, резистентності до інсуліну, гіперглікемії. В іншому втіленні даного винаходу розлад, пов'язаний з глюкозою, є цукровим діабетом 2 типу. В іншому варіанті розлад, пов'язаний з глюкозою, вибраний з групи, що складається з підвищеного рівня глюкози, переддіабетичного стану, порушення пероральної толерантності до 5 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 60 глюкози, поганого глікемічного контролю, цукрового діабету 2 типу, синдрому X (також відомого як метаболічний синдром), гестаційного діабету, резистентності до інсуліну та гіперглікемії. Лікування розладів, пов'язаних з глюкозою, може включати зниження рівня глюкози, підвищення контролю глікемії, зниження інсулінорезистентності і/або попередження розвитку розладу, пов'язаного з глюкозою (наприклад, запобігання розвитку діабету 2 типу у пацієнта, який страждає на порушену пероральну толерантність до глюкози або підвищені рівні глюкози). Використані тут терміни "синдром Х", "метаболічний синдром" і "метаболічний синдром X" мусять означати розлад, який представляє фактори ризику для розвитку цукрового діабету 2 типу та серцево-судинних захворювань і характеризується резистентністю до інсуліну та гіперінсулінемією, і може супроводжуватися одним або більше з наступних: (а) порушенням толерантності до глюкози, (б) цукровим діабетом типу 2, (с) дісліпідемією, (г) гіпертонією і (е) ожирінням. Використані тут, якщо не вказано інше, терміни "лікувати", "лікування" і т.п., мусять включати керування та догляд за суб'єктом або пацієнтом (переважно - ссавцем, більш переважно людиною) з метою боротьби із захворюванням, станом або розладом, і включають введення сполуки за даним винаходом для попередження початку симптомів або ускладнень, полегшення симптомів або ускладнень, або усунення захворювання, стану або розладу. Використаний тут, якщо не вказано інше, термін "профілактика" мусить включати (а) зниження частоти одного або більше симптомів, (б) зменшення тяжкості одного або більше симптомів, (в) затримку або уникнення розвитку додаткових симптомів і/або (г) затримка або уникнення розвитку розладу або стану. Фахівeць в даній галузі зрозуміє, що там, де даний винахід спрямований на способи профілактики, суб'єкт, що потребує них (тобто суб'єкт, що потребує попередження) мусить включати будь-якого суб'єкта або пацієнта (переважно - ссавця, більш переважно - людину) хто зазнав або у нього наявний щонайменше один симптом розладу, захворювання або стану, що підлягає попередженню. Крім того, суб'єкт, який цього потребує, може додатково бути суб'єктом (переважно - ссавцем, більш переважно - людиною), у якого ще не наявні будь-які симптоми розладу, захворювання або стану, що підлягає попередженню, але який був визнаний лікарем, клініцистом, або іншим медичним фахівцем, що він має ризик розвитку зазначеного розладу, захворювання або стану. Наприклад, суб'єкт може вважатися таким, що має ризик розвитку розладу, захворювання або стану (і, отже, потребує профілактики або профілактичного лікування) як наслідок історії хвороби суб'єкта, включаючи, але не обмежуючись, сімейною історією, схильністю, співіснуючими (супутніми) розладами або станами, генетичним тестуванням, тощо. Термін "суб'єкт", використовуваний тут, відноситься до тварини, переважно - ссавця, найбільш переважно - людини, яка була об'єктом лікування, спостереження або експерименту. Переважно, суб'єкт зазнав і/або у нього наявний щонайменше один симптом захворювання або розладу, що підлягає лікуванню і/або попередженню. Термін "терапевтично ефективна кількість", використаний тут, означає таку кількість активної сполуки або фармацевтичного засобу, яка викликає в тканинній системі, тварині або людині біологічну або медичну відповідь, якої добивається дослідник, ветеринар, лікар або інший клініцист, що включає полегшення симптомів захворювання або розладу, що лікують. Оптимальні дози для введення можуть бути легко визначені фахівцями в даній галузі, і будуть варіювати залежно, наприклад, від способу введення, сили препарату, способу введення а також прогресування стану хвороби. Крім того, фактори, пов'язані з конкретним пацієнтом, якого лікують, включаючи вік пацієнта, вагу, дієту і час введення, призведуть до необхідності коригування дози. Фахівцю в даній галузі буде зрозуміло, що, як in vivo так і in vitro випробування з використанням відповідних, відомих і загальноприйнятних клітинних і/або тваринних моделей прогнозуватимуть здатність тестованої сполуки або спільної терапії до лікування або профілактики даного розладу. Фахівцю в даній галузі також буде зрозуміло, що клінічні випробування на людині, включаючи перше введення людині, випробування діапазону доз та ефективності, у здорових пацієнтів і/або тих, хто страждає від даного розладу, можуть бути виконані у відповідності зі способами, добре відомими в клінічній і медичній галузях. Використаний тут термін "композиція" охоплює продукт, що містить певні інгредієнти в певних кількостях, а також будь-який продукт, який можна одержати, прямо чи опосередковано, з поєднань певних інгредієнтів у певних кількостях. Для забезпечення більш стислого опису деякі кількісні вирази тут представлені у вигляді діапазону, від приблизно кількості X до приблизно кількості Y. Слід розуміти, що там, де вказаний діапазон, діапазон не обмежується вказаними верхньою і нижньою межами, а включає 6 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 весь спектр від приблизно кількості X через приблизно кількості Y, або будь-яке значення чи діапазон в ньому. Для забезпечення більш стислого опису деякі кількісні вирази, наведені тут, не означені терміном "приблизно". Зрозуміло, що незважаючи на те, явним чином вжитий термін "приблизно", чи ні, мається на увазі, що кожна кількість, наведена в даному описі, відноситься до фактичного заданого значення; також мається на увазі, що вона відноситься до наближення до такого заданого значення, якe можна логічно припустити на основі звичайної кваліфікації в даній галузі, включаючи наближення, обумовлені експериментальними умовами і/або умовами вимірювання для такої заданої величини. Приклади відповідних розчинників, основ, температур реакції та інших реакційних параметрів і компонентів наведені в докладних описах, які слідують нижче. Фахівцю в даній галузі буде зрозуміло, що список із вказаних прикладів не призначений, і не має тлумачитись, як будь-яким чином обмежуючий винахід, викладений у формулі винаходу, яка слідує далі. Фахівцю в даній галузі буде зрозуміло, що там, де стадія реакції за даним винаходом може бути здійснена в різних розчинниках або системах розчинників, вказану стадію реакції можна також проводити в суміші відповідних розчинників або систем розчинників. Коли способи одержання сполук за винаходом дають суміш стереоізомерів, ці ізомери можуть бути розділені звичайними методами, такими як препаративна хроматографія. Сполуки можуть бути одержані в рацемічній формі, або індивідуальні енантіомери можуть бути одержані або шляхом енантіоспецифічного синтезу або шляхом розділення. Сполуки можуть, наприклад, бути розділені на їх компонентні енантіомери за допомогою стандартних методик, таких як утворення діастереомерних пар шляхом утворення солі з оптично активною кислотою, такою як (-)-ді-п-толуол-D-винна кислота і/або (+)-ді-п-толуол-L-винна кислота з подальшою фракційної кристалізацією і регенерацією вільної основи. Сполуки також можуть бути розділені шляхом утворення діастереомерних складних ефірів або амідів з подальшим хроматографічним поділом і видаленням хіральної допоміжної речовини. Альтернативно, сполуки можуть бути розділені з використанням хіральної колонки ВЕРХ. Крім того, хіральна ВЕРХ проти стандарту може бути використана для визначення відсотка енантіомерного надлишку (%ен). Енантіомерний надлишок може бути розрахований наступним чином: [(Rmoles-Smoles)/(Rmoles+Smoles)]х100 %, де Rmoles і Smoles є R і S молярними фракціями в суміші, так що Rmoles+Smoles=1. Енантіомерний надлишок може бути альтернативно розрахований за питомим обертанням бажаного енантіомеру і виготовленої суміші наступним чином: Даний винахід спрямований на співкристал L-проліну із сполукою формули (1-X), переважно кристалічний співкристал L-проліну із сполукою формули (1-X). Даний винахід також спрямований на співкристал лимонної кислоти із сполукою формули (1-X), переважно кристалічний співкристал лимонної кислоти із сполукою формули (1-X). Одержання кристалічних співкристалів L-проліну і лимонної кислоти: Співкристали L-проліну та лимонної кислоти із сполукою формули (1-X) були виготовлені як частина скринінгу співкристалів. Стисло, приблизно 15 мг сполуки формули (1-X) додавали в кожну лунку в 48-лунковому змелювальному блоці разом з приблизно 1 молярним еквівалентом співкристалу-затравки (L-пролін або лимонна кислота, відповідно) і 10 мкл розчинника (обраного з ацетону, етанолу, ізопропілового ефіру оцтової кислоти, толуолу, води). Шість (6) окремих експериментів були проведені для кожного співкристалу-затравки (5 розчинників та 1 суха лунка). Лунки були піддані 10 хвилинному помелу на барабанному кульовому млині, за яким послідував негайний аналіз ПРД. Кристалічний співкристал L-проліну із сполукою формули (1-X) додатково одержують шляхом суспендування сполуки формули (1-X) (~1 г) і L-проліну в ацетоні при стехіометрії 1:1. Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) додатково отримують термічною кристалізацією сполуки формули (1-X) (~1 г) і лимонної кислоти в ізопропілацетаті при стехіометрії 1:1. Фізична та хімічна стабільність співкристалів L-проліну і лимонної кислоти: Кристалічний співкристал L-проліну із сполукою формули (1-X) тестували на фізичну стабільність при зберіганні приблизно 10 мг співкристалу в 10 мл сироваткових обтискових флаконах, за таких умов: (а) від 5 °C, герметичний (б) 25 °C/60 % відносної вологості (ВВ), відкритий, (в) 40 °C, герметичний, (г) 40 °C/75 % ВВ, відкритий; (е) 60 °C, герметичний; та (е) 80 °C, герметичний; дані зі стабільності збирали у 1 день, 1 тиждень, 2 тижні і 4 тижні. Було 7 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 60 встановлено, що кристалічний співкристал L-проліну із сполукою формули (1-X) фізично стабільний до 4 тижнів за всіх цих умов, без видимих змін кольору. Зразки кристалічного співкристалу L-проліну із сполукою формули (1-X), досліджувані на фізичну стабільність, відібрані у 1 день, 1 тиждень, 2 тижні і 4 тижні, були додатково протестовані на хімічну стійкість/деградацію. Кристалічний співкристал L-проліну із сполукою формули (1-X) (~10 мг) розбавляли розчином 50:50 вода:ацетонітрил (10 мл), а потім додатково розбавляли в 10 разів для вимірювань ВЕРХ. У 1 день, 1 тиждень, 2 тижні і 4 тижні, все зразки кристалічного співкристалу L-проліну ввижалися хімічно стабільними. Піки деградації не спостерігалися і виміряні % зони залишалися незмінними в кожній часовій точці. Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) був аналогічним чином перевірений на фізичну стабільність при зберіганні приблизно 10 мг співкристалу в 10 мл сироваткових обтискових флаконах, за таких умов: (а) від 5 °C, герметичний, (б) 25 °C/60 % ВВ, відкритий, (в) 40 °C, герметичний, (г) 40 °C/75 % ВВ, відкритий; (е) 60 °C, герметичний, і (е) 80 °C, герметичний; дані зі стабільності збирали у 1 день, 1 тиждень, 2 тижні і 4 тижні. Було встановлено, що кристалічний співкристал лимонної кислоти із сполукою формули (1-X) фізично стабільний до 4 тижнів при цих умовах, хоча невелика кількість деградації (99 %. Кілька невеликих піків деградації спостерігалися також у 1 тиждень, 2 тиждень і 4 тиждень у зразках, що зберігалися при температурі 40 °C/75 %ВВ, відкритими і 80 °C, герметичними, хоча пікова чистота для цих зразків також залишилась >99 %. ПРД, ДСК, ТГА і ДСП виміри: Кристалічний співкристал L-проліну із сполукою формули (1-X) і кристалічний співкристал лимонної кислоти з сполукою формули (1-X) були додатково охарактеризовані за допомогою порошкової рентгенівської дифракції (ПРД), динамічної скануючої калориметрії (ДСК), термогравіметричного аналізу (ТГА) і динамічної сорбції/десорбції пари (ДСП). ДРП: порошкові рентгенівські дифракційні картини були отримані з використанням рентгенівського дифрактометру Bruker AXS D8 Discover, оснащеного GADDS™ (система виявлення дифракції загальнoї площі), Bruker AXS HI-STAR Area Detector на відстані 15,05 см як для калібрування системи, джерело міді (Cu/K 1.54056A), автоматизована сцена x-y-z, і 0,5 мм коліматор. Зразок пресували у формі гранул і встановлювали на x-y-z сцені. Дифрактограму отримували в умовах навколишнього середовища при установці потужності на 40 кВ і 40 мА в режимі відображення, в той час як зразок залишався нерухомим. Час експозиції становив приблизно 1 хвилину для кожного зразка. Отримана дифрактограма пройшла процедуру просторового перепризначення для врахування геометричного подушкоподібного спотворення детектора площі, потім була інтегрована уздовж хі від -118,8 до -61,8 градусів і 2-θ 2.1-37 градусів при розмірі кроку 0,02 градуса з нормалізацією в режимі "bin normalize". На додаток до використання програмного забезпечення Jade, дифракційні картини, отримані на машині Bruker, були переглянуті за допомогою програмного забезпечення EVA. ДСК: аліквоту зразка зважували в алюмінієвому герметичному піддоні для зразка. Піддон для зразка був завантажений до приладу (Q1000 диференційного скануючого калориметру, TA Instruments), який був обладнаний автоматичним пробовідбірником. Термограмма була отримана шляхом окремого нагрівання зразка зі швидкістю 10 °C/хв від Tmin (як правило, при кімнатній температурі) до Т max (зазвичай 300 °C), використовуючи порожній алюмінієвий герметичний піддон для порівняння. Як газ для продування зразка був використаний сухий азот, швидкість потоку якого було встановленo 50 мл/хв. Теплові переходи були переглянуті і проаналізовані за допомогою аналітичного програмного забезпечення, постаченого з приладом. ТГА: аліквоту зразка переносили в платиновий піддон для зразка. Піддон був поміщений на вантажну платформу і потім автоматично завантажений до приладу (Q500 термогравіметричного аналізатору, TA Instruments) з використанням управляючого програмного забезпечення. Термограмми були отримані шляхом окремого нагрівання зразка при 10 °C/хв від 8 UA 111199 C2 5 10 15 20 Tmin (як правило, при кімнатній температурі) до Тмах (зазвичай 300 °C) в струмі сухого азоту, при швидкості потоку продування зразка 60 мл/хв та швидкості потоку продування противаги 40 мл/хв. Теплові переходи (наприклад, зміни ваги) були переглянуті і проаналізовані за допомогою аналітичного програмного забезпечення, постаченого з приладом. ДСП: сорбцію вологи характеризували на DVS-1 Instrument (Surface Measurement Systems, Allentown, PA).У кожному випадку зразок піддавали кривій сушіння від навколишньої до 0 % відносної вологості (ВВ), з подальшим проведенням двох циклів сорбції (від 0 % ВВ до 90 % ВВ) і десорбції (від 90 % ВВ до 0 % відносної вологості) з кроком у 10 % ВВ при 25 °C. На кожному кроці зразку давали врівноважитись при певному % відносної вологості і, таким чином, стабілізуватись за набутою або втраченою вагою до переходу приладу до наступного кроку в рамках методу. Властивості кристалічного співкристалу L-проліну: Кристалічний співкристал L-проліну із сполукою формули (1-X) було охарактеризовано картиною порошкової рентгенівської дифракції (ПРД); порівнянням картини співкристалу з картинами ПРД компонентів співкристалу, зокрема ПРД сполуки формули (1-X) і ПРД L-проліну. Фігура 1, вказана нижче, показує типові виміряні картини ПРД для L-проліну (угорі), сполуки формули (1-X) (внизу) і кристалічного співкристалу L-проліну із сполукою формули (1-X) (всередині). В одному з втілень кристалічний співкристал L-проліну із сполукою формули (1-X) може бути охарактеризований його картиною порошкової рентгенівської дифракції, що містить піки, перераховані в таблиці 1, нижче. Таблиця 1 Кристалічний співкристал L-проліну зі сполукою формули (1-X) № 1 2 3 4 5 6 7 8 9 10 11 12 25 30 35 40 Позиція [°2θ] 3,76 9,52 10,99 16,99 17,84 18,63 19,93 20,88 21,96 23,42 25,92 26,77 d-відстань [Å] 23,50 9,29 8,05 5,22 4,97 4,76 4,46 4,25 4,05 3,80 3,44 3,33 Відносна інтенсивність [%] 92 49 22 24 100 92 26 20 44 43 23 30 Переважно, кристалічний співкристал L-проліну зі сполукою формули (1-X) характеризується його картиною ПРД, яка включає піки, що мають відносну інтенсивність, яка перевищує або дорівнює приблизно 25 %, переважно, що мають відносну інтенсивність, яка перевищує або дорівнює приблизно 40 %. В іншому втіленні даного винаходу, кристалічний співкристал L-проліну із сполукою формули (1-X) може бути охарактеризований такими піками ПРД°2θ: 3,74, 9,50, 10,98, 17,78, 18,62, 21,94, 23,43 і 26,82; як показано у ПРД спектрі з виміряними піками, ілюстрованому Фігурою 2. Кристалічний співкристал L-проліну із сполукою формули (1-X) було далі охарактеризовано з використанням диференційної скануючої калориметрії (ДСК), вимір від 25 °C до 300 °C зі швидкістю 10 °C/хв і виявлено, що він демонструє різку температуру плавлення при 188 °C, з плечем при 180 °C. Кристалічний співкристал L-проліну із сполукою формули (1-X) було далі охарактеризовано за допомогою термогравіметричного аналізу (ТГА), вимір від 25 °C до 300 °C зі швидкістю 10 °C/хв і виявлено втрату ваги у 1 % до 180 °C (вважається, що через втрату залишкового розчинника), з подальшою втратою ваги ще 25 % до 280 °C, що відповідає втраті 1 молярного еквіваленту L-проліну. Кристалічний співкристал L-проліну із сполукою формули (1-X) було далі охарактеризовано за допомогою динамічної сорбції пари (ДСП), вимір від 0 % ВВ до 90 % ВВ (2 повних цикли) при 25 °C. Було встановлено, що кристалічний співкристал L-проліну із сполукою формули (1-X) є 9 UA 111199 C2 5 10 15 гігроскопічним, хоча збільшення ваги не спостерігалося, поки % ВВ не досягнув 40 %. Між 40 % ВВ і 90 % ВВ, співкристал набрав 12 % маси, втраченої (з деяким гістерезисом) під час десорбційної частини вимірювального циклу. ПРД, отримана після проведення ДСП (виділено при 0 % ВВ) показала, що у цьому зразку не спостерігалося жодного незворотного перетворення форми. Властивості кристалічного співкристалу лимонної кислоти: Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) було охарактеризовано картиною порошкової рентгенівської дифракції (ПРД); порівнянням картини співкристалу з картинами ПРД компонентів співкристалу, зокрема, ПРД сполуки формули (1-X) і ПРД лимонної кислоти. Фігура 3, яку показано нижче, ілюструє типові виміряні картини ПРД для лимонної кислоти (угорі), сполуки формули (1-X) (внизу) і кристалічного співкристалу лимонної кислоти із сполукою формули (1-X) (всередині). В одному втіленні кристалічний співкристал лимонної кислоти із сполукою формули (1-X) може бути охарактеризований його картиною порошкової рентгенівської дифракції, що містить піки, перераховані в таблиці 2 нижче. Таблиця 2 Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) № 1 2 3 4 5 6 7 8 9 10 11 12 13 20 25 30 35 40 Позиція [°2θ] 4,23 9,15 12,40 14,72 16,51 17,68 18,94 19,70 20,65 22,36 23,09 23,63 25,65 d- відстань [Å] 20,88 9,67 7,14 6,02 5,37 5,02 4,69 4,51 4,31 3,97 3,85 3,76 3,47 Відносна інтенсивність [%] 100 7 5 4 24 8 8 43 7 6 8 10 9 Переважно, кристалічний співкристал лимонної кислоти із сполукою формули (1-X) характеризується його картиною ПРД, яка включає піки, що мають відносну інтенсивність, яка перевищує або дорівнює приблизно 5 %, більш переважно, що мають відносну інтенсивність, яка перевищує або дорівнює приблизно 10 %. В іншому втіленні даного винаходу, кристалічний співкристал лимонної кислоти із сполукою формули (1-X) може бути охарактеризований такими піками ПРД°2θ: приблизно 4,2, 9,16, 12,39, 16,54, 17,69, 19,70, 23,63 і 25,66; як показано у ПРД спектрі з виміряними піками, ілюстрованому Фігурою 4. Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) було далі охарактеризовано з використанням диференційної скануючої калориметрії (ДСК), вимір від 25 °C до 300 °C зі швидкістю 10 °C/хв і виявлено, що він демонструє одну чітку точку плавлення при 156 °C. Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) було далі охарактеризовано за допомогою термогравіметричного аналізу (ТГА), вимір від 25 °C до 300 °C зі швидкістю 10 °C/хв і виявлено, що він демонструє незначну втрату ваги 0,38 % до 155 °C. Ця втрата ваги, як вважають, відбувається через втрату залишкового розчинника і не є показником наявності гідратованої форми. Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) було далі охарактеризовано за допомогою динамічної сорбції пари (ДСП), вимір від 0 % ВВ до 90 % ВВ (2 повних цикли) при 25 °C. Було встановлено, що кристалічний співкристал лимонної кислоти із сполукою формули (1-X) не є гігроскопічним, з поступовим збільшенням у 0,5 % маси, що спостерігали від 0 %-80 % ВВ, яку масу було знов втрачено на десорбції. ПРД, отримана після 10 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 60 проведення ДСП (виділено при 0 % ВВ) показала, що в цьому зразку не спостерігалося жодної з форм перетворення. Даний винахід також включає фармацевтичні композиції, що містять будь-який з кристалічних співкристалів сполуки формули (1-X), як описано тут, з фармацевтично прийнятним носієм. Фармацевтичні композиції, що містять одну або декілька сполук описаного тут винаходу як активний інгредієнт, можуть бути отримані шляхом ретельного змішування сполуки або сполук з фармацевтичним носієм відповідно до звичайних фармацевтичних методик змішування. Носій може приймати широке розмаїття форм залежно від бажаного способу введення (наприклад, перорального, парентерального). Таким чином, для рідких пероральних препаратів, таких як суспензії, еліксири і розчини, відповідні носії та добавки включають воду, гліколі, олії, спирти, ароматизатори, консерванти, стабілізатори, барвники тощо; для твердих пероральних препаратів, таких як порошки, капсули і таблетки, відповідні носії та добавки включають крохмалі, цукри, розріджувачі, гранулюючі агенти, змащувальні речовини, зв'язувальні речовини, розпушувачі тощо. Тверді пероральні препарати також можуть бути покриті речовинами, такими, як цукри, або бути покриті ентеросолюбильною оболонкою з тим, щоб керувати основним місцем всмоктування. Для парентерального введення носій зазвичай складається з стерильної води та інші інгредієнти можуть бути додані для збільшення розчинності або схоронності. Ін'єкційні суспензії або розчини також можуть бути виготовлені з використанням водних носіїв з відповідними добавками. Для виготовлення фармацевтичних композицій цього винаходу, одну або кілька сполук даного винаходу як активний інгредієнт ретельно змішують з фармацевтичним носієм відповідно до звичайних фармацевтичних методик змішування, де носій може приймати широке розмаїття форм, залежно від форми препарату, бажаної для введення, наприклад, пероральної або парентеральної, такої як внутрішньом'язова. При виготовленні композицій в пероральній лікарській формі, може бути використане будь-яке із звичайних фармацевтичних середовищ. Таким чином, для рідких пероральних препаратів, таких як, наприклад, суспензії, еліксири і розчини, відповідні носії та добавки включають воду, гліколі, олії, спирти, ароматизатори, консерванти, барвники тощо; для твердих пероральних препаратів, таких як, наприклад, порошки, капсули, таблетки у формі капсули, гелеві капсули і таблетки, відповідні носії та добавки включають крохмалі, цукри, розріджувачі, гранулюючі агенти, змащувальні речовини, зв'язувальні речовини, розпушувачі тощо. Внаслідок легкості їх введення таблетки і капсули являють собою найбільш вигідну пероральну дозовану одиничну форму, в цьому випадку, очевидно, використовують тверді фармацевтичні носії. За бажання, таблетки можуть бути покриті цукром або ентеросолюбильною оболонкою за допомогою стандартних методик. Для парентерального введення носій звичайно включає стерильну воду, хоча можуть бути включені інші інгредієнти, наприклад, для таких цілей, як сприяння розчиненню або для консервації. Можуть бути також виготовлені суспензії для ін'єкцій, в яких можуть бути використані відповідні рідкі носії, суспендуючі агенти тощо. Фармацевтичні композиції за винаходом будуть містити, на одиницю дози, наприклад, таблетку, капсулу, порошок, ін'єкцію, чайну ложку тощо, кількість активного інгредієнта, необхідну для доставки ефективної дози, як описано вище. Фармацевтичні композиції за винаходом будуть містити, на одиницю дози, наприклад, таблетку, капсулу, порошок, ін'єкцію, супозиторію, чайну ложку тощо, від приблизно 0,1 до приблизно 1000 мг або будь-яку кількість або діапазон в цих межах, і можуть бути надані в дозуванні від приблизно 0,01 до приблизно 500 мг/кг/день, або в будь-якій кількості або діапазоні в цих межах, переважно від приблизно 0,5 до приблизно 100 мг/кг/день, або в будь-якій кількості або діапазоні в цих межах. Дозування, однак, можна варіювати залежно від потреби пацієнтів, тяжкості стану, що підлягає лікуванню, і використаної сполуки. Може бути використане або щоденне введення або пост-періодичне дозування. Переважно ці композиції існують у вигляді одиничних дозованих форм, таких як таблетки, пігулки, капсули, порошки, гранули, стерильні парентеральні розчини або суспензії, дозовані аерозолі або рідкі спреї, краплі, ампули, автоінжекторні пристрої або супозиторії; для перорального, парентерального, інтраназального, сублінгвального або ректального введення або для введення шляхом інгаляції або инсуфляции. Крім того, композиція може бути представлена у формі, придатній для введення один раз на тиждень або один раз на місяць; наприклад, нерозчинна сіль активної сполуки, така, як деканоат, може бути адаптована для забезпечення депо-препарату для внутрішньом'язової ін'єкції. Для виготовлення твердих композицій, таких як таблетки, основний активний інгредієнт змішують з фармацевтичним носієм, наприклад звичайними таблетуючими інгредієнтами, такими як кукурудзяний крохмаль, лактоза, сахароза, сорбіт, тальк, стеаринова кислота, стеарат магнію, дикальцій фосфат або 11 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 60 смоли, та з іншими фармацевтичними розріджувачами, наприклад, водою, з утворенням твердої попередньої композиції, що містить гомогенну суміш сполуки даного винаходу або її фармацевтично прийнятну сіль. При згадуванні цих попередніх композицій як гомогенних, мається на увазі, що активний інгредієнт рівномірно диспергований по всій композиції, так що композицію можна легко розділити на однаково ефективні дозовані форми, такі як таблетки, пігулки та капсули. Цю тверду попередню композицію потім поділяють на одиничні дозовані форми описаного вище типу, що містять від 0,01 до приблизно 1000 мг, або будь-яку кількість або діапазон в цих межах, активного інгредієнта за цим винаходом. Таблетки або пігулки нової композиції можуть бути покриті або ускладнені іншим чином для забезпечення дозованої форми, що надає перевагу пролонгованої дії. Наприклад, таблетка або пігулка може містити внутрішній дозований і зовнішній дозований компонент, причому останній існує у вигляді оболонки на першому. Два компоненти можуть бути розділені ентеросолюбильним шаром, який служить, щоб чинити опір руйнуванню в шлунку і дозволяє внутрішньому компоненту проходити неушкодженим в дванадцятипалу кишку або бути сповільненим при вивільненні. Для таких ентеросолюбільних шарів або покриттів можуть бути використані різноманітні матеріали, такі матеріали включають багато полімерних кислот з такими матеріалами, як шелак, цетиловий спирт і ацетат целюлози. Рідкі форми, в яких нові композиції даного винаходу можуть бути включені для введення перорально або шляхом ін'єкції, включають водні розчини, відповідним чином ароматизовані сиропи, водні або олійні суспензії і ароматизовані емульсії з харчовими оліями, такими як бавовняна олія, кунжутна олія, кокосова олія, або арахісова олія, а також еліксири і подібні фармацевтичні носії. Відповідні диспергуючі або суспендуючі агенти для водних суспензій включають синтетичні і природні камеді, такі як трагакант, аравійська камедь, альгінат, декстран, натрій карбоксиметилцелюлоза, метилцелюлоза, полівінілпіролідон або желатин. Спосіб лікування розладів, пов'язаних з глюкозою, описаний в даному винаході, може бути також здійснений з використанням фармацевтичної композиції, що містить будь-яку з сполук, визначених в даному винаході, і фармацевтично прийнятний носій. Фармацевтична композиція може містити між приблизно 0,01 мг до приблизно 1000 мг сполуки, або будь-яку кількість або діапазон в цих межах; переважно приблизно 0,1 мг до приблизно 500 мг сполуки, і може являти собою будь-яку форму, придатну для вибраного способу введення. Носії включають необхідні та інертні фармацевтичні ексципієнти, включаючи, але не обмежуючись ними, сполучні речовини, суспендуючі агенти, змащувальні речовини, ароматизатори, підсолоджувачі, консерванти, барвники та покриття. Композиції, придатні для перорального введення, включають тверді форми, такі як пігулки, таблетки, таблетки у формі капсули, капсули (у кожному випадку включаючи форму негайного вивільнення, спланованого за часом вивільнення і уповільненого вивільнення), гранули та порошки, і рідкі форми, такі як розчини, сиропи, еліксири, емульсії, і суспензії. Форми, придатні для парентерального введення, включають стерильні розчини, емульсії і суспензії. Переважно, сполуки даного винаходу можуть бути введені у вигляді разової добової дози, або повна денна доза може бути введена у вигляді розділених доз на два, три або чотири рази на день. Крім того, сполуки даного винаходу можуть вводитися в інтраназальній формі за допомогою місцевого застосування відповідних інтраназальних носіїв або через трансдермальні шкірні пластирі, добре відомі фахівцям у цій галузі. При введенні у формі трансдермальної системи доставки, введення доз буде, звичайно, безперервним, а не переривчастим, протягом всього режиму дозування. Наприклад, для перорального введення у вигляді таблетки або капсули активний компонент ліків може бути об'єднаний з пероральним, нетоксичним фармацевтично прийнятним інертним носієм, таким як етанол, гліцерин, вода тощо. Більше того, коли бажано або необхідно, відповідні зв'язувальні речовини, змащувальні речовини, розпушувачі і барвники також можуть бути включені в суміш. Відповідні зв'язувальні речовини включають, без обмеження, крохмаль, желатин, природні цукри, такі як глюкоза або бета-лактоза, кукурудзяні підсолоджувачі, природні та синтетичні камеді, такі як аравійська камедь, трагакант або олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію тощо. Розпушувачі включають, без обмеження, крохмаль, метилцеллюлозу, агар, бентоніт, ксантанову камедь тощо. Рідкі форми можна відповідним чином ароматизовувати і вводити суспендуючі або диспергуючі агенти, такі як синтетичні і природні камеді, наприклад, трагакант, гуміарабік, метилцелюлоза тощо. Для парентерального введення бажані стерильні суспензії і розчини. Ізотонічні препарати, які зазвичай містять відповідні консерванти, використовуються, коли бажано внутрішньовенне введення. 12 UA 111199 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для виготовлення фармацевтичної композиції даного винаходу, сполуку формули (I) як активний інгредієнт ретельно змішують з фармацевтичним носієм відповідно до звичайних фармацевтичних методів змішування, де носій може приймати широке розмаїття форм залежно від форми препарату, бажаної для введення (наприклад, пероральної або парентеральної). Відповідні фармацевтично прийнятні носії добре відомі в даній галузі. Описи деяких з цих фармацевтично прийнятних носіїв можуть бути знайдені в The Handbook of Pharmaceutical Excipients, published by the American Pharmaceutical Association and the Pharmaceutical Society of Great Britain. Способи отримання фармацевтичних композицій були описані в численних публікаціях, таких як Pharmaceutical Dosage Forms: Tablets. Second Edition. Revised and Expanded. Volumes 1-3, edited by Lieberman et al; Pharmaceutical Dosage Forms: Parenteral Medications. Volumes 1-2, edited by Avis et al; and Pharmaceutical Dosage Forms: Disperse Systems, Volumes 1-2, edited by Lieberman et al; published by Marcel Dekker, Inc. Кристалічні співкристали сполуки формули (1-X) даного винаходу можуть бути введені в будь-якій із зазначених вище композицій і у відповідності до режимів дозування, встановлених в даній галузі, коли потрібне лікування розладів, пов'язаних з глюкозою. Добова доза продуктів може варіювати в широкому діапазоні від приблизно 0,01 до приблизно 1000 мг на дорослу людину на день, або в будь-якій кількості або діапазоні в цих межах. Для перорального введення композиції переважно представлені у формі таблеток, що містять 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5.0, 10.0, 15.0, 25,0, 50,0, 100, 150, 200, 250 і 500 міліграм активного інгредієнта для симптоматичного підбору дози для пацієнта, що підлягає лікуванню. Переважно, кристалічний співкристал сполуки формули (1-X) вводять в дозуванні від приблизно 0,01 мг/кг до приблизно 500 мг/кг маси тіла на день, або 0,01 мг/кг до приблизно 200 мг/кг маси тіла на день, або в будь-якій кількості або діапазоні в цих межах. Переважно, діапазон становить від приблизно 0,01 до приблизно 50 мг/кг маси тіла на день, або будь-яку кількість або діапазон в цих межах, більш переважно, приблизно від 0,05 мг/кг до приблизно 10 мг/кг, або будь-яку кількість або діапазон в цих межах, більш переважно, від приблизно 1 до приблизно 5 мг/кг маси тіла на день, або будь-яку кількість або діапазон в цих межах. В одному втіленні ефективну кількість кристалічного співкристалу сполуки формули (1-X) постачають в дозуванні 10 мг, 25 мг, 50 мг, 100 мг, 150 мг або 300 мг або в будь-якій кількості або діапазоні в цих межах. Кристалічні со-кристали сполуки формули (1-X) можуть бути введені в режимі від 1 до 4 разів на день. Оптимальні дозування для введення можуть бути легко визначені фахівцями в даній галузі, і будуть варіювати залежно від конкретної використаної сполуки, способу введення, від сили препарату, способу введення, і прогресування стану захворювання. Крім того, фактори, пов'язані з конкретним пацієнтом, якого лікують, в тому числі вік пацієнта, вага, дієта і час введення, призведуть до необхідності коригування дозування. Фахівцю в даній галузі буде зрозуміло, що, випробування як in vivo так і in vitro з використанням відповідних, відомих і загальноприйнятних клітинних і/або тваринних моделей будуть прогнозувати здатність тестованої сполуки до лікування або профілактики даного розладу. Фахівцю в даній галузі також буде зрозуміло, що клінічні випробування на людині, включаючи перше введення людині, випробування діапазону доз та ефективності, у здорових пацієнтів і/або тих, хто страждає від даного розладу, можуть бути виконані у відповідності зі способами, добре відомими в клінічній і медичній галузях. Наступні приклади викладені для допомоги в розумінні винаходу, і не призначені і їх не слід тлумачити як такі, що будь-яким чином обмежують винахід, викладений у формулі винаходу, яка слідує нижче. Приклад 1 Кристалічний співкристал L-проліну сполуки формули (1-X) Сполуку формули (1-X) (100 мг) додавали до Wig-L-Bug флакону разом з L-проліном (26,30 мг) (1:1,1 молярне співвідношення API:CCF), розмелювальною кулею і ацетоном (20 мкл). WigL-Bug піддавали помелу протягом 10 хвилин. За допомогою ПРД було підтверджено, що зібрана після після помелу тверда речовина є очікуваним кристалічним співкристалом L-проліну із сполукою формули (1-X). Приклад 2 Кристалічний співкристал L-проліну із сполукою формули (1-X) Сполуку формули (1-X) (50,18 мг) додавали до 4 мл конічної пробірки разом з L-проліном (13,15 мг) (1:1,1 молярне співвідношення API:CCF), після чого додавали ацетон (2 мл). Закриту ковпачком пробірку коротко нагрівали за допомогою теплового пістолету. Білий твердий 13 UA 111199 C2 5 10 15 20 25 30 35 матеріал швидко осаджувався з розчину; його було зібрано і підтверджено за допомогою ПРД, що це - очікуваний кристалічний співкристал L-проліну із сполукою формули (1-X). Приклад 3 Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) Сполуку формули (1-X) (100 мг) додавали до Wig-L-Bug флакону разом з лимонною кислотою (43,83 мг) (1:1,1 молярне співвідношення API:CCF), розмелювальною кулею і ізопропілацетатом (20 мкл). Wig-L-Bug піддавали помелу протягом 10 хвилин. За допомогою ПРД було підтверджено, що зібрана після після помелу тверда речовина є очікуваним кристалічним співкристалом лимонної кислоти із сполукою формули (1-X). Приклад 4 Кристалічний співкристал лимонної кислоти із сполукою формули (1-X) Сполуку формули (1-X) (50,72 мг) додавали до 4 мл конічної пробірки разом з лимонною кислотою (21,83 мг) (1:1,1 молярне співвідношення API:CCF), потім додавали ізопропілацетат (1 мл). Закриту ковпачком пробірку нагрівали з теплового пістолету до повного розчинення твердих речовин. Через те, що при охолодженні не спостерігалося жодної кристалізації, ковпачок було відкрито, і розчиннику дали повільно випаровуватися. Після 2 днів (після приблизно 20 %-вого зниження розчиннику) в насичений розчин було додано затравки бажаної речовини і протягом декількох годин випав осад білої твердої кристалічної речовини. За допомогою ПРД було підтверджено, що виділена речовина - це очікуваний кристалічний співкристал лимонної кислоти із сполукою формули (1-X). Приклад 5 Тверда, пероральна дозова форма - можливий приклад Як конкретне втілення пероральної композиції, 100 мг кристалічного співкристалу L-проліну із сполукою формули (1-X), виготовленого, як описано за винаходом, змішують з достатньо тонко розмеленою лактозою, щоб забезпечити загальну кількість від 580 до 590 мг для заповнення жорсткої гелевої капсули розміру 0. Приклад 6 Тверда пероральна дозувальна форма - можливий приклад Як конкретне втілення пероральної композиції, 100 мг кристалічного співкристалу лимонної кислоти із сполукою формули (1-X), виготовленого, як описано за винаходом, змішують з достатньо тонко розмеленою лактозою, щоб забезпечити загальну кількість від 580 до 590 мг для заповнення жорсткої гелевої капсули розміру 0. Хоча попередній опис розкриває принципи даного винаходу, з прикладами, наведеними з метою ілюстрації, слід розуміти, що здійснення винаходу охоплює всі звичайні різновиди, пристосування і/або видозміни, які потрапляють в обсяг пунктів наступної формули винаходу та їх еквівалентів. ФОРМУЛА ВИНАХОДУ 40 1. Співкристал L-проліну і сполуки формули (I-Х) CH3 S F OH O HO OH OH 45 , (I-X) який характеризується піками в порошковій рентгенодифрактограмі при наступних значеннях кута, °2: 3,74, 9,50, 10,98, 17,78, 18,62, 21,94, 23,43 і 26,82. 2. Співкристал за п. 1, точка плавлення якого дорівнює 188 °C, за результатами вимірювання методом ДСК. 3. Співкристал лимонної кислоти і сполуки формули (I-Х) 14 UA 111199 C2 CH3 S F OH O HO OH OH 5 , (I-X) який характеризується піками в порошковій рентгенодифрактограмі при наступних значеннях кута, °2: 4,2, 9,16, 12,39, 16,54, 17,69, 19,70, 23,63 і 25,66. 4. Співкристал за п. 3, точка плавлення якого дорівнює приблизно 156 °C за результатами вимірювання методом ДСК. 15 UA 111199 C2 16 UA 111199 C2 17 UA 111199 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 18
ДивитисяДодаткова інформація
Назва патенту англійськоюL-proline and citric acid co-crystals of (2s, 3r, 4r, 5s, 6r )- 2- (3- ((5- (4-fluorophenyl)thiophen-2-yl)methyl)-4-methylphenyl)-6- (hydroxymethyl)tetrahydro-2h-pyran-3,4,5-triol
Автори англійськоюNguyen, Minh, Collier, Edwin, A.
Назва патенту російськоюСокристаллы l-пролина и лимонной кислоты с (2s,3r,4r,5s,6r)-2-(3-((5-( 4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(гидроксиметил)тетрагидро-2н-пиран-3,4,5-триолом
Автори російськоюНгуйен Минх, Коллиер Эдвин А.
МПК / Мітки
МПК: C07D 409/10, C07H 7/00, A61K 31/70, C07H 7/04
Мітки: l-проліну, 2s,3r,4r,5s,6r)-2-(3-((5-(4-фторфеніл)тіофен-2-іл)метил)-4-метилфеніл)-6-(гідроксиметил)тетрагідро-2н-піран-3,4,5-тріолом, співкристали, лимонної, кислоти
Код посилання
<a href="https://ua.patents.su/20-111199-spivkristali-l-prolinu-i-limonno-kisloti-z-2s3r4r5s6r-2-3-5-4-ftorfeniltiofen-2-ilmetil-4-metilfenil-6-gidroksimetiltetragidro-2n-piran-345-triolom.html" target="_blank" rel="follow" title="База патентів України">Співкристали l-проліну і лимонної кислоти з (2s,3r,4r,5s,6r)-2-(3-((5-(4-фторфеніл)тіофен-2-іл)метил)-4-метилфеніл)-6-(гідроксиметил)тетрагідро-2н-піран-3,4,5-тріолом</a>
Попередній патент: Похідні 1-феніл-2-піридинілалкільних спиртів як інгібітори фосфодіестерази
Наступний патент: Спосіб виробництва мартенситної сталі, що має високу міцність, та лист або деталь, одержані за таким способом
Випадковий патент: Спосіб визначення критичної густини струму у надпровідниках