Спосіб виготовлення комбінованого антигіпертензивного препарату у формі таблеток
Формула / Реферат
Спосіб виготовлення комбінованого антигіпертензивного препарату у формі таблеток, що включає змішування компонентів, зволоження суміші, сушіння, калібрування, опудрювання, таблетування та покриття плівкою, який відрізняється тим, що спочатку змішують валсартан, амлодипіну бесилат, 30-60 % мікрокристалічної целюлози від її загальної кількості, 30-40 % кросповідону та 40-60 % крохмалю переджелатинізованого і зволожують суміш попередньо приготованим водно-спиртовим розчином полімерних зволожувачів, вологу масу висушують при температурі робочого повітря 50-80 °C і додають до висушеного грануляту решту мікрокристалічної целюлози, ковзні речовини - тальк або діоксид кремнію колоїдний, або їх суміш, перемішують протягом 10-20 хвилин і наприкінці додають антиадгезивну речовину - магнію стеарат, і знову змішують 2-5 хвилин, одержану суміш пресують у таблетки та покривають їх плівковою оболонкою.
Текст
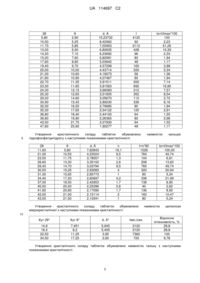
Реферат: Винахід належить до медицини, а саме до кардіології. Винахід стосується способу виготовлення комбінованого антигіпертензивного препарату, у формі таблеток, що містить валсартан та амлодипину бесилат. UA 114697 C2 (12) UA 114697 C2 UA 114697 C2 Винахід належить до медицини, а саме до кардіології, де як антигіпертензивні препарати використовуються тверді лікарські форми, що містять валсартан та інші антигіпертензивні лікарські речовини, зокрема амлодипіну безилат. Валсартан Емпірична формула C24H29N5O3 Молекулярна маса 435,519 N-(1-оксипентил)-N-[2-(1Н-тетразол-5Хімічна назва іл)феніл]фенілметил]-L-валін H N H3 C H3 C O O O 5 NH2 O CH3 O Cl . Це кристалічний порошок білого або майже білого кольору, який добре розчиняється в 96 % спирті і в метанолі, помірно розчиняється в етилацетаті Р, практично не розчиняється у воді. Амлодипіну бесилат Емпіричная формула С20Н25СLN2O5С6Н6O3S Структурна формула CH3 Cl O H3 C O H O O H3 C H N H3 C H3C O N H O O NH2 NH2 O O Cl H O CH3 10 Молекулярна маса: 567,1 15 3-етил-5-метил(4RS)-2-[(2аміноетокси)метил]-4-(2-хлорофеніл)Хімічна назва: 6-метил-1,4-дигідропіридин-3,5дикарбоксилат бензенсульфонат Це порошок білого або майже білого кольору, мало розчинний у воді, легко розчинний у метанолі, помірно розчинний в етанолі, мало розчинний в 2-пропанолі. У пошуках більшої ефективності антигіпертензивних препаратів одним з головних напрямів є заміна двох або більше препаратів, які одночасно застосовуються, в єдину комбінацію, де спосіб виготовлення і дози відповідають за найбільшу ефективність препарату. В клінічній практиці давно використовується одночасне застосування валсартану та блокаторів кальцієвих каналів. 1 UA 114697 C2 5 10 15 20 25 30 35 40 45 50 55 Відомо лікарський препарат, в якому фірмою "Новартіс" для більшої ефективності варсартан використовують у комбінації з блокаторами кальцієвих каналів, зокрема з амлодипіну бесилатом в одній лікарській формі [US 6395728, А61K 331/135, 2001]. Виготовлення такого препарату здійснюють методом сухого компактування. У патенті фірми "LupinLTD" MX 2010007281, А61K 9/20, А61K 31/41, А61K 31/4422, 2010-1005 і в патенті CN101647797, А61K 31/4422, 2010-02-17, запропоновані моношарові таблетки з великими дозами валсартану, в яких біоеквівалентність досягається застосуванням різних складів допоміжних речовин і валсартану та амлодипіну бесилату, які мають необхідні розміри частинок і відповідні технологічні властивості. Такі технології виготовлення потребують спеціального технологічного обладнання та підготовку субстанцій. Перспективнішим є застосування технології вологого гранулювання. У патенті фірми "HETERO" WO2011001440, А61K 31/41, А61K 31/4422, 06.01.2011, запропоновано технологію вологої грануляції таблеток валсартану і комбінованих препаратів, які містять поряд з валсартаном гідрохлортіазид, амлодипіну бесилат. У цій технології запропоновано використання манітолу як наповнювача та грануляцію водним розчином повідону К30. Розчинність валсартану показано за перші 10-20 хвилин тільки при рН 6,8. У матеріалах патенту немає даних про розчинність інших компонентів таблеток, а синхронна розчинність комбінованого препарату є важливим фактором оптимальності технології. Крім того, у запропонованому складі таблеток кількість валсартану становить від 20 до 35 %, тобто потребуються значні кількості допоміжних речовин і значна маса таблетки, що затрудняє їх покриття плівкою та використання. Волога грануляція, як і сухе компактування, викликає труднощі, тому що валсартан має недостатні технологічні властивості: нерозчинність у воді, малу насипну масу, значну аерофільність, дуже малу змочуваність водою. Найближчим до винаходу, що заявляється, є препарат, який містить активні речовини валсартан та амлодипіну бесилат, і допоміжні речовини - целюлозу мікрокристалічну, кросповідон, магнію стеарат, кремнію діоксид колоїдний, гіпромелозу (гідроксипропілметилцелюлозу), титану діоксид (E171), заліза оксид (Е172), макрогол 4000 (поліетиленгліколь 4000), тальк [US 2010303906 А1, А61К 31/4422, А61К 45/06]. Для досягнення більшої біодоступності пропонується виготовлення таблеток з дозами валсартану 80 мг і 160 мг, амлодипіну бесилату 5 мг і 10 мг у вигляді моношарових, а для таблеток з дозою валсартану 320 мг у вигляді двошарових таблеток. Зазначені таблетки виготовляють сухим гранулюванням. Для зазначеного складу препарату, як показують наші експериментальні дані, використання методів вологою грануляцію не дає можливості отримати таблетки з біоеквівалентними характеристиками діючих речовин. Недоліком способу виготовлення препарату є те, що гранулювання таблеток можна здійснити тільки за допомогою дорогого технологічного обладнання для фармацевтичних підприємств, яке виконує вальцювання для компактування порошків. У патенті UA 58573, C07D 209/00, 11.04.2011 визначено кристалічну структуру компонентів таблеток і постульовано вплив деяких ефектів на розчинність лікарської форми. У патентах UA 58574, 11.04.2011, C07D 209/00, і UA 41304 C07D 209/00, 12.05.2009 визначено кристалічну структуру валсартану в монопрепараті, в комбінованому препараті з гідрохлортиазидом. Як видно з цих патентів, валсартан є аморфною речовиною з декількома максимальними значеннями гало, які свідчать, що субстанція складається з декількох фракцій аморфних частинок малих розмірів. Ця структура пояснює запропоновану в патенті DE102008051783 А1, А61K 31/41, 2010, необхідність при сухому гранулюванні використовувати певні значення тиску компактування 25-65 KN і доцільність додавання до утвореного грануляту до 40 % порошку субстанції. Найближчим до винаходу, що заявляється, є кристалічна структура, яка визначена в патенті UА 41304, 12.05.2009, C07D 209/00, де у складі речовин як наповнювач використовується також квазіаморфна речовина - мікрокристалічна целюлоза. Показано, що ці компоненти впливають на форму і структуру дифрактограми, яка має два значних гало, і лише при деяких значеннях 2Ө рентгенівське проміння відображається кристалами гідрохлортіазиду та тальку, що входить до складу допоміжних речовин. З даних, які показані в цьому патенті, відображення для більшості кутів є сумісним для наповнювача, а також при трьох значеннях 2Ө там відображаються випромінювання від тальку. 2 UA 114697 C2 5 10 15 20 25 30 35 40 45 50 В основу винаходу поставлено задачу створення складу комбінованого антигіпертензивного препарату, який би дозволив виготовляти таблетки методом вологої грануляції з біоеквівалентними характеристиками. Друга задача, поставлена в основу винаходу, полягає в створенні способу виготовлення комбінованого антигіпертензивного препарату валсартану з амлодипіном, методом вологої грануляції на різному обладнанні. Третя задача, яка поставлена в основу винаходу, - створення способу прогнозування якості комбінованого антигіпертензивного препарату шляхом визначення його кристалічної структури, що забезпечує необхідні фізико-механічні властивості і розчинення діючих речовин з таблетки, а також прогнозує біоеквівалентність препаратів при виборі допоміжних речовин. Першу поставлену задачу вирішують тим, що комбінований антигіпертензивний препарат у формі таблеток, який включає валсартан, амлодипіну безилат, гідрофільний структуроутворювач - мікрокристалічну целюлозу, розпушувачі, ковзні речовини - тальк, діоксид кремнію колоїдний, антиадгезивну речовину - магнію стеарат, згідно з винаходом, містить полімерні речовин для гранулювання, у наступній кількості компонентів, мас. %: валсартан 35-55 амлодипіну безилат у 1,3-5,5 перерахунку на основу полімерні речовини для 1,5-3 гранулювання мікрокристалічна целюлоза 29-38 розпушувачі 8-15 ковзні речовини 1,7-5,6 магнію стеарат 1-2. Як полімерні речовини можуть бути використані коповідон К30, гідроксипропілцелюлоза, крохмальний клейстер або крохмальний клейстер з натрієм лаурилсульфатом. У комбінації з мікрокристалічною целюлозою може бути використана суміш з гідрофільними наповнювачами - манітолом, лактозою, кальцієм дифосфат дигідратом. Як розпушувачі можуть бути використані кроскармелоза, кросповідон. Другу задачу, поставлену в основу винаходу, вирішують тим, що в способі виготовлення комбінованого антигіпертензивного препарату у формі таблеток, який включає змішування компонентів, зволоження суміші, сушіння, калібрування, опудрювання, таблетування та покриття плівкою, згідно з винаходом, спочатку змішують валсартан, амлодипіну бесилат, 3060 % мікрокристалічної целюлози від її загальної кількості, 30-40 % кросповідону та 40-60 % крохмалю преджелатинізованого, зволожують суміш попередньо приготованим водноспиртовим розчином полімерних зволожувачів, вологу масу висушують при температурі робочого повітря 50-80° і додають до висушеного грануляту решту мікрокристалічної целюлози, ковзні речовини - тальк або діоксид кремнію колоїдний, або їх суміш, перемішують протягом 1020 хвилин і наприкінці додають антиадгезивну речовину - магнію стеарат і знову змішують 2-5 хвилин. Другу задачу, поставлену в основу винаходу, також вирішують тим, що в способі виготовлення комбінованого антигіпертензивного препарату у формі таблеток, який включає змішування компонентів, зволоження суміші, сушіння, калібрування, опудрювання, таблетування та покриття плівкою, згідно з винаходом, спочатку змішують валсартан, амлодипіну бесилат, 30-60 % мікрокристалічної целюлози від її загальної кількості, 35-60 % від загальної кількості натрію кроскармелози, 40-60 % від загальної кількості кремнію діоксиду колоїдного, 40-60 % від загальної кількості тальку і зволожують суміш попередньо приготованим 3 водним розчином полімерних зволожувачів при об'ємі робочого повітря 2000-3800 м /год. і швидкості розпилювання 0,3-0,6 кг/хв., вологу масу висушують при температурі робочого повітря 50-80° і додають до висушеного грануляту решту мікрокристалічної целюлози, ковзні речовини - тальк або діоксид кремнію колоїдний, або їх суміш, перемішують протягом 10-20 хвилин і наприкінці додають антиадгезивну речовину - магнію стеарат і знову змішують 2-5 хвилин. Третю поставлену задачу вирішують тим, що в способі прогнозування якості комбінованого антигіпертензивного препарату у формі таблеток, до якого входять діючі речовини - валсартан, амлодипіну бесилат і допоміжні речовини, шляхом визначення його кристалічної структури методом рентгеноструктурного аналізу при випромінюванні 1,5405 Å, згідно з винаходом, як допоміжні речовини використовують мікрокристалічну целюлозу, кроскармелозу натрію, колоїдний діоксид кремнію, тальк, магнію стеарат, кальцію гідрофосфату дигідрат, 3 UA 114697 C2 гідроксипропилцелюлозу, при цьому одержують наступну кристалічну структуру комбінованого антигіпертензивного препарату. 2θ 9,5 d, Å 9,3 І=n*80 132 І=I/Imax*100 42,9 11,60 5,80 7,6 308 100,00 18,9 9,45 4,70 40 13 20,9 10,45 4,25 200 64,9 21,9 10,95 4,06 52 16,9 22,4 11,2 3,97 44 14,3 23,3 11,65 3,82 52 16,9 25,3 28,6 12,65 14,3 3,52 3,12 116 172 37,7 55,8 29,2 14,6 3,06 240 77,9 30,5 15,25 2,93 100 32,5 31,2 15,6 2,87 24 7,8 34,2 17,1 2,62 76 24,7 35,5 37,0 17,75 18,5 2,53 2,43 20 40 6,5 13 39,7 19,85 2,27 24 7,8 41,5 42,0 20,75 21,0 2,17 2,15 52 44 16,9 14,3 43,0 5 θ 4,75 21,5 2,10 24 7,8 Амлодипіну бесилат Кальцію дифосфат дигідрат Кальцію дифосфат дигідрат, амлодипіну бесилат Кальцію дифосфат дигідрат Кальцію дифосфат дигідрат Кальцію дифосфат дигідрат, амлодипіну бесилат Утворення кристалічного складу таблеток обумовлено наявністю валсартану з наступними показниками кристалічності. 2θ 5,8 14,50 22,60 10 Примітка Валсартан, тальк Кальцію дифосфат дигідрат, амлодипіну бесилат Гало, амлодипіну бесилат Гало, валсартан, кальцію дифосфат дигідрат, амлодипіну бесилат Гало, валсартан, магнію стеарат Гало, валсартан, магнію стеарат Гало, валсартан, магнію стеарат Гало валсартан Тальк Кальцію дифосфат дигідрат, амлодипіну бесилат Кальцію дифосфат дигідрат, амлодипіну бесилат Кальцію дифосфат дигідрат, амлодипіну бесилат Кальцію дифосфат дигідрат, θ 2,90 7,25 11,30 d, Å 15,23732 6,10861 3,93425 І 784 1360 1856 Іо=I/Imax*100 42,24 гало 73,30 гало 100,00 Утворення кристалічного складу таблеток обумовлено наявністю амлодипіну бесилату з наступними показниками кристалічності. 4 UA 114697 C2 2θ 5,80 10,50 11.70 13,00 14,20 15,20 17,60 19,40 20,00 21,20 21,80 22,70 23,30 24,30 25,30 29,20 30,90 32,00 35,30 36,80 39,80 43,50 47,80 5 θ 2,90 5,25 5,85 6,50 7,10 7,60 8,80 9,70 10,00 10,60 10,90 11,35 11,65 12,15 12,65 14,60 15,45 16,00 17,65 18,40 19,90 21,75 23,90 d, Å 15,23732 8,42062 7,55953 6,80635 6,23692 5,82581 5,03642 4,57299 4,43714 4,19073 4,07467 3,91511 3,81563 3,66083 3,51835 3,05670 2,89230 2,79685 2,54122 2,44100 2,26365 2,07930 1,90277 І 4120 92 2112 428 96 80 48 160 220 56 80 200 692 312 352 112 336 80 120 64 80 64 48 Утворення кристалічного складу таблеток обумовлено гідрофосфатдигідрату з наступними показниками кристалічності. 2θ 11,60 21,00 23,50 26,60 29,40 30,50 31,30 34,40 37,00 40,00 41,60 42,00 43,00 θ 5,80 10,50 11,75 13,30 14,70 15,25 15,65 17,20 18,50 20,00 20,80 21,00 21,50 d, Å 7,62843 4,23024 3,78557 3,35102 3,03794 2,93083 2,85773 2,60697 2,42953 2,25396 2,17090 2,15114 2,10341 Іо=I/Imax*100 100 2,23 51,26 10,39 2,33 1,94 1,17 3,88 5,34 1,36 1,94 7,14 16,80 7,57 8,54 2,72 8,16 1,94 2,91 1,55 2,98 1,55 1,17 наявністю І=n*80 1528 760 104 208 760 320 80 336 136 40 136 160 80 n 19,1 9,5 1,3 2,6 9,5 4 1 4,2 1,7 0,6 1,7 2 1 Утворення кристалічного складу таблеток обумовлено мікрокристалічної з наступними показниками кристалічності. кальцію Іо=I/Imax*100 100,00 49,74 6,81 13,62 49,74 20,94 5,24 21,99 8,90 2,62 8,90 10,47 5,24 наявністю целюлози 10 Кут 2θ° Кут θ° d, Å° Іімп./сек. 14,9 16,4 22,50 34,50 7,451 8,2 11,25 17,25 5,945 5,405 3,95 2,60 2120 2120 7360 720 Відносна інтенсивність, % 28,8 28,8 100 9,78 Утворення кристалічного складу таблеток обумовлено наявністю тальку з наступними показниками кристалічності. 5 UA 114697 C2 Тальк 2θ 9,60 19,10 28,70 48,80 θ 4,80 9,55 14,35 24,40 d, Å 9,20794 4,64414 3,10881 1,86515 I 24960 5880 32480 2200 Io=I/Imax*100 76,85 18,10 100,00 6,77 Утворення кристалічного складу таблеток обумовлено наявністю магнію стеарату з наступними показниками кристалічності. № п/п 2θ θ d, Å Іімп./сек. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 5,4 7,2 8,8 13,8 15,0 15,7 19,8 21,8 22,5 23,5 25,2 30,2 31,6 37,0 2,7 3,6 4,4 6,9 7,5 7,85 9,9 10,9 11,25 11,75 12,6 15,1 15,8 18,5 16,37 12,28 10,05 6,42 5,91 5,44 4,48 4,08 3,95 3,78 3,53 2,96 2,83 2,43 880 40 192 40 40 40 96 960 266 224 56 72 24 40 Івідн. %. 92 4,0 20,0 4,0 4,0 4,0 Гало 10,0 Гало 10,0 Гало 28 Гало 23 6 7,5 2,5 4 5 10 Третю поставлену задачу вирішують також тим, що в способі прогнозування якості комбінованого антигіпертензивного препарату у формі таблеток, до якого входять діючі речовини - валсартан, амлодипіну бесилат і допоміжні речовини, шляхом визначення його кристалічної структури методом рентгеноструктурного аналізу при випромінюванні 1,5405 Å, згідно з винаходом, як допоміжні речовини використовують мікрокристалічну целюлозу, манітол, кроскармелозу натрію, колоїдний діоксид кремнію, тальк, магнію стеарат, гідроксипропилцелюлозу, при цьому одержують наступну кристалічну структуру комбінованого антигіпертензивного препарату. 2θ° 5,8 10,4 11,6 12,5 14,6 18,7 θ° 2,9 5,2 5,8 6,25 7,3 9,35 d, Å 15,2 8,51 7,63 7,08 6,07 4,74 Іімп./сек. 200 88 80 64 392 984 І% 18 8 7 6 35 87 19,5 9,75 4,55 328 29 19,9 9,95 4,46 608 54 20,4 10,2 4,35 328 29 21,1 10,55 4,21 680 60 23,4 11,7 3,80 1128 100 25,8 12,9 3,45 112 10 28,3 29,5 31,6 15,15 14,75 15,8 3,15 3,03 2,83 144 328 104 13 29 9 6 Примітка Валсартан, амлодипіну бесилат Амлодипіну бесилат Амлодипіну бесилат Амлодипіну бесилат Гало 1, валсартан, манітол Гало 2, валсартан, манітол Гало 2, Валсартан амлодипіну бесилат Гало 2, Валсартан, манітол, амлодипіну бесилат Гало 2, Валсартан, манітол, амлодипіну бесилат Гало 2, Валсартан, манітол, амлодипіну бесилат, магнію стеарат Гало 2, Валсартан, манітол, амлодипіну бесилат, магнію стеарат Гало 2, Валсартан, манітол, амлодипіну бесилат Манітол, тальк Манітол, амлодипіну бесилат Манітол UA 114697 C2 33,5 38,7 44,0 16,75 19,35 22,0 2,67 2,32 2,06 184 160 160 16 14 14 Манітол Манітол Манітол Утворення кристалічного складу таблеток обумовлено наявністю манітолу з наступними показниками кристалічності № п/п 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 2θ 8,5 10,4 11,4 14,6 16,8 18,7 20,4 21 21,7 23,2 24,8 25,9 26,5 28,2 29,5 30,5 31,3 31,7 32,6 33,5 34,2 34,9 36 37,5 38,6 40 41,8 42,8 44 45,5 47,2 47,8 θ 4,25 5,2 5,7 7,3 8,4 9,35 10,2 10,5 10,85 11,6 12,4 12,95 13,25 14,1 14,75 15,25 15,65 15,85 16,3 16,75 17,1 17,45 18 18,75 19,3 20 20,9 21,4 22 22,75 23,6 23,9 d, A 10,4 8,51 7,76 6,07 5,25 4,75 4,35 4,23 4,09 3,83 3,59 3,44 3,36 3,16 3,03 2,93 2,86 2,82 2,75 2,67 2,62 2,57 2,49 2,4 2,36 2,25 2,16 2,11 2,06 1,99 1,93 1,9 Іімп./сек. 24 232 32 624 184 1376 504 808 232 1552 152 264 80 248 520 32 120 152 120 288 120 64 136 24 280 40 56 56 256 48 80 56 I% 1,5 15 2 40 12 87 32 52 15 100 10 17 5 16 34 2 8 10 8 19 8 4 9 2 18 3 4 4 16 3 5 4 5 10 Третю поставлену задачу вирішують ще тим, що в способі прогнозування якості комбінованого антигіпертензивного препарату у формі таблеток, до якого входять діючі речовини - валсартан, амлодипіну бесилат, і допоміжні речовини, шляхом визначення його кристалічної структури методом рентгеноструктурного аналізу при випромінюванні 1,5405 Å, згідно з винаходом, як допоміжні речовини використовують мікрокристалічну целюлозу, лактози моногідрат, кроскармелозу натрію, діоксид кремнію колоїдний, тальк, магнію стеарат, гідроксипропилцелюлозу, при цьому одержують наступну кристалічну структуру комбінованого антигіпертензивного препарату. 7 UA 114697 C2 № п/п θ° d, Å Іімп./сек. 1 2 3 5,8 11,6 12,5 2,9 5,8 6,25 15,2 7,63 7,08 248 80 80 I % 25 8 8 4 14,6 7,3 6,06 104 11 5 19,1 9,55 4,65 328 33 6 19,5 9,75 4,55 568 58 7 19,9 9,95 4,46 984 100 8 20,8 10,4 4,270 224 23 9 21.1 10,55 4,21 296 30 10 22,7 11,35 3,92 384 39 11 23,7 11,85 3,75 192 20 12 25,4 12,7 3,51 48 5 13 14 5 2θ° 28,3 30,8 14,15 15,4 3,15, 2,90 48 48 5 5 Валсартан, амлодипіну бесилат Амлодипіну бесилат Гало 1, амлодипіну бесилат, лактоза Гало 1, валсартан, амлодипіну бесилат Гало 2, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза Гало 2, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза Гало 2, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза, магнію стеарат Гало 2, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза Гало 2, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза Гало 3, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза, магнію стеарат Гало 3, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза, магнію стеарат Гало 3, валсартан, амлодипіну бесилат, лактоза Тальк Амлодипіну бесилат Утворення кристалічного складу таблеток обумовлено наявністю лактози моногідратом з наступними показниками кристалічності № п/п 1 2 3 4 5 6 7 8 9 10 11 12 13 14 10 Примітка 2θ 12,7 16,5 19,2 19,5 20 20,8 21,2 22,8 23,8 25,7 27,6 34,8 37,7 38,3 θ 6,35 8,25 9,6 9,75 10,00 10,40 10,60 11,40 11,90 12,85 13,80 17,4 18,85 19,15 dÅ 6,29 5,37 4,62 4,55 4,44 4,27 4,19 3,90 3,74 3,47 3,23 2,58 2,39 2,35 Іімп./сек. 352 256 800 1200 2352 352 560 128 208 160 96 96 240 176 Івідн. %. 15 11 34 51 100 15 24 5 9 7 4 4 10 7 Наведений склад препарату містить сукупність допоміжних речовин, з яких, в залежності від способу виготовлення і технологічного оснащення, обирається оптимальний склад гідрофільних наповнювачів, полімерних речовин для гранулювання та розпушувачів. З широкого кола водорозчинних і гідрофільних допоміжних речовин, які використовуються як наповнювачі, як показали експериментальні дослідження, найефективнішими є мікрокристалічна целюлоза, манітол, кальцію дифосфат дигідрат, лактоза або їх суміші. 8 UA 114697 C2 5 10 15 20 25 30 35 40 Вибраний наповнювач у залежності від способу одержання і технологічного обладнання потребує різних речовин для гранулювання. Так для виготовлення маси для таблетування за допомогою швидкісного змішувача найдоцільнішим є використання мікрокристалічної целюлози або її суміші з манітолом або лактозою, застосуванням для грануляції водно-спиртових розчинів, крохмального розчину з натрію лаурилсульфатом або без нього, манітолу з застосуванням для грануляції коповідону К30 або гідроксипропілцелюлози. При використанні технології киплячого шару експериментальні данні показали, що найдоцільнішим є використання кальцію гідрофосфату дигідрату в суміші з мікрокристалічною целюлозою і як гранулюючої рідини - розчин гідроксипропілцелюлози. Склад допоміжних речовин підвищує механічні властивості таблеток, створює кращу розчинність гідрофобного валсартану. Для цієї мети в склад введено також колоїдний діоксид кремнію. Розчинність в цьому складі допоміжних речовин забезпечує значна кількість кросповідону, який може утворювати комплекси з лікарськими речовинами. Вибір як наповнювача мікрокристалічної целюлози у комбінації з кристалічними наповнювачами сприяє утворенню достатньої капілярної структури таблетки, що, в свою чергу, сприяє разом з кросповідоном її розчинності. Кроскармелоза використовується в більшій кількості, ніж в звичайних технологіях, і в сукупності з тальком і мікрокристалічною целюлозою дає необхідну міцність, а разом з крохмалем і мікрокристалічною целюлозою - необхідну розчинність. Колоїдний діоксид кремнію та магнію стеарат поліпшують плинність порошкової маси та зменшують її адгезивність до поверхні прес-інструменту, тобто вживаються за своїми відомими якостями. Склад допоміжних речовин утворює з лікарськими речовинами технологічні системи, які дозволяють одержати таблетку з бажаними властивостями - міцністю і розчинністю. Сухий гранулят потребує певних значень технологічних властивостей, одна з яких - розмір частинок, регулюються вибраними режимами гранулювання і розміром калібрувального отвору сита. Від цього показника тісно залежать плинність і насипна маса таблеткової маси. Для регулювання цих властивостей використовуються певні технологічні режими проведення вологої грануляції, що залежні також від технологічного обладнання, а також порядок використання тальку, діоксиду кремнію аморфного або їх суміші. При застосуванні вологої грануляції можливе використання як аморфних, так і кристалічних допоміжних речовин. У комбінованих препаратах валсартану з амлодипіном бесилатом лікарські субстанції є кристалічними речовинами і, незважаючи на малу дозу амлодипіну бесилату (5 або 10 мг в таблетці), він може впливати на кристалічний склад лікарської форми і поведінку при її виготовленні. Обладнання для вологої грануляції існує двох основних типів. Перший спосіб - механічного змішування порошкової суміші з наступним зволоженням, сушінням та сухою грануляцією. Другий спосіб - змішування в потоці повітря з одночасним зволожуванням, сушінням. Технологічні властивості валсартану - практично нерозчинність у воді, мала об'ємна щільність перешкоджають використанню однакових розчинників при виготовленні таблеток методами вологої грануляції на різному обладнанні. Винахід пояснюється прикладами. Приклад 1 Таблиця 1 Склад Валсартан Амлодипіну бесилат у перерахунку на основу Манітол Мікрокристалічна целюлоза Гідроксипропілцелюлоза Кросповідон Крохмал преджелатинізований Кремнію діоксид колоїдний Тальк Магнію стеарат Всього Плівка Opadry pink Разом мг 160 10 54 38 7,6 25 13 6 6 5,4 325 10 335 9 % 49,23 3,08 16,61 11,69 2,34 7,69 4 1,85 1,85 1,66 100 3 UA 114697 C2 5 10 15 20 1. Приготування розчину зволожувача. Готують 3 % розчин гідроксипропілцелюлози у воді, до якої додають 10 % спирту етилового. 2. Завантаження та гранулювання. Зважують і подають у швидкісний змішувач валсартан, амлодипіну бесилат, манітол, 60 % мікрокристалічної целюлози, 30 % кросповідону та 50 % крохмалю переджелатинізованого, змішують і зволожують розчином гідроксипропілцеллюлози з етапу 1. 3. Сушіння і грануляція. Вологу масу висушують при температурі не вище 60 °C і калібрують через сито з діаметром отворів 1 мм. 4. Опудрювання. До висушеного і от каліброваного грануляту додають залишкову кількість мікрокристалічної целюлози, кросповідону, крохмалю переджелатинізованого, кремнію діоксиду колоїдного, тальку, перемішують протягом 10-20 хвилин. До готової суміші додають стеарат магнію і додатково перемішують 2-5 хвилин. 5. Таблетування. Пресують таблетки-ядра вагою 325 мг. 6. Покриття плівкою. На поверхню таблеток наноситься плівкова оболонка Opadry pink. Можуть використовуватись готові плівкові суміші, які пропонуються різними виробниками. Приклад 2 Таблиця 2 Склад Валсартан Амлодипіну бесилат в перерахунку на основу Кальцію дифосфат дигідрат Мікрокристалічна целюлоза Кроскармелоза натрію Гідроксипропілцелюлоза Кремнію діоксид колоїдний Тальк Магнію стеарат Всього Плівка Opadry pink Разом 25 30 35 40 мг 160 % 45,71 5 1,43 80,94 47,25 30 7,56 7 7 5,25 350 10 360 23,13 13,5 8,57 2,16 2 2 1,5 100 2,78 Спосіб виготовлення лікарського препарату здійснюють наступним чином. 1. Приготування розчину зволожувача. Готують 2,5-3,5 % розчин гідроксипропілцелюлози. 2. Завантаження та перемішування. Валсартан, амлодипину бесилат, кальцію гідрофосфатдигідрат, 30-45 % мікрокристалічної целюлози, 35-60 % від загальної кількості натрію кроскармелози, 40-60 % від загальної кількості кремнію діоксиду колоїдного, 40-60 % від загальної кількості тальку завантажують в обладнання для виготовлення грануляту методом "киплячого шару" і перемішують при об'ємі робочого повітря від 2800 до 3600 м/год. 3. Зволоження. Суміш зволожують водним розчином гідроксипропілцелюлози при об'ємі робочого повітря 3 від 2000 до 3800 м /год. і при швидкості розпилювання від 0,3 до 0,6 кг/хв. 4. Сушіння. Вологу масу висушують при температурі робочого повітря від 70 до 80 °C. 5. Калібрування і опудрювання. Висушений гранулят калібрують і опудрюють мікрокристалічною целюлозою, залишковою кількістю натрію кроскармелози, аеросилу, тальку та магнію стеаратом. 6. Таблетування. Пресують таблетки-ядра масою 350 мг, що містять валсартану 160 мг, амлодипіну 5 мг. 7. Покриття оболонкою. 10 UA 114697 C2 На поверхню таблеток наноситься плівкова оболонка Opadry pink. використовуватись готові плівкові суміші, які пропонуються різними виробниками. Приклад 3 Можуть Таблиця 3 Склад Валсартан Амлодипину бесилат у перерахунку на основу Лактоза моногідрат Мікрокристалічна целюлоза Кроскармелоза натрію Коповідон К30 Кремнію діоксид колоїдний Тальк Магнію стеарат Всього Плівка Opadry pink Разом мг 160 % 45,71 10 2,86 45,25 71,5 28 10 10 10 5,25 350 10 360 12,92 20,43 8 2,86 2,86 2,86 1,5 100 2,78 5 10 15 20 25 30 35 40 Спосіб виготовлення 1. Готують 3 % водний розчин коповідону К30. 2. Приготування маси для таблетування. Зважують і подають в установку киплячого пару валсартан, амлодипіну бесилат, лактозу, 30-45 % мікрокристалічної целюлози, 35 % натрію кроскармелози, 50 % тальку, 50 % кремнію діоксиду колоїдного. 3. Зволоження. Суміш зволожують водним розчином коповідону К-30 при об'ємі робочого повітря від 2000 3 до 3800 м /год. і при швидкості розпилювання від 0,3 до 0,6 кг/хв. 4 етап. Сушіння. Вологу масу висушують при температурі робочого повітря від 70 до 80 °C. 5 етап. Калібрування і опудрювання. Висушений гранулят калібрують і опудрюють, мікрокристалічною целюлозою, 25 % від загальної кількості, 65 % натрію кроскармелози, 50 % від загальної кількості аеросилу, 50 % від загальної кількості тальку, магнію стеаратом. 6 етап. Таблетування. Пресують таблетки - ядра масою 350 мг, що містять валсартану 160 мг, амлодипіну бесилату 10 мг. 7 етап. Покриття оболонкою. Покривають плівковим розчином OPADRY до ваги сухої плівки 10 мг. Кристалічний склад визначають при дослідженні дифрактограм різних зразків таблеток і субстанції в наступних умовах: дифрактометр ДРОН 3, сцинтиляційний детектор; o мідний антикатод λ=1,5405А , напруга 40 кВ, сила струму 40 мА; розміщення θ-θ; діапазон вимірювань 5-40°; безперервна реєстрація на папері з уточненням положення шляхом точкової реєстрації з часом вимірювання на етапі 10 с; приріст перед кожним вимірюванням 0,02°; графітовий монохроматор на відбитому промені В таблиці 4 наведена дифрактограма відомого препарату Ексфорж фірми Новартіс, який містить валсартану 160 мг, амлодипіну бесилату 10 мг, у перерахунку на основу, та допоміжні речовини: целюлозу мікрокристалічну, кросповідон, магнію стеарат, кремнію діоксид колоїдний, гіпромелозу (гідроксипропілметилцелюлоза), титану діоксид (Е171), оксид залізу (Е172), макрогол 4000 (поліетиленгліколь 4000), тальк. 11 UA 114697 C2 Таблиця 4 № п/п 2θ θ d, Å І, імп./сек. І, % 1 5,75 2,88 15,39 64 17,8 2 3 4 5 6,6 9,5 10,5 11,6 3,30 4,75 5,25 5,80 13,39 9,31 8,43 7,63 32 136 24 56 8,9 37,8 6,7 15,6 6 15 7 19 9,50 4,67 48 13,3 8 20,3 10,15 4,37 96 26,7 9 22,6 11,30 3,93 360 100 10 24,25 12,13 3,31 72 20 11 25,4 12,7 3,25 176 48,9 12 28,7 14,35 3,11 136 37,8 14 37,85 18,93 2,37 56 15,6 Примітка Валсартан, амлодипіну бесилат тальк, валсартан Тальк Амлодипіну бесилат Амлодипіну бесилат Гало, валсартан, мікрокристалічна целюлоза Гало, валсартан, амлодипіну бесилат, мікрокристалічна целюлоза Гало валсартан, амлодипу бесилат, мікрокристалічна целюлоза Амлодипіну бесилат, магнію стеарат, гало валсартан, мікрокристалічна целюлоза Амлодипіну бесилат, Гало валсартан, мікрокристалічна целюлозаАмлодипіну бесилат гало валсартан, мікрокристалічна целюлоза Тальк, амлодипіну бесилат Валсартан В таблиці 5 наведено дифрактограму валсартану з амлодипіном бесилатом за прикладом 2. 5 12 UA 114697 C2 Таблиця 5 2θ 9,5 θ 4,75 d, Å 9,3 І=n*80 132 І=I/Imax*100 42,9 11,60 5,80 7,6 308 100,00 18,9 9,45 4,70 40 13 20,9 10,45 4,25 200 64,9 21,9 10,95 4,06 52 16,9 22,4 11,2 3,97 44 14,3 23,3 11,65 3,82 52 16,9 25,3 28,6 25,3 28,6 12,65 14,3 12,65 14,3 3,52 3,12 3,52 3,12 116 172 116 172 37,7 55,8 37,7 55,8 29,2 14,6 3,06 240 77,9 30,5 15,25 2,93 100 32,5 31,2 15,6 2,87 24 7,8 34,2 17,1 2,62 76 24,7 35,5 17,75 2,53 20 6,5 37,0 18,5 2,43 40 13 39,7 19,85 2,27 24 7,8 41,5 20,75 2,17 52 16,9 42,0 21,0 2,15 44 14,3 43,0 21,5 2,10 24 7,8 Утворення кристалічного показниками кристалічності. складу таблеток 5 13 обумовлено Примітка Валсартан, тальк Кальцію дифосфат дигідрат, амлодипіну бесилат Гало, амлодипіну бесилат Гало, валсартан, кальцію дифосфат, амлодипіну бесилат Гало, валсартан, магнію стеарат Гало, валсартан, магнію стеарат Гало, валсартан, магнію стара Гало, валсартан Тальк Гало, валсартан Тальк Кальцію дифосфат дигідрат, амлодипіну бесилат Кальцію дифосфат дигідрат, амлодипіну бесилат Кальцію дифосфат дигідрат, амлодипіну бесилат Кальцію дифосфат дигідрат Амлодипіну бесилат Кальцію дифосфат дигідрат Кальцію дифосфат дигідрат, амлодипіну бесилат Кальцію дифосфат дигідрат Кальцію дифосфат дигідрат Кальцію дифосфат, амлодипіну бесилат валсартаном з наступними UA 114697 C2 Таблиця 6 Валсартан 2θ 5,8 14,50 22,60 θ 2,90 7,25 11,30 d, Å 15,23732 6,10861 3,93425 І 784 1360 1856 І=I/Imax*100 42,24 гало 73,30 гало 100,00 Амлодипіну бесилат характеризується дифрактограмою наступного складу 5 Таблиця 7 2θ 5,80 10,50 11,70 13,00 14,20 15,20 17,60 19,40 20,00 21,20 21,80 22,70 23,30 24,30 25,30 29,20 30,90 32,00 35,30 36,80 39,80 43,50 47,80 θ 2,90 5,25 5,85 6,50 7,10 7,60 8,80 9,70 10,00 10,60 10,90 11,35 11,65 12,15 12,65 14,60 15,45 16,00 17,65 18,40 19,90 21,75 23,90 d, Å 15,23732 8,42062 7,55953 6,80635 6,23692 5,82581 5,03642 4,57299 4,43714 4,19073 4,07467 3,91511 3,81563 3,66083 3,51835 3,05670 2,89230 2,79685 2,54122 2,44100 2,26365 2,07930 1,90277 І 4120 92 2112 428 96 80 48 160 220 56 80 200 692 312 352 112 336 80 120 64 80 64 48 Іо=I/Imax*100 100 2,23 51,26 10,39 2,33 1,94 1,17 3,88 5,34 1,36 1,94 7,14 16,80 7,57 8,54 2,72 8,16 1,94 2,91 1,55 2,98 1,55 1,17 Утворення кристалічного складу таблеток також обумовлено кальцію дифосфатом дигідратом з наступними показниками кристалічності. 14 UA 114697 C2 Таблиця 8 2θ 11,60 21,00 23,50 26,60 29,40 30,50 31,30 34,40 37,00 40,00 41,60 42,00 43,00 θ 5,80 10,50 11,75 13,30 14,70 15,25 15,65 17,20 18,50 20,00 20,80 21,00 21,50 d, Å 7,62843 4,23024 3,78557 3,35102 3,03794 2,93083 2,85773 2,60697 2,42953 2,25396 2,17090 2,15114 2,10341 І=n*80 1528 760 104 208 760 320 80 336 136 40 136 160 80 n 19,1 9,5 1,3 2,6 9,5 4 1 4,2 1,7 0,6 1,7 2 1 І=I/Imax*100 100,00 49,74 6,81 13,62 49,74 20,94 5,24 21,99 8,90 2,62 8,90 10,47 5,24 Дифрактограма целюлози мікрокристалічної має гало при наступних кутах 20°. Таблиця 9 Кут 2θ° Кут θ° d, Å° 14,9 16,4 22,50 34,50 7,451 8,2 11,25 17,25 5,945 5,405 3,95 2,60 Відносна інтенсивність, % 28,8 28,8 100 9,78 Іімп./сек. 2120 2120 7360 720 5 Дифрактограма тальку відтворюється при наступних кутах 2θ°. Таблиця 10 2θ 9,60 19,10 28,70 48,80 θ° 4,80 9,55 14,35 24,40 d, Å 9,20794 4,64414 3,10881 1,86515 І 24960 5880 32480 2200 Іо=I/Imax*100 76,85 18,10 100,00 6,77 Дифрактограма магнію стеарату відтворюється при наступних кутах 20°. 10 Таблиця 11 № п/п 2θ θ d, Å Іімп./сек. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 5,4 7,2 8,8 13,8 15,0 15,7 19,8 21,8 22,5 23,5 25,2 30,2 31,6 37,0 2,7 3,6 4,4 6,9 7,5 7,85 9,9 10,9 11,25 11,75 12,6 15,1 15,8 18,5 16,37 12,28 10,05 6,42 5,91 5,44 4,48 4,08 3,95 3,78 3,53 2,96 2,83 2,43 880 40 192 40 40 40 96 960 266 224 56 72 24 40 15 Івідн. %. 92 4,0 20,0 4,0 4,0 4,0 гало 10,0 гало100 гало28 гало23 6 7,5 2,5 4 UA 114697 C2 5 Порівняння дифрактограми таблиці 11 з дифрактограмою валсартану з патенту UA 58573 показує, що навіть незначна доза амлодипіну бесилату дає значущі відміни в кристалічному складі препарату. Крім того, в патенті UA 58573 не показано в таблиці як проявляються гало, що теж дає істотні свідчення про структуру препарату. Таблетки валсартану з амлодипіном бесилатом, в яких використовується як наповнювач манітол, мають дифрактограму наведену в таблиці 6, за складом таблеток зразку 1. Таблиця 12 2θ° 5,8 10,4 11,6 12,5 14,6 18,7 θ° 2,9 5,2 5,8 6,25 7,3 9,35 d, Å° 15,2 8,51 7,63 7,08 6,07 4,74 Іімп./сек. 200 88 80 64 392 984 1% 18 8 7 6 35 87 19,5 9,75 4,55 328 29 19,9 9,95 4,46 608 54 20,4 10,2 4,35 328 29 21,1 10,55 4,21 680 60 23,4 11,7 3,80 1128 100 25,8 12,9 3,45 112 10 28,3 29,5 31,6 33,5 38,7 44,0 15,15 14,75 15,8 16,75 19,35 22,0 3,15 3,03 2,83 2,67 2,32 2,06 144 328 104 184 160 160 13 29 9 16 14 14 Примітка Валсартан, амлодипіну бесилат Амлодипіну бесилат Амлодипіну бесилат Амлодипіну бесилат Гало 1, валсартан, манітол Гало 2, валсартан, манітол Гало 2, валсартан, амлодипіну бесилат Гало 2, валсартан, манітол, амлодипіну бесилат Гало 2, валсартан, манітол, амлодипіну бесилат Гало 2, валсартан, манітол, амлодипіну бесилат, магнію стеарат Гало 2, валсартан, манітол, амлодипіну бесилат, магнію стеарат Гало 2, валсартан, манітол, амлодипіну бесилат Манітол, тальк Манітол, амлодипіну бесилат Манітол Манітол Манітол Манітол Таблиця 13 Манітол № п/п 2θ° θ° d, A° Іімп./сек. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 8,5 10,4 11,4 14,6 16,8 18,7 20,4 21 21,7 23,2 24,8 25,9 26,5 28,2 29,5 4,25 5,2 5,7 7,3 8,4 9,35 10,2 10,5 10,85 11,6 12,4 12,95 13,25 14,1 14,75 10,4 8,51 7,76 6,07 5,25 4,75 4,35 4,23 4,09 3,83 3,59 3,44 3,36 3,16 3,03 24 232 32 624 184 1376 504 808 232 1552 152 264 80 248 520 10 16 І % 1,5 15 2 40 12 87 32 52 15 100 10 17 5 16 34 UA 114697 C2 Продовження таблиці 13 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 30,5 31,3 31,7 32,6 33,5 34,2 34,9 36 37,5 38,6 40 41,8 42,8 44 45,5 47,2 47,8 15,25 15,65 15,85 16,3 16,75 17,1 17,45 18 18,75 19,3 20 20,9 21,4 22 22,75 23,6 23,9 2,93 2,86 2,82 2,75 2,67 2,62 2,57 2,49 2,4 2,36 2,25 2,16 2,11 2,06 1,99 1,93 1,9 32 120 152 120 288 120 64 136 24 280 40 56 56 256 48 80 56 2 8 10 8 19 8 4 9 2 18 3 4 4 16 3 5 4 Таблетки валсартану з амлодипіном бесилатом, в яких використані як допоміжні речовини лактози моногідрат та мікрокристалічна целюлоза, за складом прикладу 3 наведені в таблиці 14 5 Таблиця 14 № п/п 2θ° θ° d, A° 1 2 3 5,8 11,6 12,5 2,9 5,8 6,25 15,2 7,63 7,08 І імп./сек. 248 80 80 4 14,6 7,3 6,06 104 11 5 19,1 9,55 4,65 328 33 6 19,5 9,75 4,55 568 58 7 19,9 9, 95 4,46 984 100 8 20,8 10,4 4,270 224 23 9 21.1 10,55 4,21 296 зо 10 22,7 11,35 3,92 384 39 11 23,7 1.1,85 3,75 192 20 12 25,4 12,7 3,51 48 5 13 14 28,3 30,8 14,15 15,4 3,15 2,90 48 48 5 17 I% Примітка 25 8 8 Валсартан, амлодипіну бесилат Амлодипіну бесилат Гало 1, амлодипіну бесилат, Лактоза Гало 1, валсартан, амлодипіну бесилат Гало 2, амлодипіну бесилат, лактоза, МКЦ Гало 2, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза Гало 2, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза, магнію стеарат Гало2, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза Гало 2, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза Гало 3, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза, магнію стеарат Гало 3, валсартан, амлодипіну бесилат, лактоза, мікрокристалічна целюлоза, магнію стеарат Гало 3, валсартан, амлодипіну бесилат, лактоза, Тальк Амлодипіну бесилат UA 114697 C2 Лактози моногідрат Таблиця 15 № п/п 10 θ dÅ Іімп./сек. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 5 2θ 12,7 16,5 19,2 19,5 20 20,8 21,2 22,8 23,8 25,7 27,6 34,8 37,7 38,3 6,35 8,25 9,6 9,75 10,00 10,40 10,60 11,40 11,90 12,85 13,80 17,4 18,85 19,15 6,29 5,37 4,62 4,55 4,44 4,27 4,19 3,90 3,74 3,47 3,23 2,58 2,39 2,35 352 256 800 1200 2352 352 560 128 208 160 96 96 240 176 Івідн. %. 15 11 34 51 100 15 24 5 9 7 4 4 10 7 Порівняння дифрактограм таблиць 4-15 показує, що різні наповнювачі по-різному впливають на можливість незалежного визначення діючих речовин, насамперед, амлодипіну бесилату, порізному проявляються гало, які обумовлені значною кількістю в таблетках валсартану, який теж має частково кристалічну, а більшою мірою, аморфну структуру. Як показано на подальших даних з кінетики розчинення діючих речовин, різниця в запропонованих складах препарату, в способах виготовлення і апаратурі, що випростується для цього, не впливає суттєво на кінетику розчинення, як показник біоеквівалентності препарату. На Фіг. 1 і Фіг. 2 наведені дані розчинення компонентів у порівнянні з прототипом. ФОРМУЛА ВИНАХОДУ 15 20 25 Спосіб виготовлення комбінованого антигіпертензивного препарату у формі таблеток, що включає змішування компонентів, зволоження суміші, сушіння, калібрування, опудрювання, таблетування та покриття плівкою, який відрізняється тим, що спочатку змішують валсартан, амлодипіну бесилат, 30-60 % мікрокристалічної целюлози від її загальної кількості, 30-40 % кросповідону та 40-60 % крохмалю переджелатинізованого і зволожують суміш попередньо приготованим водно-спиртовим розчином полімерних зволожувачів, вологу масу висушують при температурі робочого повітря 50-80 °C і додають до висушеного грануляту решту мікрокристалічної целюлози, ковзні речовини - тальк або діоксид кремнію колоїдний, або їх суміш, перемішують протягом 10-20 хвилин і наприкінці додають антиадгезивну речовину магнію стеарат, і знову змішують 2-5 хвилин, одержану суміш пресують у таблетки та покривають їх плівковою оболонкою. 18 UA 114697 C2 Комп’ютерна верстка О. Гергіль Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 19
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 209/00, A61K 31/41
Мітки: виготовлення, комбінованого, спосіб, форми, таблеток, антигіпертензивного, препарату
Код посилання
<a href="https://ua.patents.su/21-114697-sposib-vigotovlennya-kombinovanogo-antigipertenzivnogo-preparatu-u-formi-tabletok.html" target="_blank" rel="follow" title="База патентів України">Спосіб виготовлення комбінованого антигіпертензивного препарату у формі таблеток</a>
Попередній патент: Спосіб лікування хворих на подагру чоловіків у поєднанні з артеріальною гіпертензією
Наступний патент: Спосіб вимірювання теплоти згоряння суміші газів парової конверсії спиртів та пристрій для його здійснення
Випадковий патент: Пристрій для контролю потужності лазерного випромінювання