19-норстероїди і їх застосування для лікування прогестеронзалежних станів
Формула / Реферат
1. Сполука загальної формули
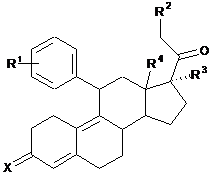
або її фармацевтично прийнятна сіль, де: R1 знаходиться в пара-положенні і вибраний з групи, яка складається з -SOCH3 і -SO2CH3; R2 вибраний з групи, яка складається з атома водню, алкокси і ацилокси; R3 вибраний з групи, яка складається з С1-6алкілу, гідроксигрупи, алкокси і ацилокси; R4 являє собою метил; X являє собою =O.
2. Сполука або її сіль за п. 1, де R1 являє собою -SO2CH3; і R2 являє собою алкокси.
3. Сполука або її сіль за п. 1, де R1 являє собою -SO2CH3; і R2 являє собою атом водню.
4. Сполука або її сіль за п. 2, де R2 являє собою метокси.
5. Сполука або її сіль за п. 4, де R3 являє собою ацетокси.
6. Сполука або її сіль за п. 1, де R2 являє собою атом водню; і R3 являє собою ацетокси.
7. Сполука або її сіль за п. 1, де R1 являє собою -SOCH3; R2 являє собою алкокси або атом водню.
8. Сполука або її сіль за п. 7, де R2 являє собою метокси; і R3 являє собою ацетокси.
9. Сполука або її сіль за п. 7, де R2 являє собою атом водню; і R3 являє собою ацетокси.
10. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки або її солі за будь-яким з пп. 1-9 і фармацевтично прийнятний ексципієнт, причому переважно фармацевтична композиція знаходиться в формі, придатній для вагінального введення, такій як вагінальний супозиторій, гель або крем.
11. Сполука або її сіль за пп. 1-9, придатна для лікування прогестеронзалежного стану, вибраного з групи, яка складається з ендометріозу і болю, пов'язаного з ним, аденоміозу, обмеженого розростання ендометріоїдної тканини яєчника, дисменореї, фібром матки, гіперпроліферації ендометрія, раку яєчника, раку шийки матки, у пацієнта, який потребує цього.
12. Сполука або її сіль за п. 11, де сполуку вводять способом, вибраним з групи, яка складається з вагінального введення, внутрішьоматкового введення і місцевого введення, і де ефективна кількість менше ефективної кількості системного введення.
Текст
Реферат: Даний винахід стосується галузі лікування гормонозалежних станів. Описані нові сполуки і способи лікування таких станів. Варіанти здійснення даного винаходу розкривають спосіб лікування ендометріозу, дисменореї, раку молочної залози, фіброми матки і гіперпроліферації ендометрія. UA 113283 C2 (12) UA 113283 C2 UA 113283 C2 5 10 15 20 25 30 За даною заявкою заявляється пріоритет згідно з Міжнародною заявкою № РСТ/US2010/062068, поданою 23 грудня 2010 року, зміст якої у всій повноті включений в даний опис за допомогою посилання. Галузь техніки, до якої належить винахід У деяких варіантах здійснення даний винахід стосується 19-норстероїдних модуляторів прогестеронового рецептора із зниженою печінковою токсичністю і поліпшеною розчинністю, композицій, що містять вказані сполуки, і застосуванню даних модуляторів прогестеронового рецептора для лікування прогестеронзалежних станів. Рівень техніки Дія стероїдного гормонального прогестерону на репродуктивну систему добре задокументована. Наприклад, прогестерон є життєво важливим під час вагітності і для її збереження і надає дію на різні тканини репродуктивної системи. Повідомлялося і про дію прогестерону на тканини за межами репродуктивної системи, але вона не так добре охарактеризована. Антипрогестини, сполуки, які інгібують дія прогестерону, володіють значним потенціалом для застосування в фармакологічній регуляції фертильності і різних станів і захворювань, таких як рак молочної залози і ендометріоз. Перший описаний антипрогестин, міфепристон (RU 486), є одним з представників ряду похідних 19-нортестостерону з сильною спорідненістю до прогестеронових і глюкокортикоїдних рецепторів і має антипрогестагенну і протиглюкокортикоїдну активність. На основі молекули 19-норпрогестерону були синтезовані різні антипрогестини. Застосування відомих антипрогестинів пов'язане з деякими недоліками, тому вони не є ідеально придатними для тривалого застосування. Якщо вказані і інші недоліки застосування антипрогестинів в лікуванні можна було поліпшити, то був би досягнутий значний прогрес в лікуванні гормонозалежних розладів. Суть винаходу В одному варіанті здійснення даний винахід надає нові стероїди, які володіють ефективною антипрогестагенною активністю, мінімальною протиглюкокортикоїдною активністю і зниженою печінковою токсичністю. Нові стероїди можуть також володіти поліпшеними технологічними властивостями. Більш конкретно, даний винахід надає сполуки загальної формули: 1 35 40 45 2 3 4 і їх фармацевтично прийнятні солі, де R , R , R , R і Х є такими, як описано нижче. В іншому варіанті здійснення даний винахід надає способи, де сполука загальної формули I (або фармацевтичні композиції, що містять сполуку загальної формули I) застосовують для лікування різних гормонозалежних (тобто естроген- і/або прогестеронзалежних) станів у пацієнта, потребуючого такого лікування. В іншому варіанті здійснення винаходу сполуку загальної формули I вводять протягом тривалого періоду для лікування хронічного гормонозалежного стану. В іншому варіанті здійснення винаходу сполуку загальної формули I вводять будь-яким способом, включаючи пероральне введення (тобто введення в шлунковокишковий тракт суб'єкта). У переважному варіанті здійснення винаходу сполуку загальної формули I вводять на вагінальну слизову оболонку протягом тривалого лікування хронічного гормонозалежного стану. У ще одному варіанті здійснення даний винахід надає способи введення композицій, що містять одну або більше сполук загальної формули I, які не виявляють печінкової токсичності. Гормонозалежні стани, які можна лікувати за допомогою композицій згідно з винаходом, включають, але без обмеження, ендометріоз і біль, пов'язаний з ним, аденоміоз, обмежене розростання ендометріоїдної тканини яєчника, дисменорею, ендокринні гормонозалежні пухлини, фіброму матки, гіперпроліферацію ендометрію, рак яєчника, рак шийки матки і рак молочної залози. Композиції згідно з даним винаходом також можуть застосовуватися для 1 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 виклику менструації, для індукування скорочувальної діяльності матки, а також для контрацепції. Короткий опис фігур На фіг. 1 представлене порівняння Cmax (максимальна концентрація в плазмі) і площі під кривою (AUC) при пероральному і вагінальному введенні CDB-4124 або CDB-4453 в дозі 25 мг собакам породи бігль. На фіг. 2 представлена фактична Cmax, що спостерігається для Proellex (CDB-4124) і його монодеметилованого метаболіту CDB-4453, при пероральному введенні CDB-4124 в дозах 12,5 мг, 25 мг і 50 мг, а також Cmax, що прогнозуються для доз 3 мг, 6 мг і 9 мг. На фіг. 2 також представлена фактична Cmax, що спостерігається для Proellex (CDB-4124) і його монодеметилованого метаболіту CDB-4453, при вагінальному введенні CDB-4124 в дозах 12,5 мг, 25 мг і 50 мг. На фіг. 3 проілюстроване порівняння інгібування прогестерон-індукованої проліферації ендометрію в естрадіол-сенсибілізованих незрілих кроликів після підшкірної ін'єкції і перорального введення CDB-4124. На фіг. 4 проілюстроване порівняння антипрогестагенної дії CDB-4124 в трьох дозах при пероральному введенні відносно введення через слизову оболонку піхви на естрадіолсенсибілізованих незрілих кроликах в присутності прогестерону, що визначається зниженням McPhail індексу. Лікування тільки прогестероном (контроль-розріджувач) забезпечує вимірювання базису прогестагенної активності. Докладний опис винаходу Хоча даний винахід може бути здійснений в різних формах, потрібно розуміти, що наведений нижче опис декількох варіантів здійснення винаходу представлений як приклади і він не призначено для обмеження винаходу його конкретними варіантами здійснення. Заголовки надані виключно для зручності і в будь-якому випадку не повинні розглядатися як обмеження винаходу. Варіанти здійснення, представлені під будь-яким заголовком, можуть бути об'єднані з варіантами здійснення, представленими під будь-яким іншим заголовком. Потрібно розуміти, що будь-які інтервали, співвідношення і інтервали співвідношень, які можуть бути утворені будь-якими числами або даними, представляють в даному описі додаткові варіанти здійснення даного винаходу. Це стосується інтервалів, які можуть бути утворені і які включають кінцеві верхні і/або нижні кордони або не включають їх. Таким чином, фахівцям в даній галузі буде зрозуміло, що багато які такі відносини, інтервали і інтервали співвідношень можуть бути однозначно отримані з даних і чисел, представлених в даному описі, і всі вони представляють варіанти здійснення винаходу. Перед розкриттям і описом сполук, композицій і способів згідно з даним винаходом потрібно розуміти, що термінологія, що використовується в даному описі, є термінологією, призначеною для опису конкретних варіантів здійснення і не призначена для обмеження винаходу. Потрібно зазначити, що ті, що використовуються в даному описі і прикладеній формулі винаходу форми однини включають множину, якщо контекст явно не вказує інше. Визначення Термін “пероральне" введення означає, що активний агент в препараті призначений для проковтування, тобто призначений для доставки в шлунково-кишковий тракт для абсорбції. Термін “ефективна доза" означає кількість активного компонента композиції, достатню для лікування конкретного стану. Термін “селективні модулятори рецепторів прогестерону" означає сполуки, які впливають на функції рецепторів прогестерону тканиноспецифічним чином. Сполуки виступають як антагоністи рецепторів прогестерону в одних тканинах (наприклад, в тканині молочної залози) і як агоністів рецепторів прогестерону в інших тканинах (наприклад, в матці). Термін “лікувати" або “лікування", що використовується в даному описі, стосується будьякого лікування будь-якого прогестеронзалежного розладу або захворювання і включає, але без обмеження, інгібування розладу або захворювання, купірування розвитку розладу або захворювання; полегшення розладу або захворювання, наприклад, виклик регресії розладу або захворювання; або полегшення стану, викликаного захворюванням або розладом, полегшення симптомів захворювання або розладу. Термін “запобігання" або “профілактика" відносно прогестеронзалежного розладу або захворювання означає запобігання початку розвитку розладу або захворювання, якщо розладу або захворювання ще немає, або запобігання подальшому розвитку розладу або захворювання, якщо розлад або захворювання вже має місце. Наприклад, композиції даного винаходу можуть застосовуватися для запобігання рецидиву пухлини. Рецидив пухлини може мати місце 2 UA 113283 C2 5 10 15 20 25 30 35 40 45 внаслідок залишкових мікроскопічних груп або гнізд пухлинних клітин, які згодом розвиваються в пухлини, що клінічно виявляються. Термін “агоніст прогестерону" означає сполуку, яка зв'язується з рецептором прогестерону і імітує дію природного гормону. Термін “антагоніст прогестерону" означає сполуку, яка зв'язується з рецептором прогестерону і інгібує дію прогестерону. Термін “по суті не знизилися", що використовується в даному описі з посиланням на рівні гормонів у жінки, означає, що рівні гормонів підтримуються в межах норми в процесі введення композиції згідно з даним винаходом. Таким чином, вважається, що може статися деяке зниження рівня гормонів при умові, що рівень гормонів залишається в межах норми. Термін “по суті не підвищилися", що використовується в даному описі з посиланням на рівні гормонів у жінки, означає, що рівні гормонів підтримуються в межах норми в процесі введення композиції згідно з даним винаходом. Таким чином, вважається, що може статися деяке підвищення рівня гормонів, при умові, що рівень гормонів залишається в межах норми. Термін “алкіл", що використовується в даному описі, стосується насиченої аліфатичної вуглеводневої групи з прямим, розгалуженим або циклічним ланцюгом, що містить від 1 до 12 атомів вуглецю, переважно від 1 до 6 атомів вуглецю, яка в цьому випадку визначається як “нижчий алкіл". Термін “алкіл", коли використовується в даному описі, включає термін “заміщені алкіли", який стосується алкілу, який визначений вище, що містить одну або більше функціональних груп, таких як арил, ацил, галоген, гідроксигрупа (наприклад, гідроксиметил), аміно, ацилокси, алкокси (наприклад, метоксиметил) і т.п. Вказані групи можуть приєднуватися до будь-якого атома вуглецю алкільного фрагмента. Термін “алкініл", який означає лінійні або розгалужені радикали, що містять, щонайменше, один потрійний вуглець-вуглецевий зв'язок, не охоплюється терміном “алкіл". Термін “алкеніл", що використовується в даному описі, стосується одновалентного нерозгалуженого або розгалуженого ланцюга, що містить один або більше подвійних зв'язків, і включає, але без обмеження, С2-С8алкенільні групи, таких як вініл, аліл, бутеніл, пентеніл, гексеніл. Термін “алкеніл" включає радикали з “цис" і “транс" орієнтаціями. Алкенільна група може бути незаміщеною або заміщена одним або двома відповідними замісниками. Термін “алкініл", який означає лінійні або розгалужені радикали, що містять, щонайменше, один потрійний вуглець-вуглецевий зв'язок, не охоплюється терміном “алкеніл". Термін “ацилокси", що використовується в даному описі, стосується органічного радикала, отриманого з органічної кислоти за допомогою видалення атома водню, такого як ацетокси, формілокси і т.п. Органічний радикал може бути додатково заміщений однією або більше функціональними групами, такими як алкіл, арил, аралкіл, ацил, атом галогену, аміногрупа (наприклад, являє собою гліцинат), тіольна, гідроксигрупа, алкоксигрупа і т.п. Термін “ацил", що використовується в даному описі, стосується групи -С(О)R, де R являє собою алкіл або арил (заміщений або незаміщений). Термін “алкокси", що використовується в даному описі, стосується групи -OR, де R являє собою нижчий алкіл, арил або аралкіл, і включає, але без обмеження, метокси, етокси, фенокси, метоксіетокси, трет-бутокси і т.п. Термін “гідроксигрупа", що використовується в даному описі, стосується групи -ОН. Термін “арил", що використовується в даному описі, стосується ароматичної заміщеної групи, яка може являти собою єдине кільце або множину конденсованих кілець, ковалентно пов'язану або приєднану до звичайної групи, такої як етиленовий або метиленовий фрагмент, і включає феніл, нафтил, біфеніл, може містити гетероатом, такий як тієніл і піридил. Арильна група може бути заміщена атомами галогену, карбонільною групою, алкоксигрупою і т.п. Сполуки В одному аспекті даний винахід стосується сполук загальної формули: 50 3 UA 113283 C2 1 5 і їх фармацевтично прийнятних солей, де: R може знаходитися в пара-, орто- або метаположенні і являє собою функціональну групу, включаючи, але без обмеження, -СН(ОН)СН3; алкіл; алкеніл; циклоалкіл; циклоалкеніл; арил; алкілсульфініл (наприклад, CH3SO2); алкілсульфоніл (наприклад, CH3SО2; ацил (наприклад, форміл, ацетил, пропіоніл, бутирил і т.п.); алкокси (наприклад, -OCH3; -О(CH2)2CH3, -О-CH2-CH=CH2); тіоалкокси; тіоалкіл (наприклад, -SCH3); ацилокси (наприклад, ацетокси, пропаноїлокси); Si(CH3)3; де Х і Y являють собою ацил; і гетероцикл, що переважно містить, щонайменше, один атом азоту (наприклад, 10 азиридиніл ( або ), азириніл ( або ), азетидиніл, піролідиніл (NС4Н8), заміщений піролідиніл (наприклад, метоксипіролідиніл, етоксипіролідиніл), пірол ( піридиніл ), піперидиніл (-NC5H10), заміщений піперидиніл (наприклад, -О(СН2)2NC5H10), ( ), морфолініл (NC4H8O), етоксиморфолініл), оксазиніл, піперазиніл ( заміщений морфолініл (наприклад, ), заміщений піперазиніл (наприклад, 2 15 20 25 30 35 40 45 ), діазиніл і азол, такий як піразол ( )); R являє собою функціональну групу, що складається з, але без обмеження, атома водню, атома галогену, алкілу, ацилу, гідроксигрупи, алкокси (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т.д.), ацилокси (наприклад, формілокси, ацетокси, пропіонілокси, 6 гептаноїлокси, гліцинат і т.д.), алкілкарбонату, ципіонілокси, S-алкілу, S-CN, S-ацилу і -OC(О)R , 6 де R являє собою функціональну групу, що складається з алкілу, алкоксіалкілу (наприклад, 3 CH2OCH3) або алкокси (-OCH3); R являє собою функціональну групу, що складається з, але без обмеження, алкілу (наприклад, метилу, метоксиметилу), гідроксигрупи, алкокси (наприклад, 4 метокси, етокси, метоксіетокси і т.д.) і ацилокси; R являє собою функціональну групу, що складається з, але без обмеження, атома водню і алкілу; і X являє собою функціональну групу, 5 5 що складається з, але без обмеження, =О, =N-OR , де R являє собою водень або алкіл, OH, CH2, OAlk1 і OCOAlk2, де Alk1 і Alk2 являють собою C1-C8алкіл або C7-C15аралкіл, при умові, що 1 якщо R знаходиться в пара-положенні і являє собою -OCH3, -SCH3, -NC4H8, -NC5H10, -NC4H8О, 5 5 CHO, -CH(OH)CH3, -COCH3, -О(CH2)2NC4H8) або -O(CH2)2NC5H10, X не є =О або =N-ОR , де R 2 3 являє собою водень або алкіл, при умові, що якщо R являє собою водень, R являє собою 4 1 гідроксигрупу або метил, R являє собою метил, і Х являє собою =О, тоді R не є метоксигрупою, ізопропілом, фенілом або воднем. В одному переважному варіанті здійснення винаходу надана сполука загальної формули I 1 або її фармацевтично прийнятна сіль, де R знаходиться в пара-положенні і являє собою OCH3, -SCH3, -NC4H8 (піролідино), -NC5H10 (піперидино), -NC4H8O (морфоліно), -CHO, CH(OH)CH3, -COCH3, -О(CH2)2NC4H8 (метоксипіролідино) або -О(CH2)2NC5H10 2 (етоксипіперидинофеніл); R являє собою атом водню, атом галогену, алкіл, ацил, гідроксигрупу, алкокси (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т.д.), ацилокси (наприклад формілокси, ацетокси, пропіонілокси, гептаноїлокси, гліцинат і т.д.), 6 6 алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил і -OC(О)R , де R являє собою функціональну групу, що складається з алкілу, алкоксіалкілу (наприклад, -CH2OCH3) або 3 алкокси (наприклад, -OCH3); R являє собою алкіл (наприклад, метил, метоксиметил), 4 гідроксигрупу, алкоксигрупу (наприклад, метокси, етокси, метоксіетокси і т.д.) або ацилокси; R являє собою атом водню або алкіл; і X являє собою OH, CH 2, OAlk1 або OCOAlk2, де Alk1 і Alk2 являють собою C1-C8алкіл або C7-C15аралкіл. В особливо переважному варіанті здійснення 1 2 винаходу R знаходиться в пара-положенні і являє собою -СОСН3 або СНО, R являє собою 3 4 алкоксигрупу, R являє собою алкіл, гідроксигрупу, алкоксигрупу або ацилоксигрупу, R являє 4 UA 113283 C2 5 10 15 20 25 30 собою алкіл, і Х являє собою ВІН, СН2, OAlk1 або ОСОAlk2, де Alk1 і Alk2 являє собою С1-С8алкіл 1 або С7-С15аралкіл. Ще більш переважно, R знаходиться в пара-положенні і являє собою 2 3 4 СОСН3, R являє собою метоксигрупу, R являє собою ацетоксигрупу, R являє собою метил, і Х являє собою ОН, СН2, ОAlk1 або ОСОAlk2, де Alk1 і Alk2 являють собою С1-С8алкіл або С7С15аралкіл. В іншому переважному варіанті здійснення винаходу надана сполука загальної формули I 1 або її фармацевтично прийнятна сіль, де R знаходиться в мета- або орто-положенні і являє собою -OCH3, -SCH3, -NC4H8 (піролідино), -NC5H10 (піперидино), -NC4H8О (морфоліно), -CHO, CH(OH)CH3, -COCH3, -Об(CH2)2NC4H8 (метоксипіролідино) або -О(CH2)2NC5H10 2 (етоксипіперидинофеніл); R являє собою атом водню, атом галогену, алкіл, ацил, гідроксигрупу, алкокси (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т.д.), ацилокси (наприклад, формілокси, ацетокси, пропіонілокси, гептаноїлокси, гліцинат і т.д.), 6 6 алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил і -OC(О)R , де R являє собою функціональну групу, включаючи алкіл, алкоксіалкіл (наприклад, -CH2OCH3) або алкокси (3 OCH3); R являє собою алкіл (наприклад, метил, метоксиметил), гідроксигрупу, алкоксигрупу 4 (наприклад, метокси, етокси, метоксіетокси і т.д.) або ацилоксигрупу; R являє собою атом 5 5 водню або алкіл; і Х являє собою -О, =N-OR , де R являє собою атом водню або алкіл, ОН, СН2, Alk1 або ОСОAlk2, де Alk1 і Alk2 являє собою С1-С8алкіл або С7-С15аралкіл, при умові, що 2 3 4 якщо R являє собою атом водню, R являє собою гідроксигрупу, R представляє метил, і Х 1 являє собою =О, R не є метоксигрупою. В особливо переважному варіанті здійснення винаходу 1 2 R знаходиться в мета- або орто-положенні і являє собою -СОСН3 або СНО, R являє собою 3 алкоксигрупу, ацилоксигрупу або атом водню, R являє собою алкіл, гідроксигрупу, алкоксигрупу 4 5 5 або ацилоксигрупу, R являє собою алкіл, і Х являє собою =О, =N-OR , де R являє собою водень або алкіл, OH, CH2, OAlk1 або OCOAlk2, де Alk1 і Alk2 являють собою C1-C8алкіл або C7C15аралкіл. Особливо переважні сполуки включають 21-метокси-17-ацетокси-11-(31 ацетилфеніл)-19-норпрегна-4,9-дієн-3,20-діон (де R знаходиться в мета-положенні і являє 2 3 4 собою -СОСН3, R являє собою метокси, R являє собою ацетокси, R являє собою метил, і Х являє собою =О) структурної формули, представленої нижче: 1 17-ацетокси-11-(3-ацетилфеніл)-19-норпрегна-4,9-дієн-3,20-діон (де R знаходиться в 2 3 мета-положенні і являє собою -СОСН3, R являє собою атом водню, R являє собою ацетокси, 4 R являє собою метил, і Х являє собою =О) структурної формули, представленої нижче: 1 35 і 21-ацетокси-17-ацетокси-11-(3-ацетилфеніл)-19-норпрегна-4,9-дієн-3,20-діон (де R 2 3 4 знаходиться в мета-положенні і являє собою -СОСН3, R і R являє собою ацетокси, R являє собою метил, і Х являє собою =О) структурної формули, представленої нижче: 5 UA 113283 C2 5 10 15 20 25 30 35 40 45 У ще одному переважному варіанті здійснення винаходу надана сполука загальної формули 1 I або її фармацевтично прийнятна сіль, де R знаходиться в пара-положенні і являє собою алкіл; алкеніл; циклоалкіл; циклоалкеніл; арил; алкілсульфініл (наприклад, метилсульфініл); алкілсульфоніл (наприклад, SO2CH3); тіоалкокси; Si(CH3)3; де Х і Y являють собою ацил; азиридиніл, азириніл, азетидиніл, метоксипіролідиніл, етоксиморфолініл, оксазиніл, 2 піперазиніл, метилпіперазиніл, етилпіперазиніл або діазиніл; R являє собою атом водню, атом галогену, алкіл, ацил, гідроксигрупу, алкоксигрупу (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т.д.), ацилоксигрупу (наприклад, формілокси, ацетокси, пропіонілокси, гептаноїлокси, гліцинат і т.д.), алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил 6 6 або -OC(О)R , де R являє собою функціональну групу, що складається з алкілу, алкоксіалкілу 3 (наприклад, -CH2OCH3) або алкоксигрупи (-OCH3); R являє собою алкіл (наприклад, метил, метоксиметил), гідроксигрупу, алкоксигрупу (наприклад, метокси, етокси, метоксіетокси і т.д.) 4 5 5 або ацилокси; R являє собою атом водню або алкіл; і X являє собою =О, =N-OR , де R являє собою атом водню або алкіл, OH, CH2, OAlk1 або OCOAlk2, де Alk1 і Alk2 являють собою C12 3 C8алкіл або C7-C15аралалкіл, при умові, що якщо R представляє атом водню, R являє собою 4 1 гідроксигрупу або метил, R являє собою метил, і Х являє собою =О, R не є ізопропілом або 1 фенілом. В особливо переважному варіанті здійснення винаходу R знаходиться в пара2 3 положенні і являє собою алкілсульфініл, R являє собою алкоксигрупу, R являє собою алкіл, 4 гідроксигрупу, алкоксигрупу або ацилоксигрупу, R являє собою алкіл і Х являє собою =О, =N5 5 OR , де R являє собою атом водню або алкіл, ОН, СН2, ОAlk1 або ОСОAlk2, де Alk1 і Alk2 1 являють собою С1-С8алкіл або С7-С15аралалкіл. Ще більш переважно, R знаходиться в пара2 3 4 положенні і являє собою -SOCH3, R являє собою метоксигрупу, R являє собою ацетокси, R являє собою метил, і Х являє собою =О. У ще одному переважному варіанті здійснення винаходу надана сполука загальної формули 1 I або її фармацевтично прийнятна сіль, де R знаходиться в мета- або орто-положенні і являє собою алкіл; алкеніл; циклоалкіл; циклоалкеніл; арил; алкілсульфініл (наприклад, CH 3SO); алкілсульфоніл (наприклад, CH3SО2); тіоалкокси; Si(CH3)3; , де X і Y являють собою ацил, азиридиніл, азириніл, азетидиніл, метоксипіролідиніл, етоксиморфолініл, оксазиніл, 2 піперазиніл, метилпіперазиніл, етилпіперазиніл або діазиніл; R являє собою атом водню, атом галогену, алкіл, ацил, гідроксигрупу, алкоксигрупу (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т.д.), ацилоксигрупу (наприклад, формілокси, ацетокси, пропіонілокси, гептаноїлокси, гліцинат і т.д.), алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил 6 6 або -OC(О)R , де R являє собою функціональну групу, включаючи алкіл, алкоксіалкіл 3 (наприклад, -CH2OCH3) або алкокси (- OCH3); R являє собою алкіл (наприклад, метил, метоксиметил), гідроксигрупу, алкоксигрупу (наприклад, метокси, етокси, метоксіетокси і т.д.) 4 5 5 або ацилоксигрупу; R являє собою атом водню або алкіл; і X являє собою =О, =N-OR , де R являє собою атом водню або алкіл, OH, CН 2, OAlk1, або OCOAlk2, де Alk1 і Alk2 являють собою 1 C1-C8алкіл або C7-C15аралалкіл. В особливо переважному варіанті здійснення винаходу R 2 знаходиться в орто- або мета-положенні і являє собою алкілсульфініл, R являє собою 3 4 алкоксигрупу, R являє собою алкіл, гідроксигрупу, алкоксигрупу або ацилоксигрупу, R являє 5 5 собою алкіл, і Х являє собою =О, =N-OR , де R являє собою атом водню або алкіл, ОН, СН2, ОAlk1 або ОСОAlk2, де Alk1 і Alk2 являють собою С1-С8алкіл або С7-С15аралалкіл. Ще більш 6 UA 113283 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 2 переважно, R знаходиться в мета-положенні і являє собою -SOCH3, R являє собою метокси, 3 4 R являє собою ацетокси, R являє собою метил, і Х являє собою =О. 1 Особливо переважними R замісниками, які знаходяться в орто-, мета- або парі-положенні, є -CHO, -COCH3 і SOCH3. 2 Особливо переважними R замісниками є алкокси (зокрема, метокси або етокси) і атом водню. 3 Особливо переважними R замісниками є алкокси (зокрема, метокси або етокси) і ацилоксигрупа (зокрема, ацетокси, пропіонілокси і формілокси). 4 Особливо переважними R замісниками є алкіли, переважно метил. Особливо переважним Х замісником є =О. Сполуки загальної формули I можуть бути синтезовані стандартними способами хімічного синтезу, включаючи способи, що використовуються для синтезу сполук, розкритих в патентах США 6861415, 6900193 і 020238, зміст яких включений в даний опис за допомогою посилань. Зокрема, для синтезу сполук згідно з даним винаходом можуть застосовуватися схеми синтезу, подані на фіг. 1, 2 і 3 в патенті США 6861415 і на фіг. 1-11 в патенті США, в поєднанні з методиками синтезу, відомими в даній галузі техніки, такими як описано в патенті США 6020328. Сполуки загальної формули I містять фенільну групу при C11, яка є заміщеною в орто-, 1 мета- або пара-положенні (тобто в положенні R загальної формули I) функціональною групою, яка не може метаболізуватися з отриманням первинного аміну після введенні сполуки. Наприклад, сполуки, що містять диметиламінофенільну групу в C11β положенні, піддаються деалкілуванню при введенні з отриманням первинного аміноаніліну (-феніл-NН2) в C11β положенні. Деалкілування проходить в дві стадії: на першій стадії диметиламінофенільна група піддається монодеметилуванню відносно швидко в монометиламінофеніл; на другій стадії в процесі відносно повільної реакції алкільна група, що залишилася, видаляється з утворенням первинного аміну. Без теоретичного обгрунтування вважається, що анілінові або заміщені анілінові групи (феніл-NRH) можуть виступати як реакційноздатні нуклеофіли, сприяючі несприятливим реакціям в печінці у пацієнтів, яким введені ці сполуки, за допомогою утворення білкових адуктів, зокрема, при довгостроковому введенні у відносно високих дозах. Відповідно, 1 1 R не є первинним, вторинним або третинним аміном. Крім того, R не є функціональною групою, відмінною від первинного, вторинного і третинного аміну, яка сама заміщена первинним, вторинним або третинним аміном. Таким чином, сполуки згідно з даним винаходом несподівано можуть застосовуватися для тривалого лікування гормонозалежних розладів. Деякі сполуки загальної формули I також можуть володіти підвищеною розчинністю в різних розчинниках, включаючи водні і спиртові (наприклад, етанол) розчинники. Зокрема, автори 1 даного винаходу виявили, що сполуки загальної формули I, що містять R , що означає ацил 2 (зокрема, СОСН3), алкілсульфініл або алкілсульфоніл в мета- (або орто-) положенні, і R , що означає алкоксигрупу, зокрема, метокси, можуть бути несподівано розчинними в різних полярних розчинниках (тобто мати діелектричну постійну, що дорівнює, щонайменше, 15), володіють сильною антипрогестатиновою активністю і мінімальною антиглюкокортикоїдною активністю, що робить їх особливо придатними як терапевтичні засоби для лікування прогестеронзалежних розладів. В іншому варіанті здійснення даний винахід стосується способів лікування прогестеронзалежного стану введенням однієї або більше сполук загальної формули I (або фармацевтичної композиції, що містить одну або більше сполук загальної формули I), як описано вище. Очікується, що сполуки загальної формули I не сприяють несприятливим печінковим реакціям у пацієнтів, які отримують дані сполуки, і, отже, відповідно до даного аспекту даного винаходу, вони можуть вводитися будь-яким способом, включаючи, але без обмеження, пероральне (тобто введення в шлунково-кишковий тракт), під’язикове/букальне, внутрішньосудинне, внутрішньом'язове, підшкірне, інгаляційне введення, введення в слизову оболонку (наприклад, ректальне або вагінальне) і місцеве введення. У переважному варіанті здійснення винаходу композицію, що містить одну або більше сполук загальної формули I, вводять перорально в дозі, щонайменше, 25 мг/доба, більш переважно, щонайменше, 50 мг/доба, для лікування гормонозалежного стану протягом періоду, рівного, щонайменше, 2, 3, 4, 5, 6, 7, 8, 9, 10 або більш місяцям. Способи Даний винахід надає також способи введення антипрогестинів для лікування гормонозалежних (наприклад, прогестеронзалежних) станів, які дозволяють уникнути печінкової токсичності. В одному варіанті здійснення даний винахід стосується способів лікування прогестеронзалежного стану шляхом перорального введення сполуки формули I, переважно в 7 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 дозі, щонайменше, 25 мг/доба, більш переважно, щонайменше, 50 мг/доба. Сполуки загальної формули I можуть вводитися перорально щодня (тобто, щонайменше, один раз на добу безперервно протягом декількох днів) протягом періоду, рівного, щонайменше, 2, 3, 4, 5, 6, 7, 8, 9, 10 або більше місяцям. У ще одному варіанті здійснення даний винахід стосується неперорального введення композиції, що містить одну або більше сполук загальної формули для лікування гормонозалежного (наприклад, прогестеронзалежного) стану. Цей аспект винаходу частково виникає з несподіваного виявлення того, що деякі 19-нортестостерон- або 19-норпрогестеронпохідні антипрогестини можуть виявляти токсичну дію відносно печінки при терапевтичних концентраціях, що обмежує їх клінічне застосування. Зокрема, було встановлено, що у пацієнтів при хронічному щоденному пероральному введенні (тобто при проковтуванні) терапевтичних доз антипрогестину/SPRM CDB-4124 виявляється печінкова токсичність. Великі кількості монодеметилованого метаболіту CDB-4124 виявлені внаслідок фармакокінетичних досліджень у пацієнтів після перорального введення CDB-4124, свідчачи про те, що CDB-4124 піддається значному метаболізму на першій стадії метаболізму в печінці, що зумовлює можливість пошкодження печінки. Сполуки формули I містять C11β замісники, які, як очікується, не утворюють білкових адуктів в печінці, не надають токсичної дії на печінку і, крім того, діють в обхід першої стадії метаболізму при непероральному введенні. У ще одному варіанті здійснення винаходу сполуки вводять неперорально в терапевтично ефективній дозі, яка є відносно низькою в порівнянні з терапевтично ефективною дозою сполуки, коли її вводять перорально. Наприклад, при введенні місцево на вагінальну слизову оболонку терапевтично ефективна доза може складати менше 50 мг/доба, менше 40 мг/доба, менше 30 мг/доба, менше 20 мг/доба, менше 10 мг/доба, менше 5 мг/доба, може знаходитися в інтервалі від 5 мг/доба до 50 мг/доба, в інтервалі від 5 мг/доба до 40 мг/доба, в інтервалі від 5 мг/доба до 30 мг/доба, в інтервалі від 5 мг/доба до 20 мг/доба або в інтервалі від 5 мг/доба до 10 мг/доба. В іншому пов'язаному варіанті здійснення винаходу ефективна кількість сполуки при місцевому введенні менше ефективної кількості, яка необхідна при системному введенні, наприклад, ефективна кількість при місцевому введенні у вагінальну слизову оболонку може бути в 2, 3, 4, 5, 6, 7, 8, 9 і навіть в 10 разів менше ефективної кількості при системному введенні для лікування ендометріозу, фіброми матки і інших захворювань в даній галузі. Очікується, що сполуки загальної формули I, які описані вище, виявляють знижену печінкову токсичність або не виявляють її взагалі при доставці як пероральним, так і непероральним способом, що робить їх придатними для застосування в лікуванні різних прогестеронзалежних станів при введенні будь-яким способом, включаючи, але без обмеження, пероральне, під’язикове/букальне, внутрішньосудинне, внутрішньом'язове, підшкірне, інгаляційне або введення на слизову оболонку (наприклад, ректальне або вагінальне) і місцеве введення. Непероральне введення сполук загальної формули I може знижувати печінкову токсичність (якщо вона має місце) в порівнянні з пероральним введенням цих же сполук. При непероральному способі введення сполуку переважно вводять способом, при якому дія здійснюється в обхід першої стадії метаболізму, таким як, але без обмеження, внутрішньовенне, внутрішньом'язове, під’язикове введення і введення на слизову оболонку (наприклад, вагінальне, внутрішньоматкове або ректальне). В одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту з раком молочної залози для лікування раку молочної залози. У переважному варіанті здійснення винаходу пацієнтом є жінка, і рак молочної залози експресує рецептор естрогену людини (hER) або рецептор прогестерону людини (hPR), більш переважно експресує hER і hPR. В іншому варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту, що страждає раком молочної залози з однією або більше пухлинами, резистентними до лікування антиестрогенами, для лікування раку молочної залози. Наприклад, сполуки згідно з даним винаходом можуть бути особливо корисні для лікування у пацієнтів резистентного до тамоксифену раку молочної залози. В іншому варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту, страждаючому розладом, вибраним з групи, яка складається з внутрішньопротокового раку молочної залози in situ (DCIS), слизеутворювального (колоїдного) раку, медулярного раку молочної залози, папілярного раку молочної залози, аденоїдно-кістозного раку (ACC), хвороби Педжета соска, запального захворювання молочної залози, фіброаденоми і фіброзно-кістозної мастопатії, для лікування вказаного розладу. У ще одному варіанті здійснення композицію згідно з даним винаходом вводять жінці, що проходить естрогенну терапію, для запобігання розвитку раку молочної залози у жінки. 8 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 60 У ще одному варіанті здійснення винаходу композицію вводять непероральним способом, який діє в обхід першої стадії метаболізму і який вибраний з групи, яка складається з під’язиково/букального, внутрішньосудинного, внутрішньом'язового, підшкірного, інгаляційного, введення в слизову оболонку (наприклад, ректальне, внутрішньоматкове або вагінальне) і місцевого застосування. У переважному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту з раком молочної залози в формі черезшкірної латки, гелю або мазі, яка наноситься безпосередньо на молочну залозу (наприклад, на сосок або білясоскове кільце) для лікування раку молочної залози. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту, потребуючому цього, для придушення пролиферации ендометрію. У переважному варіанті здійснення винаходу композицію згідно з винаходом вводять вагінально для придушення проліферації ендометрію. В іншому варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту, потребуючому цього, для лікування ендометріозу. У переважному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту вагінально для лікування ендометріозу. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючої цього, для лікування дисменореї. У переважному варіанті здійснення винаходу композицію згідно з винаходом вводять вагінально пацієнту, потребуючому цього, для лікування дисменореї. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючому цього, для лікування фіброми матки. У переважному варіанті здійснення винаходу композицію згідно з винаходом вагінально вводять пацієнту для лікування фіброми матки. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючому цього, для лікування аденоміозу. У переважному варіанті здійснення винаходу композицію згідно з винаходом вагінально вводять пацієнту для лікування аденоміозу. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючому цього, для лікування обмеженого розростання ендометріоїдної тканини. У переважному варіанті здійснення винаходу композицію згідно з винаходом вагінально вводять пацієнту для лікування обмеженого розростання ендометріоїдної тканини. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючому цього, для лікування раку яєчника. У переважному варіанті здійснення винаходу композицію згідно з винаходом вводять вагінально пацієнту для лікування раку яєчника. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючому цього, для лікування раку шийки матки. У переважному варіанті здійснення винаходу композицію згідно з винаходом вагінально вводять пацієнту для лікування раку шийки матки. В особливо переважному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту, страждаючому ендометріозом, дисменореєю, фібромою матки, аденоміозом, раком яєчників або раком шийки матки, непероральним способом введення для забезпечення місцевої доставки сполуки в уражену ділянку. Сполука може вводитися у відповідний препарат для такого неперорального місцевого застосування. Наприклад, сполука може вводитися, але без обмеження тільки цим способом введення, в препарат для депо-ін'єкції (наприклад, твердий або на масляній основі для підшкірного або внутрішньом'язового введення) для повільного вивільнення сполуки протягом тривалого періоду часу; препарат для внутрішньопіхвового введення, такий як вивільняюче гормон вагінальне кільце тороїдального перерізу; вагінальна свічка; вагінальна пілюля; внутрішньоматковий препарат, такий як внутрішньоматковий пристрій (IUD) або препарат у вигляді матриці; пристрій, що імплантується для доставки лікарського засобу; гель для місцевого застосування; або черезшкірна заплатка. Переважно, сполуку вводять в препарат в формі вагінального кільця, маткового препарата-депо, вагінальної свічки або т.п., який підтримує повільне, але безперервне вивільнення антипрогестину, діючого місцево, але не системно. У переважному варіанті здійснення винаходу ендометріоз, дисменорея, фіброми матки, аденоміоз, рак яєчника або рак шийки матки лікують інтравагінальним введенням препарату, що містить сполуку загальної формули I, у піхву пацієнту, потребуючому такого лікування. Потрібно розуміти, що сполука вбирається слизовою оболонкою піхви, яка безпосередньо контактує з інтравагінальним препаратом. Інтравагінальне кільце є переважним препаратом для інтравагінального введення і може розроблятися для забезпечення безперервного вивільнення 9 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 60 антипрогестину у піхві. Період введення може складати, наприклад, від 1 до 3 місяців, після чого препарат може бути замінений новим препаратом для забезпечення безперервного тривалого лікування. У ще одному переважному варіанті здійснення винаходу ендометріоз, дисменорею, фіброму матки, аденоміоз, рак яєчника або рак шийки матки лікують введенням вагінальної пілюлі або вагінальної свічки, що містить сполуку загальної формули I, у піхву пацієнту, потребуючому такого лікування. Вагінальна пілюля і вагінальна свічка можуть бути отримані добре відомими способами з використанням добавок, таких як розріджувач, зв'язуючий агент і основа для свічки, які традиційно використовуються при отриманні таких препаратів. У ще одному переважному варіанті здійснення винаходу ендометріоз, дисменорею, фіброми матки, аденоміоз, рак яєчника або рак шийки матки лікують введенням внутрішьоматкового препарату, що містить сполуку загальної формули I, в порожнину матки пацієнта, потребуючому такого лікування. Внутрішьоматковий препарат може являти собою препарат-матрицю, який забезпечує безперервне вивільнення сполуки в матку. Період введення внутрішьоматкового препарату може становити приблизно 6 місяців, після чого препарат може бути видалений і введений новий препарат, так що досягається тривале лікування розладу. Внутрішьоматковий препарат може бути отриманий стандартними способами з використанням основи матриці (наприклад, полімеру, включаючи, але без обмеження, силіконовий каучук, етиленвінілацетат, етилцелюлозу, карбоксиметилетилцелюлозу, поліетиленгліколь, полівініловий спирт, карбоксивініловий полімер або колаген), інертного внутрішньоматкового пристрою і необов'язково відповідного зшиваючого агента і/або агента, сприяючого вивільненню, такої як полісорбат 60, полісорбат 80, гліцерин, ізопропілпальмітат і ізопропілміристат. Препаратматриця може бути одношаровим або двошаровим. Форма внутрішьоматкового препарату не обмежена, але є відповідною для місцевого введення в матку. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючому цього, для виклику менструації. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючому цього, для стимулювання пологів. У ще одному варіанті здійснення винаходу композицію згідно з винаходом вводять пацієнту жіночої статі, потребуючому цього, як контрацептив. Композиції, що містять сполуку загальної формули I, як описано вище, можуть бути придатними для тривалого перорального введення, оскільки очікується, що ці сполуки виявляють знижену печінкову токсичність або не виявляють печінкової токсичності. Альтернативно, сполука загальної формули I може постійно вводиться способом, який виключає першу стадію метаболізму і, отже, знижує або виключає його метаболізм печінкою. Таким чином, композиції згідно з винаходом можуть вводитися постійно, не викликаючи токсичної дії на печінку. Переважно, сполуки володіють тільки низькою зв'язуючою активністю відносно глюкокортикоїдного рецептора і, отже, не впливають несприятливим чином на функції глюкокортикоїдного рецептора. Отже, композиції згідно з винаходом можуть також асоціюватися із зниженими побічними ефектами, такими як перепади настрою, втома і втрата маси, які звичайно мають місце, коли використовуються антипрогестини з високою спорідненістю до глюкокортикоїдних рецепторів. Переважно, сполуки згідно з даним винаходом володіють низькою або по суті не володіють естрогенною, протиестрогенною і протиандрогенною активністю. В одному варіанті здійснення композицію згідно з винаходом, що містить сполуку загальної формули I в кількості, ефективній для лікування гормонозалежного стану, вводять протягом періоду введення, що становить, щонайменше, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 або більше днів. Композицію також можна вводити протягом періоду введення, що становить, щонайменше, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 або більше місяців. Композицію також можна вводити протягом періоду, що становить, щонайменше, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 або більше років. Протягом періоду введення композицію можна вводити щодня або періодично, наприклад, через день, раз на місяць і т.п. Композицію також можна вводити з перервами. Наприклад, композицію можна вводити протягом періоду, що становить 1, 2, 3, 4, 5 або більше місяців з подальшою перервою введення, і потім знову вводити протягом періоду, що становить 1, 2, 3, 4, 5 або більше місяців, і т.д. В одному варіанті здійснення композицію вводять з перервами, так що у суб'єкта спостерігається менструація протягом, щонайменше, одного періоду перерви введення. Очікується, що даний підхід дозволяє уникнути несприятливих ефектів, пов'язаних з потовщеним або застійним ендометрієм, які можуть супроводжувати тривале лікування антагоністами прогестерону, таких як кров'янисті виділення, раптова кровотеча, 10 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 60 гіперпроліферація ендометрію або рак ендометрію. Щонайменше, один і переважно кожний період перерви введення має тривалість, достатню для настання у суб'єкта менструації. Більш переважно, у суб'єкта спостерігається менструація протягом кожного періоду переривання введення. В особливо переважному варіанті здійснення винаходу композицію вводять щодня протягом чотирьох місяців з подальшою перервою введення, протягом якого у пацієнта наступає менструація, потім протягом ще одного періоду введення, що становить чотири місяці, і т.д. В одному варіанті здійснення винаходу композиції згідно з винаходом містять фармацевтично прийнятну сіль сполуки загальної формули I, як описано вище. У залежності від технологічних умов сольова сполука може бути представлена в нейтральній або в сольовій формі. Сольові форми включають гідрати і інші сольвати, а також кристалічні поліморфи. Вільні основи, а також солі цих кінцевих продуктів можуть застосовуватися згідно з даним винаходом. Кислотно-адитивні солі можуть бути перетворені відомими способами у вільну основу з використанням основних реагентів, таких як луги, або іонним обміном. Отримана вільна основа також може утворювати солі з органічними або неорганічними кислотами. При отриманні кислотно-адитивних солей переважно використовують кислоти, які утворюють відповідні фармацевтично прийнятні солі. Прикладами таких кислот є хлористоводнева кислота, сірчана кислота, фосфорна кислота, азотна кислота, аліфатична кислота, аліциклічні карбонові або сульфонові кислоти, такі як мурашина кислота, оцтова кислота, пропіонова кислота, янтарна кислота, гліколева кислота, молочна кислота, яблучна кислота, винна кислота, лимонна кислота, аскорбінова кислота, глюконова кислота, фумарова кислота, малеїнова кислота, гідроксималеїнова кислота, пірувінова кислота, аспаргінова кислота, глютамінова кислота, п-гідроксибензойна кислота, памова кислота, етансульфонова кислота, гідроксіетансульфонова кислота, фенілоцтова кислота, мигдалева кислота, галогенбензолсульфонова кислота, толуолсульфонова кислота, галактарова кислота, галактуронова кислота або нафталінсульфонова кислота. Все кристалічні поліморфи можуть бути використані згідно з даним винаходом. Основно-адитивні солі також можуть бути використані згідно з даним винаходом і можуть бути отримані шляхом приведення в контакт вільної кислоти з достатньою кількістю бажаної основи для отримання солі стандартним чином. Вільна кислотна форма може бути регенерована шляхом приведення в контакт сольової форми з кислотою і виділенням вільної кислоти стандартним чином. Фармацевтично прийнятні основно-адитивні солі утворюються з металами або амінами, такими як лужні і лужноземельні метали і органічні аміни. Прикладами металів, що застосовуються як катіони, є натрій, калій, кальцій, магній і т.п. Прикладами відповідних амінів є амінокислоти, такі як лізин, холін, діетаноламін, етилендіамін, Nметилглюкамін і т.п. Композиції згідно з даним винаходом можуть бути отримані в лікарській формі, що включає дозовану одиницю або дозовані одиниці, придатні для перорального, під’язикового/букального, парентерального, черезшкірного введення, введення через слизову оболонку (наприклад, вагінальне або ректальне) або місцевого введення. Парентеральне введення включає, але без обмеження, внутрішньовенне, внутрішньоартеріальне, інтраперітонеальне, підшкірне, внутрішньом'язове, інтратекальне і внутрішньосуглобне введення. У ще одному варіанті здійснення винаходу композиції згідно з даним винаходом отримані в формі свічки для ректального введення, які можуть містити основу свічки, включаючи, але без обмеження, масло какао або гліцериди. У ще одному варіанті здійснення винаходу композиції згідно з даним винаходом містять сполуку загальної формули I і біоадгезивний носій, такий як носій, описаний в патенті США 4615697, зміст якого включений в даний опис за допомогою посилання. Біоадгезивний носій може бути в формі гелю, крему, таблетки, пілюлі, капсули, свічки або плівок або в будь-якій іншій фармацевтично прийнятній формі, яка буде прилипати до слизової оболонки піхви. Композиції згідно з даним винаходом також можуть бути виготовлені в формі, відповідній для введення інгаляцією, яка може являти собою, але без обмеження, розчин, суспензію або емульсію, яка може вводитися у вигляді сухого порошку або в формі аерозолю з використанням газу-витискувача в аерозольній упаковці, такого як дихлорфторметан або трихлорфторметан. Композиції згідно з даним винаходом також можуть бути виготовлені в формі, відповідній для черезшкірної доставки, наприклад в формі крему, мазі, лосьйону, пасти, гелю, медичного пластиру, заплатки або мембран. Такі композиції можуть містити будь-які відповідні ексципієнти, наприклад добавки, що підвищують проникність, і т.п. Композиції згідно з даним винаходом також можуть бути виготовлені в формі, відповідній для парентерального введення, включаючи, але без обмеження, введення ін'єкцією або 11 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 60 безперервним вливанням. Препарати для ін'єкції можуть бути в формі суспензій, розчинів або емульсій в масляних або водних розріджувачах. Такі композиції також можуть постачатися в формі порошку для розбавлення відповідним розріджувачем, включаючи, але без обмеження, стерильну апірогенну воду, WFI і т.п. Композиції згідно з даним винаходом також можуть бути виготовлені в формі депопрепарату, який може вводитися імплантацією або внутрішньом'язовою ін'єкцією. Такі композиції можуть вводитися в препарат з відповідними полімерними або гідрофобними матеріалами (наприклад, у вигляді емульсії у відповідному маслі), іонообмінними смолами або у вигляді паганорозчинних похідних (наприклад, у вигляді паганорозчинної солі). Композиції згідно з даним винаходом також можуть бути виготовлені у вигляді ліпосомного препарату. Ліпосомні препарати можуть включати ліпосоми, які проникають в задані клітини або клітини рогового шару і зливаються з клітинною мембраною, доставляючи, таким чином вміст ліпосоми в клітину. Наприклад, можуть застосовуватися ліпосоми, описані в патенті США 5077211 (Yarosh), в патенті США 4621023 (Redziniak et al.) або в патенті США 4508703 (Redziniak et al.). Композиція згідно з винаходом може бути в твердій лікарській формі дозованої одиниці, такій як таблетки (наприклад, суспензійні таблетки, суспензійні таблетки для розкушування, таблетки швидкої дисперсії, жувальні таблетки, шипучі таблетки, двошарові таблетки і т.д.), таблетки у вигляді капсули, капсули (наприклад, м'які або тверді желатинові капсули), порошок (наприклад, розфасований порошок, порошок для отримання дисперсії або шипучий порошок), коржики, саше, облатки, пастилки, пелети, гранули, мікрогранули, інкапсульовані мікрогранули, порошкові аерозольні препарати або будь-яка інша тверда лікарська форма, відповідним чином адаптована для введення. Відповідні рідкі лікарські форми композиції згідно з винаходом включають розчини, водні або масляні суспензії, еліксири, сиропи, емульсії, рідкі аерозольні препарати, гелі, креми, мазі і т.д. Такі композиції також можуть бути виготовлені в формі сухого продукту для змішування з водою або іншим відповідним розріджувачем перед застосуванням. В одному варіанті здійснення рідкі або напівтверді композиції зберігаються в закритому контейнері при кімнатній температурі, при охолоджуванні (наприклад, при температурі приблизно 5-10°С) або при температурі замерзання протягом періоду приблизно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 або 12 місяців і зберігають, щонайменше, приблизно 90%, щонайменше, приблизно 92,5%, щонайменше, приблизно 95% або, щонайменше, приблизно 97,5% початкової антипрогестинової сполуки.) Композиції згідно з винаходом можуть, якщо це бажане, містити один або більше фармацевтично прийнятних ексципієнтів. Термін «ексципієнт» в даному описі означає будь-яку речовину, яка сама по собі не є терапевтичним засобом, але використовується як носій або розріджувач для доставки терапевтичного агента суб'єкту або додається до фармацевтичної композиції для спрощення роботи з нею або поліпшення її характеристик зберігання, або для полегшення процесу отримання препарату композиції стандартної дози. Приклади ексципієнтів включають, але без обмеження, розріджувачі, добавки, що викликають дезінтеграцію, зв'язуючі агенти, адгезиви (наприклад, біологічні адгезиви), змочувальні агенти, лубриканти, добавки, що підвищують ковзання, добавки, що модифікують поверхню, або поверхнево-активні речовини, віддушки, суспендуючі агенти, емульгатори, неводні розріджувачі, консерванти, антиоксиданти, адгезиви, добавки, регулюючі pH і осмотичний тиск (наприклад, буферні добавки), захисні добавки, загусники, підсолоджувачі, смакові добавки, добавки, що приховують смак, барвники, пігменти або барвники, добавки, що підвищують проникаючу здатність, і речовини, що додаються для поліпшення зовнішнього вигляду композиції. Композиції згідно з даним винаходом можуть вводитися будь-яким способом, включаючи, але без обмеження, пероральне, парентеральне, під’язикове, черезшкірне, ректальне введення, введення в слизову оболонку, місцеве введення, введення за допомогою інгаляції, букальне введення або їх комбінації. Парентеральне введення включає, але без обмеження, внутрішньовенне, внутрішньоартеріальне, інтраперитонеальне, підшкріне, внутрішньом'язове, інтратекальне, внутрішньосуглобне, інтрацистернальне і внутрішньошлуночкове введення. Терапевтично ефективна кількість композиції, необхідна для застосування в терапевтичному лікуванні, змінюється в залежності від періоду часу, протягом якого бажана дана активність, віку і стану пацієнта, що підлягає лікуванню, а також деяких інших чинників, і, в кінцевому результаті, визначається лікуючим лікарем. Однак звичайно, дози, що застосовуються для лікування людини, знаходяться в інтервалі приблизно від 0,001 мг/мг до приблизно 500 мг/кг на добу, наприклад, приблизно від 1 мг/кг до приблизно 1 мг/кг на добу або приблизно від 1 мкг/мг до приблизно 100 мкг/кг на добу. Для найбільш великих ссавців загальна 12 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 60 добова доза складає приблизно від 1 до 100 мг, переважно приблизно від 2 до 80 мг. Схема лікування може коректуватися для забезпечення оптимальної терапевтичної відповіді. Бажана доза може стандартно вводитися в разовій дозі або поділятися на множинні дози, що вводяться через відповідні інтервали, наприклад, вводитися в двох, трьох, чотирьох або більшій кількості невеликих доз на добу. Звичайно, композиція згідно з винаходом може вводитися суб'єкту для забезпечення суб'єкта антипрогестином в кількості приблизно від 1 мкг/кг до приблизно 1 мг/кг маси тіла, наприклад, приблизно 1 мкг/кг, приблизно 25 мкг/кг, приблизно 50 мкг/кг, приблизно 75 мкг/кг, приблизно 100 мкг/кг, приблизно 125 мкг/кг, приблизно 150 мкг кг, приблизно 175 мкг/кг, приблизно 200 мкг кг, приблизно 225 мкг/кг, приблизно 250 мкг/кг, приблизно 275 мкг/кг, приблизно 300 мкг/кг, приблизно 325 мкг/кг, приблизно 350 мкг/кг, приблизно 375 мкг/кг, приблизно 400 мкг/кг, приблизно 425 мкг/кг, приблизно 450 мкг/кг, приблизно 475 мкг кг, приблизно 500 мкг/кг, приблизно 525 мкг кг, приблизно 550 мкг/кг, приблизно 575 мкг/кг, приблизно 600 мкг/кг, приблизно 625 мкг/кг, приблизно 650 мкг/кг, приблизно 675 мкг/кг, приблизно 700 мкг/кг, приблизно 725 мкг/кг, приблизно 750 мкг/кг, приблизно 775 мкг кг, приблизно 800 мкг/кг, приблизно 825 мкг/кг, приблизно 850 мкг/кг, приблизно 875 мкг/кг, приблизно 900 мкг/кг, приблизно 925 мкг/кг, приблизно 950 мкг/кг, приблизно 975 мкг/кг або приблизно 1 мг/кг маси тіла. Пацієнти, одержуючі лікування за допомогою композицій згідно з даним винаходом, повинні в плановому порядку контролювати рівні естрогену і глюкокортикоїдів в сироватці крові. Далі для кращого розуміння винаходу представлені приклади, які, однак, не обмежують галузь даного винаходу. Приклад 1. Кількісне визначення in vitro афінності зв’язування антипрогестинів Біологічні випробування для визначення конкурентного зв’язування проводили з використанням цитозольних препаратів. Цитозол для кількісного визначення зв’язування з прогестероновим рецептором (PR) і глюкокортикоїдним рецептором (GR) кролика отримували з матки або вилочкової залози, відповідно, естрадіол-сенсибілізованних незрілих кроликів. Для зв’язування з матковим PR кролика готували препарат цитозолу, що містить PR матки кролика, в TEGMD буфері (10 мM Tris, pH 7,2, 1,5 мM EDTA, 0,2 мM молібдату натрію, 10% гліцерину, 1 мM DTT) і отриманий 3 препарат інкубували з 6 нM 1,2-[ H]прогестерону (NEN Life Science Products; 52 Ci/ммоль); сполуки, що тестуються, додавали в концентраціях від 2 до 100 нM. Для зв’язування з GR вилочкової залози кролика препарат цитозолу приготовляли в TEGMD буфері і отриманий 3 препарат інкубували з 6 нM 6,7-[ H]dex (NEN; 35 або 40 Ci/ммоль); сполуки, що тестуються, додавали в концентраціях від 2 до 100 нM. Для кількісного визначення зв’язування з прогестероновим рецептором-А (rhPR-A) або прогестероновим рецептором-В (rhPR-B) людини приготовляли цитозольні екстракти Sf9 клітин комах, інфікованих рекомбінантним бакуловірусом і експресуючих hPR-A або hPR-B. Sf9 цитозол (приготований в TEGMD буфері, що містить наступні інгібітори протеази: бацитрацин при 100 мкг/мл, апротинін при 2 мкг/мл, лейпептин при 94 мкг/мл, пепстатин А при 200 мкг/мл), 3 інкубували з 6,8 нM 1,2,6,7,16,17-[ H]прогестерону (NEN; 143 Ci/ммоль); сполуки, що тестуються, додавали в концентраціях від 1 до 100 нM. 3 Після інкубування протягом ночі при 4°С пов'язані і непов'язані [ H]-стероїди розділяли додаванням деревного вугілля з декстрановим покриттям і центрифугували при 2100×g протягом 15 хвилин при 4°С. Супернатанти від GR аналізів декантували і обраховували в рідинному сцинтиляційному лічильнику Beckman LS-1800. Супернатанти, що містять PR, за допомогою піпеток переносили в 24-ямкові мікропланшети і обраховували в рідкому сцинтиляційному лічильнику Packard TopCount. Число імпульсів на хвилину (cpm) вводять в Packard's RIASmart™ для розрахунку значень EC50. Відносну афінність зв’язування для кожної сполуки, що тестується, розраховували таким чином: (EC 50 еталону)/(EC50 конкурента)×100. Еталоном для дослідів PR зв’язування є P4, стандартом для дослідів GR зв’язування є dex. Приклад 2. Кількісне визначення протиглюкокортикоїдної активності і антагоністичної активності у відношенні прогестерону in vivo. Для кількісного визначення in vivo антагоністичної активності сполук, що тестуються, відносно прогестерону T47D-CO клітини раку молочної залози, вирощені в моношаровій культурі в DMEM, що не містить фенолового червоного, забезпеченою 10% фетальною телячою сироваткою (FBS), 10 Од./мл пеніциліну G і 10 мкг/мл стрептоміцину сульфату, трансфікували чутливою до гормону плазмідою репортерного гена, наприклад, PRE2-tk-LUC, що містить дві копії елемента прогестинової/глюкокортикоїдної/андрогенної відповіді, розташованого вище промотору тимідинкінази (tk) і гена-репортера люциферази (LUC) світляка. Трансфіковані 13 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітини T47D-CO інкубували в максимальній (попередньо визначеній) стимулюючій концентрації прогестерону (наприклад, Р4) за відсутності і в присутності сполуки, що тестується, при її різних концентраціях протягом 20 годин. LUC активність визначали з використанням системи Promega's Luciferase Assay System і обчислювали IC50 сполуки, що тестується. Для кількісного визначення глюкокортикоїдної антагоністичної активності in vivo HepG2 клітини гепатобластоми людини, вирощені в моношаровій культурі DMEM, що не містить фенолового червоного, забезпеченої 10% FBS і ручкою/стрептококом (pen/strep), котрансфікували відповідною чутливою до гормону плазмідою репортерного гена, такою як PRE2-tk-LUC і плазміда GR екпресії. Трансфіковані HepG2 клітини інкубували в максимальній (попередньо визначеній) стимулюючій концентрації дексаметазону за відсутності або в присутності різних концентрацій сполуки, що тестується, протягом 20 годин. IC 50 сполуки, що тестується, визначали зміною LUC активності. Приклад 3. Хронічне щоденне введення CDB-2124, асоційоване з токсичними печінковими ефектами Первинні дослідження, що проводяться з Proellex (аkа CDB-4124), показали ефективність препарату в кожній добовій дозі, що тестується. Розробка Proellex була зосереджена на двох найбільш високих дозах, 25 мг і 50 мг, на основі даних про те, що більш високі дози придушували потовщення ендометрію і можливість маткових кровотеч. Ні доклінічні випробування на тваринах, ні невеликі дослідження на жінках в Європі в більш високих дозах тривалістю до шести місяців не прогнозували печінкової токсичності, яка виявилася на III фазі клінічних досліджень, проведених в США на різних представниках населення. Proellex, що доставляється перорально в добовій дозі 50 мг/день, показав сильну токсичну дію на печінку у приблизно 3-4% жінок, що приймали дану дозу. При прийомі 12,5 мг несприятливого впливу на печінку, відмінного від плацебо, не спостерігалося. Максимальні концентрації CDB-4124 і його монодеметилованого метаболіту для дози 12,5 мг становили 25% від концентрації дози 50 мг. Всі токсичні ефекти були усунені у тих жінок, які поверталися для подальшого вивчення безпеки віддалених результатів, включаючи тих пацієнтів, у яких розвинулися серйозні побічні ефекти (SAE), пов'язані з печінкою. Такі ефекти, що спостерігаються, коли Proellex вводився перорально в дозі 50 мг/доба, були значно нижче по частоті і тяжкості при введенні Proellex в дозі 25 мг/доба. Це спостереження було додатково підкріплене тим фактом, що в дозі 25 мг/доба були успішно досягнуті більш тривалі експозиції, ніж при дозі 50 мг/доба, підтверджуючи, що тривала експозиція в більш низьких дозах необов'язково приводить до такої ж токсичності, що спостерігалася в дозі 50 мг/доба. У цей час проведені подвійні сліпі клінічні випробування і випробування з відкритою міткою, в яких взяли участь більше 600 пацієнтів, в тому числі жінки з підтвердженими випадками ендометріозу або міоми матки, яким щодня протягом місяця перорально вводили капсули CDB4124 (Proellex) з дозами 12,5 мг, 25 мг або 50 мг. Серед цих пацієнток близько 500 отримували Proellex і близько 130 отримували плацебо. З пацієнток, одержуючих Proellex, близько 190 отримували дозу 50 мг CDB-4124 на добу, близько 260 отримували дозу 25 мг CDB-4124 на добу і близько 55 отримували дозу 12,5 мг CDB-4124 на добу. У пацієнток, що беруть участь у випробуванні, контролювалися ферменти печінки. Рівнем ферменту печінки, при якому клінічні випробування повинні були припинятися, була активність печінкових амінотрансфераз, яка дорівнювала трьом верхнім кордонам норми (ULN) або більше (>3×ULN).) Під час клінічних випробувань било виявлено тринадцять пацієнток, у яких підвищення активності печінкових ферментів становило 3×ULN, але це було підтверджене в повторному тесті протягом 48 годин тільки у дев'яти пацієнтів. Серед дев'яти пацієнток з підтвердженим підвищенням активності печінкових ферментів до рівня >3×ULN у семи підвищення активності було досить серйозним, щоб ці результати були представлені в FDA як SAE. Одна з цих семи пацієнток отримувала дозу 25 мг CDB-4124 на добу, і інші шість отримували дозу 50 мг CDB4124 на добу. Активність печінкових ферментів на рівні >3×ULN зберігалася у п'яти з дев'яти пацієнток з підтвердженим підвищенням активності печінкових ферментів до рівня >3×ULN. Ці п'ять пацієнтів раніше отримували дозу 50 мг на добу. Одна з цих пацієнток в цей час перорально отримує лікарські препарати для лікування печінки. Клінічні випробування, що включають введення CDB-4124 у всіх дозах, добровільно припинялися після виявлення цих SAE, і пацієнтів згодом розміщували в клінічних умовах Управлінням по контролю за продуктами і медикаменти США з міркувань безпеки. Фармакокінетичні дослідження, проведені з участю пацієнтів, виявили високі Cmax і Тmax протягом 1-2 години після введення. Були також виявлені великі кількості монодеметилованого метаболіту CDB-4124, явно вказуючи на першу стадію метаболізму антипрогестину. При 14 UA 113283 C2 5 10 15 20 25 30 35 40 45 50 55 отриманні додаткових доказів першої стадії метаболізму було встановлено, що первинні культури гепатоцитів людини і тварин швидко дають монодеметилований метаболіт CDB-4124. Метаболізм CDB-4124 в печінці зумовлює можливість пошкодження печінки і значно знижує концентрацію антипрогестину до того, як він досягне великого кола кровообігу. Таким чином, альтернативні способи введення антипрогестинів, які дозволяють обійти першу стадію метаболізму, такі як, але без обмеження, внутрішньовенне, внутрішньом'язове і під’язикове, повинні дозволити антипрогестинам абсорбуватися безпосередньо у велике коло кровообігу і тим самим забезпечити спосіб лікування прогестин-залежних станів без токсичності для печінки. При способах введення, які дозволяють уникнути першої стадії метаболізму, може також зажадатися менше в порівнянні з пероральним введенням лікарського засобу на дозу для досягнення такого ж терапевтичного ефекту. Доклінічні дослідження проводили на пухлинах молочної залози, індукованих 7,12диметилбенз(а)антраценом (DMBA). Ці дослідження показали ефективність непероральних способів доставки CDB-4124. Зокрема, доставка CDB-4124 підшкірною ін'єкцією була ефективною в зниженні кількості і розміру DMBA-індукованих пухлин молочної залози, забезпечуючи доказ даної концепції. Приклад 4. Вагінальна доставка CDB-4124 і CDB-4453 знижує системні концентрації в порівнянні з пероральним введенням і діє в обхід першої стадії метаболізму Собакам породи бігль вводили CDB-4124 або CDB-4453 (монодеметилований метаболіт CDB-4124) в дозах 25 мг в препаратах в формі тонкоподрібненого порошку або в формі вагінальних супозиторіїв. Як показано на фіг. 1, CDB-4124 і CDB-4453 при пероральному введенні у вигляді тонкоподрібненого порошку швидко метаболізувалися після досягнення пікової концентрації в плазмі (Cmax). У протилежність цьому, при місцевому введенні цих же сполук в формі вагінальних супозиторіїв лікарські препарати метаболізувалися повільно, і пікові концентрації в плазмі (Cmax) були відносно низькими. Крім того, системний вплив препарату був значно більш низьким при місцевому введенні (порівняйте AUC для CDB-4124 і CDB-4453 при вагінальному і пероральному введенні). Максимальні циркулюючі концентрації (Cmax) CDB-4124, отримані після вагінального введення біглям, екстраполювали на людей для доз 12,5 мг, 25 мг і 50 мг, що дійсно вводяться під час клінічних досліджень III фази. Як можна бачити з фіг. 2, прогностична C max для вагінального введення людям CDB-4124 в дозі 12,5 мг становила приблизно 6,5% цієї ж дози при пероральному введенні, і прогностична Cmax для вагінального введення CDB-4124 в дозі 50 мг у людей становила приблизно 2% такої самої дози при пероральному введенні. Приклад 5. Біологічна доступність CDB-4124 в матці є дивно низькою при пероральному введенні Для визначення, чи можуть низькі циркулюючі рівні CDB-4124 при місцевому введенні надавати яку-небудь дію на прогнозовану ефективність проводили анти-клауберговське дослідження, в якому незрілим естрадіол-сенсибілізованим кроликам вводили спільно прогестерон і CDB-4124 в різних дозах підшкірним або пероральним способами введення. Щонайменше, 3 висококваліфікованих фахівця оцінювали матку кролика матки на зростання залози на комплексний і загальний прогестерон-індукований «розвиток». Аналізували інгібування (в процентах) прогестерон-індукованої проліферації ендометрію для кожної дози. Як показано на фіг. 3, максимальне інгібування спостерігалося в дозі менше 1 мг/кг при підшкірному введенні CDB-4124. Проте, для максимального гальмування необхідно приблизно 8-кратне збільшення дози при пероральному введенні (тобто 8 мг/кг). Важливе те, що 8 мг/кг близько відповідає дозі 50 мг/доба CDB-4124, що вводиться в пацієнтам-жінкам, як описано в прикладі 3. Це показує, що ефективна місцева концентрація CDB-4124 на ендометрії значно знижується, коли препарат вводиться перорально, найвірогідніше через першу стадію метаболізму препарату. Відповідно, для досягнення терапевтичного ефекту, наприклад, для свідчення, локалізованого в зоні таза і статевих шляхів, при пероральному введенні потрібні відносно високі дози CDB-4124, відповідно близькі до дозування CDB-4124, при якому в прикладі 3 спостерігалися токсичні ефекти. Проводили ще одне антиклауберговське дослідження, при якому незрілим естрадіолсенсибілізованим кроликам вводили тільки прогестерон (як контроль розріджувач) або спільно вводили прогестерон і CDB-4124 в трьох різних дозах при вагінальному або пероральному введенні. Аналізували інгібування прогестерон-індукованої проліферації ендометрію в кожній дозі. На фіг. 3 представлене зниження McPhail індексу після збільшення доз CDB-4124, що вводяться кожним способом. Максимальне інгібування (тобто зниження показника McPhail до 1,5) спостерігалося при вагінальному введенні 0,2 мг/кг CDB-4124 в порівнянні з 0,8 мг/кг при 15 UA 113283 C2 5 10 15 20 25 пероральному введенні. Результати даного дослідження показали, що при вагінальній доставці дія CDB-4124 в чотири рази перевершувала ефект такої ж дози, введеної перорально. Загалом, дані показали, що антипрогестин можна вводити вагінально в дозі, в чотири рази меншій ефективної дози при пероральному введенні, при цьому досягається тільки мала частка максимальних циркулюючих концентрацій в порівнянні з пероральним введенням, що дозволяє уникнути печінкової токсичності. Наприклад, еквівалентна антипрогестагенна активність CDB4124 на матці спостерігається в дозі 50 мг при пероральному введенні і в дозі 12,5 мг при вагінальному введенні; однак, Cmax, що спостерігається в 12,5 мг при вагінальному введенні, становить всього 2% концентрації, що спостерігається при пероральному введенні дози 50 мг. Відносно висока місцева концентрація препарату, що досягається при місцевому введенні, дозволяє при відносно низькій дозі препарату (в порівнянні з пероральним введенням) досягнути терапевтичного ефекту для показання, локалізованого в зоні таза і в статевих шляхах (наприклад, ендометріоз, міома матки і рак яєчників). Внаслідок того, що висока концентрація лікарського препарату в системі кровообігу (і зв'язаною першою стадією метаболізму лікарського засобу) не досягається при місцевому введенні, усунення важкої печінкової токсичності, що спостерігається у незначного процента пацієнтів після перорального введення CDB-4124 в дозах 25 і 50 мг в попередніх клінічних дослідженнях III фази, є несподіваною перевагою місцевого введення препарата. Аналогічні переваги повинні мати місце при місцевому введенні інших антипрогестинів. 1 2 Приклад 6. Вплив R і R замісників на термодинамічну розчинність Проводили порівняльне дослідження термодинамічної розчинності вказаних нижче сполук і СDB-4124: 1 21-метокси-17-ацетокси-11-(3-ацетилфеніл)-19-норпрегна-4,9-дієн-3,20-діон (де R 2 3 знаходиться в мета-положенні і являє собою -СОСН3, R являє собою метокси, R являє собою 4 ацетокси, R являє собою метил, і Х являє собою =О) (CDB-4239) структурної формули, представленої нижче: 1 30 17-ацетокси-11-(3-ацетилфеніл)-19-норпрегна-4,9-дієн-3,20-діон (де R знаходиться в 2 3 мета-положенні і являє собою -СОСН3, R являє собою атом водню, R являє собою ацетокси, 4 R являє собою метил, і Х являє собою =О) (REP-4510) структурної формули, представленої нижче: 1 35 і 21-ацетокси-17-ацетокси-11-(3-ацетилфеніл)-19-норпрегна-4,9-дієн-3,20-діон (де R 2 3 4 знаходиться в мета-положенні і являє собою -СОСН3, R і R являє собою ацетокси, R являє собою метил, і Х являє собою =О) (CDB-4241) структурної формули, представленої нижче: 16 UA 113283 C2 Встановлено, що CDB-4239, CDB-4241 і REP-4510 є твердими кристалічними речовинами з наступними характеристиками: Сполука CDB-4239 CDB-4241 REP-4510 5 10 Початкова температура (С) 105,5 208,2 261,5 ДСК Піковий максимум (С) 110,1 209,5 262,9 Ентальпія (Дж/г) 7,9 55,3 62,9 TG Втрата маси (%) до 120С 1,0 0,1 0,1 Стисло, 300 мкл розчинника (етанол, 0,1 М HCl або дистильована Н 2О) додають до 14-16 мг твердої сполуки (5 паралельних змін на зразок, на розчинник, середні концентрації 93-107 мМ). Суміші струшують при 37°С проятгом 24 і 72 годин. Концентрації фільтратів визначають рідинною хроматографією з УФ детектором (РХ/УФ) з 3-точковим калібруванням. У кінці вимірювань не спостерігалося значного розкладання зразків. Результати представлені в таблицях 1 і 2. Таблиця 1 Сполука REP-4510 CDB-4241 CDB-4239 CDB-4124 Етанол 3,30 мМ 26,27 мМ >98,15 мМ* 36,80 мМ 0,08 2,05 6,24 24 години 0,1М HCl Середн. SD 0,50 мкМ 0,03 3,21 мкМ 0,12 140,40 мкМ 2,30 53,09 мкМ 1,92 Дистильована вода Середн. SD 0,52 мкМ 0,04 3,08 мкМ 0,22 140,60 мкМ 0,50 7,10 мкМ 0,50 * сполука повністю розчинена Таблиця 2 Сполука REP-4510 CDB-4241 CDB-4239 CDB-4124 Етанол Середн. 2,90 мМ 21,58 мМ >100,10 мМ* 34,10 мМ SD 0,09 2,76 5,99 72 години 0,1М HCl Середн. SD 0,45 мкМ 0,01 3,90 мкМ 0,16 110,20 мкМ 11,80 56,12 мкМ 0,73 Дистильована вода Середн. SD 0,44 мкМ 0,02 3,05 мкМ 0,14 54,80 мкМ 4,20 3,20 мкМ 0,60 * сполука повністю розчинена 15 20 Кристалічну форму досліджують методом порошкової рентгенографії (XRPD) після відновлення суспензії через 24 і 72 години. Яких-небудь змін із сполуками, що досліджуються, в процесі суспендування суспензії не спостерігалося. Виявлене зниження тенденції до водного і 1,0 М HCl розчинників у CDB-4239 при дослідженні протягом 24 і 72 годин. Це не можна пояснити перетворенням в більш стабільну форму. Конкретна причина даного явища, що спостерігається, не відома. 1 Аналіз отриманих даних показує, що сполуки загальної формули I, де R означає ацил 2 (зокрема, СОСН3), алкілсульфініл або алкілсульфоніл в мета- (або орто-) положенні, і R означає алкокси, зокрема, метокси, несподівано будуть розчинятися і будуть зберігати антипрогестинову активність при низькій антиглюкокортикоїдній активності. ФОРМУЛА ВИНАХОДУ 25 1. Сполука загальної формули 17 UA 113283 C2 R R 1 R 4 2 O R 3 X 1 5 10 15 20 25 або її фармацевтично прийнятна сіль, де: R знаходиться в пара-положенні і вибраний з групи, 2 яка складається з -SOCH3 і -SO2CH3; R вибраний з групи, яка складається з атома водню, 3 алкокси і ацилокси; R вибраний з групи, яка складається з С1-6алкілу, гідроксигрупи, алкокси і 4 ацилокси; R являє собою метил; X являє собою =O. 1 2 2. Сполука або її сіль за п. 1, де R являє собою -SO2CH3; і R являє собою алкокси. 1 2 3. Сполука або її сіль за п. 1, де R являє собою -SO2CH3; і R являє собою атом водню. 2 4. Сполука або її сіль за п. 2, де R являє собою метокси. 3 5. Сполука або її сіль за п. 4, де R являє собою ацетокси. 2 3 6. Сполука або її сіль за п. 1, де R являє собою атом водню; і R являє собою ацетокси. 1 2 7. Сполука або її сіль за п. 1, де R являє собою -SOCH3; R являє собою алкокси або атом водню. 2 3 8. Сполука або її сіль за п. 7, де R являє собою метокси; і R являє собою ацетокси. 2 3 9. Сполука або її сіль за п. 7, де R являє собою атом водню; і R являє собою ацетокси. 10. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки або її солі за будь-яким з пп. 1-9 і фармацевтично прийнятний ексципієнт, причому переважно фармацевтична композиція знаходиться в формі, придатній для вагінального введення, такій як вагінальний супозиторій, гель або крем. 11. Сполука або її сіль за пп. 1-9, придатна для лікування прогестеронзалежного стану, вибраного з групи, яка складається з ендометріозу і болю, пов'язаного з ним, аденоміозу, обмеженого розростання ендометріоїдної тканини яєчника, дисменореї, фібром матки, гіперпроліферації ендометрія, раку яєчника, раку шийки матки, у пацієнта, який потребує цього. 12. Сполука або її сіль за п. 11, де сполуку вводять способом, вибраним з групи, яка складається з вагінального введення, внутрішьоматкового введення і місцевого введення, і де ефективна кількість менше ефективної кількості системного введення. 18 UA 113283 C2 19 UA 113283 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel 19-nor-steroids and their use for treating progesterone-dependent conditions
Автори англійськоюPodolski, Joseph, S., Wiehle, Ronald, D.
Автори російськоюПодольски Джозеф С., Виле Роналд Д.
МПК / Мітки
МПК: C07J 9/00, A61K 31/57
Мітки: 19-норстероїди, прогестеронзалежних, станів, застосування, лікування
Код посилання
<a href="https://ua.patents.su/22-113283-19-norsterodi-i-kh-zastosuvannya-dlya-likuvannya-progesteronzalezhnikh-staniv.html" target="_blank" rel="follow" title="База патентів України">19-норстероїди і їх застосування для лікування прогестеронзалежних станів</a>
Попередній патент: Рекомбінантна клітина mycobacterium bovis як вакцина
Наступний патент: Спосіб поліпшеного приживлення гемопоетичних стовбурових клітин
Випадковий патент: Плавкий запобіжник












