Терапевтичні гетероциклічні сполуки, спосіб їх одержання, спосіб профілактики та лікування, лікарський засіб та спосіб його одержання
Номер патенту: 37178
Опубліковано: 15.05.2001
Автори: Робертсон Алан Дункан, Мартін Грем Річард, Хілл Алан Пітер, Глен Роберт Чарльз
Формула / Реферат
І .Терапевтические гетероциклические соединения формулы (I)
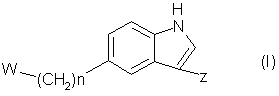
в которой n является числом от 0 до 3, W является группой формул (і), (іі) или (iii):
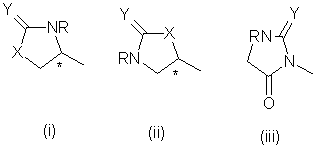
в которых R является водородом или С1-4-алкилом, Χ является -О-, -S-, -ΝΗ- или –CH2-, Y является кислородом или серой, а хиральный центр * в формуле (і) или (іі) находится в своей (S)- или (R)-форме, или является смесью их в любых соотношениях, и Ζ является группой формул (iv), (v) или (vi):
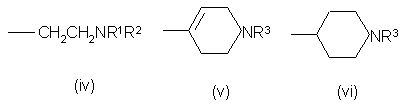
в которых R1 и R2 независимо выбираются из водорода и С1-4 алкила, a R3 является водородом и С1-4 алкилом, их соли, сольваты и физиологически приемлемые производные в качестве агонистов 5-НТ1-подобных рецепторов.
2.Соединение формулы (I) по п.1, отличающееся тем, что
n-является I, или
W является группой формулы (i), или
Z является группой формулы (iv) или (vi),
и физиологически приемлемые соли, сольваты и физиологически функциональные производные его.
3. Соединение формулы (І) по п.І, отличающееся тем, что:
n является I,
W является группой формулы (i), где R является водородом, Χ является -О-, а Y является кислородом, и Z является группой формулы (iv) или (vi), где R1 = R2 = водород или метил,
и физиологически приемлемые соли, сольваты и физиологически функциональные производные его.
4.Соединение формулы (I) по п.1, отличающееся тем, что соединением является:
N,N-диметил-2-[5- (2-оксо-1,3-оксазолидин-4-илметил)-IН-индол-3-ил]-этиламин или
3-(1- метил-4- пиперидил)-5-(2- оксо-1,3- оксазолидин-
4-илметил) - IH- индол, или в его (S)- или (R)-форме, или в виде смеси их в любых соотношениях, или физиологически приемлемой солью, сольватом или физиологически функциональным производным их.
5. Соединение формулы (I) по п.4, отличающееся тем, что соединением является (S)- N,N,-диметил-2-[5- (2-oксо-1,3- окоазолидин-4-ил-метил)-ІН-индол-3-ил]- етиламин или физиологически приемлемая соль, сольват или физиологически функциональное производное его.
6. Соединение формулы (I) по любому из пп. от 1 до 5, или физиологически приемлемая соль, сольват или физиологически функциональное производное его, для использования в качестве лекарственного средства.
7. Соединение формулы (І) по любому из пп. от 1 до 5, или физиологически приемлемая соль, сольват или физиологически функциональное производное его, для использования при профилактике или лечении клинического состояния, для которого показано применение агониота для 5- НТ1-подобного рецептора.
8. Соединение формулы (I) по любому из пп. от 1 до 5, или физиологически приемлемая соль, сольват или физиологически функциональное производное его, для использования при профилактике или лечении мигрени.
9. Способ профилактики и лечения клинического состояния у млекопитающих, отличающийся тем, что вводят указанным млекопитающим терапевтически эффективное количество соединения формулы (І) , по любому из пп. от 1 до 5, или физиологически приемлемой соли, сольвата или физиологически функционального производного его.
10. Способ по п.9, профилактики или лечения клинического состояния, для которого показано использование агониста для 5-НТ1— подобного рецептора.
11. Способ по п.10, профилактики или лечения мигрени.
12. Способ по любому из пп. от 9 до 11, отличающийся тем, что указанным млекопитающим является человек.
1З. Лекарственное средство, отличающееся тем, что включает соединение формулы (I) по любому из пп. от 1 до 5, или физиологически приемлемую соль, сольват или физиологически функциональное производное его, фармацевтически приемлемый носитель, и необязательно, одно или более других физиологически активных средств.
14. Лекарственное средство по п. 13, отличающееся
тем, что находится в форме таблетки или капсулы.
15. Способ получения соединения формулы (I):
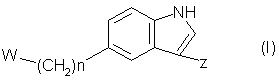
в которой
n является целым числом от 0 до 3,
W является группой формул (i), (ii) или (iii):

где R является водородом или С1-4 -алкилом, Χ является -O-, -S-, NH- или CH2; Y является кислородом или серой, а хиральныи центр * в формуле (i) или находится в его (S)- или (R)-форме, или является смесью их в любых соотношениях, и
Z является группой формул (iν), (v) или (vi):

где R1 и R2 независимо выбираются из водорода и С1-4 алкила, а R3 является водородом или C1-4 -алкилом, отличающийся тем, что (а) в случае, когда Z являетcя группой формулы (iv),
осуществляют реакцию соединения формулы (II):
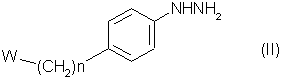
где n и W имеют определенные выше значения, с соединением формулы (ІII)
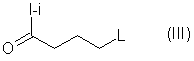
или с карбонил - защищенной формой его, где L является подходящей удаляемой группой или защищенной амино - группой, которая может быть превращена in sity в амино - группу или является группой –NR1R2, где R1 и R2 имеют определенные выше значения,
(б) в случае, когда Z является группой формулы (v), проводят реакцию соединения формулы (XXXI):
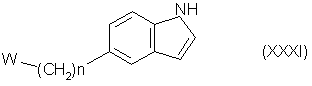
где n и W имеют определенные выше значения, с соединением формулы (XXVIII):
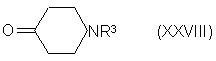
где R3 имеет определенные выше значения, и
(в) в случае, когда Z является группой формулы
(vi), восстанавливают cоединение формулы (І), в которой n и W имеют определенные выше значения, a Z является группой формулы (v) или в случае, когда y является группой формулы (i) или (ii), проводят реакцию соединения формулы (ХV):
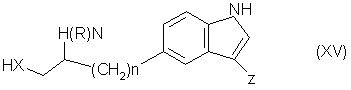
или (ХХV):
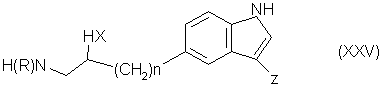
где n, R и X имеют определенные выше значения, а Z является группой формулы (vi), с cоединением формулы (VII):
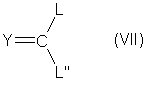
где Y имеет определенные выше значения, а L и L”, которые могут быть одинаковыми или различными, являются подходящими уходящими группами, и, необязательно, превращают соединение формулы (I), полученное таким образом, в соответствующую соль, сольват или физиологически функциональное производное его.
16. Способ получения лекарственного средства, отличающийся тем, что:
(а) получают соединение формулы (I) или физиологически приемлемой соли, сольвата или физиологически функциональное проізводное его по способу, заявленному в п. 17, и
(б) смешивают продукт реакции из стадии(а) с фармацевтически приемлемым носителем, и, необязательно, одним или более физиологически активными средствами.
17. Способ по пп. 16, отличающийся тем, что включает дополнительную стадию (в), в которой смеси из стадии (б) придают форму таблетки или капсулы.
Текст
УКРАЇНА (19) UA (51) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ (11) 37178 (13) C2 7 C07D413/06, 413/14,403/06, 401/14, A61K31/40 ОПИС ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) ТЕРАПЕВТИЧНІ ГЕТЕРОЦ ИКЛІЧНІ СПОЛУКИ, СПОСІБ ЇХ ОД ЕРЖАННЯ, СПОСІБ ПРОФІЛАКТИКИ ТА ЛІКУВАННЯ, ЛІКАРСЬКИЙ ЗАСІБ ТА СПОСІБ ЙОГО ОДЕРЖАННЯ Y Y NR X * RN X , RN (i) * N , (ii) , (iii) O в которых R является водородом или С1-4алкилом, Х является -О-, -S-, -NH- или -СН2-, Y является кислородом или серой, а хиральный центр * в формуле (і) или (ii) находится в своей (S)- или (R)-форме, или является смесью их в любых соотношениях, и Z является группой формул (iv), (v) или (vi): —CH2 CH2 NR'R 2 (iv) В.Ш. 3 NR , , (v) (13) в которых R1 и R2 независимо выбираются из водорода и С 1-4 алкила, a R3 является водородом и С1-4 алкилом, их соли, сольваты и физиологически приемлемые производные в качестве агонистов 5НТ1-подобных рецепторов. 2. Соединение формулы (I) по п. 1, отличающе еся тем, что: n является 1, или W является группой формулы (i) , или Z является группой формулы (iv) или (vi), и физиологически приемлемые соли, сольваты и физиологически функциональные производные его. 3. Соединение формулы (I) по п.1, отличающе еся тем, чтo: n является 1, W является группой формулы (i ) , где R является водородом, Х является -О-, а Y является кислородом, и Z является группой формулы (iv) или (vi ), где R1 = R2 = вoдoрoд или метил, и физиологически приемлемые соли, сольваты и физиологически функциональные производные его. 4.Соединение формулы (I) по п.1, отличающе еся тем, что соединением является N,N-диметил-2-[5(2-оксо-1,3-оксазолидин-4-илметил)-1H-индол-3-ил]этиламин или 3-(1-метил-4- пиперидил)-5-(2- оксо1,3- оксазолидин-4-илметил) -1H-индол, или в его ( S)- или ( R)-форме, или в виде смеси их в любых соотношениях, или физиологичеcки приемлемой солью, сольватом или физиологически функциональным производным их. 5. Соединение формулы (I) по п.4, отличающе еся тем, что соединением является (S)-N,N,-диметил2-[5-(2-оксо-1,3-оксазолидин-4-ил-метил)-1Н-индол3-ил]- этиламин или физиологически приемлемая соль, сольват или физиологически функциональное производное его. 6. Соединение формулы (I) по любому из пп. от 1 до 5, или физиологически приемлемая соль, сольват или физиологически функциональное произ C2 (vi) 37178 Y , (11) , (I) Z в которой n является числом от 0 до 3, W является группой формул (і), (іі) или (ііі): (CH2 )n 3 UA W NR (19) (21) 93002089 (22) 06.06.1991 (24) 15.05.2001 (31) 9012672.3, 9102182.4 (32) 07.06.1990, 01.02.1991 (33) GB, GB (86) PCT/GB91/00908, 06.06.1991 (46) 15.05.2001, Бюл. № 4, 2001 р. (72) Робертсон Алан Дункан, GB, Хілл Алан Пітер, GB, Глен Роберт Чарльз, GB, Мартін Грем Річард, GB (73) АСТРАЗЕНЕКА АБ, SE (56) 1. ЕР, А, 0313397, 26.04.1989. 2. ЕР, А, 0354777, 14.02.1990. 3. ЕР, А, 0303506, 15.02.1989. 4. GB, А, 2186874, 26.08.1987. (57) 1. Терапевтические гетероциклические соединения формулы (I) H N 37178 водное его, для использования в качестве лекарственного средства. 7. Соединение формулы (I) по любому из пп. от 1 до 5, или физиологически приемлемая соль, сольват или физиологически функциональное производное его, для использования при профилактике или лечении клинического состояния, для которого показано применение агониста для 5НТ1-подобного рецептора. 8. Соединение формулы (I) по любому из пп. от 1 до 5, или физиологически приемлемая соль, сольват или физиологически функциональное производное его, для использования при профилактике или лечении мигрени. 9. Способ профилактики и лечения клинического состояния у млекопитающих, отличающийся тем, что вводят указанным млекопитающим терапевтически эффективное количество соединения фор мулы (I), по любому из пп. от 1 до 5, или физиологически приемлемой соли, сольвата или фи зиологически функционального производного его. 10. Способ по п. 9, профилактики и лечения клинического состояния, для которого показано использование агониста для 5-НТ1-подобного рецептора. 11. Способ по п. 10, профилактики и лечения мигрени. 12. Способ по любому из пп. от 9 до 11, отличающийся тем, что указанным млекопитающим является человек. 13. Лекарственное средство, отлича ющееся тем, что включает соединение формулы (I) по любому из пп. от 1 до 5, или физиологически приемлемую соль, сольват или физиологически функциональное производное его, фармацевтически приемлемый носитель и, необязательно, одно или более други х физиологически активных средств. 14. Лекарственное средство по п. 13, отличающе еся тем, что находится в форме таблетки или капсулы. 15. Способ получения соединения формулы (I): —CH2 CH2 NR'R 2 (iv) NHNH 2 W X * (i) , RN * (ii) O , (CH2 )n (XXXI) где n и W имеют определенные выше значения, с соединением формулы ( ХХVIII): NR O N (III) или с карбонил-защищенной формой его, где L является подходящей удаляемой группой или защищенной аминогруппой, которая может быть превращена in sity в аминогруппу или является группой -NR1R2,где R1 и R2 имеют определенные выше значения, (б) в случае, когда Z является группой формулы (V), проводят реакцию соединения формулы (XXXI): H N (I) , L , O 3 , (XXVIII) где R3 имеет определенные выше значения, и (в) в случае, когда Z является группой формулы (vi), восстанавливают соединение формулы (І), в которой n и W имеют определенные выше значения, a Z является группой формулы (v) или в случае, когда Y является группой формулы (i) или (ii), проводят реакцию соединения формулы (ХV): RN X (II) H Y NR , (CH 2 )n где n и W имеют определенные выше значения, с соединением формулы (III) Z Y , где R1 и R2 независимо выбираются из водорода и С1-4-алкила, а R3 является водородом или С1-4-алкилом, отличающийся тем, что (а) в случае, когда Z являетcя группой формулы (iv), осуществляют реакцию соединения формулы (II): в которой n является целым числом от 0 до 3, W является группой формул (i), (ii ) или (iii): Y 3 (vi) W , (CH2 )n (v) NR H N W 3 NR , , , (iii) где R является водородом или C1-4 -алкилом, X является -O-,-S-,NH- или CH2;Y является кислородом или серой, а хиральный центр * в формуле (i) или находится в его (S)- или (R)- форме, или является смесью их в любых соотношениях, и Z является группой формул (iv), (v) или (vi): H N H(R)N HX 2 (CH2 )n , Z (XV) 37178 или (ХХV): HX H (R)N и, необязательно, превращают соединение формулы (I), полученное таким образом, в соответствующую соль, сольват или физиологически функциональное производное его. 16. Способ получения лекарственного средства, отличающийся тем, что: (а) получают соединение формулы (I) или физиологически приемлемой соли, сольвата или физиологически функциональное производное его по способу , заявленному в п.17, и (б) смешивают продукт реакции из стадии (а) с фармацевтически приемлемым носителем и, необязательно, одним или более физиологи чески активными средствами. 17. Способ по п. 16, отличающийся тем, что включает дополнительную стадию (в), в которой смеси из стадии (б) придают форму таблетки или капсулы. H N , (CH2 )n (XXV) Z где n , R и X имеют определенные выше значения, а Z является группой формулы ( vi), с соединением формулы (VII): L Y C , (VII) L' где Y имеет определенные выше значения, а L и L’, которые могут быть одинаковыми или различными, являются подходящими уходящими группами, ____________________ Настоящее изобретение относится к новым хи мическим соединениям, получению их, фармацевтическим композициям, содержащим их, и использованию их в медицине, в частности, профилактике и лечении мигрени. Рецепторы, которые являются промежуточным звеном действий 5-окситриптамина (5-HT, идентифи цировали у млекопитающих как в перифе рии, так и в головном мозге. Согласно классифи кации и номенклатуре, предложенным в недавней статье (Bradley et al. Heuropharmac, 25, 563 (1986)), эти рецепторы могут быть классифицированы в тре х основных типах, а именно, "5-HT1-подобные", 5-HT2 и 5-HT3 . Различные классы соединений предлагали в качестве 5–HT агонистов (веществ, обладающих сродством к рецептору) или антаго нистов для те рапевтического использования, но они не всегда специфичны к определенному типу 5-HT рецептора. Описание изобрете ния патента Европы 0313397 описывает класс 5-HT агонистов, которые являются специфическими к определенному типу "5-HT1-подобного" рецептора и являются эффективными лекарственными средствами для лечения клинических состояний, в которых се лективный агонист для это го типа рецептора является показательным (требуется). Например, рассматриваемый рецептор является промежуточным звеном (посредничает в) ва зоконстрикции (сужения кровеносных сосудов) в каротидном васкулярном ложе и тем самым изменяет кровоток в нем. Поэтому соединения, описанные в описании изобретения Европейского патента, являются благотворными при лечении или профилактике состояний, в кото рых вазоконстрикция в каротидном васкулярном ложе является показательной (требуется), например, мигрени, состояния связанного с избыточной дилатацией (расши рением) каротидной сосудистой сети. Однако, в пределах объема ранней заявки является то, что "ткань-мишень" может быть любой тканью, в которой действие связывается с посредничеством "5-HT1-подобных" рецепторов названного вы ше ти па. Мы в настоящее время открыли дополнительный класс соединений, обладающих необыч ным агонизмом к "5-HT1-подобным" рецепторам и превосходным поглощением (абсорбцией) после пероральной дозы. Эти свойства делают соединения особенно полезными для некоторых лекарственных применений, особенно профи лактики и лечения мигрени, "гистаминовой" головной боли и головной боли, связанной с васкулярными нарушениями, в дальнейшем все вместе называемых "мигренью". Поэтому, по первой особенности настоящего изобретения, предлагается соединение формулы (I) H N W , (CH2 )n (I) Z в которой n является целым числом от 0 до 3, w является группой формулы (i), (ii) или (iii). Группы формул (i), (ii) и (iii) Y Y Y NR X * RN X , RN (i) * N * , (ii) , (iii) O в кото рой R является водородом, или С1-4 алкилом, Х является -О-, -S-, -NН- или -CH2-, W является кислородом или серой, хиральный центр * в формуле (i) или (ii) нахо дится в своей (S) или (R)форме или является их смесью в любых пропорциях, а Z является группой формулы (iv), (v), или (vi). Группы формул —CH2 CH2 NR'R 2 (iv) 3 3 NR , , (v) 37178 NR ное соединение, использование, для которого оно предполагается, способны применения и реципиент. Типичная суточная доза для лечения мигрени, как можно полагать, лежит в пределах от 0,01 до 5 мг на кг живого веса. Унифи цированные дозы могут со держать от 1 до 100 мг соединения формулы (I), например, ампулы для инъекции могут со держать от 1 до 10 мг, а перорально принимаемые унифи цированно дозированные лекарственные формы, такие как таблетки или капсулы, могут содержать от 1 до 100 мг. Такие унифицированные дозы могут применяться один или более раз в сутки, отдельно или в составах его. Вн утривенная доза, как можно полагать, лежит в пределах от 0,01 до 0,15 мг/кг и обычно применяется в виде вливания от 0,0003 до 0,15 мг на кг в минуту. Растворы для вливания, пригодные для этой цели, могут со держать от 0,01 до 10 мг/мл. Когда действующее соединение является солью или сольватом соединения формулы (I), доза основывается на катионе (для солей), или несольватированном соединении. В дальнейшем ссылкам на "соединение(я) формулы (I)" предполагают включать физиологически приемлемые соли и сольваты и х. По третьей особенности настояще го изобретения, поэтому предлагаются фармацевтические композиции, включающие, в качестве действующе го ингредиента, по меньшей мере, одно соединение формулы (I) и/или фармакологически приемлемую соль или сольват его вместе с, по меньшей мере, одним фармацевтическим носителем или наполните лем. Эти фармацевтические композиции могут быть использованы при профилактике или лечении клинических состояний, для которых агонист для "5-HT1-подобного" рецептора является показательным, например, мигрени. Носитель должен быть фармацевтически приемлемым для реципиента и должен быть совместим с другими ингредиентами в композиции (т.е. не иметь на них вpедного воздействия). Носитель может быть твердым или жидким и предпочтительно включается в состав вместе с по меньшей мере одним соединением формулы (I) в ви де лекарственной формы с унифи цированной дозой, например, таблетки, которая может содержать от 0,05 до 95 вес.% действующего ингредиента. Если желательно, в фармацевтические композиции изобрете ния могут быть вве дены также другие фи зиологи чески действующие ингредиенты. Возможные лекарственные формы включают формы, пригодные для перорального, подъязычного, трансбуккального (внутриротового), парентерального (например, подкожного, вн утримышечного или врутривенного), ректального, наружного и интраназального (внутриносового) применения. Наиболее подхо дящий способ применения для конкретного пациента зависит от природы и остроты состояния, подлежащего вы лечива нию, и от природы действующе го соединения, но, где это возможно, пероральное применение является предпочтительным. Лекарственные формы, пригодные для перорального применения, могут быть выработаны в виде раздельных лекарственных форм, та ких как таблетки, капсулы, крахмальные капсулы или лепешки, каждая из кото рых содержит заранее опре 3 , (vi) в которой R1 и R2 независимо выбираются из водорода и С1-4 алкила, а R3 является водородом или С1-4-алкилом, и соли, сольваты и фи зиологически функциональные производные его. Соединения формулы (I), имеющие особенно желательные свойства для лечения и профилакти ки мигрени, включают соединения, в которых n является 1, W является группой формулы (i), a Z является груп пой формулы (iv) или (vi). Из них особенно предпочтительными являются соединения формулы (I), в которой n является 1, W является группой формулы (i), в которой R является водородом, Х является -О-, а Y является кислородом и Z является группой формулы (iv) или (vi), в которой R1=R2=водород или метил. Двумя соединениями формулы (I), имеющими исключительные свойства для лечения и профи лактики мигрени, являются N,N-диметил-2-[5(2-оксо-1,3-оксазолидин-4-ил-метил) -1Н-индол-3ил]-этиламин и 3-(1-метил-4-пиперидил)-5-(2-оксо1,3-оксазолидин-4-илметил)-1Н-индол либо в их (S)- или (R)-форме, либо в виде смеси их в любых соотношениях. Соли и сольваты этих соединений, например, гидраты малеатов, являются особенно предпочтительными. Физиологически приемлемые соли являются особенно пригодными для лекарственного применения из-за их более высокой растворимости в воде по сравнению с родственными, т.е. основными, соединениями. Такие соли определенно должны иметь физиологически приемлемый анион. Подходящие физиологически приемлемые соли соединений настояще го изобрете ния включают соли, получаемые из уксусной, соляной, бромисто водородной, фосфорной, яблочной, малеиновой, фумаровой, лимонной, серной, молочной или винной кислоты. Сукцинатный или хлоридные соли являются особенно предпочтительными для лечебных целей. Соли, обладающие фи зиологически не приемлемым анионом, нахо дятся в пределе объема изобретения в качестве полезных интермедиатов для получения физиологически приемлемых солей и/или для использования в нелечебных, например ин витро (в лабораторном сосуде), ситуациях. По второй особенности настоящего изобретения, предлагается соединение формулы (I) или фи зиологически приемлемая соль, сольват или фи зиологически функциональное производное их для использования в качестве терапевтического средства, в частности, в качестве агониста для "5– HT1-подобного", ре цептора, например, в качестве каротидного вазокостриктора при профи лактике и лечении мигрени. Однако, как показывается, "органы-мише ни" для представленных соединений, кроме каротидной сосудистой сети, нахо дятся в пределах объема настоящего изобретения. Количество соединения формулы (I), или соли, или сольваты его, которое требуется для достижения соответствующего биологического действия, зависит от ряда факторов, та ких как конкрет 4 37178 деленное количество действующе го соединения, в виде порошков или гранул, в ви де растворов или суспензий в водных или неводных жидкостях, или в ви де эмульсий типа масло в воде или вода в масле. Лекарственные формы, пригодные для подъязычного или трансбуккального применения, включают лепешки, содержащие действующие соединения и, обычно, вкусовую и аромати зирующую основу, та кую как сахар и акация или трагакант, и пастилы, содержащие действующее соединение в инертной основе, та кой как желатина и глицерин или саха роза и акация. Лекарственные формы, пригодные для парентерального применения, обычно включают стерильные водные растворы, содержащие заранее определенную концентрацию действующего соединения, раствор предпочтительно является изотоническим с кровью предполагаемого реципиента. Хотя такие растворы предпочтительно применяются внутривенно, они могут быть применены также путем подкожной или внутримышечной инъекции. Лекарственные формы, пригодные для ректального применения, предпочтительно вырабатываются в виде суп позиторий с унифи цированной дозой, включающи х действующий ингредиент и один или более твердых носителей, образующих основу для суппозито рий, например, масло какао. Лекарственные формы, пригодные для наружного или интраназального применения, включают мази, кремы, лосьоны, пасты, ге ли, аэрозоли и масла. Подхо дящи ми носителями для таких лекарственных форм являются нефтяное желе, ланолин, полиэтиленгликоли, спирты и и х со четания. Действующий ингредиент обычно содержится в таких лекарственных формах при концентрации от 0,1 до 15 вес.%. Лекарственные формы изобретения могут быть приготовлены по любому подхо дящему способу, обычно путем равномерного и однородного смешивания действующе го (их) соединения (й) с жидкими или тонко размолоты ми твердыми носителями, или с обоими носителями, в требуе мых пропорциях, а затем, если необхо димо, формования, получающейся смеси в пылевую форму. Например, таблетка может быть получена путем прессования однородной смеси, включающей порошок или гранулы действующе го ингредиента и одного или более необязательных ингредиентов, таких как связующее, смазочное вещество, инертный разбавитель или поверхностно-активное диспергирующее вещество, или путем формования однородной смеси порошкообразного действующе го ингредиента и инертного жидкого разбавите ля. Водные растворы для паренте рального применения обычно получаются растворением действующе го соединения в доста точном количестве воды, что бы получить целевую концентрацию, а затем превраще нием полученного раствора в стерильный и изотонический раствор. Таким образом, по четвертой особенности настояще го изобретения, предлагается использование соединения формулы (I) при получении лекарственного средства для профи лакти ки или лечения клинического состояния, для кото рого пока зан агонист для "5-HT1-подобного" рецептора, например, мигрени. По пятой особенности изобрете ния, предлагается способ профи лактики или лечения клинического состояния у млекопитающих, например, человека, для которых показан агонист для "5HT1-подобного" рецептора, например, мигрени, который (способ) включает введение указанным млекопитающим терапевтически эффективного количества соединения формулы (I) или физиологически приемлемой соли, сольвата или фи зиологически функционального производного его. По шестой особенности изобрете ния, соединения формулы (I), в которой Z является группой формулы (iv), могут быть получены реакцией взаимодействия соединения формулы (II), выделенной или ин ситу (на месте): NHNH 2 W , (CH 2 )n (II) в которой n и W имеют определенные выше значения, с соединением формулы (III) H O L (III) или с карбонил-замещенной формой его, такой как диметил- или диэтил-ацеталем, в которой L является подхо дящей уходящей группой, такой как хлор, или защищен ной амино-группой, любая из которых может быть превраще на ин ситу в аминогруп пу или является груп пой – NR1R2, где R 1 и R2 имеют определенные выше значения. Реакция обычно проводится кипячением с обратным холодильником соединением в систе ме полярных раство рителей, например, этанол /вода, разбавленная уксусная кислота или во да в присутствии кислотной ионообменной смолы, например, "Амберлита 15". Стандартные методы N-алкилирования могут быть использованы, что бы превратить соединения формулы (I), в которой Z является группой формулы (iv), а R1 и/или R2 являются водородом, в соответствующие соединения, в которых R1 и/или R2 являются С1–4-алкилом. Соединения формулы (I), в которой Z = (iv), а R1 = R2 = С1–4 алкил, могут быть получены из соответствующе го соединения, в котором R1 = = R2 = H, с помощью методов N,N-диалкилирования, хорошо известным специалистам в данной области те хники, например, путем обработки с соответствующим альдегидом в присутствии восстанавливающей системы, например, цианоборогидрид натрия/уксусная кислота, в полярном растворите ле, таком как метанол. Соединения формулы (I), в которой Z = (iv), а R1 или R2 = C1–4 алкил, могут быть получены из соответствующе го соединения, в котором R1 = = R2 = H, путем N-бензилирования, используя бензальдегид и подхо дящий восстановитель, например, борогидрид натрия, в полярном растворителе, таком как этанол, за кото рым следуе т N-алки 5 37178 лирование, используя подхо дящее средство, такое как соответствующий диалкилсульфат, обычно в присутствии основания, например, безводного карбоната калия, в полярном апротонном растворите ле, таком как ДМФА, и наконец, N-дебензилирование, обычно путем ката лити ческого гидрирования, используя например, Pd/C в полярном растворителе, та ком как этанол. Гидразины формулы (II) могут быть получены из соответствующе го анилина формулы (IV) рид натрия, в системе полярных растворителей, такой как этанол/вода, при 0оС. Сложный эфир может быть получен путем этерифи кации соответствующей карбоновой кислоты, используя, например, соответствующий спирт и или путем восстановления соответстввующе го пара-нитросоединения, например, путем каталитического гидрирования. Как кислота, так и пара-нитросоединение, могут быть получены из соответствующей пара-нитроаминокислоты, кислота путем N-алкоксикарбонилирования, используя, например, R5OCOCl, где R5 имеет определенные выше значения, за которым следуе т восстановление нитрогруп пы, например, путем каталитического гидрирования, или путем восстановления нитрогруппы, за которым следует N-алкоксикарбонилирование, а пара-нитросоединение путем N-алкоксикарбонилирования (что касается кислоты), за которым следует эте рифи кация, используя, например, соответствующий спирт и HCl, или путем этерификации, за которой следует N-алкоксикарбонилирование. пара-Нитроаминокислота может быть получена коммерческим путем или получена из легко доступных исходных веществ по методам, известным специалистам в данной области те хники или получаемым из хи мической литературы, например, путем паранитрования соответствующей аминокислоты, используя, например, конц. Н2SO4/конц. HNO3 при 0оС. Соединения формулы (XXXIV), в которой Х является кислородом, могут быть получены путем восстановления соответствующего динитросоединения, обычно путем каталитического гидрирования, используя, например, Pd/C в полярном растворите ле, таком как этанол. Динитросоединение может быть получено реакцией соответствующего альдегида с нитрометаном, обычно в присутствии основания, например, метоксида натрия, в полярном растворителе, та ком как мета нол, за которым следует пара-нитрование, используя, например, конц. Н2SO4/конц. HNO3, или пара-нитрование соответствующего альдегида, за кото рым следует реакция с нитрометаном. Альдегид может быть получен коммерческим путем или получен из легко доступных исходных веществ по методам, известным специалистам в данной области техники или получаемых из хи мической литературы. NH 2 W , (CH 2 )n (IV) в которой n и W имеют определенные выше значения, путем диазоти рования, за которым следует восстановление. Диазотирование обычно проводят путем использования нитрата натрия/конц. HCl и получающее ся диазосоединение восстанавливают ин ситу, используя, например, хлорид олова (II)/конц. HCl. Получающийся гидразин может быть выделен или превращен в соединение формулы (I) ин ситу. Анилины формулы (IV) могут быть получены путем восстановления соответствующе го паранитро-соединения формулы (V) NO2 W , (CH 2 )n (V) в которой n и W имеют определенные выше значения, обычно путем каталитического гидрирования, используя, например, Pd/C в системе полярных растворите лей, такой как подкисленная смесь этанола, воды и этилацетата. Анилины формулы (IV), в которой W является группой формулы (i) или (ii), могут быть получены также путем циклизации соединения формулы (XXXIII): H(R4 )N HX NH 2 Пара-нитросоединения формулы (V) могут быть получены: а) в случае, когда W является груп пой формулы (i) в которой Y является кислородом или серой, реакцией соединения формулы (VI): (XXXIII) (CH 2 )n или (XXXIV): NH 2 HX 4 H (R )N (CH 2 )n H(R)N , (XXXIV) HX в которых n и Х имеют определенные выше значения, а R4 является группой – СООR5, где R5 является C1–4 алкилом, обычно путем нагревания в присутствии основания, такого как метоксид натрия. Соединения формулы (XXXIII), где Х является кислородом, могут быть получены путем восстановления соответствующего С 1–4 алкилового сложного эфи ра, используя, например, гидрогид NO 2 , (CH 2 )n (VI) в которой n, R и X имеют определенные выше значения, с соединением формулы (VII): L Y C , L' 6 (VII) 37178 в которой Y имеет определенные выше значения, а L и L', которые могут быть одинаковыми или различными, являются подхо дящи ми уходящими груп пами, например, хло ром, этокси, трихлорметилом, трихлорметоксигруппой или имидазолилом, например, в случае когда L=L' = хлор, в неполярном растворителе, таком как толуол, в присутствии основания, например, гидроокси калия. б) в случае, когда W является груп пой формулы (ii), в которой Y является кислородом или серой, реакцией соединения формулы (VIII): NO 2 HX H (R)N Соединения формулы (VIII) могут получаться реакцией раскрытия цикла соединения формулы (V), в которой имеет определенные выше значения, а W является группой формулы (ii), в которой R, X и Y имеют определенные выше значения, например, путем кипячения с обратным холодильником в 2N водной КОН. Соединения формулы (III), (VII), (IX) и (X) могут быть получены коммерческим путем или получены из легко доступных исходных ве ществ по методам, известным специалистам в данной области техники или получаемым из химической литературы. Пара-нитросоединения формулы (V), в которой W является группой формулы (i) или (ii), могут быть получены также путем пара-нитрования соединения формулы (XXXVI): , (CH 2 )n (VIII) в которой n, R и X имеют определенные выше значения, с соединением формулы (VII), в которой Y, L, L' имеют определенные выше значения, используя обычно условия реакции, описанные в (а), в) в случае, когда W является группой формулы (iii), реакцией соединения формулы (IX): W , (CH2 )n (IX) в которой R имеет определенные выше значения, с соединением формулы (Х): HX , (XXXVII) , (CH 2 )n RN , (XXXVI) H(R)N O NH , в которой n и W имеют определенные выше значения, используя, например, конц. Н2SO4/конц. HNO3 при 0оС. Соединения формулы (XXXVI) могут быть получены реакцией соединения формулы (XXXVII): NO 2 HO (CH 2)n (XXXVIII) или (XXXVIII): (X) HX O H (R)N в которой R имеет определенные выше значения, обычно в полярном апротонном растворителе, таком как ДМФА, в присутствии диэтилового эфи ра азодикарбоновой кислоты и Ph3P (ДЭ АД/Ph3P). Соединения формулы (VI) могут быть получены реакцией раскрытия цикла соединения формулы (V), в которой n имеет определенные выше значения, а W является группой формулы (i), в которой R, X и Y имеют определенные выше значения, например, путем кипячения с обратным холодильником в 2 N водной КОН. Соединения формулы (VI), в которой X является кислородом, могут быть получены этерифи кацией соответствующей карбоновой кислоты, обычно обработкой с хлористым тионилом и соответствующим спиртом при –10оС, за которой следует восстановление сложного эфира, используя, например, борогидрид натрия, в систе ме полярных растворите лей, такой как этанол/вода, при 0оС. Кислота может быть получена коммерческим путем или получена из легко доступных исходных веществ по методам, известным специалистам в данной области те хники или получаемым из химической литературы, например, путем пара-нитрования соответствующей аминокислоты, используя, например, конц. Н2SO4/конц. HNO3 при 0оС. (CH 2 )n в которой n, R и Х имеют определенные выше значения с соединением формулы (VII), в которой Y, L и L' имеют определенные выше значения, обычно в присутствии основания, например, гидроокиси калия в неполярном растворителе, та ком как толуол. Соединения формулы (XXXVII) и (XXXVIII) могут быть получены путем восстановления соответствующи х нитро-соединений, обычно каталитическим гидрированием, используя, например, Pd/C в полярном растворите ле, таком как этанол. Нитро-соединение, соответствующее соединению формулы (XXXVII), может быть получено реакцией соединения формулы (XXIV): O2N (CH 2 )n+1 , (XXIV) в которой n имеет определенные выше значения, с параформальдегидом в полярном апротонном растворителе, таком как ДМФА, в присутствии основания, например, метоксида натрия, при 0оС, 7 37178 0оС. Кислота может быть получена реакцией раскрытия цикла соединения формулы (XVI): или этерифи кацией соответствующей карбоновой кислоты, обычно обработкой с хлористым тионилом и соответствующим спиртом при –10оС, за которой следует восстановление сложноэфирной груп пы, используя, например, борогидрид натрия, в системе полярных растворителей, такой как этанол/вода, при 0оС. Нитро-соединение, соответствующее соединению формулы (XXXVIII), может быть получено реакцией соответствующего альдегида с нитромета ном, обычно в присутствии основания, например, метоксида натрия, в полярном растворителе, та ком как метанол. Соединение формулы (XXIV), кислота и альдегид могут быть получены коммерческим путем или получены из легко доступ ных исходных ве ществ по методам известным специалистам в данной области техники или получаемым из химической литературы. O NR 6 R N (CH 2) n HX в которой n, R и Z имеют определенные выше значения, а R6 является водородом или бензилом, обычно путем кипячения с обратным холодильником в во де в присутствии основания, например, гидроокиси бария. Соединения формулы (XVI), в кото рой n¹0, могут быть получены восстановлением соединения формулы (XVII): H N O H (R)N RH (XV) , Z, O (XVII) в которой n, R, R6 и Z имеют определенные выше значения, обычно путем каталитического гидрирования, используя, например, Pd/C в системе полярных растворите лей, такой как этанол/вода. Наоборот, чтобы восстановить двойную связь и тем самым ввести хи ральный центр в положение 4 диоксоимидазольного цикла может быть использован энантиоселективный восстановитель, такой как Rh (код) (дипамп)+ BF– (ICS Chem. Comm. 275, (1991)). Стадия восстановления может быть использована, чтобы превратить соединение формулы (XVII), в которой Z является группой формулы (V), в соединение формулы (XVI), в которой Z является группой формулы (vi). Соединения формулы (XVII) могут быть получены реакцией соединения формулы (XVIII): H N (CH2 )n CH (CH 2)n-1 или (XXV): HX RN 6 H N (CH2 )n Z , (XVI) O Пара-нитросоединения формулы (V), в которой W является группой формулы (i), (ii) или (iii), в которой R является С1-4 алкилом, могут быть получены из соответствующего соединения формулы (Y), в которой R является водородом, путем N-алкилирования, используя подхо дящий реагент, такой как соответствующий диалкилсульфат, обычно в присутствии основа ния, например, гидрида натрия, в неполярном растворите ле, таком как ТГФ. Соединения формулы (I), в которой W является группой формулы (i) или (ii), могут быть получены также реакцией соединения формулы (XV): H(R)N H N (XXV) Z в которой n, R, X и Z имеют определенные выше значения, с соединением формулы (VII), в которой Y, L и L' имеют определенные выше значения, например, в случае, когда L=L' этокси, путем нагревания в присутствии основания, например, карбоната калия. Соединения формулы (ХV) могут быть получены реакцией раскрытия цикла соединения формулы (I), в которой n и Z имеют определенные выше значения, а W является группой формулы (i), в которой R, X и Y имеют определенные выше значения, например, путем кипячения с обратным холодильником в 2N водной КОН. Соединения формулы (XV), в которой Х является кислородом, могут быть получены этерифи кацией соответствующей карбоновой кислоты, обычно обработкой с хлористым тионилом и соответствующим спиртом при -10оС, за которой следует восстановление сложного эфира, используя, например, борогидрид натрия, в систе ме полярных растворителей, такой как этанол-вода, при H N OHC (CH 2 )n-1 Z, (XVIII) в которой n и Z имеют определенные выше значения, в случае, когда R6 должен быть водородом, с соединением формулы (X), в которой R имеет определенные выше значения, обычно путем нагревания в ледяной уксусной кислоте в присутствии ацетата аммония. Соединения формулы (XVIII) могут быть получены путем восстановительного гидролиза соответствующе го нитрила, обычно используя никель Ренея и гипофосфит натрия в смеси воды, уксусной кислоты и пиридина. Нитрил может быть получен реакцией соединения формулы (XIX): 8 37178 Соединения формулы (XV), в которой R является водородом, могут быть получены путем восстановления соединения формулы (XX): H N NC , (CH2)n-1 (XIX) в которой n имеет определенные выше значения, с соответствующим соединением формулы (XXVIII), в случае, когда Z должен быть группой формулы (v) или (vi): 3 O NR , HX (XXVIII) O2N Z , (CH2)n+1 (XXI) Z в которой n и Z имеют определенные выше значения, с параформальдегидом в полярном апротонном растворителе, таком как ДМФА, в присутствии основания, например, метоксида натрия, при 0оС. Соединения формулы (XXI) могут быть получены реакцией соединения формулы (XXII): H N N (CH 2) n Rz (XX) H N NHNH 2 NR , (CH2 )n в которой n, X и Z имеют определенные выше значения, обычно каталитическим гидрирова нием, используя, например, Pd/C в полярном растворителе, таком как этанол. Подобная стадия может быть использована, чтобы превратить соединение формулы (ХХ), в кото рой Z является группой формулы (V), в соединение формулы (XV), в которой Z является группой формулы (vi). Соединения формулы (ХХ), в которой Х является кислородом, могут быть получены реакцией соединения формулы (XXI): в которой R3 имеет определенные выше значения, обычно путем кипячения с обратным холодильником в полярном растворите ле, таком как метанол, в присутствии основания, например, гидроокиси калия. Соединения формулы (XIX) и (XXVIII) могут быть получены коммерческим путем или получены из легко доступных исходных веществ по методам, известным специалистам в данной области техники или получаемым из химической лите ратуры. Соединения формулы (XVI), в которой n = 0, могут быть получены одинаковым способом. Соединения формулы (XVI), в которой R6 является бензилом, а Z является группой формулы (iv), могут быть получены реакцией соединения формулы (XXXV): O H N O2 N O2N , (XXXV) O (CH2)n+1 , (XXII) в которой n имеет определенные выше значения, в случае, когда Z должен быть группой формулы (v) или (vi) с соответствующим соединением формулы (XXVIII), в которой R3 имеет определенные выше значения, обычно путем нагревания в ледяной уксусной кислоте. Соединения формулы (ХХII), в которой n¹0, могут быть получены путем восстановления соединения формулы (XXIII): в которой n и R имеют определенные выше значения, с соединением формулы (III), в которой Z имеет определенное выше значение, используя обычно условия реакции, описанные выше для реакции соединения (II) c (III). Гидразины формулы (XXXV) могут быть получены из соответствующе го анилина, используя обычно условия реакции, описанные выше для превращения соединения (IV) в (II). Ани лин может быть получен путем восстановления соответствующе го пара-нитросоединения, используя обычно условия реакции, описанные выше для превраще ния соединения (V) в (IV). Пара-нитросоединение может быть получено реакцией соответствующей пара-нитроаминокислоты с бензилизоцианатом в присутствии основания, например, гидроокиси калия, в полярном растворите ле, таком как вода. Пара-нитроаминокислота может быть получена коммерческим путем или получена из легко доступ ных исходных веществ по методам, известным специалистам в данной области техники или получаемым из химической лите ратуры, например, путем пара-нитрования соответствующей аминокислоты, используя, например, конц. H2SO4/конц. HNO3 при 0оС. H N CH O2N CH (CH2) n-1 , (XXIII) в которой n имеет определенные выше значения, используя, например, борогидрид натрия и 40 % вес./объем водную NaOH в полярном апротонном растворителе, та ком как ацетонитрил, при 0оС. Соединения формулы (XXIII) могут быть получены путем нагревания соответствующе го альдегида с нитромета ном в присутствии ацетата аммония. Альдегид может быть получен из соединения формулы (XIX), в которой n имеет определен 9 37178 ные выше значения, используя условия реакции, описанные выше для получения соединения формулы (XVIII) из соответствующе го нитрила. Соединения формулы (XXII), в которой n=0, могут быть получены коммерческим путем или получены из легко доступных исходных ве ществ по методам, известным специалистам в данной области техники или получаемым из химической литературы. Соединения формулы (XXI), в кото рой n¹0, могут быть получены также из соединения формулы (XXXIX): CH 7 R O2C (CH2) n-1 HN H N , (CH2)n Z (XXVI) в которой n и R имеют определенные выше значения, является группой формулы (v) или (vi) а R 7 является С1–4-алкилом, обычно путем нагревания в водной кислоте, например, 2 N HCl. Соединения формулы (XXVI), в которой Z является группой формулы (v), могут быть получены реакцией соединения формулы (XXVII): H N CH O2N O RN , (XXXIX) Z O RN 7 в которой n и Z имеют определенные выше значения, используя условия реакции, аналогичные используе мым при превраще нии (XXIII) в (XXII). Соединения формулы (XXXIX), в которой n и Z имеют определенные выше значения, используя условия реакции, аналогичные используемым при получении (XXIII) из соответствующе го альдегида и нитрометана. Соединения формулы (ХХ), в которой Х не является кислородом, могут быть получены коммерческим путем или получены из легко доступных исходных ве ществ по методам, известным специалистам в данной области техники или получаемым из химической литературы. Соединения формулы (XXV) могут быть получены реакцией раскрытия цикла соединения формулы (I), в которой n и Z имеют определенные выше значения, а W является группой формулы (ii), в которой R, X и Y имеют определенные выше значения, например, путем кипячения с обратным хо лодильником в 2 N водной КОН. Соединения формулы (I), в которой W является группой формулы (i), где Y является серой, могут быть получены путем кипячения с обратным хо лодильником соединения формулы (XV), в которой n, R и Х имеют определенные выше значения, с соединением формулы (VII), в которой Y является серой, а L и L' имеют определенные выше значения, например, N,N'-тиокарбонилимидазолом, обычно в апротонном растворителе, та ком как ТГФ. Соединения формулы (I), в которой W является группой формулы (ii), в которой Y является серой, могут быть получены путем кипячения с обратным холодильником соединения формулы (XXV), в которой n, R и Х имеют определенные выше значения, с соединением формулы (VII), в которой Y является серой, а L, и L' имеют определенные выше значения, например, N,N’-тиокарбонилимидазолом, обычно в апротонном растворителе, та ком как ТГФ. R O2C HN H N , (CH2)n (XXVII) в кото рой n, R и R7 имеют определенные выше значения, с соединением формулы (XXVIII), в которой R3 имеет определенные выше значения, обычно путем нагрева ния в неводной кислоте, например, ледяной уксусной кислоте. Соединения формулы (XXVI), в которой Z является группой формулы (vi), могут быть получены путем восста новления соединения формулы (XXVI), в которой Z является группой формулы (V), обычно путем каталитического гидрирования, используя, например, Pd/C в системе полярных раство рителей, такой как подкисленные метанол/вода. Соединения формулы (XXVII) могут быть получены реакцией соединения формулы (XXIX): H N H2N , (CH2)n (XXIX) в которой n имеет определенные выше значения, с соединением формулы (ХХХ): NCO 7 R O 2C , (XXX) в которой R7 имеет определенные выше значения, обычно в апротонном растворителе, та ком как ДСМ (хлористый мети лен). Соединения формулы (XXIX) и (ХХХ) могут быть получены коммерческим путем или получены из легко доступных исходных вещество по методам, известным специалистам в данной области техники или получаемым из химической лите ратуры. Соединения формулы (I), в которой Z является группой формулы (iv), могут быть получены также из соединения формулы (XXXI): Соединения формулы (I), в которой W является группой формулы (iii), а Z является группой формулы (v) или (vi), могут быть получены также циклизацией соединения формулы (XXVI): 10 37178 Соединения формулы (XXXII) могут быть получены реакцией гидразина формулы (II), в которой n и W имеют определенные выше значения, с фе нилтиоацетальдегидом, или с карбонилзащищенной формой его, например, диэтилацеталь, в полярном растворителе, таком как подкисленный этанол. Соединения формулы (I), в которой Z является группой формулы (vi), могут быть получены также путем восстановления соединения формулы (I), в которой Z является группой формулы (v), обычно путем каталитического гидрирования, используя, например, Pd/C в системе полярных растворителей, такой как подкисленные метанол/вода. Для лучшего понимания изобретения в качестве пояснения представляются следующие примеры. Синтетические примеры. Синте тический пример 1. Получение (S)-2-[5-(2-оксо-1,3-оксазолидин4-илметил)-1Н-индол -3-ил]-этиламина а) Хлоргидрат мети лового эфи ра (S)-4-нитрофе нилаланина. Ме танол (110 мл) обрабатывают по каплям хло ристым тионилом (26,3 г) при -10оС и к полученному раствору добавляют в виде твердого вещества 1–4-нитрофенилаланин (Флюка 21,7 г). Смесь перемешивают в те чение ночи при комнатной температуре и метанол уда ляют в ва кууме, чтобы получить целевой продукт реакции в виде бледно-желтого твердого ве щества (21,2 г). (б) (S)-2-Амино-3-(4-нитрофенил)-пропанол. Продукт реакции из стадии (а), (21,2 г) растворяют в смеси этанола/воды (190 мл), 100/90 в объемном отношении) и раствор добавляют по каплям при 0оС к перемешиваемому раствору борогидрида натрия (13,0 г) в смеси этанола/воды (190 мл, 100/90 в объемном отношении). Получающуюся смесь кипятят с обратным холодильником в течение 2,5 часов, охлаждают и выпадающий осадок отфильтровывают. Этанол частично удаляют из фильтрата в ва кууме и получающийся осадок отфильтровывают и высушивают, что бы получить целевой продукт реакции в виде бледножелтого твер дого ве щества (7,5 г). (в) (5-)-4-(4-Нитробензил)-1,3-оксазолидин2-он. Продукт реакции из стадии (б) (4,9 г) суспендируют в то луо ле, суспензию охлаждают до 0оС и раствор гидроокиси калия (7,0 г) в во де (56 мл) добавляют по каплям. К полученному раствору добавляют по каплям раствор фосгена, (62,5 мл 12 % вес/объем) раствора в толуо ле) в течение 30 минут и перемешивании, продолжающемся в течение 1 часа. Смесь экстрагируют эти лацетатом и экстракты промывают со левым раствором, высушивают и выпаривают в ва кууме, чтобы получить желтое масло. Кристаллизация из этилацетата дает целевой продукт реакции в виде кристаллов бледно-желтого цвета (2,3 г). H N W , (CH2)n (XXXI) в которой n и W имеют определенные выше значения, по методам, известным специалистам в данной области те хники или получаемым из химической литературы, например, обработкой с (COL)2, где L является подхо дящей ухо дящей груп пой, например, хлором, чтобы получить соответствующее соединение 3-COCOL, которое может быть обработано затем с HNR 1R2, где R1 и R2 имеют определенные выше значения, и восстановлено, используя, например, литийалюминийгидрид. Или же соединение формулы (XXXI) может быть обработано смесью СН 2О/KCN, чтобы получить соответствующее 3-цианометильное соединение, которое затем может быть подвергнуто каталитическому гидрированию над никелем Ренея в присутствии HNR 1R2, который определен выше. Упомянутое выше 3-цианометильное соединение может быть получено также путем циклизации соединения формулы (XXXX): NHN = CH(CH 2)2CN W , (CH 2)n (XXXX) в которой n и W имеют определенные выше значения, обычно путем кипячения с обратным холодильником в апротонном растворителе, таком как хло роформ, в присутствии полифосфатного сложного эфира. Соединения формулы (ХХХХ) могут быть получены реакцией соединения формулы (II), в которой n и W имеют определенные выше значения, с 3-цианопропаналем, или с карбонилзащищенной формой его, такой как диэтилацеталь, обычно в водной кислоте, например, разбавленной НСl. Соединения формулы (I), в которой Z является группой формулы (v), могут быть получены также реакцией соединения (XXXI), кото рой n и W имеют определенные выше значения, с соединением формулы (XXVIII), в которой R3 имеет определенные выше значения, обычно, но путем нагревания в ледяной уксусной кислоте. Соединения формулы (XXXI) могут быть получены путем восстановления соединения формулы (XXXII): Формула (XXXII) H N W (CH2)n , (XXXII) SPh (г) Хлоргидрат (S)-4-(4-аминобензил)-1,3-оксазолидин-2-она. Суспензию продукта реакции из стадии (в) (0,79 г) и 10% палладия на угле (0,26 г) в смеси этанола (15 мл) воды (11 мл), этилацета та (2,0 мл) и водной 2N HCl (2,3 мл) перемеши вают при 1-ат в которой n и W имеют определенные выше значения, обычно путем нагревания с никелем Ренея в полярном растворителе, таком как IРА (изопропиловый спирт). 11 37178 мосферном давлении водорода до тех пор, пока не прекратится поглощение водорода. Смесь фильтруют через Hytlo и фильтрат выпаривают в вакууме, чтобы получить целевой продукт реакции в виде бледно-желтого пенообразного вещества (0,79 г). д) Хлор гидрат (S)-4-(4-гидразинобензил)-1,3оксазолидин-2-она. Продукт реакции из стадии (г) (0,79 г) суспендируют в во де (4,8 мл) и по каплям добавляют конц. HCl (8,1 мл). Полученную смесь охлаждают до –5оС и раствор нитрита натрия (0,24 г) в воде (2,4 мл) добавляют по каплям к перемешиваемой смеси в течение 15 минут, за которым следует 30ти минутное перемешивание при температуре от -5 до 0оС. Затем раствор добавляют при 0оС в течение 15 минут к перемешиваемому раствору хлористо го олова (II) (3,8 г) в конц. НСl (6,9 мл), за которым следует 3-х ча совое перемеши вание при комнатной температуре. Раствор выпаривают в вакууме и остаток растирают в по рошок с помощью простого эфира, чтобы получить целевой продукт реакции в виде бледно-желтого твердого вещества (0,96 г). (е) (S)-2-[5-(2-оксо-1,3-оксазолидин-1-ил-метил)-1Н-индол-3-ил] -этиламин. Продукт реакции из стадии (д) (0,84 г) растворяют в смеси этанола/воды (125 мл, 5:1) и раствор обрабатывают диметилацета лем 4-хлорбутанальдегида (IACS 1365 (1951) 0,52 г). Смесь кипятят с обратным холодильником в течение 2 часов, растворитель удаляют в ва кууме и остаток элюируют че рез силикагелевую колонку, используя смесь хлористого метилена EtOH NH 4OH (30:8:1) в качестве элюента. Целевой продукт реакции получают в ви де бесцветного масла (0,21 г). Соль синтети ческого примера 1. Ма леат (соль малеиновой кислоты). Этанольный раствор малеиновой кислоты (1,0 экв) добавляют по каплям к свободному основанию (0,21 г) и эта нол выпаривают в ва кууме. Полученную смолу вы сушивают при температуре ниже 0оС, чтобы избавиться от воды и получить целевой продукт реакции в виде белого продукта этилацетатом. Объединенные экстракты промывают солевым раствором, высушивают и выпаривают, что бы получить бесцветное масло (0,14 г), которое кристаллизуют из изопропилового спирта, чтобы получить целевой продукт реакции в виде белого кристаллического твердого вещества (0,10 г) т.пл. 139–141оС. 1 Н-ЯМР (ДМСО-d6 d): 2,2-(6Н, синглет, NMe2), 2,5 (2H, мультиплет, СН Ar) 2,7–3,0 (мультиплет СН 2) 4,1 (2Н, мультиплет СН2О) 4,3 (1Н, мультиплет СН) 6,9 (1Н, дублет Ar) 7,1 (1Н, синглет, Ar) 7,3 (1Н, дублет Ar) 7,4 (1Н, синглет Ar) 7,7 (1Н, синглет, NHCO) и 10,7 (1Н, синглет, NH). Микроанализ: C 64,26 (64,11) Н 8,28 (8,34) N 12,02 (12,00). [a]22 –5,79 (С=0,5 МеОН). D Соли синтетического примера 2. Ма леат. Раствор малеиновой кислоты (0,17 г) в этаноле (5 мл) добавляют к раствору свободного основания (0,5 г) в этаноле (5 мл). Смесь выпаривают в ва кууме и полученное масло растирают в порошок с помощью простого эфи ра и метанола, чтобы получить малеатную соль в виде белого твердого вещества, кото рое кристаллизуют из этанола (0,45 г), т. пл. 151–152оС. Хлоргидрат. Эфирный раствор HCl (1,1 экв.) добавляют по каплям к перемешиваемому раство ру свободного основания (0,35 г) в метаноле (1 мл) при 0оС. Хлоргидратная соль выпадает в осадок в ви де масла. Смесь выпаривают в вакууме и получающееся пенообразное вещество кристаллизуют из изопропилового спирта, что бы получить целевой продукт реакции в виде белого твердого вещества (0,36 г), т.пл. 118–120оС. [a]23 –9,35 (С=0,31, воD да). Сукцинат (соль янтарной кислоты). Раствор янтарной кислоты (0,36 г) в этаноле (10 мл) добавляют к раствору сво бодного основания (1,0 г) в этаноле (10 мл). Смесь выпаривают в вакууме и полученное пенообразное вещество расти рают в порошок с помощью изопропилового спирта, что бы получить сукцинатную соль в ви де белого твердого вещества (1,0 г) т.пл. 122–123оС. Бензоат. Раствор бензойной кислоты (0,37 г) в эта ноле (10 мл) добавляют к раствору сво бодного основания (1,0 г) в этаноле (10 мл). Смесь выпаривают в вакууме и полученное пенообразное вещество кристаллизуют из эти лацетата, что бы получить бензоатную соль в виде белого твердого вещества (0,74 г), т.пл. 90–92оС. Синте тический пример 3. Другой метод получения 0,9 изопропанолата 0,5 гидрата (S)-N,N-диметил-2-[5-(2-оксо-1,3-оксазолидинилметил)-1Н- индол-3-ил)-этиламина. Диэтилацеталь 4-диметиламинобутанальдегида (Croatica Chemica Acta 36, 103 (1964), 3,9 г) добавляют к раство ру продукта реакции из стадии (д) синте тического примера 1 (10,4 г) в смеси уксусной кислоты (50 мл) и воды (150 мл) и полученную смесь кипятят с обратным холодильником в течение 4,5 часов. Смесь охлаждают, выпаривают в ва кууме и остаток элюируют че рез колонку с кремнеземом, используя смесь хлористого метилена/EtOH/ NH 4OH (50:8:1) в качестве элюента, лиофи лизации (лиофи лата) (0,22 г) [a]21 – 5,82 A (с=0,3–MeOH). 1Н-ЯМР (ДМСО-d6 d): 2,7–3-5 (6H, мультиплет, СН2), 3,35 (2Н, синглет, NH2) 4,05 (2Н, мультиплет, СН2), 4,25 (1Н, мультиплет, СН), 6,05 (2Н, синглет, малеиновая кислота) 6,98 (1Н, дублет, Ar) 7,2 (1Н синглет Ar) 7,3 (1Н, дублет Ar) 7,4 (1Н, синглет Ar) 7,75 (1Н, синглет NH) и 10,9 (1Н, синглет NH). Микроанализ: С 55,03 (54,96) Н 5,54 (5,85) N 10,30 (10,68). Синте тический пример 2. Получение 0,9 изопропанолата 0,5 гидрата (S)-N,N-диметил-2-[5-(2-оксо-1,3-оксазолидин-4-илметил) -1Н-индол-3-ил]-этиламина Раствор формальдегида (0,03 г) в метаноле (1,8 мл) добавляют к раствору сво бодного основания из стадии (е) Синте тического примера 1 (0,12 г) и цианоборогидрата натрия (0,04 г) в смеси метанола (5,5 мл) и ледяной уксусной кислоты (0,14 г) и полученную смесь перемеши вают в течение ночи при комнатной температуре. рН доводят до 8,0 используя водный К2СО3 и смесь экстрагируют 12 37178 чтобы получить целевой продукт реакции в виде бледно-желтого масла, которое кристаллизуют из изопропилового спирта в виде белого кристаллического твердого ве щества (3,5 г), т.пл. 138–140оС. карбонат бария. Последний отфильтровывают и фильтрат выпаривают в вакууме, чтобы получить целевой продукт реакции в виде желтого пенообразного ве щества (1,3 г). (е) Метиловый эфир (+)-3-[3-(1-метил-4-пиперидил)-1Н-ндол-5-ил]- аланина. Раствор продукта реакции из стадии (д) (6,2 г) в метаноле (40 мл) добавляют по каплям к раствору хло ристо го тионила (2,9 мл) в метаноле (35 мл) при -10oС. Полученную смесь перемешивают в течение ночи при комнатной температуре, затем выпаривают в ва кууме и остаток элюируют через колонку с кремнеземом, используя смесь хло ристого метилена EtOH/NH4OH (30:8:1) в качестве элюента. Элюат выпаривают в вакууме, чтобы получить целевой продукт реакции в виде желтого пенообразного ве щества (4,8 г). Н-ЯМР, микроанализ и [a ]D та кие же, что и у продукта реакции синтетического примера 2. 1 Синте тический пример 4. Получение (+)-3-(1-метил-4-пиперидил)-5-(2оксо-1,3-оксазолидин-4-ил -метил)-1Н-индола. (а) 3-(1-Метил-1,2,3,6-тетрагидро-4-пиридил)1Н-индол-5-карбонитрил. 5-Цианоиндол (Альдрих, 20,0 г) добавляют к раствору КОН (22,4 г) в метаноле (200 мл). Затем добавляют N-метил-4-пиперидон (Альдрих, 40,4 г) по каплям и полученную смесь кипятят с обратным холодильником в течение 4 часов, затем охлаждают и выливают к воду. Получающийся осадок отфильтровывают и высушивают, чтобы получить целевой продукт реакции в виде бледно-розового кристаллического твердого вещества (32,6 г). (б) 3-(1-Метил-1,2,3,5-тетрагидро-4-пиридил)1Н-индол-5-карбальденид. Никель Ренея (приблизительно 10 г) добавляют к раствору продукта реакции из стадии (а) (5,0 г) и ги пофосфита натрия (6,0 г) в смеси воды (25 мл), ледяной уксусной кислоты (25 мл) и пиридина (25 мл) при 45оС. Полученную смесь перемешивают при 45оС в течение 1 часа, охлаждают и подще лачивают до рН 9 с помощью 0,88 NH4OH. Смесь фильтруют че рез Hytlo и фильтрат экстрагируют хлороформом. Объединенные экстракты высушивают и выпаривают в ва кууме, чтобы получить целевой продукт реакции в виде не совсем белого твердого вещества, которое перекристаллизовывают из эта нола (2,4 г). (в) 5-[3-(1-Метил-1,2,3,6-тетрагидро-4-пиридил)-1Н-индол-5-илметилен]-2,4-имидазолидиндион. Смесь продукта реакции из стадии (б) (2,4 г), гидантиона (Альдрих 0,98 г) и ацетата аммония (0,74 г) в ледяной уксусной кислоте (2,4 мл) нагревают при 120оС в течение 4 часов. Смесь охлаждают и получающийся осадок отфильтровывают и высушивают, что бы получить целевой продукт реакции в ви де желто го твердого вещества (2,4 г). (г) (+) -5-(2,5-Диоксо-4-имидазолидинилметил)-3-(1-метил-4-пиперидил) -1Н-индол. Продукт реакции из стадии (в) (2,4 г) суспендируют в смеси воды (100 мл) и этанола (200 мл) и добавляют 10 % весовом отношении Pd/C (0,25 г). Смесь перемешивают при 1-атмосферном давлении водорода в течение 17 часов, когда завершается поглощение. Смесь фильтруют че рез фильтрат и вы паривают в ва кууме, чтобы получить целевой продукт реакции в виде бесцветного твердого вещества (2,4 г). (д) (+)-3-[3-(1-Метил-4-пиперидил)-1Н-индол5-ил]-аланин. Раствор продук та реакции из стадии (г) (2,4 г) и гидрата гидроокиси бария (8,4 г) в воде (50 мл) кипятят с обратным холодильником в течение 72 часов, затем охлаждают и вы паривают в ва кууме. Оста ток переносят в горячий метанол и фильтруют, что бы удалить соли бария. Фильтрат выпаривают в ва кууме, оста ток растворяют в во де и добавляют сухой лед, что бы высадить в осадок (ж) (+)-3-[3-(1-Метил-4-пиперидил)-1Н-индол-5-ил)-2-амино-1-пропанол. Раствор продукта реакции из стадии (е) (4,8 г) в воде (20 мл) и этаноле (20 мл) добавляют по каплям к суспензии борогидрида натрия (0,61 г) в смеси воды (20 мл) и этанола (20 мл) при 0oС. Полученную смесь кипятят с обратным холодильником в течение 3 часов, затем выпаривают в ва кууме и остаток элюируют че рез колонку с кремнеземом, используя смесь хлористого метилена EtOH/NH 4OH (30:8:1) в качестве элюента. Элюат выпаривают в ва кууме и остаток перекристаллизовывают из смеси изопропилового спирта/простого эфи ра, чтобы получить целевой продукт реакции в виде бесцветного кристаллического твердого вещества (1,1 г), т.пл. 191–192оС. 1 Н-ЯМР (ДМСО-d6 d): 1,6–1,8 (2H, 2 x CHNMe), 1,8–2,1 (4H, 2 x CH2) 2,2 (3H, синглет NMe) 2,6–3,0 (2Н, 2 х CH NMe, 1H, CH, 2H, CH2Ar), 3,9–4,1 (2Н, мультиплет, СН2О), 4,2–4,4 (1Н, мультиплет, СН11) 6,9 (1Н, дублет, Ar) 7,1 (1H, дублет Ar) 7,3 (дублет, Ar) 7,4 (1Н, синглет Ar) 7,8 (синглет NHCO) и 10,7 (1Н, синглет NH). Соль синтети ческого примера 4. Хлоргидрат. К перемешиваемому раствору свободного основания (1,1 г) в эта ноле (5 мл) добавляют по каплям при 5оС конц. HCl (1,0 экв.). Добавление простого эфи ра к полученной смеси вызывает выпадение в осадок целевого продукта реакции в виде белого твердого вещества (1,1 г), т.пл. 235– 236оС (разл.). Синте тический пример 5. Другойспособ получения (+)-3-(1-метил-4-пиперидил)-5-(1,3-оксазолидин-4-илметил)-1Н-индола. (а) 1Н-индол-5-карбальдегид. Никель Ренея (6,7 г) добавляют к раствору 5-цианоиндола (Альдрих, 10,0 г) и гипофосфата натрия (20,0 г) в смеси воды (73 мл), ледяной уксусной кислоты (73 мл) и пиридина (145 мл) при 45оС. Полученную смесь перемешивают при 45оС в те чение 2 часов, затем охлаждают и фильтруют через Hytlo. Фильтрат разбавляют водой и экстрагируют этилацетатом. Объединенные экстракты промывают во дой, 10%-ной водной лимонной кислотой, водной HCl, водой и солевым раствором, высушивают и выпаривают в ва кууме, чтобы получить целевой продукт реакции в виде тускло-жел 13 37178 того твер дого ве щества, которое перекристаллизовывают из хлороформа (7,5 гм). (б) 5-(2-Нитроэтенил)-1Н-индол. Смесь продукта реакции из стадии (а) (7,5 г) ацетата аммония (1,5 г) и нитрометана (77 мл) нагревают при 110оС в течение 2 часов, затем охлаждают и выпаривают в ва кууме. Остаток растирают в порошок с помощью воды, что бы получить целевой продукт реакции в виде желто го твердого вещества, которое отфильтровывают и высушивают (9,2 г). (в) 5-(2-Нитроэтил)-1Н-индол. Раствор борогидрида натрия (2,0 г) и 40 % вес./объемн. водной NaOH добавляют по каплям к раствору продук та реакции из стадии (б) (1,9 г) в ацетонитриле (55 мл) при 0оС. рН поддерживают при 3–6 путем периодических добавлений 2N водной HCl. Полученный раствор перемешивают при 0оС в те чение 2 часов, затем разбавляют водой и экстрагируют хло ристым метиленом. Объединенные экстракты промывают солевым раствором, высушивают и выпаривают в ва кууме, чтобы получить желтое масло, которое элюируют че рез колонку с кремнеземом, используя хлороформ в качестве элюента, чтобы получить целевой продукт реакции в ви де бледно-желтого масла (0,78 г). (г) 3-(1-Метил-1,2,3,6-тетрагидро-4-пиридил)(2-нитроэтил)-1Н-индол. N-Метил-4-пиперидон (Альдрих 4,2 г) добавляют к раствору продукта реакции из стадии (в) (2,3 г) в ледяной уксусной кислоте (35 мл) при 100оС. Полученный раствор нагревают при 100оС в те чение 1 часа, охлаждают и вы ливают в смесь 0,88 NH4OH (61 мл) и льда (61 г). Полученное твердое вещество отфильтровывают, вы сушивают и перекристаллизовывают из этанола, чтобы получить целевой продукт реакции в виде белого твердого вещества (1,6 г). (д) (+)-3-[3-(1-Метил-1,2,3,6-тетрагидро-4-пиридил)-1Н-индол-5-ил]- 2-амино-1-пропанол. Ме токсид натрия (0,30 г) добавляют к раствору продукта реакции из стадии (г) (1,5 г) в ДМФА (15 мл) при 0оС. К полученному раство ру добавляют по каплям суспензию пара-формальдегида (0,19 г) в ДМФА (20 мл). Полученную смесь перемеши вают при 0оС в течение 1,5 часов, затем выливают в воду и экстрагируют эти лацетатом. Объединенные экстракты промывают во дой и солевым раство ром, высуши вают и вы паривают в вакууме, чтобы получить желтое масло, которое элюируют че рез колонку с кремнеземом, используя смесь хлористо го метилена EtOH/NH4 OH (50:8:1) в ка честве элюента, что бы получить целевой продукт реакции в ви де не совсем белого твер дого вещества (0,85 г), ко торое перекристаллизовы вают из эта нола. (е) (+)-3-[3-(1-Метил-4-пиперидил)-1Н-индол5-ил]- 2-амино-1-пропанол. Продукт реакции из стадии (д) (0,08 г) растворяют в этаноле (25 мл) и добавляют 10% в весовом отношении Pd/C (0,23 г). Смесь перемешивают при 1-атмосфер ном давлении водорода в течение 7 часов, когда завершается поглощение водорода. Смесь фильтруют че рез целит и фильтрат выпаривают в ва кууме, чтобы получить целевой продукт реакции в ви де бесцветного масла, которое элюируют че рез колонку с кремнеземом, используя смесь хлористого метилена EtOH/NH 4OH (50:8:1) в качестве элюента. (ж) (+)-3-(1-Метил-4-пиперидил)-5-(1,3-оксазолидин-4-илметил)-1Н-индол. Смесь продукта реакции из стадии (е) (1,6 г) диэтилкарбоната (0,71 г) и карбоната калия (0,08 г) нагревают при 130оС в течение 5 часов. Смесь охлаждают, переносят в метанол и нерастворимый карбонат калия отфильтровывают. Фильтрат выпаривают в ва кууме и остаток элюируют че рез колонку с кремнеземом, используя смесь хлористого мети лена EtOH/NH 4OH (30:8:1) в качестве элюента, что бы получить бесцветное пенообразное вещество, которое кристаллизуют из смеси изопропилового спирта/просто го эфи ра, чтобы получить целевой продукт реакции в виде бесцветного кристаллического твердого вещества (1,1 г), т.пл. 191–192оС. 1Н-ЯМР и микроанализ являются такими же, что и для продукта реакции из синте тического примера 4. Синте тический пример 6. Получение (R)-2-[5-(2-оксо-1,3-оксазолидин4-илметил)-1Н-индол-3-ил) этиламина. (а) (R)-4-(4-нитробензил)-1,3-оксазолидин-2он. Раствор Д-4-нитрофенилаланина (Фдюка, 53 г) и диметоксиэтана (250 мл) нагревают до 67 oС и в течение 1 часа добавляют BF3 · Et2 O (Альдрих, 37 мл). Полученный раствор перемеши вают при 67oС в течение 1 часа, затем нагревают до 80oС и добавляют в течение 1 часа при 80–85oС, (Альдрих, 40 мл). Полученный раствор нагревают при 85oС в те чение 4 часов, затем охлаждают и добавляют метанол (40 мл). Раствор нагревают до 85 oС и растворители уда ляют перегонкой до 1/3 первоначального объема. Добавляют 6 N водную NaOH (136 мл) к горячему раствору, кото рый затем нагревают при 85oС в течение 1/2 часа, охлаждают и добавляют хлористый метилен (100 мл). Раствор охлаждают до от -15 до -20oС и раствор трихлорметилового эфира хлормуравьиной кислоты (Альдрих, 18,2 мл) в хлористом метилене (23 мл) добавляют при температуре ниже -10oС. рН поддерживают при 9–11 путем периодических добавлений 6 N водной NaOН. Полученный раствор перемеши вают при комнатной температуре в течение 1 часа, затем разбавляют водой и экстрагируют хло ристым метиленом. Объединенные экстракты промывают водой и солевым раствором, высушивают и выпаривают в ва кууме, чтобы получить целевой продукт реакции в ви де бледно-коричневого твердого вещества, которое перекристаллизовывают из эти лацетата, что бы получить бледно-желтое твердое вещество (35 г), т.пл. 113– 115, [a]21 + 46,47 (С=0,56 МеОН). D (б) Хлоргидрат (R)-4-(4-аминобензил)-1,3-оксазолидин-2-она. Продукт реакции из стадии (а) (10,0 г) суспендируют в смеси воды (120 мл), этанола (60 мл) мл 2 N водной HCl (22,5 мл) и добавляют 10 вес.% Pd/C (1,0 г). Смесь перемешивают при 1-атмосферном давлении водорода в течение 8 часов, когда завершается поглоще ние водорода. Смесь фильтруют через Hytlo и фильтрат выпаривают в вакууме, чтобы получить целевой продукт реакции 14 37178 в ви де бесцветного стеклообразного вещества (10,3 г). (в) Хлоргидрат (R)-4-(4-гидразинобензил)1,3-оксазолидин-2-она. Продукт реакции из стадии (б) (10,3 г) суспендируют в во де (53 мл) и по каплям добавляют конц. HCl (106 мл). Полученную смесь охлаждают до -5oС и к перемешиваемой смеси в течение 15 минут добавляют по каплям раствор нитрита натрия (3,2 г) в во де (30 мл), за которым следует 30минутное перемеши вание при температуре от -5 до 0oС. Раствор добавляют затем при 0oС в течение 15 минут к перемеши ваемому раствору хлористо го олова (II) (51 г) в конц. HCl (91 мл), за которым следуе т 3-часовое перемешива ние при комнатной температуре. Раствор выпаривают в вакууме и остаток растирают в по рошок с помощью простого эфира, чтобы получить целевой продукт реакции в виде бледно-желтого твердого вещества (11 г). (г) (R)-2-[5-(2-оксо-1,3-оксазолидин-4-илметил)-1Н-индол-3-ил] -этиламин. Продукт реакции из стадии (в) (8,8 г) растворяют в смеси этанол/воды (500 мл, 5:1 в объемном отноше нии) и раствор обрабатывают диметилацеталем 4-хлорбута нальдегида (I. Amer. Chem. Soc., 1365, (1951), 5,5 г). Смесь кипятят с обратным холодильником в течение 2 часов, растворитель удаляют в вакууме и остаток элюируют че рез колонку с кремнеземом, используя смесь хлористого метилена /EtOH/NH 4OH (30:8:1 в объемном отноше нии) в качестве элюента. Це левой продукт реакции получают в ви де бледно-желто го масла (0,60 г). Соль синтети ческого примера 7. Хлоргидрат. К перемешиваемому раствору свободного основания (0,45 г) в этаноле (4,5 мл) добавляют по каплям при 0оС конц. HCl (0,16 мл). Смесь выпаривают в ва кууме и полученное пенообразное вещество растирают в порошок с помощью этилацетата, что бы получить целевой продукт реакции в виде белого твердого вещества, т.пл. 130oС, [a]21 +5,15 (с=0,77 МеОН). D Синте тический пример 8. Получение хлоргидрата (S)-N,N-диметил-2[5-(2-тиа-1,3-оксазолидин-4-илметил)-1Н-индол-3ил]этиламина. (а) (S)-N,N-диметил-2-[5-(2-амино-1-пропанол)-1Н-индол-3-ил] -этиламин. Раствор хло ристоводородной соли продукта реакции из синтети ческого примера 2 (0,33 г) в 2 N водной КОН (10 мл) кипятят с обратным холодильником в течение 4 часов, затем охлаждают и экстрагируют эти лацета том. Объединенные экстракты высушивают и вы паривают в ва кууме, чтобы получить целевой продукт реакции в ви де бесцветного масла (0,25 г). (б) Хлоргидрат (S)-N,N-диметил-2-[5-(2-тиа1,3-оксазолидин-4-ил-метил)-1Н-индол-3-ил]-этиламина. Раствор N,N-тиокарбонилимидазола (Альдрих, 0,21 г) в ТГФ (4 мл) добавляют по каплям к перемеши ваемому раствору продукта реакции из стадии (А) (0,31 г) в ТГФ (4 мл) и смесь кипятят с обратным холодильником в течение 23 часов, затем охлаждают и выпаривают в вакууме. Остаток хроматографи руют че рез колонку с кремнеземом, используя смесь хлористого метилена EtOH/NH 4OH (20:8:1) в качестве элюента, что бы получить целевой продукт реакции в виде бесцветного масла. Соль синтети ческого примера 8. Хлоргидрат. К свободному основанию добавляют по каплям 1М этанольный раствор HСl (1,0 экв.) и этанол выпаривают в ва кууме. Полученную смолу высушивают при температуре ниже 0oС, чтобы удалить воду и получить целевой продукт реакции в виде белого твердого вещества (0,17 г), т.пл. 133– Соль синтети ческого примера 6. Хлоргидрат. К перемешиваемому раствору свободного основания (0,16 г) в этаноле (2 мл) при 0оС добавляют по каплям конц. HCl (0,06 мл). Хло ристоводородная соль выпадает в осадок в виде желтовато-коричневого твердого вещества, т. пл. 269– 271oС, [a]21 + 5,88 (с=0,27 МеОН). D Синте тический пример 7. Получение (R)-N,N-диметил-2-[5-(2-оксо-1,3оксазолидин-4-илметил)-1Н-индол-3-ил)этиламина. Раствор 35 % вес./объемн. водного формальдегида (0,3 мл) в мета ноле (2,0 мл) добавляют к раствору продукта реакции из стадии (г) синте тического примера 6 (0,44 г) и цианоборогидрида натрия (0,13 г) в смеси метанола (8,5 мл) и ледяной уксусной кислоты (0,51 г) при 10oC и полученную смесь перемешивают при комнатной температуре в течение 2,5 часов. Добавляют 2N водную NaOH (1,3 мл), затем борогидрид натрия (0,19 г), после чего 2N водную HCl (1,3 мл). Метанол выпаривают в ва кууме и остающийся раствор разбавляют водой, доводят до рН 7 с помощью твердого карбоната калия и промывают эти лацетатом. Добавляют дополнительное количество карбоната калия до рН 11 и раствор экстрагируют этилацетатом. Объединенные экстракты вы паривают в ва кууме, чтобы получить целевой продукт реакции в виде белого пенообразного вещества (0,45 г). 5 136oС) размягчается при 128oС) [a]24,D –29,8 (с=0,5 вода). Синте тический пример 9. Получение бромгидрата (S)-2-[5-(3-метил-2оксо-1,3-оксазолидин-4-ил-ме тил)-1Н-ин дол-3ил] эти ламина. (а) (S)-3-метил-4-(4-нитробензил)-2-оксазолидинон. Гидрид натрия (0,80 г) в ви де 60%-ной в весовом отношении дисперсии в масле) добавляют при комнатной температуре к перемешиваемому раствору продукта реакции из стадии (в) синтетического примера 1 (4,4 г) в сухом ТГФ (150 мл). Смесь перемеши вают в те чение 1,5 часов, затем добавляют диметилсульфат (2,1 мл) и перемешивание продолжают в те чение дополнительных 16 часов. Добавляют добавочной 0,40 г гидрида натрия и перемешивание продолжают в те чение еще 2 часов. Смесь выпаривают в ва кууме и остаток суспендируют в эти лацетате и фильтруют. Фильт 15 37178 рат выпаривают в ва кууме и остаток кристаллизуют из смеси этилацетата/гексана, чтобы получить целевой продукт реакции в виде желтых кри ноле (9,0 мл). Когда завершается бур ное выделение газа, добавляют раствор 37% вес/объем водный формальдегид (0,16 г) в метаноле (2,0 мл) и смесь перемеши вают в течение 1 часа, затем разбавляют водой, насыщают карбонатом калия и экстрагируют эти лацетатом. Объединенные экстракты выпаривают в ва кууме и остаток элюируют через колонку с кремнеземом, используя смесь хло ристого метилена MeOH/NH4OH (60:8:1) в качестве элюента, что бы получить свободное основание целево го продукта реакции в ви де бесцветного масла (0,25 г). Последнее растворяют в этаноле (10 мл), обрабатывают раствором малеиновой кислоты (0,09 г) в эта ноле (1 мл) и полученный раствор выпаривают в вакууме, чтобы получить масло, которое растирают в по рошок с помощью эфи ра, высуши вают при температуре ниже 0oС, чтобы избавиться от во ды и получить целевой продукт реакции в ви де бесцветного стеклообраз сталлов (3,7 г) т.пл. 146–147oС. [a]23 + 64,6 (с=1, D 0 МеОН). (б) Хлоргидрат (S)-3-метил-4-(4-аминобензил)-2-оксазолидинона. Суспензию продукта реакции из стадии (а) (4,0 г) и 10 вес. % Pd/C (0,20 г) в смеси этанола (70 мл) и разбавленной HСl (2 N водной HCl (12 мл) + вода (55 мл)) гидрируют при давлении 45 psi (3,16 атм) в течение 1 часа. Смесь фильтруют че рез Hytlo и фильтрат вы паривают в ва кууме, чтобы получить целевой продукт реакции в виде пенообразного ве щества. (в) Хлоргидрат (S)-3-метил-4-(4-гидразинобензил)-2-оксазолидинона. Раствор продукта реакции из стадии (б) (4,1 г) в воде (24 мл) охлаждают до -5 оС и добавляют конц. HCl. Раствор нитрита натрия (1,2 г) в во де (12 мл) добавляют, а затем продолжают перемешивать в течение 0,5 часа. Полученный раствор добавляют по каплям при -5оС к перемешиваемому раствору дигидрата хлористого олова (II) (18,8 г) в конц. HCl (34 мл). Полученную смесь перемешивают при 0оС в течение 2,5 часов, затем выпаривают в ва кууме. Остаток переносят в воду, доводят до рН 2,5, используя 10N водную NаОН и фильтруют. Фильтрат выпаривают в ва кууме и остаток растирают в порошок с помощью этанола и фильтруют. Фильтрат выпаривают в ва кууме, чтобы получить целевой продукт реакции в виде пенообразного вещества. (г) Гидробромид (S)-2-[5-(3-метил-3-оксо-1,3оксазолидин-4-ил-метил)-1Н-индол-3-ил] этиламина. Диметилацеталь 4-хлорбутанальдеги да (I. Amer. Chem. Soc. 1365 (1951) 2,3 г) добавляют к перемеши ваемому раствору продукта реакции из стадии (в) (4,4 г) в смеси этанола/воды (150 мл/30 мл) и смесь кипятят с обратным холодильником в течение 2 часов. Охлажденную смесь выпаривают в ва кууме и остаток элюируют че рез колонку с кремнеземом, используя смесь хлористого метилена /MeOH/NH 4OH (60:8:1) в качестве элюента, чтобы получить коричневое масло (1,7 г). Часть этого масла (0,25 г) растворяют в эта ноле и обрабатывают с избытком HBr в уксусной кислоте (приблизительно 45% вес/объем). Полученный раствор выпаривают в ва кууме и остаток растирают в порошок с помощью эфира, затем кристаллизуют из смеси этанола/гексана, чтобы получить целевой продукт реакции в ви де бледно-желтых ного ве щества [a]22 + 24,5 (c= 0,5 Me OH). ЭлеD ментарный анализ 1Н-ЯМР и масс-спектрометрия соответствуют предполагаемой структуре. Синте тический пример 11. Получение 0,75 гидрата малеата (S)-N-бензил-2-[-5-(2-оксо-1,3-оксазолидин-4-илметил)-1Ниндол-3-ил]-этиламина. Бензальдегид (0,70 г) добавляют при комнатной температуре к перемешиваемому раствору cоединения cинтетического примера 1 (1,7 г) в этаноле (20 мл). Раствор перемеши вают в течение 36 часов, затем добавляют по частям борогидрат натрия (0,25 г) и перемешивание продолжают в течение еще 2 часов. Раствор выпаривают в вакууме и остаток охлаждают, подкисляют с помощью 2N водной HCl, подще лачивают бикарбонатом натрия, насыщают карбонатом калия и экстрагируют эти лацета том. Объединенные экстракты выпаривают в ва кууме, чтобы получить масло, которое элюируют че рез колонку с кремнеземом, используя смесь хлористого метилена EtOH/NH4OH (100:8:1) в качестве элюента, что бы получить свободное основание целевого продук та реакции в виде желтого пенообразного ве щества (1,6 г). Часть этого вещества (0,13 г) растворяют в этаноле (10 мл), обрабатывают раствором малеиновой кислоты (43 мл) в этаноле (1 мл) и полученный раствор выпаривают в ва кууме. Остаток высушивают при температуре ниже 0оС, чтобы избавиться от воды и получить целевой продукт реакции в виде бледно-желтого порошка (0,16 г) [a]24 +1,4 D (c = 0,5 MeOH). Элементарный анализ, 1Н-ЯМР и масс-спектрометрия согласуются с предложенной структурой. Синте тический пример 12. Получение гидрата малеата (S)-N-бензил-Nметил-2-[5-(2-оксо-1,3-оксазолидин-4-илметил)-1Ниндол-3-ил)этиламина. К раствору сво бодного основания из синтетического примера 11 (0,45 г) в ДМФА (8,0 мл) добавляют при комнатной температуре безводный карбонат калия (0,34 г). Суспензию перемешивают в те чение 0,5 часа, затем раствор диметилсульфа та (0,17 г) в ДМФА (2,0 мл) добавляют и перемешивание продолжают в течение еще 3 часов. Добавляют воду (40 мл) и смесь экстрагируют этилацетатом. Объединенные экстракты выпаривают кристаллов (0,14 г) т.пл. 203–205оС, [a]25 + 29,9 D (c=0,5 MeOH). Эле ментарный анализ и Н-ЯМР соответствуют предполагаемой структуре. Синте тический пример 10. Получение малеата 0,75 гидрата (S)-N,N-диметил-2-[5-(3-ме тил-2-оксо-1,3-оксазолидин-4-илметил) -1Н-индол-3-ил]этиламина. Цианоборогидрид натрия (0,14 г), за которым следует ле дяная уксусная кислота (0,54 мл), добавляют при комнатной температуре к перемешиваемому раство ру сво бодного основания (0,52 г) из стадии (г) cинтетического примера 9 в мета 16 37178 в ва кууме, чтобы получить желтое масло, которое элюируют че рез колонку с кремнеземом, используя смесь хлористого мети лена /EtOH/NH4OH (100:8:1) в качестве элюента, что бы получить свободное основание целевого продук та реакции в виде бесцветного масла (0,32 г). Часть это го масла (73 г) растворяют в эта ноле (10 мл), обрабатывают раствором малеиновой кислоты (23 г) в этаное (1 мл) и полученный раствор выпаривают в вакууме. Остаток высуши вают при температуре ниже 0oС, чтобы избавиться от воды и получить целевой продукт реакции в виде бледно-желтого еще 2,0 г никеля Ренея и кипячение с обратным хо лодильником продолжают в течение дополнительных 2 ч. Суспензию фильтруют в го рячем состоянии через Hytlo и фильтрат выпаривают в вакууме, чтобы получить масло. Последнее элюируют че рез колонку с кремнеземом, используя этилацетат в качестве элюента, чтобы получить целевой продукт реакции в виде пенообразного вещества (1,3 г). 1Н-ЯМР и масс-спектрометрия согласуются с предложенной структурой. в) 0,33 Метанолат 0,75 гидрата (5)-3-(1-метил-1,2,3,6-тетрагидро-4-пиридил)-5-(2-оксо-1,3-оксазолидин-4-илметил)-1Н-индола. 1-Метил-4-пиперидон (0,74 г Альдрих) добавляют к перемешиваемому раствору продукта реакции из стадии (б) (0,30 г) в ледяной уксусной кислоте (2,0 мл) и смесь перемеши вают при 100оС в те чение 2 ч. Охлажденную смесь выливают на смесь льда NH4OH (20 мл) и полученное твердое вещество отфильтровывают. Последнее элюируют че рез колонку с кремнеземом, используя смесь хлористого мети лена (EtOH/NH4OH) (60:8:1) в качестве элюента и кристаллизуют из эти лацетата, что бы получить целевой продукт реакции в виде бесцветного твердого вещества (0,11 г) т.пл. порошка [a]24 + 3,1 (c = 0,5 MeOH). ЭлементарD ный анализ 1Н-ЯМР и масс-спектрометрия согласуются с предложенной структурой. Синте тический пример 13. Получение 0,5 гидрата малеата (S)-N-метил2-[5-(2-оксо-1,3-оксазолидин-4-илметил)-1Н-индол3-ил]-этиламина. Суспензию свободного основания продукта реакции из cинтетического примера 12 (0,25 г) и 10 вес. % Pd/C (0,10 г) в эта ноле (25 мл) гидрируют в течение 16 часов. Смесь фильтруют че рез Hytlo и фильтрат выпаривают в ва кууме. Остаток элюируют че рез колонку с кремнеземом, используя смесь хлористого метилена EtOH/NH4OH (30:8:1) в качестве элюента, чтобы получить свободное основание целевого продук та реакции (0,14 г). Последнее растворяют в эта ноле (10 мл), обрабаты вают раствором малеиновой кислоты (0,06 г) в этаноле (1 мл) и полученный раствор выпаривают в вакууме. Остаток высушивают при температуре ниже 0oС, что бы избавиться от во ды и получить целевой продукт реакции в виде гиг 225–227оС [a]20 – 45,4 (c = 0,5 1N водная HCl). D Элементарный анализ и 1Н-ЯМР согласуются с предложенной структурой. Синте тический пример 15. Получение гидробромида (S)-3-(1-метил-4пиперидил)-5-(2-оксо-1,3-оксазолидин-4-илметил)1Н-индола. Суспензию продукта реакции из cинтетического примера 14 (0,35 г) и 10 вес. % Pd (0,10 г) в смеси метанола (10 мл), воды (10 мл) и 1N водной HCl гидрируют в течение 5 ч. Смесь фильтруют через Hytlo и фильтрат вы паривают в ва кууме. Остаток подщелачивают с помощью NH4OH, выпаривают в вакууме и элюируют че рез колонку с кремнеземом, используя смесь хлористого метилена EtOH/NH 4OH (45:8:1) в качестве элюента, что бы получить масло. Последнее растворяют в этаноле (5,0 мл) и обрабаты вают избытком HBr в уксусной кислоте (приблизительно 45 % вес./об.), чтобы получить целевой продукт реакции в ви де бесцвет роскопичного твердого вещества [a]21 –5,4 (c = D =0,5 MeOH). Элементарный анализ и Н-ЯМР согласуются с предложенной структурой. Синте тический пример 14. Получение 0,33 метанола и 0,75 гидрата (S)3-(1-метил-1,2,3,6-тетрагидро-4-пиридил)-5-(2-оксо1,3 -оксазолидин-4-илметил)-1Н-индола. (а) ( )-3-фе нилтио-5-(2-оксо-1,3-оксазолидин4-илметил-1Н-индол. Диэтилацеталь фенилтиоацетальдегида (I.C.S. Chem. Comm. 924 (1978), 9,1 г) добавляют при комнатной температуре к перемешиваемому раствору продукта реакции из стадии (д) cинтетического примера 1 (9,8 г) в смеси этанола (150 мл) и воды (100 мл). Добавляют конц. HCl (5 капель) и смесь перемешивают при комнатной температуре в течение 2 суток, затем частично выпаривают в ва кууме. Полученную водную суспензию экстрагируют эти лацетатом и объединенные экстракты промывают во дой и выпаривают в ва кууме, чтобы получить коричневое масло. Последнее элюируют через колонку с кремнеземом, используя смесь хло ристого метилена EtOH/NH4OH (150:8:1) в качестве элюента, чтобы получить целевой продукт реакции в ви де бледно-желтого масла (5,0 г). б) (S)-5-(2-оксо-1,3-оксзаолидин-4-илметил)1Н-индол. Никель Ренея (3,0 г) добавляют к раствору продукта реакции из стадии (а) (3,1 г) в изопропиловом спирте (150 мл) и суспензию кипятят с обратным холодильником в течение 1 ч. Добавляют ных кристаллов (0,20 г). Т.пл. 260–261оС. [a]21 D – 5,2 (c = 0,5 во да). Элементарный анализ и 1НЯМР согласуются с предложенной структурой. Синте тический пример 16. Получение гидрата (R)-3-(1-метил-1,2,3,6тетрагидро-4-пиридил)-5-(2-оксо-1,3-оксазолидин5-илметил)-1Н-индола. а) Хлоргидрат (R)-4-(4-гидразинобензил)1,3-оксазолидин-2-она. По стадиям, одинаковым со стадиями от (а) до (в) из cинтетического примера 6 превращают Д4-нитрофенилаланин в хлор гидрат (R)-4-(4-гидразинобензил)-2-оксазолидинона. б) Гидрат (R)-3-(1-метил-1,2,3,6-тетрагидро4-пиридил) -5-(2-оксо-1,3-оксазолидин-4-илметил)1Н-индола. По стадиям, аналогичным стадиям от (а) до (в) из cинтетического примера 14, превращают продукт реакции из стадии (а) в гидрат (R)-3-(1-метил-1,2,3,6-тетрагидро-4-пиридил)-5-(2-оксо-1,3-ок 17 37178 сазолидин-4-илметил)-1Н-индола, т.пл. 229–231 оС обратным холодильником, затем выпаривают в вакууме. Остаток экстрагируют эфи ром, подкисляют и хроматографируют, используя обратимую фа зовую ЖХВД-колонку с кремнеземом и элюируя смесью 10–90 об.% воды/ацето нитрила вместе с 0,1 М водным аммоний-ацетатным буфе ром при рН 4,0 в течение 20 мин, чтобы получить целевой продукт реакции (0,01 г), и после обработки с НСl, продукт реакции из синтетического примера 8 (0,11 г). Оба продукта высушивают при температуре ниже 0оС, чтобы удалить воду и получить Н-ЯМР и масс-спектрометрию, которые согласуются с предложенной структурой. Синте тический пример 21. Получение хлоргидрата (+)-N,N-диметил-2[5-(2-оксо-1,3-оксазолидин-5-илметил)-1Н-индол-3ил]-этиламина. а) (+)-1-нитрометил-2-фенилэтанол. Ме токсид натрия (1,1 г) добавляют к перемешиваемому раствору нитрометана (Альдрих, 12,2 г) в метаноле (100 мл) при 0 оС и смесь перемешивают в те чение 10 мин. Раствор фе нилацетальдегида (Альдрих, 24,0 г) в метаноле (50 мл) добавляют по каплям в течение 15 мин и смесь перемеши вают в течение 45 мин при 0 оС, затем доводят до комнатной температуры в те чение 1 ч и перемешивают в те чение ночи. Смесь выпаривают в вакууме и остаток растворяют в воде и экстрагируют эфи ром. Объединенные экстракты промывают водой и солевым раствором и выпаривают в ва кууме, чтобы получить целевой продукт реакции в ви де желто го масла (29,0 г). б) Хлор гидрат (+)-1-аминометил-2-фенилэтанола. Суспензию продукта реакции из стадии (а) (10,0 г) и 10 вес. % Pd/C (1,0 г) в этаноле (250 мл) гидрируют до тех пор, пока поглощение водорода не прекратиться. Смесь фильтруют че рез Hytlo и фильтрат вы паривают в ва кууме. Оста ток растворяют в эти лацета те и экстрагируют 2N водной HCl. Объединенные экстракты промывают этилацетатом, затем выпаривают в ва кууме, чтобы получить целевой продукт реакции в виде розовато-белого твердого вещества (6,8 г). в) (+)-5-Бензил-1,3-оксазолидин-2-он. Раствор КОН (9,4 г) в воде (85 мл) добавляют к перемешиваемому раствору продукта реакции из стадии (б) (5,1 г) в толуоле (150 мл) при 0oС. Раствор фосгена (9,8 г) в толуоле (78,4 мл = 12,5 % вес/об) добавляют по каплям в течение 15 мин и смесь доводят до комнатной температуры; затем перемешивают в те чение ночи. Водную фазу отделяют и экстрагируют эти лацетатом. Объединенные экстракты выпаривают в вакууме, чтобы получить целевой продукт реакции в виде белого твердого вещества (2,2 г) т.пл. 106–108oС. Элементарный анализ согласуется с предложенной структурой. г) (+)-5-(4-нитробензил)-1,3-оксазолидин-2он. К продук ту реакции из стадии (в) при 0 оС добавляют конц. Н2SO4 (1,6 мл), а затем конц. HNO3 (0,33 мл) приблизительно, 0,05 мл за 5 мин) также при 0оС. Смесь перемешивают в те чение 0,5 ч при 0оС, а затем в течение 0,5 ч при комнатной температуре. Добавляют смесь воды/льда (100 мл) и реакционную смесь экстраги руют этилацета том. [ ] + 24,9 (c = 0,5 1N водная HCl). Элементарный анализ и Н-ЯМР согласуются с предложенной структурой. Синте тический пример 17. Получение бромгидрата (R)-3-(1-метил-4-пиперидил)-5-(2-оксо-1,3-оксазолидин-4-илметил)-1Ниндола. По методу, аналогичному из cинтетического примера 15, превращают продукт реакции из синтетического примера 16 в бромгидрат (R)-3-(1-метил-4-пиперидил)-5-(2-оксо-1,3-оксазолидин-4-илa 18 D метил)-1Н-индола, т.пл. 260–261 [a]19 + 4,6 (c = D =0,5 вода). Элементарный анализ и 1Н-ЯМР согласуются с предложенной структурой. Синте тический пример 18. Получение гидрата (R)-3-(1-бензил-1,2,3,6тетрагидро-4-пиридил)-5-(2-оксо-1,3-оксазолидин4-илметил)-1Н-индола. 1-Бензил-4-пиперидон (Альдрих, 2,8 г) добавляют к перемешиваемой суспензии (R)-5-(2-оксо-1,3-оксазолидин-4-илметил)-1Н-индола (1,0 г), промежуточного предшественника (исходного вещества) продукта реакции из синтети ческого примера 16, в ледяной уксусной кислоте (20 мл) и перемеши вают при 100оС в течение 3 ч. Охлажденную смесь выпаривают в ва кууме и остаток растворяют в метаноле, подще лачивают с помощью NH4OH и выпаривают в вакууме, чтобы получить темный деготь. Последний элюируют через колонку с кремнеземом, используя смесь хлористого метилена EtOH/NH 4OH (100:8:1) в качестве элюента и обрабатывают хло ристым метиленом. Полученный осадок отфильтровывают, что бы получить целевой продукт реакции в виде желтых кристаллов (0,25 г), т.пл. 169–170,5оС. Элементарный анализ и Н-ЯМР согласуются с предложенной структурой. Синте тический пример 19. Получение бромгидрата (R)-3-(4-пиперидил) -5-(2-оксо-1,3-оксазолидин-4-илметил)-1Н-индола. Суспензию продукта реакции из синтетического примера 18 (0,25 г) и 10 вес.% Pd/C (0,10 г) в метаноле (25 мл) гидрируют при давлении 90 рsi (6,32 атм) в течение 20 ч, когда прекращается поглощение водорода. Смесь фильтруют че рез Hytlo и фильтрат выпаривают в ва кууме. Остаток элюируют че рез колонку с кремнеземом, используя смесь хлористого мети лена EtOH/NH 4OH (30:8:1) в качестве элюента, чтобы получить масло. Последнее растворяют в изопропиловом спирте и обрабатывают избытком HBr в уксусной кислоте (приблизительно 45 % вес./об., чтобы получить гигроскопичное твердое вещество, которое высушивают при температуре ниже 0, чтобы удалить воду и получить целевой продукт реакции в виде бледнокоричневого порошка. Элементарный анализ и 1 Н-ЯМР согласуются с предложенной структурой. Синте тический пример 20. Получение ацетата (+)-N,N-диметил-2-[5-(1тио-2-тиа-3-оксазолидин-4-илметил) -1Н-индол-3ил)этиламина. Сероуглерод (90 мкл) добавляют к перемешиваемому раствору продукта pеакции из стадии (а) синтетического примера 8 (0,31 г) и гидроокиси калия (0,08 г) в этаноле (3,8 мл) и смесь кипятят с 18 37178 Объединенные экстракты выпаривают в ва кууме, чтобы получить желтое масло, которое перекристаллизовывают из эти лацетата, что бы получить целевой продукт реакции в ви де белого порошка (0,4 г) т.пл. 143–146оС. д) Хлоргидрат (+)-5-(4-аминобензил)-1,3-оксазолидин-2-она. Суспензию продукта реакции из стадии (г) (1,4 г) и 10 вес. % Pd/C (0,14 г) в смеси воды (21 мл) этанола (28 мл) и 2 N водной HCl (3,2 мл) гидрируют в те чение 2 ч, когда прекращается поглоще ние водорода. Смесь фильтруют че рез Hytlo и фильтрат выпаривают в вакууме, чтобы получить целевой продукт реакции в виде бледно-желтого пенообразного ве щества (1,4 г). е) Хлоргидрат (+)-N,N-диметил-2-[5-(2-оксо1,3-оксазолидин-5-илметил)-1Н-индол-3-ил)-этиламина. К перемешиваемому раствору продук та реакции из стадии (д) (1,4 г) в во де (8,5 мл) при 0оС добавляют конц. HCl (14,5 мл). Раствор нитрита натрия (0,43 г) в воде (4,3 мл) добавляют по каплям в течение 15 мин при 0оС и смесь перемешивают в течение 0,5 ч при 0оС. Смесь добавляют затем по каплям к перемешиваемому раствору хло ристого олова (II) (6,8 г) в конц. HCl (12,4 мл) при 0оС в течение 15 мин. Смесь доводят до комнатной температуры в те чение 1 ч, затем выпаривают в ва кууме. Остаток растворяют в во де (30 мл), доводят до рН 2,5, используя 10N водную NaOH и выпадающие в осадок соли отфильтровывают. Диэти лацеталь-4-диметиламинобутанальдегида (Groatica Chemica Acta, 36, 103 (1964) 1,1 г), за кото рым следует ио нообменная смола типа "Ам берлит 15" (Альдрих, 3,0 г), добавляют к фильтрату и смесь нагревают в течение 3 ч при 100оС, фильтруют и фильтрат выпаривают в вакууме. Оста ток обрабатывают го рячим этанолом, фильтруют и фильтрат вы паривают в ва кууме. Остаток растирают в порошок с помощью этилацетата, фильтруют и фильтрат выпаривают в ва кууме. Оста ток перекристаллизовывают из эта нола, чтобы получить целевой продукт реакции в виде бледно-желтого твердого вещества (0,75 г), т. пл. 280–281оС. Н-ЯМР и масс-спектрометрия согласуются с предложенной структурой. По стадиям, аналогичным стадиям от (г) до (е) синтетического примера 1 и cинтетического примера 2 или стадиям (г) и (д) синтетического примера 1 и синтетического примера 3 и стадиям от (д) до (з) синтетического примера 4, превращают продукт реакции из стадии (а) в (S)-N,N-диметил-2-[5-(2-оксо-1,3-оксазолидин-4-илметил)-1Ниндол-3-ил]-этиламин. Cинте тический пример 23. Получение (S)-N,N-диметил-2-[5-(2-оксо-1,3оксазолидин-4-илметил)-1Н- индол-3-ил)-этиламина. а) Хлоргидрат (S)-4-(4-гидразинобензил)-1,3оксазолидин-2-она. По стадиям, аналогичным стадиям от (а) до (в) из синтети ческого примера 6, превращают 1-4нитрофе нилаланин в хлоргидрат (S)-4-(4-гидразинобензил)-1,3-оксазолидин-2-она. б) (S)-[4-[4-2-[-(3-цианопропилиден)-гидразино] бензил]-1,3 -оксазолидин-2-он. 1 М водную НСl (4,0 мл) добавляют к раствору продукта реакции из стадии (а) (2,4 г) в во де (35 мл). Диэтилацеталь 3-цианопропанальдегида (Альдрих, 1,7 г) добавляют при комнатной температуре и смесь перемешивают в течение 2 ч. Добавляют еще 0,20 г ацеталя и смесь перемешивают в те чение дополнительных 20 мин. Водную фа зу декантируют от получающейся смолы и экстрагируют эти лацетатом. Экстракты объединяют со смолой и выпаривают в ва кууме, чтобы получить целевой продукт реакции (2,5 г). в) (S)-3-цианометил-5-(2-оксо-1,3-оксазолидин-4-илметил)-1Н-индол. Раствор продукта реакции из стадии (б) (2,5 г) и полифосфатный сложный эфир (20,0 г) в хлорофор ме (40 мл) кипятят с обратным холодильником в течение 20 мин. К охлажденной смеси добавляют лед и хлороформ выпаривают в ва кууме. Остающуюся водную фа зу экстрагируют эти лацетатом и объединенные экстракты выпаривают в вакууме, чтобы получить целевой продукт реакции в ви де бледно-желто го масла (1,8 г). г) (S)-N,N-диметил-2-[5-(2-оксо-1,3-оксазолидин-4-илметил)-1Н- индол-3-ил)-этиламин. Суспензию продукта реакции из стадии (в) (1,3 г) и 10 вес. % Pd/C (1,0 г) в 30 вес. % этанольном диметиламине (25 мл) гидрируют в течение 24 ч и фильтруют через Hytlo. К фильтрату добавляют свежеприготовленный (0,7 г) и этанольный диметиламин (5 мл) и гидрирование продолжают в течение еще 16 ч. Смесь фильтруют че рез колонку с кремнеземом, используя смесь хлористого метилена EtOH/NH 4OH (40:8:1) в качестве элюента, что бы получить целевой продукт реакции в виде бесцветного пенообразного вещества (0,3 г). Элементарный анализ и 1Н-ЯМР согласуются с предложенной структурой. Синте тический пример 22. Получение (S)-N,N-диметил-2-[5-(2-оксо-1,3оксазолидин-4-илметил)-1Н- индол-3-ил)-этиламина. a) (S)-5-(4-нитробензил)-1,3-имидазолидин2,4-дион. Бензилизоцианат (Альдрих, 3,2 г) добавляют к раствору 1-4-нитрофенилаланина (Альдрих, 4,2 г) и гидроокиси калия (1,3 г) в воде (40 мл) при 0оС. Смесь нагревают при 60–70оС в течение 2 ч, фильтруют и фильтрат подкисляют с помощью конц. НСl, чтобы получить не совсем белое твердое вещество, которое отфильтровывают, суспендируют в 2N водной НСl (20 мл) и кипятят с обратным холодильником в течение 2 ч. Охлажденную смесь разбавляют водой и фильтруют, что бы получить целевой продукт реакции в виде белого твердого вещества (45,6 г). б) (S)-N,N-Диметил-2-[5-(2-оксо-1,3-оксазолидин-4-илметил)-1Н- индол-3-ил)-этиламин. Синте тические примеры от 24 до 31. По методам, аналогичным описанным в синтетических примерах от 1 до 23, получают следующие соединения формулы (1). ЯМР и микроанализ для каждого соединения согласуются с предложенной структурой. 24) 0,75 гидрат малеата-2-[5-(3-метил-2-оксоимидaзолидин-4-илметил)-1Н-индол-3-ил]-этиламина, т. пл. 94–98 оС. 19 37178 25) 0,95 гидрат малеата -2-[5-(3-метил-2-оксоимидозолидин-5-илметил)-1Н- индол-3-ил)-N,Nдиметилэтиламина (белый продукт лиофильной сушки). 26) Гидрат хлоргидрата 2-[5-[2-(2,5-диоксоимидазолидинил)-этил-1Н-индол-3-ил]-этиламина, т.пл. 83–85оС. 27) Гидрат малеата 2-[5-[2-(2,5-диоксоимидазолидинил)-этил]-1H-ин дол-3-ил]-N,N-диметилэтиламина (бледно-желтый продукт лио фильной сушки). 28) Хлоргидрат 5-[2-(2-5-диоксоимидазолидинил)-этил-3-(1-метил-4-пиперидинил)-1Н-индола, т. пл. 320–322оС (разл.). 29) Гидрат малеата 2-[5-(5-метил-2-оксоимидазолидин-4-илэтил)-1Н-индол-3-ил]-этиламина, т.пл. 99оС (размягчается при 88оС). 30) 1,4 гидрат ацетата 5-[3-(4-пиперидил)-1Н-индол-5-илметил]-2,4-имидазолидиндиона, т.пл. 92–93оС (размягчается при 86оС). 31) 2,75 гидрат диацетата 2-[5-(1-метил-2оксо-4-имидазолидинилметил)-1Н-индол-3-ил]-этиламина (бледно-желтый продукт лиофильной сушки). Примеры приготовления лекарственных средств. В следующи х примерах "действующим ингредиентом" может быть любое соединение формулы (I) и/или физиологически приемлемая соль, сольват или фи зиологически функциональное производное его. 1) Приготовление лекарственных форм в таблетках (i) Пероральная форма Действующий ингредиент Авицел Лактоза Крахмал (кукурузный) Крахмал (предва рительно желати низированный ПГ15) Натрий-гликолят крахмала Повидон Стеарат магния (iii) Трансбуккальная форма Действующий ингредиент Гидроксипропилметилцеллюлоза (НРМС) Поликарбофил Стеарат магния В 25 – 47 9 Действующий ингредиент Авицел Лактоза Крахмал (1500 NF) Натрий-гликолят крахмала Стеарат магния – – 3 1 85 Действующий ингредиент Макрогол 4000 Вр Лецитин Арахи совое масло 32 – – 1 65 мг/таблетка D 25 10 – 51 – – 3 – 90 F 25 45 153 – – 2 225 G 25 – – 117 6 2 150 Н 25 200 – – 225 I 25 – 100 100 225 Лекарственная форма Н может быть приготовлена путем плавления Макрогола 4000 ВР, диспергирования действующе го ингредиента в расплаве и наполнения двусто ронних жестких желатиновых капсул смесью расплава. Лекарственная форма I может быть приготовлена путем диспергирования действующего ингредиента в де цитине и арахи совом масле и заполнения мягких, эластичных желатиновых капсул полученной дисперсией. (iii) Контролируе мое выделение мг/капсула Действующий ингредиент 25 Авицел 123 Лактоза 62 Триэтилцитрат (триэти ловый эфир лимонной кислоты) 3 Этилцеллюлоза 12 225 (ii) Подъязычная форма Действующий ингредиент Авицел Лактоза Маннит Сахароза Акация Повидон Стеарат магния 25 39 1 90 Лекарственные формы F и G могут быть приготовлены смешиванием ингредиентов и наполнением двусторонних жестких желатиновых капсул полученной смесью. (ii) Жидкое наполнение мг/капсула С 25 7 – – – 5 3 1 125 25 Лекарственная форма может быть приготовлена непосредственным прессованием смешанных ингредиентов. 2) Лекарственные формы в капсулах (i) Порошок мг/капсулы мг/таблетка А 25 13 78 – мг/таблетка Е 25 – 36 57 3 3 – 1 125 Лекарственная форма может быть приготовлена путем смеши вания и экструдирования первых че тырех ингредиентов и превращения в сферическую форму и вы сушивания экструдата. Высушенные шарики покрываются этилцеллюлозой в качестве мембраны, контролирующей выделение, и заполняются в двухсторонние, жесткие желатиновые капсулы. Лекарственные формы от А до Е могут быть приготовлены путем влажного гранулирования первых шести ингредиентов с повидоном, за которым следует до бавление стеарата магния и прессование в таблетку. 20 37178 3) Лекарственная форма для внутривенной инъекции вес. % Действующий ингредиент 2 Соляная кислота количество Цитратный буфер раствора доводят до рН 7 Вода для инъекций До 100 % Действующий ингредиент смеши ва ется в цитратном буфе ре и добавляется достато чное коли чество со ляной кисло ты, что бы повлиять на раство рение и довести рН до 7. Получен ный раствор дово дится до объема и фильтр уется через микропористый фильтр в сте рильные стеклянные ампулы, кото рые ук упориваются и запаиваются. Действующий ингредиент (63 мкм)* Твердый жир, ВР (Вайтепсол Н15–Динамит Нобель) мг/суппозиторий 50 1950 2000 *Действующий ингредиент используется в виде порошка, в который, по меньшей мере, 90 % частиц имеют диаметр 63 мкм или меньше. Одна пятая часть Вайтепсола Н15 расплавляется в сосуде с паровой рубашкой при температуре максимум 45оС. Действующий ингредиент просеивается черезсито с размером отверстий 200 мкм и смешивается с расплавленной основой, используя миксер Сильверсона, снабженный резательной головкой до тех пор, пока не будет достигнута однородная дисперсия. Поддерживая смесь при 45оС, остальную часть Вайтепсола Н15 добавляют к суспензии, которая перемешивается, чтобы обеспечить гомогенную смесь. Вся суспензия пропускается затем через сито из нержавеющей ста ли и размером отверстий 250 мкм и, при непрерывном перемеши вании, оставляют охлаждаться до 40оС. При температуре 38–40оС, 2 г аликвоты смеси заполняются в подхо дящие пластмассовые формы и суппозитории оставляют охлаждаться до комнатной температуры. 4) Интраназальная лекарственная форма вес. % Действующий ингредиент 0,5 % Соляная кислота количество Цитратный буфер раствора доводят до рН 7 Ме тиловый эфир оксибензойной кислоты 0,2% Пропиловый эфир оксибензойной кислоты 0,02 % Вода для инъекций доводят до100 % Действующий ингредиент поглощается в смеси оксибензоатов и цитратного буфе ра и добавляется достаточное количество соляной кислоты, что бы повлиять на растворение и довести рН до 7. Полученный раствор доводится до объема и фильтруется через микропористый фильтр в стерилизованные стеклянные ампулы, которые укупориваются и запаиваются. 8) Лекарственная форма в виде пессарии (вагинальных суп позиторий) мг/пессарий Действующий ингредиент (63 мкм) 50 Безводная декстроза 470 Карто фельный крахмал 473 Стеарат магния 473 1000 Вышеуказанные ингредиенты непосредственно смеши ваются и пессарии получаются прессованием полученной смеси. Биологическое испытание Соединения формулы (1), полученные в синте тических примерах от 1 до 17, каждое испытывают на их активность в качестве агонистов для "5–НТ1-подобного" рецептора, являющегося посредником сокращения гладкой мышцы, по следующе му способу. Подкожные вены правой и левой ног получают от новозеландских белых кроликов-самцов (2,4–2,7 кг), которых забили путем внутривенной инъекции пентобарбитона натрия (60 мг/кг). Кольцевые сегменты (шириной 3–5 мм), полученные из каждого сосуда (вены), подвешивают между двумя проволочными крючками и погружают в ванночки для органов объемом 20 мл, содержащие раствор Кребса (рН 7,4) следующего состава (мМ): NaCl 118,41 н, NaHCO3 25,00, KCl 4,75, K2HPO4 1,19, MgSO4 1,19, глюкоза 11,10 и CaCl 2 2,50. Кокаин (30 мкМ) содержится в растворе Кребса на всем протяжении эксперимента, чтобы предотвратить поглощение аминов симпатическими нейронами (нервными клетками). Раствор поддерживают при 37оС и непрерывно продувают (газируют) смесью 95 % кислорода/5 % углекислого газа. Повышенная в изометрической силе ткани измеряют, используя датчики силового смешивания типа Грасс FT03С и регистрируют на самопишущем приборе типа Гоулд ВД–212. 5) Лекарственная форма для внутримышечной инъекции Действующий ингредиент 0,05 г Бензиловый спирт 0,10 г Гликофурол 75 1,45 г Вода для инъекций количество раствора доводят до 3,00 мл Действующий ингредиент растворяется в гликофуроле. Добавляется бензиловый спирт, который растворяется, и добавляется вода до 3 мл. Смесь фильтруется через микропористый фильтр в сте рилизованные стеклянные ампулы, которые укупориваются и запаиваются. 6) Сиропообразная лекарственная форма Действующий ингредиент 0,05 г Раствор сорбита 1,50 г Глицерин 1,00 г Бензоат натрия 0,005 г Вкусовое и ароматизирующее вещества 0,0125 мл Бензоат натрия растворяется в части очищенной воды и добавляется раствор сорбита. Добавляется и растворяется действующий ингредиент. Полученный раствор смешивается с глицерином и доводится до требуе мого объема с помощью очищенной воды. 7) Лекарственная форма в виде суп позиторий 21 37178 Силу в 1,0 г применяют к каждому препарату и повторно устанавливают дважды в те чение последующего 30-минутного периода времени. Во время этого периода времени ткани подвергают действию паргилина (500 мкМ), что бы необратимо ингибировать моноамин-оксидазу, и действию феноксибензамина (0,1 мкм), чтобы инактивировать a 1-адреноцепто ры. К концу 30 минут, ингибиторы уда ляют путем нескольких изменений раствора Кребса в ван ночках для органов. Активность агонистов оценивают путем совокупных добавлений испытуе мого соединения, причем его концентрация увеличивается в 0,5 log10-единицах возраста ний до тех пор, пока дополнительные добавления не будут вызывать дальнейшего изменения в силе (смешения) ткани. В каждом эксперименте активность испытуемого соединения сравнивают с активностью 5–НТ. Активность выражают в ви де p[A50 ]–log10 [M], где М является молярной концентрацией агониста, требуе мого для создания половины максимального действия. Результа ты, полученные для соединений синтетических примеров 2/3 и 4/5, представляются в таблице. Пример Активность p[A50] 2/3 7,0 4/5 6,3 Данные по токсичности Хло ристоводородную соль соединения из синте тических примеров 2/3 перорально путем кормления через желудочный зонд вводят крысам вида Вистар в виде раствора в дистиллированной воде при дозах 25,100 и 200 мг/кг в основной форме и собакам Бигля (ищейкам?) при дозах 0,25, 0,50, 1,0 и 2,0 мг/кг в основной форме один раз в сутки в течение 14 суток. В отдельном исследовании собаки в течение 30 суток, дозировка свободного основания была повышена от 2 мг/кг на первые сутки до 100 мг/кг на 30-е сутки. Свободное основание перорально вводят также собаковидным (Cynomolgus) обезьянам при дозе 50 мг/кг один раз в сутки в течение 15 суток. Наблюдают о тсутствие до казательства о токсичности в любы х из выше упомянуты х исследова ний при любых использован ных до зировках. Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 22
ДивитисяДодаткова інформація
Назва патенту англійськоюTherapeutic heterocyclic compounds, method for preparation thereof, method for prevention and treatment, medicinal agent and method for preparation thereof
Автори англійськоюRobertson Alan Duncan, Hill Alan Peter, Glen Robert Charles, Martin Graeme Richard
Назва патенту російськоюТерапевтические гетероциклические соединения, способ их получения, способ профилактики и лечения, лекарственное средство и способ его получения
Автори російськоюРобертсон Алан Дункан, Хилл Алан Питер, Глен Роберт Чарльз, Мартин Грем Ричард
МПК / Мітки
МПК: C07D 417/04, A61P 25/06, C07D 413/14, A61P 43/00, C07D 417/14, A61K 31/44, A61K 31/42, C07D 401/14, C07D 413/06, C12P 21/08, A61K 31/445, A61K 31/425, A61P 25/04, A61K 31/4427, C07D 417/06, A61K 31/40, A61K 31/415, C07D 403/06, A61P 9/00
Мітки: сполуки, профілактики, терапевтичні, спосіб, засіб, лікування, лікарський, одержання, гетероциклічні
Код посилання
<a href="https://ua.patents.su/22-37178-terapevtichni-geterociklichni-spoluki-sposib-kh-oderzhannya-sposib-profilaktiki-ta-likuvannya-likarskijj-zasib-ta-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Терапевтичні гетероциклічні сполуки, спосіб їх одержання, спосіб профілактики та лікування, лікарський засіб та спосіб його одержання</a>
Попередній патент: Гетероциклічні сполуки або їх фармацевтично прийнятні адитивні солі кислоти або n-оксид гетероциклічної сполуки або його адитивна сіль кислоти
Випадковий патент: Спосіб отримання похідних 7-[2-(2-амінотіазоліл-4) -2алкоксііміноацетамідо]-3-тіометил-3-цефем-4-карбонової кислоти у вигляді син-ізомерів












