Похідні тієно[2,3-d]піримідину і їх застосування для лікування аритмії
Формула / Реферат
1. Сполука формули (Ia)
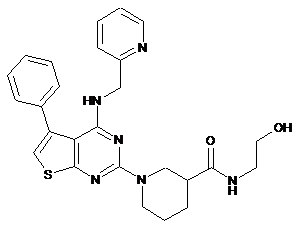 (Ia)
(Ia)
або її фармацевтично прийнятний естер або сіль.
2. Сполука за п. 1, що має формулу (Іb)
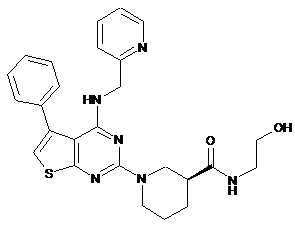 (Іb).
(Іb).
3. Сполука за п. 1, що має формулу (Іс)
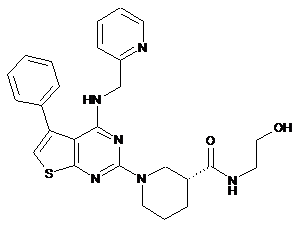 (Іс).
(Іс).
4. Сполука за п. 1, яка містить суміш сполук за формулою (Іb) і (Іс).
5. Сполука за п. 4, яка містить рацемічну суміш сполук за формулою (Іb) і (Іс).
6. Сполука за п. 4, яка містить енантіомерний надлишок сполуки за формулою (Іb).
7. Сполука за п. 4, яка містить енантіомерний надлишок сполуки за формулою (Іс).
8. Фармацевтична композиція, яка містить щонайменше одну сполуку за будь-яким з пп. 1-7 і, необов'язково, один або більше фармацевтично прийнятних наповнювачів.
9. Сполука за будь-яким з пп. 1-7 для застосування в лікуванні серцево-судинних, нейронних, слухових, ниркових, метаболічних захворювань та захворювань, пов’язаних з проліферацією клітин.
10. Композиція за п. 8 для застосування в лікуванні серцево-судинних, нейронних, слухових, ниркових, метаболічних захворювань та захворювань, пов’язаних з проліферацією клітин.
11. Спосіб інгібування калієвих каналів, який включає введення суб'єкту ефективної кількості щонайменше однієї сполуки за будь-яким з пп. 1-7 або композиції за п. 8.
12. Спосіб за п. 11, який відрізняється тим, що він призначений для лікування або профілактики аритмії.
13. Сполука за будь-яким з пп. 1-7 для застосування в інгібуванні калієвих каналів.
14. Сполука за п. 13, призначена для застосування в лікуванні або профілактиці аритмії.
15. Композиція за п. 8 для застосування в інгібуванні калієвих каналів.
16. Композиція за п. 15, яка відрізняється тим, що така композиція призначена для застосування в лікуванні або профілактиці аритмії.
17. Застосування сполуки за будь-яким з пп. 1-7 для виготовлення лікарського засобу для застосування в інгібуванні калієвих каналів.
18. Застосування за п. 17, де лікарський засіб призначений для застосування в лікуванні або профілактиці аритмії.
Текст
Реферат: Даний винахід стосується сполук тієнопіримідину, які є інгібіторами калієвих каналів. Також описуються фармацевтичні композиції, що містять зазначені сполуки, і їх застосування в лікуванні аритмії. UA 110131 C2 (12) UA 110131 C2 UA 110131 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ Даний винахід стосується сполук тієнопіримідину, які є інгібіторами калієвих каналів. Також наводяться фармацевтичні композиції, що містять зазначені сполуки, та їх застосування в лікуванні аритмії. РІВЕНЬ ТЕХНІКИ Іонні канали є білками, що пронизують ліпідний бішар клітинної мембрани й забезпечують + + 2+ ‾ шлях руху води, через який можуть проходити специфічні іони, такі як Na , K , Са і Сl (Herbert, 1998). Калієві канали представляють найбільшу й найбільш різноманітну підгрупу іонних каналів і відіграють центральну роль у регуляції мембранного потенціалу й контролю клітинної збудливості (Armstrong & Hille, 1998). Калієві канали були розподілені на генні сімейства на основі їх амінокислотної послідовності і їх біофізичних властивостей (номенклатуру див. у Gutman et al., 2003). Сполуки, що модулюють калієві канали, мають численне терапевтичне застосування при різних захворюваннях, включаючи серцево-судинні, нейронні, слухові захворювання, хвороби нирок, метаболічні захворювання й проліферацію клітин (Shieh et al, 2000; Ford et al., 2002). Більш конкретно, калієві канали, такі як Kv4.3, Kir2.1, hERG, KCNQ1/minK і Kv1.5, беруть участь у фазі реполяризації потенціалу дії в кардіоміоцитах. Ці підтипи калієвих каналів пов'язували з серцево-судинними захворюваннями і розладами, включаючи синдром подовженого інтервалу QT, гіпертрофію, фібриляцію шлуночків і фібриляцію передсердь, всі з яких можуть призвести до серцевої недостатності та смерті (Marban, 2002). Субодиниця затриманого випрямлення току у калієвому каналі людини, Kv1.5, експресується виключно в міоцитах передсердь і, як вважають, забезпечує терапевтичні можливості для лікування фібриляції передсердь з деяких різних причин (див. огляд Brendel і Peukert, 2002): (і) існує доказ того, що Kv1.5 лежить в основі серцевого надшвидкого випрямляча із затримкою (Kv(ur)) фізіологічного струму у людей завдяки аналогічним біофізичним і фармакологічним властивостям (Wang et al., 1993; і Fedida et al., 1993). Це було підтримано антисмисловими олігонуклеотидами до Kv1.5, які, як було показано, зменшують амплітуду Kv(ur) в міоцитах передсердь людини (Feng et ai, 1997). (іі) електрофізіологічні записи продемонстрували, що Kv(ur) селективно експресується в міоцитах передсердь, а отже дозволяє уникнути стимулювання потенційно смертельної шлуночкової аритмії через втручання в шлуночкову реполяризацію (Amos et a/., 1996; Li et ai, 1996; і Nattel, 2002). (ііі) Інгібування Kv(ur) у міоцитах передсердь людини з фібриляцією передсердь продовжувало тривалість потенціалу дії в порівнянні з нормальними міоцитами передсердь здорової людини (Courtemanche et ai., 1999). (iv) Подовження тривалості потенціалу дії шляхом селективного інгібування Kv1.5 може являти більш безпечні фармакологічні втручання для захисту від реципрокних аритмій передсердь, таких як фібриляція передсердь і тріпотіння передсердь, у порівнянні з традиційними протиаритмічними засобами III класу шляхом подовження рефрактерного періоду передсердь, залишаючи незмінною рефрактерність шлуночків (Nattel et ai., 1999, Knobloch et ai, 2002; і Wirth et ai, 2003). Широко повідомлялося, що протиаритмічні засоби III класу є пріоритетним способом лікування серцевих аритмій (Colatsky et ai, 1990). Традиційні і нові протиаритмічні блокатори калієвого каналу класу III, як повідомлялося, мають механізм дії шляхом безпосередньої модуляції Kv1.5 або KV(Ur). Всі відомі протиаритмічні засоби III класу амбасилід (Feng et ai, 1997), хінідин (Wang et a/., 1995), клофіліум (Malayev et ai, 1995) і бертосаміл (Godreau et ai, 2002), як повідомлялося, були зареєстровані як блокатори калієвих каналів Kv(ur) в міоцитах передсердь людини. Нове похідне бензопірану NIP-142 блокує канали Kv1.5, подовжує рефрактерний період передсердь і припиняє фібриляцію і тріпотіння передсердь на моделях собак in vivo (Matsuda et ai, 2001), a S9947 інгібує Kv1.5, що стабільно експресується як в ооцитах Xenopus, так і в клітинах яєчника китайського хом'ячка (СНО), і Kv(ur) в нативних кардіоміоцитах щура та людини (Bachmann et ai, 2001). В інших роботах були описані інші нові модулятори калієвого каналу, які націлені на Kv1.5 або Kv(ur) для лікування серцевих аритмій та включають дифеніли (Peukert et ai 2003), аміди тіофенкарбонових кислот (WO0248131), похідні бісарилу (WO0244137, WO0246162), похідні карбонаміду (WO0100573, WO0125189) аміди антранілової кислоти (WO2002100825, WO02088073, WO02087568), дигідропіримідини (WO0140231), похідні циклоалкілу (WO03063797), похідні індану (WO0146155, WO9804521), похідні тетралінбензоциклогептану (WO9937607), похідні тіазоліндону й метатіазанону (W09962891), похідні бензаміду (WO0025774), похідні ізохіноліну (WO0224655), похідні піридазинонів (W09818475, W09818476), похідні хроману (WO9804542), похідні бензопірану (WO0121610, WO03000675, WO0121609, WO0125224, WO02064581), похідні бензоксазину (WO0012492), і нову сполуку А1998, очищену з матеріалу Ocean (Xu & Xu, 2000). Повідомлялося про неспецифічні інгібітори 1 UA 110131 C2 5 10 15 20 25 30 35 40 45 50 55 60 потенціалзалежних калієвих каналів, які також можуть модулювати Kv1.5 (US05753676, US05821251, ЕР0743936В). Тієнопіримідини, як повідомлялося, використовують як протизапальні, протигрибкові, протиостеопорозні й антимікробні засоби, і, серед іншого, як серцево-судинні засоби (які діють шляхом модуляції фосфодіестеразної групи ферментів, або шляхом модуляції натрієвої / протонної системи обміну). Тієно[2,3-d]-піримідини, заміщені в четвертому положенні з необов'язковим заміщенням бензиламіновою або фенетиламіновою молекулою, а в п'ятому положенні метильною групою, можуть слугувати як протизапальні або протиостеопорозні засоби (Katada et ai, 1999). Було продемонстровано, що такі сполуки модулюють активність декількох типів клітин, в тому числі лейкоцитів, які беруть початок з гемопоетичних клітин-попередників у кістковому мозку. Підвищена активність лейкоцитів може призвести до різних запальних захворювань; тому сполуки, цитотоксичні у відношенні до лейкоцитів, можуть діяти як протизапальні лікарські засоби. Вважається, що такі сполуки пригнічують клітинну активність шляхом зв'язування з інтегринами на поверхні лейкоцитів і запобігання подальшим явищам клітинної передачі сигналу. Тієно[2,3-d]піримідини, заміщені в четвертому положенні гетероарилтіолами, арилтіолами, арилметилтіолами, гетероариламінами, бензиламіном, гідроксильною і хлорною групами, також можуть бути корисними протизапальними засобами (Stewart et al., 2001). Було продемонстровано, що цей ряд сполук інгібує індуковану експресію молекул клітинної адгезії на поверхні просвіту судинного ендотелію, у такий спосіб запобігаючи адгезії лейкоцитів у місці запалення. Тїєно[2,3-d]піримідини із заміщеною гідразиновою групою в четвертому положенні і фенільною групою в п'ятому положенні (Hozien et al., 1996), тетрагідробензо[b]тієно[2,3d]піримідини (Ismail et al., 1995), тієно[2,3-d]піримідини, які мають водневу, хлорну, гідразинову, гетероциклільну, амінну, метильну, етильну або фенільну групу в другому положенні, алкіламіновий, алкілариламіновий, аміновий, діалкіламіновий або гідразиновий замінник в четверому положенні, водневу або метильну групу в п'ятому положенні, водневу, метилацетамідну або фенільну групу в шостому положенні або тетраметиленову в 5,6-ому положенні (GB7549025), і ведучий ряд 5-феніл- і 5,6-тетраметилентієно[2,3-d]піримідинів з метилом або фенілом в другому положенні і алкіламіно або ариламіно в четвертому положенні (Коппо et al., 1989), всі продемонстрували наявність протимікробної активності. Тетрагідробензотієно[2,3-d]піримідин із 2-оксо-З-піролідинілметиленгідразиновим фрагментом в четвертому положенні продемонстрував деяку гербіцидну активність проти абутілону теофраста (Ram et al., 1981). Крім того, повідомлялось, що 4-хлоротетрагідробензотієно[2,3d]піримідин є гербіцидним, тетрагідробензотієно-[2,3-d]піримідини з тіоловим, гідразиновим, 2фтораніліновим, 3-фтораніліновим або 4-діетиланіліновим замінником в четвертому положенні мають бактерицидну дію проти Streptococcus fecales, а тетрагідробензотієно[2,3-d]піримідини з 2,4- дихлоробензиламіновим або 2-фтораніліновим замінником в четвертому положенні мають протигрибкову дію проти Pythium (Ram, 1979). Тієно[2,3-d]піримідини з водневою, гідроксильною, тіоловою, галогеновою або ціано групою в другому положенні, алкіламіновою, арилалкіламіновою або гідроксиалкіламіно групами в четвертому положенні, водневою, алкільною або галогеновою групами в п'ятому і/або шостому положенні або алкіленовою групою в п'ятому, шостому положенні були представлені як контролюючі кліщів засоби (AU 521790). В іншому місці тетрагідробензо[b]тієно[2,3-d]піримідини демонструють протипухлинну активність (Shehata et al., 1996) і знеболювальну активність, що становить половину від такої у аспірину (Moneer et al., 1994), ряд тієно[2,3-d]піримідинів з 4-алкіламіно або ариламіно, 5-Н або 5-метил, 6-метил або 5,6-тетраметиленом продемонстрували, що вони є перспективними як антицитокініни (Jordis et al., 1986), ряд 5,6-диметил-тієно[2,3-d]піримідинів і 5,6тетраметилентієно[2,3-d]піримідинів, обидва заміщені в другій положенні ариламінами або гетероциклічними амінами й в четвертому положенні ариламінами, продемонстрували властивості інгібування агрегації тромбоцитів крові (DD 226893), пірано- й тіопірано[3,4b]тієно[5,4-d]піримідини з заміщенням в четвертому положенні аміном, бутиламіном, аніліном, циклогексиламіном, бензиламіном, фенетиламіном і 2-гідроксиетиламіном, як повідомляється, проявляють протисудомну активність (Noravyan et al., 1977), а 4-[(бензо-2,1,3-тіадіазоліл4)аміно]-5,6,7,8-тетрагідробензотієно-(2,3-d)-піримідин, як повідомляється, має глистогінну активність щодо личинкового альвеолярного ехінококозу (RU 2116309). Тієно[2,3-d]піримідини з заміщеною аміно групою в четвертому положенні, водневим, алкіловим або галогеновим заміщенням в 5 і 6-положеннях і алкіловим ланцюгом в другому положенні, як стверджується, є інгібіторами фосфодіестерази V і є корисними при лікуванні серцево-судинних захворювань і порушень потенції (DE10104802). 2 UA 110131 C2 5 10 15 20 В іншому місці було виявлено, що 5-алкіл тієно[2,3-d]піримідини з піперазиніловим замінником в четвертому положенні є інгібіторами натрієвих / протонних обмінників і корисними при лікуванні різних серцево-судинних розладів, включаючи стенокардію й аритмію (WO 01/27107). Було виявлено, що 4-[(феніл)аміно]-тієно[2,3-d]шримідини, які несуть 5-тіофеніловий замінник і 2-метиловий замінник, мають молюскоцидну активність (Hosni et al, Acta Poloniae Pharmaceutica, 1999, 56(1), 49-56). Також нещодавно повідомлялось, що тієнопіримідини є потужними інгібіторами РФРЕС (Munchhof, 2004). Декілька публікацій розкривають сполуки, які показані як такі, що діють на калієві канали. Так US6531495 розкриває 2'-амінометилдифеніл-2-карбоксаміди, WO2002/100825 розкриває аміди антранілової кислоти як протиаритмічні засоби, a WO2002/036556 розкриває ациламіноалкілбензенсульфонаміди як серцево-судинні засоби. В WO 2004/111057 повідомляється про тієнопіримідинові сполуки, що є корисними як інгібітори калієвих каналів, зокрема для інгібування калієвих каналів Kv1.5 або Kv(ur). СУТНІСТЬ ВИНАХОДУ Перший аспект даного винаходу описує сполуку формули (Іа) або її фармацевтично прийнятний естер або сіль. В одному із варіантів втілення сполука має формулу (Іb) В іншому варіанті втілення сполука має формулу (Іс) 3 UA 110131 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті втілення Сполука формули (Іа) містить суміш сполук формул (Іb) і (Іс). У ще одному варіанті втілення Сполука формули (Іа) містить рацемічну суміш сполук формул (Іb) і (Іс). У ще одному альтернативному варіанті втілення Сполука формули (Іа) містить енантіомерний надлишок сполуки формули (Іb) або енантіомерний надлишок сполуки формули (Іс). Другий аспект даного винаходу надає фармацевтичну композицію, яка містить, щонайменше, одну із вищезазначених сполук і, необов'язково, один або більше фармацевтично прийнятних наповнювачів. Сполуки і композиції згідно з винаходом є інгібіторами калієвих каналів, які є особливо корисними для інгібування калієвих каналів Kv1.5 або Kv(ur) для лікування серцевої аритмії в передсердях, такого як фібриляція передсердь. Даний винахід не обмежений лікуванням серцевих аритмій, сполуки також є корисними для лікування захворювань, які потребують інгібування калієвих каналів (наприклад, Shieh et al, 2000; Ford et al., 2002). Отже, третій аспект даного винаходу надає спосіб інгібування калієвих каналів, який включає введення суб'єкту ефективної кількості щонайменше однієї сполуки або композиції згідно з винаходом. Цей аспект даного винаходу додатково надає сполуку або композицію згідно з винаходом для застосування в інгібуванні калієвих каналів. Крім того, цей аспект даного винаходу додатково надає спосіб використання сполуки згідно з винаходом для виготовлення лікарського засобу для застосування в інгібуванні калієвих каналів. Вислови "спосіб інгібування калієвих каналів" і "застосування в інгібуванні калієвих каналів", які використовуються тут, включають способи і застосування для лікування або профілактики розладу, який реагує на інгібування функціонування калієвого каналу. Розлад може бути аритмією. Сполуки згідно з винаходом мають корисні властивості порівняно із сполуками існуючого рівня техніки, зокрема з точки зору активності та/або селективності. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Рацемічна суміш "Рацемічна суміш" містить приблизно рівні кількості сполук формули (Іb) і формули (Іс). Іншими словами, сполука або композиція, що містить "рацемічну суміш" сполук формули (Іb) і формули (Іс) містить суміш сполук у співвідношенні приблизно 1:1 або 50:50. Енантіомерний надлишок Сполука або композиція, що містить "енантіомерний надлишок" сполуки формули (Іb) або сполуки формули (Іс), містить більше зазначеного енантіомера, ніж іншого (також відома як скалемічна суміш). Енантіомерній надлишок є надлишком однієї сполуки порівняно з іншою, виражений як відсотковий вміст від цілого. Наприклад, співвідношення 98:2 в суміші сполуки формули (Іb) до сполуки формули (Іс) має 96 % енантіомерного надлишку сполуки формули (Іb). Так, сполуки і композиції згідно з винаходом можуть містити енантіомерний надлишок сполуки формули (Іb) щонайменше 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 % або до 100 % (тобто енантіомерно чиста до межі виявлення чистоти). Альтернативно, сполуки і композиції згідно з винаходом можуть містити енантіомерний надлишок сполуки формули (Іс) щонайменше 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 % або до 100 %. R і S термінологія Термін "R" або "S" ізомер, який використовується, стосується двох можливих енантіомерів відповідно до системи Кана-Інгольда-Прелога, прийнятої Міжнародним союзом теоретичної і прикладної хімії (IUPAC). Таким чином, Сполука формули (Іb) є "S-ізомером", а Сполука формули (Іс) є "R-ізомером". Фармацевтично прийнятний естер або сіль Термін "фармацевтично прийнятний естер" включає сполуки згідно з винаходом, в яких атом водню спиртової групи може бути замінений з утворенням естеру (наприклад, атом водню може бути замінений -С(О)С-1-6 алкілом). Термін "фармацевтично прийнятна сіль" включає сіль, виготовлену з фармацевтично прийнятних нетоксичних кислот або основ, в тому числі з неорганічних або органічних кислот і основ. Фармацевтично прийнятні солі приєднання кислоти сполук згідно з винаходом включають, але не обмежуються перерахованими, солі неорганічних кислот, таких як галогеноводневі кислоти (наприклад, хлористоводнева, бромистоводнева і йодистоводнева кислота), сірчана кислота, азотна кислота і фосфорні кислоти. Крім того, фармацевтично прийнятні солі приєднання кислоти сполук згідно з винаходом включають, але не обмежуються перерахованими, солі органічних кислот, таких як аліфатичні, ароматичні, карбонові й 4 UA 110131 C2 5 10 15 20 25 30 35 сульфонові класи органічних кислот, приклади яких включають: аліфатичні монокарбонові кислоти, такі як мурашина кислота, оцтова кислота, пропіонова кислота або масляна кислота; аліфатичні гідроксикислоти, такі як молочна кислота, лимонна кислота, винна кислота або яблучна кислота; дикарбонові кислоти, такі як малеїнова кислота або бурштинова кислота; ароматичні карбонові кислоти, такі як бензойна кислота, р-хлоробензойна кислота, фенілоцтова кислота, дифенілоцтова кислота або трифенілоцтова кислота; ароматичні гідроксикислоти, такі як о-гідроксибензойна кислота, р-гідроксибензойна кислота, 1-гідроксинафталін-2-карбонова кислота або З-гідроксинафталін-2-карбонова кислота; і сульфонові кислоти, такі як метансульфонова кислота, етансульфонова кислота або бензенсульфонова кислота. Інші фармацевтично прийнятні солі приєднання кислоти сполук згідно з винаходом включають, але не обмежуються такими як солі гліколевої кислоти, антранілової кислоти, саліцилової кислоти, мигдальної кислоти, ембонової (памової) кислоти, пантотенової кислоти, стеаринової кислоти, сульфанілової кислоти, альгенової кислоти й галактуронової кислоти. Фармацевтично прийнятні основні солі сполук згідно з винаходом включають, але не обмежуються перерахованим, металеві солі, такі як солі лужних металів або солі лужноземельних металів (наприклад, натрію, калію, магнію або кальцію) і солі цинку або алюмінію. Крім того, фармацевтично прийнятні основні солі сполук згідно з винаходом включають, але не обмежуються перерахованим, солі, утворені з аміаком або фармацевтично прийнятними органічними амінами або гетероциклічними основами, такими як етаноламіни (наприклад, діетаноламін), бензиламіни, N-метил-глюкамін, аміно кислотами (наприклад, лізин) або піридин. Синтез Сполуки формули (І) можуть бути одержані як рацемат, як скалемічна суміш, або як хірально чистий енантіомер з використанням шляхів, описаних на схемі 1 нижче: Це включає приготування сполук формули (І), використовуючи "лінійний шлях", аналогічний шляху синтезу, описаному в WO2004/111057 із сполук формули (II) і аміноетанолу. Типово цю реакцію проводять з використанням зв'язуючого реагенту, такого як 1-етил-3-(3диметиламінопропіл)-карбодіімід (ЕДК) або 2-(7-аза-1 Н-бензтриазол-1 -іл)-1,1,3,3тетраметилуронію гексафторфосфат (HATU), застосовуючи стандартні способи, відомі фахівцям у даній галузі техніки, такі як реакція в розчиннику, такому як тетрагідрофуран, ацетонітрил або диметилформамід, в діапазоні температур від кімнатної температури до температури кипіння. Альтернативно, сполуки формули (І) можуть бути одержані зі сполук формули (III) шляхом заміщення 2-хлоро замінника сполукою формули (IX) за присутності основи, такої як М, г\І-діізопропілетиламін і розчинника, такого як N-метилпіролідинон із звичайним нагріванням або мікрохвильовим опроміненням. 5 UA 110131 C2 5 10 15 Сполуки формули (II) можна отимати зі сполуки формули (III) шляхом заміщення 2-хлоро замінника комерційно доступною ніпекотиновою кислотою за присутності основи, такої як ІЧ, Мдіізопропілетиламін і розчинника, такого як N-метилпіролідинон із звичайним нагріванням або мікрохвильовим опроміненням. Сполуки формули (III) легко синтезуються зі сполук формули (IV) шляхом реакції нуклеофільного заміщення 2-амінометилпіридином, необов'язково за присутності розчинника або основи, і необов'язково за підвищеної температури або при мікрохвильовому опроміненні. Краще розчинник (за наявності) є спиртом, краще етанолом, а основа є блокованою азотистою основою, такою як триетиламін. Реакцію проводять за кімнатної температури. Сполука формули (IV) може бути синтезована шляхом реакції сполуки формули (V) з хлоруючим реагентом, таким як фенілфосфоновий дихлорид або фосфористий оксихлорид. Сполуки формули (V) можуть бути синтезовані шляхом реакції сполуки формули (VI) з ціанатом лужного металу, краще ціанатом калію. 20 Сполука формули (VI) може бути одержана за допомогою "реакції Гевальда", в якій Сполука формули (VII) реагує в основних умовах і у відповідному розчиннику, такому як етанол, з перетвореною на порошок сіркою. Краще основа є діізопропілетиламіном (основа Ханіга), а розчинник може бути спиртом, краще етанолом, і реакцію проводять за температури в діапазоні між 25 і 65 °C. 6 UA 110131 C2 5 10 15 20 25 30 35 Сполуки формули (VII) можуть бути одержані за допомогою реакції конденсації Кневенагеля шляхом нагрівання сполуки формули (VIII) з етилціаноацетатом (NCCH2CO2Et) за присутності кислоти й ацетату амонію в придатному розчиннику, такому як толуол, необов'язково з азеотропним видаленням води. Краще кислота є оцтовою кислотою. Це дає алкіліден ціано естер у вигляді пари (Е і Z) геометричних ізомерів. Сполука формули (IX) може бути одержана зі сполуки формули (X) за допомогою гідролізу трет-бутилкарбаматної (ВОС) захисної групи сильною кислотою в розчиннику, такому як дихлорометан. Типово кислота є трифтороцтовою кислотою. Сполука формули (X) може бути одержана зі сполуки формули (XI) і аміноетанолу. Типово цю реакцію проводять з використанням зв'язуючого реагенту, такого як 1-етил-3-(3диметиламінопропіл)-карбодіімід (ЕДК) або 2-(7-аза-1 Н-бензтриазол-1 -іл)-1,1,3,3тетраметилуронію гексафторфосфат (HATU), застосовуючи стандартні способи, відомі фахівцям у даній галузі техніки, такі як реакція в розчиннику, такому як тетрагідрофуран, ацетонітрил або диметилформамід в діапазоні температур від кімнатної температури до температури кипіння. Фармацевтичні композиції Як обговорювалося в даному документі, сполуки згідно з винаходом є корисними в лікуванні різних станів. Так, другий аспект даного винаходу надає фармацевтичну композицію або склад, що містить, щонайменше, одну сполуку згідно з винаходом і необов'язково один або більше фармацевтично прийнятних наповнювачів. Типові фармацевтично прийнятні наповнювачі включають: • розчинники, наприклад, лактозу, декстрозу, сахарозу, маніт, сорбіт, целюлозу й/або гліцин; • змащувачі, наприклад, двоокис кремнію, тальк, стеаринову кислоту, її магнієву або кальцієву сіль і/або поліетиленгліколь; • зв'язувальні речовини, наприклад, силікат магнію і алюмінію, крохмальну пасту, желатин, трагакант, метилцелюлозу, карбоксиметилцелюлозу натрію й/або полівінілпіролідон; • дезінтегранти, наприклад крохмалі, агар, альгінову кислоту або її натрієву сіль, або шипучі суміші, й/або • абсорбенти, барвники й/або підсолоджувачі. Композиції згідно з винаходом можуть бути представлені в формах стандартних доз, що містять задану кількість кожного активного інгредієнта на одну дозу. Така одинична доза може бути адаптована для забезпечення сполуки в дозі 5-100 мг/добу, краще в будь-якій із доз 5 7 UA 110131 C2 5 10 15 20 25 30 35 40 45 50 55 60 15мг/добу, 10-30 мг/добу, 25-50 мг/добу, 40-80 мг/добу або 60-100 мг/добу. Для сполук згідно з винаходом забезпечуються дози в діапазоні 100-1000 мг/добу, краще будь-яка з доз 100-400 мг/добу, 300-600 мг/добу або 500-1000 мг/добу. Такі дози можуть бути представлені у вигляді разової дози або у вигляді декількох дискретних доз. Кінцева доза буде залежати від стану, що підлягає лікуванню, способу введення, віку, маси і стану пацієнта, і буде призначатись на розсуд лікаря. Композиції згідно з винаходом можуть бути адаптовані для введення будь-яким придатним способом, наприклад, пероральним (у тому числі букальним або сублінгвальним), ректальним, назальним, місцевим (у тому числі букальним, сублінгвальним або трансдермальним), вагінальним або парентеральним (у тому числі підшкірним, внутрішньом'язовим, внутрішньовенним або внутрішньошкірним) шляхом. Такі композиції можуть буті одержані будьяким способом, відомим в галузі фармації, наприклад, шляхом об'єднання активного інгредієнта з носієм (носіями) або наповнювачем (ами). Фармацевтичні композиції, адаптовані для перорального введення, можуть бути представлені у вигляді дискретних одиниць, таких як капсули або таблетки, порошки або гранули, розчини або суспензії у водних або неводних рідинах; їстівні піни або збиті креми, або рідкі емульсії типу масло-в-воді, або рідкі емульсії типу вода-в-маслі. Фармацевтичні композиції, адаптовані для трансдермального введення, можуть бути представлені у вигляді дискретних пластирів, призначених для того, щоб залишатися в тісному контакті з епідермісом реципієнта протягом тривалого періоду часу. Наприклад, активний інгредієнт може доставлятись із пластиру за допомогою іонофорезу, як в цілому описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтичні композиції, адаптовані для місцевого нанесення, можуть бути сформульовані у вигляді мазей, кремів, суспензій, лосьйонів, порошків, розчинів, паст, гелів, спреїв, аерозолів або масел. Для нанесення в око або на інші зовнішні тканини, наприклад, в ротову порожнину і на шкіру, композиції краще наносяться у вигляді мазі або крему для місцевого застосування. При складанні рецептури у вигляді мазі, активний інгредієнт може бути використаний або з парафіновою, або зі змішуваною з водою мазевою основою. Альтернативно, активний інгредієнт може бути сформульований у вигляді крему з основою крему типу масло-в-воді або з основою типу вода-вмаслі. Фармацевтичні композиції, адаптовані для місцевого нанесення в око, включають очні краплі, в яких активний інгредієнт розчинений або суспендований у відповідному носії, особливо у водному розчиннику. Фармацевтичні композиції, адаптовані для місцевого нанесення в ротову порожнину, включають льодяники, пастилки та рідини для полоскання рота. Фармацевтичні композиції, адаптовані для ректального введення, можуть бути представлені у вигляді супозиторіїв або клізм. Фармацевтичні композиції, адаптовані для назального введення, де носій являє собою тверду речовину, включають грубозернистий порошок, що має розмір часток, наприклад, в діапазоні від 20 до 500 мкм, який вводять способом вдихання, тобто шляхом швидкого вдихання через носовий прохід з контейнера з порошком, який тримають близько до носа. Придатні композиції для введення у вигляді назального спрею або у вигляді назальних крапель, в яких носієм є рідина, включають водні або масляні розчини активного інгредієнта. Фармацевтичні композиції, адаптовані для введення шляхом інгаляції, включають тонкоподрібнені частинки пилу або аерозолі, які можуть бути одержані за допомогою різних видів дозованих аерозолів під тиском, розпилювачів або апаратів для вдування. Фармацевтичні композиції, адаптовані для вагінального введення, можуть бути представлені у вигляді песаріїв, тампонів, кремів, гелів, паст, пін або аерозольних композицій. Фармацевтичні композиції, адаптовані для парентерального введення, включають водні та неводні стерильні розчини для ін'єкцій, які можуть містити антиоксиданти, буфери, бактеріостати і розчинені речовини, які надають композиції ізотонічність з кров'ю передбачуваного реципієнта; а також водні й неводні стерильні суспензії, які можуть включати суспендуючі речовини й згущувачі. Композиції можуть бути представлені в контейнерах з одиничною стандартною дозою або в багатодозових контейнерах, наприклад, герметичних ампулах і флаконах, і можуть зберігатися у висушеному заморожуванням (ліофілізованому) стані, що вимагає безпосередньо перед використанням тільки додавання стерильного рідкого носія, наприклад, води для ін'єкцій. Приготовлені для негайного введення розчини й суспензії для ін'єкцій можуть бути одержані зі стерильних порошків, гранул і таблеток. 8 UA 110131 C2 5 10 15 20 25 30 35 40 45 50 55 Переважними композиціями стандартної дози є ті, які містять добову дозу або суб-дозу, як описано вище, або її відповідну частину активного інгредієнта. Необхідно розуміти, що крім інгредієнтів, конкретно зазначених вище, композиції можуть також включати інші речовини, що є звичайними в даній галузі техніки, які мають відношення до типу розглянутої композиції, наприклад, ті, що придатні для перорального введення, можуть включати ароматизатори. СПОСОБИ ВТІЛЕННЯ ВИНАХОДУ Наступні протоколи описують приготування:1. рацемату, який одержують, використовуючи "конвергентний шлях" (Приклади від 1 до 6) 2. енантіомерів, які одержують, використовуючи "конвергентний шлях" (Приклади від 1 до 5 і від 7 до 12) 3. енантіомерів, які одержують, використовуючи "лінійний шлях" (Приклади від 1 до 5 і від 13 до 16) Синтез і визначення енантіомерів Бажану енантіомерно чисту сполуку одержують шляхом ретельного відбору реагентів і використання відповідних умов експерименту і, зокрема, послідовності у відношенні кроків формування хірального центру і наступної реакції. В ході синтезу було встановлено, що "лінійній шлях" був менш схильним до рацемізації, оскільки кінцеве утворення амідного зв'язку може бути проведене за більш низької температури, на відміну від "конвергентного шляху", який забезпечує кращі виходи, але з виявлюваною рацемізацією. Для "лінійного шляху", чисті енантіомери ніпекотинової кислоти були одержані шляхом класичного розчинення комерційно доступної недорогої рацемічної ніпекотинової кислоти, використовуючи 1-(5)-камфорсульфонову кислоту як розчинник, проведення аналізу, який визначає єн (енантіомерний надлишок) після формування ВОС похідного зразка. Енантіомерну чистоту визначали шляхом хіральної ВЕРХ. Аналітичні способи 1 Спектри протонного магнітного резонансу ( Н ЯМР) реєстрували на спектрометрі Varian 400MHz Mercury Plus. Всі спектри були визначені в дмсо-сіб, якщо не зазначено інше, і хімічні зсуви наведені в (сигма) одиницях в напрямку зменшення інтенсивності поля відносно внутрішнього стандарту тетраметилсилану (ТМС), а константи міжпротонного зв'язування наведені в герцах (Гц), структури розщеплення позначені в такий спосіб: с - синглет, д -дублет, т - триплет, кв - квартет, м - мультиплет, ш - широкий пік, дд -дублет дублетів, дт - дублет триплетів, шс - широкий синглет, дк - дублет квартету. ІЧ (інфрачервоні) спектри були визначені на інструменті Perkin Elmer Spectrum One. Мас-спектри були визначені на інструменті з іонною пасткою Agilent 6310 Ion trap. Аналіз ВЕРХ (спосіб (а)) проводили на системі Waters 2695, використовуючи колонку ZORBAX SB С-18 (4,6 × 50 мм); Рухома фаза: А: 0,05 % ТФОК (AQ, ) В: 0,05 % ТФОК (MeCN); T%B: 0/20, 5/90, 8/90, 8,1/20; швидкість потоку 1,0 мл/хв; Хіральна колонка: Chiralpak IC (4,6 × 250 мм)5мкм, рухома фаза: А: Гексан, В: ЕЮН (70:30); швидкість потоку 0,8 мл/хв, працює протягом 40 хвилин. Температури плавлення визначали на інструменті EX-Melt (Модель: МРА120). Альтернативно, аналіз ВЕРХ (спосіб (Ь)) проводили за допомогою системи градієнтного насоса для транспортування рідини Waters 616 і детектора на фотодіодній матриці Waters 996. Хіральна колонка: Daicel Chiralpak AD-H (Chiral technologies) реєструє хіральну чистоту за довжини хвилі 244 нм; рухома фаза 80 % Гексани:20 % ЕЮН; швидкість потоку 0,8 мл/хв; температура 40 °C. Мас-спектри були визначені на інструменті серії Agilent 1100 (Модель: G1946C). Наступні сполуки, наведені тільки як приклад, можуть бути синтезовані з використанням інформації, описаної в даному документі. Фармакологічний профіль сполук згідно з даним винаходом може бути легко оцінений фахівцями в даній галузі техніки з використанням рутинних експериментів, наприклад, процедур і методик, проілюстрованих тут і докладно описаних у роботі Fordefa/., 2002. Приклад 1 Етиловий естер (г)-2-ціано-3-феніл-бут-2-енової кислоти (VII) 9 UA 110131 C2 5 10 15 20 25 30 35 40 Перемішану суміш ацетофенону (VIII) (180 г, 1,5 моль), етилціаноацетату (170 г, 1,3 моль), ацетату амонію (23,1 г), оцтової кислоти (72 г) і толуолу (300 мл) нагрівають за кипіння протягом 18 годин, в той час як видаляють із реакційної суміші воду шляхом азеотропної дистиляції. Суміші дають можливість охолонути до температури навколишнього середовища, додають толуол (100 мл), потім суміш промивають водою (З х 100 мл). Об'єднані водні промивки струшують з толуолом (50 мл), потім об'єднані розчини толуолу висушують над сульфатом магнію, фільтрують, і розчинник видаляють in vacuo. Залишкове масло дистилюють під зниженим тиском, щоб одержати етиловий естер 2-ціано-3-феніл-бут-2-енової кислоти у вигляді масла (309 г), яке використовують без подальшого очищення. Приклад 2 Етиловий естер 2-аміно-4-феніл-тіофен-3-карбонової кислоти (VI) За температури навколишнього середовища додають етиловий естер 2-ціано-3-феніл-бут-2енової кислоти (513,25 г, 2,3 моль) до енергійно перемішуваної суспензії перемеленої в порошок сірки (76 г, 2,3 моль) в етанолі (500 мл). Порціямидодають диетиламін (200 мл) протягом 20 хвилин, під час яких температура реакції зростає до 62 °C. Суміші дають можливість охолонути до температури 36 °C, потім її нагрівають до 50 °C і продовжують перемішування за цієї температури протягом 1 години. Після закінчення цього часу перемішування припиняють, гарячий розчин видаляють від сірки, що не прореагувала, за допомогою декантації, потім дають йому можливість охолонути до температури навколишнього середовища. Одержану в результаті тверду речовину збирають фільтрацією, промивають невеликою кількістю холодного етанолу і висушують in vacuo, щоб одержати етиловий естер 2аміно-4-фенілтіофен-3-карбонової кислоти у вигляді помаранчевої твердої речовини (195 г), яку використовують без подальшого очищення. Приклад З 5-феніл-1 Н-тієно[2,3-сІ]піримідин-2,4-діон (V) Етиловий естер 2-аміно-4-феніл-тіофен-3-карбонової кислоти (2,0 г, 8,1 ммоль) і ціанат калію (Aldrich, 2,0 г, 24,3 ммоль) додають до крижаної оцтової кислоти (VWR, 20 мл) і перемішують за температури навколишнього середовища протягом 18 год. Реакційну суміш розбавляють водою (50 мл) і одержаний в результаті осад фільтрують, промивають водою і висушують до одержання вологого осаду на фільтрі. Тверду речовину суспендують у воді (100 мл) і підлужнюють до рівня рН 12-14 додаванням концентрованого гідроксиду натрію. Одержану в результаті суспензію нагрівають за температури 100 °C протягом 2 год. з перемішуванням, потім охолоджують до температури навколишнього середовища і підкисляють додаванням крижаної оцтової кислоти. Одержану в результаті тверду речовину збирають фільтрацією, промивають водою і висушують in vacuo за температури 40 °C, щоб одержати 5-феніл-1Нтієно[2,3-сІ]піримідин-2,4-діон у вигляді білої твердої речовини. Вихід = (1,1 г, 56 %). Приклад 4 2,4-дихлоро-5-феніл-тієно[2,3-с1]піримідин (IV) 10 UA 110131 C2 5 10 15 20 25 30 Перемішану суміш 5-феніл-1Н-тієно[2,3-с/]піримідин-2,4-діону (1,07 г, 4,39 ммоль) і фенілфосфонового дихлориду (Aldrich, 10 мл, надлишок) нагрівають за температури 150 °C протягом 7 год., потім дозволяють відстоятись за температури навколишнього середовища протягом 18 год. Одержаний в результаті темний розчин виливають в суміш крижану вода і екстрагують з ДХМ (3 × 150 мл). Об'єднані екстракти промивають насиченим розчином гідрокарбонату натрію (150 мл) і висушують (MgS04). Розчинник видаляють in vacuo і маслянистий залишок розтирають з 40-60 °C петролейним ефіром, щоб одержати 2,4-дихлоро5-феніл-тієно[2,3-с/]піримідин у вигляді блідо-жовтої твердої речовини. Вихід = (0,82 г, 66 %). Приклад 5 (2-хлоро-5-феніл-тієно[2,3-с1]піримідин-4-іл)-піридин-2-ілметил-амін (III) Суміш 2,4-дихлоро-5-феніл-тієно[2,3-сІ]піримідину (1,77 г, 6,3 ммоль), 2-амінометилпіридину (Aldrich, 782 мкл, 7,6 ммоль) і триетиламіну (VWR, 1,06 мл, 7,63 ммоль) кип'ятять в етанолі (ЗО мл) протягом 3 годин. Після охолодження реакційну суміш виливають у воду (300 мл) і перемішують протягом 1 години. Одержаний в результаті осад фільтрують, промивають водою (2 х ЗО мл) і висушують у вакуумі за температури 40 °C, щоб одержати (2-хлоро-5-фенілтієно[2,3-сІ]піримідин-4-іл)-піридин-2-ілметил-амін у вигляді блідо-жовтої твердої речовини. Вихід = (1,55 г, 70 %). Рацемат - конвергентний шлях Приклад 6 (Рацемічний) 1-{5-феніл-4-[(піридин-2-ілметил)-аміно]-тієно[2,3-сІ] піримідин-2-іл}-піперидин3 карбонової кислоти (2-гідрокси-етил)-амід (Іа) (2-хлоро-5-феніл-тіено[2,3-сІ]піримідин-4-іл)-піридин-2-ілметил-амін (44 мг, 0,124 ммоль), піперидин-3-карбонової кислоти (2-гідроксиетил)амід (Fluorochem, 32 мг, 0,188 ммоль, 1,5 екв) і М, М-діізопропілетиламін (Aldrich, 0,188 ммоль) розчиняють в N-метилпіролідиноні (1,5 мл) в пробірці Biotage, придатній для мікрохвильового нагрівання, і нагрівають до температури 200 °C, і підтримують за цієї температури протягом ЗО хв. При охолодженні розчинники видаляють in vacuo. Залишок розтирають з ДХМ (2 × 10 мл) і екстракти об'єднують, концентрують і очищають за допомогою препаративної ТШХ (елюент 10 % МеОН/ДХМ), щоб одержати продукт у вигляді жовтого масла, яке при зберіганні повільно перетворюється на тверду воскоподібну речовину. Тверда 11 UA 110131 C2 5 10 15 20 25 30 35 воскоподібна речовина може бути перетворена на легкосипучий порошок шляхом перетирання в діетиловому ефірі протягом 1-2 год. (0,5 г в 10 мл). Вихід=18,3 мг (ЗО %) Енантіомери - конвергентний шлях Приклад 7 Трет-бутиловий естер (8)-3-(2-гідрокси-етилкарбамоїл)-піперидин-1-карбонової кислоти (8)-піперидин-1,3-дикарбонової кислоти 1-трет-бутиловий естер (500 мг, 2,2 ммоль), HATU (833 мг, 2,2 ммоль) і діізопропілетиламін (761 мкл, 4,4 ммоль) перемішують у сухому ДХМ (10 мл) у крижаній бані протягом 5хв, потім за кімнатної температури протягом 5 хв. Додають етаноламін (198 мкл, 3,28 ммоль), і реакційну суміш перемішують за кімнатної температури протягом 3 годин. Реакційну суміш розбавляють ДХМ (40 мл), промивають водою (50 мл), шар ДХМ відокремлюють, висушують (MgSO4) і концентрують. Залишок пропускають через колонку з силікагелем (20 г ізолюту). Елююють: МеОН/ДХМ 0-5 % 5CV, МеОН/ДХМ 5 %-5 % 10CV, МеОН/ДХМ 5-10 % 5CV. ТШХ візуалізують за допомогою КМпО4. Це дає вихід продукту у вигляді прозорого масла (327 мг). Аналогічним способом одержують: Приклад 8 Трет-бутиловий естер (ІЗ)-3-(2-гідрокси-етилкарбамоїл)-шперидин-1-карбонової кислоти Приклад 9 (З)-піперидин-З-карбонової кислоти (2-гідрокси-етил)-амід Продукт вищевказаної реакції перемішують в 1:1 ТФОК/ДХМ протягом 2 год., потім концентрують in vacuo до масла. Його розчиняють у МеОН (5 мл) і завантажують на картридж SCX 5 г. Картридж промивають МеОН (10 мл), потім продукт елююють 2М NH3/MeOH (10 мл). Фракцію концентрують, щоб одержати білу тверду речовину. Вихід = 260 мг. Аналогічним способом одержують: Приклад 10 (Р)-піперидин-З-карбонової кислоти (2-гідрокси-етил)-амід Приклад 11 (5)-1-{5-феніл-4-[(піридин-2-ілметил)-аміно]-тієно[2,3-d]піримідин-2-іл}піперидин-3карбонової кислоти (2-гідрокси-етил)-амід (Іb) (З)-піперидин-З-карбонової кислоти (2-гідрокси-етил)-амід вступає в реакцію з (2-хлоро-5феніл-тієно[2,3-сІ]піримідин-4-іл)-піридин-2-ілметил-аміном як описується в Прикладі 6 вище, щоб одержати (8)-1-{5-феніл-4-[(піридин-2-ілметил)-аміно]-тієно[2,3-d]піримідин-2-іл}-піперидин3-карбонової кислоти (2-гідрокси-етил)-амід у вигляді жовтої піни (188 мг). Аналогічним способом одержують: Приклад 12 12 UA 110131 C2 5 10 15 20 25 30 35 (Р)-1-{5-феніл-4-[(піридин-2-ілметил)-аміно]-тієно[2,3-d]піримідин-2-іл}-піперидин-3карбонової кислоти (2-гідрокси-етил)-амід (Іс) Енантіомери - через лінійний шлях Приклад 13 (S)-ніпекотинової кислоти-(S)-камфорсульфонатна сіль Хіральне розділення (S) ніпекотинової кислоти з комерційно доступної рацемічної суміші До розчину (S)-камфорсульфонової кислоти (18 кг, 77 моль) в ацетоні (127 кг) за температури 55-58 °C швидко завантажують розчин (R, S)-ніпекотинової кислоти (10 кг, 77 моль) у воді (20 кг). Суміш підтримують за температури 55-58 °C доти, поки не розчиняться всі тверді речовини. Розчин повільно охолоджують до 20-25 °C, щоб осадити сіль, потім перемішують протягом ночі й ізолюють. Для подальшого збільшення діастереомерної чистоти, одержану в результаті сіль рекристалізують із ацетону (16 кг) і води (4 кг) за температури 5558 °C. Ще раз охолоджують гарячий розчин до температури 20-25 °C, перемішують протягом ночі й ізолюють, щоб одержати очищену (З)-ніпекотинової кислоти-(8)-камфорсульфонатну сіль (14 кг). Приклад 14 (З)-піперидин-З-карбонової кислоти гідро хлорид (8)-піперидин-1,3-дикарбонової кислоти 1-трет-бутиловий естер (20 кг, 87,2 моль) суспендують в оцтовій кислоті (189 кг) і охолоджують до температури 15 °C. Завантажують надлишок газоподібного хлористого водню (9,6 кг) і перемішують протягом ~4 годин для завершення зняття захисту. Суспензію ізолюють і осад на фільтрі промивають оцтовою кислотою (2 × 31,5 кг). Потім осад на фільтрі висушують у вакуумі, щоб одержати продукт (14,4 кг). Приклад 15 (5)-1-{5-феніл-4-[(піридин-2-ілметил)-аміно]-тієно[2,3-с1]піримідин-2-іл}-піперидин-3карбонова кислота (2-хлоро-5-феніл-тієно[2,3-сІ]піримідин-4-іл)-піридин-2-ілметил-амін (5,9 кг, 16,7 моль) і (S)HineKOTMHOBOi кислоти гідрохлорид (4,15 кг, 25,1 моль) розчиняють в бутиролнітрилі (13,9 кг). Додають надлишок діізопропілетиламіну (8,6 кг, 66,9 моль) і суміш нагрівають до температури 110 °C протягом періоду часу від 24 до 48 годин для завершення реакції. Після закінчення зв'язування (залишається
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;thieno [2,3 -d] pyrimidine derivatives and their use to treat arrhythmia
Автори англійськоюJohn, Derek Edward, Ford, John
Назва патенту російськоюПроизводные тиено[2,3-d]пиримидина и их применение для лечения аритмии
Автори російськоюДжон Дерек Эдвард, Форд Джон
МПК / Мітки
МПК: C07D 495/04, A61K 31/495, A61P 9/00
Мітки: похідні, лікування, застосування, тієно[2,3-d]піримідину, аритмії
Код посилання
<a href="https://ua.patents.su/23-110131-pokhidni-tiehno23-dpirimidinu-i-kh-zastosuvannya-dlya-likuvannya-aritmi.html" target="_blank" rel="follow" title="База патентів України">Похідні тієно[2,3-d]піримідину і їх застосування для лікування аритмії</a>
Попередній патент: Спосіб визначення впливу речовини на біополімери
Наступний патент: Спосіб одержання жорстких пінополіуретанів
Випадковий патент: Спосіб безінструментального формоутворення асиметричних лез поковок зубів землерийних машин












