Похідні піримідину та їх застосування для лікування распіраторних захворювань, наприклад хозл
Формула / Реферат
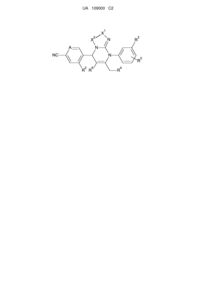
1. Сполука формули (І):
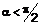 , (I)
, (I)
або її фармацевтично прийнятна сіль, де
А є C-R1;
R1 та R2 є гідрогеном;
R4 є гідрогеном;
R3 є трифлуорметилом;
R5 є гiдpoгeном;
R6 є -CO2R11;
-Х1-Х2- є -NR19-CO-;
R11 є радикалом формули -[Alk1]p-[Q]t-[Alk2]q-Z, де
р та q незалежно є 0 або 1, t є 0;
кожен з Alk1 та Аlk2 незалежно є С1-С6алкіленовим радикалом;
Z є
(і) -N(RA)(RB), де RA та RB незалежно є гідрогеном або С1-С6-алкілом, або
(ii)-N+(RA)(RB)(RC), дe
RA, RB та RC незалежно є С1-С6-алкілом;
R19 є вибраним з гідрогену або С1-С6-алкілу.
2. Сполука за пунктом 1, де R11 є радикалом формули -[Alk1]p-[Q]t-[Alk2]q-Z, де -[Alk1]p-[Q]t-[Alk2]q- є структурою (IV), де V1 є 0, 1, 2, 3 або 4, та Z є структурою (VI), де RA та RB є такими, як визначено в пункті 1,
![]() , (IV)
, (IV)
 , (VI)
, (VI)
та де атоми нітрогену аміну можуть бути кватернізованими.
3. Сполука за будь-яким з попередніх пунктів, де -Х1-Х2- є -NR19-CO- та R19 є метилом.
4. Сполука за будь-яким з попередніх пунктів у формі фармацевтично прийнятної солі.
5. Сполука за пунктом 1, яка вибрана з групи, що включає:
2-диметиламіноетиловий естер 7-(4-ціанофеніл)-5-метил-4-(3-трифлуорметилфеніл)-4,7-дигідро-[1,2,4]триазоло[1,5-а]піримідин-6-карбонової кислоти,
2-диметиламіноетиловий естер 5-(4-ціанофеніл)-2,7-диметил-3-оксо-8-(3-трифлуорметилфеніл)-2,3,5,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин-6-карбонової кислоти та
{2-[5-(4-ціанофеніл)-2,7-диметил-3-оксо-8-(3-трифлуорметилфеніл)-2,3,5,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин-6-карбонілоксі]етил}триметиламонію бромід.
6. Фармацевтична композиція, що містить сполуку за будь-яким з попередніх пунктів та фармацевтично прийнятний носій або наповнювач.
7. Фармацевтична композиція за пунктом 6, яка є адаптованою для перорального введення або введення через легеневий шлях.
8. Сполука за будь-яким з пунктів 1-5 для лікування або для застосування у виробництві лікарського засобу, що застосовують в лікуванні захворювання або стану, в якому залучений HNE, де захворюванням або станом є хронічне обструктивне захворювання легень (ХОЗЛ), хронічний бронхіт, фіброз легень, пневмонія, гострий респіраторний дистрес-синдром (ГРДС), емфізема легень, емфізема, що викликана палінням, або муковісцидоз.
Текст
Реферат: Сполуки формули (І) є інгібіторами нейтрофілеластази: 2 X X 1 N R 3 N A NC N R R 1 2 R 6 R 1 2 5 4 15 , (I) 19 1 6 де А є C-R або N; -Х -Х - є -CR =N- або -NR -CO-; та R -R , R у формулі винаходу. 15 та R 19 є такими, як визначено UA 109000 C2 (12) UA 109000 C2 UA 109000 C2 5 10 15 20 25 30 35 40 45 50 Галузь винаходу Даний винахід стосується гетероциклічних сполук, які є похідними піримідину, що мають інгібіторні властивості до нейтрофіл-еластази людини, та їх застосування в терапії. Передумови створення винаходу Нейтрофіл-еластаза людини (HNE) є 32 кДа серин-протеїназою, знайденою в азурофільних гранулах нейтрофілів. Вона відіграє важливу роль в руйнуванні широкого спектру протеїнів позаклітинного матриксу, у тому числі фібронектину, ламініну, протеогліканів, колагенів III і IV типу, а також еластину (Bieth, G. In Regulation of Matrix accumulation, Mecham, R. P. (Eds), Academic Press, NY, USA 1986, 217-306). Вже давно вважається, що HNE відіграє важливу роль у підтримці гомеостазу завдяки відновленню та видаленню пошкоджених тканин шляхом розкладання структурних протеїнів тканин. Крім того, вона має відношення до захисту від бактеріальної інвазії шляхом руйнування тіла бактерії. На додаток до її впливу на тканини матриксу, HNE була залучена в позитивну регуляцію IL-8 генну експресію, а також індукує IL-8 вивільнення з епітеліальних клітин легенів. В моделях на тваринах хронічного обструктивного захворювання легенів, індукованого палінням тютюну, піддавання дії як інгібіторам малої молекули, так і інгібіторам протеїнів HNE, інгібує відповідь запалення та розвиток емфіземи (Wright, J. L. et al. Am. J. Respir. Crit. Care Med. 2002, 166, 954-960; Churg, A. et al. Am. J. Respir. Crit. Care Med. 2003, 168, 199-207). Таким чином, HNE може відігравати роль, як в руйнуванні матриксу, так і в посиленні відповідей запалення в хронічних респіраторних захворюваннях, де надходження нейтрофілів є характерною особливістю. Більш того, вважається, що HNE відіграє важливу роль в ряді легеневих захворюваннях, включаючи хронічне обструктивне захворювання легень (ХОЗЛ), муковісцидоз (МВ), гострий респіраторний дистрес-синдром (ГРДС), емфізему легенів, пневмонія та фіброз легенів. Він також бере участь у ряді серцевосудинних захворюваннях, при яких ремоделювання тканини включає, наприклад, серцеву недостатність та генерацію ішемічного пошкодження тканин після гострого інфаркту міокарда. ХОЗЛ є загальним терміном, що охоплює три різних патологічних стани, кожен з яких робить свій вклад в зниження надходження повітря: хронічний бронхіт, емфізема легенів та захворювання дрібних дихальних шляхів. Загалом всі три будуть існувати в різних ступенях у пацієнтів, у яких виявлено ХОЗЛ, та всі три можуть бути пов’язані із запаленням опосередкованим нейтрофілами, що підтверджено зростанням числа нейтрофілів, яке спостерігається в бронхоальвеолярному витоку (БАВ) рідини у пацієнтів з ХОЗЛ (Thompson, A. B.; Daughton, D.; et al. Am. Rev. Respir. Dis. 1989, 140, 1527-1537). Вже давно вважається, що основним патогенним фактором в ХОЗЛ є баланс протеаза-антипротеаза (також відомий як «припущення еластаза:антиеластаза»), в якій дисбаланс HNE та ендогенних антипротеаз, таких як 1-антитрмпсин (1-AT), секреторний лейкоцитарний інгібітор протеази (SLPI) та попередник елафіну, призводить до різних запальних порушень ХОЗЛ. У осіб, які мають генетичний дефіцит інгібітору протеази 1-антитрипсину, розвивається емфізема легенів, важкість якої наростає протягом довгого часу (Laurrell, C. B.; Erikkson, S Scand. J. Clin. Invest. 1963 15, 132-140). Тому, надлишок HNE є деструктивним, що призводить до руйнування морфології легенів з втратою еластичності та руйнування альвеолярних зв’язок дихальних шляхів у легенях (емфізема) під час одночасного підвищення проникності капілярів та гіперсекреції слизу (хронічний бронхіт). Короткий опис винаходу Даний винахід передбачає нові сполуки, які є інгібіторами HNE, та є придатними в лікуванні захворювань або станів, в яких відіграє роль активність HNE. Детальний опис винаходу В одному втіленні винахід передбачає сполуки формули (I): (І), де 1 A є C-R або N; 1 2 7 R та R є вибраними з гідрогену, галогену, нітро, ціано, -S(O)nR , аміно, моно- або ді-C1-C68 9 10 алкіламіно, -NHCOR , -NH(C=O)NHR , -NHSO2R , Cl-C6-алкілу, C2-C6-алкенілу, C2-C6-алкінілу, 1 UA 109000 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідроксилу, C1-C6-алкокси або C2-C6-алкенілокси, де C1-C6-алкіл та C1-C6-алкокси можуть бути додатково заміщеними від одного до трьох ідентичними або різними радикалами, вибраними з групи, що складається з галогену, гідрокси та C1-C4-алкокси; n є 0, 1 або 2; 4 R є гідрогеном; 3 5 R та R є незалежно вибраними з гідрогену, галогену та C1-C6-алкілу, який додатково може бути заміщений галогеном; 7 R вибирають з C1-C6-алкілу, гідроксі-C1-C6-алкілу, C1-C4-алкокси, аміно, моно- або ді-C1-C4алкіламіно, гідроксикарбонілу, амінокарбонілу, C3-C6-циклоалкілу, фенілу або C2-C6-алкенілу; де C3-C6-циклоалкіл може бути заміщений одним або більше C1-C4-алкілом, гідроксилом та C1-C4алкокси, та феніл може бути заміщений одним або більше галогеном, ціано, C1-C4-алкіллом, дифлуорметил, трифлуорметил, дифлуорметокси, трифлуорметокси та C1-C4-алкокси; 8 9 10 R та R є незалежно вибраними з гідрогену та C1-C6-алкілу, та R є C1-C6-алкілу; 6 11 12 13 14 R є -CO2R , -CONR R або -COR ; 1 2 15 19 -X -X - є -CR =N- або -NR -CO- ; R12 є гідрогеном або C1-C6-алкілом; 11 13 14 1 2 R , R , R кожен незалежно є радикалом формули -[Alk ]p-[Q]t-[Alk ]q-Z, де p, q та t незалежно є 0 або 1 за умови, що p, q та t одночасно не є 0; 1 2 Alk та Alk кожен незалежно є C1-C6-алкіленовим радикалом; Q є двовалентним моно- або біциклічним карбоциклічним або гетероциклічним радикалом, що має 3-9 кільцевих членів; Zє (i) моноциклічним гетероциклічним кільцем з 5 або 6 кільцевими членами або містковою гетероциклічною кільцевою системою з 7 або 8 кільцевими членами, де кільцевими гетероатомами є нітроген, згадане моноциклічне кільце або місткова кільцева система, що є зв’язаним з залишком молекули через кільцевий карбон, та де кільцевий нітроген може бути кватернізованим шляхом заміщення C1-C3-алкілом або бензилом, останній може бути заміщений в своєму фенольному кільці; або A B A B (ii) -N(R )(R ), де R та R незалежно є гідрогеном, або C1-C6-алкільною, C3-C6циклоалкільною групою, або феніл(C1-C6)алкільною групою, необов’язково заміщеною в фенільному кільці; або, взяті разом з нітрогеном, до якого вони є приєднаними, утворюють моноциклічне гетероциклічне кільце з 5-7 кільцевими атомами, які додатково можуть містити гетероатом, вибраний з N, O або S; або + A B C (iii) -N (R )(R )(R ), де A B C R , R і R незалежно є C1-C6-алкілом, C3-C6-циклоалкільною групою або феніл(C1C6)алкільною групою, необов’язково заміщеною в фенільному кільці; або A R є C1-C6-алкілом, C3-C6-циклоалкільною групою або феніл(C1-C6)алкільною групою, B C необов’язково заміщеною в фенільному кільці, R і R взяті разом з нітрогеном, до якого вони є приєднаними, утворюють моноциклічне гетероциклічне кільце з 5-7 кільцевими атомами, яке додатково може містити гетероатом, вибраний з N, O або S; або A B C R , R і R взяті разом з нітрогеном, до якого вони є приєднаними, утворюють місткову гетероциклічну кільцеву систему з 7 або 8 кільцевими членами; A B C D (iv) -NR C(=NR )NR R , де A B C D A B C D R , R , R і R незалежно є гідрогеном або C1-C6-алкілом; або будь-які з R , R , R і R незалежно є гідрогеном або C1-C6-алкілом, тоді як інші два взяті разом є C1-C6-алкіленовим радикалом; або A B C (v) -C(=NR )NR R , де A B C A B C R , R і R незалежно є гідрогеном або C1-C6-алкілом; або будь-який один з R , R і R є гідрогеном або C1-C6-алкілом, тоді як інші два взяті разом є C1-C6-алкіленовим радикалом; A C B (vi) -NR C(=NR )R , де A B C A B C R , R і R незалежно є гідрогеном або C1-C6-алкілом; або будь-який один з R , R і R є гідрогеном або C1-C6-алкілом, тоді як інші два взяті разом є C1-C6-алкіленовим радикалом; 19 R є вибраним з гідрогену, (C1-C6)алкілу, фенілу, моноциклічного гетероарилу, що має 5 або 6 кільцевих атомів, феніл(C1-C6)алкілу, гідроксі(C1-C6)алкілу або трифлуорметилу; 15 E R є вибраним з феніл(C1-C6)алкілу, нітрилу (-CN), NH2-(C1-C6)алкілу, NHR -(C1-C6)алкілу, E F E E E E E F NR R -(C1-C6)алкілу, -COOH, -COR , -SO2R , -CONH2, -CONHR , -SO2NHR , -CONR R або E F E F SO2NR R , де R і R незалежно є (C1-C6)алкілом, фенілом або моноциклічним гетероарилом, E F що має 5 або 6 кільцевих атомів, або R і R , коли приєднані до одного й того ж атому нітрогену, утворюють циклічне аміно кільце. Сполуки формули (I), зазначені вище, можуть бути одержаними у формі солей, а саме 2 UA 109000 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично прийнятних солей, N-оксидів, їх гідратів та сольватів. Будь-який пункт формули щодо сполуки в даному документі, або посилання на “сполуки за винаходом”, “сполуки, яких стосується винахід”, “сполуки формули (I)”, тощо, включає такі сполуки так чи інакше в формі солі, N-оксиду, гідрату або сольвату. Сполуки за винаходом можуть застосовувати в лікуванні або попередженні захворювань, в яких залучені HNE, наприклад, хронічне обструктивне захворювання легень (ХОЗЛ), хронічний бронхіт, фіброз легенів, пневмонія, гострий респіраторний дистрес-синдром (ГРДС), емфізема легенів, емфізема, викликана палінням та кістозний фіброз. Таким чином, іншими аспектами винаходу є (i) фармацевтична композиція, що містить сполуку за винаходом та фармацевтично прийнятний носій або наповнювач; та (ii) застосування сполуки за винаходом для виробництва лікарського засобу для лікування або попередження захворювання або стану, в які залучені HNE. Термінологія Як використано в даному документі, термін “C a-Cb-алкіл”, де a і b є цілими числами, стосується лінійного або розгалуженого ланцюга алкільного радикалу, що має від a до b атомів карбону. Таким чином, коли a є 1 та b є 6, наприклад, термін включає метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил та н-гексил. Як використано в даному документі, термін “Ca-Cb-алкеніл”, де a і b є цілими числами, стосується лінійного або розгалуженого ланцюга алкенільного залишку, що має від a до b атомів карбону та має, щонайменше, один подвійний зв’язок або E, або Z стереохімічної конфігурації. Таким чином, коли a є 2 та b є 6, наприклад, термін включає, наприклад, вініл, аліл, 1- і 2-бутеніл та 2-метил-2-пропеніл. Як використано в даному документі, термін "Ca-Cb-алкініл", де a і b є цілими числами, стосується лінійного або розгалуженого ланцюга вуглеводневих груп, що мають від a до b атомів карбону та, до того ж, мають один потрійний зв’язок. Таким чином, коли a є 2 та b є 6, наприклад, термін включає, наприклад, етиніл (-C≡CH), 1-пропініл, 1- і 2-бутиніл, 2-метил-2пронініл, 2-пентиніл, 3-пентиніл, 4-пентиніл, 2-гексиніл, 3-гексиніл, 4-гексиніл та 5-гексиніл. Як використано в даному документі, термін "двовалентний Ca-Cb-алкіленовий радикал", де a і b є цілими числами, стосується насиченого вуглеводневого ланцюга, що має від a до b атомів карбону та дві вільних валентності. Як використано в даному документі, термін " двовалентний Ca-Cb-алкеніленовий радикал", де a і b є цілими числами, стосується двовалентного вуглеводневого ланцюга, що має від a до b атомів карбону та, щонайменше, один подвійний зв’язок. Як використано в даному документі, не уточнений термін "карбоциклічний" стосується моно-, бі- або трициклічного радикалу або місткового моноциклічного або біциклічного радикалу, що має аж до 16 кільцевих атомів, всі з яких є карбонами, та включає арил та циклоалкіл. Містковий карбоциклічний радикал має моноциклічне або біциклічне кільце з двома кільцевими атомами, зв’язаними алкіленовим містком, такі як радикали біцикло[2.2.2]октану, біцикло[3.1.1]гептану та адамантану. Як використано в даному документі, не уточнений термін "циклоалкіл" стосується моноциклічного насиченого карбоциклічного радикалу, що має від 3 до 8 атомів карбону та включає, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, біцикло[2.2.2]октаніл та адамантаніл. Як використано в даному документі, не уточнений термін "арил" стосується моно-, бі- або трициклічного карбоциклічного ароматичного радикалу, та включає радикали, що мають два моноциклічних карбоциклічних ароматичних кільця, які є напряму зв’язані ковалентним зв’язком. Ілюстрацією таких радикалів є феніл, біфеніл та нафтил. Як використано в даному документі, не уточнений термін "гетероарил" стосується моно-, біабо трициклічного ароматичного радикалу, що містить один або більше гетероатомів, вибраних з S, N або O, та включає радикали, що мають два таких моноциклічний кільця, або одне таке моноциклічне кільце та одне моноциклічне арильне кільце, які є напряму зв’язаними ковалентним зв’язком. Ілюстрацією таких радикалів є тієніл, бензотієніл, фурил, бензофурил, піроліл, імідазоліл, бензімідазоліл, тіазоліл, бензотіазоліл, ізотіазоліл, бензізотіазоліл, піразоліл, оксазоліл, бензоксазоліл, ізоксазоліл, бензізоксазоліл, ізотіазоліл, триазоліл, бензотриазоліл, тіадіазоліл, оксадіазоліл, піридиніл, піридазиніл, піримідиніл, піразиніл, триазиніл, індоліл та індазоліл. Коли гетероарильне кільце містить sp2 нітроген, такий як у випадку піридину або імідазолу, то нітроген може бути квартенізованим нітрогеном, як в піридинію або імідазолію. Як використано в даному документі, не уточнений термін "гетероцикліл" або "гетероциклічний" або “гетероциклоалкіл” включає "гетероарил", як визначено вище, та в його неароматичному значенні стосується моно-, бі- або трициклічного, або місткового моно 3 UA 109000 C2 5 10 15 20 25 30 35 40 45 50 55 циклічного, або біциклічного неароматичного радикалу, що містить один або більше гетероатомів, вибраних з S, N та O, та груп, що містять моноциклічний неароматичний радикал, що містить один або більше таких гетероатомів, які є ковалентно з’єднаними з іншим таким радикалом або моноциклічним карбоциклічним радикалом. Містковий гетероциклічний радикал має моноциклічне або біциклічне кільце, що містить, щонайменше, один S, N або O кільцевий атом з двома кільцевими атомами, такими як два кільцевих карбони, або кільцевий нітроген та кільцевий карбон, зв’язаними за допомогою алкіленового містка, такі як радикали 1азабіцикло[2.2.2]октан. Коли кільцевий нітроген є містковим, то, таким чином, він далі може бути заміщеним, як центр кватернізованого нітрогену. Ілюстрацією таких радикалів є пролільна, фуранільна, тієнільна, піперидинільна, імідазолільна, оксазолільна, ізоксазолільна, тіазолільна, тіадіазолільна, піразолільна, піридинільна, піролідинільна, піримідинільна, морфолінільна, піперазинільна, індолільна, морфолінільна, бензофуранільна, піранільна, ізоксазолільна, бензімідазолільна, метилендіоксифенільна, етилендіоксифенільна, малеімідна, сукцинімідна та 1-азабіцикло[2.2.2]октанільна або 1-метил-1-азабіцикло[2.2.2]октанільна групи. Якщо інше не зазначено в контексті, в якому він зустрічається, термін "заміщений", як застосовано до будь-якого залишку в даному документі означає заміщений аж до чотирма сумісними замісниками, кожен з яких незалежно може бути, наприклад, C 1-C6-алкілом, циклоалкілом, C1-C6-алкокси, гідрокси, гідроксил-C1-C6-алкілом, меркапто, меркапто-C1-C6алкілом, C1-C6-алкілтіо, фенілом, моноциклічним гетероарилом, що має 5 або 6 кільцевих атоми, галогеном (включаючи флуор, бром та хлор), трифлуорметилом, трифлуорметокси, G G G G нітро, нітрилом (-CN), оксо, -COOH, -COOR , -COR , -SO2R , -CONH2, -SO2NH2, -CONHR , G G H G H G G H G G H SO2NHR , -CONR R , -SO2NR R , -NH2, -NHR , -NR R , -OCONH2, -OCONHR , -OCONR R , G G H G G H H G NHCOR , -NHCOOR , -NR COOR , -NHSO2OR , -NR SO2OH, -NR SO2OR ,-NHCONH2, G H G H G H G G H G H NR CONH2, -NHCONHR , -NR CONHR , -NHCONR R або -NR CONR R , де R і R незалежно є C1-C6-алкілом, C3-C6-циклоалкілом, фенілом або моноциклічним гетероарилом, що має 5 або G H 6 кільцевих атомів, або R і R , коли приєднані до одного і того ж атому нітрогену, утворюють циклічне амінне кільце, таке як піперидиніл, морфолініл або піперазиніл. “Необов’язково заміщений” може бути однією з вищезгаданих груп замісників. Як використано в даному документі, термін “сіль” включає основні адитивні та кислотні адитивні. Сполуки за винаходом, які є кислотними можуть утворювати солі, в тому числі фармацевтично прийнятні солі, з основами, такими як гідроксиди лужних металів, наприклад, гідроксиди натрію та калію; гідроксиди лужноземельних металів, наприклад, гідроксиди кальцію, барію та магнію; з органічними основами, наприклад, N-метил-D-глюкаміном, холіном три(гідроксиметил)амінометаном, L-аргініном, L-лізином, N-етил піперидином, дибензиламіном, тощо. Ті сполуки (I), які є основними, можуть утворювати солі, в тому числі фармацевтично прийнятні солі, з неорганічними кислотами, наприклад, з гідрогенгалогенними кислотами, такими як гідрогенхлоридна або гідрогенбромідна кислоти, сульфатною кислотою, нітратною кислотою або фосфорною кислотою, тощо, та з органічними кислотами, наприклад, з оцтовою, винною, бурштиновою, фумаровою, малеїновою, яблучною, саліциловою, лимонною, метансульфоновою, п-толуолсульфоновою, бензойною, бензолсульфоновою, глутаміновою, молочною та мигдалевою кислотами, тощо. Ті сполуки (I), які мають кватернізований нітроген, можуть також утворювати четвертинні солі з фармацевтично прийнятними противойонами, такими як хлорид, бромід, ацетат, форміат, п-толуолсульфонат, сукцинат, гемісукцинат, нафталін-біс-сульфонат, метансульфонат, ксинафоат, тощо. Сполуки за винаходом, які містять один або більше фактичних або потенційних хіральних центри, через присутність асиметричних атомів карбону, можуть існувати у вигляді декількох діастереоізомерів з R або S стереохімічною конфігурацією в кожному хіральному центрі. Винахід включає всі такі діастереоізомери та їх суміші. В сполуках за винаходом формули (I), в будь-якій сумісній комбінації: Кільце, що містить A є фенілом або 3-піридильним кільцем. 1 2 R і R є вибраними з будь-якого типу замісників, для яких вони є визначеними у відповідній формулі (I), включаючи гідроген, галоген, такий як флуоро та хлоро, нітро, ціано, -S(O)2(C1C3алкіл), такий як метансульфоніл, аміно, моно- або ді-C1-C6-алкіламіно, такий як метиламіно та диметиламіно, -NHCOCH3, -NH(C=O)NHCH3, -NHSO2CH3, C1-C6-алкіл, такий як метил, етил або н- або ізопропіл, C2-C6-алкеніл, такий як вініл або аліл, C2-C6-алкініл, такий як CH≡C-, гідроксил, C1-C6-алкокси, такий як метокси або етокси, або C2-C6-алкенілокси, такий як алілокси, де C1-C6алкіл та C1-C6-алкокси можуть бути додатково заміщеними від одного до трьох однаковими або різними радикалами, вибраними з групи, що складається з галогену, такого як флуор, гідрокси та C1-C4-алкокси. 4 UA 109000 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 2 В одному типі сполуки за винаходом кільце, що містить А є фенілом, R є гідрогеном, та R є 2 гідрогеном або 2-метансульфонілом. В іншому типі кільце, що містить A є 3-піридилом та R є гідрогеном або 2-метансульфонілом. 3 5 R та R також можуть бути вибраними з будь-якого типу замісників, для яких вони є визначеними у відповідності до формули (I), таких як гідроген, флуор, хлор або бром, та C 1-C6алкілу, такого як метил, який додатково може бути заміщений галогеном, як у випадку 5 3 трифлуорметилу. В одному типі сполуки за винаходом R є гідрогеном та R є 3трифлуорметилом, 3-хлор- або 3-бром-. 6 11 12 13 14 11 13 14 R є -CO2R , -CONR R або -COR , де кожен з R , R , R незалежно є радикалом 1 2 формули -[Alk ]p-[Q]t-[Alk ]q-Z, де p, q та t незалежно є 0 або 1 за умови, що p, q та t не є одночасно 0; 1 2 Alk та Alk кожен незалежно є C1-C6-алкіленовим радикалом, таким як -CH2-, -CH2CH2- або CH2CH2CH2-; Q є двовалентним моно- або біциклічним карбоциклічним або гетероциклічним радикалом, що має 3-9 кільцевих членів, таким як 1,3-циклопентиленовий, 1,4-циклогексиленовий, 1-4феніленовий, 2,5-піридиніленовий, 1,4-піперидиніленовий або 1,4-піперазиніленовий радикал; Zє (i) моноциклічним 5- або 6-членним гетероциклом, що містить нітроген, таким як піридил або імідазоліл, або містковою 7- або 8-членною гетероциклічною системою, що містить нітроген, такою як 1-азабіцикло[2.2.2]октанове кільце, згаданим моноциклічним кільцем або містковою кільцевою системою, що є з’єднаною із залишком молекули через кільцевий карбон, та в якій кільцевий нітроген може бути кватернізованим C 1-C3-алкілом, таким як метил, фенілом або бензилом, де останній є необов’язково заміщеним в фенільному кільці; або A B A B (ii) -N(R )(R ), де R та R незалежно є гідрогеном, або C1-C6-алкільною групою, такою як метил, етил або н- або ізопропіл, C3-C6-циклоалкільною групою, такою як циклопропіл, циклопентил або циклогексил, або феніл(C1-C6)алкільною групою, такою як бензил, необов’язково заміщений в фенільному кільці; або, взяті разом з нітрогеном, до якого вони є приєднаними, утворюють моноциклічне гетероциклічне кільце з 5-7 кільцевими атомами, яке додатково може містити гетероатом, вибраний з N, O або S, таке як піперидинове, піперазинове або морфолінове кільце; або + A B C (iii) -N (R )(R )(R ), де A B C R , R та R незалежно є C1-C6-алкільною групою, такою як метил, етил або н- або ізопропіл, C3-C6-циклоалкільною групою, такою як циклопропіл, циклопентил або циклогексил, або феніл(C1-C6)алкільною групою, такою як бензил, необов’язково заміщений в фенільному кільці; або A R є C1-C6-алкільною групою, такою як метил, етил або н- або ізопропіл, C3-C6циклоалкільною групою, такою як циклопропіл, циклопентил або циклогексил, або феніл(C 1B C6)алкільною групою, такою як бензил, необов’язково заміщений в фенільному кільці та R та C R взяті разом з нітрогеном, до якого вони є приєднаними, утворюють моноциклічне гетероциклічне кільце з 5-7 кільцевими атомами, яке додатково може містити гетероатом, вибраний з N, O або S, таке як піперидинове, піперазинове або морфолінове кільце; або A B C R , R та R взяті разом з нітрогеном, до якого вони є приєднаними, утворюють місткову гетероциклічну кільцеву систему з 7-8 кільцевими членами; A B C D (iv) -NR C(=NR )NR R , де A B C D R , R , R та R незалежно є гідрогеном або C1-C6-алкілом, таким як метил; або будь-які два A B C D з R , R , R та R незалежно є гідрогеном або C1-C6-алкілом, тоді як інші два взяті разом є C1C6-алкіленовим радикалом, таким як -CH2-, -CH2CH2- або -CH2CH2CH2-; або A B C (v) -C(=NR )NR R , де A B C R , R та R незалежно є гідрогеном або C1-C6-алкілом, таким як метил; або будь-який один A B C з R , R та R є гідрогеном або C1-C6-алкілом, таким як метил, тоді як інші два взяті разом є C1C6- алкіленовим радикалом, таким як -CH2-, -CH2CH2- або -CH2CH2CH2-; A C B (vi) -NR C(=NR )R , де A B C R , R та R незалежно є гідрогеном або C1-C6-алкілом, таким як метил; або будь-який один A B C з R , R та R є гідрогеном або C1-C6-алкілом, таким як метил, тоді як інші два взяті разом є C1C6- алкіленовим радикалом, таким як-CH2-, -CH2CH2- або -CH2CH2CH2-. 6 11 12 13 Більш складні R замісники включають ті, що представлені як -CO2R , -CONR R або 14 11 13 14 1 2 1 2 COR , де R , R та R мають формулу -[ Alk ]p-[Q]t-[Alk ]q-Z, де -[Alk ]p-[Q]t-[Alk ]q- є вибраним зі 1 2 структур (IV) та (V), де кожен з V та V незалежно є 0, 1, 2, 3 або 4 та X є двовалентним моноабо біциклічним карбоциклічним або гетероциклічним радикалом, що має 3-9 кільцевих члени, таким як 1,4-циклогексилен, 1,3-циклопентилен, 1,4-фенілен або 2,4-піридинілен, та Z є 5 UA 109000 C2 A B C D вибраним зі структур (VI)-(XVI), де R , R , R та R є такими, як визначено у відповідності до 1 2 3 формули (I), та кожен з V , V , та V незалежно є 0, 1, 2, 3 або 4. * * X V1 *" * V2 V1 (IV) (V) V2 A R N * V3 * A R N V1 (VII) (VI) (VIII) A V1 N 20 25 V3 + N V2 V2 V1 * A 15 N V1 V2 (X) R N N B R A R R N C D R N (XI) A C R N 10 R N (IX) 5 * A R * * N * * N B R R * B R N C R (XII) (XIII) (XIV) Атоми нітрогену в аміні та піридині, що присутні в групах (VI)-(XIV), можуть бути кватернізованими необов’язково заміщеною C 1-C6-алкільною або бензольною групою. 6 11 11 В одному типі сполуки за винаходом R має формулу -CO2R , де R є радикалом формули 2 2 -Alk -Z, де Alk та Z є такими, як визначено та розкрито вище.Наприклад, в даному типі сполуки 2 A B + A B C Alk може бути -CH2-, -CH2CH2- або -CH2CH2CH2- та Z може бути -N(R )(R ) або -N (R )(R )(R ), A B C де R , R та R незалежно є C1-C6-алкільною групою, такою як метил, етил або н- або ізопропіл, C3-C6-циклоалкільною групою, такою як циклопропіл, циклопентил або циклогексил, або феніл(C1-C6)алкільною групою, такою як бензил, необов’язково заміщений в фенільному кільці. 6 + Таким чином, R може бути -CO2CH2CH2N(CH3)2 або -CO2CH2CH2N (CH3)3 1 2 15 19 15 19 -X -X - є -CR =N- або -NR -CO-, де R та R є такими, як визначено вище у відповідності до формули (I). Таким чином 19 R може бути, наприклад, гідрогеном, метилом, етилом, н- або ізопропілом, 2-, 3- або 4піридилом, 2- або 3-тієнілом, оксазолілом, ізоксазолілом, тіазолілом, ізотіазолілом, імідазолілом, бензилом, гідроксиметилом, 2-гідроксіетилом або трифлуорметилом; та 15 E R може бути, наприклад, бензилом; нітрилом (-CN); амінометилом; 2-аміноетилом; NHR E E F (C1-C6)алкілом, де R є метилом або етилом, та (C1-C6)алкіл є -CH2- або -CH2CH2-; NR R -(C1E F C6)алкілом, де R та R незалежно є метилом або етилом, та (C1-C6)алкіл є -CH2- або -CH2CH2-; E E E E E F E F E -COOH; або -COR , -SO2R , -CONH2, -CONHR , -SO2NHR , -CONR R , або -SO2NR R , де R та F E F R незалежно є метилом або етилом, або R та R , коли приєднані до одного й того ж атому нітрогену, утворюють циклічне нітрогенвмісне кільце. 1 6 Приклади конкретних груп R -R включають ті, що присутні в сполуках прикладів в даному документі. Терапевтичне застосування представлених сполук, як відомо, є прийнятним до будь-якого захворювання, що є принаймні частково опосередкованим дією еластази нейтрофілів людини. 6 UA 109000 C2 5 10 15 20 25 30 35 40 45 50 55 Наприклад, представлені сполуки можуть бути корисними в лікуванні хронічного обструктивного захворювання легень (ХОЗЛ), муковісцидозу (МВ), гострого респіраторного дистрес-синдрому (ГРДС), емфіземи легень, пневмонії та фіброзу легень. Представлений винахід також стосується фармацевтичних препаратів, що містять, як активний інгредієнт, сполуку за винаходом. Інші сполуки можуть бути поєднані зі сполуками за даним винаходом для попередження та лікування запальних захворювань легень. Таким чином, представлений винахід також стосується фармацевтичних композицій для попередження та лікування запальних захворювань легень, що містять терапевтично ефективну кількість сполуки за винаходом та один або більше інших терапевтичних агентів. Прийнятні терапевтичні агенти для комбінованої терапії зі сполуками за винаходом включають: (1) кортикостероїд, наприклад флутиказон або будесонід, (2) агоніст 2адренорецептору, наприклад сальметерол або форметерол; (3) модулятор лейкотрієну, наприклад монтелукаст або пранлукаст; (4) антихолінергічні агенти, наприклад селективні антагоністи мускаринових-3 (M3) рецепторів, такі як тіотропійбромід; (5) інгібітори фосфодіестерази IV (ФДЕ-IV), наприклад рофлуміласт або ціломіласт; (6) протикашльовий засіб, такий як кодеїн або декстраморфан; та (7) нестероїдний протизапальний засіб (НПЗЗ), наприклад ібупрофен або кетопрофен. Масове співвідношення першого та другого активних інгредієнтів може варіювати та буде залежати від ефективної дози кожного інгредієнту. Як правило, застосовуватимуть ефективну дозу кожного. Величина профілактичної або терапевтичної дози сполуки за винаходом, зрозуміло, буде варіювати в залежності від природи важкості стану особи, що лікують, та конкретної сполуки, та шляху її введення, та, як правило, буде визначатися шляхом клінічного випробування відповідно до вимог у фармацевтичній галузі. Вона також буде варіювати в залежності від віку, ваги та реакції окремого пацієнта. В цілому, денний діапазон доз буде знаходитися в межах від 0,001 мг до 100 мг на кг маси тіла ссавця, переважно від 0,01 мг до 50 мг на кг, та найбільш переважно від 0,1 до 10 мг на кг, в одноразовій або поділених дозах. З іншого боку, може бути необхідним застосовувати дози, що в деяких випадках виходять за дані межі. Інший аспект представленого винаходу передбачає фармацевтичні композиції, які містять сполуку за винаходом та фармацевтично прийнятний носій. Термін «композиція», як і у фармацевтичній композиції, призначений охоплювати продукт, що містить активний(і) інгредієнт(и) та інертний(і) інгредієнт(и) (фармацевтично прийнятні наповнювачі), які складають носій, а також будь-який продукт, що є результатом, безпосереднього або опосередкованого поєднання, комплексоутворення або агрегації будь-яких двох або більше інгредієнтів, або дисоціації одного або більше інгредієнтів, або з інших типів реакцій або взаємодією одного або більше інгредієнтів. Таким чином, фармацевтичні композиції за представленим винаходом охоплюють будь-які композиції виготовлені шляхом змішування сполуки за винаходом, додаткового(их) активного(их) інгредієнту(ів) та фармацевтично прийнятних наповнювачів. Фармацевтичні композиції за представленим винаходом містять сполуку за винаходом, як активний інгредієнт, або її фармацевтично прийнятну сіль, та також можуть містити фармацевтично прийнятний носій, та необов'язково інші терапевтичні інгредієнти. Термін "фармацевтично прийнятні солі" стосується солей, одержаних з фармацевтично прийнятних нетоксичних основ або кислот, включаючи неорганічні основи або кислоти та органічні основи або кислоти. Будь-який прийнятний шлях введення може бути використаний для забезпечення ссавців, зокрема людини, ефективною дозою сполуки за представленим винаходом. В терапевтичному застосуванні активну сполуку можуть вводити будь-яким зручним, прийнятним або ефективним шляхом. Прийнятні шляхи введення є відомими кваліфікованому фахівцю в даній галузі з рівня техніки та включають пероральний, внутрішньовенний, ректальний, парентеральний, місцевий, очний, назальний, букальний та легеневий (інгаляційний). Композиції, прийнятні для введення шляхом інгаляції, є відомими та можуть включати носії та/або розріджувачі, які є відомими для застосування в таких композиціях. Композиція може містити 0,01-99% за вагою активної сполуки. Переважно, одинична доза містить активну сполуку в кількості від 1 мкг до 10 мг. Найбільш прийнятний рівень дозування може бути визначений будь-яким прийнятним способом, відомим кваліфікованому фахівцю в даній галузі з рівня техніки. Слід мати на увазі, однак, що конкретна кількість для будь-якого конкретного пацієнта буде залежати від цілого ряду факторів, включаючи активність конкретної сполуки, що застосовують, вік, масу тіла, дієту, загальний стан здоров'я та стать пацієнта, час введення, шлях введення, швидкість виведення, 7 UA 109000 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосування будь-яких інших лікарських засобів, та тяжкість захворювання, що піддають лікуванню. Для інгаляційного введення, переважною формою активної сполуки є мікрочастки. Вони можуть бути одержані різними способами, включаючи висушування при розпилюванні, ліофільне висушування та мікронізацію. Як приклад, композиція за винаходом може бути одержана як суспензія для введення через небулайзер або як аерозоль в рідкому пропеленті, наприклад, в дозованому аерозольному інгаляторі з розпиленням зжатим повітрям (PMDI). Пропеленти, придатні для застосування в PMDI є відомими кваліфікованому фахівцю та включають CFC-12, HFA-134a, HFA-227, HCFC-22 (CCl2F2) та HFA-152 (CH4F2 та ізобутан). В переважному втіленні винаходу, композиція за винаходом є сухою порошковою формою для введення з використанням сухого порошкового інгалятора (DPI). Багато типів DPI є відомими. Мікрочастки для доставки шляхом введення можуть бути сформульовані з допоміжними речовинами, що допомагають доставці та вивільненню. Наприклад, в сухій порошковій композиції, мікрочастки можуть бути сформульовані з великими частинками носія, які допомагають їм долетіти з DPI всередину легень. Прийнятні частинки носія є відомими та включають частинки лактози, які можуть мати масовий середній аеродинамічний діаметр більше ніж 90 мкм. У випадку аерозольного препарату переважним складом є: Сполука за винаходом 24 мг / каністру Лецитин, NF Рід. Конц. 1,2 мг / каністру Трихлорфлуорметан, NF 4,025 г / каністру Дихлордифлуорметан, NF 12,15 г / каністру. Сполуки за винаходом можуть застосовувати в комбінації з іншими лікарськими засобами, які використовують для лікування/попередження/пригнічення або покращення захворювань або станів, за яких представлені сполуки є корисними. Такі інші лікарські засоби можуть вводити шляхом та в кількості, що зазвичай використовують, відповідно, одночасно або послідовно зі сполукою за винаходом. Коли сполуку за винаходом застосовують одночасно з одним або більше іншими лікарськими засобами, то переважним є фармацевтична композиція, що містить такі інші лікарські засоби додатково до сполуки за винаходом. Відповідно, фармацевтичні композиції за представленим винаходом включають ті, які також містять один або більше інших активних інгредієнтів додатково до сполуки за винаходом. Агенти за винаходом можуть вводити у вигляді інгаляційних форм. Генерація аерозолю може бути здійснена з використанням, наприклад, працюючих під тиском струменевих розпилювачів або ультразвукових розпилювачів, переважно з використанням дозованих аерозолів з носієм пропелентом або вільним від пропеленту введенням мікронізованих активних сполук з, наприклад, інгаляційних капсул або інших систем доставки "сухого порошку". Активні сполуки можуть бути дозованим, як описано в залежності від системи інгалятора, що використовують. Додатково до активних сполук форми введення можуть додатково містити наповнювачі, такі як, наприклад, пропеленти (наприклад, хладон у випадку дозованих аерозолів), поверхнево-активні речовини, емульгатори, стабілізатори, консерванти, ароматизатори, наповнювачі (наприклад, лактоза у випадку порошкових інгаляторів) або, у відповідних випадках, додаткові активні сполуки. З метою інгаляції, доступною є велика кількість систем, за допомогою яких аерозолі з оптимальним розміром часток можуть бути згенерованими та введеними, використовуючи техніку інгаляції, яка є прийнятною для пацієнта. Додатково застосовують адаптери (спейсери, розширювачі) та грушоподібні контейнери (наприклад, Nebulator®, Volumatic®), та автоматичні пристрої, що випускають розпилений спрей (Autohaler®), для дозованих аерозолів, зокрема, у разі порошкових інгаляторів доступними є ряд технічних рішень (наприклад, Diskhaler®, Rotadisk®, Turbohaler® або інгалятори наприклад, як описано в ЕР-А-0505321). Способи синтезу 1 2 15 Зразки за винаходом, в яких X -X є -CR =N- можуть бути одержані відповідно до схем 1-4. 1 2 19 11 Сполуки, в яких X -X є -NR -CO- можуть бути одержані відповідно до схем 5-10. Група R , 13 14 1 2 група R та група R є групою формули -[Y]m-[Alk ]p-[Q]t-[Alk ]q-Z або групою, яка пізніше може 1 2 15 19 бути перетворена в таку групу. Для сполук, в яких X -X є -CR =N- або -NR -CO-, група може бути введена, наприклад, але не виключно, відповідно до схеми 11. На схемі 1, 3-аміно-1,2,4-триазол, альдегід, такий як 4-ціанобензальдегід, та кетон з бета електроноакцепторною групою E (наприклад, естер, амід або кетон) можуть піддаватися реакції з утворенням проміжної сполуки (1), яка далі може бути арильована з прийнятною 8 UA 109000 C2 5 арилбороновою кислотою, такою як 3-(трифлуорметил)фенілборонова кислота, за умов мідного каталізу, одержуючи зразки типу (2). Реакцію можуть виконувати в присутності основи, наприклад, піридину або триетиламіну, або в присутності, або за відсутністю розчинника, такого як дихлорметан. Інші реакції можуть проводити в різних розчинниках, які повинні бути сумісними з реагентами, що використовують, та можуть бути проведені при різних прийнятних температурах, як правило 0-80C, в залежності від розчинника, що використовують. Et 3N EtOH Cu(OAc)2 Et 3N/ДХМ або піридин (2) (1) 10 Схема 1 Енантіомери рацемічної суміші (1) або (2) могли бути розділені шляхом хіральної ВЕРХ. Альтернативно, коли карбонову кислоту можуть вводити в структуру (1) або (2), наприклад, але не виключно, шляхом розщеплення відповідного естеру, розділення могло б виконуватися шляхом кристалізації з хіральною основою (схеми 2 та 3). і) Кристалізація з хіральною основою Естер розщеплення ii) HCl Окремий енантіомер R' = H або Ar R'' = наприклад, аліл або бензил Схема 2 і) Кристалізація з хіральною основою Естер розщеплення 15 20 ii) HCl Окремий енантіомер R' = H або Ar R'' = алкіл або арил Схема 3 Трьох компонентну реакцію на схемі 1 також можуть виконувати стереоспецифічним способом, використовуючи хіральну кислоту Льюїса (схема 4), з одержанням виключно необхідного стереоізомеру або більше його енантіомеру (J. Am. Chem. Soc., 2005, 127, 1638616387). кислота Льюїса Хіральний ліганд 25 Схема 4 Інші зразки за винаходом (6) можуть бути одержані відповідно до схеми 5. OМетилсечовина, альдегід та кетон з бета-електронакцепторною групою E (наприклад, естер, амід або кетон) можуть реагувати в присутності основи, такої як натрію гідрогенкарбонат, 9 UA 109000 C2 5 10 утворюючи проміжну сполуку (3). Реакція з активованим хлорформіатом, таким як 4нітрофенілхлорформіат або пентафлуорфенілхлорформіат, продукує (4). Замикання кільця потім може досягатись, використовуючи заміщений гідразин, щоб одержати (5). Арилювання (5) можуть здійснювати, використовуючи арилборонову кислоту, таку як 3(трифлуорметил)фенілборонова кислота, за умов мідного каталізу та в присутності основи, наприклад, піридину або триетиламіну. Реакцію можуть проводити з або без розчинника. Група R’ може бути видалена за прийнятних умов та коли R’ = H, атом нітрогену можуть алкілувати або ацилювати, використовуючи стандартні хімічні підходи. Всі реакції можуть виконувати в різних розчинниках, які повинні бути сумісними з реагентами, що використовують, та можуть відбуватися при різних прийнятних температурах, як правило, при 0-80C, в залежності від розчинника, що використовують. NaHCO3 ArOC(O)Cl ДМФ Піридин, ДМХ (3) R'NHNH2 MeCN Cu(OAc)2 Et 3N/ДХМ або піридин (4) 15 (5) (6) Схема 5 Енантіомери рацемічної суміші (3), (5) або (6) можуть розділяти шляхом хіральної ВЕРХ. Схеми з 6 до 9 показують яким чином введення карбоксильної групи в хіральну проміжну сполуку може дозволити розділення хіральної солі шляхом кристалізації. і) Кристалізація з хіральною основою Естер розщеплення ii) HCl R' = наприклад, аліл або бензил Окремий енантіомер Схема 6 і) Кристалізація з хіральною основою Естер розщеплення ii) HCl R' = H або Ar R'' = наприклад, аліл або бензил 20 Окремий енантіомер Схема 7 10 UA 109000 C2 і) Кристалізація з хіральною основою Естер розщеплення ii) HCl R' = алкіл або арил Окремий енантіомер Схема 8 і) Кристалізація з хіральною основою Естер розщеплення ii) HCl Окремий енантіомер R' = H або Ar R'' = алкіл або арил 5 Схема 9 Трьох компонентну реакцію на схемі 5 також можуть виконувати стереоспецифічним способом з одержанням виключно, або з енентіомерною перевагою, більш активного енантіомеру (J. Am. Chem. Soc., 2005, 127, 16386-16387). Кислота Льюїса Хіральний ліганд 10 Схема 10 На схемах 1, 3, 4, 5, 8, 9 та 10 група E може бути модифікованою на різних стадіях, використовуючи стандартні хімічні способи. Схема 11 описує випадок, коли група E є естером, дана функціональна група може бути перетворена, використовуючи хімічні способи, що є у розпорядженні кваліфікованого фахівця в даній галузі. 11 UA 109000 C2 O-[Alk 1]p-[Q]t -[Alk 2]q-Z Естерифікація, наприклад, HO-[Alk 1] p-[Q]t -[Alk 2]q-Z ДІПЕА, HATU, ДМФ Естер, наприклад, аліловий або бензиловий розщ еплення Амідування, наприклад, H2N-[Alk 1] p-[Q]t -[Alk 2]q-Z ДІПЕА, HATU, ДМФ NH-[Alk 1]p-[Q]t -[Alk 2]q-Z 5 10 15 20 Схема 11 Загальні експериментальні деталі Якщо не вказане інше, то реакції не проводили в інертній атмосфері. В тих випадках, коли розділення проводили з використанням картриджа RediSep® Si, використовували автоматичну хроматографічну систему (CombiFlash® компаньйон) разом з попередньо заповненою поліпропіленовою (RediSep®) колонкою, що містить діоксид силіцію з середнім розміром частинок 35-70 мкм (230-400 меш). ‘Isolute® PE-AX картридж’ стосується попередньо заповненої поліпропіленової колонки, що містить сорбент на основі діоксиду силіцію з хімічно зв’язаною кватернізованою амонійною функціональною групою. Всі розчинники та комерційно доступні реагенти використовували як отримали. Умови препаративної ВЕРХ ВЕРХ система 1 Блокована колонка з оберненою фазою C18 (250 × 21,2 мм Gemini колонка з розміром частинок 5 мкм), що елююють градієнтом A: вода; B: ацетонітрил (з додаванням 0,1% мурашиної кислоти) зі швидкістю потоку, як правило, 18 мл/хв та градієнтом 1 %/хв., що зростає в B. УФ детекція на 254 нм. Умови аналітичного РХ-МС РХ-МС спосіб 1 РХ на Waters Platform з колонкою з оберненою фазою C18 (30 × 4,6 мм Phenomenex Luna з розміром частинок 3 мкм), елюювання A: вода + 0,1% мурашиної кислоти; B: метанол + 0,1% мурашиної кислоти. Градієнт: Градієнт - Час 0,00 0,50 4,50 5,50 6,00 25 швидкість потоку мл/хв 2,0 2,0 2,0 2,0 2,0 %A 95 95 5 5 95 Детекція - МС, ELS, УФ МС іонізаційний метод - Електроспрей (позитивний та негативний іон) РХ-МС спосіб 2 12 %B 5 5 95 95 5 UA 109000 C2 Waters Micromass ZQ2000 з колонкою з оберненою фазою (100 × 2,1 мм Acquity BEH з розміром частинок 1,7 мкм) витримували при 40C, елюювання A: вода + 0,1% мурашиної кислоти; B: ацетонітрил + 0,1 % мурашиної кислоти. Градієнт: Градієнт - Час 0,00 0,40 6,00 6,80 7,00 8,00 швидкість потоку мл/хв 0,4 0,4 0,4 0,4 0,4 0,4 %A 95 95 5 5 95 95 %B 5 5 95 95 5 5 5 10 15 20 25 30 Детекція - МС, УФ ФДМ (фотодіодна матриця) МС іонізаційний метод - Електроспрей (позитивний/негативний іон) Скорочення, використані в експериментальному розділі: ДХМ - дихлорметан ДІПЕА - діізопропілетиламін ДМФ - N,N-диметилформамід HATU - O-(7-азабензотриазол-1-іл)-N,N,N’,N’-тетраметилуронію гексафлуорфосфат ВЕРХ - високоефективна рідинна хроматографія ІПС - ізопропіловий спирт к.т. - кімнатна температура Rt - час утримання Проміжна сполука 1 Аліловий естер 7-(4-ціанофеніл)-5-метил-4,7-дигідро-[1,2,4]триазоло[1,5-a]піримідин-6карбонової кислоти 3-Аміно-1,2,4-триазол (1,28 мг, 15,24 ммоль) та триетиламін (2,2 мл, 15,25 ммоль) нагрівали в ІПС (30 мл) при 90C доки розчинилася найбільша частина твердої речовини. Додавали 4ціанобензальдегід (2,0 г, 15,27 ммоль) та аліл ацетоацетат (2,17 г, 15,28 ммоль) та реакційну суміш нагрівали при 90C протягом ночі. Летючі речовини випаровували та залишок розподіляли між етилацетатом та водою. Значну частину твердої речовини відфільтровували та етилацетатний шар відокремлювали, промивали сольовим розчином, сушили (Na 2SO4) та зменшували об’єм. Тверду речовину, яку осадили, відфільтровували, промивали етилацетатом та об’єднували з твердою речовиною, одержаною раніше. Світло жовтий продукт сушили в вакуумі при 40C. Вихід: 1,42 г (29%) + РХ-МС (спосіб 1): Rt = 2,88 хв, m/z = 322 [M+H] Проміжна сполука 2 13 UA 109000 C2 5 10 15 20 25 30 35 Аліловий естер 7-(4-ціанофеніл)-5-метил-4-(3-трифлуорметилфеніл)-4,7-дигідро[1,2,4]триазоло[1,5-a]піримідин-6-карбонової кислоти Проміжну сполуку 1 (1,42 г, 4,42 ммоль), 3-(трифлуорметил)фенілборонову кислоту (1,68 г, 8,85 ммоль), купруму (II) ацетат (1,08 г, 8,85 ммоль) та триетиламін (1,23 мл, 8,85 ммоль) розчиняли в ДХМ (15 мл), та реакційну суміш струшували на повітрі протягом 7 днів. Додавали наступні кількості боронової кислоти, триетиламін та купруму (II) ацетат, та через наступних 7 днів, суміш розбавляли ДХМ і 1M водним розчином HCl та фільтрували через Celite®. Органічний шар відокремлювали, промивали сольовим розчином, сушили (Na2SO4) та випаровували. Сиру олію коричневого кольору розчиняли в метанолі та елюювали через Isolute® PE-AX картридж, який знаходився з метанолом. Розчинник випаровували та сирий продукт хроматографували на RediSep® Si картриджі (120 г), елююючи 5-100% етилацетатом в пентані. Продукт одержували у вигляді жовтої піни. Вихід: 276 мг (13%) + РХ-МС (спосіб 1): Rt = 3,90 хв, m/z = 466 [M+H] Проміжна сполука 3 7-(4-Ціанофеніл)-5-метил-4-(3-трифлуорметилфеніл)-4,7-дигідро-[1,2,4]триазоло[1,5a]піримідин-6-карбонова кислота Проміжну сполуку 2 (276 мг, 0,594 ммоль), морфолін (206 мг, 2,37 ммоль) та тетра(трифенілфосфін)паладію (0) (68 мг, 0,059 ммоль) розчиняли в ДХМ (5 мл) та розчину давали постояти при к.т. протягом 1 години. Реакційну суміш розбавляли ДХМ та додавали воду. Тверду речовину відфільтровували. ДХМ відокремлювали, сушили (Na 2SO4) та випаровували. Залишок розтирали з ацетонітрилом, одержуючи більш тверду речовину. Додаткову кількість продукту одержували з маточного розчину, використовуючи ВЕРХ систему 1. Вихід: 183 мг (72%) + РХ-МС (спосіб 2): Rt = 4,26 хв, m/z = 426 [M+H] Проміжна сполука 4 Аліловий естер 4-(4-ціанофеніл)-2-метокси-6-метил-1,4-дигідропіримідин-5-карбонової кислоти 4-Ціанобензальдегід (13,1 г, 100 ммоль) розчиняли в ДМФ (200 мл) та додавали натрію бікарбонат (33,4 г, 400 ммоль), після чого O-метилізосечовини гемісульфат (14,8 г, 120 ммоль) та алілацетоацетат (15,06 г, 110 ммоль). Суміш нагрівали в атмосфері азоту при 70C протягом ночі. Після того, як дали охолонути до к.т., суміш фільтрували та фільтрат випаровували. Одержану в результаті олію оранжевого кольору розподіляли між етилацетатом та водою. Органічний шар відокремлювали, промивали сольовим розчином, сушили (Na2SO4) та випаровували. Сирий продукт очищували за допомогою флеш хроматографії на силікагелі, 14 UA 109000 C2 5 10 15 20 25 30 35 елююючи 0-30% етилацетатом в ДХМ, одержуючи чисту проміжну сполуку 4 у вигляді жовтої піни. Вихід: 16,8 г (53%) + РХ-МС (спосіб 1): Rt = 2,18 хв, m/z = 312 [M+H] Проміжна сполука 5 Аліловий естер 5-(4-ціанофеніл)-2,7-диметил-3-оксо-2,3,5,8-тетрагідро-[1,2,4]триазоло[4,3a]піримідин-6-карбонової кислоти Проміжну сполуку 4 (2,15 г, 6,91 ммоль) та піридин (4,5 мл) розчиняли в ДХМ (20 мл) та розчин охолоджували на крижаній бані. Додавали 4-нітрофенілхлорформіат (1,38 г, 6,91 ммоль) та реакційну суміш струшували, все ще підтримуючи охолодження. Через 2 години додавали метилгідразин (550 мкл, 10,4 ммоль) та, через 10 хвилин, реакційну суміш розбавляли ДХМ, промивали водою, сушили (Na2SO4) та випаровували. Сліди піридину видаляли шляхом відгонки азеотропної суміші з толуолом. Продукт очищували на колонці RediSep® Si (120 г), елююючи 40-80% етилацетатом в циклогексані. Проміжну сполуку 5 одержували у вигляді світло жовтої твердої речовини. Вихід: 1,22 г (50%) + РХ-МС (спосіб 1): Rt = 2,79 хв, m/z = 352 [M+H] Проміжна сполука 6 Аліловий естер 5-(4-ціанофеніл)-2,7-диметил-3-оксо-8-(3-трифлуорметилфеніл)-2,3,5,8тетрагідро-[1,2,4]триазоло[4,3-a]піримідин-6-карбонової кислоти Проміжну сполуку 5 (1,01 г, 2,88 ммоль ), 3-(трифлуорметил)фенілборонову кислоту (1,09 г, 5,74 ммоль), купруму (II) ацетат (525 мг, 4,27 ммоль) та піридин (455 мг, 5,76 ммоль) струшували в ДХМ (15 мл) на повітрі при к.т. Через 16 годин додавали триетиламін (1,16 г, 11,5 ммоль), та реакційну суміш струшували протягом наступних 3 днів. Потім додавали піридин (10 мл), та реакційну суміш нагрівали на повітрі при 50C протягом 7 днів. Після охолодження піридин випаровували, та залишок розподіляли між ДХМ та 1M водним розчином HCl. Двофазну суміш фільтрували через Celite®, та органічний шар відокремлювали, сушили (Na 2SO4) та випаровували. Залишок обробляли сумішшю 1:1 етилацетат:пентан, та тверду речовину відфільтровували. Фільтрат випаровували та сирий продукт очищували на картриджі RediSep® Si (80 г), елююючи 20-100% етилацетатом в пентані. Проміжну сполуку 6 одержували у вигляді оранжевої смоли. Вихід: 277 мг (19%) + РХ-МС (спосіб 1): Rt = 3,81 хв, m/z = 496 [M+H] Проміжна сполука 7 15 UA 109000 C2 5 10 15 20 5-(4-Ціанофеніл)-2,7-диметил-3-оксо-8-(3-трифлуорметилфеніл)-2,3,5,8-тетрагідро[1,2,4]триазоло[4,3-a]піримідин-6-карбонова кислота Застосовуючи спосіб подібний до того, що описано для проміжної сполуки 3, одержують проміжну сполуку 7 з проміжної сполуки 6. + РХ-МС (спосіб 1): Rt = 3,20 хв, m/z = 456 [M+H] Приклад 1 2-Диметиламіноетиловий естер 7-(4-ціанофеніл)-5-метил-4-(3-трифлуорметилфеніл)-4,7дигідро-[1,2,4]триазоло[1,5-a]піримідин-6-карбонової кислоти Проміжну сполуку 3 (50 мг, 0,118 ммоль), N,N-диметилетаноамін (209 мг, 2,35 ммоль) та HATU (53 мг, 0,141 ммоль) розчиняли в ДМФ (1 мл), та розчину давали постояти при к.т. протягом ночі. Розчинник випаровували та продукт очищували, використовуючи ВЕРХ систему 1. Вихід: 10 мг (17%) + РХ-МС (спосіб 2): Rt = 3,41 хв, m/z = 497,18 [M+H] Приклад 2 2-Диметиламіноетиловий естер 5-(4-ціанофеніл)-2,7-диметил-3-оксо-8-(3трифлуорметилфеніл)-2,3,5,8-тетрагідро-[1,2,4]триазоло[4,3-a]піримідин-6-карбонової кислоти 16 UA 109000 C2 Застосовуючи спосіб подібний до того, що використовували для синтезу сполуки з Прикладу 1, одержували сполуку Прикладу 2 з проміжної сполуки 7. + РХ-МС (спосіб 2): Rt = 3,46 хв, m/z = 527,31 [M+H] Приклад 3 5 10 15 20 25 {2-[5-(4-Ціанофеніл)-2,7-диметил-3-оксо-8-(3-трифлуорметилфеніл)-2,3,5,8-тетрагідро[1,2,4]триазоло[4,3-a]піримідин-6-карбонілоксі]етил}триметиламонію бромід Сполуку з Прикладу 2 (26 мг, 0,05 ммоль) розчиняли в 30% розчині бромметану в ацетонітрилі (4 мл). Реакційній суміші давали постояти при к.т. протягом ночі. Летючі речовини випаровували. Залишок розчиняли у воді та сушили при заморожуванні, одержуючи сполуку Прикладу 3, у вигляді білої твердої речовини. Вихід: 31 мг (100%) + РХ-МС (спосіб 2): Rt = 3,45 хв, m/z = 541,31 [M+H] Біологічне дослідження Сполуки прикладів випробовували на HNE інгібіторну активність. Флуоресценція пептидного субстрату Дослідження проводили в 96-лункових планшетах при загальному об’ємі, що аналізують, 100 мкл. Кінцева концентрація ферменту (лейкоцитарна еластаза людини, Sigma E8140) становила 0,00036 одиниць/лунку. Пептидний субстрат (MeO-Suc-Ala-Ala-Pro-ValAMC, Calbiochem #324745) використовували з кінцевою концентрацією 100 мкМ. Кінцева концентрація ДМСО становила 1% в буфері, що аналізують (0,05 M Тріс HCl, pH 7,5, 0,1 M NaCl; 0,1M CaCl 2; 0,0005% brij-35). Ферментна реакція розпочиналася при додаванні ферменту. Ферментну реакцію виконували при к.т. та через 30 хв зупиняли додаванням 50 мкл соєвого інгібітору трипсину (Sigma T-9003) з кінцевою концентрацією 50 мкг/лунку. Флуоресценцію записували на FLEX станції (Molecular Devices), використовуючи фільтри з довжиною хвилі збудження 380 нм та емісії 460 нм. Ефективність сполук визначали за концентраційними серіями з 10 концентрацій в діапазоні від 1000 нМ до 0,051 нМ. Результатами є середні значення двох незалежних експериментів, кожен з яких виконували в двох повторах. Сполуки мали активність в діапазоні 1-200 нМ. 30 ФОРМУЛА ВИНАХОДУ 1. Сполука формули (І): 2 X X 1 N R 3 N A NC N R 35 R 2 R 6 R 5 4 , (I) або її фармацевтично прийнятна сіль, де 1 А є C-R ; 1 2 R та R є гідрогеном; 17 UA 109000 C2 4 5 10 15 R є гідрогеном; 3 R є трифлуорметилом; 5 R є гiдpoгeном; 6 11 R є -CO2R ; 1 2 19 -Х -Х - є -NR -CO-; 11 1 2 R є радикалом формули -[Alk ]p-[Q]t-[Alk ]q-Z, де р та q незалежно є 0 або 1, t є 0; 1 2 кожен з Alk та Аlk незалежно є С1-С6алкіленовим радикалом; Zє A B A B (і) -N(R )(R ), де R та R незалежно є гідрогеном або С1-С6-алкілом, або + A B C (ii)-N (R )(R )(R ), дe A B C R , R та R незалежно є С1-С6-алкілом; 19 R є вибраним з гідрогену або С1-С6-алкілу. 11 1 2 1 2 2. Сполука за пунктом 1, де R є радикалом формули -[Alk ]p-[Q]t-[Alk ]q-Z, де -[Alk ]p-[Q]t-[Alk ]q1 A B є структурою (IV), де V є 0, 1, 2, 3 або 4, та Z є структурою (VI), де R та R є такими, як визначено в пункті 1, * V1 * *" , (IV) , (VI) 20 25 30 35 40 та де атоми нітрогену аміну можуть бути кватернізованими. 1 2 19 19 3. Сполука за будь-яким з попередніх пунктів, де -Х -Х - є -NR -CO- та R є метилом. 4. Сполука за будь-яким з попередніх пунктів у формі фармацевтично прийнятної солі. 5. Сполука за пунктом 1, яка вибрана з групи, що включає: 2-диметиламіноетиловий естер 7-(4-ціанофеніл)-5-метил-4-(3-трифлуорметилфеніл)4,7-дигідро-[1,2,4]триазоло[1,5-а]піримідин-6-карбонової кислоти, 2-диметиламіноетиловий естер 5-(4-ціанофеніл)-2,7-диметил-3-оксо-8-(3трифлуорметилфеніл)-2,3,5,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин-6-карбонової кислоти та {2-[5-(4-ціанофеніл)-2,7-диметил-3-оксо-8-(3-трифлуорметилфеніл)-2,3,5,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин-6-карбонілоксі]етил}триметиламонію бромід. 6. Фармацевтична композиція, що містить сполуку за будь-яким з попередніх пунктів та фармацевтично прийнятний носій або наповнювач. 7. Фармацевтична композиція за пунктом 6, яка є адаптованою для перорального введення або введення через легеневий шлях. 8. Сполука за будь-яким з пунктів 1-5 для лікування або для застосування у виробництві лікарського засобу, що застосовують в лікуванні захворювання або стану, в якому залучений HNE, де захворюванням або станом є хронічне обструктивне захворювання легень (ХОЗЛ), хронічний бронхіт, фіброз легень, пневмонія, гострий респіраторний дистрес-синдром (ГРДС), емфізема легень, емфізема, що викликана палінням, або муковісцидоз. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 18
ДивитисяДодаткова інформація
Автори англійськоюEdwards, Christine, Kulagowski, Janusz, Finch, Harry
Автори російськоюЭдвардс Кристин, Кулаговски Януш, Финч Гари
МПК / Мітки
МПК: A61P 1/00, A61K 31/519, C07D 487/04, A61P 11/00
Мітки: хозл, распіраторних, піримідину, захворювань, похідні, наприклад, лікування, застосування
Код посилання
<a href="https://ua.patents.su/20-109000-pokhidni-pirimidinu-ta-kh-zastosuvannya-dlya-likuvannya-raspiratornikh-zakhvoryuvan-napriklad-khozl.html" target="_blank" rel="follow" title="База патентів України">Похідні піримідину та їх застосування для лікування распіраторних захворювань, наприклад хозл</a>
Попередній патент: Спосіб та апарат для переробки шламів
Наступний патент: Пристрій для променевого опалювання приміщень
Випадковий патент: Спосіб будівництва куща свердловин на морі