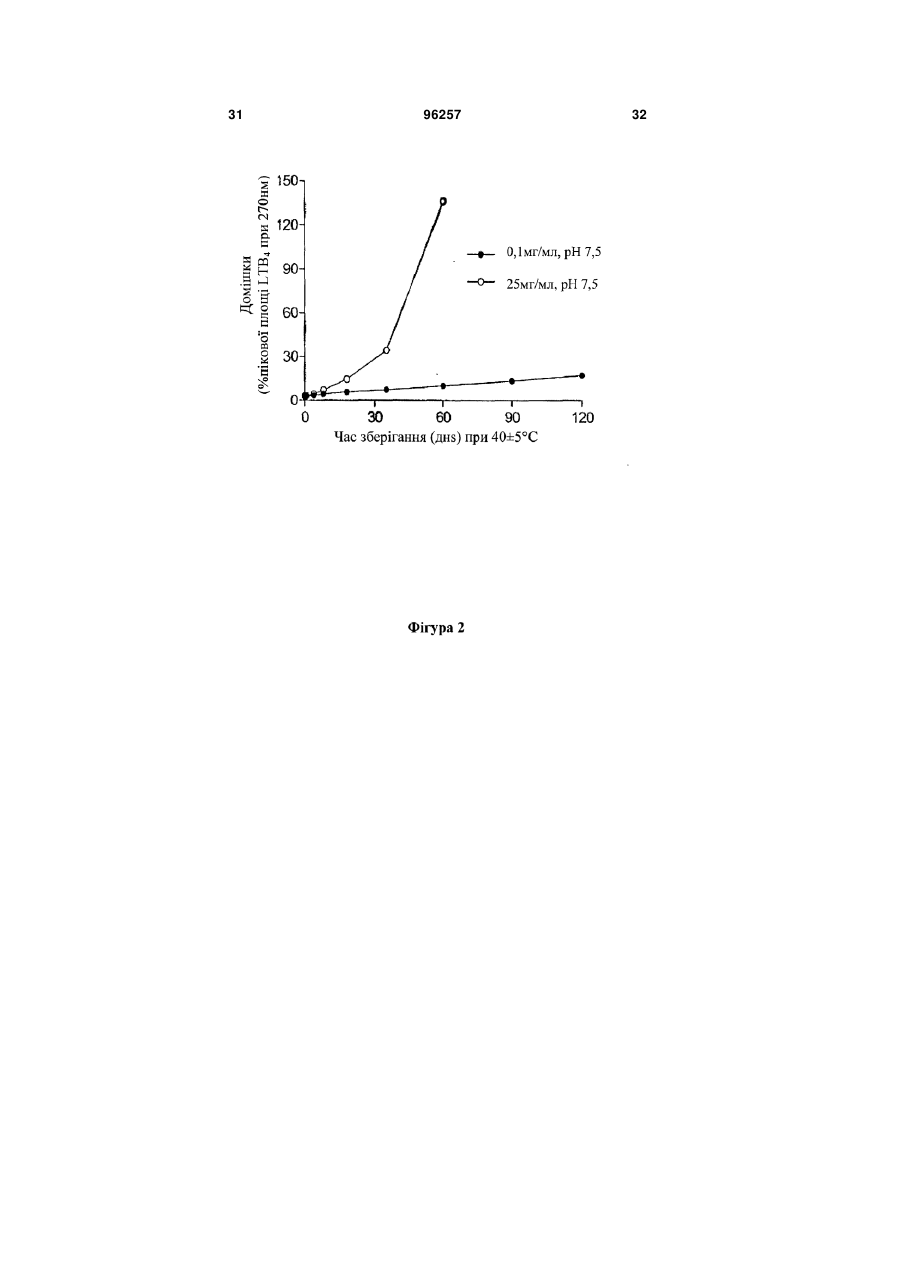
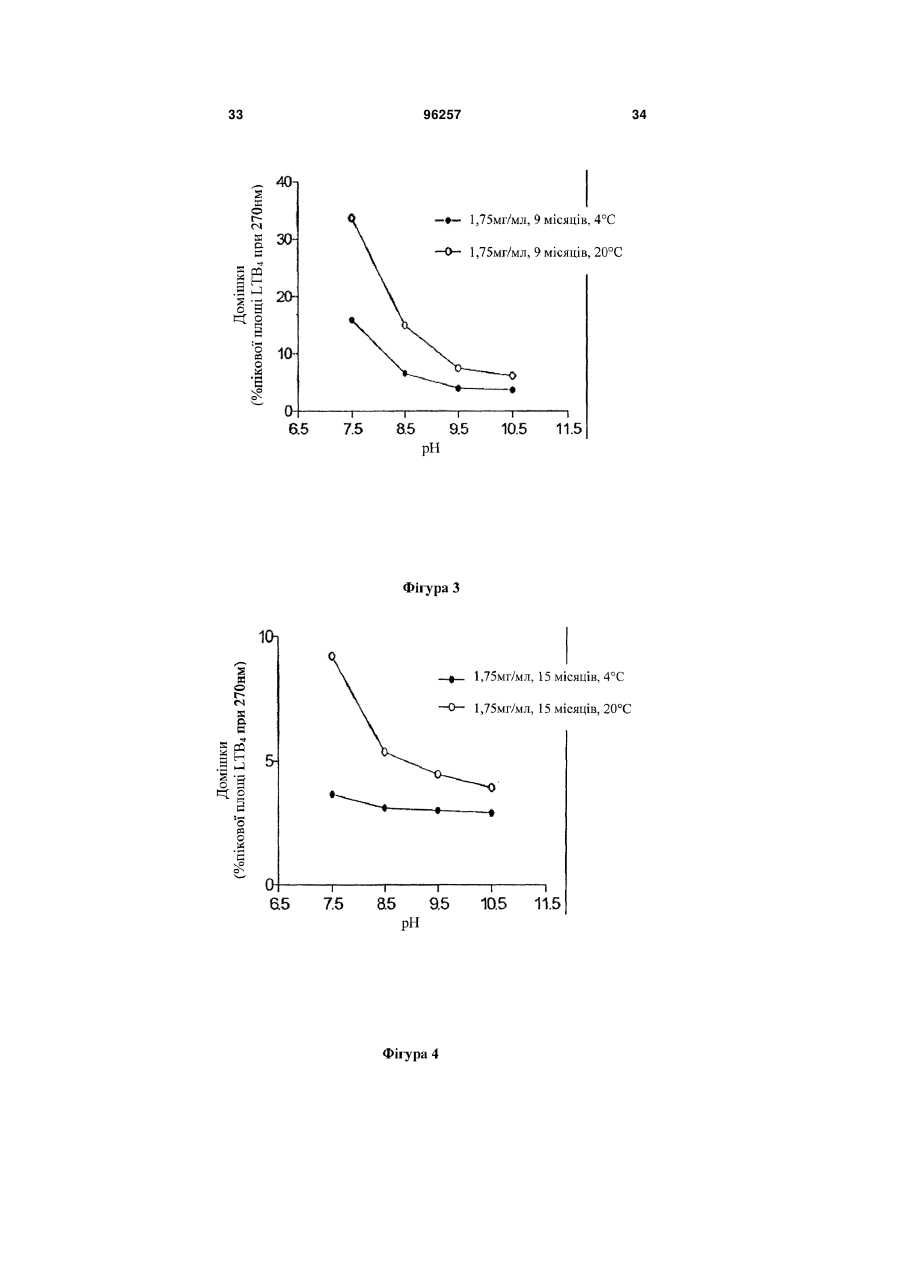
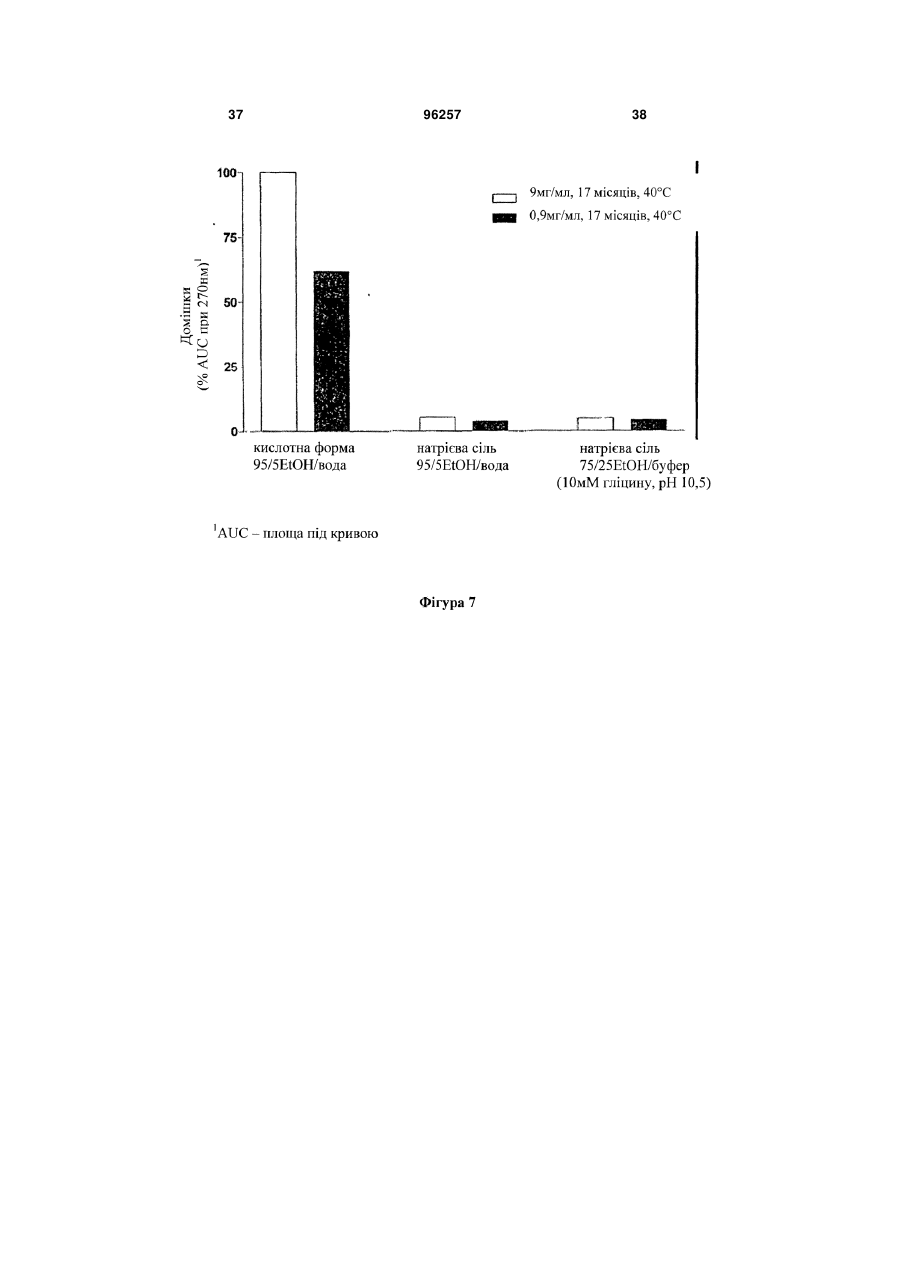
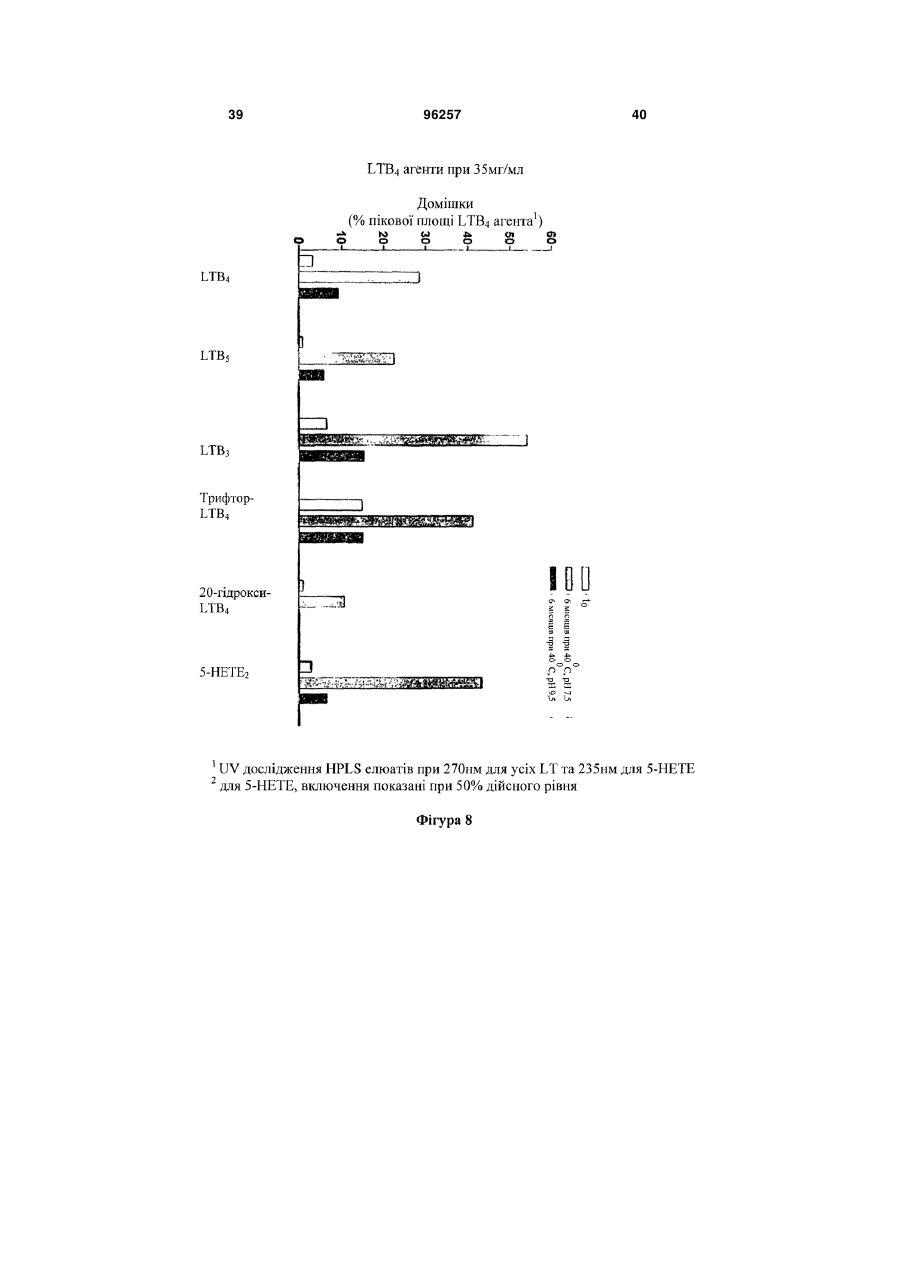
Стабілізована фармацевтична композиція лейкотриєн-b4 (ltb4) агента
Формула / Реферат
1. Стабілізована фармацевтична композиція LTB4 агента, що містить терапевтично ефективну кількість LTB4 агента, його солі, його складного ефіру або його простого ефіру разом з фармацевтично прийнятним носієм при лужній рН віл 8,2 до 14, ефективної для стабілізації зазначеного LTB4 агента, що, таким чином, підвищує термін придатності зазначеної композиції, або з фармацевтично прийнятним носієм і лужною реакцією;
де LTB4 агент являє собою одну або більш поліненасичену жирну кислоту, вибрану з групи, що включає LTB4, 14,15-дигідро-LTB4, 17,18-дегідро-LTB4, 19-гідрокси- LTB4, 20-гідрокси-LTB4 та їх 5(R)-гідрокси, 5(S)гідроперокси, 5(R)-гідроперокси та 5-деокси аналоги; LTA4; 14,15-дигідро-LTA4, 17,18-дегідро-LTA4; 14,15дигідро-LTA4 метиловий складний ефір, LTA4 метиловий складний ефір, 5(S)-гідрокси-6,8,11,14(E,Z,Z,Z)-ейкозатетраеноєву кислоту ("5-НЕТЕ"), 14,15-дигідро-5-НЕТЕ, 17,18-дегідро-5-НЕТЕ та їх 5(R)-гідрокси, 5(S)-гідроперокси, 5(R)-гідроперокси аналоги,
та де носій з лужною реакцією являє собою інертну, фармацевтично прийнятну речовину (або речовини), то створює лужну мікро- рH від 8,2 до 14 навколо кожної частинки LTB4, у випадку стабілізованої композиції LTB4, що знаходиться в ліофілізованій, кристалічній або твердій аморфній формі, якщо вода адсорбована на частинках суміші, або якщо вода додана до суміші в невеликих кількостях.
2. Композиція, що містить LTB4 агент, його сіль, його складний ефір або його простий ефір разом з фармацевтично прийнятним носієм при лужній рН від 8,2 до 14 або з фармацевтично прийнятним носієм з лужною реакцією;
де LTB4 агент являє собою одну або більш поліненасичену жирну кислоту, вибрану і групи, що включає LTB4, 14,15-дигідро-LTB4, 17,18-дегідро-LTB4, 19-гідрокси-LTB4, 20-гідрокси-LTB4 та їх 5(R)-гідроперокси, 5(S)гідроперокси, 5(R)-гідроперокси та 5-деокси аналоги; LTA4; 14,15-дигідро-LTA4, 17,18-дегідро-LTA4; 14,15-дигідро-LTA4 метиловий складний ефір, LTA4 метиловий складний ефір, 5(S)-гідрокси-6,8,11,14(Е,Z,Z,Z)-ейкозатетраеноєву кислоту ("5-НЕТЕ"), 14,15-дигідро-5-НЕТЕ, 17,18-дегідро-5-НЕТЕ та їх 5(R)-гідрокси, 5(S)-гідроперокси, 5(R)-гідроперокcи аналоги.
та де носій з лужною реакцією являє собою інертну, фармацевтично прийнятну речовину (або речовини), що створює лужну мікро- рН від 8,2 до 14 навколо кожної частинки LTB4, у випадку стабілізованої композиції LTB4, що знаходиться в ліофілізованій, кристалічній або твердій аморфній формі, якщо вода адсорбована на частинках суміші, або якщо вода додана до суміші в невеликих кількостях.
3. Композиція або стабілізована композиція за будь-яким з пп. 1 або 2, де композиція або стабілізована момпозиція містить тільки нетоксичні речовини.
4. Композиція або стабілізована композиція за будь-яким э пп. 1 - 3, де зазначена лужна рН змінюється від 8,5 до 11,5,
5. Композиція або стабілізована композиція за будь-яким і пп. 1 - 4, де зазначена лужна рН змінюється від 9,5 до 11,5.
6. Композиція або стабілізована композиція за будь-яким з пп. 1 - 5, де зазначена композиція знаходиться в рідкій формі, або в ліофілізованій формі, або в кристалічній формі, або в твердій аморфній формі.
7. Композиція або стабілізована композиція за будь-яким з пп. 1 - 6, де зазначений носій являє собою водний носій.
8. Композиція або стабілізована композиція за п. 7, де зазначений водний носій вибраний із групи, що включає воду, розчини гідроксидів лужних металів, наприклад, розчин гідроксиду натрію, буферний сольовий розчин, наприклад, фосфатний буферний сольовий розчин (PBS), водний розчин, що включає спирт, розчини цукрів або їх суміш.
9. Композиція або стабілізована композиція за п. 8, де спирт зазначеного водного розчину, що містять спирт, вибраний із групи, що включає етанол, пропіленгліколь, бензиловий спирт, пропандіол, гліцерол та маніт.
10. Композиція або стабілізована композиція за будь-яким з пп. 1 - 6, де зазначений носій є носієм, вибраним із групи, що включає органічні розчинники та їх суміш і воду.
11. Композиція або стабілізована композиція за п. 10, де зазначена суміш містить воду та, щонайменше, 50 % (об'єм/об'єм), переважно, щонайменше, 60 % (об'єм/об'єм) спирту.
12. Композиція або стабілізована композиція за п. 11, де зазначений спирт вибраний із групи, що включає етанол, пропіленгліколь, бензиловий спирт, пропандіол, гліцерол та маніт.
13. Композиція або стабілізована композиція за п. 8, де зазначена композиція є стабілізованою при температурі від -25 °С до 45 °С, якщо зазначений носій с водним носієм, а зазначена композиція знаходиться в рідкій формі, та температурі від -25 °С до 45 °С, якщо зазначений посій є носієм, що містить спирт, або зазначена композиція знаходиться в ліофілізованій формі.
14. Композиція або стабілізована композиція за будь-яким з пп. 1 - 5, де зазначений носій являє собою тверду частинку, покриту лужною матрицею або складає лужну матрицю.
15. Композиція або стабілізована композиція за будь-яким з пп. 1 - 14. де зазначений LTB4 агент є лейкотрієном В4 [5S,12R-дигідрокси-6,8,10,14(Z,E,E,Z)-ейкозатетраєноєвою кислотою] ("LTB4").
16. Композиція або стабілізована композиція за будь-яким з пп. 1 - 14, де зазначений LTB4 агент вибраний із групи, що включає LTB4, 14,15-дигідро-LTB4 ("LTB3"), 17,18-дегідро-LTB4 ("LTB5"), 19-гідрокси-LTB4, 20-гідрокси-LTB4 та їх 5(S)-гідроперокси та 5-деокси аналоги.
17. Композиція або стабілізована композиція за будь-яким з пп. 1 - 14, де зазначений LTB4 агент вибраний із групи, що включає 5(R)-гідрокcи та 5(R)-гідроперокси аналоги зазначеного LTB4 агента.
18. Композиція або стабілізована композиція за будь-яким з пп. 1 - 14, де зазначений LTB4 агент вибраний із групи, що включає метиловий складний ефір LTB4 та етиловий складний ефір LTB4.
19. Композиція або стабілізована композиція за будь-яким з пп. 1 - 14, де зазначений LTB4 агент вибраний із групи, що включає 5(S)-гідрокси-6,8,11,14(E,Z,Z,Z)-eйкозатетраеноєву кислоту ("5-НЕТЕ"), 14,15-дигідро-5-НЕТЕ, 17,18-дегідро-5-НЕТЕ та їх 5(R)-гідрокси, 5(S)- гідроперокси, 5(R)-гідроперокси аналоги.
20. Композиція або стабілізована композиція за будь-яким з пп. 1 - 14, де зазначений LTB4 агент вибраний із групи, що включає LTB4, LIB3, LTB5, 20-гідрокси-LTB4, 19-гідрокси-LTB4 та їх 5-деокси аналоги.
21. Композиція або стабілізована композиція за будь-яким з пп. 1 - 14, де зазначений LTB4 агент вибраний із групи, що включає LTB4, LTB3, LTB5, 20-гідрокcи-LTB4 та їх 5-деокси аналоги.
22. Композиція або стабілізована композиція за будь-яким з пп. 1 - 21, де зазначений LTB4 агент присутній у кількостях від близько 0,1 мкг/мл до 25 мг/мл композиції.
23. Композиція або стабілізована композиція за будь-яким з пп. 1 - 22, де зазначений LTB4 є присутнім у кількостях від близько 0,1 мкг/мл до 1 мг/мл композиції.
24. Композиція або стабілізована композиція за будь-яким з пп. 1 - 23, що містить менш ніж 25 % (об'єм/об'єм) ацетонітрилу.
25. Композиція або стабілізована композиція за будь-яким з пп. 1 - 24, що додатково містить як зовнішній шар ентеросолюбільне покриття.
26. Композиція або стабілізована композиція за п. 25, що додатково містить шар, що відокремлює, між ядром, що містить LTB4 агент та носій з лужною реакцією, та зовнішнім шаром.
27. Композиція або стабілізована композиція за будь-яким з пп. 1 - 26, що додатково містить хелатоутворюючий агент або фармацевтично прийнятну сіль хелатоутворюючого агента в кількості, ефективній для стабілізації зазначеного LTB4 агента.
28. Композиція або стабілізована композиція за п. 27, де хелатоутворюючий агент являє собою амінополікарбоксильну кислоту.
29. Композиція або стабілізована композиція за будь-яким з пп. 27 - 28, де хелатоутворюючий агент вибраний із групи, що включає етилендіамін-тетраоцтову кислоту (EDTA), діетилентриамінпентаоцтову кислоту (DTPA), нітрилотриоцтову кислоту (NTА), глутамінову кислоту та аспарагінову кислоту.
30. Композиція або стабілізована композиція за п. 29, де хелатоутворюючим агентом є EDTA.
31. Композиція або стабілізована композиція за п. 29, де хелатоутворюючим агентом є DTPА.
32. Композиція або стабілізована композиція за п. 27, де фармацевтично прийнятна сіль вибрана з групи, що включає солі натрію та калію.
33. Композиція або стабілізована композиція за будь-яким з пп. 27 - 32, що додатково містить людський сироватковий альбумін (НSA).
34. Композиція або стабілізована композиція за будь-яким з пп. 27 - 33, де зазначений хелатоутворюючий агент присутній у кількостях від близько 0,001 % до близько 1,0 % ваги стабілізованої композиції LTB4 агента.
35. Композиція або стабілізована композиція за будь-яким з пп. 27 - 33, де зазначений хелатоутворюючий агент присутній у кількостях від близько 0,01 % до близько 40 % ваги стабілізованої композиції LTB4 агента.
Текст
1. Стабілізована фармацевтична композиція LTB4 агента, що містить терапевтично ефективну кількість LTB4 агента, його солі, його складного ефіру або його простого ефіру разом з фармацевтично прийнятним носієм при лужній рН від 8,2 до 14, ефективної для стабілізації зазначеного LTB4 агента, що, таким чином, підвищує термін придатності зазначеної композиції, або з фармацевтично прийнятним носієм і лужною реакцією; де LTB4 агент являє собою одну або більше поліненасичених жирних кислот, вибраних з групи, що включає LTB4, 14,15-дигідро-LTB4, 17,18-дегідроLTB4, 19-гідрокси-LTB4, 20-гідрокси-LTB4 та їх 5(R)гідрокси, 5(S)гідроперокси, 5(R)-гідроперокси та 5деокси аналоги; LTA4; 14,15-дигідро-LTA4, 17,18дегідро-LTA4; 14,15дигідро-LTA4 метиловий складний ефір, LTA4 метиловий складний ефір, 5(S)гідрокси-6,8,11,14(E,Z,Z,Z)-ейкозатетраєноєву кислоту ("5-НЕТЕ"), 14,15-дигідро-5-НЕТЕ, 17,18дегідро-5-НЕТЕ та їх 5(R)-гідрокси, 5(S)гідроперокси, 5(R)-гідроперокси аналоги, та де носій з лужною реакцією являє собою інертну, фармацевтично прийнятну речовину (або речовини), що створює лужну мікро-рH від 8,2 до 14 2 (19) 1 3 або в кристалічній формі, або в твердій аморфній формі. 7. Композиція або стабілізована композиція за будь-яким з пп. 1-6, де зазначений носій являє собою водний носій. 8. Композиція або стабілізована композиція за п. 7, де зазначений водний носій вибраний із групи, що включає воду, розчини гідроксидів лужних металів, наприклад, розчин гідроксиду натрію, буферний сольовий розчин, наприклад, фосфатний буферний сольовий розчин (PBS), водний розчин, що включає спирт, розчини цукрів або їх суміш. 9. Композиція або стабілізована композиція за п. 8, де спирт зазначеного водного розчину, що містять спирт, вибраний із групи, що включає етанол, пропіленгліколь, бензиловий спирт, пропандіол, гліцерол та маніт. 10. Композиція або стабілізована композиція за будь-яким з пп. 1-6, де зазначений носій є носієм, вибраним із групи, що включає органічні розчинники та їх суміш і воду. 11. Композиція або стабілізована композиція за п. 10, де зазначена суміш містить воду та щонайменше 50 % (об'єм/об'єм), переважно щонайменше 60 % (об'єм/об'єм) спирту. 12. Композиція або стабілізована композиція за п. 11, де зазначений спирт вибраний із групи, що включає етанол, пропіленгліколь, бензиловий спирт, пропандіол, гліцерол та маніт. 13. Композиція або стабілізована композиція за п. 8, де зазначена композиція є стабілізованою при температурі від -25 °С до 45 °С, якщо зазначений носій є водним носієм, а зазначена композиція знаходиться в рідкій формі, та температурі від -25 °С до 45 °С, якщо зазначений носій є носієм, що містить спирт, або зазначена композиція знаходиться в ліофілізованій формі. 14. Композиція або стабілізована композиція за будь-яким з пп. 1-5, де зазначений носій являє собою тверду частинку, покриту лужною матрицею або складає лужну матрицю. 15. Композиція або стабілізована композиція за будь-яким з пп. 1-14, де зазначений LTB4 агент є лейкотрієном В4 [5S,12R-дигідрокси6,8,10,14(Z,E,E,Z)-ейкозатетраєноєвою кислотою] ("LTB4"). 16. Композиція або стабілізована композиція за будь-яким з пп. 1-14, де зазначений LTB4 агент вибраний із групи, що включає LTB4, 14,15дигідро-LTB4 ("LTB3"), 17,18-дегідро-LTB4 ("LTB5"), 19-гідрокси-LTB4, 20-гідрокси-LTB4 та їх 5(S)гідроперокси та 5-деокси аналоги. 17. Композиція або стабілізована композиція за будь-яким з пп. 1-14, де зазначений LTB4 агент вибраний із групи, що включає 5(R)-гідрокcи та 5(R)-гідроперокси аналоги зазначеного LTB4 агента. 18. Композиція або стабілізована композиція за будь-яким з пп. 1-14, де зазначений LTB4 агент вибраний із групи, що включає метиловий складний ефір LTB4 та етиловий складний ефір LTB4. 19. Композиція або стабілізована композиція за будь-яким з пп. 1-14, де зазначений LTB4 агент вибраний із групи, що включає 5(S)-гідрокси6,8,11,14(E,Z,Z,Z)-eйкозатетраєноєву кислоту ("5 96257 4 НЕТЕ"), 14,15-дигідро-5-НЕТЕ, 17,18-дегідро-5НЕТЕ та їх 5(R)-гідрокси, 5(S)- гідроперокси, 5(R)гідроперокси аналоги. 20. Композиція або стабілізована композиція за будь-яким з пп. 1-14, де зазначений LTB4 агент вибраний із групи, що включає LTB4, LIB3, LTB5, 20-гідрокси-LTB4, 19-гідрокси-LTB4 та їх 5-деокси аналоги. 21. Композиція або стабілізована композиція за будь-яким з пп. 1 - 14, де зазначений LTB4 агент вибраний із групи, що включає LTB4, LTB3, LTB5, 20-гідрокcи-LTB4 та їх 5-деокси аналоги. 22. Композиція або стабілізована композиція за будь-яким з пп. 1-21, де зазначений LTB4 агент присутній у кількостях від близько 0,1 мкг/мл до 25 мг/мл композиції. 23. Композиція або стабілізована композиція за будь-яким з пп. 1-22, де зазначений LTB4 є присутнім у кількостях від близько 0,1 мкг/мл до 1 мг/мл композиції. 24. Композиція або стабілізована композиція за будь-яким з пп. 1-23, що містить менш ніж 25 % (об'єм/об'єм) ацетонітрилу. 25. Композиція або стабілізована композиція за будь-яким з пп. 1-24, що додатково містить як зовнішній шар ентеросолюбільне покриття. 26. Композиція або стабілізована композиція за п. 25, що додатково містить шар, що відокремлює, між ядром, що містить LTB4 агент та носій з лужною реакцією, та зовнішнім шаром. 27. Композиція або стабілізована композиція за будь-яким з пп. 1-26, що додатково містить хелатоутворюючий агент або фармацевтично прийнятну сіль хелатоутворюючого агента в кількості, ефективній для стабілізації зазначеного LTB4 агента. 28. Композиція або стабілізована композиція за п. 27, де хелатоутворюючий агент являє собою амінополікарбоксильну кислоту. 29. Композиція або стабілізована композиція за будь-яким з пп. 27-28, де хелатоутворюючий агент вибраний із групи, що включає етилендіамінтетраоцтову кислоту (EDTA), діетилентриамінпентаоцтову кислоту (DTPA), нітрилотриоцтову кислоту (NTА), глутамінову кислоту та аспарагінову кислоту. 30. Композиція або стабілізована композиція за п. 29, де хелатоутворюючим агентом є EDTA. 31. Композиція або стабілізована композиція за п. 29, де хелатоутворюючим агентом є DTPА. 32. Композиція або стабілізована композиція за п. 27, де фармацевтично прийнятна сіль вибрана з групи, що включає солі натрію та калію. 33. Композиція або стабілізована композиція за будь-яким з пп. 27-32, що додатково містить людський сироватковий альбумін (НSA). 34. Композиція або стабілізована композиція за будь-яким з пп. 27-33, де зазначений хелатоутворюючий агент присутній у кількостях від близько 0,001 % до близько 1,0 % ваги стабілізованої композиції LTB4 агента. 35. Композиція або стабілізована композиція за будь-яким з пп. 27-33, де зазначений хелатоутворюючий агент присутній у кількостях від близько 5 96257 6 0,01 % до близько 40 % ваги стабілізованої компо зиції LTB4 агента. (a) Галузь даного винаходу Даний винахід стосується нової фармацевтичної формуляції LTB4 агента з лужною рН, ефективною для стабілізації LTB4 агента і забезпечення підвищеного терміну придатності формуляції. Таким чином, даний винахід стосується композиції, що включає LTB4 агент і фармацевтично прийнятний носій при лужній рН. (b) Опис відомого рівня техніки Лейкотрієн В4 являє собою тетраненасичену жирну кислоту з двадцятьма атомами вуглецю і є відносно нестабільною молекулою. Ізотонічні водні розчини LTB4 при рН 7,0 - 7,6, що прийнятні для введення людям і тваринам, стабільні тільки короткі періоди часу (від тижнів до місяців), якщо зберігаються при температурному діапазоні від 2°С до 25°С (і вище 25°С). Фактично, LTB4 агенти піддаються окисненню, ізомеризації подвійних зв'язків (LTB4 містить два cis і два trans подвійні зв'язки), рацемізації (LTB4 містить два хіральних центра), етерифікації (LTB4 містить карбоксильну групу), лактонізації в числі можливих різних структуральних перебудов. Незважаючи на те, що LTB4 агенти широко застосовуються у фармацевтиці, їх застосування як терапевтичних агентів для тварин або людей проблематично, через їх недостатні стабільність і термін придатності в розчині при температурах від 2°С до 25°С. З наукової літературі видно, що дотепер формуляції LTB4 для введення людям і тваринам являють собою водні розчини при рН 7,0 - 7,5, які зберігаються при дуже низьких температурах (20°С або нижче), щоб уникнути розкладу. Альтернативно, LTB4 застосовують у формі розчинів у етанолі, що також зберігаються при низькій температурі, які розбавляють буфером (рН 7,0 - 7,5) або випарюють насухо і заново розчиняють у буфері (рН 7,0 - 7,5) безпосередньо перед застосуванням, щоб уникнути розкладу. Такі формуляції не відповідають вимогам для застосування LTB4 як терапевтичного агента для людей і тварин (недоцільні і мають короткий термін придатності). З огляду на потенціал LTB4 агентів як терапевтичних агентів для профілактики і лікування інфекцій та раку у людей і тварин, було б бажане одержання нової фармацевтичної формуляції LTB4 агента, що діє в лужній рН для стабілізації LTB4 агента, і одержання формуляції з підвищеним терміном придатності. Однією з цілей даного винаходу є одержання нової фармацевтичної формуляції LTB4 агента, що діє в лужній рН для стабілізації LTB4 агента, і одержання формуляції з підвищеним терміном придатності. За одним варіантом здійснення даного винаходу представлена фармацевтична формуляція LTB4 агента, що включає терапевтично ефективну кількість LTB4 агента, його солі, його складного ефіру або його простого ефіру разом з фармацевтично прийнятним носієм при лужній рН, ефектив ній для стабілізації LTB4 агента, що, такимчином, підвищує термін придатності формуляції. Таким чином, даний винахід стосується композиції, що включає LTB4 агент, його сіль, його складний ефір або його простий ефір і фармацевтично прийнятний носій при лужній рН. За іншим варіантом здійснення даного винаходу переважна лужна рН змінюється від 7,1 до 14, більш переважно від 7,5 до 10,5. Переважно рН складає більш 7,6, більш переважно від 7,7 до 11,5. Ще більш переважно рН складає більш 8,1, наприклад, від 8,2 до 14, особливо від 8,5 до 12,5, наприклад, від 8,5 до 11,5, найбільше переважно від 9,5 до 11,5, наприклад, близько 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11,0, 11,1, 11,2, 11,3, 11,4 або 11,5. В іншому переважному варіанті здійснення переважна лужна рН змінюється від 8,0 до 9,0, від 8,5 до 9,5, від 9,0 до 10,0, від 9,5 до 10,5 або від 10,0 до 11,5. У деяких варіантах здійснення фармацевтична формуляція LTB4 агента включає терапевтично ефективну кількість LTB4 агента разом з фармацевтично прийнятним носієм, що реагує в лужному середовищі. Дана заявка описує варіант здійснення, що стосується фармацевтично прийнятного носія при лужній рН, ефективній для стабілізації розглянутої фармацевтичної формуляції, цей варіант здійснення також включає фармацевтично прийнятний носій, що реагує в лужному середовищі. За наступним варіантом здійснення даного винаходу носій являє собою водний носій. За іншим варіантом здійснення даного винаходу носій є твердою частинкою, покритою лужною матрицею, або являє собою лужну матрицю, і носій може бути вибраний із групи, що включає органічні розчинники або їх суміш і воду. За наступним варіантом здійснення даного винаходу стабілізована формуляція включає воду і, щонайменше, 50% (об'єм/об'єм), переважно, щонайменше, 60% (об'єм/об'єм), більш переважно, щонайменше, 70% (об'єм/об'єм), наприклад, близько 75% (об'єм/об'єм), особливо, щонайменше, 80% (об'єм/об'єм) співрозчинника. В окремому варіанті здійснення даного винаходу стабілізована формуляція включає воду і 1 - 49% розчинника або воду і 50 - 99% співрозчинника. Зазначений співрозчинник може бути вибраний з групи, що включає етанол, пропіленгліколь, поліетиленгліколь, ізопропіловий спирт, бензиловий спирт, пропандіол, гліцерол, глікофурол, диметилсульфоксид, диметилацетамід та їх суміші. В окремому варіанті здійснення даного винаходу стабілізована формуляція включає, щонайменше, 90% (об'єм/об'єм) зазначеного співрозчинника. За іншим варіантом здійснення даного винаходу формуляція знаходиться в рідкій формі або ліофілізованій формі або в кристалічній формі або в твердій аморфній формі, переважно в рідкій формі або в ліофілізованій формі. 7 За наступним варіантом здійснення даного винаходу водний носій вибраний із групи, що включає воду, розчини гідроксидів лужних металів, наприклад, розчин гідроксиду натрію, буферні сольові розчини, наприклад, фосфатно-буферний сольовий розчин (PBS), водний розчин, що містить співрозчинники, наприклад, водний розчин, що містить спирт, розчини цукрів або їх суміш. Зазначений водний розчин, що містить співрозчинник, звичайно містить від близько 1% до близько 49% (об'єм/об'єм) співрозчинника. За іншим варіантом здійснення даного винаходу співрозчинник, що міститься у водному розчині, вибраний із групи, що включає етанол, пропіленгліколь, поліетиленгліколь, ізопропіловий спирт, бензиловий спирт, пропандіол, гліцерол, глікофурол, диметилсульфоксид, диметилацетамід та їх суміші. За наступним варіантом здійснення даного винаходу формуляція стабілізована при температурі, що змінюється від -25°С до 45°С, переважно від 0°С до 40°С, наприклад, 2°С - 35°С, особливо 5°С - 25°С, якщо носій є водяним носієм, а формуляція знаходиться в рідкій формі, та при температурі, що змінюється від -25°С до 45°С, переважно від 20°С до 40°С, більш переважно -10°С - 30°С, особливо 0°С - 20°С, найбільше переважно 0°С 10°С, якщо носій є органічним носієм, наприклад, носій, що містить спирт, або формуляція знаходиться в ліофілізованій формі. Іншими найбільш переважними температурними діапазонами, якщо носій є органічним носієм, наприклад, носій, що містить спирт, або формуляція знаходиться в ліофілізованій формі, є -20°С - 0°С, наприклад, -10°C - 0°C або 20°С - 40°C, наприклад, 20°C - 30°C. За іншим варіантом здійснення даного винаходу формуляція додатково включає хелатоутворюючий агент або фармацевтично прийнятну сіль хелатоутворюючого агента в кількості, ефективній для стабілізації LTB4 агента. Переважні хелатоутворюючі агенти за іншим варіантом здійснення даного винаходу включають, без обмеження, наступні: • амінополікарбоксильну кислоту, • етилендіамінтетраоцтову кислоту (EDTA), діетилентриамінпентаоцтову кислоту (DTPA), нітрилотриоцтову кислоту (NTА), глутамінову кислоту та аспарагінову кислоту, • етиленглікольтетраоцтову кислоту (EGTA) та • діетилтриамінпентаоцтову кислоту (DTPА). За наступним варіантом здійснення даного винаходу фармацевтично прийнятна сіль може бути вибрана з групи, що містить солі іонів натрію та калію. За окремим варіантом здійснення даного винаходу стабілізована формуляція може також бути стабілізованою в ліофілізованій формі за допомогою включення у формуляцію людського сироваткового альбуміну (HSA). За наступним варіантом здійснення даного винаходу хелатоутворюючий агент присутній у кількостях від близько 0,001% до близько 1,0% ваги формуляції LTB4 агента, більш переважно хелатоутворюючий агент присутній у кількостях від бли 96257 8 зько 0,01% до близько 40% ваги формуляції LTB4 агента. Переважні LTB4 агенти за даним винаходом включають, без обмеження, наступні: • лейкотрієн В4 [5S,12R-дигідрокси6,8,10,14(Z,E,E,Z)-ейкозантетраеноєва кислота] ("LTB4"), LTB4, 14,15-дигідро-LTB4 ("LTB3"), 17,18дегідро-LTB4 ("LTB5"), 19-гідрокси-LTB4, 20гідрокси-LTB4 і 5(S)гідроперокси та їх 5-деокси аналоги, • 5(R)-гідрокси та 5(R)-гідроперокси аналоги LTB4 агента, • лейкотрієн А4 ("LTA4"), 14,15-дигідро-LТА4 ("LTA3") та 17,18-дегідро-LTA4 ("LTA5"), • 14,15-дигідро-LТА4 метиловий складний ефір та LTB4 метиловий складний ефір, • 5(S)-гідрокси-6,8,11,14(Е,Z,Z,Z)ейкозантетраеноєву кислоту ("5-НЕТЕ"), 14,15дигідро-5-НЕТЕ, 17,18-дегідро-5-НЕТЕ та їх 5(R) гідрокси, 5(R)-гідроперокси, 5(S)-гідроперокси аналоги, • лейкотрієньї С4 і D4 та 14,15-дигідро або їх 17,18-дегідро аналоги; N-ацил або N-алкіл похідні лейкотрієнів С4 і D4 та їх 14,15-дигідро або 17,18дегідро аналоги, • 5,12-дигідрокси-6,8,10,14ейкозантетраеноєву кислоту, 5-гідрокси-6,8,11,14ейкозантетраеноєву кислоту та їх ізомери, • 20,20,20-трифторметил-LТВ4; 19-метилLТВ4, 19,19-диметил-LТВ4, 19-фтор-LТВ4, 19,19дифтор-LТВ4, 18,20-дифтор-LТВ4 і 20-фтор-LТВ4, • 3-тіо-LТВ4, 3-гідрокси-LТВ4, 3-метил-LТВ4, 3,3-диметил-LТВ4, 3-фтор-LТВ4, 3,3-дифтор-LТВ4 та 2,3-дифтор-LТВ4, LTB4 метилсульфоніламід, LTB4 метиламід, 1-тетразоль LTB4, та • їх сіль, їх похідне простого ефіру та їх похідне складного ефіру. Особливо переважно LTB4 агенти за даним винаходом вибрані з групи, що включає LTB4, LTB3, LTB5, 20-гідрокси-LТВ4, 20,20,20трифторметил-LТВ4, 19-гідрокси-LТВ4, 18-гідроксиLТВ4, 3-гідрокси-LТВ4, 2-гідрокси-LТВ4, 4-гідроксиLТВ4, їх 5-деокси аналоги та солі, їх прості або складні ефіри. Ще більш переважно LTB4 агенти за даним винаходом вибрані з групи, що включає LTB4, LTB3, LTB5, 20-гідрокси-LТВ4, 20,20,20трифторметил- LТВ4, 3-гідрокси- LТВ4, їх 5-деокси аналоги та солі, їх прості або складні ефіри. LTB4 агент переважно присутній у кількостях від близько 0,1 мкг/мл до 25 мг/мл формуляції, переважно від 1 мкг/мл до 25 мг/мл формуляції, більш переважно від близько 1 мкг/мл до 1 мг/мл формуляції. Фігура 1 показує, що хелатоутворюючий агент EDTA підсилює стабільність водного розчину Na солі LTB4 при рН 7,4. Фігура 2 показує вплив концентрації LTB4 на стабільність водних розчинів Na солі LTB4. Фігура 3 показує вплив рН (фосфат/гліциновий буфер) на стабільність водного розчину Na солі LTB4 при 1,75 мг/мл. 9 Фігура 4 показує вплив рН (фосфатний буфер) на стабільність водних розчинів Na солі LTB4 при 17,5мкг/мл. Фігура 5 показує вплив різних буферних міцностей (фосфат/гліциновий буфер) на стабільність водних розчинів Na солі LTB4. Фігура 6 показує, що людський сироватковий альбумін (HSA) або/та лужна рН (фосфатний буфер) підсилює стабільність водних ліофілізованих розчинів (що містять маніт) Na солі LTB4. Фігура 7 показує, що лужна рН (фосфат/гліциновий буфер) підсилює стабільність розчинів в етанолі (95/5, етанол/вода та 75/25, етанол/буфер, об'єм/об'єм) LTB4 (кислотна форма та Na сіль). Фігура 8 показує, що лужна рН (фосфат/гліциновий буфер) підсилює стабільність різних LTB4 агентів у розчині. Фігура 9 додатково показує, що лужна рН (фосфат/гліциновий буфер) підсилює стабільність різних LTB4 агентів у розчині. Фігура 10 показує, що LTB4 стабілізований у широкому діапазоні лужної рН, та що високу рН потрібно підняти для забезпечення стабільності. Фігура 11 показує ефективне поглинання LTB4 на моделі щура при введенні в тонку кишку та порівняння з внутрішньовенним та підшкірним введенням. Стабільність водних розчинів LTB4 аналізували при різних експериментальних умовах. З'ясували, що 1) стабільність LTB4 розчинів значно підвищувалася при лужній рН; та що 2) хелатоутворюючі агенти, наприклад, EDTA, сприяли стабільності LTB4 розчинів. Позитивний ефект лужної рН на стабільність LTB4 розчину спостерігали при застосуванні або фосфатного буфера, або гліцинового буфера; позитивний ефект лужної рН на стабільність LTB4 розчину спостерігали при усіх концентраціях аналізованого лікарського засобу (17,5мкг/мл - 17,5мг/мл) та при усіх аналізованих температурах (4°С та 40°С). Вираз "підвищений термін придатності" у контексті даного винаходу означає розширення стабільності LTB4 агентів у формуляціях або композиціях за даним винаходом у порівнянні з формуляціями або композиціями LTB4 агентів, що не включають фактор рН, як описано вище, та/або хелатоутворюючі агенти, як описано вище. Період часу стабільності LTB4 агентів у формуляціях або композиціях за даним винаходом в порівнянні з формуляціями або композиціями LTB4 агентів, що не включають фактор рН, як описано вище, та/або хелатоутворюючі агенти, як описано вище, складає, в залежності від температури, домішок та концентрації LTB4 агентів, переважно більш, щонайменше, тижня, наприклад, щонайменше, два, три або чотири тижні, більш переважно, щонайменше, два, три або чотири місяці, особливо, щонайменше, шість, дев'ять або дванадцять місяців, наприклад, щонайменше, 24 або 48 місяців. Посилання на період часу стабільності LTB4 агентів у формуляціях або композиціях потрібно розуміти як період часу, коли рівень включень менше ніж 10%, переважно менше ніж 6%, найбільше 96257 10 переважно менше ніж 5%, наприклад, менше ніж 4%, 3%, 2% або 1%. Вираз "включення" у контексті даного винаходу потрібно розуміти як продукти розпаду LTB 4 агента, що виміряються зворотно-фазовою високоефективною рідинною хроматографією (HPLC) та ультрафіолетовою (UV) фотометрією при 270нм. Таким чином, чим вище рівень включень, тим нижче стабільність формуляції LTB4 агента. У даному описі, у прикладах і фігурах рівень включень виражається як відсоток пікової площі включень по відношенню до пікової площі LTB4, що вимірювали за допомогою UV фотометрії при 270нм. У прикладах і фігурах, що мають до них відношення, рівень включень можна виразити як відсоток загальної площі під кривою при 270нм. Використовуване визначення буде зрозумілим з контексту прикладів. Вираз "їх солі" потрібно розуміти як фармацевтично прийнятні основно-адитивні солі, отримані обробкою кислотної функціональної групи, наприклад, карбонової кислоти, відповідними основами, такими як, неорганічні основи, наприклад, гідроксиди лужних металів; звичайно гідроксид натрію або калію; карбонати лужних металів; звичайно карбонат або гідрокарбонат натрію або калію; гідроксиди лужноземельних металів; звичайно гідроксид кальцію або магнію; карбонати лужноземельних металів; звичайно карбонат або гідрокарбонат кальцію або магнію; або амонію; або органічні основи, наприклад, первинні, вторинні або третинні аміни, алкоголяти лужних або лужноземельних металів, наприклад, метанолат натрію, етанолат натрію або етанолат калію. Переважними солями за даним винаходом є основно-адитивні солі з гідроксидом натрію або калію. Вираз "їх складні ефіри" потрібно розуміти як фармацевтично прийнятні складні ефіри, отримані обробкою функціональної групи кислотної форми або форми похідної кислоти будь-яким типовим етерифікуючим агентом, відомим фахівцю в даній галузі. У контексті даного винаходу складні ефіри зазначених LTB4 агентів являють собою переважно C1-6 алкільні ефіри, наприклад, метиловий ефір, етиловий ефір, n-пропіловий ефір, і-пропіловий ефір, n-бутиловий ефір, і-бутиловий ефір, sбутиловий ефір, t-бутиловий ефір, n-пентиловий ефір, і-пентиловий ефір, s-пентиловий ефір, неопентиловий ефір та n-гексиловий ефір. Складні ефіри описаних LTB4 агентів можуть також являти собою внутрішньомолекулярні складні ефіри, тобто лактони, утворені внутрішньомолекулярною етерифікацією, наприклад, 5-гідроксигрупи з карбоксильной групою. Вираз "їх прості ефіри" потрібно розуміти як фармацевтично прийнятні прості ефіри, отримані обробкою функціональної групи спиртової форми або форми похідної спирту будь-яким звичайним етерифікуючим агентом, відомим фахівцю в даній галузі. У контексті даного винаходу простими ефірами описаних LTB4 агентів є переважно С1-6, алкільні прості ефіри, наприклад, метиловий простий ефір, етиловий простий ефір, n-пропіловий простий ефір, і-пропіловий простий ефір, n-бутиловий простий ефір, і-бутиловий простий ефір, s 11 бутиловий простий ефір, t-бутиловий простий ефір, n-пентиловий простий ефір, і-пентиловий простий ефір, s-пентиловий простий ефір, неопентиловий простий ефір та n-гексиловий простий ефір. LTB4 агенти Лейкотрієн В4 (LTB4) агент за даним винаходом є або LTB4, або деякими структурально спорідненими поліненасиченими жирними кислотами, що відповідають їх біологічної активності. Вони являють собою або речовини природного походження, або аналоги таких речовин природного походження. Усі LTB4 агенти можна одержати хімічним синтезом за допомогою методів, описаних у літературі, і більшість з них є комерційно доступними. Застосовуваний у даному описі вираз "LTB4 агент" означає одну або більш наступну поліненасичену жирну кислоту, що на додаток до LTB4 є або попередником, або метаболітом LTB4, або LTB4 аналогом: LTB4, 14,15-дигідро-LTB4, 17,18дегідро-LТВ4, 19-гідрокси-LТВ44, 20-гідрокси-LТВ4 та їх 5(R)-гідрокси, 5(S)гідроперокси, 5(R)гідроперокси та 5-деокси аналоги; LTA4; 14,15дигідро-LТA4, 17,18-дегідро-LТА4; 14,15-дигідроLТА4 метиловий складний ефір, LTA4 метиловий складний ефір, 5(S)-гідрокси-6,8,11,14(E,Z,Z,Z)ейкозантетраеноєва кислота ("5-НЕТЕ"), 14,15дигідро-5-НЕТЕ, 17,18-дегідро-5-НЕТЕ та їх 5(R)гідрокси, 5(S)-гідроперокси, 5(R)-гідроперокси аналоги. Вираз "LTB4 агент" також включає інші похідні поліненасичених жирних кислот: лейкотрієни С4 і D4 та їх 14,15-дигідро або 17,18-дегідро аналоги; N-ацильні або N-алкільні похідні лейкотрієнів С4 і D4 та їх 14,15-дигідро або 17,18-дегідро аналоги; усі ізомерні 5,12-дигідрокси-6,8,10,14ейкозантетраеноєві кислоти та 5-гідрокси6,8,11,14-ейкозантетраеноєві кислоти. Вираз "LTB4" також включає варіанти, що являють собою нековалентно модифіковані жирні кислоти, наприклад, натрієву або калієву солі LTB4 агентів. Вираз "LTB4 агент" також включає варіанти, при яких модифікацію вводять у молекулу за допомогою реагуючих цільових функціональних груп жирної кислоти з органічним дериватизуючим агентом, який здатний реагувати з обраною функціональною групою (що дає, наприклад, похідні складних або простих ефірів LTB4 агента) або викликати внутрішньомолекулярне перегрупування (наприклад, утворення лактонів з гідроксильованими жирними кислотами). Утворені сполуки можуть змінювати біологічну активність та/або біодоступність. Таким чином, ковалентно модифікована жирна кислота може бути проліками зі зниженою біологічною активністю, що при введенні in vivo повільно трансформується в більш активну молекулу (недериватизований LTB4 агент). Варіантами також можуть бути метаболічно стабільні і біологічно активні аналоги LTB4 агентів, зміна яких приводить до уповільненого розподілу сполуки (знижений метаболізм та/або елімінація). Варіанти з модифікаціями на омега-кінці (наприклад, 20,20,20-трифторметил-LТВ4) виявляють підвище 96257 12 ну стійкість до омега-окиснення (катаболічний процес ненасичених жирних кислот); інші варіанти з модифікацією на омега-кінці з 13 - 20 атомами вуглецю (наприклад, 19-метил-LТВ4 або 19,19диметил-LТВ4 або 19-фтор-LТВ4 або 19,19дифтор-LТВ4 або 18,20-дифтор-LТВ4 або 20-фторLТВ4) можуть виявляти підвищену стійкість до омега-окиснення, а варіанти з модифікаціями на карбоксильному кінці з числом атомів вуглецю 1, 2, 3 або 4 (наприклад, 3-тіо-LTB4, 3-гідрокси-LТВ4, 3метил-LТВ4 або 3,3-диметил-LТВ4 або 3-фтор-LТВ4 або 3,3-дифтор-LТВ4 або 2,3-дифтор-LТВ4, LTB4 метилсульфоніламід, LTB4 метиламід, 1-тетразоль LTB4), можуть виявляти підвищену метаболічну стійкість до бета-окиснення та/або до елімінації (наприклад, включення в чуттєвий до пробенециду переносник органічних кислот). Інші варіанти з модифікацією(ями) з 12 атомами вуглецю, наприклад, 12(R)-метил-LТВ4, можуть виявляти підвищену стійкість до скорочення 11,12 подвійних зв'язків (метаболічний шлях LTB4). Іншими варіантами є аналоги LTB4 агентів зі структуральними змінами, наприклад, змінами в довжині ланцюга (довжина ланцюга підвищується або знижується до 4 вуглеців), додавання подвійного зв'язку(їв), насичення подвійного зв'язку(їв), зміна у геометрії подвійного зв'язку(ів) (cis на trans або навпаки), зміна подвійного зв'язку(їв) на потрійний зв'язок(и), зміна в конфігурації однієї або більше функціональних груп (R на S або S на R), або де одна або більше функціональних груп або замісників або вилучені, додані або замінені на інші функціональні групи або замісники (включаючи, але не обмежуючи, гідропероксил, карбоніл, сульфгідрил, сульфоксид, сульфон, цистеініл, глютатіоніл, цистеініл-гліцин, метил, ізопропіл, бензил, хлоро, фторо), або де положення однієї або більше функціональних груп та/або одного або більше подвійних зв'язків зрушені на один, два або три вуглеці відносно омегакінця. LTB4 агентом може бути варіант, що має одну або кілька вищезгаданих структуральних модифікацій. Вираз "формуляція LTB4 агента" також включає формуляції сполук, що можуть містити суміш двох або кількох LTB4 агентів або LTB4 агента та одного або кількох однаково або менш активного ізомеру(ів) LTB4 агента (позиційних, геометричних або оптичних ізомерів). Інфекції Інфекціями, які можна лікувати LTB4 агентами за даним винаходом, є інфекції, викликані мікробними патогенами людини та/або тварин. Більш того, розглядається попередження або профілактика інфекцій і стимулювання нейтрофільної функції формуляціями або композиціями LTB4 за даним винаходом. Вираз "мікробні патогени людини та/або тварин" включає, без обмеження, ДНК і РНК віруси, загалом, та Retroviridae, бактерії, гриби та паразити. Діапазони доз Терапевтично ефективна кількість LTB4 агента для введення буде варіювати в залежності від даного застосовуваного LTB4 агента, типу або способу введення, одночасного застосування ін 13 ших активних сполук, віку і розміру пацієнта, типу, серйозності та поширеності інфекції, відгуків окремих пацієнтів і т. п. У випадку LTB4 його можна вводити в достатніх дозах для одержання ефективної пікової або стабілізованої концентрації від близько 0,1 нМ до 10мкМ, переважно від 0,1нМ до 1000нМ, більш переважно від близько 0,25нМ до 2,5мкМ, наприклад, 0,25нМ до 25нМ. Ефективну дозовану кількість LTB4 агента можна визначити клінічно після розгляду усіх вищезгаданих критеріїв. У випадку агентів LTB4, крім LTB4, що мають різну біологічну активність, необхідна ефективна пікова або стабільна концентрація може бути різною, наприклад, до 25мкМ, такою як до 10мкМ. Дозовану кількість агента, необхідну для отримання бажаних концентрацій у крові, можна визначити фармакокінетичними дослідженнями, як описано в Marleau et al., J. Immunol. 150: 206, 1993, and Marleau et al, Br. J. Pharmacol. 112: 654, 1994. pH Вираз "лужна pH" включає лужну рН від 7,1 до 14, що ефективна при стабілізації LTB4 агента у водних або органічних розчинах або у твердій або ліофілізованій формуляції за даним винаходом. Переважні діапазони лужної рН складають від 8,2 до 14, особливо від 8,5 до 12,5, наприклад, від 8,5 до 11,5, найбільше переважно від 9,5 до 11,5, наприклад, близько 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11,0, 11,1, 11,2, 11,3, 11,4 або 11,5. В іншому кращому варіанті здійснення переважна лужна рН змінюється від 8,5 до 9,5, від 9,0 до 10,0, від 9,5 до 10,5 або від 10,0 до 11,5. Вираз "носій із лужною реакцією" включає іншу інертну, фармацевтично прийнятну речовину (або речовини), що у випадку стабілізованої формуляції LTB4, яка знаходиться в ліофілізованій, кристалічній або твердій аморфній формі, якщо вода адсорбована частинками суміші, або якщо вода додана до суміші в невеликих кількостях, створює лужну "мікро-рН" від 8,2 до 14, особливо від 8,5 до 12,5, наприклад, від 8,5 до 11,5, найбільше переважно від 9,5 до 11,5, наприклад, близько 9,5, 9,6, 9,7, 9,8, 9,9, 10,0, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11,0, 11,1, 11,2, 11,3, 11,4 або 11,5, навколо кожної частинки LTB4. У наступному переважному варіанті здійснення лужна "мікро-рН" змінюється від 8,0 до 9,0, від 8,5 до 9,5, від 9,0 до 10,0 або від 10,0 до 11,5. Такі речовини, що створюють зазначену "мікро-рН", можна вибрати, не обмежуючи, з речовин, наприклад, натрієвої, калієвої, кальцієвої, магнієвої та алюмінієвої солі фосфорної кислоти, карбонової кислоти, лимонної кислоти або інших прийнятних слабких неорганічних або органічних кислот; речовин, що звичайно застосовують в антацидних препаратах, наприклад, гідроксидів алюмінію, кальцію і магнію; оксиду магнію або композитних речовин, наприклад, Al2O3.6Mg.CO2.12H2O,(Mg6Al2(OH)16CO3.4H2O),Mg.A l2O3.2SiO2.nH2O або подібних сполук; органічних рН-буферних речовин, наприклад, тригідроксиметиламінометану або інших подібних, фармацевтично прийнятних рН-буферних речовин. Фармацевтично прийнятні носії 96257 14 Вираз "фармацевтично прийнятний носій" включає будь-який носій, наприклад, будь-який водний носій, прийнятний для фізіологічного та фармацевтичного застосування. Такий носій вибраний із групи, що включає воду, буферні сольові розчини, наприклад, фосфатно-буферний сольовий розчин (PBS), або розчин хлориду натрію, забуферений агентами, такими як Tris, гліцин або інші амінокислоти, зокрема основні амінокислоти, водний розчин, що містить спирт, наприклад, етанол, пропіленгліколь, пропандіол, гліцерол або маніт, а також розчини цукрів, наприклад, розчини глюкози або лактози, або суміш різних згаданих розчинників. Більш того, вираз "фармацевтично прийнятний носій" може включати інертні розріджувачі або наповнювачі, наприклад, сахарозу, сорбітол, цукор, маніт, мікрокристалічну целюлозу, крохмалі, включаючи картопляний крохмаль, карбонат кальцію, хлорид натрію, лактозу, фосфат кальцію, сульфат кальцію або фосфат натрію; агента, що гранулюють, та агенти, що дезінтегрують, наприклад, похідні целюлози, включаючи мікрокристалічну целюлозу, крохмалі, включаючи картопляний крохмаль, кроскармелозу натрію, альгінати або альгінову кислоту; зв'язуючі агенти, наприклад, сахарозу, глюкозу, сорбітол, акацієву камедь, альгінову кислоту, натрію альгінат, желатин, крохмаль, пептизований крохмаль, мікрокристалічну целюлозу, магнію алюмінію силікат, карбоксиметилцелюлозу натрію, метилцелюлозу, гідроксипропілметилцелюлозу, етилцелюлозу, полівінілпіролідон або поліетиленгліколь; та агенти, що змазують, включаючи гліданти та антиадгезиви, наприклад, стеарат магнію, стеарат цинку, стеаринову кислоту, кремнезем, гідрогеновані рослинні олії або тальк. В окремому варіанті здійснення даного винаходу вираз "фармацевтично прийнятний носій" включає тільки нетоксичні речовини. У переважному варіанті здійснення даного винаходу вираз "фармацевтично прийнятний носій" не включає ацетонітрил. Вираз "токсичний" має значення, добре відоме фахівцю в даній галузі, більш детально в контексті формуляцій за даним винаходом токсична речовина являє собою речовину, яка кількісно присутня у формуляціях за даним винаходом і може знижувати функціональність або викликати структуральні ушкодження клітини або організму. Тому "нетоксична речовина" не включає ацетонітрил. В особливо переважному варіанті здійснення даного винаходу формуляція включає тільки нетоксичні речовини. Формуляція за даним винаходом може включати менше ніж 25% (об'єм/об'єм) ацетонітрилу, переважно менше ніж 15%, ще більш переважно менше ніж 5%, найбільше переважно менше ніж 1% (об'єм/об'єм). Можна застосовувати будь-який прийнятний тип або спосіб введення для забезпечення ссавця, особливо людини, ефективною дозою формуляції LTB4 агента за даним винаходом. Наприклад, можна застосовувати пероральне, парентеральне, внутрішньодуоденальне, усередину тонкої кишки та місцеве введення. Дозовані форми включають 15 таблетки, капсули, порошки, розчини, дисперсії, суспензії, креми, мазі та аерозолі. Для парентерального, наприклад, підшкірного, внутрішньовенного або місцевого введення, формуляцію за даним винаходом, якщо необхідно, перетворюють у розчин, гель або емульсію за допомогою фармацевтичних речовин, прийнятних для цієї мети, наприклад, солюбілізаторів, загусників, емульсифікаторів, агентів для тонічності, консервантів або інших допоміжних речовин. Місцеві засоби, застосовувані у фармацевтиці, являють собою водні розчини, серед яких, наприклад, буферні системи або ізотонічні або гіпертонічні суміші води і розчинників, що змішуються з водою, такі як, наприклад, спирти або арилові спирти, олії, поліалкіленгліколі, етилцелюлоза, гідроксипропілцелюлоза, карбоксиметилцелюлоза, полівінілпіролідон або сополімери етиленоксиду та пропіленоксиду (плюронілового) ізопропілміристату. Приклади прийнятних буферних речовин являють собою гідроксид натрію та амінокислоти, наприклад, гліцин, аргінін, гістидин та лізин; фосфат натрію, ацетат натрію або глюконатний буфер. Форма для місцевого введення може також містити нетоксичні допоміжні речовини, такі як, наприклад, поліетиленгліколі, та протибактеріальні сполуки. Формуляції тривалого вивільнення також розглядаються в межах даного винаходу. Такі формуляції дуже різноманітні, що зрозуміло фахівцю в даній галузі. Приклади речовин тривалого вивільнення включають органічні розчинники або полімери, що біологічно руйнуються, біологічно сумісні полімери, включаючи, наприклад, емульсії, гелі, мікросфери та гідрогелі. Переважними формуляціями тривалого вивільнення для використання за даним винаходом є мікрокапсула або мікросфера та міцели. Мікрокапсули/сфери являють собою надзвичайно маленькі частинки активних сполук, що поміщені у прийнятний полімер, щоб сформувати сфери, які варіюють у діаметрі від близько 40 до 500мкм (переважно менше ніж 150мкм), та легко вводяться ін'єкцією при суспендуванні в прийнятному рідкому носії. LTB4 агент можна формулювати як стерильну фармацевтичну композицію для терапевтичного застосування, прийнятну для будь-якого місцевого або системного введення. Продукт може бути у формі без розчинника (наприклад, ліофілізований розчин, що містить маніт) та готовим до відновлення для застосування шляхом додавання прийнятного носія або розріджувача. Для запобігання розкладу, продукт може знаходитися у формі розчину, який може бути водним або органічним та готовим до введення або готовим до модифікації шляхом додавання прийнятного розріджувача. Для модифікації продукту у формі розчину за даним винаходом можна використовувати стерильний розріджувач, що може містити матеріали, звичайно застосовувані в умовах, наближених до фізіологічних. У цьому випадку стерильний розріджувач може містити солі та/або буферні агенти для досягнення фізіологічно прийнятної тонічності та рН, наприклад, хлорид натрію, фосфат та/або 96257 16 інші речовини, фізіологічно прийнятні та/або безпечні для використання. Застосовувана у формі водного розчину фармацевтична композиція буде головним чином містити багато речовин, описаних вище, для відновлення продукту, що не містить розчинник. Якщо застосовувати у формі розчину в органічному розчиннику, то для відновлення продукту, що не містить розчинник, невеликий об'єм розчину, що містить жирну кислоту (LTB4 агент), потрібно буде розбавити водним розчином, що містить багато речовин, описаних вище. Така фармацевтична композиція, головним чином, буде містити багато речовин, описаних вище, для відновлення продукту, що не містить розчинник. LTB4 агент можна застосовувати в комбінації з іншими агентами, включаючи, але не обмежуючи, протимікробні агенти, протиракові агенти, иммуносупресивні агенти, иммуностимулючі агенти, протизапальні агенти, цитокіни, ростові фактори (наприклад, G-CSF, M-CSF та GM-CSF), ретиноїди та сполуки, здатні знижувати поглинання, елімінування або метаболізм LTB4 агента, наприклад, пробенецид, дипірідамол або клофібрат. Якщо представлений LTB4 агент вводити пацієнту в якості протиінфекційного, то це може бути пероральна, внутрішньоартеріальна, внутрішньовенна, внутрішньоперитоніальна, підшкірна, внутрішньоназальна, внутрішньом'язова ін'єкція, інгаляція або подібне. Дозовані форми з ентеросолюбільним покриттям Як показано на моделі щура (Приклад 11), внутрішньодуоденальне введення LTB4 агентів забезпечує необхідний фармакокінетичний профіль. Таким чином, у переважному варіанті здійснення формуляції за даним винаходом можуть бути в пероральній дозованій формі з ентеросолюбільним покриттям. З зазначених вище якостей стабільності LTB4 агентів очевидно, що необхідно захистити пероральну дозовану форму зазначених LTB4 агентів від контакту з кислотною реакцією шлункового соку, щоб вона досягла тонкої кишки без руйнування. Препарати з ентеросолюбільним покриттям стійкі до розчинення в кислотному середовищі, але швидко розчиняються в середовищі від нейтрального до лужного. Дозована форма з ентеросолюбільним покриттям переважно характеризується наступним чином. Ядра, що містять LTB4 агент, змішаний із сполуками, що реагують у лужному середовищі, або сіль LTB4 агента, необов'язково змішаного із сполукою, що реагує в лужному середовищі, покриті двома або більш шарами, причому перший шар/шари, що розчиняється у воді або швидко розпадається у воді, складається з некислотних або інертних фармацевтично прийнятних речовин. Цей/ці перший шар/шари відокремлює/відокремлюють матеріал ядра з лужною реакцією від зовнішнього шару, що є ентеросолюбільним покриттям. На завершення, дозовану форму з ентеросолюбільним покриттям обробляють прийнятним способом для зниження вмісту води до дуже низького рівня, щоб досягти задовільної 17 стабільності дозованої форми під час тривалого терміну зберігання. Ядра LTB4 агент змішують з інертними, переважно розчинними у воді, традиційними фармацевтичними компонентами для одержання переважної концентрації активної сполуки у фінальній суміші та з реагуючою у лужному середовищі або інертною, фармацевтично прийнятною речовиною (або речовинами), що створює "мікро-рН", як зазначено вище, якщо вода адсорбується частинками суміші, або якщо вода додається до суміші в невеликих кількостях. Такі речовини можна вибрати з речовин, наприклад, натрієвої, калієвої, кальцієвої, магнієвої та алюмінієвої солей фосфорної кислоти, вугільної кислоти, лимонної кислоти або інших прийнятних слабких неорганічних або органічних кислот; речовин, що звичайно застосовують в антацидних препаратах, наприклад, гідроксиди алюмінію, кальцію та магнію; оксиду магнію або композитних речовин, наприклад, Al2O3.6Mg СО2.12Н2О, (Mg6Al2(OH)16CO3 4Н2О), Mg.Al2O3.2SiO2.nH2O, причому n не є цілим числом та менше ніж 2, або подібних сполук; органічних рН-буферних речовин, наприклад, трисгідроксиметиламінометану або інших подібних, фармацевтично прийнятних рНбуферних речовин. Потім порошкову суміш формулюють у невеликі гранули, тобто пелети або таблетки, традиційними фармацевтичними способами. Ці пелети або таблетки використовують як ядра для подальшого процесу. Шар, що відокремлює Ядра з лужною реакцією, що містять LTB4 агент, повинні відокремлюватися від полімерів ентеросолюбільного покриття, що містить вільні карбоксильні групи, що у противному випадку викликає руйнування LTB4 агента під час процесу покриття або під час зберігання. Підшар (шар, що відокремлює) також служить рН-буферною зоною, де іони водню, що дифундують від зовнішнього покриття до лужного ядра, можуть реагувати з гідроксильними іонами, що дифундують від лужного ядра до поверхні покритих частинок. рНбуферні властивості шару, що відокремлює, можна додатково підсилити введенням у шар речовин, вибраних із групи сполук, що звичайно використовуються в антацидних формуляціях, таких як, наприклад, магнію оксид, гідроксид або карбонат, алюмінію або кальцію гідроксид, карбонат або силікат; композитних сполук алюмінію/магнію, таких як, наприклад, Al2O3.6Mg СО2.12Н2О, (Mg6Al2(OH),6CO3,4H2O), MgO.Al2O3.2SiO2.nH2O, причому n не є цілим числом та менше ніж 2, або подібних сполук; або інших фармацевтично прийнятних рН-буферних речовин, таких як, наприклад, натрієва, калієва, кальцієва, магнієва та алюмінієва солі фосфорної, лимонної або інших прийнятних, слабких, неорганічних або органічних кислот. Шар, що відокремлює, складається з одного або більш розчинних у воді інертних шарів, що необов'язково містять рН-буферні речовини. Шар(шари), що відокремлює, можна наносити на ядра - пелети або таблетки - традиційними спо 96257 18 собами нанесення покриття в прийнятній ємності з покриттям або в апараті з флюїдизованим шаром із застосуванням води та/або традиційних органічних розчинників для розчину покриття. Матеріал для шару, що відокремлює, вибирають з фармацевтично прийнятних, розчинних у воді, інертних сполук або полімерів, що застосовують для нанесення плівки, таких як, наприклад, цукор, поліетиленгліколь, полівінілпіролідон, полівініловий спирт, гідроксипропілцелюлоза, гідроксиметилцелюлоза або гідроксипропілметил-целюлоза. Товщина шару, що відокремлює, складає не менше ніж 2мкм, для невеликих сферичних пелетів переважно не менше ніж 4мкм, для таблеток переважно не менше ніж 10мкм. У випадку таблеток можна застосовувати інший спосіб нанесення покриття шляхом сухого покриття. Спочатку таблетку, що містить кислотнолабільну сполуку, пресують, як описано вище. Навколо цієї таблетки за допомогою прийнятного таблеткового преса пресують інший шар. Зовнішній шар, що відокремлює, містить фармацевтично прийнятні таблеткові наповнювачі, що розчиняються у воді або швидко розпадаються у воді. Шар, що відокремлює, має товщину не менше ніж 1мм. Шар, що відокремлює, також може містити традиційні пластифікатори, пігменти, діоксид титану, тальк та інші добавки. Шар ентеросолюбільного покриття наносять на ядра з підшаром традиційною методикою нанесення покриття, наприклад, у ємності з покриттям, в апараті з флюїдизованим шаром із застосуванням розчинів полімерів у воді та/або в прийнятних органічних розчинниках або за допомогою латексної суспензії зазначених полімерів. Як ентеросолюбільні покриваючі полімери можна використовувати, наприклад, целюлози ацетат фталат, гідроксипропілметилцелюлози фталат, полівініл ацетат фталат, со-полімеризовані метакрилову кислоту/метилові ефіри метакрилової кислоти, наприклад, сполуки, відомі під торговою маркою R R Eudragit L 12,5 або Eudragit L 100, (Röhm Pharma), або подібні сполуки, що застосовують для одержання ентеросолюбільних покриттів. Ентеросолюбільне покриття також можна наносити за допомогою водної дисперсії полімеру, R наприклад, Aquateric (FMC Corporation), Eudragit L 100-55 (Röhm Pharma), Coating CE 5142 (BASF). Шар ентеросолюбільного покриття може необов'язково містити фармацевтично прийнятний пластифікатор, такий як, наприклад, цетанол, триацетин, ефіри лимонної кислоти, наприклад, відомі під R торговою маркою Citroflex (Pfizer), ефіри фталевої кислоти, дибутил сукцинат або подібні пластифікатори. Для кожного полімеру ентеросолюбільного покриття звичайно оптимізують дозу пластифікатора, і вона звичайно складає 1 - 20% полімеру ентеросолюбільного покриття. Шар ентеросолюбільного покриття може також включати дисперсанти, наприклад, тальк; барвники та пігменти. Таким чином, препарат з ентеросолюбільним покриттям за даним винаходом складається з ядер, що містять LTB4 агент, змішаний із сполукою з лужною реакцією, або ядер, що містять сіль луж 19 ного металу кислотно-лабільної сполуки, змішаної із сполукою з лужною реакцією. Ядра з покриттям, що розчиняється у воді або швидко розпадається у воді та необов'язково містить рН-буферну речовину, яка відокремлює лужні ядра від ентеросолюбільного покриття. Дозовану форму з підшаром остаточно покривають ентеросолюбільним покриттям, що робить дозовану форму нерозчинною в кислотному середовищі, але вона швидко розпадається/розчиняється в середовищі від нейтрального до лужного, такому як, наприклад, рідини, що присутні у проксимальній частині тонкої кишки, ділянці, де повинне відбуватися розчинення. Хелатоутворюючий агент Вираз "хелатоутворюючий агент" включає металеві хелатоутворюючі агенти, відомі в даній галузі. Хелатори для іонів металу звичайно являють собою поліфункціональні молекули, що мають безліч негативно заряджених та/або багатих електронами ліганд, що можуть блокувати іони металу з різними афінностями. Прийнятні багаті електронами функціональні групи включають карбоксильні групи, гідроксигрупи та аміногрупи. Розташування цих груп в амінополікарбоксильних кислотах, гідроксиполікарбоксильних кислотах, гідроксиамінокарбоксильних кислотах і т. п. приводить до утворення компонентів, що діють як чудові хелатори. При цьому вони включають амінополікарбоксильні кислоти, такі як, наприклад, етилендіамінтетраоцтова кислота (EDTA), діетилентриамін пентаоцтова кислота (DTPA), нітрилотриоцтова кислота (NTА), N-2-ацетамідо-2-імінодіоцтова кислота (ADA), bis(аміноетил)-гліколевий ефір, Ν,Ν,Ν',Ν'тетраоцтова кислота (EGTA), transдіаміноциклогексан тетраоцтова кислота (DCTA), глутамінова кислота та аспарагінова кислота; та гідроксиамінокарбоксильні кислоти, такі як, наприклад, N-гідроксиетилімінодіоцтова кислота (HIMDA), N,N-bis-гідроксиетилгліцин (біцин) та N(трисгідроксиметилметил)гліцин (трицин); та Nзаміщені гліцини, наприклад, гліцилгліцин. Інші кандидатні хелатори включають 2-(2-аміно-2оксоктил)аміноетан сульфонову кислоту (BES). Усе вищезгадане також включає солі карбоксильних та інших кислотних функціональних груп. Приклади таких солей включають солі натрію, калію та інших слабко зв'язаних іонів металу; природа солі та число зарядів, що будуть нейтралізовані, буде залежати від числа присутніх карбоксильних груп та рН, при якій додається стабілізуючий хелатор. Як відомо в даній галузі, хелатоутворюючі агенти мають різну міцність зв'язку даних цільових іонів. Загалом, іони важких металів зв'язані міцніше, ніж їх еквіваленти з однаковими зарядами, але +2 з меншою молекулярною масою. Наприклад, Сu +2 завжди хелатується сильніше, ніж Са , що дає можливість у деяких випадках застосовувати кальцієві солі використовуваних хелаторів. Щоб оцінити відносну міцність, як довільний стандарт для порівняння хелаторів, тут використовується постійна стабільності іона міді при рН формуляції. Ці постійні стабільності, звичайно, залежать від рН. Вони доступні з літератури, і можуть бути знайдені, наприклад, у Perrin, D. D., et al., "bufferss for рН 96257 20 and Metal Ion Control" Chapman & Hall, London, N.Y., (1974), та, зокрема, у International Union of Pure & Applied Chemistry: "Stability Constants", suppl 1 (1971) Alden press, Oxford. Силу хелаторів можна класифікувати за допомогою знайдених у цих посиланнях значень стабільності комплексів +2 Сu , як міри сили хелатора. Використовують значення "log бета" як негативні логарифми константи дисоціації для комплексу. Чим вище значення logбета, тим сильніше зв'язок між іоном міді та хелатоутворюючим компонентом. Звичайно, рН при який проводять визначення, є істотним чинником, тому що різні карбоксильні групи, що містяться у хелаторі, сильніше зв'язуються з окремим іоном, оскільки вони негативно заряджені. Особливо ефективними за даним винаходом є хелатори зі значеннями log-бета для іона міді близько 7 або більш (як визначено при рН формуляції, що заявляється); більш переважні мають значення 10 або більш; та найбільш переважні мають значення log-бета при рН застосування 15 або більш. Таким чином, переважними є, наприклад, трицин, біцин, ADA та HIMDA, як досить сильні; ще більш переважними є NTA, DTPA та EDTA. Серед найбільш переважних хелаторів для застосування за даним винаходом - EDTA та DTPA. У даній галузі відома велика кількість хелатоутворюючих агентів, а кандидатний хелатор можна легко визначити за його значенням log-бета стосовно іона міді при певній рН застосування, та, якщо він має фармацевтично прийнятні властивості, що дозволяють його застосовувати в композиціях для введення пацієнтам, його можна оцінити як прийнятний для застосування у способі за даним винаходом та у композиціях за даним винаходом. Необхідно також враховувати розчинності у воді, хоча різні хелатори можуть бути присутніми у різних кількостях, в залежності від природи іншої частини формуляції. Тоді як, хелатоутворюючий агент присутній у стабілізуючих кількостях, його % від загальної ваги може складати від близько 0,001% до близько 1,0% (вага/вага) усієї формуляції. Переважно % хелатоутворюючого агента від загальної ваги складає від близько 0,01% до близько 0,1% (вага/вага). Ці значення відносяться до остаточного відновленого продукту для фармацевтичних показань. Якщо формуляція ліофілізована, % хелатоутворюючого агента в сухій масі може складати від близько 10% до близько 40%. Тому, у сухій формі хелатоутворюючий агент може бути присутнім у кількостях від близько 0,01% до близько 40% загальної ваги, переважно від близько 1,0% до близько 30%. Як буде зрозуміло фахівцю в даній галузі, % хелатоутворюючого агента у формуляції змінюється в залежності від специфічного агента, що збільшує об'єм, що застосовують для формуляції активної сполуки. Зрозуміло, що, чим вище рівні проблематичних іонів металу, що присутні в агенті, що збільшує об'єм, або в іншому агенті в композиції, тим вище рівні необхідного хелатора. Це легко визначити за допомогою методик для визначення оптимальних концентрацій хелатоутворюючого агента, описаних нижче. 21 Даний винахід буде легше зрозуміти завдяки посиланню на наступні приклади, що наведені для ілюстрації даного винаходу, а не для обмеження його об'єму. ПРИКЛАД 1 Матеріали і способи LTB4 (у кислотній формі) одержали від Cascade Biochem (Великобританія) у водноспиртовому розчині, 95/5. Ступінь чистоти цього стартового матеріалу складав близько 98,5% (±0,3%), як визначили зворотно-фазовою HPLC. Розчин LTB4 у етанолі нейтралізували еквівалентом гідроксиду натрію для одержання натрієвої (Na) солі LTB4. Розчин Na солі LTB4 у етанолі випарювали насухо при зниженому тиску за допомогою роторного випарного апарата і водяної бані (30°), поки не утворився маслянистий залишок. Залишок знову розчинили у фосфатно-буферному сольовому розчині Дюльбеко (DPBS) при рН 7,4, що містить або не містить 0,01% етилендіамінтетраоцтову кислоту (EDTA), для одержання остаточної концентрації LTB4 5мг/мл. Розчини розлили у 2мл боросилікатні скляні ампули типу І, які потім закупорили під аргоном за допомогою гумових пробок, покритих тефлоном, та алюмінієвих кришок. Зразки зберігали у темноті при 25 ± 5°С до аналізу у певні точки часу. Аналіз розчинів LTB4 виконували зворотно-фазовою HPLC за допомогою С18, 5 μ частинки, колонки 4,7250мм (Nucleosil) та метанол/ацетонітрил градієнтного елюювання; визначення LTB4 та включень виконували потоком за допомогою HPLC UV спектрофотометра при 270нм. Результати Як показано на Фігурі 1 водні розчини Na солі LTB4 при 5мг/мл, що не містять EDTA, показали підвищений рівень включень вже після 7 днів зберігання при 25°С, а рівень домішок досяг 23,3% пікової площі LTB4 після 14 днів зберігання. На відміну від них, розчини Na солі LTB4 при 5мг/мл, що містять 0,01% EDTA, не показали підвищення погіршення властивостей до 14 днів зберігання, а рівні домішок складали 2,9% та 8,6% після 60 та 90 днів зберігання при 25°С, відповідно. Ці дані чітко показують, що EDTA значно сповільнює деградацію водних розчинів Na солі LTB4. ПРИКЛАД 2 Матеріали і способи Розчин LTB4 (у кислотній формі) при концентрації 12мг/мл у водно-спиртовому розчині, 95/5 (від Cascade Biochem, Великобританія), нейтралізували еквівалентом гідроксиду натрію для утворення Na солі. Цей стартовий матеріал, що застосовували в експериментах, описаних у Прикладах 2-7, мав ступінь чистоти 96,8% (±0,3%), як визначили зворотно-фазовою HPLC. Розчин Na солі LTB4 у етанолі випарили (див. Приклад 1) до утворення маслянистого залишку. Потім залишок заново розчинили у фосфатному буферному розчині хлориду натрію (соляному розчині) (30мМ фосфату натрію, рН 7,5), що містить 0,01% EDTA, для одержання ізотонічного розчину Na солі LTB4 при 25мг/мл. Шляхом розчинення 25мг/мл розчину в 30мМ ізотонічному натрій фосфатно-буферному сольовому розчині, рН 7,5, що містить 0,01% 96257 22 EDTA, одержали розчин Na солі LTB4 з концентрацією 0,1мг/мл. Аліквоти розчинів розлили в 2мл скляні ампули типу І, як описано в Прикладі 1, та зберігали на повітрі у темноті при 40±5°С. Проаналізували LTB4 та включення шляхом визначення часу зворотно-фазовою HPLC за допомогою UV визначення при 270нм. Результати На Фігурі 2 показані результати вивчення змушеної деградації (40°С) водних ізотонічних з рН 7,5 розчинів Na солі LTB4 при концентрації 0,1 та 25мг/мл. Дані чітко показують, що при визначенні зворотної залежності між стабільністю і концентрацією в розчинах Na солі LTB4 25мг/мл розчин Na солі LTB4 набагато менш стабільний, чим розчин Na солі LTB4 при 0,1мг/мл. Стабільність розчину Na солі LTB4 при 0,01мг/мл подібна стабільності розчину при 0,1мг/мл (дані не показані). ПРИКЛАД 3 Матеріали і способи Водні ізотонічні розчини Na солі LTB4 при концентрації 1,75мг/мл у фосфат/гліциновому буферному сольовому розчині (3мМ фосфату натрію та 10мМ гліцинового буфера, рН 7,5, 8,5, 9,5 та 10,5), що містить 0,01% EDTA, одержали шляхом розчинення 25мг/мл розчину Na солі LTB4 (див. Приклад 2) у відповідному фосфат/гліциновому буферному сольовому розчині, що містить 0,01% EDTA. Розчини розлили в 2мл ампули для зберігання на повітрі у темноті при 4 ± 4 °С і 20 ± 5 °С протягом 9 місяців до аналізу LTB4 та включень зворотнофазовою HPLC, як описано в Прикладі 1. Результати На Фігурі 3 чітко показано, що підвищення рН водних ізотонічних розчинів Na солі LTB4 значно підсилює стабільність LTB4, як видно по зниженню рівнів включень, визначених у зразках аналізом HPLC. Вплив лужної рН на стабільність розчинів Na солі LTB4 спостерігали і при 4°С, і при 20°С, це показало, що вплив лужної рН на стабілізацію не залежить від температури. При вивченні змушеної деградації (зберігання при 40°С) підвищення рН розчинів Na солі LTB4 також привело до значного поліпшення стабільності розчину Na солі LTB4 (дані не показані). ПРИКЛАД 4 Матеріали і способи Водні ізотонічні розчини Na солі LTB4 при концентрації 17,5мкг/мл одержали розчиненням у фосфатно-буферному сольовому розчині (3мМ натрій фосфатний буфер, рН 7,5, 8,5, 9,5 та 10,5), що містить 0,01% EDTA, розчину Na солі LTB4 при 25мг/мл (Приклад 2). Розчини Na солі LTB4 при 17,5мкг/мл з 4 різними рН розлили у 2мл ампули для зберігання на повітрі у темноті при 4 ± 4°С або 20 + 5°С протягом 15 місяців до аналізу LTB4 і включень зворотно-фазовою HPLC, як описано в Прикладі 1. Результати На Фігурі 4 чітко показано, що підвищення рН водних ізотонічних розчинів Na солі LTB4 при 17,5мкг/мл значно підсилює стабільність LTB4, що видно по зниженню рівня включень, який визначали в зразках аналізом HPLC. Цей вплив лужної рН на стабільність розчинів Na солі LTB4 при 23 17,5мкг/мл набагато більш очевидний при 20°С, чим при 4°С, подібні розчини показали дуже незначну деградацію LTB4 після 15 місяців зберігання. Ці дані разом з даними, приведеними на Фігурі 3, показують, що вплив лужної рН на стабілізацію чітко спостерігається в розчинах Na солі LTB4 при 1,75мг/мл, а також 17,5мкг/мл, отже, вплив лужної рН на стабілізацію відбувається в широкому діапазоні концентрацій LTB4. ПРИКЛАД 5 Матеріали і способи Водні ізотонічні розчини Na солі LTB4 при концентраціях 35 та 350мкг/мл у фосфатнобуферному сольовому розчині (3мМ натрій фосфатний буфер, рН 9,5), що містить 0,01% EDTA і різні концентрації гліцину (від 0,01мМ до 10мМ), одержали розчиненням 25мг/мл розчину Na солі LTB4 (Приклад 2). Розчини Na солі LTB4 при 35 та 350мкг/мл з 4 різними концентраціями гліцину розлили в 2мл ампули для зберігання на повітрі у темноті при 40 ± 5°С протягом 5 місяців до аналізу LTB4 і включень зворотно-фазовою HPLC, як описано в Прикладі 1. Результати У цьому експерименті розчин Na солі LTB4 при 35мкг/мл, рН 7,5, що містить 10мМ гліцину і зберігається 5 місяців при 40°С, показав рівень включень 20% (дані не показані). На Фігурі 5 показано, що подібний розчин Na солі LTB4 при 35мкг/мл, а не при рН 9,5, був більш стабільний, як визначили по більш низькому рівню включень (6,5%), та чітко показано, що концентрація гліцинового буфера, що змінюється від 0,01мМ до 10мМ, виявляла невеликий вплив на стабільність розчинів Na солі LTB4. Дуже схожі спостереження зробили в розчинах Na солі LTB4 при 350мкг/мл, рН 9,5, що зберігаються 5 місяців при 40°С, з 4 різними концентраціями гліцину. ПРИКЛАД 6 Матеріали і способи Водні ізотонічні розчини Na солі LTB4 з концентрацією 35мкг/мл у фосфатно-буферному сольовому розчині (3мМ натрій фосфатний буфер, рН 7,5 або 9,5), що містить 0,01% EDTA, одержали, як описано в Прикладі 5. В усі розчини додали маніт до остаточної концентрації 4% для утворення при ліофілізації твердого залишку (манітового осаду), що містить Na сіль LTB4 та усі компоненти наповнювача. До деяких розчинів до остаточної концентрації Імг/мл перед остаточним регулюванням рН (до 7,5 або 9,5) додали людський сироватковий альбумін (HSA, Sigma Chemicals, Сант Луїс, Міссурі) без жирної кислоти (деліпідований). Розчини розлили у 2мл ампули, заморозили при -20°С та ліофілізували. Потім ампули, що містять ліофілізовані розчини (манітові осади), закупорили, як описано в Прикладі 1 (але на повітрі замість аргону), та зберігали у темноті при 40 ± 5°С. Через 1,5 або 4,5 місяці ампули відкрили, манітові осади (що містять LTB4) розчинили в 1мл води для утворення вихідних розчинів Na солі LTB4 при 35мкг/мл. Потім зворотно-фазовою HPLC проаналізували LTB4 та включення, як описано в Прикладі 1. Результати 96257 24 На Фігурі 6 показано, що ліофілізований розчин Na солі LTB4 при 35мкг/мл, рН 7,5, заново розчинений у воді безпосередньо після ліофілізації (час 0), мав рівень включень 2,9%, та що ідентичні ліофілізовані зразки, що зберігалися 1,5 та 4,5 місяці при 40°С, мали рівні включень 22,7% та 51,3%, відповідно. На Фігурі 6 також показано, що додавання HSA до розчину Na солі LTB4 (рН 7,5) перед ліофілізацією приводить до зниження приблизно на 50% рівня включень через 1,5 місяця зберігання. На Фігурі 6 також чітко показано, що підвищення рН від 7,5 до 9,5 у розчинах LTB4 перед ліофілізацією приводить до значного зниження рівня включень, як спостерігалося і через 1,5 місяця зберігання (у присутності HSA), і через 4,5 місяці зберігання. Ці дані чітко показують, що лужна рН також підсилює стабільність Na солі LTB4 у твердій формі, тобто після ліофілізації, у присутності маніту та у присутності або відсутності HSA. ПРИКЛАД 7 Матеріали і способи Розчин LTB4 у етанолі (кислотна форма) (EtOH/вода, 95/5), отриманий від виробника (Cascade Biochem, Великобританія), розбавили розчином EtOH/вода, 95/5, для утворення розчину LTB4 у етанолі (кислотна форма) при 9 та 0,9мг/мл. Розчин натрієвої солі LTB4 у етанолі при 9 та 0,9 мг/мл одержали шляхом додавання 1,05 еквівалента гідроксиду натрію. Розчини натрієвої солі LTB4 з концентраціями 9 та 0,9мг/мл у 75/25 у розчині EtOH/10мМ гліцину у воді при рН 10,5 (гідроксид натрію) одержали шляхом змішування 3 об'ємів розчинів натрієвої солі LTB4 при 12 та 1,2мг/мл у розчині EtOH/вода, 95/5, з 1 об'ємом 40мМ гліцинового буфера при рН 10,5. Розчини розлили у 2мл ампули для зберігання на повітрі у темноті при -80°С та 40 + 5°С протягом 17 місяців до аналізу LTB4 та включень зворотно-фазовою HPLC, як описано в Прикладі 1. Результати На Фігурі 7 показані результати вивчення змушеної деградації розчину LTB4 у етанолі (кислотна форма) або Na солі LTB4 при 2 різних концентраціях. Після 17 місяців зберігання при 40°С розчину LTB4 (кислотна форма) у етанолі (EtOH/вода, 95/5) при 9,0мг/мл відбулася повна деградація (LTB4 не визначався) з рівнем включень 100% AUC (площа під кривою при 270нм). На Фігурі 7 чітко показано, що якщо LTB4 перетворений на його натрієву сіль шляхом додавання 1,05 еквівалента гідроксиду натрію, стабільність отриманого розчину Na солі LTB4 у етанолі при однакових умовах значно покращилася з рівнем домішок тільки 5,4%. Подібним чином, вивчення змушеної деградації розчину натрієвої солі LTB4 у 75/25 EtOH 10мМ гліцину, рН 10,5, показало, що при лужній рН натрієва сіль LTB4 більш стабільна (рівень домішок 3,8%), чим LTB4 у його кислотній формі в розчині EtOH/вода, 95/5. Такі ж висновки можна зробити для розчинів LTB4 (кислотна форма) і натрієвої солі LTB4 при концентрації в 10 разів меншої (0,9 мг/мл), натрієвої солі LTB4 у розчині EtOH/вода, 95/5, з підвищеною стабільністю або в розчині EtOH/10мМ гліцин, 75/25, рН 10,5 (рівні домішок 4,9 та 4,3% AUC, відповідно), у порівнянні з кислотною формою LTB4 у 25 96257 розчині EtOH/вода, 95/5 (рівень домішок 62% AUC). Рівні домішок, визначені в 3 однакових формуляціях LTB4 у етанолі при 9 та 0,9 мг/мл, що зберігали при -80°С 17 місяців, варіювали від 2,8 до 3,7% AUC (дані не показані). У Таблиці 1, нижче, приведені значення рН, визначені у формуляціях LTB4 у етанолі, що зберігали 17 місяців при 80°С та 40°С. Дані чітко показують, що підвищена 26 стабільність дійсно відповідає більш високій рН формуляцій. Нарешті, на Фігурі 7 також показано, що за аналогією зі спостереженнями, проведеними у водних розчинах Na солі LTB4, більш концентрований (9мг/мл) розчин LTB4 у EtOH/вода, 95/5, менш стабільний, чим більш розведений (0,9 мг/мл) розчин LTB4 при однакових умовах експерименту. Таблиця 1 1 рН , що спостерігається у формуляціях LTB4 у етанолі Формуляція 9 мг/мл, кислотна форма в EtOH/вода, 95/5 9 мг/мл, натрієва сіль у EtOH/вода, 95/5 3 9 мг/мл, натрієва сіль у EtOH/буфер , 75/25 0,9 мг/мл, кислотна форма в EtOH/вода, 95/5 0,9 мг/мл, натрієва сіль у EtOH/вода, 95/5 3 0,9 мг/мл, натрієва сіль у EtOH/буфер , 75/25 -80°С 2 7,08 10,15 12,54 7,25 9,80 10,77 +40°С 5,27 9,68 10,07 5,26 9,77 10,17 1 рН виміряли за допомогою малогабаритного рН-метра "Fisher Scientific Accumet" з комбінованим електродом, при кімнатній температурі. 2 рН виміряли після 17 місяців зберігання при зазначених температурах. 3 10мМ гліцин/NaOH, рН 10,5. ПРИКЛАД 8 Матеріали і способи LTB4 та аналоги одержали в кислотній формі як розчини в етанолі. LTB4 одержали від Cascade Biochem (Великобританія), LTB5 одержали від Biomol (Plymouth Meeting, PA, США), а всі інші сполуки (LTB3, трифтор-LТВ4, 20-гідрокси-LТВ4 та 5-НЕТЕ) одержали від Cayman Chemicals (Ann Arbor, MI, США). Розчин натрієвої солі різних LTB4 агентів в етанолі (LTB4 та аналоги) одержали додаванням 1 еквівалента гідроксиду натрію. Розчин натрієвої солі LTB4 агентів в етанолі випарили насухо в потоці азоту та заново розчинили з концентрацією ~ 35мкг/мл у фосфатному буферному сольовому розчині (30мМ), що містить 10мМ гліцину, 0,01% EDTA, рН відрегулювали гідроксидом натрію до 7,5 або 9,5. Для негайного аналізу (t 0) взяли аліквоти розчинів, а розчини Na солі LTB4 агента при 35мкг/мл, що залишилися, розлили у 2мл ампули для зберігання на повітрі у темноті при 40 + 5°С шість місяців до аналізу LTB4 агентів та включень зворотно-фазовою HPLC, як описано в Прикладі 1. Результати У цьому експерименті різні розчини натрієвої солі LTB4 агентів при 35мкг/мл показали вихідний (t0) рівень домішок, що варіює від 2% до 15%, як показано на Фігурі 8 (незабарвлені стовпчики). На Фігурі 8 показано, що рівні домішок у всіх розчинах LTB4 агента, що зберігаються шість місяців при 40°С при рН 7,5, значно підвищені (сірі стовпчики). На Фігурі 8 також показано, що розчини однакових LTB4 агентів, що зберігали шість місяців при 40°С, але при більш високій рН 9,5, значно більш стабільні, що видно з більш низьких рівнів домішок усіх розчинів (чорні стовпчики). ПРИКЛАД 9 Матеріали і способи LTB4 та аналоги одержали в кислотній формі у вигляді розчинів в етанолі. Енантіомерну форму LTB4 одержали від Cascade Biochem (Великобританія), а всі інші сполуки (6-trans-LTB4, 12-eпi-LTB4 та 6-trans-12-eпi-LTB4) одержали від Cayman Chemicals (Ann Arbor, MI, США). Розчин натрієвої солі різних LTB4 агентів (LTB4 та аналоги) у етанолі одержали додаванням 1 еквівалента гідроксиду натрію. Розчин натрієвої солі LTB4 агентів в етанолі випарили насухо в потоці азоту та заново розчинили з концентрацією ~ 35мкг/мл у фосфатному буферному сольовому розчині (30мМ), що містить 10мМ гліцину, 0,01% EDTA, за допомогою гідроксиду натрію рН довели до 7,5 або 9,5. Взяли аліквоти розчинів для негайного аналізу (t0), а розчини Na солі LTB4 агента, що залишилися, при 35мкг/мл розлили у 2мл ампули для зберігання на повітрі у темноті при 40 + 5 °С шість місяців до аналізу LTB4 агентів та включень зворотнофазовою HPLC, як описано в Прикладі 1. Результати У цьому експерименті різні розчини натрієвої солі LTB4 агентів при 35мкг/мл показали вихідний (t0) рівень домішок 2% - 5%, як представлено на Фігурі 9 (незабарвлені стовпчики). На Фігурі 9 показано, що рівні домішок у всіх розчинах LTB4 агента, що зберігали шість місяців при 40°С при рН 7,5, значно підвищилися (сірі стовпчики). Також на Фігурі 9 показано, що розчини однакових LTB4 агентів, що зберігали шість місяців при 40°С, але при рН вище, ніж 9,5, значно більш стабільні, про що говорять більш низькі рівні домішок усіх розчинів (чорні стовпчики). ПРИКЛАД 10 Матеріали і способи Розчин LTB4 (кислотна форма) у етанолі, отриманий від Cascade Biochem (Великобританія), нейтралізували додаванням 1 еквівалента гідроксиду натрію для утворення натрієвої солі LTB4. 27 Аліквоти розчину натрієвої солі LTB4 в етанолі розлили у 2мл ампули (по 2мг LTB4 в ампулу), а розчинник випарили насухо в потоці азоту. Залишки в ампулах розчинили 0,9% хлоридом натрію (NaCl) (ампула 1), 0,9% NaCl у 0,1 мN NaOH (ампула 2), 0,9% NaCl у 1 мN NaOH (ампула 3), 0,9% NaCl у 10 мN NaOH (ампула 4), 0,3% NaCl у 0,1Ν NaOH (ампула 5) та у 1N NaOH (ампула 6). Аліквоти розчинів взяли для негайного аналізу (t0), а розчини натрієвої солі LTB4 при 2 мг/мл, що залишились, зберігали на повітрі у темноті при 40 ± 5°С протягом п'яти тижнів до аналізу LTB4 та включень зворотно-фазовою HPLC, як описано в Прикладі 1. Результати На Фігурі 10 приведені результати вивчення змушеної деградації водних розчинів натрієвої солі LTB4 при концентраціях гідроксиду натрію, що підвищуються (рН, що підвищується). Отримані дані показують, що натрієва сіль LTB4 цілком деградувала з рівнями домішок 100% (LTB4 не визначили) в ампулах 1 та 2, де рН опустилася до значень нижче 5 після п'яти тижнів зберігання при 40°С. Навпаки, в ампулах 3 - 6, де остаточна рН (після п'яти тижнів) складала 8,02, 9,83, 12,50 та 13,03, відповідно, рівні домішок складали 5,34, 3,46, 4,38 та 5,77 (% AUC 270нм), відповідно. Вихідні рівні домішок (при t0) варіювали від 2,65% до 3,35%. Ці дані чітко показують, що розчини натрієвої солі LTB4 стабілізувалися при лужній рН, у дуже широкому діапазоні рН, у відсутності і буфера, і хелатоутворюючого агента. ПРИКЛАД 11 У цьому прикладі досліджувалися фармакокінетичні параметри LTB4 на щурах після введення трьома різними способами, внутрішньовенно (i.v.), усередину тонкої кишки (i.j.) та підшкірно (s.c). Використовували три групи з трьох самок щурів Sprague-Dawley (вагою ~250г); тварини голодували протягом 18 годин, їх анестезували кетамін/ксилазином, у яремні вени їм ввели канюлі для постійного забору зразків крові. LTB4 вводили дозою 50мкг/кг на дозу об'ємом 4мл/кг для усіх способів введення. Зразки крові (0,5мл/зразок) відбирали через 0, 0,5, 1, 2, 5, 15, 30 та 60 хвилин після ін'єкції LTB4. Зразки крові відразу ж антикоагулювали EDTA та перенесли в крижану водяну баню до центрифугування для виділення плазми. Зразки плазми зберігали при -80°С до аналізу на вміст 96257 28 LTB4 за допомогою комерційного твердофазного иммуноферментного аналізу (ELISA) (Cayman Chemicals, Ann Arbor, MI, США). Внутрішньовенне введення (15 сек. болюс) LTB4 виконали через хвостову вену; при введенні усередину тонкої кишки LTB4 прямо ввели в тонку кишку після розтину абдомінальної порожнини; підшкірне уведення виконали в області спини. На Фігурі 11А наведені фармакокінетичні параметри після i.j. введення щурам LTB4 дозою 50мкг/кг. Дані показують, що концентрація LTB4 у плазмі швидко збільшується у щура після i.j. ін'єкції, досягаючи максимального рівня через 5 хвилин після i.j. введення; дані також показують, що рівні LTB4 у плазмі повертаються до вихідних рівнів через 30 хвилин після i.j. введення. Ці дані чітко показують, що LTB4 ефективно переноситься з тонкої кишки в периферичний кровотік. На Фігурі 11В приводиться порівняння площі під кривої (AUC) (для концентрації LTB4 у плазмі) для трьох різних способів введення. У цьому випадку фармакокінетичний параметр AUC показує системний вплив лікарського засобу. Як і передбачалося, пряме введення LTB4 у кровотік (i.v. ін'єкція) приводить до найвищої AUC. Крім того, ці дані чітко показують, що AUC LTB4 після i.j. ін'єкції досягає 35% від i.v. введеного LTB4, демонструючи, що при i.j. введенні, відбувається ефективне поглинання LTB4 у кровотоку. Ці дані також означають, що пероральне введення LTB4 за допомогою відповідної формуляції для доставки в тонку кишку представляє ефективний спосіб системного введення лікарського засобу. Для порівняння наведена AUC при s.c. введенні LTB4. Підшкірне введення відоме в даній галузі як ефективний спосіб введення LTB4 на моделях щурів. Тоді як, даний винахід описаний стосовно до специфічних варіантів його здійснення, буде зрозуміло, що можливі додаткові модифікації, а дана заявка призначена охопити будь-які варіанти, застосування або адаптації даного винаходу, що випливають, загалом, з принципів даного винаходу, і включають відступи від даного опису, які попадають під відомі або традиційні методики в галузі, до якої належить даний винахід, можуть бути застосовані до вищезгаданих особливостей та знаходяться в об'ємі формули винаходу. 29 96257 30 31 96257 32 33 96257 34 35 96257 36 37 96257 38 39 96257 40 41 96257 42 43 96257 44 45 Комп’ютерна верстка Л. Купенко 96257 Підписне 46 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюStabilized leukotriene b4 (ltb4) agent pharmaceutical formulation
Автори англійськоюBorgeat Pierre
Назва патенту російськоюСтабилизированная фармацевтическая композиция лейкотриен-b4 (ltb4) агента
Автори російськоюБоржа Пьер
МПК / Мітки
МПК: A61K 47/02, A61K 47/10, A61K 31/557
Мітки: ltb4, фармацевтична, лейкотриєн-b4, композиція, стабілізована, агента
Код посилання
<a href="https://ua.patents.su/23-96257-stabilizovana-farmacevtichna-kompoziciya-lejjkotriehn-b4-ltb4-agenta.html" target="_blank" rel="follow" title="База патентів України">Стабілізована фармацевтична композиція лейкотриєн-b4 (ltb4) агента</a>
Попередній патент: Трубчастий виріб та спосіб його виготовлення
Наступний патент: Пакувальний виріб, упаковка і спосіб, що забезпечують або зберігають бажаний колір м’ясопродукту
Випадковий патент: Спосіб проведення лотереї "тв-приз" і лотерейний білет для його здійснення