Системи та способи для уловлювання і фіксації газів та композиції, які таким чином можна отримати
Формула / Реферат
1. Спосіб фіксації парникового газу, який передбачає:
(і) отримання розчину, який містить перший реагент, який здатний взаємодіяти з парниковим газом;
(іі) контакт розчину з парниковим газом за умов, які підтримують взаємодію між першим реагентом і парниковим газом, щоб отримати щонайменше перший реагент;
(ііі) отримання пористої матриці, в якій є внутрішньопоровий простір, і яка містить щонайменше другий реагент;
(iv) забезпечення просочування розчину, який містить щонайменше перший реагент щонайменше в значній частині внутрішньопорового простору пористої матриці за умов, які підтримують взаємодію щонайменше між першим реагентом і щонайменше другим реагентом, щоб отримати щонайменше перший продукт; і
(v) забезпечення отримання щонайменше першого продукту із заповненням щонайменше частини внутрішнього простору пористої матриці, і таким чином, фіксації парникового газу.
2. Спосіб за п. 1, який відрізняється тим, що парниковий газ містить діоксид вуглецю.
3. Спосіб за п. 1, який відрізняється тим, що парниковий газ містить хімічний елемент сірку, фосфор, азот або поєднання перерахованого.
4. Спосіб за п. 1, який відрізняється тим, що тверда матриця після стадії (v) має такий же молярний об'єм, як до стадії (v).
5. Спосіб за п. 1, який відрізняється тим, що тверда матриця після стадії (v) має молярний об'єм більший, ніж до стадії (v).
6. Спосіб за п. 1, який відрізняється тим, що тверда матриця після стадії (v) має молярний об'єм менший, ніж до стадії (v).
7. Спосіб за п. 1, який відрізняється тим, що тверда матриця після стадії (v) має щільність більшу, ніж до стадії (v).
8. Спосіб за п. 1, який відрізняється тим, що парниковий газ утворюється на заводі.
9. Спосіб за п. 1, який відрізняється тим, що другий реагент містить оксид металу, гідроксид металу, сульфат металу, фторид металу, титанат металу або поєднання перерахованого.
10. Спосіб за п. 1, який відрізняється тим, що перший реагент містить оксалат, карбонат, сульфат, фосфат, цитрат, іон металу або поєднання перерахованого.
11. Спосіб за п. 1, який відрізняється тим, що перший продукт утворюється шляхом осадження.
12. Спосіб за п. 1, який відрізняється тим, що перший продукт містить карбонат кальцію.
13. Спосіб за п. 1, який відрізняється тим, що перший продукт містить карбоксилат.
14. Спосіб за п. 1, який відрізняється тим, що перший продукт містить карбонат металу, оксалат металу або поєднання перерахованого.
15. Спосіб за п. 1, який відрізняється тим, що перший продукт має температуру розкладання щонайменше біля 1000 °C.
16. Спосіб за п. 1, який відрізняється тим, що перший продукт має мікроструктуру взаємно зв'язаних решіток.
17. Спосіб за п. 1, який відрізняється тим, що перший продукт знаходиться у обводненому вигляді.
18. Спосіб за п. 1, який відрізняється тим, що здійснюється за температури приблизно нижчої ніж 300° С.
19. Спосіб за п. 1, який відрізняється тим, що здійснюється за кімнатної температури.
20. Кераміка, отримана шляхом зв'язування вуглецю, в способі фіксації вуглецю, або поєднання перерахованого, причому спосіб включає забезпечення взаємодії щонайменше одного компонента пористої матриці щонайменше з першим реагентом, який транспортується середовищем, що просочується, з отриманням щонайменше першого продукту, причому в ході цієї реакції решта частини пористої матриці діє як засіб розміщення для полегшення утворення першого продукту з реакційної суміші, і таким чином, отримується кераміка.
21. Кераміка за п. 20, яка відрізняється тим, що не містить гідравлічних зв'язків,
22. Кераміка за п. 20, яка відрізняється тим, що кераміка містить головним чином керамічні зв'язки.
23. Кераміка за п. 20, яка відрізняється тим, що кераміка і тверда матриця мають практично однакову форму.
24. Кераміка за п. 20, яка відрізняється тим, що кераміка має температуру розкладання щонайменше біля 1000 °C.
25. Кераміка за п. 20, яка відрізняється тим, що кераміка має температуру розкладання щонайменше біля 2000 °C.
26. Кераміка за п. 20, яка відрізняється тим, що перший продукт отримують шляхом іонного заміщення, приєднання іона, диспропорціонування або поєднання перерахованого.
27. Кераміка за п. 20, яка відрізняється тим, що перший продукт отримують шляхом осадження.
28. Кераміка за п. 20, яка відрізняється тим, що кераміка є цементом.
29. Спосіб за п. 20, який відрізняється тим, що перший продукт містить карбоксилат.
30. Спосіб отримання кераміки, який передбачає:
(і) отримання пористої, матриці, яка має внутрішньопоровий простір і яка містить щонайменше перший реагент;
(іі) контакт пористої матриці з середовищем, що просочується, і яке транспортує щонайменше другий реагент, який містить парниковий газ;
(ііі) забезпечення інфільтрації середовища, що просочується щонайменше до частини внутрішнього простору пористої матриці за умов, які підтримують реакцію щонайменше між першим реагентом і щонайменше другим реагентом, щоб отримати щонайменше перший продукт; і
(iv) забезпечення утворення щонайменше першого продукту із заповненням щонайменше частини внутрішнього простору пористої матриці, і таким чином, отримання кераміки
причому в цьому способі споживається і не виділяється значна кількість парникового газу.
31. Спосіб за п. 30, який відрізняється тим, що стадії (іі) - (iv) повторюють щонайменше один раз.
32. Спосіб за п. 30, який відрізняється тим, що кераміка не має гідравлічних зв'язків.
33. Спосіб за п. 30, який відрізняється тим, що парниковий газ отримують на заводі.
34. Спосіб за п. 30, який відрізняється тим, що кераміка практично не має тріщин.
35. Спосіб фіксації парникових газів, який передбачає:
(і) отримання розчину, що переносить щонайменше один парниковий газ як перший реагент;
(іі) отримання пористої матриці, яка має внутрішньопоровий простір і яка містить щонайменше другий реагент;
(ііі) забезпечення просочування розчину, який містить щонайменше перший реагент щонайменше до значної частини внутрішньопорового простору пористої матриці за умов, які підтримують взаємодію щонайменше між першим реагентом і щонайменше другим реагентом, щоб отримати щонайменше перший продукт; і
(iv) забезпечення отримання щонайменше першого продукту із заповненням щонайменше частини внутрішнього простору пористої матриці, і таким чином, фіксації парникового газу.
36. Спосіб за п. 35, який відрізняється тим, що парниковий газ розчиняється в розчині.
Текст
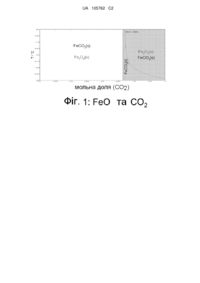
Реферат: Описаний спосіб фіксації парникового газу, який включає: (і) отримання розчину, який містить перший реагент, що здатний взаємодіяти з парниковим газом; (іі) контакт розчину з парниковим газом за умов, які підтримують взаємодію щонайменше між першим реагентом і парниковим газом, щоб oтримати щонайменше перший реагент; (ііі) отримання пористої матриці, в якій є внутрішньопоровий простір, і яка містить щонайменше один другий реагент; (iv) забезпечення просочування розчину, що містить щонайменше перший реагент щонайменше до значної частини внутрішньопорового простору пористої матриці за умов, які підтримують взаємодію щонайменше між першим реагентом і щонайменше другим реагентом, щоб отримати щонайменше перший продукт; і (v) забезпечення отримання щонайменше першого продукту із заповненням щонайменше частини внутрішнього простору пористої матриці і, таким чином, відбувається зв'язування парникового газу. UA 105762 C2 (12) UA 105762 C2 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рівень техніки Широкого визнання набули запропоновані теорії, які пов'язують глобальне потепління, яке привертає все більшу увагу, із виділенням діоксиду вуглецю, - парникового газу. У 2004 р. глобальне виділення діоксиду вуглецю склало 49 мільярдів тонн, що на 80 % більше в порівнянні з рівнем 1970 р. Тільки у США викиди діоксиду вуглецю в 2005 р. склали 6,0 мільярдів метричних тонн. Виробництво матеріалів в будівельній промисловості, таких як сталь і цемент, генерує діоксид вуглецю, разом з іншими токсичними і/або парниковими газами, на досить значному рівні. За оцінкою Агентства з Охорони довкілля в 2002 р. виробництво цементу давало внесок 5 мас. % до світового обсягу виділення діоксиду вуглецю і у поєднанні з виробництвом сталі було найбільш значним джерелом діоксиду вуглецю. Виділення діоксиду вуглецю характеризується трьома компонентами: по-перше, розкладання вапняку, де карбонат кальцію прожарюють (нагрівають) з утворенням CаO. По-друге, потрібна енергія (приблизно 5 мільйонів BTU на 1 метричну тонну цементу або 5,27 МДж/т) для проведення (нагрівання) ендотермічного розкладання вапняку. По-третє, потрібна електроенергія для роботи технологічного устаткування, такого як обпалювальна піч, що обертається та устаткування для розмелювання. У результаті, при виробництві кожної тонни цементу виділяється 1,08 тонни діоксиду вуглецю. Крім того, традиційне виробництво кераміки включає високотемпературні процеси, такі як кальцинування і спікання. Часто вихідні матеріали приводять в реакційноздатний стан для виробництва матеріалів за допомогою процесу отримання порошків, такого як розмелювання, де часточки кераміки, які називаються клінкером в цементній промисловості, подрібнюють в діапазоні від сантиметрів до мікронного розміру. Навіть такі процеси є вельми енергоємними. У 1980 р., в процесах розмелювання реагентів для отримання кераміки витрачалося приблизно 0,5 % від загальнонаціонального споживання енергії. Таким чином, існує необхідність розробки вдосконалених систем і/або способів отримання кераміки, в яких також можна мінімізувати зону залучення вуглецю, або навіть уловлення і/або зв'язування парникових газів, які утворюються при виробництві. Крім того, залишається бажаним уловлювання діоксиду вуглецю з димових газів після згорання (УДПЗ). Наприклад, такі проблеми як протитиск можуть обмежувати продуктивність енергетичної установки. Крім того, процес уловлювання часто обмежений умовами згорання, які визначаються хімією спалюваного палива, а також обраними умовами спалювання. Наприклад, в способах уловлювання на основі аміну, для високої ефективності уловлювання діоксиду вуглецю потрібна нижча температура, що підвищує витрати енергії на охолодження димових газів і зону залучення CO2 пов'язану з енергією. Таким чином, існує потреба в розробці способу, який може експлуатуватися в широкому діапазоні умов згорання палива, без якого-небудь погіршення ефективності процесу виробництва з використанням такого способу згорання, з економічно доцільним видаленням всього CO2 в газоподібному потоці, споживання CO2 з урахуванням всіх внесків у виділення CO2, технологічних матеріалів, з відшкодуванням витрат за рахунок продажу предметів споживання, і надходженням CO2 в розчиненому вигляді. Розкриття винаходу У одному варіанті винаходу запропоновано спосіб фіксації парникових газів, який передбачає: (i) отримання розчину, який містить перший реагент, який здатний взаємодіяти з парниковим газом; (ii) контакт розчину з парниковим газом за умов, які підтримують взаємодію, щонайменше, між першим реагентом і парниковим газом, щоб отримати, щонайменше, перший реагент; (iii) отримання пористої матриці, в якій є внутрішньопоровий простір, і яка містить, щонайменше, один другий реагент; (iv) забезпечення просочування розчину, який містить, щонайменше, перший реагент, щонайменше, крізь значну частину внутрішньопорового простору пористої матриці за умов, які підтримують взаємодію, щонайменше, між першим реагентом і, щонайменше, другим реагентом, щоб отримати, щонайменше, перший продукт; і (v) забезпечення отримання, щонайменше, першого продукту із заповненням, щонайменше, частини внутрішнього простору пористої матриці, і таким чином, відбувається зв'язування парникового газу. Взаємодія може включати, наприклад, розчинення, приєднання іона, іонне заміщення, осадження, диспропорціонування, або поєднання перерахованого. У іншому варіанті винаходу пропонується кераміка, отримана із застосуванням процесу захоплення вуглецю, зв'язування вуглецю або поєднання перерахованого, причому цей процес включає забезпечення взаємодії, щонайменше, одного компоненту пористої матриці, щонайменше, з першим реагентом, який транспортується середовищем, що просочується, з отриманням, щонайменше, першого продукту, причому в ході цієї реакції решта частини пористої матриці діє як засіб розміщення, для полегшення утворення першого продукту з 1 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 реакційної суміші, і таким чином, отримується кераміка. У іншому варіанті винаходу розроблений спосіб отримання кераміки, який передбачає: (i) отримання пористої матриці, яка має внутрішньопоровий простір і яка містить, щонайменше, перший реагент; (ii) контакт пористої матриці з середовищем, що просочується, і яке транспортує, щонайменше, другий реагент, який містить парниковий газ; (iii) забезпечення інфільтрації середовища, що просочується, щонайменше, в частину внутрішнього простору пористої матриці за умов, які підтримують реакцію, щонайменше, між першим реагентом і, щонайменше, другим реагентом, щоб отримати, щонайменше, перший продукт; і (iv) забезпечення утворення, щонайменше, першого продукту із заповненням, щонайменше, частини внутрішнього простору пористої матриці, і таким чином, отримується кераміка, причому в цьому способі споживається (і не виділяється) значна кількість парникового газу. У одному варіанті винаходу запропонований цемент, який практично не містить гідравлічного зв'язку. Термін гідравлічний зв'язок зазвичай може відноситися до зв'язку за участю води, такого як зв'язок, який включає, щонайменше, одну молекулу води або її частину. Наприклад, він може бути водневим зв'язком. У іншому варіанті винаходу розкрита кераміка, яка включає керамічний зв'язок, де кераміка містить мікроструктуру із зв'язаною мережею сполук. Зазвичай термін керамічний зв'язок може відноситися до хімічного зв'язування або між металом і неметалом, або між неметалом і неметалом, з ковалентним, іонним, або змішаним іонно-ковалентним типом зв'язування. У кращому варіанті хімічного зв'язування, істотну роль відіграє осадження речовини в суміжній пористій структурі, при цьому воно не базується на силах ван дер Ваальса або на водневих зв'язках. Мікроструктура із зв'язаною мережею сполук зазвичай може відноситися до мікроструктури, яка має деяку пористість і/або канали, які зв'язані між собою і доступні з поверхні. Короткий опис креслень На Фігурі 1 представлена фазова діаграма FEO на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі гідротермального спікання рідкої фази (HLPS) в одному варіанті здійснення. На Фігурі 2 представлена фазова діаграма Ca(OH)2 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 3 представлена фазова діаграма FeTiO 3 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 4 представлена фазова діаграма Fe3O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 5 представлена фазова діаграма Fe3O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. Приведені результати термодинамічних розрахунків для CaSO4 і K2CO3. На Фігурі 6 представлена фазова діаграма Ca(OH) 2 і K2CO3 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 7 представлена фазова діаграма CaSO4 і C2H2O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 8 представлена фазова діаграма MGO і C2H2O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 9 представлена фазова діаграма Ca(OH) 2 і C2H2O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 10 представлена фазова діаграма CaSO4 і K2С2O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 11 представлена фазова діаграма Ca(OH) 2 і K2С2O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 12 представлена фазова діаграма CaCO3 і H2C2O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в 2 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 одному варіанті здійснення. На Фігурі 13 представлена фазова діаграма для 0,1 молів CaCO 3 і K2С2O4 на основі термодинамічних розрахунків, проведених для обраних реагуючих часток, які використовуються в процесі HLPS в одному варіанті здійснення. На Фігурі 14 приведена залежність ступеню розкладання CaCO 3 від pH в одному варіанті здійснення. На Фігурі 15 приведена залежність ступеню розкладання CaC2O4 від pH в одному варіанті здійснення. Докладний опис винаходу Всі процитовані джерела повністю включено до опису даного винаходу як посилання. Загальні умови для гідротермального спікання рідкої фази У кращому варіанті здійснення гідротермального спікання рідкої фази (HLPS), "сира" або частково спечена, пориста, тверда матриця, яка має сполучені занурені пори, може бути перетворена на спечену кераміку під дією середовища рідкої фази, що просочується. Процес HLPS може бути здійснений за відносно м'яких умов, які часто за температурою і тиском не перевищують ті, які виникають в працюючому автоклаві. Процес HLPS може бути здійснений в широкому діапазоні температур і тисків. Наприклад, в деяких варіантах здійснення умови HLPS можуть передбачати температуру приблизно нижчу, ніж 2000 °C, таку, як приблизно нижча, ніж 1000 °C, таку, як приблизно нижча, ніж 500 °C, таку, як приблизно нижча, ніж 200 °C, таку, як приблизно нижча, ніж 100 °C, таку, як приблизно нижча, ніж 50 °C, таку, як кімнатна температура. Тиск в реакції приблизно може бути нижчим, ніж 100000 фунт/кв. дюйм (700 МПа), такий як менше 70000 фунт/кв. дюйм, такий, як приблизно нижчий, ніж 50000 фунт/кв. дюйм, такий, як приблизно нижчий, ніж 10000 фунт/кв. дюйм, такий, як приблизно нижчий, ніж 5000 фунт/кв. дюйм, такий, як приблизно нижчий, ніж 1000 фунт/кв. дюйм, такий, як приблизно нижчий, ніж 500 фунт/кв. дюйм, такий, як приблизно нижчий, ніж 100 фунт/кв. дюйм, такий, як приблизно нижчий, ніж 50 фунт/кв. дюйм, такий, як приблизно нижчий, ніж 10 фунт/кв. дюйм. У одному варіанті здійснення процес гідротермального спікання може бути проведений за температури в діапазоні приблизно від 80 °C до 180 °C і тиску в діапазоні приблизно від 1 до 3 атмосфер (1 атм приблизно дорівнює 15 фунт/кв. дюйм). Теоретично, будь-який вихідний матеріал, який здатний вступати в гідротермальну взаємодію з частинками, що просочилися, з утворенням іншої речовини, може бути використаний для отримання гідротермально спеченого продукту. Тому можуть бути вибрані численні вихідні матеріали, залежно від передбачуваного варіанта кінцевого використання, сформовані в пористу тверду матрицю, яка має бажану форму і розмір, і в подальшому їх обробляють на стадіях даного способу для перетворення на спечений кінцевий продукт. У одному варіанті здійснення пориста тверда матриця проведена з порошку оксиду металу. Цей порошок може бути аморфним або кристалічним, бажано кристалічним. Більш того, порошок оксиду металу може мати розмір дисперсних часток в широкому діапазоні від середнього розміру часток, приблизно, 0,01 мікрон до 100 мікрон, зокрема, наприклад, приблизно, від 0,02 до 50 мікрон, такий, як приблизно, від 0,04 до 20 мікрон, такий як, приблизно, від 0,08 до 10 мікрон. У одному варіанті здійснення порошок має середній розмір часток, приблизно, в діапазоні від 0,1 до 5 мікрон. Метал в оксиді металу може бути вибраний з поміж оксиду металу групи IIa, металу групи IIb, металу групи IIIb, металу групи IVb, металу групи Vb, перехідного металу, лантанідного металу, актинідного металу або їх сумішей. Бажано, вибраний оксид металу або спечений кінцевий продукт може мати потенційне застосування в галузі хімії, кераміки, як магнітний, електронний, надпровідний, як механічний і структурний матеріал, або навіть в галузі біології. Спечений кінцевий продукт може бути застосованим у промисловості або побуті. Кінцевий продукт не повинен обов'язково містити такий же матеріал, що і реагенти. Наприклад, може бути отриманий продукт, практично вільний від титанату барію, BaTiO3, з реагентів, які містять барій і/або титан. Проте в інших варіантах здійснення реагент (реагенти), який містить барій і/або титан, може діяти, головним чином як проміжна реакційна сполука, і, таким чином, необов'язково, щоб він входив до складу кінцевого продукту. Описаний тут "гідротермальний процес" може включати перетворення, які відбуваються у водному або неводному рідкому середовищі. Більше того, такі перетворення можуть включати розчинення і повторне осадження таких же хімічних часток, розчинення однієї хімічної часточки та її з'єднання з іншою хімічною частинкою, з утворенням композиційного матеріалу, в якому вихідні хімічні часточки залишаються окремими, або взаємодія хімічної часточки з іншою хімічною частинкою, щоб отримати новий хімічний компонент, який відрізняється від вихідної часточки. Таким чином, в процесі гідротермального спікання може заповнюватися 3 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 внутрішньопоровий простір або порожнини в пористій твердій матриці компонентом за рахунок осадження (або повторного осадження), приєднання іона, іонного заміщення, або поєднання перерахованого. Цей компонент може містити такі ж хімічні часточки, що і в твердій матриці, композицію, яка утворюється при повторному співосаджувані двох окремих хімічних часток, новий продукт, який утворюється при взаємодії між двома хімічними частинками, повторно осаджений матеріал, добутий з часток, які просочилися і містяться в середовищі, або поєднання перерахованого. У одному варіанті здійснення, процес HLPS може бути здійснений за умов, коли, щонайменше, частина маси сирої пористої твердої матриці взаємодіє із заздалегідь вибраними частинками, що просочилися і є присутніми в плинному середовищі, з метою отримання нового продукту. Процес HLPS Процес гідротермальної реакції може протікати відповідно до реакційного механізму розчинення/повторного осадження. Як альтернатива, взаємодія може відбуватися відповідно до механізму іонного заміщення. У першому механізмі невеликі порції компактної пористої твердої матриці можуть розчиняти, доставляючи розчинені часточки, які можуть взаємодіяти з іонами в розчині, що просочився; причому іони в розчині, що просочився, можуть бути іонами металу. У одному варіанті здійснення додаткова кількість агента, що просочився, може бути достатньою для завершення реакції в одну стадію. Як альтернатива можуть бути залучені багато стадій. Наприклад, може бути задіяна множинна інфільтрація. У одному варіанті здійснення титанат стронцію може утворитися з матриці діоксиду титану, після цього, за рахунок іншої інфільтрації, він може дати стронцієвий апатит. Як альтернатива, в результаті множинної інфільтрації може утворитися карбонат, який потім може утворити захисний шар оксалату. У іншому варіанті винаходу порошкове формування може частково просочитися і висохнути, і стадія інфільтрації може повторюватися, допоки не утворюється кінцевий продукт. Форма продукту може зберігати форму твердої матриці. У одному варіанті здійснення, коли молярний об'єм продукту більший від об'єму оксидного порошку (тобто, позитивна зміна молярного об'єму – тобто, перетворення із збільшенням молярного об'єму), зародки твердого продукту заповнюють порожнечі порошкового формування, що збільшує її щільність. Зміна молярного об'єму не обов'язково є позитивною; вона також може бути негативною (тобто, перетворення із зменшенням молярного об'єму) або без зміни, залежно від іонних часток і механізму реакції. Наприклад, частина матриці може розчинятися в ході реакції із збільшенням пористості, при цьому виникають нові хімічні зв'язки, і зміна молярного об'єму є негативною. Аналогічно, якщо нова форма матеріалу має такий же об'єм, що і перетворена матриця, тоді молярний об'єм практично не змінюється. Реакція HLPS може протікати, наприклад, шляхом приєднання іона і/або іонного заміщення. Реакції приєднання є процесом, в якому іони (аніони або катіони) в середовищі, що просочується, можуть приєднуватися до маси матриці без заміщення іншого іона в матриці. Приклади приєднання іона можуть включати перетворення оксиду на гідроксид, або оксиду на карбонат. Приклади іонного заміщення можуть включати перетворення гідроксиду на карбонат, або гідроксиду на оксалат. Крім того, реакція може протікати шляхом диспропорціонування, коли нерозчинний неорганічний матеріал основи/матриці може розщеплюватися на два нерозчинні неорганічні продукти. Диспропорціонування може здійснюватися, наприклад, з оксидами, фторидами, гідроксидами, сульфатами, змішаними оксидами металів, силікатами, гідроксиапатитами. Крім того, в ході реакції може мати місце гетерогенне зародкоутворення. Як описано раніше, зміна щільності може залежати від типу матеріалу матриці і/або від типу продукту, який утворився. Потім, після завершення гідротермальної реакції, відкриті пори можуть бути видалені, наприклад, шляхом витримування. Після завершення описаних вище реакцій, ущільнена монолітна матриця може бути промита або відмита в розчині з метою видалення надлишку розчину, що просочився. Промиваючий розчин може містити ацетат амонію і мати pH 5. У одному варіанті здійснення ущільнена матриця може бути послідовно висушена в печі за температури приблизно від 90 °C до 250 °C. Залишкова пористість, яка може бути присутньою в спеченій кераміці, може бути додатково видалена шляхом нагрівання за підвищеної температури, такої як, приблизно, 600 °C або нижче. Керамічний продукт, спечений в процесі HLPS, може застосовуватися в різних галузях. Наприклад, цей продукт може бути використаний як структурний, хімічний (наприклад, при каталізі, фільтрації), електронний компонент, як напівпровідниковий матеріал, електричний матеріал, або такий, що поєднує перераховане. 4 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 Отримання пористої твердої матриці Тверда матриця може містити матеріал, який не швидко розчиняється в розчині. В одному варіанті реалізації пориста тверда матриця виготовлена із порошку. Тип порошку може бути будь-яким. Наприклад, це може бути порошок оксиду металу. Приклади придатних порошків оксидів металів можуть включати оксиди берилію (наприклад, BeO), магнію (наприклад, MgO), кальцію (наприклад, CaO, CaO2), стронцію (наприклад, SrO), барію (наприклад, BaO), скандію (наприклад, Sc2O3), титану (наприклад, TiO, TiO2, Ti2O3), алюмінію (наприклад, A12O3), ванадію (наприклад, VO, V2O3, VO2, V2O5), хрому (наприклад, CrO, Cr2O3, CrO3, CrO2), марганцю (наприклад, MnO, Mn2O3, MnO2, Mn2O7), заліза (наприклад, FeO, Fe2O3), кобальту (наприклад, CoO, Co2O3, Co3O4), нікелю (наприклад, NiO, Ni2O3), міді (наприклад, CuO, Cu2O), цинку (наприклад, ZnO), галію (наприклад, Ga2O3, Ga2O), германію (наприклад, GeO, GeO2), олова (наприклад, SnO, SnO2), сурми (наприклад, Sb2O3, Sb2O5), індію (наприклад, In2O3), кадмію (наприклад, CdO), срібла (наприклад, Ag2O), вісмуту (наприклад, Bi2O3, Bi2O5, Bi2O4, Bi2O3, BiO), золота (наприклад, Au2O3, Au2O), цинку (наприклад, ZnO), свинцю (наприклад, PbO, PbO 2, Pb3O4, Pb2O3, Pb2O), родію (наприклад, RhO2, Rh2O3), ітрію (наприклад, Y2O3), рутенію (наприклад, RuO2, RuO4), технецію (наприклад, Tс2O, Tс2O3), молібдену (наприклад, MoO2, Mo2O5, Mo2O3, MoO3), неодиму (наприклад, Nd2O3), цирконію (наприклад, ZrO2), лантану (наприклад, La2O3), гафнію (наприклад, HfO2), танталу (наприклад, TaO2, Ta2O5), вольфраму (наприклад, WO2, W 2O5), ренію (наприклад, ReO2, Re2O3), осмію (наприклад, PdO, PdO2), іридію (наприклад, IrO2, IR2O3), платини (наприклад, PtO, PtO2, PtO3, Pt2O3, Pt3O4), ртуті (наприклад, HgO, Hg2O), талію (наприклад, TlO2, Tl2O3), паладію (наприклад, PdO, PdO2), оксиду ряду лантанідів, оксиди ряду актинідів тощо. Крім того, в залежності від конкретної галузі застосування, при отриманні заготовки також можуть бути використані суміші оксидів металів. Крім того, матриця може містити гідроксид, такий як гідроксид металу. Наприклад, матриця може містити гідроксид магнію (наприклад, Mg(OH) 2), гідроксид кальцію (наприклад, Ca(OH)2), гідроксид стронцію (наприклад, Sr(OH)2), і гідроксид барію (наприклад, Ba(OH) 2), гідроксид хрому (наприклад, Cr(OH)2), гідроксид титану (наприклад, Ti(OH)2), гідроксид цирконію (наприклад, Zr(OH)4), гідроксид марганцю (наприклад, Mn(OH)2), гідроксид заліза (наприклад, Fe(OH)2), гідроксид міді (наприклад, Cu(OH)2), гідроксид цинку (наприклад, Zn(OH) 2), гідроксид алюмінію (наприклад, Al(OH)3), або їх комбінації. Крім того, матриця може містити фторид, такий як фторид металу. Наприклад, вона може містити фторид магнію (наприклад, MgF2), фторид кальцію (наприклад, CaF2), фторид стронцію (наприклад, SrF2), і фторид барію (наприклад, BaF2), фторид хрому (наприклад, CrF2), фторид титану (наприклад, TiF3), фторид цирконію (наприклад, ZrF4), фторид марганцю (наприклад, MnF2), фторид заліза (наприклад, FeF2), фторид міді (наприклад, CuF2), фторид нікелю (наприклад, NiF2), фторид цинку (наприклад, ZnF2), фторид алюмінію (наприклад, AlF3), або поєднання перерахованого. Крім того, матриця може містити змішаний оксид металу, такий як титанат металу. Наприклад, вона може містити титанат магнію (наприклад, MgTiO 3), титанат кальцію (наприклад, CaTiO3), титанат стронцію (наприклад, SrTiO3), титанат барію (наприклад, BaTiO3), або поєднання перерахованого. Крім того, матриця може містити сульфат, такий як сульфат металу. Наприклад, вона може містити сульфат магнію (наприклад, MgSO4), сульфат кальцію (наприклад, CaSO4), сульфат стронцію (наприклад, SrSO4), і сульфат барію (наприклад, BaSO4), сульфат хрому (наприклад, Cr2(SO4)3), сульфат титану (наприклад, TiSO4, Ti2(SO4)3), сульфат цирконію (наприклад, ZrSO4), сульфат марганцю (наприклад, MnSO4), сульфат заліза (наприклад, FeSO4), сульфат міді (наприклад, CuSO4), сульфат нікелю (наприклад, NiSO4), сульфат цинку (наприклад, ZnSO4), сульфат алюмінію (наприклад, Al2(SO4)3), або поєднання перерахованого. Крім того, матриця може містити силікат, такий як силікат металу. Наприклад, вона може містити метасилікат літію, ортосилікат літію, метасилікат натрію, силікат берилію, силікат кальцію, ортосилікат стронцію, метасилікат барію, силікат цирконію, метасилікат марганцю, силікат заліза, ортосилікат кобальту, ортосилікат цинку, метасилікат кадмію, андалузит, силіманіт, гіаніт, каолініт, або поєднання перерахованого. Крім того, матриця може містити гідроксиапатит, такий як гідроксиапатит металу. Наприклад, вона може містити карбонат кальцію, тетрагідрат нітрату кальцію, гідроксид кальцію, або поєднання перерахованого. Крім того, матриця може містити матеріал інертного наповнювача, на додачу до будь-якого з вищезазначених матеріалів, та інші. Матеріал інертного наповнювача може бути будь-яким матеріалом, який розміщується в твердій матриці, щоб заповнити пори і не взаємодіє значною мірою з речовиною, яка просочилася, з хімічним зв'язуванням. Наприклад, інертний матеріал 5 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 може бути деревиною, пластиком, склом, металом, керамікою, золою, або поєднанням перерахованого. Порошок може бути охарактеризований середнім розміром часток, який може змінюватися приблизно від 0,005 мкм до 500 мкм, як наприклад, приблизно, від 0,01 мкм до 100 мкм, гранулометричним складом часток і питомою площею поверхні. Малий середній розмір часток і вузький гранулометричний склад часток можуть бути бажаними бо полегшують розчинення. Порошок може бути сформованим в сиру масу будь-якої бажаної форми і розміру з використанням будь-яких традиційних прийомів, зокрема екструзії, інжекційного формування, штампування чеканки, ізостатичного пресування і шаблонного литва. Крім того, можуть утворюватися тонкі керамічні плівки. При формуванні порошкової форми можуть бути використані будь-які змащувальні матеріали, зв'язуючі подібних матеріалів, причому вони не повинні мати негативного впливу на отримані матеріали. Бажано такі матеріали характеризуються тим, що вони випаровуються або вигоряють при нагріванні за відносно низької температури, бажано нижчої від 500 °C, не залишаючи значного залишку. Наприклад, матриця може містити мінерал, промислові відходи, або промисловий хімічний матеріал. Наприклад, мінерал може бути мінеральним силікатом або гіпсом. Наприклад, промисловим відходом може бути зольний пил, шлак, або акумуляторні відходи. Промислові хімікалії (хімічні сполуки) можуть бути будь-якими реагентами, синтезованими або отриманими на заводі або взагалі в промисловості. Порошковому формуванню може бути надано форми і розмірів матеріалу продукту, який має задану форму і розмір. Порошкове формування може мати будь-яку форму. Об'єм відкритої пористості порошкового формування (0-80 %) може залежати від співвідношення молярного об'єму продукту реакції до молярного об'єму порошку. Матеріал продукту може бути, наприклад, монолітною масою, такою як щільна монолітна маса. У одному варіанті здійснення продукт реакції, що утворився усередині пор порошкового формування, може мати молярний об'єм більший, ніж об'єм порошку. Продукт реакції може мати молярний об'єм більший, ніж об'єм оксидного порошку для того, щоб заповнити порожнечі порошкового формування в процесі реакції. Наприклад, якщо молярний об'єм продукту реакції в два рази більший, ніж об'єм оксидного порошку, то порошкове формування повинне мати відкриту пористість приблизно 50 % за об'ємом. Пори в початковому порошковому формуванні можуть бути невеликими, наприклад, приблизно між 0,01 мікрометра (мкм) і 100 мкм, такими як приблизно між 0,1 мкм і 1 мкм, причому вони рівномірно розподілені по всьому порошковому формуванню, таким чином, забезпечується повне проникнення розчину, що просочився, в порошкове формування. Загальний об'єм пор, як закрита, так і відкрита пористість і розмір пор можуть бути визначені стандартними способами. Наприклад, для оцінки цих трьох параметрів може бути використано метод втискання ртуті. Потім отримана вище заготовка може бути оброблена на стадіях, які розглянуті нижче. Отримання середовища, що просочується Як описано раніше, при гідротермальному спіканні можуть бути використані водні або неводні середовища. Вибір рідкого розчинника може залежати від часток, які просочуються і які можуть бути частиною середовища, що просочується. Часточки, що просочилися, можуть характеризуватися значною розчинністю в рідкому розчиннику за умов процесу гідротермального спікання. Наприклад, якщо часточки, що просочилися, є іонними, тоді рідким розчинником може бути вода. Деякі неіонні часточки, що просочилися, також можуть мати достатню розчинністю у водних середовищах. Крім того, у водній суміші також можуть бути присутніми водорозчинні органічні розчинники, такі як спирти (наприклад, метанол, етанол, пропанол, ізопропанол і тому подібні), поліолі (наприклад, етандіол, 1,2-пропандіол, 1,3-пропандіол тощо), деякі низькомолекулярні прості ефіри (наприклад, фуран, тетрагідрофуран), аміни (наприклад, метиламін, етиламін, піридин і тому подібні), низькомолекулярний кетон (наприклад, ацетон), сульфоксиди (наприклад, диметилсульфоксид), ацетонітрил і тому подібні. В деяких випадках до водної суміші можуть бути додані поверхнево-активні речовини (наприклад, полісилоксани, поліетиленгліколі і алкілдиметиламіноксиди і тому подібні). Бажано, щоб середовище, що просочується, містило водорозчинні солі металів (тобто, метал в іонній формі). Наприклад, катіони таких солей, можуть бути обраними з поміж наступних металів: берилію, магнію, кальцію, стронцію, барію, скандію, титану, ванадію, хрому, марганцю, заліза, кобальту, нікелю, міді цинку, алюмінію, галію, германію, олова, сурми, індію, кадмію, срібла, свинцю, родію, рутенію, технецію, молібдену, неодиму, цирконію, ітербію, лантану, гафнію, танталу, вольфраму, ренію, осмію, іридію, платини, золота, ртуті, талію, 6 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 паладію, катіонів ряду металів-лантанідів, катіонів ряду металів-актинідів, і/або їх суміші. Зазвичай аніони солей, розчинених в розчині, що просочився, наприклад, можуть бути обраними з поміж наступних груп: гідроксиди, нітрати, хлориди, ацетати, форміати, пропіонати, фенілацетати, бензоати, гідроксибензоати, амінобензоати, метоксибензоати, нітробензоати, сульфати, фториди, броміди, йодиди, карбонати, оксалат, фосфат, цитрати і силікати або їх суміші. Молярне співвідношення іонів металу, які містяться в рідині, що просочилася, до іонів металу оксидного порошку може бути підібрано таким чином, щоб отримати продукт реакції з бажаною стехіометрією. Для досягнення повного перетворення можливо необхідним є надлишок іонів металу в розчині. Залежно від середовища, що просочується, і матричного матеріалу, отриманим спеченим продуктом може бути, наприклад, титанат, якщо використовується матеріал, який містить титан. 2+ Наприклад, титанати, які мають структуру ільменіту, можуть бути отримані з TiO 2 і солей Fe , 2+ 2+ 2+ 2+ Mg , Mn , Co , Ni , або поєднання перерахованого, у воді. Титанати, які мають структуру 2+ 2+ перовскиту, можуть бути отримані з водних розчинів солей Ca , Sr , іонів барію або поєднання перерахованого. Крім того, можуть бути отримані сполуки, які мають структуру шпінелі, зокрема: Mg2TiO4, Zn2TiO4 і Cо2TiO4. Більше того, відповідно до способу запропонованого даним винаходом можуть бути отримані різні фази титанату барію, наприклад, такі, які мають формулу BaxTiyOx+2y, в якій x і у позначають цілі числа. Як альтернатива, отриманий спечений продукт може бути карбонатом, сульфатом, оксалатом, або їх комбінацією; перелік матеріалів які можна використовувати може включати матеріал, який може розкладатися до спікання, якщо застосовується традиційний спосіб спікання; наприклад, карбонат розкладатиметься з утворенням оксиду при нагріванні до спікання при традиційному способі спікання. Карбонат, сульфат, оксалат можуть бути, наприклад, карбонатом, метасульфатом, метаоксалатом відповідного металу, що містить катіон з Періодичної таблиці елементів. Визначення характеристик спеченого матеріалу Пористість спеченого матеріалу В процесі HLPS можна отримувати спечений продукт з вельми однорідною і високодисперсною мікроструктурою. Наприклад, пористість спеченого матеріалу може бути приблизно нижчою, ніж 15 відсотків, такою як, приблизно, нижча, ніж 10 відсотків, такою як, приблизно, 5 відсотків, або навіть практично без пор. Загальна пористість порошкового формування може бути визначена використовуючи стандартні методики, наприклад, за допомогою ртутного порозиметра. Щільність можна оцінити використовуючи традиційні прийоми, такі як архімедівський ртутний порозиметр. Розмір і форма спеченого матеріалу Одна з характеристик спеченого матеріалу, що залучається до процесу HLPS, полягає в тому, що він може мати таку ж форму або навіть розмір, як початкове сире порошкове формування. У одному варіанті здійснення, в якому продукт практично не зазнає якої-небудь зміни молярного об'єму, не відбувається усадки порошкового формування, що відрізняється від багатьох способів отримання кераміки, і таким чином, потрібна невелика механічна обробка спеченого матеріалу (або взагалі не потрібна). Склад спеченого матеріалу Як продемонстровано в прикладах, для отримання спеченого матеріалу можуть бути використані самі різні хімічні композиції. Більше того, немає необхідності обмежувати якимнебудь конкретним чином ряд різних оксидів і солей металів, які використовуються для утворення спеченого матеріалу. Крім того, стехіометрія кінцевого продукту може визначатися молярними співвідношеннями реагентів, присутніх в сирому порошковому формуванні і середовища, що просочується. Склад спеченого матеріалу можна оцінити, використовуючи методи кількісної дифракції рентгенівських променів (QXRD) і індуктивно зв'язаної плазми (ICP). Мікроструктура і споріднені механічні характеристики Спечений продукт процесу HLPS може мати мікроструктуру, яка практично нагадує сітчасті, взаємно переплетені решітки. Крім того, моноліти, отримані в процесі HLPS, можуть проявляти композиційні структури, такі як структура вкладної гільзи. Крім того, продукт може характеризуватися відмінними механічними характеристиками, такими як висока межа міцності на розрив, міцність на стиснення і бажаний модуль розтягування. Це зміцнення може виникати за рахунок утворення хімічного зв'язування в ході взаємодії між фізично зв'язаними частинками шляхом іонного заміщення, приєднання іонів, оствальдовского дозрівання (тобто, рекристалізації, при якій можуть утворюватися нові решітки), або поєднання перерахованого. У одному варіанті здійснення, оствальдовське дозрівання може включати витримку карбонатного матеріалу в лужному середовищі. Більш того, у випадку наявності позитивної зміни молярного 7 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 об'єму, може бути досягнуте ущільнення, як описано раніше. Отримання цементу з використанням процесу HLPS Традиційно цемент отримують в дві стадії: (i) проводять високотемпературний процес синтезу цементу і потім цемент ущільнюють і зв'язують з водою, щоб отримати монолітну структуру. В процесі HLPS можуть бути об'єднані стадії синтезу і ущільнення/зв'язування цементу, з отриманням компактного, енергетично ефективного і екологічно чистого процесу. Цей процес може бути гнучким, з використанням різноманітних вихідних матеріалів, що дозволяє використовувати в процесі звичайні доступні компоненти (наприклад, виробничі відходи), таким чином, мінімізуються транспортні витрати. Замість отримання кераміки з використанням високотемпературних процесів, HLPS може забезпечити альтернативний процес для отримання великої кількості керамічних матеріалів, які представляють інтерес, в плинному середовищі, за умов м'яких температури і/або тиску. Кристали кераміки можуть бути виконані без використання "корегуючих" процесів розмелювання, наявних в традиційних процесах, і мають розмір кристалів і морфологію з відповідною реакційною здатністю для отримання матеріалів. Більш того, хімічні зв'язки в продукті, отриманому способом HLPS, можуть бути керамічними зв'язками, або можуть практично не містити гідравлічних зв'язків, які зазвичай утворюються в процесі отримання традиційного будівельного матеріалу (тобто, цементу). У традиційному цементі є гідравлічні зв'язки, і в результаті їх механічна міцність може погіршуватися, починаючи приблизно з 200 °C; цемент може втратити майже всю міцність при 1000 °C. За рахунок значної мінімізації утворення гідравлічних зв'язків (тобто, зв'язків за участю молекул води або їх частин) кераміка, отримана в процесі HLPS, може витримувати температуру, щонайменше, близько 1000 °C. Інша перевага використання HLPS для отримання цементу, або взагалі кераміки, може полягати в скороченні часу реакції для утворення керамічного продукту. В основі гідротермічних реакцій можуть бути взаємодії у водному розчині, де кераміка може утворюватися безпосередньо з розчину за температури, яка зазвичай є нижчою, ніж приблизно 400 °C, такою, як нижча, ніж 300 °C, або, приблизно, за кімнатної температури. Крім того, отримана кераміка може мати високу щільність, практично без гідравлічних зв'язків і, головним чином, з керамічними зв'язками. Наприклад, зв'язки в цементі можуть бути створені за рахунок гідратації порошків, суспендованих у воді. У традиційній кераміці більшість зв'язків створюються за рахунок дифузії, спричиненої високотемпературним випаленням. Навпаки, в процесі HLPS кераміка може утворюватися шляхом взаємодії монолітного порошкового формування або твердої матриці з середовищем, що просочується, для того, щоб заповнити внутрішньопоровий простір (тобто, пори) часток. При утворенні зародків і вирощуванні кристалів в цьому внутрішньопоровому просторі може сформуватися хімічний зв'язок між частинками і з порошковою матрицею, і створюється керамічно зв'язана монолітна маса. В результаті, на відміну від процесу гідравлічної цементації, можуть утворюватися безводні керамічні зв'язки, які можуть бути стабільні, щонайменше, за температури близько 1000 °C, такої як, приблизно, 2000 °C. Більше того, на відміну від процесу ущільнення (наприклад, спікання в твердій фазі), температура процесу може бути нижчою, ніж приблизно 90 °C, такої як кімнатна температура. Як описано раніше, продукт процесу HLPS може зазнавати змін молярного об'єму (збільшення або зменшення), або об'єм практично не змінюється. У одному варіанті здійснення, при позитивній зміні молярного об'єму, може відбуватися ущільнення. У одному варіанті здійснення, де тверда матриця може служити засобом розміщення для утворення зв'язаної структури, практично не відбувається зміни розмірів. В результаті, практично не утворюються пошкодження, такі як тріщини або дефекти. Хоча розміри матеріалу не змінюються, відносну пористість структури можна регулювати шляхом вибору хімічної реакції, в якій відсоток зміни молярного об'єму між продуктом і реагентом може визначати пористість, яку ще має структура. Наприклад, пориста на 50 % структура, яка взаємодіє з утворенням продукту, в якому є зміна молярного об'єму на 100 %, може повністю ущільнитися. У одному варіанті здійснення, наявність пор великого розміру може бути бажаною для досягнення повного перетворення. Відмічено, що початкову щільність можна регулювати шляхом вибору матричного порошку, а також технології формування при пресування порошку. Існує велика кількість реакцій, в яких можна розробити збільшення або зменшення об'єму, щоб отримати (дивіть таблицю 1) зміну пористості при зв'язуванні кераміки з кристалами, які утворюються в цій реакції. Наприклад, перетворення матриці CaSO4 на оксалат CaC2O4•H2O може привести до збільшення молярного об'єму (ущільнення) на 44,4 об. %, тоді як перетворення CaSO4 в CaCO3 може привести до зменшення молярного об'єму (збільшення 8 UA 105762 C2 5 10 15 пористості) на -19,7 о. %. Регулювання цього процесу можна додатково підсилити шляхом змішування компонентів негативною і позитивною зміною об'єму, щоб створити композицію, сумарну зміну щільності якої (частка пористості) можна задавати від нуля до позитивного або негативного значення. Як показано в таблиці 1, можливе значне збільшення молярного об'єму, до 616 об. %, і зменшення молярного об'єму, до 50,2 об. %. Здатність зменшення або збільшення пористості може бути вельми корисною. Наприклад, значне збільшення молярного об'єму може бути корисним в матрицях з низькою щільністю, які можуть сприйняти велике розширення, таких як конструкція, яка може входити до складу матеріалів для спорудження доріг або будівельних конструкцій. З іншого боку, значне зменшення об'єму може бути використане для поліпшення транспортування або взаємодії розчинів, які зв'язують конструкцію у міру протікання реакцій, шляхом збільшення проникності при протіканні реакції. Крім того, композиційні матеріали можуть передбачати додавання інертних порошків з метою зменшення зростання (або падіння) щільності, що може пропорційно знижувати зростання молярного об'єму (або зниження). Зазвичай, якщо реакція призводить до об'ємного розширення або скорочення матриці, кристали, які утворюються в реакції, можуть служити як зв'язка з матрицею, будучи реагентом, інертним компонентом або продуктом, який вже утворився в результаті реакції. Таблиця 1 Щільність, молекулярна маса, молярний об'єм % зміни молярного об'єму при перетворенні вихідного матеріалу на карбонат, % зміни молярного об'єму при перетворенні на оксалат в процесі HLPS Вихідний матеріал CaSO4 CaSO4.2H2O Молярний об'єм Зміна молярного об'єму при Зміна молярного об'єму при 3 (см /моль) перетворенні на карбонат % перетворенні на оксалат % 45,99 -19,7 44,4 74,21 -50,23 -10,51 FEO Fe2O3 Fe3O4 30 35 558,94 418,8 428,54 11,2 24,61 27,64 33,68 146,92 12,34 0 9,66 616,28 225,88 190,09 97,2 FeTiO3 FeCO3 CaCO3 (кальцит) 25 148,09 95,33 99 MGO Mg(OH)2 MgCO3 Ca(OH)2 20 11,97 15,21 14,93 32,14 29,71 36,93 -7,58 0 0 145,48 165,6 79,83 Процес HLPS може забезпечити спосіб формування керамічних зв'язків для великої кількості матеріалів, зокрема тих, які не можна отримати використовуючи будь-який з традиційних процесів. Відповідно, така кераміка як мармур, карбонат кальцію (CaCO 3) природного походження, може бути синтезована з некарбонатного джерела кальцію. У зв'язку з гнучкістю процесу HLPS його можна використовувати для уловлювання парникових газів, таких як діоксид вуглецю, і при цьому утворюється щільна кераміка, як описано раніше. Крім того, цей процес можна інтегрувати з установкою для генерування енергії, в якій виділяються парникові гази, причому ці гази можна уловлювати і подавати безпосередньо в процес HLPS як реагент. Утворення кераміки за рахунок уловлювання газу В процесі HLPS можна уловлювати газ з атмосфери і використовувати в реакції з утворенням різноманітної кераміки, включаючи мармур або цемент. Цей газ може бути будьякого типу, такого як парниковий газ, включаючи діоксид вуглецю, або газ, який містить, головним чином, вуглець, сірку, фосфор, азот, водень, кисень або поєднання перерахованого. Фазові діаграми, отримані розрахунковим шляхом на основі термодинаміки, можуть бути використані для полегшення вибору відповідного реагенту для процесу HLPS. Наприклад, при взаємодії CaSO4 з CO2 не може утворитися CaCO3, хоча було знайдено багато інших систем для цієї реакції. Приведені нижче хімічні реакції з матрицею, яка взаємодіє з насиченими 9 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчинами CO2, в поєднанні з результатами термодинамічних розрахунків реакцій, демонструють можливість їх застосування для фіксації діоксиду вуглецю з утворенням карбоксилатних сполук. Наголошується, що джерело вуглецю і його концентрація є змінними чинниками, причому концентрація інших реагентів для кераміки підтримується постійною. Для кожної системи приведені отримані фази для діапазону температур, включаючи кімнатну температуру. FеO+CO2 FeCO3 (Фігура 1) Ca(OH)2+CO2 CaCO3+H2O (Фігура 2) FeTiO3+CO2 FeCO3+TiO2 (Фігура 3) Fe3O4+CO2 FeCO3+Fe2O3 (Фігура 4) Подібно до ільменіту (FeTiO3), перовскіт (CaTiO3), сфен (CaTiSiO5) або лужноземельні польові шпати (CaAl2Si2O8) можуть розкладатися до карбонату і відповідного оксиду. Для реакцій, таких як Fe2O4 з відповідним відновлюючим середовищем, можливе відновлення часток 3+ Fe , так що всі часточки заліза стають двовалентними і доступними для карбонізації. 3+ Прогнозується, що оксиди на основі Fe не утворюють карбонату заліза. З деякими матеріалами CO2 не може реагувати відповідно до розрахунків. Наприклад, CaSO4 взаємодіє з розчиненим CO2. У інших випадках, можуть бути вигіднішими інші прийоми уловлювання CO2. Наприклад, калій може бути перетворений електрохімічно на гідроксид калію, таким чином, фіксується газоподібний діоксид вуглецю з утворенням K 2CO3, і потім CaCO3 осідає з CaSO4 таким чином: CaSO4+K2CO3 CaCO3+K2SO4 (Фігура 5) Аналогічні реакції можуть бути здійснені з карбонатними солями натрію або амонію. У одному варіанті здійснення, може бути отриманий пористий мармур (тобто, карбонат кальцію), а K2SO4 може залишатися в структурі. Інші немінеральні реагенти також можуть бути використані для уловлювання CO2, як наприклад, Ca(OH)2. Ca(OH)2+K2CO3 CaCO3+2KOH (Фігура 6) Перелік інших придатних лужних карбонатів може включати Na 2CO3 і NH4CO3. Зазвичай лужні карбонати можуть бути виведені з лужних гідроксидів. У реакціях за участю гідроксидів, таких як приведені вище, можна регенерувати лужний гідроксид, коли відбувається карбонізація. Таким чином, подібна реакція може забезпечити повторне використання лужного гідроксиду з метою додаткового уловлювання CO2. У одному варіанті здійснення, можуть бути використані мінеральні оксиди для того, щоб регенерувати лужний гідроксид, коли використовується реакція карбонізації: MO+M'2CO3+H2O MCO3+2M'OH + + 4+ де M=Na , K , NH Може бути використаний залізняк, (Fe2O4/Fe3O4), широко поширена на Землі. Як альтернатива, може бути використаний Mg в процесі реактивного спікання, який може бути ініційований за допомогою вапняку таким чином: 2+ + Mg + K2CO3+CaCO3 MgCO3/CaCO3+2K Таким чином, пориста маса вапняку може бути заповнена карбонатом магнію (MgCO 3), щоб отримати композиційний матеріал. Однією важливою перевагою отримання структурного матеріалу, такого як карбонат, з уловлюванням парникового газу, такого як діоксид вуглецю, може бути те, що діоксид вуглецю споживається в ході процесу, і що в цьому процесі не утворюється значна кількість парникових газів. Фіксація газу У одному варіанті здійснення, дві молекули CO2 можуть фіксуватися з використанням 2полідентатних лігандів, таких як оксалат, C2O4 . Цей реагент може містити дві молекули CO2, зв'язаних разом вуглець-вуглецевим зв'язком (C-C). Були проведені розрахунки для наступних оксалатних систем, з метою визначення можливості їх застосування, відповідні результати представлені на фігурах: H2C2O4 CaSO4+H2C2O4 CaC2O4•H2O+H2SO4 (Фігура 7) MgO+H2C2O4+2H2O MgC2O4•2H2O+H2O (Фігура 8) Ca(OH)2+H2C2O4 CaC2O4•H2O+H2O (Фігура 9) K2С2O4 CaSO4+K2С2O4+H2O CaC2O4•H2O+K2SO4 (Фігура 10) Ca(OH)2+K2С2O4+H2O CaC2O4•H2O+2KOH (Фігура 11) У деяких варіантах здійснення, в реакціях за участю карбонату можна регенерувати KOH у вигляді продукту реакції, який може бути використаний повторно в додаткових реакціях, з 10 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 фіксацією карбонату. Крім того, можуть бути використані інші оксалати, такі як (NH 4)2C2O4 і Na2C2O4, також як будь-який попередник оксалату, який може утворювати оксалатні аніони при дисоціації. Можуть бути використані багато оксалатів, які є стабільними за кімнатної -3 температури. Наприклад, феріоксалат [Fe(C2O4)3] може бути розчинним аніоном, який може поглинати до 6 молів CO2 на атом заліза, що може бути бажаним при уловлюванні і/або фіксації діоксиду вуглецю. Також можуть бути використані оксалатні солі, які можуть утворювати оксалати і виділяти газоподібний діоксид вуглецю або розчинний карбонат таким чином: CaCO3+H2C2O4 CaC2O4•H2O+CO2 (Фігура 12) CaCO3+K2С2O4 CaC2O4•H2O+K2CO3 (Фігура 13) Застосування карбоксилатних матеріалів може забезпечити підвищену хімічну довговічність в порівнянні з традиційними цементами. Наприклад, розкладання традиційного мармуру може починатися при значенні pH, приблизно, нижчому ніж 6, але може витримувати середовище з дуже високим pH без розкладання (Фігура 14). Наприклад, коли використовуються оксалати типу моногідрату оксалату кальцію, матеріал може витримувати pH в діапазоні від більше 2 і до менше 13, без розкладання (Фігура 15). Відсутність гідравлічних зв'язків також може забезпечувати знижену чутливість до солей, які використовуються для видалення льоду з холодної поверхні. Галузі застосування Однією з переваг утворення кераміки при уловлюванні і/або фіксації парникових газів з використанням HLPS є пластичність цих процесів. Наприклад, взаємодія може початися у будьякий момент, що забезпечує швидкий монтаж структур на місці. Наприклад, можуть бути використані пристрої типу парового катка для порошкового формування з подальшим нагріванням системи, тоді як суміші пари і діоксиду вуглецю ініціюють процес спікання. Як альтернатива, карбонатні розчини можна інжектувати всередину пористого шару з подальшим затвердіванням і нагріванням під дією катка. Ливарні форми можуть містити полімерне облицювання, яке є хвилеводом для мікрохвильової енергії для локального нагрівання води, щоб ініціювати і завершити реакцію, де локальний тиск в стислих структурах може відповідати докритичним або надкритичним умовам реакції. Така пластичність може забезпечувати швидке затвердівання матеріалів на будівельних об'єктах, для чого буде потрібний короткий час. Крім того, можливість додавання води на місці, в процесі HLPS, може дати зниження маси будівельних матеріалів, постачання яких є необхідним, таким чином, знижуються витрати і споживання енергії. Більш того, в процесі HLPS вода може бути використана швидше як розчинник для середовища, що просочується, ніж як реагент, як в традиційному цементі. Зокрема, вода із процесу HLPS може бути або використана повторно, або повернена в екосистему. У одному варіанті здійснення, операції уловлювання і фіксації газу можуть бути об'єднані в одному процесі. Наприклад, парниковий газ можна уловлювати за допомогою взаємодії часток, здатних реагувати з парниковим газом. У подальшому, захоплений газ (вже у обводненому вигляді), для його фіксації, може стати реакційноздатною частинкою в розчині, який потім грає роль середовища, що просочується, як це описано раніше. Як альтернатива, стадія уловлювання не використовується до фіксації. Наприклад, середовище, що просочується,може стати легко доступним при мінімальному розчиненні парникового газу, і тому в цьому варіанті здійснення використовується тільки фіксація парникового газу. За бажанням, середовище може бути промислово доступним продуктом. У одному варіанті здійснення можливість створення технологічного процесу без усадки може забезпечити утворення різноманітних багатокомпонентних структур, в яких компоненти, які відрізняються від зв'язуючої фази, можуть пасивно залишатися в структурі. Такими компонентами можуть бути гравій і пісок, які можуть забезпечувати хорошу проникність структури, яка може бути посилена об'єднаними решітками зв'язаних карбонатних матеріалів, які пронизують всю пористу структуру гравію і піску. Крім того, можуть бути введені інші структури, такі як сталеві арматурні прути, де міжфазні взаємодії можуть забезпечувати додаткове посилення. Розчинний силікат, який утворився з гравію і піску, може підтримувати цю взаємодію із сталлю, а також підтримувати утворення інших силікатних сполук, які дають додатковий внесок в зв'язуючі фази в композиційній структурі на основі карбонату. Крім того, відсутність усадки може сприяти впровадженню пристрою в середовище з низькою напругою, з метою полегшення контролю в реальному масштабі часу механічної стійкості матеріалу, а також напруженого стану. Одна додаткова перевага продукту, описаного у винаході, може включати вогнестійкість, особливо для карбонатів. Такі карбонати як карбонат кальцію не розкладаються при досягненні 11 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 60 досить високих температур (приблизно від 800 до 1000 °C, залежно від розміру часток CaCO3 і парціального тиску діоксиду вуглецю – pCO2). Інертні матеріали, такі як неорганічні відражаючі, забарвлені, або люмінесцентні часточки глушника, також можуть бути введені до цієї карбоксилатної кераміки. Наприклад, розкладання FeTiO3, як вказано раніше, може бути використане для отримання композиційних будівельних матеріалів з діоксиду титану і FeCO3. Уловлювання вуглецю після згорання Карбоксилати, такі як карбонати металів і оксалати металів, можуть бути використані для уловлювання діоксиду вуглецю після згорання в процесі HLPS. Карбонатні іони можуть бути отримані з молекул CO2 з використанням наступної швидкої реакції: 2CO2+2OH CO3 + H2O. Наголошується, що вода утворюється як побічний продукт. Таким чином, якщо обробляються великі кількості CO2, утворення води також може бути вигідним, коли вода стає дефіцитною. У одному варіанті здійснення, можуть бути використані 1-2 неорганічних катіона на кожен іон карбонату як показано нижче: z+ 2xM + CO3 Mx(CO3). Наприклад, коли неорганічним іоном є натрій, співвідношення діоксиду вуглецю до неорганічного продукту дорівнює 1:2 з розрахунку на атомні відсотки, тоді як, якщо неорганічним іоном є кальцій, співвідношення діоксиду вуглецю до неорганічного продукту дорівнює 1:1 з розрахунку на атомні відсотки. Одновалентні карбонати можуть бути бажаними, оскільки вони є добре розчинними у воді. Також використовуються оксалати металів. Для отримання одного оксалатного іона використовують дві молекули CO2 таким чином: 22CO2+2e C2O4 Цей іон може бути отриманий або з монооксиду вуглецю або біологічно з CO2 в широкому діапазоні розростання. Здатність оксалату уловлювати 2 молекули діоксиду вуглецю на кожен оксалатний аніон може забезпечити інші можливості для уловлювання CO2. Наприклад, такі мінерали, як вапняк, зазвичай можуть розкладатися з виділенням CO2 таким чином: CaCO3 CаO+CO2. Як альтернатива, карбонат може розкладатися з приєднанням оксалату: CaCO3+K2С2O4+H2O CaC2O4•H2O+K2CO3. 2Таким чином, аніон CO3 може бути вилученим з вапняку з утворенням попередника K2CO3, який далі може бути використаний при гідротермальному спіканні, на відміну від виділення газоподібного CO2, який необхідно буде уловлювати. Ця реакція також може протікати з приєднанням щавлевої кислоти: CaCO3+H2C2O4 CaC2O4•H2O+CO2. Загальновідомо, що гідроксид кальцію отримують шляхом гідратації оксиду кальцію у воді. Гідроксид кальцію може бути перетворений на карбонат, таким чином: Ca(OH)2+CO2 CaCO3+H2O Таким чином, ця реакція є нейтральною за вуглецем, оскільки в ній споживається діоксид вуглецю, який раніше виділився при отриманні CаO. Проте, якщо оксалат використовується, тоді в цій реакції може споживатися вуглець таким чином: Ca(OH)2+H2C2O4 CaC2O4•H2O+H2O або Ca(OH)2+K2С2O4+H2O CaC2O4•H2O+2KOH. У одному варіанті здійснення лужна основа, яка утворюється в реакції, може бути використаною далі як розчин, який уловлює діоксид вуглецю. Таким чином, один процес HLPS для уловлювання діоксиду вуглецю може запустити інший процес HLPS. Розчин для уловлювання вуглецю після згорання може мати в своїй основі розчинний гідроксид, такий як гідроксид натрію. Розчинний гідроксид може бути використаний як уловлюючий розчин за допомогою промивальної колонки. Перевага запропонованого способу полягає в тому, що в ньому можна використовувати весь тепловміст димових газів, працюючи за високої температури, і в тому, що діоксид вуглецю кількісно реагує і що використовуються вихідні матеріали, які можуть бути отримані у будьякому місці, що також може бути зручним для транспортування. Зона захоплення діоксиду вуглецю може бути дуже невеликою, якщо димові гази мають необхідний тепловміст для випаровування і карбонізації. Не обмежуючі робочі приклади Приклад 1. Карбонат кальцію з гідроксиду кальцію і карбонату калію Порошок оксиду кальцію ~5 г, взаємодіє з деіонізованою водою (приблизно 100 мл) з 12 UA 105762 C2 5 10 15 20 25 30 утворенням Ca(OH)2 в тефлоновій посудині за кімнатної температури. Суміш гідроксиду кальцію і води охолоджують до кімнатної температури. Потім суміш струшують і виливають в колоїдний прес, допоки резервуар не заповниться приблизно на 75 %. На колоїдний прес поволі подають навантаження 7000 фунтів (3175 кг). Тефлонову посудину заповнюють деіонізованою водою (200 мл) і розчиняють в ній 30 г K2CO3. Вологий коржик Ca(OH)2 викладають на тефлоновий піддон і поміщають в тефлонову посудину. Кришку посудини закривають і зберігають за кімнатної температури протягом 4 діб. Потім коржик виймають і промивають деіонізованою водою. Продукт реакції досліджують методом рентгенівської дифракції; знайдено, що цей продукт містить головним чином CaCO3 з невеликою домішкою Ca(OH)2. Зразок зберігає свою форму і має достатню механічну міцність, щоб протидіяти руйнуванню. Приклад 2. Моногідрат оксалату кальцію з гідроксиду кальцію і щавлевої кислоти Порошок оксиду кальцію ~5 г, взаємодіє приблизно з 100 мл деіонізованої води з утворенням Ca(OH)2 в тефлоновій посудині за кімнатної температури. Суміш гідроксиду кальцію і води охолоджують до кімнатної температури. Потім суміш струшують і виливають в колоїдний фільтр-прес діаметром 25,4 мм (1 дюйм), поки резервуар не заповниться приблизно на 75 %. На колоїдний прес поступово подають навантаження 7000 фунтів (3175 кг). Тефлонову посудину заповнюють деіонізованою водою (200 мл) і змішують з 30 г H2C2O4. Вологий коржик Ca(OH)2 викладають на тефлоновий піддон і поміщують в тефлонову посудину. Кришку посудини закривають і зберігають за кімнатної температури протягом 4 діб. Потім коржик виймають і промивають деіонізованою водою. Методом рентгенівської дифракції виявлена наявність обох фаз CaC2O4•H2O і Ca(OH)2. Зразок зберігає свою форму і розмір при пресуванні, причому ці розміри не змінюються після гідротермального спікання рідкої фази. Цей матеріал має механічну міцність. Може бути досягнута велика глибина реакції з отриманням міцнішого матеріалу, якщо Ca(OH) 2 змішувати з щавлевою кислотою в ході пресування, а не з використанням чистої води. Приведені вище приклади і кращі варіанти здійснення призначені для ілюстрації обсягу домагань і не повинні розглядатися як такі, що будь-як обмежують винахід. Звичайно, інші варіанти здійснення стануть очевидними для фахівців в цій галузі техніки з урахуванням докладних відомостей, приведених в описі винаходу. Передбачається, що такі інші варіанти здійснення охоплюються обсягом і задумом винаходу, який обмежується тільки формулою винаходу, приведеною нижче. ФОРМУЛА ВИНАХОДУ 35 40 45 50 55 1. Спосіб фіксації парникового газу, який передбачає: (і) отримання розчину, який містить перший реагент, який здатний взаємодіяти з парниковим газом; (іі) контакт розчину з парниковим газом за умов, які підтримують взаємодію між першим реагентом і парниковим газом, щоб отримати щонайменше перший реагент; (ііі) отримання пористої матриці, в якій є внутрішньопоровий простір, і яка містить щонайменше другий реагент; (iv) забезпечення просочування розчину, який містить щонайменше перший реагент щонайменше в значній частині внутрішньопорового простору пористої матриці за умов, які підтримують взаємодію щонайменше між першим реагентом і щонайменше другим реагентом, щоб отримати щонайменше перший продукт; і (v) забезпечення отримання щонайменше першого продукту із заповненням щонайменше частини внутрішнього простору пористої матриці, і таким чином, фіксації парникового газу. 2. Спосіб за п. 1, який відрізняється тим, що парниковий газ містить діоксид вуглецю. 3. Спосіб за п. 1, який відрізняється тим, що парниковий газ містить хімічний елемент сірку, фосфор, азот або поєднання перерахованого. 4. Спосіб за п. 1, який відрізняється тим, що тверда матриця після стадії (v) має такий же молярний об'єм, як до стадії (v). 5. Спосіб за п. 1, який відрізняється тим, що тверда матриця після стадії (v) має молярний об'єм більший, ніж до стадії (v). 6. Спосіб за п. 1, який відрізняється тим, що тверда матриця після стадії (v) має молярний об'єм менший, ніж до стадії (v). 7. Спосіб за п. 1, який відрізняється тим, що тверда матриця після стадії (v) має щільність більшу, ніж до стадії (v). 8. Спосіб за п. 1, який відрізняється тим, що парниковий газ утворюється на заводі. 13 UA 105762 C2 5 10 15 20 25 30 35 40 45 50 55 9. Спосіб за п. 1, який відрізняється тим, що другий реагент містить оксид металу, гідроксид металу, сульфат металу, фторид металу, титанат металу або поєднання перерахованого. 10. Спосіб за п. 1, який відрізняється тим, що перший реагент містить оксалат, карбонат, сульфат, фосфат, цитрат, іон металу або поєднання перерахованого. 11. Спосіб за п. 1, який відрізняється тим, що перший продукт утворюється шляхом осадження. 12. Спосіб за п. 1, який відрізняється тим, що перший продукт містить карбонат кальцію. 13. Спосіб за п. 1, який відрізняється тим, що перший продукт містить карбоксилат. 14. Спосіб за п. 1, який відрізняється тим, що перший продукт містить карбонат металу, оксалат металу або поєднання перерахованого. 15. Спосіб за п. 1, який відрізняється тим, що перший продукт має температуру розкладання щонайменше близько 1000 °C. 16. Спосіб за п. 1, який відрізняється тим, що перший продукт має мікроструктуру взаємно зв'язаних решіток. 17. Спосіб за п. 1, який відрізняється тим, що перший продукт знаходиться у обводненому вигляді. 18. Спосіб за п. 1, який відрізняється тим, що здійснюється за температури приблизно нижчої ніж 300 °С. 19. Спосіб за п. 1, який відрізняється тим, що здійснюється за кімнатної температури. 20. Кераміка, отримана шляхом зв'язування вуглецю, в способі фіксації вуглецю, або поєднання перерахованого, причому спосіб включає забезпечення взаємодії щонайменше одного компонента пористої матриці щонайменше з першим реагентом, який транспортується середовищем, що просочується, з отриманням щонайменше першого продукту, причому в ході цієї реакції решта частини пористої матриці діє як засіб розміщення для полегшення утворення першого продукту з реакційної суміші і, таким чином, отримується кераміка. 21. Кераміка за п. 20, яка відрізняється тим, що не містить гідравлічних зв'язків, 22. Кераміка за п. 20, яка відрізняється тим, що кераміка містить головним чином керамічні зв'язки. 23. Кераміка за п. 20, яка відрізняється тим, що кераміка і тверда матриця мають практично однакову форму. 24. Кераміка за п. 20, яка відрізняється тим, що кераміка має температуру розкладання щонайменше близько 1000 °C. 25. Кераміка за п. 20, яка відрізняється тим, що кераміка має температуру розкладання щонайменше близько 2000 °C. 26. Кераміка за п. 20, яка відрізняється тим, що перший продукт отримують шляхом іонного заміщення, приєднання іона, диспропорціонування або поєднання перерахованого. 27. Кераміка за п. 20, яка відрізняється тим, що перший продукт отримують шляхом осадження. 28. Кераміка за п. 20, яка відрізняється тим, що кераміка є цементом. 29. Спосіб за п. 20, який відрізняється тим, що перший продукт містить карбоксилат. 30. Спосіб отримання кераміки, який передбачає: (і) отримання пористої, матриці, яка має внутрішньопоровий простір і яка містить щонайменше перший реагент; (іі) контакт пористої матриці з середовищем, що просочується, і яке транспортує щонайменше другий реагент, який містить парниковий газ; (ііі) забезпечення інфільтрації середовища, що просочується щонайменше до частини внутрішнього простору пористої матриці за умов, які підтримують реакцію щонайменше між першим реагентом і щонайменше другим реагентом, щоб отримати щонайменше перший продукт; і (iv) забезпечення утворення щонайменше першого продукту із заповненням щонайменше частини внутрішнього простору пористої матриці і, таким чином, отримання кераміки, причому в цьому способі споживається і не виділяється значна кількість парникового газу. 31. Спосіб за п. 30, який відрізняється тим, що стадії (іі)-(iv) повторюють щонайменше один раз. 32. Спосіб за п. 30, який відрізняється тим, що кераміка не має гідравлічних зв'язків. 33. Спосіб за п. 30, який відрізняється тим, що парниковий газ отримують на заводі. 34. Спосіб за п. 30, який відрізняється тим, що кераміка практично не має тріщин. 35. Спосіб фіксації парникових газів, який передбачає: (і) отримання розчину, що переносить щонайменше один парниковий газ як перший реагент; 14 UA 105762 C2 5 (іі) отримання пористої матриці, яка має внутрішньопоровий простір і яка містить щонайменше другий реагент; (ііі) забезпечення просочування розчину, який містить щонайменше перший реагент щонайменше до значної частини внутрішньопорового простору пористої матриці за умов, які підтримують взаємодію щонайменше між першим реагентом і щонайменше другим реагентом, щоб отримати щонайменше перший продукт; і (iv) забезпечення отримання щонайменше першого продукту із заповненням щонайменше частини внутрішнього простору пористої матриці і, таким чином, фіксації парникового газу. 36. Спосіб за п. 35, який відрізняється тим, що парниковий газ розчиняється в розчині. 15 UA 105762 C2 16 UA 105762 C2 17 UA 105762 C2 18 UA 105762 C2 19 UA 105762 C2 20 UA 105762 C2 21 UA 105762 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 22
ДивитисяДодаткова інформація
Автори російськоюRiman, Richard, E., Atakan, Vahit
МПК / Мітки
МПК: B01D 53/62, B01D 53/73, C01F 11/18
Мітки: способи, уловлювання, системі, фіксації, композиції, чином, можна, отримати, газів, таким
Код посилання
<a href="https://ua.patents.su/24-105762-sistemi-ta-sposobi-dlya-ulovlyuvannya-i-fiksaci-gaziv-ta-kompozici-yaki-takim-chinom-mozhna-otrimati.html" target="_blank" rel="follow" title="База патентів України">Системи та способи для уловлювання і фіксації газів та композиції, які таким чином можна отримати</a>
Попередній патент: Каток з шинами напівпорожнього типу для сільськогосподарських машин
Наступний патент: 8-заміщені піридо[2,3-b]піразини та їх застосування
Випадковий патент: Вузол кріплення