Фармацевтична композиція, що включає агоніст glp-1, інсулін і метіонін
Номер патенту: 109420
Опубліковано: 25.08.2015
Автори: Шеттлє Ізабелль, Хаук Герріт, Терч Катрін, Хагендорф Анніка, Зіфке-Хенцлер Верена, Мюллер Вернер
Формула / Реферат
1. Рідка композиція, що включає агоніст GLP-1 і/або його фармакологічно прийнятну сіль, інсулін і/або його фармакологічно прийнятну сіль і, необов'язково, щонайменше одну фармацевтично прийняту допоміжну речовину, яка відрізняється тим, що дана композиція містить L-метіонін і має значення рН від 3,5 до 4,5, де агоніст GLP-1 являє собою desPro36ексендин-4(1-39)-LyS6-NH2 та інсулін являє собою Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiн людини.
2. Рідка композиція за п. 1, яка відрізняється тим, що містить фармацевтично прийнятний консервант і/або фармацевтично прийнятний засіб, що забезпечує ізотонічність.
3. Рідка композиція за п. 1 або 2, яка відрізняється тим, що містить м-крезол і/або гліцерин.
4. Рідка композиція за одним з попередніх пунктів, яка відрізняється тим, що має значення рН приблизно 4,5.
5. Рідка композиція за одним з попередніх пунктів, яка відрізняється тим, що містить метіонін в кількості від 0,5 до 20 мг/мл, зокрема в кількості від 1 до 5 мг/мл.
6. Рідка композиція за одним з попередніх пунктів, яка відрізняється тим, що має після зберігання протягом 6 місяців при температурі +25 °С хімічну цілісність.
7. Рідка композиція за одним з попередніх пунктів, яка відрізняється тим, що має після зберігання протягом 6 місяців при температурі +25 °С фізичну цілісність.
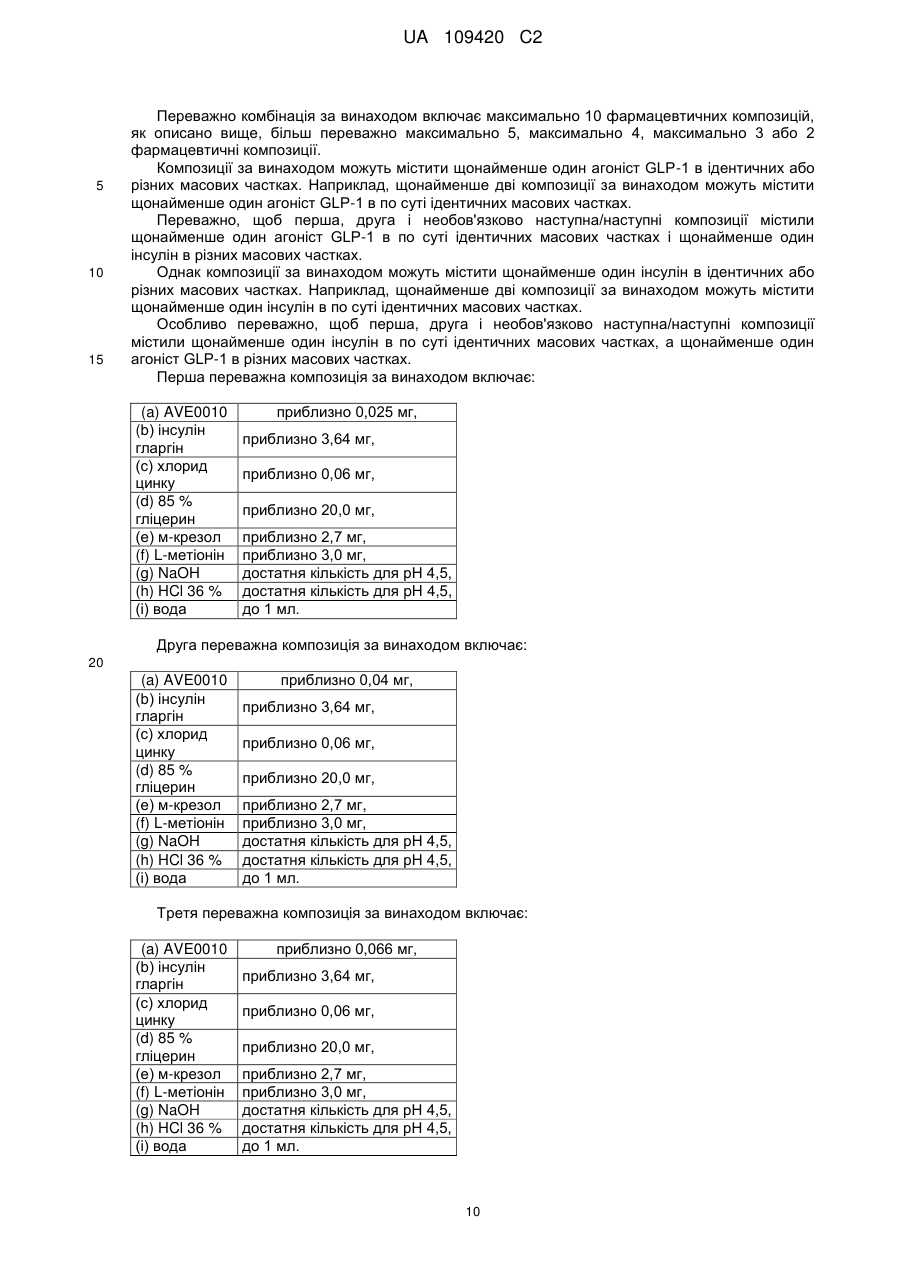
8. Рідка композиція за одним з попередніх пунктів, яка відрізняється тим, що містить наступні компоненти:
(a) desPro36ексендин-4(1-39)-LyS6-NH2,
(b) Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiн людини,
(c) хлорид цинку,
(d) м-крезол (необов'язково),
(е) L-метіонін,
(f) гліцерин,
(g) соляну кислоту в кількості, достатній для одержання значення рН приблизно 4,5,
(h) розчин NaOH в кількості, достатній для одержання значення рН приблизно 4,5, і
(і) воду.
9. Композиція за одним з попередніх пунктів, яка відрізняється тим, що являє собою композицію для ін'єкцій.
10. Композиція за одним з попередніх пунктів для лікування цукрового діабету.
11. Комбінація, яка включає першу фармацевтичну композицію за одним з пп. 1-10, другу фармацевтичну композицію за одним з пп. 1-10 і, необов'язково, щонайменше одну наступну фармацевтичну композицію за одним з пп. 1-10, кожна з яких містить щонайменше один інсулін і щонайменше один агоніст GLP-1, і щонайменше один інсулін і/або щонайменше один агоніст GLP-1 містяться в різних масових частках відносно загальної маси композиції, де агоніст GLP-1 являє собою desPro36ексендин-4(1-39)-LyS6-NH2 та інсулін являє собою Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiн людини.
12. Комбінація за п. 11, при цьому масові частки щонайменше одного Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiну людини і щонайменше одного desPro36ексендин-4(1-39)-LyS6-NH2 в першій фармацевтичній композиції, у другій фармацевтичній композиції і в щонайменше одній, необов'язковій, наступній фармацевтичній композиції вибирають таким чином, щоб фармацевтичні композиції мали різне відношення Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiнy людини до desPro36ексендин-4(1-39)-LyS6-NH2 в перерахунку на масові частки.
13. Комбінація за п. 11 або 12, причому перша, друга і, необов'язково, наступна або наступні композиції містять щонайменше один Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiн людини в, по суті, ідентичних масових частках і щонайменше один desPro36ексендин-4(1-39)-LyS6-NH2 в різних масових частках.
14. Комбінація за п. 11 або 12, причому перша, друга і, необов'язково, наступна або наступні композиції містять щонайменше один desPro36ексендин-4(1-39)-LyS6-NH2 в, по суті, ідентичних масових частках, а щонайменше один Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiн людини в різних масових частках.
15. Набір для лікування цукрового діабету, який містить комбінацію за одним з пп. 11-14.
16. Застосування композиції за одним з пп. 1-10, комбінації за пп. 11-14 або набору за п. 15 для одержання лікарського засобу для лікування цукрового діабету.
17. Спосіб лікування цукрового діабету пацієнтів композицією за одним з пп. 1-10, комбінацією за пп. 11-14 або набором за п. 15, який включає введення композиції пацієнтам.
18. Спосіб за п. 17, який додатково включає введення метформіну, Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiнy людини і/або desPro36ексендин-4(1-39)-LyS6-NH2, і/або фармакологічно принятної солі пацієнту з цукровим діабетом.
19. Спосіб за п. 18, який відрізняється тим, що мова йде про додаткову терапію, зокрема лікування Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiном людини і/або desPro36ексендин-4(1-39)-LyS6-NH2.
20. Спосіб за одним з пп. 18 і 19, який відрізняється тим, що терапію застосовують у пацієнтів, які не достатньою мірою можуть контролювати діабет II типу за допомогою Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiнy людини і/або desPro36ексендин-4(1-39)-LyS6-NH2.
21. Спосіб за одним з пп. 18 або 19, який відрізняється тим, що пацієнти повинні мати значення НbА1с від 7 до 10 %.
22. Спосіб за одним з пп. 18, 19 або 20 для лікування діабету II типу і/або ожиріння.
23. Застосування композиції за будь-яким з пп. 1-10 як доповнення до дієти для того, щоб контролювати рівень цукру в крові у пацієнтів з діабетом II типу, якщо показане застосування Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiнy людини або desPro36ексендин-4(1-39)-LyS6-NH2.
Текст
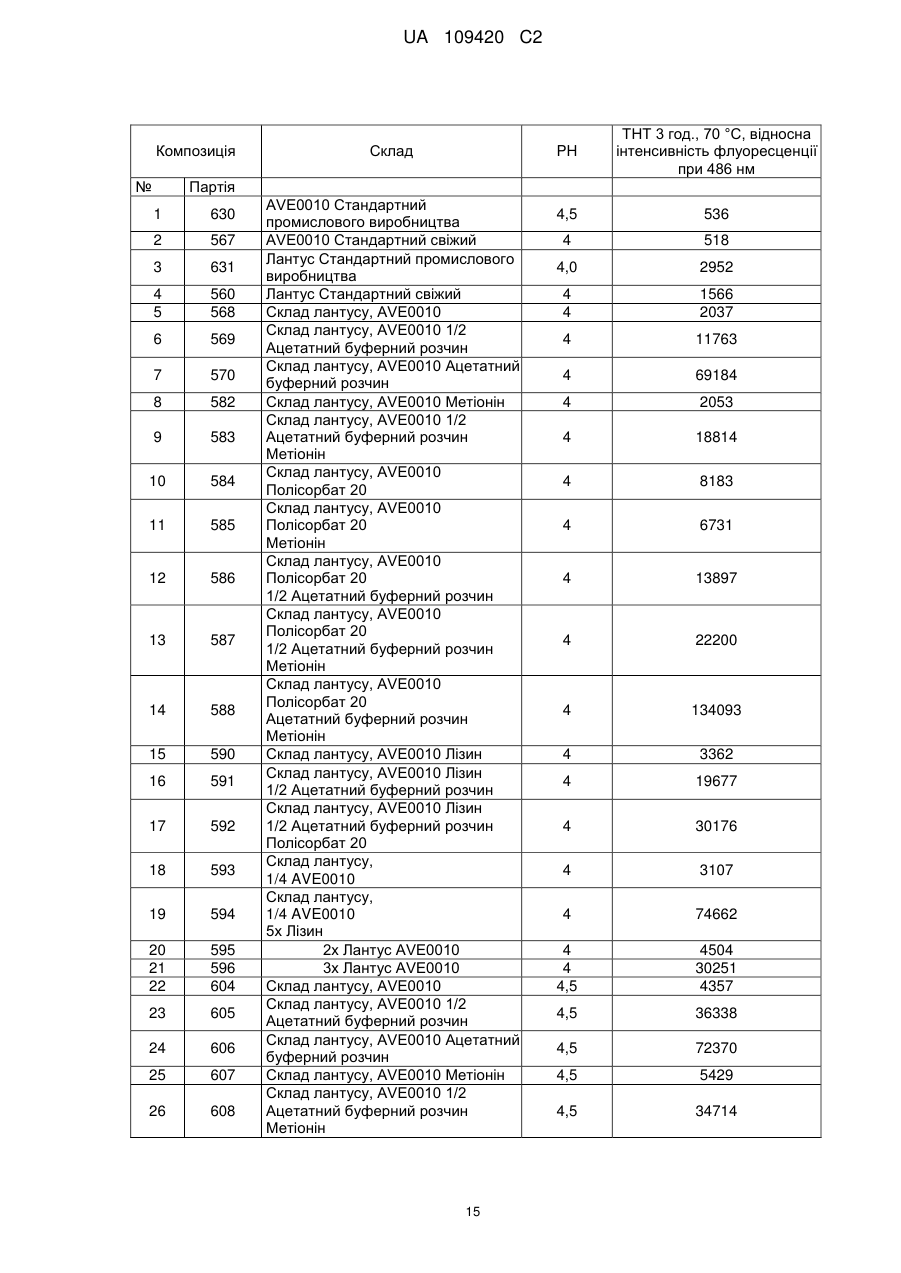
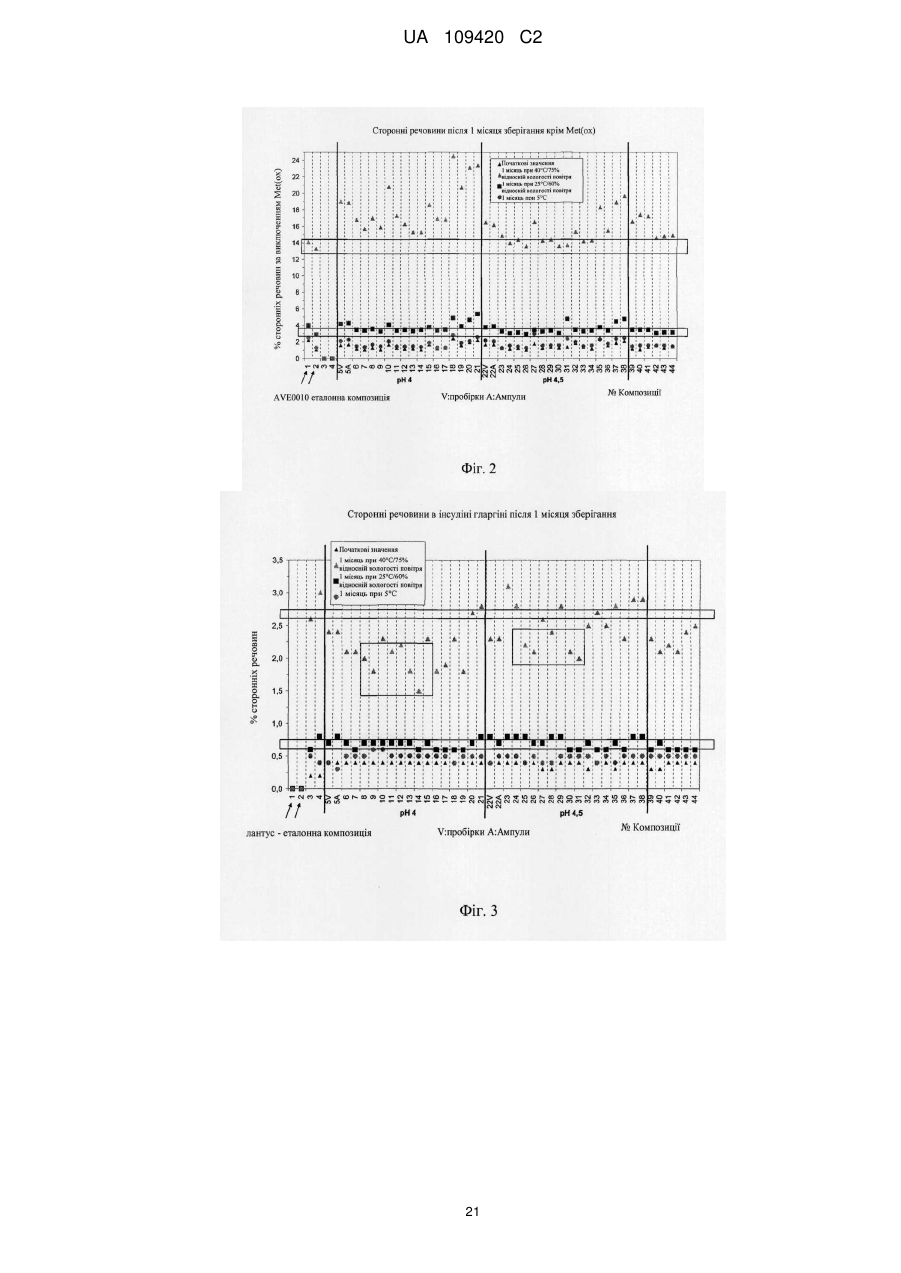
Реферат: 36 Винахід стосується рідкої композиції, що включає агоніст GLP-1 (desPro ексендин-4(1-39)-LyS6NH2) і/або його фармакологічно прийнятну сіль, інсулін (Gly(A21)-Arg(B31)-Arg(B32)-iнcyлiн людини) і/або його фармакологічно прийнятну сіль і, необов'язково, щонайменше одну фармацевтично прийнятну допоміжну речовину, де дана композиція містить L-метіонін та має значення pH від 3,5 до 4,5. UA 109420 C2 (12) UA 109420 C2 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 60 Об'єктом даної заявки є рідка композиція, яка включає агоніст GLP-1 і/або його фармакологічно прийнятну сіль, інсулін і/або його фармакологічно прийнятну сіль і, необов'язково, щонайменше одну фармацевтично прийнятну допоміжну речовину, причому дана композиція відрізняється тим, що містить метіонін. Наступним об'єктом є композиція за винаходом для лікування цукрового діабету. Ще одним об'єктом є застосування композиції за винаходом для одержання лікарського засобу для лікування цукрового діабету. Наступним об'єктом даної заявки є спосіб одержання композиції за винаходом, що включає композицію агоніста GLP-1 і/або його фармакологічно прийнятної солі з інсуліном і/або його фармацевтично прийнятною сіллю, метіоніном і, необов'язково, щонайменше однією фармацевтично прийнятною допоміжною речовиною. Наступним об'єктом є спосіб лікування пацієнтів композицією за винаходом, який включає введення композиції пацієнтам. Звичайно композиції інсуліну і GLP-1-сполук містять засіб, що забезпечує ізотонічність, буферний розчин для доведення значення pH і консервант. Наступним часто застосовуваним компонентом композицій інсуліну є цинк, який утворює з інсуліном комплекс. Таким чином, досягають уповільненої дії інсуліну. WO 2003/02021 (Eli Lilly) стосується рідкої попередньо приготованої композиції, яка включає 8 сполуку GLP-1 і базальний інсулін. Одна конкретна композиція містить Val -GLP-1 або ексендин4, інсулін NPH, гліцерин як засіб, що забезпечує ізотонічність, м-крезол і фенол як консервант, і 8 22 фосфатний буфер з pH 7,6 або 8. Інша композиція містить ексендин-4 або Val -Glu -GLP-1(737)OH, інсулін-гларгін (лантус), цинк, гліцерин і манітол як засіб, що забезпечує ізотонічність, мкрезол як консервант, ацетат натрію і цинку, pH 4. У WO 2004/035623 (Zealand Pharmaceuticals) описана рідка композиція, що включає стабілізований ексендин, 50 мМ гістидин, від 100 до 200 мМ сахароза, манітол або інший прийнятний цукор, 20 мМ метіонін, 20 мМ аспаргін-глютамін або Asp, з pH 5,3. Стабілізації досягають певною модифікацією амінокислотних залишків ексендину-4(1-39), наприклад, в положеннях Gln13, Met14, Trp25 або Asn28. Дана композиція не містить інсуліну. У WO 2005/046716 (Novo Nordisk) описують рідку композицію, яка містить ліраглютид і інсулін аспарт, буферний розчин з pH 7,7, полоксамер 188 як поверхнево-активну речовина, фенол, пропіленгліколь і необов'язково цинк. Без полоксамеру 188 дана композиція є нестабільною. Стабілізації можна досягнути за допомогою полісорбату 20. WO 2006/029634 (Novo Nordisk) стосується рідкої фармацевтичної композиції, яка містить B10 інсулінотропний пептид (агоніст GLP-1), інсуліновий пептид і ліганд His (ліганд His в положенні 10 В-ланцюга інсуліну). Композиція може як ПАР містити полісорбат 20 або полоксамер 188. Конкретна описана в даному документі композиція містила інсулін людини або B28-Asp-інсулін людини (інсулін аспарт), ліраглютид (агоніст GLP-1), гліцерин як засіб, що забезпечує ізотонічність, ацетат цинку, з pH 7,4 або 7,9. Залежно від кількості застосовуваного інсуліну або ліраглютиду дана композиція була частково нестабільна вже після 15 днів зберігання при кімнатній температурі. Стабільності даної композиції досягали додаванням В10 ліганду His . Наступні композиції складалися з ліраглютиду, інсуліну аспарту або детеміру, пропіленгліколю, фенолу і фосфатного буфера з pH 7,7. Дані композиції практично відразу були B10 нестабільними. Додавання полоксамеру 188 або полісорбату 20 і ліганду His приводило до стабілізації. У WO 2006/051103 (Novo Nordisk) описана рідка композиція, яка містить детемір (базальний інсулін), ліраглютид (сполука GLP-1) і полоксамер 188 або полісорбат 20 як ПАР. Додатково містяться фенол, NaCl, пропіленгліколь, ацетат цинку і натрійфосфатний або гліцилгліциновий буфер (pH 7,7). У деяких композиціях міститься м-крезол. Дані композиції можна стабілізувати додаванням полоксамеру 188 або полісорбату 20. WO 2008/124522 (Biodel) стосується композицій, які містять інсулін, цинк-халатуючий агент (наприклад, EDTA або EGTA) і аналог GLP-1. У всьому світі близько 120 млн. чоловік страждають цукровим діабетом. Серед них приблизно 12 млн. діабетиків I типу, для яких заміщення ендокринної секреції інсуліну, якої бракує, є на даний час єдиною можливою терапією. Хворі мають потребу довічно, як правило, декілька разів на день в ін'єкціях інсуліну. На протилежність діабету I типу, при діабеті II типу не обов'язково існує нестача інсуліну, однак у множині випадків, передусім в прогресуючій стадії, лікування інсуліном необов'язково в комбінації з оральними антидіабетичними засобами розглядають як найбільш сприятливу форму терапії. У здорової людини вивільнення інсуліну підшлунковою залозою суворо пов'язане з концентрацією глюкози в крові. Підвищений рівень глюкози в крові, який утворюється після прийому їжі, незабаром компенсується відповідним підвищенням секреції інсуліну. У стані 1 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 натщесерце рівень інсуліну падає до найнижчого значення, якого вистачає, щоб забезпечувати безперервне постачання чутливих до інсуліну органів і тканин глюкозою і підтримувати вироблення глюкози в печінці вночі на низькому рівні. Компенсацією фізіологічної секреції інсуліну екзогенним, в більшості випадків підшкірним, введенням інсуліну, як правило, не досягають вищеописаної якості фізіологічного регулювання рівня глюкози в крові. Часто доходить до безконтрольного підвищення або зниження рівня глюкози в крові, що може викликати загрозу для життя в найважчих формах. Однак, нарівні з цим, підвищений протягом багатьох років рівень глюкози в крові без первинних симптомів також представляє значний ризик для здоров'я. Великомасштабне DCCT-дослідження в США (The Diabetes Control and Complications Trial Research Group (1993), N. Engl. J. Med. 329, 977-986) однозначно підтвердило, що хронічно підвищений рівень глюкози в крові значною мірою відповідає за розвиток пізніх ускладненні діабету. Пізні ускладнення діабету являють собою мікро- і макросудинні пошкодження, які виявляють себе при відомих обставинах як ретинопатія, нефропатія або невропатія і можуть приводити до втрати зору, ниркової недостатності, а також до втрати кінцівок і, крім того, супроводжуються підвищеним ризиком для серця і пов'язаними з порушенням кровообігу хворобами. З цього зрозуміло, що поліпшення лікування діабету повинно бути націлене насамперед на те, щоб утримувати рівень глюкози в крові по можливості ближче до фізіологічного діапазону. Після програми посиленого інсулінового лікування, вищезгаданої мети необхідно досягати неодноразовими щоденними ін'єкціями швидко і уповільнено діючих препаратів інсуліну. Швидкодіючі форми приймають перед прийомом їжі для того, щоб вирівнювати виникаючий після прийому їжі підйом рівня глюкози в крові. Уповільнено діючий базальний інсулін повинен забезпечувати основне постачання інсуліном, зокрема вночі, для виключення гіпоглікемії. Інсулін являє собою поліпептид з 51 амінокислот, які розподілені на 2 амінокислотних ланцюги: ланцюг А з 21 амінокислоти і ланцюг В з 30 амінокислот. Ланцюги зв'язані один з одним 2-ма дисульфідними містками. Препарати інсуліну багато років застосовують для лікування діабету. При цьому застосовують інсулін не тільки природного походження, а останнім часом також похідні інсуліну і його аналоги. Аналоги інсуліну являють собою аналоги інсуліну природного походження, а саме інсуліну людини або інсуліну тварин, які відрізняються від, відповідно, в іншому такого ж інсуліну природного походження, заміною щонайменше одного амінокислотного залишку природного походження залишком іншої амінокислоти і/або додаванням/видаленням щонайменше одного амінокислотного залишку. При цьому мова може йти також про амінокислоти, які не є природними. Похідні інсуліну являють собою похідні інсуліну природного походження або аналоги інсуліну, які одержані хімічним модифікуванням. Хімічне модифікування може полягати, наприклад, в додаванні однієї або декількох певних хімічних груп до однієї або декількох амінокислот. Як правило похідні інсуліну і аналоги інсуліну надають в порівнянні з людським інсуліном трохи змінену дію. Аналоги інсуліну з прискореним настанням дії описані в EP 0214826, EP 0375437 і EP 0678522. EP 0124826 стосується заміщення B27 і B28. EP 0678522 описує аналоги інсуліну, які в положенні B29 мають різні амінокислоти, переважно пролін, але не глютамінову кислоту. EP 0375437 охоплює аналоги інсуліну з лізином або аргініном в B28, які опціонально можуть бути модифіковані в B3 і/або A21. У EP 0419504 описані аналоги інсуліну, які захищені від хімічної модифікації, в яких замінені аспарагін в B3 і щонайменше одна додаткова амінокислота в положеннях A5, A15, A18 або A21. У WO 92/00321 описані аналоги інсуліну, у яких щонайменше одна амінокислота в положеннях B1-B6 замінена лізином або аргініном. Дані інсуліни мають згідно з WO 92/00321 продовжену дію. Уповільнену дію також мають описані в EP-A 0368187 аналоги інсуліну. Наявні в продажу препарати інсуліну з інсуліну природного походження для інсулінзамісної терапії розрізнюються в походженні інсуліну (наприклад, інсулін великої рогатої худоби, інсулін свині, інсулін людини), а також складом, що може впливати на профіль дії (початок дії і час впливу). Завдяки комбінації різних препаратів інсуліну можна досягати різних профілів дії і встановлювати якомога більш фізіологічні значення цукру крові. На даний час технологія рекомбінантних ДНК робить можливим одержання даних модифікованих інсулінів. До них відносять інсулін гларгін (Gly(A21)-Arg(B31)-Arg(B32)-інсулін людини, лантус) з тривалим часом впливу. Інсулін гларгін вводять у вигляді кислого, чистого розчину, і потім він внаслідок його властивостей розчинення в фізіологічній області pH випадає в підшкірній тканині у вигляді стабільних асоціатів гексамерів. Інсулін гларгін вводиться один раз на день і відрізняється від 2 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 60 інших інсулінів тривалої дії рівномірним профілем в рідкій фазі і пов'язаним з цим зменшенням небезпеки нічних гіпоглікемій (Schubert-Zsilavecz et al., 2:125-130 (2001)). Спеціальний препарат інсуліну гларгіну, який приводить до подовженого часу впливу, відрізняється тим, що являє собою прозорий розчин з кислим значенням рН. Ексендини являють собою групу пептидів, які можуть знижувати концентрацію цукру в крові. Ексендини мають схожу послідовність з GLP-1(7-36) (53 %, Goke et al. J. Biol Chem. 268, 1965055). Ексендин-3 і ексендин-4 стимулюють підйом вироблення cAMP в клітинах ацинуса підшлункової залози морських свинок за допомогою взаємодії з рецепторами ексендину (Raufman, 1996, Reg. Peptides. 61:1-18). Ексендин-3 на протилежність ексендину-4 викликає підйом вивільнення амілази в клітинах ацинуса підшлункової залози. Ексендини діють як агоністи GLP-1. Глюкагоноподібний пептид 1 (GLP-1) являє собою гормон внутрішньої секреції, який підвищує інсулінову відповідь після орального прийому глюкози або жирів. У загальному GLP-1 знижує концентрацію глюкагону, уповільнює випорожнення шлунка, стимулює біосинтез проінсуліну, підвищує чутливість до інсуліну і стимулює незалежний від інсуліну біосинтез глікогену (Holst (1999), Curr. Med. Chem. 6:1005, Nauck et al. (1997), Exp Clin Endocrinol Diabetes 105:187, Lopez-Delgado et al. (1998), Endocrinology, 139:2811). GLP-1 людини має 37 залишків амінокислот (Heinrich et al., Endocrinol. 115:2176 (1984), Uttenthal et al., J Clin Endocrinol Metabol (1985), 61:472). Активні фрагменти GLP-1 включають GLP-1(7-36) і GLP-1(7-37). Ексендин-3, ексендин-4 і агоністи ексендину пропонують для лікування цукрового діабету і попередження гіперглікемії, при цьому зменшуються рухливість і випорожнення шлунка (US 5424286 і WО 98/05351). Аналоги ексендину можуть відрізнятися заміщеними амінокислотами і/або такими, що закінчуються С-обривами природної послідовності ексендину-4. Подібні аналоги ексендину описані в WO 99/07404, WO 99/25727 і WO 99/25728. Твердофазний синтез AVE0010 описаний в WO 01/04156 A1. AVE0010 має послідовність: 36 desPro ексендин-4(1-39)-Lys6-NH2. Дана речовина розкрита в WO 01/04156 як SEQ ID NO:93: H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-S-K-K-K-K-KK-NH2 (SEQ ID NO:1). Ексендин-4 (39 AS) має послідовність: H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-P-S-NH2 (SEQ ID NO:2). Ексендин-3 має послідовність (J. Bio. Chem., 267, 1992, 7402-7405): H-His-Ser-Asp-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-PheIle-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-NH2 (SEQ ID NO: 3). GLP-1 має послідовність: H-A-E-G-T-F-T-S-D-V-S-S-Y-L-E-G-Q-A-A-K-E-F-I-A-W-L-V-K-G-R-NH2 (SEQ ID NO: 4). Задача даного винаходу полягає в тому, щоб підвищити стабільність рідких композицій, що включають агоніст GLP-1 і інсулін. Зокрема необхідно поліпшити фізичну і хімічну цілісність. Дану задачу вирішують за допомогою того, що агоніст GLP-1 і інсулін комбінують з метіоніном. Було виявлено, що метіонін може поліпшувати стабільність при зберіганні композицій, що включають агоніст GLP-1, такий як AVE0010, і інсулін, такий як інсулін гларгін. Метіонін не надає впливу на фізичну цілісність даних композицій. Стабільність фармацевтично ефективних поліпептидів може погіршуватися через різні причини. До даних причин належать вплив pH, температури, світла і певних компонентів. У контексті даного винаходу було виявлено, що ряд загальноприйнятих компонентів композицій інсуліну або композицій агоніста GLP-1 негативно позначається на хімічній і/або фізичній цілісності і стабільності при зберіганні композицій, які містять інсулін і агоніст GLP-1. Даними компонентами є, наприклад, ацетат, полісорбат 20, полісорбат 80, полоксамер 188, хлорид бензалконію і лізин. Тому композиції за винаходом переважно не містять вказаних компонентів. Об'єктом даного винаходу є рідка композиція, що включає агоніст GLP-1 і/або його фармакологічно прийнятну сіль, інсулін і/або його фармакологічно прийнятну сіль і, необов'язково, щонайменше одну фармацевтично прийнятну допоміжну речовину, причому дана композиція відрізняється тим, що містить метіонін. Композиція за винаходом містить метіонін переважно в кількості від 0,5 мг/мл до 20 мг/мл, більш переважно в кількості від 1 мг/мл до 5 мг/мл, особливо переважно в кількості 3,0 мг/мл. Метіонін може застосовуватися в D-формі. Також може застосовуватися метіонін в L-формі. Також може застосовуватися суміш D- і L-форми в будь-яких пропорціях. Зокрема, композиція за винаходом не містить ПАВ, такі як поліоли, часткові складні і прості ефіри і складні і прості ефіри жирних кислот і багатоатомних спиртів, таких як гліцерин і 3 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 сорбітол. Композиції за винаходом, зокрема, не містять часткових складних і простих ефірів і складних і простих ефірів жирних кислот і гліцерину і сорбітолу, вибраних з групи, що включає ® ® ® ® ® Span , Tween , Myrj , Brij , Cremophor . Далі, композиції не містять, зокрема, поліолів, вибраних з групи, що включає поліпропіленгліколі, поліетиленгліколі, полоксамери, плюроніки, тетроніки. Зокрема, композиції за винаходом вільні від щонайменше полісорбату і полоксамеру. Зокрема, композиція за винаходом по суті не містить, переважно зовсім не містить, полісорбат, такий як, наприклад, полісорбат 20. Зокрема, композиція за винаходом по суті не містить, переважно зовсім не містить, полісорбат 80. Зокрема, композиція за винаходом по суті не містить, переважно зовсім не містить, полоксамер, такий як, наприклад, полоксамер 188. Зокрема, композиція за винаходом по суті не містить, переважно зовсім не містить, хлорид бензалконію. Зокрема, композиція за винаходом по суті не містить, переважно зовсім не містить, гістидин. Зокрема, композиція за винаходом по суті не містить, переважно зовсім не містить, EDTA, зокрема натрій-EDTA. Зокрема, композиція за винаходом по суті не містить, переважно зовсім не містить, гістидин і натрій-EDTA. Композиція за винаходом може містити одну або декілька речовин, які звичайно застосовують для буферизації значення pH (буферні речовини). Прикладами подібних буферних речовин є ацетати, цитрати і фосфати. Зокрема, композиція за винаходом може містити одну або декілька речовин, які звичайно застосовують для буферизації значення pH, в кількості, достатній для того, щоб бути протиіоном для агоніста GLP-1 і/або інсуліну. Композиція за винаходом може містити одну або декілька буферних речовин, наприклад, кожну в кількості до 1 мг/мл, до 0,5 мг/мл, до 0,1 мг/мл, до 0,05 мг/мл, до 0,02 мг/мл або до 0,01 мг/мл. Композиція за винаходом також може по суті не містити буферних речовин. Переважно композиція за винаходом не містить буферних речовин. Композиція за винаходом може містити ацетат, наприклад, в кількості до 1 мг/мл, до 0,5 мг/мл, до 0,1 мг/мл, до 0,05 мг/мл, до 0,02 мг/мл або до 0,01 мг/мл. Дана кількість, наприклад, є достатньою для того, щоб бути протиіоном для агоніста GLP-1. Також композиція за винаходом може по суті не містити ацетат. Переважно композиція за винаходом не містить ацетат. Композиція за винаходом може містити цитрат, наприклад, в кількості до 1 мг/мл, до 0,5 мг/мл, до 0,1 мг/мл, до 0,05 мг/мл, до 0,02 мг/мл або до 0,01 мг/мл. Дана кількість, наприклад, є достатньою для того, щоб бути протиіоном для агоніста GLP-1. Також композиція за винаходом по суті не містить цитрат. Переважно композиція за винаходом не містить цитрат. Композиція за винаходом може містити фосфат, наприклад, в кількості до 1 мг/мл, до 0,5 мг/мл, до 0,1 мг/мл, до 0,05 мг/мл, до 0,02 мг/мл або до 0,01 мг/мл. Дана кількість, наприклад, є достатньою для того, щоб бути протиіоном для агоніста GLP-1. Також композиція за винаходом по суті не містить фосфат. Переважно композиція за винаходом не містить фосфат. Згідно з даним винаходом фармацевтична композиція може мати значення pH в кислій або фізіологічній області. Кисла область pH лежить переважно в інтервалі pH 1-6,8, pH 3,5-6,8 або pH 3,5-5. Фізіологічна область pH лежить переважно в інтервалі pH 2,5-8,5, більш переважно pH від 4,0 до 8,5, ще більш переважно pH від 6,0 до 8,5. Особливо переважним є значення pH приблизно 4,5. Для доведення значення pH придатні фізіологічно безпечні розбавлені кислоти (звичайно HCl) або, відповідно, луги (звичайно NaOH). Композиція за винаходом може містити придатний консервант. Придатними консервантами є, наприклад, фенол, м-крезол, бензиловий спирт і/або складний ефір п-гідроксибензойної кислоти. Переважним є м-крезол. Однак також можна відмовитися від застосування консерванту. Композиція за винаходом може містити іони цинку. Концентрація іонів цинку знаходиться переважно в області від 1 мкг/мл до 2 мг/мл, більш переважно від 5 мкг/мл до 200 мкг/мл, зокрема максимум 0,06 мг/мл, особливо переважно 0,06 мг/мл. Далі, композиція за винаходом може містити придатний засіб, що забезпечує ізотонічність. Придатними є, наприклад, гліцерин, декстроза, лактоза, сорбітол, манітол, глюкоза, NaCl, сполуки кальцію або магнію, такі як CaCl2 і т. д. Концентрація гліцерину, декстрози, лактози, сорбітолу, манітолу і глюкози знаходиться звичайно в області від 100-250 мМ, NaCl знаходиться в концентрації до 150 мМ. Переважним є гліцерин. Зокрема, переважний 85 % гліцерин в концентрації 20,0 мг/мл. 4 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 60 Далі, композиція за винаходом може містити додаткові добавки, наприклад солі, які уповільнюють вивільнення щонайменше одного інсуліну. Переважно композиція не містить даних добавок. Зокрема, дана композиція передбачена для парентерального введення. Композиція за винаходом переважно являє собою придатну для введення ін'єкцією композицію, більш переважно придатну для підшкірних ін'єкцій. Зокрема, композиція за винаходом придатна для однократного щоденного введення. Зокрема, композиція за винаходом після зберігання протягом 1 місяця, 2 місяців, 4 місяців або 8 місяців при температурі 5 °C або 25 °C має активність щонайменше 80 %, щонайменше 90 %, щонайменше 95 %, або щонайменше 98 % від активності у вихідний момент часу. "Активність" в даній заявці може означати активність інсуліну, який застосовують в композиції за винаходом. Способи визначення активності інсуліну відомі фахівцям. "Активність" в даній заявці може також означати активність агоніста GLP-1, який застосовують в композиції за винаходом. Способи визначення активності агоніста GLP-1 відомі фахівцям. Композиція за винаходом, зокрема, після зберігання протягом 1 місяця, 2 місяців, 4 місяців або 6 місяців має хімічну цілісність. Хімічна цілісність означає, зокрема, те, що після зберігання при температурі 5 °C, 25 °C або 40 °C щонайменше 80 %, щонайменше 90 %, щонайменше 95 %, або щонайменше 98 % діючих речовин відносно вихідного моменту часу знаходяться по суті в хімічно незміненій формі. Хімічна цілісність може означати хімічну цілісність агоніста GLP-1. Агоніст GLP-1 може містити залишок метіоніну (наприклад, в положенні 14 в AVE0010). Хімічна цілісність агоніста GLP-1 означає, зокрема, те, що відвернене окислення даного залишку метіоніну. Хімічна цілісність може також означати хімічну цілісність інсуліну. Переважно хімічна цілісність означає цілісність інсуліну і агоніста GLP-1. Композиція за винаходом, зокрема, після зберігання протягом 1 місяця, 2 місяців, 4 місяців або 6 місяців має фізичну цілісність. Фізична цілісність означає, зокрема, те, що після зберігання при температурі 5 °C, 25 °C або 40 °C щонайменше 80 %, щонайменше 90 %, щонайменше 95 %, або щонайменше 98 % діючих речовин відносно вихідного моменту часу по суті знаходяться в фізично незміненій формі. Фізична цілісність може означати фізичну цілісність агоніста GLP-1. Також фізична цілісність може означати фізичну цілісність інсуліну. Фізична цілісність означає, зокрема, те, що агоніст GLP-1 і/або інсулін не утворюють агрегатів, таких як, наприклад, фібрили. Переважно фізична цілісність означає фізичну цілісність інсуліну і агоніста GLP-1. Агоніст GLP-1 переважно вибирають з групи, що складається з ексендину-3 і його аналогів і похідних, ексендину-4 і його аналогів і похідних, при цьому агоніст GLP-1 більш переважно вибирають групи, що складається з AVE0010 і ексендину-4. Ексендин-3, аналоги і похідні ексендину-3, ексендин-4 і аналоги, і похідні ексендину-4 можна знайти в WO 01/04156, WO 98/30231, US 5424286, в заявці EP 99610043.4 і в WO 2004/005342. Вказані документи включені в дану роботу у вигляді посилання. Описані у вказаних документах ексендин-3, ексендин-4 і їх аналоги, і похідні можуть бути синтезовані описаними в даній роботі способами, причому за необхідності після закінчення одержання можна проводити модифікацію. Послідовності AVE0010 (SEQ ID NO:1), ексендину-4 (SEQ ID NO:2) і ексендину-3 (SEQ ID NO:3) мають високу міру відповідності. Послідовності AVE0010 і ексендину-4 ідентичні в положеннях 1-37. Послідовність 1-39 ексендину-4 в 37 з 39 положень (94 %) ідентична послідовності ексендину-3 в положеннях 48-88. Основуючись на даних послідовностях, фахівці можуть наведені тут дані положень, які належать до певної послідовності (наприклад, до послідовності AVE0010 або ексендину-4), без ускладнень застосувати до інших послідовностей. Аналоги і похідні ексендину-3 і/або ексендину-4 містять, зокрема,модифіковані послідовності амінокислот. Наприклад, окремі амінокислоти можуть бути видалені (наприклад, 36 37 28 14 desPro , desPro , desAsp , desMet(О) в ексендині-4 і відповідні положення в ексендині-3). 14 25 28 Також окремі положення можуть бути замінені (наприклад, Met(O) , Trp(О2) , IsoAsp , 28 38 Asp Pro в ексендині-4 і відповідні положення в ексендині-3), причому також можна застосовувати неприродні амінокислоти, такі як Met(О) (метіонінсульфоксид або метіонінсульфон), Trp(О2) (N-формілкінуренін) і/або IsoAsp (β-аспартат або ізоаспартат). Ненатуральні амінокислоти можна без ускладнень вводити в послідовність у формі відповідних амінокислотних структурних елементів. Далі, можуть бути модифіковані С-кінець і/або N-кінець, наприклад, за допомогою додаткових послідовностей, таких як -(Lys)-, -(Lys)2-, -(Lys)3-, -(Lys)4-, -(Lys)5-, -(Lys)6-, -Asn(Glu)5-, при цьому -(Lys)4-, -(Lys)5-, -(Lys)6-, -Asn-(Glu)5- є переважними. Карбоксильну групу С 5 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 кінця переважно модифікують в групу аміду кислоти (-NH2). Необов'язково модифікування Скінців і/або N-кінців проводять як додаткову стадію технологічного процесу після закінчення синтезу. Фармацевтично прийнятну сіль можна одержувати на наступній стадії технологічного процесу після закінчення циклу синтезу згідно зі способом за винаходом. Способи одержання фармацевтично прийнятних солей пептидів відомі фахівцям. Переважною фармацевтично прийнятною сіллю є ацетат. Агоніст GLP-1 переважно вибирають з групи, що складається з ексендину-4, аналогів і похідних ексендину-4 і їх фармакологічно прийнятних солей. Наступним переважним агоністом GLP-1 є аналог ексендину-4, який вибирають з групи, що складається з: 36 H-desPro ексендин-4-Lys6-NH2, 36,37 H-des(Pro )ексендин-4-Lys4-NH2, 36,37 H-des(Pro )ексендин-4-Lys5-NH2 і їх фармакологічно прийнятних солей. Наступним переважним агоністом GLP-1 є аналог ексендину-4, який вибирають з групи, що складається з: 36 28 desPro [Asp ]ексендин-4(1-39), 36 28 desPro [IsoAsp ]ексендин-4(1-39), 36 14 28 desPro [Met(O) ,Asp ]ексендин-4(1-39), 14 28 desPro36[Met(O) ,IsoAsp ]ексендин-4(1-39), 36 25 28 desPro [Trp(O2) ,Asp ]ексендин-2(1-39), 36 25 28 desPro [Trp(O2) ,IsoAsp ]ексендин-2(1-39), 36 14 25 28 desPro [Met(O) Trp(O2) ,Asp ]ексендин-4(1-39), 36 14 25 28 desPro [Met(O) Trp(O2) ,IsoAsp ]ексендин-4(1-39) і їх фармакологічно прийнятних солей. Наступним переважним агоністом GLP-1 є аналог ексендину-4, який вибирають з групи, що містить аналоги ексендину-4, до С-кінців яких, як описано в попередній частині, приєднаний пептид -Lys6-NH2. Наступним переважним агоністом GLP-1 є аналог ексендину-4, який вибирають з групи, що складається з: 36 28 H-(Lys)6-desPro [Asp ]ексендин-4(1-39)-Lys6-NH2, 28 36 37 38 desAsp Pro ,Pro ,Pro ексендин-4(1-39)-NH2, 36 37 38 28 H-(Lys)6-desPro ,Pro ,Pro [Asp ]ексендин-4(1-39)-NH2, 36 37 38 28 H-Asn-(Glu)5desPro ,Pro ,Pro [Asp ]ексендин-4(1-39)-NH2, 36 37 38 28 desPro ,Pro ,Pro [Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 37 38 28 H-(Lys)6-desPro ,Pro ,Pro [Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 37 38 28 H-Asn-(Glu)5-desPro ,Pro ,Pro [Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 25 28 H-(Lys)6-desPro [Trp(O2) ,Asp ]ексендин-4(1-39)-Lys6-NH2, 28 36 37 38 25 H-desAsp ,Pro ,Pro ,Pro [Trp(O2) ]ексендин-4(1-39)-NH2, 36 37 38 25 28 H-(Lys)6-desPro ,Pro ,Pro [Trp(O2) ,Asp ]ексендин-4(1-39)-NH2, 36 37 38 25 28 H-Asn-(Glu)5-desPro ,Pro ,Pro [Trp(O2) ,Asp ]ексендин-4(1-39)-NH2, 36 37 38 25 28 desPro ,Pro ,Pro [Trp(О2) ,Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 37 38 25 28 H-(Lys)6-desPro ,Pro ,Pro [Trp(O2) ,Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 37 38 25 28 H-Asn-(Glu)5-desPro ,Pro ,Pro [Trp(O2) ,Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 14 28 H-(Lys)6-desPro [Met(O) ,Asp ]ексендин-4(1-39)-Lys6-NH2, 14 28 36 37 38 desMet(O) Asp Pro ,Pro ,Pro ексендин-4(1-39)-NH2, 36 37 38 14 28 H-(Lys)6-desPro ,Pro ,Pro [Met(O) ,Asp ]ексендин-4(1-39)-NH2, 36 37 38 14 28 H-Asn-(Glu)5-desPro ,Pro ,Pro [Met(O) ,Asp ]ексендин-4(1-39)-NH2, 36 37 38 14 28 desPro ,Pro ,Pro [Met(O) ,Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 37 38 14 28 H-(Lys)6-desPro ,Pro ,Pro [Met(O) ,Asp ]ексендин-4(1-39)-Lys6-NH2, 36 37 38 14 28 H-Asn-(Glu)5-desPro ,Pro ,Pro [Met(O) ,Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 14 25 28 H-(Lys)6-desPro [Met(O) ,Trp(O2) ,Asp ]ексендин-4(1-39)-Lys6-NH2, 28 36 37 38 14 25 desAsp Pro ,Pro ,Rro [Met(O) ,Trp(O2) ]ексендин-4(1-39)-NH2, 36 37 38 14 25 28 H-(Lys)6-desPro ,Pro ,Pro [Met(O) ,Trp(O2) ,Asp ]ексендин-4(1-39)-NH2, 36 37 38 14 28 H-Asn-(Glu)5-desPro ,Pro ,Pro [Met(O) ,Asp ]ексендин-4(1-39)-NH2, 36 37 38 14 25 28 desPro ,Pro ,Pro [Met(O) ,Trp(O2) ,Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 37 38 14 25 28 H-(Lys)6-desPro ,Pro ,Pro [Met(O) ,Trp(O2) ,Asp ]ексендин-4(1-39)-(Lys)6-NH2, 36 37 38 14 25 28 4(1-H-Asn-(Glu)5-desPro ,Pro ,Pro [Met(O) ,Trp(O2) ,Asp ]ексендин-4(1-39)-Lys)6-NH2 і їх фармакологічно прийнятних солей. 6 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 Також можна вибирати агоніст GLP-1 з GLP-1 і аналогів і похідних GLP-1. Наступний 34 26 ε α переважний агоніст GLP-1 вибирають з групи, що складається з Arg ,Lys (N (γ-глутаміл(N гексадеканоїл)))GLP-1(7-37) [Ліраглютид] і його фармакологічно прийнятної солі. Наступним переважним агоністом GLP-1 є AVE0010. AVE0010 має послідовність 36 desPro ексендин-4(1-39)-Lys6-NH2 (SEQ ID NO:1). Також переважні фармакологічно прийнятні солі AVE0010. Агоніст GLP-1, наприклад AVE0010, застосовують зокрема в кількості від 0,01 мг/мл до 0,5 мг/мл або від 0,05 мг/мл до 1,5 мг/мл. У даній заявці поняття "інсулін" включає не тільки немодифікований інсулін, а також аналоги інсуліну, похідні інсуліну і метаболіти інсуліну. Композиції за винаходом включають один або декілька компонентів незалежно один від одного, вибраних з групи, яка складається з інсуліну (наприклад, немодифікованого інсуліну), аналогів інсуліну, похідних інсуліну, метаболітів інсуліну і будь-яких комбінацій вказаних речовин. Щонайменше один інсулін може бути незалежно вибраний з групи, яка складається з інсуліну великої рогатої худоби, його аналогів, похідних і метаболітів, інсуліну свині, його аналогів, похідних і метаболітів і інсуліну людини, його аналогів, похідних і метаболітів. Переважно, щонайменше один інсулін незалежно вибирають з інсуліну людини, його аналогів, похідних і метаболітів. Далі, згідно з даним винаходом інсулін можна незалежно вибирати з немодифікованих інсулінів, зокрема з інсуліну великої рогатої худоби, інсуліну свині і інсуліну людини. Щонайменше один інсулін може бути незалежно вибраний з групи, що складається з інсуліну великої рогатої худоби, інсуліну свині і інсуліну людини. Більш переважно, щонайменше один інсулін незалежно вибирати з інсуліну людини. Згідно з даним винаходом інсулін може бути вибраний з немодифікованого інсуліну, зокрема з інсуліну великої рогатої худоби, інсуліну свині і інсуліну людини. Згідно з даним винаходом похідні інсуліну являють собою похідні одержаного з натуральних джерел інсуліну і/або аналоги інсуліну, які одержані за допомогою хімічного модифікування. Хімічне модифікування може, наприклад, полягати в приєднанні однієї або декількох певних хімічних груп до однієї або декількох амінокислот. Аналоги інсуліну, які описані в EP 0214826, EP 0375437, EP 0678522, EP 0419504, WO 92/00321, EP-A0368187 і W02009/063072, можуть бути компонентами композиції за винаходом. Документи EP 0214826, EP 0375437, EP 0678522, EP 0419504, WO 92/00321, EP-A0368187 і WO 2009/063072 включені в дану роботу як посилання. Згідно з даним винаходом переважний аналог інсуліну може бути вибраний з групи, яка включає Gly(A21)-Arg(B31)-Arg(B32)інсулін людини (інсулін гларгін), Lys(B3)-Glu(B29)інсулін В28 В29 людини; Lys Pro інсулін людини (інсулін лізпро), B28Asp-інсулін людини (інсулін аспарт), інсулін людини, у якому пролін в положенні B28 замінений Asp, Lys, Leu, Val або Ala і у якому в положенні B29 Lys може бути замінений на Pro; AlaB26-інсулін людини; Des(B28-B30)інсулін людини; Des(B27)інсулін людини або B29Lys(ε-тетрадеканоїл),des(B30)інсулін людини (інсулін εB29 εB29 α детемір), N -тетрaдеканоїл, des(B30)інсулін людини, N -(N -(HOOC(CH2)14CO)-γB29 ε εВ29 Glu)desB30-інсулін людини, Lys (N літохоліл-γ-Glu)des(B30)інсулін людини, N -ωεВ29 карбоксипентaдеканоїл-γ-L-глютаїламід, desB30-інсулін людини і N -ωкарбоксипентaдеканоїл-γ-амінобутанoїл, des(B30)інсулін людини. Згідно зі способом за винаходом переважно похідне інсуліну може бути вибране з групи, яка включає B29-N-міристоїл-des(B30)інсулін людини, B29-N-пальмітоїл-des(B30)інсулін людини, B29-N-міристоїл-інсулін людини, B29-N-пальмітоїл-інсулін людини, B28-N-міристоїлВ28 В29 В28 В29 Lys Рro інсулін людини, B28-N-пальмітоїл-Lys Pro інсулін людини, B30-N-міристоїлВ29 В30 В29 В30 Thr Lys інсулін людини, B30-N-пальмітоїл-Thr Lys інсулін людини, B29-N-(N-пальмітоїл-Yглютаміл)des(B30)інсулін людини, B29-N-(N-літохоліл-Y-глютаміл)des(B30)інсулін людини, B29N-(ω-карбоксигептадеканоїл)des(B30)інсулін людини і B29-N-(ω-карбоксигептадеканоїл)інсулін εB29 εB29 α людини, N -тетрaдеканоїл, des(B30)інсулін людини, N -(N -(HOOC(CH2)14CO)-γ-Glu)desB30B29 ε εB29 інсулін людини, Lys (N літохоліл-γ-Glu)des(B30)інсулін людини, N -ωεB29 карбоксипентaдеканоїл-γ-L-глютаїламід, desB30-інсулін людини і N -ωкарбоксипентaдеканоїл-γ-амінобутаноїл, des(B30)інсулін людини. Згідно з даним винаходом більш переважне похідне інсуліну вибирають з групи, що В28 В29 складається з Gly(A21)-Arg(B31)-Arg(B32)інсуліну людини, Lys Pro інсуліну людини (інсулін лізпро), B28Asp-інсуліну людини (інсулін аспарт), B29Lys(ε-тетрадеканоїл),desB30-інсуліну людини (інсулін детемір). 7 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 60 Композиції за винаходом містять 60-6000 нмоль/мл, переважно 240-3000 нмоль/мл інсуліну, такого, як його визначають в даній роботі. Концентрація 240-3000 нмоль/мл відповідає залежно від застосовуваного інсуліну приблизно концентрації 1,4-35 мг/мл або 40-500 одиниць/мл. Одним особливо переважним об'єктом за винаходом є композиція, така, як описано тут, яка В28 В29 включає щонайменше один інсулін, вибраний незалежно з Lys Pro -інсуліну людини (інсулін лізпро), B28Asp-інсуліну людини (інсулін аспарт), B29Lys(ε-тетрадеканоїл),desB30-інсуліну людини (інсулін детемір) і інсуліну гларгіну (Gly(A21)-Arg(B31)-Arg(B32)інсулін людини), і включає AVE0010 і/або його фармакологічно прийнятну сіль. Наступним, особливо переважним об'єктом, є композиція, така, як описано тут, яка включає інсулін гларгін (Gly(A21)-Arg(B31)36 Arg(B32)інсулін людини) і AVE0010 (desPro ексендин-4(1-39)-Lys6-NH2) і/або його фармакологічно прийнятну сіль. Дані, особливо переважні композиції, мають переважно кислий pH 1-6,8, більш переважно pH3,5-6,8, ще більш переважно pH 3,5-4,5. У особливому варіанті здійснення композиція за винаходом включає наступні компоненти: 36 (a) desPro ексендин-4(1-39)-Lys6-NH2, (b) Gly(A21)-Arg(B31)-Arg(B32)інсулін людини, (с) хлорид цинку, (d) м-крезол, (е) L-метіонін, (f) гліцерин, (г) соляна кислота в кількості, необхідній для встановлення значення pH приблизно 4,5, (h) розчин NaOH в кількості, необхідній для встановлення значення pH приблизно 4,5, і (i) вода. Зокрема композиція за винаходом складається з вказаних вище компонентів від (a) до (i). За необхідності можна відмовитися від застосування м-крезолу. Тоді, відповідно, композиція за винаходом складається з компонентів від (a) до (с) і від (е) до (i). Наступним об'єктом даного винаходу є комбінація щонайменше двох композицій за винаходом. При цьому в неї входять перша, друга композиції і, необов'язково, щонайменше одна наступна фармацевтична композиція, кожна з яких містить інсулін і агоніст GLP-1. Тому об'єктом даного винаходу є комбінація, яка включає першу фармацевтичну композицію і другу фармацевтичну композицію і, необов'язково, щонайменше одну наступну фармацевтичну композицію, кожна з яких містить щонайменше один інсулін і щонайменше один агоніст GLP-1, і щонайменше один інсулін і/або щонайменше один агоніст GLP-1 містяться в різних масових частках відносно загальної ваги композицій. У даній заявці вираз "необов'язково, щонайменше одну наступну фармацевтичну композицію" означає, що комбінація за винаходом нарівні з першою і другою фармацевтичними композиціями може включати ще щонайменше одну наступну фармацевтичну композицію. Таким чином, комбінація за винаходом може включати, наприклад, 3, 4, 5, 6, 7, 8, 9, 10 або більше фармацевтичних композицій за винаходом. Переважними є комбінації, які містять першу і другу фармацевтичні композиції за винаходом. Також переважними є комбінації, які містять першу, другу і третю фармацевтичні композиції за винаходом. Також переважними є комбінації, які містять першу, другу, третю і четверту фармацевтичні композиції за винаходом. Також переважними є комбінації, які містять першу, другу, третю, четверту і п'яту фармацевтичні композиції. Масові частки щонайменше одного інсуліну і щонайменше одного агоніста GLP-1 в першій фармацевтичній композиції, другій фармацевтичній композиції і, необов'язково, в щонайменше одній додатковій фармацевтичній композиції можуть бути вибрані таким чином, що фармацевтичні композиції мають різне співвідношення інсуліну до агоніста GLP-1 в перерахунку на масові частки. При цьому перша композиція може мати найменше співвідношення, а друга композиція наступне по величині співвідношення. Якщо є щонайменше одна наступна композиція, вона може мати наступне по величині співвідношення. Якщо є ще одна наступна композиція, вона може мати знову наступне по величині співвідношення. Таким чином, композиції від першої до другої і необов'язково до наступної композиції мають зростаюче співвідношення інсуліну до агоніста GLP-1 в перерахунку на масові частки. Масова частка однієї з двох діючих речовин, тобто щонайменше одного інсуліну або щонайменше одного GLP-агоніста, в першій фармацевтичній композиції, у другій фармацевтичній композиції і необов'язково в щонайменше одній додатковій фармацевтичній композиції переважно вибирають таким чином, щоб при введенні певного об'єму першої, другої 8 UA 109420 C2 5 10 15 20 25 30 35 40 45 50 55 і/або щонайменше однієї додаткової композиції могла бути введена призначена доза даної діючої речовини. Особливо переважно дана діюча речовина є щонайменше одним інсуліном. Масова частка іншої з двох діючих речовин, тобто щонайменше одного інсуліну або щонайменше одного агоніста GLP-1, в першій фармацевтичній композиції, у другій фармацевтичній композиції і необов'язково в щонайменше одній наступній фармацевтичній композиції переважно вибирають таким чином, щоб співвідношення інсуліну до агоніста GLP-1 в перерахунку на масові частки зростало від першої до другої і необов'язково наявної наступної композиції. Особливо переважно даною діючою речовиною є щонайменше один агоніст GLP-1. Крім того масову частку другої з двох діючих речовин в фармацевтичних композиціях визначають таким чином, щоб одну з фармацевтичних композицій можна було вибирати таким чином, щоб доза, що вводиться, першої з двох діючих речовин і доза, що вводиться, другої діючої речовини були надані в певному об'ємі. Разом з тим вибирають фармацевтичну композицію, яка містить бажане співвідношення. Теоретично фармацевтична композиція могла б надаватися для кожного окремого терапевтично бажаного співвідношення масових часток щонайменше одного інсуліну і щонайменше одного агоніста GLP-1 для того, щоб досягати оптимального дозування, що відповідає потребам, для обох діючих речовин для кожного пацієнта. У даному винаході певної кількості фармацевтичних композицій достатньо для того, щоб охоплювати необхідні на практиці дозування для обох активних речовин. Певну область дозування в межах терапевтично раціонального інтервалу визначають для кожного пацієнта для кожної з обох активних речовин. При цьому доза, що вводиться, повинна для певного пацієнта по суті коливатися в межах даної області дозування, щоб не відбувалося передозування або недостатнього дозування. Оскільки насамперед кількість інсуліну необхідно підбирати для кожного пацієнта і точно дозувати, область концентрацій агоніста GLP-1 сприяє тому, що фармацевтична композиція за винаходом, яка має певне співвідношення щонайменше одного інсуліну і щонайменше одного агоніста GLP-1, перекриває терапевтичну область дозувань інсуліну одночасно з синергетичними кількостями агоніста GLP-1, що належать до них. Співвідношення можна вибирати таким чином, щоб кожному бажаному дозуванню інсуліну відповідало дозування щонайменше одного агоніста GLP-1, яке знаходиться в межах бажаної області, наприклад синергетичної області. Як було сказано вище, співвідношення компонентів в першій, другій і, необов'язково, щонайменше одній наступній композиції лікарського засобу можна вибирати таким чином, що співвідношення зростає від першої до другої і необов'язково щонайменше однієї наступної композиції. Якщо дозування агоніста GLP-1 при бажаному дозуванні інсуліну однієї композиції (наприклад, першої композиції) знаходиться поза (як правило, вище) бажаною областю дозування агоніста GLP-1, то вибирають для застосування наступну композицію (наприклад, другу композицію) або наступну композицію з великим співвідношенням щонайменше одного інсуліну до щонайменше одного агоніств GLP-1, в якій кількість агоніста GLP-1 при бажаному дозуванні інсуліну знаходиться в бажаній області. Дане співвідношення в першій, другій і необов'язково наявній щонайменше одній наступній композиції в комбінації можна вибирати таким чином, що області дозувань інсуліну, які відповідають бажаним дозуванням щонайменше одного агоніста GLP-1, примикають одна до одної і/або перекривають одна одну. Переважно області перекривають одна одну. Перекривання означає, зокрема, те, що можна вибрати щонайменше дві композиції, які при бажаному дозуванні щонайменше одного інсуліну містять таку кількість щонайменше одного агоніста GLP-1, яка знаходиться в межах бажаної області дозувань. Наприклад, достатньо 3 композицій для того, щоб підібрати дозу щонайменше одного інсуліну для індивідуального пацієнта, вибрану з області від 15 до 80 одиниць інсуліну, і одночасно дозувати агоніст GLP-1 в кількості в межах області від 10 до 20 мкг (див. Фігуру 4). Також можна надати комбінацію за винаходом, в якій співвідношення вибирають таким чином, що кожному бажаному дозуванню агоніста GLP-1 відповідає дозування щонайменше одного інсуліну, яке знаходиться в бажаній області. Далі, співвідношення компонентів в першій, другій і, необов'язково, щонайменше одній наступній композиції лікарського засобу можна вибирати таким чином, що області дозувань агоніста GLP-1, які відповідають бажаним дозуванням щонайменше одного інсуліну, примикають одна до одної і/або перекривають одна одну. Переважно дані області перекривають одна одну. Перекривання в даному контексті означає, зокрема, те, що можна вибрати щонайменше дві композиції, які при бажаному дозуванні щонайменше одного агоніста GLP-1 містять таку кількість щонайменше одного інсуліну, яка знаходиться в межах бажаної області дозувань. 9 UA 109420 C2 5 10 15 Переважно комбінація за винаходом включає максимально 10 фармацевтичних композицій, як описано вище, більш переважно максимально 5, максимально 4, максимально 3 або 2 фармацевтичні композиції. Композиції за винаходом можуть містити щонайменше один агоніст GLP-1 в ідентичних або різних масових частках. Наприклад, щонайменше дві композиції за винаходом можуть містити щонайменше один агоніст GLP-1 в по суті ідентичних масових частках. Переважно, щоб перша, друга і необов'язково наступна/наступні композиції містили щонайменше один агоніст GLP-1 в по суті ідентичних масових частках і щонайменше один інсулін в різних масових частках. Однак композиції за винаходом можуть містити щонайменше один інсулін в ідентичних або різних масових частках. Наприклад, щонайменше дві композиції за винаходом можуть містити щонайменше один інсулін в по суті ідентичних масових частках. Особливо переважно, щоб перша, друга і необов'язково наступна/наступні композиції містили щонайменше один інсулін в по суті ідентичних масових частках, а щонайменше один агоніст GLP-1 в різних масових частках. Перша переважна композиція за винаходом включає: (a) AVE0010 (b) інсулін гларгін (с) хлорид цинку (d) 85 % гліцерин (е) м-крезол (f) L-метіонін (g) NaOH (h) HCl 36 % (i) вода приблизно 0,025 мг, приблизно 3,64 мг, приблизно 0,06 мг, приблизно 20,0 мг, приблизно 2,7 мг, приблизно 3,0 мг, достатня кількість для pH 4,5, достатня кількість для pH 4,5, до 1 мл. Друга переважна композиція за винаходом включає: 20 (a) AVE0010 (b) інсулін гларгін (с) хлорид цинку (d) 85 % гліцерин (е) м-крезол (f) L-метіонін (g) NaOH (h) HCl 36 % (i) вода приблизно 0,04 мг, приблизно 3,64 мг, приблизно 0,06 мг, приблизно 20,0 мг, приблизно 2,7 мг, приблизно 3,0 мг, достатня кількість для pH 4,5, достатня кількість для pH 4,5, до 1 мл. Третя переважна композиція за винаходом включає: (a) AVE0010 (b) інсулін гларгін (с) хлорид цинку (d) 85 % гліцерин (е) м-крезол (f) L-метіонін (g) NaOH (h) HCl 36 % (i) вода приблизно 0,066 мг, приблизно 3,64 мг, приблизно 0,06 мг, приблизно 20,0 мг, приблизно 2,7 мг, приблизно 3,0 мг, достатня кількість для pH 4,5, достатня кількість для pH 4,5, до 1 мл. 10 UA 109420 C2 Четверта переважна композиція за винаходом включає: (a) AVE0010 (b) інсулін гларгін (с) хлорид цинку (d) 85 % гліцерин (е) м-крезол (f) L-метіонін (g) NaOH (h) HCl 36 % (i) вода 5 10 15 20 25 30 35 приблизно 0,1 мг, приблизно 3,64 мг, приблизно 0,06 мг, приблизно 20,0 мг, приблизно 2,7 мг, приблизно 3,0 мг, достатня кількість для pH 4,5, достатня кількість для pH 4,5, до 1 мл. Особливо переважними є комбінації, що включають щонайменше 2, 3 або 4 з наведених вище першої, другої, третьої і четвертої переважних композицій. "Приблизно" в даній заявці означає, що компоненти можуть знаходитися в кількості, наприклад, в межах ±10, ±20 або±30 від вказаних числових значень в композиції і/або комбінації за винаходом; переважно±10. Якщо композиція або комбінація за винаходом включає більше одного інсуліну, то дані інсуліни вибирають незалежно один від одного. Якщо композиція або комбінація за винаходом включає більше одного агоніста GLP-1, то дані агоністи GLP-1 вибирають незалежно один від одного. Комбінацію за винаходом, зокрема, надають як лікарський засіб. Наступним об'єктом даного винаходу є набір, який містить комбінацію, що включає щонайменше одну, максимально чотири композиції за винаходом, а також необов'язкове ® Лантус . Набір за винаходом може бути призначений для застосування медичним персоналом або нефахівцями, зокрема пацієнтами самостійно або помічниками, наприклад родичами. У наборі окремі фармацевтичні композиції, які входять в комбінацію за винаходом, знаходяться в окремих упаковках, так що пацієнт може вибирати композицію, придатну для поточної потреби, і вводити кількість, що відповідає потребі. Набір за винаходом включає, наприклад, комбінацію за винаходом у вигляді набору шприців, скляних ампул і/або стрижнів, які містять щонайменше ® одну композицію за винаходом, необов'язково в комбінації з композицією Лантусу . Придатною упаковкою є шприци або скляні посудини з придатним закриваючим елементом, з яких за необхідності можна витягувати окремі терапевтично ефективні дози. Також придатними є ін'єкційні стрижні ("стрижні", "ручки") для введення інсуліну, які включають контейнер (наприклад патрон), який містить фармацевтичну композицію за винаходом. Зокрема набір за винаходом може являти собою ін'єкційний стрижень, що складається з двох окремих контейнерів, з яких за необхідності можна витягувати окремі терапевтичні дози. Також набір може являти собою шприц з двома контейнерами, в якому другий контейнер виконаний як резервуар з голкою (резервуар-голка). У даному винаході набір переважно складається з комбінації з першої композиції, яка містить агоніст GLP-1, інсулін, гліцерин, хлорид цинку, необов'язково м-крезол, L-метіонін, зі значенням pH-4,5 у воді, і другої композиції, яка переважно містить інсулін, гліцерин, хлорид цинку і м-крезол зі значенням pH-4,5 у воді. Перша композиція переважно має наступний склад: (a) AVE0010 (b) інсулін гларгін (с) хлорид цинку (d) 85 % гліцерин (е) м-крезол (f) L-метіонін (g) NaOH (h) HCl 36 % (i) вода приблизно 0,4 мг або приблизно 0,8 мг, приблизно 3,64 мг, приблизно 0,06 мг, приблизно 20,0 мг, 0,0 мг або приблизно 2,7 мг, приблизно 3,0 мг, достатня кількість для pH 4,5, достатня кількість для pH 4,5, до 1 мл. Друга композиція переважно має наступний склад: 11 UA 109420 C2 (a) інсулін гларгін (b) хлорид цинку (с) 85 % гліцерин (d) м-крезол (е) NaOH (f) HCl 36 % (g) вода 5 10 15 20 25 30 35 40 45 50 приблизно 3,64 мг, приблизно 0,06 мг, приблизно 20,0 мг, приблизно 2,7 мг, достатня кількість для pH 4,5, достатня кількість для pH 4,5, до 1 мл. Наступним об'єктом даного винаходу є спосіб лікування пацієнтів композицією за винаходом, який включає введення композиції пацієнтам. Ще одним наступним об'єктом даного винаходу є спосіб лікування пацієнтів комбінацією за винаходом або набором за винаходом, таким, як описано тут. Зокрема, даний спосіб включає введення комбінації за винаходом, що включає першу фармацевтичну композицію, другу фармацевтичну композицію і, необов'язково, щонайменше одну наступну фармацевтичну композицію, кожна з яких містить щонайменше один інсулін і щонайменше один агоніст GLP-1, і щонайменше один інсулін і/або щонайменше один агоніст GLP-1 містяться в різних масових частках відносно загальної маси композиції, при цьому спосіб включає: (a) вибір дози щонайменше одного інсуліну, яку необхідно ввести, (b) вибір дози щонайменше одного агоніста GLP-1, яку необхідно ввести, (с) вибір композиції з першої, другої і, необов'язково, щонайменше однієї наступної композиції лікарських засобів, яка містить дози з (a) і (b) в таких концентраціях, що дози з (a) і (b) знаходяться в одному і тому ж об'ємі, і (d) визначення і введення кількості, яка відповідає дозам з (a) і (b). Визначення доз згідно зі стадією (a) і/або стадією (b) відбувається відповідно до індивідуальної потреби пацієнта. Стадію (с) способу лікування за винаходом можна здійснити за допомогою таблиці. Дана таблиця може бути частиною комбінації за винаходом, лікарського засобу за винаходом або набору за винаходом. Приклад 2 містить приклад таблиці за винаходом. Композиція за винаходом, комбінація за винаходом, лікарський засіб і/або набір за винаходом, зокрема, передбачені для лікування цукрового діабету, зокрема для лікування цукрового діабету I типу або II типу. Наступними можливими показаннями є симптоми, які пов'язані з цукровим діабетом. Переважно композицію за винаходом застосовують для регулювання концентрації глюкози в плазмі крові в станах натщесерце, після прийому їжі і/або після всмоктування, для поліпшення переносимості глюкози, для запобігання гіпоглікемії, для запобігання припиненню функціонування β-клітин підшлункової залози, для зниження ваги і/або для запобігання збільшенню ваги. Наступним об'єктом даного винаходу є застосування композиції за винаходом, комбінації за винаходом або набору за винаходом для виготовлення лікарського засобу для лікування цукрового діабету, зокрема I типу або II типу, і/або пов'язаних з ним симптомів, як описано тут. Наступним об'єктом даного винаходу є спосіб виготовлення композиції за винаходом, комбінації за винаходом і/або набору за винаходом, що включають склад агоніста GLP-1 і/або його фармакологічно прийнятної солі з інсуліном і/або його фармацевтично прийнятною сіллю, метіоніном і, необов'язково, щонайменше однією фармацевтично прийнятною допоміжною речовиною. Наступним об'єктом даного винаходу є спосіб виготовлення композиції за винаходом, який включає склад агоніста GLP-1 і/або його фармакологічно прийнятної солі з метіоніном і, необов'язково, щонайменше однією фармацевтично прийнятною допоміжною речовиною. Наступним об'єктом даного винаходу є застосування композиції за винаходом спільно з введенням метформіну, інсуліну гларгіну або AVE0010, зокрема в додатковій терапії до введення метформіну, інсуліну гларгіну або AVE0010. 36 Зокрема композиція містить desPro ексендин-4(1-39)-Lys6-NH2 (AVE0010) і/або його фармакологічно прийнятну сіль, інсулін гларгін і/або його фармакологічно прийнятну сіль. Особливо переважне додаткове лікування переважною композицією пацієнтів з діабетом II типу, який не в достатній мірі контрольований за допомогою інсуліну гларгіну і/або AVE0010. Також це стосується пацієнтів, які молодше 50 років і/або які мають індекс маси тіла щонайменше 30. 12 UA 109420 C2 5 10 15 20 25 30 У даному винаході додаткова терапія включає, зокрема, лікування діабету II типу композицією за винаходом додатково до метформіну, AVE0010 і/або інсуліну гларгіну. Композицію за винаходом можна застосовувати з інтервалом 24 год. (дозування один раз на день). Метформін, інсулін гларгін і AVE0010 можна вводити різними способами введення. Метформін можна вводити орально, AVE0010 і інсулін гларгін підшкірно. Пацієнти, яких можна лікувати за допомогою додаткової терапії за винаходом, мають HbA1c значення від 7 до 10 %. Переважно вони мають вік від 18 до 50 років. Додаткова терапія за винаходом, зокрема, застосовна для пацієнтів, які не можуть в достатній мірі контролювати діабет II типу тільки з допомогою метформіну, AVE0010 або інсуліну гларгіну. Переважно дану терапію застосовують при недостатньому контролі за допомогою інсуліну гларгіну або AVE0010. Наступним об'єктом даного винаходу є застосування композиції за винаходом як доповнення до дієти для того, щоб контролювати рівень цукру в крові у пацієнтів з діабетом II типу, якщо показане застосування інсуліну гларгіну і AVE0010. Зокрема метформін приймають в дозі щонайменше 1,0 г/день, переважно щонайменше 1,5 г/день протягом 3 місяців. Далі, даний винахід роз'яснюється за допомогою наступних фігур і прикладів. На фігурі 1 показаний вміст окисленого метіоніну Met(ox) в AVE0010 після 1 місяця зберігання при різних температурах відносно вихідного моменту часу. У рамці наведені значення для еталонних композицій AVE0010 номер 1 і 2. На фігурі 2 показаний вміст сторонніх речовин в AVE0010 крім Met(ox) після 1 місяця зберігання при різних температурах відносно вихідного моменту часу. У рамці наведені значення для еталонних композицій AVE0010 при 25 °C і при 40 °C. На фігурі 3 показаний вміст сторонніх речовин в інсуліні гларгіні після 1 місяця зберігання при різних температурах відносно вихідного моменту часу. У вузькій рамці наведені значення для еталонної композиції інсуліну гларгіну при 25 °C і при 40 °C. У широкій рамці наведені композиції з найнижчим вмістом сторонніх речовин в AVE0010. Фігура 4: Концепція "3 ручки покривають все". Приклад 1 1. Предмет дослідження Випробовували фізичну і хімічну стабільність композицій, що включають агоніст GLP-1 (AVE0010) і інсулін (інсулін гларгін, лантус). 2. Використані композиції В досліджуваних композиціях містилися речовини в наступних концентраціях/кількостях. 35 Речовина Фармакопея Інсулін гларгін Виробник Назва Sanofi-Aventis Метіонін USP Poly Peptide LabTorrance CA, США MP Biomedicals Хлорид цинку Ph. Eur., USP, BP Merck Ph. Eur., JP Hedinger, Штутгарт Ph. Eur., USP Ph.Eur., JP Ph. Eur. Hedinger, Штутгарт Kolb SEPPIC BASF, Людвігсхафен Sigma-Aldrich AVE0010 Гліцерин 85 % М-крезол Полісорбат 20 Полісорбат 80 Полоксамер 188 Хлорид бензалконію, Ph. Eur., JP L-лізин Resum, F-Ham, Degussa Ацетат NaOH Ph. Eur., JP Merck HCl Ph. Eur., JP Merck Вода 13 Tween 20 Tween 80 Lutrol F68 Застосовувана кількість [мг/мл] 3,63 7,27 10,67 0,1 0,025 3 0,03 0,06 0,09 20 18 2,7 0,02 0,02 0,02 0,02 1,0 5,0 1,75 3,5 0,1N до досягнення рН 4,0 або 4,5 0,1N до досягнення рН 4,0 або 4,5 до 1 мл UA 109420 C2 5 10 15 20 25 30 35 40 45 50 Якщо в зв'язку з компонентом композиції вказаний множник (наприклад, 1/2, 1/4, 2x, 3x, 5x, як наприклад 1/2 ацетат, 5x лізин, 2x лантус і 3x лантус), то застосовують концентрації відповідних речовин, зменшені або збільшені у вказану кількість разів. 3. Способи випробувань 3.1. Фізична стабільність 3.1.1. ТНТ-випробування Тіофлавін-Т (THT) специфічно зв'язується з фібрилами білків, що приводить до зміни флуоресценції ТНТ. THT не зв'язується з AVE0010 або інсуліном. Кінетика утворення фібрил може бути виміряна в присутності THT як вимірювання флуоресценції. Збільшення флуоресценції відповідає утворенню фібрил. Форма кривої дозволяє зробити висновок про схильність композиції утворювати фібрили. Вимірювання флуоресценції проводили на приладі для вимірювання флуоресценції Tecan Infinite 200. Для аналізу кінетики утворення фібрил застосовували мікрофотографічний зчитувальний пристрій для високотемпературної флуоресценції Photomed FluoDia 770. Спектр флуоресценції тіофлавіну-Т визначали на приладі для вимірювання флуоресценції Tecan Infinite 200 при 23 °C. 900 мкл інсуліну змішували з 10 мкл тіофлавіну-Т (1 мМ в H2О). Потім суміш розподіляли в чорний V-подібний 96-ямковий планшет від фірми Biozym (100 мкл в кожну ямку). Флуоресцентне випромінювання вимірювали в інтервалі від 470 до 600 нм (величина кроку 1 нм) після імпульсу при 450 нм з посиленням 100, час накопичення 200 мкс, 25 показань при кімнатній температурі. Кінетику зв'язування тіофлавіну-Т вимірювали на мікрофотографічному зчитувальному пристрої для високотемпературної флуоресценції Photomed FluoDia 770. Даний інструмент складається по суті з 50W-кварцової галогенової лампи для стимулювання, револьверної головки зі світлофільтрами для стимулювання і випромінювання, яка може включати до 4 наборів фільтрів, і PMT-детектора. Обігріваюча пластина для 96-ямкового планшета дозволяє досягати дуже високої точності температури (більше ±0,3 °C). 10 мкл розчину тіофлавіну-Т (10,1 мМ в надчистій воді) додавали до 1 мл композиції і легко перемішували, обертаючи пробірки декілька разів. Потім суміш розподіляли в чорний Vподібний 96-ямковий планшет фірми Biozym (100 мкл в кожну комірку, 8 комірок на кожний зразок). Всі вимірювання проводили з наступними параметрами: число циклів: 181, фільтр для стимулювання: 450 нм, інтервал: 1 хв., фільтр для випромінювання: 486 нм, час накопичення: 20 мс, контроль температури: стандартний режим контролю температури, число усереднень: 4, задана температура: 70 °C, ослаблення: 4, середнє значення флуоресценції визначали, виходячи з 8 паралельних вимірювань. 3.2. Хімічна стабільність Композиції на хімічну стабільність випробовували після одержання (t0) або після зберігання протягом 1 місяці при 4 °C, 25 °C (60 % відносна вологість) і 40 °C (75 % відносна вологість). Вимірювання проводили на приладі HPLC (ВЕРХ) (тип альянс) для водних систем, при цьому застосовували спосіб 100 %-площі піків. Для відділення застосовували градієнт з 0,1 % TFA і ацетонітрилу як рухому фазу, і C18-кислу обернену фазу (Jupiter) як тверду фазу. Для аналізу композицію обробляли розчином ацетату цинку, що приводило до преципітації інсуліну гларгіну. Преципітат центрифугували і аналізували тільки верхній рівень. Сторонні речовини в інсуліні гларгін. Кількість сторонніх речовин визначали з допомогою HPLC (водні системи), при цьому застосовували спосіб 100 %-площі піка. Для відділення застосовували як рухому фазу буферизований розчин фосфату натрію (pH 2,5) з градієнтом NaCl і ацетонітрилу. Як нерухому фазу застосовували C18-кислу обернену фазу (Supersher). 4. Узагальнення експериментальних даних фізичної стабільності. 14 UA 109420 C2 Композиція № PH Склад ТНТ 3 год., 70 °C, відносна інтенсивність флуоресценції при 486 нм 4,5 536 4 518 4,0 2952 4 4 1566 2037 4 11763 4 69184 4 2053 4 18814 4 8183 4 6731 4 13897 4 22200 4 134093 4 3362 4 19677 4 30176 4 3107 4 74662 4 4 4,5 4504 30251 4357 4,5 36338 4,5 72370 4,5 5429 4,5 34714 Партія 1 630 2 567 3 631 4 5 560 568 6 569 7 570 8 582 9 583 10 584 11 585 12 586 13 587 14 588 15 590 16 591 17 592 18 593 19 594 20 21 22 595 596 604 23 605 24 606 25 607 26 608 AVE0010 Стандартний промислового виробництва AVE0010 Стандартний свіжий Лантус Стандартний промислового виробництва Лантус Стандартний свіжий Склад лантусу, AVE0010 Склад лантусу, AVE0010 1/2 Ацетатний буферний розчин Склад лантусу, AVE0010 Ацетатний буферний розчин Склад лантусу, AVE0010 Метіонін Склад лантусу, AVE0010 1/2 Ацетатний буферний розчин Метіонін Склад лантусу, AVE0010 Полісорбат 20 Склад лантусу, AVE0010 Полісорбат 20 Метіонін Склад лантусу, AVE0010 Полісорбат 20 1/2 Ацетатний буферний розчин Склад лантусу, AVE0010 Полісорбат 20 1/2 Ацетатний буферний розчин Метіонін Склад лантусу, AVE0010 Полісорбат 20 Ацетатний буферний розчин Метіонін Склад лантусу, AVE0010 Лізин Склад лантусу, AVE0010 Лізин 1/2 Ацетатний буферний розчин Склад лантусу, AVE0010 Лізин 1/2 Ацетатний буферний розчин Полісорбат 20 Склад лантусу, 1/4 AVE0010 Склад лантусу, 1/4 AVE0010 5x Лізин 2x Лантус AVE0010 3x Лантус AVE0010 Склад лантусу, AVE0010 Склад лантусу, AVE0010 1/2 Ацетатний буферний розчин Склад лантусу, AVE0010 Ацетатний буферний розчин Склад лантусу, AVE0010 Метіонін Склад лантусу, AVE0010 1/2 Ацетатний буферний розчин Метіонін 15 UA 109420 C2 27 609 28 610 29 611 30 612 31 613 32 614 33 615 34 616 35 617 36 618 37 38 619 620 39 657 40 658 41 659 42 660 43 661 44 662 Склад лантусу, AVE0010 Полісорбат 20 Склад лантусу, AVE0010 Полісорбат 20 Метіонін Склад лантусу, AVE0010 Полісорбат 20 1/2 Ацетатний буферний розчин Склад лантусу, AVE0010 Полісорбат 20 1/2 Ацетатний буферний розчин Метіонін Склад лантусу, AVE0010 Полісорбат 20 Ацетатний буферний розчин Метіонін Склад лантусу, AVE0010 Лізин Склад лантусу, AVE0010 Лізин 1/2 Ацетатний буферний розчин Склад лантусу, AVE0010 Лізин 1/2 Ацетатний буферний розчин Полісорбат 20 Склад лантусу 1/4x AVE0010 Склад лантусу 1/4x AVE0010 5x Лізин 2x Лантус AVE0010 3x Лантус AVE0010 Склад лантусу AVE0010 Полісорбат 80 Метіонін Склад лантусу, AVE0010 Полоксамер 188 Метіонін Склад лантусу, AVE0010 Хлорид бензалконію Метіонін Склад лантусу, AVE0010 Полісорбат 80 Метіонін Склад лантусу, AVE0010 Полоксамер 188 Метіонін Склад лантусу, AVE0010 Хлорид бензалконію Метіонін 4,5 1166 4,5 5564 4,5 12115 4,5 16397 4,5 779 4,5 9726 4,5 74027 4,5 9520 4,5 3713 4,5 83384 4,5 4,5 13120 41684 4 9309 4 767 4 1040 4,5 16803 4,5 689 4,5 942 5. ТНТ-випробування Метіонін не має впливу на схильність до утворення фібрил. Номер композиції 2 4 8 25 Склад AVE0010 Стандартний Лантус Стандартний Склад лантусу, AVE0010, метіонін, pH 4 Склад лантусу, AVE0010, метіонін, pH 4,5 5 16 Інтенсивність флуоресценції при 486 нм 518 1566 2053 5429 UA 109420 C2 Композиції мали значення флуоресценції як у еталонних композицій (номер 2 і 4). При значеннях менше приблизно 6000 схильність до утворення фібрил відсутня. Якщо AVE0010, лантус і метіонін комбінують з ацетатним буферним розчином з полісорбатом 20 або без нього при pH 4, існує висока схильність до утворення фібрил. 5 Номер композиції 2 4 9 13 14 10 15 20 25 30 35 40 45 Склад AVE0010 Стандартний Лантус Стандартний Склад лантусу, AVE0010, 1/2 ацетат, метіонін, рН 4 Склад лантусу, AVE0010, полісорбат 20, 1/2 ацетат, метіонін, рН 4 Склад лантусу, AVE0010, полісорбат 20, ацетат, метіонін, рН 4 Інтенсивність флуоресценції при 486 нм 518 1566 18814 22200 134093 Значення для композицій 13 і 14 знаходяться явно вище порога схильності до утворення фібрил. 6.1. Результати Полісорбат 20 і полісорбат 80 можуть приводити до помутніння, яке може бути виявлене у випробуванні при подвійному заломленні світла. Отже, обидві дані речовини можуть приводити до фізичної нестабільності композицій AVE0010 і інсуліну. Додавання метіоніну не приводить до фізичної нестабільності. 7. Хімічна стабільність 7.1. Стабільність в момент часу t0 Композиції, які містять метіонін (з і без ацетату натрію), мають найнижчий вміст сторонніх речовин (в сумі приблизно від 1,2 до 1,5 %). Наступні композиції мають низький вміст сторонніх речовин. 8 Склад лантусу, AVE0010, метіонін, pH 4; 9 Склад лантусу, AVE0010, 1/2 ацетатного буферного розчину, метіонін, pH 4; 11 Склад лантусу, AVE0010, полісорбат 20, метіонін, pH 4; 13 Склад лантусу, AVE0010, 1/2 ацетатного буферного розчину, полісорбат 20, метіонін, pH 4; 14 Склад лантусу, AVE0010, ацетатний буферний розчин, полісорбат 20, метіонін, pH 4; 25 Склад лантусу, AVE0010, метіонін, pH 4,5; 26 Склад лантусу, AVE0010, 1/2 ацетатного буферного розчину, метіонін, pH 4,5; 28 Склад лантусу, AVE0010, полісорбат 20, метіонін, pH 4,5; 30 Склад лантусу, AVE0010, 1/2 ацетатного буферного розчину, полісорбат 20, метіонін, pH 4,5; 31 Склад лантусу, AVE0010, ацетатний буферний розчин, полісорбат 20, метіонін, pH 4,5. Композиції, які не містять метіонін, показали високий вміст сторонніх речовин. Полісорбат 20 не має негативного впливу на хімічну стабільність композиції. Ацетатний буферний розчин не має негативного впливу на хімічну стабільність, якщо його комбінують з метіоніном і полісорбатом 20. Якщо в композиції є лізин, то сума сторонніх речовин більше. Такий же результат дають композиції, які містять полісорбат 80, полоксамер 188 і хлорид бензалконію. Визначення сторонніх речовин в інсуліні гларгіні показало, що всі композиції мають порівняльну кількість сторонніх речовин (від 0,3 до 0,4 %). 7.2. Стабільність після 1 місяця 7.2.1. Сторонні речовини в AVE0010 У випробуванні визначали вміст окисленого метіоніну в композиціях. Послідовність AVE0010 має в положенні 14 залишок метіоніну. Послідовність інсуліну гларгіну не має залишків метіоніну. Тому вміст окисленого метіоніну вказує на окислення залишку метіоніну в AVE0010. Дані узагальнені на фігурі 1. Сумарні дані показують, що без метіоніну при значенні pH 4,5 вміст Met(ox) вище, ніж при pH 4,0. Без метіоніну як компонента композиції вміст Met(ox) найбільший, якщо вміст інсуліну гларгіну підвищений або вміст AVE0010 зменшений. В основному найбільший вміст Met(ox) був виміряний після зберігання при 40 °C/75 % відносній вологості. При цьому найменший вміст Met(ox)-AVE0010 (
ДивитисяДодаткова інформація
Автори англійськоюHagendorf, Annika, Hauck, Gerrit, Mueller, Werner, Schoettle, Isabell, Siefke-Henzler, Verena, Tertsch, Katrin
Автори російськоюХагендорф Анника, Хаук Геррит, Мюллер Вернер, Шеттле Изабелль, Зифке-Хенцлер Верена, Терч Катрин
МПК / Мітки
МПК: A61K 38/28, A61K 38/26, A61P 3/10, A61K 47/20
Мітки: glp-1, агоніст, композиція, метіонін, включає, інсулін, фармацевтична
Код посилання
<a href="https://ua.patents.su/24-109420-farmacevtichna-kompoziciya-shho-vklyuchaeh-agonist-glp-1-insulin-i-metionin.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що включає агоніст glp-1, інсулін і метіонін</a>
Попередній патент: Нагрівальний пристрій
Наступний патент: Фармацевтична композиція, яка містить ліганди сигма-рецептора
Випадковий патент: Спосіб оцінки селекційного матеріалу соняшнику за площею листової поверхні в різні фази розвитку рослини