Нове протипухлинне застосування кабазитакселу
Формула / Реферат
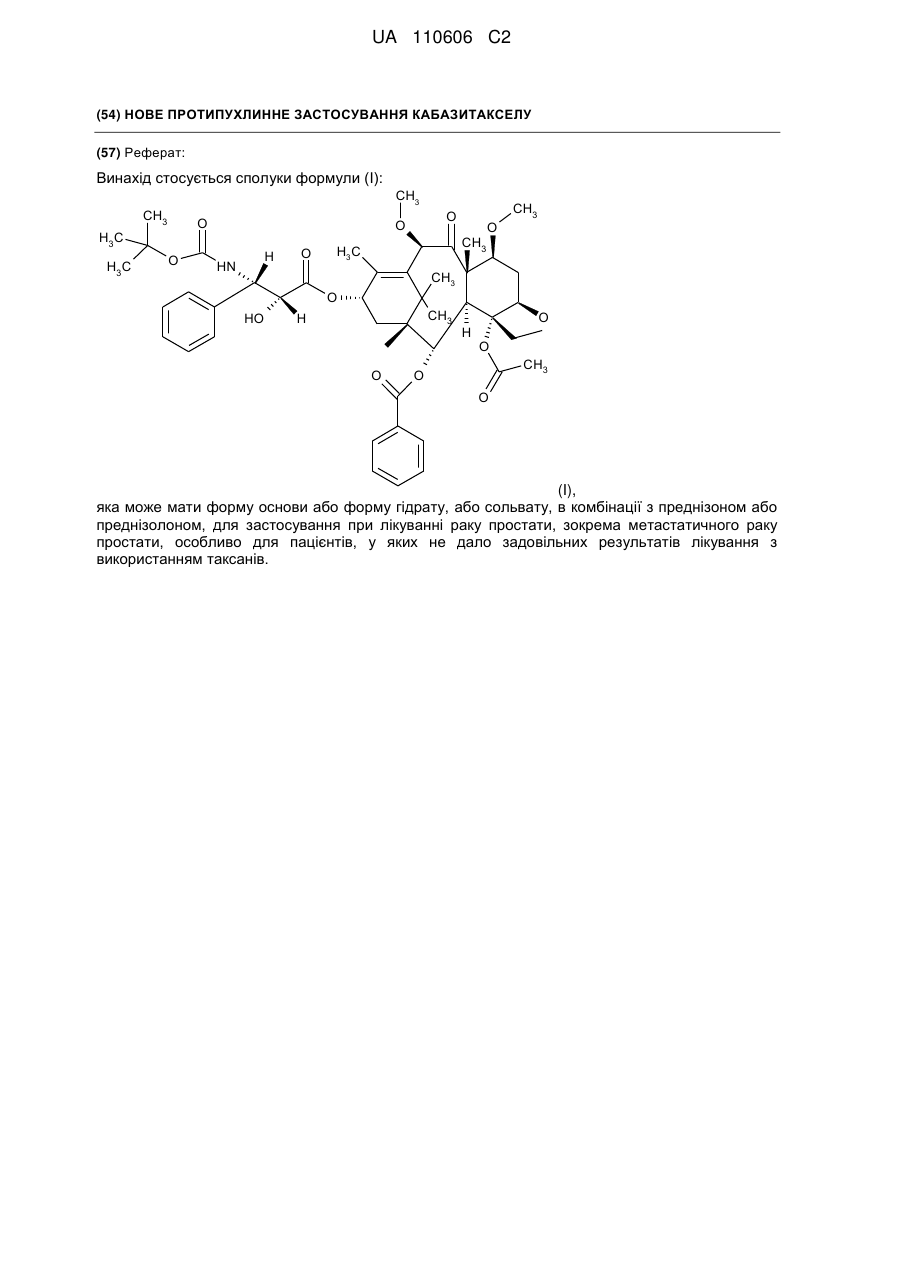
1. Застосування комбінації сполуки формули
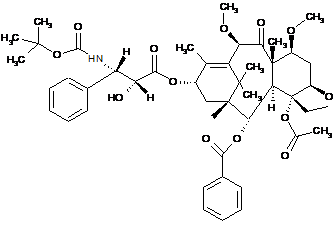 ,
,
яка може мати форму основи або форму гідрату або сольвату, з преднізоном або преднізолоном як лікарського засобу для лікування пацієнта з раком простати.
2. Застосування за п. 1, де у пацієнтів, що піддаються лікуванню, не вдалося досягти задовільних резульгатів при лікуванні, що базується на застосуванні таксанів.
3. Застосування за п. 1 або 2, де пацієнтів, які піддаються лікуванню, раніше лікували згідно зі схемами, що базуються на застосуванні доцетакселу.
4. Застосування за будь-яким з пп. 1-3, де рак простати є метастатичним захворюванням на пізній стадії.
5. Застосування за п. 3 або 4, де рак простати являє собою кастраційно-резистентний рак простати або гормонрефрактерний рак простати.
6. Застосування за будь-яким з пп. 1-5, де вказана сполука знаходиться в формі сольвату з ацетоном.
7. Застосування за п. 6, де вказаний сольват з ацетоном містить від 5 до 8 % мас. і переважно від 5 до 7 % мас. ацетону.
8. Застосування за будь-яким з пп. 1-7, де вказану сполуку вводять в дозі від 15 до 25 мг/м2, причому преднізон або преднізолон вводять в дозі 10 мг/день.
9. Застосування за п. 8, де вказану сполуку вводять в дозі 25 мг/м2.
10. Застосування за будь-яким з пп. 1-9, де лікування включає повторне введення вказаної сполуки у вигляді нового циклу кожні 3 тижні.
11. Застосування за п. 10, де середня кількість циклів складає 6.
12. Застосування за будь-яким з пп. 1-11, де комбінація містить вказану сполуку і преднізон і призначена для застосування як лікарського засобу для лікування пацієнтів з кастраційно-резистентним метастатичним раком простати або гормонрефрактерним раком простати, яких раніше лікували згідно зі схемами, що базуються на застосуванні доцетакселу.
13. Застосування за будь-яким з пп. 1-12, де вказану сполуку вводять в такій кількості, щоб забезпечити AUC приблизно 991 нг·год./мл (CV 34 %).
14. Застосування за будь-яким з пп. 1-13, де вказану сполуку вводять в такій кількості, щоб забезпечити Сmах приблизно 226 нг·год./мл (CV 107 %).
15. Застосування за будь-яким з пп. 1-14, де вказану сполуку вводять в такій кількості, щоб забезпечити плазмовий кліренс 48,5 л/год. (CV 39 %).
16. Застосування за будь-яким з пп. 1-15, де в процесі лікування додатково здійснюють моніторинг аналізів крові і вимірювання рівнів нейтрофілів у пацієнта.
17. Застосування за п. 16, де вказаний моніторинг включає відбирання зразків крові у пацієнта.
18. Застосування за п. 17, де додатково припиняють введення кабазитакселу пацієнту з кількістю нейтрофілів ≤1500 клітин/мм3.
19. Застосування за будь-яким з пп. 1-10, яке додатково включає зменшення дози сполуки, якщо у пацієнта виникла фебрильна нейтропенія або тривала нейтропенія; припинення лікування, якщо кількість нейтрофілів у пацієнта ≤1500 клітин/мм3; і, необов'язково, відновлення лікування, коли кількість нейтрофілів у пацієнта повертається на рівень ≥1500 клітин/мм3.
20. Застосування за будь-яким з пп. 1-10, де лікування додатково включає введення пацієнту G-CSF перед введенням вказаної сполуки, де вважається, що для вказаного пацієнта є підвищений ризик ускладнень, пов'язаних з нейтропенією.
21. Застосування за будь-яким з пп. 1-10, де пацієнту вводять лікарський засіб для попередження алергії до введення кабазитакселу.
22. Набір для лікування пацієнта з раком простати, який включає:
a) кабазитаксел і преднізон або преднізолон;
b) пакувальний матеріал, і
c) інструкцію із застосування лікарського засобу.
Текст
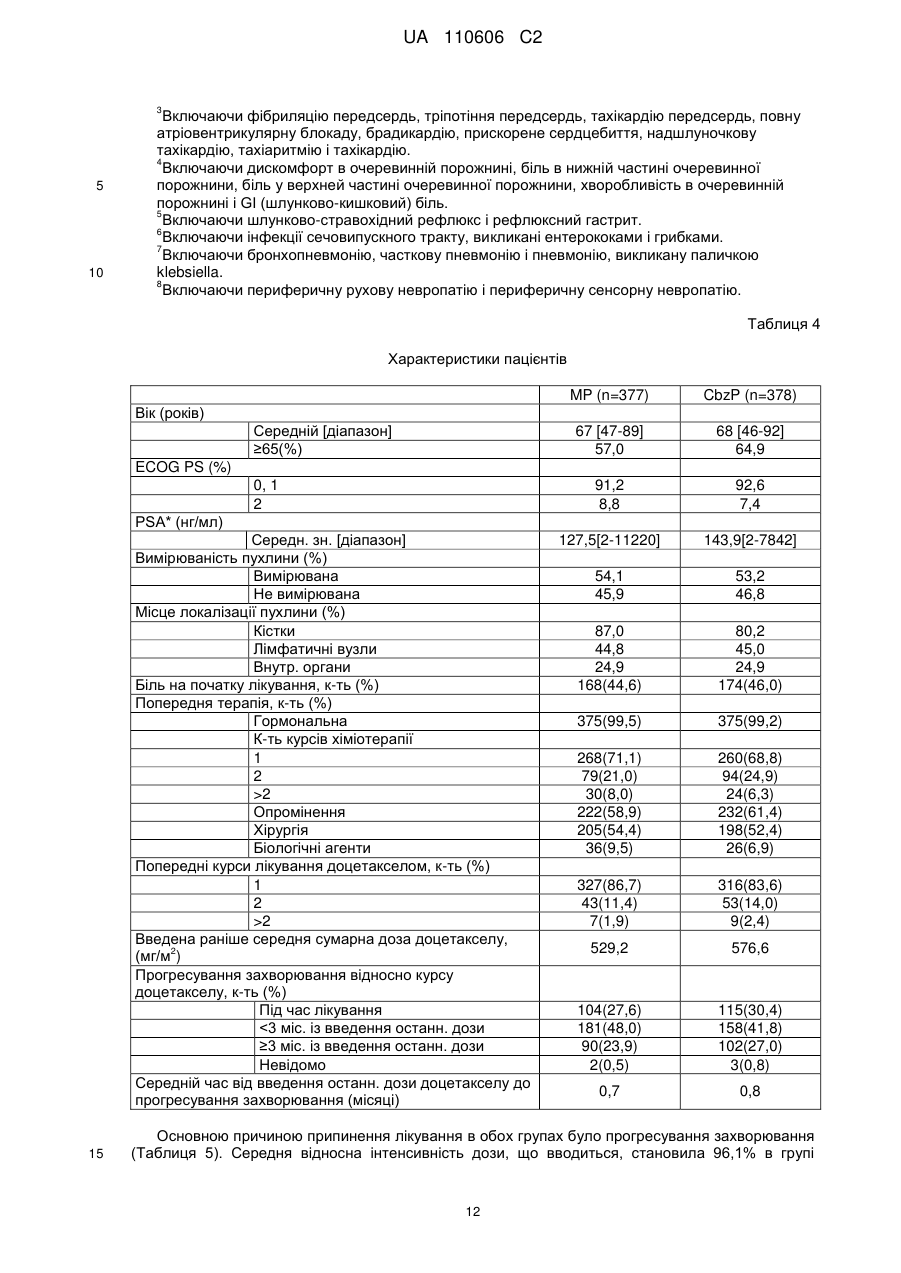
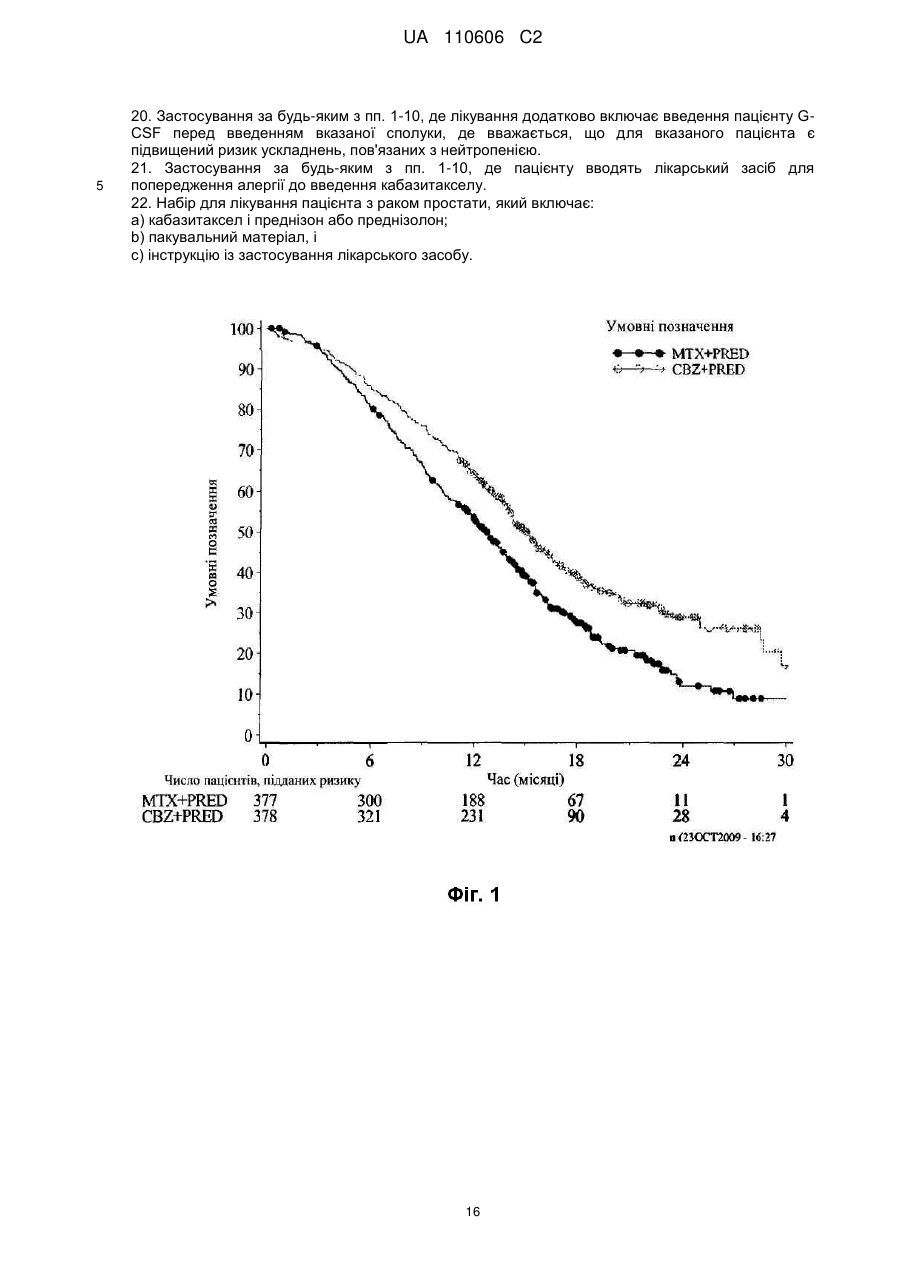
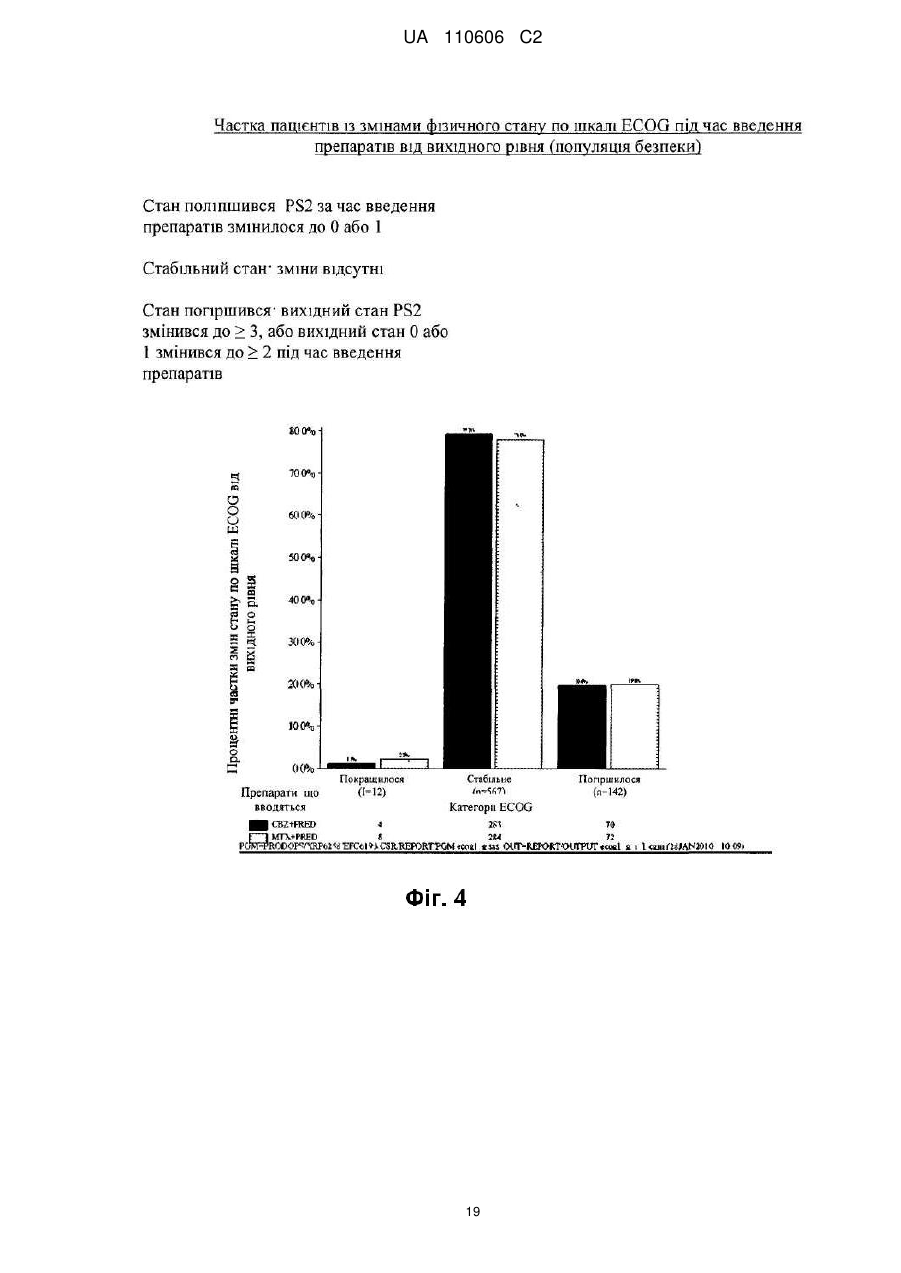
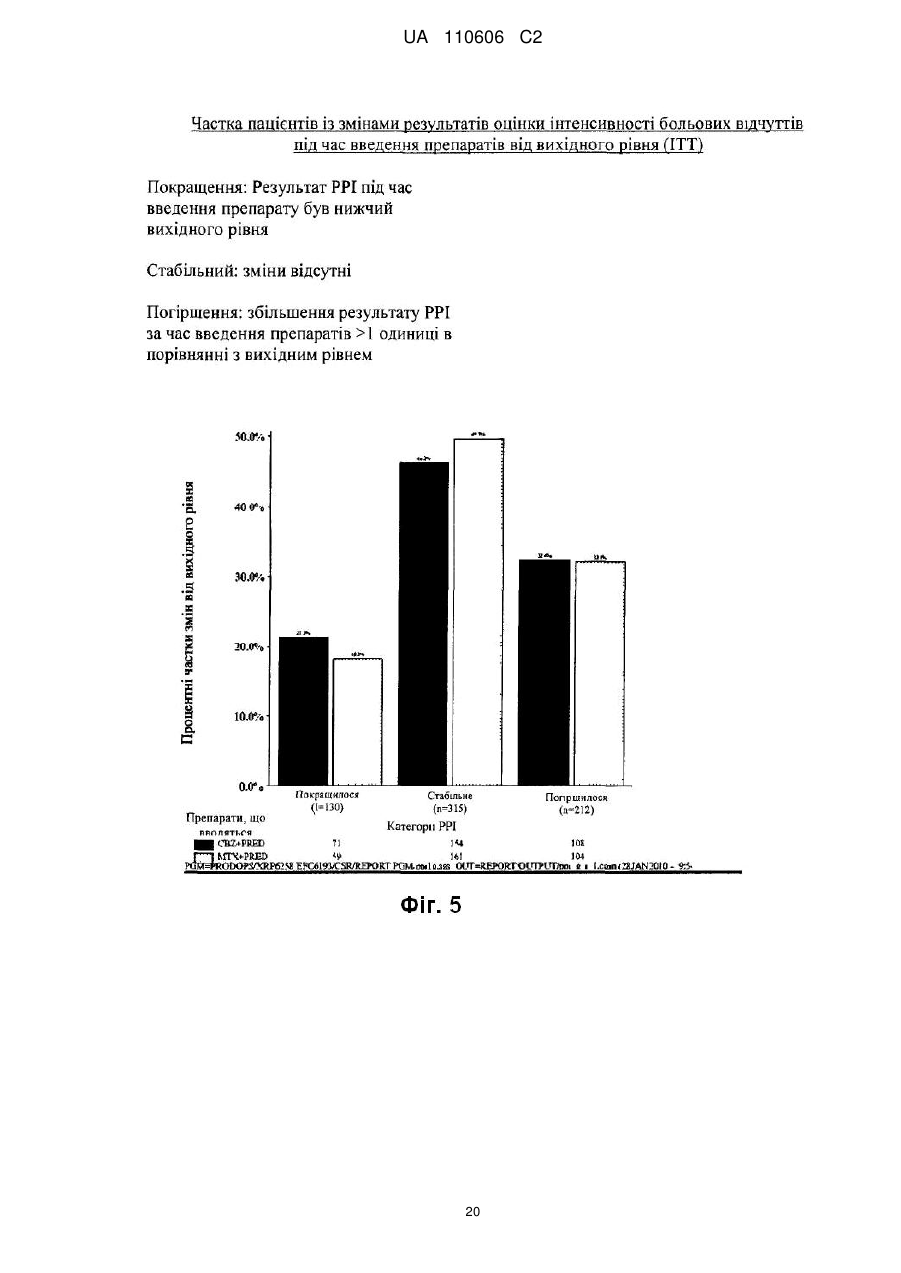
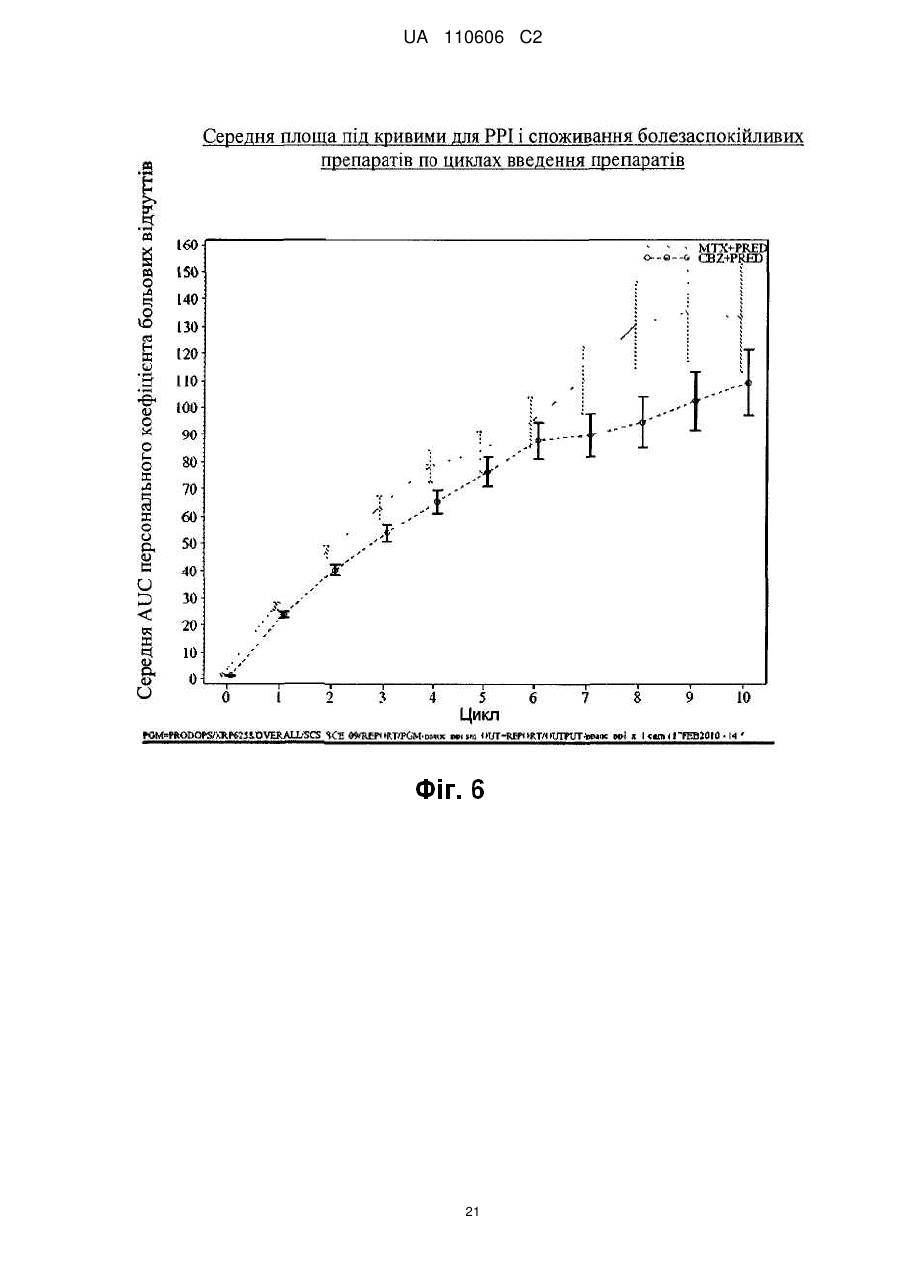
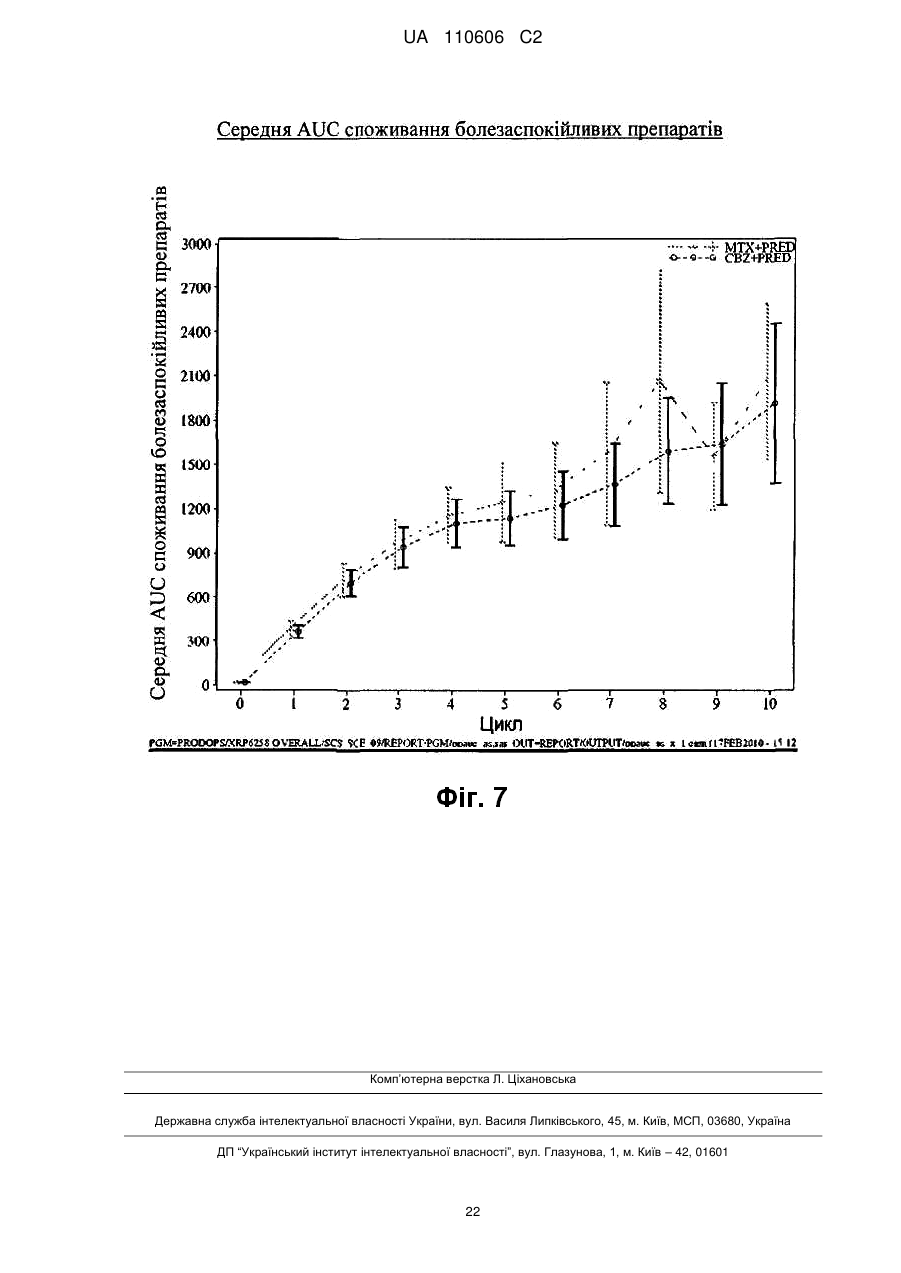
Реферат: Винахід стосується сполуки формули (І): CH3 CH3 O H3 C H3C O H HN O CH3 O O CH3 H3C O CH3 O HO CH3 H O H O O CH3 O O (I), яка може мати форму основи або форму гідрату, або сольвату, в комбінації з преднізоном або преднізолоном, для застосування при лікуванні раку простати, зокрема метастатичного раку простати, особливо для пацієнтів, у яких не дало задовільних результатів лікування з використанням таксанів. UA 110606 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується нового протипухлинного застосування кабазитакселу для лікування раку простати, який може бути метастатичним, в тому числі у пацієнтів, для яких не вдалося досягти задовільних результатів за допомогою лікування, основаного на застосуванні таксанів. Зокрема, даний винахід стосується застосування кабазитакселу для лікування пацієнтів з кастраційно-резистентним метастатичним раком простати, які раніше піддавалися лікуванню по схемі із застосуванням доцетакселу, що є незадоволеною потребою сучасної медицини. ПРОБЛЕМИ ТЕХНІКИ ВІДОМОГО РІВНЯ Рак простати вражає значну частину чоловічого населення у всьому світі: в 2002 р. на планеті було зареєстровано 680 000 випадків цього захворювання; прогнозується, що до 2010 р. щорічно буде виникати 900 000 нових випадків раку простати (CA Cancer J.Clin., 55, 74-108). Рак простати є раковим захворюванням, що найчастіше зустрічається у чоловіків після раку легенів. Як правило, на першому етапі раку простати лікують усуненням андрогенних гормонів, тобто шляхом хірургічного видалення яєчок (The Current State of Hormonal Therapy for Prostate Cancer CA Cancer J. Clin., May 2002; 52: 154-179) або радіаційною терапією (External beam radiation therapy for prostate cancer CA Cancer J. Clin., Nov. 2000; 50: 349-375). Лікування із застосуванням антиандрогенів або гормонів приводять до нетривалої реакції і не спричиняють якого-небудь збільшення тривалості життя. Застосування цитотоксичної хіміотерапії не є стандартним способом лікування, хоча встановлена роль подібних препаратів в полегшенні симптомів і зниженні рівнів PSA (простатаспецифічного антигену). У випадку монотерапії не вдалося досягти ступеня реакції більшого ніж 30%; здійснювалося тестування комбінацій, що впливають на рівні PSA. Не було виявлено якого-небудь впливу на час виживаності і, більше того, проблематичною стала токсичність цих способів лікування, зокрема у пацієнтів старшого віку, оскільки, крім ракового захворювання, вони, як правило, страждали на пов'язані з ним проблем зі здоров'ям і мали обмежений резерв кісткового мозку. До цього часу, застосовувані хіміотерапевтичні препарати обмежувалися циклофосфамідом, антрациклінами (доксорубіцином або мітоксантроном) і естрамустином, причому результати цього лікування були відносно посередніми. Паліативні ефекти спостерігалися у пацієнтів після введення кортикоїдів самих по собі або мітоксантрону в поєднанні з преднізоном або гідрокортизоном. Після клінічних випробувань фази II, комбінація мітоксантрону з кортикоїдами була визнана стандартним способом лікування гормон-резистентного раку простати. Пізніше, лікування із застосуванням доцетакселу в комбінації з етрамустином або преднізоном дало можливість лікувати форми раку, стійкі до усунення гормонів (Advances in Prostate Cancer Chemotherapy: А New Era Begins CA Cancer J.Clin., Sep.2005; 55:300-318), причому тривалість життя збільшилася на 2,4 місяці. Загальновизнано, що при раку простати на пізніх стадіях тяжко оцінити реакцію на лікування внаслідок різнорідності захворювання і відсутності консенсусу відносно критеріїв цієї реакції. У багатьох пацієнтів з метастатичним раком простати немає вимірної пухлини, але є симптоми, серед яких переважають кісткові метастази. Було виявлено, що вимірювання рівня PSA є засобом оцінки нових потенційних лікарських засобів, і, крім того, такими засобами є вимірювання розміру пухлини, якщо є така можливість, вимірювання кісткових пухлин, визначення якості життя і сили больових відчуттів. Крім того, рак може набувати резистентності до застосовуваних засобів, зокрема, до таксанів, що обмежує можливості лікування. Було описано декілька механізмів резистентності до таксанів (експресія Р-глікопротеїну P-gp, ген mdr-1, зміна метаболізму таксану, мутація гена тубуліну і т. д.): див.: Drug Resistance Update 2001, 4(1), 3-8; J.Clin.Onc. 1999, 17(3), 1061-1070. Проблема відомого рівня техніки, яку малося намір вирішити даним винаходом, полягала в розробці нових терапевтичних можливостей лікування раку простати, зокрема, у пацієнтів, яким не допомогло лікування на основі таксанів, наприклад, пацієнтів з кастраційно-резистентним метастатичним раком простати, які раніше піддавалися лікуванню по схемі, основаній на доцетакселі (який є в продажу під торговою маркою Taxotere®), причому потреба у вказаному лікуванні не задоволена в сучасній медицині. Відомо, що з квітня 2006 г було проведено чотири клінічних випробування кабазитакселу. Три тести, проведені по схемі монотерапії, дали можливість визначити максимально переносиму дозу і токсичність при граничному дозуванні: ці тести були проведені на пухлинах 2 грудей, простати і на саркомі. Застосовували дозування 10-30 мг/м кожні три години. Клінічне випробування фази II проводили на пацієнтах з раком грудей, які до цього отримували таксани і антрацикліни як допоміжний засіб (тобто після хірургічної операції), або як лікування першої 1 UA 110606 C2 5 10 15 20 25 30 35 40 45 лінії. Рівні реакції становили 14,6% при використанні як допоміжний засіб і 9,5% при використанні як лікування другої лінії. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід стосується застосування нових протипухлинних фармацевтичних терапевтичних засобів, що включають кабазитаксел формули Крім того, даний винахід стосується способів лікування пацієнтів з раком простати, що включає введення вказаному пацієнту ефективної кількості протипухлинного засобу кабазитакселу. Вказаний протипухлинний засіб, призначений для лікування раку простати, зокрема, для лікування пацієнтів, яким не допомогло лікування на основі таксанів, наприклад, пацієнтів, яких раніше лікували по схемах, основаних на застосуванні доцетакселу, може мати форму безводної основи, гідрату або сольвату. Цю сполуку переважно вводять пацієнту з метастатичним захворюванням на пізній стадії. Зокрема, сполуку вводять пацієнту з кастраційно-резистентним раком простати. Кабазитаксел переважно вводять в комбінації з кортикоїдом, вибраним зокрема з преднізону і преднізолону. Цей кортикоїд переважно вводять перорально в дозуванні 10 мг/день. У деяких аспектах даного винаходу, кабазитаксел вводять в комбінації з преднізоном при його застосуванні як лікарського засобу для лікування пацієнтів з гормон-рефрактерним раком простати, яких раніше лікували по схемах на основі доцетакселу. У деяких аспектах даного винаходу, кабазитаксел вводять в дозі (що визначається для 2 кожного введення) від 20 до 25 мг/м . Кабазитаксел може мати форму сольвату з ацетоном. Більш конкретно, сольват ацетону і кабазитакселу містить від 5% до 8% і, переважно, від 5% до 7% ацетону по масі. У деяких аспектах даного винаходу, кабазитаксел можна вводити внутрішньовенною 2 інфузією в дозі від 15 до 25 мг/м , і цей цикл введення протипухлинного засобу повторюють з інтервалом 3 тижня між кожним введенням кабазитакселу, причому вказаний інтервал може бути збільшений на 1-2 тижні, залежно від того, як пацієнт переніс попереднє введення кабазитакселу. У деяких варіантах здійснення, ефективна кількість кабазитакселу дозволяє добитися як мінімум одного терапевтичного ефекту, вибраного з групи, що складається із збільшення підсумкової виживаності, часткової реакції, зменшення розміру пухлини, скорочення метастазів, повної ремісії, часткової ремісії, стабілізації захворювання або повної реакції. Даний винахід стосується також фармацевтичної композиції, що застосовується для лікування пацієнтів з раком простати, що включає клінічно доведену безпечну і ефективну кількість кабазитакселу. Інші варіанти здійснення даного винаходу включають способи застосування, лікування, сприяння застосуванню і поширення кабазитакселу. Даний винахід стосується також упаковок і готових виробів. КОРОТКИЙ ОПИС ІЛЮСТРАТИВНИХ МАТЕРІАЛІВ На фіг. 1 зображені криві підсумкової виживаності Каплана-Мейєра в клінічному дослідженні кабазитакселу. На фіг. 2 зображені криві виживаності без прогресування захворювання Каплана-Мейєра в клінічному дослідженні кабазитакселу. 2 UA 110606 C2 5 10 15 20 На фіг. 3 показаний аналіз підсумкової виживаності в підгрупах пацієнтів, які починали проходити лікування, визначених за вихідними характеристиками. Відношення ризиків 1 говорить на користь групи мітоксантрону. CI означає довірчий інтервал. На фіг. 4 графічно зображена частка пацієнтів із змінами загального фізичного стану по шкалі ECOG від вихідного рівня під час лікування (популяція безпеки). На фіг. 5 графічно зображена частка пацієнтів, у яких під час лікування сталися зміни результатів по інтенсивності больових відчуттів від вихідного рівня (ITT). На фіг. 6 графічно показана середня площа під кривою для PPI і даних про споживання болезаспокійливих препаратів по циклах лікування. На фіг. 7 графічно представлені середні AUC даних про споживання болезаспокійливих препаратів. ОПИС ВИНАХОДУ Визначення Термін "ефективна кількість" в даному описі означає кількість фармацевтичної сполуки, наприклад, кабазитакселу, що чинить вплив на ракове захворювання, яке підлягає лікуванню. Термін "клінічно доведений" в даному описі означає дані по клінічній ефективності, які достатні для того, щоб задовольняти стандарти, необхідні для схвалення FDA. Термін "кастраційно-резистентний рак простати" в даному описі є синонімом гормонрефрактерного раку простати. Термін "пацієнт" в даному описі включає як людину, так і тварину. У одному з варіантів здійснення пацієнт є людиною. Кабазитаксел належить до сімейства таксоїдів і має формулу: . 25 30 35 40 Кабазитаксел має наступне хімічне найменування: 4α-ацетокси-2α-бензоїлоксі-5β,20-епокси1β-гідрокси-7β,10β-диметокси-9-оксо-11-таксен-13α-іл (2R, 3S)-3-трет-бутоксикарбоніламіно-2гідрокси-3-фенілпропіонат. Синонімічне найменування кабазитакселу (2α,5β,7β,10β,13α)-4ацетокси-13-({(2R, 3S)-3-[(трет-бутоксикарбоніл)аміно]-2-гідрокси-3-фенілпропаноїл}окси)-1гідрокси-7,10-диметокси-9-оксо-5,20-епокситакс-11-ен-2-іл бензоат. Ця сполука і спосіб її отримання описані в WO 96/30355, EP 0 817 779 B1 і US 5 847 170, які включені в дану заявку за допомогою посилання. Кабазитаксел можна вводити в формі основи (порівняйте приведену вище формулу) або в формі гідрату. Крім того, кабазитаксел може мати форму сольвату, тобто молекулярного комплексу, який характеризується включенням кристалізаційного розчинника в кристал, що складається з молекул діючого начала (з цього питання див. стор. 1276 J. Pharm. Sci. 1975, 64(8), 1269-1288). Сольват може являти собою в тому числі сольват з ацетоном і, більш конкретно, може бути сольватом, описаним в WO 2005/02846. Сольват кабазитакселу з ацетоном може містити від 5% до 8% і переважно від 5% до 7% по масі ацетону (величина в % означає кількість ацетону/(кількість ацетону + кількість кабазитакселу) × 100). Середній вміст ацетону становить 7%, що приблизно відповідає стехіометричній кількості, яка дорівнює 6,5% для сольвату, що містить одну молекулу ацетону. Описана нижче методика дозволяє отримати сольват кабазитакселу і ацетону: 3 UA 110606 C2 5 10 15 20 25 30 35 40 45 50 55 60 940 мл очищеної води при температурі 20±5 °C (кімнатна температура) додають до розчину 207 г 4α-ацетокси-2α-бензоїлоксі-5β,20-епокси-1β-гідрокси-7β,10β-диметокси-9-оксо-11-таксен13α-іл (2R,3S)-3-трет-бутоксикарбоніламіно-2-гідрокси-3-фенілпропіонату при приблизно 92% по вазі в приблизно 2 літрах ацетону, після чого вносять кристалічну затравку у вигляді суспензії 2 г 4α-ацетокси-2α-бензоїлоксі-5β,20-епокси-1β-гідрокси-7β,10β-диметокси-9-оксо-11-таксен-13αіл (2R,3S)-3-трет-бутоксикарбоніламіно-2-гідрокси-3-фенілпропіонату, виділеного з суміші ацетон/вода, в суміші 20 мл води і 20 мл ацетону. Отриману суміш перемішують протягом приблизно 10-22 годин і додають 1,5 літри очищеної води протягом 4-5 годин. Цю суміш перемішують протягом 60-90 хвилин і потім фільтрують отриману суспензію при зниженому тиску. Шар осаду промивають на фільтрі розчином, отриманим з 450 мл ацетону і 550 мл очищеної води, і потім сушать в печі при 55 °C і зниженому тиску (0,7 кПа) протягом 4 годин. Отримують 197 г сольвату 4α-ацетокси-2α-бензоїлоксі-5β,20-епокси-1β-гідрокси-7β,10βдиметокси-9-оксо-11-таксен-13α-іл (2R, 3S)-3-трет-бутоксикарбоніламіно-2-гідрокси-3фенілпропіонату з ацетоном, що містить 0,1% води і 7,2% ацетону (теоретична кількість для стехіометричного сольвату 6,5%). Кабазитаксел можна вводити парентерально, наприклад, внутрішньовенним шляхом. Галенова форма кабазитакселу, прийнятна для введення за допомогою внутрішньовенної інфузії, являє собою таку форму, в якій кабазитаксел розчинений у воді в присутності ексципієнтів, вибраних з ПАР, співрозчинників глюкози або хлориду натрію і т. д. Наприклад, галенову форму кабазитакселу можна отримати розбавленням заздалегідь приготованого розчину кабазитакселу, що знаходиться в стерильному флаконі (80 мг кабазитакселу + 2 мл розчинника + Polysorbat 80), в 6 мл суміші води і етанолу (13% по масі 95% етанолу) в стерильному флаконі, з отриманням 8 мл розчину, придатного для повторного розбавлення в перфузійному мішку. Концентрація кабазитакселу в цьому придатному для повторного розбавлення розчині становить приблизно 10 мг/мл. Після цього отримують розчин для перфузії, вводячи відповідну кількість цього придатного для повторного розбавлення розчину в перфузійний мішок, що містить воду і глюкозу (приблизно 5%) або хлорид натрію (приблизно 0,9%). Кабазитаксел можна вводити в комбінації з кортикоїдом, наприклад, преднізоном або преднізолоном, у вигляді двох окремих фармацевтичних препаратів. Відповідно, один з аспектів даного винаходу стосується способу лікування раку простати, що включає введення пацієнта, потребуючого такого лікування, ефективної кількості кабазитакселу в комбінації з кортикостероїдом, таким як преднізон або преднізолон. Цю комбінацію вводять багато разів відповідно до протоколу, який залежить від пацієнта, що піддається лікуванню, (вік, маса тіла, історія лікування і т. д.), і може бути визначений кваліфікованим лікарем. У одному з аспектів даного винаходу, кабазитаксел вводять пацієнту за допомогою перфузії по дискретній програмі з інтервалом між введеннями, що дорівнюють 3 тижням, причому цей інтервал можна збільшити на 1 або 2 тижні залежно від того, як пацієнт переніс попереднє введення. Середнє число циклів дорівнює 6. Преднізон або преднізолон можуть вводитися щодня, наприклад, шляхом прийняття однієї дози на день, протягом всього курсу лікування. Приклади доз для двох цих протипухлинних агентів приведені в розділі 2 "Приклади". Рекомендована в даний час доза кабазитакселу становить 25 мг/м при введенні шляхом інфузії тривалістю одна година, і доза преднізону або преднізолону дорівнює 10 мг на день при пероральному введенні. У деяких аспектах даного винаходу, у підлягаючого лікуванню пацієнта є рак простати, резистентний до гормональної терапії (тобто гормон-рефрактерний), і цього пацієнта раніше лікували доцетакселом. У деяких аспектах, у пацієнта є рак простати, який прогресував під час або після лікування доцетакселом. У деяких аспектах, пацієнта раніше лікували доцетакселом 2 при його сумарній дозі не меншій ніж 225 мг/м . У конкретному аспекті, у пацієнта спостерігалося прогресування захворювання протягом шести місяців після гормональної терапії або під час лікування доцетакселом, або після лікування доцетакселом. У іншому конкретному аспекті, у пацієнта було зафіксовано прогресування захворювання протягом трьох місяців після гормональної терапії або після лікування доцетакселом. У деяких аспектах даного винаходу, у підлягаючого лікуванню пацієнта є пухлина, що вимірюється, і може спостерігатися прогресування захворювання за рахунок метастатичного ураження внутрішніх органів або м'яких тканин розміром не менше ніж 1 см згідно з даними MRI (ЯМР-томографії) або аксіального томографічного сканування (комп'ютерної томографії). У деяких аспектах даного винаходу, у підлягаючого лікуванню пацієнта є пухлина, що не вимірюється, і може спостерігатися збільшення рівня PSA за результатами трьох вимірювань з 1-тижневим інтервалом або поява нових осередків ураження. 4 UA 110606 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких аспектах даного винаходу, підлягаючий лікуванню пацієнт піддався кастрації шляхом орхидектомії або за допомогою агоністів LHRH, усунення андрогенів або монотерапії із застосуванням естрамустину. У переважному аспекті, очікувана тривалість життя підлягаючого лікуванню пацієнта повинна складати не менше 2 місяців. У деяких аспектах, лікуванню не підлягають пацієнти, які раніше отримували мітоксантрон, 2 або отримували менше ніж 225 мг/м доцетакселу, або піддавалися радіаційній терапії, яка привела до знищення більше ніж 40% кісткового мозку, або отримували лікування протягом 4 тижнів, що передують тесту, або мали невропатію або стоматит, що стосувалися головного мозку або оболонки головного мозку, або продемонстрували тяжку алергічну реакцію на полісорбати або преднізон, або аналіз крові яких показав помітне зменшення рівнів нейтрофілів, гемоглобіну або тромбоцитів, підвищений вміст білірубіну і/або ферментів печінки і креатиніну, або у яких є проблеми з серцем, або інфекції, що вимагають застосування антибіотиків. Один з аспектів даного винаходу стосується способу збільшення тривалості життя пацієнта з гормон-рефрактерним метастатичним раком простати, що включає введення пацієнту клінічно доведеної ефективної кількості кабазитакселу в комбінації з преднізоном або преднізолоном. У конкретному аспекті, пацієнт перед цим піддався лікуванню по схемі, що включає доцетаксел. Кабазитаксел можна вводити в комбінації з лікарськими засобами, призначеними для запобігання або послаблення нудоти і блювання, або для запобігання або послаблення алергічної реакції на введення кабазитакселу. Переважно, щоб ці засоби вводилися пацієнту до введення основного препарату, наприклад, як мінімум за 30 хвилин до введення кожної дози кабазитакселу. Один з аспектів даного винаходу стосується способу зниження ризику тяжкої алергічної реакції у пацієнта з раком простати, що піддається лікуванню кабазитакселом, що включає введення пацієнту лікарського засобу для запобігання алергічній реакції перед введенням кабазитакселу. Можуть виникати тяжкі алергічні реакції на кабазитаксел, і ці реакції можуть включати генералізований висип/еритему, гіпотензію і бронхоспазм. Необхідно пильно спостерігати за алергічними реакціями пацієнта, особливо під час першої і другої інфузій. Алергічні реакції можуть виникати протягом декількох хвилин після початку інфузії кабазитакселу, тому повинні бути доступні засоби і обладнання для лікування гіпотензії і бронхоспазму. Якщо виникає тяжка алергічна реакція, необхідно негайно перервати інфузію кабазитакселу і ввести відповідний терапевтичний засіб. Приклади лікарських засобів, які можуть застосовуватися для профілактики алергічної реакції на лікування кабазитакселом, включають антигістамінні засоби, наприклад, дексхлорфенірамін (наприклад, 5 мг) і дифенгідрамін (наприклад, 25 мг) або еквівалентні антигістамінні засоби; а також кортикостероїди, наприклад, дексаметазон (наприклад, 8 мг) або еквівалентний стероїд. Проте, кабазитаксел не треба давати, і він може бути протипоказаний пацієнтам, у яких є історія тяжких алергічних реакцій на кабазитаксел. У залежності від складу композиції, що вводиться, кабазитаксел може також бути протипоказаний пацієнтам, у яких є історія алергічних реакцій на інші лікарські засоби, до складу яких входить полісорбат 80. Один з аспектів даного винаходу стосується готового промислового виробу, що включає: a) пакувальний матеріал; b) кабазитаксел, і c) етикетку або вкладку, поміщену в пакувальний матеріал, в якій є вказівка на можливість виникнення тяжких алергічних реакцій. При лікуванні кабазитакселом можуть з'являтися шлунково-кишкові симптоми, наприклад, нудота, блювання і діарея. Повідомлялося про смертність, пов'язану з діареєю і порушенням балансу електролітів. Отже, пацієнтам може також біти потрібна регідратація і, при необхідності, лікування протидіарейними або протиблювотними засобами. Може потребуватися відкласти лікування або скоротити дози, якщо у пацієнта виникне діарея ≥3 ступеня. Відповідно, способи за даним винаходом включають введення в комбінації з кабазитакселом лікарського засобу для профілактики алергічної реакції або лікарського засобу для профілактики або послаблення нудоти і блювання. Приклади лікарських засобів, які можуть застосовуватися для профілактики або послаблення нудоти і блювання, включають антагоністи гістамінового рецептора H 2 і протиблювотні засоби, такі як ондансетрон, гранісетрон і долесетрон. Можливим побічним ефектом лікування кабазитакселом є нейтропенія, яка характеризується зниженою кількістю нейтрофілів. На жаль, повідомлялося про ряд випадків смерті від нейтропенії. Тому для моніторингу нейтропенії необхідно здійснювати часте 5 UA 110606 C2 5 10 15 20 25 30 35 40 45 50 55 відбирання зразків крові і їх аналіз. При появі нейтропенії, лікування кабазитакселом може бути перерване і розпочате знову, коли кількість нейтрофілів повернеться на рівень >1500 мм. Кабазитаксел не треба давати пацієнтам з кількістю нейтрофілів ≤1500 клітин/мм. Тому даний винахід стосується також способу лікування раку простати кабазитакселом, що включає введення пацієнту кабазитакселу, моніторинг аналізів крові пацієнта і визначення рівня нейтрофілів. У одному з аспектів цей спосіб додатково включає припинення лікування кабазитакселом при виникненні нейтропенії і, необов'язково, відновлення лікування кабазитакселом при відновленні кількості нейтрофілів до рівнів >1500/мм. У одному з аспектів моніторинг включає відбирання зразків крові у пацієнта. Визначення числа нейтрофілів може бути здійснено по методиках, добре відомих фахівцях в даній галузі техніки. Один з аспектів даного винаходу стосується способу зниження ризику ускладнень нейтропенії, що включає введення кабазитакселу в комбінації з агентом, прийнятним для лікування нейтропенії. Цим агентом для лікування нейтропенії є, наприклад, гематопоетичний фактор росту, який регулює вироблення і діяльність нейтрофілів, такий як гранулоцитарний колонієстимулюючий фактор людини (G-CSF). У окремому аспекті винаходу, нейтропенія є ускладненою нейтропенією. Ускладнена нейтропенія включає фебрильну нейтропенію, тривалу нейтропенію або інфекції, супутні нейтропенії. У переважному варіанті здійснення, засіб для лікування нейтропенії вводять до введення кабазитакселу. Окремий аспект винаходу включає спосіб зменшення ризику ускладнень нейтропенії у пацієнта з раком простати, якого лікують кабазитакселом, що включає моніторинг результатів аналізу крові у пацієнта через регулярні інтервали часу при лікуванні пацієнта кабазитакселом; зменшення дози кабазитакселу, якщо у пацієнта виникає фебрильна нейтропенія або тривала нейтропенія; припинення лікування кабазитакселом, якщо кількість нейтрофілів в крові пацієнта стає ≤1500 клітин/мм; і, необов'язково, відновлення лікування кабазитакселом, якщо кількість нейтрофілів у пацієнта відновлюється до рівня ≥1500 клітин/мм. У окремому аспекті, необхідно розглянути первинну профілактику за допомогою G-CSF у пацієнтів з клінічними ознаками високого ризику (вік >65 років, поганий стан здоров'я, епізоди фебрильної нейтропенії, що були раніше, обширні радіаційні ураження, що були раніше, поганий статус харчування або інші серйозні супутні патології), які схиляють пацієнтів до ускладнень тривалої нейтропенії. Терапевтичне застосування G-CSF і повторної профілактики потрібно мати на увазі для всіх пацієнтів, які, як вважається, мають підвищений ризик ускладнень нейтропенії. У іншому аспекті, моніторинг повного аналізу крові проводять на щотижневій основі під час 1-го циклу введення і перед кожним наступним циклом введення з тим, щоб при необхідності була можливість відрегулювати дозу. Отже, інший аспект способу зниження ризику ускладнень нейтропенії включає моніторинг аналізів крові пацієнта і регулювання дози кабазитакселу. Приклад зміни дози описаний в прикладі 2. Один з аспектів даного винаходу стосується готового промислового виробу, що включає: a) пакувальний матеріал; b) кабазитаксел, і c) етикетку або вкладку, поміщену в пакувальний матеріал, в якій є вказівка, що кабазитаксел не треба давати пацієнтам з кількістю нейтрофілів ≤1500 клітин/мм. Необхідно виявляти випадки ниркоподібної недостатності і вживати проти них енергійні заходів, відповідно до способів, відомих фахівцям в даній галузі. Ниркоподібна недостатність може бути пов'язана з сепсисом, зневодненням або обструктивною уропатією. Крім того, порушення функцій печінки (наприклад, загальний білірубін ≥ULN, або AST і/або ALT ≥1,5×ULN) може приводити до збільшення концентрації кабазитакселу, і кабазитаксел не треба давати пацієнтам з порушенням функції печінки. Кабазитаксел може заподіювати шкоду плоду при введенні вагітним жінкам. Преднізон або преднізолон при введенні в кількості 10 мг на день не впливають на фармакокінетику кабазитакселу. Первинний метаболізм кабазитакселу відбувається під дією CYP3A. Одночасне введення сильних інгібіторів CYP3A (наприклад, кетоконазолу, ітраконазолу, кларитроміцину, атазанавіру, індинавіру, нефазодону, нелфінавіру, ритонавіру, саквінавіру, телітроміцину, вориконазолу) може збільшити концентрації кабазитакселу. Тому потрібно уникати спільного введення кабазитакселу з сильними інгібіторами CYP3A. Необхідно попереджати про обережність при спільному застосуванні кабазитакселу з інгібіторами CYP3A помірної сили. Один з аспектів даного винаходу стосується способу лікування пацієнта з раком простати, що включає 6 UA 110606 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначення, чи піддавався пацієнт лікуванню інгібітором CYP3A, припинення лікування інгібітором CYP3A і потім введення кабазитакселу пацієнту. Одночасне введення з сильним стимулятором CYP3A (наприклад, фенітоїном, карбамазепіном, рифампіном, рифабутином, рифапентином, фенобарбіталом) може зменшити концентрації кабазитакселу. Тому потрібно уникати спільного введення кабазитакселу з сильними стимуляторами CYP3A. Отже, один з аспектів даного винаходу стосується способу лікування пацієнта від раку простати, що включає визначення того, чи піддавався пацієнт лікуванню стимулятором CYP3A, припинення лікування стимулятором CYP3A і введення кабазитакселу пацієнту. Крім того, пацієнти повинні стримуватися від вживання препаратів звіробою. У деяких аспектах даного винаходу, кабазитаксел вводять в такій кількості, яка забезпечує AUC приблизно 991 нг·ч/мл (CV 34%). У деяких аспектах даного винаходу, кабазитаксел вводять в такій кількості, яка забезпечує Cmax приблизно 226 нг·ч/мл (CV 107%). У деяких аспектах даного винаходу, кабазитаксел вводять в такій кількості, яка забезпечує плазмовий кліренс 48,5 л/ч (CV 39%). Один з аспектів даного винаходу стосується упаковки, що включає кабазитаксел і етикетку, розташовану в місці, помітному потенційному покупцеві, що включає надруковане твердження, яке інформує потенційних покупців, що середнє значення C max кабазитакселу упацієнтів з метастатичним раком простати становить 226 нг/мл (CV 107%). Інший аспект даного винаходу стосується упаковки, що включає кабазитаксел і етикетку, розташовану в місці, помітному потенційному покупцеві, що включає надруковане твердження, яке інформує потенційних покупців, що середнє значення AUC кабазитакселу у пацієнтів з метастатичним раком простати становить 991 нг·ч/мл (CV 34%). Ще один аспект даного винаходу стосується упаковки, що включає кабазитаксел і етикетку, розташовану в місці, помітному потенційному покупцеві, що включає надруковане твердження, яке інформує потенційних покупців, що кабазитаксел має плазмовий кліренс 48,5 л/ч (CV 39%). Для забезпечення належного призначення і відпускання лікарських засобів, а також згоди пацієнта на лікування способами, описаними в даний заявці, може застосовуватися ряд освітніх матеріалів. Наприклад, в літературі і ряді інших матеріалів, наприклад, в інструкції по застосуванню, листівках-вкладишах в упаковки, інформації для пацієнта, інформаційних листках для лікарів, інформаційних листках для працівників охорони здоров'я, рекламі в медичних журналах і на веб-сайтах продуктів, можуть бути описані ризики і користь від застосування кабазитакселу. Даний винахід стосується також упаковки, що включає кабазитаксел і етикетку, де вказана етикетка містить одне або декілька повідомлень про те, що: a) ефективність і безпека кабазитакселу в комбінації з преднізоном були оцінені для пацієнтів з гормон-рефрактерним метастатичним раком простати, яких раніше лікували по схемі, що включає доцетаксел; або b) загалом 775 пацієнтів були випадковим чином розподілені по групах і отримували або 3 кабазитаксел в кількості 25 мг/м кожні три тижні, максимум 10 циклів введення, спільно з 2 преднізоном в дозуванні 10 мг перорально щодня, або мітоксантрон 12 мг/м внутрішньовенно кожні три тижні максимум 10 циклів, спільно з преднізоном в дозуванні 10 мг перорально щодня; або c) середнє число циклів в групі, що отримувала кабазитаксел, дорівнювало 6, і в групі, що отримувала мітоксантрон, це число дорівнювало 4. Крім того, даний винахід стосується упаковки, що включає кабазитаксел і етикетку, де вказана етикетка містить одне або декілька повідомлень про те, що: a) є повідомлення про смерть від нейтропенії; або b) необхідно здійснювати часті аналізи крові для спостереження за розвитком нейтропенії; або c) не треба приймати кабазитаксел, якщо кількість нейтрофілів складає ≤1500 клітин/мм. Далі, даний винахід стосується способу сприяння застосуванню кабазитакселу, де вказаний спосіб включає етап доведення до реципієнта принаймні одного інформаційного повідомлення, вибраного з: a) є повідомлення про смерть від нейтропенії; або b) необхідно здійснювати часті аналізи крові для спостереження за розвитком нейтропенії; або c) не треба приймати кабазитаксел, якщо кількість нейтрофілів складає ≤1500 клітин/мм; d) можливий розвиток тяжкої алергічної реакції; або 7 UA 110606 C2 5 10 15 20 25 30 35 40 45 50 55 60 e) можливий розвиток тяжкої алергічної реакції, яка може включати генералізований висип/еритему, гіпотензію і бронхоспазм; або f) негайно припинити введення кабазитакселу при появі тяжкої реакції; або g) негайно припинити введення кабазитакселу при появі тяжкої реакції і провести необхідне лікування; або h) кабазитаксел протипоказаний пацієнтам з історією тяжких алергічних реакцій на кабазитаксел, і лікарські препарати, до складу яких входить полісорбат 80. Крім того, даний винахід стосується способу поширення кабазитакселу, де згаданий кабазитаксел супроводжується інформацією, в якій указано, що: a) є повідомлення про смерть від нейтропенії; або b) необхідно здійснювати часті аналізи крові для спостереження за розвитком нейтропенії; або c) не треба приймати кабазитаксел, якщо кількість нейтрофілів складає ≤1500 клітин/мм; d) можливий розвиток тяжкої алергічної реакції; або e) можливий розвиток тяжкої алергічної реакції, яка може включати генералізований висип/еритему, гіпотензію і бронхоспазм; або f) негайно припинити введення кабазитакселу при появі тяжкої реакції; або g) негайно припинити введення кабазитакселу при появі тяжкої реакції і провести необхідне лікування; або h) кабазитаксел протипоказаний пацієнтам з історією тяжких алергічних реакцій на кабазитаксел і лікарські препарати, до складу яких входить полісорбат 80. Приклад 1 Проводили клінічне дослідження, в ході якого пацієнтам або вводили кабазитаксел, або здійснювали стандартне лікування на основі мітоксантрону, де кожний зі вказаних препаратів застосовували в комбінації з преднізоном або преднізолоном. Більш конкретно, пацієнтів у віці понад 18 років з метастатичним кастраційно-резистентним раком простати, вимірним по критеріях RECIST, або невимірним з підвищеними рівнями PSA або наявністю нових осередків ураження, із загальним фізичним станом по шкалі ECOG (Eastern Cooperative Oncology Group - Східної Об'єднаної Онкологічної Групи США) 0-2 і належним функціонуванням органів (кількість нейтрофілів у пацієнта повинна було становити >1500 клітин/мм, тромбоцитів >100 000 клітин/мм, гемоглобін>10 г/дл, креатинін
ДивитисяДодаткова інформація
Автори англійськоюGupta, Sunil
Автори російськоюГупта Сунил
МПК / Мітки
МПК: A61K 45/06, A61P 35/00, A61K 31/56, A61K 31/164
Мітки: нове, застосування, протипухлинне, кабазитакселу
Код посилання
<a href="https://ua.patents.su/24-110606-nove-protipukhlinne-zastosuvannya-kabazitakselu.html" target="_blank" rel="follow" title="База патентів України">Нове протипухлинне застосування кабазитакселу</a>
Попередній патент: Застосування toll-подібного рецептора і агоніста toll-подібного рецептора для лікування раку
Наступний патент: Спосіб переробляння матеріалу, що містить лігноцелюлозу
Випадковий патент: Закупорювальний пристрій для пляшки з рідиною