Фармацевтична композиція для перорального застосування, що містить декскетопрофен та трамадол
Формула / Реферат
1. Фармацевтична композиція, як тверда лікарська форма для перорального застосування, яка містить:
і) комбінацію двох активних фармацевтичних інгредієнтів, декскетопрофену, як сіль з органічними основами, та трамадолу, як сіль з неорганічними кислотами, в якій:
- органічну основу вибрано з групи, що складається з трометамолу, L-лізину і L-аргініну;
- неорганічну кислоту вибрано з групи, що складається з соляної і бромисто-водневої кислоти;
іі) наповнювач, який є мікрокристалічною целюлозою;
ііі) зв'язувальний агент, який вибрано з групи, що складається з кукурудзяного крохмалю, попередньо желатинізованого кукурудзяного крохмалю та гіпромелози або їх сумішей;
iv) фармацевтично прийнятний наповнювач,
і в якій всі компоненти композиції знаходяться у фізичному контакті один з одним.
2. Фармацевтична композиція за п. 1, в якій два активних інгредієнти утворюють гомогенну суміш, в якій ці активні інгредієнти є ретельно перемішаними.
3. Фармацевтична композиція за п. 1, в якій фармацевтичний наповнювач вибрано з розпушувача, мастила та гліданта.
4. Фармацевтична композиція за пп. 1-3, яка містить суміш двох активних інгредієнтів у масовому відношенні декскетопрофену до трамадолу, яке складає 2:1-1:10, еквівалентному масовому відношенню декскетопрофену трометамолу до гідрохлориду трамадолу, яке складає 2,59:1-1:7,7.
5. Фармацевтична композиція за п. 4, яка містить суміш двох активних інгредієнтів у масовому відношенні декскетопрофену до трамадолу, як 1:1-1:6, еквівалентному масовому відношенню декскетопрофену трометамолу до гідрохлориду трамадолу, як 1,3:1-1:4,63.
6. Фармацевтична композиція за пп. 1-3, яка містить два активних інгредієнти, декскетопрофен та трамадол або їх солі, у наступних кількостях для кожної пероральної дози:
- 8-50 мг декскетопрофену, еквівалентному 11,8-73,8 мг декскетопрофену трометамолу;
- 17,6-105,4 мг трамадолу, еквівалентному 20-120 мг гідрохлориду трамадолу.
7. Фармацевтична композиція за п. 6, що містить два активних інгредієнти, декскетопрофен та трамадол або їх солі, у наступних кількостях для кожної пероральної дози:
- 10-30 мг декскетопрофену, еквівалентному 14,8-44,29 мг декскетопрофену трометамолу;
- 26,3-87,8 мг трамадолу, еквівалентному 30-100 мг гідрохлориду трамадолу.
8. Фармацевтична композиція за пп. 1-7, яка містить два активних інгредієнти, декскетопрофен та трамадол або їх солі, у наступних кількостях для кожної пероральної дози:
- 12,5 мг або 25 мг декскетопрофену, еквівалентному 18,45 мг або 36,95 мг декскетопрофену трометамолу;
- 32,9 мг або 65,9 мг трамадолу, еквівалентному 37,5 мг або 75 мг гідрохлориду трамадолу.
9. Фармацевтична композиція за пп. 1-8, в якій мікрокристалічна целюлоза має масову концентрацію 45-75 % від загальної кількості.
10. Фармацевтична композиція за пп. 1-9, в якій зв'язувальний агент вибрано з групи, що складається з кукурудзяного крохмалю, попередньо желатинізованого кукурудзяного крохмалю та гіпромелози або їх сумішей, у кількостях 5-20 %, переважно 7-12 % від загальної маси композиції.
11. Фармацевтична композиція за пп. 3-10, в якій розпушувач вибрано з кроскармелози натрію та натрію крохмальгліколяту або їх сумішей, у кількостях 4-14 % від загальної маси композиції.
12. Фармацевтична композиція за пп. 1-11, де розчинення двох активних інгредієнтів, декскетопрофену та трамадолу відбувається протягом проміжку часу, що не перевищує 15 хв., переважно 3-11 хв.
13. Фармацевтична композиція за пп. 1-12, де швидкість розчинення та профіль чистоти компонентів залишається незмінним протягом строку зберігання, що дорівнює 18 місяців при температурі (25±2)°С та (60±5)% відносної вологості у пакуванні типу "алюміній-алюміній" та ПВХ/ПВДХ.
14. Фармацевтична композиція за пп. 1-13 у вигляді таблетки для негайного вивільнення активних компонентів.
15. Фармацевтична композиція за п. 14, де таблетка має зовнішнє плівкове покриття на основі гіпромелози.
16. Фармацевтична композиція за п. 14, яка має зовнішнє плівкове покриття на основі полівінілового спирту.
17. Фармацевтична композиція за пп. 1-13, яка має форму капсули для негайного вивільнення обох активних компонентів.
18. Фармацевтична композиція за пп. 1-17 для втамування гострого болю, пов'язаного з наступними хворобливими станами: головний біль, зубний біль, запалення та мігрень.
19. Спосіб виробництва фармацевтичної композиції за пп. 1-18, який полягає у гранулюванні у киплячому шарі та сушінні у киплячому шарі суміші активних компонентів та наповнювачів.
Текст
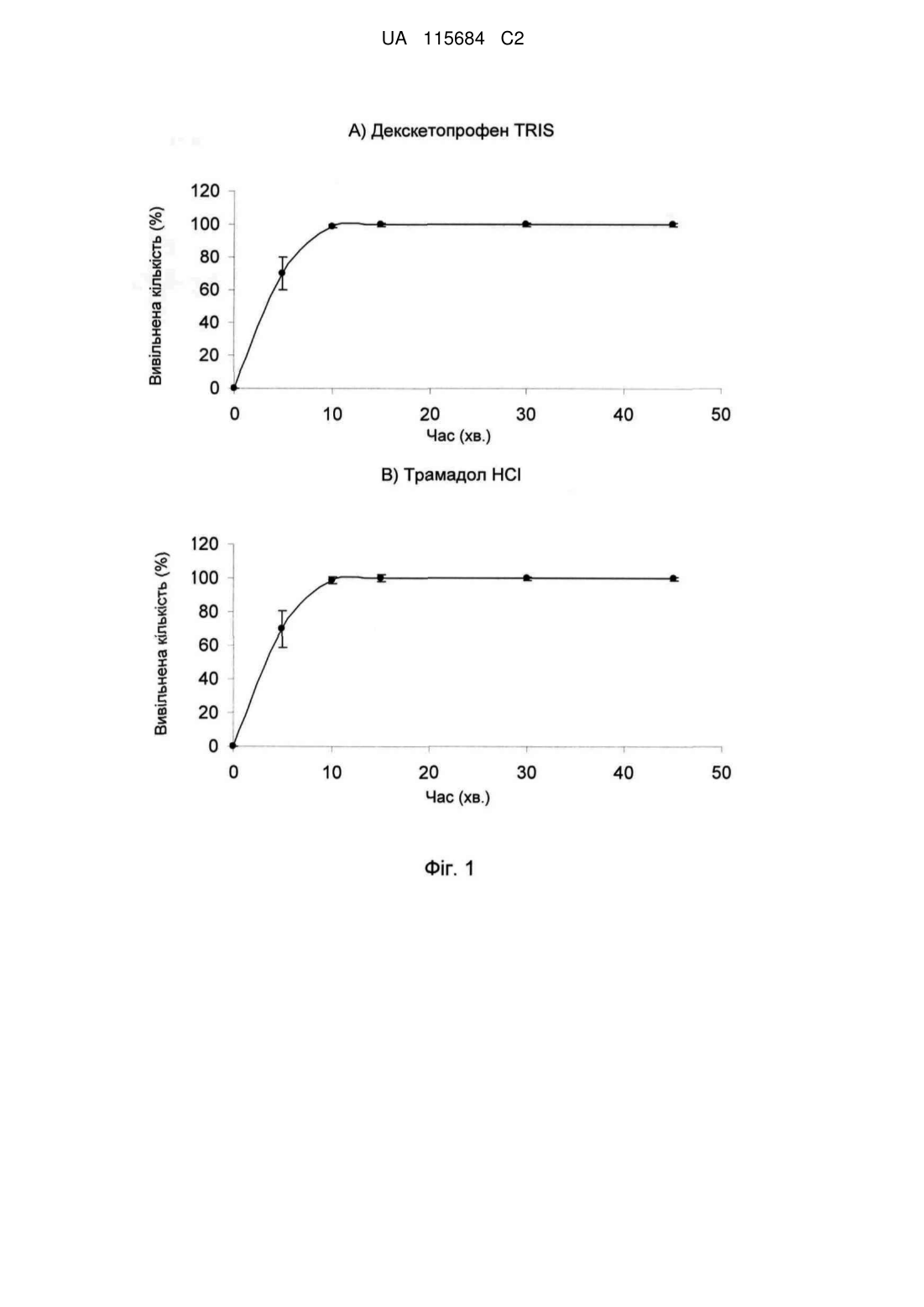
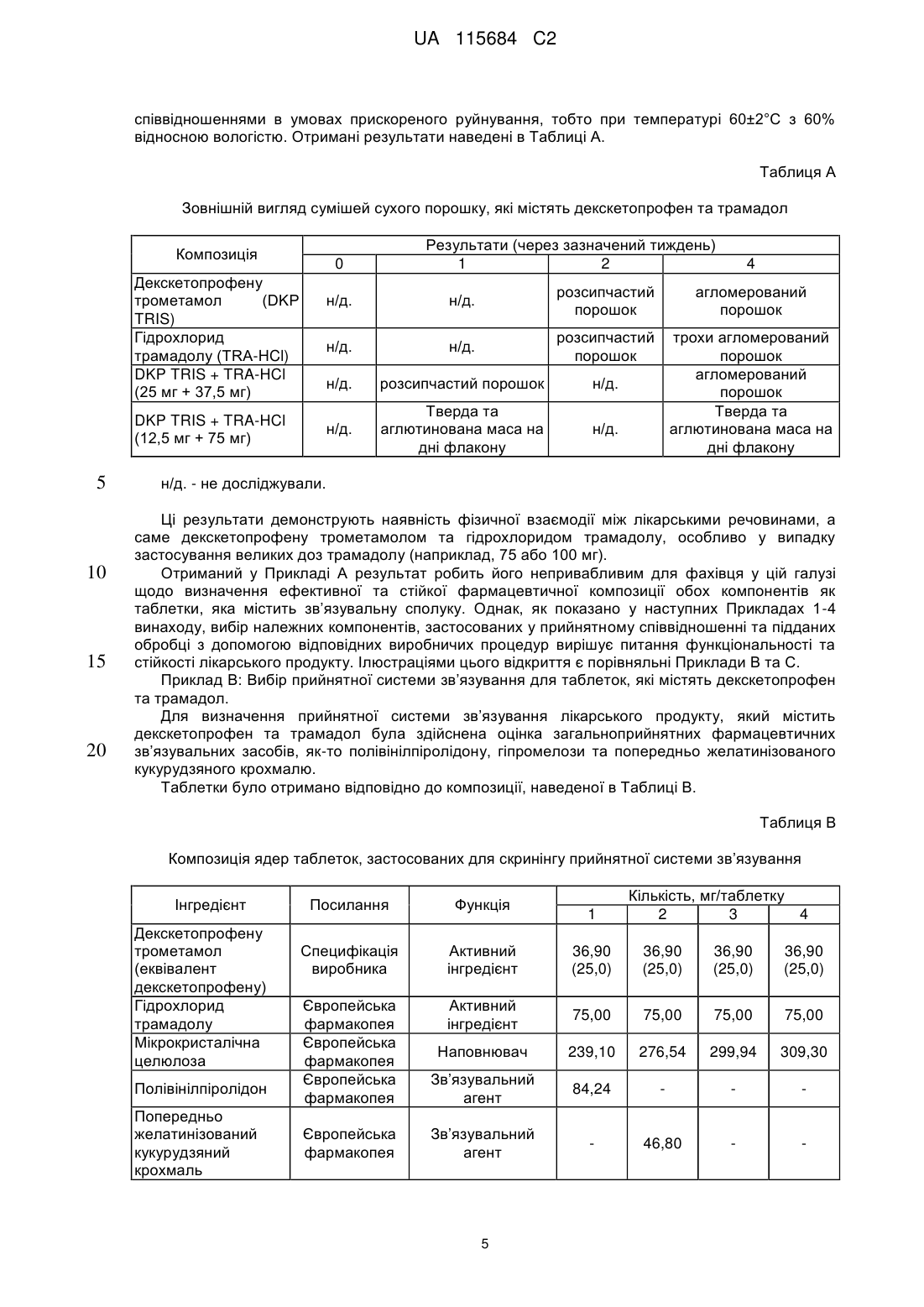
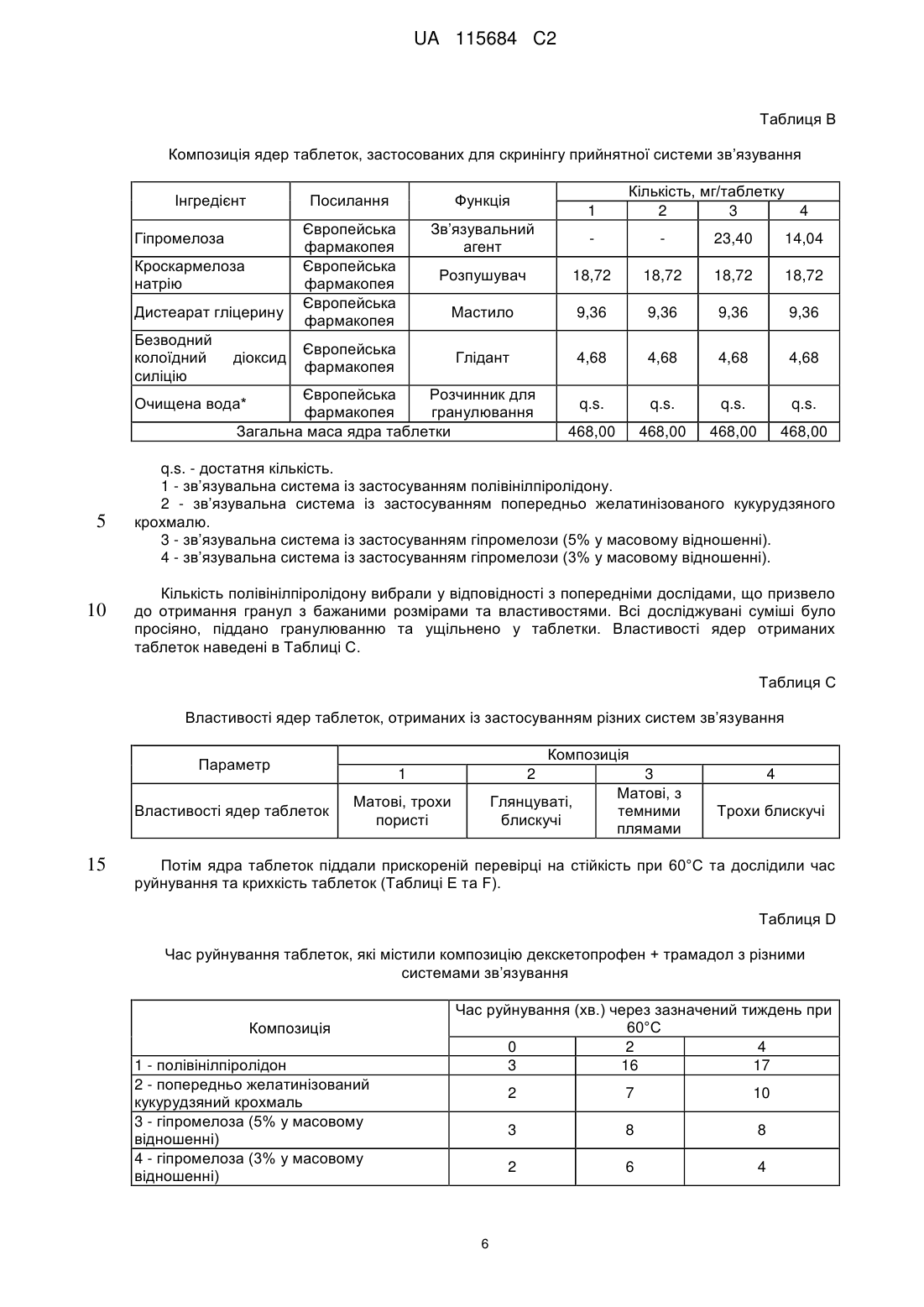
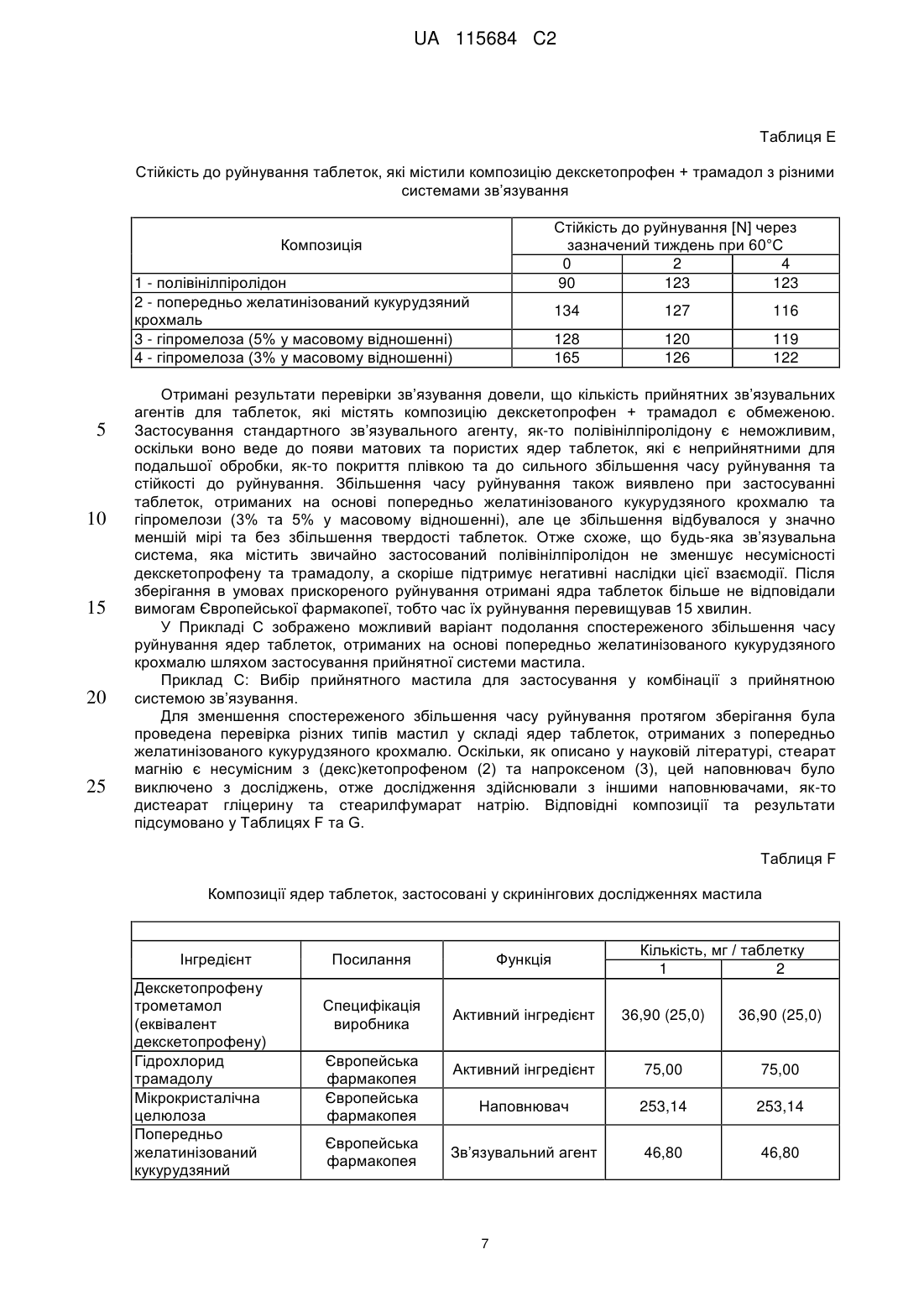
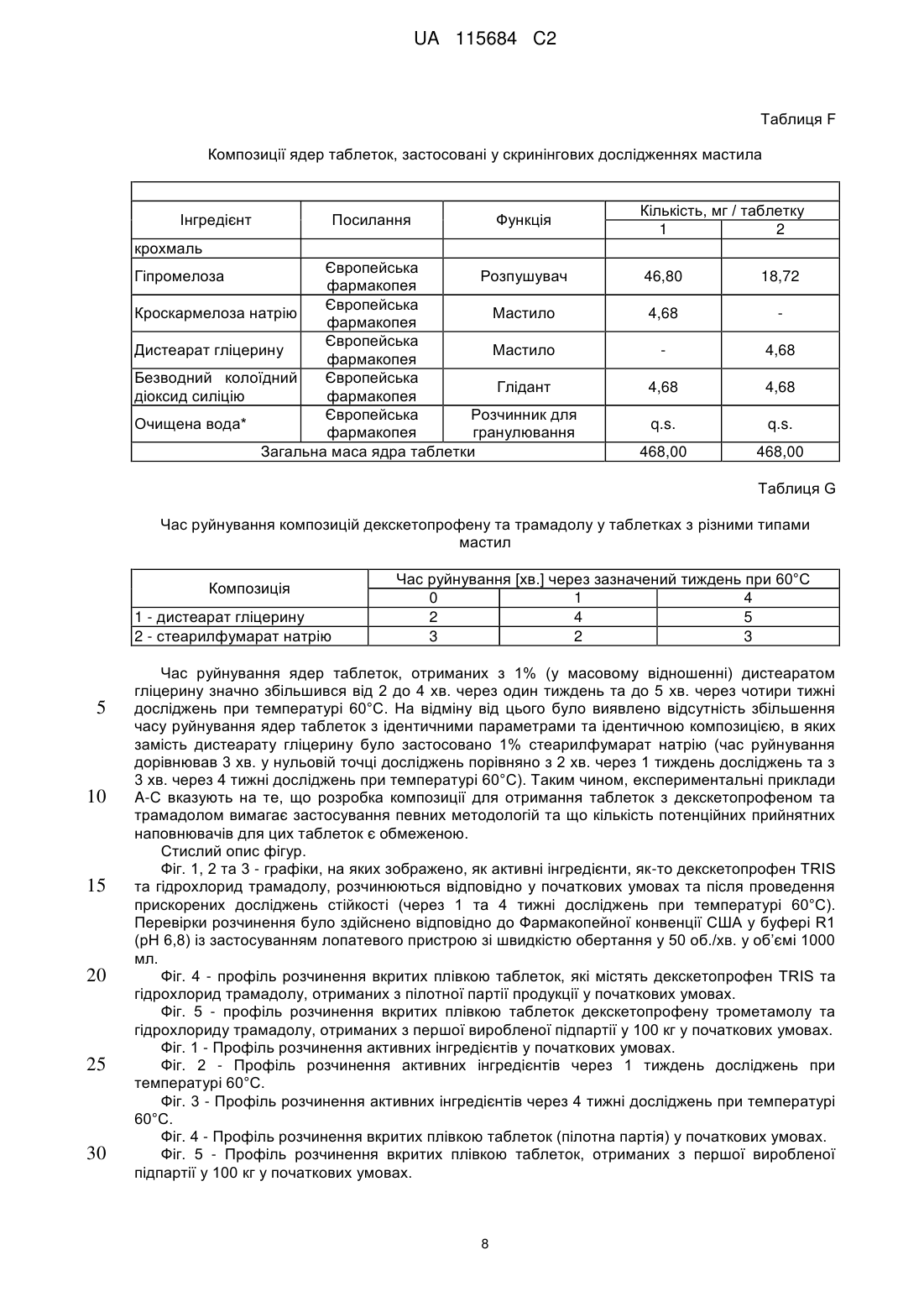
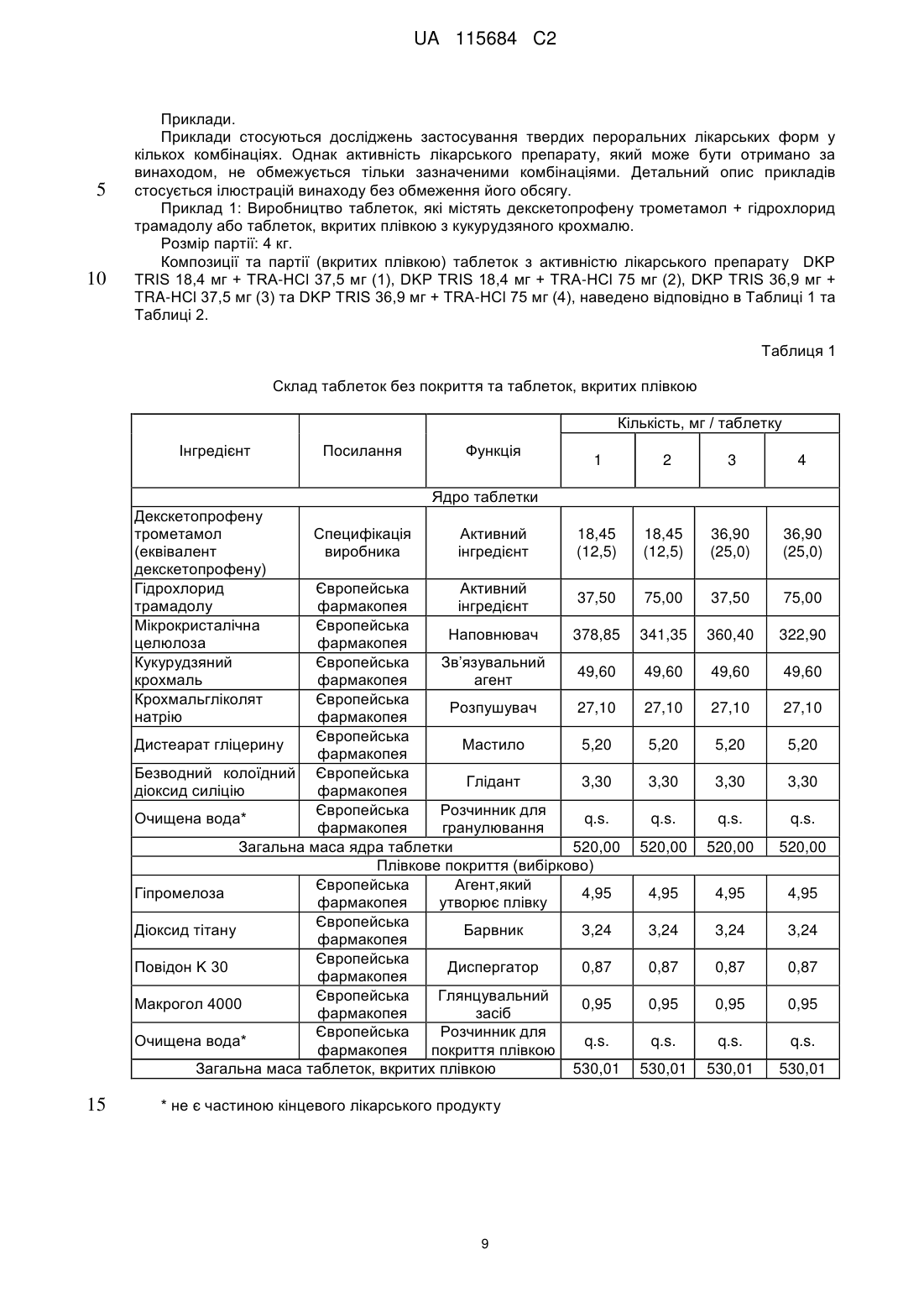
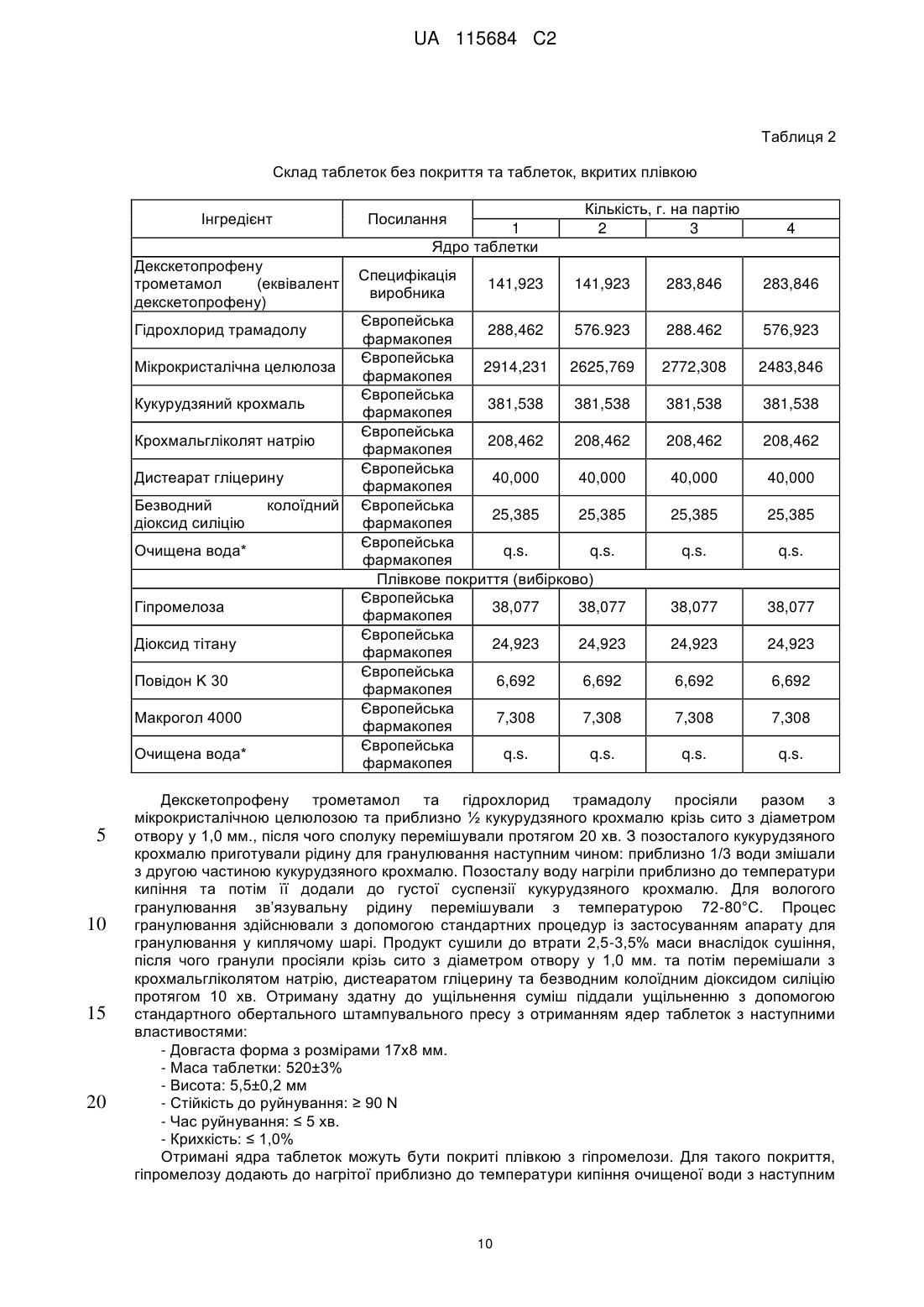
Реферат: Винахід стосується фармацевтичної композиції як твердої лікарської форми для перорального застосування, яка містить: і) комбінацію двох фармакологічно активних компонентів, солі декскетопрофену з органічною основою та солі трамадолу з органічною кислотою, в якій: - органічну основу вибрано з групи, яка складається з трометамолу, L-лізину, L-аргініну; - органічну кислоту вибрано з групи, яка складається з соляної, бромистоводневої кислоти; іі) мікрокристалічна целюлоза є наповнювачем; ііі) зв'язувальний агент вибрано з групи, яка складається з кукурудзяного крохмалю, попередньо желатинізованого кукурудзяного крохмалю та гіпромелози або їх сумішей; iv) фармацевтично прийнятний наповнювач, і в якій всі компоненти композиції знаходяться у фізичному контакті один з одним. UA 115684 C2 (12) UA 115684 C2 UA 115684 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується стійкого фармацевтичного препарату, який містить комбінацію двох активних фармацевтичних інгредієнтів декскетопрофену та трамадолу та знаходиться у вигляді твердої лікарської форми для перорального застосування з негайним вивільненням обох активних інгредієнтів. Декскетопрофен є S-(+) енантіомером добре відомого нестероїдного протизапального лікарського засобу (НПЗП) кетопрофену, який є оборотним інгібітором циклооксигенази (ЦОК) та має хімічну назву S-(+)-2-(3-бензоїл феніл)пропіонової кислоти. Рацемічний кетопрофен застосовують, як знеболювальний та протизапальний засіб та ці функції спричинені лише дією його S-(+) енантіомеру (декскетопрофен), а R-(-) енантіомер не сприяє цим активним властивостям. Препарат трометамінової солі декскетопрофену як вкритих плівкою 12,5 мг та 25 мг таблеток для перорального застосування з негайним вивільненням вмісту було зареєстровано у країнах ЄС та у кількох неєвропейських країнах у якості лікарського засобу для симптоматичного вгамування гострого болю легкої та помірної інтенсивності, як-то кістковом'язового болю, дисменореї та зубного болю. Трамадол є (1RS,2RS)-2-[(диметиламіно)метил]-1-(3-метоксифеніл)циклогекса-нолу, опіоїдним знеболювальним засобом центральної дії. Трамадол є у продажу з 1977 року ® (Tramal , Grünenthal). Для перорального застосування цей препарат можна придбати об'ємом 50-300 мг як капсули, таблетки та композиції з уповільненим вивільненням. Гідрохлорид трамадолу є активним інгредієнтом продуктів, які зареєстровано як лікарські засоби у багатьох ® ® ® ® країнах ЄС, як-то препарат Contramal (Італія), Adolonta (Іспанія), Tramal та Tramundin (Німеччина). Окрім цього, ця сполука також входить до складу наявних у продажу препаратів у ® комбінації з іншими активними інгредієнтами, як-то лікарський препарат Zaldiar , що містить 37,5 мг гідрохлориду трамадолу та 325 мг парацетамолу. Поєднання анальгетиків є предметом численних досліджень. Дослідження комбінації НПЗП з опіоїдом проводили із застосуванням комбінації ібупрофену з оксикодоном та ібупрофену з кодеїном. Комбінація 400 мг ібупрофену та 5 мг оксикодону є у продажу у Сполучених Штатах ® під назвою Combunox (Forest Pharmaceuticals, Inc.). Як повідомлено Raffa et. al. згідно з Патентом США 5 516 803, комбінація трамадолу та ібупрофену має синергетичну дію у лікуванні болю та кашлевих станів. Зазначені у формулі винаходу цього патенту відповідні масові відношення дорівнювали 1:1-1:200 з бажаними відношеннями приблизно 1:2-1:20. У публікації Tuncer et al. (Eur J Gynaecol Oncol. 2003;24(2):181-4.) було показано, що кетопрофен в клінічних умовах здається зменшує потребу у морфіні на 33-40% із застосуванням припустимого для кетопрофену центрального механізму знеболення при внутрішньовенному введенні. Відповідно до Siyam et al. in Anesthesiology 2003; 99: A996, спільне введення трамадолу та кетопрофену веде до появи значної антиноцицептивної синергічної дії та до скорочення побічних ефектів. Обґрунтування розвитку пероральних комбінацій з фіксованою кількістю декскетопрофену та трамадолу має наступні причини: 1. Декскетопрофен та трамадол мають різні механізми дії, та перший має антиноцицептивну активність, головним чином, на периферичному рівні, a другий є анальгетиком центральної дії. Отже, від застосування комбінації цих сполук слід очікувати появу адитивного або синергетичного знеболення, тим самим дозволяючи зменшити необхідні дози для окремих агентів та внаслідок цього зменшити ризик появи несприятливих подій. 2. Декскетопрофен та трамадол мають різні фармакокінетичні профілі, отже очікується, що їх комбінація буде відрізнятися швидким початком знеболювальної дії (що типово для декскетопрофену) та її довгою тривалістю (що характерно для трамадолу). Однак у науковій літературі існує багато прикладів наявності технічних бар'єрів у виробництві адекватних фармацевтичних препаратів, які разом містять кетопрофен та трамадол. Наприклад, звичайний фармацевтичний наповнювач моногідрату лактози, який застосовують в різних пероральних фармацевтичних композицій, наприклад таблеток та таблеток, вкритих плівкою, у таблетках, що містять декскетопрофен, призводить до значного знебарвлення, через що його застосування не бажане. Крім того, з наукової літератури відомо, що ін'єкція гідрохлориду трамадолу є несумісною з ацикловіром та кліндаміцином, однак є стійкою при змішуванні з 20% манітом або лактованим розчином Рінгера. Крім того, було досліджено випадіння осаду для розчину трамадолу для ін'єкцій або інфузії (50 мг/мл) у разі його змішування в тому ж шприці з розчинами, які містять НПЗП, як-то диклофенак натрію, індометацин та піроксикам. У EP546676 описано фармацевтичну композицію, яка містить трамадол та НПЗП на основі похідної пропіонової кислоти, яка може бути кетопрофеном, та бажана композиція складається з трамадолу з ібупрофеном. Композиції, які описано в прикладах,- це водні розчини, через що 1 UA 115684 C2 5 10 15 20 25 30 35 40 45 50 55 60 не було помічено певних проблем з твердими композиціями. У WO2007008752 описано фармацевтичні композиції, що містять два лікарські засоби, які можуть, серед іншого, бути трамадолом та НПЗП; ці композиції знаходяться у твердій формі, але для окремих вивільнень ці два лікарські засоби розташовано у різних шарах. У US6294195 описано пероральну знеболювальну лікарську форму уповільненого вивільнення для введення раз на день, що містить опіоїдний знеболювальний лікарський засіб та вибірково неопіоїдний лікарський засіб. Ці засоби також охоплюють трамадол та кетопрофен, але наведені приклади мають відношення тільки до морфіну. У WO2008/092219 описано тверді композиції з трамадолом та кетопрофеном. При перемішуванні твердого кетопрофену та трамадолу повідомлено про взаємодію між двома активними інгредієнтами, як було показано з допомогою диференціальної скануючої калориметрії (ДСК), що призвело до появи «густої та в'язкої маси, яку було важко розчинити та поява якої може призвести до змінення біодоступності лікарських засобів». Також у цій патентній заявці описані різні можливості для «доставляння трамадолу та кетопрофену у фармацевтичних формах та/або у вигляді продуктів з запобіганням виникнення будь-якого контакту між ними та/або з уникненням взаємодії між двома активними компонентами» з припущенням того, що виробництво із застосуванням стандартних способів та обладнання є технічно недоцільним та не призводить до отримання стійкої фармацевтичної форми. У цьому контексті слід зазначити, що призначена дія лікарського засобу, а саме вгамування помірного та тяжкого болю особливо вимагає негайного вивільнення активних інгредієнтів, якому може перешкоджати фізична взаємодія між кетопрофеном та трамадолом. Окрім цього, як описано у Botha et al. (1989) in Drug Development and Industrial Pharmacy 15 (3), 415-426, Botha et al. (1990) in Drug Development and Industrial Pharmacy 16 (4), 673-683, Tita et al (2011) in Journal of Pharmaceutical and Biomedical Analysis, 56, 221-227, отримання композицій з кетопрофеном та іншими НПЗП, як-то напроксеном є достатньо незвичайною справою. Було виявлено несумісність кетопрофену з загальноприйнятними фармацевтичними наповнювачами, як-то лактоза, фосфати кальцію, стеарат магнію або Precirol® ATO 5 (пальмітостеарат гліцеролу), що може призвести до збільшення часу розпаду, порушення швидкостей розчинення та до розкладання препарату під час його зберігання в умовах дослідження стійкості. Окрім цього, у AU703310B2 (EP7592963) під назвою «Лікарська форма трамадолу або його солі зі швидким вивільненням» описано отримання приготування таблеток без зв'язувальної речовини, які містить трамадол, оскільки розробка швидкорозкладаних та швидкорозчинних таблеток зі зв'язувальною речовиною та трамадолом вважається неможливою. Більш детальніше було висвітлено, що гідрохлорид трамадолу під час руйнування зачиняє капіляри у таблетці через високу розчинність цієї сполуки у воді, що призводить до швидкого утворення дуже концентрованого дифузійного граничного шару. Крім того, це руйнування не може бути прискорено шляхом збільшення вмісту руйнуючого агента. Небажані характеристики трамадолу з точки зору розробки лікарського продукту стають ще більш виразними при поєднанні його з декскетопрофеном. Фактично, через свою липку природу та тенденцію до агломерації останню сполуку слід піддати додатковій обробці з отриманням гранул, які містять зв'язувальну речовину, таким чином виключаючи отримання будь-яких таблеток, позбавлених такої речовини. Недоліки, пов'язані з цією технологією, які описані у WO2008/092219 долаються заявленим винаходом, яким передбачено відповідну методологію, призначену для отримання фармацевтично прийнятних твердих пероральних композицій декскетопрофену та трамадолу, в яких обидві сполуки знаходяться у вигляді солей внаслідок застосування стандартних способів та обладнання без необхідності застосування спеціалізованих процедур. З технологічної точки зору були визначені основні принципи виробництва цих композицій, позбавлених складної методології, яка потребує відокремлення обох активних інгредієнтів та ці принципи полягають у наступному: - Застосування обох активних компонентів як солей. - Застосування прийнятного матеріалу наповнювача. - Застосування прийнятної зв’язувальної системи для гранулювання з отриманням гранул прийнятного розміру та структури. - Застосування відповідної технології для виробництва, особливо у випадку процедур гранулювання, тобто застосування гранулювання у киплячому шарі, що веде до м'якого та легкого руйнування / розчинення гранулярної структури, яка є особливо прийнятною для твердої лікарської форми негайного вивільнення. З метою уникнення потенційної фізичної несумісності декскетопрофену та трамадолу та 2 UA 115684 C2 5 10 15 20 25 30 35 40 45 50 55 60 утворення твердої та липкої маси, зазначеної у WO2008/092219, необхідно дотримуватися встановлених принципів, описаних вище, втілення яких зображено у наведених нижче прикладах. Поєднання визначених параметрів веде до отримання стійкої та технологічно здійсненної фармацевтичної лікарської форми, прийнятної для вгамування гострого болю помірної та сильної інтенсивності, що виникає з різних причин та пов’язаною з різними хворобами, як-то післяопераційний, головний, зубний біль, біль у спині та у суглобах, запалення та мігрень. Відповідно до WO2008/092219, технологічна композиція декскетопрофену та трамадолу повинна вимагати застосування спеціалізованих, складних способів, як-то багатошарове таблетування, окреме гранулювання обох активних інгредієнтів та/або пакування в окремі блистерні пресовані вироби для забезпечення відокремленого зберігання обох активних інгредієнтів. Однак у заявленому винаході було несподівано виявлено, що виробництво фармацевтично стійкої композиції цих двох активних інгредієнтів, прийнятних для вгамування помірного та тяжкого болю є можливим без застосування нестандартних способів та технологій. Заявленим винаходом передбачено технологічно стійку композицію, яка містить активні компоненти декскетопрофен та трамадол разом з наповнювачами з фармацевтично прийнятною якістю, зокрема з наповнювачами та зв’язувальними сполуками, якщо наповнювачем є мікрокристалічна целюлоза та зв’язувальна сполука бажаним чином є вибраною з групи, що складається з кукурудзяного крохмалю, попередньо желатинізованого кукурудзяного крохмалю, гіпромелози або їх суміші. Для цілей винаходу гіпромелоза є гідроксипропілметилцелюлозою або ГПМЦ. У бажаному втіленні декскетопрофен застосовують як сіль трометаміну (трометамолу) та трамадол, як гідрохлоридна сіль. Крім того, отримання фармацевтичних лікарських форм здійснюють із застосуванням стандартних фармакологічних процесів, як-то перемішування, просіювання, гранулювання, таблетування та покриття плівкою разом із застосуванням стандартного технологічного обладнання та устаткування. Таким чином, обидва активні інгредієнти не відокремлюють з допомогою спеціалізованого або унікального виробництва та/або процедур пакування, як-то багатошарового таблетування, таблетування двох різних гранул/кристалів з плівковим покриттям або пакування у блістери з відокремленим пресуванням. Відповідно за винаходом, декскетопрофен знаходиться у вигляді солі з органічними або неорганічними основами та трамадол знаходиться у вигляді солі з органічними або неорганічними кислотами. Ці органічні або неорганічні основи вибрано з групи, що складається з трометамолу, триметиламіну, диметиламіну, етиламіну, тріетиламіну, діетиламіну, L-лізину, L-аргініну, діетаноламіну, гідроксиду натрію, гідроксиду кальцію, та переважним чином це є трометамол. Для цілей винаходу трометамол є 2-аміно-2-гідроксиметил-1,3-пропандіолом, також відомим, як трометиламін або TRIS. Органічні або неорганічні кислоти вибрано з групи, що складається з соляної, бромистоводневої, фосфорної, сірчаної, метансульфонової, бензолсульфонової, толуолсульфонової, оцтової, пропіонової, яблучної, малеїнової, янтарної, лимонної, L-винної, молочної, малонової, аспарагінової та глутамінової кислоти, але переважним чином це є соляна кислота. Комбінацію за винаходом призначено для вгамування гострого та післяопераційного болю помірної та сильної інтенсивності, що виникає з різних причин, та пов’язаного з різними хворобами, як-то головний, зубний біль, біль у спині та у суглобах, запалення та мігрень. Фіксовану комбінацію обох сполук призначено для отримання оптимізованого керування болем з меншою кількістю побічних дій, ніж побічні дії, які спостерігали для кожної з цих обох сполук окремо. Згідно з винаходом фармацевтичні форми є твердими пероральними лікарськими формами, переважно як вкритих плівкою таблеток з негайним вивільненням. Відповідно до винаходу фармацевтичні композиції містять суміш двох активних інгредієнтів для дозипероральної дози у наступних кількостях: Кількість декскетопрофену (мол. маса 254,28) дорівнює 8-50 мг, переважно 10-30 мг та найбільш переважно 12,5-25 мг (еквівалентна кількість трометамолу декскетопрофену (мол. маса 375,42) дорівнює 11,8-73,8 мг, переважно 14,8-44,3 мг та найбільш переважно 18,4-36,9 мг). Кількість трамадолу (мол. маса 263,28) дорівнює 17,6-105,4 мг, переважно 26,3-87,8 мг та найбільш переважно 32,9-65,9 мг [еквівалентна кількість гідрохлориду трамадолу (мол. маса 299,84) дорівнює 20-120 мг, переважно 30-100 мг, 37,5 мг та найбільш переважно 75 мг]. 3 UA 115684 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ці фармацевтичні композиції містять суміш двох активних інгредієнтів для пероральної дози у масовому відношенні декскетопрофен/трамадол, яке дорівнює 2:1-1:10, переважно 1:1-1:6 (еквівалентно масовому відношенню трометамолу декскетопрофену/гідрохлориду трамадолу, яке дорівнює 2,59:1-1:7,7, переважно 1,3:1-1:4,63). Окрім активних інгредієнтів, ці фармацевтичні композиції можуть містити одну або декілька фармацевтично прийнятних домішок, вибраних з фармацевтичних наповнювачів, зв’язувальних агентів, розпушувачів, мастил та глідантів. Наповнювач складається з мікрокристалічної целюлози та вміст його у кожній дозі повинен складати 45-75% (у масовому відношенні) від загальної кількості. Зв’язувальні агенти вибрано з групи, яка складається з кукурудзяного крохмалю, попередньо желатинізованого кукурудзяного крохмалю, гіпромелози або їх сумішей у кількостях, які складають 5% - 20%, переважно 7% - 12% від загальної ваги композиції. Розпушувач вибрано з кроскармелози натрію та крохмальгліколяту натрію або їх сумішей у кількостях, які складають 4% - 14% від загальної ваги композиції. Мастило вибрано з групи, яка складається з дистеарату гліцерину, стеарилфумарату натрію або їх сумішей та бажаним мастилом є стеарилфумарат натрію. Бажаним глідантом є безводний колоїдний діоксид силіцію. Відповідно до заявленого винаходу, всі компоненти композицій ретельно змішують. Під терміном «ретельно змішують» мається на увазі змішування компонентів та, зокрема, двох активних компонентів, спрямоване на те, щоб ніколи не виключався фізичний контакт між компонентами композиції та, зокрема, між двома її активними компонентами. Одиниця дозування препарату для перорального застосування може бути вибірково покритою фармацевтичними домішками, вибраними з фармацевтичних плівкоутворюючих агентів, пігментів, дисперсантів та глянцювальних агентів. Переважним чином дози є покритими гіпромелозою або зовнішнім плівковим покриттям на основі полі(вінілового) спирту. Не всі стандартні фармацевтичні наповнювачі можуть бути застосовані разом з декскетопрофеном та трамадолом. Застосування моногідрату лактози, який є стандартним фармацевтичним наповнювачем та який звичайно застосовують в якості наповнювача у ® комбінації з мікрокристалічною целюлозою (наприклад, MicroceLac ) з декскетопрофеном є неможливим. Отримані таблетки мають жовто-помаранчеві плями, що свідчить про хімічну несумісність та про значно збільшений час руйнування після прискорених досліджень стійкості. Також виключається застосування такого загальноприйнятного зв’язувального агента, як полівінілпіролідон (ПВД), оскільки воно веде до отримання матових пористих ядер таблеток, які є неприйнятними для подальшої обробки, як-то покриття їх оболонкою та до сильного збільшення часу руйнування та стійкості до руйнування. Несподівано у всіх досліджуваних умовах стійкими виявилися ті фармацевтичні композиції, які містили i) сіль декскетопрофену, переважно трометамол, ii) сіль трамадолу, переважно гідрохлорид трамадолу, iii) мікрокристалічну целюлозу в якості наповнювача з великим відсотком від загальної кількості у масовому відношенні iv) зв’язувальний агент v) один або декілька фармацевтично прийнятних наповнювачів; та в яких всі ці складові були ретельно перемішані. Ці фармацевтичні композиції можуть бути отримані з допомогою стандартних фармацевтичних процесів, в яких обидва інгредієнти не відокремлюють шляхом спеціалізованого або унікального виробничого процесу та/або процедур пакування та можна налагодити їх виробництво з допомогою гранулювання у киплячому шарі або сушіння таблеток або капсул у киплячому шарі для забезпечення негайного вивільнення обох активних компонентів. Композиції за винаходом характеризуються розчиненням двох активних інгредієнтів, декскетопрофену та трамадолу протягом часу, який не перевищує 15 хвилин та точніше складає 3-11 хвилин. Ці композиції характеризуються швидкістю розчинення та профілем чистоти компонентів, які залишаються незмінними впродовж 18-місячного зберігання при температурі (25±2)°C з відносною вологістю у 60±5% у блістерах типу «алюміній-алюміній» та «ПВХ/ПВДХ-алюміній». Експериментальний розділ. Декскетопрофен характеризується виразною фізико-хімічною несумісністю до трамадолу, та ця взаємодія пояснена нижче (Приклад A). Приклад A: Перевірка сумісності декскетопрофену трометамолу та гідрохлориду трамадолу як сумішей сухого порошку. Декскетопрофену трометамол та гідрохлорид трамадолу перемішували разом з різними 4 UA 115684 C2 співвідношеннями в умовах прискореного руйнування, тобто при температурі 60±2°C з 60% відносною вологістю. Отримані результати наведені в Таблиці A. Таблиця А Зовнішній вигляд сумішей сухого порошку, які містять декскетопрофен та трамадол Композиція Декскетопрофену трометамол (DKP TRIS) Гідрохлорид трамадолу (TRA-HCl) DKP TRIS + TRA-HCl (25 мг + 37,5 мг) 10 15 20 4 н/д. н/д. розсипчастий порошок агломерований порошок н/д. н/д. розсипчастий порошок н/д. розсипчастий порошок н/д. н/д. DKP TRIS + TRA-HCl (12,5 мг + 75 мг) 5 Результати (через зазначений тиждень) 1 2 0 Тверда та аглютинована маса на дні флакону н/д. трохи агломерований порошок агломерований порошок Тверда та аглютинована маса на дні флакону н/д. - не досліджували. Ці результати демонструють наявність фізичної взаємодії між лікарськими речовинами, а саме декскетопрофену трометамолом та гідрохлоридом трамадолу, особливо у випадку застосування великих доз трамадолу (наприклад, 75 або 100 мг). Отриманий у Прикладі А результат робить його непривабливим для фахівця у цій галузі щодо визначення ефективної та стійкої фармацевтичної композиції обох компонентів як таблетки, яка містить зв’язувальну сполуку. Однак, як показано у наступних Прикладах 1-4 винаходу, вибір належних компонентів, застосованих у прийнятному співвідношенні та підданих обробці з допомогою відповідних виробничих процедур вирішує питання функціональності та стійкості лікарського продукту. Ілюстраціями цього відкриття є порівняльні Приклади B та C. Приклад B: Вибір прийнятної системи зв’язування для таблеток, які містять декскетопрофен та трамадол. Для визначення прийнятної системи зв’язування лікарського продукту, який містить декскетопрофен та трамадол була здійснена оцінка загальноприйнятних фармацевтичних зв’язувальних засобів, як-то полівінілпіролідону, гіпромелози та попередньо желатинізованого кукурудзяного крохмалю. Таблетки було отримано відповідно до композиції, наведеної в Таблиці B. Таблиця В Композиція ядер таблеток, застосованих для скринінгу прийнятної системи зв’язування Інгредієнт Декскетопрофену трометамол (еквівалент декскетопрофену) Гідрохлорид трамадолу Мікрокристалічна целюлоза Полівінілпіролідон Попередньо желатинізований кукурудзяний крохмаль Кількість, мг/таблетку 2 3 4 Посилання Функція Специфікація виробника Активний інгредієнт 36,90 (25,0) 36,90 (25,0) 36,90 (25,0) 36,90 (25,0) Європейська фармакопея Європейська фармакопея Європейська фармакопея Активний інгредієнт 75,00 75,00 75,00 75,00 Наповнювач 239,10 276,54 299,94 309,30 Зв’язувальний агент 84,24 Європейська фармакопея Зв’язувальний агент 46,80 5 1 UA 115684 C2 Таблиця В Композиція ядер таблеток, застосованих для скринінгу прийнятної системи зв’язування Інгредієнт Гіпромелоза Кроскармелоза натрію Дистеарат гліцерину Безводний колоїдний силіцію діоксид Функція Європейська фармакопея Європейська фармакопея Європейська фармакопея Зв’язувальний агент 23,40 14,04 Розпушувач 18,72 18,72 18,72 18,72 Мастило 9,36 9,36 9,36 9,36 Глідант 4,68 4,68 4,68 4,68 q.s. q.s. q.s. q.s. 468,00 468,00 468,00 468,00 Європейська фармакопея 1 Європейська Розчинник для фармакопея гранулювання Загальна маса ядра таблетки Очищена вода* 5 10 Кількість, мг/таблетку 2 3 4 Посилання q.s. - достатня кількість. 1 - зв’язувальна система із застосуванням полівінілпіролідону. 2 - зв’язувальна система із застосуванням попередньо желатинізованого кукурудзяного крохмалю. 3 - зв’язувальна система із застосуванням гіпромелози (5% у масовому відношенні). 4 - зв’язувальна система із застосуванням гіпромелози (3% у масовому відношенні). Кількість полівінілпіролідону вибрали у відповідності з попередніми дослідами, що призвело до отримання гранул з бажаними розмірами та властивостями. Всі досліджувані суміші було просіяно, піддано гранулюванню та ущільнено у таблетки. Властивості ядер отриманих таблеток наведені в Таблиці C. Таблиця С Властивості ядер таблеток, отриманих із застосуванням різних систем зв’язування Композиція Параметр Властивості ядер таблеток 15 1 2 Матові, трохи пористі Глянцуваті, блискучі 3 Матові, з темними плямами 4 Трохи блискучі Потім ядра таблеток піддали прискореній перевірці на стійкість при 60°C та дослідили час руйнування та крихкість таблеток (Таблиці E та F). Таблиця D Час руйнування таблеток, які містили композицію декскетопрофен + трамадол з різними системами зв’язування Композиція 1 - полівінілпіролідон 2 - попередньо желатинізований кукурудзяний крохмаль 3 - гіпромелоза (5% у масовому відношенні) 4 - гіпромелоза (3% у масовому відношенні) Час руйнування (хв.) через зазначений тиждень при 60°C 0 2 4 3 16 17 2 10 3 8 8 2 6 7 6 4 UA 115684 C2 Таблиця Е Стійкість до руйнування таблеток, які містили композицію декскетопрофен + трамадол з різними системами зв’язування Стійкість до руйнування [N] через зазначений тиждень при 60°C 0 2 4 90 123 123 Композиція 1 - полівінілпіролідон 2 - попередньо желатинізований кукурудзяний крохмаль 3 - гіпромелоза (5% у масовому відношенні) 4 - гіпромелоза (3% у масовому відношенні) 5 10 15 20 25 134 127 116 128 165 120 126 119 122 Отримані результати перевірки зв’язування довели, що кількість прийнятних зв’язувальних агентів для таблеток, які містять композицію декскетопрофен + трамадол є обмеженою. Застосування стандартного зв’язувального агенту, як-то полівінілпіролідону є неможливим, оскільки воно веде до появи матових та пористих ядер таблеток, які є неприйнятними для подальшої обробки, як-то покриття плівкою та до сильного збільшення часу руйнування та стійкості до руйнування. Збільшення часу руйнування також виявлено при застосуванні таблеток, отриманих на основі попередньо желатинізованого кукурудзяного крохмалю та гіпромелози (3% та 5% у масовому відношенні), але це збільшення відбувалося у значно меншій мірі та без збільшення твердості таблеток. Отже схоже, що будь-яка зв’язувальна система, яка містить звичайно застосований полівінілпіролідон не зменшує несумісності декскетопрофену та трамадолу, а скоріше підтримує негативні наслідки цієї взаємодії. Після зберігання в умовах прискореного руйнування отримані ядра таблеток більше не відповідали вимогам Європейської фармакопеї, тобто час їх руйнування перевищував 15 хвилин. У Прикладі C зображено можливий варіант подолання спостереженого збільшення часу руйнування ядер таблеток, отриманих на основі попередньо желатинізованого кукурудзяного крохмалю шляхом застосування прийнятної системи мастила. Приклад C: Вибір прийнятного мастила для застосування у комбінації з прийнятною системою зв’язування. Для зменшення спостереженого збільшення часу руйнування протягом зберігання була проведена перевірка різних типів мастил у складі ядер таблеток, отриманих з попередньо желатинізованого кукурудзяного крохмалю. Оскільки, як описано у науковій літературі, стеарат магнію є несумісним з (декс)кетопрофеном (2) та напроксеном (3), цей наповнювач було виключено з досліджень, отже дослідження здійснювали з іншими наповнювачами, як-то дистеарат гліцерину та стеарилфумарат натрію. Відповідні композиції та результати підсумовано у Таблицях F та G. Таблиця F Композиції ядер таблеток, застосовані у скринінгових дослідженнях мастила Інгредієнт Декскетопрофену трометамол (еквівалент декскетопрофену) Гідрохлорид трамадолу Мікрокристалічна целюлоза Попередньо желатинізований кукурудзяний Кількість, мг / таблетку 1 2 Посилання Функція Специфікація виробника Активний інгредієнт 36,90 (25,0) 36,90 (25,0) Активний інгредієнт 75,00 75,00 Наповнювач 253,14 253,14 Зв’язувальний агент 46,80 46,80 Європейська фармакопея Європейська фармакопея Європейська фармакопея 7UA 115684 C2 Таблиця F Композиції ядер таблеток, застосовані у скринінгових дослідженнях мастила Інгредієнт Посилання Функція Кількість, мг / таблетку 1 2 крохмаль Європейська Розпушувач фармакопея Європейська Кроскармелоза натрію Мастило фармакопея Європейська Дистеарат гліцерину Мастило фармакопея Безводний колоїдний Європейська Глідант діоксид силіцію фармакопея Європейська Розчинник для Очищена вода* фармакопея гранулювання Загальна маса ядра таблетки Гіпромелоза 46,80 18,72 4,68 4,68 4,68 4,68 q.s. q.s. 468,00 468,00 Таблиця G Час руйнування композицій декскетопрофену та трамадолу у таблетках з різними типами мастил Композиція 1 - дистеарат гліцерину 2 - стеарилфумарат натрію 5 10 15 20 25 30 Час руйнування [хв.] через зазначений тиждень при 60°C 0 1 4 2 4 5 3 2 3 Час руйнування ядер таблеток, отриманих з 1% (у масовому відношенні) дистеаратом гліцерину значно збільшився від 2 до 4 хв. через один тиждень та до 5 хв. через чотири тижні досліджень при температурі 60°C. На відміну від цього було виявлено відсутність збільшення часу руйнування ядер таблеток з ідентичними параметрами та ідентичною композицією, в яких замість дистеарату гліцерину було застосовано 1% стеарилфумарат натрію (час руйнування дорівнював 3 хв. у нульовій точці досліджень порівняно з 2 хв. через 1 тиждень досліджень та з 3 хв. через 4 тижні досліджень при температурі 60°C). Таким чином, експериментальні приклади A-C вказують на те, що розробка композиції для отримання таблеток з декскетопрофеном та трамадолом вимагає застосування певних методологій та що кількість потенційних прийнятних наповнювачів для цих таблеток є обмеженою. Стислий опис фігур. Фіг. 1, 2 та 3 - графіки, на яких зображено, як активні інгредієнти, як-то декскетопрофен TRIS та гідрохлорид трамадолу, розчинюються відповідно у початкових умовах та після проведення прискорених досліджень стійкості (через 1 та 4 тижні досліджень при температурі 60°C). Перевірки розчинення було здійснено відповідно до Фармакопейної конвенції США у буфері R1 (pH 6,8) із застосуванням лопатевого пристрою зі швидкістю обертання у 50 об./хв. у об’ємі 1000 мл. Фіг. 4 - профіль розчинення вкритих плівкою таблеток, які містять декскетопрофен TRIS та гідрохлорид трамадолу, отриманих з пілотної партії продукції у початкових умовах. Фіг. 5 - профіль розчинення вкритих плівкою таблеток декскетопрофену трометамолу та гідрохлориду трамадолу, отриманих з першої виробленої підпартії у 100 кг у початкових умовах. Фіг. 1 - Профіль розчинення активних інгредієнтів у початкових умовах. Фіг. 2 - Профіль розчинення активних інгредієнтів через 1 тиждень досліджень при температурі 60°C. Фіг. 3 - Профіль розчинення активних інгредієнтів через 4 тижні досліджень при температурі 60°C. Фіг. 4 - Профіль розчинення вкритих плівкою таблеток (пілотна партія) у початкових умовах. Фіг. 5 - Профіль розчинення вкритих плівкою таблеток, отриманих з першої виробленої підпартії у 100 кг у початкових умовах. 8 UA 115684 C2 5 10 Приклади. Приклади стосуються досліджень застосування твердих пероральних лікарських форм у кількох комбінаціях. Однак активність лікарського препарату, який може бути отримано за винаходом, не обмежується тільки зазначеними комбінаціями. Детальний опис прикладів стосується ілюстрацій винаходу без обмеження його обсягу. Приклад 1: Виробництво таблеток, які містять декскетопрофену трометамол + гідрохлорид трамадолу або таблеток, вкритих плівкою з кукурудзяного крохмалю. Розмір партії: 4 кг. Композиції та партії (вкритих плівкою) таблеток з активністю лікарського препарату DKP TRIS 18,4 мг + TRA-HCl 37,5 мг (1), DKP TRIS 18,4 мг + TRA-HCl 75 мг (2), DKP TRIS 36,9 мг + TRA-HCl 37,5 мг (3) та DKP TRIS 36,9 мг + TRA-HCl 75 мг (4), наведено відповідно в Таблиці 1 та Таблиці 2. Таблиця 1 Склад таблеток без покриття та таблеток, вкритих плівкою Кількість, мг / таблетку Інгредієнт Посилання Функція 1 2 3 4 18,45 (12,5) 18,45 (12,5) 36,90 (25,0) 36,90 (25,0) 75,00 37,50 75,00 341,35 360,40 322,90 49,60 49,60 49,60 27,10 27,10 27,10 5,20 5,20 5,20 3,30 3,30 3,30 q.s. q.s. q.s. 520,00 520,00 520,00 4,95 4,95 4,95 3,24 3,24 3,24 0,87 0,87 0,87 0,95 0,95 0,95 q.s. q.s. q.s. 530,01 530,01 530,01 Ядро таблетки Декскетопрофену трометамол (еквівалент декскетопрофену) Гідрохлорид трамадолу Мікрокристалічна целюлоза Кукурудзяний крохмаль Крохмальгліколят натрію Специфікація виробника Активний інгредієнт Європейська Активний 37,50 фармакопея інгредієнт Європейська Наповнювач 378,85 фармакопея Європейська Зв’язувальний 49,60 фармакопея агент Європейська Розпушувач 27,10 фармакопея Європейська Дистеарат гліцерину Мастило 5,20 фармакопея Безводний колоїдний Європейська Глідант 3,30 діоксид силіцію фармакопея Європейська Розчинник для Очищена вода* q.s. фармакопея гранулювання Загальна маса ядра таблетки 520,00 Плівкове покриття (вибірково) Європейська Агент,який Гіпромелоза 4,95 фармакопея утворює плівку Європейська Діоксид тітану Барвник 3,24 фармакопея Європейська Повідон K 30 Диспергатор 0,87 фармакопея Європейська Глянцувальний Макрогол 4000 0,95 фармакопея засіб Європейська Розчинник для Очищена вода* q.s. фармакопея покриття плівкою Загальна маса таблеток, вкритих плівкою 530,01 15 * не є частиною кінцевого лікарського продукту 9 UA 115684 C2 Таблиця 2 Склад таблеток без покриття та таблеток, вкритих плівкою Інгредієнт Посилання Декскетопрофену трометамол (еквівалент декскетопрофену) Специфікація виробника Гідрохлорид трамадолу Мікрокристалічна целюлоза Кукурудзяний крохмаль Крохмальгліколят натрію Дистеарат гліцерину Безводний діоксид силіцію Очищена вода* Гіпромелоза Діоксид тітану Повідон K 30 Макрогол 4000 Очищена вода* 5 10 15 20 колоїдний 1 Ядро таблетки 141,923 Кількість, г. на партію 2 3 141,923 Європейська 288,462 576.923 фармакопея Європейська 2914,231 2625,769 фармакопея Європейська 381,538 381,538 фармакопея Європейська 208,462 208,462 фармакопея Європейська 40,000 40,000 фармакопея Європейська 25,385 25,385 фармакопея Європейська q.s. q.s. фармакопея Плівкове покриття (вибірково) Європейська 38,077 38,077 фармакопея Європейська 24,923 24,923 фармакопея Європейська 6,692 6,692 фармакопея Європейська 7,308 7,308 фармакопея Європейська q.s. q.s. фармакопея 4 283,846 283,846 288.462 576,923 2772,308 2483,846 381,538 381,538 208,462 208,462 40,000 40,000 25,385 25,385 q.s. q.s. 38,077 38,077 24,923 24,923 6,692 6,692 7,308 7,308 q.s. q.s. Декскетопрофену трометамол та гідрохлорид трамадолу просіяли разом з мікрокристалічною целюлозою та приблизно ½ кукурудзяного крохмалю крізь сито з діаметром отвору у 1,0 мм., після чого сполуку перемішували протягом 20 хв. З позосталого кукурудзяного крохмалю приготували рідину для гранулювання наступним чином: приблизно 1/3 води змішали з другою частиною кукурудзяного крохмалю. Позосталу воду нагріли приблизно до температури кипіння та потім її додали до густої суспензії кукурудзяного крохмалю. Для вологого гранулювання зв’язувальну рідину перемішували з температурою 72-80°C. Процес гранулювання здійснювали з допомогою стандартних процедур із застосуванням апарату для гранулювання у киплячому шарі. Продукт сушили до втрати 2,5-3,5% маси внаслідок сушіння, після чого гранули просіяли крізь сито з діаметром отвору у 1,0 мм. та потім перемішали з крохмальгліколятом натрію, дистеаратом гліцерину та безводним колоїдним діоксидом силіцію протягом 10 хв. Отриману здатну до ущільнення суміш піддали ущільненню з допомогою стандартного обертального штампувального пресу з отриманням ядер таблеток з наступними властивостями: - Довгаста форма з розмірами 17x8 мм. - Маса таблетки: 520±3% - Висота: 5,5±0,2 мм - Стійкість до руйнування: ≥ 90 N - Час руйнування: ≤ 5 хв. - Крихкість: ≤ 1,0% Отримані ядра таблеток можуть бути покриті плівкою з гіпромелози. Для такого покриття, гіпромелозу додають до нагрітої приблизно до температури кипіння очищеної води з наступним 10 UA 115684 C2 5 10 15 додаванням повідону K 30, макроголю 4000 та перемішуванням отриманої суміші до отримання прозорого розчину. Безпосередньо перед покриттям до розчину додають діоксид титану та диспергують його з допомогою мішалки з високою частотою перемішування. Покриття плівкою здійснюють у стандартному дражувальному котлі з отриманням покритою плівкою таблеток з наступними властивостями: - Маса таблетки: 530±5% - Висота: 5,6±0,3 мм - Стійкість до руйнування: ≥ 90 N - Час руйнування: ≤ 7,5 хв. Отримані зразки партій з різними співвідношеннями декскетопрофену / трамадолу було досліджено в умовах, рекомендованих ICH (Міжнародною конференцією з узгодження технічних вимог щодо реєстрації лікарських препаратів для медичного застосування) впродовж 18 місяців при температурі (25±2)°C та (60±5)% відносної вологості . Результати цих досліджень наведено в Таблицях 3-6. Отримані результати свідчать про відмінну хімічну та фізичну стійкість отриманих партій (по відношенню до руйнування, розчинення та інших параметрів таблеток). Таблиця 3 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 18,4 мг + TRA-HCl 37,5 мг при температурі (25±2)°C та (60±5)% відносної вологості у блістерах типу «алюміній-алюміній» Досліджувані параметри Загальні та особливі характеристики лікарської форми Розчинення (через 30 хв.). - Декскетопрофен TRIS [%] - Гідрохлорид трамадолу [%] Час руйнування [хв.] Аналіз Декскетопрофен TRIS [%] Гідрохлорид трамадолу [%] Додатковий параметр Стійкість до руйнування - Середнє значення Специфікація терміну придатностіРезультати (через зазначений місяць) 0 3 6 9 12 18 (Q=75) 101 98 99 100 101 101 (Q=75) 102 102 101 102 102 102 Не перевищує 15 3 4 5 4 3 4 90,0 -105,0 99,4 102,1 100,2 100,7 100,4 102,2 90,0 -105,0 99,7 101,8 102,9 102,0 101,6 105,0 t: ≥ 90 N 203 252 198 189 189 199 Таблиця 4 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 18,4 мг + TRA-HCl 75 мг при температурі (25±2)°C та (60±5)% відносної вологості у блістерах типу «алюміній-алюміній» Досліджувані параметри Загальні та особливі характеристики лікарської форми Розчинення (через 30 хв.). - Декскетопрофен TRIS [%] - Гідрохлорид трамадолу [%] Специфікація терміну придатності Результати (через зазначений місяць) 0 3 6 9 12 18 (Q=75) 102 100 101 101 98 102 (Q=75) 103 100 102 100 100 102 11 UA 115684 C2 Таблиця 4 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 18,4 мг + TRA-HCl 75 мг при температурі (25±2)°C та (60±5)% відносної вологості у блістерах типу «алюміній-алюміній» Досліджувані параметри Час руйнування [хв.] Аналіз Декскетопрофен TRIS [%] Гідрохлорид трамадолу [%] Додатковий параметр Стійкість до руйнування - Середнє значення Специфікація терміну придатності Не перевищує 15 Результати (через зазначений місяць) 0 3 6 9 12 18 6 7 9 9 11 8 90,0-105,0 99,1 101,7 101,3 103,3 100,9 101,6 90,0-105,0 99,2 101,8 101,3 103,1 101,1 101,2 t: ≥ 90 N 200 224 189 194 183 192 Таблиця 5 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 36,9 мг + TRA-HCl 37,5 мг при температурі (25±2)°C та (60±5)% відносної вологості у блістерах типу «алюміній-алюміній» Досліджувані параметри Загальні та особливі характеристики лікарської форми Розчинення (через 30 хв.). - Декскетопрофен TRIS [%] - Гідрохлорид трамадолу [%] Час руйнування [хв.] Аналіз Декскетопрофен TRIS [%] Гідрохлорид трамадолу [%] Додатковий параметр Стійкість до руйнування - Середнє значення Специфікація терміну придатності Результати (через зазначений місяць) 0 3 6 9 12 18 (Q=75) 102 101 102 100 101 102 (Q=75) 101 100 100 100 100 101 Не перевищує 15 3 5 6 3 1 3 98,2 102,3 101,6 102,2 101,1 102,4 96,8 100,5 101,4 100,8 98,7 101,4 207 257 190 205 203 204 90,0-105,0 90,0-105,0 t: ≥ 90 N Таблиця 6 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 36,9 мг + TRA-HCl 75 мг при температурі (25±2)°C та (60±5)% відносної вологості у блістерах типу «алюміній-алюміній» Досліджувані параметри Загальні та особливі характеристики лікарської форми Розчинення (через 30 хв.). - Декскетопрофен TRIS [%] Специфікація терміну придатності (Q=75) Результати (через зазначений місяць) 0 3 6 9 12 18 104 12 103 103 н/д. 101 99 UA 115684 C2 Таблиця 6 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 36,9 мг + TRA-HCl 75 мг при температурі (25±2)°C та (60±5)% відносної вологості у блістерах типу «алюміній-алюміній» Досліджувані параметри - Гідрохлорид трамадолу [%] Час руйнування [хв.] Аналіз Декскетопрофен TRIS [%] Гідрохлорид трамадолу [%] Додатковий параметр Стійкість до руйнування - Середнє значення Специфікація терміну придатності (Q=75) Результати (через зазначений місяць) 0 3 6 9 12 18 (1) 104 3 t: ≥ 90 N н/д. 8 103 7 99 8 103,1 103,0 103,2 104,9 104,1 102,4 103,1 103,4 102,7 102,6 152 90,0-105,0 102 9 100,6 90,0-105,0 101 8 100,5 Не перевищує 15 184 170 167 174 183 н/д.- досліджень не проводили. 5 Приклад 2. Виробництво таблеток декскетопрофену трометамолу + гідрохлориду трамадолу, вкритих плівкою з попередньо желатинізованого кукурудзяного крохмалю. Загальна маса партії - 550 г. Склад таблеток, вкритих плівкою: Активні речовини Декскетопрофену трометамол Гідрохлорид трамадолу Інші інгредієнти Ядро таблетки: Мікрокристалічна целюлоза Попередньо желатинізований кукурудзяний крохмаль Кроскармелоза натрію Стеарилфумарат натрію Безводний колоїдний діоксид силіцію Очищена вода* Плівкове покриття: Покриття на основі полівінілового спирту Очищена вода* 10 15 20 25 Кількість на одиничну одиницю дози (мг) 36,90 75,00 Кількість на партію (г) 57,99 117,86 179,70 282,39 29,20 45,89 21,90 3,65 3,65 q.s. 34,41 5,74 5,74 q.s. 7,30 q.s. 11,47 q.s. * не є частиною кінцевого продукту. Декскетопрофену трометамол та гідрохлорид трамадолу просіяли разом з мікрокристалічною целюлозою та 1/2 кроскармелозою натрію крізь сито з діаметром отвору 1,0 мм. Отриману сполуку перенесли до пристрою для гранулювання у киплячому шарі. Для отримання зв’язувальної рідини попередньо желатинізований кукурудзяний крохмаль додали до очищеної води та перемішували приблизно 60 хв. з метою отримання гомогенної зв’язувальної густої суспензії. Гранулювання здійснювали із застосуванням стандартних процедур у пристрої для гранулювання у киплячому шарі. Продукт сушили до втрати 2,5-3,5% маси внаслідок сушіння, після чого гранули просіяли крізь сито з діаметром отвору у 1,0 мм. та потім перемішали з кроскармелозою натрію та безводним колоїдним діоксидом силіцію протягом 10 хв. Отриману здатну до ущільнення суміш піддали ущільненню з допомогою стандартного обертального штампувального пресу з отриманням ядер таблеток з наступними властивостями: - Довгаста форма з розмірами 16x7 мм - Маса таблетки: 350 мг ± 5% - Висота: 4,5±0,2 мм 13 UA 115684 C2 5 10 15 20 25 30 35 - Стійкість до руйнування: ≥ 90 N - Час руйнування: ≤ 4 хв. - Крихкість: ≤ 1,0% Отримані ядра таблеток потім покрили з допомогою системи покриття водною плівкою на основі характерного полівінілового спиртового компонента, отриманого згідно з інструкціями виробника. Покриття плівкою здійснювали у стандартному дражувальному котлі з отриманням покритою плівкою таблеток з наступними властивостями: - Маса таблетки: 357 мг ± 5% - Висота: 4,6±0,2 мм - Стійкість до руйнування: ≥ 90 N - Час руйнування: ≤ 6 хв. Профілі розчинення таблеток, вкритих плівкою із застосуванням буферу R1 (Європейська Фармакопея, pH 6,8) об’ємом 1000 мл у лопатевому апараті зі швидкістю перемішування 50 об/хв наведені у Фіг. 1-3. У Фіг. 1 наведені початкові значення профілів розчинення обох активних інгредієнтів та у Фіг. 2 та 3 відображені профілі розчинення, отримані після проведення, відповідно, 1- та 4-тижневої перевірки стійкості у прискорених умовах руйнування при температурі 60°C у сушильній шафі. Жодної значної різниці між цими профілями розчинення визначено не було, отже фізико-хімічну взаємодію обох сполук можна виключити. Приклад 3: Виробництво таблеток декскетопрофену + трамадолу, вкритих плівкою із застосуванням попередньо желатинізованого кукурудзяного крохмалю в якості зв’язувального агента та кроскармелози натрію в якості розпушувача у пілотній дослідній партії (12,7 кг). Обсяг композиції, ідентичної наведеної у Прикладі 2 збільшили до 12,7 кг (пілотна дослідна партія). Характеристики ядер таблеток наведені нижче: - Довгаста форма з розмірами 14x6 мм - Маса таблетки: 350 мг ± 5% - Висота: 5,1±0,5 мм - Стійкість до руйнування: 130±15 N - Час руйнування: ≤ 6 хв. - Крихкість: ≤ 0,5% Властивості таблеток, вкритих плівкою були наступними: - Маса таблетки: 357 мг ± 5% - Висота: 5,2±0,5 мм - Стійкість до руйнування: ≥ 90 N - Час руйнування: ≤ 15 хв. Профіль розчинення та стійкість таблеток, вкритих плівкою було перевірено у прискорених умовах руйнування при 40°C / 75% відносної вологості. Результати наведені у Фіг. 4 та Таблиці 7. Таблиця 7 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 36,9 мг +75 мг TRA-HCl при температурі (25±2)°C та (60±5)% відносної вологості у блістерах типу «алюміній-алюміній» Досліджувані параметри Загальні та особливі характеристики лікарської форми Розчинення (через 30 хв.). - Декскетопрофен TRIS [%] - Гідрохлорид трамадолу [%] Час руйнування [хв.] Аналіз Декскетопрофен TRIS [%] Гідрохлорид трамадолу [%] Додатковий параметр (7) Стійкість до руйнування [N] 40 Специфікація терміну Результати (через зазначений місяць) придатності 0 3 6 (1) (Q=75) (1) (Q=75) не перевищує 15 98 99 6 101 102 7 98 99 6 90,0-105,0 90,0-105,0 101,3 102,7 99,6 101,4 99,2 100,8 t: ≥ 90 191 228 233 Приклад 4: Виробництво великої партії (223 кг) таблеток декскетопрофену + трамадолу, вкритих плівкою із застосуванням попередньо желатинізованого кукурудзяного крохмалю в якості зв’язувального агента та кроскармелози натрію в якості розпушувача. 14 UA 115684 C2 Композицію за Прикладами 2 та 3 було незначно змінено, та її обсяг було збільшено до розмірів великої партії у 223 кг. Гранулювання здійснювали у двох підпартіях. Композиція таблеток, вкритих плівкою: Активні речовини Декскетопрофену трометамол Гідрохлорид трамадолу Інші інгредієнти Ядро таблетки: Мікрокристалічна целюлоза Попередньо желатинізований кукурудзяний крохмаль Кроскармелоза натрію (внутрішня фаза) Кроскармелоза натрію (зовнішня фаза) Стеарилфумарат натрію Безводний колоїдний діоксид силіцію Очищена вода* Плівкове покриття: Покриття на основі полівінілового спирту Очищена вода* 5 10 15 20 25 30 36,90 75,00 Кількість на підпартію для гранулювання [кг] 11,121 22,603 179,70 54,157 108,314 29,20 8,800 17,600 11,02 3,321 6,642 22,04 13,292 1,83 4,442 7,37 1,103 q.s. 7,30 4,400 q.s. q.s. Кількість на одноразову дозу [мг] Кількість на партію [кг] 22,241 45,206 Для отримання першої підпартії у 100 кг, декскетопрофену трометадол, гідрохлорид трамадолу, мікрокристалічну целюлозу та кроскармелозу натрію для внутрішньої фази перемішали та просіяли разом крізь сито з діаметром отвору у 1,0 мм. Отриману сполуку перенесли до пристрою для гранулювання у киплячому шарі. Для отримання зв’язувальної рідини попередньо желатинізований кукурудзяний крохмаль додали до очищеної води та перемішували приблизно 60 хв. з метою отримання гомогенної зв’язувальної густої суспензії. Гранулювання здійснювали із застосуванням стандартних процедур у пристрої для гранулювання у киплячому шарі. Продукт сушили до втрати 2,5-3,5% маси внаслідок сушіння, після чого гранули просіяли крізь сито з діаметром отвору у 1,0 мм. та потім перемішали з кроскармелозою натрію та безводним колоїдним діоксидом силіцію протягом 10 хв. Другу підпартію отримали з допомогою подібних процедур та потім додали до першої підпартії, після чого до суміші обох підпартій додали попередньо просіяний стеарилфумарат натрію. Отриману здатну до ущільнення суміш піддали ущільненню з допомогою стандартного обертального штампувального пресу з отриманням ядер таблеток з наступними властивостями: - Довгаста форма з розмірами 14x6 мм - Маса таблетки: 363 мг ± 2% - Висота: 5,1±0,2 мм - Стійкість до руйнування: 115-150 N - Час руйнування: ≤ 5 хв. - Крихкість: ≤ 0,05 % Властивості вкритих плівкою таблеток були наступними: - Маса таблетки: 370 мг ± 5% - Висота: 5,2±0,2 мм - Стійкість до руйнування: > 90 N - Час руйнування: ≤ 6 хв. 15 UA 115684 C2 Таблиця 8 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 36,9 мг + TRA-HCl 75 мг при температурі (40±2)°C та (75±5)% відносної вологості у блістерах типу «алюміній-алюміній» Специфікація терміну придатності Досліджувані параметри Загальні та особливі характеристики лікарської форми Розчинення (через 30 хв.). - Декскетопрофен TRIS [%] - Гідрохлорид трамадолу [%] Час руйнування [хв.] Аналіз Декскетопрофен TRIS [%] Гідрохлорид трамадолу [%] Додатковий параметр (7) Стійкість до руйнування [N] Результати (через зазначений місяць) 0 3 6 (Q=75) (Q=75) не перевищує 15 100 100 8 98 98 8 98 100 9 90,0-105,0 90,0-105,0 98,7 100,5 99,5 100,1 98,8 100,0 t: ≥ 90 221 255 266 Таблиця 9 Дані досліджень стійкості таблеток, вкритих плівкою DKP TRIS 36,9 мг + TRA-HCl 75 мг при температурі (30±2)°C та (75±5)% відносної вологості у блістерах типу «алюміній-алюміній» Специфікація терміну придатності Досліджувані параметри Загальні та особливі характеристики лікарської форми Розчинення (через 30 хв.). - Декскетопрофен TRIS [%] - Гідрохлорид трамадолу [%] Час руйнування [хв.] Аналіз Декскетопрофен TRIS [%] Гідрохлорид трамадолу [%] Додатковий параметр (7) Стійкість до руйнування [N] 5 Результати (через зазначений місяць) 0 3 6 (Q=75) (Q=75) не перевищує 15 100 100 8 94 95 8 96 95 8 90,0-105,0 90,0-105,0 98,7 100,5 100,1 100,8 97,6 99,9 t: ≥ 90 221 232 245 Профіль розчинення отриманих вкритих плівкою таблеток наведено на Фіг. 5, та він є порівнянним до профілю розчинення таблеток зі зразка та пілотних партій. ФОРМУЛА ВИНАХОДУ 10 15 20 1. Фармацевтична композиція, як тверда лікарська форма для перорального застосування, яка містить: і) комбінацію двох активних фармацевтичних інгредієнтів, декскетопрофену, як сіль з органічними основами, та трамадолу, як сіль з неорганічними кислотами, в якій: - органічну основу вибрано з групи, що складається з трометамолу, L-лізину і L-аргініну; - неорганічну кислоту вибрано з групи, що складається з соляної і бромисто-водневої кислоти; іі) наповнювач, який є мікрокристалічною целюлозою; ііі) зв'язувальний агент, який вибрано з групи, що складається з кукурудзяного крохмалю, попередньо желатинізованого кукурудзяного крохмалю та гіпромелози або їх сумішей; iv) фармацевтично прийнятний наповнювач, і в якій всі компоненти композиції знаходяться у фізичному контакті один з одним. 2. Фармацевтична композиція за п. 1, в якій два активних інгредієнти утворюють гомогенну суміш, в якій ці активні інгредієнти є ретельно перемішаними. 16 UA 115684 C2 5 10 15 20 25 30 35 40 45 3. Фармацевтична композиція за п. 1, в якій фармацевтичний наповнювач вибрано з розпушувача, мастила та гліданта. 4. Фармацевтична композиція за пп. 1-3, яка містить суміш двох активних інгредієнтів у масовому відношенні декскетопрофену до трамадолу, яке складає 2:1-1:10, еквівалентному масовому відношенню декскетопрофену трометамолу до гідрохлориду трамадолу, яке складає 2,59:1-1:7,7. 5. Фармацевтична композиція за п. 4, яка містить суміш двох активних інгредієнтів у масовому відношенні декскетопрофену до трамадолу, як 1:1-1:6, еквівалентному масовому відношенню декскетопрофену трометамолу до гідрохлориду трамадолу, як 1,3:1-1:4,63. 6. Фармацевтична композиція за пп. 1-3, яка містить два активних інгредієнти, декскетопрофен та трамадол або їх солі, у наступних кількостях для кожної пероральної дози: - 8-50 мг декскетопрофену, еквівалентному 11,8-73,8 мг декскетопрофену трометамолу; - 17,6-105,4 мг трамадолу, еквівалентному 20-120 мг гідрохлориду трамадолу. 7. Фармацевтична композиція за п. 6, що містить два активних інгредієнти, декскетопрофен та трамадол або їх солі, у наступних кількостях для кожної пероральної дози: - 10-30 мг декскетопрофену, еквівалентному 14,8-44,29 мг декскетопрофену трометамолу; - 26,3-87,8 мг трамадолу, еквівалентному 30-100 мг гідрохлориду трамадолу. 8. Фармацевтична композиція за пп. 1-7, яка містить два активних інгредієнти, декскетопрофен та трамадол або їх солі, у наступних кількостях для кожної пероральної дози: - 12,5 мг або 25 мг декскетопрофену, еквівалентному 18,45 мг або 36,95 мг декскетопрофену трометамолу; - 32,9 мг або 65,9 мг трамадолу, еквівалентному 37,5 мг або 75 мг гідрохлориду трамадолу. 9. Фармацевтична композиція за пп. 1-8, в якій мікрокристалічна целюлоза має масову концентрацію 45-75 % від загальної кількості. 10. Фармацевтична композиція за пп. 1-9, в якій зв'язувальний агент вибрано з групи, що складається з кукурудзяного крохмалю, попередньо желатинізованого кукурудзяного крохмалю та гіпромелози або їх сумішей, у кількостях 5-20 %, переважно 7-12 % від загальної маси композиції. 11. Фармацевтична композиція за пп. 3-10, в якій розпушувач вибрано з кроскармелози натрію та натрію крохмальгліколяту або їх сумішей, у кількостях 4-14 % від загальної маси композиції. 12. Фармацевтична композиція за пп. 1-11, де розчинення двох активних інгредієнтів, декскетопрофену та трамадолу відбувається протягом проміжку часу, що не перевищує 15 хв., переважно 3-11 хв. 13. Фармацевтична композиція за пп. 1-12, де швидкість розчинення та профіль чистоти компонентів залишається незмінним протягом строку зберігання, що дорівнює 18 місяців при температурі (25±2) °С та (60±5) % відносної вологості у пакуванні типу "алюміній-алюміній" та ПВХ/ПВДХ. 14. Фармацевтична композиція за пп. 1-13 у вигляді таблетки для негайного вивільнення активних компонентів. 15. Фармацевтична композиція за п. 14, де таблетка має зовнішнє плівкове покриття на основі гіпромелози. 16. Фармацевтична композиція за п. 14, яка має зовнішнє плівкове покриття на основі полівінілового спирту. 17. Фармацевтична композиція за пп. 1-13, яка має форму капсули для негайного вивільнення обох активних компонентів. 18. Фармацевтична композиція за пп. 1-17 для втамування гострого болю, пов'язаного з наступними хворобливими станами: головний біль, зубний біль, запалення та мігрень. 19. Спосіб виробництва фармацевтичної композиції за пп. 1-18, який полягає у гранулюванні у киплячому шарі та сушінні у киплячому шарі суміші активних компонентів та наповнювачів. 17 UA 115684 C2 18 UA 115684 C2 19 UA 115684 C2 20 UA 115684 C2 21 UA 115684 C2 Комп’ютерна верстка А. Крулевський Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 22
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions containing dexketoprofen and tramadol
Автори англійськоюSchmitz, Reinhard, Kohl, Tobias
Автори російськоюШмиц Райнгард, Коль Тобиас
МПК / Мітки
МПК: A61K 31/135, A61K 9/20, A61K 31/192
Мітки: трамадол, перорального, фармацевтична, композиція, містить, застосування, декскетопрофен
Код посилання
<a href="https://ua.patents.su/24-115684-farmacevtichna-kompoziciya-dlya-peroralnogo-zastosuvannya-shho-mistit-deksketoprofen-ta-tramadol.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція для перорального застосування, що містить декскетопрофен та трамадол</a>
Попередній патент: Комбінована терапія для лікування госпітальної пневмонії
Наступний патент: Спосіб виготовлення моделі абсолютно чорного тіла
Випадковий патент: Спосіб виробництва затяжного печива