Фармацевтична композиція з покращеною біодоступністю
Номер патенту: 116004
Опубліковано: 25.01.2018
Автори: Метчетт Майкл Аллен, Ма Хуа, Сендху Харпреет К., Чжан Ю-Е, Ломуссіо Стів, Шах Навніт-Харговіндас
Формула / Реферат
1. Фізично стійка тверда дисперсія, яка включає 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфеніл)-3-(3-хлор-2-фторфеніл)-4-ціано-5-(2,2-диметилпропіл)-піролідин-2-карбоніл]-аміно}-3-метоксибензойну кислоту формули (А)
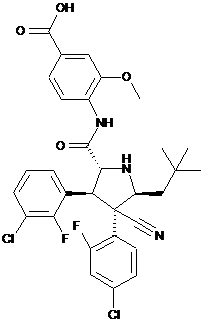 , (A)
, (A)
має розчинність у воді менше 1 мкг/мл і температуру плавлення більше 270 °С, разом із стабілізуючим полімером, яким є гіпромелози ацетату сукцинат (ГПМЦАС), EUDRAGITR L-100, Eudragit L100-55, коповідоном (PVP VA64).
2. Тверда дисперсія за будь-яким з п. 1, де відношення кількості за масою сполуки формули А в твердій дисперсії до кількості за масою стабілізуючого полімеру в ній становить між 5:95 і 70:30.
3. Тверда дисперсія за п. 1, де відношення кількості за масою сполуки А в твердій дисперсії до кількості за масою стабілізуючого полімеру в ній переважно складає від 30:70 до 50:50.
4. Тверда дисперсія за п. 1, де тверду дисперсію одержують розпилювальним сушінням розчину, що включає сполуку А і коповідон (PVP VA64).
5. Тверда дисперсія за п. 2, де тверду дисперсію одержують мікроосадженням розчину, що включає сполуку А і гіпромелози ацетату сукцинат (ГПМЦАС).
6. Твердий препарат одноразової дози, що включає тверду дисперсію за будь-яким з пп. 1-5 разом з широко використовуваними фармацевтичними інгредієнтами, вибраними з групи, яка складається з розпушувачів, розчинників, змащуючих речовин, ковзних речовин, разом з плівковою оболонкою.
7. Твердий препарат одноразової дози за п. 6, який включає приблизно 80 % твердої дисперсії за будь-яким з пп. 1-5 у вигляді аморфної твердої дисперсії разом з приблизно 7 % кроскармелози натрію, приблизно 6,8 % маніту, приблизно 4 % кросповідону, приблизно 1,5 % колоїдного діоксиду кремнію і приблизно 0,7 % стеарату магнію, який потім інкапсулюють або пресують і покривають оболонкою у вигляді таблетки.
8. Спосіб одержання твердої дисперсії за п. 1, що включає 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфеніл)-3-(3-хлор-2-фторфеніл)-4-ціано-5-(2,2-диметилпропіл)-піролідин-2-карбоніл]-аміно}-3-метоксибензойну кислоту формули (А)
 , (A)
, (A)
яка має розчинність у воді менше 1 мкг/мл, та стабілізуючий полімер, згідно з яким одержують розчин сполуки і полімеру в диметилацетаміді або будь-якому іншому відповідному розчиннику і спільно осаджують лікарський засіб з полімером, використовуючи антирозчинник.
9. Фармацевтичний препарат, який містить тверду дисперсію за будь-яким з пп. 1-5 разом з додатковими фармацевтично прийнятними допоміжними речовинами.
10. Тверда дисперсія за будь-яким з пп. 1-5 для застосування як лікарського засобу для лікування раку, зокрема гострого мієлобластного лейкозу (ГМЛ) або раку передміхурової залози.
Текст
УКРАЇНА (19) UA (11) 116004 (13) C2 (51) МПК (2017.01) A61K 31/40 (2006.01) A61K 9/16 (2006.01) A61P 35/00 A61K 47/32 (2006.01) A61K 9/10 (2006.01) A61K 9/14 (2006.01) A61K 47/36 (2006.01) A61K 47/38 (2006.01) МІНІСТЕРСТВО ЕКОНОМІЧНОГО РОЗВИТКУ І ТОРГІВЛІ УКРАЇНИ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (21) Номер заявки: a 2015 07997 (22) Дата подання заявки: 20.01.2014 (24) Дата, з якої є чинними 25.01.2018 права на винахід: (31) Номер попередньої 61/755,074 (32) Дата подання 22.01.2013 заявки відповідно до Паризької конвенції: попередньої заявки відповідно до Паризької конвенції: (33) Код держави-учасниці US Паризької конвенції, до якої подано попередню заявку: (41) Публікація відомостей 12.10.2015, Бюл.№ 19 про заявку: (46) Публікація відомостей 25.01.2018, Бюл.№ 2 про видачу патенту: (86) Номер та дата подання міжнародної заявки, поданої відповідно до Договору PCT PCT/EP2014/050974, 20.01.2014 (72) Винахідник(и): Ломуссіо Стів (US), Ма Хуа (US), Метчетт Майкл Аллен (US), Сендху Харпреет К. (US), Шах Навніт Харговіндас (US), Чжан Ю-Е (US) (73) Власник(и): Ф. ХОФФМАНН-ЛЯ РОШ АГ, Grenzacherstrasse 124, CH-4070 Basel, Switzerland (CH) (74) Представник: Новiкова Лiдiя Аркадiївна, реєстр. №36 (56) Перелік документів, взятих до уваги експертизою: CN102871950, A, 16.01.2013 WO2010114928, A2, 07.10.2010 WO9638131, A1, 05.12.1996 US2010152190, A1, 17.06.2010 European Medicines agency, "Zelboraf vermurafenib" (20111215), URL: European Medicines agency, "Zelboraf - vermurafenib" (20111215), URL: http://www.ema.europa.eu/docs/en_ GB/document_library/EPAR__Public_assessment_report/human/ 002409/WC500124400.pdf (20140408), XP055112775 [I] 1,3,13-15 * page 10, paragraph 2.2.2 1,3,13-15 * page 10, paragraph 2.2.2 (54) ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ З ПОКРАЩЕНОЮ БІОДОСТУПНІСТЮ (57) Реферат: Винахід стосується твердих дисперсій слаборозчинних у воді сполук, зокрема 4-{[(2R,3S,4R,5S)4-(4-хлор-2-фторфеніл)-3-(3-хлор-2-фторфеніл)-4-ціано-5-(2,2-диметилпропіл)-піролідин-2карбоніл]-аміно}-3-метоксибензойної кислоти, що утворюється сумісним осадженням з розчинником або сушінням розпиленням, що дає в результаті покращені біодоступність, безпеку і переносимість зазначених сполук. UA 116004 C2 (12) UA 116004 C2 UA 116004 C2 5 10 Область винаходу Даний винахід відноситься до твердо-аморфної дисперсії мікроосадженого нефасованого порошку (MBP від Micro-precipitated Bulk Powder) або висушеного розпиленням продукту, що включає сполуку 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фтор-феніл)-3-(3-хлор-2-фтор-феніл)-4-ціано-5(2,2-диметил-пропіл)-піролідин-2-карбоніл]-аміно}-3-метокси-бензойна кислота (сполука A), щоб покращити біодоступність, безпеку і переносимість сполуки. Рівень техніки винаходу Даний винахід відноситься до фармацевтичної композиції, яка включає стабілізовану твердо-аморфну дисперсію, що має високий вміст лікарського засобу, такий як 50%-70%, надзвичайно слаборозчинної сполуки (сполука A), яка дає значно покращене розчинення і біодоступність щодо кристалічної форми зазначеної сполуки. Сполука 4-{[(2R,3S,4R,5S)-4-(4хлор-2-фтор-феніл)-3-(3-хлор-2-фтор-феніл)-4-ціано-5-(2,2-диметил-пропіл)-піролідин-2карбоніл]-аміно}-3-метокси-бензойна кислота (сполука A), а також способи її одержання розкриті в патенті США № 8,354,444 і WO2011/098398. 15 (A) 20 25 30 35 4-{[(2R,3S,4R,5S)-4-(4-Хлор-2-фтор-феніл)-3-(3-хлор-2-фтор-феніл)-4-ціано-5-(2,2-диметилпропіл)-піролідин-2-карбоніл]-аміно}-3-метокси-бензойна кислота (C31H29Cl2F2N3O4) (сполука A) є сильним і селективним інгібітором взаємодії p53-MDM2, яка активує p53 шлях і викликає арешт клітинного циклу та/або апоптоз в цілому ряду видів пухлин, експресуючих p53 дикого типу in vitro та in vivo. Сполука A відноситься до нового класу інгібіторів MDM2, які мають високу протиракову терапевтичну активність, зокрема до лейкозу, такому як ГМЛ, і солідним пухлинам, таким як наприклад недрібноклітинний рак легені, рак молочної залози і колоректальний рак. Вищезгадані міжнародна заявка на патент і патент США описують сполуку A в кристалічній формі і в даний документ включені повністю шляхом посилання на них. Кристалічна форма сполуки має початкову температуру плавлення приблизно 277 ºC. Кристалічні форми мають досить низьку розчинність у воді (< 0,05 мкг/мл у воді) при фізіологічних значеннях pH (які знаходяться в діапазоні pH 1,5 - 8,0) і отже менш оптимальну біодоступність (висока нестабільність). Таким чином бажано одержати форму сполуки, яка має покращені розчинність / швидкість розчинення і біодоступність. Суть винаходу Згідно даному винаходу запропонована аморфна форма сполуки A, яка по суті не містить кристалічної сполуки. Сполука входить до складу комплексу сполуки / полімеру в кількості, рівній або такої, що перевищує 30% від маси комплексу. Інший аспект винаходу є фармацевтичною композицією, яка включає комплекси за винаходом, де сполука A знаходиться в терапевтично ефективній кількості. 1 UA 116004 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інший аспект винаходу полягає в тому, що комплекс аморфної лікарської речовини з полімером стабільний при високому вмісті лікарського засобу. Іншим аспектом винаходу є спосіб одержання комплексів за винаходом, які містять фармацевтично активні сполуки в стабілізованій аморфній формі. Ключовими ознаками винаходу є: a) Одержання стабілізованої твердо-аморфної дисперсії сполуки A. b) Вміст лікарської речовини 10 - 70% в кінцевому продукті. c) Не дивлячись на те, що аморфна тверда дисперсія стійка при високому вмісті лікарського засобу, такому як 70%, оптимальний вміст лікарської речовини для досягнення якнайкращої дії складає 10 - 50%. d) Застосування полімерів, таких як гіпромелози ацетату сукцинат, повідон і коповідон, на рівні від 30% до 99%. Короткий опис креслень Фігура 1 ілюструє спосіб мікроосадження. Фігура 2 ілюструє дію сполуки A на мавпах при різних технологіях виготовлення лікарського засобу: кристалічна (як є) суспензія, кристалічна мікронна суспензія, тверда дисперсія з Eudragit L100 і тверда дисперсія з ГПМЦАС. Фігура 3 ілюструє профіль залежно від часу концентрацій в плазмі сполуки A, що дозується у вигляді: P1 - суспензійної лікарської форми аморфної твердої дисперсії у вигляді MBP при 30% вмісті лікарського засобу з ГПМЦАС; P2 - суспензійної лікарської форми аморфної твердої дисперсії у вигляді MBP при 50% вмісті лікарського засобу з ГПМЦАС; P3 - суспензійної лікарської форми аморфної речовини, одержаної в ході ЕГР (екструзії гарячого розплаву) з PVP VA 64 при 30% вмісті лікарського засобу; P4 - кристалічній мікронній суспензії; P5 інкапсульованої лікарської форми, наповненої гранулами сполуки A у вигляді меглумінової солі. Фігура 4 ілюструє стабільність аморфної твердої дисперсії на діаграмі порошкової рентгенівської дифракції (XRPD від X-ray powder diffraction). Тверда дисперсія (50% вміст лікарського засобу з полімером ГПМЦАС) залишалася аморфною після а) 4 годинної і b) 8 годинної обробки при 70 ºC. Фігура 5 ілюструє стабільність аморфної твердої дисперсії на діаграмі порошкової рентгенівської дифракції (XRPD). MBP при 50% вмісті лікарського засобу з полімером ГПМЦАС у вигляді аморфної речовини: а) спочатку, b) 6-місяців при 40 ºC / 75% ВВ, з) 6-місяців при 25 ºC / 60% ВВ. Фігури 6a і b порівнюють стабільність MBP з фізичною сумішшю аморфного АФІ і полімеру при однаковому співвідношенні при використанні способу циклічного нагріву диференціальної скануючої калориметрії (ДСК). A) Фізична суміш показала плавлення. B) MBP показав перехід в склоподібний стан (Tg від glass transition, температура склування). Фігура 7 ілюструє взаємодію між лікарською речовиною і полімером в MBP при використанні спектроскопії FTIR (від Fourier Transform Infrared, інфрачервоної спектроскопії на основі перетворення Фурьє). а) фізична суміш b) MBP. Фігура 8a ілюструє діаграму XRPD таблетки, одержаної згідно прикладу 16 (тобто такої, що включає висушену розпиленням тверду дисперсію сполуки A (50% мас/мас) з коповідоном), в порівнянні з плацебо (таблетка без твердої дисперсії). Діаграма XRPD таблетки відповідає діаграмі плацебо, указуючи на те, що кристалічний АФІ (сполука A) не виявлений. Фігура 8b ілюструє стабільність таблетки згідно прикладу 16 протягом деякого часу при використанні порошкової рентгенівської дифракції. Порівняння початкового вимірювання таблетки (нижня крива) з кривими, одержаними через 3 місяці зберігання в подвійних блістерних упаковках (середня) і флаконах ПЕНТ (верхня) при 40 ºC і 75 відносній вологості (ВВ), указує на те, що кристалічна сполука A не може бути виявлена при зберіганні. Фігура 9 ілюструє розчинення in vitro двох препаратів покритих плівковою оболонкою таблеток сполуки A, що включають тверду дисперсію, одержану 1) мікроосадженням (МВР з 50% сполуки А і ГПМЦАС) і 2) сушкою розпиленням (50% сполуки А і PVP VA 64, приклад 16). Докладний опис винаходу Біодоступність терапевтично активної сполуки зазвичай визначають за (i) розчинністю / швидкістю розчинення сполуки, та (ii) коефіцієнтом розподілу / проникності сполуки через мембрану шлунково-кишкового тракту об'єкту. Основною причиною низької біодоступності терапевтично активної сполуки зазвичай є низька розчинність / швидкість розчинення зазначеної сполуки. Низька біодоступність також часто супроводжується високими змінними показниками рівнів крові пацієнта і непередбачуваними доза / терапевтичними ефектами внаслідок нерівномірної абсорбції лікарського засобу пацієнтом. Як використовується в даному документі, термін "слаборозчинний", коли відноситься до 2 UA 116004 C2 5 10 15 20 25 30 35 40 45 50 55 60 хімічної сполуки стосовно її розчинності у воді або маслі, може бути визначений як у Фармакопеї США і Національному формулярі (USP-NF від U.s. Pharmacopeia and National Formulary). Згідно цьому визначенню розчинність визначається в частинах розчинника, необхідних для розчинення однієї частини речовини, що розчиняється. Для сполуки, яка дуже мало розчинна в конкретному розчиннику, такому як вода, необхідно 30 - 100 частин розчинника, щоб розчинити одну частину сполуки. Для сполуки, яка мало розчинна, необхідно 100 - 1000 частин розчинника. Для сполуки, яки дуже мало розчинна, необхідно 1000 - 10,000 частин розчинника. Для сполуки, яка нерозчинна (така як сполука A), необхідно більше 10,000 частин розчинника, щоб розчинити одну частину речовини, що розчиняється. Недостатня розчинність таких лікарських засобів і неможливість одержати досить високі концентрації лікарських засобів в розчині з фармацевтично прийнятними носіями є серйозною проблемою при виготовленні цих лікарських засобів і таким чином обмежують терапевтичну корисність, яка може бути досягнута для таких сполук. Крім того, недостатня розчинність є проблемою при розробці сполук для всіляких мішеней, яким потрібні значно високі дози і необхідно встановити дуже широкий діапазон безпеки за терапевтично ефективною дозою. Таким чином, існувала значна потреба в способі збільшення розчинності цих лікарських засобів. Для покращення необхідних властивостей слаборозчинних лікарських засобів розроблена безліч методик, включаючи, але не обмежуючись цим, наступні: 1. Солеутворення: Це найбільш широко використовуваний підхід до збільшення розчинності слабокислих або слабоосновних НХС. (Wadke, D. A. et al, Pharmaceutical Dosage Forms: Tablets, Vol. 1, 1989, pp 1-73). На розчинність солі зазвичай впливає протиіон, і вибір протиіона визначається безліччю параметрів, таких як розчинність, гігроскопічність і стійкість фізичної форми. Не дивлячись на численні переваги, пов'язані з сольовими формами, розробка стабільної солі не завжди можлива. У багатьох випадках збільшену швидкість розчинення складно досягти внаслідок зворотного перетворення солей у відповідні ним форми кислоти або основи у фізіологічному середовищі. 2. Подрібнення: Внаслідок їх слабкої розчинності абсорбція / біодоступність деяких сполук обмежується швидкістю розчинення. Зменшення розміру частинок значно покращує швидкість розчинення, забезпечуючи кращий потенціал поглинання, і можливо дає покращене лікування. Мокрий спосіб помелу (патент США № 5494683) і нанотехнологія (PCT міжнар. заявка WO 2004022100) є двома прикладами методик, які можна застосувати до слаборозчинних у воді лікарських засобів. Не дивлячись на те, що ці загальноприйняті способи зазвичай використовують для збільшення швидкості розчинення лікарського засобу, існують практичні обмеження, так що необхідне поліпшення біодоступності не завжди може бути досягнуте просто подрібненням. Також накопичення із-за підвищеної поверхневої енергії або погане змочування можуть відміняти користь від зменшеного розміру частинок. 3. Одержання ліпідного препарату: Слаборозчинні лікарські засоби можуть розчинятися в наповнювачі на основі ліпіду в значно більшій концентрації, чим у водних середовищах. Після дозування ліпідний препарат диспергує в шлунковому і кишковому соку, що забезпечує велику площу поверхні для розповсюдження лікарського засобу з його розчину в ліпіді в шлунковий або кишковий сік. Висока розчинність лікарського засобу в ліпідному препараті забезпечує сильну рухому силу для дифузії. Одним прикладом є самоемульгуюча система доставки лікарського засобу (SEDDS від self-emulsifying drug delivery system). Залежно від вибору ліпідного наповнювача одержана в результаті водна дисперсія може давати дуже тонкодисперсну або грубу емульсію (див., наприклад, патенти США № 5969160, 6057289, 6555558 і 6638522). Деякі обмеження методик виготовлення цих препаратів походять від недостатньої розчинності лікарського засобу в ліпідних наповнювачах, фізичній нестійкості (наприклад, кристалізації поліморфу із зменшеною розчинністю) і т. д. 4. Тверда дисперсія: Останніми роками тверді дисперсії привертають увагу в області пероральних препаратів, особливо для слаборозчинних сполук. Методики виготовлення твердих дисперсій включають стабілізацію лікарського засобу в його аморфній формі у складі матриці носія. Аморфна форма забезпечує швидше розчинення лікарського засобу і є особливо перспективною для лікарських засобів, що вводяться перорально, (внаслідок великого вибору матриць носіїв). Проте для того, щоб використовувати цю методику ефективно, необхідно визначити відповідний носій, який сумісний з лікарським засобом. Розроблено декілька методик одержання твердих дисперсій, включаючи сумісне осадження (див., наприклад, патенти США № 5985326 і 6350786), плавлення / сушіння розпиленням (див., наприклад, патент США № 7008640) та екструзію гарячого розплаву (див., наприклад, патент США № 7081255). Всі ці методики забезпечують високо диспергуючу молекулу ліків в полімерній матриці, що покращує розчинення лікарського засобу з дисперсії. Тверді дисперсії, одержані різними методами, 3 UA 116004 C2 5 10 15 20 можуть відрізнятися властивостями, такими як проникність, площа поверхні, щільність, стабільність, гігроскопічність, розчинення і, отже, біодоступність. Проте не існує доказу в літературі, що дозволяє говорити про перевагу одного способу над іншим для досягнення необхідного фармакокінетичного профілю, особливо кращої відповідності з дозою. Не дивлячись на те, що деякі з цих методик добре відомі, більшість з них створює ряд особливих проблем і не може застосовуватися до сполук, подібних до цегляної муки, тобто з дуже високою температурою плавлення і практично нерозчинними ні в одному з органічних розчинників. Крім того, аморфні тверді дисперсії є високоенергетичними препаратами, які створюють додаткові труднощі, оскільки вони за своєю природою термодинамічно нестійкі. Отже, їх успішна розробка залежить у великій мірі від розуміння специфічних взаємодій, відповідальних за їх стабілізацію (Serajuddin, A. T. M. J. Pharm. Sci. 1999, 88, 1058-1066; Janssens, S. and Van den Mooter, G. J. Pharm. Phamacol. 2009, 61, 1571-1586). Проте не існує універсального або надійного способу вибору ані методики, ані полімеру для одержання гарантованої аморфної стабільності і покращеної біодоступності. Як повідомлялося, параметри розчинності сприяють вибору полімерів. Проте, як показано нижче в таблиці 1, параметри розчинності і порядок їх між різними полімерами не узгоджуються з різними обчисленнями і, отже, різні полімери можуть бути вибрані, виходячи з різних обчислень. Отже, обчислення не передбачають перевагу від використання одного конкретного полімеру над іншим з погляду забезпечення стабільної аморфної дисперсії. Таблиця 1 Обчислення параметрів розчинності сполуки A з різними полімерами Ліки/Полімер Сполука A ГПМЦ-АС Колідон PVP VA 64 ПВП (K30, K90…..) Eudragit L100 Eudragit L100-55 Eudragit EPO Soluplus 25 30 35 40 45 δ (ван Кревелен) 26,3537 26,0281 24,2935 25,9657 23,447 23,5976 20,3652 19,4651 δ (Хансен) 20,3818 40,5648 25,6482 27,6816 21,1627 20,4951 16,68035 20,2765 δ (Хоу) 26,3537 ~ 24,3355 24,8893 20,2345 20,5515 16,802 Для препаратів твердої дисперсії, якщо аморфні речовини перекристалізуються, можна припустити, що на біодоступність впливає втрата переваги від покращеної розчинності аморфної форми. Проте не ясно, як вміст лікарської речовини або полімеру впливає на біодоступність, коли стійкість аморфної форми зберігається в широкому діапазоні вмісту лікарського засобу. Опис попереднього рівня техніки Сполука A, способи її синтезу, а також загальноприйняті фармацевтичні препарати, що містять сполуку, описані в WO2011/098398. Дана патентна заявка описує спосіб одержання термодинамічно стабільної форми сполуки і механізм дії молекули. Патент США № 6350786 розкриває фармацевтичні композиції, які включають аморфну дисперсію всіляких сполук, тобто толкапону, аккутану, саквінавіру і деяких інших, одержаних при використанні методики мікроосадженого нефасованого порошку (MBP). Було виявлено, що методика MBP широко застосовується, і було знайдено, що декілька різних полімерів, тобто Eudragit® L100-55, Eudragit® L100, гідроксипропілметилцелюлози фталат (HP-50) або Eudragit® S100 є вдалими при одержанні стійкої аморфної дисперсії цих лікарських засобів. Заявка на патент США № US2010/0310659 A1 описує фармацевтичну композицію {3-[5-(4хлор-феніл)-1H-піроло[2,3-b]піридин-3-карбоніл]-2,4-дифтор-феніл}-аміду пропан-1-сульфонової кислоти з ГПМЦ-АС при використанні методики MBP. Заявка на патент США № US2009/145999 розкриває аморфну композицію {3-[5-(4-хлорфеніл)-1H-піроло[2,3-b]піридин-3-карбоніл]-2,4-дифтор-феніл}-аміду пропан-1-сульфонової кислоти з полімером коповідон через процес екструзії гарячого розплаву. Заявка на патент США № US12/902186 визначає фармацевтичну композицію низькоплавкої лікарської речовини HEP з ГПМЦ-АС при використанні методики MBP і ЕГР, коли аморфна дисперсія за допомогою способу ЕГР показувала трохи покращені фармакокінетичні властивості в порівнянні з препаратом MBP. 4 UA 116004 C2 5 10 15 20 25 30 35 40 45 50 55 60 У патенті США № 6350786 розкриті тверді дисперсії при використанні нерозчинних у воді іонних полімерів з молекулярною масою більше ніж 80,000 Да для одержання стабільного аморфного препарату. Патент США № 6548555 описує застосування іонних полімерів, включаючи гіпромелози ацетату сукцинат (ГПМЦАС), для одержання твердих дисперсій з покращеною розчинністю і кращою біодоступністю. WO2007/109605 розкриває висушені розпиленням композиції, що включають ліки і, крім того багатьох інших полімерів, ПВП або ПВП-ВА. ГПМЦАС є полімером, який використовується для виготовлення твердих дисперсій лікарських засобів (наприклад, H. Konno, L.s. Taylor, Journal of Pharmaceutical Sciences, Vol.95 №12, 2006, 2692-2705). Інші полімери, як використовуються в даному документі, зокрема повідон (ПВП) і коповідон (PVP VA 64), є у продажу, наприклад, у BASF SE (67056 Ludwigshafen, Germany). Kondo із співавт. показали покращену пероральну абсорбцію слаборозчинних лікарських засобів в кишкових копреципітатах (наприклад, J Pharm Sciences, 83(4) 1994). Полімером, використовуваним в цьому препараті, був гіпромелози фталат, і копреципітати одержували методом випаровування розчинника з подальшим сушінням при 80 °C. Виходячи з даних про розчинення, такі системи копреципітатів, солюбілізовані співрозчинниками, або варіанти твердої дисперсії можуть знову перетворюватися на кристалічну форму, приводячи до втрати біодоступності при високій дозі. Тоді як мікросоосадження використовується для стабілізації деяких лікарських речовин в твердому стані, можливо не потрібно задовільно задати фармакокінетичний профіль таких слаборозчинних сполук, особливо залежного від дози впливу, який дуже важливий для управління безпекою і ефективністю сполуки. Ці перенасичені препарати можуть знову перетворюватися на кристалічну форму при зберіганні або в умовах навантаження, приводячи до втрати біодоступності. Виявлено, що вибір полімеру і способу одержання аморфної дисперсії відіграє вирішальну роль в стабілізації цій дисперсії. Проте не існує абсолютного способу, щоб апріорі вирішити, чи забезпечить даний полімер або спосіб достатню стійкість аморфної дисперсії. Виявлено, що вміст лікарського засобу в твердо-аморфному препараті є вирішальним. Зазвичай чим нижче вміст лікарського засобу, тим краще стійкість. Вище конкретного вмісту лікарського засобу аморфна тверда дисперсія має високий ризик перекристалізуватися протягом терміну придатності і, отже, зменшити користь від покращеної розчинності і біодоступності. Lin і Cham -(C.w. Lin, T.m. Cham. Effect of particle size on the available surface area of nifedipine from nifedipine-polyethylene glycol 6000 solid dispersions. Int. J. Pharm., 127 (1996), pp. 261272) продемонстрували, що тверді дисперсії напроксену в ПЕГ 6000 вивільняли лікарський засіб швидше, коли використовували 5 або 10% вміст напроксену, чим коли використовували 20, 30 або 50% вміст. Дані результати можна пояснити за допомогою результатів дифракції рентгенівських променів, які указували на те, що дисперсії з низькими рівнями вмісту напроксену були аморфними, тоді як з високим вмістом були частково кристалічними (Dissolution Improvement of High Drug-loaded Solid Dispersion. AAPS Pharmscitech 2006; 7 (2) Article 52). Складність методики одержання твердої дисперсії при розробці фармацевтичного продукту полягає в тому, що потрібна велика кількість носія, тобто більше 60% до 90% мас/мас, для досягнення бажаного розчинення. Цей високий відсоток носія забезпечує стабільність якості продукту під час виготовлення і в процесі зберігання на складі. Даний винахід відноситься до стабілізованих твердих дисперсій сполуки A, які відрізняються підвищеною швидкістю розчинення і значно покращеною біодоступністю. У одному втіленні дані тверді дисперсії одержують в ході мікроосадження, що приводить до вказаної твердої дисперсії у вигляді мікроосадженого нефасованого порошку (MBP). В іншому втіленні дані тверді дисперсії одержують в ході процесів сушки розпилюванням (СР). Залежно від способу можна використовувати різні полімери для ефективного утримання сполуки A у вказаній твердій дисперсії. Порівняльний аналіз полімерів проводили, використовуючи наступні полімери: - Гідроксипропілметилцелюлоза (ГПМЦ 2910, E5) - Гідроксипропілцелюлоза ГПЦ LF - Повідон K30 (ПВП K30) - Коповідон (PVP VA 64) - Eudragit EPO (катіонний співполімер на основі диметиламіноетилметакрилату, бутилметакрилату і метилметакрилату) - Soluplus 5 UA 116004 C2 5 10 15 20 25 30 35 40 45 50 55 60 - ГПМЦАС, LF Досліджували наступні масові співвідношення сполуки A : полімеру: 70% A : 30% полімеру; 50% A : 50% полімеру; 30% A : 70% полімеру і 50% A : 45% полімеру : 5% ДОСС (діоктилсульфосукцинату натрію або докузату натрію). Крім того, досліджували наступні полімери при масовому співвідношенні 50% A : 50% полімеру і 30% A : 70% полімеру: - Повідон 12 PF (ПВП 12 PF) - Повідон 17 PF (ПВП 17 PF) - Повідон K25 (ПВП K25) - Повідон K30 (ПВП K30) - Повідон K90 (ПВП K90) - Коповідон (PVP VA 64) - Eudragit EPO (катіонний співполімер на основі диметиламіноетилметакрилату, бутилметакрилату і метилметакрилату) - Soluplus - ГПМЦАС, LF Було продемонстровано, що серед різних перевірених полімерів ГПМЦАС, повідон (ПВП) і коповідон (PVP VA 64) показують покращені профілі розчинення сполуки A. Покращені профілі розчинення означають покращене вивільнення сполуки A з твердої дисперсії, що утворюється цією сполукою і відповідним полімером. Крім того, застосування повідону або коповідону може давати профілі розчинення, які не залежать від значення pH в середовищі розчинення. Отже, розчинення і таким чином вивільнення сполуки A з твердої дисперсії, що утворюється з повідоном або коповідоном, може вже відбуватися скоро після перорального введення такої твердої дисперсії, наприклад, в шлунку. Тому це швидке розчинення / вивільнення сполуки A може значно покращити біодоступність сполуки A. Як використовується в даному документі, термін "тверда дисперсія" означає будь-яку тверду композицію, що має щонайменше два компоненти. У конкретних втіленнях тверда дисперсія, як розкрито в даному документі, включає активний інгредієнт (наприклад, сполуку A); що переважно диспергує серед принаймні одного іншого компоненту, наприклад, полімеру. У конкретних втіленнях тверда дисперсія, як розкрито в даному документі, є фармацевтичною дисперсією, яка включає щонайменше один фармацевтично або біологічно активний інгредієнт (наприклад, сполуку A). У деяких втіленнях тверда дисперсія включає сполуку A, що молекулярно диспергує з полімером. Переважно тверда дисперсія є однофазною системою. Особливо переважна тверда дисперсія за даним винаходом є мікроосадженим нефасованим порошком (MBP), що включає сполуку A. В іншому втіленні тверду дисперсію одержують сушкою розпиленням, і вона включає сполуку A і як полімер коповідон (PVP VA 64). Термін "молекулярно диспергований", як використовується в даному документі, відноситься до випадкового розподілу сполуки (наприклад, сполуки A) з полімером. У конкретних втіленнях сполука знаходиться в полімері в кінцевому стані розфасовки. Див., наприклад, M.G. Vachon et al., J. Microencapsulation, 14:281-301 (1997) і Vandelli et al., J. Microencapsulation, 10: 55-65 (1993). У деяких втіленнях сполука (наприклад, сполука A) може диспергувати в матриці, що утворюється полімером в його твердому стані, так що сполука фіксується в своїй аморфній формі. Чи диспергує молекулярно сполука в полімері, можна довести різними способами, наприклад, при одержанні в результаті твердого молекулярного комплексу, що має єдину температуру склування, або відсутністю сигналів, вказуючих на кристалічні кількості зазначеної сполуки (наприклад, сполуки A) на рентгенівських дифракційних кривих. Термін "твердий молекулярний комплекс", як використовується в даному документі, означає тверду дисперсію, яка включає сполуку A, що молекулярно диспергує в полімерній матриці. Термін "фіксувати", як використовується в даному документі відносно фіксації активної сполуки в полімерній матриці, означає, що молекули сполуки взаємодіють з молекулами полімеру таким чином, що молекули сполуки утримуються у вищезазначеній матриці і перешкоджають зародженню кристалів у зв'язку з відсутністю рухливості. У деяких втіленнях полімер може запобігати утворенню міжмолекулярних водневих зв'язків або слабким дисперсійним силам між двома або більше молекулами ліків сполуки A. Див., наприклад, Matsumoro and Zografi, Pharmaceutical Research, Vo. 16 № 11, p 1722-1728, 1999. Відсотки (%), як використовуються в даному документі, виражені у вагових відсотках (вага%, мас/мас), якщо особливо не вказано інше. Таким чином в першому аспекті запропонована тверда дисперсія, яка включає сполуку A і полімер. Також запропонований твердий молекулярний комплекс, який включає сполуку A і полімер. Полімер може бути неіонним полімером або іонним полімером. У конкретних втіленнях 6 UA 116004 C2 5 10 15 20 25 30 35 40 полімер вибраний з групи, що включає гідроксипропілметилцелюлози ацетату сукцинат (ГПМЦАС), гідроксипропілметилцелюлозу, співполімери метакрилової кислоти і подібні, а також суміші двох або більше полімерів. У переважному втіленні полімер вибраний з ГПМЦАС або повідону (ПВП, Коллідон®), або коповідону (Коллідон® ВА 64; PVP VA 64). Стійка тверда дисперсія включає від приблизно 10% до приблизно 90%, в конкретних втіленнях від приблизно 30% до приблизно 70%, або від приблизно 40% до приблизно 60%, або від приблизно 20% до приблизно 50%, або від приблизно 50% до приблизно 70% (мас/мас) сполуки A, що молекулярно диспергує в матриці, яка утворюється полімером. У конкретних втіленнях цей полімер є гиіромелози ацетату сукцинат (ГПМЦАС) або повідон (ПВП), або коповідон (PVP VA 64). Найпереважніше композиція стабілізованої аморфної дисперсії сполуки A за даним винаходом не містить значні кількості кристалічної сполуки A, як показано за допомогою аморфної порошкової рентгенівської дифракції (XRPD) вказаних композицій. Активний інгредієнт (тобто сполука A) має хімічну назву 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфеніл)-3-(3-хлор-2-фтор-феніл)-4-ціано-5-(2,2-диметил-пропіл)-піролідин-2-карбоніл]-аміно}-3метокси-бензойна кислота, (сполука A) і може бути зображений наступною структурною формулою: . Кристалічна форма сполуки A (у даному документі іноді званої "лікарським засобом", "АФІ") має температуру плавлення приблизно 277 ºC і зберігає дуже низьку розчинність у воді ( 270 °C, разом із стабілізуючим полімером. В іншому втіленні даного винаходу запропонована тверда дисперсія, як розкрито вище, де 7 UA 116004 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполука, що має розчинність у воді менше 1 мкг/мл, є 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфеніл)-3-(3-хлор-2-фтор-феніл)-4-ціано-5-(2,2-диметил-пропіл)-піролідин-2-карбоніл]-аміно}-3метокси-бензойну кислоту (сполука A). В іншому втіленні даного винаходу запропонована тверда дисперсія, як розкрито вище, де стабілізуючий полімер є гіпромелози ацетату сукцинат (ГПМЦАС). В іншому втіленні даного винаходу запропонована тверда дисперсія, як розкрито вище, де R стабілізуючий полімер є EUDRAGIT L-100 або Eudragit L100-55. В іншому втіленні даного винаходу запропонована тверда дисперсія, як розкрито вище, де стабілізуючий полімер є повідоном (ПВП) або коповідоном (PVP VA 64). В іншому втіленні даного винаходу запропонована будь-яка з твердих дисперсій, як розкрито вище, де відношення кількості за масою сполуки A в твердій дисперсії до кількості за масою стабілізуючого полімеру в неї ж знаходиться між 5:95 і 70:30. В іншому втіленні даного винаходу запропонована будь-яка з твердих дисперсій, як розкрито вище, де відношення кількості за масою сполуки A в твердій дисперсії до кількості за масою стабілізуючого полімеру в неї ж переважно складає 30:70 до 50:50. У ще іншому втіленні тверду дисперсію за даним винаходом одержують сушінням розпиленням розчину коповідону (PVP VA 64) і сполуки A. Можна використовувати будь-який розчинник, в якому розчинними є і коповідон, і сполука A. Переважно 50% (за масою) коповідону і 50% (за масою) сполуки A розчиняють в ацетоні. Сукупна кількість коповідону + сполуки A складає 3 - 7%, переважно 5% (за масою) розчину ацетону. Цей розчин сушать розпиленням традиційними способами розпилювального сушіння з подальшим другим процесом сушіння. Можна використовувати всі загальноприйняті способи для другого сушіння, переважно поличну сушарку, гвинтову сушарку або сушарку в псевдозрідженому шарі. Одержаний таким чином розпилювальним сушінням порошок додатково характеризується розподілом частинок за розмірами від приблизно d10 = 5 до 10 мкм, d50 = 10 до 20 мкм і d90 = 30 до 60 мкм (зміряно за 3 допомогою лазерної дифракції), і об'ємною щільністю 0, 10 до 0,30 г/см . Тверду дисперсію, зокрема MBP та/або висушені розпиленням продукти, що одержуються запропонованими способами, можна використовувати у великій різноманітності форм введення лікарських засобів, які слаборозчинні у воді, таких як сполука A, і зокрема для пероральних лікарських форм. Зразкові лікарські форми включають порошки або гранули, які можна приймати всередину перорально або сухими, або перетвореними при додаванні води з утворенням пасти, суспензії, суспензії або розчину; таблетки, капсули або пілюлі. Різні допоміжні речовини можна змішувати, подрібнювати або гранулювати з твердою дисперсією, як описано в даному документі, з утворенням речовини, відповідної для вищенаведених лікарських форм. Як правило можливо корисні допоміжні речовини можуть бути розділені на наступні класи: інші матричні речовини або розчинники, поверхнево-активні речовини, лікарські комплексоутворюючі речовини або солюбілізатори, наповнювачі, розпушувачі, пов'язуючі речовини, змащуючі речовини і pH модифікатори (наприклад, кислоти, основи або буфери). Приклади інших матричних речовин, наповнювачів або розчинників включають лактозу, маніт, ксиліт, мікрокристалічну целюлозу, фосфат кальцію і крохмаль. Приклади поверхнево-активних речовин включають лаурилсульфат натрію і полісорбат 80. Приклади лікарських комплексоутворюючих речовин або солюбілізаторов включають поліетиленгліколі, кофеїн, ксантен, гентизинову кислоту і циклодекстрини. Приклади розпушувачів включають натрію крохмалю гліколят, альгінат натрію, карбоксиметилцелюлозу натрію, метилцелюлозу і кроскармелозу натрію. Приклади зв’язуючих речовин включають метилцелюлозу, мікрокристалічну целюлозу, крохмаль і камідь, такі як гуарова камідь і трагакант. Приклади змащуючих речовин включають стеарат магнію і стеарат кальцію. Приклади pH модифікаторів включають кислоти, такі як лимонна кислота, оцтова кислота, аскорбінова кислота, молочна кислота, аспарагінова кислота, янтарна кислота, фосфорна кислота і подібні; основи, такі як ацетат натрію, ацетат калію, оксид кальцію, оксид магнію, фосфат натрію, гідроксид натрію, гідроксид кальцію, гідроксид алюмінію і подібні, і буфери, що як правило включають суміші кислот і солей вказаних кислот. Щонайменше одна функція включення таких pH модифікаторів полягає в регулюванні швидкості розчинення лікарського засобу, матричного полімеру або обох, тим самим регулюється місцева концентрація лікарського засобу в процесі розчинення. Допоміжні речовини можуть бути включені в твердо-аморфну дисперсію в ході або після її утворення. На додаток до вищенаведених допоміжних речовин або ексципієнтів можливо корисно застосовувати загальноприйняті речовини і способи для розробки і одержання пероральних лікарських форм при використанні композицій, розкритих в даному документі, відомі кваліфікованим фахівцям в даній області техніки. Отже, в іншому втіленні запропоновано твердий препарат одноразової дози, переважно 8 UA 116004 C2 5 10 15 20 25 30 35 40 45 50 таблетка, що включає тверду дисперсію за даним винаходом разом з широко використовуваними фармацевтичними інгредієнтами, вибраними з групи, що включає розпушувачі, розчинники, змащуючі речовини, ковзаючі речовини, разом з плівковою оболонкою. В іншому втіленні даного винаходу запропоновано твердий препарат одноразової дози, що включає приблизно 80% будь-якої твердої дисперсії згідно даному винаходу разом з приблизно 7% кроскармелози натрію, приблизно 6,8% маніту, приблизно 4% кросповідону, приблизно 1,5% колоїдного діоксиду кремнію і приблизно 0,7% стеарату магнію, який потім інкапсулюють або пресують і покривають оболонкою у вигляді таблетки. У ще іншому втіленні даного винаходу запропонований твердий препарат одноразової дози, який відрізняється тим, що тверду дисперсію, одержану при сушінні розпиленням сполуки A разом з коповідоном (PVP VA 64), що становить приблизно 80% мас/мас від маси ядра, додатково змішують з наповнювачем (6,8% до 10,8% від маси ядра), переважно вибраним з маніту, мікрокристалічної целюлози, моногідрату лактози або діоксиду кремнію; одним або двома розпушувачами (4% мас/мас від маси ядра), вибраними з кроскармелози натрію або кросповідону; ковзаючою речовиною (1% мас/мас від маси ядра), переважно колоїдним діоксидом кремнію; і змащуючою речовиною (0,2% мас/мас від маси ядра) стеарат магнію, використовуючи барабанний змішувач. У ще іншому втіленні запропонований конкретний склад таблетки згідно прикладу 16. В іншому втіленні даного винаходу запропонований спосіб одержання твердої дисперсії сполуки, що має розчинність у воді менше 1 мкг/мл, переважно сполуки A, та іонного полімеру, згідно якому одержують розчин сполуки і полімеру в диметилацетаміді, або будь-якому іншому відповідному розчиннику, і спільно осаджують лікарський засіб з полімером, використовуючи антирозчинник. Полімер в цьому втіленні переважно є ГПМЦАС. В іншому втіленні даного винаходу запропонований спосіб одержання твердої дисперсії сполуки, що має розчинність у воді менше 1 мкг/мл, переважно сполуки A, та іонного полімеру, згідно якому одержують розчин сполуки і полімеру в ацетоні, або будь-якому іншому відповідному розчиннику, і сушать розпиленням лікарський засіб з полімером. Полімер в цьому втіленні переважно вибраний з повідону (ПВП) або коповідону (PVP VA 64). В іншому втіленні даного винаходу запропонований фармацевтичний препарат, що включає тверду дисперсію за даним винаходом разом з додатковими фармацевтично прийнятними ад'ювантами. В іншому втіленні даного винаходу запропонована тверда дисперсія за даним винаходом для застосування як ліків для лікування раку, зокрема ГМЛ або раку передміхурової залози. В іншому втіленні даного винаходу запропоновано застосування твердої дисперсії за даним винаходом для виготовлення ліків для лікування раку, зокрема ГМЛ або раку передміхурової залози. Надзвичайно низька розчинність / біодоступність ставлять завдання досягти необхідної дії і профілю безпеки сполуки A. Оскільки низька біодоступність гідрофобних лікарських засобів з надзвичайно низькою розчинністю у воді може бути серйозною проблемою, були вивчені різні підходи до досягнення необхідних високих рівнів розчинності лікарського засобу і швидкості розчинення. Далі ці підходи будуть проілюстровані наступними прикладами, які не обмежують об'єм винаходу. Приклади A.: Методики виготовлення кристалічного препарату Нижче наведені докладні дані (приклад 1) всіляких методик виготовлення препаратів з кристалічною формою або сольовою формою сполуки. Таблиця 1 ілюструє відносну біодоступність, одержану за допомогою цих методик виготовлення препаратів. Кристалічні препарати одержували таким чином: Приклад 1: Кристалічна мікронна суспензія Кристалічну суспензію одержували, диспергуючи кристалічну сполуку A в наповнювачі на водній основі, що включає 2% гідроксипропілцелюлози, 0,15% полісорбату 80, 0,09% метилпарабену і 0,01% пропілпарабену. Суспензію розтирали, щоб досягти середній діаметр частинок < 10 мкм (d0,5). 55 9 UA 116004 C2 Таблиця 2 Покращення біодоступності на мавпах Параметри Доза Одиниці вимірювання мг/кг Внутрішньовенно Перорально Перорально 1,25 30 Після їжи 15,8 16,1 1,8 0,5 30 Мікронна кристалічна суспензія Після їжи 35,0 35,5 1,4 1,2 1,1 1,7 5,2% 11,5% Препарат Корм AUC (0-t*) AUC екстрап % AUC екстрап AUC/Доза Пероральна Cмакс Біодоступність 5 Кристалічний мкг, г/мл мкг, г/мл % г, мкг/мл/мг/кг Після їжи 12,8 12,9 0,7 10,3 мкг/мл Приклад 2: Суспензія на основі солі В ході перевірки солей визначили декілька можливих солей сполуки A (див. нижче Таблицю 3). Серед них меглумін був багатообіцяючою сіллю з самою покращеною розчинністю у воді і тому був перевірений в ході фармакокінетичного дослідження на тваринах в твердій лікарській формі в капсулі, що містить меглумінову сіль сполуки A у вигляді гранул з полоксамером 188, кросповідоном, колоїдним діоксидом кремнію і стеаратом магнію. Біодоступність (дія) не покращилася (Фігура 3). 10 Таблиця 3 Розчинність різних солей сполуки A Сіль сполуки A Сульфат п-Толуолсульфонова кислота Натрій Бензолсульфонат Меглумін Калій Метансульфонова кислота (Мезилат) 15 20 25 30 Розчинність (мкг/мл) < 0,02 < 0,02 0,7 1400 0,5 100% Мавпа (30 мг/кг) 10 Суспензія MBP (аморфна) 11,5% 17,4% Приклад 4 (аморфна тверда дисперсія з Eudragit L100): MBP з Eudragit L100 при 30% вмісті лікарського засобу: Сполука A у вигляді аморфної твердої дисперсії (MBP), порошок для розбавлення, що містить 30% сполуки A і 70% полімеру Eudragit L 100. Кінцева дозована концентрація еквівалентна 6 мг/мл сполуки A у водному наповнювачі, що містить 2% мас/мас гідроксипропілцелюлози, 0,1% полісорбату 80 і 0,09% метилпарабену, і 0,01% пропілпарабену. (Фігура 2) Приклад 5: Аморфна тверда дисперсія сполуки A з ГПМЦАС при 30% вмісті лікарського засобу: Сполука A у вигляді аморфної твердої дисперсії, співосадженої (MBP), при 30% вмісті лікарського засобу з 70% полімеру ГПМЦ-АС. Кінцева концентрація розбавленої дозованої суспензії складала 1 мг/мл сполуки A у водному наповнювачі, що містить 2% мас/мас гідроксипропілцелюлози, 0,1% полісорбату 80 і 0,09% метилпарабену, і 0,01% пропілпарабену. Приклад 6: Аморфна тверда дисперсія сполуки A з ГПМЦАС при 50% вмісті лікарського засобу: Сполука A у вигляді аморфної твердої дисперсії (MBP), що містить 50% сполуки A і 50% полімеру ГПМЦ-АС. Потім MBP розбавляли до дозованої суспензії при концентрації 1 мг/мл сполуки A у водному наповнювачі, що містить 2% мас/мас гідроксипропілцелюлози, 0,1% полісорбату 80 і 0,09% метилпарабену, і 0,01% пропілпарабену. (Фігура 3) Приклад 7: Аморфна тверда дисперсія сполуки A з ГПМЦАС при 70% вмісті лікарського засобу: Сполука A у вигляді аморфної твердої дисперсії (MBP), порошок для розбавлення, що містить 70% сполуки A і 30% полімеру ГПМЦ-АС. Концентрація суспензії після розбавлення складала 4 мг/мл. Приклад 8: Аморфна тверда дисперсія сполуки A з ГПМЦАС при 50% вмісті лікарського засобу в лікарській формі таблетки: Аморфну тверду дисперсію MBP сполуки A, що містить 50% сполуки A і 50% ГПМЦ-АС, додатково обробляли до таблеток. Композиція була 92,8% сполукою A у вигляді аморфної твердої дисперсії (MBP) з 5% кроскармелози натрію, 1,5% колоїдного діоксиду кремнію і 0,7% стеарату магнію. Приклад 9: Аморфна тверда дисперсія сполуки A з ГПМЦАС при 30% вмісті лікарського засобу в лікарській формі таблетки: Аморфну тверду дисперсію сполуки A, що містить 30% сполуки A і 70% ГПМЦ-АС, додатково обробляли до таблеток. Таблетки включали 94% сполуки A (30% сполуки A і 70% ГПМЦ-АС) у вигляді аморфної твердої дисперсії (MBP) з 3,7% кроскармелози натрію, 1,2% колоїдного діоксиду кремнію, 0,5% гідроксипропілцелюлози і 0,6% стеарату магнію. Приклад 10: Аморфна тверда дисперсія сполуки A з ГПМЦАС при 50% вмісті лікарського засобу в лікарській формі таблетки: Аморфну тверду дисперсію MBP сполуки A, що містить 50% сполуки A і 50% ГПМЦ-АС, додатково обробляли до таблеток. Таблетки включали 80% МВР (50% сполуки A і 50% ГПМЦАС) у вигляді аморфної твердої дисперсії з 7% кроскармелози натрію, 6,8% маніту, 4% кросповідону, 1,5% колоїдного діоксиду кремнію і 0,7% стеарату магнію. Ядра таблеток можуть бути потім покриті загальноприйнятою водною плівкотвірною сумішшю. 11 UA 116004 C2 5 Приклад 11. Збільшення розчинності аморфної твердої дисперсії: Приблизно 5 мг сполуки A у вигляді MBP поміщали в 20 мл 37 ºC біологічно відповідних рідин (штучний кишковий сік натщесерце (FaSSIF) і штучний кишковий сік після їжі (FeSSIF)) і фільтрували через 0,2 мкм фільтр через деякий час. Потім фільтрат аналізували за допомогою ВЕРХ. Таблиця 5 Збільшення розчинності Розчинність Розчинник Кристалічна форма 2 мкг/мл 3 мкг/мл FaSSIF FeSSIF 10 15 20 25 MBP (Аморфний) 5 мкг/мл 15 мкг/мл Приклад 12. Стабільність MBP при високій температурі (показано на XRPD діаграмах порошку) (Фігура 4) Приклад 13. Доказ стабільної аморфної твердої дисперсії: Відповідно до порошкової рентгенівської дифракції (XRPD) MBP залишався аморфним після 6 місяців зберігання при 25 ºC / 60% ВВ і 6 місяців - при 40 ºC / 75% ВВ. (Фігура 5) Приклад 14. Порівняння аморфної твердої дисперсії MBP з фізичною сумішшю тих же самих компонентів при використанні способу циклічного нагріву диференціальної скануючої калориметрії (ДСК) показало, що фізична суміш кристалізується, тоді як MBP залишається аморфним. (Фігура 6) Приклад 15 Спектроскопія FTIR (інфрачервона спектроскопія з перетворенням Фурьє) показала (Фігура 7), що в MBP лікарська речовина і полімер молекулярно дисперговані, забезпечуючи велику стійкість, і не схильні кристалізації. З іншого боку, аморфний АФІ у фізичній суміші молекулярно не диспергує і, отже, не підданий кристалізації. Таким чином гомогенна молекулярна дисперсія є головним фактором чудової стійкості навіть при високому вмісті лікарського засобу. Приклад 16: Покрита плівковою оболонкою таблетка, що містить висушену розпиленням тверду дисперсію сполуки A з коповідоном (PVP VA 64) Таблетка містить 800 мг порошку, одержаного розпилювальою сушкою (SDP від spray dried powder) сполуки A і коповідону (PVP VA 64), еквівалентних 400 мг сполуки A (вільна основа). Таблиця 6 Склад таблетки Компонент 1 Кількість (мг/таблетка) Ядро Сполука A 400,00 Коповідон 400,00 2 (сполука A + коповідон ) (800,00) 3 Манит (висушений розпиленням, 200) 68,00 Кроскармелоза натрію 70,00 Кросповідон 40,00 Колоїдний діоксид кремнію 15,00 Стеарат магнію 7,00 Загальна вага ядра 1000,00 4, 5 Плівкова оболонка Полівініловий спирт, частково 12,000 гідролізований Діоксид титану 6,234 Поліетиленгліколь 6,060 Тальк 4,440 12 Функціональне призначення Активний інгредієнт Полімер Галенова проміжна сполука Наповнювач Розпушувач Розпушувач Ковзаюча речовина Змащуюча речовина Покривний агент Барвник Пластифікатор Ковзаюча речовина UA 116004 C2 Компонент 1 Оксид заліза жовтий Оксид заліза червоний Оксид заліза чорний Загальна вага плівкової оболонки Загальна вага таблетки, покритої плівковою оболонкою 5 10 15 20 25 30 35 40 45 50 Кількість (мг/таблетка) 0,990 0,240 0,036 30,000 Функціональне призначення Барвник Барвник Барвник 1030,00 Ацетон використовують в процесі сушіння розпиленням; по суті, його видаляють в ході обробки. 2 Порошок, одержаний распилювальним сушінням (SDP), включає 50% сполуки A і 50% коповідону. 3 Можна використовувати для урівноваження активності SDP 4 Очищену воду (USP / Європейська фармакопея) використовували в процесі нанесення водної плівки; по суті, її видаляли в ході обробки. 5 Можна використовувати наявну в продажі плівкотвірну суміш, наприклад, Opadry II коричневий 85F26792. Стадії способу: 1) Розчиняють сполуку A (50% мас/мас порошку, одержаного распилювальним сушінням) і коповідон (50% мас/мас порошку, одержаного распилювальним сушінням) в ацетоні, одержуючи 5% (мас/мас) твердий склад. 2) Розчин, одержаний в 1), коли пропущено через 4 мкм фільтр в пристрій распилювального сушіння, розпилюють, використовуючи розпилювач на колесі, що обертається, або двохпотокову форсунку, або механічну форсунку в сушильній шафі. Дрібнодисперсний туман, утворений розпилювачем, змішують з потоком гарячого азоту (110 до 150 °C) і починають випаровувати розчинники з крапель. Швидкість подання розчину підбирають, щоб досягти необхідної температури газу на виході (60 до 90 °C). Сушильний газ несе тонкодисперсний порошок через сушильну шафу в циклонний сепаратор. У циклонному сепараторі порошок відокремлюють від сушильного газу і порошок збирають під дією сили тяжіння в барабани. Газ по суті без порошку тече в корпус рукавного фільтру, де дуже дрібнодисперсні частинки утримуються в мішкових фільтрах. Газ без порошку охолоджують в газоохолоджувачі, де відбувається конденсація розчинника, і сушильний газ після повторного нагрівання направляють знов для сушки в сушильну шафу. 3) Здійснюють вторинне сушіння висушеної розпилюванням речовини, одержаної в 2), щоб зменшити кількість ацетону, що знаходиться в продукті. Для вторинного сушіння використовували поличну сушарку. 4) Висушений розпилюванням порошок, як одержано в 3), додатково змішували з манітом в якості наповнювача; кроскармелозою натрію в якості розпушувача; колоїдним діоксидом кремнію в якості ковзаючої речовини, використовуючи барабанний змішувач. 5) Суміш, одержану в 4), додатково змішували із стеаратом магнію (0,2% від маси ядра) в якості змащуючої речовини в барабанному змішувачі. 6) Здійснювали суху грануляцію суміші, одержаної в 5), використовуючи роликовий прес Gerteis, обладнаний або портативним гранулятором, або зубчатим ротором, і сито з отвором 0,8 мм. Альтернативно портативному гранулятору можна використовувати зубчатий ротор. Отвір може складати від 0,5 мм до 0,8 мм. 7) Гранули, одержані в 6), змішували з колоїдним діоксидом кремнію в якості ковзаючої речовини і кроскармелозою натрію в якості розпушувача в барабанному змішувачі. 8) Суміш, одержану в 7), додатково змішували із стеаратом магнію (0,5% від маси ядра) в якості змащуючої речовини в барабанному змішувачі, щоб одержати готову суміш для пресування таблеток. 9) Готову суміш пресували до таблеток, використовуючи роторну машину таблетки, наприклад, Korsch XL 100 WipCon. Вагу таблетки доводили до кінцевого необхідного дозування, тобто 400 мг. Ці 400 мг ядра мають розмір від 20,1 мм до 9,5 мм. 10) Таблетки, одержані в 9), покривають плівковою оболонкою, використовуючи апарат з перфорованим барабаном для нанесення покриттів, наприклад, апарат для нанесення покриттів Glatt, використовуючи плівкотвірну систему, що містить ПВС. Кількість нанесеного 13 UA 116004 C2 5 10 15 20 25 плівкового покриття складає 3% від маси ядра. Плівкове покриття включає 1,2% полівінілового спирту, частково гідролізованого, 0,6234% діоксиду титану, 0,606% поліетиленгліколю, 0,444% тальку, 0,099% оксиду заліза жовтого, 0,024% оксиду заліза червоного і 0,0036% оксиду заліза чорного. Кількість плівкового покриття може складати до 5% від маси ядра. Також можна використовувати альтернативні плівкотвірні системи, наприклад, для захисту від вологи. Приклад 17: Дані про стабільність (діаграми XRPD) твердої дисперсії з прикладу 16 при зберіганні Дифракційні рентгенограми реєстрували в умовах навколишнього середовища в геометрії пропускання за допомогою дифрактометра STOE STADI P (Cu K альфа-випромінювання, первинний монохроматор, кремнієвий стриповий детектор, діапазон кутів від 3° до 42° 2тета, загальний час вимірювання приблизно 30 хвилин). Зразки одержували і аналізували без додаткової обробки (наприклад, подрібнення або просіювання) речовини (Фігури 8a, b). Діаграма XRPD твердої дисперсії згідно прикладу 16, тобто висушеної розпиленням твердої дисперсії, що включає 50% сполуки A і коповідон (PVP VA 64), відповідає діаграмі плацебо, показуючи тим самим, що із самого початку кристалічний АФІ (сполука A) не виявлений (Фіг. 8a). Діаграми XRPD вказаної твердої дисперсії після 3 місяців зберігання в подвійних блістерних упаковках і флаконах ПЕНТ (умови зберігання: 40 ºC і 75% відносній вологості (ВВ), відповідають діаграмі спочатку зміряної твердої дисперсії, показуючи тим самим, що кристалічний АФІ (сполука A) не виявлений (Фіг. 8b). Приклад 18: Дані про розчинення (in vitro) таблеток, що включають різні тверді дисперсії Випробування на розчинність in vitro проводили з двома препаратами сполуки А у вигляді покритих плівковою оболонкою таблеток, що включають тверду дисперсію, одержану 1) мікроосадженням (МВР з 50% сполуки А і ГПМЦАС) і 2) сушінням розпилюванням (50% сполуки А і PVP VA 64, приклад 16). Використовувані середовища були 0,01 молярну (0,01 н) хлористоводневу кислоту (HCl), що імітує середовище шлунку натщесерце, а також штучний кишковий сік натщесерце (FaSSIF від Fasted State Simulated Intestinal Fluid), що імітує середовище тонкої кишки натщесерце. Точна установка викладена в наступній Таблиці 7. Таблиця 7 Параметри випробувань на розчинність Компонент Дозування (мг) Прилад Середовище Об’єм (мл) Число обертів Тривалість (хвилини) Час відбору проб (хвилини) Утримуючий пристрій Вхідний фільтр Фільтр N Кількісний аналіз 30 35 40 Сполука А 400 USP2 0,01 н HCl (0 – 30 хвилин) / FaSSIF (штучний кишковий сік натщесерце) (30 – 240 хвилин) 500 + 500 75 240 10, 20, 30, 45, 60, 90, 120, 150, 180, 210, 240 F06: № F07: CAP-WHTS99 35 мкм фільтр з скловолокна 1 мкм фільтр з стекловолокна (Acrodisc: Pall) 3 Автономна ВЕРХ згідно SAM-0101609 Склад середовищ 0,01 н HCl (1 л) Зважували (0,83 мл) 37% димлячу HCl в 1000 мл мірній колбі, заздалегідь наповненій 500 мл дист. води, і заповнювали до 1000 мл. Ретельно перемішували, охолоджували до кімнатної температури перед використанням. FaSSIF (3 л) Стадія 1 Щоб одержати буфер, розчиняли 1,260 г NaOH (гранули), 13,410 г дигідрату NaH2PO4 і 18,558 г NaCl приблизно в 2,700 л очищеної води. Доводили рН до 6,5 з допомогою або 1 н NaOH, або 1 н HCl. Доводили до об'єму (3,000 л) за допомогою очищеної води при кімнатній температурі. Стадія 2 Додавали 6,720 г SIF Powder Original до приблизно 1,5 л буфера. Перемішували до повного 14 UA 116004 C2 розчинення порошку. Доводили до об'єму (3,000 л) за допомогою буфера при кімнатній температурі. ФОРМУЛА ВИНАХОДУ 5 1. Фізично стійка тверда дисперсія, яка включає 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфеніл)-3-(3хлор-2-фторфеніл)-4-ціано-5-(2,2-диметилпропіл)-піролідин-2-карбоніл]-аміно}-3метоксибензойну кислоту формули (А) OH O O NH O Cl H N F N F Cl 10 15 20 25 30 , (A) має розчинність у воді менше 1 мкг/мл і температуру плавлення більше 270 °С, разом із R стабілізуючим полімером, яким є гіпромелози ацетату сукцинат (ГПМЦАС), EUDRAGIT L-100, Eudragit L100-55, коповідоном (PVP VA64). 2. Тверда дисперсія за п. 1, де відношення кількості за масою сполуки формули А в твердій дисперсії до кількості за масою стабілізуючого полімеру в ній становить між 5:95 і 70:30. 3. Тверда дисперсія за п. 1, де відношення кількості за масою сполуки А в твердій дисперсії до кількості за масою стабілізуючого полімеру в ній переважно складає від 30:70 до 50:50. 4. Тверда дисперсія за п. 1, де тверду дисперсію одержують розпилювальним сушінням розчину, що включає сполуку А і коповідон (PVP VA64). 5. Тверда дисперсія за п. 2, де тверду дисперсію одержують мікроосадженням розчину, що включає сполуку А і гіпромелози ацетату сукцинат (ГПМЦАС). 6. Твердий препарат одноразової дози, що включає тверду дисперсію за будь-яким з пп. 1-5 разом з широко використовуваними фармацевтичними інгредієнтами, вибраними з групи, яка складається з розпушувачів, розчинників, змащуючих речовин, ковзних речовин, разом з плівковою оболонкою. 7. Твердий препарат одноразової дози за п. 6, який включає приблизно 80 % твердої дисперсії за будь-яким з пп. 1-5 у вигляді аморфної твердої дисперсії разом з приблизно 7 % кроскармелози натрію, приблизно 6,8 % маніту, приблизно 4 % кросповідону, приблизно 1,5 % колоїдного діоксиду кремнію і приблизно 0,7 % стеарату магнію, який потім інкапсулюють або пресують і покривають оболонкою у вигляді таблетки. 8. Спосіб одержання твердої дисперсії за п. 1, що включає 4-{[(2R,3S,4R,5S)-4-(4-хлор-2фторфеніл)-3-(3-хлор-2-фторфеніл)-4-ціано-5-(2,2-диметилпропіл)-піролідин-2-карбоніл]-аміно}3-метоксибензойну кислоту формули (А) 15 UA 116004 C2 OH O O NH O Cl H N F N F Cl 5 , (A) яка має розчинність у воді менше 1 мкг/мл, та стабілізуючий полімер, згідно з яким одержують розчин сполуки і полімеру в диметилацетаміді або будь-якому іншому відповідному розчиннику і спільно осаджують лікарський засіб з полімером, використовуючи антирозчинник. 9. Фармацевтичний препарат, який містить тверду дисперсію за будь-яким з пп. 1-5 разом з додатковими фармацевтично прийнятними допоміжними речовинами. 10. Тверда дисперсія за будь-яким з пп. 1-5 для застосування як лікарського засобу для лікування раку, зокрема гострого мієлобластного лейкозу (ГМЛ) або раку передміхурової залози. 16 UA 116004 C2 17 UA 116004 C2 18 UA 116004 C2 19 UA 116004 C2 20 UA 116004 C2 21 UA 116004 C2 Комп’ютерна верстка В. Мацело Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 22
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition with improved bioavailability
Автори англійськоюLomuscio, Steve, Ma, Hua, Matchett, Michael Allen, Sandhu, Harpreet K., Shah, Navnit Hargovindas, Zhang, Yu-E
Автори російськоюЛомуссио Стив, Ма Хуа, Метчетт Майкл Аллен, Сэндху Харпреет К., Шах Навнит Харговиндас, Чжан Ю-Е
МПК / Мітки
МПК: A61K 9/16, A61K 47/36, A61K 31/40, A61K 9/14, A61K 47/32, A61K 9/10, A61K 47/38
Мітки: композиція, фармацевтична, покращеною, біодоступністю
Код посилання
<a href="https://ua.patents.su/24-116004-farmacevtichna-kompoziciya-z-pokrashhenoyu-biodostupnistyu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція з покращеною біодоступністю</a>
Попередній патент: Змішувач для приготування будівельних сумішей
Наступний патент: Контактор з властивостями швидкого вимкнення
Випадковий патент: Спосіб і установка для виготовлення гарячекатаної стрічки з аустенітних нержавіючих сталей












