Спосіб одержання штаму мікроорганізму, спосіб продукування триптофану
Текст
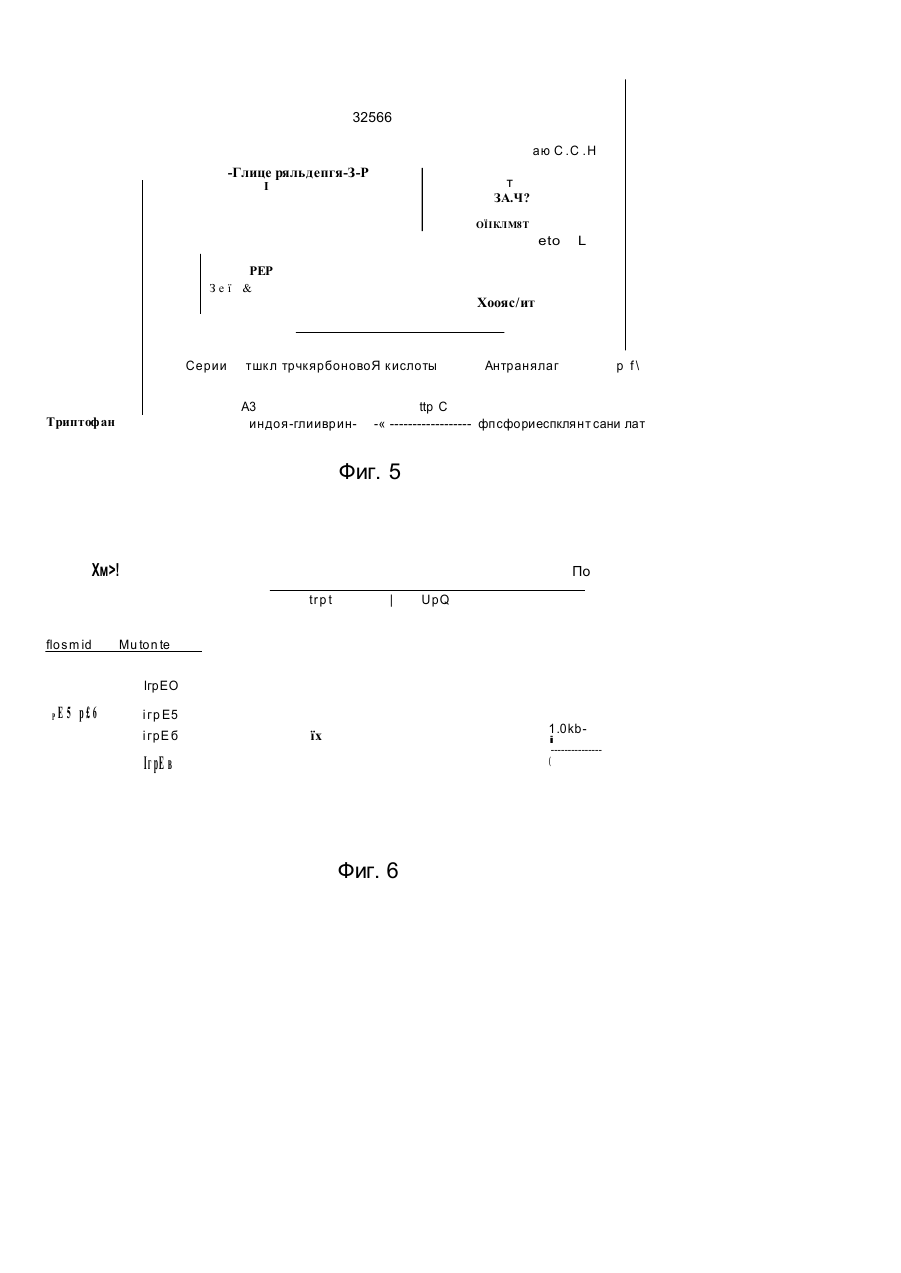
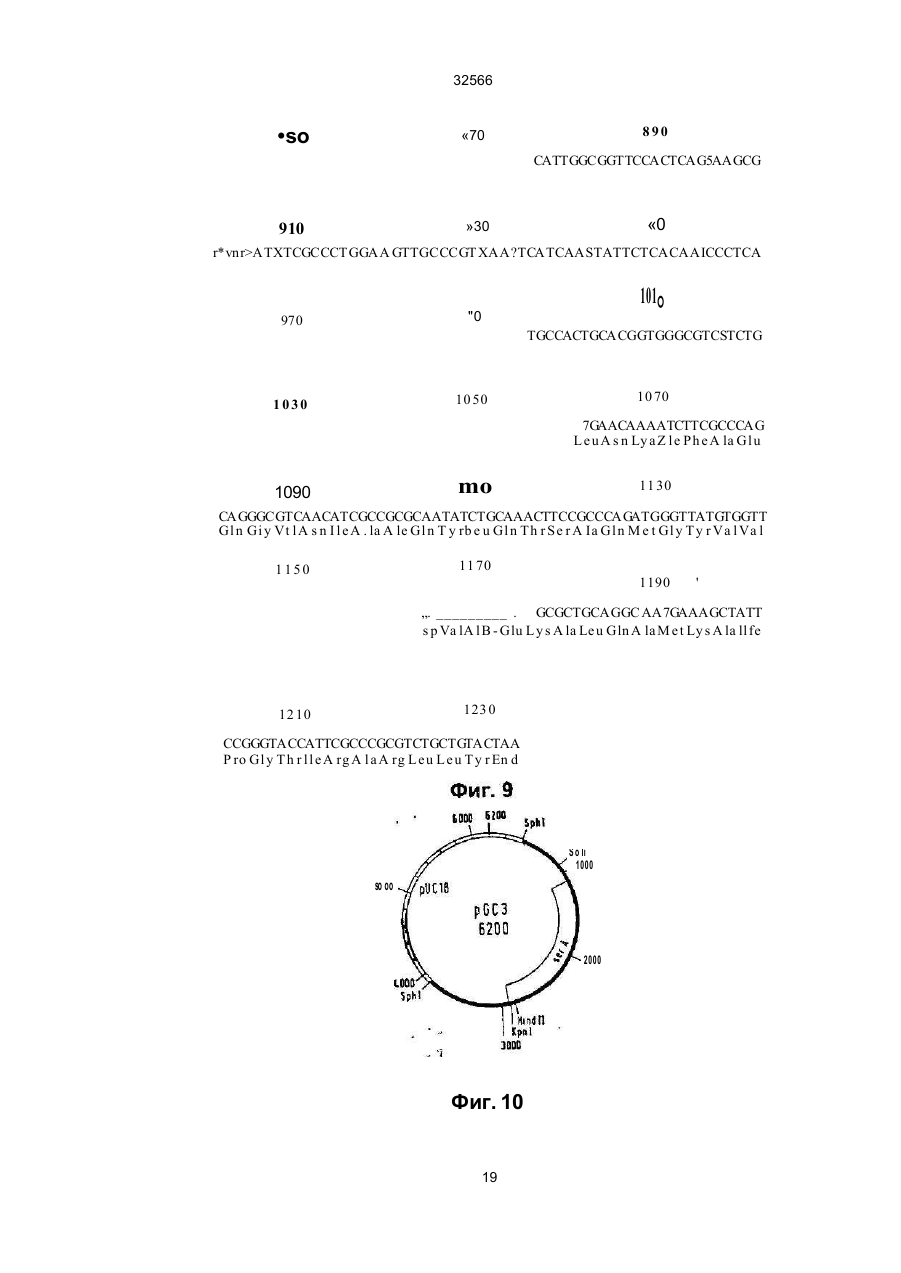
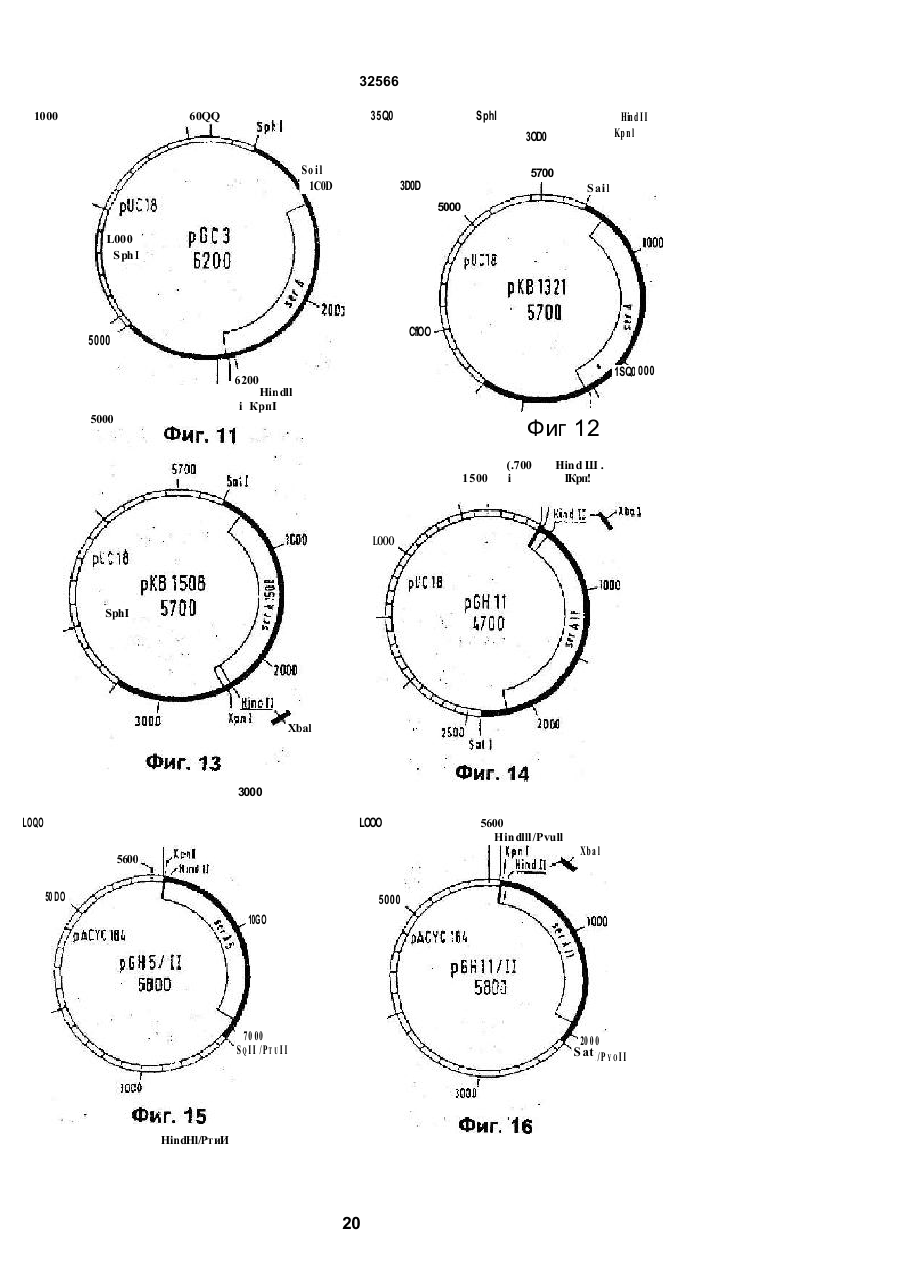
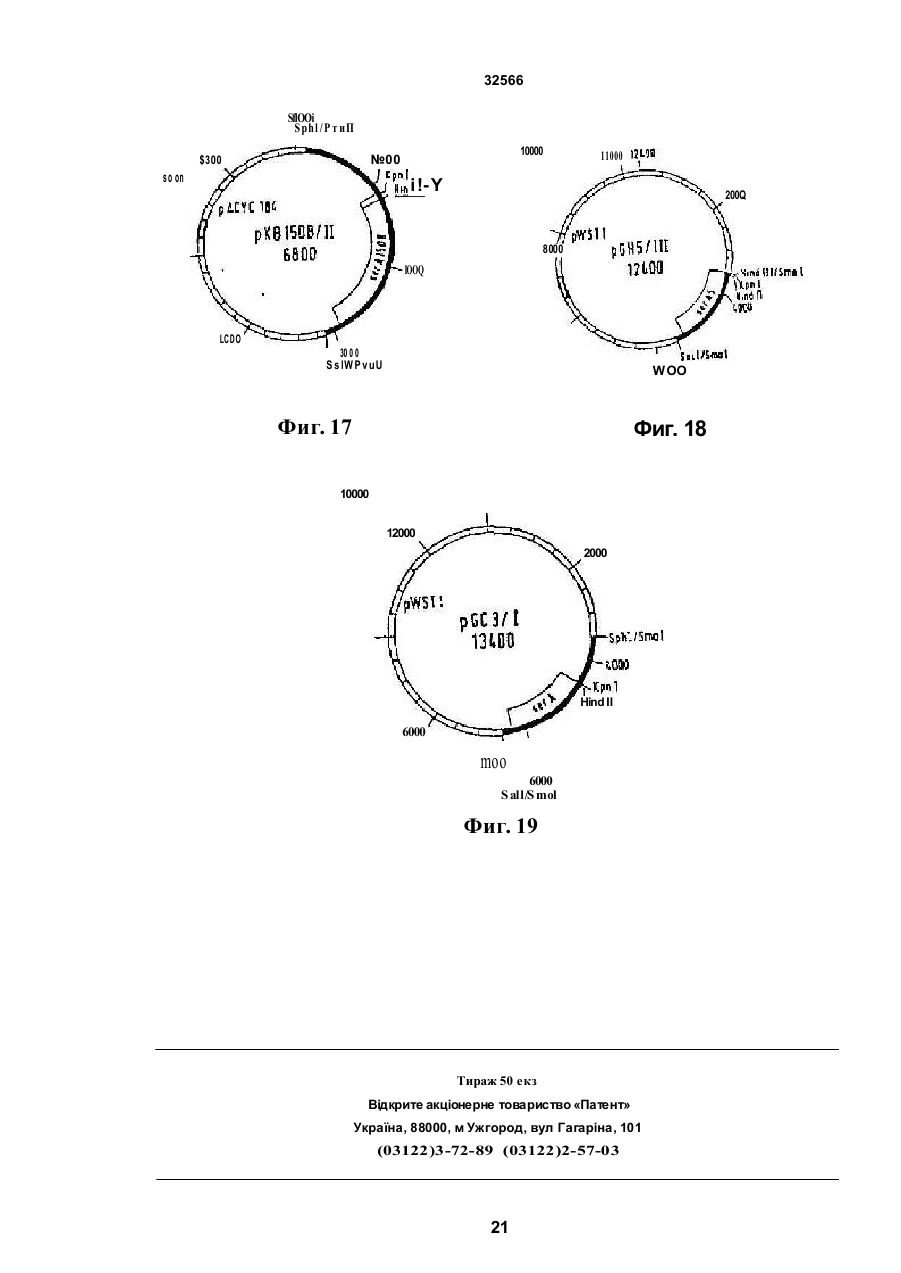
1 Способ получения штамма микроорганизма с улучшенной продукцией триптофана, обладающего разрегулированным метаболизмом триптофана предусматривающий введение в штамм ser А-аллеля, о тличающий ся тем что вводят устойчивый к регуляции по типу обратной связи ser Aаллель 2 Способ продуцирования триптофана, предусматривающий культивирование микроорганизма продуцента трипто фана, отличающийся тем, что в качестве микроорганизма продуцента используют микроорганизм с разрегулированным триптофановым и сериновым метаболизмом, который разрегулирован устойчивым по типу обратноч сзязи ser А-аллелем с величиной KJ ДЛЯ серинэ между 0,1 мМ и 50 мМ циллы (Bacillus) патент США №4588687, для коринебактерии и бревибактерии европейский патент №0388474 В случае эти х способов возникает ряд проблем при осуществлении процесса Это может быть нестабильность и потеря вектора или зэмедпенный рост продуцирующего штамма В европейском патенте №А-0401375 (заявитель, Kyowa Hakko Kogyo Co ) описывается способ продуцирования L-триптофана с помощью штаммов коринебактерий и бревибактерии, которые содержат рекомбинантные плазмиды Эти плазмиды несут генетическую информацию для синтеза ферментов DAHP-синтазы, антранилатсинтазы, индол-3-глицерин-Р-синтаэы, трифто фансинтазы и фосфоглицератдегидрогемазы Применяют устойчивые к регуляции по типу обратной связи аллели антранилатсинтазы Далее известно повышение продуцирования триптофана в штаммах с регулированным метаЬолизмом триптофана за счет введения нескольких генов дикого типа ser А ипи ser А, В, С Так в Chemical Abstracts (С А )Ш (1989) 16 86 88 g и С A Hi (1989) 16 86 89 г описывается применение штаммов Bacillus, которые переэкспримируют ser А-аллель дикого типа соответственно все гены дикого типа метаболизма серина (ser A, ser В и ser С) на плаэмидах для продуцирования триптофана В ВОИС-А-87/01130 описывается использо О со ш ю см со 32566 вание ser A-, ser B-, ser С-аллелей дикого типа для продуцирований триптофана в E.coli. Повышение выхода триптофана за счет предотвращения разложения серина в клетке известно из европейского патента №А-0149539 (заявитель: Stauffer Chemical Company) В этой заявке на патент описываются Е coli K-12 - мутанты, в которых разрушен разлагающий серии фермент сериндеаминаза (Sda). Там описывается также применение таких штаммов для продуцирования аминокислот. В примере VIII описывается использование такого штамма для сверхпродуцирования триптофана из антранилата. Улучшенный по сравнению со штаммом с интактной сериндеаминазой выход триптофана в европейской заявке на патент объясняется тем, что в микроорганизмах, в которых запас триптофана на предшествующей стадии очень высок, серии, соответственно производительность биосинтеза серина является фактором, лимитирующим скорость продуцирования триптофана Наиболее близким к предлагаемому является способ получения триптофана путем глубинного культивирования продуцирующих его микроорганизмов Bacillus sibMis ВНИИ-генетика-15 в условиях аэрации на питательной среде (SU, авторское сви де тель ство , 9 9081 4 , кл С 12 Р 13 /2 2, 1983) Задачей изобретения является поиск микроорганизмов, которые в повышенной степени продуцируют трипто фан, и разработка способов, которые позволяют получать такие микроорганизмы. Задача решается благодаря штаммам микроорганизмов, которые отличаются тем, что они обладают разрегулированным метаболизмом триптофана и разрегулированным по крайней мере за счет устойчивого к регуляции по типу обратной связи ser А-аллеля метаболизмом серина. В изобретении под устойчивыми к регуляции по типу обратной связи ser А-аллелями нужно понимать мутанты ser А-гена, которые кодируют фосфоглицератдегидрогеназу к чувствительности к серину, пониженной по сравнению с соответствующей фосфоглицератдегидрогеназой дикого типа соответствующего микроорганизма. Благодаря предлагаемой согласно изобретению комбинации по меньшей мере одного устойчивого к регуляции по типу обратной связи ser Aаллеля с микроорганизмом с разрегулированным метаболизмом триптофана удивительным образом повышается вы ход трип то фана вплоть до в 2,6 раза по сравнению с выходом, которого можно достигать с помощью тех же микроорганизмов без устойчиво го к регуляции по типу обратной связи ser А-аллеля при прочих равных условиях к ультивирования. То, что предлагаемые в изобретении штаммы р повышенной степени продуцируют триптофан, является неожиданным, так как устойчивые к регуляции по типу обратной связи ser А-аллели обладают эффектом только при высоком внутриклеточном уровне серина (Tosa Т., Piger L.T.. 1971, Journal of Bacteriology, т. 106: 972-982; Winicov J., Piger L.T- 1974, Journal of Biological Chemistry, т. 249, с. 1348-1355). Согласно уровню техники (например, европейский патент №А-014953Э), мик роорганизмы с разрегулированным метаболизмом триптофана, однако, имеют низкий уровень серина. Поэтому благодаря предлагаемому согласно изобретению введению устойчивого к регуляции по типу обратной связи ser А-аллеля в микроорганизмы с разрегулированным метаболизмом триптофана нельзя ожидать никакого повышения продуцирования триптофана. Так как в случае всех известных микроорганизмов метаболизм триптофана протекает по представленному на фиг. 5 пути метаболизма и применяемые для получения предлагаемых в изобретении штаммов способы в принципе известны и применимы ко всем микроорганизмам, предлагаемые согласно изобретению штаммы получаются из любых микроорганизмов. Для получения предлагаемого согласно изобретению штамма предпочтительно пригодны бактерии Особенно предпочтительны грамотрицательные бактерии, в особенности Е coli. Предлагаемые согласно изобретению штаммы можно получать таким образом, что в любом триптофан-прототрофном исходном штамме полностью или частично ликвидируется регуляция метаболизма триптофана и в этот штамм вводится устойчи вый к регуляции по тип у обратной связи ser А-аллель. Предлагаемые согласно изобретению штаммы также можно получать таким образом, что в триптофан-ауксотрофных исходных штаммах восстанавливают способность синтезировать триптофан, причем реконструированный метаболизм триптофана разрегулирован, и в такие штаммы вводят устойчивый к регуляции по типу обратной связи ser А-аллель. Разрегулирование метаболизма триптофана в микроорганизмах возможно за счет ряда различных способов, которые известны из уровня техники. Возможностью разрегулирования метаболизма триптофана является изменение фермента антранилатсинтазы. Этот фермент во всех микроорганизмах катализирует первую стадию специфического в отношении триптофана биосинтеза. Он подавляется в своей активности триптофаном и в зависимости от количества триптофана тем самым регулируе т поток метаболитов за счет пути биосинтеза триптофана. Фермент кодируется trp Е-геном. Измененные trp Е-гены, которые кодируют антранилатсинтаэы с пониженной по сравнению с соответствующей антранилатсинтазой дикого типа чувствительностью по отношению к триптофану, в дальнейшем обозначаемые также как устойчивые к регуляции по типу обратной связи trp Е-аллели, можно получать путем мутагенеза и последующей селекции триптофан-прототрофного исходного штамма. Для этой цели соответствующий штамм подвергают индуцирующей мутации обработке (Miller J.H. 1972, Expenments in Molecular Jentefics, Cold Spring Harbor Laboratory, США. 113-185). Обработанный штамм выращивают на питательной среде, которая содержит по меньшей мере один антагонист триптофана в количестве, достаточном для подавления штамма в росте. Примерами пригодных антагонистов триптофана являются 4тметиптриптофан, 5-метилтриптофан, 6 32566 метилтриптофан, галогенированные триптофаны, триптазан, индол, индопакриловая кислота. Резистентные клоны испытывают на чувствительность к триптофану их антранилатсинтазы. Для определения чувствительности к триптофану антранилатсинтазы можно использовать любой метод, который позволяет определять активность этого фермента в присутствии триптофана Например, хорисмат в пригодной буферной системе можно вводить во взаимодействие с его реакционным компонентом глутамином при ферментативном катализе (Bauerle R. и др , 1987, Methods in Eugymology, 142, 366-386) Из тест-смеси кинетически отбирают аликвоту и с помощью ВЭЖХ-анализа определяют образующееся во времени количество продукта реакции Образующееся во времени (в единицу времени) количество антранилата является прямой мерой активности антранилатсинтазы. Тест осуществляют в присутствии и в отсутствие триптофана, чтобы определить чувствительность испытуемой антранилатсинтазы. Также можно получать нечувстви тельные к триптофану trp Е-аллели путем прямого способа генной инженерии (Bauerle R и др , 1987, Methods in Engymology, 142, 366-386) Описано число мутаций в аминокислотной последовательности антранилатсинтазы различных организмов, которое приводит к пониженной чувствительности фермента по отношению к триптофану (например, для сальмонеллы, Cabgutri М G., Bauerle R., 1991, J of Bio!. Chem., 266, 8328-8335, для бревибактерии, кори небактерии: Mafsui k. и др., 1987, J Bact, 169, 5330-5332). Известны методы, которые позволяют проводить в ДНК-фрагменте, в специфическом сайте, мутацию. Такие методы описаны в следующи х публикациях: Sakar G., Sommerauer S.S., 1990, Bio Techniques, 8, 404—407 описывают зависящий от реакции цепи лолимеразы сайт- направленный мутагенез; Ausube) F М. и др. 1987, Current Protocols in Molecular Biology, Greene Publishing Associates описывают зависящие от фага М13 методы; Smith М„ 1985, Ann. Rev. Genet. 19 423-462 описывает другие методы. ДНК-фрагмент, который охватывает trpE-ген дикого типа, рекомбинируется с помощью уже описанных стандартных способов для получения рекомбинантной ДНК на векторе. Благодаря применению вышеуказанных методов сайт-направленного1 мутагенеза один или несколько нуклеотидов ДНК-последовательности изменяют так, что кодированная теперь геном аминокислотная последовательность соответствует аминокислотной последовательности, нечувствительной к триптофану антранилатсинтаэы. С помощью описанных способов в пюбом trp Е-гене можно проводить одну или несколько мутаций, которые способствуют тому, что кодированная антранилатсинтаэа имеет приводящую к нечувствительности к триптофану аминокислотную последовательность Дополнительно желательны, но необязательны в предлагаемом согласно изобретению штамме, следующие свойства: дефектный белокрепрессор триптофана, дефектный аттенуационный контроль экспрессии trp-оперона, дефектная триптофаназа. Эти свойства могут дости гаться в предлагаемом согласно изобретению штамме про ще всего путем выбора исходного штамма, который уже имеет одно или несколько соответствующи х свойств Получение или выбор можно осуществлять путем комбинации указанных далее методов селекции Белок-репрессор триптофана представляет собой высший регуляторный белок биосинтеза триптофана. Вместе с триптофаном в качестве апорепрессора этот белок репримирует экспрессию trp-оперон-генов. Белок кодируется геном trp R. Мутанты-репрессоры триптофана можно выбирать, например, среди мутантов, которые резистентны против антагонистов триптофана, например, 5-ме тил триптофан. Примеры описываются в J. Mol. Biol. 44, 1969, 185-193, или Genetics, 52, 1965, 1303-1316. Наряду с контролем с помощью trp R-кодированного белка trp-оперон дополнительно подлежит аттенуационному конгропю Ответственным за регуляцию является ДНК-участок до первого гена trp-оперона Мутации или делеции в этой области могут приводить к разрегулированию Такие мутанты можно выбирать среди мутантов, которые резистентны к антагонистам триптофана, как 5-метилтриптофан Между прочим, такие мутации, особенно делеции, получают тем. что благодаря способу сайт-направленного мутагенеза индуцируют это изменение сайт-специфически в аттенуационной области ДНК За счет уже описанных способов сайт-специфического мутагенеза можно рекомбинировать инактивированную аттен уационную область в хромосоме предлагаемого в изобретении штамма на участке природной аттенуационной области Фермент триптофаназа (tna А) катализирует разложение триптофана на индол, пируват и ЫНз. Желательно, чтобы этот фермент был неактивен в штаммах продуцирования триптофана Штаммы, которые дефектны в этом ферменте, можно получать таким образом, что организмы подвергают мутагенной обработке и среди мутантов ищут такие, которые более не в состоянии использовать триптофан в качестве источника углерода и азота Подобный пример описывается в J. Bact 85, 1965, 680-685. Альтернативно также можно с помощью вышеуказанных способов проводить сайт-специфические делеции в tnaA-гене, которые приводят к инактивации. Ряд дополнительных мутаций исходного штамма пригоден для того, чтобы способствовать дальнейшему увеличению продуцирования триптофана. Так, наряду со способом биосинтеза триптофана дополнительно предпочтителен нечувствительный к регуляции общий путь биосинтеза ароматических аминокислот (способ через шикимовуго кислоту) Поэтому штаммы, которые обладают нечувствительной к регуляции синтазой дегидроарабиногептулозоновой кислоты и белокрепрессор тирозина (tyr R) которых инактивирован за счет мутации штаммов для получения предлагаемых согласно изобретению штаммов Также предпочтительны штаммы, метаболизм фенилаланина и тирозина которых нарушен Благодаря этому обеспечивается исключительное превращение молекулы-предшественника хорисмата в 32566 триптофан. Такие штаммы имеют, например, мутации или делеции в генах phe А и/или tyr A. ^ Известен ряд штаммов, которые разрегулированы в одной или нескольких стадиях биосинтеза триптофана ипи в способе получения через шикимовуго кислоту и пере продуцируют триптофан. Примерами являются Bacillus subtifis Fenri BP-4, Fefm'P 1483 (патен т ФРГ №3123001 ); Bre vi bacte rium fla vum ATCC 2 1427 (па тен т С ША №3849251); Corynebacterium glutamicum ATCC 21 842 -2185 1 (п а тен т С ША №35 94279 , п а тен т США №3849251), Micrococcus luteus ATCC 21102 (патент США №3385762), E.coii ATCC 31743 (патент Канады №1182409). Эти штаммы также пригодны в качестве исходных штаммов для получения предлагаемых согласно изобретению штаммов. Они показывают, что штаммы продуцирования триптофана согласно изобретению можно получать в самых различных группах организмов. ; Наряду со штаммами с разрегулированным Sevi3 MOM триптофана для получения предлагаемых согласно изобретению штаммов необходим по меньшей мере один ген, который кодирует фосфоглицератдегидрогеназу с пониженной по сравнению с соответствующей фосфо глицератдегидрогеназой дикого типа чувстви тельностью к серину. Фосфо глицерзтдегидрогеназа (PGO) кодируется геном ser А. Последовательность ser А-гена дикого типа известна (Tobey К L, Grant G.A., 1986, J. Вас. 261, N 26, 1279-1283). Сверхэкспрессия продукта, вырабатываемого ser А-геном дикого типа, через плазмидный вектор также известна (Schuller и др., 1989 , J. Biol. Chem, 264 , 26452648). Получение устойчивых к регуляции по типу обратной связи ser А-аллелей с помощью классических генетических способов описывается у Tosa Т, Piger L.T., 1971, J. Вас. 106, №3, 972-982 При этом селекцию осуществляют через резистентность мутантов по отно шению к аналогу серина серии гид роксамату. Мутации в этом литературном источнике подробнее не охарактеризоаываются; влияние мутации на метаболизм не исследуется. Устойчивые к регуляции по типу обратной связи ser А-аллели , например, также получают тем, что микроорганизмы подвергают мутагенезу. В качестве мутагенов принимают во внимание УФоблучение и любые химические мутагены, как например этилметансульфонат или N-MeTvm-N'-нитроN-нитроэогуанидин. Дозировку и длительность экспозиции выбранного мутагена определяют обычным способом (Miller J.H. 1972, Experiments in molecular Genetics, Cold Spruig Harbor Laboratories, США, 113-143). Обработанные мутагеном популяции организмов подвергают селекции на клоны с ser А-генами, которые кодируют нечувствительные к серину фоссг,оглицератдегидрогеназы. Например, обработанную мутагеном популяцию инкубируют на тверл.'и среде культи вирования, которая содержит '..-рингидроксамат в достаточном количестве, чтоРм подавлять рост нерезистентных бактерий. PejncreHTHbie клоны испытывают на чувствительность к серину их фосфоглицератдегидрогеназы. Например, вариант осуществления этого способа описывается у Tosa и Ptger, 1972, J. Bad, 100,№3, 972-982. Аллели, которые кодируют нечувствительную к серину фосфоглицератдегидрогеназу, также можно получать с помощью способов генной инженерии. Участок PGD, который способствует регуляции серина, находится в С-концевой области белка. Поэтому вставки, замещения или делеции отдельных или нескольких аминокислот предпочтительно осуществляют в 25% С-концевых аминокислот, PGD-белка, особенно предпочтительно в 50% С-концевых аминокислот PGD-белка. Это приводит к пониженной чувстви тельности PGD к серину Аллели, которые кодируют такие PGDs, получают тем. что изменяют З'-область ser А-гена, который кодирует указанные С-концевые области PGD, Для этой цели неизменный ser А-ген путем применения известных специалисту приемов для получения рекомбинантной ДНК, таких как рестрикция, лигирование и трансформация (Maniatis Т., Fritsch E.F., и Sambrook J., Molecular Cloning; A Laboratory Manual , 1982, Cold Spring Harbor Laboratory), рекомбинируют на векторе клонирования. Специфические изменения в З'-области структурного гена достигается, например, путем приемов сайт-направ пенного мутагенеза. Примеры нечувствительных к серину PGDs, которые пригодны для экспрессии в микроорганизмах с разрегулированным метаболизмом триптофана, приводятся в табл. 1 в виде представленных их С-концевых аминокислотных последовательностей Вплоть до представленной области белковые последовательности ферментов не отличаются от последовательностей дикого типа. Для того чтобы испытывать генные продукты ser А-аллелей на PGD-активность и чувствительность к серину, применяют следующие тесты: PGD-Активность определяют путем обнаружения прямой ипи обратной реакции фермента по методу Mcki trick J.C. и Lewis J Р., 1980, J. Bad., 141 235-245. Активность фермента при этом измеряется без серина и с различными концентрациями серина. Указанный тест пригоден для определения чувствительности к серину любой фосфоглицератдегидрогенээы. Также можно применять любой другой способ измерения PGD-активности. В качестве меры чувстви тельности к серину фермента служит Кгзначение, т.е. концентрации серина, которые подавляют активность фермента на 50% К, -значения и С-концевые аминокислотные последовательности некоторых устойчивых к регуляции по типу обратной связи ser А-аллелей, а также ser А-гена дикого типа (ser AWT) представпены в табл. 1. Для получений предлагаемых согласно изобретению штаммов предпочтительно пригодны ser Л*аллели с К, -значением 100 ц М - 50 мМ Для экспрессии PGD-белков в предлагаемом согласно изобретению штамме можно использовать любой рекомбинантный вектор, который приводит к экспрессии нечувствительного к серину ser А-аллеля. Пригодный для получения предлагаемых в изобретении штаммов рекомбинантный вектор охватывает по меньшей мере ser 32566 А-ген, который кодирует PGD, обладающую пониженной по сравнению с диким типом чувствительностью по отношению к серину, и долю вектора, который автономно реплицируется в реципиентном штамме Примеры векторов, которые эвтономно'реплицируются в Є coll, указаны у Pouwels Р.Н , Enger - Ualk B.E., Brammer WJ, 1985, Cloning Vectors, Elsevier, Амстердам. Такими векторами являются плазмиды с высоким числом копий, например pBR 322, PUC12; плазмиды со средним числом копий, например pACYC1184, 177, плазмиды с низким числом копий, например pSC IOI, векторы-фаги, например М13, Х-векторы. Сравниваемые векторы описываются для большого числа бактерий {например, в европейском патенте №0401735 для коринебактерий и бревибактерий или в С А. 111 (1989) 168588д) Предпочтительно пригодны векторы с числом копий от среднего до низкого, особенно предпочтительны векторы с р15А-репликоном, такие как pACYC184 (АТСС 37033) или рАС1С177 (АТСС 37031). Большое число векторов для других бактерий описано в литературе (Pouwels и др, 1985, Cloning Vectors Elsevier Science Publishers, Амстердам). Пригодные рекомбинэнтные векторы можно получать с помощью стандартных способов для получения рекомбинантной ДНК Эти способы подробно описаны, например, у Maniatis Т., Fntsch E.F., и Sambrook H., 1982, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, США; или Ausubel F.M. и др , 1987, Current Protocols in Molecular Biology, Greene Publishing Associates, США. Получение рекомбинантных векторов, например, возможно благодаря тому, что ДНК донорного организма, который имеет ser А-аллель в хромосоме или на рекомбинантном векторе, кодирующий нечувстви тельную к серину PGD, фрагментируют с помощью рестрикционных ферментов. Фрагментированную ДНК легируют с помощью обычных методов, например п 7тем использования фермента Т4-ДНК-лигазы, с также переведенной в линейную форму с помощью рестрикционных ферментов векторной молекулой. Смесь после легирования используют для того, чтобы трансформировать реципиентные штаммы с разрегулированным метаболизмом триптофана известными способами, такими как кальцийхлоридный шок или электропорация Векторы, которые содержат желательные ser А-аллели, могут получаться в реципиентных штаммах, например, благодаря вышеуказанным способам, например селекции на резистентность к антибиотикам или комплементирование ser А-мутаций В следующем варианте осуществления предлагаемых согласно изобретению штаммов ser А-аллели интегрируют в виде единичных копий в хромосомы. Это может достигаться, во-первых, благодаря тому, что вышеописанные стратегии в отношении мутагенеза и селекции осуществляют с помощью триптофанразрегулированного исходного штамма. Во-вторых, также можно ser А-аллели, которые находятся на рекомбинантных векторах, инте грирова ть в хромосом у продуцир уемо го штамма Число методов для такой интеграции известно Описания этих способов (приемов) см в следующи х публикациях Интеграция через посредство Lambda - фагов- Balakrishnan и Backmann. 1998, Gene, 67. 97103, Simons R W и др 1987, Gene, 53, 85-89; гее D-эависиыая замена гена. Shervell и др , 1987, J. Bact, 141, 235-245, другие методы. Sflhavy и др., 1988, Experiments with Gene Fusions. Cold Spring Harbor Laboratory При ферментации предлагаемых согласно изобретению штаммов оказалось, что штаммы, содержащие устойчивый к регуляции по типу обратной связи ser А-аллель с К,-значением для серина от 100 цМ до 50 мМ и с разрегулированным метаболизмом триптофана и содержащие trp Е-аллепь с Ki-значением для триптофана 0,1 мМ - 20 мМ, дают самый высокий выход триптофана Пример 1. Скрининг устойчивых к регуляции по типу обратной связи trp Е-аллелей и интеграция этих аллелей в хромосому Для поиска устойчивых к регуляции по типу обратной связи frpE-аллелей используют триптофан-аналог 5-метилтриптофэн В качестве мутагенного агента служит Ы-метил-М'-нитро-М-нитроэо- гуанидин (NG). Используемым исходным штаммом является Ecoli K12 УМС9 АТСС 33927. При осуществлении мутагенеза руководствуются указаниями Miller (Miller J H. 1972, Experiments in Molecular Genetics, Cold Spring Harbor Laboratory, Cold Spring Harbor Нью-Йорк, 125-129) Примерно 2 109 клеток УМС9 из экспоненциальной фазы роста культуры, выращи ваемой в LB, помещенных в 4 мл 0.1 М натрийцитратного буфера с рН 5,5, инкубируют в течение 30 мин при 37°С с 50 мкг/мл NG После двухкратной промывки с помощью 0,1 М фосфатного буфера с рН 7,0, 0,1 мл клеток выдерживают в течение ночи при 37°С при встря хивании в LB 3 Затем 0,1 мл клеток из 1 1СГ в 0.9% различных разбавлений (10 NaCI) наносят на пластины с минимальной средой со 100 мкг/мл 5-метилтриптофана. Наряду с 5-метилтриптофаном минимальная среда содержит 5 г/л глюкозы. 5 мг/л витамина Вь 3 г/л КН2РО4 , 12 г/л КгНРО4; 0,3 г/л MgSCU 7НгО; 0,1 г/л NaCJ, 5 г/л {NH4hSCy, 14,7 мг/л СаСІг 2Н2О, 2 мг/л FeSO 4 x х 7Н;О; 1 г/л Ыа э-цитрата и 15 г/л агара. Спустя 24—48ч выдерживания при 37°С субхультивируются резистентные 5- метилтриптофану клоны и разъединяются на вышеуказанных пластинах. Для характеристики полученных мутантов определяют Кі-значение для вырабатываемого trpE-геном продукта триптофана (Bauerle R и др., 1987, Methods m Enzymology, 142, 366-386) При этом мутанты можно подразделять на два класса. Мутанты класса 1 включают устойчивые к регуляции по типу обратной связи антранилатсинтаэы. Мутанты класса 2 включают ферменты с повышенной антранилатсинтазаактивностью при неизменном Кі-значении. Для охарактериэования на молекулярном уровне соответствующие ДНК-области различных мутантов клонируют и секвенируют. Для этой цели соответствующую хромосомную ДНК изолируют и расщепляют в смеси с рестрикционными фермен 32566 тами Nhel и Clal. Фрагменты величиной примерно 5 к.в. (тысяч пар оснований) изолируют и лигируют с размером 4158 п о (комплементарных пар гетероциклических оснований ДНК) Nhet/Claf - фрагментом pBR 322. Легированную смесь трансформируют в trpE-штамм Ecoli KB 862 {DSM 7196). Селектируют на клоны, которые могут расти на минимальной среде без триптофана. Все комплементирующие плазмиды содержат величиной 5 к.в. Nhe !/СІа!-фрагмент. Наряду с trpE- и trpD-reнами этот размером 5 к в Nhel/Clal-фрагмент содержит также ДНК-области, идущие вверх от trpE (примерно 0,8 к в ) и вниз от irpD (примерно 1 к в.). В табл. 2 перечислены различия аминокислотных последовательностей и Ki-эначения мутанто в класса 1. В непредставленных областях последовательности мутантов совпадают с последовательностью дикого типа. Анализ на секвенирование мутантов класса 2 показывает, что мутации имеют место либо в области оператора trp-промотора, либо в ДНК-области, которая кодирует trp-лидерный-пептид. Обозначаемые с помощью AtrpL I и соответственно AtrpL2 мутации имеют 136 п.о и соответственно 110 п.о. - депецию в ДНК-области, которая кодирует лидерный пептид В случае Atrpl-1 мутации делеция охватывает область от нуклеотидной позиции 3 3 впло ть до поз иции 168 , в случае AtrpL2 мутации - область от н уклеотидиой позиции 11 до позиции 120 в хранящейся под АС-номером V 00372 в EMBL-банке данных последовательности. Для того чтобы достичь более сильной экспрессии устойчивых к регуляции по типу обратной связи trp Е-аллелей, комбинируют оба класса мута н то в. Для этой це ли п риме няют м утацию AtrpLI класса 2. На фиг. 6 схематически представлено положение Atrp L1-мутации (класс 2} и мутаций trp E0, trp E5, trp E6 и trp E8 (класс 1). Из плазмиды pAtrPL (фиг. 6) выделяют размером 1,6 к.в. Nrul-фра гмент, которы й несе т AtrpLI -мутацию, и обменивают на соответствующий Nrul-фрагмент дикого типа плазмид рЕО, рЕ5, рЕ6, соответственно, рЕ8 (фиг 6). Полученные плазмиды обозначают plEO, plE5, р!Е6, соответственно р1Е8 и применяют для хромосомной интеграции путем гомологичной рекомбинации. Для этой цели из указанных плазмид выделяют соответствующий, величиной примерно 5 кв., хромосомный Nhel / Clal-фрагмент, такой как описан в примере 2, из агарозы с низкой температурой плавления и трансформируют » линейной форме в recD - штамм PD 106 ( Atrp LD 102). В качестве метода трансформации используют СаСІг-метод согласно Cohen и др., 1972, Ргос. Natl. Acad. Sci., USA 69, 2110-2114. Штамм PD 106 депонирован со гла сно будап е штском у со гла шен ию о т 28.07.1992 в немецкой коллекции микроорганизмов (DSM) под номером 7195 (DSM 7195) Селекционируют на клоны, которые могут расти на минимальной среде без триптофана и чувствительны к ампициллину, т.е. свободны от плазмиды. Благодаря Р1-трансдукции ((Miller J.H. 1972, Experiments in Molecular Genetics. Cold Spring Harbor, Нью-Йорк, 201-205) trpE-аллели, которые кодируют различно устойчивые в регуляции по типу обратной связи trpE-ферменты и, смотря по обс тоя тельствам, скомбиниро ваны с Atrp LI-м утацией, из соответствующи х штаммов переводятся в KB 862 Штамм KB 862. согласно будапештскому соглашению от 28.07.1992 г., депонирован в немецкой коллекции микроорганизмов (DSM) под номером 7196 (DSM 7196). Селекцию осуществляют при выращивании на свободной от тритофана минимальной среде/ Полученные штаммы обозначают как PD 103 (trp ЕО). KB 862 (trp E5), SV 164 (trp E8) и SV 163 (trp E6). Пример 2. Получение ser А-генов, которые кодируют нечувстви тельные к серину фосфоглицерзтдегидрогенаэы. Ser А-ге н дико го типа из E.C oli - штамма Е colt В (АТСС 23226) клонируют на плазмидном векторе pUC 18. Для того чтобы получить хромосомную ДНК это го штамма, его выра щивают в течение ночи при 37°С в питательной среде Пуриа. Клетки бактерий собирают путем центрифугирования (4000 д). Лизис клеток и очистку ДНК осуществляют согласно протоколу, описанному Ausubel и др., 1987,2.4.1 - 2 4.2, Current Protocols in Molecular Biology, Creene Publishing Associates. Полученное количество ДНК определяют спектрофотометрически при длине волны 260 нм. Выходы составляют 600 мкг/100 мл. 10 мкг хромосомной ДНК расщепляют с пом о щью р е стрик цио нн о го фе рме н та Sph l (Boehnnger Mannheim GmbH) при указанных изготовителем условия х. Примерно 3 мкг смеси фрагментов лигируют с 0,2 мкг также Sphl-раэрезанно-го автономного реплицируемого плазмидного вектора pUC18 (фирма Boehnnger Mannheim GmbH) 1 за счет фермента Т4-лигазы (фирма Boehnnger Mannheim GmbH) при предписанных изготовите лем условия х Ли гированн ую смесь используют для того, чтобы трансформировать ser А-мутанты PC 1523 (CGSC # : 5411) (CGSC E.coli Geneti c Stock Centre, Department ot Biology 255 OML, Jale University, Postbox 6666, New Ha ven, CT, USA). В качестве способа трансформации применяют СаСІ2-метод Cohen и др., 1972, Ргос. Natl. Acad. Sci., США, 69, 2110-2114. Трансформированные бактерии высевают на минимальную среду без серина. Клоны, которые растут без серина, содержат ser А-ген из Е coli на 3,5 к.в. Sphl-фрагмента. Последовательность дикого типа Ser А-гена воспроизведена на фиг. 7-9 (SEQ ID N 13; SEQ ID N 14). Рекомбинантный вектор с ser А-геном обозначен какрССЗ(фиг. 10). ser А-Аллель ser A5 получают тем, что ллаэмиду pGC3 разрезают с помощью рестрикционных фе рмен то в Sail ' и Kpnl (фирма Bo ehringe r Mannheim GmbH), согласно указаниям изготовителя. Полученные фрагменты разделяют путем электрофореза на геле агарозы. Sail - КрпІ-Фрагмент величиной 2,0 к.в , который содержит полный ser А-ген вплоть до 8 С-концевого кодона, выделяют очищенным из геля. Для этой цели проводят электрофорез на "низкоплавкой" агарозе (фирма Boehringer Mannheim GmbH) так, что ДНК можно извлечь путем простого расплавления агарозы. 0,2 мкг этого фрагмента лигируют с эквимолекулярными количествами Hindll! / Sail - разрезанного pUC18 и синтетически полученного двунитевого олигон уклеоти да с помощью Т 4-лига эы (фирма 6 32566 Boehnnger Mannheim GmbH) согласно указаниям изготовителя Нуклеотидчая последовательность этого олигонуклеотида следующая 1 З CATTCGCGCCCGTCTGCTGTAATA CTAGGTAAGCGCGGGC AGAC GACATTATT C GA SEQ IDNO11 3' 5' 5' Этот олигонуклеотид дополняет 7 и 8 последних С-концевых кодонов ser А генов Вместо восьмого кодона вводится Stop-триплет ТАА Кодированная с помощью этого ser А-гена фосфоглицератдегидрогенада таким образом сокращается на одну С концевую аминокислоту Аминокислотная последовательность измененной PGD представлена в табл 1 (ser A5) Рекомбинантная плазмида обозначается как pGH5 (фиг 11) С помощью лигированной смеси трансформируют ser А-мутанты PCI523 ser А-Аллель ser AI508 получают следующим образом Плазмиду pGC3 разрезают с помощью Sphl / Sail (фирма Boehnnger Mannheim GmbH) согласно указаниям изготовителя Фра гмент величиной 3 к в , который несет полный ser А-ген, очищают электрофоретичесш и лигируют с разрезанным с помощью Sphl / Salt вектором pUC 18 Полученная в результате плазмида обозначается как рКВ1321 (фиг 12) рКВ!321 с рестрикционной эндонуклеазой Hind И (фирма Boehnnger Mannheim GmbH) инкубируют в условиях, которые позволяют осуществлять только частичное разрезание (0,05 ед фермента на 1 мкг ДНК в течение 10 мин, остальные реакционные условия согласно указаниям изготовителя) Благодаря этому образуется фракция фрагменто в, которая разрезана в позиции 1793 ser А-гена с помощью Hind II В этот сайт путем лигирования вводят ДНК-линкер с ХЬаі-сайтом Последовательность ДНК-линкера следующая 1 5' З TGCTCTAGAGC A ACGAGATCTCGT SEQ ID NO 12 З' 5і Вставка приводит к PGD, которая на этом участке содержит 4 дополнительные аминокислоты Ее последовательность предс
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for obtaining strain of microorganism, a method for producing tryptophan
Автори англійськоюWich Gunter, Leinfelder Walfred, Bakman Kait
Назва патенту російськоюСпособ получения штамма микроорганизма, способ продуцирования триптофана
Автори російськоюВих Гюнтер, Лайнфельдер Вальфред, Бакман Кайт
МПК / Мітки
МПК: C12P 13/22, C12N 15/00, C12R 1/19, C12N 1/21
Мітки: спосіб, штаму, мікроорганізму, триптофану, продукування, одержання
Код посилання
<a href="https://ua.patents.su/24-32566-sposib-oderzhannya-shtamu-mikroorganizmu-sposib-produkuvannya-triptofanu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання штаму мікроорганізму, спосіб продукування триптофану</a>
Попередній патент: Горілка “ххі век”
Наступний патент: Анкерно-кутова опора лінії електропередачі
Випадковий патент: Шахтна неперекидна кліть для транспортування довгомірних матеріалів