Похідні індолу, фармацевтична композиція і спосіб лікування
Формула / Реферат
1. Производные индола формулы I
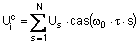 , І
, І
в которой:
Z представляет собой
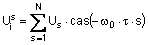 ;
;
R1 представляет собой
![]() ,
, 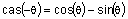 ,
, 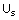
Х представляет собой О, NH или S;
А, В, D, Е и F каждый независимо представляет собой С, N, О или S;
r2, r3, R4, r5 и R6 каждый независимо представляет собой водород, (С1-С6)-алкил, арил, (С1-С3)-алкиларил, галоген, циано-, нитро-, -NR7R8, -(CH2)mOR9, -SR9, -SО2R9, -SО2NR7R8, -NR7SО2R8, -NR7CО2R9, -NR7COR9,
-CONR7R8 или -CО2R9;
одна из пар R2 и r3, r3 и R4, R4 и R5 или R5 и R6 могут быть взяты вместе, образуя пяти-семичленное алкильное кольцо, шестичленное арильное кольцо, пяти-семичленное гетероалкильное кольцо, содержащее 1 гетероатом из N, О или S, или пяти- или шестичленное гетероарильное кольцо, содержацее 1 или 2 гетероатома из N, О или S;
r7 и R8 каждый независимо представляет собой водород, (С1-С6)-алкил, -(CH2)qR10, (С1-С3)-алкиларил, арил, или R7 и R8 могут быть взяты вместе, образуя четырех-шестичленное кольцо;
R9 представляет собой водород, (С1-С6)-алкил, (С1-С3)-алкиларил, арил, или -(CH2)wR11;
r10 и r11 каждый независимо представляет собой -ОН, -OR12, -CО2R12, -CONHR12 или цианогруппу;
R12 представляет собой водород, (С1-С6)-алкил, арил или (С1-С6)-алкиларил;
r13 представляет собой водород, -OR14 или –NHCOR14;
R14 представляет собой (С1-С6)-алкил, (С1-С3)-алкиларил;
n равен 0,1 или 2;
m равен 1,2 или 3;
q равен 2,3 или 4;
w равен 2, 3 или 4;
вышеупомянутые арильные группы и арильные части вышеупомянутых алкиларильных групп независимо представляют собой фенил или замещенный фенил, при этом упомянутый замещенный фенил может быть замещен одним-тремя (С1-С4)-алкилами, галогенами, гидроксилами, цианогруппами, карбоксамидогруппами, нитрогруппами и (С1-С4)-алкоксигруппами; и
прерывистая линия означает необязательную двойную связь;
и его фармацевтически приемлемые соли.
2. Соединение по п. 1, отличающееся тем, что R1 представляет собой
![]() ,
, 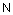 ,
,
где r7, r8 и r13 имеют значения, определенные в п. 1.
3. Соединение по п. 2, отличающееся тем, что Z представляет собой
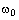 или
или 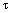
где А, D, Е, R2, R3, R4 и R5 имеют значения, определенные в п. 1,
и Х представляет собой Nh.
4. Соединение по п. 3, отличающееся тем, что r1 представляет собой
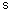
где r7 и r13 имеют значения, определенные в п. 1.
5. Соединение по п. 4, отличающееся тем, что r13 представляет собой водород.
6. Соединение по п. 4, отличающееся тем, что Z представляет собой
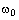
где А, D, Е, R2, R3, R4 и R5 имеют значения, определенные в п. 1, и Х представляет собой NН.
7. Соединение по п. 2, отличающееся тем, что r1 представляет собой
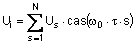
где r7 и r13 имеют значения , определенные в п.1.
8. Соединение по п. 7, отличающееся тем, что r13 представляет собой -OR14 и r14 представляет собой -СН3.
9. Соединение по п. 7, отличающееся тем, что Z представляет собой
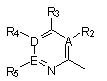 ,
,
где А, D, Е, R2, R3, R4 и R5 имеют значения, определенные в п. 1, и Х представляет собой NН.
10. Соединение по п. 3, отличающееся тем, что Z представляет собой
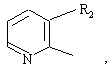
где R2 представляет собой NO2, СN, SO2CH3, SO2Ph, CONH2, и X представляет собой NН.
11. Соединение по п. 10, отличающееся тем, что R1 представляет собой
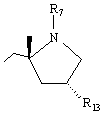 ,
,
где r7 и r13 имеют значения, определенные в п. 1.
12. Соединение по п. 1, представляющее собой соединение из перечисленных ниже соединений:
3-(2-диметиламиноэтил)-5-(3,5-динитропирид-2-иламино) -1H-индол;
3-(2-диметиламиноэтил)-5-(3-нитропирид-2-иламино)-1H-индол;
3-(2-диметиламиноэтил)-5- (3-трифторметилпирид-2-иламино) -1H-индол;
(r)-5-(3-нитропирид-2-иламино) -3-(пирролидин-2-илметил)-1H-индол;
(r)-3-(N-метилпирролидин-2-илметил)-5-(нитропирид-2-иламино)-1H-индол;
(R,S)-3-(N -метилпирролидин-3-ил)-5-(3-нитропирид-2-иламино)-1H-индол;
5-(бензоксаз-2-иламино) -3-(2-диметиламиноэтил)-1H-индол;
(r)-3-(N-циклопропилметилпирролидин -2-илметил)-5-(3-нитропирид-2-иламино)-1H-индол;
(r)-5-(3-нитропирид-2-иламино)-3-(N-(2 пропинил)пирролидин-2-илметил)-1H-индол;
(r)-5-(3-нитропирид-2-иламино)-3-(N-(2-пропенил)пирролидин-2-илметил)-1H-индол;
(r)-5-(3-нитропирид-2-иламино)-3-(N -пропилпирролидин-2-илметил)-1H-индол;
(r)-3-(N бутилпирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1H-индол;
(R)-3-(N-этилпирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1H-индол;
(R)-5-(3-нитропирид-2-иламино)-3-( N -пентилпирролидин-2-илметил)-1H-индол;
(R)-3-(N-( 2-метоксиэтил) пирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1H-индол;
(R)-3-(N-(2-цианоэтил)пирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1H-индол;
(R)-3-(N(2-цианометил)пирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1H-индол;
5-(4-бензил-1,3-тиаз-2-иламино)-3-( 2-диметиламиноэтил)-1H-индол;
(R)-5-(3-бензилтио-1,2,4-тиадиаз-5-иламино) -3-(N -метилпирролидин-2-илметил)-1H-индол;
3-(2-диметиламиноэтил)-5-(пиримид-2-иламино)-1H-индол;
3-(2-диметиламиноэтил)-5-(3-метилсульфонилпирид-2-иламино)-1H-индол;
(R)-3-(N-метилпирролидин-2-илметил)-5-(2-нитрофениламино) -1H-индол;
(R)-5-(6-метокси-3-нитропирид-2-иламино) -3- (N -метилпирролидин-2-илметил) -1H-индол;
(R)-5-(4-метил-3-нитропирид-2-иламино)-3-(N-метилпирролидин-2-илметил)1H-индол;
(R)-3-(N метилпирролидин-2-илметил)-5-(3-нитро-5-фенилпирид-2-иламино)-1H-индол;
(R)-5-(3-цианопирид-2-иламино )-3-(N -метилпирролидин-2-илметил)-1H-индол;
(R)-5-(6-изопропокси-3-нитропирид-2-иламино)-3-(N-метилпирролидин-2-илметил)-1H-индол;
(R)-5-(4-циано-2-нитрофениламино)3-(N-метилпирролидин-2-илметил) -1H-индол;
(R)-3(N-метилпирролидин-2-илметил) -5-( 4-трифторметил-2-нитрофениламино) -1H-индол;
(R)-5-(5,6-дихлор-2-нитрофениламино)-3-(N -метилпирролидин-2-илметил) -1H-индол;
5-(4-циано-2-нитрофениламино)-3-[(2R, 4R)-N-метил-4-метоксипирролидин-2-илметил]-1H-индол;
5-(4-бензил-1,3-тиаз-2-иламино)-3-(2-диметиламиноэтил)-1H-индол;
(R)-5-(3-бензилтио-1,2,4-тиадиаз-5-иламино)-3-(N-метилпирролидин-2-илметил)-1H-индол; и
(R)-5-(5-хлор-2-нитрофениламино)-3-(N метилпирролидин-2-илметил)-1H-индол.
13. Фармацевтическая композиция для лечения состояния, выбранного из гипертензии, депрессии, страха, пищевых расстройств, ожирения, токсикомании, "гистаминовой" головной боли, мигрени, боли и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми расстройствами, отличающаяся тем, что содержит соединение по п. 1 в количестве, эффективном для лечения такого состояния, и фармацевтически приемлемый носитель,
14. Фармацевтическая композиция для лечения расстройств, являющихся следствием дефицитной серотонинергической нейротрансмиссии, отличающаяся тем, что содержит соединение по п. 1, в количестве, эффективном для лечения такого расстройства, и фармацевтически приемлемый носитель.
15. Способ лечения состояния, выбираемого из гипертензии, депрессии,страха, пищевых расстройств, ожирения, токсикомании, "гистаминовой" головной боли, мигрени, боли и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми расстройствами, отличающийся тем, что вводят млекопитающему, нуждающемуся в таком лечении, соединение по п. 1, в количестве, эффективном для лечения такого состояния.
16. Способ лечения расстройств, являющихся следствием дефицитной серотонинергической нейротрансмиссии, отличающийся тем, что вводят млекопитающему, нуждающемуся в таком лечении, соединение по п. 1 в количестве, эффективном для лечения такого состояния.
Текст
1. Производные индола формулы I R4 D R5 E B A R2 R2 B R3 F D R6 A E R4 или R5 ; R1 представляет собой R7 N R7 N NR 7R 8 , , или C2 R3 (13) в которой: Z представляет собой 41297 I Х представляет собой О, NH или S; А, В, D, Е и F каждый независимо представляет собой С, N, О или S; R2, R3, R4 , R5 и R6 каждый независимо представляет собой водород, (С1-С6)-алкил, арил, (С1-С3)алкиларил, галоген, циано-, нитро-, -NR7R8, -(CH2)mOR9, -SR9, -SО 2R9, -SО 2NR7R8, -NR7SО2R8, -NR7CО2R9, -NR 7COR9, -CONR7R8 или -CО2R9 ; одна из пар R2 и R3, R3 и R4, R4 и R5 или R5 и R6 могут быть взяты вместе, образуя пяти-семичленное алкильное кольцо, шестичленное арильное кольцо, пяти-семичленное гетероалкильное кольцо, содержащее 1 гетероатом из N, О или S, или пяти- или шестичленное гетероарильное кольцо, содержащее 1 или 2 гетероатома из N, О или S; R7 и R8 каждый независимо представляет собой водород, (С1-С6)-алкил, -(CH2)qR10, (С1-С3)-алкиларил, арил, или R7 и R8 могут быть взяты вместе, образуя четырех-шестичленное кольцо; R9 представляет собой водород, (С1-С6)-алкил, (С1-С3)-алкиларил, арил или -(CH2)wR11; R10 и R11 каждый независимо представляет собой -ОН, -OR12, -CО 2R12 , -CONHR12 или цианогруппу; R12 представляет собой водород, (С1-С6)-алкил, арил или (С1-С6)-алкиларил; R13 представляет собой водород, -OR14 или -NHCOR14; R14 представляет собой (С1-С6)-алкил, (С1-С3)-алкиларил; n равен 0, 1 или 2; m равен 1, 2 или 3; q равен 2, 3 или 4; w равен 2, 3 или 4; вышеупомянутые арильные группы и арильные части вышеупомянутых алкиларильных групп независимо представляют собой фенил или замещенный фенил, при этом упомянутый замещенный фенил может быть замещен одним-тремя (С1-С4)-алкилами, галогенами, гидроксилами, циа (11) , ; UA R 13 (19) NH N * ()n R1 X Z H 41297 ногруппами, карбоксамидогруппами, нитрогруппами и (С1-С4)-алкоксигруппами; и прерывистая линия означает необязательную двойную связь; и его фармацевтически приемлемые соли. 2. Соединение по п. 1, отличающееся тем, что R1 представляет собой 7. Соединение по п. 2, отличающееся тем, что R1 представляет собой R7 N R7 R 13 N NR 7R 8 , где R7 и R13 имеют значения, определенные в п. 1. 8. Соединение по п. 7, отличающееся тем, что R13 представляет собой -OR14 и R14 представляет собой -СН3. 9. Соединение по п. 7, отличающееся тем, что Z представляет собой или R7 H N * ()n R3 R 13 R4 , где R7, R 8 и R13 имеют значения, определенные в п. 1. 3. Соединение по п. 2, отличающееся тем, что Z представляет собой R5 R3 R5 A D E R3 R2 E N A R5 R4 или N , где А, D, Е, R2, R3, R 4 и R5 имеют значения, определенные в п. 1, и Х представляет собой NH. 4. Соединение по п. 3, отличающееся тем, что R1 представляет собой , где R2 представляет собой NO2, СN, SO2CH3, SO2Ph, CONH 2, и X представляет собой NН. 11. Соединение по п. 10, отличающееся тем, что R1 представляет собой R7 H R7 N N R 13 R 13 , где R7 и R13 имеют значения, определенные в п. 1. 5. Соединение по п. 4, отличающееся тем, что R13 представляет собой водород. 6. Соединение по п. 4, отличающееся тем, что Z представляет собой R5 A D E N , где R7 и R13 имеют значения, определенные в п. 1. 12. Соединение по п. 1, представляющее собой соединение из перечисленных ниже соединений: 3-(2-диметиламиноэтил)-5-(3,5-динитропирид-2иламино)-1H-индол; 3-(2-диметиламиноэтил)-5-(3-нитропирид-2иламино)-1H-индол; 3-(2-диметиламиноэтил)-5-(3-трифторметилпирид-2-иламино)-1H-индол; (R)-5-(3-нитропирид-2-иламино)-3-(пирролидин2-илметил)-1H-индол; (R)-3-(N-метилпирролидин-2-илметил)-5-(нитропирид-2-иламино)-1H-индол; (R,S)-3-(N-метилпирролидин-3-ил)-5-(3-нитропирид-2-иламино)-1H-индол; R3 R4 , R2 D E N R2 A D где А, D, Е, R2, R3, R 4 и R5 имеют значения, определенные в п. 1, и Х представляет собой NН. 10. Соединение по п. 3, отличающееся тем, что Z представляет собой R2 R4 , R2 , где А, D, Е, R2, R3, R 4 и R5 имеют значения, определенные в п. 1, и Х представляет собой NН. 2 41297 5-(бензоксаз-2-иламино)-3-(2-диметиламиноэтил)-1H-индол; (R)-3-(N-циклопропилметилпирролидин-2илметил)-5-(3-нитропирид-2-иламино)-1H-индол; (R)-5-(3-нитропирид-2-иламино)-3-(N-(2-пропинил)пирролидин-2-илметил)-1H-индол; (R)-5-(3-нитропирид-2-иламино)-3-(N-(2-пропенил)пирролидин-2-илметил)-1H-индол; (R)-5-(3-нитропирид-2-иламино)-3-(N-пропилпирролидин-2-илметил)-1H-индол; (R)-3-(N-бутилпирролидин-2-илметил)-5-(3нитропирид-2-илметил)-1H-индол; (R)-3-(N-этилпирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1H-индол; (R)-5-(3-нитропирид-2-иламино)-3-(N-пентилпирролидин-2-илметил)-1H-индол; (R)-3-(N-(2-метоксиэтил)пирролидин-2-илметил) -5-(3-нитропирид-2-иламино)-1H-индол; (R)-3-(N-(2-цианоэтил)пирролидин-2-илметил)-5(3-нитропирид-2-иламино)-1H-индол; (R)-3-(N(2-цианометил)пирролидин-2-илметил)5-(3-нитропирид-2-иламино)-1H-индол; 5-(4-бензил-1,3-тиаз-2-иламино)-3-(2-диметиламиноэтил)-1H-индол; (R)-5-(3-бензилтио-1,2,4-тиадиаз-5-иламино)-3(N-метилпирролидин-2-илметил)-1H-индол; 3-(2-диметиламиноэтил)-5-(пиримид-2-иламино)1H-индол; 3-(2-диметиламиноэтил)-5-(3-метилсульфонилпирид-2-иламино)-1H-индол; (R)-3-(N-метилпирролидин-2-илметил)-5-(2-нитрофениламино)-1H-индол; (R)-5-(6-метокси-3-нитропирид-2-иламино)-3-(Nметилпирролидин-2-илметил)-1H-индол; (R)-5-(4-метил-3-нитропирид-2-иламино)-3-(Nметилпирролидин-2-илметил)-1H-индол; (R)-3-(N-метилпирролидин-2-илметил)-5-(3нитро-5-фенилпирид-2-иламино)-1H-индол; (R)-5-(3-цианопирид-2-иламино)-3-(N-метилпирролидин-2-илметил)-1H-индол; (R)-5-(6-изопропокси-3-нитропирид-2-иламино)3-(N-метилпирролидин-2-илметил)-1H-индол; (R)-5-(4-циано-2-нитрофениламино)3-(Nметилпирролидин-2-илметил)-1H-индол; (R)-3-(N-метилпирролидин-2-илметил)-5-(4трифторметил-2-нитрофениламино)-1H-индол; (R)-5-(5,6-дихлор-2-нитрофениламино)-3-(Nметилпирролидин-2-илметил)-1H-индол; 5-(4-циано-2-нитрофениламино)-3-[(2R,4R)-Nметил-4-метоксипирролидин-2-илметил]-1Hиндол; 5-(4-бензил-1,3-тиаз-2-иламино)-3-(2-диметиламиноэтил)-1H-индол; (R)-5-(3-бензилтио-1,2,4-тиадиаз-5-иламино)-3(N-метилпирролидин-2-илметил)-1H-индол; и (R)-5-(5-хлор-2-нитрофениламино)-3-(N-метилпирролидин-2-илметил)-1H-индол. 13. Фармацевтическая композиция для лечения состояния, выбранного из гипертензии, депрессии, страха, пищевы х расстройств, ожирения, токсикомании, "гистаминовой" головной боли, мигрени, боли и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми расстройствами, отличающаяся тем, что содержит соединение по п. 1 в количестве, эффективном для лечения такого состояния, и фармацевтически приемлемый носитель. 14. Фармацевтическая композиция для лечения расстройств, являющи хся следствием дефицитной серотонинергической нейротрансмиссии, отличающаяся тем, что содержит соединение по п. 1 в количестве, эффективном для лечения такого расстройства, и фармацевтически приемлемый носитель. 15. Способ лечения состояния, выбираемого из гипертензии, депрессии, страха, пищевых расстройств, ожирения, токсикомании, "гистаминовой" головной боли, мигрени, боли и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми расстройствами, отличающийся тем, что вводят млекопитающему, н уждающемуся в таком лечении, соединение по п. 1 в количестве, эффективном для лечения такого состояния. 16. Способ лечения расстройств, являющихся следствием дефицитной серотонинергической нейротрансмиссии, отличающийся тем, что вводят млекопитающему, нуждающемуся в таком лечении, соединение по п. 1 в количестве, эффективном для лечения такого состояния. Настоящее изобретение относится к производным индола, к способам и промежуточным соединениям для их получения, к фармацевтическим композициям, содержащим производные индола, и к их применению в медицине. Активные соединения настоящего изобретения пригодны для лечения мигрени и других нарушений. Патенты США № 4839377 и № 4855314 и публикация заявки на Европейский патент № 313397 относятся к 5-замещенным 3-аминоалкилиндолам. Сообщается, что соединения пригодны для лечения мигрени. Заявка на патент Великобритании 040279 относится к 3-аминоалкил-1Н-индолтиоамидам и карбоксамидам. Сообщается, что соединения пригодны для лечения гипертензии, болезни Рейно и мигрени. Публикация заявки на Европейский патент № 303506 относится к 3-полигидропиридил-5-замещенным-1Н-индолам. Сообщается, что соединения являются агонистами 5НТ1-рецептора, обладают сосудосужающей активностью и пригодны для лечения мигрени. Публикация заявки на европейский патент № 354777 относится к N-пиперидинилиндолилэтилалкансульфонамидным производным. Сообщается, что соединения являются агонистами 5НТ1-рецептора, обладают сосудосужающей активностью и пригодны для лечения головной боли. Краткое изложение сути изобретения. Настоящее изобретение относится к соединениям формулы I: 3 41297 R1 X Z NH , R12 представляет водород, (С1-С6) алкил, арил или (C1-C6) алкиларил; R13 представляет водород, -OR14 или - NHCOR 14 ; R14 представляет (С1-С6)алкил или (С1-С3) алкиларил; n равно 0, 1 или 2; m равно 1, 2 или 3; q равно 2, 3 или 4; w равно 2, 3 или 4; указанные арильные группы и арильные фрагменты указанных алкиларильных групп независимо представляют собой фенил или замещенный фенил, и указанный замещенный фенил может быть замещен одним-тремя (С1-С4) алкилами, галогеном, гидроксигруппами, цианогруппами, карбоксамидогруппами, нитрогруппами и (C1-С4) алкоксигруппами; а прерывистая пиния обозначает необязательную двойную связь; и к их фармацевтически приемлемым солям. Указанные соединения пригодны для лечения мигрени и других состояний, которые обсуждаются ниже. Соединения изобретения включают все оптические изомеры формулы I (например, все R- и Sэнантиомеры) и их рацемические и диастереомерные смеси. Когда R1 представляет: I в которой Z представляет: R3 R4 D R5 E B A R2 R2 B R3 F D R6 A E R4 или R5 R1 представляет: R7 N R7 N NR 7R 8 , , R7 или H R7 H N N * ()n R 13 * ()n предпочтительны R-диастереомеры с хиральным атомом углерода, отмеченным *. Когда R13 представляет -OR14 или –NHCOR14, особенно предпочтительны цис-эпимеры (абсолютная конфигурация (2R, 4R)). Если нет других указаний, алкильные группы, которые здесь указаны, так же как и алкильные фрагменты других гр упп, которые здесь упоминаются (например, алкоксигрупп), могут быть линейными или разветвленными, и они также могут быть циклическими (например, циклопропилом, циклобутилом, циклопентилом или циклогексилом), или быть линейными или разветвленными и содержать циклические части. Предпочтительными соединениями настоящего изобретения являются соединения формулы I, в которых R1 представляет: R 13 X представляет О, NH или S; А, В, D, Е и F, каждый независимо, представляет собой С, N, О или S; R2, R3, R4 , R5 и R6 , каждый независимо, представляет собой водород, (С2-С6)алкил, арил, (С1-С3)алкиларил, галоген (например, фтор, хлор, бром или иод), цианогруппу, нитрогруппу, -NR7R8, -(CH2)mOR9, -SR9, -SО 2R9, -SО 2NR7R8, -NR7SО2R8, -NR7CО2R9, -NR7COR9, -CONR7R8 или CО2R9; образующие одну и х пар R2 и R3, R3 и R4, R4 и R5 или R5 и R6, взятые вместе, могут образовывать пятисемичленное алкильное кольцо, шестичленное арильное кольцо, пяти-семичленное гетероалкильное кольцо, содержащее 1 гетероатом N, О или S, или пяти-шестичленное гетероарильное кольцо, содержащее 1 или 2 гетероатома N, О или S; R7 и R8, каждый независимо, представляет водород, (С1-С6) алкил, -(CH2)q R10, (С1-С3) алкиларил, арил; или R7 и R8, взятые вместе, могут образовывать четырех-шестичленное кольцо; R9 представляет водород, (С1-С6) алкил, (С1-С3) алкиларил, арил или -(CH2)wR11; R10 и R11, каждый независимо, представляет собой -ОН, -OR12, -CO2R12, -CONHR12 или цианогруппу; R7 N NR 7R 8 4 , , или 41297 R7 H (R)-5-(3-нитропирид-2-иламино)-3-(N-(2-пропинил)пирролидин-2-илметил)-1Н-индол; (R)-5-(3-нитропирид-2-иламино)-3-(N-(2-пропенил)пирролидин-2-илметил)-1Н-индол; (R)-5-(3-нитропирид-2-иламино)-3-(N-(2-пропилпирролидин-2-илметил)-1Н-индол; (R)-3-(N-бутилпирролидин-2-илметил)-5-(3нитропирид-2-иламино)-1Н-индол; (R)-3-(N-этилпирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1Н-индол; (R)-5-(3-нитропирид-2-иламино)-3-(N-(2-пентилпирролидин-2-илметил)-1Н-индол; (R)-3-(N-(2-метоксиэтил)пирролидин-2-илметил)5-(3-нитропирид-2-иламино)-1Н-индол; 5-(4-бензил-1,3-тиаз-2-иламино)-3-(2-диметиламиноэтил)-1Н-индол; (R)-5-(3-бензилтио-1,2,4-тиадиаз-5-иламино)-3(N-метилпирролидин-2-илметил)-1Н-индол; 3-(2-диметиламиноэтил)-5-(пиримид-2-иламино)1Н-индол; 3-(2-диметиламиноэтил)-5-(3-метилсульфонилпирид-2-иламино)-1Н-индол; (R)-3-(N-мeтилпиppoлидин-2-илмeтил)-5-(2нитрофениламино)-1Н-индол; (R)-5-(6-метокси-3-нитропирид-2-иламино)-3-(Nметилпирролидин-2-илметил)-1Н-индол; (R)-5-(4-метил-3-нитропирид-2-иламино)-3-(Nметилпирролидин-2-илметил)-1Н-индол; (R)-3-(N-метилпирролидин-2-илметил)-5-(3-нитро-5-фенилпирид-2-иламино)-1Н-индол; (R)-5-(3-цианопирид-2-иламино)-3-(N-метилпирролидин-2-илметил)-1Н-индол; (R)-5-(6-изопропокси-3-нитропирид-2-иламино)3-(N-метилпирролидин-2-илметил)-1Н-индол; (R)-5-(4-циано-2-нитрофениламино)-3-(N-метилпирролидин-2-илметил)-1Н-индол; (R)-3-(N-метилпирролидин-2-илметил)-5-(4-трифторметил-2-нитрофениламино)-1Н-индол; (R)-5-(5,6-дихлор-2-нитрофениламино)-3-(N-метилпирролидин-2-илметил)-1Н-индол; 5-(4-циано-2-нитрофениламино)-3-[(2R,4R)-N-метил-4-метоксипирролидин-2-илметил]-1Н-индол; (R)-5-(5-хлор-2-нитрофениламино)-3-(N-метилпирролидин-2-илметил)-1Н-индол; (R)-3-(N-(2-цианоэтил) пирролидин-2-илметил)-5(3-нитропирид-2-иламино)-1Н-индол и (R)-3-(N-цианометил) пирролидин-2-илметил) -5(3-нитропирид-2-иламино)-1Н-индол. Другими характерными соединениями настоящего изобретения являются следующие соединения: 6-(3-(2-диметиламиноэтил)индол-2-иламино) пурин; 3-(2-диметиламиноэтил)-5-(2-нитрофениламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(3-аминокарбониллирид-2-иламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(2,6-динитрофениламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(2-цианофениламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(2,4-динитрофениламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(6-этоксикарбонил-3метилтио-1,2,4-триазин-5-иламино)-1Н-индол; 5-(1-фенилтетраз-5-иламино)-(2-диметиламиноэтил)-1Н-индол; N * ()n R 13 где: R7, R8 и R13 имеют определенные выше значения; Z представляет: R2 R3 R4 A D E R5 R2 A R3 D E N или R4 R5 где: А, D, Е, R2, R3, R4 и R5 имеют определенные выше значения; и X равен NH. Вышеизложенное описание настоящего изобретения включает соединения следующи х формул: R7 H Z X N NH Z R 13 NR7 R8 X NH Z , X ,и N R7 N Особенно предпочтительными являются следующие соединения: 3-(2-диметиламиноэтил)-5-(3,5-динитропирид-2иламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(3-нитропирид-2-иламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(3-трифторметилпирид-2-иламино)-1Н-индол; (R)-5-(3-нитропирид-2-иламино)-3-(пирролидин2-илметил)-1Н-индол; (R)-3-(N-метилпирролидин-2-илметил)-5-(нитропирид-2-иламино)-1Н-индол; (R,S)-3-(N-метилпирролидин-3-ил)-5-(3-нитропирид-2-иламино)-1Н-индол; 5-(бензоксаз-2-иламино)-3-(2-диметиламиноэтил)-1Н-индол; (R)-3-(N-циклопропилметилпирролидин-2илметил)-5-(3-нитропирид-2-иламино)-1Н-индол; 5 41297 5-(3-нитропирид-2-иламино)-3-(пиперид-4-ил)1Н-индол; 5-(3-нитропирид-2-иламино)-3-(1,2,5,6-тетрагидропирид-4-ил)-1Н-индол; 5-(5-нитропирид-2-иламино)-3-(1,2,5,6-тетрагидропирид-4-ил)-1Н-индол; 5-(3-нитропирид-2-илокси)-3-(1,2,5,6-тетрагидропирид-4-ил)-1Н-индол; 5-(5-нитропирид-2-илокси)-3-(1,2,5,6-тетрагидропирид-4-ил)-1Н-индол; 3-(2-диметиламиноэтил)-5-(3-аминопирид-2иламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(3-фенилкарбониламинопирид-2-иламино)-1Н-индол; 3-(2-диметиламиноэтил)-5-(6-бензиламинокарбонил-3-метилтио-1,2,4-триазин-5-иламино)1Н-индол; 5-амино-3-(N-метилпирролидин-3-ил)-1Н-индол; (R)-5-амино-3-(N-метилпирролидин-2-илметил)1Н-индол; (R)-5-амино-3-(пирролидин-2-илметил)-1Ниндол. Настоящее изобретение также относится к фармацевтической композиции для лечения состояния, выбираемого среди гипертензии, депрессии, страха, пищевы х расстройств, ожирения, токсикомании, "гистаминовой" головной боли, мигрени, боли и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми заболеваниями, которая включает количество соединения формулы I или его фармацевтически приемлемой соли, эффективное для лечения такого состояния, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения состояния, выбираемого среди гипертензии, депрессии, страха, пищевых расстройств, ожирения, токсикомании, "гистаминовой" головной боли, мигрени, боли и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми заболеваниями, заключающемуся во введении млекопитающему (например, человеку), нуждающемуся в таком лечении, количества соединения формулы I или его фармацевтически приемлемой соли, эффективного для лечения такого состояния. Настоящее изобретение относится также к способу лечения расстройств, являющихся результатом дефицитной серотонергической нейротрансмиссии (например, депрессии, страха, пищевых расстройств, ожирения, токсикомании, "гистаминовой" головной боли, мигрени, боли и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми заболеваниями), заключающемуся во введении млекопитающему (например, человеку), нуждающемуся в таком лечении, количества соединения формулы I или его фармацевтически приемлемой соли, эффективного для лечения такого состояния. Настоящее изобретение также относится к соединению формулы II: H X R1 NH II в которой X и R1 имеют те же значения, которые определены для формулы I. Соединения формулы II могут быть использованы, например, в качестве промежуточных соединений для получения соединений формулы I. Подробное описание изобретения. Соединения формулы I получают в соответствии со следующей далее реакционной схемой: Соединение формулы II, в котором R1 имеет значения, установленные выше для формулы I, вводят во взаимодействие с соединением формулы III A или III B, в которых X, А, В, D, Е, F, R2, R3, R4, R5 и R6 имеют значения, определенные выше для формулы I, и LG представляет собой отщепляющуюся гр уппу, такую как, например, Сl, Вг, I, SСН3, SO2CH3, SPh или SO 2Ph (Рh=фенил). Эта реакция может быть осуществлена в кислой, щелочной или нейтральной среде, обычно при повышенных температурах. Подходящие основания включают гидрокарбонат натрия, триалкиламины, гидрид натрия и карбонат натрия. Предпочтительным основанием является триэтиламин. Подходящие кислоты включают минеральные кислоты (например, соляную или бромистоводородную кислоту) и органические кислоты (например, уксусную кислоту). Предпочтительной кислотой является уксусная кислота. Подходящие растворители включают метанол, этанол, диоксан, тетрагидрофуран, ацетонитрил и N,N-диметилформамид. Предпочтительным растворителем является этанол. Реакцию обычно проводят при температуре от 50°С до 154°С, предпочтительно - от 70°С до 80°С. 6 41297 Соединения формулы II могут быть получены, как показано в общих чертах ниже: Соединения формулы V могут быть получены взаимодействием соединения формулы VI, в котором R16 имеет значение, определенное выше для формулы IV, с соответствующим электрофилом в кислой, щелочной или нейтральной среде. Подходящие электрофилы включают хлорангидриды N-защищенной пролиновой кислоты, N-защищенные 4-пиперидоны, оксалилхлорид и имиды малеиновой кислоты. В случае оксалилхлорида образующийся в результате хлор-ангидрид индол3-глиоксамовой кислоты затем вводят в реакцию со вторичным амином формулы NHR5R6, где R5 и R6 имеют значения, определенные для формулы I. Подходящие кислоты включают минеральные кислоты, уксусн ую кислоту и муравьиную кислоту. Подходящие основания включают реактивы Гриньяра, в том числе магнийбромид, первичные, вторичные или третичные амины, металлический натрий или калий или гидрид натрия. Подходящие растворители включают простые эфиры (в том числе тетрагидрофуран и диэтиловый эфир), бензол, толуол, уксусн ую кислоту, муравьиную кислоту или (С1-С3)спирты. Реакцию обычно проводят при температуре от 0°С до 150°С, предпочтительно - в интервале от 0°С до 120°С. В случае, когда электрофил представляет собой хлорангидрид Nзащищенной пролиновой кислоты, предпочтительным растворителем является бензол, реакцию предпочтительно вести в щелочной среде, используя магнийбромид как предпочтительное основание, и реакцию ведут предпочтительно при 0°С. В случае, когда электрофилом является Nзащищенный 4-пиперидон, предпочтительным растворителем является метанол, реакцию предпочтительно проводить в щелочной среде, используя в качестве предпочтительного основания метоксид натрия, и температура реакции предпочтительно составляет 65°С. В случае, когда электрофилом является оксалилхлорид, предпочтительным растворителем является простой эфир, реакцию предпочтительно осуществлять в щелочной среде, используя в качестве предпочтительного основания HNR5R6, и температура реакции предпочтительно составляет 0°С. В случае, когда электрофилом является имид малеиновой кислоты, предпочтительным растворителем является уксусная кислота, реакцию предпочтительно проводить в кислой среде, используя уксусн ую кислоту в качестве предпочтительной кислоты, и температура реакции предпочтительно составляет 101°С. Соединения формулы IV могут быть получены из соединения формулы V, в которой R17 представляет собой: R 15 NH VII NH VI R 16 R 17 R 16 NH V R1 R 16 NH IV R1 H X NH II Соединения формулы VI, в которых R16 представляет собой группу с защи щенным гетероатомом, такую как, например, -N(R18)2, -NHR18, -OR18, -SR18, 2,5-диметил-1Н-пиррол или -NO2, и R18 представляет собой водород, бензоил или бензил, получают путем взаимодействия соединения формулы VII, где: R15 представляет собой -SH, -NH2, -ОН, с бензил- или бензоилгалогенидами (предпочтительно - бензилбромидом или бензоилхлоридом) или ацетилацетоном в присутствии основания и в инертном растворителе. Соединения формулы VII являются либо коммерчески доступными, либо могут быть получены методами, известными специалистам в данной области. Подходящие основания включают бикарбонат натрия, карбонат натрия, гидрид натрия и триалкиламины. Предпочтительным основанием является триэтиламин. Подходящие растворители включают диметилформамид, простые эфиры (включая тетрагидрофуран) и (С1-С3) спирты. Предпочтительным растворителем является тетрагидрофуран. Реакцию обычно проводят при температуре от 25°С до 100°С, предпочтительно - при 25°С. CO2R19 O N NR5R6 R 13 7 , O , 41297 O CO2R19 Подходящие алкилирующие агенты включают алкил-галогениды (хлориды, бромиды или иодиды), алкилтозилаты, алкилмезилаты, алкилтрифлаты, α, β-ненасыщенные кетоны, α, β-ненасыщенные сложные эфиры, α, β-ненасыщенные амиды и α, βненасыщенные нитрилы, в зависимости от нужной группы R7. Предпочтительны алкилгалогениды (иодиды). Подходящие растворители включают метиленхлорид, хлороформ, четыреххлористый углерод, ацетонитрил, тетрагидрофуран, диэтиловый эфир, диоксан, N,N-диметилформамид, этанол, пропанол, метанол. Предпочтительным растворителем является ацетонитрил. Реакцию обычно проводят при температуре между 0°С и 150°С, предпочтительно - от 25°С до 65°С. Если нет особых указаний, давление для каждой указанной выше реакции не является критическим. Обычно реакцию проводят при давлении от одной до трех атмосфер, предпочтительно при окружающем давлении (около одной атмосферы). Соединения формулы I, которые являются по характеру основаниями, способны образовывать многочисленные различные соли с различными органическими и неорганическими кислотами. Хотя такие соли для введения животным должны быть фармацевтически приемлемыми, на практике часто желательно сначала выделить из реакционной смеси соединение формулы І в виде фармацевтически неприемлемой соли, затем просто превратить ее снова в свободное основание обработкой щелочным реагентом и после этого превратить свободное основание в фармацевтически приемлемую аддитивную соль кислоты. Аддитивные соли кислоты основных соединений настоящего изобретения легко получают обработкой основания по существу эквивалентным количеством выбранной минеральной или органический кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После тщательного испарения растворителя получают нужную соль в виде твердого вещества. Кислоты, которые используются для получения фармацевтически приемлемых аддитивных солей кислоты основных соединений настоящего изобретения, являются кислотами, которые образуют нетоксичные аддитивные соли кислоты, т. е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлориды, гидробромиды, гидроиодиды, нитраты, сульфаты или бисульфаты, фосфаты или кислые фосфаты, ацетаты, лактаты, цитраты или кислые цитраты, тартраты или битартраты, сукцинаты, малеаты, фумараты, глюконаты, сахараты, бензоаты, метансульфонаты и памоаты (т. е. 1,1'-метилен-бис-(2гидрокси-3-нафтоаты)). Соединения формулы I, которые по природе являются также кислотными, например, когда Z содержит карбоксилат, способны образовывать соли оснований с различными фармацевтически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочноземельных металлов, и, в частности, соли натрия и калия. Эти соли получают обычными техническими приемами. Химические основания, которые используются в качестве реагентов при получении фармацевтически приемлемых основных солей N NR 5 O , или R5 и R6 имеют значения, установленные выше для формулы I, R16 имеет значения, установленные выше для формулы IV, и R19 представляет собой трет-бутил или бензил, посредством восстановления гидридом в инертном растворителе. Подходящие восстановители включают алюмогидрид лития, борогидрид лития и диборан. Предпочтителен алюмогидрид лития. Подходящие инертные растворители включают тетрагидрофуран, диоксан и другие простые эфиры. Предпочтительным растворителем является тетрагидрофуран. Реакцию обычно проводят при температуре от 25°С до 100°С, предпочтительно - при 65°С. Соединения формулы II могут быть получены из соединений формулы IV, с помощью деблокирования гетероатома с использованием катализатора переходного металла и источника водорода или полугидрохлорида гидроксиламина. Подходящие растворители включают (С1-С4)-спирты, этилацетат, ацетон или диметилформамид. Предпочтительным растворителем является этанол. Подходящие катализаторы переходных металлов включают палладий-на-угле, (гидроксид палладия)-на-угле и оксид платины. Предпочтительным катализатором является (гидроксид палладия)-наугле. Подходя щие источники водорода включают водород (газ), формиат аммония и муравьиную кислоту. Предпочтителен водород (газ), обычно при давлении 1-3 атмосферы, предпочтительно - 3 атмосферы. Реакцию обычно проводят при температуре от 25°С до 100°С, предпочтительно - при 40°С. Соединения формулы VII коммерчески доступны. Соединения формулы II могут быть также получены с использованием методов, известных специалистам в данной области техники, например таким, который изложен в Shaw, E. and Woolley, D. W., J. Am. Chem. Soc., 1877 (1953), или способами, описанными в примерах 9, 12, 14, 16, 17, 21 или 25. Соединения формулы III являются или коммерчески доступными или могут быть получены способами, известными специалистам в данной области техники. Соединения формулы I также получают алкилированием соединения формулы Iа: H H X Z NH N ()n R 13 Ia в которой Z, X и n имеют определенные выше значения, при взаимодействии алкилирующего агента и основания в инертном растворителе. 8 41297 настоящего изобретения, являются основаниями, которые образуют нетоксичные аддитивные соли основания с описанными здесь кислыми соединениями формулы I. Эти нетоксичные аддитивные соли основания включают соли, образованные фармацевтически приемлемыми катионами, такими как, например, катионы натрия, калия, кальция и магния. Эти соли легко могут быть получены обработкой соответствующи х кислотных соединений водным раствором, содержащим нужные фармацевтически приемлемые катионы, и последующим упариванием образующегося в результате раствора досуха, предпочтительно - при пониженном давлении. С другой стороны, они также могут быть получены смешиванием растворов кислотных соединений в низших спиртах и нужного алкоксида щелочного металла и последующим упариванием досуха образующегося в результате раствора, так же, как и в предыдущем случае. В любом случае, предпочтительно использовать стехиометрические количества реагентов, чтобы обеспечить полноту реакции, а также максимальный выход нужного конечного продукта. Соединения формулы I и их фармацевтически приемлемые соли(называемые здесь далее также активными соединениями) пригодны для применения в психотерапии и являются сильными агонистами серотонина (5-НТ1) и могут применяться для лечения депрессии, страха, пищевых расстройств, ожирения, токсикомании, "гистаминовой" головной боли, мигрени, хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми заболеваниями, боли и других расстройств, являющихся результатом дефицитной серотонэргической нейротрансмиссии. Соединения также могут быть использованы как центрально действующие гипотензивные и сосудорасширяющие средства. Активные соединения изобретения оценивают как средства против мигрени посредством испытания степени, до которой они сходны с суматриптаном в опыте с сокращением отрезка выделенной подкожной вены ноги собаки (P. P. A. Humphrey et al., Br. J. Pharmacol., 94, 1128 (1988)). Это действие может быть блокировано метиотепином, известным антагонистом серотонина. Известно, что суматриптан используют при лечении мигрени, и он дает селективное увеличение каротидной сосудистой сопротивляемости в опыте на собаке, находящейся под наркозом. Полагают (W. Fenwick et al., Br. J. Pharmacol., 96, 83 (1989)), что это является основой его эффективности. Композиции настоящего изобретения могут быть составлены обычным способом с использованием одного или нескольких фармацевтическим приемлемых носителей. Так, активные соединения изобретения могут быть составлены для орального, трансбуккального, внутриносового, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения, или в форме, подходящей для введения посредством ингаляции или инсуффляции. Фармацевтические композиции для орального введения могут принимать форму, например, таблеток или капсул, приготовленных обычными способами с фармацевтически приемлемыми наполнителями, такими как связующие (например, пред варительно желатинированный маисовый крахмал, поливинилпирролидон, гидроксипропил-метилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазки (например, стеарат магния, тальк или кремнезем); разрыхлители (например, картофельный крахмал или натрийкрахмалгликолят); или смачиватели (например, лаурилсульфат натрия). На таблетки методами, хорошо известными в те хнике, могут быть нанесены покрытия. Жидкие препараты для орального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут иметь вид сухого продукта для приготовления состава с водой или другим подходящим растворителем непосредственно перед применением. Такие жидкие препараты могут быть приготовлены обычными способами с применением фармацевтически приемлемых добавок, таких как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза, гидрированные съедобные жиры); эмульгаторы (например, лецитин, аравийская камедь); неводные растворители (например, миндальное масло, эфиры жирных кислот или этиловый спирт); и консерванты (например, метил- или пропилгидробензоаты или сорбиновая кислота). Композиции для трансбуккального введения могут принимать форму таблеток или лепешек, составленных обычным способом. Активные соединения изобретения могут быть составлены для парентерального введения посредством инъекций, включая обычные технические приемы катетеризации или инфузии. Составы для инъекций могут быть представлены в форме единичной дозы, например, в ампулах или в упаковках для мультидозы, с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать такие составляющие агенты, как суспендирующие вещества, стабилизаторы и/или диспергаторы. С другой стороны, активные ингредиенты могут находиться в форме порошка для приготовления состава с подходящим растворителем, например, стерильной апирогенной водой, непосредственно перед применением. Активные соединения настоящего изобретения также могут быть составлены в виде ректальных композиций, таких как суппозитории, основанных на масле какао или на других глицеридах. Активные соединения изобретения для внутриносового введения и введения посредством ингаляции удобно поставлять в виде раствора или суспензии в упаковке с распыляющим устройством, которое сжимает или накачивает пациент, или представлены для аэрозольного распыления в емкости под давлением или в распылителе с применением подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходяще го газа. В случае аэрозоля под давлением дозировочная единица может быть определена с помощью встроенного клапана для подачи отмеренного количества. Емкость под давлением или распылитель могут содержать раствор или суспензию активного соединения. Капсулы и патрон (изготовленные, например, из желатина) 9 41297 для использования в ингаляторе или инсуффляторе могут быть составлены из смеси, содержащей соединения изобретения в виде порошка и подходящую порошкообразную основу, такую как лактоза или крахмал. Предлагаемые дозы активных соединений изобретения для орального, парентерального или трансбуккального введения для среднего взрослого человека для лечения состояний, указанных выше (например, мигрени) составляют от 0,1 до 200 мг активного ингредиента в единичной дозе, которая может быть введена, например, 1-4 раза в день. Аэрозольные композиции для лечения состояний, которые упоминались выше (например, мигрени) у взрослого среднего человека находятся предпочтительно в таком интервале, чтобы каждая отмеренная доза или "выдох" аэрозоля содержал от 20 мкг до 1000 мкг соединения изобретения. Общая дневная доза аэрозоля будет находиться в пределах от 100 мкг до 10 мг. Введение может осуществляться несколько раз в день, например, 2, 3, 4 или 8 раз, подавая при этом каждый раз, например, 1, 2 или 3 дозы. Следующие примеры, не являющиеся ограничивающими, иллюстрируют получение соединения настоящего изобретения. Температуры плавления не корректированы. Данные ЯМР приведены в частях на миллион (δ) и соотносятся с дейтериевым лок-сигналом от образца растворителя. Удельное вращение измеряется при комнатной температуре с использованием D-линии натрия. Если нет других указаний, все масс-спектры сняты с использованием электронного удара (EI, 70 эв). Закупленные реагенты используют без дополнительной очистки. Хроматографией является колоночная хроматография, выполняемая с использованием силикагеля 32-63 мкм и под давлением азота (флэш-хроматография). Комнатная температура означает температур у в 20-25°С. Пример 1. Общий метод синтеза 5-ариламино1Н-индолов посредством конденсации производного 5-аминоиндола с галоидареном Раствор 5-аминоиндола (2,00 ммоль), галоидарена (3,00 ммоль, 1,5 экв.) и основания (если требуется, 3,00 ммоль) в подходящем безводном растворителе (10 мл) либо нагревают при температуре кипения с обратным холодильником в атмосфере азота в течение 1-18 часов, в зависимости от субстрата, либо перемешивают при комнатной температуре в течение 1 часа, в зависимости от субстрата. Реакционную смесь охлаждают и затем непосредственно хроматографируют с использованием силикагеля (приблизительно 50 г) и элюирования смесью метиленхлорид:метанол:(гидроксид аммония) в соотношении 9:1:0,1 и получают производное 5-ариламино-1Н-индола. В некоторых случаях выполняют перекристаллизацию твердого вещества, полученного при хроматографии, и получают чистые для анализа образцы названного в заголовке соединения. В соответствии с этой методикой получают следующие далее соединения. А. 3-(2-Диметиламиноэтил)-5-(3-нитропирид-2иламино)-1Н-индол. Используют 5-амино-3-(2-диметиламиноэтил) индол (Shaw, E. and Woolley, D. W., J Am. Chem. Soc., 1877 (1953)) и 2-хлор-3-нитропиридин. В качестве основания используют триэтиламин, в качестве растворителя - п-диоксан, реакционную смесь кипятят с обратным холодильником (101°С) в течение 3 часов. Хроматография дает названное в заголовке соединение (67%) в виде темно-красной пены: Т. пл. 59,0-61,0°С; 1 Н ЯМР (CDCl3) δ 8,66 (ш.с, 1Н), 8,51 (дд, J=8,3 и 1,8 Гц, 1Н), 8,41 (дд, J=4,4 и 1,8 Гц, 1Н), 7,76 (ш.с, 1Н), 7,30-7,24 (м, 2Н), 6,97 (д, J=2,1 Гц, 1Н), 6,73 (дд, J=8,3 и 4,4 Гц, 1Н), 2,97-2,92 (м, 2Н), 2,70-2,63 (м, 2Н), 2,36 (с, 6Н); 13 С Я МР (CDCl3) δ 155,7, 151,5, 135,5, 134,5, 129,4, 128,2, 127,9, 122,8, 119,3, 114,4, 114,3, 113,0, 111,5, 60,3, 45,4, 23,7. Элементный анализ для C17H19N5O2·1/3Н2 О: Вычислено: С 61,62; Н 5,98; N 21,13. Найдено: С 61,58; Н 5,65; N 20,80. В. 3-(2-Диметиламиноэтил)-5-(2-нитрофениламино)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил) индол и 2-фторнитробензол. В качестве основания применяют пиридин, в качестве растворителя - бромбензол и реакционную смесь нагревают при температуре кипения с обратным холодильником (156°С) в течение 11 часов. Хроматография дает названное в заголовке соединение (82%) в виде твердого темно-красного вещества: Т. пл. 116,0-117,0°С; 13 С ЯМР (CD3OD) δ 146,7, 136,7, 133,2, 131,0, 129,5, 127,2, 124,7, 121,3, 117,3, 117,2, 117,0, 114,1, 113,4, 61,4, 45,4, 24,2. HRMS (масс-спектр, выс. разреш.): Вычислено для C18H20N4O 2 324,1588; Найдено 324,1564. Элементный анализ для C18H20N4O2·1/3Н2 О: Вычислено: С 65,44; Н 6,31; N 16,96; Найдено: С 65,44; Н 5,92; N 16,96. С. 3-(2-Диметиламиноэтил)-5-(3,5-динитропирид-2-иламино)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил) индол и 2-хлор-3,5-динитропиридин. В качестве основания используют триэтиламин, в качестве растворителя - тетрагидрофуран, и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Непосредственная фильтрация реакционной смеси дает темно-красное твердое вещество , которое перекристаллизовывают из этанола и получают названное в заголовке соединение (7%) в виде твердого темно-красного вещества: Т. пл. 194,0-195,0°С; 13 С ЯМР (ДМСО-d6) δ 152,2, 150,7, 134,7, 134,1, 131,2, 128,2, 127,1, 126,7, 123,9, 119,1, 114,8, 112,7, 111,4, 59,7, 44,9, 22,8; HRMS: вычислено для C17H18N6O4 370,1391, найдено 370,1358. Элементный анализ для C17H18N6O4·1/2Н2 O: Вычислено: С 53,82; Н 5,04; N 22,15; Найдено: С 53,55; Н 4,56; N 21,98. D. 3-(2-Диметиламиноэтил)-5-(3-аминокарбонилпирид-2-иламино)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил) индол и 2-хлорникотинамид. В качестве основания используют пиридин, в качестве растворителя бромбензол, и реакционную смесь нагревают при 10 41297 температуре кипения с обратным холодильником (156°С) в течение 18 часов. Хроматография и последующая перекристаллизация (метанол/вода) образующегося твердого вещества дают названное в заголовке соединение (36%) в виде твердого желтого вещества: Т. пл. 127,0-129,0°С; 13 С ЯМР (CD3OD) δ 173,0, 157,9, 152,2, 139,0, 135,4, 132,4, 129,0, 123,9, 119,1, 113,7, 113,2, 113,0, 112,5, 111,3, 61,4, 45,4, 24,3; HRMS: вычислено для C18H21N5O: 323,1748, найдено 323,1726. Элементный анализ для C18H21N5O·H2O: Вычислено: С 63,33; Н 6,79; N 20,51; Найдено: С 63,19; Н 6,50; N 20,30. Е. 3-(2-Диметиламиноэтил)-5-(2,6-динитрофениламино)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил) индол и 1-хлор-2,6-динитробензол. В качестве основания используют триэтиламин, в качестве растворителя - тетрагидрофуран, и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Хроматография дает названное в заголовке соединение (57%) в виде темно-красного твердого вещества : Т. пл. 187,0-188,0°С; 13 С ЯМР (ДМСО-d6) δ 139,9, 135,2, 134,0, 132,0, 131,8, 127,2, 123,8, 117,0, 115,4, 112,9, 112,0, 109,3, 59,9, 45,1, 23,0; HRMS: вычислено для C18H19N5O: 369,1439, найдено 369,1428. Элементный анализ для C18H19N5O: Вычислено: С 58,53; Н 5,18; N 18,96; Найдено: С 58,45; Н 4,96; N 18,68. F. 3-(2-Диметиламиноэтил)-5-(2-цианофениламино)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил) индол и 2-фторбензонитрил. В качестве основания используют пиридин, в качестве растворителя - 2-фторбензонитрил, и реакционную смесь перемешивают при кипячении с обратным холодильником в течение 8 часов. Хроматография дает названное в заголовке соединение (2%) в виде прозрачного светло-коричневого масла: 1 H ЯМР (CD3OD) δ 7,43 (дд, J=7,7 и 1,5 Гц, 1Н), 7,38 (д, J=1,9 Гц, 1Н), 7,34 (д, J=8,6 Гц, 1Н), 7,307,23 (м, 1Н), 7,07 (с, 1Н), 6,97 (дд, J=8,6 и 1,9 Гц, 1Н), 6,85 (д, J=8,5 Гц, 1H), 6,73-6,67 (м, 1Н), 4,91 (c, 2Н), 2,92-2,86 (м, 2H), 2,65-2,59 (м, 2Н), 2,30 (с, 6Н); HRMS: вычислено для C19H20N4: 304,1690, найдено 304,1682. G. 3-(2-Диметиламиноэтил)-5-(3-трифторметилпирид-2-иламино)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил) индол и 2-хлор-3-трифторметилпиридин. В качестве основания используют пиридин, в качестве растворителя - N,N-диметилформамид, и реакционную смесь нагревают при температуре кипения с обратным холодильником (153°С) в течение 18 часов. Хроматография дает названное в заголовке соединение (10%) в виде прозрачного светло-коричнезого масла: 13 С ЯМР (CD3OD) δ 155,4, 152,3, 136,9, 136,1, 131,7, 129,0, 124,0, 120,9, 115,7, 113,9, 113,5, 112,5, 110,5, 61,4, 45,4, 24,3; LRMS (масс-спектр, низкое разреш.) (m/z, о тносительная интенсивность) 348 (100, М+), 303 (16), 290 (28), 268 (11), 250 (20); HRMS: вычислено для C18H19F3N4 348,1564, найдено 348,1532. Н. 3-(2-Диметиламиноэтил)-5-(2,4-динитрофениламино)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил) индол и 1-хлор-2,4-динитробензол. В качестве основания используют триэтиламин, в качестве растворителя - тетрагидрофуран, и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Хроматография дает названное в заголовке соединение (73%) в виде темно-красного твердого вещества : Т. пл. 177,0-179,0°С; 13 С ЯМР (ДМСО-d6) δ 148,2, 135,6, 135,2, 130,1, 129,6, 128,2, 127,9, 124,3, 123,5, 119,6, 116,9, 116,3, 113,3, 112,5, 60,0, 45,2, 23,0; FAB HRMS: вычислено для C18H19N5O 4·[Н+] 370,1517, найдено 370,1492. I. (R)-5-(3-Нитропирид-2-иламино)-3-(пирролидин-2-илметил)-1Н-индол Используют (R)-5-амино-3-(пирролидин-2-илметил)индол и 2-хлор-3-нитропиридин. В качестве основания используют ацетат натрия, в качестве растворителя - уксусную кислоту, и реакционную смесь нагревают при кипячении с обратным холодильником (116°С) в течение 2 часов. Колоночная хроматография дает названное в заголовке соединение (23%) в виде темно-красной пены: 1 Н ЯМР (CDCl3) δ 10,05 (ш.с, 1Н), 9,23 (ш.с, 1Н), 8,49 (дд, J=1,8 и 8,3 Гц, 1Н), 8,39 (1,8 и 4,5 Гц, 1Н), 7,70 (д, J=1,7 Гц, 1Н), 7,33-7,22 (м, 2Н), 6,98 (с, 1Н), 6,73 (дд, J=4,5 и 8,3 Гц, 1Н), 3,46-3,34 (м, 1Н), 3,10-2,97 (м, 1Н), 2,97-2,78 (м, 3Н), 1,99-1,64 (м, 3Н), 1,56-1,42 (м, 1Н); 13 С Я МР (CDCl3) δ 155,7, 151,5, 135,5, 134,5, 129,2, 128,1, 127,8, 123,8, 119,4, 114,3, 113,0, 111,6, 59,5, 45,7, 31,3, 30,6, 24,7; ЕАВ LRMS (m/z, относительная интенсивность) 338 (6, [МН+]), 309 (12), 155 (49), 135 (38), 119 (100). Элементный анализ для C18H19N5O·0,67C2Н4O2 (уксусная кислота): Вычислено: С 61,53; Н 5,79; N 18,56; Найдено: С 61,57; Н 5,74; N 18,82. J. (R)-3-(N-Метилпирролидин-2-илметид)-5-(3нитропирид-2-иламино)-1Н-индол Используют (R)-3-(N-метилпирролидин-2-илметил)индол и 2-хлор-3-нитропиридин. В качестве основания используют триэтиламин, в качестве растворителя - ацетонитрил, и реакционную смесь кипятят с обратным холодильником в течение 3,5 часов. Хроматография дает названное в заголовке соединение (81%) в виде темно-красной пены: 1 Н ЯМР (CDCl3) δ 10,11 (ш.с, 1Н), 8,52 (дд, J=1,8 и 8,4 Гц, 1Н), 8,43 (1,8 и 4,5 Гц, 1Н), 8,33 (ш.с, 1Н), 7,77 (д, J=1,7 Гц, 1Н), 7,35 (д, J=8,7 Гц, 1Н), 7,26 (дд, J=2,0 и 8,6 Гц, 1Н), 7,03 (д, J=2,1 Гц, 1Н), 6,74 (дд, J=4,4 и 8,4 Гц, 1Н), 3,21-3,12 (м, 2Н), 2,68-2,58 (м, 1Н), 2,54-2,46 (м, 1Н), 2,47 (с, 3Н), 2,28-2,18 (м, 1Н), 1,89-1,73 (м, 2Н), 1,73-1,54 (м, 2Н); 13 С Я МР (CDCl3) δ 155,7, 151,5, 135,5, 134,3, 129,5, 128,2 128,1, 123,1, 119,4, 114,3, 113,0, 111,4, 66,7, 57,5, 40,8, 31,5, 29,9, 21,9. 11 41297 Элементный анализ для C19H21N5O2·1/3Н2 О: Вычислено: С 63,85; Н 6,11; N 19,59. Найдено: С 63,86; Н 5,86; N 19,31. К. 6-(3-(2-Диметиламиноэтил)индол-5-иламино)пурин Используют 5-амино-3-(2-диметитаминоэтил) индол и 6-хлорпурин. Основание не используют, в качестве растворителя применяют уксусн ую кислоту и реакционную смесь нагревают при температуре кипения с обратным холодильником (116°С) в течение 15 часов. Хроматография дает названное в заголовке соединение (66%) в виде белой пены: Т. пл. с разложением, 175°С; 13 С ЯМР (CD3OD) δ 153,7, 153,4, 141,5, 136,0, 131,5, 128,3, 125,6, 119,2, 113,3, 113,0, 109,9, 59,1, 43,6, 21,9. Элементный анализ для C17H19N7O2·НСІ·2Н2 О: Вычислено: С 51,84; Н 6,14; N 24,89; Найдено: С 52,14; Н 6,22; N 25,03. L. (R,S)-3-(N-Метилпирролидин-3-ил)-5-(3-нитропирид-2-иламино)-1Н-индол Используют (R,S)-3-(N-метилпирролидин-3-ил) индол и 2-хлор-3-нитропиридин. В качестве основания используют ацетат натрия, в качестве растворителя - уксусную кислоту, и реакционную смесь кипятят с обратным холодильником в течение 4 часов. Хроматография дает названное в заголовке соединение (44%) в виде темно-красной пены: Т. пл. 55,0-57,0°С; 13 С Я МР (CDCl3) δ 155,7, 151,5, 135,5, 135,0, 129,0, 128,1, 127,1, 121,7, 119,3, 119,2, 114,7, 113,0, 111,6, 62,8, 56,2, 42,4, 35,1, 32,1; FAB LRMS (m/z, относительная интенсивность) 306 (МH+, 100), 155 (38). Элементный анализ для C18H19N5O 2·1/2C4H4O 2 [этилацетат]: Вычислено: С 62,98; Н 6,08; N 18,36; Найдено: С 62,71; Н 5,80; N 18,51. М. 3-(2-Диметиламиноэтил)-5-(6-этоксикарбонил-3-метилтио-1,2,4-триазин-5-иламино)-1Ниндол Используют 5-амино-3-(2-диметиламиноэтил) индол и 6-карб-этокси-5-хлор-3-метилтио-1,2,4триазин (Pesson, М., et al., Eur. Med. Chem., 269 (1972)). В качестве основания применяют триэтиламин, в качестве растворителя - тетрагидрофуран, и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Хроматография дает названное в заголовке соединение (53%) в виде твердого оранжевого вещества: Т. пл. 197,0-199,0°С со вспениванием; 13 С ЯМР (ДМСО-d6) δ 173,2, 165,5, 150,5, 133,9, 132,5, 127,7, 127,1/ 123,9, 116,8, 113,0, 112,2, 111,5, 62,0, 60,0, 45,2, 23,1, 14,0, 13,2; LRMS (m/z, относительная интенсивность) 400 (М+, 11), 386 (5), 195 (11), 163 (13), 58 (100). Элементный анализ для C19H24N6O2S·3H2 О: Вычислено: С 56,22; Н 6,11; N 20,70; Найдено: С 56,50; Н 5,89; N 20,33. N. 5-(Бензоксаз-2-иламино)-3-(2-диметиламиноэтил)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил) индол и 2-хлор-бензоксазол. Основание не используют, в качестве растворителя применяют уксусн ую кислоту и реакционную смесь перемеши вают при температуре кипения с обратным холодильником (116°С) в течение 2 часов. Хроматография дает названное в заголовке соединение (24%) в виде светло-желтой пены: 13 С Я МР (CDCl3) δ 160,5, 148,1, 142,7, 133,8, 130,0, 127,8, 124,0, 123,1, 121,0, 116,4, 116,4, 113,6, 111,8, 110,8, 108,9, 60,1, 45,3, 23,4; LRMS (m/z, о тносительная интенсивность), 320 (М+, 33), 262 (15), 101 (12), 86 (33), 58 (100). Элементный анализ для C19H21N4O·1/4Н2O: Вычислено: С 70,23; Н 6,36; N 17,24; Найдено: С 70,53; Н 6,46; N 17,06. О. 5-(1-Фенилтетраз-5-иламино)-(2-диметиламиноэтил)-1Н-индол. Используют 5-амино-3-(2-диметиламиноэтил) индол и 5-хлор-1-фенил-1Н-тетразол. В качестве основания применяют карбонат натрия, в качестве растворителя - абсолютный этанол, и реакционную смесь нагревают при температуре кипения с обратным холодильником (78°С) в течение 48 часов. Хроматография с последующей обработкой хроматографического остатка хлороформом дает названное в заголовке соединение (7%) в виде твердого белого вещества: Т. пл. 187,0-188,0°С; 1 Н ЯМР (CD3OD) δ 7,73 (д, J=1,9 Гц, 1Н), 7,56-7,52 (м, 3Н), 7,29-7,22 (м, 3Н), 7,20 (дд, J=2,0 и 8,6 Гц, 1Н), 6,98-6,95 (м, 1Н), 4,93 (с, 2Н), 2,96-2,91 (м, 2Н), 2,66-2,59 (м, 2Н), 2,27 (с, 6Н); FAB LRMS (m/z, относительная интенсивность) 348 (МН+, 100), 309 (23); HRMS: вычислено для C19H21N7 347,1861, найдено 347,1867. Элементный анализ для C19H21N7·2/3СНСl3 [хлороформ]: Вычислено: С 55,33; Н 4,64; N 22,96; Найдено: С 55,50; Н 4,94; N 23,33. Р. 5-(3-Бензилтио-1,2,4-тиадиаз-5-иламино)-3(N-метил-пирролидин-2-илметил)-1Н-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 3-бензилтио-5-хлор1,2,4-тиадиазол. В качестве основания применяют ацетат натрия, в качестве растворителя - уксусную кислоту, и реакционную смесь кипятят с обратным холодильником в течение 1,5 часов. Колоночная хроматография дает названное в заголовке соединение (9%) в виде твердого аморфного вещества : 1 Н ЯМР (CD3OD) δ 7,67 (ш.с, 1Н), 7,40-7,17 (м, 6Н), 7,09 (с, 1Н), 7,04 (дд, J=8,6 и 2,1 Гц, 1Н), 4,88 (ш.с, приблизит. 3Н), 4,40 (с, 2Н), 3,16-3,03 (м, 2Н), 2,60-2,37 (м, 2Н), 2,43 (с, 3Н), 2,25-2,19 (м, 1Н), 1,83-1,50 (м, 4Н); 13 С ЯМР (CD3OD) δ 169,0, 139,1, 135,7, 133,1, 130,1, 129,5, 129,2, 128,3, 125,3, 116,3, 113,8, 113,2, 110,8, 68,4, 58,3, 41,1, 36,8, 32,4, 30,4, 22,4; HRMS: вычислено для C23H25N5S2 435,1555, найдено 435,1518. Элементный анализ для C23H25N5S2·0,4NН3: Вычислено: С 62,50; Н 5,75; N 17,11; Найдено: С 62,93; Н 5,50; N 17,57. Q. 3-(2-Диметиламиноэтил)-5-(пиримид-2-иламино)-1Н-индол Используют 5-амино-3-(2-диметиламиноэтил)1Н-индол и 2-хлорпиримидин. В качестве основания применяют ацетат натрия, в качестве растворителя - уксусную кислоту, и реакционную смесь 12 41297 1 кипятят с обратным холодильником в течение 12 часов. Колоночная хроматография дает названное в заголовке соединение (11%) в виде твердого желтого вещества. 13 С ЯМР (CD3OD) δ 162,6, 159,2, 135,4, 132,2, 128,9, 124,0, 118,6, 113,7, 112,6, 112,4, 112,3, 61,3, 45,4, 24,3; HRMS: вычислено для C16H19N5 281,1642, найдено 281,1660. Элементный анализ для C16H19N5·0,5C2H4O 2 [уксусная кислота]: Вычислено: С 65,62; Н 6,80; N 22,51; Найдено: С 65,74; Н 6,68; N 22,60. R. 3-(2-Диметиламиноэтил)-5-(3-метилсульфонилпирид-2-иламино)-1Н-индол Используют 5-амино-З-(2-диметиламиноэтил)1Н-индол и 2-хлор-3-метилсульфонилпиридин. В качестве основания используют 2,6-лутидин, в качестве растворителя - бромбензол, и реакционную смесь кипятят с обратным холодильником в течение 3,5 часов. Колоночная хроматография дает названное в заголовке соединение (13%) в виде твердого желтого вещества: Т. пл. 66,0-68,0°С; 1 Н ЯМР (CDCl3) δ 8,46 (с, NH), 8,33 (дд, J=4,8 и 1,9 Гц, 1Н), 8,33 (ш.с, NH), 8,06 (дд, J=7,8 и 1,9 Гц, 1Н), 7,66 (д, J=1,8 Гц, 1Н), 7,29 (д, J=8,5 Гц, 1Н), 7,20 (дд, J=8,6 и 2,0 Гц, 1Н), 6,97 (д, J=2,2 Гц, 1Н), 6,78 (дд, J=7,8 и 4,8 Гц, 1H), 3,15 (с, 3Н), 2,94-2,88 (м, 2Н), 2,66-2,60 (м, 2Н), 2,34 (с, 6Н); HRMS: вычислено для C18H22N4O2S 358,1459, найдено 358,1490. S. 3-(N-Метилпирролидин-2-илметил)-5-(2-нитрофениламино)-1Н-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил) -1Н-индол и о-нитрофторбензол. В качестве основания используют триэтиламин, в качестве растворителя - о-нитрофторбензол, и реакционную смесь кипятят с обратным холодильником в течение 24 часов. Колоночная хроматография дает названное в заголовке соединение (48%) в виде красного твердого аморфного вещества: 1 H ЯМР (CDCl3) δ 9,62 (ш.с, NH), 8,77 (ш.с, NH), 8,19 (дд, J=8,7 и 1,5 Гц, 1Н), 7,47 (д, J=1,6 Гц, 1Н), 7,38 (д, J=8,5 Гц, 1Н), 7,29-7,23 (м, 1Н), 7,09-7,00 (м, 3Н), 6,69-6,64 (м, 1Н), 3,20-3,12 (м, 2Н), 2,63 (дд, J=14,0 и 9,5 Гц, 1Н), 2,54-2,45 (м, 1Н), 2,45 (с, 3Н), 2,25 (дд, J=17,1 и 9,2 Гц, 1Н), 1,91-1,54 (м, 4Н); 13 С Я МР (CDCl3) δ 145,4, 135,7, 134,8, 132,1, 130,1, 128,6, 126,5, 123,6, 120,7, 116,4, 116,1, 114,1, 112,2, 66,7, 57,5, 40,8, 31,5, 29,8, 21,9; FAB HRMS: вычислено для [C20H22N4O 2·Н] 351,1823, найдено 351,1797. Т. 5-(6-Ме токси-3-нитропирид-2-иламино)-3(N-метилпирролидин-2-илметил)-1H-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 2-хлор-6-метокси-3нитропиридин. В качестве основания используют триэтиламин, в качестве растворителя - абсолютный этанол, и реакционную смесь кипятят с обратным холодильником в течение 5,5 часов. Колоночная хроматография дает названное в заголовке соединение (54%) в виде красного твердого аморфного вещества: Н ЯМР (CDCl3) δ 8,80 (ш.с, NH), 8,37 (д, J=9,1 Гц, 1Н), 7,85 (с, 1Н), 7,34-7,28 (м, 2H), 7,08 (д, J=2,1 Гц, 1Н), 6,14 (д, J=9,1 Гц, 1Н), 3,85 (с, 3Н), 3,19-3,11 (м, 2Н), 2,61 (дд, J=13,8 и 9,5 Гц, 1Н), 2,54-2,45 (м, 1Н), 2,45 (с, 3Н), 2,24 (дд, J=I7,1 и 9,3 Гц, 1Н), 1,91-1,54 (м, 4Н); 13 С Я МР (CDCl3) δ 166,9, 151,3, 138,2, 134,0, 129,6, 127,8, 123,3, 122,0, 118,6, 114,1, 113,3, 111,1, 102,0, 66,5, 57,5, 54,7, 40,8, 31,6, 29,9, 21,9; HRMS: вычислено для C20H23N5O3 381,1803, найдено 381,1799. U. 5-(4-Метил-3-нитропирид-2-иламино)-3-(Nметилпирролидин-2-илметил)–1H-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 2-хлор-4-метил-3-нитропиридин. В качестве основания применяют триэтиламин, в качестве растворителя - абсолютный этанол, и реакционную смесь кипятят с обратным холодильником в течение 24 часов. Колоночная хроматография дает названное в заголовке соединение (34%) в виде красного твердого аморфного вещества: 1 H ЯМР (CDCl3) δ 9,26 (ш.с, NH), 8,79 (ш.с, NH), 8,10 (д, J=4,8 Гц, 1Н), 7,64 (д, J=1,7 Гц, 1Н), 7,29 (д, J=8,5 Гц, 1Н), 7,17 (дд, J=8,5 и 1,9 Гц, 1Н), 6,97 (д, J=2,2 Гц, 1Н), 6,56 (д, J=4,8 Гц, 1Н), 3,25-3,16 (м, 2Н), 2,67 (дд, J=13,2 и 9,4 Гц, 1Н), 2,64-2,56 (м, 1Н), 2,56 (с, 3Н), 2,46 (с, 3Н), 2,30 (дд, J=17,7 и 9,4 Гц, 1Н), 1,90-1,60 (м, 4Н); 13 С Я МР (CDCl3) δ 152,2, 151,5, 146,6, 134,3, 131,1, 130,0, 127,9, 123,4, 119,4, 117,1, 114,0, 113,3, 111,6, 67,0, 57,4, 40,7, 31,4, 29,5, 21,8, 21,7; FAB HR MS: вычислен для [C20H23N5O 2·Н] 366,1932, найдено 366,1957. V. 3-(N-Метилпирролидин-2-илметил)-5-(3-нитро-5-фенилпирид-2-иламино)-1Н-индол Используют (R)-5-амино-3-(N-метилпиррролидин)-2-илметил)-4Н-индол и 2-бром-3-нитродифенил. В качестве основания используют триэтиламин, в качестве растворителя - N,N-диметилформамид, и реакционную смесь нагревают до 110°С в течение 12 часов. Колоночная хроматография дает названное в заголовке соединение (24%) в виде красного аморфного твердого вещества: 1 Н ЯМР (CDCl3) δ 9,63 (ш.с, NH), 8,97 (ш.с, NH), 8,42 (д, J=2,2 Гц, 1Н), 7,56-7,25 (м, 9Н), 7,08 (д, J=9,0 Гц, 2Н), 3,50-3,32 (м, 2Н), 2,95-2,79 (м, 2Н), 2,59-2,52 (м, 1H), 2,53 (с, 3Н), 2,05-1,71 (м, 4Н); 13 С Я МР (CDCl3) δ 144,4, 138,8, 134,9, 134,5, 132,4, 131,1, 130,2, 129,7, 129,0, 127,3, 126,2, 124,7, 124,1, 120,8, 116,7, 115,9, 112,7, 112,0, 67,9, 57,4, 40,6, 31,2, 28,6, 21,9; FAB HRMS: вычислено для [C26H26N4O 2·H] 427,2136, найдено 427,2099. W. 5-(3-Цианопирид-2-иламино)-3-(N-метилпирролидин-2-илметил)-1Н-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 2-хлорникотинонитрил. В качестве основания используют карбонат натрия, в качестве растворителя - N,N-диметилформамид, и реакционную смесь нагревают при 110°С в течение 20 часов . Колоночная хроматография дает названное в заголовке соединение (32%) в виде оранжевого твердого аморфного вещества. Rf=0,4 в смеси метиленхлорид:метанол:(гидроксид аммония) = 9:1:0,1: 13 41297 13 13 С Я МР (CDCl3) δ 157,7, 152,7, 141,7, 134,2, 129,8, 128,1, 123,1, 122,2, 118,7, 116,8, 113,6, 113,2, 111,5, 102,2, 66,6, 57,5, 40,8, 31,5, 30,0, 21,9; FAB HR MS: вычислено для [C20H21N5·H] 332,2073, найдено 332,1871. X. 5-(6-Изопропокси-3-нитропирид-2-иламино)3-(N-метилпирролидин-2-илметил)-1Н-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 2,6-дихлор-3-нитропиридин. Основание не применяют и в качестве растворителя используют 2-пропанол. Эту реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем к упомянутой реакционной смеси при охлаждении при 0°С по каплям добавляют раствор гидрида натрия (5 экв.) в 2-пропаноле. Полученную в результате смесь перемешивают при комнатной температуре в атмосфере азота в течение 2,5 часов. Реакционную смесь затем упаривают при пониженном давлении. Колоночная хроматография остатка дает названное в заголовке соединение (42%) в виде твердого оранжевого аморфного вещества: 1 Н ЯМР (СDСl3) δ 10,6 (ш.с, NH), 8,57 (ш.с, NH), 8,37 (д, J=9,2 Гц, 1Н), 7,71 (с, 1Н), 7,34-7,28 (м, 2Н), 7,05 (д, J=2,0 Гц, 1Н), 6,08 (д, J=9,2 Гц, 1Н), 5,14 (септ., J=6,2 Гц, 1Н), 3,18-3,10 (м, 2Н), 2,61 (дд, J=14,0 и 9,4 Гц, 1Н), 2,54-2,45 (м, 1Н), 2,44 (с, 3Н), 2,23 (дд, J=17,2 и 9,3 Гц, 1Н), 1,90-1,53 (м, 4Н), 1,25 (д, J=6,1 Гц, 3Н), 1,24 (д, J=6,2 Гц, 3Н); 13 С Я МР (CDCl3) δ 166,3, 151,8, 138,1, 134,1, 129,5, 127,9, 123,1, 121,7, 119,2, 114,2, 113,9, 111,0, 102,8, 70,4, 66,4, 57,5, 40,8, 31,5, 29,9, 21,9, 14,0, 11,0; FAB HRMS: вычислено для [C22H27N5O 3·Н] 410,2194, найдено 409,2187. Y. 5-(4-Циано-2-нитрофениламино)-3-(N-метилпирролидин-2-илметил)-1Н-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 4-хлор-3-нитробензонитрил. В качестве основания используют триэтиламин, в качестве растворителя - абсолютный этанол, и реакционную смесь кипятят с обратным холодильником в течение 4 часов. Колоночная хроматография дает названное в заголовке соединение (80%) в виде красного твердого вещества: Т. пл. 170,0-171,0°С; 13 С Я МР (СDСl3) δ 147,3, 137,1, 135,4, 132,0, 131,4, 128,6, 128,0, 125,3, 120,6, 117,9, 117,1, 116,3, 113,1, 111,9, 99,1, 68,1, 57,3, 40,6, 31,2, 28,1, 21,9. Элементный анализ для C21H21N5O2·0,05CH2Cl2: Вычислено: С 66,59; Н 5,60; N 18,44; Найдено: С 66,56; Н 5,26; N 18,42. Z. 3-(N-Метилпирролидин-2-илметил)-5-(4-трифторметил-2-нитрофениламино)-1Н-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 4-хлор-3-нитробензотрифторид. В качестве основания используют триэтиламин, в качестве растворителя - абсолютный этанол, и реакционную смесь кипятят с обратным холодильником в течение 4,5 часов. Колоночная хроматография дает названное в заголовке соединение (38%) в виде красной пены. Rf=0,30 в смеси метиленхлорид:метанол:(гидроксид аммония) = 9:1:0,1: С Я МР (CDCl3) δ 147,0, 139,7, 135,1, 131,6, 131,0, 129,2, 128,5, 124,7, 124,2, 120,7, 118,6, 116,8, 116,6, 113,6, 112,6, 67,1, 57,4, 40,8, 31,3, 29,2, 21,9; FAB LRMS 419 [МН+]. Элементный анализ для C21H21F3N 4O2 ·0,6СН2СІ2: Вычислено: С 55,27; Н 4,77; N 11,94; Найдено: С 55,44; Н 4,58; N 11,52. АА. 5-(5,6-Дихлор-2-нитрофениламино)-3-(Nметилпирролидин-2-илметил)-1H-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 1,2,3-трихлорнитробензол. В качестве основания используют карбонат натрия, в качестве растворителя - N,N-диметилформамид, и реакционную смесь нагревают при 125°С в течение 3 часов. Колоночная хроматография дает названное в заголовке соединение (60%) в виде твердого красного вещества. Rf=0,4 в смеси метиленхлорид:метанол:(гидроксид аммония) = 9:1:0,1: 1 H ЯМР (CDCl3) δ 8,59 (ш.с, NH), 8,36 (ш.с, NH), 7,96 (д, J=9,1 Гц, 1Н), 7,23 (д, J=8,6 Гц, 1Н), 7,09 (с, 1Н), 7,07 (д, J=9,1 Гц, 1Н), 6,99 (д, J=1,9 Гц, 1Н), 6,81 (дд, J=8,6 и 2,1 Гц, 1Н), 3,15-3,05 (м, 2Н), 2,54 (дд, J=13,8 и 9,6 Гц, 1Н), 2,46-2,33 (м, 1Н), 2,40 (с, 3Н), 2,22 (дд, J=17,4 и 9,3 Гц, 1Н), 1,84-1,48 (м, 4Н); FAB HRMS: вычислено для [C20H20Cl2N4O 2·H] 419,1044, найдено 419,1046. ВВ. 5-(5-Хлор-2-нитрофениламино)-3-((N-метилпирролидин-2-илметил)-1Н-индол Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол и 2,4-дихлорнитробензол. В качестве основания используют карбонат натрия, в качестве растворителя - N,N-диметилформамид, и реакционную смесь нагревают при 125°С в течение 3 часов. Колоночная хроматография дает названное соединение (50%) в виде твердого красного вещества. FAB HRMS: вычислено для [C20H21ClN4O2 ·H] 385,1434, найдено 385,1451. CC. 5-(4-Циано-2-нитрофениламино)-3([2R,4R)-N-метил-4-метоксипирролидин-2-илметил]-1Н-индол Используют 5-амино-3-[(2R,4R)-N-метил-4-метоксипирролидин-2-илметил]-1Н-индол и 4-хлор-3нитробензонитрил. В качестве основания применяют триэтиламин, в качестве растворителя –абсолютный этанол, и реакционную смесь кипятят с обратным холодильником в течение 3,5 часов. Колоночная хроматография дает названное в заголовке соединение (56%) в виде красного твердого аморфного вещества: 1 Н ЯМР (СDСl3) δ 9,92 (ш.с, NH), 8,54 (д, J=1,9 Гц, 1Н), 8,52 (ш.с, NH), 7,45-7,39 (м, 3Н), 7,13 (ш.с, 1Н), 7,03 (дд, J=8,8 и 1,7 Гц, 1Н), 7,03 (д, J=8,9 Гц, 1Н), 3,80-3,70 (м, 1Н), 3,26 (с, 3Н), 3,253,15 (м, 2Н), 2,70 (дд, J=14,2 и 9,5 Гц, 1Н), 2,492,38 (м, 1Н), 2,42 (c, 3Н), 2,25 (дд, J=10,8 и 5,3 Гц, 1Н), 2,19-2,10 (м, 1Н), 1,67-1,56 (м, 1Н); 13 С Я МР (СDСl3) δ 147,2, 137,0, 135,1, 132,1, 131,3, 128,5, 128,0, 124,1, 120,3, 118,0, 117,0, 116,8, 114,0, 112,6, 99,0, 78,5, 65,9, 62,4, 56,5, 40,6, 39,2, 29,5; FAB HRMS: вычислено для [C22H23N5O 3·Н] 406,1881, найдено 406,1872. 14 41297 13 Пример 2. Общая методика алкилирования (R)-5-(3-нитропирид-2-иламино)-3-(пирролидин-2метил)-1Н-индолов К перемешиваемому раствору (R)-5-(3-нитропирид-2-иламино)-3-(пирролидин-2-илметил)1Н-индола (0,337 г, 1,00 ммоль) и триэтиламина (0,126 г, 1,25 ммоль, 1,25 экв.) либо в безводном метиленхлориде, либо в безводном ацетонитриле, в абсолютном этаноле или в изопропаноле (10 мл) при комнатной температуре в атмосфере азота по каплям добавляют алкилирующий агент (1,25 ммоль). Полученный в результате реакционный раствор затем перемешивают в атмосфере азота при комнатной температуре или кипятят с обратным холодильником в течение 1-20 часов, в зависимости от субстрата. Полученную в результате реакционную смесь непосредственно подвергают колоночной хроматографии, используя силикагель (приблизительно 25 г) и элюирование смесью метиленхлорид:метанол:(гидроксид аммония) = 9:1:0,1, и получают названное в заголовке соединение. Следуя этой методике, получают перечисленные далее соединения. A. (R)-3-(N-Циклопропилметилпирролидин-2илметил)-5-(3-нитропирид-2-иламино)-1Н-индол Растворителем для реакции является метиленхлорид, алкилирующий агент представляет собой бромметилциклопропан и реакционный раствор кипятят с обратным холодильником в течение 4 часов. Хроматографией получают названное в заголовке соединение (34%) в виде темно-красной пены: 13 С Я МР (CDCl3) δ 155,7, 151,4, 135,5, 134,3, 129,4, 128,2, 123,1, 119,3, 114,4, 114,3, 113,0, 111,4, 65,0, 59,9, 55,0, 30,9, 30,3, 22,2, 10,0; FAB LRMS (m/z, относительная интенсивность) 392 (М+, 33), 374 (3), 307 (3), 267 (7), 220 (7), 154 (10), 124 (100); HRMS: вычислено для C22H25N5O2 391,2011, найдено 391,1988. В. (R)-5-(3-Нитропирид-2-иламино)-3-(N-(2пропинил)пирролидин-2-илметил)-1H-индол Растворителем для реакции является метиленхлорид, алкилирующий агент представляет собой пропаргилбромид и реакционный раствор перемешивают при комнатной температуре в течение 2 часов. Хроматография дает названное в заголовке соединение (69%) в виде темно-красной пены: 13 С Я МР (CDCl3) δ 155,7, 151,4, 135,5, 134,3, 129,4, 128,0, 123,1, 119,2, 114,3, 114,0, 113,0, 111,3, 79,1, 72,8, 61,6, 53,2, 40,8, 31,2, 29,8, 21,9; FAB LRMS (m/z, относительная интенсивность) 376 (МН+,67), 350 (5), 307 (17), 267 (12), 220 (10), 136 (100); HRMS: вычислено для C21H21N5O2 375,1697, найдено 375,1585. С. (R)-5-(3-Нитропирид-2-иламино)-3-(N-(2пропенил)-пирролидин-2-илметил)-1H-индол Растворителем для реакции является метиленхлорид, алкилирующий агент представляет собой аллилиодид и реакционный раствор перемешивают при комнатной температуре в течение 2,5 часов. Хроматография дает названное в заголовке соединение (59%) в виде темно-красной пены: С Я МР (CDCl3) δ 155,7, 151,2, 135,6, 134,2, 129,9, 128,2, 126,9, 126,6, 125,6, 125,1, 119,6, 113,4, 112,2, 109,6, 67,4, 56,3, 53,7, 30,7, 30,3, 27,2, 22,0; FAB LRMS (m/z, относительная интенсивность) 378 (М+,100), 336 (3), 267 (10), 220 (13), 136 (40). Элементный анализ для C21H23N5O2 ·1,6 СНСІ3 (хлороформ): Вычислено: С 47,75; Н 4,36; N 12,32; Найдено: С 47,89; Н 4,51; N 12,68; HRMS: вычислено для C21H23N5O2 377,1854, найдено 377,1881. D. (R)-5-(3-Нитропирид-2-иламино)-3-(N-пропилпирролидин-2-илметил)-1H-индол Растворителем для реакции является метиленхлорид, алкилирующий агент представляет собой пропилиодид и реакционный раствор перемешивают при комнатной температуре в течение 18 часов. Хроматография дает названное в заголовке соединение (26%) в виде темно-красной пены: 13 С Я МР (CDCl3) δ 155,6, 151,2, 135,5, 134,2, 130,0, 128,2, 126,8, 125,2, 119,7, 113,3, 113,1, 112,2, 109,6, 69,3, 56,9, 54,5, 30,6, 27,1, 22,0, 18,7, 11,4; FAB LRMS (m/z, относительная интенсивность) 380(М+, 80), 363 (3), 333 (5), 271 (6), 243 (8), 157 (60), 135 (43), 112 (100); El LRMS (m/z, относительная интенсивность) 379(М+, 0,2), 378 (1), 267 (3), 220 (5), 128 (14), 112 (100); HRMS: вычислено для C21H25N5O2 379,2011, найдено 379,2027. Е. (R)-3-(N-Бутилпирролидин-2-илметил)-5-(3нитропирид-2-иламино)-1Н-индол Растворителем для реакции является метиленхлорид, алкилирующий агент представляет собой бутилиодид и реакционный раствор перемешивают при комнатной температуре в течение 18 часов. Хроматография дает названное в заголовке соединение (33%) в виде темно-красной пены: 13 С Я МР (CDCl3) δ 155,7, 151,2, 135,5, 134,2, 130,0, 128,2, 126,8, 125,2, 119,7, 113,3, 113,2, 112,3, 109,5, 69,2, 55,0, 54,5, 30,6, 27,1, 26,8, 22,0, 20,0, 13,3; LRMS (m/z, относительная интенсивность) 393 (М+, 0,2), 392 (1), 391 (1), 267 2), 220 (3), 126 (100); HRMS: вычислено для C22H27N5O2 393,2167, найдено 393,2156. F. 3-(N-(2-Гидроксициклопентил) пирролидин2-илметил)-5-(3-нитропирид-2-иламино)-1Н-индол Растворителем для реакции является метиленхлорид, алкилирующий агент представляет собой циклопентеноксид и реакционный раствор нагревают при температуре кипения с обратным холодильником (82%) в течение 20 часов. Хроматография дает названное в заголовке соединение (57%) в виде темно-красной пены, содержащей смесь диастереомеров у атома углерода, присоединенного к спирту. 13 С Я МР (CDCl3) δ 155,6, 151,3, 135,5, 134,2, 129,3, 129,3, 128,1, 123,3, 123,2, 119,0, 118,9, 114,6, 114,2, 114,2, 113,0, 111,4, 111,4, 75,5, 74,7/70,6, 69,1, 62,4, 61,7, 51,1, 48,2, 34,6, 32,8, 31,1, 30,9, 30,8, 30,3, 29,2, 23,1, 23,0, 22,7, 21,7, 20,5; 15 41297 1 LRMS (m/z, относительная интенсивность) 421 (М+, 0,2), 420 (1), 419 (1), 418 (55), 380 (13), 348 (22), 279 (100), 218 (30), 169 (44), 154 (91); HRMS: вычислено для C23H27N5O3 421,2116, найдено 421,2040. G. (R)-3-(N-Этилпирролидин-2-илметил)-5-(3нитропирид-2-иламино)-1Н-индол Растворителем в реакции является ацетонитрил, алкилирующий агент представляет собой этилиодид, реакционный раствор перемешивают при комнатной температуре в течение 7 часов. Хроматография дает названное в заголовке соединение (32%) в виде темно-красной пены: 13 С Я МР (CDCl3) δ 155,6, 151,2, 135,5, 134,2, 130,0, 128,2, 126,8, 125,2, 119,7, 113,3, 113,2, 112,2, 109,5, 68,8, 53,8, 50,1, 30,7, 27,2, 21,9, 10,5; FAB LRMS (m/z, относительная интенсивность) 366 (МН+, 100), 332 (8), 257 (8), 229 (15), 157 (55), 135 (37); HRMS: вычислено для C20H23N5O2 365,1854, найдено 365,1836. Н. (R)-5-(3-Нитропирид-2-иламино)-3-(N-пентилпирролидин-2-илметил)-1Н-индол Растворителем для реакции является метиленхлорид, алкилирующий агент представляет собой пентилиодид и реакционный раствор перемешивают при комнатной температуре в течение 18 часов. Хроматография дает названное в заголовке соединение (23%) в виде темно-красной пены: 13 С Я МР (СDСl3) δ 155,6, 151,2, 135,5, 134,2, 130,0, 128,2, 126,8, 125,3, 119,7, 113,3, 113,1, 112,2, 109,6, 69,1, 55,2, 54,5, 30,7, 28,7, 27,2, 24,5, 22,0, 21,8, 13,7; FAB LRMS (m/z, относительная интенсивность) 408 (МН+, 36), 327 (8), 136 (100); HRMS: вычислено для C23H29N5O2 407,2324, найдено 407,2299. I. (R)-3-(N-(2-Метилоксиэтил)пирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1Н-индол Растворителем для реакции является смесь ацетонитрил - метиленхлорид (1:1), алкилирующий агент представляет собой смесь 2-бромэтилметилового эфира с иодидом натрия (1,25 ммоль) и реакционный раствор нагревают при температуре кипения с обратным холодильником (40°С) в течение 7 часов. Хроматография дает названное в заголовке соединение (32%) в виде темно-красной пены: 13 С Я МР (СDСl3) δ 155,7, 151,2, 135,5, 134,2, 129,8, 128,1, 126,9, 125,0, 119,6, 113,4, 113,3, 112,2, 109,4, 69,1, 66,9, 59,0, 55,4, 46,4, 29,9, 26,8, 22,0; LRMS (m/z, относительная интенсивность) 395(М+, 0,5), 394 (1), 348 (20), 267 (39), 220 (68), 128 (100); HRMS: вычислено для C21H25N5O3 395,1960, найдено 395,1940. J. (R)-3-(N-(2-Цианоэтил)пирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1Н-индол Растворителем для реакции является абсолютный этанол, алкилирующий агент представляет собой акрилонитрил, основание не используют и реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Хроматография дает названное в заголовке соединение (27%) в виде темно-красной пены: Н ЯМР (СDСl3) δ 10,1 (ш.с, 1Н), 8,52 (дд, J=8,4 и 1,6 Гц, 1Н), 8,44 (дд, J=1,5 и 4,4 Гц, 1Н), 8,19 (ш.с, 1Н), 7,76 (ш.с, 1Н), 7,38-7,27 (м, 2Н), 7,09 (д, J=1,5 Гц, 1Н), 6,76 (дд, J=4,5 и 8,3 Гц, 1Н), 3,27-3,13 (м, 4Н), 3,08-3,01 (м, 1Н), 2,88-2,78 (м, 1Н), 2,74-2,49 (м, 4Н), 2,32-2,22 (м, 1Н), 1,90-1,57 (м, 4Н); LRMS (m/z, относительная интенсивность) 390 (М+, 17), 335 (5), 268 (54), 220 (24), 123 (100); HRMS: вычислено для C21H22N6O2 390,1807, найдено 390,1773. К. (R)-3-(N-(2-Цианометил)пирролидин-2-илметил)-5-(3-нитропирид-2-иламино)-1Н-индол Растворителем для реакции является смесь ацетонитрил - метиленхлорид (3:2), алкилирующий агент представляет собой бромацетонитрил и реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Хроматография дает названное в заголовке соединение (76%) в виде темно-красной пены: 13 С Я МР (CDCl3) δ 155,8, 151,4, 135,5, 134,2, 129,6, 128,1, 127,9, 123,3, 119,3, 115,5, 114,1, 113,1, 111,5, 62,1, 53,7, 40,7, 31,2, 29,9, 22,2; LPMS (m/z, относительная интенсивность) 376(М+, 6), 375 (28), 279 (58), 180 (10), 16 (14), 109 (100); HRMS: вычислено для C20H20N6O2 376,1650, найдено 376,1641. Пример 3. Общая методика получения 5-ариламино-3-(пиперид-4-ил)-1Н-индолов, 5-ариламино3-(1,2,5,6-тетрагидропирид-4-ил)-1Н-индолов или 5-арилокси-3-(1,2,5,6-тетрагидропирид-4-ил)-1Ниндолов при отщеплении защитных групп от 5ариламино-3-(N-трет-бутоксикарбонилпиперид-4ил)-1Н-индолов, 5-ариламино-3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-1Н-индолов или 5-арилокси-3-(N-трет-бутоксикарбонил1,2,5,6-тетрагидропирид-4-ил)-1Н-индолов, соответственно Через раствор 5-ариламино-3-(N-трет-бутоксикарбонилпиперид-4-ил)-1Н-индола, 5-ариламино3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-1Н-индола или 5-арилокси-3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-1Ниндола (2,00 ммоль) в абсолютном этаноле (20 мл) при перемешивании, при 0°С, пропускают газообразный НСl в течение приблизительно 15 минут. Полученную в результате смесь перемешивают при 0°С в атмосфере азота в течение 6 часов. Смесь затем фильтруют и получают 5-ариламино-3-(пиперид-4-ил)-1Н-индол, 5-ариламино-3(1,2,5,6-тетрагидропирид-4-ил)-1Н-индол или 5арилокси-3-(1,2,5,6-тетрагидропирид-4-ил)-1Ниндол в виде гидрохлорида (НСl-соли). А. 5-(3-Нитропирид-2-иламино)-3-(пиперид-4ил)-1Н-индол Используют 3-(N-трет-бутоксикарбонилпиперид-4-ил)-5-(3-нитропирид-2-иламино)-1Н-индол. Фильтрацией получают названное в заголовке соединение (83%) в виде темно-красного твердого вещества : Т. пл., разложение, 220°С; 13 С ЯМР (ДМСО-d6) δ 155,5, 150,8, 135,7, 134,4, 129,2, 127,9, 126,0, 121,8, 119,3, 118,3, 114,5, 113,4, 111,5, 43,5, 31,0, 29,0; LRMS (m/z, о тносительная интенсивность), 337 (М+, 31), 302 (44), 281 (31), 240 (100). Элементный анализ для C18H19N5O2 ·3,0НСl: 16 41297 Вычислено: С 48,39; Н 4,96; N 15,68; Найдено: С 48,73; Н 5,16; N 15,21. В. 5-(3-Нитропирид-2-иламино)-3-(1,2,5,6-тетрагидропирид-4-ил)-1Н-индол Используют 3-(N-трет-бутоксикарбонил-1,2,5,6 -тетрагидропирид-4-ил)-5-(3-нитропирид-2-иламино)-1Н-индол. Фильтрация дает названное в заголовке соединение (82%) в виде темно-красного твердого вещества: Т. пл., разложение, 204°С; 13 С ЯМР (ДМСО-d6) δ 155,3, 150,7, 135,7, 134,9, 130,5, 130,0, 128,1, 124,7, 124,3, 119,6, 115,7, 114,7, 113,5, 111,8, 48,6, 41,2, 23,9; Элементный анализ для C18H17N5O2·2,75 НСl·СН3ОН (метанол): Вычислено: С 48,80; Н 5,12; N 14,98; Найдено: С 49,11; Н 5,14; N 15,34. С. 5-(5-Нитропирид-2-иламино)-3-(1,2,5,6-тетрагидропирид-4-ил)-1H-индол Используют 3-(N-трет-бутоксикарбонил-1,2,5,6 -тетрагидро-пирид-4-ил)-5-(5-нитропирид-2-иламино)-1Н-индол. Фильтрация дает названное в заголовке соединение (87%) в виде темно-красного твердого вещества: Т. пл., разложение, 273°С; 13 С ЯМР (ДМСО-d6) δ 159,9, 146,7, 135,2, 134,2, 132,2, 131,9, 130,1, 124,5, 124,4, 118,0, 115,0, 113,0, 112,1, 41,9, 40,6, 24,7; LRMS (m/z, о тносительная интенсивность), 336 (20), 335 (М+, 100), 306 (50), 294 (53), 167 (67). Элементный анализ для C18H17N5O2·2,1HCl: Вычислено: С 52,48; Н 4,67; N 17,00; Найдено: С 52,41; Н 4,54; N 16,71. D. 5-(3-Нитропирид-2-илокси)-3-(1,2,5,6-тетрагидропирид-4-ил)-1Н-индол Используют 3-(N-трет-бутоксикарбонил1,2,5,6-тетрагидропирид-4-ил)-5-(3-нитропирид-2илокси)-1Н-индол. Фильтрация дает названное в заголовке соединение (53%) в виде твердого желтого ве щества: Т. пл. 244,0-245,0°С; 13 С ЯМР (ДМСО-d6) δ 155,9, 152,1, 146,2, 135,9, 134,8, 134,1, 129,7, 125,3, 124,6, 118,7, 116,2, 114,9, 112,7, 112,4, 112,3, 41,2, 24,0. Элементный анализ для C18H16N4O3 ·1,5НСl·0,5СН3ОН (метанол): Вычислено: С 54,59; Н 4,83; N 13,76; Найдено: С 54,21; Н 4,56; N 13,44. Е. 5-(5-Нитропирид-2-илокси)-3-(1,2,5,6-тетрагидропирид-4-ил)-1Н-индол Используют 3-(N-трет-бутоксикарбонил-1,2,5,6 -тетрагидропирид-4-ил)-5-(5-нитропирид-2-илокси) -1Н-индол. Фильтрация дает названное в заголовке соединение (19%) в виде оранжевой пены: 13 С ЯМР (ДМСО-d6) δ 167,7, 146,2, 144,9, 140,0, 135,5, 134,8, 129,7, 124,2, 115,5, 112,7, 112,3, 110,9, 44,7, 42,8, 28,1; LRMS (m/z, относительная интенсивность), 336(М+, 24), 307 (9), 210 (100), 185 (40). HRMS: вычислено для C18H16N4O3 336,1224, найдено 336,1196. Пример 4. 3-(2-Диметиламиноэтил)-5-(3-аминопирид-2-иламино)-1Н-индол Смесь 3-(2-диметиламиноэтил)-5-(3-нитропирид-2-иламино)-1Н-индола (1,27 г, 3,90 ммоль), 10% Pd-на-угле (200 мг) и абсолютного этанола (20 мл) встряхивают в а тмосфере водорода (3 атм) в течение 2 часов. Реакционную смесь фильтруют через диатомовую землю и фильтрат упаривают при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле (приблизительно 40 г) и элюируют абсолютным этанолом, получают названное в заголовке соединение (0,74 г, 64%), в виде не совсем белого твердого вещества: Т. пл. 196,0-198,0°С, с выделением газа. 13 С ЯМР (ДМСО-d6) δ 145,3, 134,5, 133,6, 132,1, 131,0, 127,3, 122,6, 118,8, 116,1, 114,2, 112,1, 110,8, 108,6, 60,1, 45,2, 23,4; HRMS вычислено для C17H21N5 295,1793, найдено 295,1810. Элементный анализ для C17H21N5·0,4С2Н6О (этанол): Вычислено: С 68,13; Н 7,52; N 22,32; Найдено: С 68,12; Н 7,19; N 22,51. Пример 5. 3-(2-Диметиламиноэтил)-5-(3-фенилкарбониламинопирид-2-иламино)-1Н-индол К раствору 3-(2-диметиламиноэтил)-5-(3-аминопирид-2-иламино)-1Н-индол (0,157 г, 0,53 ммоль) и триэтиламина (74 мкл, 0,54 ммоль, 1,0 экв.) в безводном тетрагидрофуране (3 мл) добавляют по каплям при перемешивании бензоилхлорид (62 мкл, 0,54 ммоль, 1,0 экв.). Образующуюся в результате реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 15 минут. Добавляют насыщенный раствор бикарбоната натрия (10 мл) и эту водную смесь экстрагируют этилацетатом (3x10 мл). Органические экстракты объединяют, сушат (MgSO4) и упаривают при пониженном давлении. Остаток обрабатывают диэтиловым эфиром и получают названное в заголовке соединение (0,082 г, 39%) в виде твердого аморфного вещества: 13 С ЯМР (ДМСО-d6) δ 166,5, 151,9, 144,5, 134,5, 132,7, 132,5, 131,6, 128,3, 128,0, 127,2, 122,8, 119,6, 117,3, 113,3, 112,1, 110,8, 110,4, 59,9, 45,0, 23,1; LRMS (m/z, о тносительная интенсивность), 339 (М+, 100), 354 (33), 249 (10), 235 (18), 204 (10), 160 (86); HRMS: вычислено для C24H25N5O 399,2062, найдено 399,2080. Пример 6. 3-(2-Диметилаоминоэтил)-5-(6-бензиламино-карбонил-3-метилтио-1,2,4-триазин-5иламино)-1Н-индол К перемешиваемой смеси 3-(2-диметиламиноэтил)-5-(6-этоксикарбонил-3-метилтио-1,2,4-триазин-5-иламино)-1Н-индола (0,25 г, 0,62 ммоль), в метиленхлориде (5 мл) при комнатной температуре в атмосфере азота добавляют по каплям бензиламин (0,14 мл, 1,25 ммоль, 2,0 экв.). Образующуюся в результате реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 48 часов и затем фильтруют. Полученное в результате твердое желтое вещество перекристаллизовывают из смеси метанол - этилацетат (4:1) и получают названное в заголовке соединение (0,063 г, 22%) в виде желтого твердого вещества : Т. пл.207,0-209,0°С; FAB HRMS: вычислено для [C24H27N 7OS·Н+] 462,2079, найдено 462,2054. Элементный анализ для C24H27N7OS·3,4Н2O: Вычислено: С 60,67; Н 6,05; N 20,63; 17 41297 Найдено: С 60,58; Н 5,73; N 20,58. Пример 7 N-Метил-3-(5-фенилкарбониламиноиндол-3-ил)сукцинамид Раствор 5-фенилкарбониламино-1Н-индола (2,50 г, 10,58 ммоль) (Chem. Abstracts, 10991g (1954)) и N-метилимида малеиновой кислоты (2,94 г, 26,46 ммоль, 2,5 экв.) в ледяной уксусной кислоте (75 мл) кипятят с обратным холодильником в атмосфере азота в течение 24 часов. Полученный в результате реакционный раствор упаривают при пониженном давлении и оставшееся масло растворяют в этилацетате (50 мл). Этот раствор промывают насыщенным раствором бикарбоната натрия (2x25 мл), сушат (MgSO4) и выпаривают при пониженном давлении. Оставшееся масло подвергают колоночной хроматографии, используя силикагель (приблизительно 100 г) и элюирование смесью этилацетат:гексан (градиент от 1:3 до 1:1), получают названное в заголовке соединение (1,06 г, 29%) в виде белого твердого вещества : Т. пл. 226,5-227,5°С; FAB LRMS (m/z, о тносительная интенсивность), 348 (МН+, 100), 332 (2), 275 (4), 263 (5). Элементный анализ для C20H17N3O3·1/8Н2 О: Вычислено: С 68,71; Н 4,97; N 12,02; Найдено: С 68,68; Н 4,74; N 11,91. Пример 8. 5-Бензиламино-3-(N-метилпирролидин-3-ил)-1Н-индол К раствору N-метил-3-(5-фенилкарбонил-аминоиндол-3-ил)сукцинамида (18,31 г, 52,71 ммоль) в безводном тетрагидрофуране (270 мл) при 0°С при перемешивании добавляют алюмогидрид лития (20,01 г, 527 ммоль, 10 экв.) в виде твердого вещества порциями в течение 45 минут. Полученную в результате реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 24 часов. Затем к реакционной смеси осторожно добавляют воду (5 мл) и этилацетат (100 мл). Полученную в результате смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь фильтруют и фильтрат упаривают при пониженном давлении. Оставшееся масло подвергают колоночной хроматографии, используя силикагель (приблизительно 500 г) и элюирование смесью этилацетат:метанол:триэтиламин (градиент от 9:0:1 до 8:1:1) и получают названное в заголовке соединение (7,90 г, 49%) в виде светло-желтого масла: 13 С Я МР (ацетон-d6) δ 142,9, 142,1, 132,3, 129,3, 128,6, 127,5, 121,9, 118,6, 112,5, 102,0, 63,6, 57,1, 49,9, 42,8, 36,5, 33,0; FAB LRMS (m/z, о тносительная интенсивность), 306 (МН+, 100), 263 (4), 248 (4), 223 (8). Пример 9. 5-Амино-3-(N-метилпирролидин-3ил)-1Н-индол Смесь 5-бензиламино-3-(N-метилпирролидин3-ил)-1Н-индола (7,80 г, 25,5 ммоль), формиата аммония (16,10 г, 255 ммоль, 10 экв.) и 10% Pd-наугле (0,78 г) в абсолютном этаноле (250 мл) кипятят с обратным холодильником в атмосфере азота в течение 1 часа. Реакционную смесь фильтруют и фильтрат упаривают при пониженном давлении. Оставшееся масло подвергают колоночной хроматографии, используя силикагель (приблизительно 200 г) и элюирование 0,3% триэтиламина в метаноле, получают названное в заголовке соединение (0,9 г, 16%) в виде светло-желтого масла: 1 Н ЯМР (CD3OD) δ 7,13 (д, J=8,5 Гц, 1Н), 6,94 (ш.с, 2Н), 6,65 (дд, J=2,0 и 8,5 Гц, 1Н), 4,91 (с, 2-NH), 3,66-3,50 (м, 1Н), 3,17-3,08 (ш.т, 1Н), 2,96-2,85 (м, 1Н), 2,67-2,50 (м, 2Н), 2,40 (с, 3Н), 2,37-2,24 (м, 1Н), 2,08-1,93 (м, 1Н); FAB LRMS (m/z, относительная интенсивность 216 (МН+, 100). Пример 10 (R)-3-(R-Бензилоксикарбонилпирролидин-2-илкарбонил)-5-дибензиламино-1Ниндол К смеси (R)-N-карбобензилоксипролина (3,59 г, 14,41 ммоль) и N,N-диметилформамида (0,1 мл) в метиленхлориде (45 мл) при перемешивании добавляют по каплям оксалилхлорид (1,8 мл, 21,62 ммоль, 1,5 экв.). Полученную в результате выделяющую газ смесь перемешивают при комнатной температуре в атмосфере азота в течение 1,5 часов. Реакционный раствор затем упаривают при пониженном давлении, получая в остатке хлорангидрид (R)-N-карбобензилокси-пролиновой кислоты, который растворяют в безводном эфире (50 мл). Этот раствор по каплям и при перемешиваний добавляют к предварительно подготовленному раствору 5-дибензиламиноиндола (9,00 г, 28,81 ммоль, 2,0 экв.) и этилмагнийбромида (3,0М в эфире, 10,08 мл, 30,25 ммоль, 2,1 экв.) в безводном эфире (75 мл), который перед добавлением в него эфирного раствора хлорангидрида (R)-N-карбобензилоксипролиновой кислоты перемешивают при комнатной температуре в атмосфере азота в течение 30 минут. Полученную в результате реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 30 минут и затем добавляют этилацетат (100 мл) и насыщенный раствор бикарбоната натрия (75 мл). Органический слой удаляют и водный слой экстрагируют этилацетатом (100 мл). Органические экстракты объединяют, сушат (MgSO4) и упаривают при пониженном давлении, получают масло зеленого цвета. Обрабатывают это масло безводным эфиром (50 мл) и получают названное в заголовке соединение в виде белого твердого вещества: Т. пл. 176,0-177,0°С; LRMS (m/z, о тносительная интенсивность), 543 (М+, 100), 453 (10), 407 (7), 339 (40), 307 (10), 247 (10), 154 (38); [α]25=+112° (ТГФ, с=1,0). Элементный анализ для С 35Н33N3О3 : Вычислено: С 77,32; Н 6,12; N 7,73; Найдено: С 77,35; Н 6,30; N 7,66. Пример 11. (R)-5-Дибензиламино-3-(N-метилпирролидин-2-илметил)-1Н-индол К смеси алюмогидрида лития (0,96 г, 25,2 ммоль, 2,0 экв.) с безводным тетрагидрофураном (125 мл) при перемешивании и при 0°С добавляют по каплям раствор (R)-3-(N-бензилоксикарбонилпирролидин-2-илкарбонил)-5-дибензиламино-1Н-индола (6,90 г, 12,69 ммоль) в безводном тетрагидрофуране (25 мл). Полученную в результате реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 30 минут. Затем добавляют борогидрид лития (0,55 г, 25,2 ммоль, 2,0 экв.) и реакционную смесь нагревают при температуре кипения с об 18 41297 ратным холодильником (66°С) в атмосфере азота в течение 6 часов. Реакционную смесь охлаждают и добавляют последовательно воду (1,5 мл), раствор гидроксида натрия (20%, 1,5 мл) и еще раз воду (4,5 мл). Полученную в результате смесь перемешивают при комнатной температуре в атмосфере азота в течение 1 часа, фильтруют через диатомовую землю, фильтрат упаривают при пониженном давлении и получают масло зеленого цвета (8,8 г). Масло растворяют в абсолютном этаноле (90 мл) и добавляют карбонат цезия (8,0 г) и карбонат натрия (8,0 г). Полученную в результате смесь кипятят с обратным холодильником в течение 12 часов. Реакционную смесь затем упаривают при пониженном давлении и остаток обрабатывают насыщенным раствором бикарбоната натрия (50 мл) и етилацетатом (100 мл). Органический слой удаляют, а водный слой экстрагируют этилацетатом (100 мл). Органические экстракты объединяют, сушат (MgSO 4) и упаривают при пониженном давлении, получают коричневое масло. Колоночная хроматография масла с использованием силикагеля (приблизительно 200 г) и элюирования смесью метиленхлорид:метанол:гидроксид аммония) (9:1:0,1) дает названное в заголовке соединение (4,63 г, 89%) в виде светлозеленой пены: 1 H ЯМР (CDCl3) δ 7,82 (ш.с, NH), 7,35-7,19 (м, 10Н), 7,20 (д, J=8,6 Гц, 1Н), 6,95 (д, J=2,1 Гц, 1Н), 6,85 (дд, J=2,3 и 8,7 Гц, 1Н), 6,80 (д, J=2,2 Гц, 1Н), 4,65 (с, 4Н), 3,25-3,02 (м, 2Н), 2,52 (дд, J=9,5 и 13,9 Гц, 1Н), 2,39-2,15 (м, 1Н), 2,30 (с, 3H), 1,85-1,40 (м, 4Н); 13 С Я МР (CDCl3) δ 143,2, 139,7, 130,5, 128,5, 128,2, 127,3, 126,8, 122,9, 112,9, 112,5, 112,2, 111,8, 103,4, 67,0, 57,4, 56,4, 40,6, 31,4, 29,7, 21,9; HRMS: вычислено для C28H31N3 409,2520, найдено 409,2475. Пример 12. (R)-5-Амино-3-(N-метилпирролидин-2-илметил)-1Н-индол Смесь (R)-5-дибензиламино-3-(N-метилпирролидин-2-илметил)-1Н-индола (1,08 г, 2,64 ммоль) и гидроксида палладия (II)-на-угле (0,6 г) в абсолютном этаноле (25 мл) встряхивают в а тмосфере водорода (3 атм) при 40°С в течение 4 часов. Полученную в результате смесь фильтруют через диатомовую землю, фильтрат упаривают при пониженном давлении и получают названное в заголовке соединение (0,60 г, 2,62 ммоль, 99%) в виде белой пены: 1 Н ЯМР (ДМСО-d6) δ 10,65 (ш.с, NH), 7,14 (д, J=2,2 Гц, 1Н), 7,12 (д, J=8,6 Гц, 1Н), 6,85 (д, J=1,6 Гц, 1Н), 6,60 (дд, J=2,0 и 8,6 Гц, 1Н), 3,63-2,83 (м, 7Н), 2,78 (с, 3Н), 2,05-1,67 (м, 4Н); [α]25=+9° (МеОН, с=1,0); HRMS: вычислено для C14H19N3 229,1575, найдено 229,1593. Пример 13. (R)-3-(N-Бензилоксикарбонилпирролидин-2-илметил)-5-дибензиламино-1Н-индол К раствору (R)-3-(N-бензилоксикарбонилпирролидин-2-ил-карбонил)-5-дибензиламино-1Н-индола (1,50 г, 2,75 ммоль) в безводном тетрагидрофуране (30 мл) при перемешивании добавляют борогидрид лития (0,24 г, 11,0 ммоль, 4,0 экв.) в твердом виде. Полученную в результате реакционную смесь кипятят с обратным холодильником в течение 4 часов. Затем добавляют насыщенный раствор бикарбоната натрия (10 мл) и эту смесь перемешивают при комнатной температуре в течение 30 минут. Водную смесь затем экстрагируют этилацетатом (3x25 мл), органические экстракты объединяют, сушат (MgSO4) и упаривают при пониженном давлении. Колоночная хроматография остатка с использованием силикагеля (приблизительно 50 г) и элюирования смесью этилацетат гексан (1:3) дает названное в заголовке соединение (1,02 г, 70%) в виде белой пены. FAB LRMS (m/z, относительная интенсивность) 530 (МН+, 87), 529 (М+, 100), 439 (10), 409 (10), 325 (32), 235 (20). Пример 14. (R)-5-Амино-3-(пирролидин-2-илметил)-1Н-индол Смесь (R)-3-(N-бензилоксикарбонилпирролидин-2-илметил)-5-дибензиламино-1Н-индола (7,90 г, 14,91 ммоль) и влажного гидроксида палладия (II)-на-угле (катализатор Pearlman, 3,16 г) в абсолютном этаноле (100 мл) встряхивают в атмосфере водорода (3 атм) в течение 12 часов при комнатной температуре. Полученную в результате смесь фильтруют через диатомовую землю. Фильтрат упаривают и сушат при пониженном давлении, получают названное в заголовке соединение в виде белой пены (3,20 г, 100%): 1 Н ЯМР (CD3OD) δ 7,18 (д, J=8,5 Гц, 1Н), 7,08 (с, 1Н), 6,92 (д, J=2,0 Гц, 1Н), 6,69 (дд, J=1,9 и 8,5 Гц, 1Н), 3,81-3,69 (м, 1Н), 3,30-2,95 (м, 4Н), 2,05-1,55 (м, 4Н); 13 С ЯМР (CD3OD) δ 140,1, 133,4, 129,1, 125,0, 114,6, 113,1, 109,8, 105,1, 62,1, 46,0, 31,1, 29,1, 24,3; LRMS (m/z, относительная интенсивность) 215 (М+, 2), 198 (1), 146 (100), 128 (7), 117 (9), 70 (60). Пример 15. Общая методика конденсации 5амино-3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-1Н-индола, 5-амино-3-(N-третбутоксикарбонилпиперид-4-ил)-1Н-индола или 3(N-трет-бутоксикарбонил-1,2,5,6-тетрарагидропирид-4-ил)-5-гидрокси-1Н-индола с 2-хлорпиридинами с целью получения 3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-(пирид-2иламино)-1Н-индолов, 3-(N-трет-бутоксикарбонилпиперид-4-ил)-5-(пирид-2-иламино)-1Н-индолов или 3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-(пиридин-2-илокси)-1Н-индолов, соответственно К раствору 5-амино-3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-1Н-индола, 5-амино-3-(N-трет-бутоксикарбонилпиперид-4-ил)1Н-индола или 3-(N-трет-бутоксикарбонил-1,2,5,6тетрагидропирид-4-ил)-5-гидрокси-1Н-индола (10,0 ммоль) и основания (12,0 ммоль, 1,2 экв.) в безводном тетрагидрофуране или диоксане (35 мл) добавляют 2-хлорпиридин (11,0 ммоль, 1,1 экв.). Полученный в результате реакционный раствор перемешивают при комнатной температуре с обратным холодильником или при комнатной температуре в атмосфере азота в течение 3-48 часов, в зависимости от субстрата и растворителя. Затем к реакционной смеси добавляют насыщенный раствор бикарбоната натрия (25 мл) и эту водную смесь экстрагируют этилацетатом (3x25 мл). Органические экстракты объединяют, сушат (МgSO 4) и упаривают при пониженном давлении. Остаток подвергают колоночной хрома 19 41297 тографии, используя силикагель (приблизительно 150 г) и элюирование соответствующей системой растворителей, и получают нужный 3-(N-третбутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5(пирид-2-иламино)-1Н-индол, 3-(N-трет-бутоксикарбонилпиперид-4-ил)-5-(пирид-2-иламино)-1Ниндол или 3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-(пиридин-2-илокси)-1Ниндол. Следуя этой методике, получают перечисленные далее соединения. А. 3-(N-трет-Бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-(3-нитропирид-2-иламино)-1Ниндол Используют 5-амино-3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-1Н-индол и 2хлор-3-нитропиридин. Основанием является триэтиламин, растворителем является тетрагидрофуран, реакционную смесь нагревают при температуре кипения с обратным холодильником (66°С) в течение 8 часов и системой растворителей для хроматографии является смесь диэтиловый эфир - гексан (градиент от 1:1 до 1:0). Получают названное в заголовке соединение (73%) в виде темно-красной пены: 1 Н ЯМР (СDСl3) δ 10,1 (ш.с, 1Н), 8,51 (дд, J=1,8 и 8,4 Гц, 1Н), 8,43 (дд, J=1,8 и 4,5 гц, 1Н), 8,20 (ш.с, 1Н), 8,00 (ш.с, 1Н), 7,40-7,35 (м, 2Н), 7,19 (д, J=2,5 Гц, 1Н), 6,75 (дд, J=4,5 и 8,3 Гц, 1Н), 6,12 (ш.м, 1Н), 4,12 (ш.м, 2Н), 3,66 (ш.т, J=5,7 Гц, 2Н), 2,55 (ш.м, 2Н), 1,49 (с, 9Н); ТСХ (диэтиловый эфир): Rf=0,4. В. 3-(N-трет-Бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-(5-нитропирид-2-иламино)-1Ниндол Используют 5-амино-3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-1Н-индол и 2хлор-5-нитропиридин. Основанием является триэтиламин, растворителем является тетрагидрофуран, реакционную смесь нагревают при температуре кипения с обратным холодильником (66°С) в течение 48 часов и системой растворителей для хроматографии является смесь метиленхлорид:гексан (1:1), получают названное в заголовке соединение (76%) в виде темно-красной пены: 1 Н ЯМР (CDCl3) δ 8,95 (д, J=2,4 Гц, 1Н), 8,18 (дд, J=2,8 и 9,3 гц, 1Н), 7,96 (ш.с, 1Н), 7,38 (д, J=8,9 Гц, 1Н), 7,32 (с, 1Н), 7,24 (дд, J=2,2 и 8,8 Гц, 1Н), 6,70 (д, J=9,0 Гц, 1Н), 6,10 (ш.м, 1Н), 4,89 (с, 2-NH), 4,08 (ш.м, 2Н), 3,65 (ш.т, J=5,6 Гц, 2Н), 2,56 ш.м, 2Н), 1,49 (с, 9Н); ТСХ (диэтиловый эфир): Rf=0,45. С. 3-(N-трет-Бутоксикарбонилпиперид-4-ил)-5(3-нитропирид-2-иламино)-1Н-индол Используют 5-амино-3-(N-трет-бутоксикарбонилпиперид-4-ил)-1Н-индол и 2-хлор-3-нитропиридин. Основанием является триэтиламин, растворителем является диоксан, реакционную смесь нагревают при температуре кипения с обратным холодильником (101°С) в течение 5 часов и системой растворителей для хроматографии является раствор этилацетата (30-40%) в гексане, получают названное в заголовке соединение (70%) в виде темно-красной пены: 13 С Я МР (CDCl3) δ 155,8, 155,0, 151,6, 135,5, 134,6, 129,4, 126,9, 121,3, 120,8, 119,8, 114,8, 113,1, 111,5, 79,4, 44,5, 33,6, 32,8, 28,5. Элементный анализ для C23H27N5O 4·1/4С4Н8O 2 (этилацетат): Вычислено: С 62,73; Н 6,36; N 15,24; Найдено: С 62,51; Н 6,08; N 15,21. D. 3-(N-трет-Бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-(3-нитропирид-2-илокси)-1Ниндол Используют 3-(N-трет-бутоксикарбонил1,2,5,6-тетрагидропирид-4-ил)-5-гидрокси-1Ниндол и 2-хлор-3-нитропиридин. Основанием является гидрид натрия (60% в масле), растворителем является тетрагидрофуран, реакционную смесь перемешивают при комнатной температуре в течение 3 часов и системой растворителей для хроматографии является смесь диэтиловый эфир - гексан (градиент от 1:1 до 4:1); получают названное в заголовке соединение (62%) в виде желтого твердого вещества: Т. пл. 206,0-208,0°С, с выделением пузырьков; 1 Н ЯМР (ДМСО-d6) δ 8,53 (дд, J=1,8 и 8,3 Гц, 1Н), 8,33 (дд, J=1,8 и 4,4 Гц, 1Н), 7,62 (д, J=2,0 Гц, 1Н), 7,50 (ш.с, 1Н), 7,42 (д, J=8,6 Гц, 1Н), 7,30 (дд, J=4,4 и 8,3 Гц, 1Н), 6/94 (дд, J=2,0 и 8,6 Гц, 1Н), 6,056,01 (м, 1Н), 4,02-3,94 (м, 2Н), 3,54 (ш.т, J=5,6 Гц, 2Н), 2,54-2,45 (м, 2Н), 1,42 (с, 9Н); ТСХ (метиленхлорид:гексан=1:1):Rf=0,2; ТСХ (диэтиловый эфир):Rf=0,3. Е. 3-(N-трет-Бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-(5-нитропирид-2-илокси)-1Ниндол Используют 3-(N-трет-бутоксикарбонил-1,2,5,6 -тетрагидропирид-4-ил)-5-гидрокси-1Н-индол и 2-хлор-5-нитропиридин. Основанием является гидрид натрия (60% в масле), растворителем является тетрагидрофуран, время реакции при нагревании при температуре кипения с обратным холодильником (66°С) составляет 12 часов и системой растворителей для хроматографии является смесь диэтиловый эфир - гексан (1:3), получают названное в заголовке соединение (78%) в виде желтой пены: 1 Н ЯМР (CD3OD) δ 8,88 (д, J=2,8 Гц, 1Н), 8,39 (дд, J=2,8 и 9,1 Гц, 1Н), 7,56 (д, J=2,1 Гц, 1Н), 7,39 (д, J=8,7 Гц, 1Н), 7,31 (с, 1Н), 6,94-6,88 (м, 2Н), 5,98 (ш.м, 1Н), 4,88 (c, NH), 4,00 (ш.м, 2Н), 3,59 (ш.т, J=5,3 Гц, 2Н), 2,50 (ш.м, 2Н), 1,44 (с, 9Н); LRMS (m/z, относительная интенсивность) 436 (М+, 4), 379 (68), 363 (16), 335 (29), 57 (100); ТСХ (метиленхлорид:диэтиловый эфир=1:1): Rf=0,5. Пример 16. 5-Амино-(N-трет-бутоксикарбонилпиперид-4-ил)-1Н-индол Смесь 3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-нитро-1Н-индола (3,55 г, 10,34 ммоль) и 10% палладий-на-угле (0,55 г) в абсолютном этаноле (60 мл) встряхивают в атмосфере водорода (3 атм.) в течение 7 часов при комнатной температуре. Полученную в результате реакционную смесь фильтруют через диатомовую землю и фильтрат упаривают при пониженном давлении. Оставшееся твердое вещество обрабатывают диэтиловым эфиром и получают названное в заголовке соединение (2,56 г, 78%) в виде светло-розового твердого вещества: Т. пл., разложение, 215°С; 20 41297 13 С Я МР (СDСl3) δ 155,0, 139,0, 131,3, 127,3, 120,4, 119,8, 112,9, 111,8, 104,1, 79,4, 44,5, 33,8, 32,7, 28,5. Элементный анализ для C18H25N3O2·1,4Н2 О: Вычислено: С 67,57; Н 8,03; N 13,13; Найдено: С 67,20; Н 8,07; N 13,44. Пример 17. Общая методика получения 3-(Nтрет-бутоксикарбонил-1,2,5,6-тетраграгидропирид4-ил)-1Н-индолов из индолов К раствору натрия (2,51 г, 105 ммоль, 7 экв.) в абсолютном метаноле (50 мл) при перемешивании добавляют индол (15,0 мл) и N-трет-бутоксикарбонил-4-пиперидон (8,96 г, 45,0 ммоль, 3,0 экв.). Полученный в результате реакционный раствор нагревают при температуре кипения с обратным холодильником (65°С) в атмосфере азота в течение 3-24 часов, в зависимости от используемого индола. Полученный в результате реакционный раствор упаривают при пониженном давлении и остаток обрабатывают насыщенным раствором гидрокарбоната натрия (50 мл) и этилацетатсм (50 мл). Органический слой удаляют, а водный слой экстрагируют етилацетатом (2x50 мл). Все органические экстракты объединяют, сушат (MgSO 4) и упаривают при пониженном давлении. Остаток очищают либо растиранием в диэтиловом эфире, либо колоночной хроматографией и получают нужный 3-(N-трет-бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил-1Н-индол. Следуя этой методике, получают перечисленные далее соединения. А. 5-Амино-3-(N-трет-бутоксикарбонил-1,2,5,6тетрагидропирид-4-ил)-1Н-индол Используют 5-аминоиндол, реакционную смесь кипятят с обратным холодильником в течение 5 часов и остаток после экстракции очищают хроматографией, используя силикагель (приблизительно 200 г) и элюирование диэтиловым эфиром, получают названное в заголовке соединение (70%) в виде не совсем белой пены: 1 Н ЯМР (CD3OD) δ 7,26 (д, J=1,8 Гц, 1Н), 7,17 (с, 1Н), 7,15 (д, J=8,9 гц, 1Н), 6,70 (дд, J=2,0 и 8,5 Гц, 1Н), 6,09-6,03 (м, 1Н), 4,88 (с, 3Н, способные к обмену протоны), 4,12-4,06 (м, 2Н), 3,63 (ш.т, J=5,1 Гц, 2Н), 2,57-2,47 (м, 2Н), 1,49 (с, 9Н); ТСХ (диэтиловый эфир):Rf=0,2. В. 3-(N-трет-Бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-гидрокси-1Н-индол Используют 5-гидроксииндол, время кипячения реакционной смеси с обратным холодильником составляет 3 часа и твердый остаток после экстракции обрабатывают диэтилозым эфиром (100 мл), получают названное в заголовке соединение (88%) в виде белого твердого вещества: Т. пл., с разложением, 230°С; 13 С ЯМР (ДМСО-d6) δ 154,0, 151,1, 131,5, 130,5, 125,2, 123,5, 115,4, 114,8, 112,1, 111,5, 104,2, 78,7, 43,5, 39,2, 38,9, 28,2. Элементный анализ для C18H22N2O3: Вычислено: С 68,77; Н 7,05; N8,91; Найдено: С 68,73; Н 7,15; N 8,89. С. 3-(N-трет-Бутоксикарбонил-1,2,5,6-тетрагидропирид-4-ил)-5-нитро-1Н-индол Используют 5-нитроиндол, реакционную смесь кипятят с обратным холодильником в течение 24 часов и остаток после экстракции очищают хроматографией, используя силикагель (приблизитель но 200 г) и элюирование этилацетатом в гексане (от 1:2 до 1:1), получают названное в заголовке соединение (72%) в виде желтого твердого вещества: Т. пл., с разложением, 230°С; 1 Н ЯМР (CDCl3) δ 9,24 (ш.с, 1Н), 8,78 (д, J=1,3 Гц, 1Н), 8,09 (дд, J=1,4 и 9,4, Гц, 1Н), 7,40 (д, J=9,3 Гц, 1Н), 7,30 (д, J=l,8 Гц, 1Н), 6,17-6,15 (м, 1Н), 4,164,13 (м, 2H), 3,68 (т, J=5,8 Гц, 2Н), 2,58-2,48 (м, 2Н), 1,50 (с, 9Н). Элементный анализ: C15H21N3O 4·0,1Н2О: Вычислено: С 62,63; Н 6,19; N 12,17; Найдено: С 62,71; Н 6,09; N 11,81. Пример 18. 5-Дибензиламино-1Н-индол К перемешиваемой смеси 5-аминоиндола (3,0 г, 22,7 ммоль) и триэтиламина (10,5 мл, 74,9 ммоль, 3,3 экв.) в ацетонитриле (30 мл) при комнатной температуре и в атмосфере азота добавляют по каплям бензилбромид (8,2 мл, 68,9 ммоль, 3,0 экв.). Полученную в результате реакционную смесь кипятят с обратным холодильником в атмосфере азота в течение 3 часов. Полученную в результате реакционную смесь фильтруют и фильтрат упаривают при пониженном давлении. Колоночная хроматография остатка с использованием силикагеля (приблизительно 200 г) и элюирование смесью этилацетат - гексан (градиент от 1:9 до 1:1) дает названное в заголовке соединение в виде не совсем белого твердого вещества: Т. пл.124,0-126,0°С; 13 С Я МР (ацетон-d6) δ 144,3, 140,8, 131,8, 129,9, 129,2, 128,3, 127,5, 125,7, 113,5, 112,4, 106,4, 101,9, 57,0; ТСХ (15% этилацетата в гексане):Rf=0,3. Пример 19. 5-Нитроиндол-3-N,N-диметилглиоксамид К смеси 5-нитроиндола (10,0 г, 61,7 ммоль) и фталимида (4,00 г, 40% вес.) в безводном эфире (250 мл) при перемешивании добавляют по каплям оксалилхлорид (17,0 мл, 0,194 моль, 3,1 экв.). Полученную в результате реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 72 часов. Образовавшуюся в результате реакционную смесь охлаждают на ледяной бане (0°С) и к реакционной смеси осторожно добавляют при энергичном перемешивании раствор эфира (80 мл) и диметиламина (80 мл, сконденсирован при -78°С). Полученную в результате смесь энергично перемешивают при комнатной температуре в течение 1 часа. Затем эфир удаляют из реакционной смеси испарением при пониженном давлении и остаток обрабатывают водой (500 мл) и метиленхлоридом (500 мл). Доводят величину рН водного слоя до 3, используя концентрированную НСl. Метиленхлоридный слой отделяют, а водный слой экстрагируют метиленхлоридом (3x500 мл). Метиленхлоридные экстракты объединяют, суша т (MgSO 4) и упаривают при пониженном давлении. Перекристаллизация оставшегося твердого вещества из кипящего метанола с охлаждением дает названное в заголовке соединение (Rf=0,15 в 10% растворе ацетона в метиленхлориде, 5,74 г, 22,0 ммоль, 36%) в виде светло-желтого твердого вещества: Т. пл. 248,0-249,0°С; 21 41297 ИК (КВr) 1755, 1740, 1730, 1650, 1620, 1585, 1530 см -1; 1 Н ЯМР (ДМСО-d6) δ 12,9 (ш.с, NH), 8,97 (д, J=2,3 Гц, 1Н), 8,43 (с, 1Н), 8,18 (дд, J=2,3 и 9,0 Гц, 1Н), 7,74 (д, J=9,0 Гц, 1Н), 3,02 (с, 3Н), 2,95 (с, 3Н); 13 С ЯМР (ДМСО-d6) δ 166,6, 143,2, 140,4, 140,2, 124,5, 118,9, 117,2, 114,2, 113,6, 36,8, 33,6; LRMS (m/z, относительная интенсивность) 261 (24, М+), 190 (29), 189 (100), 173 (15), 143 (83), 115 (23); HRMS: вычислено для C12H11N3O4 261,0750, найдено 261, 0746. Элементный анализ для C12H11N3O4: Вычислено: С 55,17; Н 4,24; N 16,08; Найдено: С 55,15; Н 3,96; N 15,96. Пример 20. 3-(2-Диметиламиноэтил)-5-нитроиндол К раствору 5-нитроиндол-3-N,N-диметилглиоксамида (5,36 г, 20,52 ммоль) в безводном тетрагидрофуране (55 мл) при перемешивании медленно по каплям добавляют раствор борана в тетрагидрофуране (0,1М, 78,8 мл, 78,8 ммоль, 3,8 экв.). Полученный в результате реакционный раствор перемешивают при комнатной температуре в атмосфере азота в течение 16 часов. К реакционному раствору осторожно добавляют насыщенный раствор гидрокарбоната натрия (200 мл) и полученную водную смесь экстрагируют диэтиловым эфиром (3x150 мл). Эфирные экстракты объединяют, сушат (MgSO 4), упаривают при пониженном давлении, получают комплекс 3-(2-диметиламиноэтил)-5-нитроиндола с бораном в виде аморфного оранжевого твердого вещества (6,9 г): 1 H ЯМР (ДМСО-d 6) δ 11,7 (ш.м, NH), 8,58 (д, J=2,2 Гц, 12Н), 8,00 (дд, J=2,3 и 9,0 Гц, 1Н), 7,52 (д, J=8,8 Гц, 1Н), 7,49 (ш.с, 1Н), 3,23-3,17 (м, 2Н), 3,02-2,97 (м, 2Н), 2,63 (с, 6Н). Это твердое вещество помещают в абсолютный этанол (150 мл) вместе с фторидом цезия (6,9 г) и карбонатом натрия (6,9 г) и полученную в результате смесь кипятят с обратным холодильником в атмосфере азота в течение 16 часов. Полученную в результате реакционную смесь фильтруют через целит® и фильтрат упаривают при пониженном давлении. Оставшееся масло хроматографируют, используя силикагель (приблизительно 450 г) и элюирование смесью метиленхлорид:метанол:(гидроксид аммония) (8:2:0,1), получают названное в заголовке соединение (2,58 г, 11,06 ммоль, 54%) в виде твердого желтого вещества: Т. пл.133,0-135,0°С; ИК (КВr) 1625, 1575, 1550, 1526, 1480, 1470, 1460, 1445, 1380, 1370, 1330 см-1; 1 Н ЯМР (ДМСО-d6) δ 11,55 (ш.м, NH), 8,48 (д, J=2,2 Гц, 1Н), 7,94 (дд, J=2,3 и 9,0 Гц, 1Н), 7,47 (д, J=9,0 Гц, 1Н), 7,40 (ш.с, 1Н), 2,88-2,83 (м, 2Н), 2,53-2,48 (м, 2Н), 2,19 (с, 6Н); 13 С ЯМР (ДМСО-d6) δ 140,2, 139,3, 126,6, 126,5, 116,3, 116,0, 115,6, 111,7, 59,8, 45,1, 22,7; LRMS (m/z, относительная интенсивность) 233 (7, М+), 189 (7), 188 (8), 143 (10), 129 (23), 115 (14), 59 (36), 58 (100); HRMS: вычислено для C12H15N3O2 : 233,1166, найдено 233,1155. Элементный анализ дляC12H15N3O 2: Вычислено: С 61,79; Н 6,48; N 18,01; Найдено: С 61,39; Н 6,45; N 17,68. Пример 21. 5-Амино-3-(2-диметиламиноэтил) индол Смесь 3-(2-диметиламиноэтил)-5-нитроиндола (1,85 г, 7,93 ммоль) и 10% палладия-на-угле (0,40 г, 20% вес.) в абсолютном этаноле (30 мл) встряхивают в атмосфере водорода (3 атм.) в течение 6 часов. Образующуюся в результате смесь фильтруют через целит®, целитную подушку промывают большим количеством абсолютного этанола. Объединенные фильтраты упаривают при пониженном давлении и получают названное в заголовке соединение (1,60 г, 7,87 ммоль, 99%) в виде прозрачного, немного темного, гигроскопичного масла: ИК (СНСl3) 3480, 1610, 1585, 1460, 1335 см -1; 1 Н ЯМР (CDCl3) δ 8,10 (ш.м, NH), 7,12 (д, J=8,5 Гц, 1Н), 6,91 (д, J=2,3 Гц, 1Н), 6,88 (д, J=2,2 Гц, 1Н), 6,64 (дд, J=2,2 и 8,5 Гц, 1Н), 2,89-2,84 (м, 2H), 2,64-2,58 (м, 2Н), 2,34 (с, 6Н); 13 С Я МР (CDCl3) δ 139,1, 131,2, 128,3, 122,2, 113,1, 112,9, 111,7, 103,8, 60,3, 45,4, 23,7; LRMS (m/z, относительная интенсивность) 203 (9, М+), 158 (2), 145 (6), 83 (66), 58 (100); HRMS: вычислено для C12H17N3: 203,1424, найдено 203,1418. Элементный анализ для C12H17N3·1/2Н2O: Вычислено: С 67,89; Н 8,55; N 19,79; Найдено: С 67,71; Н 8,60; N 19,41. Пример 22. Общая методика синтеза N-(индол-5-ил)-N'-бензоилтиомочевин. К раствору тиоцианата аммония (0,45 г, 5,90 ммоль, 1,2 экв.) в ацетоне (10 мл) при перемешивании добавляют порциями бензилхлорид (0,68 мл, 5,90 ммоль, 1,2 экв.) и полученную в результате смесь кипятят с обратным холодильником в атмосфере азота в течение 1 часа. К охлажденному реакционному раствору затем добавляют соответствующий 5-аминоиндол (5,00 ммоль) и смесь упаривают при пониженном давлении. Остаток помещают в насыщенный раствор гидрокарбоната натрия (10 мл) . Эту водную смесь экстрагируют этилацетатом (2x10 мл), экстракты объединяют, суша т (Na2SO4) и упаривают при пониженном давлении. Остаток подвергают колоночной хроматографии, используя силикагель (приблизительно 75 г) и элюирование смесью метиленхлорид:метанол:(гидроксид аммония) (9:1:0,1), получают названное в заголовке соединение. Следуя этой методике, получают перечисленные далее соединения. A. N-(3-(N-Метилпирролидин-2-илметил)-1Ниндол-5-ил)-N'-бензоилтиомочевина Используют (R)-5-амино-3-(N-метилпирролидин-2-илметил)-1Н-индол. Хроматография дает названное в заголовке соединение (46%) в виде желтой пены: 13 С Я МР (СDСl3) δ 178,8, 167,0, 135,0, 133,6, 131,7, 129,5, 129,1, 127,6, 127,5, 123,4, 119,2, 115,0, 114,3, 111,4, 66,6, 57,4, 40,8, 31,4, 29,8, 21,8; [α]25=+62° (с=2, CDCl 3). Элементный анализ для C22H24N4OS·0,4СН2 Сl2: Вычислено: С 63,08; Н 5,86; N 13,14; Найдено: С 62,76; Н 5,94; N 12,94. В. N-(3-(2-Диметиламиноэтил)-1Н-индол-5-ил)N'-бензоилтиомочевина 22 41297 Используют (R)-5-амино-3-(2-диметиламиноэтил)-1Н-индол. Хроматография дает названное в заголовке соединение (22%) в виде желтой пены. Rf=0,4 в метиленхлорид:метанол:(гидроксид аммония) (9:1:0,1): HRMS: вычислено для C20H22N4OS 366,1517, найдено 366,1467. Элементный анализ для C20H22N4OS·0,2СН2 СІ2: Вычислено: С 63,27; Н 5,89; N 14,61; Найдено: С 63,53; Н 5,83; N 14,61. Пример 23. Общая методика синтеза N-(индол-5-ил)-тиомочевин К раствору N-(индол-5-ил)-N'-бензоилтиомочевины (5,5 ммоль) в абсолютном этаноле (40 мл) добавляют при перемешивании по каплям раствор гидроксида натрия (3,00 г) в воде (28 мл). Полученную в результате реакционную смесь кипятят с обратным холодильником в течение 1 часа. Затем этанол удаляют из реакционной смеси испарением при пониженном давлении, величину рН оставшейся водной смеси доводят до 10, используя концентрированную НСl и твердый карбонат натрия. Водную смесь экстрагируют этилацетатом (3x50 мл), экстракты объединяют, сушат (Na2SO4) и упаривают при пониженном давлении. Остаток используют или в таком виде, как он есть, или кристаллизуют из метиленхлорида, получая названное в заголовке соединение. Следуя этой методике, получают перечисленные далее соединения. A. N-(3-(N-Метиленпирролидин-2-илметил)1Н-индол-5-ил)тиомочевина Остаток после экстракции представляет собой названное в заголовке соединение (73%) в виде желтого твердого вещества. Rf=0,15 в 10% растворе триэтиламина в ацетоне: 1 H ЯМР (CD3OD) δ 7,29 (д, J=8,8 Гц, 1Н), 7,12 (д, J=2,2 Гц, 1Н), 7,11 (с, 1Н), 6,78 (дд, J=8,6 и 2,2 Гц, 1Н), 4,91 (с, 4Н), 3,23-3,13 (м, 2Н), 2,75-2,40 (м, 3Н), 2,52(0, 3Н), 1,94-1,57 (м, 4Н). В. N-(3-(2-Диметиламиноэтил)-1Н-индол-5ил)тиомочевина. Кристаллизация из метиленхлорида остатка после экстракции дает названное в заголовке (28%) в виде твердого вещества бежевого цвета: Т. пл. 190,0-191,0°С; 13 С ЯМР (ацетон-d6) δ 183,6, 136,0, 128,9, 124,4, 120,2, 116,4, 115,0, 112,7, 61,1, 45,6, 24,1; HRMS: вычислено для [C13H18N4S·Н]+: 263,1333, найдено 263,1291. Пример 24. Общая методика синтеза 5-(4бензил-1,3-тиаз-2-иламино)-1Н-индолов К раствору N-(индол-5-ил)тиомочевины (1,00 ммоль) в абсолютном этаноле (5 мл) при перемешивании добавляют 1-фенил-3-хлор-3-пропанон (0,27 г, 1,00 ммоль, 1 экв.) и полученный в результате раствор кипятят с обратным холодильником в атмосфере азота в течение 3 часов. К образовавшемуся реакционному раствору добавляют насыщенный раствор гидрокарбоната натрия (10 мл) и эту водную смесь перемешивают при комнатной температуре в течение 30 минут. Затем удаляют этанол упариванием при пониженном давлении, оставшуюся водную смесь экстрагируют этилацетатом (2x10 мл). Экстракты объединяют, суша т (Na2SO4) и упаривают при пониженном давлении. Остаток очищают либо кристаллизацией, либо колоночной хроматографией, используя силикагель (приблизительно 25 г) и элюирование смесью метиленхлорид:метанол:(гидроксид аммония) (9:1:0,1) и получают названное в заголовке соединение. Следуя этой методике, получают перечисленные далее соединения. А. 5-(4-Бензил-1,3-тиаз-2-иламино)-3-(N-метилпирролидин-2-илметил)-1H-индол Хроматография дает названное в заголовке соедиенние (3%) в виде не совсем белого твердого вещества: 13 С Я МР (ацетон-d6) δ 167,0, 153,1, 140,7, 134,4, 134,0, 129,7, 128,9, 126,7, 124,3, 124,0, 115,5, 113,9, 112,3, 109,4, 101,8, 67,3, 58,0, 41,0, 38,7, 30,5, 22,5; HRMS: вычислено для C24H26N4S: 402,1881, найдено 402,1872. В. 5-(4-Бензил-1,3-тиаз-2-иламино)-3-(2-N,Nдиметил-аминоэтил)-1H-индол Растирание остатка после экстракции дает названное в заголовке соединение (20%) в виде не совсем белого твердого вещества: Т. пл.170,5-172,0°С; 13 С Я МР (ацетон-d6) δ 167,2, 153,1, 140,7, 134,4, 134,1, 129,8, 128,9, 128,8, 126,7, 123,9, 115,7, 114,3, 112,3, 109,4, 101,8, 61,1, 45,6, 38,7, 24,3; HRMS: вычислено для C22H24N4S: 376,1724, найдено 376,1685. Элементный анализ для C22H24N4S·0,4Н2O: Вычислено: С 68,86; Н 6,51; N 14,60; Найдено: С 68,98; Н 6,18; N 14,44. Пример 25. 5-Амино-3-[(2R,4R)-Н-метил-4-метоксипирролидин-2-илметил]-1Н-индол Смесь 5-(2,5-диметил-1Н-пирролил)-3-[(2R,4R) -N-метил-4-метоксипирролидин-2-илметил]-1Ниндола (2,20 г, 6,52 ммоль), гидрохлорида гидроксиламина (7,25 г, 104 ммоль, 16 экв.) и триэтиламина (7,28 мл, 52,2 ммоль, 8 экв.) в 2-пропаноле (22 мл) кипятят с обратным холодильником в атмосфере азота в течение 8 часов. Полученный в результате реакционный раствор упаривают при пониженном давлении и остаток обрабатывают этилацетатом (50 мл) и насыщенным раствором бикарбоната натрия (50 мл). Этилацетатный слой отделяют, а водный слой экстрагируют метиленхлоридом (3x50 мл). Все органические экстракты объединяют, сушат (MgSO4) и упаривают при пониженном давлении, получают названное в заголовке соединение (1,68 г, 100%) в виде не совсем белого твердого аморфного вещества. Rf=0,4 в смеси метиленхлорид:метанол:(гидроксид аммония) (9:1:0,1). 1 Н ЯМР (CD3OD) δ 7,14 (д, J=8,5 Гц, 1Н), 6,99 (с, 1Н), 6,94 (ш.с, 1Н), 6,68 (ш.д, J=8,5 Гц, 1Н), 4,90 (с, 3-NH), 3,86-3,77 (м, 1Н), 3,24 (с, 3Н), 3,24-3,13 (м, 2Н), 2,93-2,80 (м, 1H) , 2,69 (дд, J=13,7 и 9,7 Гц, 1Н), 2,51 (с, 3Н), 2,40-2,18 (м, 2Н), 1,73-1,63 (м, 1Н); 13 С ЯМР (CD3OD) δ 139,7, 133,4, 129,3, 124,4, 114,4, 112,8, 111,2, 105,5, 79,3, 68,3, 66,1, 56,7, 40,7, 39,5, 30,1. Пример 26. 5-(2,5-Диметил-1Н-пирролил)-3[(2R,4R)-N-метил-4-метоксипирролидин-2-илметил]-1H-индол 23 41297 К смеси алюмогидрида лития (1,65 г, 43,5 ммоль, 6,3 экв.) в безводном тетрагидрофуране (80 мл) добавляют частями твердый 3-[(2R, 4R)-N-бензилоксикарбонилпирролидин-2-карбонил)-5-(2,5-диметил-1Н-пирролил)-1Н-индол (3,24 г, 6,87 ммоль) и полученную в результате реакционную смесь кипятят с обратным холодильником в атмосфере азота в течение 24 часов. К полученной в результате реакционной смеси осторожно добавляют последовательно воду (1,65 мл), затем раствор гидроксида натрия (2н, 1,65 мл), затем воду (5 мл) и затем этилацетат (30 мл). Полученную в результате смесь перемешивают при комнатной температуре в течение 12 часов и затем фильтруют. Фильтрат упаривают при пониженном давлении. Остаток подвергают колоночной хроматографии, используя силикагель (приблизительно 60 г) и элюирование смесью метиленхлорид:метанол:(гидроксид аммония) (12:1: 0,1) и получают названное в заголовке соединение (2,20 г, 95%) в виде белой пены. Rf=0,5 в смеси метиленхлорид:метанол:(гидроксид аммония) (9:1:0,1): 1 Н ЯМР (CDCl3) δ 8,88 (ш.с, NH), 7,43 (д, J=1,8 Гц, 1Н), 7,39 (д, J=8,4 Гц, 1Н), 7,11 (д, J=2,2 Гц, 1Н), 6,98 (дд, J=8,4 и 1,9 Гц, 1Н), 5,94 (с, 2Н), 3,80-3,74 (м, 1Н), 3,30-3,31 (м, 2Н), 3,28 (с, 3Н), 2,73 (дд, J=14,1 и 9,6 Гц, 1Н), 2,56-2,43 (м, 1Н), 2,45 (с, 3Н), 2,30 (дд, J=10,9 и 5,6 Гц, 1Н), 2,25-2,15 (м, 1Н), 2,06 (с, 6Н), 1,72-1,64 (м, 1Н); 13 С Я МР (CDCl3) δ 135,5, 130,7, 129,4, 128,5, 127,8, 127,0, 123,9, 122,1, 118,4, 113,7, 111,5, 105,0, 78,5, 66,0, 62,5, 56,4, 40,6, 39,2, 29,7, 13,2; FAB HRMS: вычислено для (C21H27N3 O·Н): 338,2234, найдено 338,2247. Пример 27. 3-[(2R,4R)-N-Бензилоксикарбонилпирролидин-2-илкарбонил]-5-(2,5-диметил-1Нпирролил)-1H-индол К раствору (2R,4R)-4-метоксипролина (Krapcho, et al., J. Med. Chem., 1148 (1988)) (5,22 г, 18,8 ммоль) в безводном метиленхлориде (50 мл) с небольшим количеством N,N-диметилформамида (0,5 мл) при перемешивании добавляют по каплям оксалилхлорид (2,44 мл, 28,0 ммоль, 1,5 экв.). Полученный в результате выделяющий газ раствор перемешивают при комнатной температуре в атмосфере азота в течение 2 часов. Реакционный раствор затем упаривают при пониженном давле нии, обрабатывают гексаном (2X20 мл) и оставшийся хлорангидрид пролиновой кислоты растворяют в бензоле (25 мл). Отдельно к раствору 5(2,5-диметил-1Н-пирролил)-1Н-индола (7,22 г, 38,0 ммоль, 2,0 экв.) в бензоле (30 мл) добавляют раствор этилмагнийбромида (3,0М в эфире, 13,0 мл, 39 ммоль, 2,0 экв.) и образующийся в результате выделяющий газ раствор перемешивают при комнатной температуре в атмосфере азота в течение 30 минут, а затем охлаждают до 0°С. К этому охлажденному (0°С) раствору магниевой соли индола добавляют быстро, при энергичном перемешивании, бензольный раствор хлорангидрида пролиновой кислоты. Получающуюся в результате реакционную смесь перемешивают при 0°С в атмосфере азота в течение 10 минут. За тем добавляют насыщенный раствор гидрокарбоната натрия (80 мл) и эту водную смесь экстрагируют этилацетатом (2x80 мл). Органические экстракты объединяют, сушат (MgSO 4) и упаривают при пониженном давлении. Оставшееся масло кристаллизуют смешиванием с диэтиловым эфиром (80 мл) в течение ночи и получают названное в заголовке соединение (7,15 г, 81%) в виде белого твердого вещества: Т. пл.189,0-191,0°С; Rf=0,4 в смеси этилацетат:гексан (2:1); FAB HRMS: вычислено для (C28H29N3O 4·Н): 472,2238, найдено 472,2281. Пример 28. 5-(2,5-Диметил-1Н-пирролил)-1Ниндол Смесь 5-аминоиндола (1,32 г, 10,0 ммоль), ацетонилацетона (4,0 мл, 34 ммоль, 3,5 экв.) и толуола (25 мл) кипятят с обратным холодильником в атмосфере азота, используя ловушку ДинаСтарка, в течение 24 часов. Реакционную смесь охлаждают и затем проливают через силикагельный (приблизительно 200 г) фильтр, затем 10% раствором эфира в гексане и получают названное в заголовке соединение (1,52 г, 72%) в виде не совсем белого твердого кристаллического вещества. Rf=0,75 в диэтиловом эфире: 13 С Я МР (СDСl3) δ 135,0, 131,4, 129,5, 128,1, 125,6, 122,4, 120,3, 111,3, 105,0, 103,0, 13,2. Элементный анализ для C14H14N2: Вычислено: С 79,97; Н 6,71; N 13,32; Найдено: С 79,72; Н 6,75; N 13,13. __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 24
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole derivatives, a pharmaceutical composition and a method for treatment
Автори англійськоюMACOR JOHEN E.
Назва патенту російськоюПроизводные индола, фармацевтическая композиция и способ лечения
Автори російськоюМекор Джон И.
МПК / Мітки
МПК: A61P 25/04, C07D 401/04, C07D 209/14, A61P 25/30, C07D 473/34, C07D 473/02, A61P 25/20, A61P 9/08, A61K 31/505, A61K 31/40, A61P 43/00, A61P 25/26, A61P 25/00, A61K 31/403, C07D 413/12, A61P 3/04, A61K 31/42, A61K 31/44, C07D 417/14, C07D 401/12, A61K 31/404, C07D 401/14, C07D 417/12, C07D 403/12, A61K 31/41, A61K 31/425, A61P 25/24, C07D 403/04, A61K 31/52, C07D 209/16, C07D 403/06, A61K 31/4427, A61P 25/06
Мітки: лікування, фармацевтична, індолу, композиція, спосіб, похідні
Код посилання
<a href="https://ua.patents.su/24-41297-pokhidni-indolu-farmacevtichna-kompoziciya-i-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні індолу, фармацевтична композиція і спосіб лікування</a>
Попередній патент: Складні ефіри нуклеозиду та його похідні, фармацевтична композиція на їх основі
Наступний патент: Фенілгідразинове похідне, спосіб боротьби зі шкідниками сільськогосподарських культур та інсектоакарициднонематоцидна композиція
Випадковий патент: Венекстрактор












