Виробництво фармацевтичних композицій зі швидким вивільненням на основі водонерозчинних лікарських засобів і фармацевтичні композиції, отримані способом за винаходом
Формула / Реферат
1. Спосіб виробництва пероральної форми дозування, яка включає тіазинкарбоксамід, що має швидке розчинення в шлунковій рідині, який включає етапи:
a) одержання тіазинкарбоксаміду або його фармацевтично прийнятної солі;
b) одержання одного або декількох лужних речовин; і
c) змішування згаданого тіазинкарбоксаміду і згаданої лужної речовини (речовин) і необов'язково одного або декількох наповнювачів шляхом спільного розмелювання без додавання рідини, і необов'язково
d) додавання одного або декількох фармацевтично прийнятних наповнювачів і необов'язково
e) пресування згаданої суміші с) або d) у таблетку; де тіазинкарбоксамід має розчинність при кімнатній температурі менше 0,1 % ваг./об. у 0,1 N соляній кислоті або має величину рКа менше 5,5; і
де молярне співвідношення між згаданим тіазинкарбоксамідом та вказаною лужною речовиною (речовинами) знаходиться в діапазоні від 1:100 до 1:1.
2. Спосіб за п. 1, який відрізняється тим, що етап спільного розмелювання (с) застосовують тільки до тіазинкарбоксаміду та лужної речовини (речовин).
3. Спосіб за п. 1 або 2, який відрізняється тим, що згаданий спосіб виконують за сухих умов, виключаючи застосування рідини.
4. Спосіб за будь-яким з пп. 1-3, у якому молярне співвідношення тіазинкарбоксаміду і лужної речовини (речовин) знаходиться в діапазоні від 1:100 до 1:10.
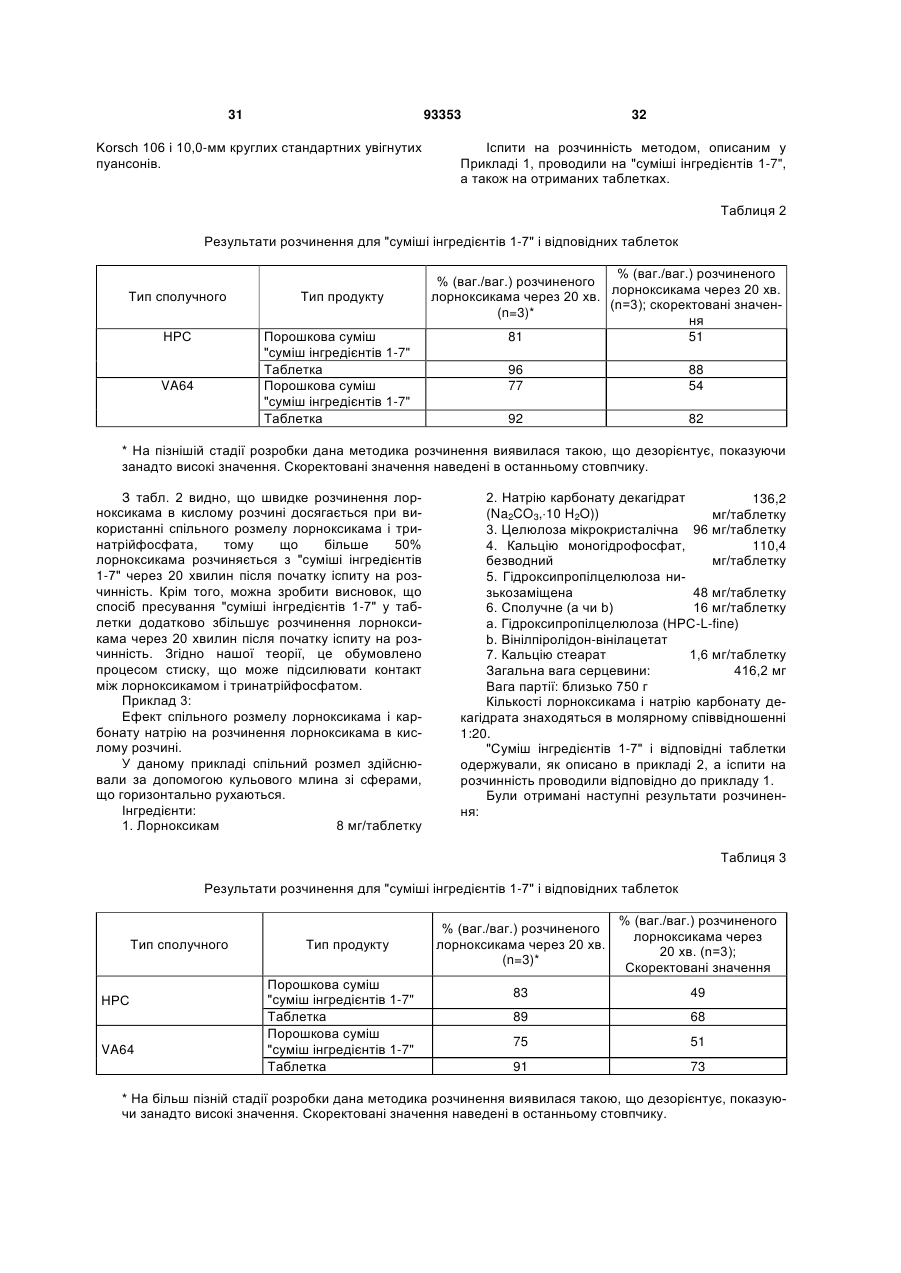
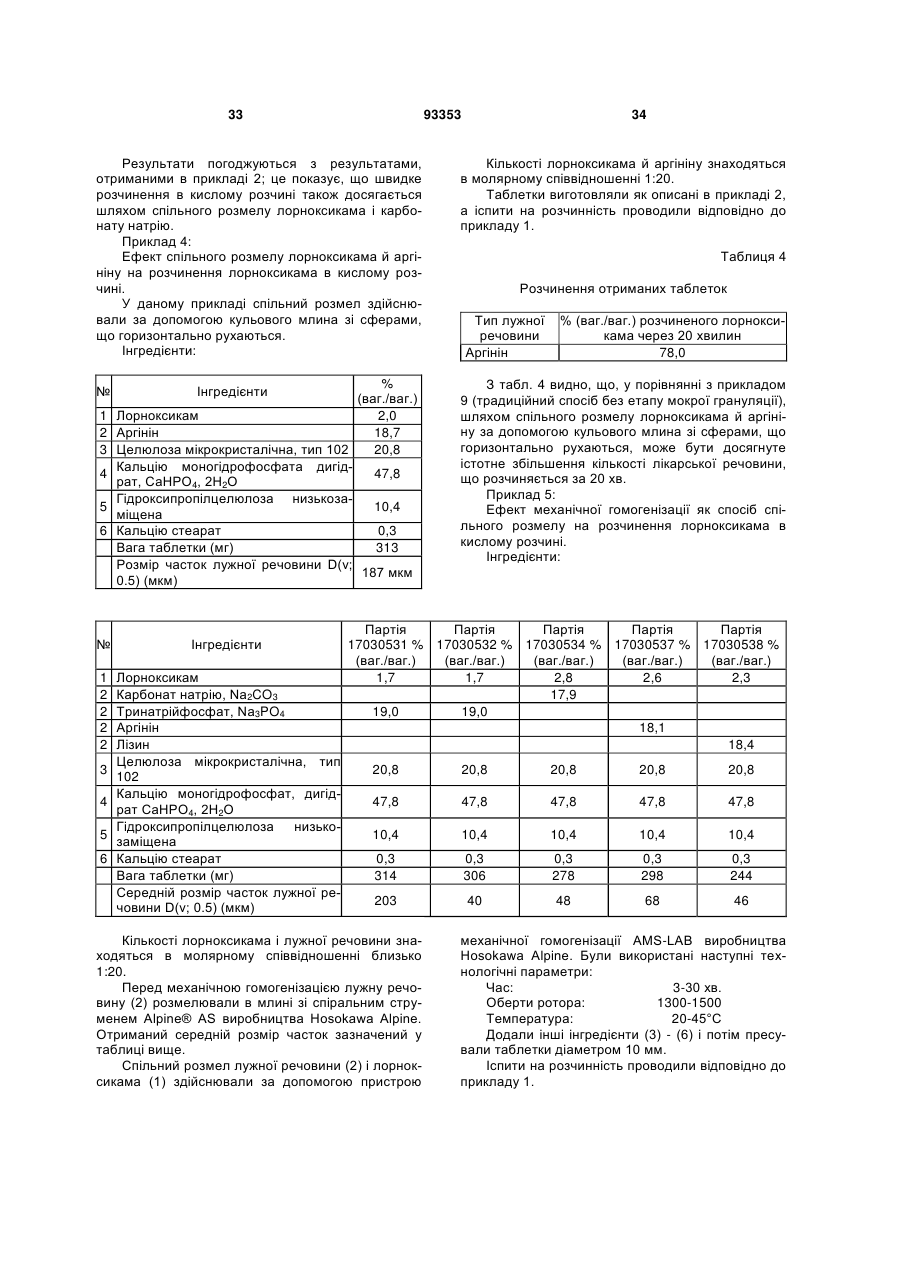
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що молярне співвідношення тіазинкарбоксаміду і лужної речовини (речовин) знаходиться в діапазоні від 1:10 до 1:40, і у якому зазначеним тіазинкарбоксамідом є лорноксикам.
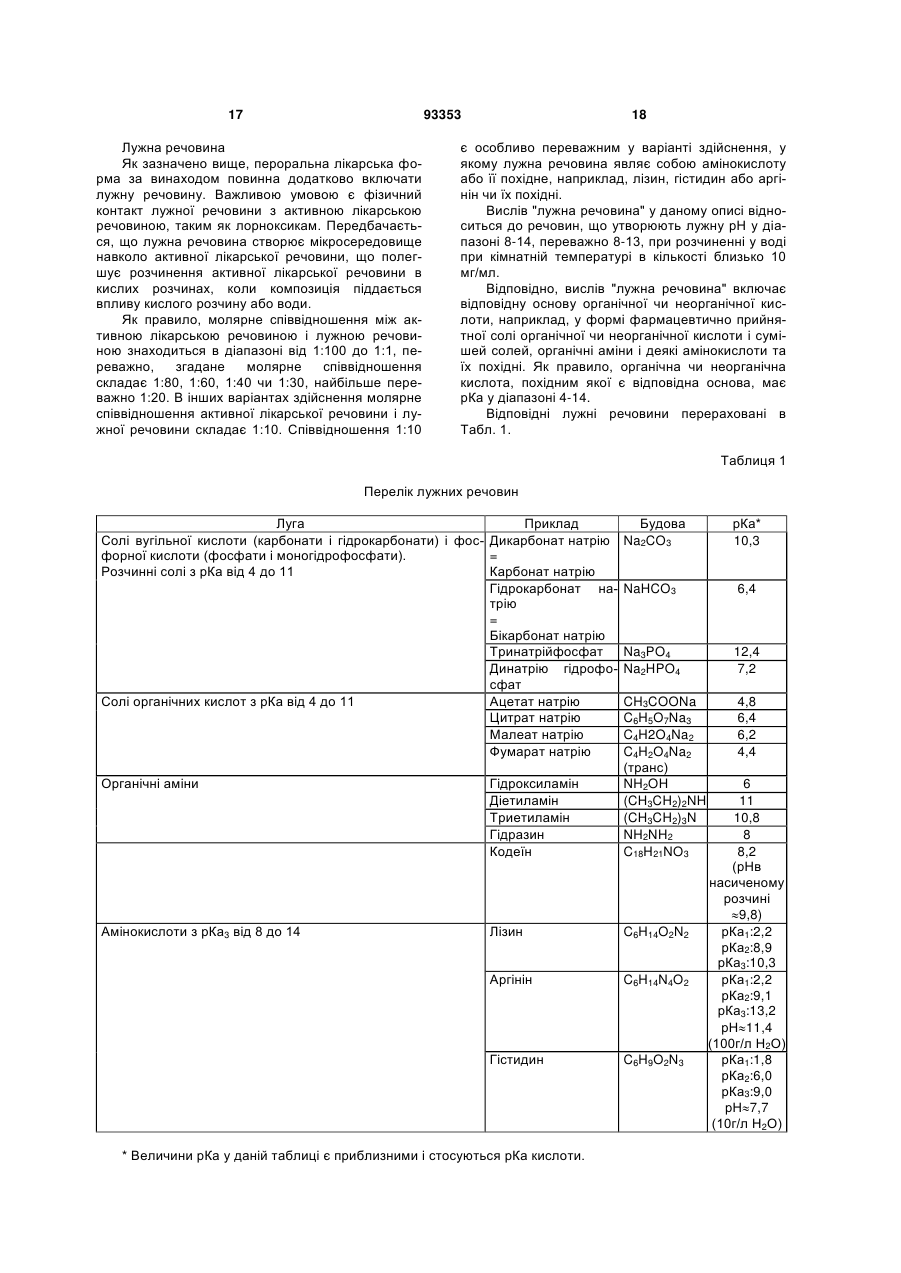
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що лужна речовина (речовини) є водорозчинною, і характеризується тим, що 1 частина лужної речовини може бути розчинена максимум у 100 частинах води.
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що лужна речовина (речовини) являє собою сіль органічної кислоти, сіль неорганічної кислоти, органічний амін або амінокислоту, чи похідне цих сполук.
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що лужна речовина (речовини) являє собою амінокислоту або її похідне.
9. Спосіб за п. 8, який відрізняється тим, що амінокислота або її похідне являє собою лізин, аргінін або гістидин.
10. Спосіб за п. 7, який відрізняється тим, що органічна кислота і неорганічна кислота мають рКа у діапазоні 4-14.
11. Спосіб за п. 7, який відрізняється тим, що лужна речовина (речовини) являє собою сіль неорганічної кислоти, вибраної з вугільної кислоти або фосфорної кислоти.
12. Спосіб за будь-яким з пп. 1-11, який відрізняється тим, що тіазинкарбоксамід являє собою ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам або теноксикам чи їх фармацевтично прийнятну сіль.
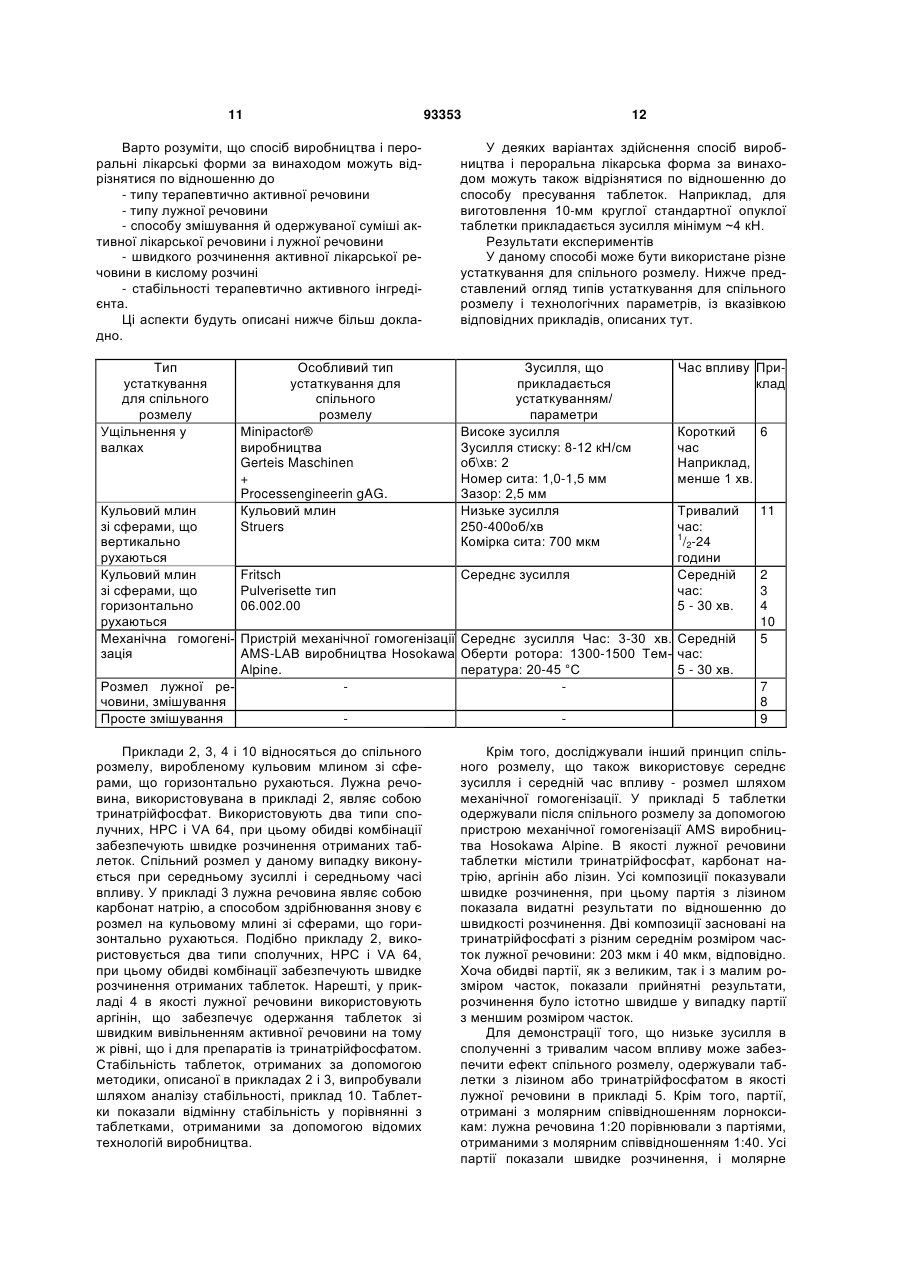
13. Спосіб за будь-яким з пп. 1-12, який відрізняється тим, що вказане спільне розмелювання здійснюють на валковому пресі.
14. Спосіб за будь-яким з пп. 1-13, який відрізняється тим, що спільне розмелювання здійснюють з використанням пристрою Ball Mill.
15. Спосіб за будь-яким з пп. 1-14, де тіазинкарбоксамідом є лорноксикам.
16. Спосіб за будь-яким з пп. 1-14, де композиція або кожна пероральна форма дозування містить 4-12 мг лорноксикаму.
17. Спосіб за будь-яким з пп. 1-14, де зазначена композиція або пероральна форма дозування знаходиться в формі спресованої таблетки.
18. Спосіб за будь-яким з пп. 1-14, де молярне співвідношення лорноксикаму і лужної речовини (речовин) знаходиться в діапазоні від 1:100 до 1:10.
19. Фармацевтична композиція, одержувана способом за будь-яким з пп. 1-18.
20. Фармацевтична композиція за п. 19, що включає:
- тіазинкарбоксамід; і
- амінокислоту або її похідне.
21. Фармацевтична композиція за п. 19, яка відрізняється тим, що
- тіазинкарбоксамід являє собою ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам або теноксикам чи їх фармацевтично прийнятну сіль; і
- лужна речовина являє собою гістидин, лізин або аргінін.
22. Фармацевтична композиція за п. 19, яка відрізняється тим, що
- тіазинкарбоксамід являє собою лорноксикам чи його фармацевтично прийнятну сіль; і
- лужна речовина являє собою гістидин, лізин або аргінін.
23. Фармацевтична композиція за п. 19, яка відрізняється тим, що
- тіазинкарбоксамід являє собою лорноксикам; і
- лужна речовина являє собою гістидин, лізин або аргінін.
24. Стабільна фармацевтична композиція для перорального застосування, що включає:
- тіазинкарбоксамід чи його фармацевтично прийнятну сіль;
- одну або декілька лужних речовин, вибраних з солі, що містить аніон, вибраний з СО32-, HPO42-, PO43- і катіон, вибраний з Na+ і К+; і
- сполучне у формі гідрофільного полімеру;
де вказана фармацевтична композиція виготовлена способом, що використовує інтенсивне перемішування у вигляді спільного розмелювання і без використання рідини, і де молярне співвідношення між вказаним тіазинкарбоксамідом і його фармацевтично прийнятною сіллю і вказаною лужною речовиною (речовинами) знаходиться в діапазоні від 1:100 до 1:1.
25. Стабільна фармацевтична композиція для перорального застосування, що включає:
- тіазинкарбоксамід чи його фармацевтично прийнятну сіль; і
- одну або декілька амінокислот або їх похідні;
де вказана фармацевтична композиція виготовлена способом, що включає змішування вказаного тіазинкарбоксаміду чи його фармацевтично прийнятної солі і вказаної однієї або декількох амінокислот або її похідногоі факультативно одного або декількох наповнювачів шляхом спільного розмелювання і без додавання рідини, де молярне співвідношення між вказаним тіазинкарбоксамідом або його фармацевтично прийнятною сіллю і вказаною амінокислотою (амінокислотами) або її похідним знаходиться в діапазоні від 1:100 до 1:1.
26. Фармацевтична композиція за п. 25, яка відрізняється тим, що амінокислота або її похідне являє собою гістидин, лізин або аргінін.
27. Фармацевтична композиція за п. 24 або 25, яка відрізняється тим, що тіазинкарбоксамід являє собою ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам, теноксикам чи їх фармацевтично прийнятну сіль.
28. Фармацевтична композиція за п. 24 або 25, яка відрізняється тим, що тіазинкарбоксамід являє собою лорноксикам чи його фармацевтично прийнятну сіль.
29. Фармацевтична композиція за п. 25, яка відрізняється тим, що тіазинкарбоксамід являє собою лорноксикам, і в якій амінокислота або її похідне являє собою лізин.
30. Фармацевтична композиція за п. 25, яка відрізняється тим, що тіазинкарбоксамід являє собою лорноксикам, і в якій амінокислота або її похідне являє собою аргінін.
31. Фармацевтична композиція за будь-яким з пп. 19-30, яка відрізняється тим, що композиція включає опіоїд або триптан в комбінації з лорноксикамом.
32. Фармацевтична композиція за будь-яким з пп. 19-31, де тіазинкарбоксамідом є лорноксикам.
33. Фармацевтична композиція за будь-яким з пп. 19-32, де композиція або кожна пероральна форма дозування містить 4-12 мг лорноксикаму.
34. Фармацевтична композиція за будь-яким з пп. 24-33, де зазначена композиція або пероральнa форма дозування знаходиться в формі спресованої таблетки.
35. Фармацевтична композиція за будь-яким із пп. 19-34, де молярне співвідношення лорноксикаму і лужної речовини (речовин) знаходиться в діапазоні від 1:100 до 1:10.
Текст
1. Спосіб виробництва пероральної форми дозування, яка включає тіазинкарбоксамід, що має швидке розчинення в шлунковій рідині, який включає етапи: a) одержання тіазинкарбоксаміду або його фармацевтично прийнятної солі; b) одержання одного або декількох лужних речовин; і c) змішування згаданого тіазинкарбоксаміду і згаданої лужної речовини (речовин) і необов'язково одного або декількох наповнювачів шляхом спільного розмелювання без додавання рідини, і необов'язково d) додавання одного або декількох фармацевтично прийнятних наповнювачів і необов'язково e) пресування згаданої суміші с) або d) у таблетку; де тіазинкарбоксамід має розчинність при кімнатній температурі менше 0,1 % ваг./об. у 0,1 N соляній кислоті або має величину рКа менше 5,5; і 2 (19) 1 3 93353 4 12. Спосіб за будь-яким з пп. 1-11, який відрізняється тим, що тіазинкарбоксамід являє собою ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам або теноксикам чи їх фармацевтично прийнятну сіль. 13. Спосіб за будь-яким з пп. 1-12, який відрізняється тим, що вказане спільне розмелювання здійснюють на валковому пресі. 14. Спосіб за будь-яким з пп. 1-13, який відрізняється тим, що спільне розмелювання здійснюють з використанням пристрою Ball Mill. 15. Спосіб за будь-яким з пп. 1-14, де тіазинкарбоксамідом є лорноксикам. 16. Спосіб за будь-яким з пп. 1-14, де композиція або кожна пероральна форма дозування містить 4-12 мг лорноксикаму. 17. Спосіб за будь-яким з пп. 1-14, де зазначена композиція або пероральна форма дозування знаходиться в формі спресованої таблетки. 18. Спосіб за будь-яким з пп. 1-14, де молярне співвідношення лорноксикаму і лужної речовини (речовин) знаходиться в діапазоні від 1:100 до 1:10. 19. Фармацевтична композиція, одержувана способом за будь-яким з пп. 1-18. 20. Фармацевтична композиція за п. 19, що включає: - тіазинкарбоксамід; і - амінокислоту або її похідне. 21. Фармацевтична композиція за п. 19, яка відрізняється тим, що - тіазинкарбоксамід являє собою ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам або теноксикам чи їх фармацевтично прийнятну сіль; і - лужна речовина являє собою гістидин, лізин або аргінін. 22. Фармацевтична композиція за п. 19, яка відрізняється тим, що - тіазинкарбоксамід являє собою лорноксикам чи його фармацевтично прийнятну сіль; і - лужна речовина являє собою гістидин, лізин або аргінін. 23. Фармацевтична композиція за п. 19, яка відрізняється тим, що - тіазинкарбоксамід являє собою лорноксикам; і - лужна речовина являє собою гістидин, лізин або аргінін. 24. Стабільна фармацевтична композиція для перорального застосування, що включає: - тіазинкарбоксамід чи його фармацевтично прийнятну сіль; - одну або декілька лужних речовин, вибраних з солі, що містить аніон, вибраний з СО32-, HPO42-, PO43- і катіон, вибраний з Na+ і К+; і - сполучне у формі гідрофільного полімеру; де вказана фармацевтична композиція виготовлена способом, що використовує інтенсивне перемішування у вигляді спільного розмелювання і без використання рідини, і де молярне співвідношення між вказаним тіазинкарбоксамідом і його фармацевтично прийнятною сіллю і вказаною лужною речовиною (речовинами) знаходиться в діапазоні від 1:100 до 1:1. 25. Стабільна фармацевтична композиція для перорального застосування, що включає: - тіазинкарбоксамід чи його фармацевтично прийнятну сіль; і - одну або декілька амінокислот або їх похідні; де вказана фармацевтична композиція виготовлена способом, що включає змішування вказаного тіазинкарбоксаміду чи його фармацевтично прийнятної солі і вказаної однієї або декількох амінокислот або її похідного і факультативно одного або декількох наповнювачів шляхом спільного розмелювання і без додавання рідини, де молярне співвідношення між вказаним тіазинкарбоксамідом або його фармацевтично прийнятною сіллю і вказаною амінокислотою (амінокислотами) або її похідним знаходиться в діапазоні від 1:100 до 1:1. 26. Фармацевтична композиція за п. 25, яка відрізняється тим, що амінокислота або її похідне являє собою гістидин, лізин або аргінін. 27. Фармацевтична композиція за п. 24 або 25, яка відрізняється тим, що тіазинкарбоксамід являє собою ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам, теноксикам чи їх фармацевтично прийнятну сіль. 28. Фармацевтична композиція за п. 24 або 25, яка відрізняється тим, що тіазинкарбоксамід являє собою лорноксикам чи його фармацевтично прийнятну сіль. 29. Фармацевтична композиція за п. 25, яка відрізняється тим, що тіазинкарбоксамід являє собою лорноксикам, і в якій амінокислота або її похідне являє собою лізин. 30. Фармацевтична композиція за п. 25, яка відрізняється тим, що тіазинкарбоксамід являє собою лорноксикам, і в якій амінокислота або її похідне являє собою аргінін. 31. Фармацевтична композиція за будь-яким з пп. 19-30, яка відрізняється тим, що композиція включає опіоїд або триптан в комбінації з лорноксикамом. 32. Фармацевтична композиція за будь-яким з пп. 19-31, де тіазинкарбоксамідом є лорноксикам. 33. Фармацевтична композиція за будь-яким з пп. 19-32, де композиція або кожна пероральна форма дозування містить 4-12 мг лорноксикаму. 34. Фармацевтична композиція за будь-яким з пп. 24-33, де зазначена композиція або пероральнa форма дозування знаходиться в формі спресованої таблетки. 35. Фармацевтична композиція за будь-яким із пп. 19-34, де молярне співвідношення лорноксикаму і лужної речовини (речовин) знаходиться в діапазоні від 1:100 до 1:10. Даний винахід відноситься до області фармацевтичних препаратів, зокрема, до способів поліпшення розчинення і всмоктування водонероз чинних лікарських засобів. Даний винахід головним чином сфокусований на композиціях, що включають лікарську речовину, що відноситься до 5 класу лікарських речовин, які звичайно позначають НПЗЗ (нестероїдні протизапальні засоби). Зокрема, інтерес представляють НПЗЗ із низькою розчинністю у воді і шлунковій рідині, а також із проблемами стабільності. Прикладом такого НПЗЗ є лорноксикам. Однак інші лікарські речовини, що мають низьку розчинність у кислому середовищі та/або рКа нижче 5,5, також можуть бути придатні для одержання композиції за винаходом. У даному винаході запропоновані пероральні лікарські форми з істотно поліпшеною стабільністю. Для полегшення болю в першу чергу необхідно швидке всмоктування лікувальних засобів у кров, що циркулює. Тому для пероральних лікарських форм дуже важливо, щоб лікарська речовина розчинялася, цілком або частково, вже в шлунковій рідині. Таким чином, у випадку, якщо лікарський засіб не всмоктуються зі слизової шлунка, воно може бути вже підготовлене для всмоктування при вході у верхній відділ кишкового тракту, а саме, у дванадцятипалу кишку. Сама дванадцятипала кишка містить обмежену кількість рідини, що обумовлює повільне розчинення в ній лікарського засобу, однак слабка кислота може бути більш розчинною в кишковій рідині. У літературі описано декілька способів виробництва і складання пероральних лікарських форм із лікарських засобів, що є, власне кажучи, водонерозчинними і представляють собою слабкі кислоти, з метою досягнення швидкого розчинення in vitro у шлунковій рідині. Деякі повідомлення відносяться до способу поліпшення розчинності НПЗЗ шляхом утворення аддукта з циклодекстрином. WO 9641646 відноситься до парентерального препарату лорноксикама, виготовленому у виді аддукта з циклодекстрином. Цей лікарський засіб має форму або порошку для розчинення, або розчину. Усі приклади включають етап сольватування, і дане повідомлення не містить яких-небудь згадувань про одержання препарату без використання води. WO 9532737 також відноситься до аддукту НПЗЗ, такому як лорноксикам з циклодекстрином. Технологія виготовлення включає етап зволоження, таким чином, дане повідомлення включає обов'язкове використання води в процесі виготовлення. В інших повідомленнях запропоновані інші підходи до поліпшення розчинності НПЗЗ. Наприклад, часто повідомляється, що такі водонерозчинні речовини варто комбінувати з лужною речовиною. Також повідомляється, що технологія виробництва повинна включати контактування порошку, що містить лікарський засіб і луг, з водяним середовищем для утворення дисперсної композиції. В ЕР 1109534 В1 описаний склад, що містить терапевтично та/або профілактично активну речовину, що має розчинність не більше 0,1 % ваг./об. у 0,1 N соляній кислоті при кімнатній температурі, при цьому основою композиції є порошок, що включає активну речовину і лужну речовину, і який приводять у контакт із водяним середовищем для утворення дисперсної композиції. Описані композиції мають таку швидкість розчинення в 0,1 N со 93353 6 ляній кислоті, що, щонайменше, 50% лікарської речовини набуває розчиненої форми протягом перших 20 хвилин іспиту на розчинність. Важливим є твердження, що висока швидкість розчинення, описана в даному патенті, не може бути досягнута, якщо активна речовина і лужна речовина піддаються обробці в умовах, при яких відсутній водяний контакт між цими двома компонентами (тобто в безводних умовах). WO 9912524 відноситься до багатокомпонентного препарату з модифікованим вивільненням, у якому активною речовиною є НПЗЗ. Препарат відрізняється тим, що він містить дві багатокомпонентні фракції, при цьому одна фракція показує швидке вивільнення, а друга - повільне вивільнення. Фракція зі швидким вивільненням відповідає препарату зі швидким вивільненням, описаному в посиланні ЕР 1109534 (WO 15195), згаданому вище. JP 3240729 і ЕР 792147 також відносяться до препаратів, у яких активну сполуку гранулюють разом з лужною речовиною з використанням водяного розчину. Однак до теперішнього часу склалося розуміння того, що використання водяних розчинів у технологіях виробництва створює певні проблеми стосовно лікарських препаратів, що є нестабільними в присутності води і лужної речовини. З іншого боку, вся передісторія даної галузі явно вказує на те, що для забезпечення швидкого розчинення in vitro необхідна мокра грануляція. Таким чином, існує необхідність в одержанні препаратів, що показують швидке розчинення в соляній кислоті, але в той же час мають високу стабільність. Пропонується фармацевтична композиція, що призначена для перорального введення і виготовляється способом, що використовує мінімальну кількість рідини, переважно взагалі без використання рідини, а також використовує інтенсивне перемішування у вигляді спільного розмелу або еквівалентного процесу для забезпечення тісного фізичного контакту між активною лікарською речовиною і підсилювачем розчинення (лужною речовиною). Хоча пероральна лікарська форма була отримана без використання рідини взагалі, отримані партії мали вологовміст на тому ж рівні, що і партії, отримані шляхом мокрої грануляції. Несподівано виявилося, що партії, отримані за винаходом, мали істотно поліпшену стабільність незалежно від вологовмісту. Примітно те, що партії, отримані шляхом спільного розмелу, показували швидке розчинення in vitro. Активна лікарська речовина має високу швидкість розчинення in vitro в умовах, що імітують шлункову рідину, так що, щонайменше, 50% активної лікарської речовини розчиняється протягом перших 20 хвилин іспиту на розчинність in vitro. Таким чином, у першому аспекті винахід відноситься до способу виробництва фармацевтичної композиції, а також до фармацевтичних композицій, одержуваним цим способом. Спосіб включає наступні етапи: a) одержання активної лікарської речовини, що має розчинність при кімнатній температурі менше 7 0,1% ваг./об. у 0,1 N соляній кислоті або що має величину рКа менше 5,5; і b) одержання одного або декількох лужних речовин; і c) змішування згаданої активної лікарської речовини і згаданої лужної речовини шляхом спільного розмелу без додавання рідини, і, можливо, d) додавання в суміш одного або декількох фармацевтично прийнятних наповнювачів і, можливо, e) пресування згаданої суміші с) або d) у таблетку. Таким чином, даний винахід відноситься не тільки до способів виробництва фармацевтичних композицій, але також і до стабільних фармацевтичних композицій. Несподівано було виявлено, що фармацевтичні композиції, що включають водонерозчинні лікарські засоби, можуть бути виготовлені і складені способом, що забезпечує швидке розчинення активної лікарської речовини в шлунковій рідині, а також забезпечує умови для поліпшення стабільності по відношенню до активної лікарської речовини. У даному винаході лікарська речовина в процесі виробництва не піддається зовсім, чи піддається лише в мінімальному ступені впливу рідини або будь-якого водяного розчину. Дотепер вважалося, що композиція, отримана способом, що виключає використання води, буде мати більш низький вологовміст, ніж після мокрої грануляції. Низький вологовміст можливо повинен був забезпечувати більш тривалий термін збереження для цих композицій, ніж для препаратів, складених і перероблених традиційним способом. Однак вологовміст композицій, виготовлених за винаходом, виявився таким самим, як у композиціях, отриманих шляхом мокрої грануляції з наступним сушінням гранулята. Зовсім несподівано виявилося, що запропонований спосіб спільного розмелу забезпечує істотно поліпшену стабільність незалежно від вологовмісту. В той же час, запропоновані композиції показують швидке розчинення in vitro, хоча колишні розробки вказують на те, що для забезпечення швидкого розчинення in vitro активна речовина і лужний наповнювач повинні контактувати з водою. Таким чином, даний спосіб сприятливий для активних речовин, чутливих до води. Сприятливо те, що описуваний спосіб спільного розмелу є економічно вигідним, оскільки цей спосіб вимагає меншої кількості технологічних етапів. Зокрема, усувається трудомісткий етап зволоження і наступний дорогий етап сушіння, що використовується у попередній технології виробництва. Крім того, стають необов'язковими особливі вимоги, що стосуються осушення повітря виробничих приміщень. У першому аспекті винахід відноситься до способу виробництва пероральної лікарської форми, що показує швидке розчинення активної лікарської речовини в шлунковій рідині; спосіб включає наступні етапи: a) одержання активної лікарської речовини, що має розчинність при кімнатній температурі менше 0,1% ваг./об. у 0,1 N соляній кислоті або що має величину рКа менше 5,5; і 93353 8 b) одержання одного або декількох лужних речовин; і c) змішування згаданої активної лікарської речовини і згаданої лужної речовини шляхом спільного розмелу без додавання рідини, і, можливо, d) додавання в суміш одного або декількох фармацевтично прийнятних наповнювачів і, можливо, є) пресування згаданої суміші с) або d) у таблетку. В другому аспекті винахід відноситься до способу виробництва пероральної лікарської форми, що має швидке розчинення активної лікарської речовини в шлунковій рідині; спосіб включає наступні етапи: a) одержання активної лікарської речовини, що має розчинність при кімнатній температурі менше 0,1% ваг./об. у 0,1 N соляній кислоті або що має величину рКа менше 5,5; і b) одержання одного або декількох лужних речовин; c) розмел згаданої лужної речовини без додавання рідини; d) змішування згаданої лужної речовини (речовин), отриманої на етапі с), зі згаданою активною лікарською речовиною, і, можливо, є) додавання в суміш одного або декількох фармацевтично прийнятних наповнювачів, і f) пресування згаданої суміші d) або є) у таблетку. У третьому аспекті винахід відноситься до способу виробництва пероральної лікарської форми, що має швидке розчинення активної лікарської речовини в шлунковій рідині; спосіб включає наступні етапи: a) одержання активної лікарської речовини, що має розчинність при кімнатній температурі менше 0,1% ваг./об. у 0,1 N соляній кислоті або що має величину рКа менше 5,5; і b) одержання одного або декількох лужних речовин; і c) змішування згаданої активної лікарської речовини і згаданої лужної речовини і, можливо, одного або декількох наповнювачів шляхом спільного розмелу без додавання рідини, і, можливо d) додавання в суміш одного або декількох фармацевтично прийнятних наповнювачів, і, можливо, є) пресування згаданої суміші с) або d) у таблетку. У четвертому аспекті винахід відноситься до способу виробництва пероральної лікарської форми, що показує швидке розчинення активної лікарської речовини в шлунковій рідині; спосіб включає наступні етапи: a) одержання активної лікарської речовини, що має розчинність при кімнатній температурі менше 0,1% ваг./об. у 0,1 N соляній кислоті або що має величину рКа менше 5,5; і b) одержання одного або декількох лужних речовин, що мають розчинність у воді, щонайменше, 40 мг/мол і середній розмір часток у діапазоні від 1 до 400 мкм, наприклад, від 1 до 300 мкм, зокрема, від 5 до 200 мкм; і 9 c) змішування згаданої лужної речовини, отриманої в b), зі згаданою активною лікарською речовиною, і, можливо, d) додавання в суміш одного або декількох фармацевтично прийнятних наповнювачів, і e) пресування згаданої суміші с) або d) у таблетку. Іншими словами, виробництво здійснюється в сухих умовах, що виключають використання рідини. Такі пероральні лікарські форми переважно є твердими або напівтвердими. У наступному аспекті винахід у цілому відноситься до пероральної лікарської форми зі швидким вивільненням активного інгредієнта, при цьому пероральна лікарська форма включає активну лікарську речовину, описану тут, у тісному фізичному контакті з одним або декількома лужними речовинами. В одному з окремих аспектів, спосіб виробництва, описаний тут, призначений для одержання пероральної лікарської форми. У наступному аспекті пероральна лікарська форма може бути додатково охарактеризована стосовно її стабільності. Хоча в процесі виробництва пероральної лікарської форми виключається використання водяного розчину, пропоновані композиції все рівно можуть мати вологовміст на тому ж рівні, що і композиції, одержувані мокрою грануляцією. Як показано в прикладі 10, зовсім несподівано виявилося, що при порівнянні партій, виготовлених шляхом спільного розмелу, з партіями, виготовленими шляхом мокрої грануляції, причому всі партії мали вологовміст на одному рівні незалежно від способу виробництва, спостерігається істотне поліпшення стабільності для партій, виготовлених шляхом спільного розмелу. Механізм поліпшення стабільності в деталях не ясний, але, не обмежуючись якою-небудь теорією, можна припустити, що під впливом грануляційної рідини у випадку мокрої грануляції змінюється кристалічна структура активної лікарської речовини. Такої зміни кристалічної структури не відбувається в композиціях, одержуваних шляхом спільного розмелу. Тому автор винаходу, не обмежуючись цією теорією, зробив припущення, що при контакті із грануляційною рідиною лікарської речовини, наприклад, лорноксикама, лікарська речовина, у даному випадку лорноксикам, частково розчиняється з наступним затвердінням у вигляді менш стабільної форми. Ця менш стабільна форма, швидше за все, являє собою аморфну форму лікарської речовини, наприклад, активної лікарської речовини. На основі багатообіцяючих результатів стосовно стабільності, отриманих для лорноксикама, можна зробити висновок, що цей спосіб буде також сприятливим для інших лікарських речовин, таких як інші НПЗЗ, включаючи тіазинкарбоксаміди. Поліпшена стабільність була продемонстрована аналізом стабільності, описаним у прикладі 10, в якому композиції, отримані спільним розмелом, порівнювали з партією, отриманою шляхом мокрої грануляції. У цьому аналізі як індикаторний параметр стабільності вибрали продукт розкладання лорноксикама, HN-10004. У цьому випадку спільний розмел здійснювали за допомогою ку 93353 10 льового млина зі сферами, що горизонтально рухаються. Однак існує тверде переконання, що тип спільного розмелу не впливає на стабільність, оскільки вирішальним фактором стабільності є наявність чи відсутність контакту активної лікарської речовини з грануляційною рідиною. Інші методики спільного розмелу, описані тут, також є прийнятними. На момент початку іспитового періоду визначали вологовміст таблеток. Вологовміст усіх композицій знаходився на одному рівні, при цьому партія, отримана мокрою грануляцією, мала тенденцію до більш низького вологовмісту, ніж дві інші композиції. Дотепер було добре відомо, що стабільність лорноксикама в комбінації з лужною речовиною тісно пов'язана з низьким вологовмістом у таблетці. В аналізі стабільності стабільність випробували шляхом проведення декількох контрольних вимірів протягом 6-місячного періоду, як видно із приклада 10. Як індикаторний параметр стабільності в прикладі 10 вибрали продукт розкладання HN-10004. При всіх контрольних вимірах кількість HN-10004 у партіях №№ 17110431 і 17110432 (отриманих спільним розмелом) була нижче, ніж у партії № 10225671 (отриманою мокрою грануляцією). При всіх контрольних вимірах стабільність двох композицій, отриманих спільним розмелом, виявилась істотно вище стабільності партії, отриманої мокрою грануляцією, незважаючи на той факт, що партія, отримана мокрою грануляцією, мала більш низький вологовміст. На момент початку іспиту також виявлений більш низький вміст HN-10004 у продукті, отриманому спільним розмелом. Це показує, що розкладання партій, що виготовляються шляхом мокрої грануляції, відбувається вже в процесі виробництва. Таким чином, несподівано виявилося, що спосіб спільного розмелу забезпечує одержання продукту з істотно поліпшеною стабільністю, незважаючи на більш високий вологовміст. Спосіб спільного розмелу був продемонстрований для лорноксикама як модельної речовини, і вважається дуже ймовірним, що даний спосіб буде прийнятним для інших активних лікарських речовин. Такі лікарські речовини, як правило, являють собою слабку кислоту, а лужна речовина буде функціонувати як підсилювач розчинення, тому спосіб спільного розмелу особливо сприятливий для активних лікарських речовин із проблемами стабільності. У спеціальних варіантах здійснення винаходу пероральна лікарська форма додатково містить сполучне, яке, на відміну від ряду звичайних технологій виробництва, не має форми водяного розчину в процесі виробництва чи не було оброблено водяним розчином перед використанням. Тому сполучне не показує набрякання, що можна визначити за допомогою мікроскопа, наприклад, скануючого електронного мікроскопа (SEM), що має високу збільшувальну здатність. 11 Варто розуміти, що спосіб виробництва і пероральні лікарські форми за винаходом можуть відрізнятися по відношенню до - типу терапевтично активної речовини - типу лужної речовини - способу змішування й одержуваної суміші активної лікарської речовини і лужної речовини - швидкого розчинення активної лікарської речовини в кислому розчині - стабільності терапевтично активного інгредієнта. Ці аспекти будуть описані нижче більш докладно. Тип устаткування для спільного розмелу Ущільнення у валках Кульовий млин зі сферами, що вертикально рухаються Кульовий млин зі сферами, що горизонтально рухаються Механічна гомогенізація 93353 12 У деяких варіантах здійснення спосіб виробництва і пероральна лікарська форма за винаходом можуть також відрізнятися по відношенню до способу пресування таблеток. Наприклад, для виготовлення 10-мм круглої стандартної опуклої таблетки прикладається зусилля мінімум ~4 кН. Результати експериментів У даному способі може бути використане різне устаткування для спільного розмелу. Нижче представлений огляд типів устаткування для спільного розмелу і технологічних параметрів, із вказівкою відповідних прикладів, описаних тут. Особливий тип устаткування для спільного розмелу Minipactor® виробництва Gerteis Maschinen + Processengineerin gAG. Кульовий млин Struers Зусилля, що прикладається устаткуванням/ параметри Високе зусилля Зусилля стиску: 8-12 кН/см об\хв: 2 Номер сита: 1,0-1,5 мм Зазор: 2,5 мм Низьке зусилля 250-400об/хв Комірка сита: 700 мкм Fritsch Pulverisette тип 06.002.00 Середнє зусилля Час впливу Приклад Короткий 6 час Наприклад, менше 1 хв. Тривалий час: 1 /2-24 години Середній час: 5 - 30 хв. Пристрій механічної гомогенізації Середнє зусилля Час: 3-30 хв. Середній AMS-LAB виробництва Hosokawa Оберти ротора: 1300-1500 Тем- час: Alpine. пература: 20-45 °С 5 - 30 хв. Розмел лужної речовини, змішування Просте змішування Приклади 2, 3, 4 і 10 відносяться до спільного розмелу, виробленому кульовим млином зі сферами, що горизонтально рухаються. Лужна речовина, використовувана в прикладі 2, являє собою тринатрійфосфат. Використовують два типи сполучних, НРС і VA 64, при цьому обидві комбінації забезпечують швидке розчинення отриманих таблеток. Спільний розмел у даному випадку виконується при середньому зусиллі і середньому часі впливу. У прикладі 3 лужна речовина являє собою карбонат натрію, а способом здрібнювання знову є розмел на кульовому млині зі сферами, що горизонтально рухаються. Подібно прикладу 2, використовується два типи сполучних, НРС і VA 64, при цьому обидві комбінації забезпечують швидке розчинення отриманих таблеток. Нарешті, у прикладі 4 в якості лужної речовини використовують аргінін, що забезпечує одержання таблеток зі швидким вивільненням активної речовини на тому ж рівні, що і для препаратів із тринатрійфосфатом. Стабільність таблеток, отриманих за допомогою методики, описаної в прикладах 2 і 3, випробували шляхом аналізу стабільності, приклад 10. Таблетки показали відмінну стабільність у порівнянні з таблетками, отриманими за допомогою відомих технологій виробництва. 11 2 3 4 10 5 7 8 9 Крім того, досліджували інший принцип спільного розмелу, що також використовує середнє зусилля і середній час впливу - розмел шляхом механічної гомогенізації. У прикладі 5 таблетки одержували після спільного розмелу за допомогою пристрою механічної гомогенізації AMS виробництва Hosokawa Alpine. В якості лужної речовини таблетки містили тринатрійфосфат, карбонат натрію, аргінін або лізин. Усі композиції показували швидке розчинення, при цьому партія з лізином показала видатні результати по відношенню до швидкості розчинення. Дві композиції засновані на тринатрійфосфаті з різним середнім розміром часток лужної речовини: 203 мкм і 40 мкм, відповідно. Хоча обидві партії, як з великим, так і з малим розміром часток, показали прийнятні результати, розчинення було істотно швидше у випадку партії з меншим розміром часток. Для демонстрації того, що низьке зусилля в сполученні з тривалим часом впливу може забезпечити ефект спільного розмелу, одержували таблетки з лізином або тринатрійфосфатом в якості лужної речовини в прикладі 5. Крім того, партії, отримані з молярним співвідношенням лорноксикам: лужна речовина 1:20 порівнювали з партіями, отриманими з молярним співвідношенням 1:40. Усі партії показали швидке розчинення, і молярне 13 співвідношення не вплинуло на швидкість розчинення. Нарешті, високе зусилля в сполученні з коротким часом впливу створювали шляхом ущільнення у валках. У прикладі 6 таблетки одержували за допомогою пристрою Minipactor® виробництва Gerteis Maschinen + Processengineering AG з використанням тринатрійфосфата або лізина в якості лужної речовини. Партії одержували на основі малого і великого розміру часток лужної речовини. Усі партії показали швидке розчинення, і розмір часток не зробив очевидного впливу при такому способі спільного розмелу. Як альтернатива, щільний контакт, що забезпечується спільним розмелом, може бути встановлений шляхом розмелу лужної речовини на устаткуванні, що використовується для спільного розмелу, або на іншому придатному устаткуванні, з наступним простим змішуванням чи гомогенізацією і потім таблетуванням, причому таблетування виконують при високому зусиллі і короткому періоді впливу. У прикладі 7 лізин в якості лужної речовини подрібнювали в млині зі спіральним струменем Hosokawa Alpine до середнього розміру часток 5 мкм із наступним пресуванням суміші інгредієнтів у таблетки. Одержали дві партії, обидві з який показали швидке розчинення. На підставі цих прикладів можна зробити висновок, що для одержання таблеток зі швидким розчиненням необхідний спільний розмел активної лікарської речовини разом з лужною речовиною, чи розмел лужної речовини з наступним пресуванням у таблетки, чи, в альтернативі, мокра грануляція, застосовувана в попередній технології. Для демонстрації цього твердження таблетки одержували відповідно до попередньої технології (наприклад, JP 3240729 або ЕР 1109534), а саме, способом мокрої грануляції, але без етапу зволоження. Цей експеримент описаний більш докладно в прикладі 9, і, як видно з цього прикладу, отримані таблетки показали неприйнятно повільне розчинення. Таким чином, дані приклади демонструють, що швидке розчинення забезпечується спільним розмелом терапевтично активної лікарської речовини, що має розчинність при кімнатній температурі менше 0,1% ваг./об. у 0,1N соляній кислоті або має величину рКа менше 5,5, разом з лужною речовиною, можливо, з наступним додаванням інших наповнювачів і, можливо, з наступним таблетуванням суміші інгредієнтів. В альтернативі, лужна речовина може бути розмелена способами, описаними тут, для наступного змішування з активною лікарською речовиною, можливо, з наступним додаванням інших наповнювачів для наступного пресування в таблетки. Нарешті, швидке розчинення може бути забезпечено спільним розмелом активної лікарської речовини разом з лужною речовиною і, можливо, разом з іншими наповнювачами, з наступним можливим уведенням додаткових наповнювачів і наступним пресуванням суміші інгредієнтів у таблетки. Терапевтично активний інгредієнт 93353 14 У принципі, будь-який активний інгредієнт, що відрізняється низькою розчинністю в кислому розчині, може бути перероблений вищезгаданим способом виробництва для поліпшення розчинення в кислому розчині і, таким чином, забезпечення швидкого всмоктування лікарського препарату у верхньому відділі шлунково-кишкового тракту після перорального прийому виготовленої композиції. Згідно даного винаходу, активний інгредієнт являє собою терапевтично активну сполуку з низькою розчинністю в 0,1 N соляній кислоті, наприклад, розчинністю в 0,1 N соляній кислоті менше 0,1% ваг./об. Відповідно до іншого визначення, терапевтично активна сполука має величину рКа менше 5,5; відомо, що такі сполуки погано розчиняються в шлунковій рідині. Крім того, активний інгредієнт може бути визначений як інгредієнт, що відноситься до групи НПЗЗ, що характеризуються як слабкі кислоти. Прикладами НПЗЗ є лорноксикам і напроксен. Більшість згаданих активних лікарських речовин являють собою слабкі кислоти, тобто, речовини, що мають величину рКа нижче ~5,5, наприклад, у діапазоні від ~3,0 до ~5,5, або в діапазоні від ~4,0 до ~5,0. У цьому зв'язку варто згадати, що величина рКа для лорноксикама складає ~4,7, для напроксена ~4,2, для індометацина ~4,5, для ібупрофена ~5,2 і для ацетилсаліцилової кислоти ~3,5. Крім того, активні лікарські речовини, подібні згаданим вище, як правило, мають погану розчинність у середовищах з рН нижче зазначеної величини рКа. Наприклад, розчинність лорноксикама при рН 0,1 N соляної кислоти складає менше 1 мг/100 мл при кімнатній температурі. Активні лікарські речовини на зразок ацетилсаліцилової кислоти, індометацина і напроксена розглядаються як речовини, практично нерозчинні у воді й у 0,1 N НСl при кімнатній температурі. Вислів "активна лікарська речовина" у даному описі й у формулі винаходу використовується як синонім висловів "терапевтично активна речовина", "терапевтично активний інгредієнт" і "терапевтично активна сполука". Подібним чином, вислів "фармацевтична композиція" у даному описі й у формулі винаходу використовується як синонім висловів "фармацевтичний препарат", "препарат" і "лікарська форма". Відповідні приклади активних лікарських речовин, придатних для використання в композиціях за винаходом, у цілому являють собою слабокислотні речовини, такі як, наприклад, парацетамол та/або нестероїдні протизапальні речовини НПЗЗ, такі як: - похідні аміноарилкарбонових кислот, такі як енфенамова кислота, флуфенамова кислота, ізоніксин, меклофенамова кислота, мефенамова кислота, морніфлумат, ніфлумова кислота і толфенамова кислота, - похідні арилоцтових кислот, такі як ацеклофенак, ацеметацин, амфенак, бромфенак, цимметацин, диклофенак, етодолак, фентіазак, глюкаметацин, індометацин, лоназолак, метіавінова кислота, оксаметацин, піразолак, проглюметацин, суліндак, тіарамід, толметин і зомепірак, - арилкарбонові кислоти, такі як кеторолак і тиноридин, 15 - похідні арилпропіонових кислот, такі як алмінопрофен, бермопрофен, карпрофен, дексибупрофен, фенбуфен, фенопрофен, флуноксапрофен, флюрбіпрофен, ібупрофен, ібупроксам, кетопрофен, локсопрофен, напроксен, оксапрозин, пранопрофен, протизинова кислота і тіапрофенова кислота, - піразоли, такі як епіризол, - піразолони, такі як бензпіперилон, мофебутазон, оксифенбутазон, фенилбутазон і раміфеназон, - похідні саліцилової кислоти, такі як ацетаміносалол, ацетилсаліцилова кислота, бенорилат, етерисалат, фендосал, імідазола саліцилат, лізина ацетилсаліцилат, морфоліна саліцилат, парсалмід, саламідоцтова кислота і салсалат, - тіазинкарбоксаміди, такі як ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам і теноксикам, - інші, такі як буцилламін, буколом, бумадизон, диференпірамід, дитазол, еморфазон, набуметон, німесулід, проквазон, акривастин і піроксикам (наприклад, у формі бета-циклодекстринового комплексу), при цьому НПЗЗ може мати форму фармацевтично прийнятної солі або проліків. З комерційної точки зору найбільший інтерес представляють наступні НПЗЗ: лорноксикам, диклофенак, німесулід, ібупрофен, піроксикам, піроксикам (бета-циклодекстрин), напроксен, кетопрофен, теноксикам, мелоксикам, толфенамова кислота, бромазепам, ацеклофенак, індометацин, набуметон, ацеметацин, морніфлумат, мелоксикам, флюрбіпрофен, тіапрофенова кислота, проглюметацин, мефенамова кислота, фенбуфен, етодолак, толфенамова кислота, суліндак, фенілбутазон, фенопрофен, толметин, ацетилсаліцилова кислота, дексибупрофен та їх фармацевтично прийнятні солі, комплекси та/або проліки і суміші. Зокрема, інтерес представляють наступні НПЗЗ: піроксикам, мелоксикам, ібупрофен, толфенамова кислота і бромазепам. Інші важливі активні лікарські речовини включають інгібітори СОХ-2 (СОХ -абревіатура циклооксигенази), такі як целекоксиб і флосулід. В даний час найбільш переважною лікарською речовиною є лорноксикам і його фармацевтично прийнятні солі, комплекси та/або проліки, такі як ефіри. Лорноксикам може бути присутнім у композиції за винаходом у вигляді єдиної лікарської речовини або в комбінації з іншими лікарські речовинами, такими як опіоїди або триптани. Відповідні приклади опіоїдних речовин включають морфін, гідроморфон, кодеїн, оксикодон, гідрокодон, метадон, леворфанол, фентаніл, бупренорфін, буторфанола тартрат, дезоцин, налбуфіна гідрохлорид і меперидин. Відповідні приклади триптанових речовин включають метоклопрамід, суматриптан, ризатриптан, наратриптан, колмітриптан, елетриптан, алмотриптан, золмітриптан і фроватриптан. У тих випадках, коли композиція зі швидким вивільненням за винаходом включає як терапевтично активний інгредієнт НПЗЗ, кількість активної лікарської речовини складає від 1 до ~1600 мг (ваг.). В альтернативі, лікарська форма може містити еквівалентні молярні кількості фармацевтич 93353 16 но прийнятних солей активного інгредієнта. Лікарська форма містить кількість речовин, необхідну для забезпечення власне еквівалентного терапевтичного ефекту. У переважних варіантах здійснення винаходу активний інгредієнт являє собою лорноксикам. Цей лікарський засіб є слабкою кислотою (рКа менше 5,5), має розчинність у 0,1 N НСl менше 0,1% ваг./об. і схильний до розкладання в присутності води. Схильність до розкладання в присутності води залежить від присутності наповнювачів, таких як лужні речовини, і зокрема, залежить від способу виробництва, як було показано в даному описі. Швидкість розчинення активної лікарської речовини може також залежати від розміру часток лікарської речовини. Відповідно, у переважних варіантах здійснення винаходу активна лікарська речовина може бути також визначена по відношенню до її гранулометричного складу. Гранулометричний склад може бути визначений за допомогою лазерної дифракції (наприклад, з використанням приладу Malvern Mastersizer 2000). Гранулометричний склад розраховують з використанням співвідношень теорії Фраунгофера чи Мі. Зразок спочатку диспергують у тенсидному розчині в якості попередньої обробки. Потім аліквоту попередньо диспергованої речовини переносять у дисперсійну ванну, в якій відбувається подальше диспергування при перемішуванні й обробці ультразвуком. Цю суспензію пропускають крізь вимірювальну комірку. У процесі вимірів перемішування продовжується, а ультразвук виключається. Як правило, гранулометричний склад, визначений вищезгаданим способом лазерної дифракції активної лікарської речовини, є таким, що, щонайменше, 90% об. речовини має розмір часток менше 100 мкм, переважно менше 75 мкм, більш переважно менше 50 мкм, наприклад, ~40 мкм. У деяких варіантах здійснення гранулометричний склад є таким, що, щонайменше, 95% об. речовини має розмір часток менше 32 мкм, наприклад, менше 20 мкм чи, більш переважно, менше 10 мкм. В інших варіантах здійснення гранулометричний склад є таким, що, щонайменше, 80% об. речовини має розмір часток менше 10 мкм. Проте варто розуміти, що розмір часток у діапазоні низьких величин може бути практично неприйнятний. Таким чином, у додаткових кращих варіантах здійснення винаходу активна лікарська речовина має гранулометричний склад, визначений за допомогою лазерної дифракції, у якому щонайменше 90% об. активної лікарської речовини має розмір часток більш 0,1 мкм. У деяких варіантах здійснення використовується середній розмір часток, D(v; 0,5) (мкм). Як правило, середній розмір часток стосується наповнювачу, наприклад, середній розмір часток лужної речовини. Під середнім розміром часток мається на увазі гранулометричний склад, визначений вищезгаданим способом лазерної дифракції, у якому 50% часток мають розмір, зазначений вище, а 50% часток - менше середнього розміру часток, при цьому склад визначають в об'ємних відсотках. 17 93353 Лужна речовина Як зазначено вище, пероральна лікарська форма за винаходом повинна додатково включати лужну речовину. Важливою умовою є фізичний контакт лужної речовини з активною лікарською речовиною, таким як лорноксикам. Передбачається, що лужна речовина створює мікросередовище навколо активної лікарської речовини, що полегшує розчинення активної лікарської речовини в кислих розчинах, коли композиція піддається впливу кислого розчину або води. Як правило, молярне співвідношення між активною лікарською речовиною і лужною речовиною знаходиться в діапазоні від 1:100 до 1:1, переважно, згадане молярне співвідношення складає 1:80, 1:60, 1:40 чи 1:30, найбільше переважно 1:20. В інших варіантах здійснення молярне співвідношення активної лікарської речовини і лужної речовини складає 1:10. Співвідношення 1:10 18 є особливо переважним у варіанті здійснення, у якому лужна речовина являє собою амінокислоту або її похідне, наприклад, лізин, гістидин або аргінін чи їх похідні. Вислів "лужна речовина" у даному описі відноситься до речовин, що утворюють лужну рН у діапазоні 8-14, переважно 8-13, при розчиненні у воді при кімнатній температурі в кількості близько 10 мг/мл. Відповідно, вислів "лужна речовина" включає відповідну основу органічної чи неорганічної кислоти, наприклад, у формі фармацевтично прийнятної солі органічної чи неорганічної кислоти і сумішей солей, органічні аміни і деякі амінокислоти та їх похідні. Як правило, органічна чи неорганічна кислота, похідним якої є відповідна основа, має рКа у діапазоні 4-14. Відповідні лужні речовини перераховані в Табл. 1. Таблиця 1 Перелік лужних речовин Луга Приклад Солі вугільної кислоти (карбонати і гідрокарбонати) і фос- Дикарбонат натрію форної кислоти (фосфати і моногідрофосфати). = Розчинні солі з рКа від 4 до 11 Карбонат натрію Гідрокарбонат натрію = Бікарбонат натрію Тринатрійфосфат Динатрію гідрофосфат Солі органічних кислот з рКа від 4 до 11 Ацетат натрію Цитрат натрію Малеат натрію Фумарат натрію Будова Na2CO3 NaHCO3 6,4 Na3PO4 Na2HPO4 12,4 7,2 4,8 6,4 6,2 4,4 Органічні аміни Гідроксиламін Діетиламін Триетиламін Гідразин Кодеїн CH3COONa C6H5O7Na3 C4H2O4Na2 C4H2O4Na2 (транс) NH2OH (CH3CH2)2NH (CH3CH2)3N NH2NH2 C18H21NO3 Амінокислоти з рКа3 від 8 до 14 Лізин C6H14O2N2 Аргінін C6H14N4O2 Гістидин C6H9O2N3 * Величини рКа у даній таблиці є приблизними і стосуються рКа кислоти. рКа* 10,3 6 11 10,8 8 8,2 (рНв насиченому розчині 9,8) рКа1:2,2 рКа2:8,9 рКа3:10,3 рКа1:2,2 рКа2:9,1 рКа3:13,2 рН11,4 (100г/л Н2О) рКа1:1,8 рКа2:6,0 рКа3:9,0 рН7,7 (10г/л Н2О) 19 В одному з варіантів здійснення даного винаходу лужна речовина являє собою сіль органічної чи неорганічної кислоти або суміш таких солей, при цьому органічна чи неорганічна кислота має рКа у діапазоні 4-14, переважно в діапазоні від 6 до 13,5, більш переважно в діапазоні 7-13, найбільше переважно в діапазоні 8-13, наприклад, 8,513, зокрема, 9-13, наприклад, 9-12,5. У деяких варіантах здійснення даного винаходу лужна речовина являє собою сіль неорганічної кислоти, вибраної з вугільної чи фосфорної кислоти, наприклад, гідрокарбонат, дигідрофосфат і гідрофосфат. Іншими словами, сіль має аніон, вибраний з карбонату, фосфату і гідрофосфату, а в якості катіону вибирають лужний або лужноземельний метал, такий як натрій, калій, кальцій, магній і т.п., наприклад, сіль містить аніон, вибраний з СО32-, НРО42-, РО43-, і катіон, вибраний з Na+, K+, Ca2+, Mg2+. Як правило, сіль неорганічної кислоти вибирають з динатрію карбонату, динатрію фосфорнокислого і тринатрійфосфата. Використання гідрокарбонатів, як правило, є не цілком придатним через ефект газовиділення ("шипучості"), якщо це не є метою. У деяких варіантах здійснення даного винаходу лужна речовина являє собою сіль органічної кислоти, при цьому органічну кислоту вибирають з лимонної кислоти, малеїнової кислоти або оцтової кислоти. Іншими словами, сіль містить аніон, вибраний з ацетату, гідроцитрату, цитрату, гідромалеату або малеату. Як правило, сіль органічної кислоти являє собою натрію ацетат, тринатрію цитрат, динатрію гідроцитрат або динатрію малеат, переважно тринатрію цитрат. У наступному варіанті здійснення даного винаходу лужна речовина являє собою органічний амін, вибраний з гідроксиламіна, діетиламіна, триетиламіна чи гідразина. У наступному варіанті здійснення даного винаходу лужна речовина являє собою амінокислоту, таку як гістидин, лізин чи аргінін. Крім того, мається на увазі, що лужна речовина повинна бути розчинна у воді, щоб, щонайменше, відповідати категорії помірно розчинних у воді: 1 частина лужної речовини може бути розчинений максимум у 100 частинах води. Переважно, лужна речовина повинна бути розчинна у воді в такому співвідношенні: 1 частина лужної речовини розчиняється максимум у 30 частинах води. Крім того, варто розуміти, що лужна речовина повинна бути представлена у формі твердої речовини, наприклад, у формі порошку, грануляту і т.п. Спосіб виробництва Як згадано вище, спосіб за винаходом включає перший етап змішування активної лікарської речовини і лужної речовини шляхом інтенсивного механічного перемішування. Важливо те, що згаданий етап змішування має єдину мету - забезпечити тісний фізичний контакт між активною лікарською речовиною і лужним засобом для одержання бажаного мікросередовища. Для забезпечення тісного фізичного контакту переважно 93353 20 можуть не додаватись інші наповнювачі, і може використовуватись активна лікарська речовина і лужна речовина в молярних співвідношеннях у діапазоні від 1:100 до 1:1. Переважно, згадане молярне співвідношення складає 1:80, 1:60, 1:40 чи 1:30, найбільше переважно 1:20. Як правило, метою згаданої операції змішування не є вплив на розмір часток активної лікарської речовини. У деяких випадках можна очікувати, що інтенсивне перемішування може знизити розмір часток лужної речовини, якщо розмір вихідних часток вище 100 мкм. Важливо те, що змішування здійснюють в умовах, що виключають додавання рідин, таких як водяні розчини, вода, суміші органічних розчинників і води, для того щоб забезпечити умови, що зменшують можливість розкладання активної лікарської речовини. Таким чином, зі способу виключений етап звичайної мокрої грануляції. Змішування проводять механічним способом, що передає енергію суміші активної лікарської речовини і лужного засобу, приводячи активну лікарську речовину і лужну речовину в тісний фізичний контакт, набагато більш щільний, ніж при звичайному змішуванні, з утворенням дисперсної речовини. Одержувана дисперсна речовина включає активна лікарська речовина і лужна речовина, власне гомогенно змішані один з одним, але не дисперговані один в одному на молекулярному рівні. Таким чином, варто розуміти, що одержувана дисперсна речовина містить кожний з компонентів (лужна речовина і лікарська речовина) у вигляді окремих часток. У принципі, будь-який механічний спосіб, що забезпечує одержання дисперсної речовини відповідно до приведеного тут визначенням, може бути використаний. У цілому, такий механічний спосіб вимагає інтенсивного змішування, зокрема, такого, яке забезпечується шляхом спільного розмелу. Вислів "спільний розмел" тут означає високо інтенсивне механічне змішування двох або декількох речовин, що приводить ці дві речовини в тісний фізичний контакт один з одним, більш щільний, ніж при звичайному змішуванні, наприклад, змішуванні в барабані. Вислів "спільний розмел" тут також включає будь-який спосіб, що забезпечує одержання такої ж дисперсної речовини, яке може бути отримане шляхом спільного розмелу, наприклад, змішування, що забезпечується сухою грануляцією шляхом ущільнення у валках, як описано вище. Операцію спільного розмелу переважно застосовують тільки до активної лікарської речовини і лужної речовини, але у випадках, коли це сприяє досягненню швидкого розчинення, можуть додаватися більш низькі кількості інших інгредієнтів. У тих варіантах здійснення, в яких лужна речовина має схильність до налипання, що спостерігається, наприклад, при використанні деяких амінокислот в якості лужної речовини, сприятливим є додавання невеликих кількостей інших інгредієнтів, таких як кальцію моногідрофосфат, безводний (СаНРО3), тринатрійфосфат (Na3PO4), алюмосилікат магнію, оксид магнію, кальцію карбонат (СаСО3), кальцію 21 сульфату дигідрат (CaSO4, 2H2O), сорбіт або тальк. У переважному варіанті здійснення спільний розмел проводять для суміші, що складається власне з активної лікарської речовини і лужної речовини. В одному з варіантів здійснення розмел виконують тільки для лужної речовини, при цьому розмел проводять тими ж способами, що і спільний розмел, чи за допомогою іншого придатного устаткування. Розмел, як правило, забезпечує середній розмір часток лужної речовини в діапазоні від 1 до 400 мкм, зокрема, від 1 до 300 мкм, наприклад, від 5 до 200 мкм. Після розмелу лужної речовини цю речовину змішують з активною лікарською речовиною, що має такий гранулометричний склад, що, щонайменше, 95% об. речовини має розмір часток менше 32 мкм, наприклад, менше 20 мкм, чи найбільше переважно менше 10 мкм. В інших варіантах здійснення гранулометричний склад такий, що, щонайменше, 80% об. речовини має розмір часток менше 10 мкм. Під "змішуванням" варто розуміти таку операцію змішування, що не передбачає прикладання до суміші значного зусилля, а лише має на меті змішування компонентів. Після змішування здійснюють пресування в таблетки, результатом якого є приведення активної лікарської речовини і лужної речовини в тісний контакт, що може бути отриманий шляхом спільного розмелу. У переважному варіанті здійснення за винаходом механічний спосіб являє собою спільний розмел. Спільний розмел може бути здійснений з використанням стандартного помольного устаткування, такого як Hammer Mill (наприклад, Fitz Mill виробництва Fitz Patrick). Спосіб спільного розмелу може бути також здійснений з використанням пристрою Ball Mill (наприклад, Fritz Pulverizette), що представляє собою кульовий млин зі сферами, що горизонтально рухаються. Пристрій, що використовує інший принцип, являє собою кульовий млин зі сферами, що вертикально рухаються, наприклад, кульовий млин Struers, що випускається також компанією Hosokawa. Може бути використане устаткування для механічної гомогенізації (виробництва Hosokawa) або Micros Ring Mill. Нарешті, спільний розмел може бути здійснений на валковому пресі, наприклад, Minipactor® виробництва Gerteis Maschinen + Processengineering AG. Таким чином, під "спільним розмелом" варто розуміти операцію, що забезпечує створення тісного фізичного контакту між лорноксикамом і лужною речовиною. Цей контакт може бути створений шляхом додатка щодо великого зусилля в сполученні з відносно коротким періодом впливу, як у випадку використання валкового преса. При використанні валкового преса зусилля стиску, як правило, складає 6-14 кН/см, а час впливу - менше 1 хвилини. При пресуванні таблеток також створюється відносно велике зусилля в сполученні з відносно коротким періодом впливу. При таблетуванні, як правило, зусилля складає 4 кН і більше для стандартної опуклої круглої 10-мм таблетки, а час впливу - менше 1 хвилини. В альтернативі, використання відносно невеликого зусилля в сполученні з більш тривалим періодом впливу може 93353 22 забезпечити той же ступінь спільного розмелу. Наприклад, кульовий млин зі сферами, що вертикально рухаються, створює мале зусилля, і в цьому випадку потрібно істотно більш тривалий час впливу. Також можливе використання середнього часу впливу у випадку створення середнього зусилля пристроєм механічної гомогенізації або кульовим млином зі сферами, що горизонтально рухаються. Якщо лужна речовина має малий розмір часток, фізичний контакт може бути створений шляхом простого змішування і наступного пресування в таблетки. Згаданий малий розмір часток може бути отриманий шляхом розмелу. Розмел на кульовому млині Спільний розмел, що виконується на кульовому млині, може бути зроблений за допомогою пристроїв зі сферами, що горизонтально рухаються, або зі сферами, що вертикально рухаються. Розмел на кульовому млині зі сферами, що горизонтально рухаються, здійснюється з середнім зусиллям і тому потребує середнього часу впливу, зокрема, від 5 до 30 хвилин. Прикладом устаткування, придатного для виконання розмелу на кульовому млині зі сферами, що горизонтально рухаються, є Fritz Pulverizette. Кульовий млин зі сферами, що вертикально рухаються, створює мале зусилля і тому вимагає тривалого часу впливу. Прикладом устаткування, придатного для виконання розмелу на кульовому млині зі сферами, що вертикально рухаються, є кульовий млин Straers. Механічна гомогенізація Основним принципом даної операції є надання порошку кругового руху за допомогою ротора, зі створенням великого зусилля при зустрічі з голівкою преса. Ця операція повторюється з високою швидкістю, що забезпечує переробку порошку в дисперсну речовину. Прикладом такого устаткування є пристрій механічної гомогенізації AMS-LAB виробництва Hosokawa Alpine. Ущільнення у валках Робочий принцип валкового преса складається в ущільненні порошку між двома валками, що протилежно обертаються, з утворенням твердого листа, що потім дроблять на ситі з одержанням дисперсної речовини. У цій дисперсній речовині був досягнутий щільний механічний контакт між частками порошку. Прикладом такого устаткування є Minipactor® виробництва Gerteis Maschinen + Processengineering AG. Вислів "мікронізований" тут відноситься до часток, що мають середній розмір часток менше ~5 мкм після операції розмелу. Вислів "об/хв" означає "обертів за хвилину". Цей вислів, як правило, використовується для опису числа обертів компонента устаткування, що рухається, такого як лопать змішувального устаткування або устаткування для розчинення. Вислів "номер сита" відноситься до діаметра комірки сита. Позначення "RH" відноситься до відносної вологості, що звичайно означає кількість водяної пари, що знаходиться у повітрі при визначеній температурі. 23 У принципі, одержувана суміш активної лікарської речовини і лужної речовини (спільно розмелена суміш) за винаходом може бути використана для виготовлення лікарських форм перорального застосування безпосередньо, тобто, без додавання інших фармацевтично прийнятних наповнювачів. Однак у деяких варіантах здійснення винаходу спосіб включає другий етап, що представляє собою змішування одного або декількох фармацевтично прийнятних наповнювачів зі згаданою дисперсною речовиною шляхом звичайного змішування, наприклад, змішування в барабані. Таким чином, пероральна лікарська форма за винаходом може містити один або декілька додаткових фармацевтично прийнятних наповнювачів, таких як заповнювач (розріджувач), що зв'язує, дезінтегруючий засіб, речовина, що сприяє ковзанню, барвники і т.д. Часто лікарська форма містить наповнювач, чи сполучне, чи дезінтегруючий засіб, чи речовину, що сприяє ковзанню, чи барвник, чи комбінацію одного або декількох таких наповнювачів. Наприклад, додатковий фармацевтично прийнятний наповнювач може бути вибраний з метою додання пероральній лікарській формі вигляду таблетки, пігулки, капсули, саше і т.п. Відповідно, в одному з переважних варіантів здійснення винаходу спосіб додатково включає етап пресування дисперсної речовини в умовах таблетування для одержання таблетки. Пресування порошку в дисперсну речовину поліпшує плинність при таблетуванні, що може додатково поліпшити розчинення активної речовини. В одному з варіантів здійснення додатковим фармацевтично прийнятним наповнювачем є сполучне, переважно гідрофільне сполучне, обране з похідних целюлози, сахарину або повідону. Як правило, може бути використане будь-яке сполучне, за умови, що одержувана таблетка має час розпаду у воді при 37°С менше 30 хвилин, переважно менше 15 хвилин, більш переважно менше 5 хвилин. Таким чином, додатковий аспект винаходу відноситься до фармацевтичної композиції для перорального застосування, що включає: - активну лікарську речовину, що має розчинність при кімнатній температурі менше 0,1% ваг./об. у 0,1 М соляній кислоті або що має величину рКа менше 5,5; - одну або декілька лужних речовин; і - сполучне у формі гідрофільного полімеру, таке як похідні целюлози, сахарин або повідон. Характеристики розчинення На противагу попереднім уявленням, було ясно показано, що швидке розчинення активної лікарської речовини може бути досягнуте за допомогою способу виробництва, що виключає додавання рідини, такої як водяна рідина, до дисперсної речовини, що включає активну лікарську речовину і лужну речовину. Тому в одному з варіантів здійснення винаходу одержувана дисперсна речовина або суміш інгредієнтів активної лікарської речовини і лужної речовини, можливо, у суміші з іншими наповнюва 93353 24 чами, має характеристики розчинення in vitro, при іспитах методом, що використовує 1300 мл 0,1 N розчину НСl чи 0,07 N розчину НСl рівноважного при 37°С в якості середовища для розчинення і лопатевий апарат для розчинення II Фармакопеї США при швидкості перемішування 50 об/хв, що відрізняються тим, що, щонайменше, 50% ваг./ваг. активної речовини присутнє в середовищі для розчинення в розчиненій формі через 20 хвилин після початку іспиту на розчинність. В іншому варіанті здійснення іспит на розчинність проводили при швидкості перемішування 150 об/хв, але зі збереженням всіх інших параметрів, описаних вище. Характеристики розчинення in vitro фармацевтичної композиції відрізняються тим, що, щонайменше, 50% ваг./ваг. активної речовини присутнє в середовищі для розчинення в розчиненій формі через 20 хвилин після початку іспиту на розчинність. Переважно, одержувана дисперсна речовина або суміш інгредієнтів має характеристики розчинення in vitro, що відрізняються тим, що, щонайменше, 55% ваг./ваг., наприклад, щонайменше, 60% ваг./ваг., щонайменше, 65% ваг./ваг., щонайменше, 70% ваг./ваг., щонайменше, 75% ваг./ваг., чи щонайменше, 80% ваг./ваг. активної речовини присутнє в середовищі для розчинення в розчиненій формі через 20 хвилин після початку іспиту на розчинність. Як зазначено вище, до дисперсної речовини можуть бути додані додаткові фармацевтично прийнятні наповнювачі, наприклад, з метою додаткового поліпшення швидкості розчинення. У переважних варіантах здійснення винаходу дисперсну речовину пресують у таблетку. Автор винаходу надає тут доказ того, що додатковий етап пресування дисперсної речовини забезпечує ще більш швидке розчинення лорноксикама в 0,1 N НСl. Таким чином, у наступному варіанті здійснення одержувана таблетка має характеристики розчинення in vitro, при іспитах методом, що використовує 1300 мл 0,1 N розчину НСl рівноважного при 37°С в якості середовища для розчинення і лопатевий апарат для розчинення Фармакопеї США при швидкості перемішування 50 об/хв в якості устаткування, що відрізняються тим, що, щонайменше, 75% ваг./ваг. активної речовини присутнє в середовищі для розчинення в розчиненій формі через 20 хвилин після початку іспиту на розчинність. Переважно, одержувана таблетка має характеристики розчинення in vitro, що відрізняються тим, що щонайменше, 80% ваг./ваг., наприклад, щонайменше, 85% ваг./ваг., щонайменше, 90% ваг./ваг., щонайменше, 95% ваг./ваг. активної речовини присутнє в середовищі для розчинення в розчиненій формі через 20 хвилин після початку іспиту на розчинність. Стабільність Пероральна лікарська форма за винаходом має термін збереження щонайменше такий самий, як лікарська форма, отримана з додаванням водяних рідин. На етапі розробки було несподівано виявлено, що стабільність спільно розмелених 25 композицій істотно вище стабільності композицій, отриманих традиційним способом, незважаючи на однаковий вологовміст. Тому один з варіантів здійснення винаходу відноситься до пероральної лікарської форми, що містить лорноксикам у фізичному контакті з лужною речовиною, при цьому пероральна лікарська форма є хімічно стабільної по відношенню до лорноксикама, так що, щонайменше, 85% ваг. лорноксикама присутні у пероральній лікарській формі, щонайменше, через 3 місяці збереження при 25°С і RH 60% у темряві. Збереження може здійснюватися в закритих контейнерах, блістерній упаковці чи у відкритих контейнерах. Переважно, щонайменше, 85% ваг./ваг., більш переважно 90% ваг./ваг., ще більш переважно, щонайменше, 95% ваг./ваг., найбільше переважно, щонайменше, 98% ваг./ваг. лорноксикама є присутніми у згаданій композиції або в дозованому лікарському засобі, щонайменше, через 6 місяців, переважно більш ніж через 12 місяців, ще більш переважно більш ніж через 24 місяця і найбільше переважно більш ніж через 36 місяців збереження у вищезгаданих умовах. Інший спосіб визначення аспекту стабільності за винаходом заснований на концентрації продуктів розкладання або домішок у згаданій пероральній лікарській формі лорноксикама. Концентрацію продуктів розкладання, що присутні в пероральній лікарській формі, визначають, щонайменше, через 3 місяці, наприклад, в останній день спливу 3 місяців збереження при 25°С і RH 60 % у темряві. Збереження може здійснюватися в закритих контейнерах, блістерній упаковці чи у відкритих контейнерах. Переважно, загальна кількість продуктів розкладання в пероральній лікарській формі складає менше 15 % вихідної кількості лорноксикама, більш переважно менше 10 %, ще більш переважно менше 5 %, найбільше переважно менше 2 % ваг./ваг. Це забезпечує термін збереження більш 6 місяців, переважно більш 12 місяців, ще більш переважно більш 24 місяців і найбільше переважно більш 36 місяців. Існують підстави думати, що при складанні композиції за винаходом з використанням інших активних лікарських речовин, таких як НПЗЗ, наприклад, тіазинкарбоксамідів, ці інші активні лікарські речовини також будуть задовольняти описаним вище вимогам стабільності. Інші наповнювачі Як зазначено вище, пероральна лікарська форма за винаходом може містити ряд додаткових фармацевтично прийнятних наповнювачів, відмінних від лужної речовини, наприклад, розчинники, поверхнево-активні речовини, що зв'язують, заповнювачі, дезінтегруючі засоби, покриття, розріджувачі, речовини, що сприяють ковзанню, стабілізатори, мастильні речовини, штучні підсолоджувачі, ароматизатори, буфери або барвники. Дезінтегруючими засобами можуть бути, наприклад, альгінові кислоти - альгінати, кальцію карбоксиметилцелюлоза, натрію карбоксиметилцелюлоза, кросповідон, гідроксипропілцелюлоза, гідроксипропілметилцелюлоза (НРМС), похідні целюлози, такі як гідроксипропілцелюлоза низько 93353 26 заміщена (наприклад, LH 11, LH 20, LH 21, LH 22, LH 30, LH 31, LH 32 виробництва Shin-Etsu Chemical Co.) і мікрокристалічна целюлоза, полакрилін калію або натрію, поліакрилова кислота, полікарбофіл, поліетиленгліколь, полівінілацетат, полівінілпіролідон (наприклад, Polyvidon® CL, Polyvidon® CL-M, Kollidon® CL, Polyplasdone® XL, Polyplasdone® XL-10); натрій-карбоксиметиловий крохмаль (наприклад, Primogel® і Explotab®), натрію кроскармелоза (тобто, поперечно-зшита карбоксиметилцелюлози натрієва сіль; наприклад, Ac-Di-Sol®), натрію крохмалю гліколят, крохмалі (наприклад, картопляний крохмаль, кукурудзяний крохмаль, рисовий крохмаль), прежелатинований крохмаль. Фахівцям у даній галузі буде зрозуміло, що для пресованих таблеток бажане здійснення дезінтеграцї в межах 30 хвилин, більш бажано в межах 15 хв., найбільше бажано в межах 5 хв.; тому використовуване дезінтегруючий засіб переважно приводить до дезінтеграцї таблетки в межах 30 хвилин, більш переважно в межах 15 хв., найбільше переважно в межах 5 хв. Наповнювачі/розріджувачі/сполучні можуть являти собою, наприклад, декстрини, мальтодекстрини (наприклад, Lodex® 5 і Lodex® 10), декстрозу, фруктозу, глюкозу, інозитол, еритритол, ізомальт, лактитол, лактозу (наприклад, лактозу, висушену розпиленням, -лактозу, -лактозу, Tabletose®, різні марки Pharmatose®, Microtose чи Fast-Floс®), мальтитол, мальтозу, манітол, сорбіт, сахарозу, тагатозу, трегалозу, ксиліт, гідроксипропілцелюлозу низькозаміщену (наприклад, LH 11, LH 20, LH 21, LH 22, LH ЗО, LH 31, LH 32 виробництва Shin-Etsu Chemical Co.), мікрокристалічну целюлозу (наприклад, різні марки Avicel®, такі як Avicel® PH101, Avicel® PH102 чи Avicel® PH105, Elcema® P100, Emcocel®, Vivacel®, Ming Tai® і Solka-Floc®), крохмалі або модифіковані крохмалі (наприклад, картопляний крохмаль, кукурудзяний крохмаль, рисовий крохмаль, прежелатинований крохмаль), полівінілпіролідон, сополімер полівінілпіролідону і вінілацетату, агар (наприклад, натрію альгінат), кальцію гідрофосфат, кальцію фосфат (наприклад, основний кальцію фосфат, кислий кальцію фосфат), кальцію сульфат, карбоксиакрилцелюлозу, декстрати, двохосновний кальцію фосфат, желатин, гумміарабік, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, магнію карбонат, магнію хлорид, метилцелюлозу, поліетиленгліколь, поліетиленоксид, полісахариди, наприклад, декстран, соєвий полісахарид, карбонат натрію, хлорид натрію, фосфат натрію. Речовинами, що сприяють ковзанню, і мастильними речовинами можуть бути стеаринова кислота, стеарати металів, тальк, воски і гліцериди з високими температурами плавлення, гідрогенізовані рослинні олії, колоїдна кремнезем, натрію стеарилфумарат, поліетиленгліколі й алкілсульфати. Придатні мастильні речовини включають тальк, стеарат магнію, стеарат кальцію, стеаринову кислоту, гідрогенізовані рослинні олії і т.п. Переважно, використовують стеарат магнію. 27 Поверхнево-активні речовини можуть бути неіонними (наприклад, полісорбат 20, полісорбат 21, полісорбат 40, полісорбат 60, полісорбат 61, полісорбат 65, полісорбат 80, полісорбат 81, полісорбат 85, полісорбат 120, сорбітана моноізостеарат, сорбітана монолаурат, сорбітана монопальмітат, сорбітана моностеарат, сорбітана моноолеат, сорбітана сесквіолеат, сорбітана триолеат, гліцерилмоноолеат і полівініловий спирт), аніонними (наприклад, натрію докусат і натрію лаурилсульфат) і катіонними (наприклад, бензалконію хлорид, бензетонію хлорид і цетавлон), включаючи їх суміші. Інші придатні фармацевтично прийнятні наповнювачі можуть включати барвники, ароматизатори і буфери. Також на композицію за винаходом може бути нанесене плівкове покриття, за умови, що таке покриття власне не сповільнює вивільнення активної лікарської речовини з композиції, а тільки сприяє проковтуванню, поліпшує зовнішній вигляд, стабільність або мінімізує проблеми розпилення. Плівкові покриття можуть складатися з гідроксипропілметилцелюлози (НРМС) (наприклад, НРМС Е5, НРМС Е15), гідроксиетилцелюлози, гідроксипропілцелюлози, полідекстрози і мальтодекстрина, Sepifilm™ і Sepifilm™ LP виробництва Seppic S.A., Pharmacoat® виробництва Shin-Etsu Chemical Co. Плівкові добавки можуть включати ацетильований моногліцерид, ацетилтрибутил, ацетилтрибутилцитрат, ацетилтриетилцитрат, бензилбензоат, кальцію стеарат, касторова олія, цетанол, хлорбутанол, колоїдний двоокис кремнію, дибутилфталат, дибутилсебацинат, діетилоксалат, діетилмалат, діетилмалеат, діетилмалонат, діетилфумарат, діетилфталат, діетилсебацинат, діетилсукцинат, диметилфталат, діоктилфталат, гліцерин, гліцеролтрибутират, гліцеролтриацетат, гліцерилбегенат, гліцерил моностеарат, гідрогенизовану рослинну олію, лецитин, лейцин, магнію силікат, магнію стеарат, поліетиленгліколь, пропіленгліколь, полісорбат, силікон, стеаринову кислоту, тальк, двоокис титана, триацетин, трибутилцитрат, триетилцитрат, цинку стеарат, віск. Визначення деяких термінів, використовуваних у даному описі Вислів "термін збереження" означає період часу, протягом якого терапевтично активні речовини в композиції стабільні при зовнішніх умовах, наприклад, 25°С і RH (відносної вологості) 60%, так що, щонайменше, 90%, переважно 95%, більш переважно 98% вихідної кількості згаданих речовин залишаються в композиції в межах зазначеного терміну збереження. Вислів "швидке вивільнення", "прискорене вивільнення" чи "посилене вивільнення" у даному контексті відносяться до композиції з модифікованим вивільненням, вивільнення з якої активної лікарської речовини, а потім його всмоктування відбуваються швидко. Зокрема, вислів "швидке вивільнення", "прискорене вивільнення" чи "посилене вивільнення" означають, що для композиції, що піддають описаному вище іспиту на розчинність, щонайменше, близько 50% ваг./ваг. активної 93353 28 речовини розчиняється протягом перших 20 хвилин іспиту. Вислів "складений" відноситься до вибору наповнювачів, носіїв, розріджувачів, розчинників, допоміжних розчинників, консервантів, барвників, ароматизаторів і т.д. для готування лікарського препарату з використанням згаданої композиції. Вислів "складений" також відноситься до вибору пристрою для доставки композиції або вибору ємності для застосування чи збереження композиції. У даному контексті вислів "фармацевтично прийнятний наповнювач" означає будь-яку речовину, інертну в тому сенсі, що воно власне не робить терапевтичного та/або профілактичного ефекту саме по собі. Фармацевтично прийнятний наповнювач може бути доданий до активної лікарської речовини для забезпечення можливості одержання фармацевтичного препарату, що володіє прийнятними технічними властивостями. Вислів "НПЗЗ" чи "нестероїдні протизапальні речовини" відносяться до групи лікарських засобів, що належать до нестероїдних протизапальних лікарських речовин, а також до їх фармацевтично прийнятних солей, проліків та/або комплексів і їх сумішей. Вислів "опіоїди" чи "опіоїдні речовини" тут відносяться до групи речовин, їх фармацевтично прийнятних солей, проліків та/або комплексів та їх сумішей, що використовуються для зниження помірного і сильного болю завдяки їх ефективності, легкості титрування і сприятливому співвідношенню ризику і користі. Опіоїди забезпечують анальгезуючий ефект за рахунок зв'язування зі специфічними рецепторами усередині ЦНС і за її межами. Вислів "триптани" чи триптанові речовини" тут відносяться до групи лікарських речовин, їх фармацевтично прийнятних солей, проліків та/або комплексів і їх сумішей, що діють у якості агоністів 5-гідрокситриптамінових (5-НТ) рецепторів. Триптани часто є дуже ефективними для полегшення мігрені, але не запобігають наступним приступам і не знижують їх частоти. Додаткові варіанти здійснення винаходу У першому аспекті фармацевтична композиція, одержувана способом, описаним вище, в одному з варіантів здійснення включає: - НПЗЗ; і - амінокислоту або її похідне. В іншому варіанті здійснення - активною лікарською речовиною є ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам, теноксикам, бромазепам, ібупрофен, толфенамова кислота чи дексибупрофен, чи фармацевтично прийнятна сіль або проліки такої речовини; - лужною речовиною є гістидин, лізин чи аргінін. У наступному варіанті здійснення - активною лікарською речовиною є лорноксикам чи його фармацевтично прийнятна сіль або проліки; - лужною речовиною є гістидин, лізин чи аргінін. У наступному варіанті здійснення 29 93353 - активною лікарською речовиною є лорноксикам; - лужною речовиною є гістидин, лізин чи аргінін. У наступному аспекті Фармацевтична композиція для перорального застосування включає: - НПЗЗ чи його фармацевтично прийнятну сіль або проліки; - одне чи декілька лужних речовин, що представляють собою сіль, що містить аніон, вибраний з СО32-, НРО42- РО43- і катіон, вибраний з Na+ і К+; і сполучне у формі гідрофільного полімеру. У наступному аспекті Фармацевтична композиція для перорального застосування включає: - НПЗЗ чи його фармацевтично прийнятну сіль або проліки; - одну чи декілька амінокислот або їх похідні. В одному з варіантів здійснення даного аспекту амінокислота являє собою гістидин, лізин чи аргінін. В одному з варіантів здійснення обох останніх аспектів НПЗЗ являє собою ампіроксикам, дроксикам, лорноксикам, мелоксикам, піроксикам, теноксикам, ібупрофен чи дексибупрофен, або фармацевтично прийнятну сіль або проліки такої речовини. 30 В одному з варіантів здійснення обох останніх аспектів НПЗЗ являє собою лорноксикам чи його фармацевтично прийнятну сіль або проліки. В одному з варіантів здійснення обох останніх аспектів НПЗЗ являє собою лорноксикам. В одному з варіантів здійснення обох останніх аспектів композиція має характеристики розчинення in vitro при іспитах методом, що використовує 0,1 N розчин НСl рівноважний при 37°С в якості середовища для розчинення і лопатевий апарат для розчинення Фармакопеї США при швидкості перемішування 50 об/хв в якості устаткування, що відрізняються тим, що, щонайменше, 50% ваг./ваг. активної речовини присутнє в середовищі для розчинення в розчиненій формі через 20 хвилин після початку іспиту на розчинність. Приклади Наступні приклади наведені лише для ілюстрації даного винаходу і не є обмежувальними. Приклад 1: Розчинення отриманої дисперсної речовини і пероральної лікарської форми Спосіб розчинення для іспиту вивільнення лорноксикама з таблетки Спосіб розчинення Наступний спосіб розчинення призначений для імітації умов, що існують у шлунку: Апарат: апарат для розчинення 2 Фармакопеї США, оснащений лопатями (як зазначене в USP 27 ) Фільтри: скловолоконні фільтри Whatman GF/F Середовище для розчинен- 1300 мл 0,1 N НСl з додаванням 2 г/л хлориду ня: натрію (приклади 2 і 3) чи 1300 мл 0,07 N НСl з додаванням 2 г/л хлориду натрію (приклади 4 -11) Швидкість перемішування: 50 об/хв (приклади 2 і 3) чи 150 об/хв (приклади 4-11). Температура: 37°С±0,5°С Добір зразків: Зразки відбирають кожні 5 хвилин протягом, щонайменше, 60 хвилин. Кількісна оцінка: Концентрацію лорноксикама визначають у кожному зразку з використанням спектрофотометра UV/Vis (що працює в діапазоні УФ і видимого світла), оснащеного 10-мм кюветою, при довжині хвилі виміру 378 нм. % E1cm :-587.0 1 Кожен зразок випробували в трьох екземплярах, n=3. Приклад 2: Ефект спільного розмелу лорноксикама і тринатрійфосфата на розчинення лорноксикама в кислому розчині. У даному прикладі спільний розмел здійснювали за допомогою кульового млина зі сферами, що горизонтально рухаються. Інгредієнти: 1. Лорноксикам 8 мг/таблетку 2. Тринатрійфосфат (Nа3РО4) 78 мг/таблетку 3. Целюлоза мікрокристалічна 96 мг/таблетку 4. Кальцію моногідрофосфат, 110,4 безводний мг/таблетку 5. Гідроксипропілцелюлоза низькозаміщена 48 мг/таблетку 6. Сполучне (а чи b) 16 мг/таблетку a) Гідроксипропілцелюлоза (HPC-L-fine) b) Вінілпіролідон-вінілацетат 7. Кальцію стеарат 1,6 мг/таблетку Загальна вага серцевини: 358 мг Вага партії: близько 750 г Кількості лорноксикама і тринатрійфосфата знаходилися в молярному співвідношенні 1:20. Лорноксикам (1) і тринатрійфосфат (2) піддали спільному розмелу протягом 5 хвилин з використанням пристрою Fritsch Pulverisette (тип 06.002.00; кульовий млин зі сферами, що горизонтально рухаються). До спільно розмеленої суміші 1 і 2 додали інші інгредієнти (3), (4), (5), (6) і (7) з використанням барабанного змішувача Erweka при 25 об/хв протягом 5 хв. Отриману суміш ("суміш інгредієнтів 1-7") пресували в таблетки з використанням таблетмашини 31 93353 Korsch 106 і 10,0-мм круглих стандартних увігнутих пуансонів. 32 Іспити на розчинність методом, описаним у Прикладі 1, проводили на "суміші інгредієнтів 1-7", а також на отриманих таблетках. Таблиця 2 Результати розчинення для "суміші інгредієнтів 1-7" і відповідних таблеток Тип сполучного НРС Тип продукту Порошкова суміш "суміш інгредієнтів 1-7" Таблетка Порошкова суміш "суміш інгредієнтів 1-7" Таблетка VA64 % (ваг./ваг.) розчиненого % (ваг./ваг.) розчиненого лорноксикама через 20 хв. лорноксикама через 20 хв. (n=3); скоректовані значен(n=3)* ня 81 51 96 77 88 54 92 82 * На пізнішій стадії розробки дана методика розчинення виявилася такою, що дезорієнтує, показуючи занадто високі значення. Скоректовані значення наведені в останньому стовпчику. З табл. 2 видно, що швидке розчинення лорноксикама в кислому розчині досягається при використанні спільного розмелу лорноксикама і тринатрійфосфата, тому що більше 50% лорноксикама розчиняється з "суміші інгредієнтів 1-7" через 20 хвилин після початку іспиту на розчинність. Крім того, можна зробити висновок, що спосіб пресування "суміші інгредієнтів 1-7" у таблетки додатково збільшує розчинення лорноксикама через 20 хвилин після початку іспиту на розчинність. Згідно нашої теорії, це обумовлено процесом стиску, що може підсилювати контакт між лорноксикамом і тринатрійфосфатом. Приклад 3: Ефект спільного розмелу лорноксикама і карбонату натрію на розчинення лорноксикама в кислому розчині. У даному прикладі спільний розмел здійснювали за допомогою кульового млина зі сферами, що горизонтально рухаються. Інгредієнти: 1. Лорноксикам 8 мг/таблетку 2. Натрію карбонату декагідрат 136,2 (Na2CO3,10 H2O)) мг/таблетку 3. Целюлоза мікрокристалічна 96 мг/таблетку 4. Кальцію моногідрофосфат, 110,4 безводний мг/таблетку 5. Гідроксипропілцелюлоза низькозаміщена 48 мг/таблетку 6. Сполучне (а чи b) 16 мг/таблетку a. Гідроксипропілцелюлоза (HPC-L-fine) b. Вінілпіролідон-вінілацетат 7. Кальцію стеарат 1,6 мг/таблетку Загальна вага серцевини: 416,2 мг Вага партії: близько 750 г Кількості лорноксикама і натрію карбонату декагідрата знаходяться в молярному співвідношенні 1:20. "Суміш інгредієнтів 1-7" і відповідні таблетки одержували, як описано в прикладі 2, а іспити на розчинність проводили відповідно до прикладу 1. Були отримані наступні результати розчинення: Таблиця 3 Результати розчинення для "суміші інгредієнтів 1-7" і відповідних таблеток Тип сполучного НРС VA64 Тип продукту Порошкова суміш "суміш інгредієнтів 1-7" Таблетка Порошкова суміш "суміш інгредієнтів 1-7" Таблетка % (ваг./ваг.) розчиненого лорноксикама через 20 хв. (n=3)* % (ваг./ваг.) розчиненого лорноксикама через 20 хв. (n=3); Скоректовані значення 83 49 89 68 75 51 91 73 * На більш пізній стадії розробки дана методика розчинення виявилася такою, що дезорієнтує, показуючи занадто високі значення. Скоректовані значення наведені в останньому стовпчику. 33 93353 Результати погоджуються з результатами, отриманими в прикладі 2; це показує, що швидке розчинення в кислому розчині також досягається шляхом спільного розмелу лорноксикама і карбонату натрію. Приклад 4: Ефект спільного розмелу лорноксикама й аргініну на розчинення лорноксикама в кислому розчині. У даному прикладі спільний розмел здійснювали за допомогою кульового млина зі сферами, що горизонтально рухаються. Інгредієнти: № 1 2 3 4 5 6 % (ваг./ваг.) Лорноксикам 2,0 Аргінін 18,7 Целюлоза мікрокристалічна, тип 102 20,8 Кальцію моногідрофосфата дигід47,8 рат, СаНРО4, 2Н2О Гідроксипропілцелюлоза низькоза10,4 міщена Кальцію стеарат 0,3 Вага таблетки (мг) 313 Розмір часток лужної речовини D(v; 187 мкм 0.5) (мкм) Інгредієнти № Інгредієнти 1 2 2 2 2 Лорноксикам Карбонат натрію, Na2CO3 Тринатрійфосфат, Na3PO4 Аргінін Лізин Целюлоза мікрокристалічна, тип 102 Кальцію моногідрофосфат, дигідрат СаНРО4, 2Н2О Гідроксипропілцелюлоза низькозаміщена Кальцію стеарат Вага таблетки (мг) Середній розмір часток лужної речовини D(v; 0.5) (мкм) 3 4 5 6 34 Кількості лорноксикама й аргініну знаходяться в молярному співвідношенні 1:20. Таблетки виготовляли як описані в прикладі 2, а іспити на розчинність проводили відповідно до прикладу 1. Таблиця 4 Розчинення отриманих таблеток Тип лужної речовини Аргінін % (ваг./ваг.) розчиненого лорноксикама через 20 хвилин 78,0 З табл. 4 видно, що, у порівнянні з прикладом 9 (традиційний спосіб без етапу мокрої грануляції), шляхом спільного розмелу лорноксикама й аргініну за допомогою кульового млина зі сферами, що горизонтально рухаються, може бути досягнуте істотне збільшення кількості лікарської речовини, що розчиняється за 20 хв. Приклад 5: Ефект механічної гомогенізації як спосіб спільного розмелу на розчинення лорноксикама в кислому розчині. Інгредієнти: Партія Партія Партія Партія Партія 17030531 % 17030532 % 17030534 % 17030537 % 17030538 % (ваг./ваг.) (ваг./ваг.) (ваг./ваг.) (ваг./ваг.) (ваг./ваг.) 1,7 1,7 2,8 2,6 2,3 17,9 19,0 19,0 18,1 18,4 20,8 20,8 20,8 20,8 20,8 47,8 47,8 47,8 47,8 47,8 10,4 10,4 10,4 10,4 10,4 0,3 314 0,3 306 0,3 278 0,3 298 0,3 244 203 40 48 68 46 Кількості лорноксикама і лужної речовини знаходяться в молярному співвідношенні близько 1:20. Перед механічною гомогенізацією лужну речовину (2) розмелювали в млині зі спіральним струменем Alpine® AS виробництва Hosokawa Alpine. Отриманий середній розмір часток зазначений у таблиці вище. Спільний розмел лужної речовини (2) і лорноксикама (1) здійснювали за допомогою пристрою механічної гомогенізації AMS-LAB виробництва Hosokawa Alpine. Були використані наступні технологічні параметри: Час: 3-30 хв. Оберти ротора: 1300-1500 Температура: 20-45°С Додали інші інгредієнти (3) - (6) і потім пресували таблетки діаметром 10 мм. Іспити на розчинність проводили відповідно до прикладу 1. 35 93353 36 Таблиця 5 Результати розчинення отриманих таблеток Тип лужної речовини № партії % (ваг./ваг.) розчиненого лорноксикама через 20 хвилин Середній розмір часток D(v;0.5) (мкм) 57,0 203 67,2 40 Тринатрійфосфат, 17030531 Na3PO4 Тринатрійфосфат, 17030532 Na3PO4 Карбонат натрію, 17030534 Na2CO3 Аргінін 17030537 Лізин 17030538 63,2 62,3 80,1 З табл. 5 видно, що спільний розмел шляхом механічної гомогенізації лорноксикама і лужної речовини лізина забезпечує суттєве збільшення кількості лікарської речовини, розчиненої за 20 хвилин, в порівнянні з прикладом 9 (традиційний спосіб без етапу мокрої грануляції). При використанні аргініна, тринатрійфосфата або карбоната натрію позитивний вплив на розчинення також помітний. Крім того, ці результати показують, що при використанні механічної гомогенізації малий середній розмір часток лужної речовини має позитивний вплив на розчинення. Це підтверджується № Інгредієнти Лорноксикам Тринатрійфосфат Na3PO4 Лізин Целюлоза мікрокристалічна, тип 102 Кальцію моногідрофосфат, дигідрат 4 СаНРО4, 2Н2О Гідроксипропілцелюлоза низькозамі5 щена 6 Кальцію стеарат Вага таблетки (мг) Середній розмір часток лужної речовини, D(v; 0.5) (мкм) 1 2 2 3 результатами, отриманими для спільно розмелених сумішей, що містять тринатрійфосфат, серед яких та партія, яка мала менший середній розмір часток лужної речовини, показала більш швидке розчинення, ніж партія з відносно більшим середнім розміром часток. Приклад 6: Ефект ущільнення у валках в якості способу спільного розмелу на розчинення лорноксикама в кислому розчині. Інгредієнти: Партія Партія Партія Партія Партія 13050534 13050535 13050543 13060531 13060534 % (ваг./ваг.) % (ваг./ваг.) % (ваг./ваг.) % (ваг./ваг.) % (ваг./ваг.) 1,7 1,7 2,3 2,3 2,3 19,0 19,0 18,4 18,4 18,4 20,8 20,8 20,8 20,8 20,8 47,8 47,8 47,8 47,8 47,8 10,4 10,4 10,4 10,4 10,4 0,3 336 0,3 318 0,3 261 0,3 314 0,3 324 24 мкм 203 мкм 158 мкм 26 мкм 158 мкм Кількості лорноксикама і лужної речовини знаходяться в молярному співвідношенні близько 1:20. Перед стиском на валках лужна речовина (2), використовуване в партіях 13050534 і 13060531, розмелювали з використанням пристрою Fritz Pulverisette (тип 14.702). Отриманий середній розмір часток показаний у таблиці вище. Ущільнення у валках лужної речовини (2) і лорноксикама (1) проводили з використанням пристрою Minipactor® виробництва Gerteis Maschinen + Processengineering AG. Були використані наступні технологічні параметри: Зусилля стиску: 8- 12 кН/см Об/хв: 2 Номер сита: 1,0-1,5 мм Зазор: 2,5 мм Додали інші інгредієнти (3) - (6) і пресували таблетки діаметром 10 мм. Іспити на розчинність проводили відповідно до прикладу 1. Таблиця 6 Розчинення отриманих таблеток Тип лужної речовини Тринатрійфосфат Na3PO4 Тринатрійфосфат Na3PO4 Лізин Лізин Лізин 13050534 % (ваг./ваг.) розчиненого лорноксикама через 20 хвилин 59,2 13050535 57,6 13050543 13060531 13060534 89,5 79,3 82,3 № партії 37 93353 З табл. 6 видно, що спільний розмел шляхом ущільнення у валках з використанням лізина в якості лужної речовини приводить до істотного збільшення кількості лікарської речовини, що розчиняється за 20 хв. у порівнянні з результатами прикладу 9 (традиційний спосіб без етапу мокрої грануляції). При використанні тринатрійфосфата в якості лужної речовини позитивний вплив на розчинення також помітно. Різниця в середньому ро 38 змірі часток лужної речовини не зробила істотного впливу на розчинення при використанні ущільнення у валках як спосіб спільного розмелу. Приклад 7: Ефект на розчинення лорноксикама з таблетки, для одержання якої лужна речовина була мікронізована перед простим змішуванням з наступним пресуванням суміші в таблетку. Інгредієнти № Інгредієнти 1 2 3 4 5 6 Лорноксикам Лізин Целюлоза мікрокристалічна, тип 102 Кальцію моногідрофосфат, дигідрат, СаНРО4, 2Н2О Гідроксипропілцелюлоза низькозаміщена Кальцію стеарат Вага таблетки (мг) Середній розмір часток лужної речовини D(v; 0.5) (мкм) Кількості лорноксикама і лужної речовини знаходяться в молярному співвідношенні близько 1:20 для партії 02060531 і близько 1:40 для партії 02060532. Лужну речовину (2) мікронізували з використанням млина зі спіральним струменем Alpine® AS виробництва Hosokawa Alpine. Лужну речовину (2) і лорноксикам (1) змішували в змішувачі (із пропелерними лопатями знизу). Потім за допомогою барабанного змішувача в суміш додали інші інгредієнти (3) - (6) і пресували таблетки діаметром 10 мм. Іспити на розчинність проводили відповідно до прикладу 1. Таблиця 7 Результати розчинення отриманих таблеток Тип лужної № партії речовини № 1 2 3 3 4 4 5 5 6 % (ваг./ваг.) розчиненого лорноксикама через 20 хвилин Партія 02060531 % (ваг./ваг.) 2,3 18,4 20,8 47,8 10,4 0,3 300 5,0 Лізин Лізин 02060531 02060532 Партія 02060532 % (ваг./ваг.) 1,2 19,5 20,8 47,8 10,4 0,3 429 5,0 82,0 82,9 З табл. 7 видно, що змішування мікронізованого лізина і лорноксикама приводить до істотного збільшення кількості лорноксикама, що розчиняється за 20 хв., у порівнянні з прикладом 9 (традиційний спосіб без етапу мокрої грануляції). Збільшення молярної кількості лізина, зміна співвідношення між лорноксикамом і лізинім з 1:20 до 1:40 не має істотного впливу на розчинення. Приклад 8: Ефект на розчинення лорноксикама з таблеток, для одержання яких лужну речовину піддали розмелу перед пресуванням суміші інгредієнтів у таблетки. Розчинення проводили в кислому розчині. Інгредієнти Інгредієнти Лорноксикам Тринатрійфосфат, висушений*, Na3PO4 Целюлоза мікрокристалічна, тип 102 Целюлоза мікрокристалічна, тип 101 Кальцію моногідрофосфата дигідрат СаНРО4, 2Н2О Кальцію моногідрофосфат безводний СаНРО4 Гідроксипропілцелюлоза низькозаміщена Гідроксипропілцелюлоза Кальцію стеарат Вага таблетки (мг) Середній розмір часток лужної речовини D(v;0.5) (мкм) *): Na3PO4, 12Н2О висушили до вологовмісту менше ~2% (ваг./ваг.). Розмелена суміш % (ваг./ваг.) 1,7 19,0 20,8 47,8 10,4 0,3 311 79 39 93353 Кількості лорноксикама і лужної речовини знаходяться в молярному співвідношенні близько 1:20. Висушений тринатрійфосфат (2) розмелювали з використанням пристрою Fritsch Pulverisette (тип 06.002.00; кульовий млин зі сферами, що горизонтально рухаються) і змішували з лорноксикамом (1) вручну. Потім додали інші наповнювачі (3) - (6) у барабанному змішувачі. Із суміші інгредієнтів (1) - (6) пресували таблетки діаметром 10 мм. Іспити на розчинність проводили відповідно до прикладу 1. Таблиця 8 Результати розчинення отриманих таблеток Лужна речовина % (ваг./ваг.) розчиненого лорноксикама через 20 хвилин Тринатрійфосфат, висушений* Na3PO4 53,1 *): Na3PO4, 12H2O висушили до вологовмісту менше ~2% (ваг./ваг.). З табл. 8 видно, що попередній розмел лужної речовини, тринатрійфосфата, перед пресуванням суміші інгредієнтів у таблетки збільшує кількість лорноксикама, що розчиняється за 20 хвилин, у порівнянні з прикладом 9. Приклад 9: Ефект виключення мокрої грануляції зі способу виробництва, звичайно здійснюваного відповідно до ЕР 1109534. Інгредієнти № 1 2 3 4 5 5 6 % (ваг./ваг.) Лорноксикам 2,5 Натрію бікарбонат NaHCO3 12,5 Целюлоза мікрокристалічна, тип 101 30,0 Кальцію моногідрофосфат, безвод34,5 ний СаНРО4 Гідроксипропілцелюлоза низькоза15,0 міщена Гідроксипропілцелюлоза 5,0 Кальцію стеарат 0,5 Інгредієнти 40 Вага таблетки (мг) 320 Кількості лорноксикама і лужної речовини знаходяться в молярному співвідношенні близько 1:20. Інгредієнти (2) - (5) змішували за допомогою змішувача Diosna з великим зусиллям зрушення. Потім додали лорноксикам (1) за всіма правилами з використанням планетарного змішувача. Нарешті, додали кальцію стеарат (6) за допомогою змішувача з великим зусиллям зрушення. Таблетки пресували на устаткуванні для одержання 10-мм круглих стандартних опуклих таблеток. Іспити на розчинність проводили відповідно до прикладу 1 Таблиця 9 Результати розчинення отриманих таблеток Лужна речо- % (ваг./ваг.) розчиненого лорноксивина кама через 20 хвилин Натрію бікарбонат, 31,3 NaHCO3 З табл. 9 видно, що результат розчинення таблеток, при одержанні яких був виключений етап мокрої грануляції, складає менше 50%. Це явно незадовільний результат. Приклад 10: Вплив спільного розмелу лорноксикама і лужної речовини на хімічну стабільність лорноксикама. Спільний розмел здійснювали за допомогою кульового млина зі сферами, що горизонтально рухаються. Для порівняння хімічної стабільності композицій, отриманих за винаходом, з композиціями, отриманими шляхом мокрої грануляції, виготовили наступні партії: Таблетки за винаходом, партії №№ 17110431 і 17110432. Таблетки, виготовлені за винаходом, що містять спільно розмелені лужну речовину і лорноксикам, виготовляли відповідно до прикладів 2 і 3 з варіаціями, описаними в таблиці нижче: Інгредієнти: 41 № Інгредієнти 1 Лорноксикам 2 Натрію бікарбонат NaHCO3 Натрію карбонат, висушений * 2 Na2CO3 Тринатрійфосфат, висушений ** 2 Na3PO4 3 Целюлоза мікрокристалічна, тип 101 3 Целюлоза мікрокристалічна, тип 102 Кальцію моногідрофосфат, безвод4 ний СаНРО4 Кальцію моногідрофосфата дигідрат 4 СаНРО4, 2Н2О Гідроксипропілцелюлоза низькозамі5 щена 5 Гідроксипропілцелюлоза 6 Кальцію стеарат Вага таблетки (мг) 93353 42 Мокра грануляція, партія 10225671 % (ваг./ваг.) 2,5 12,5 Спільний розмел, партія 17110431 % (ваг./ваг.) 2,4 Спільний розмел, партія 17110432 % (ваг./ваг.) 1,7 15,6 19,0 30,0 21,5 20,7 49,4 47,8 15,0 10,7 10,4 5,0 0,5 320 0,4 329 0,4 351 34,5 *): Na2CO3, 10Н2О висушили до вологовмісту менше -2% (ваг./ваг.). **): Na3PO4, 12H2O висушили до вологовмісту менше -2% (ваг./ваг.) Кількості лорноксикама і лужної речовини знаходяться в молярному співвідношенні близько 1:20. Спільний розмел лорноксикама (1) з лужною речовиною (2) проводили протягом 10 хв. за допомогою пристрою Fritsch Pulverisette (тип 06.002.00; кульовий млин зі сферами, що горизонтально рухаються). Додали інші інгредієнти (3) (6), перераховані вище, і пресували таблетки діаметром 10 мм із використанням стандартних увігнутих пуансонів. Із суміші інгредієнтів (1) - (6) пресували таблетки діаметром 10 мм із використанням пуансонів для стандартних круглих опуклих таблеток. Таблетки, отримані з використанням мокрої грануляції, партія № 10225671 Таблетки виготовляли відповідно до ЕР 1109534: матеріал, отриманий мокрою грануляцією, пресували з використанням 9,5-мм круглих стандартних увігнутих пуансонів. Крім того, на таблетки, отримані з використанням мокрої грануляції, нанесли покриття способом, також описаним у ЕР 1109534. Аналіз стабільності Аналіз стабільності проводили на наступних партіях: Партія № 10225671, Xefo Rapid, мокра грануляція Партія № 17110431, спільний розмел Партія № 17110432, спільний розмел Спільно розмелені партії порівнювали з партією, отриманою мокрою грануляцією. Як індикаторний параметр стабільності вибрали продукт розкладання лорноксикама HN-10004. Усі три партії упакували і зберігали в пакетах із двостороннім алюмінієвим покриттям. Умови збереження: 25°С/ RH 60% протягом 6 місяців 30°С/ RH 65% протягом 6 місяців 40°С/ RH 75% протягом 6 місяців Висновок При всіх контрольних вимірах кількість HN10004 у партіях №№ 17110431 і 17110432 (спільний розмел) було нижче, ніж у партії № 10225671 (мокра грануляція). У початковий момент іспиту виміряний вологовміст таблеток знаходився на одному рівні. При всіх контрольних вимірах стабільність обох спільно розмелених партій значною мірою перевершувала стабільність партії, отриманої мокрою грануляцією, незважаючи на той факт, що ця остання партія мала більш низький вологовміст. На підставі результатів аналізу стабільності можна укласти, що використання спільного розмелу забезпечує одержання композиції з істотно уповільненим утворенням ключових продуктів розкладання. Результати У початковий момент іспиту вологовміст таблеток визначали на підставі втрат при сушінні (ППС) (30 хв., 70°С). Результати представлені в Табл. 10 нижче: Таблиця 10 Вологовміст отриманих таблеток Партия № 10225671 17110431 17110432 Вологовміст (ППС) % (ваг./ваг.) 1,2 1,5 1,6 43 93353 44 25°С/ RH 60% Час зберіПартія № 10225671 HN-10004 в Партія №17110431 HN-10004B Партія №17110432 HN-10004B гання % (ваг./ваг.) від ваги лорнокси- % (ваг./ваг.) від ваги лорнокси- % (ваг./ваг.) від ваги лорнокси(місяців) кама кама кама 0 0,073 0,012 0,010 1,5 0,11 0,012 0,032 3 0,13 0,024 0,013 4,5 0,15 0,033 0,030 6 0,17 0,036 0,035 Час зберігання (місяців) 0 1,5 3 4,5 6 Партія № 10225671 HN-10004B % (ваг./ваг.) від ваги лорноксикама 0,073 0,047 0,17 0,18 0,22 30°С/ RH 65% Партія №17110431 HN-10004 в Партія №17110432 % (ваг./ваг.) від ваги лорнокси- HN-10004 в % (ваг./ваг.) від ваги кама лорноксикама 0,012 0,010 0,015 0,014 0,037 0,024 0,047 0,044 0,051 0,053 40°С/ RH 75% Час зберіПартія № 10225671 HN-10004 в Партія №17110431 HN-10004B Партія №17110432 HN-10004B гання % (ваг./ваг.) від ваги лорнокси- % (ваг./ваг.) від ваги лорнокси- % (ваг./ваг.) від ваги лорнокси(місяців) кама кама кама 0 0,073 0,012 0,010 3 0,22 0,072 0,090 6 0,22 0,12 0,11 Метод аналізу (ВЕРХ (високоефективна рідинна хроматографія)): Нерухома фаза: стовпчик ODS, 5 мкм, 100 х 2,1 мм. Температура стовпчика: 35°С Рухлива фаза: Розчинник А: Розчинити 50,0г амонію ацетату в 5000,0мл Milli-Q-water і додати 8,0мл тетрабутиламонію гідроксида (1,5 М у воді) і 22,0 мл метанолу. Розчинник В: Додати 1,00 мл октиламіна до 1000,00 мл ацетонітрила. Градієнт: Час (хв.) 0 32 36 41 50 Швидкість (мл/хв.) 0,5 0,5 0,5 0,5 0,5 Температура автоматичного пробозабірника: 20°С Об'єм, що вводиться: 20 мкл Виявлення: при 280 нм Час прогону: 50 хвилин Відносний час утримання для HN-10004, розраховане стосовно основного піка, складає близько 0,77, а відносний фактор відгуку складає 0,8. Розчинник А % 97 70 70 97 97 Розчинник В % 3 30 30 3 3 Приклад 11: Ефект спільного розмелу на розчинення лорноксикама. У даному прикладі спільний розмел здійснювали за допомогою кульового млина зі сферами, що вертикально рухаються. Інгредієнти 45 № 93353 Інгредієнти 1 Лорноксикам Тринатрійфосфат, висушений *)2 Na3PO4 2 Лізин 3 Целюлоза мікрокристалічна, тип 102 Кальцію моногідрофосфата дигідрат 4 СаНРО4, 2Н2О Гідроксипропілцеллюлоза низько5 заміщена 6 Кальцію стеарат Вага таблетки (мг) Середній розмір часток лужної речовини D(v;0.5) (мкм) 46 Партія 07020533 Партія 07020534 Партія 19040531 Партія 03050532 % (ваг./ваг.) % (ваг./ваг.) % (ваг./ваг.) % (ваг./ваг.) 2,3 1/7 1,2 1,2 19,0 18,4 20,8 20,8 19,5 20,8 19,5 20,8 47,8 47,8 47,8 47,8 10,4 10,4 10,4 10,4 0,3 238 0,3 318 0,3 277 0,3 420 158 26 158 *): Na3PO4, 12Н2О висушили до вологовмісту менше - 2% (ваг./ваг.) Кількості лорноксикама і лужної речовини знаходяться в молярному співвідношенні близько 1:20 для партій 07020533, 07020534 і близько 1:40 для партій 19040531 і 03050532. Лорноксикам (1) і лізин (2) піддали спільному розмелу з використанням кульового млина Struers протягом 4 - 10 годин і 250 - 400 об/хв. з наступним просіванням крізь сито з коміркою 700 мкм. Потім додали інші наповнювачі (3) -(6) і пресували таблетки з використанням устаткування для одержання 10-мм круглих стандартних опуклих таблеток. Іспити на розчинність проводили відповідно до прикладу 1. Таблиця 11 Результати розчинення отриманих таблеток Лужна речовина № 1 2 3 3 3 3 3 3 4 5 6 7 8 % (ваг./ваг.) розчиПартія № неного лорноксикама через 20 хв. Лізин Тринатрійфосфат Лізин Лізин 07020533 07020534 19040531 03050532 80,8 66,2 85,6 82,7 З табл. 11 видно, що використання кульового млина зі сферами, що вертикально рухаються, забезпечує істотне підвищення кількості лорноксикама, що розчиняється за 20 хв., у порівнянні з прикладом 9 (традиційний спосіб без етапу мокрої грануляції). Збільшення молярного співвідношення між лорноксикамом і лізинім з 1:20 до 1:40 не має істотного впливу на розчинення. Приклад 12: Приклади композицій, що виготовляються шляхом спільного розмелу на валковому пресі лорноксикама, лужної речовини і деяких інших наповнювачів з наступним додаванням інших наповнювачів і пресуванням у таблетки. Інгредієнти % % % % % % (ваг./ваг." (ваг./ваг.) (ваг./ваг.) (ваг./ваг.) (ваг./ваг.) (ваг./ваг.) Лорноксикам 1-3 1-3 1-3 1-3 1-3 1-3 Лізин 9-20 9-20 9-20 9-20 9-20 9-20 Молярне співвідношення, лорнокси1:10 1:10 1:10 1:10 1:101:10-1:40 кам: лізин 1:40 1:40 1:40 1:40 1:40 Кальцію моногідрофосфат безводний 10-50 СаНРО3 Тринатрійфосфат Na3PO4 10-50 Кальцію карбонат СаСО3 10-50 Алюмосилікат магнію 10-50 Магнію оксид 10-50 Кальцію сульфата дигідрат CaSO4, 10-50 2Н2О Сорбіт 5-15 Тальк 0-10 0-10 0-10 0-10 0-10 0-10 Целюлоза мікрокристалічна, тип 102 15-25 15-25 15-25 15-25 15-25 15-25 Гідроксипропілцелюлоза низькозамі5-15 5-15 5-15 5-15 5-15 5-15 щена Кальцію стеарат 0,2-1,0 0,2-1,0 0,2-1,0 0,2-1,0 0,2-1,0 0,2-1,0 Інгредієнти 47 93353 Інгредієнти (1) - (2) піддають попередньому змішуванню, просівають і перемішують. Середній розмір часток (2) знаходиться в діапазоні D(v; 0.5) від 5 мкм до 160 мкм. Після цього додають інгредієнт (5), а потім інгредієнти (3) і (4). Цю суміш піддають спільному розмелу з використанням устаткування на зразок валкового преса, кульового млина (зі сферами, що рухаються горизонтально і вертикально) чи змішувача. Потім до суміші інгредієнтів (1) -(5) додають інші інгредієнти (6) - (8) шляхом домішування. Отриману суміш інгредієнтів (1) - (8) пресують у таблетки. Комп’ютерна верстка В. Мацело 48 Кількості інгредієнтів регулюють таким чином, щоб кожна композиція містила 4-12 мг лорноксикама, а молярне співвідношення лорноксикама і лужної речовини знаходилося в діапазоні від 1:10 до 1:40, і щоб загальна кількість інгредієнтів не перевищувала 100%. Таблетки діаметром 10 мм пресують з використанням круглих стандартних увігнутих пуансонів. Потім на таблетки може бути нанесене покриття для одержання кольорових чи білих або вологостійких таблеток, як описано в ЕР 1109534. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюManufacturing of quick release pharmaceutical compositions of water insoluble drugs and pharmaceutical compositions prepared by the process of the invention
Автори англійськоюBertelsen Poul
Назва патенту російськоюПроизводство фармацевтических композиций c быстрым высвобождением ha ochobe водонерастворимых лекарсвенных средств и фармацевтические композиции, полученные способом согласно изобретению
Автори російськоюБертелсен Поул
МПК / Мітки
МПК: A61K 31/5415, A61K 31/542, A61K 9/22
Мітки: засобів, лікарських, швидким, отримані, винаходом, способом, фармацевтичних, композиції, композицій, фармацевтичні, водонерозчинних, виробництво, вивільненням, основі
Код посилання
<a href="https://ua.patents.su/24-93353-virobnictvo-farmacevtichnikh-kompozicijj-zi-shvidkim-vivilnennyam-na-osnovi-vodonerozchinnikh-likarskikh-zasobiv-i-farmacevtichni-kompozici-otrimani-sposobom-za-vinakhodom.html" target="_blank" rel="follow" title="База патентів України">Виробництво фармацевтичних композицій зі швидким вивільненням на основі водонерозчинних лікарських засобів і фармацевтичні композиції, отримані способом за винаходом</a>
Попередній патент: Похідні заміщеного індолілалкіламіно як інгібітори гістондеацетилази
Наступний патент: Місцевий противірусний препарат
Випадковий патент: Термітний склад для паяння та зварювання