Похідні заміщеного індолілалкіламіно як інгібітори гістондеацетилази
Номер патенту: 93352
Опубліковано: 10.02.2011
Автори: Артс Жанін, Тен Хольте Петер, ван Емелен Крістоф, Вердонк Марк Густааф Селін, Анжибо Патрік Рене, Пілатт Ізабель Ноель Констанс, Рю Бруно
Формула / Реферат
1. Сполука формули (І)
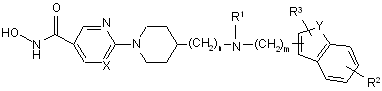 , (I)
, (I)
її N-оксидні форми, фармацевтично прийнятні адитивні солі і їх стереохімічно ізомерні форми, де
кожний n означає ціле число зі значенням 0, 1 або 2; і, коли n дорівнює 0, тоді мається на увазі прямий зв'язок;
кожний m означає ціле число зі значенням 1 або 2;
кожний X незалежно являє собою N або СН;
кожний Y незалежно являє собою О, S, або NR4; де
кожний R4 являє собою водень, С1-6алкіл, С1-6алкілоксіС1-6алкіл, С3-6циклоалкіл, С3-6циклоалкілметил, феніл С1-6алкіл, -C(=O)-CHR5R6 або -S(=O)2-N(CH3)2;
де кожний з R5 і R6 незалежно являє собою водень, аміно, С1-6алкіл або аміноС1-6алкіл; і
коли Y являє собою NR4 і R2 знаходиться в 7-положенні індолілу, тоді R2 і R4 разом можуть утворювати двовалентний радикал
-(СН2)2-
(а-1) або
-(СН2)3-
(а-2);
R1 являє собою водень, С1-6алкіл, гідроксіС1-6алкіл, С1-6алкілсульфоніл, С1-6алкілкарбоніл або моно- чи ді(С1-6алкіл)аміносульфоніл;
R2 являє собою водень, гідрокси, аміно, галоген, С1-6алкіл, ціано, С2-6алкеніл, полігалогенС1-6алкіл, нітро, феніл, С1-6алкілкарбоніл, гідроксикарбоніл, С1-6алкілкарбоніламіно, С1-6алкілокси, або моно- чи ді(С1-6алкіл)аміно;
R3 являє собою водень, С1-6алкіл або С1-6алкілокси; і
коли R2 і R3 знаходяться на сусідніх атомах вуглецю, вони можуть утворювати двовалентний радикал -О-СН2-О-.
2. Сполука за п. 1, де
кожний n означає ціле число зі значенням 0 або 1;
кожний R4 являє собою водень, С1-6алкіл, С1-6алкілоксіС1-6алкіл, С3-6циклоалкіл або фенілС1-6алкіл;
R1 являє собою водень, гідроксіС1-6алкіл, С1-6алкілкарбоніл або С1-6алкілсульфоніл; і R2 являє собою водень, галоген, С1-6алкіл, ціано, нітро, полігалогенС1-6алкіл або С1-6алкілокси.
3. Сполука за п. 1 або 2, де
кожний n означає ціле число зі значенням 1;
кожний m означає ціле число зі значенням 1;
кожний X незалежно являє собою N;
кожний Y незалежно являє собою NR4;
кожний R4 являє собою С1-6алкіл;
R1 являє собою водень;
R2 являє собою водень або галоген; і
R3 являє собою водень.
4. Сполука за будь-яким з пп. 1-3, де сполука являє собою сполуку № 1а, сполуку № 30, сполуку № 39 і сполуку № 50
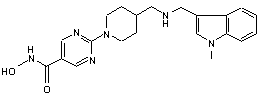

C2HF3O2; Сполука 1a
C2HF3O2 (1:1); Сполука 30
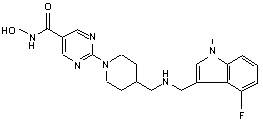
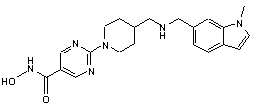
C2HF3O2 (1:1); Сполука 39
Сполука 50
5. Фармацевтична композиція, що містить фармацевтично прийнятні носії і, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4.
6. Спосіб одержання фармацевтичної композиції за п. 5, в якому фармацевтично прийнятні носії і сполуку за будь-яким з пп. 1-4 ретельно змішують.
7. Сполука за будь-яким з пп. 1-4 для використання як лікарського засобу.
8. Застосування сполуки за будь-яким з пп. 1-4 для виробництва медикаменту для лікування проліферативних захворювань.
9. Комбінація протиракового агента й інгібітора HDAC за будь-яким з пп. 1-4.
10. Спосіб одержання сполуки за п. 1, який відрізняється тим, що здійснюють
a) взаємодію проміжної сполуки формули (II), де Q являє собою тетрагідропіранілоксіамінокарбоніл, що згадується в даній заявці як проміжна сполука формули (II-а), з відповідною кислотою, такою, наприклад, як трифтороцтова кислота, з одержанням гідроксамінової кислоти формули (І)
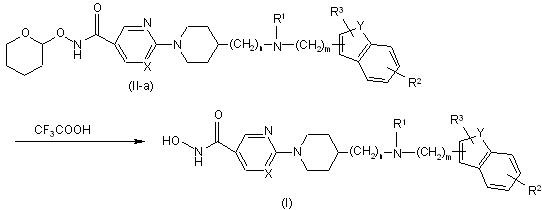 ;
;
b) взаємодію проміжної сполуки формули (II), де Q являє собою С1-2алкілоксикарбоніл, що згадується в даній заявці як проміжна сполука формули (II-с), з гідроксиламіном, у присутності основи й у відповідному розчиннику, з одержанням гідроксамінової кислоти формули (І)
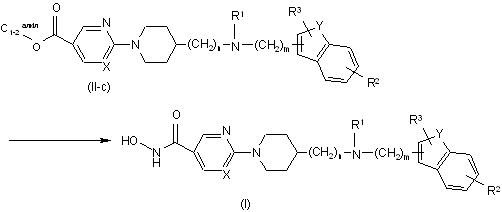 .
.
11. Сполука формули (II)
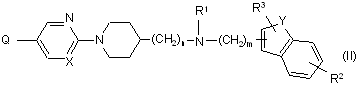 ,
,
її N-оксидні форми, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, де
кожний n означає ціле число зі значенням 0, 1 або 2; і, коли n дорівнює 0, тоді мається на увазі прямий зв'язок;
кожний m означає ціле число зі значенням 1 або 2;
кожний X незалежно являє собою N або СН;
кожний Y незалежно являє собою О, S, або NR4; де
кожний R4 являє собою водень, С1-6алкіл, С1-6алкілоксіС1-6алкіл, С3-6циклоалкіл, С3-6циклоалкілметил, фенілС1-6алкіл, -C(=O)-CHR5R6 або -S(=O)2-N(CH3)2;
де
кожний R5 і R6 незалежно являє собою водень, аміно, С1-6алкіл або аміноС1-6алкіл; і
коли Y являє собою NR4 і R2 знаходиться в 7-положенні індолілу, тоді R2 і R4 разом можуть утворювати двовалентний радикал
-(СН2)2-
(а-1) або
-(СН2)3-
(а-2);
R1 являє собою водень, С1-6алкіл, гідроксіС1-6алкіл, С1-6алкілсульфоніл, С1-6алкілкарбоніл або моно- чи ді(С1-6алкіл)аміносульфоніл;
R2 являє собою водень, гідрокси, аміно, галоген, С1-6алкіл, ціано, С2-6алкеніл, полігалогенС1-6алкіл, нітро, феніл, С1-6алкілкарбоніл, гідроксикарбоніл, С1-6алкілкарбоніламіно, С1-6алкілокси, або моно- чи ді(С1-6алкіл)аміно;
R3 являє собою водень, С1-6алкіл або С1-6алкілокси;
коли R2 і R3 знаходяться на сусідніх атомах вуглецю, вони можуть утворювати двовалентний радикал -О-СН2-О-; і
Q являє собою С1-2алкілоксикарбоніл, гідроксикарбоніл або тетрагідропіранілоксіамінокарбоніл.
12. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію сполуки формули (II), де Q являє собою гідроксикарбоніл, що згадується в даній заявці як сполука формули (ІІ-b), із проміжною сполукою формули (III) у присутності відповідних реагентів, таких як моногідрохлорид N-(етилкарбонімідоїл)-N,N-диметил-1,3-пропандіаміну (EDC) та 1-гідрокси-1H-бензотриазол (НОВТ), з утворенням сполуки формули (ІІ-а)
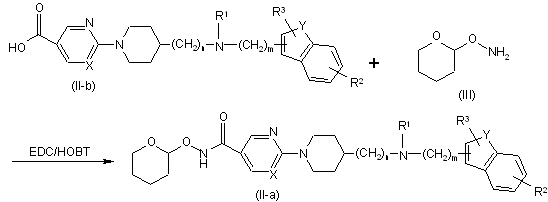 .
.
13. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (VI) з відповідним карбоксальдегідом формули (V), де t означає ціле число зі значенням 0 або 1, і, коли t дорівнює 0, тоді мається на увазі прямий зв'язок, у присутності відповідного реагенту, з утворенням сполуки формули (II-а)
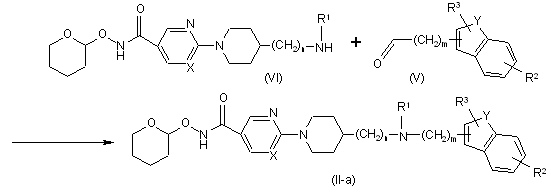 .
.
14. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію сполуки формули (II), де Q являє собою метил- або етилоксикарбоніл(C1-2алкіл), що згадується в даній заявці як сполука формули (II-с), з відповідним кислотним розчином або основним розчином, з утворенням сполуки формули (ІІ-b)
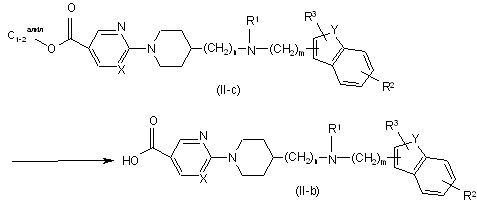 .
.
15. Спосіб одержаннясполуки за п. 11, який відрізняється тим, що здійснюють взаємодію етилового ефіру карбонової кислоти формули (IV) з відповідним карбоксальдегідом формули (V), у присутності відповідного реагенту, з утворенням сполуки формули (ІІ-с)
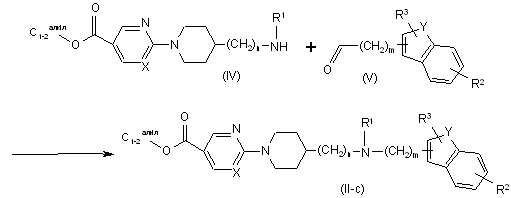 .
.
16. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (XIV) з відповідною проміжною сполукою формули (XV), у присутності відповідного реагенту, у придатному розчиннику, з утворенням сполуки формули (ІІ-с)
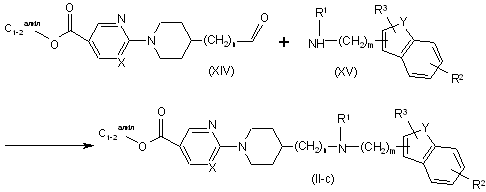 .
.
17. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (X) із проміжною сполукою формули (XI), де W являє собою відповідну відхідну групу, таку, наприклад, як галоген, наприклад, фтор, хлор, бром або йод, або сульфонілоксирадикал, такий як метилсульфонілокси, з утворенням сполуки формули (ІІ-с)
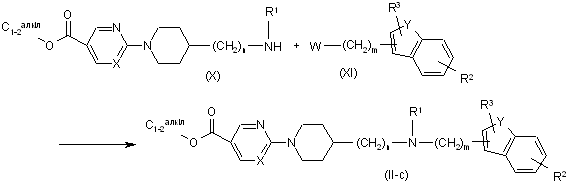 .
.
18. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (XII) із проміжною сполукою формули (XIII), де W являє собою відповідну відхідну групу, як описано вище, з утворенням сполуки формули (II-с)
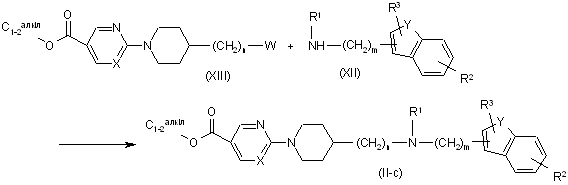 .
.
Текст
1. Сполука формули (І) 3 93352 4. Сполука за будь-яким з пп. 1-3, де сполука яв№ 39 і сполуку № 50 ляє собою сполуку № 1а, сполуку № 30, сполуку N O N H N H N HO N N H N F N N HO 4 N N H N O C2HF3O2; Сполука 1a C2HF3O2 (1:1); Сполука 30 O HO N N H N N N N H N H N N N H N N HO O F C2HF3O2 (1:1); Сполука 39 Сполука 50 5. Фармацевтична композиція, що містить фармацевтично прийнятні носії і, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4. 6. Спосіб одержання фармацевтичної композиції за п. 5, в якому фармацевтично прийнятні носії і сполуку за будь-яким з пп. 1-4 ретельно змішують. 7. Сполука за будь-яким з пп. 1-4 для використання як лікарського засобу. 8. Застосування сполуки за будь-яким з пп. 1-4 для виробництва медикаменту для лікування проліферативних захворювань. 9. Комбінація протиракового агента й інгібітора HDAC за будь-яким з пп. 1-4. 10. Спосіб одержання сполуки за п. 1, який відрізняється тим, що здійснюють a) взаємодію проміжної сполуки формули (II), де Q являє собою тетрагідропіранілоксіамінокарбоніл, що згадується в даній заявці як проміжна сполука формули (II-а), з відповідною кислотою, такою, наприклад, як трифтороцтова кислота, з одержанням гідроксамінової кислоти формули (І) O O O (CH2)n N N N H R3 R1 N Y (CH2)m X R2 (II-a) O CF3COOH HO (CH2)n N N N H R3 R1 N Y (CH2)m X R2 (I) b) взаємодію проміжної сполуки формули (II), де Q являє собою С1-2алкілоксикарбоніл, що згадується в даній заявці як проміжна сполука форму ли (II-с), з гідроксиламіном, у присутності основи й у відповідному розчиннику, з одержанням гідроксамінової кислоти формули (І) O C1-2 алкіл R3 R1 N (CH2)n N N O ; Y (CH2)m X R2 (II-с) O HO R1 N N H N (CH2)n N R3 Y (CH2)m X (I) R2 . 5 93352 11. Сполука формули (II) Q N (CH2)n N -(СН2)2(а-1) або -(СН2)3(а-2); R1 являє собою водень, С1-6алкіл, гідроксіС16алкіл, С1-6алкілсульфоніл, С1-6алкілкарбоніл або моно- чи ді(С1-6алкіл)аміносульфоніл; R2 являє собою водень, гідрокси, аміно, галоген, С1-6алкіл, ціано, С2-6алкеніл, полігалогенС1-6алкіл, нітро, феніл, С1-6алкілкарбоніл, гідроксикарбоніл, С1-6алкілкарбоніламіно, С1-6алкілокси, або моночи ді(С1-6алкіл)аміно; R3 являє собою водень, С1-6алкіл або С16алкілокси; коли R2 і R3 знаходяться на сусідніх атомах вуглецю, вони можуть утворювати двовалентний радикал -О-СН2-О-; і Q являє собою С1-2алкілоксикарбоніл, гідроксикарбоніл або тетрагідропіранілоксіамінокарбоніл. 12. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію сполуки формули (II), де Q являє собою гідроксикарбоніл, що згадується в даній заявці як сполука формули (ІІ-b), із проміжною сполукою формули (III) у присутності відповідних реагентів, таких як моногідрохлорид N-(етилкарбонімідоїл)-N,Nдиметил-1,3-пропандіаміну (EDC) та 1-гідрокси1H-бензотриазол (НОВТ), з утворенням сполуки формули (ІІ-а) R3 R1 N Y (CH2)m (II) X R2 , її N-оксидні форми, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, де кожний n означає ціле число зі значенням 0, 1 або 2; і, коли n дорівнює 0, тоді мається на увазі прямий зв'язок; кожний m означає ціле число зі значенням 1 або 2; кожний X незалежно являє собою N або СН; кожний Y незалежно являє собою О, S, або NR4; де кожний R4 являє собою водень, С1-6алкіл, С1С3-6циклоалкіл, С36алкілоксіС1-6алкіл, 5 6 6циклоалкілметил, фенілС1-6алкіл, -C(=O)-CHR R або -S(=O)2-N(CH3)2; де кожний R5 і R6 незалежно являє собою водень, аміно, С1-6алкіл або аміноС1-6алкіл; і коли Y являє собою NR4 і R2 знаходиться в 7положенні індолілу, тоді R2 і R4 разом можуть утворювати двовалентний радикал O R3 R1 N (CH2)n N N O HO 6 Y O (CH2)m O + X R2 (II-b) (III) O O EDC/HOBT O R3 R1 N (CH2)n N N N H NH2 Y (CH2)m X R2 (II-a) 13. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (VI) з відповідним карбоксальдегідом формули (V), де t означає ціле чис число зі значенням 0 або 1, і, коли t дорівнює 0, тоді мається на увазі прямий зв'язок, у присутності відповідного реагенту, з утворенням сполуки формули (II-а) O O O R3 R1 N N N H Y (CH2)n NH + (VI) (V) O O (CH2)m O X O . R1 N N H N (CH2)n N Y (CH2)m X (II-a) 14. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію сполуки формули (II), де Q являє собою метил- або етилоксикарбоніл(C1-2алкіл), що згадується в да R2 R3 R2 . ній заявці як сполука формули (II-с), з відповідним кислотним розчином або основним розчином, з утворенням сполуки формули (ІІ-b) 7 93352 8 O C1-2 R1 N алкіл R3 (CH2)n N N O Y (CH2)m X R2 (II-c) O X R2 . відповідним карбоксальдегідом формули (V), у присутності відповідного реагенту, з утворенням сполуки формули (ІІ-с) O R3 R1 N + (CH2)n NH N O X (V) R2 R3 R1 N алкіл Y (CH2)n N N O Y (CH2)m O (IV) O C1-2 (CH2)m (II-b) 15. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію етилового ефіру карбонової кислоти формули (IV) з алкіл Y (CH2)n N N O HO C1-2 R3 R1 N (CH2)m X (II-c) 16. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (XIV) з відповідною проO C1-2 міжною сполукою формули (XV), у присутності відповідного реагенту, у придатному розчиннику, з утворенням сполуки формули (ІІ-с) X (XV) (CH2)n N N O X O відхідну групу, таку, наприклад, як галоген, наприклад, фтор, хлор, бром або йод, або сульфонілоксирадикал, такий як метилсульфонілокси, з утворенням сполуки формули (ІІ-с) R3 R1 N (CH2)n X Y NH + W O (CH2)m (XI) (X) C1-2алкіл Y (CH2)m R2 . N O R3 (II-c) 17. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (X) із проміжною сполукою формули (XI), де W являє собою відповідну C1-2алкіл R2 R1 N алкіл Y (CH2)m NH (XIV) O C1-2 + (CH2)n N O R3 R1 O N алкіл R2 . R2 O R3 R1 N N (CH2)n N Y (CH2)m X (II-c) 18. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (XII) із проміжною сполу R2 . кою формули (XIII), де W являє собою відповідну відхідну групу, як описано вище, з утворенням сполуки формули (II-с) 9 93352 O C1-2алкіл N O 10 R3 R1 N (CH2)n X W + O Y (CH2)m (XII) (XIII) C1-2алкіл NH R2 O N X Даний винахід відноситься до сполук, що мають ферментативну активність інгібування гістондеацетилази (HDAC). Крім того, він відносяться до способів їх одержання, до композицій, що їх містять, а також до їх застосування, як in vitro, так і in vivo, для інгібування HDAC, а також як лікарського засобу, наприклад, як ліки для інгібування проліферативних станів, таких як рак і псоріаз. Ядерні гістони відомі як інтегральні та динамічні компоненти механізму, відповідального за регуляцію транскрипції гена та інші процеси, що кодуються ДНК, такі як реплікація, репарація, рекомбінація та поділ хромосом. Вони є суб'єктом пострансляційних модифікацій, включаючи ацетилування, фосфорилування, метилування, убіхитинування та АДФ-рибозилування. Гістондеацетилаза (деацетилази), що згадуються і даній заявці як "HDAC", являють собою ферменти, що каталізують видалення ацетильної модифікації на лізинових залишках білків, включаючи ядерні нуклеосомальні гістони Н2А, Н2В, H3 і Н4. Разом з гістонацетилтрансферазою (ацетилтрансферазами), що згадується в даній заявці як "HAT", HDAC регулюють рівень ацетилування гістонів. Баланс ацетилування нуклеосомальних гістонів відіграє важливу роль у транскрипції багатьох генів. Гіпоацетилування гістонів асоціюється з конденсованою структурою хроматину, що приводить до придушення транскрипції гена, у той час як ацетильовані гістони асоціюються з більш відкритою структурою хроматину та активуванням транскрипції. Описано одинадцять структурно родинних HDAC, і вони попадають у два класи. Клас І HDAC складається з HDAC 1, 2, 3, 8 і 11, у той час як клас II HDAC складається з HDAC 4, 5, 6, 7, 9 і 10. Елементи третього класу HDAC є структурно незв'язаними з HDAC класу І та класу II. HDAC класу І/II працюють за допомогою цинк-залежних механізмів, у той час як HDAC класу III є NADзалежними. На додаток до гістонів, інші білки також являють собою субстрат для ацетилування, у конкретних факторах транскрипції, таких як р53, GATA-1 і E2F; ядерних рецепторах, таких як рецептор глюкокортикоїдів, тироїдні рецептори, рецептори естрогенів; та в білках, що регулюють клітинний цикл, таких як pRb. Ацетилування білків зв'язане зі стабілізацією білків, таких як стабілізація р53, рекрутингом кофакторів та збільшенням зв'язування ДНК. р53 являє собою супресор пухлин, що може індукувати припинення клітинного циклу або апоп R3 R1 N (CH2)n (II-c) N Y (CH2)m R2 . тоз у відповідь на різні сигнали стресу, такі як ушкодження ДНК. Головною мішенню для індукованої р53 припинення клітинного циклу, видимо, є ген р21. Після його активування за допомогою р53, р21 ідентифікується за допомогою його асоціації з комплексами циклін/циклін-залежна кіназа, що приводить до припинення клітинного циклу у фазах як G1, так і G2, його позитивної регуляції під час сенесценції, і до його взаємодії з ядерним антигеном проліферуючих клітин. Дослідження інгібіторів HDAC показує, що вони відіграють важливу роль у припиненні клітинного циклу, клітинної диференціації, апоптозі та перетворенні трансформованих фенотипів. Інгібітор Трихостатин A (TSA), наприклад, викликає припинення клітинного циклу у фазах як G1, так і в G2, звертає трансформований фенотип різних ліній клітин і індукує диференціацію клітин лейкемії Френда та інших. TSA (та субероіланілід гідроксамінової кислоти SAHA), як повідомляється, інгібують ріст клітин, індукують кінцеву диференціацію та запобігають утворенню пухлин у мишей (Finnin et al., Nature, 401: 188-193, 1999). Трихостатин А, також, як повідомляється, є придатним для лікування фіброзу, наприклад, фіброзу печінки та цирозу печінки. (Geerts et al., заявка на Європейський патент ЕР 0827742, опублікована 11 березня 1998 року). Фармакофор для інгібіторів HDAC складається з домена зв'язування металу, що взаємодіє з цинквмістним активним сайтом HDAC, домена лінкера та домена, що розпізнає поверхню або кепіруючої ділянки, що взаємодіє з залишками на плечі активного сайту. Інгібітори HDAC, також, як повідомляється, індукують експресію гена р21. Транскрипційне активування гена р21 за допомогою цих інгібіторів промотується модифікацією хроматину після ацетилування гістонів H3 та Н4 у промоторній області р21. Це активування р21 здійснюється способом, незалежним від р53, і в такий спосіб інгібітори HDAC працюють у клітинах з мутованими генами р53, відмітною ознакою численних пухлин. На додаток до цього, інгібітори HDAC можуть мати опосередковані активності, такі як аугментація імунних реакцій хазяїна та інгібування ангіогенеза пухлин, і в такий спосіб може придушувати ріст первинних пухлин та блокувати метастази (Mai et al., Medicinal Research Reviews, 25: 261309). Зважаючи на все що, викладено вище, інгібітори HDAC можуть мати великий потенціал при 11 93352 12 лікуванні проліферативних захворювань або старою, фармакологічною активністю та/або фарманів клітин, включаючи пухлини з мутованими генакологічною ефективністю. ми р53. Проблема, що повинна вирішуватися, являє Заявка на Європейський патент ЕР 1472216, собою створення інгібіторів гістондеацетилази з опублікована на 14 серпня 2003 року, описує біцивисокою ферментативною та клітинною активнісклічні гідроксамати як інгібітори гістондеацетилази. тю, що мають підвищену біодоступність та/або Заявки на Європейський патент ЕР 1485099, ефективність in vivo. ЕР 1485348, ЕР 1485353, ЕР 1485354, ЕР Нові сполуки за даним винаходом вирішують 1485364, ЕР 1485365, ЕР 1485370, ЕР 1485378, описану вище проблему. Сполуки за даним винаопубліковані на 18 вересня 2003 року, серед іншоходом показують чудову ферментативну та кліго, описують заміщені піперазинілпіримідинілгідротинну активність інгібування гістондеацетилази. ксамінові кислоти як інгібітори гістондеацетилаз, Вони мають високу здатність до активування гена крім того, ЕР 1485365 описує R306465. р21, як на клітинному рівні, так і на рівні in vivo. Заявка на Європейський патент ЕР 1492534, Вони мають бажаний фармакокінетичний профіль опублікована на 9 жовтня 2003 року, описує сполута низьку спорідненість до ферментів Р450, що ки карбамінової кислоти, що містять піперазиновий знижує ризик шкідливої взаємодії лікарських засозв'язок, як інгібітори HDAC. бів, також, забезпечуючи більш широкі межі безпеЗаявка на Європейський патент ЕР 1495002, ки. опублікована на 23 жовтня 2003 року, описує заПереважними особливостями даних сполук є міщені піперазинілфеніл бензамідні сполуки, як метаболічна стабільність, розчинність і/або здатінгібітори гістондеацетилази. ність індукування р21. Більш конкретно, сполуки зв Заявка на Міжнародний патент WO 04/009536, даним винаходом мають підвищені часи напіврозопублікована на 29 січня 2004 року, описує похідні, паду в гепатоцитах пацюків, мають підвищену розщо містять алкільний лінкер між арильною групою і чинність/стабільність у водних розчинах і/або магідроксаматом, як інгібітори гістондеацетилази. ють підвищені здатності індукування промотору Заявка на Європейський патент ЕР 1525199. р21 in vivo. опублікована на 12 лютого 2004 року, описує (геДаний винахід відноситься до сполук формули теро)арилалкеніл-заміщені біциклічні гідроксама(І) ти, як інгібітори гістондеацетилази. Заявка на Міжнародний патент WO 04/063146, опублікована на 29 липня 2004 року, описує похідні N-гідроксибензамідних похідних із протизапальною та протипухлинною активністю. Заявка на Міжнародний патент WO 04/063169, опублікована на 29 липня 2004 року, описує замідо їх N-оксидних форм, фармацевтично прищені арилгідроксаматні похідні як інгібітори гістонйнятних адитивних солей та їх стереохімічно ізодеацетилази. мерних форм, де Заявка на Міжнародний патент WO 04/072047, кожний n означає ціле число зі значенням 0, 1 опублікована на 26 серпня 2004 року, описує індоабо 2 і, коли n дорівнює 0, тоді мається на увазі ли, бензимідазоли і нафтимідазоли як інгібітори прямий зв'язок; гістондеацетилази. кожний m означає ціле число зі значенням 1 Заявка на Міжнародний патент WO 04/082638, або 2; опублікована на 30 вересня 2004 року, описує гідкожний X незалежно являє собою N або СН; роксамати, зв'язані з неароматичними гетороциккожний Υ незалежно являє собою О, S, або лічними кільцевими системами, як інгібітори гістоNR4; де ндеацетилази. кожний R4 являє собою водень, С1-6алкіл, С1Заявка на Міжнародний патент WO 04/092115, С3-6диклоалкіл, С36алкілоксіС1-6алкіл, 5 6 опублікована на 28 жовтня 2004 року, описує гід6циклоалкілметил, фенілС1-6алкіл, -C(=O)-CHR R роксаматні похідні як інгібітори гістондеацетилази. або -S(=O)2-N(CH3)2; Заявка на Міжнародний патент WO 05/028447, де опублікована на 31 березня 2005 року, описує бекожний з R5 і R6 незалежно являє собою вонзимідазоли як інгібітори гістондеацетилази. день, аміно, С1-6алкіл або аміноС1-6алкіл; і Заявки на Міжнародний патент WO 05/030704 коли Υ являє собою NR4 і R2 знаходиться в 7та WO 05/030705, опубліковані на 7 квітня 2005 положенні індолілу, тоді R2 і R4 разом можуть року, описують бензаміди як інгібітори гістондеаутворювати двовалентний радикал цетилази. -(СН2)2- (а-1), або Заявка на Міжнародний патент WO 05/040101, -(СН2)3- (а-2); опублікована на 6 травня 2005 року, описує ацилR1 являє собою водень, С1-6алкіл, гідроксіС1сечовину та сульфонілсечовину, зв'язані з гідрокалкіл, С1-6алкілсульфоніл, С1-6алкілкарбоніл або 6 саматами як інгібітори гістондеацетилази. моно- чи ді(С1-6алкіл)аміносульфоніл; Заявка на Міжнародний патент WO 05/040161 R2 являє собою водень, гідроксі, аміно, галотакож опублікована на 6 травня 2005 року, описує ген, С1-6алкіл, ціано, С2-6алкеніл, полігалогенС1біарил-зв'язані гідроксамати як інгібітори гістонде6алкіл, нітро, феніл, С1-6алкілкарбоніл, гідроксикаацетилази. рбоніл, С1-6алкілкарбоніламіно, С1-6алкілокси, або Сполуки за даним винаходом відрізняються моно- чи ді(С1-6алкіл)аміно; від сполук, відомих з літератури, за своєю структу 13 93352 14 R3 являє собою водень, С1-6алкіл, або С1кислота), малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, 6алкілокси; і коли R2 і R3 знаходяться на сусідніх атомах вубензолсульфонова, п-толуолсульфонова, циклаглецю, вони можуть утворювати двовалентний мінова, саліцилова, п-аміносалицилова, памова радикал -О-СН2-О-. кислота, тощо. Лінії, намальовані в біциклічних кільцевих сисСполуки формули (І), що мають кислотні властемах від замісників, показують, що зв'язки можуть тивості, можуть перетворюватися в їх фармацевприєднуватися до будь-якого з відповідних кільцетично прийнятні адитивні солі основ за допомогою вих атомів біциклічної кільцевої системи. обробки зазначеної кислотної форми відповідною Термін "інгібітор гістондеацетилази" або "інгібіорганічною або неорганічною основою. Відповідні тор деацетилази гістона" використовується для форми основних солей включають, наприклад, ідентифікації сполуки, що здатна взаємодіяти з солі амонію, солі лужних і лужноземельних метадеацетилазою гістона та інгібувати її активність, лів, наприклад, солі літію, натрію, калію, магнію, більш конкретно, її ферментативну активність. кальцію, тощо, солі з органічними основами, наІнгібування ферментативної активності гістондеаприклад, солі бензатину, N-метил-D-глюкаміну, цетилази означає зменшення здатності гістондеагідрабаміну, і солі з амінокислотами, такими, нацетилази до видалення ацетильної групи із гістоприклад, як аргінін, лізин, тощо. ну. Переважно, таке інгібування є специфічним, Термін "адитивні солі кислот або основ" також тобто, інгібітор гістондеацетилази зменшує здатвключає гідрати і форми додавання розчинника, ність гістондеацетилази до видалення ацетильної що здатні утворювати сполуки формули (І). Прикгрупи із гістону при концентрації, що нижче, ніж лади таких форм являють собою, наприклад, гідконцентрація інгібітору, що потрібно для одержанрати, алкоголяти, тощо. ня якого-небудь іншого, не зв'язаного біологічного Термін "стереохімічні ізомерні форми сполук ефекту. формули (І)", як використовується в даній заявці, Як використовується в приведених вище вивизначає всі можливі сполуки, що складаються з значеннях і далі, галоген являє собою загальне тих самих атомів, з'єднаних за допомогою однієї і найменування для фтору, хлору, брому та йоду; тієї ж послідовності зв'язків, але які мають різні С1-2алкіл означає насичені вуглеводневі радикали тривимірні структури, що не є взаємно замінними, з прямим ланцюгом, що мають 1 або 2 атоми вугкотрі можуть мати сполуки формули (I). Якщо тільлецю, такі, наприклад, як метил або етил; С1-6алкіл ки не розглядається або не вказується інше, хімічвизначає С1-2алкіл і насичені вуглеводневі радикане позначення сполуки включає суміш усіх можлили з прямим та розгалуженим ланцюгом, що мавих стереохімічно ізомерних форм, що може мати ють від 3 до 6 атомів вуглецю, такі, наприклад, як зазначену сполуку. Зазначена суміш може містити пропіл, бутил, 1-метилетил, 2-метилпропіл, пенвсі діастереомери і/або енантіомери основної мотил, 2-метил-бутил, гексил, 2-метилпентил, тощо; і лекулярної структури зазначеної сполуки. Усі степолігалогенС1-6алкіл визначає С1-6алкіл, що місреохімічні ізомерні форми сполук формули (І), як у тить три ідентичних або різних галогенових замісчистій формі, так і в суміші одна з одною, як пеники, наприклад, трифторметил; С2-6алкеніл виредбачається, знаходяться в межах даного виназначає вуглеводневі радикали з прямим та ходу. розгалуженим ланцюгом, що містить один подвійN-оксидні форми сполук формули (І), як пений зв'язок і має від 2 до 6 атомів вуглецю, такі, редбачається, включають ті сполуки формули (І), наприклад, як етеніл, 2-пропеніл, 3-бутеніл, 2де один або декілька атомів азоту окиснюються до пентеніл, 3-пентеніл, 3-метил-2-бутеніл, тощо; С3так званого N-оксиду, зокрема, ті N-оксиди, де Nокисненими є один або декілька з атомів азоту 6циклоалкіл включає циклічні вуглеводневі групи, що мають від 3 до 6 атомів вуглецю, такі як циклопіперидину, піперазину або піридазинілу. пропіл, циклобутил, циклопентил, циклопентеніл, Деякі зі сполук формули (І) можуть також існуциклогексил, циклогексил, тощо. вати в їх таутомерних формах. Такі форми, хоча Фармацевтично прийнятні адитивні солі вклюне вказуються в явному вигляді в зазначеній вище чають фармацевтично прийнятні адитивні солі формулі, як передбачається, є включеними в рамкислот і фармацевтично прийнятні адитивні солі ки даного винаходу. основ. Фармацевтично прийнятні адитивні солі Скрізь, де він використовується далі, термін кислот, як розглянуто вище, як передбачається, "сполуки формули (I)", як передбачається, вклювключають терапевтично активні нетоксичні форчає також фармацевтично прийнятні адитивні солі ми адитивних солей кислот, що здатні формувати і всі стереоізомерні форми. сполуки формули (І). Сполуки формули (I), що маЯк використовується в даній заявці, терміни ють основні властивості, можуть перетворюватися "гістондеацетилаза" і "HDAC", як передбачається, в їх фармацевтично прийнятні адитивні солі кисвідносяться до будь-якого з сімейства ферментів, лот за допомогою обробки зазначеної основної що видаляють ацетильні групи з -аміно груп лізиформи відповідною кислотою. Відповідні кислоти нових залишків на N-закінченні гістона. Якщо по включають, наприклад, неорганічні кислоти, такі як контексту не вказується інше, термін "гістон", як галогенводневі кислоти, наприклад, хлороводнева передбачається, відноситься до будь-якого білка або бромводнева кислота; сірчана; азотна; фосгістона, включаючи Н1, Н2А, Н2В, H3, Н4 і Н5, з форна кислота, тощо; або органічні кислоти, такі, будь-яких видів. Білки або генні продукти HDAC наприклад, як оцтова, трифтороцтова, пропанова, людини, включають, але, не обмежуючи цим, гідроксіоцтова, молочна, піровиноградна, щавлеHDAC-1, HDAC-2, HDAC-3, HDAC-4, HDAC-5, ва, малонова, бурштинова (тобто бутандіонова HDAC-6, HDAC-7, HDAC-8, HDAC-9 HDAC-10 і 15 93352 16 HDAC-11. Гістондеацетилаза також може бути b) кожний m означає ціле число зі значенням отримана з найпростіших та грибів. 1; Перша група сполук, що представляє інтерес, c) кожний R4 являє собою водень, С1складається з тих сполук формули (I), до яких за6алкілоксіС1-6алкіл, С3-6циклоалкіл або фенілС1стосовують одне або декілька з наступних обме6алкіл; 1 жень: c) R являє собою водень, гідроксіС1-6алкіл, С14 a) кожний R являє собою водень, С1-6алкіл, 6алкілкарбоніл або С1-6алкілсульфоніл; С3-6циклоалкіл, С3-6циклоалкілметил, -C(=O)d) R2 являє собою водень, галоген, ціано, нітро 5 6 CHR R або -S(=O)2-N(CH3)2; або С1-6алкілокси; або b) R1 являє собою водень, С1-6алкіл, гідроксіС1e) R3 являє собою С1-6алкілокси; або f) коли R2 і R3 знаходяться на сусідніх атомах 6алкіл, С1-6алкілсульфоніл, або моно-чи ді(С1вуглецю, вони можуть утворювати двовалентний 6алкіл)аміносульфоніл; або c) R являє собою водень. радикал -О-СH2-О-. Друга група сполук, що представляють інтеП'ята група сполук, що представляють інтерес, рес, складається з таких сполук формули (І), до складається з таких сполук формули (І), до яких яких застосовують одне або декілька з наступних застосовують одне або декілька з наступних обобмежень: межень: a) кожний n означає ціле число зі значенням 0 a) кожний n означає ціле число зі значенням 1; або 1; b) кожний m означає ціле число зі значенням b) кожний X незалежно являє собою N; 1; c) кожний R являє собою водень або С1-6алкіл; c) кожний X незалежно являє собою N; d) R1 являє собою водень, С1-6алкіл або гідроd) кожний Υ незалежно являє собою NR4; ксіС1-6алкіл; або e) кожний R4 являє собою С1-6алкіл; 2 e) R являє собою водень, галоген, С1-6алкіл f) R1 являє собою водень; або С1-6алкокси. g) R2 являє собою водень або галоген; або Третя група сполук, що представляють інтеh) R3 являє собою водень. рес, складається з таких сполук формули (І), до Група переважних сполук складається з тих яких застосовують одне або декілька з наступних сполук формули (I), де кожний n означає ціле чисобмежень: ло зі значенням 0 або 1; кожний R4 являє собою a) кожний n означає ціле число зі значенням 0 водень, С1-6алкіл, С1-6алкілоксіС1-6алкіл, С31 або 1; 6циклоалкіл або фенілС1-6алкіл; R являє собою b) кожний R4 являє собою водень, С1-6алкіл, водень, С1-6алкіл, гідроксіС1-6алкіл, С12 С1-6алкілоксіС1-6алкіл, С3-6циклоалкіл або фенілС16алкілкарбоніл або С1-6алкілсульфоніл; і R являє собою водень, галоген, С1-6алкіл, ціано, нітро, по6алкіл; c) R1 являє собою водень, С1-6алкіл, гідроксіС1лігалогенС1-6алкіл або С1-6алкілокси. Група більш переважних сполук складається з 6алкіл, С1-6алкілкарбоніл або С1-6алкілсульфоніл; або тих сполук формули (І), де кожний n означає ціле d) R являє собою водень, галоген, С1-6алкіл, число зі значенням 1; кожний m означає ціле чисціано, нітро або С1-6алкокси. ло зі значенням 1; кожний X незалежно являє соЧетверта група сполук, що представляють інбою N; кожний Υ незалежно являє собою NR4; котерес, складається з таких сполук формули (І), до жний R4 являє собою С1-6алкіл; R1 являє собою 2 3 яких застосовують одне або декілька з наступних водень; R являє собою водень або галоген; і R обмежень: являє собою водень. a) кожний n означає ціле число зі значенням 0 Найбільш переважні сполуки являють собою або 1; сполуку № 1а, сполуку № 30, сполуку № 39 і сполуку № 50 C2HF3O2; Сполука 1a C2HF3O2 (1:1); Сполука 30 C2HF3O2 (1:1); Сполука 39 Сполука 50 Сполуки формули (І) і (II), їх фармацевтично прийнятні солі і N-оксиди і їх стереохімічно ізомерні форми можуть бути отримані звичайним способом. Вихідні матеріали і деякі проміжні сполуки являють собою відомі сполуки та є комерційно доступними або можуть бути отримані відповідно до звичайних процедур реакцій, як, у цілому, відомо в даній галузі техніки або як описано в заявках 17 93352 18 на Європейський патент ЕР 1485099, ЕР 1485348, сполук формули (II), де Q являє собою тетрагідроЕР 1485353, ЕР 1485354, ЕР 1485364, ЕР піранілоксіамінокарбоніл, що згадуються в даній 1485365, ЕР 1485370 та ЕР 1485378. заявці як проміжні сполуки формули (ІІ-а), з відпоДеякі способи одержання будуть описані далі відною кислотою, такою, як наприклад, трифторобільш докладно. Інші способи одержання кінцевих цтова кислота. Зазначену реакцію здійснюють у сполук формули (I) описуються в прикладах. відповідному розчиннику, такому, як наприклад, а) Гідроксамінові кислоти формули (І) можуть метанол або дихлорметан. бути отримані за допомогою взаємодії проміжних b) Альтернативно, гідроксам і нові кислоти формули (І) можуть бути отримані за допомогою взаємодії проміжних сполук формули (II), де Q являє собою С1-2алкілоксикарбоніл, що згадуються в даній заявці як проміжна сполука формули (II-с), Сполуки формули (І) також можуть бути перетворені на будь-які інші сполуки за допомогою відомих у даній галузі реакцій або перетворень функціональних груп. Ряд таких перетворень вже описаний вище. Інші приклади являють собою гідроліз складних ефірів карбонових кислот до відповідної карбонової кислоти або спирту; гідроліз амідів до відповідних карбонових кислот або амінів, гідроліз нітрилів до відповідних амідів; аміно групи на імідазолі або фенілі можуть бути замінені на водень за допомогою відомих у даній галузі реакцій діазотування та наступної заміни діазо-групи на водень; спирти можуть бути перетворені на складні ефіри та прості ефіри; первинні аміни можуть бути перетворені на вторинні або третинні аміни; подвійні зв'язки можуть бути гідровані до відповідного одинарного зв'язку; йодо радикал на фенільній групі може бути перетворений на естерну групу за допомогою введення моноокису вуглецю в присутності відповідного паладієвого каталізатора. Даний винахід також відноситься до проміжних сполук формули (II) з гідроксиламіном, у присутності основи, такої, як наприклад, гідроксид натрію. Зазначену реакцію здійснюють у відповідному розчиннику, такому, як наприклад, метанол. їх N-оксидних форм, фармацевтично прийнятних адитивних солей та стереохімічно ізомерних форм, де кожний n означає ціле число зі значенням 0, 1 або 2, і коли n дорівнює 0, тоді мається на увазі прямий зв'язок; кожний m означає ціле число зі значенням 1 або 2; кожний X незалежно являє собою N або СН; кожний Υ незалежно являє собою О, S, або NR4; де кожний R4 являє собою водень, С1-6алкіл, С16алкілоксіС1-6алкіл, 3-6циклоалкіл, 35 6 6циклоалкілметил, фенілС1-6алкіл, -C(=O)-CHR R або -S(=O)2-N(CH3)2; де кожний з R5 і R6 незалежно являє собою водень, аміно, С1-6алкіл або аміноС1-6алкіл; і коли Υ являє собою NR4 і R2 знаходиться в 7положенні індолілу, тоді R2 і R4 разом можуть утворювати двовалентний радикал -(СН2)2- (а-1), або -(СН2)3- (а-2); 19 93352 20 R1 являє собою водень, С1-6алкіл, гідроксіС1сполук можуть визначатися для сполук формули (II), відповідно до груп, визначеними для сполук 6алкіл, С1-6алкілсульфоніл, С1-6алкілкарбоніл або моно- чи ді(С1-6алкіл)аміносульфоніл; формули (I). R2 являє собою водень, гідрокси, аміно, галоа) Проміжні сполуки формули (ІІ-а) можуть ген, С1-6алкіл, ціано, С2-6алкеніл, полігалогенС1бути отримані за допомогою взаємодії проміжної сполуки формули (III) із проміжною сполукою фо6алкіл, нітро, феніл, С1-6алкіл карбоніл, гідроксикарбоніл, С1-6алкілкарбоніламіно, С1-6алкілокси, рмули (II), де Q являє собою гідроксикарбоніл, що або моно- чи ді(С1-6алкіл)аміно; згадуються в даній заявці як проміжні сполуки R3 являє собою водень, С1-6алкіл або С1формули (II-b), у присутності відповідних реагентів, таких як моногідрохлорид N'6алкілокси; коли R2 і R3 знаходяться на сусідніх атомах (етилкарбонімідоїл)-N,N-диметил-1,3вуглецю, вони можуть утворювати двовалентний пропандіаміну (EDC) та 1-гідрокси-1Нрадикал -О-СН2-О; і бензотриазол (НОВТ). Реакція може здійснюваQ являє собою С1-2алкілоксикарбоніл, гідроктися в присутності основи, такої як триетиламін, у сикарбоніл або тетрагідропіранілоксіамінокапридатному розчиннику, такому як суміш дихлоррбоніл. метану і тетрагідрофурану. Групи, що представляють інтерес, переважних, більш переважних і найбільш переважних b) Проміжні сполуки формули (II-а) можуть також бути отримані за допомогою взаємодії проміжної сполуки формули (VI) з відповідним карбоксальдегідом формули (V), де t означає ціле число зі значенням 0 або 1, і коли t дорівнює 0, тоді мається на увазі прямий зв'язок, у присутності відповідного реагенту, такого як боргідрид натрію, у придатному розчиннику, такому як дихлоретан або метанол. c) Проміжні сполуки формули (II-b) можуть бути отримані за допомогою взаємодії проміжних сполук формули (II), де Q являє собою метилабо етилоксикарбоніл (С1-2алкіл), що згадуються в даній заявці як проміжні сполуки формули (II-с), з відповідним кислотним розчином, наприклад, хлороводневою кислотою, або основним розчином, наприклад, гідрогенбромідом або гідроксидом натрію, у придатному розчиннику, наприклад, спирті, такому як етанол або пропанол. 21 93352 22 d) Проміжні сполуки формули (II-c) можуть бути отримані за допомогою взаємодії етилового естеру карбонової кислоти формули (IV) з відповідним карбоксальдегідом формули (V), у прису тності відповідного реагенту, такого як боргідрид натрію, наприклад, тетрагідроборат натрію, у придатному розчиннику, такому як спирт, наприклад, метанол. e) Ідентичним способом, проміжні сполуки формули (II-c) можуть бути отримані за допомогою взаємодії проміжної сполуки формули (XIV) з відповідною проміжною сполукою формули (XV), у присутності відповідного реагенту, такого як боргідрид натрію, наприклад, тетрагідроборат натрію, у придатному розчиннику, такому як спирт, наприклад, метанол. f) Проміжні сполуки формули (II-c) можуть також бути отримані за допомогою взаємодії проміжної сполуки формули (X) із проміжною сполукою формули (XI), де W являє собою відповідну групу, що відходить, таку, наприклад, як галоген, наприклад, фтор, хлор, бром або йод, або радикал сульфонілокси, такий як метилсульфонілокси, 4-метилфенілсульфонілокси, тощо. Реакція може здійснюватися в розчиннику, інертному для реакції, такому, наприклад, як спирт, наприклад, метанол, етанол, 2-метоксіетанол, пропанол, бутанол, тощо; етер, наприклад, 4,4-діоксан, 1,1‟оксибіспропан, тощо; кетон, наприклад, 4-метил2-пентанон; або N,N-диметилформамід, нітробензол, ацетонітрил, та тому подібні. Додавання відповідної основи, такої, як наприклад, карбонат або бікарбонат лужного або лужноземельного металу, наприклад, триетиламіну або карбонату натрію, може використовуватися для нейтралізування кислоти, що вивільняється в ході реакції. Мала кількість відповідного йодиду металу, наприклад, йодиду натрію або калію, може бути додана для прискорення реакції. Перемішування може збільшити швидкість реакції. Реакція може бути легко проведена при температурі, що знаходиться в межах між кімнатною температурою та температурою кипіння зі зворотним холодильником, і, якщо це бажано, реакція може здійснюватися при підвищеному тиску. g) Ідентичним способом, проміжні сполуки формули (II-c) можуть бути отримані за допомогою взаємодії проміжної сполуки формули (XII) із проміжною сполукою формули (XIII), де W являє собою відповідну групу, що відходить, як описано вище. 23 93352 24 Проміжні сполуки формули (VI) можуть бути отримані за допомогою взаємодії проміжної спо луки формули (VII) з піперидином у придатному розчиннику, наприклад, дихлорметані. Проміжні сполуки формули (VII) можуть бути отримані за допомогою взаємодії проміжної сполуки формули (VIII) із проміжною сполукою формули (III), у присутності відповідних реагентів, таких як N‟-(етилкарбонімідоїл)-N,N-диметил-1,3 пропандиамін, моногідрохлорид (EDC) і 1гідрокси-1H-бензотриазол (HOBT). Реакція може здійснюватися в присутності основи, такої як триетиламін, у придатному розчиннику, такому як, суміш дихлорметану та тетрагідрофурану. Проміжні сполуки формули (VIII) можуть бути отримані за допомогою взаємодії проміжної сполуки формули (IX) із проміжною сполукою формули (IV), де R1 являє собою водень, що згадуються в даній заявці як проміжні сполуки форму формули (N-a), у присутності гідроксиду натрію, у придатному розчиннику, такому як тетрагідрофуран, з наступною нейтралізацією хлороводневої кислоти та з додаванням карбонату натрію. Сполуки формули (I) та деякі із проміжних сполук можуть мати у своїй структурі, щонайменше, один стереогенний центр. Цей стереогенний центр може бути присутнім у R або S конфігураціях. 25 93352 26 Сполуки формули (I), як одержують в описаних ластичний синдром (MDS), пухлини мезенхімальвище способах, як правило, являють собою раценого походження (наприклад, фібросаркоми і рабмічні суміші енантіомерів, що можуть відокремлюдоміосаркоми), меланоми, тератокарциноми, нейватися один від одного за допомогою відомих у робластоми, гліоми, злоякісні пухлини шкіри даній галузі техніки процедурам. Рацемічні сполу(наприклад, кератоакантоми), карцинома молочної ки формули (I) можуть перетворюватися у відповізалози (наприклад, запущений рак молочної залодні форми діастереомерних солей за допомогою зи), карцинома нирок, карцинома яєчників, карцивзаємодії з відповідною хіральною кислотою. Занома сечового міхура та епідермальна карцинома. значені форми діастереомерних солей згодом роСполуки відповідно до даного винаходу мозділяють, наприклад, за допомогою селективної жуть використовуватися для інших терапевтичних або фракційної кристалізації, та енантіомери вивіцілей, наприклад: льняються з них за допомогою лугу. Альтернативa) сенсибілізації пухлин для радіаційної терапії ний спосіб поділу енантіомерних форм сполук фоза допомогою введення сполуки за даним винахормули (I) полягає у рідинній хроматографії з дом до, під час або після опромінення пухлини для використанням хіральної стаціонарної фази. Залікування раку; значені чисті стереохімічні ізомерні форми можуть b) лікування артропатій та остеопатологічних також бути отримані з відповідних чистих стереостанів, таких як ревматоїдний артрит, остеоартрит, хімічних ізомерних форм відповідних вихідних реювенільний артрит, подагра, поліартрит, псоріатичовин, за умови, що реакція протікає стереоспечесний артрит, анкілозний спондиліт та системна цифічно. Переважно, якщо бажаним є конкретний червона вовчанка; стереоізомер, зазначена сполука може бути синc) інгібування проліферації клітин гладких тезована за допомогою стереоспецифічних спосом‟язів, включаючи проліферативний розлад судин, бів одержання. В цих способах будуть переважно атеросклероз та рестеноз; використовуватися енантіомерно чисті вихідні реd) лікування запальних станів та станів шкіри, човини. таких як виразковий коліт, хвороба Крона, алергійСполуки формули (I), їх фармацевтично приний риніт, ускладнення відторгнення трансплантайнятні адитивні солі кислот та їх стереоізомерні тів, кон‟юнктивіт, астма, ОРДС, хвороба Бехчета, форми мають цінні фармакологічні властивості, відторгнення трансплантів, утикардія, алергійний що полягають у тому, що вони мають ефект інгібудерматит, осередкова алопеція, склеродерма, вання гістондеацетилази (HDAC). екзантема, екзема, дерматоміозит, акне, діабет, Даний винахід передбачає спосіб інгібування системна червона вовчанка, хвороба Кавасакі, аномального росту клітин, включаючи трансфоррозсіянний склероз, емфізема, фіброз сечового мовані клітини, за допомогою введення ефективміхура та хронічний бронхіт; ної кількості сполуки за даним винаходом. Аномаe) лікування ендометріозу, фиброїдів матки, льний ріст клітин відноситься до росту клітин, дисфункціональної маткової кровотечі та ендоменезалежному від нормальних регуляторних мехатриальної гіперплазії; нізмів (наприклад, до втрати контактного інгібуf) лікування васкуляризації ока, включаючи вавання). Це включає інгібування росту пухлини, як скулопатію, що впливає на ретинальні та хороїдабезпосередньо, викликаючи припинення росту, льні судини; кінцеву диференціацію і/або апоптоз ракових кліg) лікування серцевої дисфункції; тин, так і опосредовано, за допомогою інгібування h) інгібування імунодепресивних станів, таке як неоваскуляризації пухлин. лікування інфекції ВІЛ; Даний винахід також передбачає спосіб інгібуi) лікування ниркової дисфункції; вання росту пухлини за допомогою введення ефеj) придушення ендокринних розладів; ктивної кількості сполуки за даним винаходом k) інгібування дисфункції глюконеогенезу; суб‟єкту, наприклад, ссавцю (а більш конкретно, l) лікування нейропатології, наприклад, хворолюдині), що потребує такого лікування. Зокрема, в би Паркінсона, або нейропатології, що приводить даний час винахід передбачає спосіб інгібування до когнітивного розладу, наприклад, хвороба Альросту пухлин за допомогою введення ефективної цгеймера або нейрональних захворювань, кількості сполук за даним винаходом. Приклади зв‟язаних з поліглютаміном; пухлин, що можуть бути інгібовані, включають, але m) лікування психіатричних розладів, наприне обмежуються цим, рак легень (наприклад, адеклад, шизофренії, біполярного розладу, депресії, нокарциному, та включаючи недрібноклітинний рак занепокоєння та психозу; легень), ракові захворювання підшлункової залози n) інгібування нервом‟язової патології, напри(наприклад, карциному підшлункової залози, таку, клад, амілотропного латерального склерозу; наприклад, як екзокрина карцинома підшлункової o) лікування спинальної м‟язової атрофії; залози), ракові захворювання товстої кишки (наp) лікування інших патологічних станів, що приклад, карциноми товстої та прямої кишки, такі, піддаються лікуванню за допомогою посилення як наприклад, аденокарцинома товстої кишки та експресії гена; аденома товстої кишки), рак простати, включаючи q) посилення генної терапії; запущене захворювання, гематопоетичні пухлини r) інгібування адипогенезу; лімфоїдної тканини слизової оболонки (наприклад, s) лікування паразитозу, такого як малярія. гостра лімфоцитна лейкемія, лімфома BОтже, даний винахід описує сполуки формули лімфоцитів, лімфома Беркета), мієлоїдні лейкемії (I) для використання як ліки, а також використання (наприклад, гостра мієлогенна лейкемія (AML)), цих сполук формули (I) для виробництва медикафолікулярний рак щитовидної залози, мієлодисп 27 93352 28 менту, для лікування одного або декількох із зальового розчину та розчину глюкози. Також мозначених вище станів. жуть бути приготовлені суспензії для ін‟єкцій, у Сполуки формули (I), їх фармацевтично прицьому випадку можуть використовуватися відповійнятні адитивні солі кислот та стереоізомерні фодні рідкі носії, суспендуючі агенти, тощо. У компорми можуть мати цінні діагностичні властивості, зиціях, придатних для підшкірного введення, носій що полягають в тому, що вони можуть використонеобов‟язково містить агент для збільшення провуватися для детектування або ідентифікації никності і/або відповідний зволожуючий агент, неHDAC у біологічному зразку, включаючи детектуобов‟язково поєднаний з відповідними добавками вання або вимір утворення комплексу між міченою будь-якої природи в малих пропорціях, ці добавки сполукою та HDAC. не викликають значного негативного впливу на У методах виявлення або ідентифікації можна шкіру. Зазначені добавки можуть полегшити ввевикористовувати мічені сполуки, що одержують дення в шкіру і/або можуть бути корисні для одердією агентів для введення мітки, таких як радіоізожання бажаних композицій. Ці композиції можуть топи, ферменти, флуоресцентні речовини, люмівводитися різними шляхами, наприклад, як транснуючі речовини та т.п. Приклади радіоактивних дермальний пластир, як наклейка або як мазь. ізотопів включають 125I, 131I, 3H та 14C. Ферменти Особливо переважним є одержання зазначезвичайно робляться детектованими за допомогою них фармацевтичних композицій у дозованій одикон‟югування з відповідним субстратом, що, у свою ничній формі, для простоти введення й однорідночергу, каталізує детектовану реакцію. Їх приклади сті дозування. Дозована одинична форма, як включають, наприклад, бета-галактозидазу, бетавикористовується в даній заявці в описі і формулі глюкозидазу, лужну фосфатазу, пероксидазу та винаходу, відноситься до фізично окремих одималат-дегідрогеназу, переважно, пероксидазу ниць, придатних як окремі дози, кожна одиниця хрону. Люмінуючі речовини включають, наприклад, містить задану кількість активного інгредієнта, ролюмінол, похідні люмінола, люциферин, аекворин зраховану для надання бажаного терапевтичного та люциферазу. впливу, в поєднані з необхідним фармацевтичним Біологічні зразки можуть визначатися як тілесносієм. Приклади таких дозованих одиничних ні тканини або тілесні рідини. Приклади тілесних форм являють собою таблетки (включаючи таблерідин представляють собою спиномозкову рідину, тки з надсічками або таблетки з покриттям), капсукров, плазму, сироватку, сечу, мокротиння, слину, ли, пігулки, пакетики з порошком, пластинки, розтощо. чини або суспензії для ін‟єкцій, дози для Зважаючи на їх корисні фармакологічні власзаповнення чайної ложки, дози для заповнення тивості, розглянуті сполуки можуть бути виготовстолової ложки, тощо, та їх розділені набори. лені в різних фармацевтичних формах з метою Фахівець в даній області може легко визначивведення. ти ефективну кількість за результатами досліДля одержання фармацевтичних композицій джень, представлених далі. Як правило, передбаза даним винаходом, ефективну кількість конкретчається, що терапевтично ефективна кількість ної сполуки, у формі адитивної солі основи або повинна складати від 0,005 мг/кг до 100 мг/кг маси кислоти, як активний інгредієнт, ретельно змішутіла, і зокрема, від 0,005 мг/кг до 10 мг/кг маси тіють з фармацевтично прийнятним носієм, цей нола. Можливе відповідне введення необхідної дози сій може приймати різноманітні форми, у залежноу виді двох, трьох, чотирьох або більш субдоз честі від форми препарату, бажаного для введення. рез відповідні інтервали протягом дня. Зазначені Ці фармацевтичні композиції є бажаними у вигляді субдози можуть готуватися у вигляді одиничних одиничної форми дозування, придатної, переваждозованих форм, наприклад, що містять від 0,5 до но, для введення перорально, ректально, підшкір500 мг, і зокрема, від 10 мг до 500 мг активного но або за допомогою парентеральної ін‟єкції. Наінгредієнта на одиничну дозовану форму. приклад, при одержанні композицій у формі Як інший аспект даного винаходу, розглядаперорального дозування, може використовуватися ється поєднання інгібітору HDAC з іншим протирабудь-яке зі звичайних фармацевтичних середоковим агентом, зокрема, для використання як ліки, вищ, таких, як наприклад, вода, гліколі, олії, спирбільш конкретно, при лікуванні раку або пов‟язаних ти, тощо, у випадку пероральних рідких препараз ним захворювань. тів, таких як суспензії, сиропи, еліксири та розчини; Для лікування зазначених вище станів, сполуабо тверді носії, такі як крохмалі, цукри, каолін, ки за даним винаходом переважно можуть викориречовини, що змащують, зв‟язуючі матеріали, розстовуватися в поєднанні з одним або декількома пушуючі агенти, тощо, у випадку порошку, пігулок, іншими лікарськими агентами, більш конкретно, з капсул та таблеток. іншими протираковими агентами. Приклади проЗавдяки простоті їх введення, таблетки та каптиракових агентів являють собою: сули являють собою найбільш переважну форму координаційні сполуки платини, наприклад, перорального одиничного дозування, у цьому вицисплатин, карбоплатин або оксаліплатин; падку, напевно, використовуються тверді фарматаксанові сполуки, наприклад, паклітаксель цевтичні носії. Для парентеральних композицій, або доцетаксель; носій звичайно буде містити стерильну воду, щоінгібітори топоізомерази I, такі як сполуки камнайменше, у більшій частині, хоча можуть бути птотецину, наприклад, іринотекан або топотекан; включені й інші інгредієнти, наприклад, для збільінгібітори топоізомерази II, такі як протипухшення розчинності. Наприклад, можуть бути прилинні подофілотоксинові похідні, наприклад, етоготовлені розчини для ін‟єкцій, у яких носій містить позид або теніпозид; сольовий розчин, розчин глюкози або суміш со 29 93352 30 протипухлинні вінкаалкалоїди, наприклад, вінТермін "алкілуючі агенти" відноситься до групи бластин, вінкристин або вінорельбін; різних хімікатів, які мають загальну особливість, протипухлинні нуклеозидні похідні, наприклад, що вони мають здатність до введення, при фізіо5-фторурацил, гемцитабін або капецитабін; логічних умовах, алкільних груп у біологічно важалкілуючі агенти, такі як нітроіприт або нітроливі макромолекули, такі як ДНК. Разом з більшісзосечовина, наприклад, циклофосфамід, хлорамтю більш важливих агентів, таких як азотні гірчиці і буцил, кармустин або ломустин; нітрозосечовини, активні алкілуючі залишки генепротипухлинні антрациклінові похідні, наприруються in vivo після складних деградаційних реаклад, даунорубіцин, доксорубіцин, ідарубіцин або кцій, деякі з яких є ферментативними. Найбільш мітоксантрон; важливими фармакологічними діями алкілуючих антитіла HER2, наприклад, трастузумаб; агентів є ті, що порушують фундаментальні мехаантагоністи рецепторів естрогенів або селекнізми, пов‟язані з проліферацією клітин, при конктивні модулятори рецепторів естрогенів, наприретному синтезі ДНК та розподілі клітин. Здатність клад, тамоксифен, торемифен, дролоксифен, фаалкілуючих агентів втручатися у функціонування слодекс або ралоксифен; та цілісність ДНК у швидко проліферуючих тканиінгібітори ароматази, такі як ексеместан, ананах забезпечує основу для їх терапевтичних застрозол, летразол та ворозол; стосувань та для багатьох їх токсичних властивосагенти, що диференціюють, такі як ретиноїди, тей. вітамін D та агенти, що блокують метаболізм реТермін "протипухлинні похідні антрацикліну" тинової кислоти (RAMBA), наприклад, акутан; включає антибіотики, отримані від грибків StrEP. інгібітори метил-трансферази ДНК, наприклад, peuticus var. Caesius, та їх похідні, що відрізняютьазацитидин; ся тим, що вони мають тетрациклінову кільцеву інгібітори кінази, наприклад, флавоперидол, структуру з незвичайним цукром, даунозаміном, іматиніб мезилат або гефітиніб; приєднаним за допомогою глікозидного зв‟язку. інгібітори фарнезил-трансферази; Ампліфікація білка рецептору 2 фактору епіінші інгібітори HDAC; дермального росту людини (HER 2) у первинних інгібітори убіквітин-протеасомних шляхів, накарциномах молочної залози, як показано, кореприклад, Velcade; або Yondelis. лює з поганим клінічним прогнозом для визначеТермін "координаційна сполука платини" виконих пацієнтів. Трастузумаб являє собою каппаристовується в даній заявці для позначення будьантитіло до олюдненого моноклонального Ig1, якої координаційної сполуки платини, що інгібує отриманого за допомогою рекомбінантної ДНК ріст клітин пухлини, що поставляє платину у формі високого очищення, що зв‟язується з високою споіона. рідненістю та специфічністю з позаклітинним доТермін "таксанові сполуки" вказує на клас споменом рецептора HER2. лук, що мають таксанову кільцеву систему, та Багато видів раку молочної залози мають репов‟язані з або одержані з екстрактів визначених цептори естрогенів, та ріст цих пухлин може стивидів тисових дерев (Taxus). мулюватися естрогенами. Терміни "антагоністи Термін "інгібітори топізомерази" використовурецепторів естрогенів" та "селективні модулятори ється для позначення ферментів, що здатні змінюрецепторів естрогенів" використовуються для позвати топологію ДНК в еукаріотичних клітинах. Вони начення конкурентних інгібіторів зв‟язування естє критичними для важливих клітинних функцій та радіолу з рецептором естрогенів (ER). Селективні проліферації клітин. Існує два класи топоізомераз модулятори рецепторів естрогенів, коли в еукаріотичних клітинах, а саме, тип I та тип II. зв‟язуються з ER, викликають зміну тривимірної Топоізомераза I являє собою мономерний ферформи рецептора, модулюючи його зв‟язування з мент із молекулярною масою приблизно 100 000. естроген-чутливим елементом (ERE) на ДНК. Фермент зв‟язується з ДНК і робить тимчасовий У жінок після постменопаузи основним джерерозрив одного ланцюжка, розвиває подвійну спілом циркулюючого естрогена є перетворення адраль (або дозволяє їй розвитися), згодом з‟єднує ренальних та оваріальних андрогенів (андростенрозрив перед дисоціацією з ланцюжком ДНК. Топідіону та тестостерону) на естрогени (естрон та зомераза II має подібний механізм дії, що включає естрадіол) під дією ферменту ароматази в периіндукування розривів ланцюжка ДНК або утворенферичних органах. Усунення впливу естрогена за ня вільних радикалів. допомогою інгібування або інактивування аромаТермін "сполуки камптотецину" використовутази являє собою ефективне та селективне лікується для позначення сполук, що одержують з вання для деяких пацієнтів після менопаузи з горвихідної сполуки камптотецину, що являє собою монозалежним раком молочної залози. водонерозчинний алкалоїд, одержаний з аралії Термін "антиестрогенний агент" використовукитайської Camptothecin acuminata та фікуса ється в даній заявці не тільки для антагоністів реNothapodytes foetida, або пов‟язаний з ними. цепторів естрогенів та селективних модуляторів Термін "сполуки подофілотоксину" використорецепторів естрогенів, але також і для інгібіторів вується для позначення сполук, що пов‟язані або ароматази, як обговорюється вище. одержують з вихідного подофілотоксину, що екстТермін "агенти, що диференціюють," включає рагують з рослини mandrake. сполуки, що можуть, різними шляхами, інгібувати Термін "протипухлинні алкалоїди вінка" викопроліферацію клітин та індукувати диференціацію. ристовується для позначення сполук, що пов‟язані Вітамін D та ретиноїди, як відомо, відіграють голоабо одержують з екстрактів рослини барвінку вну роль у регуляції росту та диференціації різно(Vinca rosea). манітних нормальних і злоякісних типів клітин. 31 93352 32 Агенти, що блокують метаболізм ретиноєвої кисДаний винахід також відноситься до комбінації лоти (RAMBA), збільшують рівні ендогенних ретиза винаходом протиракового засобу та інгібітору ноєвих кислот за допомогою інгібування катаболіHDAC за винаходом. зму ретиноєвих кислот, опосередковуваного Даний винахід також відноситься до комбінації цитохромом P450. за винаходом для застосування в лікарській тераЗміни метилювання ДНК знаходяться серед пії, наприклад, для інгібування росту пухлинних найбільш розповсюджених аномалій неоплазії люклітин. дини. Гіперметилування в промоторах обраних Даний винахід також відноситься до комбінації генів звичайно пов‟язується з інактивуванням розза винаходом для інгібування росту пухлинних глянутих генів. Термін "інгібітори метилклітин. трансферази ДНК" використовується для познаДаний винахід також відноситься до способу чення сполук, що діють за допомогою фармаколоінгібування росту пухлинних клітин у суб‟єкта (люгічного інгібування метил-трансферази ДНК та дини), який включає введення суб‟єкту ефективної реактивування експресії гена, що придушує пухликількості комбінації за винаходом. ну. Крім того, даний винахід відноситься до споТермін "інгібітори кінази" включає ефективні собу інгібування аномального росту клітин, що інгібітори кіназ, що залучені в розвиток клітинного включає трансформовані клітини, шляхом введенциклу та програмуючу загибель клітин (апоптоз). ня ефективної кількості комбінації за винаходом. Термін "інгібітори фарнезилтрансферази" виІнгібітор HDAC та ще один лікарський засіб користовуються для позначення сполук, що розможна вводити одночасно (наприклад, у вигляді роблені для запобігання фарнезилювання Ras та окремих композицій або у вигляді єдиної композиінших внутрішньоклітинних білків. Вони, як показації) або послідовно в будь-якому порядку. В останно, мають вплив на проліферацію та виживання ньому випадку дві сполуки повинні бути введені злоякісних клітин. протягом того періоду часу, в такій кількості та Термін "інші інгібітори HDAC" включає, але, не такому способі, при яких досягається переважний обмежуючи цим: або синергічний ефект. Варто розуміти, що перекарбоксилати, наприклад, бутират, коричну киважний спосіб та порядок введення та відповідні слоту, 4-фенілбутират або валпроєву кислоту; дози та схеми лікування для кожного компонента гідроксамінові кислоти, наприклад, субероілакомбінації будуть залежати від конкретних сполук, нілід гідроксамінову кислоту (SAHA), що містять що вводяться - інгібітору HDAC та лікарського запіперазинові аналоги SAHA, біарилгідроксамат Aсобу, конкретного шляху їх введення, конкретної 161906 та його карбозилефірні, тетрагідропіридипухлині, що підлягає лікуванню, та конкретного нові та тетралонові аналоги, біциклічні арил-N«хазяїна», якого лікують. Фахівці в даній галузі гідроксикарбоксаміди, пироксамід, CG-1521, PXDтехніки можуть легко визначити оптимальні спосіб 101, сульфонамід гідроксамінову кислоту, LAQта порядок введення, дозування та схему лікуван824, LBH-589, трихостатин A (TSA), оксамфлатин, ня, використовуючи загальноприйняті методи та скриптаїд, споріднені скриптаїду трициклічні молемаючи у вигляді інформацію, викладену в даній кули, м-карбоксикоричну кислоту бісгідроксамінову заявці. кислоту (CBHA), CBHA-подібні гідроксамінові кисКоординаційну сполуку платини переважно лоти, трапоксиновий аналог гідроксамінової кисловводять при дозуванні від 1 до 500 мг на квадратти, R306465 та споріднені бензоїл- і гетероарилгіний метр (мг/м2) площі поверхні тіла, наприклад, 2 дроксамінові кислоти, аміносуберати та 50 - 400 мг/м , зокрема, для цисплатину при дозумалонілдиаміди; ванні приблизно 75 мг/м2 і для карбоплатину прициклічні тетрапептиди, наприклад, трапоксин, близно при 300 мг/м2 на курс лікування. апидицин, депсипептид, споріднені сполуки спируСполуку таксана переважно вводять при дозухостатину, RedFK-228, що містять сульфгідрилциванні від 50 до 400 мг на квадратний метр (мг/м2) клічні тетрапептиди (SCOP), циклічні тетрапептиплощі поверхні тіла, наприклад, 75 - 250 мг/м2, ди, що містять гідроксамінові кислоти, (CHAP), зокрема, для паклітакселю при дозуванні приблизTAN-174s та азумаміди; но від 175 до 250 мг/м2 і для доцетакселю приблибензаміди, наприклад, MS-275 або CI-994, або зно при 75 - 150 мг/м2 на курс лікування. депудецин. Сполуку камптотецину переважно вводять при Термін "інгібітори убиквітин-протеасомного дозуванні від 0,1 до 400 мг на квадратний метр шляху" використовується для ідентифікації сполук, (мг/м2) площі поверхні тіла, наприклад, 1 - 300 що інгібують цільове руйнування клітинних білків у мг/м2, зокрема, для іринотекану при дозуванні протеасомі, включаючи регуляторні білки клітинноприблизно від 100 до 350 мг/м2 і для топотекану го циклу. приблизно при 1 - 2 мг/м2 на курс лікування. Для лікування раку, сполуки відповідно до даПротипухлинне похідне подофілотоксину пеного винаходу можуть вводитися пацієнту, як опиреважно вводять при дозуванні від 30 до 300 мг на сано вище, у поєднанні з опроміненням. Опроміквадратний метр (мг/м2) площі поверхні тіла, нанення означає іонізуюче випромінювання, і, приклад, 50 - 250 мг/м2, зокрема, для етопозиду зокрема, гамма випромінювання, зокрема, що випри дозуванні приблизно від 35 до 100 мг/м2 і для пускається лінійними прискорювачами або радіотеніпозиду приблизно при 50 - 250 мг/м2 на курс нуклідами, що широко використовуються в даний лікування. час. Опромінення пухлини радіонуклідами може Протипухлинний вінкаалкалоїд переважно бути зовнішнім або внутрішнім. вводять при дозуванні від 2 до 30 мг на квадратний метр (мг/м2) площі поверхні тіла, зокрема, для 33 93352 34 вінбластину при дозуванні приблизно від 3 до 12 складу єдиної фармацевтичної композиції, що місмг/м2, для вінкристину при дозуванні приблизно від тить обидва компоненти. 1 до 2 мг/м2, і для вінорельбіну при дозуванні приТаким чином, даний винахід також відноситься близно від 10 до 30 мг/м2 на курс лікування. до фармацевтичної композиції, що містить інгібіПротипухлинне нуклеозидне похідне переважтор HDAC та інший лікарський засіб разом з одним но вводять при дозуванні від 200 до 2500 мг на або декількома фармацевтичними носіями. квадратний метр (мг/м2) площі поверхні тіла, наДаний винахід також відноситься до комбінації приклад, 700 - 1500 мг/м2, зокрема, для 5-FU при у формі фармацевтичної композиції, що включає дозуванні від 200 до 500 мг/м2, для гемцитабіну протираковий агент та інгібітор HDAC відповідно при дозуванні приблизно від 800 до 1200 мг/м2 і до винаходу разом з одним або декількома фардля капецитабіну приблизно від 1000 до 2500 мацевтично прийнятними носіями. мг/м2 на курс лікування. Даний винахід, крім того, також відноситься до Алкілуючий агент, такий як нітроіприт або нітзастосування комбінації за винаходом у виробницрозосечовина, переважно вводять при дозуванні тві фармацевтичної композиції для інгібування від 100 до 500 мг на квадратний метр (мг/м2) площі росту пухлинних клітин. поверхні тіла, наприклад, 120 - 200 мг/м2, зокрема, Крім того, даний винахід відноситься до продля циклофосфаміду при дозуванні приблизно від дукту, що містить як перший активний інгредієнт 100 до 500 мг/м2, для хлорамбуцину при дозуванні інгібітор HDAC за винаходом та як другий активний приблизно від 0,1 до 0,2 мг/кг, для кармустину при інгредієнт протираковий засіб, у вигляді комбінодозуванні приблизно від 150 до 200 мг/м2, і для ваного препарату для одночасного, роздільного ломустину при дозуванні приблизно від 100 до 150 або послідовного застосування в лікуванні хворих, мг/м2 на курс лікування. що страждають на рак. Протипухлинне антрациклінове похідне переЕкспериментальна частина важно вводять при дозуванні від 10 до 75 мг на Нижченаведені приклади приведені для ілюсквадратний метр (мг/м2) площі поверхні тіла, натрації. Далі, "DCM" позначає дихлорметан, "DIPE" приклад, 15 до 60 мг/м2, зокрема, для доксорубіпозначає діізопропіловий ефір, "DMA" позначає цину при дозуванні приблизно від 40 до 75 мг/м2, N,N-диметилацетамід, "DMSO" позначає диметилдля даунорубіцину при дозуванні приблизно від 25 сульфоксид, "EDC" позначає моногідрохлорид N‟до 45 мг/м2, і для ідарубіцину при дозуванні приб(етилкарбонімідоїл-N,N-диметил-1,3лизно від 10 до 15 мг/м2 на курс лікування. пропандіаміну, "EtOAc" позначає етилацетат, Трастузумаб переважно вводять при дозуванні "EtOH" позначає етанол, "HOBt" позначає 1від 1 до 5 мг на квадратний метр (мг/м2) площі погідроксі-1H-бензотриазол, "MeOH" позначає мета2 верхні тіла, зокрема, від 2 до 4 мг/м на курс лікунол, "TFA" позначає трифтороцтову кислоту і вання. "THF" позначає тетрагідрофуран. Антиестрогенний агент переважно вводять A. Одержання проміжних сполук при дозуванні приблизно від 1 до 100 мг на день, в Приклад A1 залежності від конкретного агента і від стану, що a) Одержання проміжної сполуки 1 лікують. Тамоксифен переважно вводять перорально при дозуванні від 5 до 50 мг, переважно, від 10 до 20 мг двічі на день, продовжуючи терапію протягом часу, достатнього для досягнення і підтримки терапевтичного впливу. Тореміфен переважно вводять перорально при дозуванні приблизно від 60 мг, один раз на день, продовжуючи терапію протягом часу, достатнього для досягнення і підтримки терапевтичного впливу. Анастрозол переСуміш етилового ефіру 2-[4-(амінометил)-1важно вводять перорально при дозуванні приблипіперидиніл]-5-піримідинкарбонової кислоти зно 1 мг, один раз на день. Дролоксифен (0,0114 моль), 1-метил-1H-індол-3переважно вводять перорально при дозуванні карбоксальдегіду (0,017 моль) і MgSO4 (0,5 г) у приблизно 20 - 100 мг, один раз на день. РалокMeOH (80 мл) перемішують і нагрівають зі зворотсифен переважно вводять перорально при дозуним холодильником протягом 15 годин, потім охованні приблизно 60 мг, один раз на день. Ексемеслоджують до кімнатної температури. Натрій тетратан переважно вводять перорально при дозуванні гідроборат (0,018 моль) додають порціями. Суміш приблизно 25 мг, один раз на день. перемішують при кімнатній температурі протягом 5 Ці дозування можуть бути введені, наприклад, годин, виливають у воду й екстрагують EtOAc. один, два або більше разів на курс лікування, що Органічний шар відокремлюють, сушать (MgSO4), може бути повторений, наприклад, кожні 7, 14, 21 фільтрують, і розчинник випарюють. Залишок (6,6 або 28 днів. г) очищають за допомогою колоночної хроматогЗавдяки їх корисним фармакологічним власрафії на силікагелі (15-40 мкм) (елюент: тивостям компоненти комбінацій за винаходом, DCM/MeOH/NH4OH 94/6/0,5). Чисті фракції збиратобто інгібітор HDAC та інший лікарський засіб ють, і розчинник випарюють, з одержанням 4,3 г можуть входити до складу різних фармацевтичних (90 %) проміжної сполуки 1. форм, призначених для введення. Зазначені комb) Одержання проміжної сполуки 2 поненти можуть окремо входити до складу індивідуальних фармацевтичних композицій або до 35 Суміш проміжної сполуки 1 (0,0037 моль) і гідроксиду натрію (0,0074 моль) у EtOH (60 мл) перемішують при 50°C протягом 15 годин, потім охолоджують до кімнатної температури, і розчинник випарюють насухо, з одержанням 1,5 г (100 %) проміжної сполуки 2. c) Одержання проміжної сполуки 3 EDC (0,0075 моль), потім HOBt (0,0075 моль), потім O-(тетрагідро-2H-піран-2-іл)-гідроксиламін (0,015 моль) додають при кімнатній температурі до суміші проміжної сполуки 2 (0,005 моль) у DCM (100 мл) і THF (100 мл), у потоці N2. Суміш перемішують при 40°C протягом 4 годин, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (4 г) очищають за допомогою колоночної хроматографії на силікагелі (15 - 40 мкм) (елюент: DCM/MeOH/NH4OH 96/4/0,5). Чисті фракції збирають, і розчинник випарюють, з одержанням 1 г (42 %) проміжної сполуки 3. Фракцію (0,051 г) кристалізують з DIPE. Осад відфільтровують і сушать, з одержанням 0,03 г проміжної сполуки 3, температура плавлення 70°C. Приклад A2 a) Одержання проміжної сполуки 4 Суміш етилового ефіру 2-[4-(амінометил)-1піперидиніл]-5-піримідинкарбонової кислоти (0,0072 моль) у THF (40 мл) і гідроксиду натрію, 1 н. (40 мл), перемішують при кімнатній температурі протягом ночі. Додають хлорводневу кислоту, 1 н. (40 мл). Суміш перемішують протягом 10 хвилин. Додають карбонат натрію (0,0216 моль). Суміш перемішують протягом 10 хвилин. 1-[[(9Hфлуорен-9-илметокси)карбоніл]окси]-2,5піролідиндіон (0,0072 моль) додають порціями. Суміш перемішують при кімнатній температурі протягом 6 годин, потім охолоджують до 0°C і підкисляють хлороводневою кислотою. Осад фільтрують, промивають діетиловим ефіром і сушать, з одержанням 4,1 г (100 %) проміжної сполуки 4. b) Одержання проміжної сполуки 5 93352 36 Триетиламін (0,02 моль), EDC (0,0082 моль) і HOBt (0,0082 моль) додають при кімнатній температурі до суміші проміжної сполуки 4 (0,0068 моль) у DCM/THF (200 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 15 хвилин. Додають O-(тетрагідро-2H-піран-2іл)гідроксиламін (0,0082 моль). Суміш перемішують при кімнатній температурі протягом 48 годин, виливають у воду й екстрагують DCM. Органічний шар промивають NaHCO3 10%, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (4 г) очищають за допомогою колоночної хроматографії на силікагелі (15 - 40 мкм) (елюент: DCM/MeOH/NH4OH 98/2/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 3,4 г (89 %) проміжної сполуки 5. c) Одержання проміжної сполуки 6 Суміш проміжної сполуки 5 (0,0355 моль) і піперидину (0,089 моль) у DCM (400 мл) перемішують при 35°C протягом 72 годин. Розчинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 80/20/2). Чисті фракції збирають, і розчинник випарюють, з одержанням 6,7 г (56%). Частину залишку (0,79 г) кристалізують з діетилового ефіру. Осад відфільтровують і сушать, з одержанням 0,62 г проміжної сполуки 6, температура плавлення 129°C. d) Одержання проміжної сполуки 7 Суміш проміжної сполуки 6 (0,0009 моль) і 5хлор-1H-індол-3-карбоксальдегіду (0,0012 моль) у 1,2-дихлор-етані (30 мл) перемішують при кімнатній температурі протягом ночі. Трис(ацето-O)гідроборат(1-) натрію (0,0013 моль) додають порціями. Суміш перемішують при кімнатній температурі протягом 4 годин, виливають у воду/NaOH 3н і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (0,5 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент DCM/MeOH/NH4OH 93/7/0,5). Дві фракції збирають, і розчинник випа 37 93352 38 рюють, з одержанням 0,07 г (16%) проміжної спотрагують EtOAc. Органічний шар відокремлюють, луки 7. сушать (MgSO4), фільтрують, і розчинник випарюПриклад A3 ють. Залишок (8,5 г) очищають за допомогою коa) Одержання проміжної сполуки 8 лоночної хроматографії на силікагелі (70-200 мкм) (елюент: DCM/MeOH/NH4OH 98/2/0 - 97/3/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 1,25 г (20%) проміжної сполуки 10. d) Одержання проміжної сполуки 11 Розчин етилового ефіру 2-(метилсульфоніл)-5піримідинкарбонової кислоти (0,094 моль) в ацетонітрилі (40 мл) додають при 10°C до суспензії 4піперидинметанолу (0,086 моль) і карбонату калію (0,172 моль) в ацетонітрилі (200 мл), у потоці N2. Суміш доводять до кімнатної температури, потім перемішують протягом 4 годин, виливають у воду й екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (23 г) кристалізують з ацетонітрилу/діетилового ефіру. Осад відфільтровують і сушать, з одержанням 7,8 г (34%) проміжної сполуки 8. Шар маткового розчину випарюють. Залишок (17 г) очищають за допомогою колоночної хроматографії на силікагелі (20-45 мкм) (елюент: DCM/MeOH/NH4OH 97/3/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 4,6 г (20%) проміжної сполуки 8, температура плавлення 129°C. b) Одержання проміжної сполуки 9 Триетиламін (0,038 моль), потім метансульфонілхлорид (0,025 моль) додають при 0°C до розчину проміжної сполуки 8 (0,0189 моль) у DCM (80 мл), у потоці N2. Суміш перемішують при 0°C протягом 2 годин і виливають у воду з льодом. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють, з одержанням 6,5 г (100%) проміжної сполуки 9. c) Одержання проміжної сполуки 10 Суміш проміжної сполуки 9 (0,0189 моль), Nметил-1H-індол-3-етанаміну (0,0172 моль) і карбонату калію (0,0344 моль) в ацетонітрилі (180 мл) перемішують і нагрівають зі зворотним холодильником протягом 24 годин, виливають у воду й екс Суміш проміжної сполуки 10 (0,003 моль) і гідроксиду натрію (0,006 моль) у EtOH (80 мл) перемішують і нагрівають зі зворотним холодильником протягом ночі, потім охолоджують до кімнатної температури і розчинник випарюють насухо, з одержанням 1,3 г (100%) проміжної сполуки 11, т.пл. >260°C. c) Одержання проміжної сполуки 12 EDC (0,0045 моль), потім HOBt (0,0045 моль) додають при кімнатній температурі до суміші проміжної сполуки 11 (0,003 моль) у THF (100 мл) і DCM (100 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 15 хвилин. Додають O-(тетрагідро-2H-піран-2-іл)гідроксиламін (0,012 моль). Суміш перемішують при кімнатній температурі протягом 72 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (3 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 94/6/0,1). Чисті фракції збирають, і розчинник випарюють. Залишок (0,82 г) поміщають в діетиловий ефір. Осад відфільтровують і сушать, з одержанням 0,78 г проміжної сполуки 12, температура плавлення 154°C. Приклад A4 Одержання проміжної сполуки 13 39 Суміш етилового ефіру 2-[4-(амінометил)-1піперидиніл]-5-піримідинкарбонової кислоти (0,0049 моль), метансульфонату 1H-індол-3етанолу (складний ефір) (0,0054 моль) і карбонату калію (0,01 моль) в ацетонітрилі (20 мл) перемішують і нагрівають зі зворотним холодильником протягом ночі, потім охолоджують, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (2,2 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 96/4/0,2). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,442 г (22%) проміжної сполуки 13, температура плавлення 238°C. b) Одержання проміжної сполуки 14 Суміш проміжної сполуки 13 (0,0025 моль), (2брометокси)(1,1-диметилетил)диметилсилану (0,0034 моль) і N-етил-N-(1-метилетил)-2пропанаміну (0,0038 моль) в DMSO (20 мл) перемішують при 50°C протягом 15 годин, потім охолоджують до кімнатної температури, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1,7 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 98/2/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,76 г (54%) проміжної сполуки 14. c) Одержання проміжної сполуки 15 Суміш проміжної сполуки 14 (0,0013 моль) і гідроксиду натрію (0,0027 моль) у EtOH (40 мл) перемішують при 80°C протягом ночі, потім охолоджують до кімнатної температури і розчинник 93352 40 випарюють, з одержанням 0,75 г (100%) проміжної сполуки 15. d) Одержання проміжної сполуки 16 EDC (0,002 моль), потім HOBt (0,002 моль) додають при кімнатній температурі до суміші проміжної сполуки 15 (0,0013 моль) у THF (80 мл) і DCM (80 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 15 хвилин. Додають O-(тетрагідро-2H-піран-2-іл)гідроксиламін (0,0068 моль). Суміш перемішують при кімнатній температурі протягом 72 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1,3 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,38 г проміжної сполуки 16. e) Одержання проміжної сполуки 17 Суміш проміжної сполуки 16 (0,0011 моль) і тетрабутиламонійфториду (0,0032 моль) у THF (10 мл) перемішують при кімнатній температурі протягом 72 годин, виливають у воду й екстрагують EtOAc. Органічний шар промивають водою, сушать (MgSO4), фільтрують, і розчинник випарюють, з одержанням 0,5 г (88%) проміжної сполуки 17. Приклад A5 a) Одержання проміжної сполуки 45 Розчин метилового ефіру 2-хлор-5піримідинкарбонової кислоти (0,058 моль) у DMA (80 мл) додають по краплях до розчину 4піперидинметанаміну (0,116 моль) і Nетилдіізопропіламіну (0,145 моль) у DMA (150 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 1 години і 30 хвилин, виливають у воду з льодом і екстрагують EtOAc, потім 41 93352 42 DCM. Органічний шар промивають водою, сушать (0,0039 моль) у DCM/THF (50/50) (100 мл), у потоці (MgSO4), фільтрують, і розчинник випарюють. ЗаN2. Суміш перемішують при кімнатній температурі лишок кристалізують з DIPE. Осад відфільтровупротягом 15 хвилин. Додають O-(тетрагідро-2Hють і сушать, з одержанням 10 г (65%) проміжної піран-2-іл)гідроксиламін (0,0026 моль). Суміш песполуки 45. ремішують при кімнатній температурі протягом 72 b) Одержання проміжної сполуки 46 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1 г) очищають за допомогою колоночної хроматографії на кромасилі (5 мкм) (елюент: DCM/MeOH/NH4OH 98/2/0,2 - 92/8/0,2). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,101 г (15%) проміжної сполуки 48. Приклад A6 a) Одержання проміжної сполуки 49 Суміш проміжної сполуки 45 (0,0024 моль), 1метил-5-нітро-1H-індол-3-карбоксальдегіду (0,0036 моль) і MgSO4 (0,25 г) у MeOH (80 мл) перемішують при 60°C протягом ночі, потім охолоджують до кімнатної температури. Натрій тетрагідроборат (0,0041 моль) додають порціями. Суміш перемішують при кімнатній температурі протягом 18 годин, виливають у воду й екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1,1 г) кристалізують з ацетонітрилу. Осад відфільтровують і сушать, з одержанням 0,9 г (86%) проміжної сполуки 46, температура плавлення: 150°C. c) Одержання проміжної сполуки 47 Суміш проміжної сполуки 46 (0,002 моль) і гідроксиду натрію (0,008 моль) у EtOH (60 мл) перемішують при 60°C протягом ночі, потім охолоджують до кімнатної температури і випарюють. Залишок поміщають в діетиловий ефір. Осад відфільтровують і сушать, з одержанням 0,6 г (67%) проміжної сполуки 47. d) Одержання проміжної сполуки 48 EDC (0,0019 моль) і HOBt (0,0019 моль) додають при кімнатній температурі до розчину проміжної сполуки 47 (0,0013 моль) і триетиламіну Розчин метилового ефіру 2-хлор-5піримідинкарбонової кислоти (0,033 моль) у DCM (80 мл) додають при кімнатній температурі до розчину 4-піперидинметанолу (0,066 моль) і Nетилдіізопропіламіну (0,083 моль) у DCM (100 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 3 годин і 30 хвилин, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок поміщають в пентан. Осад відфільтровують і сушать, з одержанням 7,88 г (95%) проміжної сполуки 49. b) Одержання проміжної сполуки 50 DMSO (0,058 моль) додають по краплях при 78°C до розчину етандіоїлдихлориду (0,0278 моль) у DCM (50 мл), у потоці N2. Суміш перемішують протягом 15 хвилин. Розчин проміжної сполуки 49 (0,023 моль) у DCM (200 мл) додають по краплях. Суміш перемішують при -78°C протягом 1 години і 30 хвилин. Триетиламін (0,118 моль) додають по краплях. Суміш перемішують при -78°C протягом 1 години, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок кристалізують з діетилового ефіру. Осад відфільтровують і сушать, з одержанням 3,06 г (54%) проміжної сполуки 50. c) Одержання проміжної сполуки 51 43 Проміжну сполуку 50 (0,0122 моль) додають при 5°C до розчину 1-метил-1H-індол-3-етанаміну (0,0122 моль) у MeOH (270 мл), у потоці N2. Суміш перемішують декілька хвилин. Додають натрій ціаноборгідрид (0,0183 моль) і оцтову кислоту (0,0183 моль). Суміш перемішують при кімнатній температурі протягом 48 годин, виливають у карбонат калію 10% і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (4,9 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 97/3/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 1,2 г (24%) проміжної сполуки 51. d) Одержання проміжної сполуки 52 Суміш проміжної сполуки 51 (0,0009 моль) і гідроксиду натрію (0,0039 моль) у EtOH (60 мл) перемішують і нагрівають зі зворотним холодильником протягом 15 годин, потім випарюють насухо, з одержанням проміжної сполуки 52. Цю проміжну сполуку використовують безпосередньо на наступній стадії реакції. e) Одержання проміжної сполуки 53 HOBt (0,0019 моль), потім EDC (0,0019 моль) додають при кімнатній температурі до розчину проміжної сполуки 52 (0,0009 моль) і O(тетрагідро-2H-піран-2-іл)гідроксиламіну (0,0019 моль) у DCM/THF (130 мл). Суміш перемішують при кімнатній температурі протягом 48 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, 93352 44 і розчинник випарюють. Залишок (0,93 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 97/3/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,155 г (33%) проміжної сполуки 53. Приклад A7 a) Одержання проміжної сполуки 54 Суміш етилового ефіру 2-[4-(амінометил)-1піперидиніл]-5-піримідинкарбонової кислоти (0,0038 моль), 1-етил-1H-індол-3-карбоксальдегіду (0,0049 моль) і Pd/C 10% (0,5 г) у MeOH (20 мл), що містить 1 мл 10% розчин тіофену в EtOH, гідрують при кімнатній температурі протягом 24 годин при тиску 3 бар, потім фільтрують через целіт. Розчинник випарюють насухо. Залишок (1,8 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,2 - 93/7/0,5). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,7 г (44%) проміжної сполуки 54. b) Одержання проміжної сполуки 55 Гідрид натрію 60% (0,009 моль) додають при 0°C до розчину проміжної сполуки 54 (0,0045 моль) у THF (50 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 1 години. Розчин йодоетану (0,0062 моль) у THF (10 мл) додають по краплях. Суміш перемішують при кімнатній температурі протягом ночі, виливають у воду й екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (0,6 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,16 г (8%) проміжної сполуки 55. c) Одержання проміжної сполуки 56 45 93352 46 лишок (1,7 г) очищають за допомогою колоночної хроматографії на кромасилі (15-40 мкм) (елюент: DCM/MeOH/NH3OH 98/2/0,1). Дві фракції збирають, і розчинник випарюють, з одержанням 0,265 г проміжної сполуки 58 і 0,57 г (17%) проміжної сполуки 10. b) Одержання проміжної сполуки 59 Суміш проміжної сполуки 55 (0,0003 моль) і гідроксиду натрію (0,03 г) у EtOH (15 мл) перемішують при 80°C протягом 6 годин, потім випарюють насухо, з одержанням 0,16 г (100%) проміжної сполуки 56. d) Одержання проміжної сполуки 57 Суміш проміжної сполуки 58 (0,0006 моль) і гідроксиду натрію (0,0012 моль) у EtOH (30 мл) перемішують при 80°C протягом ночі, потім охолоджують до кімнатної температури і розчинник випарюють, з одержанням 0,26 г (100%) проміжної сполуки 59. c) Одержання проміжної сполуки 60 EDC (0,0005 моль) і HOBt (0,0005 моль) додають при кімнатній температурі до суміші проміжної сполуки 56 (0,0003 моль) у DCM (20 мл) і THF (20 мл), у потоці N2. Суміш перемішують протягом 15 хвилин. Додають O-(тетрагідро-2H-піран-2іл)гідроксиламін (0,0007 моль). Суміш перемішують при кімнатній температурі протягом 72 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (0,3 г) очищають за допомогою колоночної хроматографії на кромасиле (5 мкм) (елюент: DCM/MeOH/NH4OH 93/7/0,35). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,03 г (16%) проміжної сполуки 57. Приклад A8 a) Одержання проміжної сполуки 58 Гідрид натрію (0,011 моль) додають при 5°C до розчину проміжної сполуки 13 (0,0037 моль) у THF (30 мл), у потоці N2. Суміш перемішують протягом 30 хвилин. Розчин йодометану (0,0081 моль) у THF (10 мл) додають по краплях. Суміш перемішують при 10°C протягом 2 годин, потім доводять до кімнатної температури протягом 1 години і 30 хвилин, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. За EDC (0,0009 моль) і HOBt (0,0009 моль) додають при кімнатній температурі до розчину проміжної сполуки 59 (0,0006 моль) у THF (30 мл) і DCM (30 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 15 хвилин. Додають O-(тетрагідро-2H-піран-2-іл)гідроксиламін (0,0012 моль). Суміш перемішують при кімнатній температурі протягом 24 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (0,6 г) очищають за допомогою колоночної хроматографії на кромасилі (5 мкм) (елюент: DCM/MeOH/NH4OH 99/1/0,05 і 94/6/0,3). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,1 г (33%) проміжної сполуки 60. Приклад A9 a) Одержання проміжної сполуки 61 DMSO (0,127 моль) додають при -78°C до розчину етандіоїлдихлориду (0,061 моль) у DCM (110 47 93352 48 мл), у потоці N2. Суміш перемішують протягом 15 хвилин. Розчин проміжної сполуки 8 (0,051 моль) у DCM (200 мл) додають. Суміш перемішують при 78°C протягом 1 години і 30 хвилин. Триетиламін (0,26 моль) додають по краплях. Суміш перемішують при -78°C протягом 15 хвилин, потім доводять до кімнатної температури протягом 2 годин і 30 хвилин. Додають воду. Суміш екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (14 Суміш проміжної сполуки 63 (0,0032 моль) і гіг) очищають за допомогою колоночної хроматогдроксиду натрію (0,0128 моль) у EtOH (150 мл) рафії на силікагелі (20-45 мкм) (елюент: циклогекперемішують і нагрівають зі зворотним холодильсан/EtOAc 70/30). Чисті фракції збирають, і розником протягом 5 годин, потім охолоджують до чинник випарюють, з одержанням 7,6 г (57%) кімнатної температури і поміщають у діетиловий проміжної сполуки 61. ефір. Осад відфільтровують і сушать, з одержанb) Одержання проміжної сполуки 62 ням 1,57 г (99%) проміжної сполуки 64, температура плавлення >260°C. e) Одержання проміжної сполуки 65 Натрій ціаноборгідрид (0,049 моль) і оцтову кислоту (0,034 мл) додають при кімнатній температурі до розчину 5-хлор-1-метил-1H-індол-3етанаміну (0,031 моль) і проміжної сполуки 61 (0,034 моль) у MeOH (700 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 24 годин, виливають у карбонат калію 10% і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (14,8 г) очищають за допомогою колоночної хроматографії на силікагелі (20-45 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,2). Чисті фракції збирають, і розчинник випарюють, з одержанням 4,52 г (32%) проміжної сполуки 62. c) Одержання проміжної сполуки 63 Метансульфонілхлорид (0,0049 моль) додають при 5°C до розчину проміжної сполуки 62 (0,004 моль) і триетиламіну (0,008 моль) у DCM (150 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 24 годин, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (2,39 г) поміщають у DIPE. Осад відфільтровують і сушать, з одержанням 1,78 г (84%) проміжної сполуки 63, температура плавлення 162°C. d) Одержання проміжної сполуки 64 EDC (0,0064 моль) і HOBt (0,0064 моль) додають при кімнатній температурі до розчину проміжної сполуки 64 (0,0032 моль) у THF (160 мл) і DCM (160 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 30 хвилин. Додають O-(тетрагідро-2H-піран-2-іл)гідроксиламін (0,0064 моль). Суміш перемішують при кімнатній температурі протягом 3 днів, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (2,77 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 97/3/0,1). Чисті фракції збирають, і розчинник випарюють. Залишок (0,385 г) кристалізують з CH3CN/ діетилового ефіри. Осад відфільтровують і сушать, з одержанням 0,084 г проміжної сполуки 65, температура плавлення 179°C. Приклад A10 a) Одержання проміжної сполуки 66 Розчин етилового ефіру 2-(метилсульфоніл)-5піримідинкарбонової кислоти (0,094 моль) в ацетонітрилі (240 мл) додають при кімнатній температурі до розчину 1,1-диметилетилового ефіру 4піперидиніл-карбамінової кислоти, (0,078 моль) і карбонату калію (0,156 моль) в ацетонітрилі (120 мл), у потоці N2. Суміш перемішують при кімнатній 49 93352 50 температурі протягом ночі, виливають у воду з ник випарюють насухо, з одержанням 0,7 г льодом і екстрагують EtOAc. Органічний шар про(>100%) проміжної сполуки 69. мивають водою, сушать (MgSO4), фільтрують, і c) Одержання проміжної сполуки 70 розчинник випарюють. Залишок кристалізують із діетилового ефіру. Осад відфільтровують і сушать, з одержанням 14,4 г (53%) проміжної сполуки 66, температура плавлення 160°C. b) Одержання проміжної сполуки 67 TFA (20 мл) додають при кімнатній температурі до розчину проміжної сполуки 66 (0,0225 моль) у DCM (110 мл). Суміш перемішують при кімнатній температурі протягом 15 годин, виливають у воду і підлужують карбонатом калію. Суміш екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють, з одержанням 5,5 г (98%) проміжної сполуки 67. Приклад A11 a) Одержання проміжної сполуки 68 Гідрид натрію 60% в маслі (0,0069моль) додають при 0°C до розчину етилового ефіру 2-метил1H-індол-3-оцтової кислоти (0,0046 моль) у THF (10 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 1 години. Додають йодоетан (0,006 моль). Суміш перемішують при кімнатній температурі протягом 18 годин і виливають у EtOAc і насичений розчин NaCl. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють насухо. Залишок (1,1 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: циклогексан/EtOAc 80/20). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,73 г (65%)проміжної сполуки 68. b) Одержання проміжної сполуки 69 Розчин діізобутилалюміній гідриду в толуолі (0,0045 моль) додають по краплях при -78°C до розчину проміжної сполуки 68 (0,003 моль) у DCM (15 мл) і 1,2-диметоксіетану (15 мл) (молекулярні сита: 3 ангстреми), у потоці N2. Суміш перемішують при -78°C протягом 3 годин, потім гасять HCl 3н і екстрагують DCM. Органічний шар промивають водою, сушать (MgSO4), фільтрують, і розчин Титан(IV) етоксид (0,0023 моль) додають до суміші проміжної сполуки 67 (0,0021 моль) і проміжної сполуки 69 (0,0021 моль) у 1,2-дихлор-етані (25 мл). Суміш перемішують при кімнатній температурі протягом 30 хвилин. Трис(ацето--O)гідроборат(1-) натрію (0,0023 моль) додають порціями. Суміш перемішують при кімнатній температурі протягом 18 годин, потім гасять з NaHCO3 і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють насухо. Залишок (1,2 г) очищають за допомогою колоночної хроматографії на силікагелі (5 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,2 г (21%) проміжної сполуки 70. d) Одержання проміжної сполуки 71 Суміш проміжної сполуки 70 (0,0004 моль) і гідроксиду натрію (0,0009 моль) у EtOH (30 мл) перемішують при 60°C протягом ночі, потім охолоджують до кімнатної температури і випарюють, з одержанням 0,2 г (100%) проміжної сполуки 71. e) Одержання проміжної сполуки 72 EDC (0,0007 моль) і HOBt (0,1 г) додають при кімнатній температурі до розчину проміжної сполуки 71 (0,0004 моль) і триетиламіну (0,0009 моль) у DCM/THF (40 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 15 хвилин. Додають O-(тетрагідро-2H-піран-2-іл)гідроксиламін (0,0009 моль). Суміш перемішують при кімнатній температурі протягом 72 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлю 51 93352 ють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (0,4 г) очищають за допомогою колоночної хроматографії на кромасилі (5 мкм) (елюент: DCM/MeOH/NH4OH 98/2/0,1 - 90/10/1). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,087 г (37%) проміжної сполуки 72. Приклад A12 a) Одержання проміжної сполуки 73 Проміжну сполуку 50 (0,0046 моль) додають при 5°C до розчину 6-метокси-1-метил-1H-індол-3етанаміну (0,0046 моль) у MeOH (100 мл), у потоці N2. Суміш перемішують протягом 30 хвилин. Додають натрій ціаноборгідрид (0,0068 моль), потім оцтову кислоту (0,0046 моль) порціями. Суміш перемішують при кімнатній температурі протягом 48 годин, виливають у карбонат калію 10% і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (4 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм)) (елюент: DCM/MeOH/NH4OH 96/4/0,2). Чисті фракції збирають, і розчинник випарюють. Частина (0,7 г) залишку (2,2 г) кристалізують з ацетонітрилу. Осад відфільтровують і сушать, з одержанням 0,43 г (61%) проміжної сполуки 73, температура плавлення 122°C. b) Одержання проміжної сполуки 74 Суміш проміжної сполуки 73 (0,0015 моль) і гідроксиду натрію (0,006 моль) у EtOH (90 мл) перемішують і нагрівають зі зворотним холодильником протягом 8 годин, потім випарюють насухо, з одержанням проміжної сполуки 74. c) Одержання проміжної сполуки 75 52 HOBt (0,003 моль), потім EDC (0,003 моль) додають при кімнатній температурі до розчину проміжної сполуки 74 (0,0015 моль) і O-(тетрагідро2H-піран-2-іл)гідроксиламіну (0,003 моль) у THF/DCM (200 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 48 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1,1 г) очищають за допомогою колоночної хроматографії на силікагелі (10 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,5). Чисті фракції збирають, і розчинник випарюють. Залишок (0,24 г) очищають за допомогою колоночної хроматографії на силікагелі (10 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,5). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,17 г (21%) проміжної сполуки 75. Приклад A13 a) Одержання проміжної сполуки 76 Суміш 6-метокси-1H-індол-3-етанаміну (0,053 моль) і 1,3-ізобензофурандіону (0,058 моль) у толуолі (130 мл) перемішують і нагрівають зі зворотним холодильником протягом 48 годин, потім фільтрують. Фільтрат випарюють, з одержанням 5,4 г (32%) проміжної сполуки 76. b) Одержання проміжної сполуки 77 Розчин проміжної сполуки 76 (0,017 моль) у DMF (19 мл) додають по краплях при кімнатній температурі до суспензії гідриду натрію (0,034 моль) у DMF (11 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 1 години і 30 хвилин. Додають 1-йодопропан (0,034 моль). Суміш перемішують при кімнатній температурі протягом 1 години і 15 хвилин. Додають насичений розчин NaCl. Суміш екстрагують EtOAc. Органічний шар промивають водою, сушать (MgSO4), 53 93352 54 фільтрують, і розчинник випарюють, з одержанням (елюент: DCM/MeOH 100/0 - 95/5). Чисті фракції 4,9 г проміжної сполуки 77. Цей продукт викорисзбирають, і розчинник випарюють, з одержанням товують безпосередньо на наступній стадії реакції. 1,1 г (78%) проміжної сполуки 80. c) Одержання проміжної сполуки 78 f) Одержання проміжної сполуки 81 Суміш проміжної сполуки 77 (0,068 моль) і гідразину, моногідрату (0,068 моль) у EtOH (60 мл) перемішують і нагрівають зі зворотним холодильником протягом 1 години, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють, з одержанням 3,53 г проміжної сполуки 78. Цей продукт використовують безпосередньо на наступній стадії реакції. d) Одержання проміжної сполуки 79 Натрій ціаноборгідрид (0,024 моль) і оцтову кислоту (0,0167 моль) додають при кімнатній температурі до розчину проміжної сполуки 61 (0,0167 моль) і проміжної сполуки 78 (0,015 моль) у MeOH (380 мл), у потоці N2. Суміш перемішують протягом 30 хвилин, виливають у карбонат калію 10% і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (8,84 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 96/4/0,2). Чисті фракції збирають, і розчинник випарюють, з одержанням 2,85 г (40%) проміжної сполуки 79. e) Одержання проміжної сполуки 80 Суміш проміжної сполуки 79 (0,0028 моль), йодоетану (0,0056 моль) і триетиламіну (0,0085 моль) у DMF (60 мл) перемішують при 50°C протягом 7 годин, виливають у воду з льодом і екстрагують EtOAc. Органічний шар промивають водою, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1,8 г) очищають за допомогою колоночної хроматографії на кромасилі (5 мкм) Суміш проміжної сполуки 80 (0,0022 моль) і гідроксиду натрію (0,0088 моль) у EtOH (100 мл) перемішують і нагрівають зі зворотним холодильником протягом 6 годин, потім перемішують при кімнатній температурі протягом ночі і випарюють насухо. Залишок поміщають у діетиловий ефір. Осад відфільтровують і сушать, з одержанням 0,965 г (88%) проміжної сполуки 81, температура плавлення >260°C. g) Одержання проміжної сполуки 82 EDC (0,0038 моль) і HOBt (0,0038 моль) додають при кімнатній температурі до розчину проміжної сполуки 81 (0,0019 моль) у THF (100 мл) і DCM (100 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 30 хвилин. Додають O-(тетрагідро-2H-піран-2-іл)гідроксиламін (0,0038 моль). Суміш перемішують при кімнатній температурі протягом 48 годин, виливають у воду й екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1,2 г) очищають за допомогою колоночної хроматографії на кромасилі (5 мкм) (елюент: DCM/MeOH/NH4OH 99/1/0,05 93/7/0,35). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,114 г проміжної сполуки 82. Приклад A14 a) Одержання проміжної сполуки 83 Суміш проміжної сполуки 62 (0,0034 моль) і гідроксиду натрію (0,0134 моль) у EtOH (150 мл) перемішують при 80°C протягом 3 годин, потім охолоджують до кімнатної температури і випарю 55 93352 ють насухо. Залишок поміщають у діетиловий ефір. Осад відфільтровують і сушать, з одержанням 1,18 г(78%) проміжної сполуки 83, температура плавлення >260°C. b) Одержання проміжної сполуки 84 EDC (0,0052 моль) і HOBt (0,0052 моль) додають при кімнатній температурі до розчину проміжної сполуки 83 (0,0026 моль) у THF (120 мл) і DCM (120 мл), у потоці N2. Суміш перемішують при кімнатній температурі протягом 30 хвилин. Додають O-(тетрагідро-2H-піран-2-іл)гідроксиламін (0,0052 моль). Суміш перемішують при кімнатній температурі протягом 6 днів, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (2 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 96/4/0,5). Чисті фракції збирають, і розчинник випарюють. Залишок (0,75 г, 55%) очищають за допомогою колоночної хроматографії на кромасилі (10 мкм) (елюент: DCM/MeOH/NH4OH 96/4/0,5). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,625 г проміжної сполуки 84. Цей продукт використовують безпосередньо на наступній стадії реакції. Приклад A15 a) Одержання проміжної сполуки 85 4-Піперидинметанамін (0,65 моль) і карбонат калію (96 г) перемішують в ацетонітрилі (1000 мл), а потім додають розчин етилового ефіру 2(метилсульфоніл)-5-піримідинкарбонової кислоти (0,37 моль) в ацетонітрилі (500 мл), по краплях, при кімнатній температурі, протягом 1 години. Реакційну суміш перемішують протягом ночі при кімнатній температурі, і розчинник випарюють. Залишок перемішують у воді, і суміш екстрагують DCM (2x500 мл). Органічний шар відокремлюють, промивають водою, сушать (MgSO4), відфільтровують, і розчинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (елюент 1: EtOAc/гексан 1/1; елюент 2: MeOH+невелика кількість NH4OH). Фракції продукту збирають, перемішують із суспензією карбонату калію, і суміш екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), відфільтровують і розчинник випарюють, з одержанням 31 г (32 %) проміжної сполуки 85. 56 Приклад A16 a) Одержання проміжної сполуки 86 Гідрид натрію (0,0095 моль) додають при 5°C до розчину 5-хлор-1H-індол-3-карбоксальдегіду (0,0056 моль) у THF (52 мл), у потоці N2. Суміш перемішують при 0°C протягом 1 години. Додають 1-йодопропан (0,0067 моль). Суміш перемішують при кімнатній температурі протягом 2 днів, виливають у воду й екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють, з одержанням 1,5 г проміжної сполуки 86. Цей продукт використовують безпосередньо на наступній стадії реакції. b) Одержання проміжної сполуки 87 Натрій ціаноборгідрид (0,0068 моль) і оцтову кислоту (0,0046 моль) додають при кімнатній температурі до розчину проміжної сполуки 85 (0,0042 моль) і проміжної сполуки 86 (0,0051 моль) у MeOH (120 мл), у потоці N2. Суміш перемішують і нагрівають зі зворотним холодильником протягом 2 днів, потім охолоджують до кімнатної температури, виливають у карбонат калію 10% і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (2,42 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,2). Чисті фракції збирають, і розчинник випарюють, з одержанням 1,2 г (60%) проміжної сполуки 87. c) Одержання проміжної сполуки 88 Суміш проміжної сполуки 87 (0,0025 моль) і гідроксиду натрію (0,01 моль) у EtOH (120 мл) перемішують і нагрівають зі зворотним холодильником протягом 4 годин, потім випарюють насухо. Залишок поміщають у діетиловий ефір. Осад відфільтровують і сушать, з одержанням 0,845 г (72%) проміжної сполуки 88, температура плавлення >260°C. d) Одержання проміжної сполуки 89 57 93352 58 температури, виливають у воду з льодом і екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1,88 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: DCM/MeOH/NH4OH 97/3/0,1). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,15 г (7%) проміжної сполуки 91. c) Одержання проміжної сполуки 92 EDC (0,0036 моль) і HOBt (0,0036 моль) додають при кімнатній температурі до розчину проміжної сполуки 88 (0,0018 моль) у THF (90 мл) і DCM (90 мл), у потоці N2. Суміш перемішують протягом 30 хвилин. Додають O-(тетрагідро-2H-піран-2іл)гідроксиламін (0,0036 моль). Суміш перемішують при кімнатній температурі протягом 3 днів, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (1,3 г) очищають за допомогою колоночної хроматографії на силікагелі (15-40 мкм) (елюент: Суміш проміжної сполуки 91 (0,0003 моль) у гіDCM/MeOH/NH4OH 92/8/0,5). Чисті фракції збирадроксиді натрію (0,0014 моль) і EtOH (20 мл) пеють, і розчинник випарюють, з одержанням 0,54 г ремішують і нагрівають зі зворотним холодильни(56%) проміжної сполуки 89. ком протягом одного дня, потім охолоджують до Приклад A17 кімнатної температури і випарюють насухо. Залиa) Одержання проміжної сполуки 90 шок поміщають у діетиловий ефір. Осад відфільтровують і сушать, з одержанням 0,12 г (82%) проміжної сполуки 92, температура плавлення >260°C. d) Одержання проміжної сполуки 93 Метансульфонілхлорид (0,004 моль) додають при 10°C до розчину 1,2-диметил-1H-індол-3етанолу (0,0026 моль) і триетиламіну (0,008 моль) у DCM (10 мл), у потоці N2. Суміш перемішують при 10°C протягом 4 годин. Розчинник випарюють насухо, з одержанням проміжної сполуки 90. Цей продукт використовують безпосередньо на наступній стадії реакції. b) Одержання проміжної сполуки 91 Суміш проміжної сполуки 85 (0,0054 моль), проміжної сполуки 90 (0,0075 моль) і карбонату калію (0,021 моль) в ацетонітрилі (150 мл) перемішують і нагрівають зі зворотним холодильником протягом 2 днів, потім охолоджують до кімнатної EDC (0,0005 моль) і HOBt (0,0005 моль) додають при кімнатній температурі до розчину проміжної сполуки 92 (0,0002 моль) у THF (15 мл) і DCM (15 мл). Суміш перемішують протягом 15 хвилин. Додають O-(тетрагідро-2H-піран-2-іл)гідроксиламін (0,0005 моль). Суміш перемішують при кімнатній температурі протягом 4 днів, виливають у воду з льодом і екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, і розчинник випарюють. Залишок (0,14 г) очищають за допомогою колоночної хроматографії на силікагелі (10 мкм) (елюент: DCM/MeOH/NH4OH 95/5/0,3). Чисті фракції збирають, і розчинник випарюють, з одержанням 0,035 г (25%) проміжної сполуки 93. В таблиці F-1 перераховані проміжні сполуки, отримані відповідно до одного з вищевказаних прикладів. 59 93352 60 Таблиця F-1 (проміжні сполуки) Пром. Спол. 1; Прикл. [A1] Пром. Спол. 2; Прикл. [A1]; тп. >260°C Пром. Спол. 3; Прикл. [A1]; тп. 70°C Пром. Спол. 7; Прикл. [A2] Пром. Спол. 10; Прикл. [A3] .Na; Пром. Спол. 11; Прикл. [A3]; тп. >260°C Пром. Спол.12; Прикл. [A3]; тп. 154°C Пром. Спол. 13; Прикл. [A4]; тп. 238°C Пром. Спол. 14; Прикл. [A4] .Na; Пром. Спол. 15; Прикл. [A4] .Na; Пром. Спол. 16; Прикл. [A4] Пром. Спол. 17; Прикл. [A4] Пром. Спол. 18; Прикл. [A1]; тп. 109°C Пром. Спол. 19; Прикл. [A1] .Na; Пром. Спол. 20; Прикл. [A1] Пром. Спол. 21; Прикл. [A1]; тп. 70°C
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted indolyl alkyl amino derivatives as novel inhibitors of histone deacetylase
Автори англійськоюVerdonck Marc Gustaaf Celine, Angibaud Patrick Rene, Roux Bruno, Pilatte Isabelle Noelle Constance, Ten Holte Peter, Arts Janine, van Emelen Kristof
Назва патенту російськоюПроизводные замещенного индолилалкиламино kak ингибиторы гистондеацетилазы
Автори російськоюВердонк Марк Густааф Селин, Анжибо Патрик Рене, Рю Бруно, Пилатт Изабель Ноэль Констанс, Тен Хольте Петер, Артс Жанин, ван Эмелен Кристоф
МПК / Мітки
МПК: A61P 35/00, A61K 31/506, C07D 401/14, C07D 409/14, C07D 405/14
Мітки: індолілалкіламіно, заміщеного, інгібітори, похідні, гістондеацетилази
Код посилання
<a href="https://ua.patents.su/55-93352-pokhidni-zamishhenogo-indolilalkilamino-yak-ingibitori-gistondeacetilazi.html" target="_blank" rel="follow" title="База патентів України">Похідні заміщеного індолілалкіламіно як інгібітори гістондеацетилази</a>
Попередній патент: Похідні фталазіну як інгібітори parp
Випадковий патент: Спосіб прогнозування зрощення перелому












