Похідні нітрометилтіобензолу як інгібітори альдегідредуктази, спосіб їх отримання (варіанти) та фармацевтична композиція
Номер патенту: 56205
Опубліковано: 15.05.2003
Автори: Ларді Клод, Дюмаз Іве, Дюрбен Філіп, Коллопжес Франсуа
Формула / Реферат
1. Похідні нітрометилтіобензолу загальної формули 1
(1) ,
у якій:
Р означає
радикал (і): -(CO-NH)m-SO2-R;
радикал (іі):
або радикал (ііі):
,
R означає радикал, обраний з фенілу, бензилу, дифенілметилу, нафтилу, циклоалкілалкілу, у якому алкільна частина є С1-С4, а циклоалкільна частина є С3-С7, та стирилу, причому зазначений радикал є необов'язково заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом,
R означає С3-С5 ароматичний гетероциклічний радикал, що включає 1 або 2 гетероатоми, обрані з О, S та N, причому зазначений радикал є необов'язково заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, і необов'язково сконденсований з 1 або 2 фенільними кільцями, необов'язково заміщеними однією чи кількома групами Z, які можуть бути однаковими чи різними;
або, за іншим варіантом,
R означає С1-С4-алкіл, необов'язково заміщений одним чи кількома атомами галогену, які можуть бути однаковими чи різними, С3-С7-циклоалкіл або цикло(С3-С7)алкіл(С1-С4)алкіл,
Z обирають з атома галогену, С1-С4-алкілу, С1-С4-алкоксигрупи, нітрогрупи, ціаногрупи, трифторметилу, трифторметоксигрупи, (С2-С5)алкіламіногрупи, (С1-С4)алкілсульфонілу, (С1-С4)алкілтіогрупи та фенільної групи;
Х означає водень чи атом галогену;
m дорівнює 0 чи 1;
n дорівнює 0, 1 чи 2;
Т1 та Т2 означають, незалежно один від одного, атом водню чи С1-С4-алкільну групу,
u дорівнює 0 чи 1;
А означає С1-С8-алкілен або групу
,
у є ціле число, обране з 0, 1, 2, 3 та 4; вважається, що коли Р означає радикал (іі), А може також означати зв'язок;
їх таутомерні форми та їх солі приєднання з фармацевтично прийнятними основами.
2. Сполуки формули 1 за п.1, які відрізняються тим, що
Р означає -(CO-NH)m-SO2-R,
R означає радикал, обраний з фенілу, дифенілметилу, нафтилу та стирилу, причому зазначений радикал є необов'язково заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R означає С3-С5 ароматичний гетероциклічний радикал, що включає 1 або 2 гетероатоми, обрані з О, S та N, причому зазначений радикал є необов'язково заміщеним однією чи кількома групами Z, які можуть бути однаковими чи різними, і необов'язково сконденсованим з 1 або 2 фенільними кільцями, необов'язково заміщеними однією чи кількома групами Z, які можуть бути однаковими чи різними;
або, за іншим варіантом,
R означає С1-С4-алкіл, необов'язково заміщений одним чи кількома атомами галогену, які можуть бути однаковими чи різними, С3-С7-циклоалкіл або цикло(С3-С7)алкіл(С1-С4)алкіл,
Z, X, m та n мають значення, визначені у п.1,
їх таутомерні форми та їх солі приєднання з фармацевтично прийнятними основами.
3. Сполуки формули 1 за п.1, які відрізняються тим, що
Р означає -(CO-NH)m-SO2-R,
R означає феніл; феніл, заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними; бензил; бензил, заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними; С1-С4-алкіл, необов'язково заміщений одним чи кількома атомами галогену, які можуть бути однаковими чи різними; С3-С7-циклоалкіл; цикло(С3-С7)алкіл(С1-С4)алкіл; стирил; тієніл; піридил; нафтил; дибензофурил або дифенілметил;
Z обирають з атому галогену, С1-С4-алкілу, С1-С4-алкоксигрупи, нітрогрупи, трифторметилу, трифторметоксигрупи, (С2-С5)алкіламіногрупи, (С1-С4)алкілсульфонілу та фенільної групи;
X, m та n мають значення, визначені у п.1,
їх таутомерні форми та їх солі приєднання з фармацевтично прийнятними основами.
4. Сполуки формули 1 за будь-яким з пп.1-3, які відрізняються тим, що
Р означає -(CO-NH)m-SO2-R,
R означає феніл; феніл, заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними; бензил; бензил, заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними; метил; С3-С7-циклоалкіл; цикло(С3-С7)алкіл(С1-С4)алкіл; стирил; тієніл; піридил; нафтил; дибензофурил; дифенілметил або 2,2,2-трифторетил;
Z обирають з фтору, хлору, брому, метилу, метоксигрупи, нітрогрупи, трифторметилу, трифторметоксигрупи, ацетамідогрупи, метилсульфонілу та фенілу;
Х означає водень чи хлор;
m та n мають значення, визначені у п.1,
їх таутомерні форми та їх солі приєднання з фармацевтичнo прийнятними основами.
5. Сполуки формули 1 за будь-яким з пп.1, 3 та 4, які відрізняються тим, що
Р означає -(CO-NH)m-SO2-R,
R означає феніл; феніл, заміщений однією чи кількома групами Z, які можуть бути
однаковими чи різними; метил; С3-С7-циклоалкіл; цикло(С3-С7)алкіл(С1-С4)алкіл;
стирил; тієніл; піридил; нафтил; дибензофурил; дифенілметил або 2,2,2-трифторетил;
Z обирають з фтору, хлору, брому, метилу, метоксигрупи, нітрогрупи, трифторметилу, трифторметоксигрупи, ацетамідогрупи, метилсульфонілу та фенілу;
Х означає водень чи хлор;
m та n мають вказані значення,
їх таутомерні форми та їх солі приєднання з фармацевтичнo прийнятними основами.
6. Сполуки формули 1 за будь-яким з пп.1, 3 та 4, обрані з:
N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]бензолсульфонаміду;
3,4-дифтор-N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]бензолсульфонаміду;
3-бром-N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]бензолсульфонаміду;
N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-2-(трифторметил)-бензолсульфонаміду;
N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-4-фторбензолсульфонаміду;
N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-3-фторбензолсульфонаміду;
N-[3,5-димeтил-4-[(нітрометил)сульфоніл]феніл]фенілметансульфoнaмiдy;
2,3-дифтор-N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]бензолсульфонаміду;
3,5-дифтор-N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]бензолсульфонаміду; і
N-[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-2-фторбензолсульфонаміду.
7. Сполуки формули 1 за п.1, які відрізняються тим, що
Р означає
,
А означає зв'язок або С1-С8-алкілен;
u, n, X, Т1 та Т2 мають значення, вказані у п.1;
їх таутомерні форми та їх солі приєднання з фармацевтичнo прийнятними основами.
8. Сполуки формули 1 за п.1, які відрізняються тим, що
Р означає
,
А означає групу
,
n, X, у, Т1 та Т2 мають значення, вказані у п.1;
їх таутомерні форми та їх солі приєднання з фармацевтичнo прийнятними основами.
9. Сполуки формули 1 за п.1, обрані з таких сполук:
N,N'-біс[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-1,5-пентандіамід;
N,N'-біс[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-1,8-октандіамід;
N,N'-біс[4-[(нітрометил)сульфоніл]феніл]-1,5-пентандіамід;
N,N'-біс[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-етандіамід;
N,N'-біс[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-сечовина;
N,N'-біс[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-1,4-бутандіамід;
N,N'-біс[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-1,3-пропандіамід;
N,N'-біс[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-1,3-бензолдисульфонамід;
N,N'-біс[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-1,5-бензолдиметансульфонамід.
10. Спосіб одержання сполук формули 1 за будь-яким з пп.1-6, у яких Р означає -(CO-NH)m-SO2-R, Х означає атом водню, m є нулем і n дорівнює 2, який відрізняється тим, що сполуку формули 2
, 2
у якій Т1 та Т2 мають значення, вказані у п.1, обробляють сульфонілхлоридом формули RSO2Cl, у якій R має значення, вказані у п.1, у присутності основи.
11. Спосіб одержання сполук формули 1 за будь-яким з пп.1-5, у яких Р означає -(CO-NH)m-SO2-R, Х означає атом галогену, m є нулем і n дорівнює 2, який відрізняється тим, що сполуку формули 3
, 3
у якій R, Т1 та Т2мають значення, вказані у п.1, обробляють відповідним N-галосукцинімідом у присутності генератора вільних радикалів, наприклад 2,2'-азобісізобутиронітрилу.
12. Спосіб одержання сполук формули 1 за будь-яким з пп.1-5, у яких Р означає -(CO-NH)m-SO2-R, Х означає атом водню, m дорівнює 1 і n дорівнює 2, який відрізняється тим, що сполуку формули 2
,
2
у якій Т1 та Т2 мають значення, вказані у п.1, обробляють сульфонілізоціанатом формули RSO2NCO, у якому R має значення, вказані у п.1.
13. Спосіб одержання сполук формули 1 за будь-яким з пп.1-5, у яких Р означає -(CO-NH)m-SO2-R, Х означає атом водню, і m та n дорівнюють нулю, який відрізняється тим, що сполуку формули 10
, 10
у якій Т1 та Т2 мають значення, вказані у п.1, обробляють сульфонілхлоридом формули RSO2CI, у якій R має значення, вказані у п.1, у присутності основи.
14. Спосіб одержання сполук формули 1 за будь-яким з пп.1-5, у яких Р означає -(CO-NH)m-SO2-R, Х означає атом водню, m є нулем і n дорівнює 1, який відрізняється тим, що сполуку формули 4
, 4
у якій R, Т1 та Т2 мають значення, вказані у п.1, обробляють окисником, таким як м-хлорбензойна кислота.
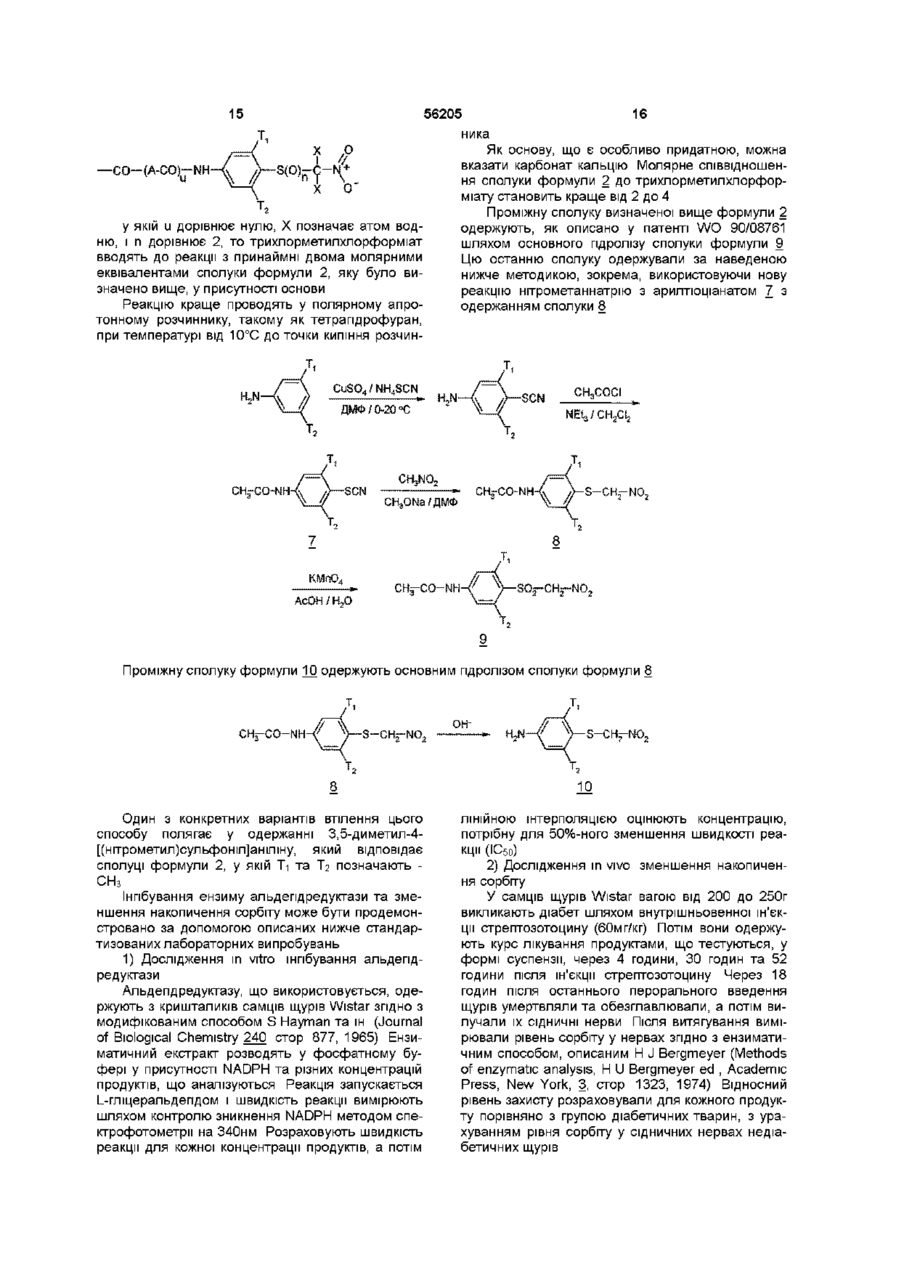
15. Спосіб одержання 3,5-диметил-4-[(нітрометил)сульфоніл]аніліну основним гідролізом N-[3,5-диметил-4-[(нітрометил)тіо]феніл]ацетаміду, який відрізняється тим, що N-[3,5-диметил-4-[(нітрометил)тіо]феніл]ацетамід одержують шляхом проведення реакції нітрометаннатрію формули NaCH2NO2 з 4-ацетамідо-2,6-диметилфенілтіоціанатом.
16. Спосіб одержання сполук формули (1) за будь-яким з пп.1, 7 та 9, у яких Р означає радикал (іі):
,
u дорівнює 1, X означає атом водню і n дорівнює 2, який відрізняється тим, що сполуку формули 2
, 2
у якій Т1 та Т2 є такими, як було визначено у п.1, обробляють дихлоридом формули 5
, 5
у якій А та u мають такі саме значення, як було вказано у п.1, у присутності основи, причому молярне співвідношення сполуки формули 2 до сполуки формули 5 принаймні дорівнює 2.
17. Спосіб одержання сполук формули 1 за будь-яким з пп.1, 8 та 9, у яких Р означає радикал (ііі):
,
Х означає атом водню і n дорівнює 2, який відрізняється тим, що сполуку формули 2
, 2
у якій Т1 та Т2 є такими, як було визначено у п.1, обробляють дихлоридом формули
CI—SO2—A—SO2—CI 6
у присутності основи, причому молярне співвідношення сполуки формули 2 до сполуки формули 6 принаймні дорівнює 2.
18. Спосіб одержання сполук формули 1 за будь-яким з пп.1 та 7, у яких Р означає радикал (іі):
Х означає атом водню, n дорівнює 2 і u дорівнює нулю, який відрізняється тим, що сполуку формули 2
, 2
у якій Т1 та Т2 є такими, як було визначено у п.1, обробляють трихлорметилхлорформіатом у присутності основи, причому молярне співвідношення сполуки формули 2 до трихлорметилхлорформіату принаймні дорівнює 2.
19. Фармацевтична композиція, що включає як активну речовину ефективну кількість принаймні однієї сполуки за будь-яким з пп.1-9, у сполученні з одним чи кількома фармацевтичнo прийнятними носіями.
20. Фармацевтична композиція за п.19, яка відрізняється тим, що вона знаходиться у формі таблеток негайної дії, таблеток пролонгованої дії, желатинових капсул, розчинів для ін'єкції, мазей чи очних крапель.
21. Сполуки за будь-яким з пп.1-9 для виготовлення лікарського продукту, призначеного для інгібування альдегідредуктази.
22. Сполуки за будь-яким з пп.1-9 для виготовлення лікарського продукту, призначеного для лікування діабетичних ускладнень, таких як катаракти, ретинопатії, невропатії, нефропатії та судинні хвороби.
Текст
1 ПОХІДНІ нітрометилтюбензолу загальної формули 1 т. SSOJ-C-N + X О (1), у якій Р означає радикал (і) -(CO-NH)m-SO2-R, радикал (м) — CO—(A-CO), х р S(O); _ А _ _ „ к і -+ х V або радикал (їм) - SO з О, S та N, причому зазначений радикал є необов'язково заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, і необов'язково сконденсований з 1 або 2 фенільними кільцями, необов'язково заміщеними однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R означає Сі-С4-алкіл, необов'язково заміщений одним чи кількома атомами галогену, які можуть бути однаковими чи різними, Сз-С7-циклоалкіл або цикло(Сз- С7)алкіл(С1-С4)алкіл, Z обирають з атома галогену, Сі-С4-алкілу, С1-С4алкоксигрупи, нітрогрупи, ціаногрупи, трифторметилу, трифторметоксигрупи, (СгС5)алкіламшогрупи, (Сі-С4)алкілсульфонілу, ( d С4)алкілтюгрупи та фенільної групи, X означає водень чи атом галогену, m дорівнює 0 чи 1, п дорівнює 0, 1 чи 2, Ті та Тг означають, незалежно один від одного, атом водню чи Сі-С4-алкільну групу, u дорівнює 0 чи 1, А означає Ci-Cs-алкілен або групу - (CHr;v S{O): x V R означає радикал, обраний з фенілу, бензилу, дифенілметилу, нафтилу, циклоалкілалкілу, у якому алкільна частина є С1-С4, а циклоалкільна частина є С3-С7, та стирилу, причому зазначений радикал є необов'язково заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R означає С3-С5 ароматичний гетероциклічний радикал, що включає 1 або 2 гетероатоми, обрані у є ціле число, обране з 0, 1, 2, 3 та 4, вважається, що коли Р означає радикал (м), А може також означати зв'язок, їх таутомерні форми та їх солі приєднання з фармацевтично прийнятними основами 2 Сполуки формули 1 за п 1 , які відрізняються тим, що Р означає -(CO-NH)m-SO2-R, R означає радикал, обраний з фенілу, дифенілметилу, нафтилу та стирилу, причому зазначений радикал є необов'язково заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R означає С3-С5 ароматичний гетероциклічний радикал, що включає 1 або 2 гетероатоми, обрані з О, S та N, причому зазначений радикал є необов'язково заміщеним однією чи кількома групами Z, які можуть бути однаковими чи різними, і необов'язково сконденсованим з 1 або 2 фенільними кільцями, необов'я О ю о (О ю 56205 обрані з І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]бензолсульфонаміду, 3,4-дифтор-І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]бензолсульфонаміду, 3-бром-І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]бензолсульфонаміду, г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-2(трифторметил)-бензолсульфонаміду, г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-4фторбензолсульфонаміду, г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-3фторбензолсульфонаміду, І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]фенілметансульфонаміду, 2,3-дифтор-І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]бензолсульфонаміду, 3,5-дифтор-І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]бензолсульфонаміду, і г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-2фторбензолсульфонаміду 7 Сполуки формули 1 за п 1 , які відрізняються тим, що 4 Сполуки формули 1 за будь-яким з пп 1-3, які Р означає відрізняються тим, що Р означає -(CO-NH)m-SO2-R, X О R означає феніл, феніл, заміщений однією чи кіль-CO-(A-CO)-NH S(O}кома групами Z, які можуть бути однаковими чи різними, бензил, бензил, заміщений однією чи кіX V лькома групами Z, які можуть бути однаковими чи різними, метил, Сз-С7-циклоалкіл, цикло(СзА означає зв'язок або С-і-Сз-алкілен, С7)алкіл(С1-С4)алкіл, стирил, ТІЄНІЛ, піридил, нафи, п, X, Ті та Т 2 мають значення, вказані у п 1, тил, дибензофурил, дифенілметил або 2,2,2їх таутомерні форми та їх солі приєднання з фартрифторетил, мацевтично прийнятними основами Z обирають з фтору, хлору, брому, метилу, меток8 Сполуки формули 1 за п 1 , які відрізняються сигрупи, нітрогрупи, трифторметилу, трифторметим, що токсигрупи, ацетамідогрупи, метилсульфонілу та Р означає фенілу, X означає водень чи хлор, m та п мають значення, визначені у п 1, їх таутомерні форми та їх солі приєднання з фар3(0)—С N SO2—A- SO—NH мацевтично прийнятними основами X 0" 5 Сполуки формули 1 за будь-яким з пп 1, 3 та 4, які відрізняються тим, що А означає групу Р означає -(CO-NH)m-SO2-R, R означає феніл, феніл, заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, метил, Сз-С7-циклоалкіл, цикло(Сз-С7)алкіл(Сі-С4)алкіл, стирил, ТІЄНІЛ, піридил, нафтил, дибензофурил, п, X, у, Ті та Т 2 мають значення, вказані у п 1, дифенілметил або 2,2,2-трифторетил, їх таутомерні форми та їх солі приєднання з фарZ обирають з фтору, хлору, брому, метилу, метокмацевтично прийнятними основами сигрупи, нітрогрупи, трифторметилу, трифторме9 Сполуки формули 1 за п 1, обрані з таких спотоксигрупи, ацетамідогрупи, метилсульфонілу та лук фенілу, г\І,г\Г-біс[3,5-диметил-4X означає водень чи хлор, [(нітрометил)сульфоніл]феніл]-1,5-пентандіамід, m та п мають вказані значення, г\І,г\Г-біс[3,5-диметил-4їх таутомерні форми та їх солі приєднання з фар[(нітрометил)сульфоніл]феніл]-1,8-октандіамід, мацевтично прийнятними основами г\І,М'-біс[4-[(нгфометил)сульфоніл]феніл]-1,56 Сполуки формули 1 за будь-яким з пп 1, 3 та 4, пентандіамід, зково заміщеними однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R означає Сі-С4-алкіл, необов'язково заміщений одним чи кількома атомами галогену, які можуть бути однаковими чи різними, Сз-С7-циклоалкіл або цикло(Сз-С7)алкіл(Сі-С4)алкіл, Z, X, m та п мають значення, визначені у п 1, їх таутомерні форми та їх солі приєднання з фармацевтично прийнятними основами 3 Сполуки формули 1 за п 1 , які відрізняються тим, що Р означає -(CO-NH)m-SO2-R, R означає феніл, феніл, заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, бензил, бензил, заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, Сі-С4-алкіл, необов'язково заміщений одним чи кількома атомами галогену, які можуть бути однаковими чи різними, Сз-С7-циклоалкіл, цикло(Сз-С7)алкіл(Сі-С4)алкіл, стирил, ТІЄНІЛ, піридил, нафтил, дибензофурил або дифенілметил, Z обирають з атому галогену, Сі-С4-алкілу, С1-С4алкоксигрупи, нітрогрупи, трифторметилу, трифторметоксигрупи, (С2-С5)алкіламшогрупи, ( d С4)алкілсульфонілута фенільної групи, X, m та п мають значення, визначені у п 1, їх таутомерні форми та їх солі приєднання з фармацевтично прийнятними основами 56205 6 г\І,г\Г-біс[3,5-диметил-4бляють сульфонілхлоридом формули RSO2CI, у [(нітрометил)сульфоніл]феніл]-етандіамід, якій R має значення, вказані у п 1, у присутності г\|,г\Г-біс[3,5-диметил-4основи [(нітрометил)сульфоніл]феніл]-сечовина, 14 Спосіб одержання сполук формули 1 за будьг\|,г\Г-біс[3,5-диметил-4яким з пп 1 -5, у яких Р означає -(CO-NH)m-SO2-R, X означає атом водню, m є нулем і п дорівнює 1, [(нітрометил)сульфоніл]феніл]-1,4-бутандіамід, який відрізняється тим, що сполуку формули 4 г\|,г\Г-біс[3,5-диметил-4т, [(нітрометил)сульфоніл]феніл]-1,3-пропандіамід, г\|,г\Г-біс[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-1,3R-SO S-CH.-NCK бензолдисульфонамід, М,М'-біс[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-1,5.4 бензолдиметансульфонамід у якій R, Ті та Тг мають значення, вказані у п 1, обробляють окисником, таким як м-хлорбензойна 10 Спосіб одержання сполук формули 1 за будькислота яким з пп 1 -6, у яких Р означає -(CO-NH)m-SO2-R, X 15 Спосіб одержання 3,5-диметил-4означає атом водню, m є нулем і п дорівнює 2, [(нітрометил)сульфоніл]аніліну основним гідроліякий відрізняється тим, що сполуку формули 2 зом І\І-[3,5-диметил-4[(нітрометил)тю]феніл]ацетаміду, який відрізняється тим, що І\І-[3,5-диметил-4pi І , , М А ^* *Г^ 2 [(нітрометил)тю]феніл]ацетамід одержують шляхом проведення реакції нітрометаннатрію формули NaCH2NO2 з 4-ацетамідо-2,6•2 f 2 диметилфенілтюціанатом у якій Ті та Тг мають значення, вказані у п 1, обробляють сульфонілхлоридом формули RSO2CI, у 16 Спосіб одержання сполук формули (1) за будьякій R має значення, вказані у п 1, у присутності яким з пп 1, 7 та 9, у яких Р означає радикал (м) основи Т, 11 Спосіб одержання сполук формули 1 за будь_ х яким з пп 1 -5, у яких Р означає -(CO-NH)m-SO2-R, X -СО-(А-СО) означає атом галогену, m є нулем і п дорівнює 2, який відрізняється тим, що сполуку формули З SO.—СНт-NO, у якій R, Ті та Тгмають значення, вказані у п 1, обробляють ВІДПОВІДНИМ N-галосукцинімідом у присутності генератора вільних радикалів, наприклад 2,2'-азобісізобутиронітрилу 12 Спосіб одержання сполук формули 1 за будьяким з пп 1 -5, у яких Р означає -(CO-NH)m-SO2-R, X означає атом водню, m дорівнює 1 і п дорівнює 2, який відрізняється тим, що сполуку формули 2 т. u дорівнює 1, X означає атом водню і п дорівнює 2, який відрізняється тим, що сполуку формули 2 у якій Ті та Тг є такими, як було визначено у п 1, обробляють дихлоридом формули 5 ПІ—(СП—й'\ —ГСіСЇ ,о у якій А та u мають такі саме значення, як було вказано у п 1, у присутності основи, причому молярне співвідношення сполуки формули 2 до сполуки формули 5 принаймні дорівнює 2 17 Спосіб одержання сполук формули 1 за будьяким з пп 1, 8 та 9, у яких Р означає радикал (їм) т, у якій Ті та Тг мають значення, вказані у п 1, обробляють сульфонілізоціанатом формули RSO2NCO, у якому R має значення, вказані у п 1 13 Спосіб одержання сполук формули 1 за будьяким з пп 1 -5, у яких Р означає -(CO-NH)m-SO2-R, X означає атом водню, і m та п дорівнюють нулю, який відрізняється тим, що сполуку формули 10 2 ,10 у якій Ті та Тг мають значення, вказані у п 1, обро .SO__A_SO N H X ,0 S(O)-CX О" X означає атом водню і п дорівнює 2, який відрізняється тим, що сполуку формули 2 у якій Ті та Тг є такими, як було визначено у п 1, обробляють дихлоридом формули 56205 8 сутності основи, причому молярне співвідношення сполуки формули 2 дотрихлорметилхлорформіату принаймні дорівнює 2 19 Фармацевтична композиція, що включає як активну речовину ефективну КІЛЬКІСТЬ принаймні однієї сполуки за будь-яким з пп 1-9, у сполученні з одним чи кількома фармацевтично прийнятними т. носіями 20 Фармацевтична композиція за п 19, яка відрізняється тим, що вона знаходиться у формі таблеток негайної дії, таблеток пролонгованої дії, желатинових капсул, розчинів для ін'єкції, мазей чи X означає атом водню, п дорівнює 2 і u дорівнює очних крапель нулю, який відрізняється тим, що сполуку фор21 Сполуки за будь-яким з пп 1-9 для виготовленмули 2 ня лікарського продукту, призначеного для інгібування альдепдредуктази 22 Сполуки за будь-яким з пп 1-9 для виготовлення лікарського продукту, призначеного для лікування діабетичних ускладнень, таких як катаракти, ретинопатії, невропати, нефропатії та судинні хвороби у якій Ті та Тг є такими, як було визначено у п 1, обробляють трихлорметилхлорформіатом у приСІ—SO2—A—SO2—СІ 6 у присутності основи, причому молярне співвідношення сполуки формули 2 до сполуки формули 6 принаймні дорівнює 2 18 Спосіб одержання сполук формули 1 за будьяким з пп 1 та 7, у яких Р означає радикал (м) Даний винахід стосується нових похідних нітрометилтюбензолу, способів їх одержання та їх лікарського застосування, зокрема, у лікуванні чи профілактиці діабетичних ускладнень Діабет характеризується високою концентрацією глюкози у крові Ця глюкоза звичайно перетворюється у ході обміну речовин ензимом гексокіназою на першій стадії гліколізу, що призводить до и деградації до пірувату Якщо концентрація глюкози занадто висока, гексокіназа стає насиченою і починає діяти другий шлях метаболізму глюкози, це полюльний шлях, у якому беруть участь по черзі два ензими альдепдредуктаза, яка перетворює глюкозу на сорбіт, і L-ідітодепдрогеназа, яка перетворює сорбіт на фруктозу У випадку діабету надлишок глюкози прискорює утворення сорбіту, який має тенденцію до накопичення Це призводить до серйозних метаболічних порушень, таких як, наприклад, підвищення осмотичного тиску, яке може призвести до дегенерації тканин Інгібітори альдепдредуктази є, таким чином, корисними для лікування чи профілактики деяких з ускладнень, викликаних діабетом Багато продуктів описано у літературі як інгібітори альдепдредуктази, що є активними in vitro та in vivo Вони є переважно похідними пдантошу, сукцинімідами та оцтовими кислотами Останнім часом, з'явились ПОХІДНІ (фенілсульфоніл)нітрометану, описані у європейському патенті №304190 і, зокрема, сполука 3,5-диметил-4[(нітрометил)сульфоніл]анілін, описана у патенті WO 90/08761 Ця сполука генерувала кілька рядів похідних, таких як продукти N-ацилювання, описані у європейському патенті №469887, і (оксамідота уреідо-фенілсульфоніл)-нітрометани, описані у європейському патенті №469889 Даний винахід стосується похідних нітрометилтюбензолу, що відповідають загальній формулі 1_ (1) у якій Р позначає радикал (і) -(CO-NH)m-SO2-R, радикал (м) R позначає радикал, обраний з фенілу, бензилу, дифенілметилу, нафтилу, циклоалкілалкілу, у якому алкільна частина є С1-С4, а циклоалкільна частина є С3-С7, та стирилу, причому зазначений радикал є необов'язково заміщеним однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R позначає С3-С5 ароматичний гетероциклічний радикал, що включає 1 або 2 гетероатоми, обрані з О, S та N, причому зазначений радикал є необов'язково заміщеним однією чи кількома групами Z, які можуть бути однаковими чи різними, і необов'язково сконденсованим з 1 або 2 фенільними кільцями, необов'язково заміщеними однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R позначає Сі-С4-алкіл, необов'язково замі 56205 10 Алкоксильна група ВІДПОВІДНО позначає групу алщении одним чи кількома атомами галогену, які кіл-О-, у якій алкіл має вказане вище значення можуть бути однаковими чи різними, С3-С7Як Сз-Сб-ароматичні гетероцикли, що включациклоалкіл або цикло(Сз-С7)алкіл(СІ-С4)алкіл, ють 1 або 2 гетероатоми, обрані з О, S та N, можZ обирають з атому галогену, Сі-С4-алкілу, d на назвати фуран, тюфен, пірол, оксазол, тіазол, С4-алкоксигрупи, нітрогрупи, ціаногрупи, трифторімідазол, піразол, ізоксазол, ізотіазол, піридин, метилу, трифторметоксигрупи, (Сгпіридазин, піримідин та піразин, перевага надаєтьС5)алкіламшогрупи, (Сі-С4)алкілсульфонілу, ( d ся піридину та тюфену С4)алкілтюгрупи та фенільної групи, X позначає водень чи атом галогену, У даному опису термін «галоген» позначає атом фтору, брому, хлору чи йоду m дорівнює 0 чи 1, п дорівнює 0, 1 чи 2, Прикладами циклоалкільних груп є циклопроТі та Тг позначають, незалежно один від однопільна, циклобутильна, циклопентильна та циклого, атом водню чи Сі-С4-алкільну групу, гексильна групи Згідно з винаходом, циклоалкілалкільна група позначає алкільну групу, заміщену u дорівнює 0 чи 1, циклоалкільною групою Термін «алкіленовий раА позначає С-і-Сз-алкілен або групу дикал» стосується насиченого ланцюга на основі ЛІНІЙНОГО чи розгалуженого двовалентного вуглеводню, такого як -СН2-, -СН2-СН2-СН2- чи -СНгСН(СН3)-СН2де у є цілим числом, обраним з 0, 1, 2, 3 та 4, Група формули вважається, що коли Р позначає радикал (м), А може також позначати зв'язок, їх таутомерних форм та їх солей приєднання з фармацевтично прийнятними основами Термін «Сі-С4-алкіл» позначає радикал на освідповідає одній з таких формул нові ЛІНІЙНОГО чи розгалуженого насиченого вуглеводню, який включає від 1 до 4 атомів вуглецю — (СН у яких у позначає 0, 1, 2, 3 чи 4 Згідно З винаходом, якщо Р позначає радикал (м) формули Т, -СО-(АгСО)—NH X О А обирають із зв'язку, Сі-Сб-алкіленового радикалу, і групи формули ;сн2)4 у якій у є цілим числом, обраним з 0, 1, 2, 3 та Навпаки, якщо Р є -(CO-NH)m-SO2-R або радикалом (мі) формули -SO—A~SO~NH -S(O)-C-N + п і X \ О" то А обирають з Сі-Сб-алкілевового радикалу, і групи формули у якій у є цілим числом, обраним з 0, 1, 2, 3 та Можливі таутомерні форми сполук формули 1 _ є невіддільною частиною винаходу Солі приєднання з фармацевтично прийнятними основами сполук формули 1, у яких X є атомом водню, і п дорівнює 1 або 2, також є невіддільною частиною даного винаходу, наприклад, солі лужного чи лужноземельного металу, такі як сіль натрію, калію, кальцію чи магнію, сіль алюмінію, сіль амонію або сіль органічної основи, яка має фармацевтично прийнятний катіон Перша група сполук, яким надається перевага, складається зі сполук формули 1, у яких Р позначає -(CO-NH)m-SO2-R, R позначає радикал, обраний з фенілу, дифенілметилу, нафтилу та стирилу, причому зазначений радикал є необов'язково заміщеним однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R позначає С3-С5 ароматичний гетероциклічний радикал, що включає 1 або 2 гетероатоми, обрані з О, S та N, причому зазначений радикал є необов'язково заміщеним однією чи кількома групами Z, які можуть бути однаковими чи різними, і необов'язково сконденсованим з 1 або 2 фенільними кільцями, необов'язково заміщеними однією чи кількома групами Z, які можуть бути однаковими чи різними, або, за іншим варіантом, R позначає Сі-С4-алкіл, необов'язково заміщений одним чи кількома атомами галогену, які можуть бути однаковими чи різними, С3-С7циклоалкіл або цикло(Сз-С7)алкіл(Сі-С4)алкіл, Z, X, m та п мають значення, визначені вище для формули (1) Друга група сполук, яким надається перевага, 12 11 56205 включає сполуки формули 1, у яких Р позначає Р позначає -(CO-NH)m-SO2-R, R позначає феніл, феніл, заміщений однією чи кількома групами Z, які можуть бути однаковими чи різними, бензил, бензил, заміщений однією чи X О" кількома групами Z, які можуть бути однаковими чи різними, Сі-С4-алкіл, необов'язково заміщений одним чи кількома атомами галогену, які можуть А позначає групу бути однаковими чи різними, Сз-С7-циклоалкіл, цикло(Сз-С7)алкіл(Сі-С4)алкіл, стирил, ТІЄНІЛ, піридил, нафтил дибензофурил, або дифенілметил, Z обирають з атому галогену, Сі-С4-алкілу, d n, X, у, Ті та Тг мають значення, вказані вище С4-алкоксигрупи, нітрогрупи, трифторметилу, тридля формули (1) фторметоксигрупи, (С2-С5)-алкіламшогрупи, ( d Найкращими сполуками є такі С4)-алкілсульфонілута фенільної групи, І\І-[3,5-диметил-4X, m та п мають значення, визначені вище для [(нітрометил)сульфоніл]феніл]бензолсульфонамід, формули (1) 3,4-дифтор-І\І-[3,5-диметил-4Поміж ЦІЄЇ другої групи сполук, яким надається [(нітрометил)сульфоніл]феніл]бензолсульфонамід, перевага, особлива перевага надається сполукам, 3-бром-Ы-[3,5-диметил-4у яких [(нітрометил)сульфоніл]феніл]бензолсульфонамід, Р позначає -(CO-NH)m-SO2-R, І\І-[3,5-диметил-4R позначає феніл, феніл, заміщений однією чи [(нітрометил)сульфоніл]феніл]-2-(трифторметил)кількома групами Z, які можуть бути однаковими бензолсульфонамід, чи різними, бензил, бензил, заміщений однією чи І\І-[3,5-диметил-4які можуть бути однаковими кількома групами Z [(нітрометил)сульфоніл]феніл]-4чи різними, метил Сз-С7-циклоалкіл, цикло(Сзфторбензолсульфонамід, С7)алкіл(С1-С4)алкіл, стирил, ТІЄНІЛ, піридил, нафІ\І-[3,5-диметил-4тил, дибензофурил, дифенілметил, або 2,2,2[(нітрометил)сульфоніл]феніл]-3трифторетил, фторбензолсульфонамід, Z обирають з фтору, хлору, брому, метилу, Ы-[3,5-диметил-4метоксигрупи, нітрогрупи, трифторметилу, три[(нітромефторметоксигрупи, ацетамідогрупи, метилсульфотил)сульфоніл]феніл]фенілметансульфонамід, нілута фенілу, 2,3-дифтор-М-[3,5-диметил-4X позначає водень чи хлор, [(нітрометил)сульфоніл]феніл]бензолсульфонамід, m та п мають значення, визначені вище для 3,5-дифтор-М-[3,5-диметил-4формули (1) [(нітрометил)сульфоніл]феніл]бензолсульфонамід, Третя група сполук, яким надається перевага, і складається зі сполук формули 1, у яких Ы-[3,5-диметил-4Р позначає -(CO-NH)m-SO2-R, [(нітрометил)сульфоніл]феніл]-2R позначає феніл, феніл, заміщений однією чи фторбензолсульфонамід, кількома групами Z, які можуть бути однаковими а також такі сполуки чи різними, метил, Сз-С7-циклоалкіл, цикло(Сзг\І,г\Г-біс[3,5-диметил-4С7) ал кіл (С1-С4) алкіл, стирил, ТІЄНІЛ, піридил, наф[(нітрометил)сульфоніл]феніл]-1,5-пентандіамід, тил, дибензофурил, дифенілметил, або 2,2,2М,М'-біс[3,5-диметил-4трифторетил, [(нітрометил)сульфоніл]феніл]-1,8-октандіамід, Z обирають з фтору, хлору, брому, метилу, М,М'-біс[4-[(нітрометил)сульфоніл]феніл]-1,5метоксигрупи, нітрогрупи, трифторметилу, трипентандіамід, фторметоксигрупи, ацетамідогрупи, метилсульфоМ,М'-біс[3,5-диметил-4нілута фенілу, [(нітрометил)сульфоніл]феніл]-етандіамід, X позначає водень чи хлор, г\І,г\Г-біс[3,5-диметил-4m та п мають значення, визначені вище для [(нітрометил)сульфоніл]феніл]-сечовина, формули (1) М,М'-біс[3,5-диметил-4Четверта група сполук, яким надається пере[(нітрометил)сульфоніл]феніл]-1,4-бутандіамід, вага, складається зі сполук формули 1, у яких М,М'-біс[3,5-диметил-4Р позначає [(нітрометил)сульфоніл]феніл]-1,3-пропандіамід, М,М'-біс[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-1,3-CO -(A-CO)-NH ЗД-Сбензолдісульфонамід, М,М'-біс[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-1,5-бензолдіметансульфонамід А позначає зв'язок чи С-і-Сз-алкілен, Сполуки за даним винаходом одержують таи, п, X, Ті та Тг мають значення, вказані вище кими способами для формули (1) (А) Якщо Р позначає -(CO-NH)m-SO2-R, X поП'ята група сполук, яким надається перевага, значає атом водню, m дорівнює 0 і п дорівнює 2, складається зі сполук формули 1, у яких 14 13 56205 то сульфонілхлорид формули RSO2CI, у якій R (Е) Якщо Р позначає -(CO-NH)m-SO2-R, X позначає атом водню, m дорівнює 0 і п дорівнює 1, має вказані вище значення, вводять до реакції зі то окисник, такий як м-хлорпербензойну кислоту, сполукою формули 2, вводять до реакції зі сполукою формули 4 R-SO—NH у якій Ті та Тг мають значення, визначені вище Для (1), у присутності придатної основи Реакцію краще проводять у розчиннику, наприклад, полярному апротонному розчиннику, такому як тетрапдрофуран, при температурі від 10°С до точки кипіння розчинника Як основи, що є особливо придатними, можна вказати карбонат кальцію (спосіб А1) або піридин (спосіб А2) (В) Якщо Р позначає -(CO-NH)m-SO2-R, X є атомом галогену, краще хлору, m дорівнює 0 і п дорівнює 2, то ВІДПОВІДНИЙ N-галосукцинімід вводять до реакції зі сполукою формули З R-SO—NH у якій R, Ті та І2 мають значення, визначені вище для (1), у присутності генератора вільних радикалів, наприклад, 2,2'-азобісізобутиронітрилу Реакцію краще проводять у розчиннику, наприклад, галовуглеводні, такому як чотирихлористий вуглець, який підтримують у стані кипіння зі зворотним холодильником (C) Якщо Р позначає -(CO-NH)m-SO2-R, X є атомом водню, m дорівнює 1 і п дорівнює 2, то сульфонілізоціанат формули R-SO2-N=C=O, у якому R має визначені вище значення, вводять до реакції зі сполукою формули 2, яку було визначено вище Реакцію краще проводять у розчиннику, наприклад, галовуглеводні, такому як метиленхлорид, при температурі, яка є близькою до кімнатної температури (D) Якщо Р позначає -(CO-NH)m-SO2-R, X є атомом водню, і m та п дорівнюють 0, то сульфонілхлорид формули RSO2CI, у якій R має визначені вище значення, вводять до реакції зі сполукою формули 1 0 _ 10 у якій Ті та Тг мають значення, визначені для (1), у присутності придатної основи Реакцію краще проводять у розчиннику, наприклад, полярному апротонному розчиннику, такому як тетрапдрофуран, при температурі, близькій до кімнатної температури Особливо придатною основою є, наприклад, карбонат кальцію у якій R, Ті та Тг мають вказані вище значення Процес краще здійснюють у розчиннику, наприклад, хлороформі, при температурі, близької до кімнатної температури (F) Якщо Р позначає радикал (м) формули Т, X ,0 -(A-CO S(O)-C- N 4 X О" о u дорівнює 1, X позначає атом водню і п дорівнює 2, то дихлорид наведеної нижче формули 5 СІ—{CO—AJu—СОСІ 5 вводять до реакції з принаймні двома молярними еквівалентами сполуки формули 2, яку було визначено вище, у присутності основи Реакцію краще проводять у розчиннику, наприклад, полярному апротонному розчиннику, такому як тетрапдрофуран, при температурі від 10°С до точки кипіння розчинника Як основи, що є особливо придатними, можна вказати карбонат кальцію (спосіб F1) або піридин (спосіб F2) Молярне співвідношення сполуки формули 2 до сполуки формули 5 становить краще від 2 до 4 Однак слід розуміти, що більша КІЛЬКІСТЬ ПОХІДНОГО аніліну може бути використана без будь-якого негативного впливу (G) Якщо Р позначає радикал (їм) формули х СА Л—сг*і ми / о X позначає атом водню і п дорівнює 2, то дихлорид наведеної нижче формули 6 CI-SOz-тА-SO2-C! 6 вводять до реакції з принаймні двома молярними еквівалентами сполуки формули 2, яку було визначено вище, у присутності основи У цьому випадку кращими прикладами придатних основ також є карбонат кальцію (спосіб G1) та піридин (спосіб G2) Реакцію краще проводять у полярному апротонному розчиннику при температурі від 10°С до точки кипіння розчинника Звичайно достатньо ввести до реакції від 2 до 4 молярних еквівалентів сполуки формули 2 з дихлоридом формули 6, хоч більша КІЛЬКІСТЬ не зашкодить реакції (Н) Якщо Р позначає радикал (м) формули 15 56205 ника Як основу, що є особливо придатною, можна вказати карбонат кальцію Молярне співвідношення сполуки формули 2 до трихлорметилхлорформіату становить краще від 2 до 4 Проміжну сполуку визначеної вище формули 2 одержують, як описано у патенті WO 90/08761 шляхом основного гідролізу сполуки формули 9 Цю останню сполуку одержували за наведеною нижче методикою, зокрема, використовуючи нову реакцію нітрометаннатрію з арилтюціанатом 7 з одержанням сполуки 8 —CO-(A-CO)-NH X 0 у якій u дорівнює нулю, X позначає атом водню, і п дорівнює 2, то трихлорметилхлорформіат вводять до реакції з принаймні двома молярними еквівалентами сполуки формули 2, яку було визначено вище, у присутності основи Реакцію краще проводять у полярному апротонному розчиннику, такому як тетрапдрофуран, при температурі від 10°С до точки кипіння розчин CuSO4/NH4SCN H.N ДУФ / 0-20 °С 16 SCN HJM СНХОСІ NEWCHXL T, /==\ 4 h CK-GO-NH-A h— SCN V V CH3NO. ——— ' >СН3ОЫа/ДМФ CH,-CO-NH T oUj~bnr j NU, AcOH / H2O Проміжну сполуку формули 1 0 одержують основним гідролізом сполуки формули 8 _ CHr-GO-NH Один з конкретних варіантів втілення цього способу полягає у одержанні 3,5-диметил-4[(нітрометил)сульфоніл]аніліну, який відповідає сполуці формули 2, у якій Ті та Тг позначають СНз Інгібування ензиму альдепдредуктази та зменшення накопичення сорбіту може бути продемонстровано за допомогою описаних нижче стандартизованих лабораторних випробувань 1) Дослідження in vitro інгібування альдепдредуктази Альдепдредуктазу, що використовується, одержують з кришталиків самців щурів Wistar згідно з модифікованим способом S Hayman та ш (Journal of Biological Chemistry 240 crop 877, 1965) Ензиматичний екстракт розводять у фосфатному буфері у присутності NADPH та різних концентрацій продуктів, що аналізуються Реакція запускається L-гліцеральдепдом і швидкість реакції вимірюють шляхом контролю зникнення NADPH методом спектрофотометри на 340нм Розраховують швидкість реакції для кожної концентрації продуктів, а потім он ЛІНІЙНОЮ інтерполяцією оцінюють концентрацію, потрібну для 50%-ного зменшення швидкості реакції (ІС5о) 2) Дослідження in vivo зменшення накопичення сорбіту У самців щурів Wistar вагою від 200 до 250г викликають діабет шляхом внутрішньовенної ін'єкції стрептозотоцину (бОмг/кг) Потім ВОНИ одержують курс лікування продуктами, що тестуються, у формі суспензії, через 4 години, ЗО годин та 52 години після ін'єкції стрептозотоцину Через 18 годин після останнього перорального введення щурів умертвляли та обезглавлювали, а потім вилучали їх СІДНИЧНІ нерви Після витягування вимірювали рівень сорбіту у нервах згідно з ензиматичним способом, описаним Н J Bergmeyer (Methods of enzymatic analysis, H U Bergmeyer ed , Academic Press, New York, 3, crop 1323, 1974) Відносний рівень захисту розраховували для кожного продукту порівняно з групою діабетичних тварин, з урахуванням рівня сорбіту у сідничних нервах недіабетичних щурів 56205 18 17 Як приклад, у таблиці нижче наведено резульнова кислота, пропіленгліколь, карбопол тати, отримані для деяких з продуктів, що тестуваКомпозиція ОЧНИХ лись крапель Активний інгредієнт 15мг Наповнювачі хлорид натрію, бензалконій хлорид, Захист проти підІнгібування вищення рівня сорвода для ІН'ЄКЦІЙ Продукти альдегід редукбіту (%) Приклад № тази in vitro IC50 (5мг/кг/день пероНаведені нижче приклади ілюструють винахід, (нМ) рально) не обмежуючи його У даних ядерного магнітного резонансу (ЯМР) 1 8 65 було використано такі скорочення с - синглет, д 10 7 66 дублет, т - триплет, кв - квартет і м - складний му13 8 70 1 льтиплет, ХІМІЧНІ зсуви 5 наведено у млн 14 7 70 Приклад 1 (спосіб А1) 24 8 80 І\І-[3,5-диметил-425 7 85 [(нітрометил)сульфоніл]феніл-бензолсульфонамід 26 6 104 7,85г (78,4ммоль) карбонату кальцію та 7,45мл 29 7 71 (58,4ммоль) бензолсульфонілхлориду додають по ЗО 8 87 черзі до суміші 9,5г (38,9ммоль) 3,5-диметил-434 9 69 [(нітрометил)сульфоніл]аніліну у 180мл тетрапдрофурану, яку витримують під атмосферою азоту Сполуки за винаходом можуть бути викорисРеакційне середовище кип'ятять зі зворотним хотані як лікарські продукти як інгібітори альдепдрелодильником протягом 8 годин Після додання дуктази і, зокрема, у лікуванні діабетичних усклад2,5мл (19,6ммоль) бензолсульфонілхлориду кип'янень, таких як катаракти, ретинопатії, невропати, тіння зі зворотним холодильником триває протянефропатії та певні судинні хвороби гом 6 годин Додають ще 2,5мл (19,6ммоль) бензолсульфонілхлориду і продовжують кип'ятити Ці лікарські продукти можуть бути введені пепротягом 22 годин Після охолодження, реакційну рорально у формі таблеток негайної чи подовжесуміш виливають до 600мл води і екстрагують меної дії, желатинових капсул чи гранул, внутрішньотиленхлоридом Ці об'єднані органічні екстракти венно у формі розчину для ІН'ЄКЦІЙ, висушують над сульфатом натрію і концентрують трансдермально у формі адгезійних трансдермадо сухого залишку під зниженим тиском Одержальних засобів, або локально у формі очних краний пастоподібний залишок очищають хроматогпель, розчину, мазі чи гелю рафією на колонці з силікагелем (елюент метиАктивний інгредієнт змішують з різними фарленхлорид) та перекристалізацією з суміші гексану мацевтичними наповнювачами Денна доза може та метиленхлориду, одержуючи 6,2г (41%) N-[3,5змінюватись від 5мг до 200мг активного інгредієндиметил-4-[(нітрометил)сульфоніл]фенілбензолта сульфонаміду Нижче як необмежуючі приклади наведено ряд фармацевтичних композицій Т пл = 129 -131 °С (гексан/метиленхлорид) Елементарний аналіз C15H16N2O6S2 (M = Композиція таблетки 384,41) негайної дії С, % н> ™ N, % S, % Активний інгредієнт ЮОмг розраховано 46,86 4.,20 7.,29 16,68 Наповнювачі лактоза, крохмаль пшениці, ПОЛІВІзнайдено 47,16 4,,14 7.,38 16,87 дон, тальк, стеарат магнію ІЧ v = 3241, 1594, 1558, 1474. 1349. 1322 8. . 1 Композиція таблетки 1160, 1140, 1090,601см 1 подовженої дії Н ЯМР (ДМСО-de) 5 = 2,52 (6Н, с), 6,50 (2Н, с, Активний інгредієнт ЮОмг обмінюється з CF3COOD), 7,04 (2Н, с), 7,63 - 7,72 Наповнювачі лактоза, ПОЛІВІДОН, тальк, стеарат (ЗН, м), 7,94-7,97 (2Н, м), 11,16 (1Н, с, обмінюєтьмагнію, полімер (похідне целюлози або похідне ся з CF3COOD) акрилових та метакрилових полімерів або похідне Вихідний матеріал 3,5-диметил-4ВІНІЛЬНОГО або гліцеридного полімеру) [(нітрометил)сульфоніл]анілін одержують шляхом Композиція желатипроведення, по черзі, описаних нижче стадій з 1 по нової капсули 5 Активний інгредієнт ЮОмг Стадія 1 Наповнювачі лактоза, крохмаль пшениці, ПОЛІВІ251,2г (З.ЗОмоль) тюціанату амонію швидко дон, тальк, стеарат магнію додають до розчину 121,2г (1 моль) 3,5Композиція ампули диметиланіліну у 1,75л безводного N,Nрозчину для ІН'ЄКЦІЙ диметилформаміду, який витримують під атмосАктивний інгредієнт 200мг ферою азоту Температура зростає від 18 до 35°С Наповнювачі маніт, вода для ІН'ЄКЦІЙ Через півтори години, після повернення темпераКОМПОЗИЦІЯ мазі тури розчину до кімнатної температури, швидко (склад на 100г мазі) додають 263,3г (1,65моль) безводного сульфату Активний інгредієнт 2г МІДІ Реакційне середовище залишають з переміНаповнювачі самоемульгувальний цетилстеаришуванням при кімнатній температурі на 3 дні, а ловий спирт, цетиларилоктаноат, ніпасол, сорбіпотім виливають до 8л води Доводять рН до 7,5 20 19 56205 шляхом додання 550г (6,55моль) бікарбонату нається з CF3COOD) трію Потім середовище фільтрують, тверду частку Стадія 4 промивають етилацетатом, а рідку частку екстраНагрітий до 50°С розчин 18,6г (118ммоль) пегують етилацетатом Об'єднані органічні рідкі фази рманганату калію у 500мл води швидко додають промивають 500мл води, висушують над сульфадо розчину 10,0г (39,3ммоль) І\І-[3,5-диметил-4том натрію і концентрують до сухого залишку під [(нітрометил)тю]-феніл]ацетаміду у 1л оцтової кизниженим тиском Одержаний пастоподібний заслоти Реакційне середовище витримують при лишок перекристалізовують з 500мл гексану, оде65°С протягом ЗО хвилин, а потім охолоджують до ржуючи 128,8г (72%) 4-амшо-2,6-диметилфенілтюкімнатної температури на льодяній бані Потім ціанату, який використовують на наступній стадії додають насичений водний розчин піросульфіту без додаткової очистки натрію, доки не відбудеться знебарвлення (приблизно 25мл) Суміш виливають до 2,5л води і ІЧ v = 3483, 3382, 2142, 1627, 1591, 1470, 1 перемішують протягом 1 години Тверду речовину, 1435, 1342, 1191,856, 850см 1 що утворилась, відокремлюють фільтрацією, проН ЯМР (ДМСО-de) 5 = 2,58 (6Н, с), 5,86 (2Н, мивають водою і висушують, одержуючи 6,1г с), 6,65 (2Н, с, обмінюється з CF3COOD) (54%) білої твердої речовини, що плавиться при Стадія 2 180 - 182°С, яка складається по суті з N-[3,546,9г (463ммоль) триетиламшу швидко додадиметил-4ють до суміші 75,2г (422ммоль) 4-амшо-2,6-диме[(нітрометил)сульфоніл]феніл]ацетаміду, і яку витилфенілтюціанату у 500мл безводного метиленкористовували на наступній стадії без додаткової хлориду, яку витримують під атмосферою азоту, а очистки потім по краплям додають 32,8г (418ммоль) ацетилхлориду Температура підвищується до 41 °С і ІЧ v = 1677, 1595, 1559, 1534, 1382, 1367, утворюється осад Наступного дня реакційне се1330, 1315, 1260, 1152, 871, 746, 639, 615см 1 1 редовище виливають до 400мл води Нерозчинну Н ЯМР (ДМСО-de) 5 = 2,25 (ЗН, с), 2,71 (6Н, частину ізолюють фільтруванням, промивають с), 6,64 (2Н, с, обмінюється з CF3COOD), 7,68 (2Н, ЮОмл метиленхлориду і висушують Одержують с), 10,48 (1Н, с, обмінюється з CF3COOD), 61,8г (67%) подразливої та сльозоточивої твердої Стадія 5 речовини бежевого кольору, що плавиться при Суміш 13,1г (45,8ммоль) І\І-[3,5-диметил-4204 - 206°С, яка складається по суті з 4-ацетамідо[(нітрометил)сульфоніл]феніл]-ацетаміду та 10,6г 2,6-диметилфенілтюціанату, і яку використовують (265ммоль) гранул гідроксиду натрію у 150мл води на наступній стадії без додаткової очистки витримували при 80°С протягом 1 години Після охолодження реакційне середовище виливають до ІЧ v = 1670, 1595, 1401, 1369, 1325, 1261 см 1 1 850мл води Підкислювання до рН 5 оцтовою кисН ЯМР (ДМСО-de) 5 = 2,08 (ЗН, с), 2,52 (6Н, лотою (біля 20мл) спричинює осадження твердої с), 7,54 (2Н, с), 10,13 (1Н, с, обмінюється з речовини, яку ізолюють фільтрацією Цю тверду CF3COOD) речовину промивають ДВІЧІ 50МЛ ВОДИ І висушуСтадія З ють, одержуючи 10,6г (95%) твердої речовини бе9,4г (174ммоль) метоксиду натрію швидко дожевого кольору, що плавиться при 128 - 130°С, яка дають до розчину 6,95мл (128ммоль) нітрометану складається по суті з 3,5-диметил-4-[(нітромеу 140мл безводного N N-диметилформаміду, який тил)сульфоніл]аніліну, і яку використовують на утримують під атмосферою азоту Температура наступній стадії без додаткової очистки спонтанно підвищується до 35°С, а потім температуру реакційного середовища доводять до 40°С і Аналітичний зразок одержують перекристалівитримують при такій температурі протягом 1 гозацією із суміші гексану та етилацетату дини Після охолодження до кімнатної температуТ пл = 130-132°С ри додають протягом 1 години 20хв по краплям Елементарний аналіз C9H12N2O4S (M = розчин 12,9г (58,6ммоль) 4-ацетамідо-2,6-диме244,26) тилфенілтюціанату у 140мл безводного N,NС, % Н, % N, % S, % диметилформаміду Суміш перемішують протягом розраховано 44,25 4,95 11,47 13,13 20 годин при кімнатній температурі, а потім вилизнайдено 44,24 4,95 11,55 13,15 вають до 1л води Одержаний розчин, при рН біля ІЧ v = 3472, 3374, 1630, 1600, 1550, 1341, 10, промивають ДВІЧІ порціями по 500мл етилаце1317, 1154, 726см 1 1 тату, а потім нейтралізують до рН 7 розведеною Н ЯМР (ДМСО-de) 5 = 2,40 (6Н, с), 6,23 (4Н, с, хлористоводневою кислотою Цей нейтральний обмінюється з CF3COOD), 6,35 (2Н, с) водний розчин екстрагують 4 рази порціями по Приклад 2 (спосіб А2) 500мл етилацетату Органічні екстракти висушуІ\І-[3,5-диметил-4ють над сульфатом натрію і концентрують до сухо[(нітрометил)сульфоніл]феніл]бензолсульфонамід го залишку при зниженому тиску Одержаний тве1,08г (6,11 ммоль) бензолсульфонілхлориду рдий осад очищають хроматографією на колонці з швидко додають до суміші 1,0г (4,09ммоль) 3,5оксидом кремнію (елюент 2/1 метиленхлодиметил-4-[(нітрометил)сульфоніл]анілшу та 0,65г рид/етилацетат), одержуючи 8,3г (56%) твердої (8,22ммоль) висушеного над гідроксидом калію речовини, яка плавиться при 160 - 163°С, що піридину у 19мл безводного тетрапдрофурану, яку складається по суті з І\І-[3,5-диметил-4утримують під атмосферою азоту Реакційне се[(нітрометил)тю]феніл]-ацетаміду редовище перемішують протягом 2год при кімнатній температурі Наступного дня його виливають ІЧ v = 1666, 1599, 1554, 1554см 1 1 до суміші води та льоду і підкислюють 1Н хлорисН ЯМР (ДМСО-de) 5 = 2,10 (ЗН, с), 2,46 (6Н, товодневою кислотою Потім суміш екстрагують с), 5,69 (2Н, с), 7,47 (2Н, с), 10,03 (1Н, с, обміню 22 21 56205 метиленхлоридом Об'єднані органічні екстраісги протягом 24 годин при кімнатній температурі, а промивають водою, висушують над сульфатом потім виливають до розчину 0,33г (3,93ммоль) натрію і концентрують до сухого залишку при знибікарбонату натрію Суміш екстрагують метиленженому тиску хлоридом Об'єднані органічні екстракти висушують над сульфатом натрію і концентрують до сухоОдержаний маслянистий залишок очищають го залишку під зниженим тиском Одержаний хроматографією на колонці з оксидом кремнію залишок очищають по черзі хроматографіями на (елюент метиленхлорид) і перекристалізацією із колонці з оксидом кремнію (елюент для першої суміші гексану та метиленхлориду, одержуючи 1,1г хроматографії метиленхлорид, елюент для другої (70%) г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]хроматографії 2/1 гексан/етилацетат) та перекрифеніл]бензолсульфонаміду, який за усіма показсталізацією із гексану, одержуючи 0,98г (42%) Nниками є ідентичним до сполуки, одержаної за [3,5-диметил-4-[(нітрометил)сульфшіл]феніл]бенПрикладом 1 золсульфонаміду Приклад 3 (спосіб D) І\І-[3,5-диметил-4Т пл > 50°С (розкладається при 130°С) [(нітрометил)тю]феніл]бензолсульфонамід Елементарний аналіз C15H16N2O5S2 (M = 368,41) 0,75г (7,49ммоль) карбонату кальцію, а потім 1,0г (5,66ммоль) бензолсульфонілхлориду додаС, % Н, % N, % S, % ють до розчину 0,80г (3,77ммоль) 3,5-диметил-4розраховано 48,90 4,38 7,60 17,40 [(нітрометил)тю]аніліну у ЗОмл безводного тетрапзнайдено 48,96 4,66 7,47 17,58 дрофурану, який утримували під атмосферою азоІЧ v = 1595, 1557, 1160, 1091, 1074, 602см 1 1 ту Після перемішування протягом 3 днів при кімН ЯМР (ДМСО-de) 5 = 2,43 (6Н, с), 6,14 (2Н, с, натній температурі реакційне середовище виливаобмінюється з CF3COOD), 6,88 (2Н, с), 7,57 - 7,66 ли до води та екстрагували метиленхлоридом (ЗН, м), 7,85-7,88 (2Н, м), 10,79 (1Н, с, обмінюєтьОб'єднані органічні екстракти промивали водою, ся з CF3COOD) висушували над сульфатом натрію і концентруваПриклад 5 (спосіб А1) ли до сухого залишку під зниженим тиском Одер4-Хлор-І\І-[3,5-диметил-4жаний залишок очищали хроматографією на коло[(нітрометил)сульфоніл]феніл]бензолсульфонамід нці з оксидом кремнію (елюент метиленхлорид), 1,45г (14,5ммоль) карбонату кальцію, а потім одержуючи 0,9г (68%) г\І-[3,5-диметил-4-[(нггроме2,3г (10,9ммоль) 4-хлорбензолсульфонілхлориду тил)тю]феніл]бензолсульфонаміду додають по черзі до суміші 1,8г (7,37ммоль) 3,5Т пл = 146 - 148°С (гексан/етилацетат) диметил-4-[(нітрометил)сульфоніл]анілшу у 45мл Елементарний аналіз C15H16N2O4S2 (M = безводного тетрапдрофурану Реакційне середо352,41) вище перемішують протягом 27год при кімнатній температурі, а потім виливають до 200мл води С, % Н, % N, % S, % Цю суміш екстрагують 3 рази метиленхлоридом розраховано 51,12 4,58 7,95 18,19 Об'єднані органічні екстракти промивають водою, знайдено 50,95 4,54 8,03 18,05 висушують над сульфатом натрію і концентрують ІЧ v = 3275, 1596, 1554, 1474, 1467, 1379, до сухого залишку під зниженим тиском Одержа1323, 1163, 1092,872, 688см 1 1 ний залишок очищають хроматографією на колонН ЯМР (ДМСО-de) 5 = 2,26 (6Н, с), 5,53 (2Н, ці з оксидом кремнію (елюент метиленхлорид), а с), 6,85 (2Н, с), 7,48 - 7,60 (ЗН, м), 7,74 - 7,77 (2Н, потім перекристалізацією із хлороформу, одержум), 10,46 (1Н, с, обмінюється з CF3COOD) ючи 0,44г (14%) 4-хлор-І\І-[3,5-диметил-43,5-Диметил-4-[(нітрометил)тю]анілін, що був [(нітрометил)сульфоніл]феніл]бензолсульфонамівихідним матеріалом, одержували за такою методикою ДУ Суміш 1,6г (6,29ммоль) г\І-[3,5-диметил-4-[(нггТ пл 160-162°С (хлороформ) рометил)тю]феніл]ацетаміду та 1,44г (Зб.Оммоль) Елементарний аналіз C15H15CIN2O6S2 (M = гранульованого гідроксиду натрію у 20мл води 418,86) витримували при 80°С протягом 1год Після охоС, % Н, % N, % лодження реакційне середовище виливали до ворозраховано 43,01 3,61 6,69 ди і екстрагували ДВІЧІ етилацетатом Об'єднані знайдено 42,99 3,59 6,72 органічні екстракти висушували над сульфатом ІЧ v = 1594, 1562, 1346, 1167, 1147, 621 см 1 1 натрію і концентрували до сухого залишку під зниН ЯМР (ДМСО-de) 5 = 2,48 (6Н, с), 6,46 (2Н, с, женим тиском Одержаний залишок очищали хрообмінюється з CF3COOD), 6,99 (2Н, с), 7,67 - 7,72 матографією на колонці з оксидом кремнію (елю(2Н, м), 7,89-7,93 (2Н, м), 11,18 (1Н, с, обмінюєтьент 2/1 гексан/етилацетат), одержуючи 0,8г (60%) ся з CF3COOD) маслянистої речовини, яка складалась з 3,5Приклад 6 (спосіб А2) диметил-4-[(нітрометил)тю]анілшу г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]фе1 Н ЯМР (ДМСО-de) 5 = 2,31 (6Н, с), 5,43 (2Н, с, ніл]-3-метилбензолсульфонамід обмінюється з CF3COOD), 5,52 (2Н, с), 6,39 (2Н, с) 1,3мл (16,1ммоль) піридину, висушеного над Приклад 4 (спосіб Е) І\І-[3,5-диметил-4гідроксидом калію, та 2,3г (12,1ммоль) 3-ме[(нітрометил)сульфшіл]феніл]бензолсульфонамід тилбензолсульфонілхлориду додають по черзі до 1,3г (5,46ммоль) 70 - 75% м-хлорпербензойної розчину 2,0г (8,19ммоль) 3,5-диметил-4-[(ніткислоти швидко додають до розчину 2,2г рометил)сульфоніл]аніліну у 50мл безводного тет(6,24ммоль) М-[3,5-диметил-4-[(нггрометил)тю]ферапдрофурану, який витримували під атмосферою ніл]-бензолсульфонаміду у 79мл безводного хлоазоту Реакційне середовище перемішували пророформу Реакційне середовище перемішують тягом 24год при кімнатній температурі, а потім 24 23 56205 витримували при 40°С протягом 1год , після чого рекристалізацією із толуолу, одержуючи 0,38г його виливають до суміші ЮОмл води та 100г льо(22%) 2,4-дифтор-І\І-[3,5-диме-тил-4ду Цю суміш підкислюють до рН 3 доданням 1Н [(нітрометил)сульфоніл]феніл]бензолсульхлористоводневої кислоти, а потім екстрагують З фонаміду рази порціями по ЮОмл метиленхлориду Об'єдТ пл 154-156°С (толуол) нані органічні екстракти промивають ЮОмл води, Елементарний аналіз C15H14F2N2O6S2 (M = висушують над сульфатом натрію і концентрують 420,40) до сухого залишку під зниженим тиском ОдержаС, % Н, % F, % N, % S, % ний залишок очищають хроматографією на колонрозраховано 42,85 3,36 9,04 6,66 15,25 ці з оксидом кремнію (елюент метиленхлорид), знайдено 42,81 3,41 8,80 6,69 15,26 одержуючи 2,3г (71%) г\І-[3,5-диметил-4-[(нггромеІЧ v = 3261, 1599, 1559, 1478, 1339, 1165, 1 тил)сульфоніл]феніл]-31149, 1124, 1075,866, 672см 1 метилбензолсульфонаміду Н ЯМР (ДМСО-de) 5 = 2,48 (6Н, с), 6,46 (2Н, с, Т пл 179 -181 °С (гексан/етилацетат) обмінюється з CF3COOD), 6,98 (2Н, с), 7,31 - 7,37 Елементарний аналіз C16H18CIN2O6S2 (M = (1Н, м), 7,54- 7,62 (1Н, м), 8,09 - 8,17 (1Н, м), 11,49 398,44) (1Н, с, обмінюється з CF3COOD) С, % Н, % N, % S, % Приклад 9 (спосіб А2) розраховано 48,23 4,55 7,03 16,09 г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]фезнайдено 48,21 4,61 7,06 15,99 ніл]-3-(трифторметил)-бензолсульфонамід ІЧ v = 3244, 1594,1565, 1339, 1308,1182, Названу у заголовку сполуку одержують за 1159,1148, 607см 1 процедурою Прикладу 6, використовуючи 3,0г 1 (12,3ммоль) 3-(трифторметил)бензолсульфонілН ЯМР (ДМСО-de) 5 = 2,38 (ЗН, с), 2,48 (6Н, хлориду с), 6,45 (2Н, с, обмінюється з CF3COOD), 6,99 (2Н, с), 7,48 - 7,53 (2Н, м), 7,69 - 7,72 (2Н, м), 11,05 (1Н, Тривалість нагрівання при 40°С 4год с, обмінюється з CF3COOD) Вихід 1,7г (46%) Приклад 7 (спосіб А2) Т пл 146 - 148°С (гексан/етилацетат) І\І-[3,5-диметил-4Елементарний аналіз C16H15F3N2O6S2 (M = [(нітрометил)сульфоніл]феніл]-4452,42) метилбензолсульфонамід С, % Н, % F, % N, % S, % Названу у заголовку сполуку одержують за розраховано 42,47 3,34 12,60 6,19 14,17 процедурою Прикладу 6, використовуючи 2,3г знайдено 42,80 3,41 12,23 6,26 14,50 (12,1ммоль) 4-метилбензолсульфонілхлориду ІЧ v = 3244, 1593, 1569, 1359, 1344, 1326, Тривалість нагрівання при 40°С Згод 1182, 1167, 1148, 1139, 1104, 1071, 641см 1 1 Вихід 0,31г (10%) Н ЯМР (ДМСО-de) 5 = 2,48 (6Н, с), 6,67 (2Н, с, Т пл 163 - 165°С (гексан/етилацетат) обмінюється з CF3COOD), 7,22 (2Н, с), 8,09 (1Н, т, Елементарний аналіз C16H18CIN2O6S2 (M = J = 7,8Гц), 8,30 (1Н, д, J = 8Гц), 8,38 - 8,43 (1Н, м), 398,44) 10,44 (1Н, с, обмінюється з CF3COOD) С, % Н, % N, % S, % Приклад 10 (спосіб А2) розраховано 48,23 4,55 7,03 16,09 3,4-Дифтор-І\І-[3,5-диметил-4знайдено 48,27 4,66 6,97 15,83 [(нітрометил)сульфоніл]феніл]ІЧ v = 3254, 1596, 1562, 1341, 1309, 1178, бензолсульфонамід 1161, 1147, 1090, 1071, 664, 635, 599см 1 Названу у заголовку сполуку одержують за 1 Н ЯМР (ДМСО-de) 5 = 2,36 (ЗН, с), 2,47 (6Н, процедурою Прикладу 8, починаючи з розчину 2,0г с), 6,45 (2Н, с, обмінюється з CF3COOD), 6,98 (2Н, (8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфос), 7,41 (2Н, д, J = 8Гц), 7,79 (2Н, д, J = 8Гц), 11,03 ніл]анілшу у 40мл тетрапдрофурану, 1,3г (1Н, с, обмінюється з CF3COOD) (16,4ммоль) піридину та 2,6г (12,2ммоль) 3,4дифторбензолсульфонілхлориду Реакційне сереПриклад 8 (спосіб А2) довище перемішують по черзі протягом 1год при 2,4-Дифтор-г\І-[3,5-диметил-4-[(нггромеЮ°С, протягом 19год при кімнатній температурі, тил)сульфоніл]феніл]-бензолсульфонамід протягом Згод при 50°С та протягом 16год при 0,65г (8,22ммоль) піридину, висушеного над гікімнатній температурі дроксидом калію, та 1,3г (6,11ммоль) 2,4-дифторбензолсульфонілхлориду додають по черзі до Вихід 1,2г (35%) охолодженого до приблизно 10°С розчину 1,0г Т пл 158-160°С (толуол) (4,09ммоль) 3,5-диметил-4-[(нітрометил)сульфоЕлементарний аналіз C15H14F2N2O6S2 (M = ніл]-аніліну у 20мл безводного тетрапдрофурану 420,40) Реакційне середовище перемішують протягом С, % Н, % F, % N, % S, % 2год при Ю°С, а потім протягом 20год при кімнарозраховано 42,85 3,36 9,04 6,66 15,25 тній температурі, після чого його виливають до знайдено 42,72 3,33 8,83 6,73 15,37 Юмл води Суміш доводять до рН 3 доданням ІЧ v = 3273, 1600, 1556, 1511, 1362, 1345, концентрованої хлористоводневої кислоти, а потім 1329, 1277, 1148, 1120, 1069, 637см 1 1 екстрагують метиленхлоридом Об'єднані органічні Н ЯМР (ДМСО-de) 5 = 2,37 (6Н, с), 6,34 (2Н, с, екстракти промивають водою, висушують над суобмінюється з CF3COOD), 6,89 (2Н, с), 7,56 - 7,67 льфатом натрію і концентрують до сухого залишку (2Н, м), 7,86 - 7,92 (1Н, м), 11,07 (1Н, с, обмінюєтьпід зниженим тиском Одержаний маслянистий ся з CF3COOD) залишок очищають хроматографією на колонці з Приклад 11 (спосіб А2) оксидом кремнію (елюент метиленхлорид) та пег\І-[3,5-диметил-4-[(нггрометил)сульфоніл]фе 25 ніл]-4-метоксибензолсульфонамід 1,33мл (16,4ммоль) піридину, висушеного над гідроксидом калію, та 2,54г (12,3ммоль) 4метоксибензолсульфонілхлориду по черзі додавали до розчину 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу у 40мл безводного тетрапдрофурану, який витримували під атмосферою азоту Реакційне середовище перемішували протягом 24год при кімнатній температурі, а потім витримували при 40°С протягом 1год , після чого його виливали до суміші води та льоду Одержаний водний розчин доводили до рН 1 доданням 1Н хлористоводневої кислоти і екстрагували метиленхлоридом Об'єднані органічні екстракти промивали водою, висушували над сульфатом натрію і концентрували до сухого залишку при зниженому тиску Одержаний маслянистий залишок очищали хроматографією колонці з оксидом кремнію (елюент метиленхлорид) та перекристалізацією із суміші гексану та етилацетату, одержуючи 1,1г (33%) N-[3,5диметил-4-[(нітрометил)сульфоніл]феніл]-4метоксибензолсульфонаміду Т пл 141 - 142°С (гексан/етилацетат) Елементарний аналіз C16H18N2O7S2 (M = 414,44) С, % Н, % N, % S, % розраховано 46,37 4,38 6,76 15,47 знайдено 46,40 4,38 6,89 15,22 ІЧ v = 3251, 1595, 1557, 1486, 1398, 1346, 1308, 1260, 1176, 1151, 1148, 1095, 1071, 874, 836, 599см 1 1 Н ЯМР (ДМСО-de) 5 = 2,58 (6Н, с), 3,93 (ЗН, с), 6,56 (2Н, с, обмінюється з CF3COOD), 7,08 (2Н, с), 7,20 - 7,25 (2Н, м), 7,92 - 7,97 (2Н, м), 11,07 (1Н, с, обмінюється з CF3COOD) Приклад 12 (спосіб А1) 4-Бром-г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]бензолсульфонамід 2,0г (20,0ммоль) карбонату кальцію та 3,8г (14,9ммоль) 4-бромбензолсульфонілхлориду додають по черзі до суміші 2,4г (9,83ммоль) 3,5диметил-4-[(нітрометил)сульфоніл]анілшу у 45мл безводного тетрапдрофурану Реакційне середовище перемішують протягом 20год при кімнатній температурі, а потім кип'ятять зі зворотним холодильником протягом 48год Після охолодження його виливають до 400мл води і екстрагують метиленхлоридом Об'єднані органічні екстракти висушують над сульфатом натрію і концентрують до сухого залишку при зниженому тиску Одержаний маслянистий залишок очищають хроматографією колонці з оксидом кремнію (елюент метиленхлорид), одержуючи 1,1г (24%) 4-6poM-N-[3,5диметил-4-[(нітрометил)сульфоніл]феніл]бензолсульфонаміду Т пл 164 - 166°С (гексан/етилацетат) Елементарний аналіз СібНібВгІЧгОєЗг (М = 463,32) С, % Н, % Вг, % N, % S, % розраховано 38,88 3,26 17,25 6,05 13,84 знайдено 39,07 3,38 17,00 5,93 13,70 ІЧ v = 3258, 1594, 1471, 1393, 1342, 1166, 1148, 1088, 1069, 740, 632, 609см 1 1 Н ЯМР (ДМСО-de) 5 = 2,64 (6Н, с), 6,62 (2Н, с, обмінюється з CF3COOD), 7,14 (2Н, с), 7,99 (4Н, м), 11,34 (1Н, с, обмінюється з CF3COOD) 56205 26 Приклад 13 (спосіб А1) 3-Бром-г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]бензолсульфонамід Названу у заголовку сполуку одержують за процедурою Прикладу 12, використовуючи 3,8г (14,9ммоль) 3-бромбензолсульфонілхлориду Тривалість кип'ятіння ЗІ зворотним холодильником 40год Вихід 0,8г (18%) Т пл 156 - 158°С (гексан/етилацетат) Елементарний аналіз СібНібВгІЧгОєЗг (М = 463,32) С, % Н, % Вг, % N, % розраховано 38,88 3,26 17,25 6,05 знайдено 39,17 3,45 17,00 5,91 ІЧ v = 3237, 1594, 1565, 1483, 1397, 1358, 1340, 1181, 1167, 1148, 1071, 885, 679, 635, 605см і 1 Н ЯМР (ДМСО-de) 5 = 2,64 (6Н, с), 6,62 (2Н, с, обмінюється з CF3COOD), 7,15 (2Н, с), 7,70 - 7,75 (1Н, м), 8,04-8,07 (2Н, м), 8,18 - 8,19 (1Н, м), 11,33 (1Н, с, обмінюється з CF3COOD) Приклад 14 (спосіб А2) г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-2-(трифторметил)-бензолсульфонамід Названу у заголовку сполуку одержують за процедурою Прикладу 6, починаючи з розчину 2,0г (8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу у 38мл тетрапдрофурану, 1,32г (16,3ммоль) піридину та 3,0г (12,3ммоль) 2(трифторметил)бензолсульфонілхлориду Тривалість нагрівання при 40°С 8год Вихід 0,7г (19%) Т пл 171 - 173°С (гексан/етилацетат) Елементарний аналіз C16H15F3N2O6S2 (M = 452,42) С, % Н, % F, % N, % S, % розраховано 42,47 3,34 12,60 6,19 14,17 знайдено 42,61 3,35 12,32 6,21 14,55 ІЧ v = 3370, 3028, 2954, 1596, 1562, 1405, 1348, 1340, 1307, 1180, 1166, 1149, 1122см 1 1 Н ЯМР (ДМСО-de) 5 = 2,42 (6Н, с), 6,41 (2Н, с, обмінюється з CF3COOD), 6,93 (2Н, с), 7,82 - 7,91 (2Н, м), 7,96-8,01 (1Н, м), 8,17- 8,20 (1Н, м), 11,38 (1Н, с, обмінюється з CF3COOD) Приклад 15 (спосіб А2) І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-2-нафталшсульфонамід 1,3мл (16,1ммоль) піридину, висушеного над гідроксидом калію, та 2,8г (12,4ммоль) 2нафталінсульфонілхлориду додавали по черзі до розчину 2,0г (8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу у 40мл безводного тетрапдрофурану, який витримували під атмосферою азоту Реакційне середовище перемішували протягом бгод при кімнатній температурі, а потім залишали на 2 дні, після чого виливали до 200мл води Суміш доводили до рН 1 розведеною хлористоводневою кислотою і екстрагували ДВІЧІ метиленхлоридом Об'єднані органічні екстракти промивали ДВІЧІ водою, висушували над сульфатом натрію і концентрували до сухого залишку при зниженому тиску Одержаний твердий залишок очищали хроматографією на колонці з оксидом кремнію (елюент 27 метиленхлорид), одержуючи 3,0г (84%) N-[3,5диметил-4-[(нітрометил)сульфоніл]феніл]-2-нафталінсульфонаміду Т пл 208 - 215°С (етилацетат) - розкладається при температурі в и щ е 2 1 5 ° С Елементарний аналіз C19H18N2O6S2 (M = 434,47) С, % Н, % N, % S, % розраховано 52,52 4,18 6,45 14,76 знайдено 52,62 4,29 6,45 14,42 ІЧ v = 3230 1557, 1340, 1180, 1163, 1148, 1072, 659, 6 4 1 с м 1 1 Н ЯМР (ДМСО-de) 5 =2,54 (6Н, с), 6,50 (2Н, с, обмінюється з CF 3 COOD), 7,13 (2Н, с), 7,76 - 7,81 (2Н, м), 7,91 -7,95(11-1, м), 8,10 - 8,33 (ЗН, м), 8,778,78 (1Н, м), 11,30 (1Н, с, обмінюється з СРзСОСЮ) Приклад 16 (спосіб А2) ІЧ-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-(2-нітрофеніл)метансульфонамід Названу у заголовку сполуку одержують за процедурою Прикладу 15, використовуючи 2,9г (12,3ммоль) (2нітрофеніл)метансульфонілхлориду Тривалість перемішування при кімнатній температурі 26год Вихід 2,6г (72%) Т пл 189 - 190°С (гексан/етилацетат) Елементарний аналіз C16H17N3O8S2 (M = 443,44) С, % Н, % N, % S, % розраховано 43,33 3,86 9,48 14,46 знайдено 43,67 3,82 9,60 14,32 ІЧ v = 3243, 1596, 1562, 1531, 1487, 1399, 1361, 1336, 1313, 1160, 1147, 1140, 902, 869, 632см 1 1 Н ЯМР (ДМСО-de) 5 = 2,58 (6Н, с), 5,21 (2Н, с), 6,56 (2Н, с, обмінюється з CP 3 COOD), 6,98 (2Н, с), 7,61 -7,64(11-1, м), 7 , 7 0 - 7 , 8 0 (2Н, м), 8 , 1 0 - 8 , 1 3 (1Н, м), 10,83 (1Н, с, обмінюється з CP 3 COOD) Приклад 17 (спосіб А2) 2-Бром-г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]бензолсульфонамід Названу у заголовку сполуку одержують за процедурою Прикладу 15, використовуючи 2,5г (9,78ммоль) 2-бромбензолсульфонілхлориду Реакційне середовище перемішують протягом 20год при кімнатній температурі, потім додають додаткові 0,6г (2,35ммоль) 2-бромбензилсульфонілхлориду і продовжують перемішувати 4год при кімнатній температурі Вихід 1,6г (42%) Т пл 140 - 142°С (гексан/етилацетат) Елементарний аналіз СібНібВгІЧагОєЗг (М = 463,32) С, % Н, % Вг, % N, % розраховано 38,88 3,26 17,25 6,05 знайдено 39,07 3,15 17,25 6,05 ІЧ v = 3295, 3041, 2969, 1595, 1562, 1478, 1337, 1192, 1188, 1144, 1071, 632, 601см 1 1 Н ЯМР (ДМСО-de) 5 = 2,54 (6Н, с), 6,54 (2Н, с, обмінюється з CF 3 COOD), 7,03 (2Н, с), 7,66 - 7,77 (2Н, м), 7,93 - 7,96 (1Н, м), 8,33 - 8,37 (1Н, м), 11,53 (1Н, с, обмінюється з СРзСОСЮ) Приклад 18 (спосіб А2) 56205 28 г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-4-(метилсульфоніл)-бензолсульфонамід 1,31мл (16,2ммоль) піридину, висушеного над гідроксидом калію, та 2,5г (9,82ммоль) 4(метилсульфоніл)бензолсульфонілхлориду додавали по черзі до розчину 1,6г (6,55ммоль) 3,5диметил-4-[(нітрометил)сульфоніл]анілшу у 50мл безводного тетрапдрофурану, який тримали під атмосферою азоту Реакційне середовище перемішували протягом 2 днів при кімнатній температурі, а потім виливали до 200мл води Одержану суміш доводили до рН 3 доданням 1Н хлористоводневої кислоти, а потім екстрагували 3 рази порціями по 200мл метиленхлориду Об'єднані органічні екстракти промивали водою, висушували над сульфатом натрію і концентрували до сухого залишку при зниженому тиску Залишок очищали хроматографією на колонці з оксидом кремнію (елюент 2/1 метиленхлорид/етилацетат) та перекристалізацією із суміші гексану та етилацетату, одержуючи 0,78г (26%) І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-4(метилсульфоніл)бензолсульфонаміду Т пл 192 - 194°С (гексан/етилацетат) Елементарний аналіз C16H18N2O8S3 (M = 462,50) С, % Н, % N, % S, % розраховано 41,55 3,92 6,06 20,80 знайдено 41,39 4,02 5,90 20,76 ІЧ v = 3281, 1597, 1586, 1555, 1485, 1401, 1395, 1366, 1349, 1328, 1306, 1294, 1289, 1165, 1150, 1090, 1072, 877, 860, 741, 624см 1 1 Н ЯМР (ДМСО-de) 5 = 2,49 (6Н, с), 3,30 (ЗН, с), 6,46 (2Н, с, обмінюється з CP 3 COOD), 7,02 (2Н, с), 8,16 (4Н, с), 11,35 (1Н, с, обмінюється з CF 3 COOD) Приклад 19 (спосіб А2) (Е)-І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]стиролсульфонамід Названу у заголовку сполуку одержують за процедурою Прикладу 18, починаючи з розчину 2,0г (8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу у 50мл тетрапдрофурану, 1,31 г (16,2ммоль) піридину та 2,5г (12,3ммоль) транс-рстиролсульфонілхлориду Реакційне середовище перемішують протягом З днів при кімнатній температурі і екстрагують метиленхлоридом Вихід 1,5г (45%) Т пл 174 - 176°С (гексан/етилацетат) Елементарний аналіз C17H18N2O6S2 (M = 410,45) С, % Н, % N, % S, % розраховано 49,74 4,42 6,83 15,62 знайдено 50,06 4,45 6,84 15,35 ІЧ v = 3235, 1610, 1595, 1577, 1555, 1475, 1390, 1357, 1345, 1323, 1164, 1141, 1067, 889, 872, 744, 627см 1 1 Н ЯМР (ДМСО-de) 5 = 2,67 (6Н, с), 6,64 (2Н, с, обмінюється з CF 3 COOD), 7,22 (2Н, с), 7,58 - 7,63 (4Н, м), 7,87 - 7,97 (ЗН, м), 11,04 (1Н, с, обмінюється з CF 3 COOD), Приклад 20 (спосіб С) 1-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-3-[(2-метилфеніл)сульфоніл]-сечовина ЗО 29 56205 Розчин 0,77мл (5,09ммоль) о-толуолсульфон(16,0ммоль) карбонату кальцію у 40мл безводного ілізоціанату у 7,7мл безводного метиленхлориду тетрапдрофурану Реакційне середовище перемідодають по краплям до суспензії 1,3г (5,32ммоль) шували протягом 6 годин при кімнатній темпера3,5-диметил-4-[(нітрометил)сульфоніл]анілшу у турі, а потім кип'ятили зі зворотним холодильни25,6мл безводного метиленхлориду Температура ком протягом 2год , після чого виливали до 200мл реакційного середовища спонтанно підвищувалась води Суміш екстрагували 3 рази метиленхлорина 7°С У розчині, який було спочатку одержано, дом Об'єднані органічні екстракти промивали воутворювався осад Перемішування продовжували дою, висушували над сульфатом натрію і концентпротягом 1 години при кімнатній температурі, а рували до сухого залишку при зниженому тиску потім твердуречовину ізолювали фільтруванням і Одержаний маслянистий залишок перекристалізопромивали гексаном, одержуючи 1,9г (вихід = вували тритуруванням із суміші гексану та етила86%) 1-[3,5-диметил-4цетату Ці кристали промивали сумішшю метиленхлориду та метанолу при кімнатній температурі, а [(нітрометил)сульфоніл]феніл]-3-[(2потім сумішшю гексану та етилацетату при КИПІННІ метилфеніл)сульфоніл]-сечовини ЗІ зворотним холодильником, і зрештою етанолом Т пл 194 - 196°С (гексан/етилацетат) при кімнатній температурі, одержуючи 0,26г (7,2%) Елементарний аналіз C17H19N3O7S2 (M = ІЧ-[4-[3,5-Диметил-4441,47) [(нітромеС, % Н, % N, % S, % тил)сульфоніл]фенілсульфамоіл]феніл]ацетаміду розраховано 46,25 4,34 9,52 14,52 знайдено 46,40 4,44 9,31 14,34 Т пл 209-210°С Елементарний аналіз C17H19N3O7S2 (M = ІЧ v = 3303, 1654, 1587, 1565, 1526, 1455, 441,47) 1393, 1362, 1341, 1326, 1164, 1153, 1131, 1089, 898, 883, 707, 606см 1 С, % Н, % N, % S, % 1 розраховано 46,25 4,34 9,52 14,52 Н ЯМР (ДМСО-de) 5 = 2,46 (6Н, с), 2,58 (ЗН, знайдено 46,25 4,43 9,78 14,25 с), 6,41 (2Н, с, обмінюється з CF3COOD), 7,24 (2Н, с), 7,38 - 7,43 (2Н, м), 7,52 - 7,57 (1Н, м), 7,94 (1Н, ІЧ v = 3382, 3190, 1676, 1592, 1550, 1536, д, J = 8Гц), 9,02 (1Н, с, обмінюється з CF3COOD), 1340, 1156, 1147см1 1 11,14 (1Н, широкий пік, обмінюється з CF3COOD) Н ЯМР (ДМСО-de) 5 = 2,10 (ЗН, с), 2,51 (6Н, с), 6,48 (2Н, с, обмінюється з CF3COOD), 7,01 (2Н, Приклад 21 (спосіб С) с), 7,78-7,81 (2Н, м), 7,86 - 7,89 (2Н, м), 10,39 (1Н, 1-[3,5-диметил-4с, обмінюється з CF3COOD), 11,03 (1Н, с, обміню[(нітрометил)сульфоніл]феніл]-3-[(4ється з CF3COOD) метилфеніл)сульфоніл]-сечовина Розчин 1,55мл (10,2ммоль) п-толуолсульфоПриклад 23 (спосіб А2) нілізоціанату у 15,5мл безводного метиленхлориду г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]федодавали по краплям до суспензії 2,6г (Ю.бммоль) ніл]-2,2,2-трифторетан-сульфонамід 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу у Названу у заголовку сполуку одержують за 52мл безводного метиленхлориду Температура процедурою Прикладу 18, починаючи з розчину реакційного середовища спонтанно підвищувалась 1,5г (6,14ммоль) 3,5-диметил-4-[(нітрометил)сульна 2°С Перемішування одержаного розчину трифоніл]анілшу у 50мл тетрапдрофурану, 0,97г вало протягом ЗО хвилин при кімнатній температу(12,0ммоль) піридину та 1,0мл (9,04ммоль) 2,2,2рі Потім реакційне середовище концентрували до трифторетансульфонілхлориду сухого залишку при зниженому тиску, залишок Елюентом для хроматографії є метиленхлоочищали хроматографією на колонці з оксидом рид кремнію (елюент метиленхлорид, а потім суміш Вихід 1,6г (68%) 9/1 метиленхлорид/метанол) та перекристалізаціТ пл 168 - 170°С (гексан/етилацетат) єю з метиленхлориду, одержуючи 2,5г (57%) 1Елементарний аналіз C11H13F3N2O6S2 (M = [3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-3390,35) [(4-метилфеніл)сульфоніл]сечовини С, % Н, % F, % N, % S, % Т пл 150-155°С розраховано 33,84 3,36 14,60 7,18 16,43 Елементарний аналіз C17H19N3O7S2 (M = знайдено 34,14 3,44 14,25 7,35 16,19 441,47) ІЧ v = 3227, 1601, 1564, 1351, 1333, 1323, С, % Н, % N, % S, % 1270, 1248, 1157, 1147, 1135, 1089см 1 1 розраховано 46,25 4,34 9,52 14,52 Н ЯМР (ДМСО-de) 5 = 2,44 (6Н, с), 4,73 (2Н, знайдено 46,40 4,44 9,31 14,12 кв, J = 10Гц), 6,39 (2Н, с, обмінюється з CF3COOD), ІЧ v = 1594, 1562, 1337, 1263, 1247, 1159, 6,96 (2Н, с), 11,04 (1Н, с, обмінюється з 1136см 1 CF3COOD) 1 Н ЯМР (ДМСО-de) 5 = 2,37 (ЗН, с), 2,55 (6Н, Приклад 24 (спосіб А1) с), 6,45 (2Н, с, обмінюється з CF3COOD), 7,38 (2Н, І\І-[3,5-диметил-4д, J = 8Гц), 7,42 (2Н, с), 7,83 (2Н, д, J = 8Гц), 9,12 [(нітрометил)сульфоніл]феніл]-4-фторбензолсуль(1Н, с, обмінюється з CF3COOD) фонамід Приклад 22 (спосіб А1) 1,65г (16,5ммоль) карбонату кальцію додавали г\І-[4-[3,5-Диметил-4-[(нггрометил)сульфодо розчину 2,0г (8,19ммоль) 3,5-диметил-4ніл]фенілсульфамоіл]феніл]ацетамід [(нітрометил)сульфоніл]аніліну у 40мл безводного тетрапдрофурану, а потім порціями додавали 2,4г 2,9г (12,4ммоль) N-ацетилсульфанілілхлориду (12,3ммоль) 4-фторбензолсульфонілхлориду Редодавали порціями до суміші 2,0г (8,19ммоль) 3,5акційне середовище кип'ятили зі зворотним холодиметил-4-[(нітрометил)сульфоніл]анілшу та 1,6г 32 31 56205 дильником протягом 50 годин Після охолодження тил)сульфоніл]феніл]фенілметансульфонамід його виливали до 200мл води і екстрагували З Названу у заголовку сполуку одержують за рази порціями по ЮОмл метиленхлориду Об'єдпроцедурою Прикладу 11, починаючи з розчину нані органічні екстракти промивали 100мл води, 3,0г (12,3ммоль) 3,5-диметил-4-[(нітрометил)сульвисушували над сульфатом натрію і концентрувафоніл]анілшу у 57мл тетрапдрофурану, 2,0мл ли до сухого залишку при зниженому тиску Одер(24,7ммоль) піридину та 3,5г (18,4ммоль) фенілжаний маслянистий залишок очищали хроматогметансульфонілхлориду рафією на колонці з оксидом кремнію (елюент Реакційне середовище перемішують протягом метиленхлорид) та перекристалізацією із суміші 20год при кімнатній температурі, а потім протягом гексану та етилацетату, одержуючи 1,2г (36%) N5год при 40°С Кінцевий продукт перекристалізо[3,5-диметил-4-[(нітрометил)сульфоніл]феніл]-4вують з суміші гексану та метиленхлориду фторбензолсульфонаміду Вихід 0,42г (8,6%) Т пл 152 - 154°С (гексан/етилацетат) Т пл 124 - 126°С (гексан/метиленхлорид) Елементарний аналіз C16H18N2O6S2 (M = Елементарний аналіз C15H15FN2O6S2 (M = 398,44) 402,41) С, % Н, % F, % N, % S, % С, % Н, % N, % S, % розраховано 48,23 4,55 7,03 16,09 розраховано 44,77 3,76 4,72 6,96 15,93 знайдено 48,49 4,59 7,03 16,04 знайдено 44,76 3,85 4,43 6,93 15,84 ІЧ v = 3256, 1596, 1566, 1488, 1405, 1359, ІЧ v = 1592, 1563, 1478, 1398, 1362, 1341, 1337, 1325, 1312, 1144, 1071, 697, 638см 1 1177, 1169, 1159, 1146, 1090, 1071, 877, 865, 841, 1 1 666, 635см Н ЯМР (ДМСО-de) 5 = 2,72 (6Н, с), 4,90 (2Н, 1 с), 6,69 (2Н, с, обмінюється з CF3COOD), 7,14 (2Н, Н ЯМР (ДМСО-de) 5 = 2,68 (6Н, с), 6,48 (2Н, с, с), 7,49 - 7,58 (5Н, м), 10,70 (1Н, с, обмінюється з обмінюється з CF3COOD), 7,18 (2Н, с), 7,61 - 7,69 CF3COOD) (2Н, м), 8,13-8,19 (2Н, м), 11,31 (1Н, с, обмінюється з CF3COOD) Приклад 27 (спосіб А2) 4-Бром-2,5-дифтор-г\І-[3,5-диметил-4-[(нггроПриклад 25 (спосіб А2) метил)сульфоніл]феніл]-бензолсульфонамід г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-3-фторбензолсульфонамід 11,3г (16,4ммоль) піридину, висушеного над гідроксидом калію, а потім 3,6г (12,3ммоль) 4-бромНазвану у заголовку сполуку одержують за 2,5-дифторбензолсульфонілхлориду додавали до процедурою Прикладу 6, починаючи з розчину 2,0г розчину 2,0г (8,19ммоль) 3,5-диметил-4-[(нітроме(8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфотил)сульфоніл]аніліну у 40мл безводного тетрапдніл]анілшу у 40мл тетрапдрофурану, 1,29г рофурану Реакційне середовище перемішували (16,3ммоль) піридину та 2,4г (12,3ммоль) 3протягом 7год ЗОхв при кімнатній температурі, а фторбензолсульфонілхлориду потім протягом 11 год при КИПІННІ зі зворотним хоРеакційне середовище перемішують протягом лодильником, після охолодження його виливали 2год при кімнатній температурі, а потім протягом до ЗООмл води і екстрагували 3 рази метиленхлобгод при 40°С ридом Об'єднані органічні екстракти промивали Вихід 1,3г (40%) водою, висушували над сульфатом натрію і конТ пл 135 - 137°С (гексан/етилацетат) центрували до сухого залишку при зниженому тисЕлементарний аналіз C15H15FN2O6S2 (M = ку Одержаний твердий залишок очищали хрома402,41) тографією на колонці з оксидом кремнію (елюент С, % Н, % F, % N, % S, % метиленхлорид) та перекристалізацією із суміші розраховано 44,77 3,76 4,72 6,96 15,93 гексану та етилацетату, одержуючи 0,24г (6,2%) 4знайдено 44,62 3,63 4,65 6,91 16,21 бром-2,5-дифтор-І\І-[3,5-диметил-4ІЧ v = 3263, 1597, 1557, 1479, 1395, 1357, [(нітроме1343, 1320, 1307, 1230, 1168, 1146, 1072, 856, 695, 1 676, 636, 610см тил)сульфоніл]феніл]бензолсульфонаміду, який 1 містив 5%мол етилацетату Н ЯМР (ДМСО-de) 5 = 2,45 (6Н, с), 6,43 (2Н, с, Т пл 167 - 169°С (гексан/етилацетат) обмінюється з CF3COOD), 6,97 (2Н, с), 7,50 - 7,73 Елементарний аналіз CisHi3BrF2N2O6S2 (М = (4Н, м), 11,16 (1Н, с, обмінюється з CF3COOD) 499,31) Приклад 26 (спосіб А2) І\І-[3,5-диметил-4[(нітромерозраховано знайдено С, % 36,24 36,50 Н, % 2,68 2,75 ІЧ v = 3242, 1565, 1480, 1350, 1167см 1 1 Н ЯМР (ДМСО-de) 5 = 2,42 (6Н, с), 6,39 (2Н, с, обмінюється з CF3COOD), 6,92 (2Н, с), 7,97 - 8,03 (2Н, м), 11,55 (1Н, с, обмінюється з CF3COOD) Приклад 28 (спосіб А2) 2,5-Дифтор-І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]бензолсульфонамід Вг, % 15,86 15,47 F, % 7,54 7,39 N, % 5,56 5,51 S, % 12,73 12,80 Названу у заголовку сполуку одержували за процедурою Прикладу 15, використовуючи 2,6г (12,2ммоль) 2,5-дифторбензолсульфонілхлориду Реакційне середовище перемішували протягом 20год при кімнатній температурі, а потім залишали вистоюватись на 5 днів перед доопрацюванням Кінцевий продукт очищали хроматографією на колонці з оксидом кремнію (елюент мети 33 ленхлорид) та перекристалізацією з толуолу Вихід 1,1г (32%) Т пл = 132 - 134°С (толуол) Елементарний аналіз C15H14F2N2O6S2 (M = 420,40) С, % Н, % F, % N, % S, % розраховано 42,85 3,36 9,04 6,66 15,25 знайдено 43,09 3,43 9,05 6,69 15,40 ІЧ v = 1562, 1486, 1353, 1159, 1147, 607см 1 1 Н ЯМР (ДМСО-de) 5 = 2,47 (6Н, с), 6,44 (2Н, с, обмінюється з CF 3 COOD), 6,99 (2Н, с), 7,49 - 7,57 (1Н, м), 7,60 - 7,64 (1Н, м), 7,86 - 7,92 (1Н, м) Вихідний матеріал 2,5дифторбензолсульфонілхлорид одержували за такою методикою 12,9г (99,9ммоль) 2,5-дифторанілшу швидко додавали до охолодженої до -10°С на бані з cardice С?сухого льоду) у етанолі суміші ЗЗмл концентрованої хлористоводневої кислоти та 10мл оцтової кислоти, а потім по краплям додавали розчин 7,4г (107ммоль) нітриту натрію у 15мл води Перемішували протягом 46хв після закінчення додавання при температурі від -10 до -25°С Цей розчин, який утримували при температурі біля -25°С, додавали порціями до охолодженої до 10°С суміші, одержаної насиченням ЮОмл оцтової кислоти дюксидом сірки та доданням 2,5г (25,3ммоль) хлориду МІДІ(І) Відбувалось значне виділення азоту Реакційному середовищу давали повернутись до кімнатної температури і витримували при цій температурі протягом 2год , після чого його виливали до 450мл суміші води та льоду, його екстрагували етиловим ефіром Об'єднані ефірні екстракти промивали насиченим водним розчином бікарбонату натрію, висушували над сульфатом натрію і концентрували Одержаний маслянистий залишок дистилювали під зниженим тиском, одержуючи 14,3г (87%) рідини, що складалась по суті з 2,5дифторбензолсульфонілхлориду, який використовували на наступній стадії без подальшої очистки Т кип = 65 - 70°С при 0,5мм рт ст ІЧ v = 3118, 3087, 1488, 1410, 1384, 1301, 1255, 1202, 1188, 1152, 1119, 1052, 8 8 1 , 832, 772, 692, 689, 605, 599см 1 1 Н ЯМР (CDCI 3 ) 5 = 7,28 - 7,32 (1Н, м), 7,38 7,42 (1Н, м), 7 , 5 8 - 7,63 (1Н, м) Приклад 29 (спосіб А2) 2,3-Дифтор-г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-бензолсульфонамід Названу у заголовку сполуку одержують за процедурою Прикладу 15, використовуючи 2,6г (12,2ммоль) 2,3-дифторбензолсульфонілхлориду Реакційне середовище перемішують протягом 20год при кімнатній температурі у темряві і залишають стояти на 3 дні перед доопрацюванням Кінцевий продукт очищають хроматографією на колонці з оксидом кремнію (елюент метиленхлорид) та перекристалізацією з толуолу Вихід 1,1г (32%) Т пл = 166 - 168°С (толуол) Елементарний аналіз C15H14F2N2O6S2 (M = 420,40) С, % Н, % F, % N, % S, % розраховано 42,85 3,36 9,04 6,66 15,25 знайдено 43,07 3,51 8,98 6,61 15,01 56205 34 ІЧ v = 3292, 1600, 1557, 1494, 1363, 1348, 1329, 1276, 1199, 1161, 1140, 636см 1 1 Н ЯМР (ДМСО-de) 5 = 2,29 (6Н, с), 6,28 (2Н, с, обмінюється з CF 3 COOD), 6,81 (2Н, с), 7,24 - 7,29 (1 Н, м), 7,61 - 7,67 (2Н, м), 11,44 (1 Н, с, обмінюється з CF 3 COOD) Вихідний матеріал 2,3-дифторбензолсульфонілхлорид одержували за процедурою, описаною у Прикладі 28, використовуючи, у першому випадку, 22мл концентрованої хлористоводневої кислоти, 7,7мл оцтової кислоти, 10,0г (77,5ммоль) 2,3дифтораніліну та 5,8г (84,1ммоль) нітриту натрію у 12мл води і, у другому випадку, 77 оцтової кислоти, насиченої дюксидом сірки, та 1,9г (19,2ммоль) хлориду МІДІ(І) Вихід 8,5г (52%) Т кип = 60 - 80°С при 0,5мм рт ст ІЧ v = 1606, 1493, 1388, 1280, 1238, 1203, 1171, 1148, 907, 824, 789, 711, 650см 1 1 Н ЯМР (CDCI 3 ) 5 = 7,37 - 7,42 (1Н, м), 7,61 7,65 (1Н, м), 7 , 7 6 - 7 , 8 1 (1Н, м) Приклад ЗО (спосіб А2) 3,5-Дифтор-г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-бензолсульфонамід Названу у заголовку сполуку одержують за процедурою Прикладу 15, використовуючи 2,6г (12,2ммоль) 3,5-дифторбензолсульфонілхлориду, який додають у вигляді розчину у 20мл тетрапдрофурану Реакційне середовище перемішують протягом 20год при кімнатній температурі у темряві і залишають стояти на 3 дні перед доопрацюванням Кінцевий продукт очищають хроматографією на колонці з оксидом кремнію (елюент метиленхлорид) та перекристалізацією з толуолу Вихід 1,8г (52%) Т пл = 187 - 190°С (толуол) Елементарний аналіз C15H14F2N2O6S2 (M = 420,40) С, % Н, % F, % N, % S, % розраховано 42,85 3,36 9,04 6,66 15,25 знайдено 43,21 3,44 8,85 6,50 15,01 ІЧ v = 3343, 2979, 1607, 1595, 1555, 1474, 1446, 1401, 1363, 1346, 1316, 1295, 1252, 1196, 1160, 1127, 1070, 993, 8 0 1 , 668, 637, 616см 1 1 Н ЯМР (ДМСО-de) 5 = 2,45 (6Н, с), 6,42 (2Н, с, обмінюється з CF 3 COOD), 6,97 (2Н, с), 7,57 - 7,64 (ЗН, м), 11,21 (1Н, с, обмінюється з CF 3 COOD) Вихідний матеріал - 3,5-дифторбензолсульфонілхлорид - одержували за процедурою, описаною у Прикладі 28, використовуючи, у першому випадку, 22мл концентрованої хлористоводневої кислоти, 7,7мл оцтової кислоти, 10,0г (77,5ммоль) 3,5дифтораніліну та 5,8г (84,1ммоль) нітриту натрію у 15мл води і, у другому випадку, 77 оцтової кислоти, насиченої дюксидом сірки, та 1,9г (19,2ммоль) хлориду МІДІ(І) Вихід 7 , 1 Г (43%) - біла тверда речовина Т кип = 60 - 120°С при 0,9мм рт ст ІЧ v = 3100, 1608, 1592, 1446, 1375, 1361, 1301, 1178, 1133, 1080, 992, 8 8 1 , 866, 662, 6 1 1 с м 1 1 Н ЯМР (CDCI 3 ) 5 = 7,04 - 7,11 (1Н, м), 7,46 7,48 (2Н, м) Приклад 31 (спосіб А2) г\І-[3,5-диметил-4-[(нггро 36 35 56205 метил)сульфоніл]феніл]-1-нафталшсульфонамід 3,5-диметилфеніл]-бензолсульфонаміду Названу у заголовку сполуку одержували за Т пл = 112 - 114°С (гексан/метиленхлорид) процедурою Прикладу 15, використовуючи 2,8г Елементарний аналіз C15H14CI2N2O6S2 (M = (12,4ммоль) 1-нафталшсульфонілхлориду 453,31) Реакційне середовище перемішують протягом С, % Н, % СІ, % N, % S, % 26год при кімнатній температурі Кінцевий продукт розраховано 39,74 3,11 15,64 6,18 14,14 очищають хроматографією на колонці з оксидом знайдено 40,24 3,20 15,71 6,29 13,70 кремнію (елюент метиленхлорид) та перекристаІЧ v = 3218, 1580, 1466, 1360, 1329, 1310, 1 лізацією з толуолу 1186, 1161, 1091, 748, 618, 609, 601см 1 Вихід 1,4г (39%) Н ЯМР (ДМСО-de) 5 = 2,38 (6Н, с), 7,00 (2Н, Т пл = 170 - 172°С (толуол) с), 7,49 - 7,59 (ЗН, м), 7,81 - 7,84 (2Н, м), 11,29 (1Н, Елементарний аналіз C19H18N2O6S2 (M = с, обмінюється з CF3COOD) 434,47) Приклад 34 (спосіб А2) С, % Н, % N, % S, % г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]ферозраховано 52,52 4,18 6,45 14,76 ніл]-2-фторбензолсульфонамід знайдено 52,65 3,89 6,51 14,72 1,29г (16,3ммоль) піридину, висушеного над гіІЧ v = 3267, 1595, 1560, 1330, 1181, 1163, дроксидом калію, та 2,4г (12,3ммоль) 21 1136, 1070, 771,636, 600см фторбензолсульфонілхлориду швидко додають по 1 черзі до розчину 2,0г (8,19ммоль) 3,5-диметил-4Н ЯМР (ДМСО-de) 5 = 2,44 (6Н, с), 6,42 (2Н, с, [(нітрометил)сульфоніл]аніліну у 40мл безводного обмінюється з CF3COOD), 6,95 (2Н, с), 7,68 - 7,83 тетрапдрофурану Суміш перемішують протягом (ЗН, м), 8,13 (1Н, д, J = 8,0Гц), 8,31 (1Н, д, J = 2год при кімнатній температурі, а потім витриму8,2Гц), 8,46 (1Н, д, J = 7,3Гц), 8,70 (1Н, д, J = ють при 40°С протягом 12год Після охолодження, 8,5Гц), 11,53 (1Н, с, обмінюється з CF3COOD) реакційне середовище виливають до суміші ЮОмл Приклад 32 (спосіб А2) води та 100г льоду, підкислюють 1Н хлористоводг\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феневою кислотою до рН 2, а потім екстрагують З ніл]-2-тюфенсульфонамід рази порціями по ЮОмл метиленхлориду Об'єдНазвану у заголовку сполуку одержують за нані органічні екстракти промивають ЮОмл води, процедурою Прикладу 6, починаючи з суміші 3,0г висушують над сульфатом натрію і концентрують (12,3ммоль) 3,5-диметил-4-[(нітрометил)сульфодо сухого залишку при зниженому тиску Пастопоніл]анілшу, 60мл тетрапдрофурану та 1,95мл дібний залишок очищають хроматографією на ко(24,1ммоль) піридину, до якої швидко додають 2,8г лонці з оксидом кремнію (елюент метиленхлорид) (15,3ммоль) 2-тюфенсульфонілхлориду та перекристалізацією з суміші гексану та етилаРеакційне середовище перемішують протягом цетату, одержуючи 1,5г (вихід = 46%) N-[3,524год при кімнатній температурі та нагрівають до диметил-4-[(нітрометил)сульфоніл]феніл]-250°С протягом 4год Кінцевий продукт очищають фторбензолсульфонаміду хроматографією на колонці з оксидом кремнію (елюент метиленхлорид) та перекристалізацією з Т пл = 175 - 177°С (гексан/етилацетат) толуолу Елементарний аналіз C15H15FN2O6S2 (M = 402,41) Вихід 0,8г (17%) Т пл = 158 - 159°С (толуол) С, % Н, % F, % N, % S, % розраховано 44,77 3,76 4,72 6,96 15,93 Елементарний аналіз C13H14N2O6S3 (M = знайдено 44,99 3,61 4,66 6,95 15,81 390,44) ІЧ v = 3236, 1598, 1583, 1557, 1475, 1390, С, % Н, % N, % S, % 1350, 1329, 1191, 1175, 1160, 1149, 1124, 1077, розраховано 39,99 3,61 7,18 24,63 1068, 890, 881, 875, 778, 623, 600см 1 знайдено 40,07 3,68 7,29 24,46 1 1 ІЧ v = 1598, 1552, 1345, 1151, 600см Н ЯМР (ДМСО-de) 5 = 2,56 (6Н, с), 6,55 (2Н, с, 1 Н ЯМР (ДМСО-de) 5 = 2,36 (6Н, с), 6,33 (2Н, с, обмінюється з CF3COOD), 7,08 (2Н, с), 7,51 - 7,56 обмінюється з CF3COOD), 6,90 (2Н, с), 7,02 - 7,04 (2Н, м), 7,84-7,87 (1Н, м), 8,11 -8,16(1Н, м), 11,55 (1Н, м), 7,63 - 7,65 (1Н, м), 7,83 - 7,85 (1Н, м), 11,09 (1Н, с, обмінюється з CF3COOD) (1Н, с, обмінюється з CF3COOD) Приклад 35 (спосіб А2) Приклад 33 (спосіб В) г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]феніл]-4-(трифторметил)-бензолсульфонамід г\І-[4-[(Дихлорнггрометил)сульфоніл]-3,5-диметилфеніл]бензолсульфонамід Названу у заголовку сполуку одержували за Суміш 0,96г (2,50ммоль) І\І-[3,5-диметил-4процедурою Прикладу 34, використовуючи 3,0г [(нітрометил)сульфоніл]феніл]-бензолсульфонамі(12,3ммоль) 4-(трифторметил)бензолсульфонілду, 0,66г (4,94ммоль) N-хлорсукциніміду та Юмг хлориду Реакційне середовище перемішували (О.Обммоль) 2,2'-азобісізобутиронітрилу у 20мл протягом 2год при кімнатній температурі, а потім чотирихлористого вуглецю кип'ятили зі зворотним нагрівали до 40°С протягом 20год холодильником протягом бгод Після охолодженВихід 1,5г (35%) ня, нерозчинну частину вилучали фільтрацією і Т пл = 187 - 188°С (гексан/етилацетат) розчин концентрували до сухого залишку при зниЕлементарний аналіз C16H15F3N2O6S2 (M = женому тиску Пастоподібний залишок очищали 452,42) хроматографією на колонці з оксидом кремнію С, % Н, % F, % N, % S, % (елюент метиленхлорид) та перекристалізацією з розраховано 42,47 3,34 12,60 6,19 14,17 суміші гексану та метиленхлориду, одержуючи знайдено 42,73 3,39 12,42 6,13 14,00 0,28г (25%) г\І-[4-[(дихлорнггрометил)сульфоніл]ІЧ v =3252, 1596, 1563, 1408, 1347, 1324, 38 37 56205 1 1166, 1140, 1131, 1092, 1062, 751, 638см гом 20год при кімнатній температурі, а потім на1 грівали до 45°С протягом 4год Кінцевий продукт Н ЯМР (ДМСО-de) 5 = 2,42 (6Н, с), 6,40 (2Н, с, очищали хроматографією на колонці з оксидом обмінюється з CF3COOD), 6,95 (2Н, с), 7,95 (2Н, д, кремнію (елюент метиленхлорид) та перекристаJ = 8,4Гц), 8,05 (2Н, д, J = 8,3Гц), 11,26 (1Н, с, облізацією із суміші гексану та етилацетату мінюється з CF3COOD) Вихід 0,48г (12%) Приклад 36 (спосіб А2) Т пл = 128 - 130°С (гексан/етилацетат) (розІЧ-[3,5-диметил-4кл) [(нітрометил)сульфоніл]феніл]-4Елементарний аналіз C21H18N2O7S2 (M = (трифторметокси)-бензолсульфонамід 474,49) Названу у заголовку сполуку одержують за С, % Н, % N, % S, % процедурою Прикладу 11 починаючи з розчину розраховано 53,15 3,82 5,90 13,51 3,1г (12,7ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу у 62,4мл тетрапдрофурану, 2,05г знайдено 52,88 3,91 5,92 13,46 (25,9ммоль) піридину та 5,0г (19,2ммоль) 4ІЧ v = 3284, 1596, 1571, 1479, 1471, 1446, (трифторметокси)бензолсульфонілхлориду 1400, 1361, 1336, 1324, 1310, 1205, 1199, 1160, 1 1129, 1069, 884, 852, 755, 637, 611см Вихід 1,8г (29%) 1 Т пл = 180 - 182°С (гексан/етилацетат) Н ЯМР (ДМСО-de) 5 = 2,41 (6Н, с), 6,36 (2Н, с, Елементарний аналіз C16H15F3N2O7S2 (M = обмінюється з CF3COOD), 7,00 (2Н, с), 7,43 (1Н Т, 468,42) J = 7,2Гц), 7,53 - 7,59 (1Н, м), 7,72 (1Н, д, J = 8,3Гц), 7,88 (1Н, д, J = 8,7Гц), 7,95 - 7,99 (1Н, м), С, % Н, % F, % N, % S, % 8,32 (1Н, д, J = 7,3Гц), 8,82 (1Н, д, J = 1,9Гц), 11,10 розраховано 41,02 3,23 12,17 5,98 13,69 (1Н, с, обмінюється з CF3COOD) знайдено 41,06 3,29 11,81 6,13 13,41 ІЧ v = 1595, 1559, 1347, 1327, 1266, 1218, Приклад 39 (спосіб А2) 1164, 1138см1 І\І-[3,5-диметил-41 [(нітрометил)сульфоніл]феніл]-4Н ЯМР (ДМСО-de) 5 = 2,34 (6Н, с), 6,31 (2Н, с, біфенілсульфонамід обмінюється з CF3COOD), 6,85 (2Н, с), 7,47 (2Н, д, J = 8,2Гц), 7,87 - 7,92 (2Н, м), 11,07 (1Н, с, обмінюНазвану у заголовку сполуку одержували за ється з CF3COOD) процедурою Прикладу 6, починаючи з розчину 2,0г (8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфоПриклад 37 (спосіб А1) ніл]анілшу у 38мл тетрапдрофурану, 1,3мл г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]фе(16,1ммоль) піридину та 3,1г (12,3ммоль) 4ніл]-2,3,4,5,6-пентафторбензолсульфонамід біфенілсульфонілхлориду Названу у заголовку сполуку одержували за Реакційне середовище перемішували протяпроцедурою Прикладу 5, починаючи з розчину 1,3г гом 20год при кімнатній температурі, а потім на(5,32ммоль) 3,5-диметил-4-[(нітрометил)сульфогрівали до 40°С протягом 4год Кінцевий продукт ніл]анілшу у 50мл тетрапдрофурану, 1,1г очищали хроматографією на колонці з оксидом (11,0ммоль) карбонату кальцію та 2,1г (7,88ммоль) кремнію (елюент метиленхлорид) та перекристапентафторбензолсульфонілхлориду Реакційне лізацією із суміші гексану та етилацетату середовище перемішували протягом 68год при кімнатній температурі Кінцевий продукт очищали Вихід 0,68г (18%) хроматографією на колонці з оксидом кремнію Т пл - 206 - 208°С (гексан/етилацетат) (роз(елюент метиленхлорид) кл) Елементарний аналіз С21H20N2O6S2 (M = Вихід 0,4Г (16%) 460,51) Т пл = 128 - 130°С (гексан/метиленхлорид) С, % Н, % N, % S, % Елементарний аналіз C15H11F5N2O6S2 (M = розраховано 54,77 4,38 6,08 13,92 474,37) знайдено 54,90 4,43 6,05 13,58 С, % Н,% F, % N, % S, % ІЧ v = 3237, 1594, 1564, 1557, 1479, 1346, розраховано 37,98 2,34 20,03 5,91 13,52 1 1156, 1068, 764, 674, 626, 604см знайдено 37,94 2,38 19,65 5,75 13,40 1 ІЧ v = 1563, 1522, 1503, 1330, 1170, 1142, Н ЯМР (ДМСО-de) 5 = 2,53 (6Н, с), 6,49 (2Н, с, 992см 1 обмінюється з CF3COOD), 7,08 (2Н, с), 7,48 - 7,57 1 (ЗН, м), 7,75 - 7,78 (2Н, м), 7,94 - 8,04 (4Н, м), 11,20 Н ЯМР (ДМСО-de) 5 = 2,49 (6Н, с), 6,50 (2Н, с, (1Н, с, обмінюється з CF3COOD) обмінюється з CF3COOD), 7,03 (2Н, с), 12,1 (широкий пік, обмінюється з CF3COOD) Приклад 40 (спосіб А2) І\І-[3,5-диметил-4Приклад 38 (спосіб А2) [(нітрометил)сульфоніл]феніл]метансульфонамід І\І-[3,5-диметил-4Розчин 1,7г (14,8ммоль) метансульфонілхло[(нітрометил)сульфоніл]феніл]-2риду у 5мл безводного тетрапдрофурану додавадибензофурансульфонамід ли по краплям до розчину 2,7г (11,0ммоль) 3,5Названу у заголовку сполуку одержували за диметил-4-[(нітрометил)сульфоніл]анілшу та 1,6г процедурою Прикладу 6, починаючи з розчину 2,0г (20,2ммоль) піридину, висушеного над гідроксидом (8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфокалію, у 50мл безводного тетрапдрофурану, який ніл]анілшу у 38мл тетрапдрофурану, 1,3мл тримали під атмосферою азоту Суміш перемішу(16,1ммоль) піридину та 3,3г (12,3ммоль) 2вали протягом бгод ЗОхв при кімнатній темперадибензофурансульфонілхлориду [одержаного згітурі, а потім кип'ятили зі зворотним холодильнидно з М Janczewski and H Maziarczyk, Rocz Chem , ком протягом 4год Потім додавали 1,1г 47(11), 2055-2069(1973)] (9,60ммоль) метансульфонілхлориду і продовжуРеакційне середовище перемішували протя 40 39 56205 вали кип'ятіння ЗІ зворотним холодильником проочищали хроматографією на колонці з оксидом тягом 1год ЗОхв Додавали ще 1,1г (9,60ммоль) кремнію (елюент метиленхлорид) і перекристаліметансульфонілхлориду і продовжували кип'ятіння зацією із суміші гексану та етилацетату зі зворотним холодильником протягом 4год Після Вихід 2,1г (54%) охолодження реакційне середовище виливали до Т пл - 206 - 208°С (гексан/етилацетат) (розохолодженої льодом води і екстрагували метиленкл) хлоридом Об'єднані органічні екстракти висушуЕлементарний аналіз С21H18N2O7S2 (M = вали над сульфатом натрію і концентрували до 474,49) сухого залишку при зниженому тиску Одержаний С, % Н, % N, % залишок перекристалізовували з охолодженої сурозраховано 53,15 3,82 5,90 міші гексану та етилацетату, одержуючи 1,1г (вихід знайдено 53,34 3,95 5,68 = 22%) г\І-[3,5-диметил-4-[(нггрометил)сульфоІЧ v = 3274, 1592, 1561, 1462, 1343, 1324, ніл]феніл]метансульфонаміду, який містив 1201, 1180, 1158, 1139, 1068, 852, 745, 705, 653, 1 14%мол етилацетату 632см 1 Т пл = 138 - 140°С (гексан/етилацетат) Н ЯМР (ДМСО-de) 5 = 2,52 (6Н, с), 6,46 (2Н, с, Елементарний аналіз C10H14N2O6S2 (M = обмінюється з CF3COOD), 7,09 (2Н, с), 7,53 - 7,55 322,35), 14%С 4 Н 8 О 2 (1Н, м), 7,69 - 7,72 (1Н, м), 7,84 (1Н, д, J = 8,3Гц), С, % Н, % N, % S, % 7,96 - 8,00 (1Н, м), 8,28 - 8,33 (2Н, м), 8,44 (1Н, д, J розраховано 38,18 4,61 8,32 19,05 = 8,1 Гц), 11,25 (1Н, с, обмінюється з CF3COOD) знайдено 37,90 4,55 8,12 18,62 Приклад 43 (спосіб А1) ІЧ v = 3269, 1598, 1569, 1344, 1339, 1309, |\|-[2-Хлор-4-[3,5-диметил-41142см 1 [(нітрометил)сульфоніл]фенілсульфамоіл]-фе1 ніл]ацетамід Н ЯМР (ДМСО-de) 5 = 2,58 (6Н, с), 3,23 (ЗН, с), 3,5 (1 Н, широкий пік, обмінюється з CF3COOD), Названу у заголовку сполуку одержували за 6,52 (2Н, с, обмінюється з CF3COOD), 7,09 (2Н, с) процедурою Прикладу 22, використовуючи 3,3г (12,3ммоль) 4-ацетамідо-З-хлорбензолсульфонілПриклад 41 (спосіб С) хлориду 1-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-3Реакційне середовище перемішували протя(фенілсульфоніл)сечовина гом 7год ЗОхв при кімнатній температурі, а потім кип'ятили зі зворотним холодильником протягом Названу у заголовку сполуку одержували за 7год ЗОхв Твердий залишок, одержаний після процедурою Прикладу 20, починаючи з суспензії концентрування при зниженому тиску, тритурували 2,8г (11,5ммоль) 3,5-диметил-4-[(нітрометил)сульз гексану, а потім промивали сумішшю гексану та фоніл]-анілшу у 56мл метиленхлориду та розчину етилацетату, і зрештою промивали етанолом 2,0г (10,9ммоль) бензолсульфонілізоціанату у 15мл метиленхлориду Вихід 0,1г (2,6%) Залишковий етилацетат вилучали з кінцевого Т пл =209-211 °С продукту кип'ятінням ЗІ зворотним холодильником Елементарний аналіз C17H18CIN3O7S2 (M = у метиленхлориді протягом 2год 475,92) Вихід 4,5г (96%) С, % Н, % СІ, % N, % S, % Т пл = 140 - 142°С (гексан/етилацетат) розраховано 42,90 3,81 7,45 8,83 13,47 Елементарний аналіз C16H17N3O7S2 (M = знайдено 42,75 3,91 7,75 8,77 13,01 427,44) ІЧ v = 3402, 3276, 1722, 1583, 1550, 1514, С, % Н, % N, % S, % 1349, 1174, 1163,631см 1 1 розраховано 44,96 4,01 9,83 15,00 Н ЯМР (ДМСО-de) 5 = 2,04 (ЗН, с), 2,39 (6Н, знайдено 45,15 4,16 10,15 14,71 с), 6,36 (2Н, с, обмінюється з CF3COOD), 6,90 (2Н, ІЧ v= 1658, 1587, 1567, 1529, 1463, 1326, с), 7,74 (1Н, дд, J = 8,7 та 2,2Гц), 7,86 (1Н, д, J = 1152, 1086, 899см 1 2,2Гц), 8,01 (1Н, д, J = 8,7Гц), 9,64 (1Н, с, обміню1 ється з CF3COOD) Н ЯМР (ДМСО-de) 5 = 2,31 (6Н, с), 6,26 (2Н, с, обмінюється з CF3COOD), 7,09 (2Н, с), 7,41 - 7,54 Приклад 44 (спосіб А2) (ЗН, м), 7,76 - 7,79 (2Н, м), 9,06 (1Н, с, обмінюється І\І-[3,5-диметил-4з CF3COOD), 10,96 (1Н, широкий пік, обмінюється [(нітрометил)сульфоніл]феніл]-2-метоксибензолз CF3COOD) сульфонамід Приклад 42 (спосіб А2) Названу у заголовку сполуку одержували за г\І-[3,5-диметил-4-[(нггрометил)сульфоніл]-3процедурою Прикладу 18, починаючи з розчину дибензофурансульфонамід 2,0г (8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]-анілшу у 50мл тетрапдрофурану, Названу у заголовку сполуку одержували за 1,31г (16,2ммоль) піридину та 2,53г (12,2ммоль) 2процедурою Прикладу 6, починаючи з розчину 2,0г метоксибензолсульфонілхлориду [одержаного (8,19ммоль) 3,5-диметил-4-[(нітрометил)сульфозгідно з Н Meerwein et al , Chem Ber 90, 841-852 ніл]-аніліну у 40мл тетрапдрофурану, 1,29г (1957)] (16,3ммоль) піридину та 3,0г (12,3ммоль) 3дибензофурансульфонілхлориду (одержаного згіКінцевий продукт очищали хроматографією на дно з М Janczewski and H Maziarczyk, Rocz Chem, колонці з оксидом кремнію (елюент метиленхло48(11), 1907-1919(1974)] рид) Реакційне середовище перемішували протяВихід 1,8г (53%) гом 2год при кімнатній температурі, а потім нагріТ пл = 172 - 174°С (гексан/етилацетат) вали до 40°С протягом 24год Кінцевий продукт Елементарний аналіз C16H18N2O7S2 (M = 41 56205 414,44) розраховано знайдено С, % 46,37 46,34 Н, % 4,38 4,29 N, % 6,76 6,74 S, % 15,47 15,29 ІЧ v = 3261, 1595, 1559, 1486, 1335, 1323, 1 1282, 1166, 1157, 1132, 1072, 600см 1 Н ЯМР (ДМСО-de) 5 = 2,59 (6Н, с), 3,98 (ЗН, с), 6,57 (2Н, с, обмінюється з CF 3 COOD), 7,10 (2Н, с), 7 , 2 3 - 7 , 2 9 (1Н, м), 7,34 (1Н, д, J = 8,1 Гц), 7 , 7 4 7,80 (1Н, м), 8,06 - 8,09 (1Н, м), 10,99 (1Н, с, обмінюється з CF 3 COOD) Приклад 45 (спосіб А2) ІЧ-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-2метилбензолсульфонамід Названу у заголовку сполуку одержували за процедурою Прикладу 27, починаючи з розчину 2,6г (Ю.бммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]-анілшу у 65мл тетрапдрофурану, 1,69мл (20,9ммоль) піридину та Зг (15,7ммоль) ортотолуолсульфонілхлориду Суміш перемішували при кімнатній температурі протягом 24 годин, потім нагрівали до 40°С протягом 8 годин, і потім залишали на 24 години при кімнатній температурі Вихід 0 , 2 9 Г (6,8%) Т пл = 118 - 120°С (гексан/етилацетат) Елементарний аналіз C16H18N2O6S2 (M = 398,44) С, % Н, % N, % S, % розраховано 48,23 4,55 7,03 16,09 знайдено 48,37 4,40 7,10 15,77 ЯМР свідчить про присутність ортометильного ізомеру (біля 50%), у суміші з мета- та пара-ізомерами (біля 50% обидва), причиною чого є той факт, що комерційний ортотолуолсульфонілхлорид (ТСІ) є у ДІЙСНОСТІ сумішшю ізомерів (про що свідчить його ЯМР-спектр) Приклад 46 (спосіб А2) І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-3метоксибензолсульфонамід Названу у заголовку сполуку одержували за процедурою Прикладу 2, починаючи з 2г (8,18ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу, 50мл тетрапдрофурану, 1,3мл (16,1ммоль) піридину та 2,5г (12,3ммоль) 3метоксибензолсульфонілхлориду (одержаного згідно з М Ludwig et al , Collect Czech Chem Commun 1984, 49, (5), 1182) Вихід 0,83г (24,7%) T пл = 166 - 168°С (гексан/етилацетат) Елементарний аналіз C16H18N2O7S2 (M = 414,44) С, % Н, % N, % S, % розраховано 46,37 4,38 6,76 15,47 знайдено 46,37 4,48 6,70 15,31 1 Н ЯМР (ДМСО-de) 5 = 3,85 (ЗН, с), 6,5 (2Н, с, обмінюється з CF 3 COOD), 7,05 (2Н, с), від 7,25 до 7,65 (4Н, м), 11,1 (1Н, с, обмінюється з CF 3 COOD) Приклад 47 (спосіб А1) І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-3піридинсульфонамід Названу у заголовку сполуку одержували за процедурою Прикладу 5, починаючи з 1,7г 42 (7ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу, 40мл тетрапдрофурану, 2,8г (28ммоль) СаСО 3 та 1,9г (10,5ммоль) 3-піридинсульфонілхлориду (одержаного згідно з Fuerst et al , J Prakt Chemie, 1967, 36, 160), перемішуючи протягом 5 годин при кімнатній температурі Сировинний продукт піддавали хроматографії на оксиді кремнію з сумішшю СНгС^/МеОН (98 2), а потім перекристалізовували з суміші гексан/етилацетат Вихід 0,11г (4%) Т пл = 191 - 192°С (гексан/етилацетат) Елементарний аналіз Ci4HisN 3 O6S2 (M = 385,42) С, % Н, % N, % S, % розраховано 43,63 3,92 10,90 16,64 знайдено 43,62 3,99 10,91 16,76 1 Н ЯМР (ДМСО-de) 5 = 6,5 (2Н, с, обмінюється з CF 3 COOD), 7,03 (2Н, с), 7,64 (1Н, дд), 8,28 (1Н, дт), 8,85 (1Н, дд), 9,06 (1Н, д), 11,3 (1Н, с, обмінюється з CF 3 COOD) Приклад 48 (спосіб А2) І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-(2трифторметилфеніл)-метансульфонамід Названу у заголовку сполуку одержували за процедурою Прикладу 2, починаючи з Зг (12,28ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу, 57мл безводного тетрапдрофурану, 2мл (24,7ммоль) піридину та 4,8г (18,5ммоль) (2трифторметилфеніл)метансульфонілхлориду (одержаного згідно з Hamer et al , J Pharm Sci , 1975, 64, 1961) Одержаний продукт перекристалізовували з суміші гексан/етилацетат Вихід 1,37г (24%) Т пл = 191 - 192°С (гексан/етилацетат) Елементарний аналіз Ci7Hi7F3N2O6S2 С, % Н, % F, % N, % S, % розраховано 43,77 3,67 12,22 6,01 13,75 знайдено 43,72 3,90 11,97 6,03 13,65 1 Н ЯМР (ДМСО-de) 5 = 2,3 (6Н, с), 4,6 (2Н, с), 6,27 (2Н, с, обмінюється з CF 3 COOD), 6,71 (2Н, с), від 7,4 до 7,6 (4Н, м), 10,6 (1 Н, с, обмінюється з CF 3 COOD) Приклад 49 (спосіб А2) І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-(3-фторфеніл)метансульфонамід Названу у заголовку сполуку одержували за процедурою Прикладу 2, починаючи з Зг (12,28ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу, 57мл безводного тетрапдрофурану, 2мл (24,7ммоль) піридину та 3,85г (18,4ммоль) (3фторфеніл)метансульфонілхлориду (одержаного згідно з патентом США №3471474) Продукт перекристалізовували з суміші гексан/етилацетат Вихід 0,45г (8,8%) Т пл = 191 - 192°С (гексан/ЕЮАс) Елементарний аналіз C17H17FN2O6S2 (M = 416,45) С, % Н, % F, % N, % S, % розраховано 46,15 4,11 4,56 6,73 15,40 знайдено 45,96 4,05 4,62 6,73 15,44 1 Н ЯМР (ДМСО-de) 5 = 2,28 (6Н, с), 4,5 (2Н, с), 6,24 (2Н, с, обмінюється з CF 3 COOD), 6,71 (2Н, с), від 6,85 до 7,0 (ЗН, м), від 7,11 до 7,21 (1Н, м), 43 56205 10,25 (1H, с, обмінюється з CF 3 COOD) Приклад 50 (спосіб А2) ІЧ-[3-[[3,5-диметил-4[(нітрометил)сульфоніл]феніламшо]сульфоніл]феніл]ацетамід Названу у заголовку сполуку одержували за процедурою Прикладу 2, починаючи з 2г (8,18ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу, 50мл безводного тетрапдрофурану, 1,3мл (16,1ммоль) піридину та розчину 3,8г (16,2ммоль) 3-ацетиламшобензолсульфонілхлориду (одержаного згідно з Вагсо et al , Synthesis, 1974, 877) у 50мл безводного тетрапдрофурану Після упарювання розчинника для екстракції залишок піддають хроматографії на оксиді кремнію з використанням як елюенту суміші гексану та етилацетату (1 1), а потім ДВІЧІ перекристалізовують з метиленхлориду Вихід 0,775г (21,4%) Т пл = 1 0 8 - 1 1 0 о С ( С Н 2 С І 2 ) Елементарний аналіз C17H19N3O7S2 (M = 441,48) С, % Н, % N, % S, % розраховано 46,25 4,34 9,52 14,53 знайдено 46,15 4,5 9,29 14,17 1 Н ЯМР (ДМСО-de) 5 = 2,08 (ЗН, с), 2,48 (6Н, с), 6,45 (2Н, с, обмінюється з CF 3 COOD), 7,0 (2Н, с), від 7,5 до 7,7 (ЗН, м), 8,36 (1Н, м), 10,3 (1Н, с, обмінюється з CF3COOD), 11,15 (1Н, с, обмінюється з CF 3 COOD) Приклад 51 (спосіб А2) І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-(2-метилфеніл)метансульфонамід Названу у заголовку сполуку одержували за процедурою Прикладу 2, починаючи з 2г (8,18ммоль) 3,5-диметил-4[(нітрометил)сульфоніл]аніліну, 38мл безводного тетрапдрофурану, 1,3мл (16,1ммоль) піридину та 2,5г (12,2ммоль) (2-метилфеніл)метансульфонілхлориду Після упарювання розчинника для екстракції залишок піддають хроматографії на оксиді крем розраховано знайдено 1 С, % 38,80 38,64 Вихід 1,1г (18%) Т пл = 1 5 2 - 1 5 4 ° С (гексан/ЕЮАс) Елементарний аналіз Ci6H 495,35) Н, % 3,26 3,22 Н ЯМР (ДМСО-de) 5 = 2,65 (6Н, с), 4,85 (2Н, с), 6,60 (2Н, с, обмінюється з CF 3 COOD), 7,08 (2Н, с), від 7,45 до 7,74 (ЗН, м), 10,8 (1Н, с, обмінюється з CF 3 COOD) Вихідний матеріал - (4-бром-2-фторфеніл)метансульфонілхлорид одержують з 4-бром-2фторбензилброміду за методикою J Nakayama et al , Tetrahedron Letters, 1984, 25 (40) 4553 Вихід 90% Маслянисту рідину очищають флешхроматографією на S1O2, елююючи СН2СІ2 1 Н ЯМР (CDCI 3 ) 5 = 4,8 (2Н, с), від 7,2 до 7,4 (4Н, м) Приклад 53 (спосіб А2) І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]циклогексилметансульфонам 44 нію, використовуючи як елюент перший раз метиленхлорид, а другий раз використовуючи суміш гексан/етилацетат (1 1) Зрештою, продукт перекристалізовують з суміші гексан/етилацетат Вихід 0 , 1 9 Г (5,6%) Т пл = 1 6 7 - 169°С (гексан/ЕЮАс) Елементарний аналіз C17H20N2O6S2 (M = 412,49) С, % Н, % N, % розраховано 49,50 4,89 6,79 знайдено 49,73 4,90 6,55 1 Н ЯМР (ДМСО-de) 5 = 2,3 (ЗН, с), 2,5 (6Н, с), 4,68 (2Н, с), 6,43 (2Н, с, обмінюється з CF 3 COOD), 6,91 (2Н, с), від 7,1 д о 7 , 3 ( 4 Н , м), 10,5 (1Н, с, обмінюється з CF 3 COOD) Вихідний матеріал - (2-метилфеніл)метансульфонілхлорид - одержують з альфа-хлор-ортоксилолу за методикою J Nakayama et al , Tetrahedron Letters, 1984, 25 (40) 4553 Вихід 3 1 % T пл = 46 - 48°С 1 Н ЯМР (CDCI 3 ) 5 = 2,4 (ЗН, с), 4,9 (2Н, с), від 7,15 до 7,40 (4Н, м) Приклад 52 (спосіб А2) 4-Бром-І\І-[3,5-диметил-4[(нітрометил)сульфоніл]феніл]-(2-фторфеніл)метансульфонамід Названу у заголовку сполуку одержували за процедурою Прикладу 2, починаючи з Зг (12,28ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу, 57мл безводного тетрапдрофурану, 2мл (24,7ммоль) піридину та 5,3г (19,78ммоль) (4бром-2-фторфеніл)метансульфонілхлориду Після упарювання розчинника залишок ДВІЧІ піддають хроматографії на оксиді кремнію, елююючи СН2СІ2, і ДВІЧІ перекристалізовують з суміші гексан/етилацетат Вг, % 16,13 16,15 F, % 3,84 3,30 N, % 5,66 5,50 S, % 12,95 12,86 |Д 3,2г (16,1ммоль) циклогексилметансульфонілхлориду (одержаного за методикою J F King et al , J Am Chem Soc , 1992, Ц 4 (5), 1743) додають по краплям до охолодженої до -20°С суміші 2г (8,18ммоль) 3,5-диметил-4-[(нітрометил)сульфоніл]анілшу, 50мл безводного тетрапдрофурану, 1,3мл (16,1ммоль) піридину, яку тримають під атмосферою азоту, і одержану суміш перемішують протягом 6 годин при -20°С Суміш залишають на ніч при -20°С, потім дають можливість нагрітись до кімнатної температури і перемішують протягом 24 годин при кімнатній температурі, а потім кип'ятять зі зворотним холодильником протягом 13 годин Суміш охолоджують, виливають у воду, підкислюють до рН = 3 за допомогою 1Н НСІ, екстрагують СН2СІ2, промивають водою, висушують над 46 45 56205 Na2SO4, фільтрують та упарюють під вакуумом [(нітрометил)сульфоніл]феніл]-1,8-октандіамід Залишок очищають хроматографією на оксиді 0,8637г (4,09ммоль) субероілхлориду додавакремнію, елююючи СН2СІ2, а потім перекристаліли до суміші 2г (8,18ммоль) 3,5-диметил-4зовують з суміші гексан/етилацетат [(нітрометил)сульфоніл]аніліну, 50мл безводного тетрапдрофурану та 1,64г (16,3ммоль) карбонату Вихід 0,085г (2,5%) кальцію, яку тримали під атмосферою азоту, і одеТ пл = 126-128°С ржану суміш перемішували протягом ночі при кімЕлементарний аналіз C16H24N2O6S2 + 17% натній температурі Цю суміш виливали у воду, С6Ні4 (М = 404,51 + 0,17 х 86,18) підкислювали до рН = 3 розведеною НСІ і нерозС, % Н, % N, % S, % чинний матеріал відфільтровували Фільтрат екстрозраховано 48,77 6,34 6,68 15,30 рагували етилацетатом і органічну фазу промивазнайдено 48,53 6,20 6,66 14,91 1 ли водою, висушували над сульфатом натрію, Н ЯМР (ДМСО-de) 5 = від 1,0 до 1,3 (5Н, м), фільтрували і упарювали під вакуумом Одержавід 1,5 до 1,7 (ЗН, м), від 1,75 до 1,90 (ЗН, м), 2,5 ний залишок об'єднували з першим нерозчинним (6Н, с), від 3,15 до 3,22 (2Н, м), 6,48 (2Н, с, обміматеріалом і перекристалізовували з суміші етанюється з CF3COOD), 7,03 (2Н, с), 10,5 (1Н, с, обнол/ДМФ мінюється з CF3COOD) Вихід 0,79г (15,4%) Приклад 54 Т пл = 235 - 238°С (ЕЮН/ДМФ) Натрієва сіль І\І-[3,5-диметил-4Елементарний аналіз C26H34N4O10S2 (M = [(нітроме626,68) тил)сульфоніл]феніл]бензолсульфонаміду С, % Н, % N, % S, % Суміш 0,34г (0,884ммоль) І\І-[3,5-диметил-4розраховано 49,83 5,47 8,94 10,23 [(нітрометил)сульфоніл]феніл]бензолсульфонаміду та 0,149г (1,77ммоль) бікарзнайдено 49,96 5,60 9,16 9,86 бонату натрію у 15мл дистильованої води переміІЧ v = 3363 та 1667см 1 1 шують протягом 24 годин при кімнатній темпераНЯМР(ДМСО^ 6 ) 5 = від 1,25 до 1,35 (4Н, м), турі від 1,5 до 1,6 (4Н, м), 2,3 (4Н, т), 2,48 (12Н, с), 6,42 Одержаний розчин упарюють під високим ва(4Н, с, обмінюється з CF3COOD), 7,5 (4Н, с), 10,2 куумом при температурі
ДивитисяДодаткова інформація
Назва патенту англійськоюNitromethylthiobenzene derivatives as aldehydreductase inhibitors
Назва патенту російськоюПроизводные нитрометилтиобензола как ингибиторы альдегидредуктазы
МПК / Мітки
МПК: A61K 31/18, A61P 27/00, C07D 333/34, A61K 31/381, C07C 317/40, A61P 13/12, C07C 317/34, A61K 31/343, C07D 213/71, C07C 317/42, C07D 307/91, C07C 323/49, A61P 25/00, A61K 31/4406, A61P 43/00, C07D 307/82, A61P 3/10, A61K 31/167, A61P 9/00
Мітки: варіанти, альдегідредуктази, нітрометилтіобензолу, похідні, отримання, спосіб, інгібітори, фармацевтична, композиція
Код посилання
<a href="https://ua.patents.su/25-56205-pokhidni-nitrometiltiobenzolu-yak-ingibitori-aldegidreduktazi-sposib-kh-otrimannya-varianti-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні нітрометилтіобензолу як інгібітори альдегідредуктази, спосіб їх отримання (варіанти) та фармацевтична композиція</a>
Попередній патент: Незнімний адгезівний мостовидний зубний протез
Наступний патент: Похідні 4-(1-піперазиніл)бензойної кислоти, спосіб їх одержання та фармацевтична композиція
Випадковий патент: Спосіб хімічної інфільтрації в паровій фазі для ущільнення пористих волокнистих заготовок, розташованих кільцеподібно штабелями