Полісахариди з антитромботичною активністю, що мають ковалентний зв’язок з біотином або похідним біотину
Номер патенту: 79736
Опубліковано: 25.07.2007
Автори: Ербер Жан-Марк, Д'юшоссуа Філіпп, Петіту Моріс, Саві П'єр
Формула / Реферат
1. Синтетичні полісахариди з антитромботичною активністю і їх фармацевтично прийнятні солі, які відрізняються тим, що мають щонайменше один ковалентний зв'язок з біотином або похідною біотину.
2. Полісахариди за п. 1, які відрізняються тим, що є сполуками формули (І):
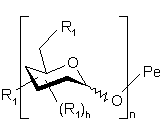 ,
,
у якій:
хвиляста лінія означає зв'язок, розташований нижче або вище площини піранозового кільця,
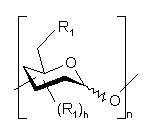 , (Po)
, (Po)
Ро означає полісахарид, який включає n ідентичних або різних моносахаридних одиниць, зв'язаних через їх аномерний карбон з Ре, а
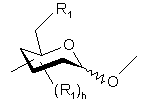
є схемою, що репрезентує моносахаридну одиницю з піранозною структурою, вибрану з гексоз, пентоз і відповідних деоксицукрів, причому ця одиниця з'єднана через її аномерний карбон з іншою моносахаридною одиницею, а гідроксильні групи цієї одиниці заміщені однаковими або різними групами R1, визначеними нижче,
Ре є пентасахаридом структури:
 , (Pe)
, (Pe)
де h = 1 або 2,
n - ціле, яке може мати значення від 0 до 25,
R1 - зв'язок -T-Biot, (С1-С6)алкоксигрупа або група –ОSО3-,
R2 - зв'язок -T-Biot, (С1-С6)алкоксигрупа або група –ОSО3-,
R3 - зв'язок -T-Biot або (С1-С6)алкоксигрупа,
R4 - зв'язок -T-Biot, (С1-С6)алкоксигрупа або група ОSО3-, або R4 утворює місток -O-CH2-, де -СН2-група, приєднана до атома карбону, який у тому ж кільці несе карбоксильну функціональну групу, причому щонайменше один з замісників R1, R2, R3 або R4 є групою -T-Biot, і
W - атом оксигену або метиленова група,
Т - один зі зв'язків, вибраний з:
NH,
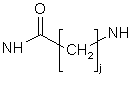
або
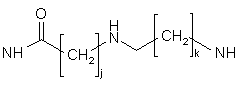 ,
,
де j i k, однакові або різні, є цілими і можуть мати значення від 1 до 10, і
- Biot-група
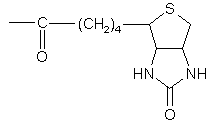 ,
,
і їх фармацевтично прийнятні солі.
3. Полісахариди за п. 1 або п. 2, які відрізняються тим, що є сполуками формули (І.1):
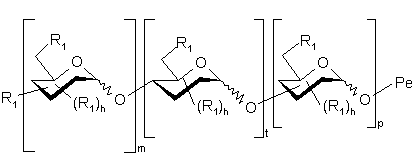 , (I.1)
, (I.1)
де:
означає специфічну родину полісахаридів Ро, приєднаних через їх аномерний карбон до Ре, як це було показано для (І),
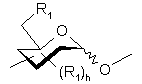
є ідентичною визначеній для (І),
- групи R1 є ідентичними визначеним для (І) і у одному і тому ж моносахариді можуть бути ідентичними або різними,
- моносахарид у []m повторюється m разів, моносахарид у []t повторюється t разів і моносахарид у []р повторюється р разів, де m - ціле, що змінюється від 1 до 5, t - ціле, що змінюється від 0 до 24 і р - ціле, що змінюється від 0 до 24, причому ![]() , і їх фармацевтично прийнятні солі.
, і їх фармацевтично прийнятні солі.
4. Полісахариди за п. 3, які відрізняються тим, що у них лише один з замісників R1, R2, R3 або R4 репрезентує зв'язок -T-Biot, де Т і Biot визначені, як для (І).
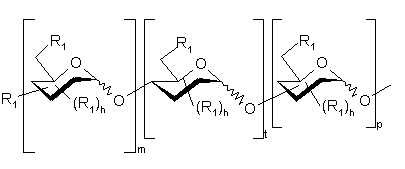
5. Полісахариди за будь-яким з пп. 1-4, які відрізняються тим, що є гексадекасахаридами формули (I.2)
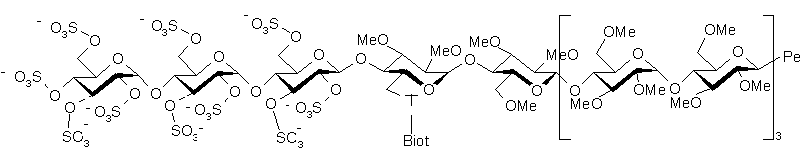 , (I.2)
, (I.2)
де
Т - один зі зв'язків, вибраний з:
NH
або
 ,
,
або
 ,
,
де j i k, однакові або різні, є цілими, що можуть приймати значення від 1 до 10;
Biot-група
 ,
,
Ре - пентасахарид структури
 , (Pe)
, (Pe)
де:
R1 - (С1-С6)алкоксигрупа або група -ОSО3-,
R2 - (С1-С6)алкоксигрупа або група -ОSО3-,
R3 - (С1-С6)алкоксигрупа,
R4 - (С1-С6)алкоксигрупа або група ОSО3-, або R4 утворює місток -O-СН2-, де група –CH2-з'єднана з атомом карбону, який несе карбоксильну функціональну групу на тому ж кільці, W - атом оксигену або метиленова група,
і їх фармацевтично прийнятні солі.
6. Полісахариди за п. 1 або п. 2, які відрізняються тим, що є пентасахаридами формули (І.3):
 , (I.3)
, (I.3)
де R1, R2, R3, R4 і W є ідентичними визначеним для (І), і їх фармацевтично прийнятні солі.
7. Полісахариди за п. 6, які відрізняються тим, що у них лише один з замісників R1, R2, R3 або R4 репрезентує зв'язок T-Biot, де Т і Biot, визначені, як для (І).
8. Полісахариди за п. 6 або п. 7, які відрізняються тим, що є сполуками формули (І.4):
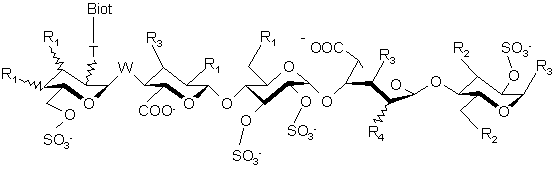 , (I.4)
, (I.4)
де Т - один зі зв'язків, вибраний з:
NH
або
 ,
,
або
 ,
,
де j i k, однакові або різні, є цілими, що можуть приймати значення від 1 до 10;
Biot-група:
 ,
,
R1 - (С1-С6)алкоксигрупа або група –ОSО3-,
R2 - (С1-С6)алкоксигрупа або група –ОSО3-,
R3 - (С1-С6)алкоксигрупа,
R4 - (С1-С6)алкоксигрупа або група ОSО3-, або R4 утворює місток -O-СН2-, де група –CH2-з'єднана з атомом карбону, який несе карбоксильну функціональну групу на тому ж кільці, W - атом оксигену або метиленова група,
і їх фармацевтично прийнятні солі.
9. Полісахариди за п. 1 або п. 2, які відрізняються тим, що вибрані з таких сполук:
метил (2,3,4,6-тетра-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(6-біотин-амідо-6-деокси-2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(6-біотин-амідо-6-деокси-2,3-ди-O-метил-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-![]() -D-глюко-піранозил)-(1—>4)-[(2,3,6-три-O-метил-
-D-глюко-піранозил)-(1—>4)-[(2,3,6-три-O-метил-![]() -D-глюкопіранозил)-(1—>4)-O-(2,3,6-три-O-метил-
-D-глюкопіранозил)-(1—>4)-O-(2,3,6-три-O-метил-![]() -D-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3-ди-O-метил-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-О-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-О-метил-![]() -D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-
-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-![]() -D-глюкопіранозид, натрієва сіль,
-D-глюкопіранозид, натрієва сіль,
метил(2,3,4,6-тетра-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(6-[6-(біотинамідо)-гексамідо]-6-деокси-2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(6-[6-(біотинамідо)-гексамідо]-6-деокси-2,3-ди-O-метил-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-![]() -D-глюкопіранозил)-(1—>4)-[(2,3,6-три-O-метил-
-D-глюкопіранозил)-(1—>4)-[(2,3,6-три-O-метил-![]() -D-глюкопіранозил)-(1—>4)-O-(2,3,6-три-O-метил-
-D-глюкопіранозил)-(1—>4)-O-(2,3,6-три-O-метил-![]() -D-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3-ди-O-метил-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -D-глюкопіранозилуроновакислота)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозилуроновакислота)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-
-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-![]() -D-глюкопіранозид, натрієва сіль,
-D-глюкопіранозид, натрієва сіль,
метил (2,3,4,6-тетра-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонат-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(6-[6-(6-біотанамідогексамідо)гексамідо]-6-деокси-2, 3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(6-[6-(6-біотанамідогексамідо)гексамідо]-6-деокси-2, 3-ди-O-метил-![]() -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-![]() -D-глюкопіранозил)-(1—>4)-[(2,3,6-три-O-метил-
-D-глюкопіранозил)-(1—>4)-[(2,3,6-три-O-метил-![]() -D-глюкопіранозил)-(1—>4)-O-(2,3,6-три-O-метил-
-D-глюкопіранозил)-(1—>4)-O-(2,3,6-три-O-метил-![]() -D-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3-ди-O-метил-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-
-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-![]() -D-глюкопіранозид, натрієва сіль,
-D-глюкопіранозид, натрієва сіль,
метил (2-біотинамідо-2-деокси-3,4-ди-O-метил-6-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -L-ідопіранозилуронова кислота) - (1—>4)-2,3,6-три-О-сульфонат-
-L-ідопіранозилуронова кислота) - (1—>4)-2,3,6-три-О-сульфонат-![]() -D-глюкопіранозид, натрієва сіль,
-D-глюкопіранозид, натрієва сіль,
метил (2-[6-(6-біотинамідогексамідо)гексамідо]-2-деокси-3,4-ди-O-метил-6-O-сульфонат-![]() -D-глюко-піранозил)-(1—>4) - (2,3-ди-O-метил-
-D-глюко-піранозил)-(1—>4) - (2,3-ди-O-метил-![]() -D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-
-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-![]() -D-глюкопіранозид, натрієва сіль,
-D-глюкопіранозид, натрієва сіль,
метил (2-[6-(6-біотинамідогексамідо)гексамідо]-2-деокси-3,4-ди-O-метил-6-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-
-D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-![]() -D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-
-D-глюкопіранозил)-(1—>4)-(2,3-ди-O-метил-![]() -L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-
-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-![]() -D-глюкопіранозид, натрієва сіль.
-D-глюкопіранозид, натрієва сіль.
10. Фармацевтична композиція, яка містить як активний агент полісахарид за будь-яким з пп. 1-9, як варіант, у комбінації з одним або кількома інертними відповідними наповнювачами.
11. Застосування фармацевтичної композиції за п. 10 при патологіях, що є наслідком модифікування гомеостазу коагуляційної системи, яке виникає при розладах серцево- і церебросудинної систем, наприклад, при тромбоемболічних розладах, пов'язаних з атеросклерозом і діабетом, наприклад, при нестабільній стенокардії, апоплексії, постангіопластичному рестенозі, ендартеректомії або введенні ендоваскулярного протезу, при тромбоемболічних розладах, пов'язаних з посттромболізним ретромбозом, з інфарктом, слабоумством ішемічного походження, з захворюваннями периферійних артерій, гемодіалізом або фібриляціями передсердя, з використанням протезів для аортокоронарного шунта; для лікування або профілактики тромбоемболічних патологій венного походження, наприклад, легеневого емболізму, для профілактики або лікування тромботичних ускладнень, що виникають після хірургічних операцій, в результаті розвитку пухлин або порушень коагуляції, викликаних бактеріями, вірусами або ензимами.
12. Застосування полісахариду за будь-яким з пп. 1-9 для покриття протезів.
13. Застосування полісахариду за будь-яким з пп. 1-9 як допоміжного засобу під час ендартеректомії, яку виконують з пористими балонами.
14. Спосіб нейтралізації антитромботичного ефекту полісахаридів за п.1 у пацієнта, який полягає в тому, що зазначеному пацієнту призначають ефективну кількість авідину або стрептавідину.
15. Застосування авідину або стрептавідину для приготування медикаментів, призначених нейтралізувати антитромботичний ефект полісахаридів за будь-яким з пп. 1-9.
Текст
1. Синтетичні полісахариди з антитромботичною активністю і їх фармацевтично прийнятні солі, які відрізняються тим, що мають щонайменше один ковалентний зв'язок з біотином або похідною біотину. 2. Полісахариди за п. 1, які відрізняються тим, що є сполуками формули (І): 2 3 79736 4 O NH NH R1 CH2 або R1 O NH H N NH k O (R1) h O HN є ідентичною визначеній для (І), - групи R1 є ідентичними визначеним для (І) і у одному і тому ж моносахариді можуть бути ідентичними або різними, - моносахарид у []m повторюється m разів, моносахарид у [] t повторюється t разів і моносахарид у []р повторюється р разів, де m - ціле, що змінюється від 1 до 5, t - ціле, що змінюється від 0 до 24 і р ціле, що змінюється від 0 до 24, причому 1 £ m + t + p £ 25 , і їх фармацевтично прийнятні солі. 4. Полісахариди за п. 3, які відрізняються тим, що у них лише один з замісників R1, R2, R3 або R4 репрезентує зв'язок -T-Biot, де Т і Biot визначені, як для (І). 5. Полісахариди за будь-яким з пп. 1-4, які відрізняються тим, що є гексадекасахаридами формули (I.2) NH O , і їх фармацевтично прийнятні солі. 3. Полісахариди за п. 1 або п. 2, які відрізняються тим, що є сполуками формули (І.1): R1 R1 O R1 O O Pe (R1 )h O (R 1)h (R1)h O O t p m , (I.1) де: - OS 3 O3S O O3 S O O O3S O O O O -OS 3 SO 3 MeO O O O O O -O S - 3 SO3 O O O O MeO O3S SO3 O O O MeO NH CH2 j , або H N CH2 CH2 k NH j , де j i k, однакові або різні, є цілими, що можуть приймати значення від 1 до 10; Biot-група S (CH2)4 3 Biot R1 R1 R3 R1 R1 W O O OOC CO O O R2 R3 SO 3O O O O O O SO3 R3 O R4 R2 SO3 , (Pe) де: R1 - (С1-С6)алкоксигрупа або група -ОSО3-, R2 - (С1-С6)алкоксигрупа або група -ОSО3-, R3 - (С1-С6)алкоксигрупа, R4 - (С1-С6)алкоксигрупа або група ОSО3-, або R4 утворює місток -O-СН2-, де група –CH2-з'єднана з атомом карбону, який несе карбоксильну функціональну груп у на тому ж кільці, W - атом оксигену або метиленова група, і їх фармацевтично прийнятні солі. 6. Полісахариди за п. 1 або п. 2, які відрізняються тим, що є пентасахаридами формули (І.3): R1 NH O , (I.2) O O HN Pe OM e OM e O MeO SO3 O C MeO O OM e OM e OMe MeO O O де Т - один зі зв'язків, вибраний з: NH або NH p S (CH 2)4 O (R1 )h O O R1 O NH (R1)h означає специфічну родину полісахаридів Ро, приєднаних через їх аномерний карбон до Ре, як це було показано для (І), , де j i k, однакові або різні, є цілими і можуть мати значення від 1 до 10, і - Biot-група R1 (R1 )h O O m j C O t CH 2 CH2 R1 R1 O j R1 R1 O O , Ре - пентасахарид структури SO3 (I.3) O R1 R3 R1 W COO O - OOC O R2 R3 O SO3O O O O O O SO3 SO3 R3 O R4 R2 , 5 79736 де R1, R2, R3, R4 і W є ідентичними визначеним для (І), і їх фармацевтично прийнятні солі. 7. Полісахариди за п. 6, які відрізняються тим, що у них лише один з замісників R1, R2, R3 або R4 репрезентує зв'язок T-Biot, де Т і Biot, визначені, як для (І). 8. Полісахариди за п. 6 або п. 7, які відрізняються тим, що є сполуками формули (І.4): Biot R1 T R1 O R1 R3 R1 W O COO O OOC O SO3O O O O O O SO3 R2 R3 O SO3 R3 O R4 R2 SO3 , (I.4) де Т - один зі зв'язків, вибраний з: NH або O NH NH CH2 j , або O NH CH2 H N CH 2 k NH j , де j i k, однакові або різні, є цілими, що можуть приймати значення від 1 до 10; Biot-група: C S (CH 2)4 O HN NH O , R1 - (С1-С6)алкоксигрупа або група –ОSО3-, R2 - (С1-С6)алкоксигрупа або група –ОSО3-, R3 - (С1-С6)алкоксигрупа, R4 - (С1-С6)алкоксигрупа або група ОSО3-, або R4 утворює місток -O-СН2-, де група –CH2-з'єднана з атомом карбону, який несе карбоксильну функціональну груп у на тому ж кільці, W - атом оксигену або метиленова група, і їх фармацевтично прийнятні солі. 9. Полісахариди за п. 1 або п. 2, які відрізняються тим, що вибрані з таких сполук: метил (2,3,4,6-тетра-O-сульфонат- a -Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонатa -D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oсульфонат- b -D-глюкопіранозил)-(1—>4)-(6-біотинамідо-6-деокси-2,3-ди-O-метил- a -Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-метил- b -Dглюко-піранозил)-(1—>4)-[(2,3,6-три-O-метил- a -Dглюкопіранозил)-(1—>4)-O-(2,3,6-три-O-метил- b D-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3ди-O-метил- a -D-глюкопіранозил)-(1—>4)-(2,3-диО-метил- b -D-глюкопіранозилуронова кислота)(1—>4)-(2,3,6-три-O-сульфонат- a -Dглюкопіранозил)-(1—>4)-(2,3-ди-O-метил- a -L 6 ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-Осульфонат- a -D-глюкопіранозид, натрієва сіль, метил(2,3,4,6-тетра-O-сульфонат- a -Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонатa -D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oсульфонат- b -D-глюкопіранозил)-(1—>4)-(6-[6(біотинамідо)-гексамідо]-6-деокси-2,3-ди-O-метилa -D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-метилb -D-глюкопіранозил)-(1—>4)-[(2,3,6-три-O-метилa -D-глюкопіранозил)-(1—>4)-O-(2,3,6-три-Oметил- b -D-глюкопіранозил)-(1—>4)]3-(6-Oсульфонат-2,3-ди-O-метил- a -D-глюкопіранозил)(1—>4)-(2,3-ди-O-метил- b -Dглюкопіранозилуроновакислота)-(1—>4)-(2,3,6-триO-сульфонат- a -D-глюкопіранозил)-(1—>4)-(2,3ди-O-метил- a -L-ідопіранозилуронова кислота)(1—>4)-2,3,6-три-O-сульфонат- a -Dглюкопіранозид, натрієва сіль, метил (2,3,4,6-тетра-O-сульфонат- a -Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонатa -D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oсульфонат- b -D-глюкопіранозил)-(1—>4)-(6-[6-(6біотанамідогексамідо)гексамідо]-6-деокси-2, 3-диO-метил- a -D-глюкопіранозил)-(1—>4)-(2,3,6-триO-метил- b -D-глюкопіранозил)-(1—>4)-[(2,3,6-триO-метил- a -D-глюкопіранозил)-(1—>4)-O-(2,3,6три-O-метил- b -D-глюкопіранозил)-(1—>4)]3-(6-Oсульфонат-2,3-ди-O-метил- a -D-глюкопіранозил)(1—>4)-(2,3-ди-O-метил- b -Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-O-сульфонат- a -D-глюкопіранозил)-(1—>4)(2,3-ди-O-метил- a -L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат- a -Dглюкопіранозид, натрієва сіль, метил (2-біотинамідо-2-деокси-3,4-ди-O-метил-6O-сульфонат- a -D-глюкопіранозил)-(1—>4)-(2,3ди-O-метил- b -D-глюкопіранозилуронова кислота)(1—>4)-(2,3,6-три-O-сульфонат- a -Dглюкопіранозил)-(1—>4)-(2,3-ди-O-метил- a -Lідопіранозилуронова кислота) - (1—>4)-2,3,6-триО-сульфонат- a -D-глюкопіранозид, натрієва сіль, метил (2-[6-(6-біотинамідогексамідо)гексамідо]-2деокси-3,4-ди-O-метил-6-O-сульфонат- a -D-глюкопіранозил)-(1—>4) (2,3-ди-O-метил- b -Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-O-сульфонат- a -D-глюкопіранозил)-(1—>4)(2,3-ди-O-метил- a -L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат- a -Dглюкопіранозид, натрієва сіль, метил (2-[6-(6-біотинамідогексамідо)гексамідо]-2деокси-3,4-ди-O-метил-6-O-сульфонат- a -Dглюкопіранозил)-(1—>4)-(2,3-ди-O-метил- b -Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-O-сульфонат- a -D-глюкопіранозил)-(1—>4)(2,3-ди-O-метил- a -L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат- a -Dглюкопіранозид, натрієва сіль. 10. Фармацевтична композиція, яка містить як активний агент полісахарид за будь-яким з пп. 1-9, як 7 79736 8 варіант, у комбінації з одним або кількома інертними відповідними наповнювачами. 11. Застосування фармацевтичної композиції за п. 10 при патологіях, що є наслідком модифікування гомеостазу коагуляційної системи, яке виникає при розладах серцево- і церебросудинної систем, наприклад, при тромбоемболічних розладах, пов'язаних з атеросклерозом і діабетом, наприклад, при нестабільній стенокардії, апоплексії, постангіопластичному рестенозі, ендартеректомії або введенні ендоваскулярного протезу, при тромбоемболічних розладах, пов'язаних з посттромболізним ретромбозом, з інфарктом, слабоумством ішемічного походження, з захворюваннями периферійних артерій, гемодіалізом або фібриляціями передсердя, з використанням протезів для аортокоронарного шунта; для лікування або профілактики тромбоемболічних патологій венного походження, наприклад, легеневого емболізму, для профілактики або лікування тромботичних ускладнень, що виникають після хірургічних операцій, в результаті розвитку пухлин або порушень коагуляції, викликаних бактеріями, вірусами або ензимами. 12. Застосування полісахариду за будь-яким з пп. 1-9 для покриття протезів. 13. Застосування полісахариду за будь-яким з пп. 1-9 як допоміжного засобу під час ендартеректомії, яку виконують з пористими балонами. 14. Спосіб нейтралізації антитромботичного ефекту полісахаридів за п.1 у пацієнта, який полягає в тому, що зазначеному пацієнту призначають ефективну кількість авідину або стрептавідину. 15. Застосування авідину або стрептавідину для приготування медикаментів, призначених нейтралізувати антитромботичний ефект полісахаридів за будь-яким з пп. 1-9. Винахід стосується нових синтетичних оліго- і полісахаридів з щонайменше одним ковалентним зв'язком з біотином або похідною біотину, які мають антикоагуляційну і антитромботичну фармакологічну активність гепарину. Гепарин каталізує, зокрема, через антитромбін III (AT III), інгібування двох ензимів, які беруть участь у каскаді коагуляції крові, а саме, фактора Ха і фактора IIа (або тромбіна) Препарати, що містять низькомолекулярні гепарини (LMWH), включають ланцюги, утворені 4-30 моносахаридами, і мають здатність більш моноселективно діяти на фактор Ха, ніж на тромбін. Відомо, що інгібування фактора Ха потребує приєднання гепарину до AT III через домен приєднання антитромбіну (Домен-Α) і що інгібування фактора На (тромбін)потребує приєднання до AT III через Домен-Α і до тромбіну через менш визначений домен (Домен-Т). Відомими є олі-госахариди, що відповідають Домену-Α [див., наприклад, патенти ЕР 84 999 і ЕР 529 715, публікацію WO 99/36428 і Bioorg. Med. Chem., 1998, 6, 1509-1516]. Ці синтетичні олігосахариди можуть селективно інгібувати (через антитромбін III) фактор Ха коагуляції, не діючи на тромбін. Вони проявляють антитромботичну активність при тромбозі вен. Синтетичні олігосахариди, здатні інгібувати тромбін і фактор Ха через активування AT III, [описані у заявках WO 98/03554 і WO 99/36443]. У цих заявках описані нові сульфатовані і алкіловані похідні полісахариду. Вони зокрема, є антикоагулянтами і антитромботиками. Було, зокрема, показано, що ці сульфатовані і алкіловані полісахариди можуть бути потужними антитромботиками і антикоагулянтами залежно від упорядкування алкільних і сульфатних груп, з'єднаних з глуцидним ланцюгом. Взагалі було виявлено, що упорядкуванням полісахаридних послідовностей можна точно коригувати активність типу GAGs для одержання високоактивних продуктів з антикоагуляційними і антитромбо-тичними фармакологічними якостями гепарину. Порівняно з гепарином їх перевагою є неспецифічна структура і відсутність реакції з тромбоцитним фактором 4, причини тромбоцитопенічної дії гепарину. Однак, використання продуктів, [описаних у WO 98/03554, WO 99/36443 і ЕР 529 715] у терапії людини може виявитись проблематичним, зокрема, якщо ці продукти мають велику тривалість півжиття. При використання цих продуктів для профілактики або лікування тромбозу необхідно відновлювати або підтримувати текучість крові, одночасно уникаючи кровотечі, оскільки, як добре відомо, кровотеча може бути викликана при лікуванні пацієнта проти будь-якої причини. Може виявитись необхідним хірургічне втр учання під час антитромботичного лікування. Крім того, під час деяких хір ургічних процедур для запобігання коагуляції крові антикоагулянти використовують у високих дозах і виникає необхідність нейтралізувати їх після операції. Отже, бажано мати антитромботичні агенти, які можуть бути нейтралізовані на кінцевій стадії операції для припинення антикоагуляційної активності. Фактично відомі синтетичні оліго-сахариди, описані вище важко нейтралізувати відомими антидотами гепарину або LMWH, включаючи протамінсульфат. Винахід стосується нових синтетичних полісахаридів з структурою, подібною структурі сполук [описаних у заявках WO 98/03554 і WO 99/36443 і у патенті ЕР 529 715]; структури синтетичних олігосахаридів винаходу є модифікованими у тому сенсі, що вони мають ковалентний зв'язок з біотином (гексагідро-2-оксо-1Н-тієно[3,4-d]імідазол-4пентановою кислотою) або з похідною біотину. Було виявлено, що введення біотину або його похідної не змінює фармакологічної активності полісахаридів. Фактично полісахариди винаходу мають антитромботичну активність, яку можна порівнювати з активністю відомих полісахаридів. Однак, їх перевагою є здатність до швидкої нейтралізації специфічним антидотом у випадку загрозливої ситуації. Таким антидотом є авідин [The Merck Index, Twelfth edition, 1996, M.N. 920, pages 151-152] або стрептавідин, два тетрамерні протеїни з масами приблизно 66000 і 60 дальтон, відповідно, з дуже високою афінністю до біотину. Взагалі винахід стосується синтетичних полі 9 сахаридів з антитромботичною дією, які мають щонайменше один ковалентний зв'язок з біотином або його похідною. Похідною біотину може бути одна з наведених у каталозі Пірса (Pierce), 19992000, cтop.62-81, наприклад, 6біотинамідогексаноат, 79736 10 формули (І): у якій: хвиляста лінія позначає зв'язок, розташований нижче або вище площини піранозового кільця, Ро позначає полісахарид, який включає n ідентичних або різних моносахаридних одиниць, зв'язаних через їх аномерний карбон з Ре, є схемою, що репрезентує моносахаридну одиницю з піранозною структурою, вибрану серед гексоз, пентоз і відповідних деоксицукрів, причому ця одиниця з'єднана через її аномерний карбон з іншою моносахаридною одиницею, а гідроксильні групи цієї одиниці заміщені однаковими або різними групами R1, визначеними нижче. Ре є полісахаридом структури: де h=1 або 2, n - ціле, яке може мати значення від 1 до 25, R1 - зв'язок -T-Biot, (С1-С6)алкоксигрупа або група -ОSО 3- гр упа, R2 - зв'язок -T-Biot, (С1-С6)алкоксигрупа або група -ОSО 3-, R3 - зв'язок -T-Biot або (С1-С6)алкоксигрупа, R4 - зв'язок -T-Biot, (С1-С6)алкоксигрупа або група -ОSО 3- або R4 утворює місток -О-СН2-, де СН2- група, приєднана до атому карбону, який у тому ж кільці несе карбоксильну функціональну груп у, причому щонайменше один з замісників R1, R2, R3 або R4 є гр упою -T-Biot і W - атом оксигену або метиленова група, Τ - один з зв'язків, вибраний серед: ΝΗ, або Зокрема, об'єктом винаходу є полісахариди де j і k, однакові або різні, є цілими і можуть 11 79736 мати значення від 1 до 10, - Biot - гр упа: і їх фармацевтично прийнятні солі. Як уже відзначалось, у цьому описі хвиляста лінія позначає зв'язок, розташований нижче або вище площини піранозового кільця. Моносахариди у Ро можуть бути однаковими або різними, а міжглікозидні зв'язки можуть бути aабо b-типу Ці моносахариди бажано вибирати серед Dабо L-гексозалоз, альтрози, глюкози, манози, галози, ідози, галактози або талози (у цьому випадку h=2) або серед D- або L-пентози, рибози, арабінози, ксилози або ліксози (у цьому випадку h=2). Інші моносахариди, наприклад, деоксицукри, також є придатними (h=1 і/або -CH2R1=СН3). Полісахаридна частина Ро може складатись з 0-25 алкілованих і ди- або трисульфатованих моносахаридних одиниць. Полісахаридна частина Ро також складатись з 0-25 алкілованих і моно- або дисульфатованих моносахаридних одиниць. Полісахаридна частина Ро може складатись з 0-25 незаряджених і/або частково і/або повністю заряджених моносахаридних одиниць. Заряджені і незаряджені одиниці можуть бути дисперговані уздовж ланцюга або вони можуть бути згруповані у заряджені або незаряджені домени. Зв'язки між одиницями можуть бути 1.2; 1.3; 1.4; 1.5; 1.6; і а- або β-типу. У цьому описі було вирішено L-ідуронову кислоту конформацією 1С4, а D-глюкуронову кислоту конформацією 4С1, хоча, як відомо ці конформації у розчині моносахаридних одиниць зазнають флуктуацій. Отже, L-ідуронова кислота маже мати конформацію 1С4,1S0 або 4С1. Згідно з одним з об'єктів, винахід стосується полісахаридів формули (I.1): 12 є специфічною родиною полісахаридів Ро, приєднаних через їх аномерний карбон до Ре, як це було показано для (1), є ідентичною визначеній для (І), групи R1 є ідентичними визначеним для (І), у одному і тому ж моносахариді, можуть бути ідентичними або різними, моносахарид у ' m повторюється m разів, моносахарид у ' t повторюється t разів i моносахарид у ' р повторюється ρ разів, де m - ціле, що змінюється від 1 до 5, t - ціле, що змінюється від 0 до 24 і p - ціле, що змінюється від 0 до 24, причому 14)-(2,3,6-три-Oсульфонат-b-D-глюкопіранозил)-(1—>4)-(6-біотинамідо-6-деокси-2,3-ди-О-метил-b-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-D 14 глюкопіранозил)-(1—>4)-[(2,3,6-три-O-метил-b-Dглюкопіранозил)-(1—>4)-О-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3-диO-метил-a-D-глюкопіранозил)-(1—>4)-(2,3-ди-Ометил-b-D-глюкопіранозилуронова кислота)-(1— >4)-(2,3,6-три-О-сульфонат-a-D-глюкопіранозил)(1—>4)-(2,3-ди-O-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-a-Dглюкопіранозид, натрієва сіль, метил (2,3,4,6-тетра-O-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонат-aD-глюкопіранозил)-(1—>4)-(2,3,6-три-Oсульфонат-b-D-глюкопіранозил)-(1—>4)-(6-[6(біотинамідо)-гексамідо]-6-деокси-2,3-ди-O-метилa-D-глюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-bD-глюкопіранозил)-(1—>4)-[(2,3,6-три-О-метил-aD-глюкопіранозил)-(1—>4)-О-(2,3,6-три-О-метил-bD-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3ди-O-метил-a-D-глюко-піранозил)-(1—>4)-(2,3-диО-метил-b-D-глюкопіранозилуронова кислота)-(1— >4)-(2,3,6-три-О-сульфонат-a-D-глюкопіранозил)(1—>4)-(2,3-ди-О-метил-a-L-ідопіранозил-уронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-a-Dглюкопіранозид, натрієва сіль, метил (2,3,4,6-тетра-O-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонат-aD-глюкопіранозил)-(1—>4)-(2,3,6-три-Осульфонат-b-D-глюкопіранозил)-(1—>4)-(6-[6-(6біотанамідогексамідо)гексамідо]-6-деокси-2,3-диO-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Ометил-b-D-глюкопіранозил)-(1—>4)-[(2,3,6-три-Oметил-a-D-глюкопіранозил)-(1—>4)-O-(2,3,6-три-Oметил-b-D-глюкопіранозил)-(1—>4)]3-(6-Осульфонат-2,3-ди-О-метил-a-D-глюкопіранозил)(1—>4)-(2,3-ди-O-метил-b-Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-O-сульфонат-a-D-глюкопіранозил)-(1—>4)(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-a-Dглюкопіранозид, натрієва сіль, метил (2-біотинамідо-2-деокси-3,4-ди-Oметил-6-O-сульфонат-a-D-глюкопіранозил)-(1— >4)-(2,3-ди-О-метил-b-Dглюкопіранозилуроновакислота)-(1—>)-(2,3,6-триО-сульфонат-a-D-глюкопіранозил)-(1—>4)-(2,3-диО-метил-a-L-ідопіранозилуронова кислота)-(1— >4)-2,3,6-три-O-сульфонат-a-D-глюкопіранозид, натрієва сіль, метил (2-[N-(6-бioтинaмiдoгeкcaнoїл)]-2дeoкcи-3,4-ди-O-мeтил-6-O-cyльфoнaт-a-Dглюкoпіранозил)-(1—>4)-(2,3-ди-O-метил-b-Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-О-сульфонат-a-D-глюкопіранозил)-(1—>4)(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-a-Dглюкопіранозид, натрієва сіль, метил (2-[6-(6біотинамідогексамідо)гексамідо]-2-деокси-3,4-диО-метил-6-О-сульфонат-a-D-глюкопіранозил)-(1— >4)-(2,3-ди-O-метил-b-O-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-O-метил-a-L 15 79736 ідопіранозилуронова кислота)-{1—>4)-2,3,6-три-Осульфонат-a-D-глюкопіранозид, натрієва сіль. Винахід включає полісахариди у кислотній формі або у формі будь-якої їх фармацевтично прийнятної солі. У кислотній формі функціональні групи –СОО- і -SO3- приймають форми, відповідно, -СООН і -SO3H. Термін "фармацевтично прийнятна сіль полісахаридів винаходу" означає полісахарид, у якому один або більше функціональних груп –СОО- і/або -SO3- мають іонний зв'язок з фармацевтично прийнятним катіоном. Бажаними є солі, у яких катіон вибраний серед катіонів лужних металів, найкраще, катіонів Na+ або K+. Сполуки формули (1) також включають сполуки, у яких один або більше атомів гідрогену або карбону заміщені їх радіоактивними ізотопами, наприклад, тритієм або карбоном-14. Такі мічені сполуки використовуються у дослідженнях метаболізму або фармакокінетики і у біо хімічному аналізі як ліганди. Спосіб приготування сполук згідно з винаходом включає використання основних синтонів диабо олігосахаридів, приготовлених, як це описано у згаданих ви ще роботах. Слід відзначити, зокрема, [патенти або заявки ЕР 300 099, ЕР 529 715, ЕР 621 282 і ЕР 649 854 і роботи С van Boeckel, M. Petitou, Angew. Chem. Int. Ed. Engl., 1993, 32, 16711690]. Ці синтони з'єднують один з одним для одержання повністю захищеного еквівалента полісахариду винаходу. Цей захищений еквівалент далі перетворюють у сполуку винаходу. Один з згаданих ви ще основних синтонів включає спеціальну захищен у функціональну групу, яка дозволяє подальше введення біотину або його похідної, наприклад, латентну аміногрупу у формі азидогрупи або захищеної Nфталімідогрупи. У згаданій вище реакції з'єднання "донор" - диабо олігосахарид, активований на його аномерному карбоні, реагує з "акцептором" - ди- або олігосахаридом, що має вільний гідроксил. Винахід включає спосіб приготування сполук формули (І), який відрізняється тим, що у першій стадії синтезують повністю захищений еквівалент бажаного полісахариду (І), що включає захи щений попередник домена Ре, подовжений на його невідновлювальному кінці захищеним попередником сульфатованого полісахариду Ро, причому один з цих попередників включає, зокрема, належним чином захищену функціональну аміногрупу для подальшого введення біотину або його похідної; у другій стадії вводять або демаскують негативно заряджені групи; у третій стадії з функціональної аміногрупи знімають захист, після чого вводять біотин або його похідну. Синтез Ре виконують відомими методами [див., наприклад, WO 98/03554 і WO 99/36443 і цитовану ви ще літератур у]. Полісахаридну частину, що є попередником Ро, синтезують з використанням відомих реакцій синтезу олігосахаридів [G.J. Boons, Tetrahedron, 1996, 52, 1095-1121, WO 98/03554 і WO 99/36443] або олігосахарид, який є донором глікозидного зв'язку з'єднують з олігосахаридом, який є акцеп 16 тором цього зв'язку, і одержують інший олігосахарид, розмір якого є сумою розмірів цих двох реагентів. Цю послідовність повторюють до одержання бажаної сполуки формули (І). Природа і профіль заряду кінцевої сполуки визначають природу хімічних сполук, що використовуються у різних стадіях синтезу згідно з правилами, добре відомими фахівцю [див., наприклад, С van Boeckel і Μ. Petitou, Angew. Chem. Int. Ed. Engl., 1993, 32, 1671-1690, або Η. Paulsen, "Advances in selective chemical syntheses of complex oligosaccharides", Angew. Chem. Int. Ed. Engl., 21,155-173 (1982)]. Сполуки винаходу одержують з їх повністю захи щених попередників через ряд реакцій: - спиртову функціональну групу перетворюють у О-сульфогруп у і знімають захист з карбонових кислот видаленням захисних груп, використаних під час приготування основного ланцюга, - вводять суль фогрупи, - знімають захист з функціональної аміногрупи, яка уможливлює введення біотину або його похідної, - вводять біотин або його похідну звичайною реакцією приєднання амінокислоти. Сполуки винаходу можуть бути приготовлені з використанням відомих способів синтезу олігосахаридів. Описаний вище процес є бажаним процесом винаходу. Однак, сполуки формули (І) можна приготувати іншими відомими методами хімії сахарів, [описаними, наприклад, у "Monosac-charides, their chemistry and their roles in natural products (Моносахариди, їх хімія і роль у природних продуктах", P.M. Collins і R.J. FerRier, J. Wiley & Sons, 1995, і у G.J. Boons, Tetrahedron, 1996, 52, 1095-1121]. Пентасахариди Ре можна одержати з дисахаридних синтонів, як це [описано у С van Boeckel і Μ. Petitou, Angew. Chem. Int. Ed. Engl., 1993, 32, 1671-1690]. Захисні групи, що використовуються для приготування сполуки (І), широко використовуються у хімії сахарів [див., наприклад, "Protective Groups in Organic Synthesis (Захисні групи у органічному синтезі)", T.W. Greene, John Wiley & Sons, New York, 1981]. Захисні групи бажано вибирати, наприклад, серед ацетилу, галогенметилу, бензоїлу, левулінілу, бензилу, заміщеного бензилу, як варіант, заміщеного тритилом, тетрагідропіранілу, алілу, пентенілу, трет-бутилдиметилсилілу (tBDMS) або триметилсилілетилових груп. Активуючими групами є ті, що звичайно використовуються у хімії сахарів [див., наприклад, G.J. Boons, Tetrahedron, 1996, 52, 1095-1121]. Ці активуючі гр упи звичайно вибирають серед імідатів, тіоглікозидів, пентенілглікозидів, ксантанів, фосфітів або галогенів. Щодо шляху, яким біотин приєднується до олігосахаридів і природи похідної біотину, хімічна література пропонує можливість використання добре відомих захисних гр уп. Бажано використовувати функціональну аміно- або тіольну груп у або карбоновокислотну користовувати функціональну аміно- або тіольну групу або карбоновокислотну функціональну груп у, або альдегідну функціональ 17 79736 ну гр уп у, які реагують з похідною біотину, що включає реактивну гр упу типу активованого естеру, малеїміду, іодацетилу або первісного аміну; ця реакція проходить в умовах, описаних в літературі [див. Savage et al., Avidin-Biotin Chemistry, Handbook, Pierce Chemical Company, 1992]. Описаний вище процес дозволяє одержати сполуки винаходу у формі солей. Для одержання відповідних кислот, сполуки винаходу у формі солей вводять у контакт з катіоннообмінною смолою у кислотній формі. Сполуки винаходу у формі кислот можна потім нейтралізувати основою для отримання бажаної солі. Для цього можуть бути використані будь-які органічні і неорганічні основи, які утворюють фармацевтично прийнятні солі сполуки формули (І). Бажаними є гідроксид натрію або калію, гідрохлорид кальцію або гідроксид магнію. Бажаними солями є натрієві і кальцієві солі сполуки формули (І). Сполуки винаходу є об'єктом біохімічних і фармакологічних досліджень. Загальна антитромботична активність цих продуктів і їх нейтралізація були вивчені на моделі венного тромбозу, яка полягала у ін'єкції тканевого фактору з подальшим застоєм у vena cava щурів, як це [описано у J.-M. Herbert et al., Blood, 1998, 91, 4197-4205]. У цій моделі було досягнуто інгібування 60% тромбозу після внутрішньовенної ін'єкції 0,1-30ммоль/кг сполуки. Ін'єкція авідину у молярному відношенні 1 до 1000 значно знижує антитромботичну дію цих сполук, причому можна досягти зниження на більш, як 50%. Прогеморагічна активність сполуки нейтралізується ін'єкцією авідину у зазначених вище дозах. Подібним чином, циркуляційна активність олігосахаридів, виміряна через анти-Ха активність і/або анти-ІІа активність, нейтралізується ін'єкцією авідину. Отже, ще одним об'єктом винаходу є спосіб використання авідину або стрептавідину, який дозволяє нейтралізувати полісахариди згідно з винаходом. Авідин або стрептавідин можуть бути використані для приготування медикаментів, призначених для нейтралізації полісахаридів винаходу. Біохімічна і фармацевтична активність олігосахариди винаходу робить їх е фективними медикаментами. їх токсичність узгоджується з таким використанням. Вони є дуже стабільними і це робить їх особливо придатними для використання як активних агентів патентованих фармацевтичних продуктів. Вони можуть бути використані при різних патологіях, що є наслідком модифікування гомеостазу коагуляційної системи, яке виникає, зокрема, при розладах серцево- і церебросудинної систем, наприклад, при тромбоемболічних розладах, пов'язаних з атеросклерозом і діабетом, наприклад, при нестійкій стенокардії, апоплексії, постангіопластичному рестенозі, ендартеректомм або введенні ендоваскулярного протезу; або при тромбоемболічних розладах, пов'язаних з посттромболізним ретромбозом, з інфарктом, з слабоумством або ішемією, з захворюваннями периферійних артерій, з гемодіалізом або фібриляціями передсердя, або 18 протягом використання протезів для аортокоронарного шунта. Крім того, ці продукти можуть бути використані для лікування або профілактики тромбоемболічних патологій венного походження, наприклад, легеневого емболізму. Вони можуть бути використані для профілактики або лікування тромботичних ускладнень, що виникають, наприклад, після хірургічних операцій, в результаті розвитку пухлин або порушень коагуляції, викликаних бактеріями, вірусами або ензимами. У випадку їх використання під час введення протезів сполуки винаходу можуть покривати протез і, отже, робити їх гемосумісними. Зокрема, вони можуть бути приєднані до внутрішньосудинних протезів (стентів). У цьому випадку їх за бажанням можна хімічно модифікувати введенням на невідновлювальному або відновлювальному кінці відповідного відгалуження, як це [описано у ЕР 649 854]. Сполуки винаходу також можуть бути використані як допоміжний засіб під час ендартеректомії, яку виконують з пористими балонами. Сполуки згідно з винаходом можна використовувати для приготування медикаментів, призначених для лікування згаданих вище хвороб. Іншим об'єктом винаходу є фармацевтична композиція, що включає як активний агент синтетичний полісахарид винаходу або одну з його фармацевтично прийнятних солей, як варіант, у комбінації з одним або кількома інертними відповідними наповнювачами. Ці наповнювачі вибирають згідно з бажаною фармацевтичною формою і бажаним способом введення: перорально, під'язично, підшкірно, внутрішньом'язово, внутрішньовенно, трансдермально,через слизову, локально або ректально. Активний агент також може бути присутній у вигляді комплексу з циклодекстрином, наприклад, a-, b- або g-циклодекстрином, 2-гідроксипропілциклодекстрином або метил-b-циклодекстрином. Активний агент може бути вивільнений балоном, що містить його, або ендоваскулярним експандером, введеним у кров'яні судини. При цьому фармакологічна ефективність активного агента не погіршується. У кожній дозованій одиниці кількість активного агента відповідає денній дозі, потрібній для отримання бажаної профілактичної або лікувальної ди. Кожна дозована одиниця може включати 0,1-100мг, бажано, 0,5-50мг, активного агента. Такі дози антикоагуляційної сполуки можуть бути нейтралізовані дозами авідину або стрептавідину від 1 до 1000мг з внутрішньовенним введенням, болюсом або інфузією. Сполуки згідно з винаходом може бути використані також у комбінації з одним або кількома іншими бажаними для даної терапії активними агентами, наприклад, антитромботиками, антикоагулянтами, інгібіторами агрегування тромбоцитів, таких, як, наприклад, дипіридамол, аспірин, тиклопідин або клопідогрел, або комплексні антагоністи глікопротеїну ІІb/ІІІа. Наведені далі методи, препарати і схеми ілюструють синтез різних інтермедіатів, що використовуються для приготування полісахаридів винаходу. Використовуються такі абревіатури. 19 79736 20 Вn - бензил; Bz -бензоїл; ТШХ - тонкошарова хроматографія; Ts - тозил; Lev: - левулініл; Et етил; Ph - феніл; Me - метил; Ас - ацетил; SE триметилсилілетил; ESI - іонізація пучком електронів; Біотин - гексапдро-2-оксо-1Н-тієно[3,4 d]імідазол-4-пентанова кислота; Ζ - бензилоксикарбоніл. Наведені далі детальні приклади синтезу сполуки винаходу є ілюстративними. Препарат 1 2-(триметилсиліл)етил 4, 6-О-бензиліден-2,3ди-О-метил-b-D-глюкопіранозид (2) Гідрид натрію (18г) додають порціями при 0°С до розчину сполуки 1 (15,8г, 42,8ммоль) [приготовленого згідно з К. Jansson et al., J. Org. Chem. , 1988, 53, 5629-5647] і метиліодиду (20мл, 319ммоль) у ТГФ (350мл). Реакційну суміш перемішують 4год. при кімнатній температурі, надлишок гідриду натрію усувають метанолом і реакційну суміш вливають у льодяну воду (1,5л). Після екстрагування етилацетатом органічну фазу промивають насиченим розчином хлориду натрію і водою, сушать над сульфатом натрію і концентрують у вакуумі. Залишок очищують хроматографією на колонці силікагелю (15/1 (об'єм./об'єм) циклогексан/етилацетат) і одержують 16,8г сполуки 2. [a]D=-41°(с=0,69,ДХМ). Препарат 2 2-(триметилсиліл)етил 6-O-бензил-2,3-ди-Oметил-b-D-глюкопіранозид (3) Порошок молекулярного сита 3Å (82г), метилоранж (кольоровий індикатор), ціаноборогідрат натрію (34г, 526ммоль) і потім краплями насичений розчину гідрохлоридної кислоти у діетилетері додають до розчину сполуки 2 (16г, 40,3ммоль) у ТГФ (600мл) до появи забарвлення. Після фільтрування і екстрагування етилацетатом органічну фазу промивають насиченим розчином гідрокарбонату натрію і водою, сушать над суль фатом натрію і концентрують у вакуумі. Хроматографія на колонці силікагелю (3/1 (об'єм/об'єм) толуол/етилацетат) дає 12,5г сполуки 3. [a]D=-42°(c=1,2, ДХМ). Препарат 3 2-(триметилсиліл)етил (2,3-ди-O-бензоїл-4,6O-бензиліден-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-О-бензоїл-b-D-глюкопіранозил)-(1—>4)-6-Обензил-2,3-ди-О-метил-b-D-глюко-піранозид (5) Суміш тіоглікозиду 4 (16,52г, 16,60ммоль) (одержаного, як для Препарату 1 публікації WO 99/36443), сполуки 3 (6,0г, 15,05ммоль) і порошку молекулярного сита 4Å (16,7г) у толуолі (300мл) перемішують у атмосфері аргону протягом 1 год. Суміш охолоджують до -20°С. Розчину Wіодсукциніміду (3,9г, 17,4ммоль) і фторметансульфонової кислоти (0,17мл, 1,97ммоль) у 1/1 (об'єм/об'єм) суміші ДХМ/діоксан (86мл) додають краплями реакційної суміші. Через 10хв., реакційну суміш фільтрують, розбавляють ДХМ, промивають надлишком 1М розчину тіосульфа ту натрію, 10%-м гідрокарбонатом натрію і водою, сушать над су 21 79736 льфатом натрію і концентрують у вакуумі. Залишок очищують хроматографією на колонці силікагелю (6/1 (об'єм/об'єм) толуол/етилацетат) і одержують 18,8г трисахариду 5. [a]D=+34°(с=1,26,ДХМ). Препарат 4 2-(триметилсиліл)етил (4,6-O-бензиліден-a-Dглюкопіранозил)-(1—>4)-(b-D-глюкопіранозил)-(1— >4)-6-O-бензил-2,3-ди-O-метил-b-Dглюкопіранозид (6) Трет-бутоксид калію (3,15г) додають розчину сполуки 5 (18,7г, 14ммоль) у 1/1 (об'єм/об'єм) суміші метанол/діоксан (140мл). Реакційну суміш перемішують 2год. при кімнатній температурі і нейтралізують смолою Dowex® 50WX4 Н+, фільтрують і концентрують у вакуумі. Залишок очищують хроматографією на колонці силікагелю (20/1 (об'єм/об'єм) ДХМ/метанол) і одержують 10,0г сполуки 6. [a]D=+29°(с=1,11,ДХМ). Препарат 5 2-(триметилсиліл)етил (4,6-О-бензиліден-2,3ди-О-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-О-метил-b-D-глюкопіранозил)-(1—>4)-6-Oбензил-2,3-ди-O-метил-b-D-глюкопіранозид (7) Гідрид натрію (5,2г, 216ммоль) додають порціями у атмосфері аргону до охолодженої суміші (0°С) сполуки 6 (9,93г, 12,24ммоль) і метиліодиду (9,0мл, 138ммоль) у безводному ТГФ (100мл). Суміш перемішують 20год. при кімнатній температурі, надлишок гідриду натрію усувають метанолом і реакційну суміш вливають у льодяну воду (500мл). Після екстрагування етилацетатом, органічну фазу промивають насиченим розчином хлориду натрію, сушать над сульфатом натрію і концентрують у 22 вакуумі, одержуючи 11г сполуки 7, яку використовують без очищення. ТШХ: Rf=0,38, силікагель, 3/2 (об'єм/об'єм) толуол/етилацетат. Препарат 6 2-(триметилсиліл) етил (2,3-ди-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)-6-О-бензил-2, 3-ди-Oметил-b)-D-глюкопіранозид (8) Сполуку 7 (11г) розчиняють у 60%-й оцтовій кислоті (180мл) і перемішують 1год. 30 при 80°С. Суміш концентрують і випарюють з толуолом. Залишок очищують хроматографією на колонці силікагелю (2/1 (об'єм/об'єм) толуол/ацетон) і одержують 8,46г сполуки 8. ТШХ: Rf=0,36, силікагель, 1/1 (об'єм/об'єм) толуол/ацетон. Препарат 7 2-(триметилсиліл)етил (6-О-бензоїл-2,3-ди-Ометил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Ометил-b-D-глюкопіранозил)-(1—>4)-6-O-бензил2,3-ди-O-метил-b-D-глюкопіранозид (9) 1-бензоїлокси-1Н-бензотриазол (5,36г, 22,4ммоль) і триетиламін (3,32мл) додають до розчину сполуки 8 (8,41г, 10,6ммоль) у ДХМ (110мл). Суміш перемішують 20 год. при кімнатній температурі і розбавляють ДХМ, промивають насиченим розчином гідрокарбонату натрію і водою, сушать над сульфатом натрію і концентрують у вакуумі. Залишок очищують хроматографією на колонці силікагелю (5/0,5/0,25 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол) і одержують 8,40г сполуки 9. [a]D=+15°(c=2, ДХМ). 23 79736 Препарат 8 2-(триметилсиліл)етил (2,3-ди-О-бензоїл-4,6О-бензиліден-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-O-бензоїл-b-D-глюкопіранозил)-(1—>4)-(6-Oбензоїл-2,3-ди-O-метил-a-D-глюко-піранозил)-(1— >4)-(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1— >4)-6-О-бензил-2,3-ди-О-метил-b-Dглюкопіранозид (10) Сполуку 9 перетворюють у сполуку 10 згідно з процедурою для Препарату 3. [a]D=+42°(с=2, ДХМ). Препарат 9 2-(триметилсиліл)етил (4,6-О-бензиліден-a-Dглюкопіранозил)-(1—>4)-(b-D-глюкопіранозил)-(1— >4)-(2,3-ди-O-метил-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1—>4)-6О-бензил-2,3-ди-О-метил-b-D-глюкопіранозид (11) Сполуку 10 перетворюють у сполуку 11 згідно з процедурою для Препарату 4. ТШХ: Rf=0,35, силікагель, 10/1 (об'єм/об'єм) ДХМ/метанол. Препарат 10 2-(триметилсиліл) етил (4,6-O-бензиліден-2,3ди-O-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-O-метил-b-D-глюкопіранозил)-(1—>4)-(2,3,6три-O-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-О-метил-b-D-глюкопіранозил)-(1—>4)-6-Обензил-2,3-ди-О-метил-b-D-глюкопіранозид (12) 24 Сполуку 11 перетворюють у сполуку 12 згідно з процедурою для Препарату 5. ТШХ: Rf=0,11, силікагель, 1/2 (об'єм/об'єм) циклогексан/етилацетат. Препарат 11 2-(триметилсиліл)етил (2,3-ди-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)-6-O-бензил-2,3-ди-Oметил-b-D-глюкопіранозид (13) Сполуку 12 перетворюють у сполуку 13 згідно з процедурою для Препарату 6. ТШХ: Rf=0,33, силікагель, 2/0,5/0,5 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол. Препарат 12 2-(триметилсиліл)етил (6-О-бензоїп-2,3-ди-Ометил-a-D-глюкопіранозил)- (1—>4)-(2,3,6-три-Oметил-b-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oметил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oметил-b-D-глюкопіранозил)-(1—>4)-6-О-бензил2,3-ди-О-метил-b-D-глюкопіранозид (14) Сполуку 13 перетворюють у сполуку 14 згідно з процедурою для Препарату 7. ТШХ: Rf=0,16, силікагель, 3/0,5/0,5 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол. 25 79736 Препарат 13 2-(триметилсиліл)етил(2,3-ди-O-бензоїл-4,6-Oбензиліден-a-D-глюкопіранозилІ)-(1—>4)-(2,3,6три-О-бензоїл-b-D-глюкопіранозил)-(1—>4)-(6-Обензоїл-2,3-ди-О-метил-a-D-глюкопіранозил)-(1— >4)-(2,3,6-три-O-метил-b-D-глюкопіранозил)-(1— >4)-(2,3,6-три-О-метил-a-D-глюкопіранозил)-(1— >4)-(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1— >4)-6-О-бензил-2,3-ди-О-метил-b-Dглюкопіранозид (15) Реакцію сполучення сполуки 14 з дисахаридом 4 проводять, як для Препарату 3, і одержують сполуку 15. [a]D=+52°(c=1,1, ДХМ). Препарат 14 2-(триметилсиліл)етил (4,6-O-бензиліден-a-Dглюкопіранозил)-(1—>4)-(-b-D-глюкопіранозил)(1—>4)-(2,3-ди-O-метил-a-D-глюкопіранозил)-(1— >4)-(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1— >4)-(2,3,6-три-О-метил-a-D-глюкопіранозил)-(1— >4)-(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1— >4)-6-О-бензил-2,3-ди-О-метил-b-Dглюкопіранозид (16) Сполуку 15 перетворюють у сполуку 16 згідно з процедурою для Препарату 4. ТШХ: Rf=0,31, силікагель, 10/1 (об'єм/об'єм) ДХМ/метанол. Препарат 15 2-(триметилсиліл)етил (4,6-O-бензиліден-2,3ди-O-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6 26 три-О-метил-b-D-глюкопіранозил)-(1—>4)-[(2,3,6три-О-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-О-метил-b-D-глюкопіранозил)-(1—>4)]2-6-Обензил-2,3-ди-О-метил-b-D-глюкопіранозид (17) Сполуку 16 перетворюють у сполуку 17 згідно з процедурою для Препарату 5. TШХ: Rf=0,46, силікагель, 10/1 (об'єм/об'єм) ДХМ/метанол. Препарат 16 2-(триметилсиліл)етил (2,3-ди-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил-(1—>4)-(2,3,6-три-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)-6-О-бензил-2,3-ди-Ометил-b-D-глюкопіранозид (18) Сполуку 17 перетворюють у сполуку 18 згідно з процедурою для Препарату 6. ТШХ: Rf=0,42, силікагель, 1/0,5/0,5 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол. Препарат 17 2-(триметилсиліл)етил (6-O-бензоїл-2,3-ди-Oметил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oметил-b-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oметил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oметил-b-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Ометил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oметил-b-D-глюкопіранозил)-(1—>4)-6-О-бензил2,3-ди-О-метил-b-D-глюко-піранозид(19) 27 79736 28 Сполуку 18 перетворюють у сполуку 19 згідно з процедурою для Препарату 7. ТШХ: Rf=0,25, силікагель, 3/0,5/0,5 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол. Препарат 18 2-(триметилсиліл)етил (2,3-ди-O-бензоїл-4,6O-бензиліден-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-O-бензоїл-b-D-глюкопіранозил)-(1—>4)-(6-Обензоїл-2,3-ди-О-метил-a-D-глюко-піранозил)-(1— >4)-(2,3,6-три-O-метил-b-D-глюкопіранозил)-(1— >4)-[(2,3,6-три-О-метил-a-D-глюкопіранозил)-(1— >4)-(2,3,6-три-O-метил-b-D-глюкопіранозил)-(1— >4)]2-6-О-бензил-2,3-ди-О-метил-b-Dглюкопіранозид (20) Суміш тіоглікозиду 4 (5,2г, 5,23ммоль), гептасахариду 19 (4,72г, 2,75ммоль) і порошку молекулярного сита 4Å у толуолі перемішують у атмосфері аргону протягом 1год. Краплями додають розчин N-іодсукциніміду (1,36г, 5,85ммоль) і трифторметансульфонової кислоти (0,140мл, 1,56ммоль) у 1/1 (об'єм/об'єм) суміші ДХМ/діоксан (32мл) при 0°С. Через 15хв. реакційну суміш фільтрують, розбавляють ДХМ, промивають послідовно 1М розчином тіосульфату натрію, 10%-м гідрокарбонатом натрію і водою, сушать над сульфатом натрію і концентрують у вакуумі. Залишок очищують хроматографією на колонці силікагелю (3/0,5/0,5 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол) і одержують 7,13г сполуки 20. [a]D=+65°(c=1,4, ДХМ). Препарат 19 2-(триметилсиліл)етил (4,6-О-бензиліден-a-Dглюкопіранозил)-(1—>4)-(b-D-глюкопіранозил)-(1— >4)-(2,3-ди-O-метил-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1—>4)[(2,3,6-три-O-метил-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1—>4)]26-O-бензил-2,3-ди-O-метил-b-D-глюкопіранозид (21) Сполуку 20 перетворюють у сполуку 21 згідно з процедурою для Препарату 4. ТШХ: Rf=0,27, силікагель, 10/1 (об'єм/об'єм) ДХМ/метанол. Препарат 20 2-(триметилсиліл)етил (4,6-O-бензиліден-2,3ди-O-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6 29 79736 три-O-метил-b-D-глюкопіранозил)-(1—>4)-(2,3,6три-O-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-O-метил-b-D-глюкопіранозил)-(1—>4)]3-6-Обензил-2,3-сіи-О-метил-b-D-глюкопіранозид (22) Сполуку 21 перетворюють у сполуку 22 згідно з процедурою для Препарату 5. ТШХ: Rf=0,31, силікагель, 5/1/1 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол. Препарат 21 2-(триметилсиліл)етил (2,3-ди-O-метил-a-D 30 глюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)-[(2,3,6-три-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)]3-6-O-бензил-2,3-ди-Oметил-b)-D-глюкопіранозид (23) Сполуку 22 перетворюють у сполуку 23 згідно з процедурою для Препарату 6. ТШХ: Rf=0,35, силікагель, 2/1/1 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол. 31 79736 Препарат 22 2-(триметилсиліл)етил (2,3-ди-О-метил-6-Отозил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oметил-b-D-глюкопіранозил)-(1—>4)-[(2,3,6-три-Ометил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Ометил-b-D-глюкопіранозил)-(1—>4]3-6-О-бензил2,3-ди-О-метил-b-D-глюкопіранозид (24) Сполуку 23 (1,09г) розчиняють у піридині (10мл) у атмосфері аргону і додають тозилхлорид (1,03г). Після 2-годинного перемішування реакційну суміш розбавляють ДХМ (100мл), органічну фазу промивають 10%-м розчином гідросульфату калію і потім водою, сушать і випарюють до сухості. Після хроматографії на колонці силікагелю (2,3/2 (об'єм/об'єм) толуол/ацетон) одержують 1,77г сполуки 24. ТШХ: Rf=0,5, силікагель, 3/1/1 (об'єм/об'єм/об'єм) циклогексан/етилацетат/етанол. Препарат 23 2-(триметилсиліл)етил (6-деокси-2,3-ди-Oметил-6-фталімідо-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1—>4)[(2,3,6-три-О-метил-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1—>4)]36-О-бензил-2,3-ди-О-метил-b-D-глюкопіранозид (25) Фталімід калію (225мг, 1,38ммоль) і 18-краун6-краунетер (121,5мг, 0,46ммоль) додають до розчину сполуки 24 (500мг, 0,23ммоль) у безводному ДМФ (11мл), що містить порошок молекулярного сита 4Å. Суміш перемішують 4год. при 80°С іпісля охолодження розбавляють ДХМ, фільтрують через Celite і концентрують. Залишок очищують хроматографією на гелі Sephadex® LH20 (3´100см) (1/1 (об'єм/об'єм) ДХМ/етанол), з подальшою хроматографією на колонці силікагелю (11/2 (об'єм/об'єм) толуол/етанол), і одержують 417,4мг сполуки 25. ТШХ: Rf=0,38, силікагель, 11/2 (об'єм/об'єм) толуол/етанол. Препарат 24 2-(триметилсиліл)етил(2,3,4,6-тетра-О-ацетилa-D-глюкопіранозил)-(1—>4)-(2,3,6-три-О-ацетилa-D-глюкопіранозил)-(1—>4)-(2,3,6-три-О-ацетилb-D-глюкопіранозил)-(1—>4)-(6-деокси-2,3-ди-Oметил-6-фтапімідо-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1—>4)[(2,3,6-три-O-метил-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-β-D-глюкопіранозил)-(1—>4)]36-О-бензил-2,3-ди-О-метил-b-D-глюкопіранозид (27) Суміш тіоглікозиду 26 (1,515г, 1,564ммоль) (приготовленого, як сполуку 41 Препарату 36 [патенту WO 99/36443]), акцептора 25 (840мг, 0,391ммоль) і порошку молекулярного сита 4Å (2,15г) у толуолі (33мл) перемішують у атмосфері аргону протягом 1 год. Реакційну суміш охолоджують до 0°С додають розчин W-іодсукциніміду 32 (387мг) і трифторметансульфонової кислоти (55,4мл) у суміші 1/1 (об'єм/об'єм) ДХМ/діоксан (7мл). Через 10хв. суміш фільтрують, розбавляють толуолом, промивають 1М розчином тіосульфату натрію у 10%-му розчині гідрокарбонату натрію і воді, сушать над сульфатом натрію і концентрують у вакуумі. Залишок очищують хроматографією на гелі Sephadex® LH20 (1/1 (об'єм/об'єм) ДХМ/е танол), з подальшою хроматографією на колонці силікагелю (5/4 (об'єм/об'єм) толуол/ацетон), і одержують 887мг сполуки 27. [a]D=+70°(с=0,35, ДХМ). Препарат 25 2-(триметилсиліл)етил(2,3,4,6-тетра-O-ацетилa-D-глюкопіранозил)-(1—>4)-(2,3,6-три-О-ацетилa-D-глюкопіранозил)-(1—>4)-(2,3,6-три-O-ацетилb-D-глюкопіранозил)-(1—>4)-(6-деокси-2,3-ди-Ометил-6-фталімідо-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1—>4)[(2,3,6-три-О-метил-a-D-глюкопіранозил)-(1—>4)(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1—>4)]32,3-ди-О-метил-b-D-глюкопіранозид (28) Розчин сполуки 27 (750мг, 0,245ммоль) у оцтовій кислоті (37мл) обробляють гідрогеном під тиском (5 бар) у присутності 10% паладію на вугіллі (750мг) протягом 2год. 30. Після фільтрування розчин концентрують і залишок очищують хроматографією на колонці силікагелю (6/1 (об'єм/об'єм) толуол/етанол), одержуючи 728мг сполуки 28. ТШХ: Rf=0,32, силікагель, 6/1 (об'єм/об'єм) толуол/етанол Препарат 26 2-(триметилсиліл)етил (2,3,4,6-тетра-Oацетил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oацетил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Oацетил-b-D-глюкопіранозил)-(1—>4)-(6-деокси-2,3ди-О-метил-6-фталімідо-a-D-глюкопіранозил)-(1— >4)-(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1— >4)-[(2,3,6-три-О-метил-a-D-глюкопіранозил)-(1— >4)-(2,3,6-три-О-метил-b-D-глюкопіранозил)-(1— >4)]3-6-О-ацетил-2,3-ди-О-метил-b-Dглюкопіранозид (29) Триетиламін (51,1мкл, 0,368ммоль), оцтовий ангідрид (32,5мкл, 0,344ммоль) і диметиламінопіридин (6,0мг, 0,049ммоль) додають до розчину сполуки 28 (728мг, 0,245ммоль) у ДХМ (10мл). Після 1-годинного перемішування реакційну суміш розбавляють ДХМ, промивають 10%-м розчином гідросульфату калію, водою, насиченим гідрокарбонатом натрію і водою, сушать над сульфатом натрію і концентрують у вакуумі. Очищення залишку хроматографією на колонці силікагелю дає 0,618мг сполуки 29. ТШХ. Rf=0,37, силікагель, 6/1 (об'єм/об'єм) толуол/етанол. 33 79736 Препарат 27 (2,3,4,6-тетра-O-ацетил-a-D-глюкопіранозил)(1—>4)-(2,3,6-три-О-ацетил-a-D-глюко-піранозил)(1—>4)-(2,3,6-три-O-ацетил-b-D-глюкопіранозил)(1—>4)-(6-деокси-2,3-ди-О-метил-6-фталімідо-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-b-Dглюкопіранозил)-(1—>4)-[(2,3,6-три-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)]3-6-О-ацетил-2,3-ди-Ометил-О-глюкопіраноза(30) Розчин сполуки 29 (579мг, 0,192ммоль) у 2/1 (об'єм/об'єм) суміші трифтороцтова кислота/ДХМ (11,5мл) перемішують протягом 1год. Реакційну суміш розбавляють сумішшю 2/1 (об'єм/об'єм) толуол/n-пропілацетат (69мл), концентрують і випарюють разом з толуолом. Залишок очищують хроматографією на колонці силікагелю (5/1 (об'єм/об'єм) толуол/етанол) і одержують 523мг сполуки 30. ТШХ: Rf=0,31, силікагель, 5/1 (об'єм/об'єм) то 34 луол/етанол. Препарат 28 (2,3,4,6-тетра-O-ацетил-a-D-глюкопіранозил)(1—>4)-(2,3,6-три-О-ацетил-a-D-глюко-піранозил)(1—>4)-(2,3,6-три-О-ацетил-b-D-глюкопіранозил)(1—>4)-(6-деокси-2,3-ди-О-метил-6-фталімідо-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)-[(2,3,6-три-O-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-метил-b-Dглюкопіранозил)-(1—>)]з-6-О-ацетил-2,3-ди-Ометил-D-глюкопіранозотрихлорацетімідат (31) Трихлорацетонітрил (65,5мкл, 0,85ммоль) і карбонат цезію (88,4мг, 0,27ммоль) додають до розчину сполуки 30 у ДХМ (3мл). Після 2-годинного перемішування суміш фільтрують і концентрують. Залишок очищують хроматографією на колонці силікагелю (6/1 (об'єм/об'єм) толуол/етанол +0,1% триетиламіну) і одержують 477мг сполуки 31. ТШХ: Rf=0,35, силікагель, 6/1 (об'єм/об'єм) толуол/етанол. 35 79736 Препарат 29 Метил (2,3,4,6-тетра-O-ацетил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-ацетил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-ацетил-b-Dглюкопіранозил)-(1—>4)-(6-деокси-2,3-ди-О-метил6-фталімідо-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-О-метил-b-D-глюкопіранозил)-(1—>4)-[(2,3,6три-О-метил-a-D-глюкопіранозил)-(1—>4)-O-(2,3,6три-Ометил-b-D-глюко-піранозил)-(1—>4)]3-(6-Оацетил-2,3-ди-О-метил-a-D-глюкопіранозил)-(1— >4)-(бензил-2,3-ди-О-метил-b-Dглюкопіранозилуронат)-(1—>4)-(3,6-ди-O-ацетил2-O-бензил-a-D-глюко-піранозил)-(1—>4)-(бензил2,3-ди-O-метил-a-L-ідопіранозилуронат)-(1—>4)2,3,6-три-О-бензил-a-D-глюкопіранозид (33) Імідат 31 (370мг, 0,121ммоль) і сполуку 32 (336мг, 0,242ммоль) [одержану згідно з Р. Westerduin et al., BioOrg. Med. Chem., 1994, 2, 1267] розчиняють у 1/2 (об'єм/об'єм) суміші ДХМ/діетилетер (5,5мл). Після додання порошку молекулярного сита 4Å суміш о холоджують до 20°С і додають 0,1Μ розчин триметилсилілтрифторметансульфонату у ДХМ (181,5мкл). Через 25хв. суміш нейтралізують доданням твердого гідрокарбонату натрію. Після фільтрування і концентрування залишок очищують хроматографією на гелі Sephadex® LH20, з подальшою хроматографією на колонці силікагелю (6/5 (об'єм/об'єм) толуол/ацетон) і одержують 302мг сполуки 33. [a]D=+86o(c=1,0, ДXM). Препарат 30 Метил (2,3,4,6-тетра-O-ацетил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-ацетил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-ацетил^-Oглюкопіранозил)-(1—>4)-(6-деокси-2,3-ди-О-метил6-фталімідо-a-D-глюкопіранозил)-(1—>4)-(2,3,6три-O-метил^-O-глюкопіранозил)-(1—>4)-[(2,3,6три-O-метил-a-D-глюкопіранозил)-(1—>4)-О-(2,3,6 36 три-О-метил-b-D-глкжо-піранозил)-(1—>4)]3-(6-Oацетил-2,3-ди-O-метил-a-D-глюкопіранозил)-(1— >4)-(2,3-ди-О-метил-a-D-глюкопіранозилуронова кислота)-(1—>4)-(3,6-ди-O-ацетил-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-a-Lідопіранозилуронова кислота)-(1—>4)-a-Dглюкопіранозид (34) Розчин сполуки 33 (104мг, 0,024ммоль) у оцтовій кислоті (5мл) обробляють у гідрогені під тиском (4бар) у присутності 10% паладію на вугіллі (104мг) 4год. Після фільтрування розчин ліофілізують і одержують сполуку 34 (87мг), яку далі використовують без очищення. Препарат 31 Метил (a-D-глюкопіранозил)-(1—>4)-(a-Dглюкопіранозил)-(1—>4)-(О-D-глюкопіранозил)(1—>4)-(6-деокси-2,3-ди-O-метил-6-фталімідо-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)-[(2,3,6-три-O-метил-a-Dглюкопіранозил)-(1—>4)-О-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)]3-(2,3-ди-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-b-Dглюкопіранозилуронова кислота)-(1—>4)-(a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-a-Lідопіранозилуронова кислота)-(1—>)-a-Dглюкопіранозид (35) Молярний розчин метоксиду натрію у метанолі (140мкл) додають до розчину сполуки 34 (80мг, 0,021ммоль) у безводному метанолі (6,9мл) у присутності порошку молекулярного сита 3Å (875мг). Через 20год. при кімнатній температурі реакційну суміш фільтрують і фільтрат нейтралізують оцтовою кислотою. Розчин концентрують наполовину і вносять на колонку Sephadex® G-25 Fine (3´92см. Після елюювання водою і ліофілізації одержують сполука 35 (66мг). 37 79736 Препарат 32 Метил (2,3,4,6-тетра-О-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонат-aD-глюкопіранозил)-(1—>4)-(2,3,6-три-Осульфонат-b-D-глюкопіранозил)-(1—>4)-(6-деокси2,3-ди-O-метил-6-фталімід-a-D-глюкопіранозил)(1—>4)-(2,3,6-три-O-метил-b-D-глюкопіранозил)(1—>4)-[(2,3,6-три-O-метил-a-D-глюкопіранозил)(1—>4)-О-(2,3,6-три-О-метил-b-D-глюкопіранозил)(1—>4)]3-(6-O-сульфонат-2,3-ди-O-метил-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-b-Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-О-сульфонат-a-D-глюкопіранозил)-(1—>4)(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-a-Dглюкопіранозид, натрієва сіль (36) Поліол 35 (66,4мг, 0,021ммоль) розчиняють у W/W-ДМФ (1,8мл). Додають комплекс сульфуртриокситриетиламін (320мг, 1,77ммоль) і суміш перемішують 20год. при 55°С. Розчин вносять на колонку Sephadex® G-25 Fine (3´92см) і елююють 0,2М хлориду натрію. Фракції, що включають продукт, концентрують і опрісняють, використовуючи ту ж колонку і елююючи водою. Після ліофілізації одержують 83мг сполуки 36. Маса: спосіб ESI, негативний режим: хімічна маса = 4968,92; експериментальна маса =4966,52±0,16a.m.u. Препарат 33 Метил (2,3,4,6-тетра-О-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонат-aD-глюкопіранозил)-(1—>4)-(2,3,6-три-Осульфонат-b-D-глюкопіранозил)-(1—>4)-(6-аміно6-деокси-2,3-ди-O-метил-a-D-глюкопіранозил)-(1— >4)-(2,3,6-три-O-метил-b-D-глюкопіранозил)-(1— >4)-[(2,3,6-три-O-метил-a-D-глюкопіранозил)-(1— >4)-О-(2,3,6-три-О-метил-O-D-глюкопіранозил)(1—>4)]3-(6-O-сульфонат-2,3-ди-O-метил-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-b-Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-О-сульфонат-a-D-глюко-піранозил)-(1—>4)(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-a-Dглюкопіранозид, натрієва сіль (37) 38 Сполуку 36 (83мг, 0,017ммоль) розчиняють у 2/1 (об'єм/об'єм) суміші етанол/вода (1,67мл). Додають гідразингідрат (81,2мкл, 1,67ммоль) і витримують під зворотним холодильником 20год. Розчин вносять на колонку Sephadex® G-25 Fine (3´92см) і елююють водою. Після концентрації фракцій, що включають продукт, залишок розчиняють у 2/1 (об'єм/об'єм) суміші етанол/вода (5,00мл) і знову обробляють гідразингідратом (81,2мкл), одержуючи 71мг сполуки 37. Маса: метод ESI, негативний режим: хімічна маса =4838,32; експериментальна маса =4814,6±0,70a.m.u. Препарат 34 Метил (6-О-ацетил-2-азидо-2-деокси-3,4-ди-Ометил-a-D-глюкопіранозил)-(1—>4)-(бензил-2,3ди-O-метил-b-D-глюкопіранозилуронат)-(1—>4)(3,6-ди-O-ацетил-2-O-бензил-a-D-глюкопіранозил)(1—>4)-(бензил-2,3-ди-O-метил-a-Lідопіранозилуронат)-(1—>4)-2,3,6-три-О-бензил-aD-глюкопіранозид (39) Трихлорацетоімідат 6-O-ацетил-2-азидо-2деокси-3,4-ди-O-метил-a-O-глюкопіранози 38 (265мг, 0,631ммоль) [одержаний згідно з J. Basten et al., Bioorg. Med. Chem. Lett. (1992], 2(9), 901) і сполуку 32 (584мг, 0,420ммоль) [одержану згідно з P. Wecrepduin et al., Bioorg. Med. Chem., 1994, 2, 1267] розчиняють у 1/2 (об'єм/об'єм) суміші ДХМ/діетилетер (28,5мл). Після додання порошку молекулярного сита 4Å, суміш охолоджують до 20°С і додають 0,1Μ розчину триметилсилілтриф 39 79736 40 торметансульфонату у ДХМ (94,6мкл). Через 10хв. додають імідат (53,8мг) і потім 0,1Μ розчину триметилсилілтрифторметансульфонату у ДХМ (19,2мкл). Через 10хв. суміш нейтралізують доданням твердого гідрокарбонату натрію. Після фільтрування і концентрування залишок очищують хроматографією на колонці силікагелю (3/1 (об'єм/об'єм) толуол/етилацетат) і одержують 499мг сполуки 39. [a]D=+66°(c=1,07, ДXM). Препарат 35 Метил (6-O-ацетил-2-аміно-2-деокси-3,4-ди-Oметил-a-D-глюкопіранозил)-(1—>4)-(2,3-ди-Oметил-b-D-глюкопіранозилуроновакислота)-(1— >4)-(3,6-ди-О-ацетил-a-D-глюко-піранозил)-(1— >4)-(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-a-D-глюкопіранозид (40) Розчин сполуки 39 (552,6мг, 0,335ммоль) у 5/1 (об'єм/об'єм) суміші трет-бутанол/етилацетат (16мл) обробляють гідрогеном під тиском (10бар) у присутності 10% паладію на вугіллі (1,10г) і 1М гідрохлоридної кислоти (0,336мл) протягом 4год. 30. Після фільтрування розчин концентрують і одержують сполуку 40, яку далі використовують без очищення. Препарат 36 Метил (2-аміно-2-деокси-3,4-ди-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-b-Dглюкопіранозилуронова кислота)-(1—>4)-(a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-a-Lглюкопіранозилуронова кислота - (1—>4)-b-Dглюкопіранозид (41) Сполуку 40 (324мг, 0,300ммоль) розчиняють у метанолі (8,8мл), додають 5М розчину гідроксиду натрію (2,2мл) і реакційну суміш перемішують при кімнатній температурі 16 год., після чого нейтралізують Dowex® 50Н+ смола і фільтрують. Розчин пропускають через колонку Sephadex® G-25 Fine, елююючи водою. Фракції, що включають продукт, концентрують і одержують 254,2мг сполуки 41. 41 79736 Аналіз ЯМР підтверджує видалення захисної групи (бензильної і ацетильної груп). ТШХ: Rf=0,26, силікагель, 5/5/1/3 (об'єм/об'єм/об'єм/об'єм) етилацетат/піридин/оцтова кислота/вода. Препарат 37 Метил (2-(бензилоксикарбоніл)аміно-2деокси~3,4-ди-O-метил-a-D-глюкопіранозил)-(1— >4)-(2,3-ди-О-метил-b-D-глюкопіранозилуронова кислота)-(1—>4)-(a-D-глюкопіранозил)-(1—>4)(2,3-ди-O-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-a-D-глюкопіранозид (42) Сполуку 41 (241,1мг, 0,253ммоль) розчиняють у воді (12,4мл) і додають гідрокарбонат натрію (63,7 мг), і потім краплями бензилхлорформат (41мкл). Після 12 годинного перемішування реакційну суміш пропускають через колонку Sephadex® G-25 Fine, елююючи водою, фракції, що включають продукт концентрують. Очищення хроматографією на колонці силікагелю (21/17/3,6/10 (об'єм/об'єм/об'єм/об'єм) етилацетат/піридин/оцтова кислота/вода) дає 221мг сполуки 42. ТШХ: Rf=0,63, силікагель, 5/5/1/3 (об'єм/об'єм/об'єм/об'єм) етилацетат/піридин/оцтова кислота/вода. Препарат 38 Метил (2-(бензилоксикарбоніл)-аміно-2деокси-3,4-ди-О-метил-6-О-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-O-метил-b-Dглюкопіранозилуроновакислота)-(1—>4)-(2,3,6-триO-сульфонат-a-D-глюкопіранозил)-(1—>4)-(2,3-диО-метил-a-L-ідопіранозилуронова кис-лота)-(1— >4)-2,3,6-три-О-сульфонат-a-D-глюкопіранозид, натрієва сіль (43) Поліол 42 (19,6мг, 0,018ммоль) розчиняють у W.W-ДМФ (1,62мл). Додають комплекс сульфуртриоксидтриетиламін (114 мг) і суміш перемішують 20 год. при 55°С у темряві. Розчин вносять на колонку Sephadex® G-25 Fine і елюююють 0,2М хлориду натрію. Фракції, що включають продукт, концентрують і опріснюють, використовуючи ту ж колонку ι елююючи водою. Ліофілізація дає 28,5мг сполуки 43. [a]D=+48°(с=2,75, вода. Препарат 39 Метил (2-аміно-2-деокси-3,4-ди-O-метил-6-Oсульфонат-a-D-глюкопіранозил)-(1—>4)-(2,3-ди-Ометил-b-D-глюкопіранозилуроновакислота)-(1— >4)-(2,3,6-три-O-сульфонат-a-D-глюкопіранозил)(1—>4)-(2,3-ди-O-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-a-Dглюкопіранозид, натрієва сіль (44) Розчин сполуки 43 (27,5мг, 0,015ммоль) у суміші трет-бутанол (333мкл)/вода (500мкл) обробляють гідрогеном під тиском (5бар) у присутності 10% паладію на вугіллі (8,25мг) протягом 16год. Після фільтрування розчин концентрують і залишок вносять на колонку Sephadex G-25 Fine (3´92см). Після елююювання водою і ліофілізації одержують 23,7мг сполуки 44. [a]D=+58°(с=1, вода). 42 Препарат 40 Метил (4-O-левулініл-2,3-ди-O-метил-b-Dглюкопіронозилуронова кислота)-(1—>4)-(3,6-диО-ацетил-a-D-глюкопіранозил)-(1—>4)-(2,3-ди-Oметил-a-L-ідопіранозилуронова кислота)-(1—>4)a-D-глюкопіранозид (46) Розчин сполуки 45 (4,50г, 3,02ммоль) [одержаної згідно з P. Westerduin et ai., BioOrg. Med. Chem., 1994, 2, 1267] у суміші етилацетат/третбутанол (72мл, 1/1, об'єм/об'єм) обробляють гідрогеном під тиском (4бар) у присутності 10% паладію на вугіллі (9,0г) протягом 6год. Після фільтрування і концентрування одержують сполуку 46, яку використовують далі без очищення. ТШХ: Rf=0,54, 26/22/4,6/17 (об'єм/об'єм/об'єм/об'єм) етилацетат/піридин/оцтова кислота/вода. Препарат 41 Метил (метил-4-O-левулініл-2,3-ди-O-метил-bD-глюкопіранозилуронат)-(1—>4)-(2,3,6-три-Oацетил-a-D-глюкопіранозил)-(1—>4)-(метил-2,3ди-О-метил-a-L-ідопіранозилуронат)-(1—>4)-2,3,6три-O-ацетил-a-D-глюкопіранозид (47) Гідрокарбонат калію (2,71г) і потім метиліодид (3,4мл) при 0°С додають до розчину сполуки 46 (2,57г, 2,71ммоль) у безводному N.W-ДМФ (35мл). Після 16-годинного перемішування при кімнатній температурі реакційну суміш о холоджують до 0°С. Додають диметиламінопіридин (132мг) і потім оцтовий ангідрид (1,5мл). Суміш перемішують протягом 16год., нейтралізують надлишок оцтового ангідриду і суміш розбавляють етилацетатом. Органічну фазу промивають 10%-м гідросульфатом калію, водою і потім насиченим розчином гідрокарбонату натрію і водою, сушать над сульфатом натрію, фільтрують і випарюють до сухості. Залишок очищують хроматографією на колонці силікагелю [9/5 циклогексан/(1/1 етилаце 43 79736 44 тат/етанол)] і одержують 2,51г сполуки 47. ТШХ: Rf=0,41, 2/1 (об'єм/об'єм) толуол/ацетон. Препарат 42 Метил (метил-2,3-ди-О-метил-b-Dглюкопіранозилуронат)-(1—>4)-(2,3,6-три-Оацетил-a-D-глюкопіранозил)-(1—>4)-(метил-2,3ди-O-метил-a-L-ідопіранозилуронат)-(1—>4)-2,3,6три-О-ацетил-a-D-глюкопіранозид (48) Сполуку 47 (2,5г, 2,56ммоль) розчиняють у 1/1 (об'єм/об'єм) суміші толуол/етанол (500мл). Додають гідразинацетат (1,01г). Після 2-годинного перемішування при кімнатній температурі реакційну суміш концентрують до сухості і залишок розчиняють у ДХМ. Органічну фазу промивають 2%-м розчином гідрокарбонату натрію і водою, сушать над сульфатом натрію, фільтрують випарюють до сухості. Хроматографія на колонці силікагелю (1/4 (об'єм/об'єм) толуол/етилацетат) дає 2,01г сполуки 48. ТШХ: Rf=0,37, 2/1 (об'єм/об'єм) толуол/ацетон. Схема 12 - Синтез пентасахариду 49 Препарат 43 Метил (6-О-ацетил-2-азидо-2-деокси-3,4-ди-Ометил-a-D-глюкопіранозил)-(1—>4)-(метил-2,3-диО-метил-b-D-глюкопіранозилуронат)-(1—>4)-(2,3,6три-O-ацетил-a-D-гпюко-піранозил)-(1—>4)(метил-2,3-ди-О-метил-a-L-ідопіранозилуронат)(1—>4)-2,3,6-три-О-ацетил-a-D-глюкопіранозид (49) Імідат 38 (1,18г, 2,81ммоль) [одержаний згідно з J. Hasten et al., Bioorg. Med. ,Chem. Lett. (1992), 2(9), 901] і сполуку 48 (1,83г, 1,75ммоль) розчиняють 1/2 (об'єм/об'єм) суміші ДХМ/діетилетер (126мл). Після додання порошку молекулярного сита 4Å, суміш охолоджують до -20°С і додають 1М розчину третбутилдиметилсилілтрифторметансульфонату у ДХМ (421мкл). Через 30хв. додають імідат (266мг) і 1М розчину третбутилдиметилсилілтрифторметансульфонату у ДХМ (168мкл). Через 10хв. суміш нейтралізують доданням твердого гідрокарбонату натрію і фільтрують. До розчину доливають ДХМ, промивають 2%-м розчином гідрокарбонату натрію і водою, сушать над сульфатом натрію і концентрують у вакуумі. Залишок очищують хроматографією на колонці силікагелю (4/3 і потім 1/1 (об'єм/об'єм) ДХМ/е тилацетат) і одержують 1,814г сполуки 49. ТШХ. Rf=0,57, 3/1 (об'єм/об'єм) толуол/етилацетат. [a]D=+93°(c=1,15, ДXM). Препарат 44 Метил (азидо-2-деокси-3,4-ди-О-метил-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-b)-Dглюкопіранозилуронова кислота)-(1—>4)-(a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-a-Lідопіранозилуронова кислота)-(1—>4)-a-Dглюкопіранозид (50) 30%-й водний розчин гідрогенпероксиду (42мл) додають при -5°С до розчину сполуки 49 (845,3мг) у ТГФ (104мл). Після 5-хвилинного перемішування додають краплями 0,7М водного розчину гідроксиду літію (19,2мл). Реакційну суміш перемішують 1год. при -5°С, потім 4год. при 0°С і, нарешті, 16год. при кімнатній температурі, після чого нейтралізують доданням 1М гідрохлоридної кислоти. Розчину вносять на колонку Sephadex® G-25 Fine (5´1000см), елююючи водою. Фракції, що включають бажану сполуку, об'єднують, концентрують і вносять на колонку Dowex AG 50 WX4 Н+ смола (50мл). Сполуку збирають при 0°С і концентрують, одержуючи 618мг сполуки 50. ТШХ: Rf=0,56, 26/22/4,6/17 (об'єм/об'єм/об'єм/об'єм) етилацетат/піридин/оцтова кислота/вода. Препарат 45 Метил (2-азидо-2-деокси-3,4-ди-O-метил-6-Oсульфонат-a-D-глюкопіранозил)-(1—>4)-(2,3-ди-Ометил-b-D-глюкопіранозилуронат)-(1—>4)-(2,3,6три-O-сульфонат-a-D-глюкопіранозил)-(1—>4)(2,3-ди-О-метил-a-L-ідопіранозилуронат)-(1—>4)2,3,6-три-О-сульфонат-a-D-глюкопіранозид, натрієва сіль (51) Безпосередньо перед використанням, сполуку 50 дистилюють разом W..W-ДМФ (3´29мл). До розчину сполуки 50 (612мг, 0,624ммоль) у W.WДМФ (58мл) додають комплекс сульфуртриоксидтриетиламін (3,84г) і суміш перемішують 16год. при 55°С у темряві. Суміш охолоджують до 0°С і додають краплями до розчину гідрокарбонату на 45 трію (5,33г) у воді (200мл). Суміш перемішують 16год. при кімнатній температурі і концентрують до сухості. Залишок розчиняють у воді і розчин вносять на колонку Sephadex® G-25 Fine і елююють 0,2М хлориду натрію. Фракції, що включають продукт, концентрують і опріснюють, використовуючи ту ж колонку і елююючи водою. Ліофілізація дає 1,06г сполуки 51. ТШХ: Rf=0,5, 3/5/1/3 (об'єм/об'єм/об'єм/об'єм) етилацетат/піридин/оцтова кислота/вода. Препарат 46 Метил (2-аміно-2-деокси-3,4-ди-O-метил-6-Oсульфонат-a-D-глюкопіранозил)-(1—>4)-(2,3-ди-Ометил-b-D-глюкопіранозилуронова кислота)-(1—>)-(2,3,6-три-О-сульфонат-a-D-глюкопіранозил)-(1— 79736 46 >4)-(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-a-Dглюкопіранозид, натрієва сіль (44) Цей гідроліз виконують двічі, кожного разу з 534,4мг сполуки 51. Розчин сполуки 51 (534,4мг) у суміші третбутанол (6,7мл, 12,6мл/г)/вода (10мл, 19мл/г) обробляють гідрогеном під тиском (5бар) у присутності 10% паладію на вугіллі (160мг) при 40°С протягом 4год. Після фільтрування (МіІІіроге® LSWP 5мкм фільтр), розчин концентрують до сухості і одержують 530мг сполуки 44. ТШХ: Rf=0,49, 3/5/1/3 (об'єм/об'єм/об'єм/об'єм) етилацетат/піридин/оцтова кислота/вода. 47 79736 Приклад 1 Метил (2,3,4,6-тетра-О-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонат-aD-глюкопіранозил)-(1—>4)-(2,3,6-три-Осульфонат-b-D-глюкопіранозил)-(1—>4)-(6біотинамідо-6-дезокси-2,3-ди-O-метил-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-метил-b-Dгпюко-піранозил)-(1—>4)-[(2,3,6-три-O-метил-a-Dглюкопіранозил)-(1—>4)-О-(2,3,6-три-О-метил-b-Dглюкопіранозил)-(1—>4)]3-(6-О-сульфонат-2,3-диО-метил-a-D-глюкопіранозил)-(1—>4)-(2,3-ди-Ометил-b-D-глюкопіранозилуроновакислота)-(1— >4)-(2,3,6-три-О-сульфонат-a-D-глюкопіранозил)(1—>4)-(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-О-сульфонат-a-Dглюкопіранозид, натрієва сіль Біотинсульфосукцинімід (16,5мг) додають до розчину сполуки 37 (18мг, 3,72ммоль) у 0,5%-му гідрокарбонаті натрію (1,5мл). Після 16-годинного перемішування при кімнатній температурі реакційну суміш вносять на колонку Sephadex® G-25 Fine і елюююють хлоридом натрію. Фракції, що включають продукт, концентрують і опріснюють на тій же колонці, елююючи водою. Ліофілізація дає 15,9мг сполуки Прикладу 1. [a]D=+59°(с=0,78, вода). Маса: спосіб ESI, негативний режим: хімічна маса =5065,12; експериментальна маса =5064,18±1,04a.m.u. Приклад 2 Метил (2,3,4,6-тетра-O-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-О-сульфонат-a 48 D-глюкопіранозил)-(1—>4)-(2,3,6-три-Осульфонат-O-глюкопіранозил)-(1—>4)-(6-[6(біотинамідо)гексамідо]-6-деокси-2,3-ди-O-метилa-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Ο-метил-aD-глюкопіранозил)-(1—>4)-[(2,3,6-три-О-метил-aD-глюкопіранозил)-(1—>4)-О-(2,3,6-три-О-метил-bD-глюкопіранозил)-(1—>4)]3-(6-O-сульфонат-2,3ди-O-метил-a-D-глюкопіранозил)-(1—>4)-(2,3-диО-метил-b)-D-глюкопіранозилуронова кислота)(1—>4)-(2,3,6-три-О-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-a-Lідопіранозилуронова кислота)-(1—>4)-2,3,6-три-Осульфонат-a-D-глюкопіранозид, натрієва сіль 6-(біотинамідо)гексаноат (16,5мг) додають до розчину сполуки 37 (18мг, 3,72ммоль) у 0,5%-му гідрокарбонаті натрію (1,5мл). Після 16-годинного перемішування при кімнатній температурі реакційну суміш вносять на колонку Sephadex® G-25 Fine і елююють хлоридом натрію. Фракції, що включає продукт, концентрують і опріснюють на тій же колонці, елююючи водою. Ліофілізація дає 17,9мг сполуки Прикладу 2. [a]D=+60°(с=1,0, вода). Маса: спосіб ESI, негативний режим: хімічна маса 5178,28; експериментальна маса =5176,3±0,77a.m.u. Приклад 3 Метил (2,3,4,6-тетра-О-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3,6-три-O-сульфонат-aD-глюкопіранозил)-(1—>4)-(2,3,6-три-Oсульфонат-b-D-глюкопіранозил)-(1—>4)-(6-[6-(6біотинамідогексамідо)гексамідо]-6-деокси-2,3-диO-метил-a-D-глюкопіранозил)-(1—>4)-(2,3,6-три-Ометил-b-D-глюкопіранозил)-(1—>4)-[(2,3,6-три-Oметил-a-D-глюкопіранозил)-(1—>4)-О-(2,3,6-три-Ометил-b-D-глюкопіранозил)-(1—>4)]3-(6-Oсульфонат-2,3-ди-O-метил-a-D-глюкопіранозил)(1—>4)-(2,3-ди-O-метил-b-Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-О-сульфонат-a-D-глюкопіранозил)-(1—>4)(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-a-Dглюкопіранозид, натрієва сіль Сульфосукцинімідил-6-(6біотинамідогексамідо)гексоанат (23,6мг) додають до розчину сполуки 37 (17мг, 3,51ммоль) у 0,5%му гідрокарбонаті натрію (1,4мл). Після 16-год. перемішування при кімнатній температурі реакційну суміш вносять на колонку Sephadex G-25 Fine і елююють хлоридом натрію. Фракції, що включають продукт, концентрують і опріснюють на тій же колонці, елююючи водою. Ліофілізація дає 17,4мг сполуки Прикладу 2. [a]D=+64°(c=1,0, вода). Маса: спосіб ESI, негативний режим: хімічна маса 5291,44; експериментальна маса =5292,1±0,83 а.m.u. Приклад 4 Метил (2-біотинамідо-2-деокси-3,4-ди-Oметил-6-O-сульфонат-a-D-глюкопіранозил)-(1— >4)-(2,3-ди-O-метил-b-D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-О-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-О-метил-a-L 49 79736 ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-Осульфонат-a-D-глюкопіранозид, натрієва сіль Розчин біотин-\/\/-гідроксисукциніміду (42мг) у N.W-ДМФ (750мкл) додають до розчину сполуки 44 (21,2мг, 0,012ммоль) у 0,5%-му гідрокарбонаті натрію (750мкл). Після 16-годинного перемішування при кімнатній температурі реакційну суміш вносять на колонку Sepha'dex® G-25 Fine. Після елюювання водою і ліофілізації одержують 22,3мг сполуки Прикладу 4. [a]D=+38°(c=0,15, вода). Маса: спосіб ESI, негативний режим: хімічна маса 1938,48; експериментальна маса =1937,48±0,11а.m.u. Приклад 5 Метил (2-[N-(6-біотинамідогексаноїл)]-2деокси-3,4-ди-O-метил-6-O-сульфонат-a-Dглюкопіранозил)-(1—>4)-(2,3-ди-O-метил-b-Dглюкопіранозилуронова кислота)-(1—>4)-(2,3,6три-O-сульфонат-a-D-глюкопіранозил)-(1—>4)(2,3-ди-О-метил-a-L-ідопіранозилуронова кислота)-(1—>4)-2,3,6-три-O-сульфонат-a-Dглюкопіранозид, натрієва сіль Цю реакцію проводять двічі, з 494,5мг сполуки 44 кожного разу. Сполуку 44 (494,5мг, 0,289ммоль) розчиняють у 0,5%-му водному розчині гідрокарбонату натрію (116мл). Краплями додають розчин сульфосукцинімід-6-біотинамідогексаноат (1,46г, 2,63ммоль) у 0,5%-му розчині гідрокарбонату натрію (12мл). Після 16-годинного перемішування при кімнатній температурі додають 1Μ водного розчину гідроксиду натрію і суміш перемішують протягом 1год. Реакційну суміш вносять на колонку Sephadex® G25 Fine (5´1000см) і елююють хлоридом натрію. Фракції, що включають продукт від двох реакцій, Комп’ютерна в ерстка Т. Чепелев а 50 об'єднують і після ліофілізації одержують 999,2мг сполуки Прикладу 5. ТШХ: Rf=0,42,3/5/1/3 (об'єм/об'єм/об'єм/об'єм) етилацетат/піридин/оцтова кислота/вода. Маса: спосіб ESI, негативний режим: хімічна маса 2051,64; експериментальна маса =2051,60±0,43a.m.u. Приклад 6 Метил (2-[6-(6біотинамідогексамідо)гексамідо]-2-деокси-3,4-диО-метил-6-О-сульфонат-a-D-глюкопіранозил)-(1— >4)-(2,3-ди-О-метил-b-D-глюкопіранозилуронова кислота)-(1—>4)-(2,3,6-три-O-сульфонат-b-Dглюкопіранозил)-(1—>4)-(2,3-ди-O-метил-a-Lідопіранозилуронова кислота)-(1—>4)-2,3,6-три-Осульфонат-a-D-глюкопіранозид, натрієва сіль Сполуку 44 (30,1мг, 17,6ммоль) розчиняють у 0,5%-му водному розчині гідрокарбонату натрію (116мл). Краплями додають розчин сульфосукцинімід-6-біотинамідогексаміду (118г, 176ммоль) у 0,5%-му розчині гідрокарбонату натрію (12мл). Після 16-годинного перемішування при кімнатній температурі додають 1М водного розчину гідроксиду натрію і суміш перемішують протягом 1 год. Реакційну суміш вносять на колонку Sephadex® G25 Fine (2´85см) і елююють хлоридом натрію. Фракції, що включають продукт, концентрують і опріснюють на колонці Sephadex® G-25 Fine (2´85см), елююючи водою. Ліофілізація дає 26,5мг сполуки Прикладу 6. Маса: спосіб ESI, негативний режим: хімічна маса 2164,48; експериментальна маса =20512164,29±0,38a.m.u. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPolysaccharides with antithrombotic activity comprising at least a covalent bond with biotin or a biotin derivative
Автори англійськоюHerbert Jean-Marc, Petitou, Maurice, Savi, Pierre
Назва патенту російськоюПолисахариды с антитромботической активностью, имеющие ковалентную связь с биотином или производным биотина
Автори російськоюЭрбер Жан-Марк
МПК / Мітки
МПК: A61P 7/02, A61K 47/42, A61P 9/10, C08B 37/00, A61P 9/00, A61P 7/04, A61P 3/00, A61K 31/715, A61P 31/12, A61P 3/10, A61K 31/7056, A61K 31/716, A61P 35/00, A61P 11/00, C07H 15/04, A61P 9/08, A61P 31/04, A61P 25/28
Мітки: біотином, зв'язок, похідним, біотину, полісахариди, мають, антитромботичною, ковалентний, активністю
Код посилання
<a href="https://ua.patents.su/25-79736-polisakharidi-z-antitrombotichnoyu-aktivnistyu-shho-mayut-kovalentnijj-zvyazok-z-biotinom-abo-pokhidnim-biotinu.html" target="_blank" rel="follow" title="База патентів України">Полісахариди з антитромботичною активністю, що мають ковалентний зв’язок з біотином або похідним біотину</a>
Попередній патент: Очищення антигенів вірусу гепатиту b (hbv) для використання у вакцинах
Наступний патент: Спосіб одержання імідазо[1,2-c][2,3]бензодіазепінів та проміжні продукти при їх одержанні
Випадковий патент: Спосіб очищення висококонцентрованого водно-спиртового розчину












