Конденсований біциклічний оксазолідинон як інгібітор сетр
Номер патенту: 114612
Опубліковано: 10.07.2017
Автори: Вачал Петр, Шао Пенчен Патрік, Сунь Ваньін, Є Фин, Катіпаллі Реватхі Редді, Лю Цзянь, Ша Дею
Формула / Реферат
1. Сполука формули І
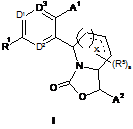
або її фармацевтично прийнятна сіль,
де R1 являє собою Н, -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл, -ОС2-С5-алкініл, -ОН, галоген, -CN, -NR6R7, -CO2R8, -C(O)NR6R7, -SO2NR6R7, НЕТ(3) або С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, де -С1-С5-алкіл, -OС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл і -ОС2-С5-алкініл необов'язково заміщені 1-7 галогенами, і де НЕТ(3) і С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, необов'язково заміщені 1-3 групами замісників, кожна з яких необов'язково являє собою галоген, -С1-С3-алкіл, -ОС1-С3-алкіл, -С2-С3-алкеніл, -ОС2-С3-алкеніл, -С2-С3-алкініл або -ОС2-С3-алкініл, де -С1-С3-алкіл, -ОС1-С3-алкіл, -С2-С3-алкеніл, -ОС2-С3-алкеніл, -С2-С3-алкініл і -ОС2-С3-алкініл необов'язково заміщені 1-7 галогенами;
R6 і R7, кожен незалежно, являють собою Н або -С1-С5-алкіл;
R8 являє собою Н або -C1-C5-алкіл, необов'язково заміщений 1-7 галогенами;
НЕТ(3) являє собою 3-6-членне гетероциклічне кільце, що містить 1-3 гетероатомні групи, кожна з яких незалежно являє собою N, NH, О, S, S(O) або S(O)2 і необов'язково має 1-3 подвійні зв'язки;
х дорівнює 0 або 1;
пунктирні лінії у формулі І представляють один необов'язковий подвійний зв'язок між 2 сусідніми атомами вуглецю;
D1 являє собою N або CR2;
D2 являє собою N або CR3;
D3 являє собою N або CR4;
R2, R3 і R4, кожен незалежно, являють собою Н, -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл, -ОС2-С5-алкініл, -ОН, галоген, -CN, -NR6R7, -CO2R8, -C(O)NR6R7 або -SO2NR6R7, де -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл і -ОС2-С5-алкініл необов'язково заміщені 1-7 галогенами;
кожен R5 незалежно являє собою -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл, -ОС2-С5-алкініл, -ОН, галоген, -CN, -NR6R7, -CO2R8, -C(O)NR6R7 або -SO2NR6R7, де -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл і -ОС2-С5-алкініл необов'язково заміщені 1-7 галогенами;
А1 являє собою феніл, НЕТ(1) або С3-С8-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, де А1 необов'язково заміщений однією групою замісника Z і необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл, -ОС2-С5-алкініл, галоген, -ОН або -CN, де -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл і -ОС2-С5-алкініл необов'язково заміщені 1-7 галогенами;
кожен НЕТ(1) являє собою 5- або 6-членне гетероциклічне кільце, що містить 1-4 гетероатомні групи, кожна з яких незалежно являє собою -N-, -NH-, -S-, -О-, -S(O) або -S(O)2-, необов'язково має одну групу -С(=О)- і необов'язково має 1-3 подвійні зв'язки;
Z являє собою А3, -С1-С3-алкілен-СО2R8, -C1-C3-алкілен-C(O)NR6R7, -С1-С3-алкілен-SО2NR6R7, -CO2R8, -C(O)NR6R7, -SO2NR6R7 або -С1-С3-алкілен-НЕТ(2), де -С1-С3-алкілен у всіх випадках використання необов'язково заміщений 1-7 галогенами, і НЕТ(2) необов'язково заміщений 1-3 замісниками, що необов'язково являють собою -С1-С3-алкіл, необов'язково заміщений 1-5 галогенами, -OС1-С3-алкіл, необов'язково заміщений 1-5 галогенами, галоген або NR6R7;
А3 являє собою феніл, С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, або НЕТ(1), де А3 необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл, -ОС2-С5-алкініл, галоген, -ОН або -CN, де -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл і -ОС2-С5-алкініл необов'язково заміщені 1-7 галогенами; і А3 необов'язково заміщений однією групою, що являє собою НЕТ(2), -С1-С4-алкілен-СО2R8, -С1-С4-алкілен-C(O)NR6R7, -C1-C4-алкілен-SO2NR6R7, -CO2R8, -C(O)NR6R7 або -SO2NR6R7, де -С1-С4-алкілен у всіх випадках використання необов'язково заміщений 1-7 галогенами; і де НЕТ(2) необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою галоген, -С1-С5-алкіл, необов'язково заміщений 1-7 галогенами, -ОС1-С5-алкіл, необов'язково заміщений 1-7 галогенами, або NR6R7;
НЕТ(2) являє собою 5-6-членне гетероциклічне кільце, що містить 1-3 гетероатомні групи, кожна з яких незалежно являє собою N, NH, О або S, необов'язково має одну групу -С(=О)- і необов'язково має 1-3 подвійні зв'язки;
А2 являє собою феніл або НЕТ(1), де А2 необов'язково заміщений 1-3 групами замісників, кожна з яких необов'язково являє собою -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл, -ОС2-С5-алкініл, галоген, -CN, -ОН або С3-С6-циклоалкіл, де -С1-С5-алкіл, -ОС1-С5-алкіл, -С2-С5-алкеніл, -ОС2-С5-алкеніл, -С2-С5-алкініл і -ОС2-С5-алкініл необов'язково заміщені 1-7 галогенами, і -С1-С3-циклоалкіл необов'язково заміщений 1-3 замісниками, кожний з яких незалежно являє собою галоген, -С1-С3-алкіл або -OС1-С3-алкіл, де -С1-С3-алкіл і -ОС1-С3-алкіл необов'язково заміщені 1-7 галогенами; і
а дорівнює 0 або цілому числу 1-3.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль,
де R1 являє собою -С1-С5-алкіл, -ОС1-С5-алкіл, галоген, -NR6R7, НЕТ(3) або -С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, де -С1-С5-алкіл і -ОС1-С5-алкіл необов'язково заміщені 1-7 галогенами, і де НЕТ(3) і -С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, необов'язково заміщені 1-3 групами замісників, кожна з яких необов'язково являє собою галоген, СН3, CF3, OCH3 або OCF3;
щонайменше один з D1, D2 або D3 являє собою CR2, CR3 або CR4;
R2, R3 і R4, кожен незалежно, являють собою Н, -С1-С5-алкіл, -ОС1-С5-алкіл або галоген, де -С1-С5-алкіл і -ОС1-С5-алкіл необов'язково заміщені 1-7 галогенами;
кожен R5 незалежно являє собою -С1-С5-алкіл, -ОС1-С5-алкіл або галоген, де -С1-С5-алкіл і -ОС1-С5-алкіл необов'язково заміщені 1-7 галогенами;
А1 являє собою феніл, НЕТ(1) або С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, де А1 необов'язково заміщений однією групою замісника Z і необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою галоген, -ОН, -CN, -С1-С5-алкіл, необов'язково заміщений 1-7 галогенами, або -ОС1-С5-алкіл, необов'язково заміщений 1-7 галогенами;
А3 являє собою феніл, -С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, або НЕТ(1), де А3 необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою -С1-С5-алкіл, необов'язково заміщений 1-7 галогенами, -ОС1-С5-алкіл, необов'язково заміщений 1-7 галогенами, -ОН або галоген, і необов'язково заміщений однією групою, що являє собою НЕТ(2), -С1-С2-алкілен-CO2R8, -С1-С2-алкілен-С(О)NR6R7, -С1-С2-алкілен-SO2NR6R7, -CO2R8, -C(O)NR6R7 або -SO2NR6R7, де -С1-С2-алкілен необов'язково заміщений 1-3 галогенами; і де НЕТ(2) необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою галоген, -С1-С5-алкіл, необов'язково заміщений 1-7 галогенами, -ОС1-С5-алкіл, необов'язково заміщений 1-7 галогенами, або NR6R7; і
А2 являє собою феніл або НЕТ(1), де А2 необов'язково заміщений 1-3 групами замісників, кожна з яких необов'язково являє собою С1-С5-алкіл, необов'язково заміщений 1-7 галогенами, -ОС1-С5-алкіл, необов'язково заміщений 1-7 галогенами, галоген, -ОН, -CN або С3-С6-циклоалкіл, необов'язково заміщений 1-3 замісниками, кожний з яких незалежно являє собою галоген, CF3, CH3, -OCF3 або -ОСН3.
3. Сполука за п. 2 або її фармацевтично прийнятна сіль,
де R1 являє собою СН3, CF3, -OCH3, -OCF3, галоген або -NR6R7;
R6 і R7, кожен незалежно, являють собою Н або -С1-С3-алкіл;
R2, R3 і R4, кожен незалежно, являють собою Н, -С1-С3-алкіл, CF3, -OС1-С3-алкіл, -OCF3 або галоген;
кожен R5 незалежно являє собою СН3, CF3, -OCH3, -OCF3 або галоген;
А1 являє собою феніл, НЕТ(1) або С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, де А1 необов'язково заміщений однією групою замісника Z і необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою -С1-С3-алкіл, необов'язково заміщений 1-5 галогенами, -ОС1-С3-алкіл, необов'язково заміщений 1-5 галогенами, галоген, -ОН або -CN;
кожен НЕТ(1) являє собою 5- або 6-членне гетероциклічне кільце, що містить 1-3 гетероатомні групи, кожна з яких незалежно являє собою -N-, -NH-, -S- або -О-, необов'язково має одну групу -С(=О)- і необов'язково має 1-3 подвійні зв'язки;
Z являє собою A3, -(CH2)1-3-CO2R8, -(CH2)1-3-C(O)NR6R7, -(CH2)1-3-SO2NR6R7, -CO2R8, -C(O)NR6R7, -SO2NR6R7 або -(СН2)1-3-НЕТ(2), де НЕТ(2) необов'язково заміщений 1-3 замісниками, що необов'язково являють собою -С1-С3-алкіл, необов'язково заміщений 1-5 галогенами, -ОС1-С3-алкіл, необов'язково заміщений 1-5 галогенами, галоген або NR6R7;
R8 являє собою Н або -С1-С3-алкіл, необов'язково заміщений 1-3 галогенами;
А3 являє собою феніл, -С3-С6-циклоалкіл, що необов'язково має 1-2 подвійні зв'язки, або НЕТ(1), де А3 необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою СН3, CF3, -OCH3, -OCF3, -OH або галоген, і необов'язково заміщений однією групою, що являє собою НЕТ(2), -(CH2)1-2-CO2R8, -(СН2)1-2-C(O)NR6R7, -(CH2)1-2-SO2NR6R7, -CO2R8, -C(O)NR6R7 або -SO2NR6R7, і НЕТ(2) необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою СН3, CF3, -ОСН3, -OCF3, галоген або NR6R7;
А2 являє собою феніл або НЕТ(1), де А2 заміщений 1-3 групами замісників, кожна з яких необов'язково являє собою СН3, CF3, -OCH3, -OCF3, галоген, -CN, -ОН або С3-С4-циклоалкіл, необов'язково заміщений 1-3 замісниками, кожний з яких незалежно являє собою галоген, CF3, CH3, -OCF3 або -ОСН3, і
а дорівнює 0, 1 або 2.
4. Сполука за п. 3, яка має формулу Іа
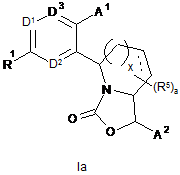 ,
,
або її фармацевтично прийнятна сіль,
де пунктирна лінія в кільці у формулі Іа являє собою необов'язковий подвійний зв'язок.
5. Сполука за п. 4 або її фармацевтично прийнятна сіль,
де R1 являє собою СН3, CF3, -OCH3, -OCF3, F, Сl або -NR6R7;
D1 являє собою N або CR2, де R2 являє собою Н, -С1-С3-алкіл, F або Сl;
D2 являє собою N або CR3, де R3 являє собою Н, -С1-С3-алкіл, F або Сl;
D3 являє собою N або CR4, де R4 являє собою Н, -С1-С3-алкіл, F або Сl;
щонайменше один з D1, D2 або D3 являє собою CR2, CR3 або CR4;
R5 являє собою Н або СН3;
А1 являє собою феніл, піридил, піразиніл, піримідиніл, піридазиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, оксадіазоліл, тіадіазоліл, оксазоліл, піроліл, тієніл, фурил, циклопропіл, циклобутил, циклогексил, циклогексеніл, циклопентил або циклопентеніл, де А1 необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою F, Сl, -ОСН3, -OCF3, -С1-С3-алкіл, -CN або CF3 і, необов'язково, одну групу замісника Z;
Z являє собою A3, -CH2CH2CO2R8, -CH2CH2C(O)NR6R7, -CH2CH2SO2NR6R7 або -СН2СН2-НЕТ(2), де НЕТ(2) необов'язково заміщений 1-2 групами замісників, кожна з яких необов'язково являє собою СН3, CF3, -OCH3, -OCF3, галоген або NR6R7;
R8 являє собою Н або -СН3;
НЕТ(2) являє собою 5-членне гетероциклічне кільце, що містить 1-3 гетероатомні групи, кожна з яких незалежно являє собою N, NH, О або S, необов'язково має одну групу -С(=О) і необов'язково має 1-3 подвійні зв'язки;
А3 являє собою феніл, циклопропіл, циклобутил, циклогексил, циклогексеніл, циклопентил, циклопентеніл або НЕТ(1), де НЕТ(1) являє собою піридиніл, піразиніл, піримідиніл, піридазиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, оксадіазоліл, тіадіазоліл, оксазоліл, піроліл, тієніл, фурил або 5-6-членне гетероциклічне кільце, що містить 1-2 гетероатомні групи, що незалежно являють собою -N-, -NH- або -О-, і необов'язково одну -С(=О)-групу, де А3 необов'язково заміщений 1-2 групами, кожна з яких незалежно являє собою СН3, CF3, -OCH3, -OCF3, -ОН або галоген, і необов'язково заміщений 1 групою, що являє собою -CO2R8, -C(O)NR6R7, -SO2NR6R7 або НЕТ(2), де НЕТ(2) необов'язково заміщений 1-2 групами замісників, кожна з яких необов'язково являє собою СН3, CF3, -OCH3, -OCF3, галоген або NR6R7;
А2 являє собою феніл або НЕТ(1), де А2 заміщений 1-3 групами замісників, кожна з яких необов'язково являє собою CF3, CH3, F, Сl, -CN або циклопропіл; і
а дорівнює 0 або 1.
6. Сполука за п. 5 або її фармацевтично прийнятна сіль,
де пунктирна лінія в кільці у формулі Іа являє собою необов'язковий подвійний зв'язок, коли х дорівнює 0;
де R1 являє собою CF3, F або -N(CH3)2;
D1 являє собою N або CR2, де R2 являє собою Н або -С1-С3-алкіл;
D2 являє собою N або CR3, де R3 являє собою Н або СН3;
D3 являє собою N або CR4, де R4 являє собою Н або СН3;
А1 являє собою феніл, піридил, тієніл, фурил, циклогексеніл або циклопентеніл, де А1 необов'язково заміщений 1-3 групами, кожна з яких незалежно являє собою F, Сl, -ОСН3, ізопропіл, -CN, -СН3 або CF3 і, необов'язково, одну групу замісника Z;
Z являє собою A3, -CH2CH2CO2R8, -СН2СН2-(5-оксо-4,5-дигідро-1,3,4-оксадіазол-2-іл) або -СН2СН2-(5-аміно-1,3,4-оксадіазол-2-іл);
R8 являє собою Н або -СН3;
А3 являє собою феніл, циклобутил, циклопентил, циклогексил або НЕТ(1), де НЕТ(1) являє собою піридиніл, 6-оксопіперидиніл, 2-оксо-1,3-оксазолідиніл, 2-оксо-1,3-оксазинаніл або 5-оксопіролідиніл, де А3 необов'язково заміщений 1-2 групами -СН3, -ОСН3 або -ОН і необов'язково заміщений 1 групою -(5-оксо-4,5-дигідро-1,3,4-оксадіазол-2-іл), -(5-аміно-1,3,4-оксадіазол-2-іл) або -CO2R8;
А2 являє собою феніл, що заміщений 1-2 групами замісників, кожна з яких необов'язково являє собою CF3, CH3, F або Сl; і
а дорівнює 0.
7. Сполука за п. 6, яка має структуру, представлену далі:
Пр. 1
Пр. 2
Пр. 3

Пр. 4
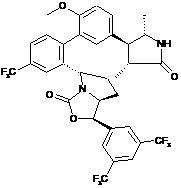
Пр. 5
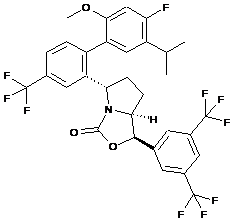
Пр. 6
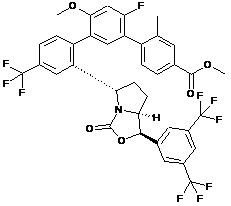
Пр. 7
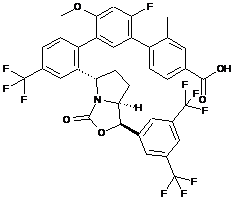
Пр. 8
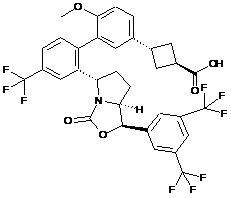
Пр. 9
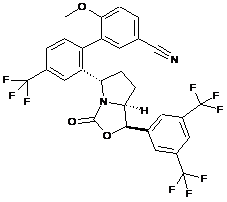
Пр. 10

Пр. 11

Пр. 12

Пр. 13
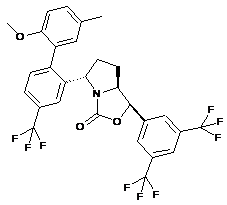
Пр. 14

Пр. 15

Пр. 16

Пр. 17

Пр. 18

Пр. 19

Пр. 20

Пр. 21

Пр. 22

Пр. 23

Пр. 24

Пр. 25

Пр. 26

Пр. 27
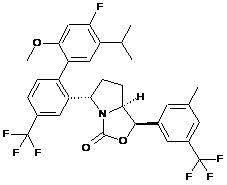
Пр. 28
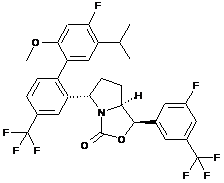
Пр. 29
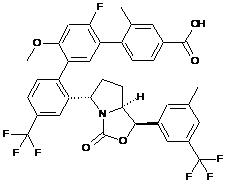
Пр. 30
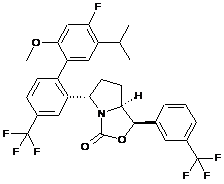
Пр. 31

Пр. 32

Пр. 33

Пр. 34
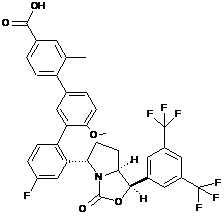
Пр. 35
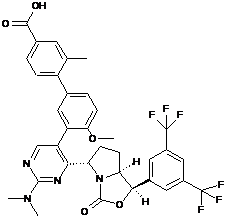
Пр. 36
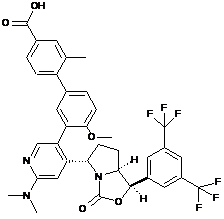
Пр. 37
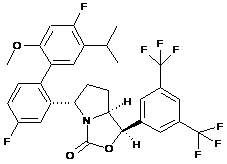
Пр. 38
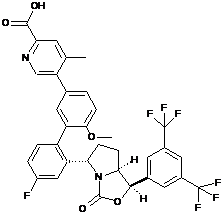
Пр. 39
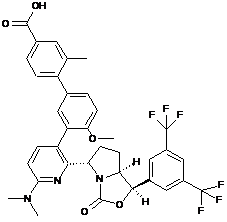
Пр. 40

Пр. 41

Пр. 42

Пр. 43

Пр. 44

Пр. 45
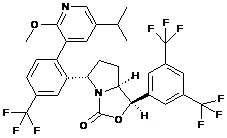
Пр. 46

Пр. 47
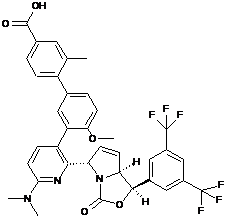
Пр. 48

Пр. 49

Пр. 50
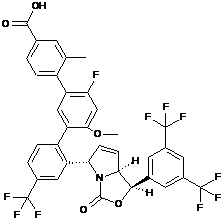
Пр. 51

Пр. 52

Пр. 53
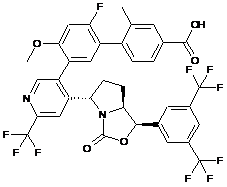
Пр. 54
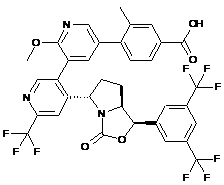
Пр. 55

Пр. 56

Пр. 57
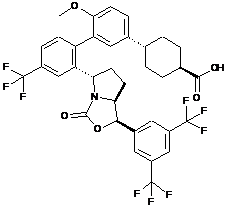
Пр. 58
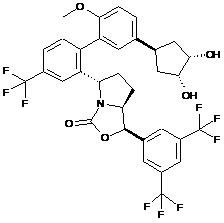
Пр. 59
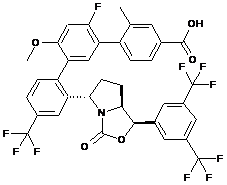
Пр. 60

Пр. 61

Пр. 62

Пр. 63

Пр. 64

Пр. 65

Пр. 66
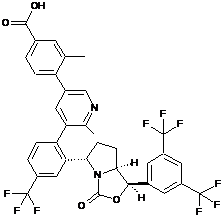
Пр. 67
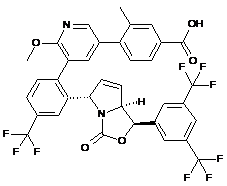
Пр. 68

Пр. 69
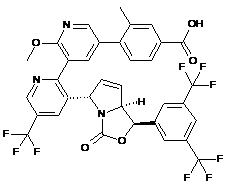
Пр. 70

Пр. 71

Пр. 72

Пр. 73

Пр. 74

Пр. 75

Пр. 76

Пр. 77

Пр. 78

Пр. 79

Пр. 80

Пр. 81
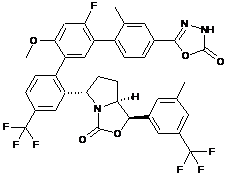
Пр. 82
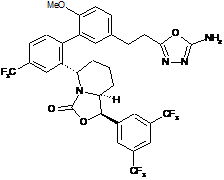
Пр. 83
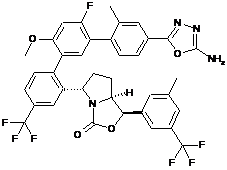
або її фармацевтично прийнятна сіль.
8. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за п. 1 або її фармацевтично прийнятної солі і фармацевтично прийнятний носій.
9. Спосіб лікування атеросклерозу, підвищення рівня HDL-C, зниження рівня LDL-C або лікування дисліпідемії у пацієнта, при необхідності такого лікування, який включає введення терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі зазначеному пацієнту.
10. Фармацевтична композиція, яка містить сполуку за п. 1 або її фармацевтично прийнятну сіль, фармацевтично прийнятний носій і один або декілька активних інгредієнтів, вибраних із групи, що складається з наступних:
(і) інгібітори HMG-CoA-редуктази;
(іі) секвестранти жовчних кислот;
(ііі) ніацин і пов'язані сполуки;
(iv) агоністи PPARa;
(v) інгібітори абсорбції холестерину;
(vi) інгібітори ацил-СоА:холестеролацилтрансферази (АСАТ);
(vii) фенольні антиоксиданти;
(viii) інгібітори мікросомального тригліцеридного білка-переносника (МТР)/АроВ-секреції;
(іх) антиоксидантні вітаміни;
(х) тироміметики;
(хі) індуктори рецепторів LDL (ліпопротеїн низької густини);
(хіі) інгібітори агрегації тромбоцитів;
(хііі) вітамін В12 (також відомий як ціанокобаламін);
(xiv) фолієва кислота або її фармацевтично прийнятна сіль або складний ефір;
(xv) ліганди FXR і LXR;
(xvi) агенти, що підвищують експресію гена АВСА1;
(xvii) транспортери жовчних кислот у клубовій кишці; і
(xviii) агоністи рецептора ніацину.
11. Сполука, яка має структуру, представлену далі:
Пр. 2
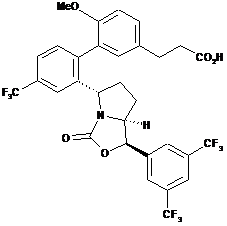
Пр. 3

Пр. 5
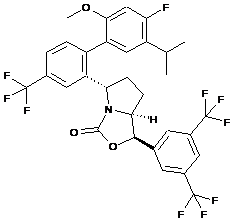
Пр. 7
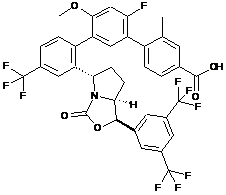
Пр. 29
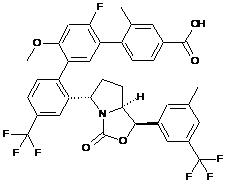
Пр. 45
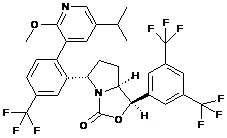
Пр. 54
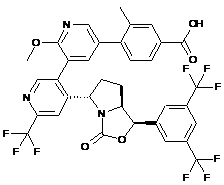
Пр. 56

Пр. 63
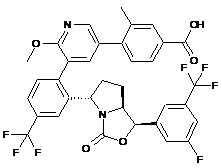
або
Пр. 64

або її фармацевтично прийнятна сіль.
12. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
 .
.
13. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
 .
.
14. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
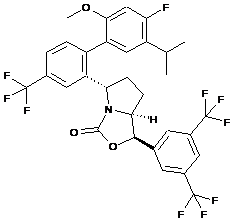 .
.
15. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
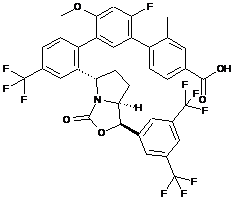 .
.
16. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
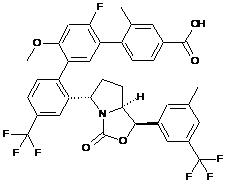 .
.
17. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
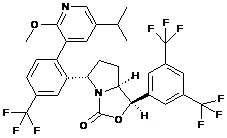 .
.
18. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
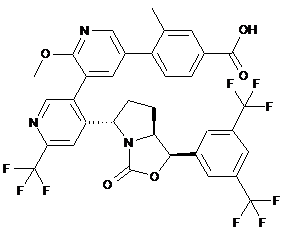 .
.
19. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
 .
.
20. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
 .
.
21. Сполука за п. 11 або її фармацевтично прийнятна сіль, що має структуру:
 .
.
22. Сполука, яка має структуру, представлену далі:
Пр. 2
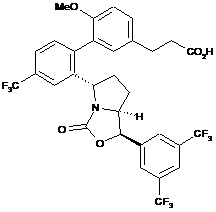
Пр. 3

Пр. 5
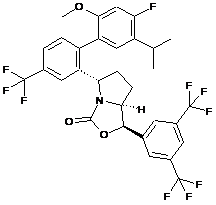
Пр. 7
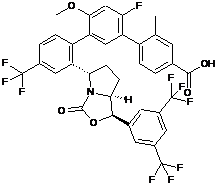
Пр. 29
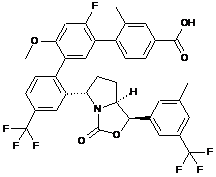
Пр. 45

Пр. 54
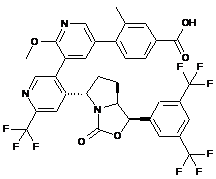
Пр. 56
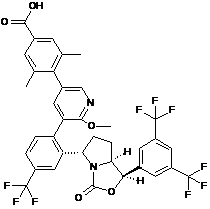
Пр. 63

або Пр. 64

23. Сполука за п. 22, яка має структуру:
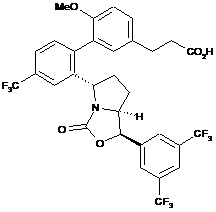 .
.
24. Сполука за п. 22, яка має структуру:
 .
.
25. Сполука за п. 22, яка має структуру:
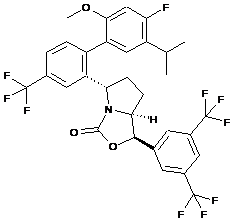 .
.
26. Сполука за п. 22, яка має структуру:
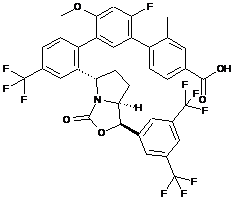 .
.
27. Сполука за п. 22, яка має структуру:
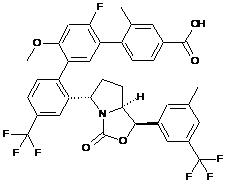 .
.
28. Сполука за п. 22, яка має структуру:
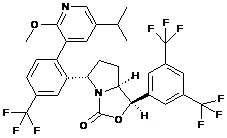 .
.
29. Сполука за п. 22, яка має структуру:
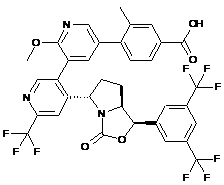 .
.
30. Сполука за п. 22, яка має структуру:
 .
.
31. Сполука за п. 22, яка має структуру:
 .
.
32. Сполука за п. 22, яка має структуру:
 .
.
Текст
клортермін; (58) циклекседрин; (59) декстроамфетамін; (60) дифеметоксидин, (61) N-етиламфетамін; (62) фенбутразат; (63) фенізорекс; (64) фенпропорекс; (65) флудорекс; (66) флумінорекс; (67) фурфурилметиламфетамін; (68) левамфетамін; (69) левофацетоперан; (70) мефенорекс; (71) метамфепрамон; (72) метамфетамін; (73) норпсевдоефедрин; (74) пенторекс; (75) фендиметразин; (76) фенметразин; (77) піцилорекс; (78) фітофарм 57; (79) зонісамід, (80) амінорекс; (81) амфехлорал; (82) амфетамін; (83) бензфетамін; і (84) хлорфентермін. Описані вище комбіновані терапевтичні засоби, у яких використовують сполуки формули I або формули Ia, можуть також застосовуватися в лікуванні метаболічного синдрому. Відповідно до одного широко розповсюдженого визначення, пацієнт із метаболічним синдромом характеризується як такий, що має три або більше симптомів, вибраних з нижченаведеної групи з п'яти симптомів: (1) абдомінальне ожиріння; (2) гіпертригліцеридемія; (3) низький рівень холестерину ліпопротеїнів високої густини (HDL); (4) високий кров'яний тиск; і (5) підвищений рівень глюкози натще, що може знаходитися в діапазоні, характерному для цукрового діабету 2 типу, якщо пацієнт також страждає цукровим діабетом. Кожний з цих симптомів визначений клінічно в третьому звіті групи експертів по виявленню, оцінці і лікуванню підвищеного рівня холестерину в крові у дорослих у рамках Національної освітньої програми по холестерину (National Cholesterol Education Program Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III or ATP III), National Institutes of Health, 2001, NIH Publication No. 01-3670). Пацієнти з метаболічним синдромом мають підвищений ризик розвитку макросудинних і мікросудинних ускладнень, що перераховані вище, у тому числі атеросклероз і ішемічна хвороба серця. Сполучення, описані вище, можуть послабити більше ніж один симптом метаболічного синдрому одночасно (наприклад, два симптоми, три симптоми, чотири симптоми або всі п'ять симптомів). АНАЛІЗИ Протокол: сцинтиляційний аналіз зближення (SPA) активності СЕТР Спочатку ліпопротеїн низької густини (LDL) (Meridian) біотинілювали шляхом інкубації LDL з біотином протягом 1 години на льоду, після чого піддавали діалізу для видалення вільного біотину. Потім сполуки в різних концентраціях інкубували з 15 нМ СЕТР (виробляюча реагент група, In Vitro Pharmacology, MRL Rahway) і 50 мкг/мл біотинільованого LDL у 50 мМ HEPES, 150 3 мМ NaCl, рН 7,4, протягом 1 години при 37ºC. Реакцію починали додаванням ефіру Hхолестерину ліпопротеїнів високої густини (HDL) (American Radiochemicals Corp) у концентрації ~0,6 нМ. Реакція протікала протягом 2 годин при температурі 37 °С, після чого реакцію гасили шляхом додавання 12 %-ої оцтової кислоти. Потім додавали в концентрації 4 мг/мл покриті PVT-стрептавідином бусини для сцинтиляційного аналізу зближення, що були доведені до кімнатної температури. Пробу потім змішували і підраховували після півгодини на планшетірідері Microbeta. In vitro радіоактивний аналіз СЕТР каталізованого CE і TG перенесення (RTA-аналіз) Реагенти і їх виробники: [3H]-холестерилолеат (GE #TRK, 886), [3H]-триолеїн (Perkin-Elmer NET-431), бутильований гідрокситолуол (Aldrich, #D4740-4), DOPC (Sigma, #P6354), бромід натрію (Fisher scientific #S255-500), PEG 8000 (Fisher, #BP233-1) і людський HDL (Intracel Corp #RP-036). In vitro аналіз для визначення сполук, що інгібують активність перенесення CETP, здійснювали, ґрунтуючись на модифікації опублікованого методу (Morton and Zilversmit, (1981) A plasma inhibitor of triglyceride and cholesteryl ester transfer activities, J. Biol. Chemical structure, 256(23), 11992-11995). Здатність інгібіторів змінювати активність CETP оцінювалася з використанням двох різних аналізів: одного з використанням рекомбінантної CETP і одного з використанням джерела ендогенної в плазмі CETP. Обидва аналізи визначають перенесення [3H]-холестерилолеат або [3H]-триолеїну від екзогенного LDL до HDL. Радіомічені донорні частинки одержували спочатку об'єднанням 100 мкл 200 мкМ бутильованого гідрокситолуолу в CHCl3, 216 мкл 21,57 мМ DOPC у EtOH, і або 500 мкКі [3H]триолеїну (Perkin Elmer #NET-431), або 500 мкКі [3H]-холестерилолеату (GE #TRK886) у скляній пробірці. Реагенти змішували, сушили в атмосфері азоту і потім знову суспендували в 2 мл 50 мМ Тріс, 27 мкМ EDTA при pН 7,4. Після короткого струшування розчин обробляли ультразвуком до прозорості і змішували з 20 мл свіжої людської сироватки. Суміш інкубували протягом ночі при температурі 37 °C. Субстрат [3H]-міченого LDL відділяли при густині 1,063 г/мл шляхом наступної ультрацентрифужної флотації в NaBr згідно зі способом Havel, Eder et 15 UA 114612 C2 5 10 15 20 25 30 35 40 45 al., 1955, і Chapman, Goldstein et al., 1981. Після виділення частинки діалізували 3× у буфері CETP (50 мМ Тріс, pН 7,4, 100 мМ NaCl, 1 мМ EDTA). Людський HDL був закуплений на фірмі Intracel і використовувався як акцепторні частинки. Аналізи перенесення здійснювали на 96-ямковому поліпропіленовому планшеті з дном vподібної форми. Для RTA з використанням рекомбінантної CETP (2 % RTA), аналітичний коктейль готували з кінцевою концентрацією 128 мкг/мл HDL, 20 нМ rCETP, 2 % людської сироватки і 1× буфера CETP. 1 мкл кожної досліджуваної сполуки, розведеної в ДМСО, додавали до 47 мкл аналітичного коктейлю на ямку і інкубували при температурі 37 °C протягом 1 години. Для ініціювання реакції перенесення додавали 2 мкл радіоміченого LDL. Після додаткових 60 хв. інкубування при температурі 37 °C дію перенесення зупиняли шляхом осаджування LDL за допомогою рівного об'єму 20 % мас./об'єм PEG 8000. Планшети центрифугували при 2000 об./хв. протягом 30 хвилин при температурі 4 °C. Аліквоту в 40 мкл супернатанту, що містить HDL, переносили в Packard Optiplate™ з 200 мкл MicroScint™ 20. Після змішування планшети підраховували за допомогою рідинної сцинтиляції. Дані підрахунків, представлені в супернатанті для порожніх зразків (ямки, що містять тільки акцептор HDL, буфер CETP і ДМСО), віднімали з даних для зразків, що містять досліджувані сполуки, і використовували для уточнення неспецифічного перенесення. Для аналізу перенесення з використанням ендогенного CETP із сироватки (95 % RTA) використовували ту ж методику, за винятком того, що була додана людська сироватка таким чином, щоб досягалася кінцева концентрація сироватки в 95 % від всього аналізованого об'єму, що давало в аналізі концентрацію приблизно 15 нМ ендогенного CETP. Потім об'єднували з буфером HDL і CETP, і реакцію проводили, як описано вище, і завершували, як описано. Порівняння підрахунків зразків з інгібіторами відносно неінгібованого (тільки ДМСО) позитивного контролю дає відсоток інгібування. Графік відсотків інгібування проти логарифма концентрації інгібітору, що відповідає сигмоїдальному 4-параметровому рівнянню, використовувався для розрахунку IC50. ПРИКЛАДИ Наступні схеми і приклади представлені для того, щоб винахід був більш повно оцінений і зрозумілий. Ці приклади є ілюстративними і не повинні бути витлумачені як обмежуючі винахід яким-небудь чином. Обсяг винаходу визначається прикладеною формулою винаходу. Вихідні продукти є комерційно доступними або одержані з використанням відомих способів або як показано нижче. Сполуки по прикладах можуть бути синтезовані з використанням загальних схем, представлених далі. Дані, одержані по прикладах, представлених далі, були одержані з використанням аналізу RTA у 95 %-й сироватці людини. IC50 по прикладах з використанням даного аналізу знаходяться в області приблизно 44-1742 нМ. Переважні сполуки мають IC50 менше ніж приблизно 500 нМ. Більш переважні сполуки мають IC 50 менше ніж приблизно 100 нМ. Коли в даному документі зазначені сполуки формули I або формули Ia, такі сполуки включають сполуки, визначені загалом формулою I або Ia, а також конкретними прикладами, описаними у даному документі. СХЕМИ СИНТЕЗІВ Синтези проміжних сполук Приклади були синтезовані відповідно до загальних схем, представлених далі. Синтетичні проміжні сполуки для одержання сполук одержані, як описано далі, і проілюстровані на наступних схемах. Різні вихідні продукти, використовувані в схемах, є комерційно доступними або можуть бути легко одержані фахівцями в даній галузі. Схема A1 16 UA 114612 C2 Схема A2 5 10 15 20 25 30 Проміжну сполуку A одержували альдольною реакцією за участі хіральної допоміжної речовини з комерційно доступних вихідних продуктів (схема A1). Обробка альдольного продукту гідразином і наступне діазотування і перегрупування Курціуса приводили до одержання проміжної сполуки A (Wang et al., Tetrahedron, 2009, 65, 6291-6303). Альтернативно, проміжна сполука A може бути одержана шляхом обробки N-Boc-аліламіну втор-бутиллітієм, потім ZnCl2 з одержанням дилітієвого реагенту, що легко взаємодіє з відомим альдегідом (Resek, J. E.; Beak, P. Tetrahedron Letters, 1993, 34, 3043) (схема A2). Наступна обробка гідридом натрію приводила до синтезу проміжної сполуки A. Проміжна сполука A - Схема A1 (4S,5R)-5-[3,5-біс(трифторметил)феніл]-4-етеніл-1,3-оксазолідин-2-он Стадія 1. До перемішуваного розчину (4S)-4-феніл-1,3-оксазолідин-2-ону (12 г, 73,5 ммоль) у ТГФ (200 мл) додавали по краплях н-BuLi (2,5M, 29,4 мл, 73,5 ммоль) за допомогою шприца при температурі -78 C. Одержану реакційну суміш перемішували при температурі -78 °C протягом 5 хвилин, потім по краплях за допомогою шприца додавали (2E)-бут-2-еноїлхлорид (8,46 мл, 88,0 ммоль). Реакційній суміші дозволяли нагрітися до температури навколишнього середовища і гасили шляхом додавання насиченого сольового розчину (100 мл) і води (100 мл). Суміш етилацетату і гексанів (1:2, 100 мл) додавали для розділення суміші, і органічні продукти відділяли, сушили над сульфатом натрію, фільтрували і концентрували. Одержане масло перекристалізовували з 5 % етилацетату в гексані (після затравки кристалами, одержаними з ранніх партій) з одержанням (4S)-3-[(2E)-бут-2-еноїл]-4-феніл-1,3-оксазолідин-2-ону (15,7 г, 67,9 1 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,4 (м, 6H), 5,5 (м, 1H), 4,73 (т, J=8,8 Гц, 1H), 4,30 (м, 1H), 1,97 (дд, J=6,8, 1,5 Гц, 3H). Стадія 2. До (4S)-3-[(2E)-бут-2-еноїл]-4-феніл-1,3-оксазолідин-2-ону (13,8 г, 59,7 ммоль) у DCM (100 мл) додавали TiCl4 (1M у DCM, 59,7 мл, 59,7 ммоль) при температурі -10 °C. Одержаний реакційний розчин переносили за допомогою канюлі в посудину, що містить DIPEA (11,26 мл, 64,5 ммоль) і DCM (100 мл), при температурі 10 °C. За допомогою шприца додавали NMP (11,49 мл, 119 ммоль), і реакційну суміш витримували протягом 1 години, потім охолоджували до температури -40 °C. За допомогою шприца додавали 3,5біс(трифторметил)бензальдегід (17,3 г, 71,6 ммоль) у DCM (25 мл), і реакційній суміші 17 UA 114612 C2 5 10 15 20 25 30 35 40 45 50 55 дозволяли нагрітися до температури 0 °C протягом 1,5 години. Реакцію гасили шляхом додавання оцтової кислоти (15 мл), насиченого розчину солі Рошеля (50 мл) і HCl (1,0M, 200 мл). Органічний продукт відділяли, і водний продукт знову екстрагували DCM (50 мл). Органічні продукти об'єднували, промивали HCl (1,0M, 100 мл), сушили над сульфатом натрію, фільтрували і концентрували. Одержане масло очищали за допомогою колонкової хроматографії, що давало (4S)-3-{(2S)-2-[(S)-[3,5-біс(трифторметил)феніл](гідрокси)метил]бут-3еноїл}-4-феніл-1,3-оксазолідин-2-он (20 г, 42,3 ммоль) у вигляді кристалічного твердого 1 продукту. H-ЯМР (500 МГц, CDCl3): δ 7,86 (c, 2H), 7,83 (c, 1H), 7,4 (м, 5H), 5,7 (м, 1H), 5,4 (м, 1H), 5,31 (д, J=10,3 Гц, 1H), 5,28 (д, J=3,9 Гц, 1H), 5,10 (д, J=17,3 Гц, 1H), 4,8 (м, 1H), 4,7 (т, J=9,0 Гц, 1H), 4,3 (м, 1H). Стадія 3. (4S)-3-{(2S)-2-[(S)-[3,5-біс(трифторметил)феніл](гідрокси)метил]-бут-3-еноїл}-4феніл-1,3-оксазолідин-2-он (20 г, 42,5 ммоль) і гідразин (2,71 г, 85 ммоль) у ТГФ (100 мл) перемішували при кімнатній температурі протягом 1 години. Реакційну суміш розбавляли сумішшю етилацетат:гексан (2:1, 200 мл) і екстрагували водою (100 мл). Органічний продукт промивали насиченим сольовим розчином (100 мл) і сушили над сульфатом натрію, фільтрували і концентрували. Сирий продукт розтирали в IPA (30 мл) для видалення хіральної допоміжної речовини. Фільтрат концентрували, що давало (2S)-2-[(S)-[3,5біс(трифторметил)феніл](гідрокси)метил]бут-3-енгідразид (14,5 г, 42,4 ммоль), який 1 використовували без додаткового очищення. H-ЯМР (500 МГц, CDCl3): δ 7,81 (c, 3H), 7,83 (c, 1H), 7,0 (ушир. с, 1H), 5,9 (м, 1H), 5,42 (д, J=3,3 Гц, 1H), 5,29 (д, J=10,3 Гц, 1H), 5,03 (д, J=17,1 Гц, 1H), 3,1 (дд, J=9,4, 3,5 Гц, 1H). Стадія 4. (2S)-2-[(S)-[3,5-біс(трифторметил)феніл](гідрокси)метил]бут-3-енгідразид (14,5 г, 42,4 ммоль) розчиняли в IPA (100 мл) і HCl (4Н в діоксані, 20 мл). За допомогою шприцевого насоса додавали трет-бутилнітрит (5,24 г, 50,8 ммоль) у IPA (20 мл) при температурі 50 °C протягом 1 години. Реакційну суміш перемішували при температурі 50 °C і протягом додаткової години, і легколеткі продукти видаляли. Сиру суміш розчиняли в етилацетаті (150 мл), промивали водним розчином Na2CO3 (100 мл), сушили над сульфатом натрію, фільтрували і концентрували. Одержане масло очищали за допомогою колонкової хроматографії, що давало (4S,5R)-5-[3,5-біс(трифторметил)феніл]-4-етеніл-1,3-оксазолідин-2-он (7 г, 21,52 ммоль) у 1 вигляді кристалічного твердого продукту ясно-жовтого кольору. H-ЯМР (500 МГц, CDCl3): δ 7,90 (c, 1H), 7,82 (c, 2H), 5,91 (д, J=8,3 Гц, 1H), 5,2 (м, 3H), 4,7 (м, 1H). Проміжна сполука A - Схема A-2 (4S,5R)-5-[3,5-біс(трифторметил)феніл]-4-етеніл-1,3-оксазолідин-2-он Стадія 1. До N-Boc-аліламіну (50,0 г, 0,318 моль) у безводному ТГФ (800 мл) при температурі -78 °C додавали по краплях втор-бутиллітій (1,30M у циклогексані, 538,0 мл, 0,7 моль) у струмені газоподібного N2. Одержаний розчин жовтого кольору перемішували при температурі -78 °C протягом додаткових 2 годин, після закінчення яких додавали ZnCl 2 (1,1M у Et2O, 349,8 мл, 0,35 моль). Розчин перемішували протягом 1 години, потім до прозорого розчину додавали 3,5-бістрифторметилбензальдегід (169,3 г, 0,700 моль). Суміш перемішували при температурі -78 °C протягом 1 години, потім гасили оцтовою кислотою (227 мл). Реакційну суміш виливали в льодяну воду (2 л), і органічний шар промивали насиченим водним розчином NaHCO3 (2×2 л) і насиченим сольовим розчином (1 л), сушили (MgSO 4) і концентрували. Сиру речовину перекристалізовували з петролейного ефіру (300 мл), що давало трет-бутил-{1-[3,5біс(трифторметил)феніл]-1-гідроксибут-3-ен-2-іл}карбамат (57 г) у вигляді порошку білого кольору. Загалом даний спосіб приводить до виходу 2,8 кг речовини. MS ESI обчислено для + C17H20F6NO3 [M+H] 400,1, знайдено 400,0. Стадія 2. В атмосфері N2 при температурі 0 °C до суміші трет-бутил-{1-[3,5біс(трифторметил)феніл]-1-гідроксибут-3-ен-2-іл}карбамату (100 г, 0,250 моль) у безводному ТГФ (1,5 л) повільно при перемішуванні додавали NaH (20 г, 0,500 моль). Після додавання суміш перемішували при температурі 0 °C протягом 1 години, потім при температурі 80 °C протягом 2-6 годин (увага: суміш перемішували і нагрівали при температурі 80 °C протягом 0,5-1 години з виділенням бульбашок). Одержану суміш охолоджували до температури 0 °C і обережно додавали MeOH (0,1 л) і льодяну воду (0,2 л) для гасіння реакції. Суміш концентрували і потім розбавляли етилацетатом (2 л), промивали водою (3×0,5 л), насиченим 18 UA 114612 C2 5 сольовим розчином (0,5 л), сушили і концентрували, що давало темне масло. Флешхроматографія на силікагелі давала сирий продукт, який перекристалізовували з етилацетату, дихлорметану і петролейного ефіру з одержанням цис-5-[3,5-біс(трифторметил)феніл]-4-етеніл1,3-оксазолідин-2-ону (25 г) у вигляді твердої речовини білого кольору. Одержану тверду речовину відділяли за допомогою хіральної SFC (колонка - OJ 250×50 мм, 10 мкм; рухома фаза - A: надкритичний CO2, B: IPA, A:B=85:15 при 230 мл/хв.; температура колонки: 38 °C; тиск у соплі - 100 бар; температура сопла - 60 °C; температура випарювання - 20 °С; температура 1 тримера - 25 °C; довжина хвилі - 220 нм). H-ЯМР (400 МГц, ДМСО-d6): δ 8,30 (c, 1H), 8,10 (c, 1H), 7,93 (c, 2H), 6,05-6,03 (д, 1H), 5,27-5,11 (м, 2H), 4,99-4,97 (д, 1H), 4,76-4,73 (т, 1H). 10 Схема B 15 20 25 На схемі B, A являє собою CH або N, де H у CH може бути заміщений. Синтез проміжної сполуки B починається з відомого або одержаного альдегіду, обробленого вінілом Гриньяра, і одержаний алкоксид прямо захищають у вигляді карбонату. Карбонат потім піддають взаємодії в умовах Ir-каталізу (Hartwig et al., J. Am. Chem. Soc. 2010, 132, 8918-8920) із проміжною сполукою A з одержанням субстрату для замикання кільця реакцією обміну з утворенням біциклічного ядра (проміжна сполука B1). Наступне відновлення дає проміжну сполуку B2. B2 перетворюють до відповідного боронового складного ефіру (проміжна сполука B3) за допомогою каталізованої Pd реакції конденсації. (1R,5S,7aS)-1-(3,5-біс(трифторметил)феніл)-5-(2-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)-5-(трифторметил)феніл)тетрагідропіроло[1,2-c]оксазол-3(1H)-он Проміжна сполука B3 (1R,5S,7aS)-1-[3,5-біс(трифторметил)феніл]-5-[2-бром-5-(трифторметил)феніл]тетрагідро1H-піроло[1,2-c][1,3]оксазол-3-он Стадія 1. До 2-бром-5-трифторметилбензальдегіду (20 г, 99 ммоль) у ТГФ (50 мл) додавали вінілмагнійбромід (1,0M, 128 мл, 128 ммоль) за допомогою шприца при температурі 0 °C. 19 UA 114612 C2 5 10 15 20 25 30 35 40 45 50 55 60 Реакційній суміші дозволяли нагрітися до кімнатної температури і перемішували протягом 30 хв. Реакцію гасили шляхом обережного, по краплях, додавання етилхлорформіату (10,7 г, 99 ммоль). Після перемішування протягом 30 хвилин реакційну суміш розбавляли гексаном (100 мл) і екстрагували за допомогою насиченого водного розчину NH 4Cl. Органічний продукт далі промивали HCl (1,0M у воді, 50 мл), потім насиченим сольовим розчином (30 мл), потім висушували над сульфатом натрію, фільтрували і концентрували досуха. Сиру речовину очищали за допомогою колонкової хроматографії, що давало 1-(2-бром-5-фторфеніл)проп-2-ен1 1-ілетилкарбонат (14,5 г, 47,8 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,56 (м, 1H), 7,24 (м, 1H), 6,97 (м, 1H), 6,43 (д, J=5,5 Гц, 1H), 6,01 (м, 1H), 5,35-5,42 (м, 2H), 4,28 (м, 2H), 1,38 (м, 3H). Стадія 2. До 500 мл RBF додавали 1-(2-бром-5-фторфеніл)проп-2-ен-1-ілетилкарбонат (10,4 г, 29,5 ммоль), (4S,5R)-5-[3,5-біс(трифторметил)феніл]-4-етеніл-1,3-оксазолідин-2-он (4 г, 12,3 ммоль), DCM (20 мл) і комплекс каталізатора Helmchen дибензо[a,e]циклооктатетраєн (dbcot) іридію фосфорамідит (407 мг, 0,369 ммоль) (Helmchen et al., Chem. Eur. J., 2010, 16, 6601-6615). Реакційну суміш перемішували при температурі 33 °C протягом 2 днів на повітрі. Реакційну суміш фільтрували через целіт і очищали за допомогою колонкової хроматографії, що давало (4S,5R)-5-[3,5-біс(трифторметил)феніл]-3-{(1S)-1-[2-бром-5-(трифторметил)-феніл]проп-2-ен-11 іл}-4-етеніл-1,3-оксазолідин-2-он (4,5 г, 7,65 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,86 (м, 2H), 7,68 (c, 2H), 7,64 (c, 1H), 7,54 (д, J=6,5 Гц, 1H), 6,22 (м, 1H), 5,75 (м, 2H), 5,43 (м, 2H), 5,20(м, 1H), 5,03 (д, J=5,0 Гц, 1H), 4,8 (д, J=8,5 Гц, 1H), 4,1 (м, 1H). Стадія 3. У 100-мілілітрову клуглодонну колбу, оснащену зворотним холодильником, поміщали (4S,5R)-5-[3,5-біс(трифторметил)феніл]-3-{(1S)-1-[2-бром-5(трифторметил)феніл]проп-2-ен-1-іл}-4-етеніл-1,3-оксазолідин-2-он (4,5 г, 7,65 ммоль) і толуол (20 мл). Систему продували азотом і додавали 1,3-біс(2,4,6-триметилфеніл)-4,5дигідроімідазол-2-іліден[2-(ізопропокси)-5-(N, Nдиметиламіносульфоніл)феніл]метиленрутеній(II)дихлорид (274 мг, 0,374 ммоль) (каталізатор Zhan 1B). Реакційну суміш нагрівали при температурі 60 °C протягом 2 годин. Розчинник видаляли при зниженому тиску, і одержане масло очищали за допомогою колонкової хроматографії, що давало (1R,5S,7aS)-1-[3,5-біс(трифторметил)феніл]-5-[2-бром-5(трифторметил)феніл]-5,7a-дигідро-1H-піроло[1,2-c][1,3]оксазол-3-он (проміжна сполука B1) (4,0 1 г, 7,14 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,95 (c, 1H), 7,79 (c, 2H), 7,76 (д, J=8,3 Гц, 1H), 7,60 (c, 1H), 7,47 (д, J=8,2 Гц, 1H), 6,34 (д, J=2,5 Гц, 1H), 6,17 (c, H), 6,12 (д, J=8,8 Гц, 1H), 5,46 (д, J=8,7 Гц, 1H), 5,29 (д, J=4,8 Гц, 1H). Стадія 4. До (1R, 5S, 7aS)-1-[3,5-біс(трифторметил)феніл]-5-[2-бром-5(трифторметил)феніл]-5,7a-дигідро-1H-піроло[1,2-c][1,3]оксазол-3-ону (3,0 г, 5,36 ммоль) у етанолі (10 мл) додавали каталізатор Уїлкінсона (Rh(PPh3)3Cl) (495 мг, 0,536 ммоль). Суміш поміщали на апарат Парра в атмосфері газоподібного водню при тиску 40 фунт/кв.дюйм протягом ночі. Після завершення реакції розчинник видаляли при зниженому тиску, і одержане масло очищали за допомогою колонкової хроматографії, що давало (1R,5S,7aS)-1-[3,5біс(трифторметил)феніл]-5-[2-бром-5-(трифторметил)феніл]тетрагідро-1H-піроло[1,21 c][1,3]оксазол-3-он (проміжна сполука B2) (3,0 г, 5,34 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,93 (c, 1H), 7,87 (c, 2H), 7,73 (м, 2H), 7,44 (д, J=2 Гц, 1H), 6,14 (д, J=7,9 Гц, 1H), 6,12 (д, J=8,8 Гц, 1H), 5,35 (м, 1H), 4,63 (м, 1H), 3,03 (м, 1H), 1,69 (м, 1H), 1,25 (м, 2H). Стадія 5. У захисній камері з рукавичками в 40-мілілітрову посудину поміщали (1R,5S,7aS)1-[3,5-біс(трифторметил)феніл]-5-[2-бром-5-(трифторметил)феніл]-тетрагідро-1H-піроло[1,2c][1,3]оксазол-3-он (проміжна сполука B2, 2,0 г, 3,56 ммоль), біс(пінаколато)диборон (1,84 г, 7,11 ммоль), ацетат калію (0,87 г, 8,9 ммоль), 1,1'-біс(ди-третбутилфосфіно)фероценпаладійдихлорид (0,122 г, 0,178 ммоль) і 20 мл диметилацетаміду. Посудину герметично закривали і нагрівали при температурі 80 °C протягом 20 годин. Реакційну суміш розбавляли метиловим трет-бутиловим ефіром, промивали 15 %-ним водним розчином NaCl. Органічні продукти обробляли поглинальною смолою для металу і концентрували. Сирий продукт очищали за допомогою колонкової хроматографії, що давало (1R,5S,7aS)-1-(3,5біс(трифторметил)феніл)-5-(2-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-5(трифторметил)феніл)тетрагідропіроло[1,2-c]оксазол-3(1H)-он (проміжна сполука B3, 1,65 г, 2,71 + ммоль). MS ESI обчислено для C27H25BF9NO4 [M+H] 610,2, знайдено 610,2. Наступні проміжні сполуки, наведені в таблиці 1, одержували згідно зі схемою B з використанням методів, зазначених у синтезах проміжних сполук B1, B2 і B3, використовуючи наявні в продажу або відомі альдегіди на стадії 1. У деяких випадках стадія 3 може бути проведена з використанням каталізатора другого покоління Hoyveda-Grubbs або каталізатора Schrock. Крім того, стадія 4 може бути проведена з використанням як каталізатора Rh/C. Для проміжних сполук B11 і B13 альдегідні вихідні продукти 2-бром-3-метил-5 20 UA 114612 C2 (трифторметил)бензальдегід і 5-бром-2-(трифторметил)ізонікотинальдегід були синтезовані на основі наступних схем. 2-Бром-3-метил-5-(трифторметил)бензальдегід 5 10 15 20 25 30 35 40 У 100-мілілітрову круглодонну колбу поміщали 2,2,6,6-тетраметилпіперидин (2,8 мл, 16,6 ммоль) і 50 мл ТГФ. За допомогою шприца додавали BuLi (9,5 мл, 15,2 ммоль, 1,6M гексановий розчин) при температурі 0 °C. Після перемішування при температурі 0 °C протягом 15 хвилин льодяну баню заміняли на баню сухий лід/ефір. В іншу 25-мілілітрову круглодонну колбу поміщали 1-бром-2-метил-4-(трифторметил)бензол (3,3 г, 13,8 ммоль) і ТГФ. Після охолодження на бані сухий лід/ацетон даний розчин за допомогою канюлі швидко переносили в першу колбу. Після завершення перенесення негайно додавали ДМФ (2,1 мл, 27,6 ммоль), і одержану реакційну суміш перемішували при зазначеній температурі протягом ще 10 хвилин, потім давали повільно нагрітися до температури -20 °C. Реакцію гасили при температурі -20 °C додаванням 50 мл 1н HCl. Дану суміш розбавляли 100 мл води й екстрагували 100 мл сумішшю EtOAc/гексан 1:9. Органічні продукти промивали 30 мл водного розчину NaHCO 3, сушили над сульфатом натрію, фільтрували і концентрували. Сирий продукт очищали за допомогою 1 хроматографії, що давало 1,8 г 2-бром-3-метил-5-(трифторметил)бензальдегіду. H-ЯМР (500 МГц, CDCl3): δ 10,50 (c, 1H), 8,03 (д, J=1,4 Гц, 1H), 7,75 (д, J=1,5 Гц, 1H), 2,60 (c, 3H). 5-Бром-2-(трифторметил)піридин-4-карбальдегід Стадія 1. До 5-бром-2-(трифторметил)ізонікотинової кислоти (20 г, 74,1 ммоль), N, Oдиметилгідроксиламіну гідрохлориду (10,84 г, 111 ммоль) і DIPEA (38,8 мл, 222 ммоль) у ДМФ (100 мл) додавали 2,4,6-трипропіл-1,3,5,2,4,6-триоксатрифосфінану 2,4,6-триоксид (53,4 мл, 89 ммоль) при температурі 0 °C за допомогою краплинної лійки протягом періоду в 10 хвилин. Реакційну суміш перемішували протягом 2 годин. Реакційну суміш концентрували до половини кількості і розбавляли EtOAc. Органічний продукт екстрагували насиченим розчином NH4Cl і потім насиченим сольовим розчином. Органічний продукт сушили над Na2SO4, фільтрували і концентрували у вакуумі. 5-Бром-N-метокси-N-метил-2-(трифторметил)піридин-4-карбоксамід 1 (21 г, 67,1 ммоль) одержували у вигляді сирого масла. H-ЯМР (500 МГц, CDCl3): δ 8,90 (c, 1H), 7,63 (c, 1H), 3,44 (c, 3H), 3,55 (c, 3H). Стадія 2. До 5-бром-N-метокси-N-метил-2-(трифторметил)піридин-4-карбоксаміду (21 г, 67,1 ммоль) у ТГФ (200 мл) додавали DIBAL-H у толуолі (1M, 73,8 мл, 73,8 ммоль) за допомогою шприца при температурі -78 °C. Реакційну суміш перемішували протягом 40 хвилин, при цьому її нагрівали до температури -10 °C. Реакційну суміш розбавляли EtOAc (100 мл) і гасили за допомогою 1н розчину HCl (150 мл). Реакційну суміш фільтрували через целіт і шар силікагелю. Шари розділяли й органічний шар екстрагували за допомогою насиченого розчину NaHCO 3 і потім насиченим сольовим розчином. Органічний шар сушили над Na 2SO4, фільтрували і концентрували у вакуумі. Сирий продукт реакції очищали за допомогою колонкової хроматографії, що давало 5-бром-2-(трифторметил)піридин-4-карбальдегід (13,1 г, 51,6 ммоль). 1 H-ЯМР (500 МГц, CDCl3): δ 10,2 (c, 1H), 9,04 (c, 1H), 8,84 (c, 1H). 45 21 UA 114612 C2 Таблиця 1 Пром. спол. B4 B5 B6 + Структура Назва по IUPAC (1R,5S,7aS)-1-[3,5біс(трифторметил)феніл]-5-(5бром-2-хлорпіридин-4іл)тетрагідро-1H-піроло[1,2c][1,3]оксазол-3-он (1R,5S,7aS)-1-[3,5біс(трифторметил)феніл]-5-(5бром-2-хлорпіридин-4-іл)-5,7aдигідро-1H-піроло[1,2c][1,3]оксазол-3-он (1R,5S,7aS)-1-[3,5біс(трифторметил)феніл]-5-(2бром-5-фторфеніл)-тетрагідро1H-піроло[1,2-c][1,3]оксазол-3он Точна маса [M+H] або 1 H-ЯМР 1 H-ЯМР (500 МГц, CDCl3): δ 8,51 (c, 1H), 7,95 (c, 1H), 7,86 (c, 2H), 7,46 (c, 1H), 6,13 (д, J=8,8 Гц, 1H), 5,25 (м, 1H), 4,59 (м, 1H), 3,0 (м, 1H), 1,69 (м, 1H), 1,25 (м, 2H) Обчислено 529,0 і 527,0; знайдено 528,9 і 526,9 1 H-ЯМР (500 МГц, CDCl3): δ 7,95 (c, 1H), 7,86 (c, 2H), 7,54 (м, 1H), 7,23 (м, 1H), 6,92 (м, 1H), 6,09 (д, J=8,0 Гц, 1H), 5,25 (м, 1H), 4,59 (м, 1H), 2,98 (м, 1H), 1,67 (м, 1H), 1,25 (м, 2H) Обчислено 539,0 і 541,0; знайдено 538,9 і 540,9 B7 (1R,5S,7aS)-1-[3,5біс(трифторметил)феніл]-5-[5бром-2(диметиламіно)піримідин-4іл]тетрагідро-1H-піроло[1,2c][1,3]оксазол-3-он B8 (1R,5S,7aS)-1-[3,5біс(трифторметил)феніл]-5-[5бром-2(диметиламіно)піримідин-4-іл]5,7a-дигідро-1H-піроло[1,2c][1,3]оксазол-3-он Обчислено 539,0 і 537,0; знайдено 538,9 і 536,9 (1R,5S,7aS)-1-[3,5біс(трифторметил)феніл]-5-(3бром-6-хлорпіридин-2іл)тетрагідро-1H-піроло[1,2c][1,3]оксазол-3-он Обчислено 529,0 і 531,0; знайдено 529,0 і 531,0 (1R,5S,7aS)-1-[3,5біс(трифторметил)феніл]-5-(3бром-6-хлорпіридин-2-іл)-5,7aдигідро-1H-піроло[1,2c][1,3]оксазол-3-он Обчислено 529,0 і 527,0; знайдено 529,0 і 527,0 B9 B10 22 UA 114612 C2 B11 B12 B13 B14 B15 (1R,5S,7aS)-1-(3,5біс(трифторметил)феніл)-5-(2бром-3-метил-5(трифторметил)феніл)тетрагідропіроло[1,2-c]оксазол3(1H)-он (1R,5S,7aS)-1-(3,5біс(трифторметил)феніл)-5-(2бром-4-метил-5(трифторметил)феніл)тетрагідропіроло[1,2-c]оксазол3(1H)-он 1 H-ЯМР (500 МГц, CDCl3): δ 7,95 (c, 1H), 7,89 (c, 2H), 7,54 (c, 1H), 7,47 (c, 1H), 6,15 (д, J=8,0 Гц, 1H), 5,41 (т, J=8,0 Гц, 1H), 4,63 (м, 1H), 3,02 (м, 1H), 2,53 (c, 3H), 1,62 (м, 1H), 1,55 (м, 1H), 1,25 (м, 1H) Обчислено 575,3 і 577,3; знайдено 575,9 і 577,9 (1R,5S,7aS)-1-(3,5Обчислено 563,0 і біс(трифторметил)феніл)-5-(5- 565,0; знайдено 563,1 бром-2-(трифторметил)піридин- і 565,1 4-іл)-тетрагідропіроло-[1,2c]оксазол-3(1H)-он (1R,5S,7aS)-1-(3,5Обчислено 517,0; біс(трифторметил)феніл)-5-(2- знайдено 516,8 хлор-5-(трифторметил)піридин3-іл)-1,7a-дигідропіроло-[1,2c]оксазол-3(5H)-он (1R,5S,7aS)-1-(3,5Обчислено 519,0; біс(трифторметил)феніл)-5-(3- знайдено 519 хлор-6-(трифторметил)піридин2-іл)-тетрагідропіроло-[1,2c]оксазол-3(1H)-он Схема C 5 10 Одержання проміжної сполуки C здійснювали за допомогою реакції конденсації Сузукі комерційно доступного броміду і боронового складного ефіру, що давало бажаний продукт. Проміжна сполука C 1-Етеніл-3-метил-5-(трифторметил)бензол До 1-бром-3-метил-5-(трифторметил)бензолу (500 мг, 2,51 ммоль) додавали ТГФ (5 мл), водний триосновний фосфат калію (2,0M, 4,18 мл, 8,37 ммоль), 2-етеніл-4,4,5,5-тетраметил 23 UA 114612 C2 5 1,3,2-діоксаборолан (387 мг, 2,51 ммоль), паладій(II)ацетат (47 мг, 0,209 ммоль) і 1,1'-біс(дитрет-бутилфосфіно)фероцен (99 мг, 0,209 ммоль). Систему продували газоподібним азотом і нагрівали при температурі 80 °C протягом 1 години. Реакційну суміш фільтрували і потім розбавляли етилацетатом і водою. Органічний шар сушили над сульфатом натрію, фільтрували і концентрували. Сирий продукт очищали за допомогою препаративної ТШХ, що давало 11 етеніл-3-метил-5-(трифторметил)бензол (300 мг, 1,61 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,47 (c, 1H), 7,40 (c, 1H), 7,34 (c, 1H), 6,76 (м, 1H), 5,85 (д, J=17,6 Гц, 1H), 2,43 (c, 1H). Схема D 10 15 20 25 Синтез проміжної сполуки D здійснюють з відомого або одержаного альдегіду, який конденсують з хіральним допоміжним сульфінамідом. Взаємодія з одержаним регентом Гриньяра і наступне видалення захисних груп дають енантіомерно збагачений бензиловий амін. Введення захисних груп аміну і поперечне зв'язування з відомим або одержаним стиролом дає попередній олефін для реакції епоксидування Shi (Shi et al., Chem. Rev., 2008, 108, 3958-3987). Опосередкована основою циклізація приводить до одержання проміжної сполуки D з високим ступенем діастереоселективності. Проміжна сполука D1 (1R,5S,7aS)-5-[2-бром-5-(трифторметил)феніл]-1-[3-метил-5(трифторметил)феніл]тетрагідро-1H-піроло[1,2-c][1,3]оксазол-3-он Стадія 1. У 250-мілілітрову круглодонну колбу поміщали (R)-(+)-2-метил-2пропансульфінамід (3,16 г, 26,1 ммоль), 2-бром-5-трифторбензальдегід (6,0 г, 23,7 ммоль) і ТГФ (20 мл). Титаній(IV)етоксид (10,8 г, 47,4 ммоль) додавали по краплях за допомогою шприца, потім нагрівали реакційну суміш при температурі 40 °C протягом 1 години. Реакційну суміш охолоджували до кімнатної температури і додавали воду (100 мл) і етилацетат (100 мл). Органічний продукт перемішували з насиченим сольовим розчином протягом 15 хв. і фільтрували для видалення твердих речовин. Органічний продукт сушили над сульфатом 24 UA 114612 C2 5 10 15 20 25 30 35 40 45 50 55 60 натрію, фільтрували і концентрували, потім очищали за допомогою колонкової хроматографії, що давало N-{(E)-[2-бром-5-(трифторметил)феніл]метиліден}-2-метилпропан-2-сульфінамід (8,0 1 г, 22,5 ммоль) у вигляді безбарвного кристалічного твердого продукту. H-ЯМР (500 МГц, CDCl3): δ 7,72 (м, 2H), 7,44 (м, 3H), 6,06 (д, J=8,1 Гц, 1H), 5,33 (т, J=8 Гц, 1H), 4,57 (м, 1H), 2,99 (м, 1H), 2,48 (c, 3H), 1,68 (м, 1H), 1,59 (м, 1H), 1,38 (м, 1H). Стадія 2. У 100-мілілітрову тригорлу круглодонну колбу, оснащену мішалкою і зворотним холодильником, додавали Mg (надлишок), каталітичну кількість йоду, ТГФ (20 мл), потім 4бромбут-1-ен (4,55 г, 33,7 ммоль), з невеликими інтервалами. Суміш нагрівали при температурі 40 °C протягом 1 години. Реакційну суміш охолоджували до кімнатної температури і свіжоодержаний реактив Гриньяра додавали за допомогою шприца в 250-мілілітрову круглодонну колбу з N-{(E)-[2-бром-5-(трифторметил)феніл]метиліден}-2-метилпропан-2сульфінамідом (8,0 г, 22,5 ммоль) у ТГФ (100 мл). Після завершення реакції суміш гасили за допомогою насиченого водного розчину NH4Cl і екстрагували етилацетатом. Органічний продукт сушили над сульфатом натрію, фільтрували, концентрували й очищали за допомогою колонкової хроматографії, що давало N-{(1S)-1-[2-бром-5-(трифторметил)феніл]пент-4-ен-1-іл}1 2-метилпропан-2-сульфінамід (6,0 г, 14,6 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,72 (м, 2H), 7,42 (д, J=8,2 Гц, 1H), 5,87 (м, 1H), 5,13 (м, 2H), 5,02 (м, 1H), 2,24 (м, 1H), 2,18 (м, 1H), 2,08 (м, 1H), 1,98 (м, 1H), 1,27 (c, 9H). Стадія 3. До N-{(1S)-1-[2-бром-5-(трифторметил)феніл]пент-4-ен-1-іл}-2-метилпропан-2сульфінаміду (6,0 г, 14,6 ммоль) у метанолі (80 мол) додавали HCl (4н у діоксані, 25,5 мл, 102 ммоль). Реакційну суміш перемішували протягом ночі при кімнатній температурі, і розчинник видаляли у вакуумі. Одержане масло екстрагували етилацетатом і промивали 10 % водним розчином гідроксиду калію. Органічний продукт сушили над сульфатом натрію і концентрували. (1S)-1-[2-бром-5-(трифторметил)феніл]пент-4-ен-1-амін (4,4 г, 14,3 ммоль) використовували + далі без додаткового очищення. MS ESI обчислено для C12H14BrF3N [M+H] 308,0 і 310,0; знайдено 308,0 і 310,0. Стадія 4. До DIPEA (7,48 мл, 42,8 ммоль) і (1S)-1-[2-бром-5-(трифторметил)феніл]пент-4-ен1-аміну (4,4 г, 14,3 ммоль) у DCM (20 мл) додавали бензилхлорформіат при температурі 0 °C. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин і гасили за допомогою води. Органічний продукт промивали 10 % водним розчином KOH, і водний шар знову екстрагували етилацетатом. Об'єднані органічні продукти сушили над сульфатом натрію, фільтрували, концентрували і потім очищали за допомогою колонкової хроматографії, що давало бензил-{(1S)-1-[2-бром-5-(трифторметил)феніл]пент-4-ен-1-іл}карбамат (5,8 г, 13,1 1 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,72 (м, 1H), 7,58 (c, 1H), 7,39 (шир., 5H), 7,1 (м, 1H), 5,83 (м, 1H), 5,3 (шир., 1H), 5,15 (м, 3H), 2,22 (м, 1H), 2,18 (м, 1H), 1,95 (м, 1H), 1,78 (м, 1H). Стадія 5. У 100-мілілітрову круглодонну колбу, оснащену зворотним холодильником, додавали бензил-{(1S)-1-[2-бром-5-(трифторметил)феніл]пент-4-ен-1-іл}карбамат (0,5 г, 1,13 ммоль), 1-етеніл-3-метил-5-(трифторметил)бензол (421 мг, 2,26 ммоль) і дихлорметан (10 мл). Систему продували азотом, і додавали 1,3-біс(2,4,6-триметилфеніл)-4,5-дигідроімідазол-2іліден[2-(ізопропокси)-5-(N,N-диметиламіносульфоніл)феніл]метиленрутеній(II)дихлорид (41 мг, 0,57 ммоль) (Zhan каталізатор-1B), потім нагрівали при температурі 60 °C протягом 20 хв. Реакційну суміш охолоджували до кімнатної температури і прямо очищали за допомогою колонкової хроматографії, що давало бензил-{(1R, 4E)-1-[2-бром-5-(трифторметил)феніл]-5-[31 метил-5-(трифторметил)феніл]пент-4-ен-1-іл}карбамат (500 мг, 0,833 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,72 (м, 1H), 7,58 (c, 1H), 7,39 (шир., 5H), 6,4 (д, J=8,2 Гц, 1H), 6,25 (м, 1H), 5,35 (м, 1H), 5,20 (м, 1H), 5,10 (c, 2H), 2,40 (c, 3H), 2,19 (м, 1H), 2,05 (м, 1H), 1,95 (м, 1H), 1,78 (м, 1H). Стадія 6. У 250-мілілітрову круглодонну колбу поміщали тетрабутиламонію гідросульфат (28 мг, 0,083 ммоль), D-Epoxone (215 мг, 0,833 ммоль), бензил-{(1R, 4E)-1-[2-бром-5(трифторметил)феніл]-5-[3-метил-5-(трифторметил)феніл]-пент-4-ен-1-іл}карбамат (500 мг, 0,833 ммоль), потім MeCN (7 мл) і EtOAc (6 мл). У реакційну суміш при температурі 0 °C додавали декагідрат тетраборату натрію (318 мг, 0,833 ммоль) у водному розчині дигідрату динатрієвої солі етилендіамінтетраоцтової кислоти (0,4 мМ, 7 мл). У реакційну суміш при температурі 0 °C протягом двох годин одночасно додавали розчин карбонату калію (1,51 г, 8,33 ммоль) у воді (7 мл) і розчин OXONE® (1,54 г, 2,50 ммоль) у водному розчині дигідрату динатрієвої солі етилендіамінтетраоцтової кислоти (0,4 мМ, 7 мл). За допомогою шприцевого насоса протягом 1,5 години додавали додаткову кількість розчину D-Epoxone (107 мг, 0,417 ммоль) у MeCN (3 мл). Реакційну суміш розбавляли водою (100 мл) і екстрагували етилацетатом (2×100 мл). Органічний продукт концентрували й очищали за допомогою колонкової хроматографії, що давало бензил-[(1S)-1-[2-бром-5-(трифторметил)феніл]-3{(2R,3R)-3-[3-метил-5-(трифторметил)феніл]оксиран-2-іл}пропіл]карбамат (300 мг, 0,487 ммоль). 25 UA 114612 C2 1 5 10 15 H-ЯМР (500 МГц, CDCl3): δ 7,73 (м, 1H), 7,56 (c, 1H), 7,38-7,42 (шир., 5H), 5,47 (м, 1H), 5,21 (м, 1H), 5,12 (c, 2H), 3,67 (c, 1H), 3,02 (c, 1H), 2,42 (c, 3H), 2,10 (м, 1H), 1,99 (м, 2H), 1,76 (м, 1H). Стадія 7. До бензил-[(1S)-1-[2-бром-5-(трифторметил)феніл]-3-{(2R,3R)-3-[3-метил-5(трифторметил)феніл]оксиран-2-іл}пропіл]карбамату (100 мг, 0,162 ммоль) у ДМФ (2 мл) при температурі 0 °C додавали LiHMDS (1,0M, 0,324 мл, 0,324 ммоль). Суміш перемішували при кімнатній температурі протягом ночі, і розчинник видаляли при зниженому тиску. Одержаний залишок очищали за допомогою препаративної ТШХ, що давало (1R,5S,7aS)-5-[2-бром-5(трифторметил)феніл]-1-[3-метил-5-(трифторметил)феніл]тетрагідро-1H-піроло[1,21 c][1,3]оксазол-3-он (75 мг, 0,148 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,72 (м, 2H), 7,46 (c, 1H), 7,44 (д, J=8,8 Гц, 3H), 6,06 (д, J=8,1 Гц, 1H), 5,33 (т, J=8,0 Гц, 1H), 4,57 (м, 1H), 2,99 (м, 1H), 2,48 (c, 3H), 1,68 (м, 1H), 1,57 (м, 1H), 1,38 (м, 1H). Наступні проміжні сполуки, наведені в таблиці 2, одержували згідно зі схемою D з використанням методу, наведеного в описі синтезу проміжної сполуки D1, використовуючи комерційно доступні або відомі альдегіди на стадії 1. Крім LiHMDS, альтернативною основою, що може бути використана на стадії 7, є DBU. Таблиця 2 Пром. спол. D2 D3 D4 D5 + Структура Точна маса [M+H] або 1 H-ЯМР 1 (1R,5S,7aS)-5-[2-бром-5H-ЯМР (500 МГц, (трифторметил)феніл]-1-[3CDCl3): δ 7,75 (м, 2H), фтор-5-(трифторметил)феніл]- 7,46 (c, 1H), 7,44 (д, тетрагідро-1H-піроло[1,2J=8,8 Гц, 1H), 7,42 (м, c][1,3]оксазол-3-он 2H), 6,07 (д, J=8,1 Гц, 1H), 5,34 (т, J=8,0 Гц, 1H), 4,59 (м, 1H), 3,02 (м, 1H), 1,68 (м, 1H), 1,60 (м, 1H), 1,33 (м, 1H) 1 (1R,5S,7aS)-5-[2-бром-5H-ЯМР (500 МГц, (трифторметил)феніл]-1-[3CDCl3): δ 7,73 (м, 2H), (трифторметил)-феніл]7,71 (c, 2H), 7,43 (д, тетрагідро-1H-піроло[1,2J=8,1 Гц, 1H), 6,09 (д, c][1,3]оксазол-3-он J=8,1 Гц, 1H), 5,33 (т, J=8,0 Гц, 1H), 4,57 (м, 1H), 2,99 (м, 1H), 1,531,66 (шир., 2H), 1,38 (м, 1H) 1 (1R,5S,7aS)-5-[2-бром-5H-ЯМР (500 МГц, (трифторметил)феніл]-1-(3,5- CDCl3): δ 8,04 (c, 1H), дихлорфеніл)-тетрагідро-1H- 7,72 (м, 2H), 7,44 (м, піроло[1,2-c][1,3]оксазол-3-он 3H), 5,98 (д, J=8,1 Гц, 1H), 5,32 (т, J=8,0 Гц, 1H), 4,59 (м, 1H), 3,02 (м, 1H), 1,68 (м, 1H), 1,60 (м, 1H), 1,33 (м, 1H) 1 (1R,5S,7aS)-5-[2-бром-5H-ЯМР (500 МГц, (трифторметил)феніл]-1-[3CDCl3): δ 7,73 (м, 2H), хлор-5-(трифторметил)феніл]- 7,65 (c, 1H), 7,61 (c, тетрагідро-1H-піроло[1,21H), 7,58 (c, 1H), 7,42 c][1,3]оксазол-3-он (д, J=8,8 Гц, 1H), 6,06 (д, J=8,1 Гц, 1H), 5,34 (т, J=8,0 Гц, 1H), 4,59 (м, 1H), 3,02 (м, 1H), 1,68 (м, 1H), 1,60 (м, 1H), 1,33 (м, 1H) Назва по IUPAC 26 UA 114612 C2 5 10 15 20 25 30 35 40 45 50 Проміжна сполука D6 (1R,5S,8aS)-1-[3,5-біс(трифторметил)феніл]-5-[2-бром-5(трифторметил)феніл]гексагідро[1,3]оксазолo[3,4-a]піридин-3-он Стадія 1. У 100-мілілітрову тригорлу круглодонну колбу, оснащену мішалкою і зворотним холодильником, додавали Mg (надлишок), каталітичну кількість йоду, ТГФ (20 мл), потім з невеликими інтервалами додавали 5-бромпент-1-ен (1,93 г, 12,9 ммоль). Суміш нагрівали при температурі 40 °C протягом 1 години. Реакційну суміш охолоджували до кімнатної температури і свіжоодержаний реактив Гриньяра додавали за допомогою шприца в 250-мілілітрову круглодонну колбу з N-{(E)-[2-бром-5-(трифторметил)феніл]метиліден}-2-метилпропан-2сульфінамідом (2,3 г, 6,5 ммоль) у ТГФ (20 мл). Після завершення реакції реакційну суміш гасили за допомогою насиченого водного розчину NH 4Cl і екстрагували етилацетатом. Органічний продукт сушили над сульфатом натрію, фільтрували, концентрували й очищали за допомогою колонкової хроматографії, що давало N-{(1S)-1-[2-бром-51 (трифторметил)феніл]гекс-5-ен-1-іл}-2-метилпропан-2-сульфінамід (1,5 г, 3,5 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,71 (д, J=8,4 Гц, 1H), 7,63 (c, 1H), 7,41 (д, J=6,4 Гц, 1H), 5,77 (м, 1H), 5,03 (м, 2H), 4,87 (м, 1H), 3,65 (м, 1H), 2,11 (м, 2H), 1,86 (м, 1H), 1,82 (м, 1H), 1,55 (м, 1H), 1,40(м, 1H), 1,22 (c, 9H). Стадія 2. До N-{(1S)-1-[2-бром-5-(трифторметил)феніл]гекс-5-ен-1-іл}-2-метилпропан-2сульфінаміду (1,5 г, 3,5 ммоль) додавали HCl (4н у діоксані, 6,16 мл, 24,6 ммоль). Реакційну суміш перемішували протягом ночі при кімнатній температурі, і розчинник видаляли у вакуумі. Одержане масло екстрагували етилацетатом і промивали 10 % водним розчином гідроксиду калію. Органічний продукт сушили над сульфатом натрію і концентрували. (1S)-1-[2-бром-5(трифторметил)феніл]гекс-5-ен-1-амін (1,11 г, 3,45 ммоль) використовували далі без + додаткового очищення. MS ESI обчислено для C13H16BrF3N [M+H] 322,0 і 324,0; знайдено 322,2 і 324,2. Стадія 3. До DIPEA (1,81 мл, 10,3 ммоль) і (1S)-1-[2-бром-5-(трифторметил)феніл]гекс-5-ен1-аміну (1,11 г, 3,45 ммоль) у DCM (20 мл) додавали бензилхлорформіат при температурі 0 °C. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин і гасили за допомогою води. Органічний продукт промивали 10 % водним розчином KOH і водний шар знову екстрагували етилацетатом. Об'єднані органічні продукти сушили над сульфатом натрію, фільтрували, концентрували і потім очищали за допомогою колонкової хроматографії з одержанням бензил-{(1S)-1-[2-бром-5-(трифторметил)феніл]гекс-5-ен-1-іл}карбамату (1,5 г, 3,29 1 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,71 (м, 1H), 7,69 (c, 1H), 7,39-7,29 (шир., 6H), 5,81 (м, 1H), 5,28 (м, 1H), 5,14 (c, 2H), 5,08 (м, 2H), 2,16 (м, 2H), 1,84 (м, 1H), 1,68 (м, 1H), 1,59 (м, 1H), 1,51 (м, 1H). Стадія 4. У 100-мілілітрову круглодонну колбу, оснащену зворотним холодильником, додавали бензил-{(1S)-1-[2-бром-5-(трифторметил)феніл]гекс-5-ен-1-іл}карбамат (1,5 г, 3,29 ммоль), 1-етеніл-3,5-біс(трифторметил)бензол (1,58 г, 6,57 ммоль) і дихлорметан (10 мл). Систему продували азотом і додавали 1,3-біс(2,4,6-триметилфеніл)-4,5-дигідроімідазол-2іліден[2-(ізопропокси)-5-(N,N-диметиламіносульфоніл)феніл]метиленрутеній(II)дихлорид (41 мг, 0,57 ммоль), потім нагрівали при температурі 60 °C протягом 20 хв. Реакційну суміш охолоджували до кімнатної температури і прямо очищали за допомогою колонкової хроматографії, що давало бензил-{(1R,5E)-6-[3,5-біс(трифторметил)феніл]-1-[2-бром-51 (трифторметил)феніл]гекс-5-ен-1-іл}карбамат (2,0 г, 2,99 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,81 (c, 1H), 7,67 (д, J=8,3 Гц, 1H), 7,37 (д, J=8,1 Гц, 1H), 5,82 (м, 1H), 5,05 (м, 2H), 4,41 (м, 1H), 3,82 (c, 1H), 2,13 (м, 2H), 1,76 (м, 1H), 1,42 (м, 1H). Стадія 5. У 250-мілілітрову круглодонну колбу поміщали тетрабутилaмонію гідросульфат (97 мг, 0,284 ммоль), D-Epoxone (370 мг, 1,43 ммоль), бензил-{(1R,5E)-6-[3,5біс(трифторметил)феніл]-1-[2-бром-5-(трифторметил)феніл]гекс-5-ен-1-іл}карбамат (1,9 г, 2,84 ммоль), потім MeCN (15 мл) і EtOAc (20 мл). У реакційну суміш при температурі 0 °C додавали декагідрат тетраборату натрію (1,08 г, 2,84 ммоль) у водному розчині дигідрату динатрієвої солі етилендіамінтетраоцтової кислоти (0,4 мМ, 7 мл). Одночасно в реакційну суміш при температурі 0 °C протягом двох годин додавали розчин карбонату калію (3,93 г, 28,4 ммоль) у воді (25 мл) і 27 UA 114612 C2 5 10 15 20 25 розчин OXONE® (5,24 г, 8,53 ммоль) у водному розчині дигідрату динатрієвої солі етилендіамінтетраоцтової кислоти (0,4 мМ, 25 мл). За допомогою шприцевого насоса протягом 1,5 години додавали додаткову кількість розчину D-Epoxone (370 мг, 1,43 ммоль) у MeCN (3 мл). Реакційну суміш розбавляли водою (100 мл) і екстрагували етилацетатом (2×100 мл). Органічний продукт концентрували, що давало тверду речовину білого кольору, яку знову піддавали реакційній обробці. Бензил-{(1S)-4-{(2S,3S)-3-[3,5-біс(трифторметил)феніл]оксиран-2іл}-1-[2-бром-5-(трифторметил)феніл]бутил}-карбамат (1,5 г, 2,19 ммоль) виділяли за 1 допомогою колонкової хроматографії. H-ЯМР (500 МГц, CDCl3): δ 7,81 (c, 1H), 7,75 (c, 2H), 7,59 (c, 1H), 7,42 (м, 2H), 5,3 (м, 1H), 5,19 (м, 1H), 5,15 (c, 2H), 3,78 (м, 1H), 2,98 (м, 1H), 1,95 (м, 2H), 1,82-1,65 (ушир. с, 2H). Стадія 6. До бензил-{(1S)-4-{(2S,3S)-3-[3,5-біс(трифторметил)феніл]-оксиран-2-іл}-1-[2-бром5-(трифторметил)феніл]бутил}карбамату (500 мг, 0,731 ммоль) у ДМФ (2 мл) додавали DBU (111 мг, 0,731 ммоль). Систему нагрівали при температурі 125 °C протягом 6 годин. Розчинник видаляли у вакуумі. Реакційну суміш розбавляли етилацетатом і водою. Органічний продукт сушили над сульфатом натрію, фільтрували і концентрували. Одержане масло очищали за допомогою колонкової хроматографії, що давало (R)-[3,5-біс(трифторметил)-феніл]{(2S,6S)-61 [2-бром-5-(трифторметил)феніл]піперидин-2-іл}метанол (280 мг, 0,509 ммоль). H-ЯМР (500 МГц, CDCl3): δ 7,9 (c, 2H), 7,81 (д, J=5,4 Гц, 2H), 7,64 (д, J=8,3 Гц, 1H), 7,35 (д, J=8,3 Гц, 1H), 5,14 (д, J=8,2 Гц, 1H), 4,51 (м, 1H), 3,16 (м, 1H), 2,06 (м, 1H), 1,95 (м, 1H), 1,80 (м, 2H), 1,62 (м, 1H), 1,29 (м, 1H). Стадія 7. До (R)-[3,5-біс(трифторметил)феніл]{(2S,6S)-6-[2-бром-5(трифторметил)феніл]піперидин-2-іл}метанолу (280 мг, 0,509 ммоль) у DCM (5 мл) додавали DIPEA (0,9 мл, 0,509 ммоль) і фосген (252 мг, 0,509 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин, потім розчинник видаляли, і реакційну суміш розбавляли етилацетатом (15 мл) і водним розчином KOH (15 мл). Органічний продукт сушили над сульфатом натрію, фільтрували і концентрували, потім очищали за допомогою препаративної ТШХ, що давало (1R,5S,8aS)-5-[2-бром-5-(трифторметил)феніл]-1-[3-метил-5(трифторметил)феніл]гексагідро[1,3]оксазолo[3,4-a]піридин-3-он (200 мг, 0,347 ммоль). MS ESI + обчислено для C22H16BrF9NO2 [M+H] 576,0 і 578,0; знайдено 576,1 і 578,1. 30 Схема E 35 40 45 Одержання проміжної сполуки E здійснювали шляхом заміни відповідної функціональної проміжної сполуки B/D на комерційно доступний амін. Проміжна сполука E1 (1R,5S,7aS)-1-[3,5-біс(трифторметил)феніл]-5-[5-бром-2-(диметиламіно)піридин-4іл]тетрагідро-1H-піроло[1,2-c][1,3]оксазол-3-он До проміжної сполуки B4 (130 мг, 0,245 ммоль) у ТГФ (0,5 мл) додавали диметиламін (2,0M, 3,7 мл, 7,4 ммоль). Систему герметично закривали і нагрівали при температурі 150 °C шляхом впливу мікрохвильового випромінювання протягом 1 години. Реакційну суміш потім очищали прямо за допомогою РХВТ, що давало (1R,5S,7aS)-1-[3,5-біс(трифторметил)феніл]-5-[5-бром-2(диметиламіно)піридин-4-іл]тетрагідро-1H-піроло[1,2-c][1,3]оксазол-3-он (80 мг, 0,149 ммоль). + MS ESI обчислено для C21H19BrF6N3O2 [M+H] 538,0 і 540,0; знайдено 538,0 і 540,0. 28
ДивитисяДодаткова інформація
Автори англійськоюShao, Pengcheng Patrick, Ye, Feng, Vachal, Petr, Sha, Deyou, Katipally, Revathi Reddy, Liu, Jian, Sun, Wanying
Автори російськоюШао Пэнчен Патрик, Е Фин, Вачал Пэтр, Ша Дею, Катипалли Рэватхи Рэдди, Лю Цзянь, Сунь Ваньин
МПК / Мітки
МПК: A61K 31/4188, C07D 498/04
Мітки: конденсований, інгібітор, біциклічний, сетр, оксазолідинон
Код посилання
<a href="https://ua.patents.su/82-114612-kondensovanijj-biciklichnijj-oksazolidinon-yak-ingibitor-setr.html" target="_blank" rel="follow" title="База патентів України">Конденсований біциклічний оксазолідинон як інгібітор сетр</a>
Попередній патент: Пестицидні композиції і способи, що їх стосуються
Наступний патент: Пристрій для утворення аерозолю з регульованим повітряним потоком
Випадковий патент: Лікарська форма на основі кори осики












