Похідні 17-гідрокси-17-пентафторетил-естра-4,9(10)-дієн-11-арилу, спосіб їх одержання та їх застосування для лікування захворювань
Номер патенту: 106502
Опубліковано: 10.09.2014
Автори: Клар Ульріх, Ротгері Андреа, Мьоллер Карстен, ШВЕДЕ Вольфганг, Боне Вільгельм
Формула / Реферат
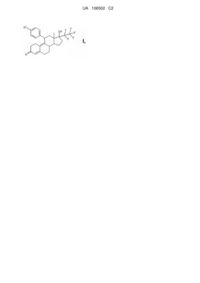
1. Сполука формули І
 , I
, I
в якій
R1 являє собою залишок Y або фенільне кільце, заміщене один або два рази залишком Y,
Y вибраний з групи, яка включає SR2, S(O)R3, S(O)2R3, S(O)(NH)R3, S(O)(NR4)R3, S(O)2NR9R10,
R2 являє собою водень, С1-С6-алкіл, С7-С10-арилалкіл або арил,
R3 являє собою С1-С6-алкіл або арил,
R4 являє собою групу S(O)2R6,
R6 являє собою феніл або 4-метилфеніл,
X означає атом кисню, NOR7 або NNHSO2R7,
R7 вибраний з групи, яка включає водень, С1-С10-алкіл, арил,
R9, R10 незалежно один від одного вибрані з групи, яка включає водень, С1-С10-алкіл або арил, або як альтернатива являють собою, разом з атомом азоту, 3-8-членне, насичене або ненасичене гетероциклічне кільце,
або її окремий стереоізомер, її сіль, сольват або сольват солі, включаючи всі кристалічні модифікації.
2. Сполука за п. 1, в якій
R1 являє собою залишок Y або фенільне кільце, заміщене один раз залишком Y,
Y вибраний з групи, яка включає SR2, S(O)R3, S(O)2R3, S(O)(NH)R3, S(O)(NR4)R3, S(O)2NR9R10,
R2 являє собою водень, С1-С6-алкіл або S-СН2-феніл,
R3 являє собою С1-С6-алкіл,
X являє собою атом кисню,
R6 являє собою феніл або 4-метилфеніл і
R9, R 10незалежно один від одного являють собою водень або С1-С6-алкіл, або феніл,
або її окремий стереоізомер, її сіль, сольват або сольват солі.
3. Сполука за п. 1, в якій R1 являє собою S(O)2R3 і X являє собою О.
4. Сполука за п. 3, в якій R3 являє собою С1-С6-алкіл.
5. Сполука за п. 4, в якій R3 являє собою метил.
6. Сполука за п. 1, в якій R1 являє собою S(O)(NH)R3 і X являє собою О,
або її окремий стереоізомер.
7. Сполука за п. 6, в якій R3 являє собою С1-С6-алкіл, або її окремий стереоізомер.
8. Сполука за п. 7, в якій R3 являє собою метил, або її окремий стереоізомер.
9. Сполука за п. 1, в якій R1 являє собою SOR3 і X являє собою О, або її окремий стереоізомер.
10. Сполука за п. 9, в якій R3 являє собою С1-С6-алкіл, або її окремий стереоізомер.
11. Сполука за п. 10, в якій R3 являє собою метил, або її окремий стереоізомер.
12. Сполука за п. 1, в якій R1 являє собою SR2 і X являє собою О.
13. Сполука за п. 12, в якій R2 являє собою водень.
14. Сполука за п. 12, в якій R2 являє собою С1-С6-алкіл.
15. Сполука за п. 14, в якій R2 являє собою метил.
16. Сполука за п. 12, в якій R2 являє собою арил.
17. Сполука за п. 16, в якій R2 являє собою феніл.
18. Сполука за п. 12, в якій R2 являє собою С7-С10-аралкіл.
19. Сполука за п. 18, в якій R2 являє собою бензил.
20. Сполука за п. 2, в якій R2 являє собою метил, етил або водень.
21. Сполука за п. 1, в якій R3 являє собою С1-С6-алкіл.
22. Сполука за п. 4, в якій R3 являє собою метил або етил.
23. Сполука за п. 1, в якій R5 являє собою феніл.
24. Сполука за п. 6, в якій n=1.
25. Сполука за п. 1, в якій X означає атом кисню.
26. Сполука за п. 1, в якій Y являє собою SR2 або S(O)2R3, або S(O)(NH)R3, де R2 означає водень, метил або етил і R3 означає метил або етил.
27. Сполука за п. 1, в якій Y являє собою S(O)2R3.
28. Сполука за п. 1, яку вибирають з групи, що включає
(11b,17b)-17-гідрокси-11-[4-(метилсульфаніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он;
(11b,17b)-11-[4-(етилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он; (11b,17b)-17-гідрокси-11-{4-[(RS)-метилсульфініл]феніл}-17-(пентафторетил)естра-4,9-дієн-3-он;
(11b,17b)-17-гідрокси-11-[4-(метилсульфоніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он;
(11b,17b)-11-[4-(етилсульфоніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он;
(11b,17b)-11-[4-(бензилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он;
N-[{4-[(11b,17b)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]фeнiл}(RS)(мeтил)оксидо-l6-сульфаніліден]-4-метилбензолсульфонамід;
(11b,17b)-17-гідрокси-11-[4-(RS-метилсульфонімідоїл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он;
(11b,17b)-17-гідрокси-11-[4'-(метилсульфаніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9-дієн-3-он;
(11b,17b)-17-гідрокси-11-[4'-(метилсульфоніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9-дієн-3-он;
N-[{4'-[(11b,17b)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]біфеніл-4-іл}(RS)(метил)оксидо-l6-сульфаніліден]-4-метилбензолсульфонамід;
(11b,17b)-17-гідрокси-11-[4'-(RS-метилсульфонімідоїл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9-дієн-3-он;
(11b,17b)-17-гідрокси-17-(пентафторетил)-11-(4'-сульфанілбіфеніл-4-іл)естра-4,9-дієн-3-он;
4'-[(11b,17b)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N,N-диметилбіфеніл-4-сульфонамід;
4-[(11b,17b)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N,N-диметилбензолсульфонамід.
29. Сполука за будь-яким з попередніх пунктів, для лікування і профілактики захворювань.
30. Сполука за будь-яким з пп. 1-28 для лікування і профілактики фібром матки, ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і станів, пов'язаних з менопаузою, або для регулювання народжуваності і екстреної контрацепції.
31. Застосування сполуки за будь-яким з пп. 1-28 для одержання лікарського засобу для лікування і/або профілактики захворювань.
32. Застосування сполуки за будь-яким з пп. 1-28 для одержання лікарського засобу для лікування і/або профілактики фібром матки, ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і станів, пов'язаних з менопаузою, або для регулювання народжуваності і екстреної контрацепції.
33. Лікарський засіб, який містить сполуку, як її визначено в будь-якому з пп. 1-28, в комбінації з іншою активною речовиною.
34. Лікарський засіб, який містить сполуку, як її визначено в будь-якому з пп. 1-28, в комбінації з інертним, нетоксичним, фармацевтично придатним наповнювачем.
35. Лікарський засіб за п. 33 або 34 для лікування і/або профілактики фібром матки, ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і станів, пов'язаних з менопаузою, або для регулювання народжуваності і екстреної контрацепції.
Текст
Реферат: Винахід стосується Формули І R похідних 1 OH F F F F X 17-гідрокси-17-пентафторетилестра-4,9(10)-дієн-11-арилу F (I) з прогестерон-антагонізуючою дією та способу їх одержання, їх застосування для лікування і/або профілактики захворювань та їх застосування для виготовлення лікарських засобів для лікування і/або профілактики захворювань, зокрема фібром матки (міоми, лейоміома матки), ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і станів, пов'язаних з менопаузою, або для регулювання народжуваності і екстреної контрацепції. UA 106502 C2 (12) UA 106502 C2 UA 106502 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід відноситься до похідних 17-гідрокси-17-пентафторетил-естра-4,9(10)-дієн-11-арилу Формули І з прогестерон-антагонізуючою дією і способу їх одержання, їх застосування для лікування і/або профілактики захворювань і їх застосування для виготовлення лікарських засобів для лікування і/або профілактики захворювань, зокрема фібром матки (міоми, лейоміома матки), ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і нездужань, пов'язаних з менопаузою, або для регулювання народжуваності і екстреної контрацепції. Ці сполуки є важливими фармацевтичними активними речовинами. Зокрема, їх можна використовувати для виготовлення фармацевтичних препаратів для лікування фібром матки або ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і нездужань, пов'язаних з менопаузою, або для регулювання народжуваності і екстренної контрацепції. Для лікування фібром матки і ендометріозу, сполуки відповідно до винаходу можна також призначати послідовно в комбінації з гестагенами. В такій схемі лікування сполуки відповідно до винаходу можна призначати протягом 1-6 місяців, з наступною перервою в лікуванні або наступним лікуванням гестагеном протягом 2-6 тижнів або наступним лікуванням пероральним контрацептивом (ПК-комбінації) протягом такого ж періоду. Ефективність сполук відповідно до винаходу як антагоністів прогестеронових рецепторів була продемонстрована in vitro в дослідженнях трансактивації і in vivo у щурів (переривання вагітності на ранньому терміні). Вперше сполуки з антагоністичною дією на прогестероновий рецептор (конкурентні антагоністи прогестеронових рецепторів) стали відомі в 1982 (RU 486; ЕР57115) і з тих пір багато з них були описані. Антагоністи прогестеронових рецепторів з фторованим 17α-бічним ланцюгом були опубліковані в WO 98/34947 і Fuhrmann et al., J. Med. Chem. 43, 5010-5016 (2000). Сполуки з фторованим 17α-бічним ланцюгом, описані в WO 98/34947, як правило мають дуже сильну антагоністичну активність по відношенню до прогестеронового рецептора. Сполуки є дуже сильнодіючими, і тому кращими в WO 98/34947 є 11β-(4-ацетилфеніл)-20,20,21,21,21 пентафтор-17-гідрокси-19-нор-17α-прегна-4,9-дієн-3-он, 11β-(4-ацетилфеніл)-20,20,21,21,21пентафтор-17-гідрокси-19-нор-17α-прегна-4-ен-3-он і 6'-ацетил-9,11β-дигідро-17β-гідрокси-17α(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естер-4-ен-3-он. Ці сполуки значною мірою трансформуються in vivo в різноманітні метаболіти, деякі з сильною, а інші зі зниженою фармакологічною активністю. Метаболізм відбувається в основному по 4-заміснику 11фенільного залишку. Сполуки, описані в WO 2008/058767, є щонайменше частково, метаболітами сполук, описаних в WO 98/34947. Завданням даного винаходу є забезпечити доступні сильнодіючі конкурентні антагоністи прогестеронових рецепторів і таким чином створити альтернативи для лікування гінекологічних захворювань. Було виявлено, що сполуки відповідно до винаходу є особливо підходящими для вирішення цього завдання. Зокрема, сполуки з алкілсульфанільними і алкілсульфонільними групами проявляють дуже високу антагоністичну активність відносно прогестеронового рецептора, тобто, вони інгібують дію прогестерону на його рецептор. Також було виявлено, що сполуки з алкілсульфонільними групами, у порівнянні з наприклад, з алканоїльними групами, мають набагато більш високу метаболічну, а також хімічну стабільність до температури, світла і окисного стресу. Наприклад, сполука (11β,17β)-17гідрокси-11-[4-(метилсульфоніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он (приклад 4) демонструє, у порівнянні з відповідним аналогом з алканоїльною або гідроксіалканоїльною групою (11β-(4-ацетилфеніл)-20,20,21,21,21-пентафтор-17-гідрокси-19-нор-17α-прегна-4,9-дієн3-он або 20,20,21,21,21-пентафтор-17-гідрокси-11β-[4-(гiдpoкciaцeтил)фeнiл]-19-нор-17β-прегна4,9-дієн-3-он), має несподівано високу стабільність при тепловому навантаженні, під впливом УФ- світла і несподівано низьку чутливість до окиснення. Сполуки з алкілсульфонімідоїльною групою в положенні 4 11-фенільного кільця мають, не дивлячись на іноді більш низьку активність in vitro, дуже сильну дію in vivo. Ці сполуки є, щонайменше частково, проліками відповідних сульфонів, і сполуки з алкілсульфонімідоїльними групами мають явно кращу розчинність у воді. Також є несподіваним, що обидві сполуки з алкілсульфонільною групою, і сполуки з алкілсульфонімідоїльними групами, особливо відповідні метильні сполуки, мають низький інгібуючий потенціал відносно досліджуваних CYPізоферментів CYP1A2, CYP2C8, CYP2C9, CYP2D6 і CYP3A4, і аж до максимальної концентрації, розчинної або використовуваної в аналізі (мінімум 10 мкМ, максимум 20 мкМ), не досягалось 50 % інгібування в будь-якому досліджуваному випадку. Ці in vitro одержані дані передбачають, для досліджуваних речовин, особливо низький ризик 1 UA 106502 C2 5 10 15 20 25 30 35 40 45 50 взаємодій з лікарськими засобами, які сумісно вводять, відносно CYP-інгібування. Крім того, для (11β,17β)-17-гідрокси-11-[4-(метилсульфоніл)феніл]-17(пентафторетил)естра-4,9-дієн-3-ону, особливо сприятливий профіль безпеки (в короткочасних і постійних дослідженнях) було виявлено в преклінічних дослідженнях на гризунах і негризунах. Даний винахід відноситься до похідних 17-гідрокси-17-пентафторетил-естра-4,9(10)-дієн-11арилу з загальною хімічною формулою І: в якій R1 являє собою залишок Υ або фенільне кільце, заміщене один або два рази залишком Υ, 2 3 3 3 4 3 Υ вибраний з групи, яка включає SR , S(O)R , S(O)2R , S(O)(NH)R , S(O)(NR )R , 9 10 S(O)2NR R , 2 R являє собою водень або С1-С6-алкіл або С7-С10-аралкіл або арил, 3 R являє собою С1-С6-алкіл або арил, 4 6 R являє собою групу S(O)2R , 6 R являє собою феніл або 4-метилфеніл 7 7 X являє собою атом кисню, NOR або NNHSO2R і 7 R вибраний з групи, яка включає водень, С1-С10-алкіл, арил 9 10 R , R незалежно один від одного вибрані з групи, яка включає водень, С 1-С10-алкіл або арил або як альтернатива являють собою, разом з атомом азоту, 3- -8-членне, насичене або ненасичене гетероциклічне кільце і їх солі, сольвати або сольвати солей, включаючи всі кристалічні модифікації. В залежності від їх структури, сполуки відповідно до винаходу загальної формули І можуть існувати в стереоізомерних формах (енантіомери, діастереомери). Тому винахід включає енантіомери або діастереомери і їх відповідні суміші, включаючи рацемати. Стереоізомерно однакові компоненти можна виділити відомим способом з вказаних сумішей енантіомерів і/або діастереомерів. Кожний з вказаних замісників на стероїдному скелеті може бути як в α-положенні, так і в βположенні. Крім того, замісники на стероїдному скелеті, який містить подвійний зв'язок і в якому подвійний зв'язок на кожному атомі має щонайменше один замісник, який не є воднем, можуть бути як Е-, так і Z-конфігурованими. Якщо сполуки відповідно до винаходу можуть існувати в таутомерних формах, даний винахід включає всі таутомерні форми. Фізіологічно безпечні солі сполук відповідно до винаходу є кращими як солі в рамках даного винаходу. Проте, солі, які не є самі по собі підходящими в фармацевтичних цілях, але можуть, наприклад, бути використані для виділення або очищення сполук відповідно до винаходу, також включені. Фізіологічно безпечні солі сполук відповідно до винаходу включають - коли вони мають основну функцію - солі з неорганічними або органічними кислотами, зокрема мінеральних кислот, карбонових кислот і сульфонових кислот, наприклад, солі хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, метансульфонової кислоти, етансульфонової кислоти, толуолсульфонової кислоти, бензолсульфонової кислоти, нафталіндисульфонової кислоти, оцтової кислоти, трифтороцтової кислоти, пропіоновой кислоти, молочної кислоти, винної кислоти, яблучної кислоти, лимонної кислоти, фумарової кислоти, малеїнової кислоти і бензойної кислоти. Фізіологічно безпечні солі сполук відповідно до винаходу включають - коли вони мають кислотну функцію - солі лужних металів, солі лужноземельних металів або амонієві солі, такі як ті, які можна одержати шляхом реакції з відповідними неорганічними або органічними основами. Μожна згадати, як приклад і ті, що є кращими, солі лужних металів (наприклад, натрієві і калієві солі), солі лужноземельних металів (наприклад, кальцієві і магнієві солі) і амонієві солі, що походять від аміаку або органічних амінів з 1-16 атомами вуглецю, таких як, наприклад і що є кращими, етиламін, діетиламін, триетиламін, етилдіізопропіламін, моноетаноламін, 2 UA 106502 C2 5 10 15 20 25 30 35 40 45 50 діетаноламін, триетаноламін,біцикло-гексиламін, диметиламіно-етанол, прокаїн, дибензиламін, N-метилморфолін, аргінін, лізин, етилендіамін, Ν-метилпіперидин, N-метилглукамін, Dметилглукамін, етилглукамін, 1,6-гексадіамін, глюкозамін, N-метилгліцин, 2-аміно-1,3пропандіол, трис-гідроксиметил-амінометан і 1-аміно-2,3,4-бутантриол. Ті форми сполук відповідно до винаходу, які демонструють, в твердому або рідкому стані, утворення едуктів з молекулами розчинника, називають сольватами в рамках винаходу. Розчинник може бути присутнім в стехіометричних або навіть нестехіометричних пропорціях. У випадку стехіометричних сольватів, їх також називают напів-, (семі-), моно-, секві-, ди-, три-, тетра-, пента-, і т.д. сольватами. Гідрати є особливою формою сольватів, де має місце координування з водою. Крім того, даний винахід також включає проліки сполук відповідно до винаходу. Термін "проліки" включає сполуки, які, коли вони присутні в організмі, перетворюються в сполуки відповідно до винаходу, наприклад за допомогою ферментативних або гідролітичних процесів. В рамках даного винаходу, якщо не вказано інакше, замісники мають наступні значення: Алкіл являє собою лінійні або розгалужені алкільні групи з 1-6 атомами вуглецю, наприклад метил, етил, пропіл, ізопропіл, н-бутил, сек-бутил, ізобутил, трет-бутил, н-пентил, ізопентил, неопентил, гексил, гептил, октил, ноніл і децил. Арил являє собою моно-трициклічний ароматичний, заміщений або незаміщений карбоциклічний залишок, наприклад феніл, нафтил, який може бути заміщеним один або декілька разів галогеном (F, СІ, Вr, І), ОН, О-алкілом, СО2Н, СО2-алкілом, NH2, NH(C1-С10алкілом), N(С1-С10-алкілом)2, зокрема N(CH3)2, NO2, N3, CN, C1-C10-алкілом, С1-С10-перфторалкілом, С1-С10-ацилом, С1-С10-ацилокси групами. Гетероарил являє собою ароматичний, моно- або біциклічний залишок з, як правило, 5-10, краще 5-6 атомами в кільці, і до 5, краще до 4 гетероатомів з серій S, О і N, наприклад і що є кращим, для бензофураніл, бензотіофеніл, хінолініл, фурил, імідазоліл, індазоліл, індоліл, ізохінолініл, оксазоліл, піридазиніл, піридил, піримідил, піроліл, тіазоліл, тієніл, піразоліл, ізоксазоліл, піразиніл, хіноліл або тетразоліл. Аралкіл являє собою аралкільні групи, які можуть містити до 14 атомів вуглецю, краще 6-10 атомів вуглецю в кільці, і 1-8, краще 1-4 атоми вуглецю в алкільному ланцюзі. Аралкільними залишками, які можуть бути розглянуті, є, наприклад, бензил, фенілетил, нафтилметил, нафтилетил, фурилметил, тієнілетил, піридилпропіл. Кільця можуть бути заміщені один або декілька разів галогеном, ОН, О-алкілом, СО2Н, СО2-алкілом, NH2, NH(С1-С10-алкілом), N(С1-С10алкілом)2, NO2, N3, CN, С1-С20-алкілом, С1-С10-перфторалкілом, С1-С20-ацилом, С1-С20-ацилокси групами. Коли залишки в сполуках відповідно до винаходу заміщені, якщо не вказано інакше, залишки можуть бути заміщені один або декілька раз. В рамках даного винаходу, для всіх залишків, які мають місце більше одного разу, їх значення є незалежними один від одного. Заміщення одним, двома або трьома ідентичними або різними замісниками є кращим. Заміщення одним замісником є особливо кращим. Кращими є сполуки формули (І), в якій 1 R являє собою залишок Υ або фенільне кільце, заміщене один раз залишком Υ, і 2 3 3 3 4 3 9 10 Υ вибраний з групи, яка включає SR , S(O)R , S(O)2R , S(O)(NH)R , S(O)(NR )R , S(O)2NR R 2 і R являє собою С1-С6-алкіл, водень або С7-С8-аралкіл, особливо краще водень, метил, етил або бензил, 3 R являє собою С1-С6-алкіл, краще метил або етил, 4 6 R являє собою групу S(O)2R і X являє собою кисень, 6 R являє собою феніл або 4-метилфеніл і 9 10 R , R незалежно один від одного являють собою водень або С1-С6-алкіл або феніл і їх солі, сольвати або сольвати солей. 3 UA 106502 C2 1 5 10 15 20 25 30 35 40 45 3 3 Особливо кращими є сполуки формули І, в яких R : S(O)2R , X: О і R : С1-С6-алкіл, зокрема 3 ті, в яких R означає метил. 1 3 3 Також особливо кращими є сполуки формули І, в яких R : S(O)(NH)R , X: О і R : С1-С6-алкіл, 3 1 зокрема ті, в яких R означає метил. Краще залишок R може бути як в R-, так і в S-конфігурації, і в будь-якому їх співвідношенні. Також кращими є наступні сполуки: (11β,17β)-17-Гідрокси-11 -[4-(метилсульфаніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он (Пр. 1) (11β,17β)-11 -[4-(Етилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он (Пр. 2) (11β,17β)-17-Гідрокси-11 - {4-[(RS)-метилсульфініл]феніл}-17-(пентафторетил)естра-4,9дієн-3-он (Пр. 3) (11β,17β)-17-Гідрокси-11 -[4-(метилсульфоніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он (Пр. 4) (11β,17β)-11-[4-(Етилсульфоніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он (Пр. 5) (11β,17β)-11-[4-(Бензилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он (Пр. 6) Ν-[{4-[(11β,17β))-17-Гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-116 iл]фeнiл}(RS)(мeтил)oкcидo-λ -cyльфaнiлiдeн]-4-мeтилбeнзoл сульфонамід (Пр. 7) (11β,17β)-17-Гідрокси-11-[4-(RS-метилсульфонімідоїл)феніл]-17-(пентафторетил)естра-4,9дієн-3-он (Пр. 8) (11β,17β)-17-Гідрокси-11-[4'-(метилсульфаніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9дієн-3-он (Пр. 9) (11β,17β)-17-Гідрокси-11-[4'-(метилсульфоніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9дієн-3-он (Пр. 10) Ν-[{4'-[(11β,17β)-17-Гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-iл]бiфeнiл-46 iл}(RS)(мeтил)oкcидo-λ -cyльфaнiлiдeн]-4-мeтилбeнзoл сульфонамід (Пр. 11) (11β,17β)-17-Гідрокси-11-[4'-(RS-метилсульфонімідоїл)біфеніл-4-іл]-17(пентафторетил)естра-4,9-дієн-3-он (Пр. 12) (11β,17β)-17-Гідрокси-17-(пентафторетил)-11-(4'-сульфанілбіфеніл-4-іл)естра-4,9-дієн-3-он (Пр. 13) 4'-[(11β,17β)-17-Гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N,Nдиметилбіфеніл-4-сульфонамід (Пр. 14) 4-[(11β,17β)-17-Гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N,N-диметилбензол сульфонамід (Пр. 15) Індивідуально вказані визначення залишків в відповідних комбінаціях або кращих комбінаціях залишків також замінені будь-якими визначеннями залишків деякої іншої комбінації незалежно від відповідних вказаних комбінацій залишків. Комбінації двох або більшої кількості вищевказаних кращих діапазонів є ще більш кращими. Було виявлено, що сполуки відповідно до винаходу і/або похідні демонструють гарну прогестерон-антагонізуючу дію. В декількох клінічних дослідженнях було виявлено, що лікування антагоністами прогестеронових рецепторів (міфепристон, асоприсніл, Проелекс) може призвести до значного зменшення фібром матки і значному скороченню симптомів, пов'язаних з вказаними фібромами матки. Крім того, клінічні дослідження показали, що під час лікування вказаними антагоністами прогестеронових рецепторів, симптоми, викликані ендометріозом (особливо болі) можуть також значно скоротитися. 4 UA 106502 C2 5 10 15 20 25 30 35 40 (В вищенаведеній формулі, А і В мають наступне значення: =О; -ОН/-Н або -ОН/-C2F5) Принцип одержання сполук загальної формули І показано в Схемі 1. Сполуки з загальною хімічною формулою І одержують, починаючи з (5'R,8'S,10'R,13'S,14'S,17'S)-5,5,13'-тpиметил-1',2',7',8',12',13',14',15',16',17'-декагідро-6'Нспіро[1,3-діоксан-2,3'-[5,10]епоксициклопента[а]фенантрен]-17'-олу (для виготовлення cм. Tetrahedron Lett. 26, 2069-2072 (1985) аналогічно способу, описаному в WO 98/34947 і в WO 2008 /058767. Πісля окиснення гідроксильної групи в положенні 17 стероїдного скелета, введення 17α-пентафторетильного бічного ланцюга в відповідні 17-кето сполуки проводять відповідно до способів, описаних в WO 98/34947 і в WO 2008/058767. Введення 11β-фенільних замісників проводять шляхом спряженого приєднання реагентів - арильних реактивів Гриньяра 8 або ариллітію при каталізі міддю. Одержують сполуки загальної формули II, де R може мати всі 1 значення, вказані для R і додатково може бути гідрокси, С1-С10-алкокси, бензилокси, С1-С10алканоїлокси, бензоїлокси, силілокси, алкоксіалкілокси групою СІ, Вr, І або групою C mFm+1SO3 з m=1-4 і А і/або В означає карбонільну групу або 17β-ΟΗ/17α-Η групу або 17β-OH/17α-C2F5 групу. Потім із сполук загальної формули II можна одержати сполуки загальної формули І. Для цього, функціональні групи необов'язково додатково модифікують. Можна згадати, зокрема, окиснення сульфідів до сульфоксидів або сульфонів за допомогою способів, відомих спеціалісту в даній галузі техніки, і утворення сульфоксімінів з сульфідів шляхом додавання Хлор амін-Т-Тригидрат® і наступного окиснення до відповідного захищеного сульфоксіміну, який потім виділяють, наприклад, шляхом кислотного розщеплення. Проте, альтернативно, також можна використовувати способи, відомі спеціалісту в даній галузі техніки, починаючи з відповідних сульфоксидів. Для сполук, в яких є біфенільний залишок в положенні 11β стероїдного скелета, це можна провести або безпосередньо шляхом спряженого приєднання реагентів - діарильних реактивів Гриньяра або діариллітію при каталізі міддю або, альтернативно, наприклад, за допомогою каталізованих паладієм реакцій сполучення відповідних функціоналізованих 11β-фенільних похідних, наприклад, з фенілтрифлатом або фенілнонафлатом як правило, спочатку можна вводити як 11β-фенільний залишок, так і 17βпентафторетильний бічний ланцюг. Функціональні групи, особливо 3-кето група, тим часом є необов'язково захищеними, наприклад, у вигляді кеталю. Як кетальну захисну групу, можна, наприклад, згадати етилендіокси або 2,2-диметилпропілен-1,2-діокси групу. Гідроксильні групи є, наприклад, захищеними у вигляді метоксиметилового, метоксіетилових, тетрагідропіранілових, бензилових, або силілових ефірів. Потім, на підходящій стадії, захисні групи відщепляють за допомогою способів, відомих спеціалісту в даній галузі техніки. Під час розщеплення 3-кетальної на 3-кето групу стероїдного скелета, необов'язково все ще присутнього 5α-гідроксильну групу видаляють, так що утворюються сполуки загальної формули 1. Якщо одержання вихідних сполук не описано в даній заявці, способи їх одержання є відомими спеціалісту в даній галузі техніки або їх можна одержати аналогічно відомим сполукам або способам, описаним в даній заявці. Суміші ізомерів можна розділити на окремі сполуки звичайними способами, наприклад, шляхом кристалізації, хроматографії або утворення солей. Одержання солей здійснюють звичайним способом, шляхом додавання еквівалентної 5 UA 106502 C2 5 10 15 20 25 30 35 40 45 50 55 60 кількості або надмірної кількості основи або кислоти, необов'язково в розчині, до розчину сполуки з загальною хімічною формулою І, з необов'язковим відокремленням осаду або обробки розчину звичайним способом. Одержані сполуки формули (І) необов'язково перетворюють, за допомогою відповідних (і) розчинників і/або (іі) основ або кислот в їх сольвати, солі і/або сольвати солей. Загальні визначення вищевказаних залишків або вказаних в кращих діапазонах застосовують як для кінцевих продуктів формули (І), так і відповідно для вихідних речовин або проміжних сполук, необхідних в кожному випадку для одержання. Сполуки відповідно до винаходу демонструють непередбачений, цінний фармакологічний, фармакокінетичний і фармакодинамічний профіль дії. Тому вони є підходящими для застосування як лікарських засобів для лікування і/або профілактики захворювань у людей і тварин. Фармацевтичну ефективність сполук відповідно до винаходу можна пояснити їх дією як антагоністів прогестеронових рецепторів, і таким чином їх антагонізуючою дією на прогестероновий рецептор. Іншим об'єктом даного винаходу є застосування сполук відповідно до винаходу для лікування і/або профілактики захворювань на основі гормонозалежних гіперпроліферативних процесів, краще гінекологічних захворювань, зокрема фібром матки, ендометріозу або гормонозалежного раку молочної залози. Іншим об'єктом даного винаходу є застосування сполук відповідно до винаходу для лікування і/або профілактики захворювань, зокрема вищевказаних захворювань. Інший об'єкт даного винаходу включає сполуки відповідно до винаходу для застосування в способі лікування і/або профілактики фібром матки, ендометріозу і гормонозалежного раку молочної залози. Іншим об'єктом даного винаходу є застосування сполук відповідно до винаходу для одержання лікарського засобу для лікування і/або профілактики захворювань, зокрема вищевказаних захворювань. Іншим об'єктом даного винаходу є спосіб лікування і/або профілактики захворювань, зокрема вищевказаних захворювань, з використанням 0.1-100 мг сполук відповідно до винаходу на добу на пацієнта при лікуванні фібром матки або ендометріозу і для контрацептивного використання або 0.1-500 мг сполук відповідно до винаходу на добу на пацієнта при захворюваннях, пов'язаних з новоутвореннями (наприклад, менінгіома або гормонозалежні новоутворення, наприклад, рак молочної залози) і для екстренної контрацепції. Інший об'єкт даного винаходу включає лікарські засоби, які містять щонайменше одну сполуку відповідно до винаходу і щонайменше одну або декілька інших активних речовин, зокрема для лікування і/або профілактики вищевказаних захворювань. Для лікування захворювань, пов'язаних з новоутвореннями, можна вводити або одночасно, або послідовно, наприклад, наступні активні речовини/класи активних речовин: СМЕР, СДЕРs, антиестрогени, інгібітори ароматази, інгібітори кінази, інгібітори ангиогенезу і/або цитостатики. Для лікування фібром матки або ендометріозу, сполуки відповідно до винаходу можна об'єднати одночасно або послідовно з гестагенами або комбінаціями естрогенів і гестагенів. Режими застосування антагоністів прогестеронових рецепторів/гестагену описані в WO 96/15794 (Spicer et al., Balance Pharm. Inc.), WO 96/03130 (Stöckemann et al., Schering AG) і РСТ/ЕР2009/003249 (Möller et al., Bayer Schering Pharma AG). Режими - необов'язково повторювані - де антагоніст прогестеронових рецепторів вводять протягом 2-4 місяців, з наступним введенням гестагену протягом 1-4 тижнів, є дуже підходящими для лікування фібром матки і ендометріозу. Введення антагоніста прогестеронових рецепторів протягом 84 днів, з наступним введенням гестагену протягом 14 днів - необов'язково повторювані - є особливо підходящим. Одночасне або послідовне введення сполук відповідно до винаходу, наприклад, з СМЕР, СДЕРs і естрогенами можна розглядати для лікування нездужань, пов'язаних з менопаузою. СМЕР (селективние модулятори естрогенових рецепторів) являють собою сполуки, які є тканеселективними і мають антиестрогенну або естрогенну дію, наприклад, в матці вони інгібують дію естрогену, але в кістках вони мають нейтральну або подібну естрогену дію. Прикладами є кломіфен, ралоксифен, тамоксифен, ториміфен, базедоксифен, ласофоксифен і ормелоксифен. Селективні дестабілизатори естрогенових рецепторів (СДЕР) являють собою фармацевтичні препарати, які повністю антагонізують естрогеновий рецептор ('чисті антиестрогени' без естрогенного активного компонента) і призводять до знижуючої регуляції рецептора (наприклад, фулвестрант, ZK-703 і ZK-253 (Hoffmann J et al., J Natl Cancer Inst 2004, 6 UA 106502 C2 5 10 15 20 25 30 35 40 45 50 55 60 96:210-218) і сполуки, описані в WO 98/007740, WO 99/33855 і WO 03/045972. Антиестрогенами є сполуки, які полностью антагонізують естрогеновий рецептор, наприклад фулвестрант. Інгібітори ароматази інгібують фермент ароматазу і тому ароматизацію андрогенів до естрогенів. Вони включають, поміж інших, анастрозол, летрозол, ексеместан, ворозол, форместанс і фадрозол. Інгібітори кінази являють собою ферменти, які переносять фосфатний залишок з АТР в інші субстрати, і зокрема в гідроксильні групи, такі як, наприклад, сорафеніб (Нексавар) або іматиніб (Глівек). Інгібітори ангиогенезу, наприклад, Авастин, зменшують або блокують постачання судин і тому і постачання крові в новоутворення. Цитостатики, наприклад, цисплатин, таксол, Таксотер, є натуральними або синтетическими речовинами, які інгібують(подавляють) ріст клітин або поділ клітин. Гестагени являють собою, в контексті даного винаходу, або натуральний прогестерон сам по собі, або синтетичні похідні, які подібно до прогестерону, зв'язуються з прогестероновим рецептором і, при дозуванні вище інгібуючої овуляцію дози, інгібують овуляцію. Як приклади синтетичних похідних, можна згадати дроспіренон, гестоден, левоноргестрел, ципротерон ацетат, десогестрел і 3-кетодесогестрел, норетистерон, норетистерон ацетат і дієногест. Комбінації гестагенів і естрогенів являють собою комбінації активних речовин, які містяться в пероральних контрацептивах, які є відомими per se, наприклад Ясмін, Фемован, Триквілар, Марвелон, ДЖАЗ і т.д. Сполуки відповідно до винаходу можуть діяти систематично і/або локально. З цією метою їх можна застосовувати підходящим способом, наприклад, пероральним, внутрішньоматковим, інтравагінальним, парентеральним, пульмональним, назальним, сублінгвальним, лінгвальним, букальним, ректальним, дермальним, трансдермальним, кон'юнктивальним, або вушним шляхом або у вигляді імплантанту або стенту. Внутрішньоматково означає, зокрема, застосування за допомогою ВМС (внутрішньоматкова система) або ВМК (внутрішньоматковий контрацептив). Інтравагінальне застосування можна здійснювати, поміж інших, за допомогою ІВК/ВКС (інтравагінальне кільце/вагінальна кільцева система). Форми для внутрішньоматкового або інтравагінального застосування (порівн. наприклад, WO 01/47490, особливо стор. 1, рядок 10 - рядок 5, рядок 13 і рядок 7, рядок 19 - рядок 58, рядок 6, або для вагінальних кілець: WO 06/010097, особливо стор. 10, рядок 22 - стор. 14, рядок 28) можуть містити сполуки відповідно до винаходу і несиліконові і/або силіконові полімери, зокрема, також еластомери на основі силоксану (порівн. WO 01/47490, особливо стор. 7, рядок 19 - стор. 15, рядок 15). Для цих шляхів введення, сполуки відповідно до винаходу можна вводити в придатних лікарських формах. Лікарські форми швидкого вивільнення і/або уповільненого вивільнення, що функціонують відповідно до попереднього рівня техніки, є придатними для перорального введення, які містять сполуки відповідно до винаходу в кристалічній і/або аморфній і/або розчиненій формі, наприклад, таблетки (таблетки, не вкриті оболонкою або таблетки, вкриті оболонкою, наприклад, з ентеросолюбільним покриттям або покриттям уповільненого розчинення або нерозчинним покриттям, які контролюють вивільнення сполук відповідно до винаходу), таблетки або плівки/пластинки, які швидко розпадаються в ротовій порожнині, плівки/ліофілізати, капсули (наприклад, тверді желатинові або м'які желатинові капсули), таблетки, вкриті оболонкою, гранули, пелети, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне застосування можна здійснювати при уникненні стадії абсорбції (наприклад, внутрішньовенно, внутрішньоартеріально, інтракардіально, інтраспінально або інтралюмбарно) або з включенням абсорбції (наприклад, внутрішньом'язово, підшкірно, інтрадермально, перкутанно або інтраперитонеально). Ін'єкційні і інфузійні препарати в формі розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків, поміж інших, є придатними як лікарські форми для парентерального введення. Для інших шляхів введення, придатними є, наприклад, інгаляциійні лікарські форми (включаючи порошкові інгалятори, розпилювачі), назальні краплі, розчини, і спреї; таблетки для лінгвального, сублінгвального або букального введення, плівки/пластинки або капсули, супозиторії, вушні або очні препарати, вагінальні капсули, водні суспензії (лосьйони, збовтувані суміші), ліпофільні суспензії, мазі, креми, трансдермальні терапевтичні системи (наприклад, пластирі), молочко, пасти, піни, присипки, імплантанти або стенти. Сполуки відповідно до винаходу можна перетворити в вищевказані лікарські форми. Це 7 UA 106502 C2 5 10 15 20 25 30 35 40 45 можна здійснити способом, відомим per se, шляхом змішування з інертними, нетоксичними, фармацевтично придатними наповнювачами. Ці наповнювачі включають, поміж інших, речовини-носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори і диспергуючі речовини або змочувальні агенти (наприклад, додецилсульфат натрію, поліоксисорбітанолеат), зв'язувальні агенти (наприклад, полівінілпіролідон), синтетичні і натуральні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, наприклад, аскорбінова кислота), барвники (наприклад, неорганічні пігменти, наприклад, оксиди заліза) і смакові добавки і/або ароматизатори. Інший об'єкт даного винаходу включає лікарські засоби, які містять щонайменше одну сполуку відповідно до винаходу, звичайно разом з одним або декількома інертними, нетоксичними, фармацевтично придатними наповнювачами, і їх застосування для вищевказаних цілей. Тим не менш, необов'язково може бути необхідно відхилитися від вказаних кількостей, а саме, в залежності від маси тіла, шляху введення, індивідуальної реакції на активну речовину, типу препарату і точки часу або інтервалу, коли здійснюється застосування. Таким чином, в деяких випадках може бути достатньо застосовувати менше, ніж вищевказана мінімальна кількість, тоді як в інших випадках вказана вища межа повинна бути перевищена. У випадку введення більшої кількості, можна порекомендувати розподілити її на декілька індивідуальних доз протягом дня. Процентні співвідношення в наступних дослідженнях і прикладах являють собою, якщо не вказано інакше, процентні співвідношення за масою; частини являють собою масові частини. Пропорції розчинників, співвідношення розведення і показники концентрації для рідин/рідких розчинів завжди відносяться до об'єму. Наступні приклади служать для того, щоб розкрити винахід, жодним чином не обмежуючи його. Приклад 1: (11 β, 17β)-17-гідрокси-11-[4-(метилсульфаніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он а) (5'R,8'S,10'R,13'S,14'S,17'S)-5,5,13'-триметил-17'-(пентафторетил)1',2',7',8',12',13',14',15',16',17'-декагідро-6'Н-спіро [1,3-діоксан-2,3'[5,10]епоксициклопента[а]фенантрен]-17'-ол 50 г (5'R,8'S,10'R,13'S,14'S)-5,5,13'-триметил-1',2',6',7',8',12',13',14',15',16'-декагідро-17'Нспіро [1,3-діоксан-2,3'-[5,10]епоксициклопента[а]фенантрен]-17'-он (для одержання див. Tetrahedron Lett. 26, 2069-2072 (1985) додавали до 116 г конденсованого пентафторйодетану в 500 мл абсолютного толуолу при -70 °C. 290 мл 1.5-молярного розчину комплексу метиллітійбромід літію в діетиловому ефірі додавали до суміші при такій самій температурі. Потім суміш перемішували протягом однієї години при 0 °C. Потім реакційну суміш додавали до насиченого водного розчину хлориду амонію і екстрагували етилацетатом. Органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували в вакуумі. Сирий продукт розчиняли в 200 мл ацетону і додавали 450 мл води. Осаджений продукт відфільтровували і сушили в вакуумі. Вихід 61.6 г 1 Н-ЯМР (400 МГц, CDCl3): δ= 6.04 brd (1H); 3.60 d (1H); 3.35-3.50 m (3H); 2.51 dbr (1H); 1.06 s (3H); 0.93 s (3H); 0.85 s (3H). b) (5R,8S,11R,13S,14S,17S)-5',5',13-триметил-11-[4-(метилсульфаніл)феніл]-17(пентафторетил)-1, 2,6,7,8,11,12,13,14,15,16,17-додекагідроспіро[циклопента[а]фенантрен-3,2'[1,3]діоксан]-5,17(4Н)-діол 8 UA 106502 C2 5 10 15 20 25 30 35 1.23 г стружки магнію суспендували в 5 мл ТГФ і додавали 50 мкл диброметану, при перемішуванні. Розчин 10.31 г 1-бром-4-(метилтіофеніл)бензол в 60 мл ТГФ додавали до суспензії таким чином, щоб температура реакції не піднімалась вище 55 °C. Потім суміш перемішували протягом додаткової години. Потім одержаний розчин охолоджували до 0 °C. Додавали 151 мг CuCl і суміш перемішували протягом додаткових 15 хвилин при 0 °C. Потім додавали розчин 5 г речовини, описаної в прикладі 1а) в 50 мл ТГФ. Потім реакційній суміші дозволяли досягти 23 °C протягом приблизно 3 годин, з перемішуванням, і потім її перемішували при цій температурі протягом додаткових 10 годин. Потім насичений водний розчин NH4Cl додавали до реакційної суміші, з зовнішнім охолодженням. Перемішування продовжували протягом 30 хвилин і потім суміш екстрагували декілька разів етилацетатом. Об'єднані органічні фази промивали насиченим розчином хлориду натрію і сушили над сульфатом натрію. Сирий продукт очищали за допомогою хроматографії на силікагелі з наступною кристалізацією з суміші дихлорметану і діізопропілового ефіру. В результаті одержували 5.72 г вказаної в заголовку сполуки. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.50 d (2H); 7.30 d (2H); 4.41 s (1H); 4.28 dbr (1H); 3.40-3.60 m (4H); 2.51 s (3H); 1.05 s (3H); 0.87 s (3H); 0.53 s (3H). c) (11β, 17β)-17-гідрокси-11 - [4-(метилсульфаніл)феніл]-17-(пентафторетил)естра-4,9-дієн3-он 500 мг сполуки, описаної в 1b) розчиняли в 15 мл метанолу. Додавали 360 мкл напівконцентрованої сірчаної кислоти і продовжували перемішування протягом 3 годин при 23 °C. Потім реакційну суміш виливали в насичений водний розчин гідрокарбонату натрію. Суміш екстрагували декілька разів етилацетатом. Об'єднані органічні фази промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували в вакуумі. Сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 297 мг вказаної в заголовку сполуки. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.20 d (2H); 7.13 d (2H); 5.80 sbr (1H); 4.45 dbr (1H); 2.51 s (3H); 0.68 s (3H). Приклад 2 (11β, 17β)-11-[4-(етилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он а) (5R,8S,11R,13S,14S,17S)-11-[4-(етилсульфаніл)феніл]-5',5',13-триметил-17(пентафторетил)-1,2,6,7,8,11,12,13,14,15,16,17-додекагідроспіро[циклопента[а]фенантрен-3,2'[1,3]діоксан]-5,17(4Н)-діол Як і в прикладі 1b), 2.7 г вказаної в заголовку сполуки одержували з 3 г сполуки, описаної в 9 UA 106502 C2 5 10 15 20 25 30 35 1а), 888 мг стружки магнію, 91 мг CuCl і 7.94 г 1-бром-4-(етилтіофеніл)бензолу в ТГФ. 1 Н-ЯМР (300 МГц, CDCI3): -7.50 d (2Н); 7.38 d (2Н); 4.43 s (1Н); 4.39 dbr (1H); 3.40-3.60 m (3H); 2.95 q (2H); 1.30 t (3H); 1.07 s (3H); 0.87 s (3H); 0.53 s (3H). b) (11β, 17β)-11 - [4-(етилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3он Як і в прикладі 1с), 125 мг вказаної в заголовку сполуки одержували з 200 мг сполуки, одержаної в 2а) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.21 d (2H); 7.08 d (2H); 5.78 sbr (1H); 4.43 dbr (1H); 2.93 q (2H); 1.29 t (3H); 0.60 s (3H). Приклад 3 (11 β, 17β)-17-Гідрокси-11 - {4-[(RS)-метилсульфініл]феніл} -17-(пентафторетил)естра-4,9дієн-3-он 180 мкл 30 % розчину пероксиду водню додавали до 0.5 мл трифтороцтової кислоти при 23 °C. Суміш перемішували протягом 30 хвилин і потім суміш додавали до суспензії, охолоджували до 10 °C, 533 мг сполуки, одержаної в прикладі 1с), в 1.8 мл трифтороцтової кислоти. Суміш перемішували протягом додаткових 2 годин при 10 °C. Потім реакційну суміш виливали в льодяну воду. Її перемішували протягом додаткових 2 годин і потім осаджений продукт відфільтровували. Одержаний сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 146 мг вказаної в заголовку сполуки і 123 мг сполуки, описаної в прикладі 4. 1 Н-ЯМР (400 МГц, CDCl3): δ= 7.58 d (2H); 7.38 d (2H); 5.80 sbr (1H); 4.50 dbr (1H); 2.71 s (3H); 0.58 s (3H) + 0.56 s (3H) (суміш діастереомерів). Приклад 4 (11β, 17β)-17-Гідрокси-11-[4-(метилсульфоніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он 5 г сполуки, описаної в прикладі 1b) розчиняли в суміші 140 мл ТГФ і 140 мл метанолу. Розчин 20 г Оксон® в 94 мл води додавали повільно по краплях при 0 °C. Потім суміш перемішували протягом додаткових 3.5 годин при 0 °C. Потім суміш води і дихлорметану додавали до реакційної суміші. Фази відокремлювали і водну фазу екстрагували декілька разів дихлорметаном. Об'єднані органічні фази промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували в вакуумі. Сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 3.8 г вказаної в заголовку сполуки. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.86 d (2H); 7.40 d (2H); 5.81 sbr (1H); 4.50 dbr (1H); 3.07 s(3H); 0.51 s (3H). Приклад 5 (11 β, 17β)-11 -[4-(етилсульфоніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он 10 UA 106502 C2 5 10 15 20 25 Як і в прикладі 4), після очищення за допомогою хроматографії на силікагелі, 183 мг вказаної в заголовку сполуки одержували шляхом реакції 400 мг сполуки, описаної в прикладі 2а) з 1.56 г Оксон® в суміші 10 мл ТГФ і 10 мл метанолу. 1 Н-ЯМР (400 МГц, CDCl3): δ= 7.82 d (2H); 7.40 d (2H); 5.80 sbr (1H); 4.52 dbr (1H); 3.13 q(2H); 1.28 t (3H); 0.51 s (3H). Приклад 6 (11β, 17β)-11 -[4-(бензилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3он а) (5R, 8S,11R,13S,14S,17S)-11-[4-(бензилсульфаніл)феніл]-5',5',13-триметил-17(пентафторетил)-1,2,6,7,8,11,12,13,14,15,16,17-додекагідроспіро[циклопента[а]фенантрен-3,2'[1,3]діоксан]-5,17(4Н)-діол Як і в прикладі 1b), 6.65 г вказаної в заголовку сполуки одержували з 8.5 г сполуки, описаної в 1а), 2.64 г стружки магнію, 171 мг CuCl і 30.36 г 1-бензилсульфаніл-4-бромбензолу в ТГФ. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.13-7.30 m (7H); 7.10 d (2H); 4.44 s (1H); 4.27 dbr (1H); 4.05 s (2H); 3.40-3.60 m (4H); 1.05 s (3H); 0.87 s (3H); 0.51 s (3H). b) (11β, 17β)-11 - [4-(бензилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн3-он Як і в прикладі 1с), 1.02 г вказаної в заголовку сполуки одержували з 1.62 г сполуки, описаної в прикладі 6а) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.15-7.40 m (7H); 7.06 d (2H); 5.78 sbr (1H); 4.40 dbr (1H); 4.08 s (2H); 0.59 s (3H). Приклад 7 N-[{4-[(11β, 17β)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-116 іл]феніл}(RS)(метил) оксидо- -сульфаніліден]-4-метилбензол сульфонамід 11 UA 106502 C2 а) N-[{4-[(5R,8S,11R,13S,14S,17S)-5,17-Дигідрокси-5',5',13-триметил-17-(пентафторетил)1,2,4,5,6,7,8,11,12,13,14,15,16,17-тетрадекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]4 11-іл]феніл}(RS)(метил)- -сульфаніліден]-4-метилбензол сульфонамід 5 10 15 20 25 3 г речовини, описаної в прикладі 1b) суспендували в 80 мл ацетонітрилу. Додавали 1.64 г Хлорамін-Т-Тригідрат® і продовжували перемішування протягом 20 годин при 23 °C. Потім реакційну суміш розводили 70 мл дихлорметану. Після відфільтровування осадженого хлориду натрію, суміш концентрували в вакуумі. Сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 3.16 г вказаної в заголовку сполуки. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.74 d (2H); 7.49 d (2H); 7.38 d (2H); 7.18 d (2H); 4.40 s (1H); 4.33 dbr (1H); 3.40-3.70 m (4H); 2.80 (3H); 2.37 s (3H), 1.05 s (3H); 0.89 s (3H); 0.45 s (3H) (суміш діастереомерів). b) N-[{4-[(5R,8S,11R,13S,14S,17S)-5,17-дигідрокси-5',5',13-триметил-17-(пентафторетил)1,2,4,5,6,7,8,11,12,13,14,15,16,17-тетрадекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]6 11-іл]феніл}(RS)(метил) оксидо -сульфаніліден]-4-метилбензол сульфонамід 3.16 г сполуки, одержаної в 7а) розчиняли в 2.5 мл ацетонітрилу і 1.6 мл метанолу. Додавали 1.22 г карбонату натрію і 2.34 мл розчину 30 % пероксиду водню. Потім суміш перемішували протягом 2.5 годин при 23 °C. Потім реакційну суміш виливали в воду. Її екстрагували декілька разів дихлорметаном. Об'єднані органічні фаз и промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували в вакуумі. Сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 2.56 г вказаної в заголовку сполуки. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.78-8.00 m (4H); 7.51 d (2H); 7.31 d (2H); 4.50 s (1H); 4.44 dbr (1H); 3.45-3.67 m (7H); 2.46 s (3H); 1.09 s (3H); 0.91 s (3H); 0.51 s (3H) (суміш діастереомерів). с) Ν-[{4-[(11, 17)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-116 іл]феніл}(RS)(метил) оксидо -сульфаніліден]-4-метилбензол сульфонамід 12 UA 106502 C2 5 10 15 20 25 Як і в прикладі 1с), 2.2 г вказаної в заголовку сполуки одержували з 2.72 г сполуки, одержаної в 7b) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.95 d (2H); 7.86 d (2H); 7.45 d (2H); 7.28 d (2H); 5.81sbr (1H); 4.51 dbr (1H); 3.41 s (3H); 2.40 s (3H); 0.51 s (3H) (суміш діастереомерів). Приклад 8 (11β, 17β)-17-Гідрокси-11-[4-(RS-метилсульфонімідоїл)феніл]-17-(пентафторетил)естра-4,9дієн-3-он 500 мг сполуки, одержаної в прикладі 7с) розчиняли в 10 мл хлороформу. 1.15 мл концентрованої сірчаної кислоти додавали при 0 °C і перемішували протягом 7 годин при 0 °C. Потім реакційну суміш виливали в насичений водний розчин гідрокарбонату натрію. Потім її робили основною шляхом додавання 5 % NaOH. Суміш екстрагували декілька разів дихлорметаном. Об'єднані органічні фази промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували в вакуумі. Сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 306 мг вказаної в заголовку сполуки. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.91 d (2H); 7.39 d (2H); 5.81 sbr (1H); 4.50 dbr (1H); 3.12 s (3H) + 3.10 s (3H); 0.56 s (3H) + 0.40 s (3H) (суміш діастереомерів). Приклад 9 (11 β, 17β)-17-Гідрокси-11 - [4'-(метилсульфаніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9дієн-3-он а) (5R,8S,11R,13S,14S,17S)-11-[4-(бензилокси)феніл]-5',5'13-триметил-17-(пентафторетил)1,2,6,7,8,11,12,13,14,15,16,17-додекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]5,17(4Н)-діол 13 UA 106502 C2 5 10 15 20 25 30 35 40 2.47 г стружки магнію суспендували в 5 мл ТГФ і додавали 50 мкл диброметану, при перемішуванні. Розчин 26.7 г 1-бром-4-(фенілметокси)бензолу в 115 мл ТГФ повільно додавали до суспензії при 65 °C. Одержаний розчин охолоджували до 0 °C. До нього додавали 301 мг CuCl. Потім перемішували протягом 10 хвилин при 0 °C і потім повільно додавали розчин 10 г речовини, описаної в прикладі 1а) в 70 мл ТГФ. Реакційній суміші дозволяли нагрітися до 23 °C при перемішуванні протягом приблизно 3 годин і потім її перемішували при такій самій температурі протягом додаткових 10 годин. Потім насичений водний розчин NH 4Cl додавали до реакційної суміші, з зовнішнім охолодженням. Суміш перемішували протягом додаткових 30 хвилин і потім екстрагували декілька разів етилацетатом. Об'єднані органічні фази промивали насиченим розчином хлориду натрію і сушили над сульфатом натрію. Сирий продукт очищали за допомогою хроматографії на силікагелі з наступною кристалізацією з суміші дихлорметану і діізопропілового ефіру. В результаті одержували 9.7 г вказаної в заголовку сполуки. 1 Н-ЯМР (400 МГц, CDCl3): δ= 7.30-7.50 m (5H); 7.12 d (2H); 6.88 d (2H); 5.02 s (2H); 4.43 s (1H); 4.28 dbr (1H); 3.50-3.60 m (3Н); 3.42 d (1H); 1.06 s (3H); 0.87 s (3H); 0.56 s (3H). b) (5R,8S,11R,13S,14S,17S)-11-[4-(бензилокси)феніл]-5',5',13-триметил-17-(пентафторетил)1, 2,6,7,8,11,12,13,14,15,16,17-додекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]5,17(4Н)-діол 5.53 г форміату амонію і 972 мг паладію на активованому деревному вугіллі (10 %) додавали до розчину 9.72 г сполуки, описаної в 9а) в 100 мл метанолу. Суміш перемішували протягом 2 годин при 23 °C і потім фільтрували на Целіт®. Фільтрат концентрували в вакуумі. В результаті одержували 8.5 г сирого продукту, який використовували на наступній стадії без очищення. 1 Н-ЯМР (300 МГц, CDCl3): δ- 7.05 d (2H); 6.70 d (2H); 4.43 sbr (1H); 4.27 dbr (1H); 3.50-3.58 m (3H); 3.41 sbr (1H); 1.94 s (3H); 0.86 s (3H); 0.54 s (3H). c) 4-[(5R,8S,11R,13S,14S,17S)-5,17-Дигідрокси-5',5',13-триметил-17-(пентафторетил)1,2,4,5,6,7,8,11,12,13,14,15,16,17-тетрадекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]11-іл]феніл-1,1,2,2,3,3,4,4,4-нонафторбутан-1 -сульфонат 14.64 мл 1.6-молярного розчину н-бутиллітію в гексані додавали при 0 °C до розчину 9.16 г сполуки, описаної в 9Ь) в 100 мл абсолютного ТГФ. Суміш перемішували протягом 30 хвилин при 0 °C і потім повільно додавали 5.62 мл перфторбутан-1-сульфонілфлориду. Потім суміш перемішували протягом додаткової 1.5 години при 0 °C. Потім реакційну суміш виливали в суміш 300 мл насиченого розчину гідрокарбонату натрію і 90 мл 2н. розчину гідроксиду натрію. Суміш перемішували протягом 45 хвилин і потім екстрагували декілька разів етилацетатом. Об'єднані органічні фази промивали насиченим розчином хлориду натрію і сушили над сульфатом натрію. Одержаний сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 10.1 г вказаної в заголовку сполуки. 1 Н-ЯМР (400 МГц, CDCl3): δ= 7.28 d (2H); 7.18 d (2H); 4.42 s (1H); 4.34 dbr (1H); 3.50-3.58 m (3H); 3.42 d (1H); 1.05 s (3H); 0.86 s (3H); 0.50 s (3H). d) (5R,8S,11R,13S,14S,17S)-5',5',13-триметил-11-[4'-(метилсульфаніл)біфеніл-4-іл]-17 14 UA 106502 C2 (пентафторетил)-1,2,6,7,8,11,12,13,14,15,16,17-додекагідроспіро[циклопента[а]фенантрен-3,2'[1,3]діоксан]-5,17(4Н)-діол 5 10 15 20 25 30 2 мл 2-молярного водного розчину карбонату натрію, 131 мг хлориду літію, 240 мг 4(метилтіо)фенілборонової кислоти і 192 мг тетракис(трифенілфосфін)паладію додавали до розчину 1.2 г сполуки, описаної в 9с) в суміші 12 мл толуолу і 6 мл етанолу. Потім суміш нагрівали зі зворотним холодильником протягом 2 годин. Потім суміш етилацетату і води додавали до реакційної суміші. Її екстрагували декілька разів етилацетатом. Об'єднані органічні фази промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували в вакуумі. Сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 927 мг вказаної в заголовку сполуки. 1 Н-ЯМР (300 МГц, CDCI3): δ= 7.45-7.55 m (4Н); 7.30 d (2Н); 7.27 d (2Н); 4.45 s (1H); 4.35 dbr (1H); 3.40-3.60 m (4H); 2.50 s (3H); 1.07 s (3H); 0.97 s (3H); 0.58 s (3H). e) (11β, 17β)-17-гідрокси-11-[4'-(метилсульфаніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9дієн-3-он Як і в прикладі 1с), 82 мг вказаної в заголовку сполуки одержували з 120 мг сполуки, одержаної в 9d) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (400 МГц, CDCl3): δ= 7.45-7.58 m (4H); 7.30 d (2H); 7.24 d (2H); 5.80 sbr (1H); 4.50 dbr (1H); 2.50 s (3H); 0.62 s (3H). Приклад 10 (11β, 17β)-17-гідрокси-11-[4'-(метилсульфоніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9дієн-3-он а) (5R,8S,11R,13S,14S,17S)-5',5',13-триметил-11-[4'-(метилсульфоніл)біфеніл-4-іл]-17(пентафторетил)-1,2,6,7,8,11,12,13,14,15,16,17-додекагідроспіро[циклопента[а]фенантрен-3,2'[1,3]діоксан]-5,17(4Н)-діол Як і в прикладі 9d), 256 мг вказаної в заголовку сполуки одержували з 500 мг сполуки, описаної в прикладі 9с) і (4-метилсульфонілфеніл)боронової кислоти в присутності тетракис(трифенілфосфін)паладію, хлориду літію, 2-молярного водного розчину карбонату натрію в суміші толуолу і етанолу. 1 Н-ЯМР (300 МГц, CDCl3): δ= 8.03 d (2H); 7.80 d (2H); 7.58 d (2H); 7.39 d (2H); 4.48s (1H); 4.45 15 UA 106502 C2 dbr (1H); 3.45-3.65 m (4H); 3.12 s (3H); 1.10 s (3H); 0.91 s (3H); 0.62 s (3H). b) (11β, 17β)-17-гідрокси-11-[4'-(метилсульфоніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9дієн-3-он 5 10 15 20 25 Як і в прикладі 1с), 62 мг вказаної в заголовку сполуки одержували з 110 мг сполуки, одержаної в 10а) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (400 МГц, CDCl3): δ= 8.00 d (2H); 7.75 d (2H); 7.55 d (2H); 7.30 d (2H); 5.80 sbr (1H); 4.50 dbr (1H); 3.09 s (3H); 0.65 s (3H). Приклад 11 N-[{4'-[(11β, 17β)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]біфеніл-4-іл} 6 (RS)(метил)оксидо -сульфаніліден] -4-метилбензол сульфонамід а) N[{4'-[(5R,8S,11R,13S,14S,17S)-5,17-дигідрокси-5',5',13-триметил-17-(пентафторетил)1,2,4,5,6,7,8,11,12,13,14,15,16,17-тетрадекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]4 11-іл]біфеніл-4-іл}(RS)(метил)-λ -cyльфaнiлiдeн]-4-мeтилбeнзoл сульфонамід Як і в прикладі 7а), 715 мг вказаної в заголовку сполуки одержували з 800 мг сполуки, одержаної в прикладі 9d) з Хлорамін-Т-Тригідрат® в ацетонітрилі. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.65-7.80 (6Н); 7.47 d (2H); 7.30 d (2H); 7.18 d (2H); 4.45 s (1Н); 4.39 dbr (1H); 3.40-3.60 m (4H); 2.87 (3H); 2.35 s (3H), 1.03 s (3H); 0.87 s (3H); 0.56 s (3H) (суміш діастереомерів). b) N-[{4'-[(5R,8S,11R,13S,14S,17S)-5,17-дигідрокси-5',5',13-триметил-17-(пентафторетил)1,2,4,5,6,7,8,11,12,13,14,15,16,17-тетрадекагідроспіро [циклопента[а] фенантрен-3,2'- [1,3] 6 діоксан] -11 -іл] біфеніл-4-іл}(RS)(метил)оксидо -сульфаніліден]-4-метилбензол сульфонамід Як і в прикладі 7b), 638 мг вказаної в заголовку сполуки одержували з 709 мг сполуки, 16 UA 106502 C2 5 10 15 20 25 одержаної в прикладі 11а) шляхом реакції з 30 % розчином пероксиду водню і карбонату натрію в суміші ацетонітрилу і метанолу. 1 Н-ЯМР (300 МГц, CDCl3): δ= 8.04 d (2H); 7.87 d (2H); 7.78 d (2H); 7.50 d (2H); 7.35 d (2H); 7.27 d (2H); 4.46 s (1H); 4.40 dbr (1H); 3.40-3.60 m (4H); 3.46 s (3H); 2.39 s (3H); 1.07 s (3H); 0.87 s (3H); 0.56 s (3H) (суміш діастереомерів). с) Ν-[{4'-[(11, 17)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-iл]бiфeнiл-46 iл}(RS)(мeтил)-oкcидo-λ -cyльфaнiлiдeн]-4-мeтилбeнзoл сульфонамід Як і в прикладі 1с), 523 мг вказаної в заголовку сполуки одержували з 633 мг сполуки, одержаної в 11b) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (300 МГц, CDCl3): δ= 8.06 d (2H); 7.87 d (2H); 7.78 d (2H); 7.52 d (2H); 7.20-7.35 m (4H); 5.80 sbr (1H); 4.51 dbr (1H); 3.45 s (3H); 2.39 s (3H); 0.62 s (3H) (суміш діастереомерів). Приклад 12 (11β, 17β)-17-гідрокси-11-[4'-(RS-метилсульфонімідоїл)біфеніл-4-іл]-17(пентафторетил)естра-4,9-дієн-3-он Як і в прикладі 8, 325 мг вказаної в заголовку сполуки одержували з 500 мг сполуки, одержаної в прикладі 11с) шляхом реакції з концентрованою сірчаною кислотою в хлороформі. 1 Н-ЯМР (300 МГц, CDCl3): δ= 8.07 d (2H); 7.74 d (2H); 7.55 d (2H); 7.30 d (2H); 5.80 sbr (1H); 4.51 dbr (1H); 3.15 s (3H); 0.64 s (3H) (суміш діастереомерів). Приклад 13 (11β, 17β)-17-гідрокси-17-(пентафторетил)-11 -(4'-сульфанілбіфеніл-4-іл)естра-4,9-дієн-3-он а) (5R,8S,11R,13S,14S,17S)-5',5',13-триметил-17-(пентафторетил)-11-(4'-сульфанілбіфеніл4-іл)-1,2,6,7,8,11,12,13,14,15,16,17-додекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]5,17(4Н)-діол 17 UA 106502 C2 5 10 15 20 25 Як і в прикладі 9d), 478 мг вказаної в заголовку сполуки одержували з 1 г сполуки, описаної в прикладі 9с) і (4-меркаптофеніл)боронової кислоти в присутності тетракис(трифенілфосфін)паладію, хлориду літію, 2-молярного водного розчину карбонату натрію в суміші толуолу і етанолу. 1 Н-ЯМР (400 МГц, CDCl3): δ= 7.14-7.32 m (8H); 4.42 s (1H); 4.30 dbr (1H); 3.40-3.60 m (4H); 1.05 s (3H); 0.88 s (3H); 0.54 s (3H). b) (11, 17)-17-гідрокси-17-(пентафторетил)-11-(4'-сульфанілбіфеніл-4-іл)естра-4,9-дієн-3он Як і в прикладі 1с), 103 мг вказаної в заголовку сполуки одержували з 200 мг сполуки, одержаної в 13 а) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (400 МГц, CDCl3): δ= 7.20-7.38 m (6H); 7.1 Id (2H); 5.78 sbr (1H); 4.42 dbr (1H);0.61 s(3H). Приклад 14 4'-[(11β, 17β)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N, Nдиметилбіфеніл-4-сульфонамід а) 4'-[(5R,8S,11R,13S,14S,17S)-5,17-дигідрокси-5',5',13-триметил-17-(пентафторетил)1,2,4,5,6,7,8,11,12,13,14,15,16,17-тетрадекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]11-іл]-N, N-диметилбіфеніл-4-сульфонамід Як і в прикладі 9d), 235 мг вказаної в заголовку сполуки одержували з 300 мг сполуки, описаної в прикладі 9с), і [4-[(диметиламіно)сульфоніл]феніл]боронової кислоти в присутності тетракис(трифенілфосфін)паладію, хлориду літію, 2-молярного водного розчину карбонату натрію в суміші толуолу і етанолу. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.83 d (2H); 7.73 d (2H); 7.52 d (2H); 7.33 d (2H); 4.47 s (1H); 4.39 dbr (1H); 3.40-3.60 m (4H); 2.75 s (6H); 1.06 s (3H); 0.88 s (3H); 0.57 s (3H). b) 4'-[(11, 17)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-Ν,Νдиметилбіфеніл-4-сульфонамід 30 18 UA 106502 C2 5 10 15 20 25 30 35 40 Як і в прикладі 1с), 113 мг вказаної в заголовку сполуки одержували з 230 мг сполуки, одержаної в 14а) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (400 МГц, CDCI3): δ= 7.83 d (2H); 7.72 d (2H); 7.55 d (2H); 7.30 d (2H); 5.80 sbr (1H); 4.52 dbr (1H); 2.75 s (6H); 0.64 s (3H). Приклад 15 4-[(11β, 17β)-17-Гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N, N-диметилбензол сульфонамід а) 4-[(5R,8S,11R,13S,14S,17S)-5,17-Дигідрокси-5',5',13-триметил-17-(пентафторетил)1,2,4,5,6,7,8,11,12,13,14,15,16,17-тетрадекагідроспіро[циклопента[а]фенантрен-3,2'-[1,3]діоксан]11-іл]-N, N-диметилбензол сульфонамід 5.1 мл 2-молярного розчину хлориду діізопропілмагнію в діетиловому ефірі розводили 10 мл ТГФ, з охолодженням (-10 °C). Потім додавали по краплях 8.12 мл 2.5-молярного розчину нбутиллітію в гексані при -10 °C протягом 30 хвилин. Суміш перемішували протягом додаткових 2 годин і потім додавали 15.1 мг CuCl. після перемішування протягом додаткових 5 хвилин, додавали розчин 500 мг речовини, описаної в прикладі 1а) в 5 мл ТГФ. Суміш перемішували протягом додаткових 3 годин при -10 °C і потім повільно нагрівали до 23 °C. Суміш перемішували протягом додаткових 12 годин при 23 °C. Потім насичений водний розчин NH4Cl додавали до реакційної суміші, з зовнішнім охолодженням. Суміш перемішували протягом додаткових 30 хвилин і потім екстрагували декілька разів етилацетатом. Об'єднані органічні фази промивали насиченим розчином хлориду натрію і сушили над сульфатом натрію. Сирий продукт очищали за допомогою хроматографії на силікагелі. В результаті одержували 214 мг вказаної в заголовку сполуки. 1 Н-ЯМР (300 МГц, CDCl3): δ= 7.65 d (2H); 7.40 d (2H); 4.45 s (1H); 4.38 dbr (1H); 3.40-3.60 m (4H); 2.69 s (6H); 1.03 s (3H); 0.89 s (3H); 0.49 s (3H). b) 4-[(11, 17)-17-Гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N, Nдиметилбензол сульфонамід Як і в прикладі 1с), 74 мг вказаної в заголовку сполуки одержували з 100 мг сполуки, одержаної в 15а) шляхом реакції з напівконцентрованою сірчаною кислотою в метанолі. 1 Н-ЯМР (400 МГц, CDCl3): δ= 7.69 d (2H); 7.38 d (2H); 5.80 sbr (1H); 4.04 dbr (1H); 2.68 s (6H); 0.52 s (3H) Приклад 16 Антагоністична дія відносно прогестеронових рецепторів в стабільних трансфектантах людських клітин нейробластоми (клітини SK-N-МС) з людським прогестероновим рецептором А або прогестероновим рецептором В і репортерною конструкцією MTV-LUC Клітини SK-N-MC (людські клітини нейробластоми), які були стабільно трансфектовані плазмідами, які експресують людський прогестероновий рецептор В (pRChPR-B-neo) або людський прогестероновий рецептор A (pRChPR-A-neo) і репортерну конструкцію (pMMTVLUC), інкубували протягом 24 годин за відсутності (негативний контроль) або в присутності збільшуваних кількостей відповідної досліджуваної сполуки (0.01 нмоль/1, 0.1 нмоль/л, 1 нмоль/л, 10 нмоль/л, 100 нмоль/л і 1 мкмоль/л), для визначення агоністичної ефективності. Як 19 UA 106502 C2 5 10 15 20 25 позитивний контроль ген-репортерної індукції, клітини обробляли синтетичним гестагеном промегестоном (0.01 нмоль/л, 0.1 нмоль/л, 1 нмоль/л, 10 нмоль/л, 100 нмоль/л і 1 мкмоі/л). Для визначення антагоністичної активності, клітини обробляли 0.1 нмоль/л промегестону і додатково збільшуваними кількості відповідної досліджуваної сполуки (0.01 нмоль/л, 0.1 нмоль/л, 1 нмоль/л, 10 нмоль/л, 100 нмоль/л і 1 мкмоі/л). Активність ген-репортера LUC (LUC = люцифераза) визначали в клітинних лізатах і вимірювали як ВСО (відносна світлова одиниця). Всі виміряні величини представлені у вигляді процентної ефективності і у вигляді концентрацій ЕС50 або ІС50 . 11-(4-Ацетилфеніл)-20,20,21,21,21-пентафтор-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-он і 20,20,21,21,21 -пентафтор-17-гідрокси-11-[4-(гідроксіацетил)феніл]-19-нор-17-прегна-4,9-дієн3-он, дуже сильнодіючі і тому кращі приклади з WO98/34947 і WO2008/058767, були протестовані як порівняльні сполуки разом з досліджуваною сполукою. a) агоністична активність: Жодна з зазначених досліджуваних сполук не продемонструвала агоністичну активність. b) антагоністична активність: Всі вказані сполуки демонстрируют 100 % антагоністичну ефективність. Антагоністична ефективність сполук представлена в Таблиці 1. Приклад 17 Дослідження на передчасне переривання вагітності на самках щурів Дія прогестерону і прогестеронового рецептора є головною попередньою умовою для успішної вагітності або гестації у ссавців. Прогестерон-антагоністичну дію сполук відповідно до винаходу досліджували на вагітних щурах (6 щурів на групу) на 5-7 день після спарювання в звичайних житлових і кормових умовах. Після успішного ручного спарювання, вагітних тварин (наявність сперми в вагінальному мазку на 1 день вагітності = 1 д.п.с.) рандомізували і ділили на експериментальну групу і контрольну групу. Потім кожна тварина одержувала підшкірно або перорально 0.15; 0.5; 1.5 або 5 мг/кг досліджуваної сполуки або 1.0 мл/кг носія (бензилбензоат/рицинова олія: 1+4 [об./об.]) на добу від 5 по 7 день (5 д.-7 д.п.с.). 20 UA 106502 C2 5 10 15 20 Аутопсію здійснювали на 9 день (9 д.п.с.). Як характеристика антагоністичної дії по відношенню до прогестеронових рецепторів, матку досліджували на наявність сайтів нідації. Повна відсутність, або також наявність патологічних, геморагічних або інших анормальних сайтів нідації на 9 день (9 д.п.с.) оцінювали як аборт. Результати досліджень представлені в Таблиці 3. Приклад 18) Метаболічна стабільність (11, 17)-17-гідрокси-11-[4-(метилсульфоніл)феніл]17-(пентафторетил)естра-4,9-дієн-3-ону і (11β,17β)-17-гідрокси-11-[4'-(метилсульфоніл)-біфеніл4-іл]-17-(пентафторетил)естра-4,9-дієн-3-ону в мікросомах печінки людини (МПЛ) Для оцінювання метаболічної стабільності сполук загальної формули І використовували виділені мікросоми печінки людини (МПЛ). Інкубування здійснювали за допомогою 2.4 мл розчину МПЛ (0.5 мг/мл вміст білка), 30 мкл досліджуваної сполуки (кінцева концентрація 1 мкМ) і 0.6 мл суміші-кофактора (= NADPHгенеруюча система 3 IU глюкоза-6-фосфатдегідрогенази, 14.6 мг глюкоза-6-фосфату, 1.2 мг NADP) при 37 °C в 100 мМ фосфатному буфері при рН значенні 7.4. Зразки вносили в 6 моментах часу (2-60 хв), осаджували з рівним об'ємом метанолу, і відновлення досліджуваних речовин, використовуваних в супернатанті, визначали за допомогою аналізу РХ-МС/МС. Притаманний кліренс речовини в препараті мікросом печінки можна підрахувати на основі часу напівжиття, встановленого для розпаду речовини. На основі цього, разом з різними 21 UA 106502 C2 5 10 15 20 25 30 35 40 фізіологічними характеристиками за ретельно перемішаною моделлю, потім можна встановити (метаболічний) in vivo кліренс відносно реакцій фази І. In vivo кліренс (метаболічнй) у людини, встановлений відповідно для досліджуваних сполук (11 β, 17β)-17-гідрокси-11 -[4(метилсульфоніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-ону і (11 β, 17β)-17-гідрокси-11 -[4'(метилсульфоніл)біфеніл-4-іл]-17-(пентафторетил)-естра-4,9-дієн-3-ону був дуже низьким: 0.1 Л/ч/кг і 9 кг. Було випробувано 3 собаки на групу і додатково 3 собаки в контрольній групі. 0.1; 0.33 і 1 мг/кг речовини вводили в 3 послідовних інфузіях, в кожному випадку протягом 30 хвилин. Максимальна кількість носія становила 0.4 мл на кг протягом 30 хвилин. Зразки крові тварин брали в різні моменти часу. Найвищим рівнем плазми (середнім для 3 тварин) був 1650 нг/мл по завершенню третьої інфузії. В досліджуваному діапазоні доз, у порівнянні з контролем, не спостерігалося жодної біологічно значної дії на серцево-судинну систему (тиск у легеневій артерії, системний артеріальний кров'яний тиск, частота серцебиття, ЕКГ). ФОРМУЛА ВИНАХОДУ 45 1. Сполука формули І R 1 OH F F F F X F ,I в якій 22 UA 106502 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 R являє собою залишок Y або фенільне кільце, заміщене один або два рази залишком Y, 2 3 3 3 4 3 9 10 Y вибраний з групи, яка включає SR , S(O)R , S(O)2R , S(O)(NH)R , S(O)(NR )R , S(O)2NR R , 2 R являє собою водень, С1-С6-алкіл, С7-С10-арилалкіл або арил, 3 R являє собою С1-С6-алкіл або арил, 4 6 R являє собою групу S(O)2R , 6 R являє собою феніл або 4-метилфеніл, 7 7 X означає атом кисню, NOR або NNHSO2R , 7 R вибраний з групи, яка включає водень, С1-С10-алкіл, арил, 9 10 R , R незалежно один від одного вибрані з групи, яка включає водень, С 1-С10-алкіл або арил, або як альтернатива являють собою, разом з атомом азоту, 3-8-членне, насичене або ненасичене гетероциклічне кільце, або її окремий стереоізомер, її сіль, сольват або сольват солі, включаючи всі кристалічні модифікації. 2. Сполука за п. 1, в якій 1 R являє собою залишок Y або фенільне кільце, заміщене один раз залишком Y, 2 3 3 3 4 3 9 10 Y вибраний з групи, яка включає SR , S(O)R , S(O)2R , S(O)(NH)R , S(O)(NR )R , S(O)2NR R , 2 R являє собою водень, С1-С6-алкіл або S-СН2-феніл, 3 R являє собою С1-С6-алкіл, X являє собою атом кисню, 6 R являє собою феніл або 4-метилфеніл і 9 10 R , R незалежно один від одного являють собою водень або С1-С6-алкіл, або феніл, або її окремий стереоізомер, її сіль, сольват або сольват солі. 1 3 3. Сполука за п. 1, в якій R являє собою S(O)2R і X являє собою О. 3 4. Сполука за п. 3, в якій R являє собою С1-С6-алкіл. 3 5. Сполука за п. 4, в якій R являє собою метил. 1 3 6. Сполука за п. 1, в якій R являє собою S(O)(NH)R і X являє собою О, або її окремий стереоізомер. 3 7. Сполука за п. 6, в якій R являє собою С1-С6-алкіл, або її окремий стереоізомер. 3 8. Сполука за п. 7, в якій R являє собою метил, або її окремий стереоізомер. 1 3 9. Сполука за п. 1, в якій R являє собою SOR і X являє собою О, або її окремий стереоізомер. 3 10. Сполука за п. 9, в якій R являє собою С1-С6-алкіл, або її окремий стереоізомер. 3 11. Сполука за п. 10, в якій R являє собою метил, або її окремий стереоізомер. 1 2 12. Сполука за п. 1, в якій R являє собою SR і X являє собою О. 2 13. Сполука за п. 12, в якій R являє собою водень. 2 14. Сполука за п. 12, в якій R являє собою С1-С6-алкіл. 2 15. Сполука за п. 14, в якій R являє собою метил. 2 16. Сполука за п. 12, в якій R являє собою арил. 2 17. Сполука за п. 16, в якій R являє собою феніл. 2 18. Сполука за п. 12, в якій R являє собою С7-С10-аралкіл. 2 19. Сполука за п. 18, в якій R являє собою бензил. 2 20. Сполука за п. 2, в якій R являє собою метил, етил або водень. 3 21. Сполука за п. 1, в якій R являє собою С1-С6-алкіл. 3 22. Сполука за п. 4, в якій R являє собою метил або етил. 5 23. Сполука за п. 1, в якій R являє собою феніл. 24. Сполука за п. 6, в якій n=1. 25. Сполука за п. 1, в якій X означає атом кисню. 2 3 3 2 26. Сполука за п. 1, в якій Y являє собою SR або S(O)2R , або S(O)(NH)R , де R означає 3 водень, метил або етил і R означає метил або етил. 3 27. Сполука за п. 1, в якій Y являє собою S(O)2R . 28. Сполука за п. 1, яку вибирають з групи, що включає (11,17)-17-гідрокси-11-[4-(метилсульфаніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он; (11,17)-11-[4-(етилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он; (11,17)-17-гідрокси-11-{4-[(RS)-метилсульфініл]феніл}-17-(пентафторетил)естра-4,9-дієн-3-он; (11,17)-17-гідрокси-11-[4-(метилсульфоніл)феніл]-17-(пентафторетил)естра-4,9-дієн-3-он; (11,17)-11-[4-(етилсульфоніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он; (11,17)-11-[4-(бензилсульфаніл)феніл]-17-гідрокси-17-(пентафторетил)естра-4,9-дієн-3-он; N-[{4-[(11,17)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-116 іл]фeнiл}(RS)(мeтил)оксидо- -сульфаніліден]-4-метилбензолсульфонамід; (11,17)-17-гідрокси-11-[4-(RS-метилсульфонімідоїл)феніл]-17-(пентафторетил)естра-4,9-дієн3-он; 23 UA 106502 C2 5 10 15 20 25 30 (11,17)-17-гідрокси-11-[4'-(метилсульфаніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9-дієн-3он; (11,17)-17-гідрокси-11-[4'-(метилсульфоніл)біфеніл-4-іл]-17-(пентафторетил)естра-4,9-дієн-3он; N-[{4'-[(11,17)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]біфеніл-46 іл}(RS)(метил)оксидо- -сульфаніліден]-4-метилбензолсульфонамід; (11,17)-17-гідрокси-11-[4'-(RS-метилсульфонімідоїл)біфеніл-4-іл]-17-(пентафторетил)естра4,9-дієн-3-он; (11,17)-17-гідрокси-17-(пентафторетил)-11-(4'-сульфанілбіфеніл-4-іл)естра-4,9-дієн-3-он; 4'-[(11,17)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N,N-диметилбіфеніл-4сульфонамід; 4-[(11,17)-17-гідроксі-3-оксо-17-(пентафторетил)естра-4,9-дієн-11-іл]-N,Nдиметилбензолсульфонамід. 29. Сполука за будь-яким з попередніх пунктів, для лікування і профілактики захворювань. 30. Сполука за будь-яким з пп. 1-28 для лікування і профілактики фібром матки, ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і станів, пов'язаних з менопаузою, або для регулювання народжуваності і екстреної контрацепції. 31. Застосування сполуки за будь-яким з пп. 1-28 для одержання лікарського засобу для лікування і/або профілактики захворювань. 32. Застосування сполуки за будь-яким з пп. 1-28 для одержання лікарського засобу для лікування і/або профілактики фібром матки, ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і станів, пов'язаних з менопаузою, або для регулювання народжуваності і екстреної контрацепції. 33. Лікарський засіб, який містить сполуку, як її визначено в будь-якому з пп. 1-28, в комбінації з іншою активною речовиною. 34. Лікарський засіб, який містить сполуку, як її визначено в будь-якому з пп. 1-28, в комбінації з інертним, нетоксичним, фармацевтично придатним наповнювачем. 35. Лікарський засіб за п. 33 або 34 для лікування і/або профілактики фібром матки, ендометріозу, інтенсивних менструальних кровотеч, менінгіом, гормонозалежного раку молочної залози і станів, пов'язаних з менопаузою, або для регулювання народжуваності і екстреної контрацепції. Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійською17-hydroxy-17-pentafluorethyl-estra-4,9(10)-dien-11-aryl derivatives, methods for the production thereof and use thereof for treating diseases
Автори англійськоюScwede, Wolfgang, Klar, Ulrich, Moeller, Carsten, Rotgeri Andrea, Bone, Wilhelm
Автори російськоюШведе Вольфганг, Клар Ульрих, Мёллер Карстен, Ротгери Андреа, Боне Вильгельм
МПК / Мітки
МПК: C07J 31/00
Мітки: 17-гідрокси-17-пентафторетил-естра-4,9(10)-дієн-11-арилу, похідні, застосування, лікування, спосіб, захворювань, одержання
Код посилання
<a href="https://ua.patents.su/26-106502-pokhidni-17-gidroksi-17-pentaftoretil-estra-4910-diehn-11-arilu-sposib-kh-oderzhannya-ta-kh-zastosuvannya-dlya-likuvannya-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Похідні 17-гідрокси-17-пентафторетил-естра-4,9(10)-дієн-11-арилу, спосіб їх одержання та їх застосування для лікування захворювань</a>
Попередній патент: Пристрій для дослідження процесу фарбопередачі у друкарському контакті
Наступний патент: Спосіб визначення переміщень поверхні об’єкта
Випадковий патент: Різальний диск